|
|
COMITÉ PERMANENT INTER-ÉTATS DE
LUTTE
CONTRE LA SÉCHERESSE DANS LE SAHEL
|
|
PERMANENT INTERSTATE COMMITTEE
FOR DROUGHT CONTROL
IN THE SAHEL
|
CENTRE REGIONAL AG R HYME T

DEPARTEMENT FORMATION ET RECHERCHE MEMOIRE DE
FIN D'ETUDES POUR l'OBTENTION DU DIPLOME DE
MASTERE EN PROTECTION DURABLE DES CULTURES ET
DE
L'ENVIRONNEMENT
Promotion : 2013-2014
Présenté par : Papa Djibril
FAYE
Etude de l'efficacité biologique du
Metarhizium acridum (Driver
et Milner) J.F. Bischoff,
Rehner et Humber sur les populations
de Bactrocera dorsalis
(Hendel) et de Ceratitis capitata
(Wiedemann) au
laboratoire
Soutenu le 14 Novembre 2014 devant le jury composé
de : Président : Pr ATTA Sanoussi
Membres : Dr IDI Adamou
Dr MAIGA Idrissa Halidou
Encadreur : Dr BADJI Kémo
Directeur de mémoire: Dr MAIGA
Idrissa Halidou, Expert Formateur en auu CRA
SECRÉTARIAT EXECUTIF : 03 BP 7049
Ouagadougou 03 BURKINA FASO. Tél. (226) 30 67 58/59 Fax : (226) 30 67 57
Email :
CILSS@fasonet.bf Site Web :
www.cilssnet.org
CENTRE RÉGIONAL AGRHYMET : BP 11011
Niamey, NIGER. Tél (227) 96 73 31 16 /96 73 24 36 Fax : (227) 96 73 24
35 Email :
admin@sahel.agrhymet.ne
Site Web :
www.agrhymet.ne
INSTITUT DU SAHEL : BP 1530 Bamako, MALI.
Tél : (227) 22 21 48 / 23 02 37 Fax : (223) 22 23 37 / 22 59 80 Email :
idriss@agrosoc.insah.ml
Site Web :
www.insah.org
Dédicaces
Accomplir sa Légende Personnelle est la seule et unique
obligation des hommes. Tout n'est qu'une seule chose.
« Et quand tu veux quelque chose, tout l'Univers conspire
à te permettre de réaliser ton désir. »
Paulo Coelho, L'Alchimiste
Je dédie ce travail :
A ma mère, Fatou Sow, le soleil qui illumine chaque jour
ma vie ;
A mon père, Papa Touty Faye, pour ses encouragements et
ses conseils ;
A mon guide spirituelle Cheikhna Cheikh Saadou Abihi (RTA) ;
A mon marabout, Cheikh Bounana Aidara, que Dieu lui accorde une
longue vie et la santé ;
A tous les Cherifs, pour leurs prières à mon
endroit ;
A tous le corps enseignant du Centre Régional AGRHYMET
;
A tous le personnel de la Direction de la Protection des
Végétaux du Sénégal ;
A mes co-stagiaires : Alioune Coundoul, André Coly,
Mamadou Diatta, Bécaye Faye ;
A mes amis Ismaila Diallo, Ousmane Sow, Ibrahima Sow, Lamine
Diop, Papa Khouma, Ndiagne Wade, Mohamed Diaby, Mamadou Diagne, Outé
diop ;
A ma famille et mes amis d'enfance de Leona Eau Clair de
Saint-Louis ;
Aux « Alphas » Ebeleba Atcholé Kezié,
Djibril Jamanca, Edem Wetro, Ibou Sabaly, Youssouf Kane ;
A ceux qui ont participé de près ou de loin
à la réalisation technique de ce mémoire.

II
Remerciements
Tout d'abord je remercie Allah (SWT) de m'avoir donné
une bonne santé, un esprit d'endurance et le courage qui m'ont permis de
finir cette formation. Ce travail a été réalisé
avec le concours du Département de la Formation et de la Recherche du
Centre régional AGRHYMET de Niamey et de la Direction de la Protection
des Végétaux du Sénégal. Que ces institutions
trouvent ici mes remerciements les plus sincères. Ma mobilité
entre ces institutions a été possible grâce à
l'appui de l'Agence Universitaire de la Francophonie et l'Union
Européenne pour la bourse qui m'a été octroyé. Que
les responsables de ces institutions trouvent ici l'expression de ma profonde
reconnaissance et de mes sincères remerciements.
Je tiens aussi à remercier le Dr Idrissa Halidou Maiga
pour avoir été mon directeur de mémoire et pour la
confiance qu'il m'a accordée, sa disponibilité. Je tiens
également à remercier le Directeur de la Direction de la
Protection des Végétaux, le Dr Emile Victor Coly, d'avoir
accepté de me recevoir dans son structure, également le Dr
Kémo Badji, entomologiste et chef du laboratoire d'entomologie et de
zoologie agricole pour m'avoir encadré et soutenu au cours de ces 4 mois
de stages et Mr El Hadji Omar Dieng. Qu'ils reçoivent ma profonde
reconnaissance et mes sincères remerciements.
Je remercie aussi mon oncle, le Dr Abdallah Samba, d'avoir
été mon tuteur et ses encouragements et conseils tout au long de
mon séjour à Niamey. Qu'il accepte l'expression de ma profonde
gratitude. Mes remerciements s'adressent aussi au personnel du laboratoire
d'entomologie et de zoologie agricole de la Direction de la Protection des
Végétaux pour leur assistance et soutiens à savoir Kalilou
Bodian, Abdoulaye Diop, Aliou Badji, Djibril Djiba, Moussa Konaté et
Augustin Sambou. J'ai eu à profiter de leurs expériences et un
plaisir de travailler avec eux.
Je remercie également l'ensemble du personnel de
l'AGHRYMET à travers son Directeur Général le Pr Bouaffou
Guy Marcel, le chef du Département de la Formation et de la Recherche le
Pr Hassan Bismarck Nacro, le chef de la Division Formation de Base le Pr
Sanoussi Atta, le chef de la Division de la formation Continue le Dr Etienne
Sarr, le chargé de la communication Mr Pape Oumar Diéye, le Dr
Benoit Sarr le Dr Mohamed Ly, le coordinateur du Mastère Protection
Durables des Cultures et de l'Environnement le Dr Mbaye Ndiaye, le Dr Sama
Gagare, le Dr Mabougou Garba et Mme Amina Beidari. Qu'ils reçoivent
l'expression de ma profonde reconnaissance et mes sincères
remerciements.

III
Je remercie aussi l'ensemble des étudiants du centre de
m'avoir accordé leurs confiances et leurs soutiens pour la charge de
Secrétaire Général de l'ASECAN. Qu'ils reçoivent
l'expression de ma profonde reconnaissance.
Je remercie également mes amis Youssouf kane, Ibrahima
Sabaly, Moussa Diagne, Iba Sané, Amina Diallo, Thioro Faye, Asta Koita,
Orlando Mendes, Amatna, Djibril Jamanca pour avoir été ma
deuxième famille à Niamey. Sans oublier mes mais nigériens
Ibrah, Adamou, Mamoudou, Boko, Baraatou, Shafatou, Nayssa, Nazaara et Estelle
pour leurs amitiés.
Je tiens également à remercier ma famille, mes
frères Cherif et Abdoulaye, mes soeurs Amy Colé et son mari, Lala
Aicha et son mari, Arame et son mari, Coumba, Yaye Salla ; mes cousins Mamadou
Ndiaye, Fatou Ba, Amadou, Hamath, Samba, Racky, Alassane, Omar, Pily, Maman
Salla, Ibranhima ; mes neveux ; mes tantes Sokhna Dioum, Colé Faye,
Marianne Faye, Aby Ndiaye Faye, Fatou Faye, Ndeye Coumba Faye, Fatim Ly ; mes
oncles Moreau Faye, Alioune Diagne, Aliou Dème, Tonton Ly Alassane
Dioum, Mamadou Dioum, pour leurs encouragements et leurs prières.

iv
Liste des Figures
Figure 1: Cycle de vie de C. capitata (Ekesi
& Billah, 2010) 10
Figure 2: Cycle de vie de Bactrocera dorsalis
(Mbaye Ndiaye, 2007) 16
Figure 3: Capacité invasive des
Tephritides (Deguine, 2011) 17
Figure 4: Technique des dilutions successives
34
Figure 5: Survie de la population de C.capitata
en fonction du temps 43
Figure 6:Survie de la population de B.dorsalis
en fonction du temps 43
Figure 7: Survie moyenne des populations de B.
dorsalis et de C. capitata en fonction du
temps. 44
Figure 9: Efficacité des
différentes doses de Metarhizium acridium sur les populations de B.
dorsalis dans le temps 45
Figure 12:
Séparation des moyennes de survie (#177; SE) des adultes selon
la dose de Metarhizium acridum (les moyennes suivies par la même lettre
ne sont pas significativement
différentes au seuil 5%) 46
Figure 13:
Taux de survie en fonction du temps des populations de B.dorsalis et
de
C.capitata 47
Figure 14: Taux de survie en
fonction du temps des populations adultes de B. dorsalis et de
C. capitata 48
Figure 15: Pourcentages moyens
de sporulation selon le mode de transmission et l'espèce - 49
Figure 16: Moyennes de pupes avortées de
B. dorsalis en fonction de la dose 52
Figure 17: Moyennes de pupes avortées de
C. capitata en fonction de la dose 52
Liste des cartes
Carte 1:Principales zones de cultures de de
l'Ouest la mangue en Afrique (WAFFI, 2014) -- 5
Carte 2: Distribution de Ceratitis capitata
(Mueller, 2003) 11
Liste des photos
Photo 1: En A adultes mâle à gauche
et femelle à droite (Prodobelt, 2014) et en B détails de
l'aile de C. capitata (Florida Division of Plant
Industry Archive, 1997) 7
Photo 2: OEufs de C. capitata (Florida
Division of Plant Industry Archive, 1997) 8
Photo 3: Larve de C. capitata (Florida
Division of Plant Industry Archive, 1997) 8
Photo 4: Pupes de C. capitata (Faye,
2014) 9
Photo 5: Adultes mâle, à gauche, et
femelle, à droite, de B. dorsalis (De Meyer, 2007) 13

V
Photo 6: OEufs de Bactrocera dorsalis
(Mille, 2010) 14
Photo 7: Larves de deuxième et de
troisième stade de B. dorsalis (Faye, 2014) 14
Photo 8: Pupes de B. dorsalis (Faye,
2014) 15
Photo 9: Désherbage d'un verger en A et
installation de cuvette en B (Ndiaye, 2007) 18
Photo 10: Enfouissement et ensachage des fruits
infestés tombés (Ndiaye, 2007) 18
Photo 11: Un Augmentorium de légumes en A
(Deguine, 2011) et de mangues en B (Billah,
2010) 19
Photo 12: Mangue ensachée avec du papier
journal (Ndiaye, 2007) 19
Photo 13: Utilisation de plante pièges
(Deguine, 2011) 21
Photo 14: Piège en seau de fabrication
locale à plus de 1,5 m du sol (Ndiaye, 2007) 21
Photo 15: Lâchers de parasitoïdes en
Casamance (DPV, 2014) 23
Photo 16: Cadavres de B. dorsalis femelle
(position dorsale et ventrale) (Faye, 2014) 27
Photo 17: Mouches mortes mâle et femelle
de C. capitata de coloration rose tuées par le
Metarhizium acridum (Faye, 2014) 27
Photo 18:
Sporulation du Metarhizium acridum au niveau des articulations en A et
de
l'ébauche alaire de Bactrocera dorsalis en B
(Faye, 2014) 28
Photo 19: Thermo-hygromètre (Hobo) 29
Photo 20: Matériel pour le test de
germination : 1 Hémocytomètre, 2 micropipette, 3 embouts, 4
microscope, 5 tubes de Falcon et portoir, 6 vortex, 7 lamelles, 8 boîtes
de Pétri, 9
SDA, 10 balance Mettler-Toledo et 11 Tween-80 30
Photo 21 : Cages en 1 et tentes en 2
d'élevage au laboratoire 31
Photo 22: Incubateur 31
Photo 23: Matériel d'observation au
laboratoire 32
Photo 24: Chambres d'auto-inoculation avec de la
gauche vers la droite les doses de 0,3 g ;
0,15 g et 0,075 g de Metarhizium acridum et la chambre
témoin (Faye, 2014) 37
Photo 25: Récupération des pupes
de B. dorsalis par tamisage (1) et 40
Photo 26: Cadavres mâle et femelle de
C. capitata avec sporulation du Metarhizium sur le
corps des insectes (Faye, 2014) 49
Photo 27:
Sporulation du Metarhizium acridum sur le cadavre d'une
mouche mâle de C.
capitata (Faye, 2014) 50
Photo 28:
Début de germination du Metarhizium de couleur blanche
sur le cadavre de B.
dorsalis femelle (Faye, 2014) 50
Photo 29:
Germination du champignon sur le cuticule de Bactrocera
dorsalis (Faye, 2014) 51
Photo 30: Pupes et émergences
avortées de Ceratitis capitata (Faye, 2014) 53

vi
Photo 31: Pupes avortées de
Bactrocera dorsalis (Faye, 2014) 53
Sigles et abréviations
AGRHYMET Centre Régional de Formation
et d'Application en Agrométéorologie et
Hydrologie Opérationnelle
CEDEAO Communauté Economique des Etats
de l'Afrique de l'Ouest
DF Degree of Freedom (Degré de
liberté)
DPV Direction de la Protection des
Végétaux
FAO Organisation des Nations Unies pour
l'Alimentation
GAMOUR Gestion Agroécologique des
mouches des légumes de la Réunion
IAEA Agence Internationale de l'Energie
Atomique
ICIPE International Centre of Insect
physiology and Ecology
IPM Integrated Pest Management
ISRA Institut Sénégalais de
Recherches Agricoles
MAT Technique d'Annihilation des
Mâles
PPDS Plus Petite Différence
Significative
REML Restricted Maximum Likelihood
SA Société Anonyme
SDA Sabouraud Dextrose Agar
SE Standard Error (Erreur standard)
SNK Student-Newman-Keuls
TIS Technique de l'Insecte Stérile
TL Temps Létal
UE Union Européenne

VII
Table des matières
Dédicaces i
Remerciements ii
Liste des Figures iv
Liste des carte iv
Liste des photos iv
Sigles et abréviations vi
Résumé x
Abstract xi
Introduction 1
? Objectifs 2
a. Objectif Général
2
b. Objectifs spécifiques
3
? Questions de recherche : 3
Chapitre I : Synthèse bibliographique
5
1.1. La mangue en Afrique de l'Ouest
5
1.2. Généralités sur les
mouches des fruits en Afrique 5
1.3. Description des espèces à
l'étude 6
1.3.1- Ceratitis (Ceratitis) capitata (Wiedemann,
1824) 6
1.3.1.5. Distribution géographique
11
1.3.2. Bactrocera dorsalis (Hendel, 1912) ex
invadens 12
1.4. LA LUTTE 16
1.4.1. Les méthodes de lutte
préventive 17
1.4.1.1. La prophylaxie
17
1.4.1.5. Les plantes pièges et attractifs
alimentaires 20
1.4.3 Technique d'annihilation des mâles
(MAT) 21
1.4.4. Les stations d'appâts : traitement
par tâche 21
1.4.5. La lutte biologique
22

VIII
1.4.6. Traitements post-récolte
24
1.4.7. La lutte intégrée
24
1.5. Metarhizium acridum
25
1.5.1. Modes d'infection du Metarhizium acridum
25
1.5.2. Fixation, germination et
pénétration du champignon sur l'hôte
26
1.5.3. Les réponses immunitaires de
l'hôte 27
1.5.4. La sporulation 28
Chapitre II : Matériels et méthodes
29
2.1. Conditions expérimentales
29
2.2. Matériel 29
2.2.1. Matériel de préparation,
d'inoculation, de comptage des conidies 29
2.2.1. Matériel d'élevage
30
2.2.2. Matériel d'incubation
31
2.2.3. Matériel d'observation
31
2.3. Matériel biologique
32
2.3.1. Metarhizium acridum
32
2.3.2. La mouche 32
2.3.2.1. Ceratitis capitata (Wiedemann)
32
2.3.2.2. Bactrocera dorsalis (Hendel)
33
2.3. La méthodologie
33
2.3.1. Test de viabilité des spores du
Metarhizium acridum 33
2.3.1.2. Préparation de l'inoculant
fongique 34
2.3.1.3. Calcul de la concentration en spores avec
l'hémocytomètre 34
2.3.1.4. Test de germination
35
2.3.2. Test de quantification du nombre de spores
collectée par mouche 35
2.3.3. Tests préliminaires de la
pathogénicité des spores du Metarhizium acridum
(Maximum challenge tests)
36
2.3.3.1. Effet du Metarhizium acridum sur les
adultes de Ceratitis capitata 36
2.3.3.2. Effet du Metarhizium acridum sur les
adultes de Bactrocera dorsalis 36
2.3.4. Evaluation de l'efficacité de 3
doses Metarhizium acridum sur les populations de
Bactrocera dorsalis et Ceratitis capitata,
détermination de la LT 50 pour chaque dose 37
2.3.3.3. Conception expérimentale
37
2.3.3.4. Procédure expérimentale
37
2.3.5. Transmission horizontale de
l'entomopathogène Metarhizium acridum 38
2.3.6. Effet du Metarhizium acridum sur les larves
de Ceratitis capitata et de Bactrocera
dorsalis 39

ix
2.3.7. Analyse des données
40
Chapitre III : Résultats 42
3.1. Test de viabilité des spores du
Metarhizium acridum 42
3.2. Test de quantification du nombre conidies
collectées par mouche 42
3.3. Maximum challenge test de l'effet du Green
Muscle sur Ceratitis capitata (Wiedemann)
42
3.4. Transmission horizontale
46
3.4.1. Transfert des conidies des mâles vers
les femelles des mouches adultes de Bactrocera
dorsalis et de Ceratitis capitata
46
4.2. Transfert des conidies des femelles vers les
mâles 47
4.3. Test de sporulation
48
6. Effets du Metarhizium acridum sur les larves
des mouches des fruits 51
Chapitre IV. Discussion 54
Conclusion générale 57
Recommandations 57
Bibliographie 59
Webographie 64

X
Résumé
En Afrique de l'Ouest, les mouches des fruits (Diptera :
Tephritidae) sont les plus importants ravageurs des cultures fruitières.
Au Sénégal, elles causent des pertes économiques
considérables de l'ordre de 60 à 80 % aux producteurs (DPV,
2004). Afin de contribuer à la mise en oeuvre d'une gestion durable et
intégrée des populations de mouches des fruits, notre
étude menée au laboratoire avait pour l'objectif d'évaluer
l'effet du Metarhizium acridum (Driver et Milner) J.F. Bischoff,
Rehner et Humber sur les populations adultes et larvaires de Bactrocera
dorsalis Hendel et de Ceratitis capitata (Wiedemann). Les nombre
de spores pouvant être collectées par une mouche a
été déterminé pour B.dorsalis et
C.capitata. Au bout de 3 minutes dans la chambre d'auto-inoculation
avec 0,3 g de Metarhizium acridum, 8,15 x10 6spores sont
collectées par B.dorsalis contre 4,6x 106 spores pour
C.capitata. Cette dose entraine une mortalité de 100 % en 5#177;6 jours
après contamination. Nous avons exploré les doses
économiques efficaces suivantes 0,3 g, 0,15 g et 0,075 g de
Metarhizium acridum. Notre étude démontre bien que le
séjour dans la dose 0,3 g était le plus efficace. Nous avons
également exploré la possibilité pour les mouches adultes
mâles traitées de contaminer les mouches adultes femelles non
traitées lors de l'accouplement ou par contact (transmission
horizontale). Les mouches mâles traitées transmettent l'infection
fongique aux mouches femelles non traitées. Similairement, des mouches
adultes femelles traitées avec le Metarhizium acridum ont aussi
transmis l'infection fongique aux mâles.
L'entomopathogénicité du Metarhizium acridum a
été étudiée sur les populations larvaires de B.
dorsalis et de C. capitata. Cinq doses de spores
mélangées avec 400 g de sable sec tamisé ont
été utilisées (1,5 g, 0,5 g, 0,3 g, 0,15 g et 0,05 g). Les
résultats montrent une importante réduction du taux
d'émergence des adultes. Cette étude suggère que le
Metarhizium acridum peut être utilisé dans les programmes de lutte
intégrée contre les populations de mouches des fruits.
Mots clés : Bactrocera dorsalis, Ceratitis
capitata, Metarhizium acridum, infection fongique,
Sénégal.

xi
Abstract
In West Africa, fruit fly (Diptera: Tephritidae) are the most
important pests of fruit crops. In Senegal, they cause considerable economic
losses of about 60-80% (DPV, 2004) to the producers. In the approach to
implement a sustainable and integrated management of fruit flies populations,
we conducted a laboratory study with the aim to evaluate the effect of the
entomopathogenic fungus Metarhizium acridum (Driver and Milner) JF
Bischoff, Rehner and Humber as a biological control agent candidate against
adult and larval populations of Bactrocera dorsalis Hendel and
Ceratitis capitata (Wiedemann),. The number of spores collected by a
fly was determined for B. dorsalis and C. capitata. The
number of spores collected after a residence time of 3 minutes in the
self-inoculation room with 0.3 g of M. acridum, was 8.15 x 10
6 spores for B. dorsalis and 4.6 x 10 6 spores
for C. capitata. This result showed 100% mortality within 5 #177; 6
days post-exposure. We also studied three economic doses of 0.3 g, 0.15 g and
0.075 g of M. acridum. Results showed that the 0.3 g dose was the most
effective. The same dose was used to determine whether adult male treated flies
could contaminate untreated female flies during mating (horizontal
transmission). When treated male flies were placed in the same cage with
healthy females, they were able to transmit fungal infection to untreated
female causing high mortality among them. Similarly, adult females treated with
M. acridum were mixed with healthy male flies, they also transmitted
fungal infection to males, resulting in high mortality. The pathogenicity of
M. acridum was also studied on larval populations of B. dorsalis
and C. capitata. Five doses of fungal spores were used (1.5 g,
0.5 g, 0.3 g, 0.15 g and 0.05 g) and mixed with 400 g of sieved dry sand. The
overall result showed a significant reduction in adult emergence of both
species compared to control. Results suggest that the M. acridum can
be incorporated in an IPM program against fruit fly populations.
Keywords: Bactrocera dorsalis, Ceratitis
capitata, Metarhizium acridum, fungal infection, Senegal.

1
Introduction
La production de fruits et de légumes en Afrique est
affectée par différents ravageurs, parmi lesquels les mouches des
fruits (Diptera : Tephritidae) occupent une place importante. La famille des
Tephritidae comprend environ 4000 espèces dont 500 genres. Elle est l'un
des groupes les plus importants économiquement (Ekesi & Billah,
2010). Les femelles de ces mouches pondent leurs oeufs, par petits groupes,
sous l'épiderme des fruits-hôtes. Les larves se développent
dans la pulpe du fruit, puis le quittent en fin de développement
larvaire pour se transformer en pupe dans le sol, d'où leur nom de
« mouches des fruits » (Abanda, et al., 2008).
L'Afrique exporte chaque année 3,6 millions tonnes de
mangues avec les pays de la CEDEAO qui couvrent environ 38% de la
récolte totale des mangues du continent soit 1,2 million de tonnes en
2006 à presque 1,4 million de tonnes en 2010. En Afrique de l'Ouest, les
pertes dues aux mouches des fruits dépassent 50 % pour les cultivars
d'intérêt commercial à partir du milieu de la campagne
mangue depuis 2005, impliquant des pertes considérables de revenus pour
les planteurs (Vayssières, et al., 2014). Ces pertes sont dues
à plusieurs espèces de mouches des fruits, Ceratitis
cosyra (Walker), C. fasciventris (Bezzi), C. rosa
(Karsch), C. anonae, C. capitata Weid. et Bactrocera
invadens Drew Tsuruta et White (Diptera: Tephritidae), constituent la
contrainte majeure à la production de mangues en Afrique. Bactrocera
dorsalis, qui, après sa première découverte en 2003
au Kenya, s'est disséminée très rapidement dans plusieurs
pays d'Afrique de l'Est, d'Afrique Centrale, d'Afrique de l'Ouest et en Afrique
Australe (Drew, et al., 2005 ; Mwatawala, et al., 2004 ;
Quilici & Vayssières, 2010 ; Ndiaye, et al., 2012 ; Dimbi,
et al., 2013).
Depuis l'introduction de Bactrocera dorsalis (ex
invadens) au Sénégal, les pertes de production de mangues ont
été estimées de 40 à 80 % par endroit (DPV, 2004
(Dimbi, et al., 2013) . Selon l'Institut Sénégalais de Recherches
Agricoles (ISRA), B. dorsalis a pris une importance toute
particulière car son pic de population coïncide avec la
période de maturation des mangues (Juillet-Août).
Bactrocera dorsalis provoque des pertes de
récolte pouvant atteindre 40 à 60 % dans les Niayes et 70
à 80 % en Casamance. Ces pertes touchent les arboriculteurs mais
également tous les acteurs de la filière (négociateurs,
vendeurs, exportateurs, transformateurs) (ISRA, 2010) ; (Grechi, et
al., 2013).

2
En Afrique de l'Ouest, Ceratitis capitata est une
mouche d'importance économique qui attaque surtout les agrumes et
d'autres fruits indigènes, cause des pertes de rendement à
répercussions économiques (Umeh, et al., 2008 ;
Maùsse & Bandeira, 2007).
En plus des pertes directes, les mouches des fruits sont des
organismes de quarantaine infligeant chaque année la destruction de
nombreuses expéditions de mangues en provenance de l'Afrique de l'Ouest
en destination de l'Europe. En France, entre 2007 et 2010, les interceptions de
cargaisons de mangues infestées par B. dorsalis sont les
suivantes : 19 interceptions en 2010 provenant du Cameroun et du Togo ; 39 en
2009 en provenance du Sénégal, du Mali, du Kenya, du Burkina
Faso, de la Côte d'Ivoire, du Togo et du Cameroun ; 18 en 2008 en
provenance du Cameroun, de la Côte d'Ivoire, du Mali, du Burkina Faso et
du Sénégal ; 1 en 2007 venant du Cameroun (De Meyer, et al.,
2010).
De nombreuses méthodes de luttes ont été
explorées: traitements aux pesticides chimiques, le traitement
localisé avec les attractifs, l'élimination des mâles, la
lutte biologique, le piégeage en masse. Au Sénégal, les
exploitations traitées à travers le piégeage des
mâles sont ré-infestées à partir des parcelles
voisines. De plus, au sein d'une parcelle infestée traitée, il
existe un très fort potentiel de recontamination à partir des
larves et pupes enfouies dans le sol (ISRA, 2010).
L'introduction récente de mesures strictes de
quarantaine et de limite maximale de résidus (LMR) par la plupart des
pays importateurs de fruits comme les Etats Unis, l'Union Européenne et
l'Australie, ont motivé la recherche et le développement
d'alternatives biologiques à la lutte chimique (Toledo, et al.,
2006) ; (Aboussaid, et al., 2009) ; (AGRHYMET, 2010) ; (Che Raghi, et
al., 2012) ; (Daniel, 2014).
Cette étude entre dans le cadre d'une contribution
à la gestion intégrée des mouches des fruits en Afrique de
l'Ouest en utilisant l'entomopathogène Metarhizium acridum
(Driver et Milner) J.F. Bischoff, Rehner et Humber, qui a fait ses preuves
dans le cadre de la lutte antiacridienne en Afrique, en Australie et en
Amérique du Sud, contre les adultes et le troisième stade
larvaire de la mouche orientale des fruits Bactrocera dorsalis
(Hendel) et de la mouche méditerranéenne des fruits
Ceratitis capitata (Wiedemann).
? Objectifs
a. Objectif Général
L'objectif général de cette étude est de
tester la possibilité pour le Metarhizium acridum (Green
Muscle®) à transmettre des épizooties sur les
populations de mouches des fruits (Diptera: Tephritidae) Bactrocera
dorsalis et de Ceratitis capitata.

3
b. Objectifs spécifiques
Les objectifs spécifiques de l'étude sont les
suivants :
Etudier l'effet du Metarhizium acridum sur les
populations adultes de mouches (primary pick-up),
Etudier la transmission horizontale (secondary pick-up) du
Metarhizium acridum chez les populations adultes,
Etudier l'efficacité biologique du Metarhizium
acridum sur les populations larvaires de Bactrocera dorsalis et
de Ceratitis capitata;
? Questions de recherche :
Dans le cadre de cette étude sur l'utilisation du
Metarhizium acridum sur les populations de B.
dorsalis et de C. capitata, les questions
importantes suivantes doivent trouver des réponses :
? Metarhizium acridum infecte-t-il les mouches ?
? Entre les mâles et les femelles, qui est le meilleur
agent vecteur de la transmission de la
maladie ?
? Les spores de Metarhizium acridum dans le sol
peuvent-elles infecter les larves en
pupaison ?
Résultats attendus
? Le Metarhizium acridum tue les populations adultes de
B. dorsalis et de C.
capitata ;
? La transmission des spores et le mode de transmission efficace
sont connus ;
? L'effet sur les populations de larves pupales est connu.
Cette présente étude rentre dans le cadre de la
recherche de méthodes de luttes alternatives aux
produits chimiques dans la gestion intégrée des
mouches des fruits au Sénégal en l'occurrence
B. dorsalis et C. capitata. Il s'agit de
vérifier l'effet du M. acridum sur les populations adultes
et sur les populations de larvaires.
Ce travail réalisé au niveau du laboratoire
d'entomologie et de zoologie agricole de la Direction de la Protection des
Végétaux du Sénégal est articulé en quatre
parties. La première partie comprend le chapitre faisant la
synthèse bibliographique sur la mangue en Afrique de l'Ouest, de la
présentation des mouches B. dorsalis et C. capitata,
de la lutte et de l'entomopathogène M. acridum. Le
deuxième chapitre est consacré au matériel et la
méthodologie utilisée pour les tests de l'étude. Le
troisième chapitre présente les résultats obtenus et le
quatrième chapitre est

4
consacré à la discussion des résultats.
Une bibliographie précédée d'une conclusion et des
recommandations clôture ce travail.

5
Chapitre I : Synthèse bibliographique
1.1. La mangue en Afrique de l'Ouest
La mangue, Mangifera indica L., est un fruit qui
constitue un élément clé du système horticole dans
de nombreuses régions tropicales et subtropicales d'Afrique et d'Asie.
Pour les populations urbaines et rurales, elle constitue un des fruits les plus
prisés, sources de vitamine A et d'autres nutriments (FAO, 1999).
En Afrique de l'Ouest, il existe un grand bassin de production
de mangues inscrit dans un périmètre compris entre Bobo-Dioulasso
(Burkina Faso), Bamako-Yanfolila (Mali) et Tafire Dikodougou (Côte
d'ivoire). La Guinée maritime et les Niayes au Sénégal,
séparées géographiquement et économiquement du
principal bassin de production, sont les deux principales zones de production
et d'exportation. Elles utilisent des circuits et des voies de transport
différents (Vannière, et al., 2004). La figure 1 montre
les zones de production de mangue en Afrique de l'Ouest (Vayssières, et
al., 2014).
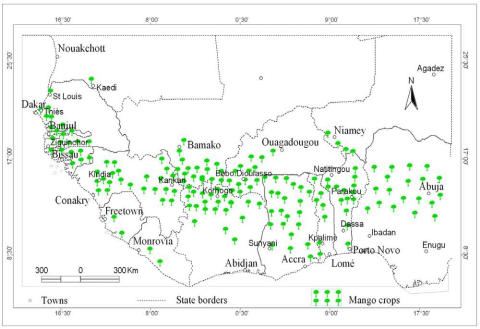
Carte 1:Principales zones de cultures de de
l'Ouest la mangue en Afrique (in Vayssières, et
al., 2014)
1.2. Généralités sur les mouches
des fruits en Afrique
Les mouches des fruits (Tephritidae) constituent un des
problèmes entomologiques majeurs des
manguiers en Afrique de l'Ouest et dans le monde. Ces
espèces sont économiquement

6
importantes de par les dégâts directs qu'elles
provoquent et en tant qu'insectes de quarantaine dans les principaux pays
importateurs : Union européenne (UE), États-Unis, Australie,
Nouvelle-Zélande, Japon, etc. (Vannière, et al.,
2004).
Toutes les espèces de cette famille ne sont pas des
ravageurs de fruits : certains taxons comme la sous-famille des Trypetinae, par
exemple, s'attaquent aux fleurs (surtout d'Asteraceae). D'autres comme la
sous-tribu des Gastrozonina sont des ravageurs des tissus parenchymateux des
racines, de tiges ou de feuilles (White & Elson-Harris, 1992). Plusieurs
espèces de mouches des fruits sont également
bénéfiques et sont utilisées en tant qu'agents de lutte
biologique contre les mauvaises herbes (Ekesi & Billah, 2010).
Bien qu'une attention particulière soit faite à
la mouche des fruits Bactrocera dorsalis ex invadens (Drew, Tsurata et
White) Hendel et à la mouche méditerranéenne Ceratitis
capitata (Wiedermann), il y a au moins une vingtaine d'espèces de
Tephritidae d'un intérêt économique en Afrique, et
particulièrement au Sénégal. Elles font partie de la
sous-famille des Dacinae et appartiennent à deux tribus : Dacini et
Ceratidini (White & Elson-Harris, 1992) ; (De Meyer, 2000) ; (Ekesi &
Billah, 2010) ; (Vayssières, et al., 2011) ; (Ndiaye, et
al., 2012).
1.3. Description des espèces à
l'étude
1.3.1- Ceratitis (Ceratitis) capitata (Wiedemann, 1824)
1.3.1.1 Position systématique
La mouche méditerranéenne des fruits appartient
à la famille des Tephritidae qui compte
environ 4000 espèces réparties dans 500 genres.
Sa position systématique est donnée ci-dessous.
Phylum Arthropoda
Classe Insecta
Ordre Diptera
Sous ordre des Cyclorrhapha
Section Acalyptratae
Super famille Tephritoidea
Famille Tephritidae
Sous famille des Dacinae
Tribu Ceratidini
Genre Ceratitis
Espèce Ceratitis capitata

7
1.3.1.2 Historique
Ceratitis capitata est originaire de la région
paléarctique sud occidentale, notamment dans le sud marocain. Elle est
présente et endémique dans la plupart des pays d'Afrique
sub-saharienne. Elle a été enregistrée à partir de
l'ouest de la Zambie par Munro (1953) et de la Namibie par Hancock et al.
(2001).. La propagation en Europe, en Égypte, au Moyen-Orient, dans
la sous-région malgache, l'Australie et les Amériques est
susceptible d'être le résultat du transport accidentel à
travers les activités commerciales (Weldon, 2014).
Cette espèce a beaucoup de synonymes dont Ceratitis
citriperda (MacLeay), Ceratitis hispanica (De Brême),
Pardalaspis asparagi (Bezzi), Tephritis capitata (Wiedemann).
Elle présente des noms communs selon la langue dont elle est
décrite comme Mittelmeerfruchtfliege (allemand), Mediterranean fruit fly
ou medfly (anglais), Mosca mediterránea ou moscamed (espagnol) et la
Mouche méditerranéenne des fruits, mouche de l'oranger, mouche
des fruits (français) (Berger, 2005).
1.3.1.3 Description morphologique
? L'Adulte
L'adulte de Ceratitis capitata ailé, mesure
4,5 à 6 mm. Les mâles et les femelles peuvent être
séparés de la plupart d'autres espèces par le fait que la
moitié apicale du scutellum étant entièrement noire et le
dessin caractéristique de l'aile. La tête en couleur jaune et une
bande claire et elle est douée d'une grande mobilité. Le
dimorphisme sexuel est très net chez la femelle par un ovipositeur
rétractile, large et rougeâtre permettant l'insertion des oeufs
dans les fruits. Le mâle possède deux soies orbitales
antérieures allongées et terminées par une petite palette
en forme de losange de couleur noirâtre.

A
B
Photo 1: En A adultes mâle à gauche
et femelle à droite (Prodobelt, 2014) et en B détails de l'aile
de C. capitata (Florida Division of Plant Industry Archive, 1997)

8
? L'oeuf
L'oeuf est de couleur blanche nacré, brillant, de forme
allongée et arquée en son milieu, convexe du côté
dorsal et concave du côté ventral. Le tégument est
nettement visible à la loupe binoculaire et on distingue bien ses
particularités au microscope. Il fait 0,9 à 1,1mm de long sur
0,20 à 0,25mm de large. L'oeuf est translucide lorsqu'il est
fraîchement pondu et peut être manipulé facilement dans
l'eau où il peut éclore. La durée d'incubation varie avec
la température (24 à 72h), les seuils thermiques étant de
18 et 38 °C (Whittier, et al., 1992).

Photo 2: OEufs de C. capitata
(Florida Division of Plant Industry Archive, 1997)
? La larve
La larve est apode, acéphale lisse et de couleur blanc
crème. Elle a une forme conique, effilée dans sa partie
antérieure et subcylindrique et tronquée dans sa partie
postérieure. Les antennes sont peu visibles et les pièces
buccales réduites aux crochets mandibulaires qui sont noirâtres.
On distingue 3 stades larvaires chez la cératite qui se
différencient par la présence, le nombre et la taille des
stigmates. La larve de troisième stade mesure 7 à 8 mm de long et
présente des stigmates fortement chitinisés.

Photo 3: Larve de C. capitata
(Florida Division of Plant Industry Archive, 1997)

9
? La nymphe

Photo 4: Pupes de C. capitata (Faye,
2014)
La nymphe ou pupe est le résultat de la nymphose de la
larve de stade 3 qui ne rejette pas son exuvie comme les larves des autres
stades, mais la garde et va devenir comme un tonnelet elliptique lisse et
résistant dont la couleur varie en fonction de la nourriture,
l'âge et le milieu. La nymphe est enclose dans l'exuvie et formant une
pupe. Cette pupe mesure 4 à 5 mm de long et prend la couleur brun
foncé. Elle ne peut survivre à une température
inférieure à 2 °C.
1.3.1.4. Cycle biologique de Ceratitis capitata
Les mâles se rassemblent sur les plantes hôtes,
où ils émettent une phéromone sexuelle attirant les
femelles. La Cératite est caractérisée par une
période pré-ovipositionnelle après laquelle la femelle
s'accouple pour la formation des ovules mûrs qui seront ensuite pondus.
La survie et la durée du développement de ce stade sont
régies par plusieurs facteurs dont notamment, la température et
les caractères physico-chimiques du site de ponte.
Les femelles adultes, grâce à leur oviscapte,
pondent leurs oeufs, groupés par 3 à 7, à
l'intérieur des fruits, à une profondeur de 2 à 5 mm
environ. Après 2 à 5 jours, les oeufs éclosent et donnent
des larves qui s'enfoncent dans la pulpe du fruit. Après le
troisième stade larvaire, elles quittent le fruit et s'enfoncent dans le
sol où s'effectue la nymphose jusqu'à l'émergence. Les
adultes récemment émergés se nourrissent des substances
sucrées présentes sur les arbres fruitiers comme le montre la
figure 1 (Nouira, 2008).
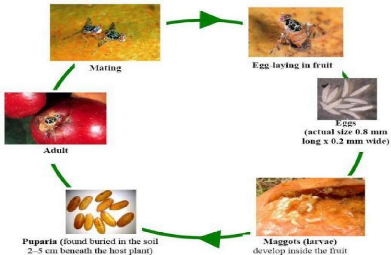

10
Figure 1: Cycle de vie de C. capitata
(Ekesi & Billah, 2010)
? Développement larvaire
Le développement larvaire est régi par deux
principaux facteurs : les conditions climatiques et la plante hôte. Les
larves peuvent manifester une compétition intra spécifique en
fonction de la densité de la population larvaire. La qualité de
l'hôte affecte aussi bien la durée de développement que les
caractéristiques biométriques de l'adulte (poids, mensurations).
Une fois que les trois stades larvaires sont achevés, celle du
troisième stade réalise le saut larvaire caractéristique
de l'espèce lui permettant de tomber sur le sol et s'y nymphoser. La
durée du développement larvaire chez la cératite varie de
6,8 à 11,8 jours.
? La pupaison
Une fois enfouie dans le sol, la larve entre dans un stade
fixe au cours duquel se déroule un ensemble de transformations
profondes. La durée de la pupaison est fonction de la température
et de l'humidité relative.
? La maturation
L'éclosion des pupes se fait dans le sol, d'où
émergera l'adulte après avoir durci ses ailes. Les adultes
sortent 6-11 jours après la nymphose à 24-26°C. A
l'émergence, les adultes présentent une période de
prématurité sexuelle. La maturité sexuelle est atteinte
après 2 à 4 jours.

11
1.3.1.5. Distribution géographique
Ceratitis capitata a une plus grande
répartition géographique comparée aux autres mouches des
fruits. En Afrique, la mouche est présente en Algérie, en Angola,
au Burkina Faso, au Burundi, au Cameroun, au Congo, en République
Démocratique du Congo, en Egypte, en Ethiopie, au Gabon, au Ghana, en
Guinée, en Côte d'Ivoire, au Kenya, au Libéria, en Libye,
au Malawi, au Maroc, au Mozambique, au Niger, au Nigeria, au
Sénégal, en Afrique du Sud, au Soudan, en Tanzanie, au Togo, en
Tunisie, en Ouganda et au Zimbabwe (White & Elson-Harris, 1992).
En dehors de la région autochtone africaine, la mouche
existe aussi en Océanie, plusieurs pays d'Europe Centrale, du Nord et en
Amérique du Sud, en Amérique Centrale et Caraïbes, le Moyen
Orient, l'Asie Orientale, les îles de l'Atlantique, du Pacifique et de
l'océan Indien, des Antilles (Chan Jr, et al., 2000) ;
(Vayssières, et al., 2011) ; (Nouira, 2008). Voir carte 2.
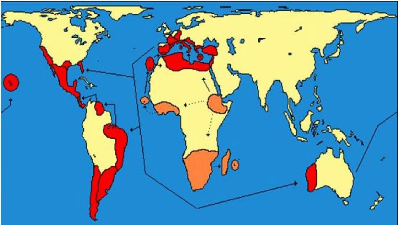
Carte 2: Distribution de Ceratitis
capitata (Mueller, 2003)
1.3.1.6 Plantes hôtes
La mouche méditerranéenne Ceratitis capitata
est une espèce strictement carpophage,
s'attaquant aux fruits et produisant entre 7 et18
générations par an. Elle est très polyphage peut
s'attaquer à plus de 250 espèces. Les agrumes sont les plus
attaqués par la mouche des fruits qui provoque d'énormes pertes
en fruits destinés à l'exportation. Au Sénégal,
elle a été piégée dans la localité de
Bayakh, dans les Niayes, au Mozambique elle a été trouvée
sur les fruits indigènes Annona senegalensis (Sapotier),
Garcinia livingtonei et Vangueria infausta (Umeh, et
al., 2004) ; (Maùsse & Bandeira, 2007) ; (Nouira, 2008).

12
1.3.1.7. Importance économique
Ceratitis capitata est un ravageur important en Afrique
qui s'est disséminé vers pratiquement
tous les autres continents; elle est devenue sans aucun doute
le ravageur individuel le plus important de sa famille. Cette mouche est
très polyphage et provoque des dégâts sur un grand nombre
de cultures fruitières non apparentées. Dans les pays
méditerranéens, elle est surtout nuisible sur agrumes et
pêchers. Elle transmet aussi des champignons provoquant la pourriture des
fruits (Cayol, et al., 1994).
1.3.2. Bactrocera dorsalis (Hendel, 1912) ex invadens
1.3.2.1 Position systématique
La mouche orientale des fruits appartient à la famille des
Tephritidae qui compte environ 4000
espèces réparties dans 500 genres (White &
Elson-Harris, 1992). Sa position systématique est donnée
ci-après.
Phylum Arthropoda
Classe Insecta
Ordre Diptera
Sous ordre des Cyclorrhapha
Section Acalyptratae
Super famille Tephritoidea
Famille Tephritidae
Sous famille des Dacinae
Tribu Dacini
Genre Bactrocera
Espèce Bactrocera dorsalis
1.3.2.2 Historique
Bactrocera dorsalis ex invadens a été
décrite pour la première fois au Kenya en 2003 (Lux, et
al., 2003), au Bénin en 2004
(Vayssières, et al., 2005), au Sénégal en 2004
(Vayssières, et al., 2011). Espèce invasive, il a
été prouvé qu'elle est un membre du complexe
Bactrocera dorsalis, une espèce asiatique qui comprend une
centaine d'espèces ravageuses, reconnue comme une espèce
distincte (Drew, et al., 2005). Son aire d'origine va du Sri Lanka, en
Inde et au Bhoutan (De Meyer & Aool, 2014). Depuis sa première
découverte en Afrique de l'Est, elle s'est rapidement propagée
dans plusieurs pays d'Afrique Centrale, de l'Est, de l'Ouest et du Sud en un
temps très court (Drew, et al., 2005) ; (Mwatawala, et
al., 2004) ; (De Meyer, et al., 2007) ; (Hill &
Terblanche, 2014).

13
La mouche orientale a eu plusieurs synonymes que sont
Chaetodacus ferrugineus (Fabricius), Chaetodacus ferrugineus
dorsalis (Hendel), Chaetodacus ferrugineus var. okinawanus
(Shiraki), Dacus dorsalis (Hendel) et Strumeta dorsalis
(Hendel). Elle a des noms communs en fonction de la langue de description
Orientalische Fruchtfliege (allemand), Oriental fruit fly (anglais), Mouche
orientale des arbres fruitiers, Mouche des fruits asiatique (français)
et Mosca oriental das frutas (espagnol).
1.3.2.3. Description morphologique ?
L'Adulte

Photo 5: Adultes mâle, à gauche,
et femelle, à droite, de B. dorsalis (De Meyer, 2007)
L'adulte de B. dorsalis est une espèce d'assez
grande taille qui présente un abdomen de forme ovale. Les ailes, en
majeure partie transparentes, sont caractérisées par une bande
costale enfumée, large et assez régulière, ainsi qu'une
bande anale. Les fémurs sont tous jaune et les tibias sombres. Au niveau
du thorax, le scutum avec la couleur de base, est très sombre, brun
orangé et parfois noir; lorsqu'il fait sombre brun-orange et
présente des bandes latérales jaunes. L'abdomen est ovale
caractérisé par une marque noire en forme de T au niveau des
tergites abdominaux 3 à 5 qui se termine par un ovipositeur en
aiguillon.
? L'oeuf


14
Photo 6: OEufs de Bactrocera dorsalis
(Mille, 2010)
L'oeuf mature fécondé est le résultat
final de l'ovogénèse et le début de la vie
indépendante. Les oeufs sont allongés, légèrement
incurvés et de couleur blanc crème ; Ils mesurent en moyenne 1 mm
de longueur et 0,2 mm de diamètre. Ils sont déposés dans
des loges façonnées par la femelle avant la ponte, à
l'aide de son ovipositeur.
? La larve
Les larves sont des asticots typiques de diptères qui
vivent et se nourrissent dans les fruits. La larve de premier stade est la plus
difficile à observer dans le fruit ; elle mesure en moyenne 2 mm. Le
deuxième stade larvaire mesure 3 mm ; c'est aussi le plus furtif. Le
troisième stade larvaire appelé aussi « larve
pré-pupale », mesure 8 mm Lorsqu'elle a terminé son
développement, la larve sort du fruit et s'enterre dans le sol pour
réaliser la dernière métamorphose par la pupaison.
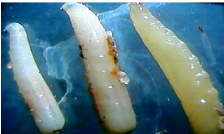
Photo 7: Larves de deuxième et de
troisième stade de B. dorsalis (Faye, 2014)
? La nymphe
La pupe est un petit tonnelet de 5 mm de longueur, de couleur
brun-rouge, qui se forme dans la terre, entre 2 et 3 cm de profondeur.


15
Photo 8: Pupes de B. dorsalis (Faye,
2014)
1.3.2.4. Distribution géographique
La mouche orientale est originaire d'Asie. Elle a
été signalée au Bangladesh, au Bhoutan, en Cambodge, en
Chine (Sud : Fujian, Guangdong, Guangxi, Guizou, Hainan, Hunan, Sichuan,
Yunnan), aux Emirats Arabes Unis, à Hong-Kong, en Inde, au Japon, au
Laos, au Myanmar, au Népal, au Pakistan, au Sri Lanka, en Taiwan, en
Thaïlande et au Viet Nam (Berger, 2005) ; (Drew, et al., 2005) ;
(Bai, et al., 2014) ; (Yang, et al., 2013). En Afrique elle
est signalée en Angola, au Bénin, au Burkina Faso, au Burundi, au
Cameroun, en Centrafrique, au Tchad, au Congo, aux Comores, en Côte
d'Ivoire, en République Démocratique du Congo, en Guinée
Equatorial, en Ethiopie, au Gabon, en Gambie, au Ghana, en Guinée, en
Guinée-Bissau, au Kenya, au Liberia, au Mali, en Mauritanie, à
Mayotte (France), au Mozambique, en Namibie, au Niger, au Nigeria, au
Sénégal, en Sierra Leone, au Soudan, en Tanzanie, au Togo, en
Ouganda et Zambie (Maiko, et al., 2007) ; (De Meyer, et al.,
2010) ; (N'Depo, et al., 2009) ; (Vayssières, et al.,
2011).
Bactrocera dorsalis est présente en
Amérique du Nord aux Etats-Unis en Californie, Floride, où elle a
été éradiquée (Stewart, 2014), elle est
signalée à Hawaii depuis 1945. Par contre elle est absente en
Europe.
1.3.2.5. Biologie et écologie
La mouche orientale des fruits B. dorsalis a le
même cycle biologique que C. capitata sans diapause. Le cycle de
vie de B. dorsalis est décrit par la figure 2.
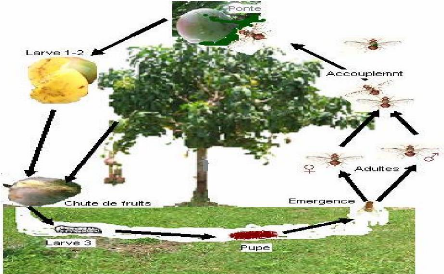

16
Figure 2: Cycle de vie de Bactrocera
dorsalis (Mbaye Ndiaye, 2007)
? Reproduction
Le développement des stades immatures, dans les
conditions de laboratoire, se fait à la température de 28 #177; 1
°C ; 50 #177; 8 % d'humidité relative ; photopériode L12:
D12 et dure 25 jours : l'incubation des oeufs dure 1,2 jours, le
développement larvaire 11,1 jours et la pupaison jusqu'à
l'émergence des adultes 12,4 jours. L'espérance de vie dès
après l'émergence des adultes est de 75,1 jours pour les femelles
et 86,4 jours pour les mâles. La fécondité nette et la
fertilité moyenne nette sont respectivement de 794,6 et 608,1 oeufs,
tandis que la ponte moyenne est de 18,2 oeufs. Avec plusieurs
générations par an, le temps moyen d'une génération
est de 31 jours (Ekesi, et al., 2006) ; (Geurts, et al.,
2014).
1.3.2.6. Plantes hôtes
B.dorsalis attaque plus de 40 espèces de
plantes (Vayssières, et al., 2005) ; (Ekesi, et al.,
2006) ; (Mwatawala, et al., 2006) ; (De Meyer, et al., 2007)
; (Rwomushana, et al., 2008) ; (Cugula, et al., 2013); qui
incluent la mangue (Manguifera indica), l'orange (Citrus
sinensis), la banane (Musa spp), la papaye (Carica
papaya) et la goyave (Psidium guajava), mais la mangue semble
être la plante-hôte préférée.
1.3.2.7 Importance économique
La mouche orientale des fruits cause chaque année des
pertes de l'ordre de 50 % de la production fruitières en Afrique ces dix
dernières années. Au Sénégal, dans la région
de la Casamance les pertes de production depuis l'introduction de B.
dorsalis étaient estimées à environ 60 tonnes
à l'hectare. Avec la combinaison de plusieurs méthodes de luttes
entre 2010 et 2013 (élimination des mâles, lâchers du
parasitoïde Fopius arisanus), les pertes dues à B.
dorsalis sont passées de 60 tonnes à 45 tonnes de mangues
infestées par hectare (DPV, 2013). En plus de la perte de la culture, la
présence de cette espèce nuisible a une incidence sur le
potentiel d'exportation de l'Afrique. Les exportations de fruits tropicaux sont
régulièrement refusées et détruites dans les ports
européens d'entrée en raison de la détection de
l'infestation par les mouches des fruits (Guichard, 2007).
1.4. LA LUTTE
L'objectif de la lutte est de réduire les pertes de
rendement en fruits et légumes dues à une infestation des mouches
et améliorer la qualité des fruits en éliminant les larves
et les dégâts causés par l'insecte.
Il existe plusieurs méthodes de contrôle de la
mouche des fruits dont entre autres, l'hygiène phytosanitaire du verger
(prophylaxie), la techniques de lâchers d'insectes stériles,
l'application

17
des appâts, l'élimination des mâles avec
paraphéromones (Méthyl eugénol, Terpenyl, acétate,
etc.), et l'utilisation d'agents de lutte biologique tels que les
parasitoïdes (parasites d'oeufs: Fopius arisanus), les
prédateurs (fourmi prédatrice tisserande : Oecophylla
longinoda) et les agents pathogènes (Champignon pathogène :
Metarhizium anisopliae, Beauveria bassiana).
Des mesures correctives sont également utilisées
pour prévenir ou réduire les dommages dues aux mouches des
fruits. Celles-ci ne permettent malheureusement pas de supprimer directement
les populations de mouches des fruits. Il s'agit de l'ensachage des fruits qui
consiste à protéger le fruit avec un sac en papier (transparent)
avant que le fruit n'atteigne le stade avant maturité, stade susceptible
d'être le plus attractif ; de la récolte précoce avant
maturité et le traitement post-récolte des fruits.
1.4.1. Les méthodes de lutte préventive
1.4.1.1. La prophylaxie
La prophylaxie, c'est le ramassage et la destruction des
fruits piqués par les mouches. Ces fruits deviennent rapidement de
véritables nids à mouches qui vont réinfecter les cultures
(Deguine, et al., 2011).
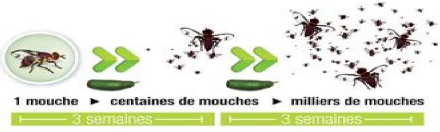
Figure 3: Capacité invasive des
Tephritides (Deguine, 2011)
1.4.1.2. L'assainissement du verger
Les vergers mal gérés ou abandonnés et
une variété d'hôtes sauvages peuvent résulter
à une forte montée de la population des mouches des fruits. Ceci
est un exercice très laborieux, mais peut être très
efficace si les fruits sont ramassés et détruits deux fois par
semaine pendant toute la saison.

B
A

18
Photo 9: Désherbage d'un verger en A et
installation de cuvette en B (Ndiaye, 2007)
Les fruits ramassés peuvent être enfouis dans le sol
à plus de 20 cm dans le sol pour éviter les
émergences d'adultes à partir de fruits
superficiels ; mis dans des sacs en plastiques de couleur noire puis
exposés au soleil pendant 3 jours et incinérés dans un
trou ou un fût vide (Ndiaye & Dabo, 2007).

Photo 10: Enfouissement et ensachage des
fruits infestés tombés (Ndiaye, 2007)
Dans le cas des zones où est mis en oeuvre un programme
de lutte biologique avec lâchers de parasitoïdes, les fruits
tombés servent habituellement comme réservoirs de
parasitoïdes qui attaquent les mouches des fruits. A cet égard, les
fruits ramassés peuvent être compostés en les
déversant dans un Augmentorium plutôt que l'enfouissement et
l'incinération des fruits. L'augmentorium sert à la fois à
l'assainissement du verger et à la conservation des ennemis naturels des
mouches des fruits (Ekesi & Billah, 2010).

A
B

19
Photo 11: Un Augmentorium de légumes en A
(Deguine, 2011) et de mangues en B (Billah,
2010)
1.4.1.3. L'ensachage des fruits
L'ensachage ou le gainage des fruits de façon individuel,
avec papier journal ou des sacs en
papier pour empêcher que les mouches femelles gravides
ne pondent leurs oeufs dans les fruits. Avec cette technique on peut produire
des fruits exempts d'attaques par les mouches. Elle est efficace quand les
fruits sont ensachés assez tôt bien avant les attaques. Bien que
laborieux, il s'agit d'une méthode efficace pour les fruits
destinés à l'exportation (Ndiaye & Dabo, 2007) ; (Ekesi &
Billah, 2010).

Photo 12: Mangue ensachée avec du
papier journal (Ndiaye, 2007)
1.4.1.4. La récolte précoce
Le développement des mouches des fruits ne se produit pas
dans certains fruits comme la
papaye, la banane et la sapotille quand ils sont 100% verts.
Seuls les fruits mûrs sont de bons hôtes. Ainsi la récolte
précoce pour prévenir une infestation par les mouches des fruits
est une technique importante dans la production de ces fruits. Bien que la
récolte précoce soit pratiquée pour la mangue, notamment
au Kenya et au Sénégal, cette pratique n'est pas efficace car
certaines espèces comme la mouche orientale des fruits B. dorsalis
et la mouche

A B

20
méditerranéenne des fruits C. capitata
sont capable d'infester des mangues vertes immatures ou matures (Ekesi
& Billah, 2010).

Photo 18: Mangues récoltées
avant maturation (Ndiaye, 2007)
1.4.1.5. Les plantes pièges et attractifs
alimentaires
Les mouches passent l'essentiel de leurs temps sur la
végétation environnante. Les femelles se
rendent sur les cultures environ une heure de temps par jour
pour pondre dans les fruits et légumes. Le maïs constitue une
plante particulièrement attractive pour les mouches. C'est la plante
piège la plus efficace. L'appât GF-120 contenant le Spinosad ou le
Mazoferm peuvent être utilisés (Deguine, et al.,
2011).
Cette méthode cible les mouches adultes principalement
les femelles et vise à les attirer (et tuer) avant qu'elles n'attaquent
les fruits. L'appât attire les mouches à une certaine distance de
l'endroit d'application et induise les mouches à se nourrir. Par
conséquent, les mouches ingèrent l'insecticide et sont
tuées (Ekesi & Billah, 2010) ; (Deguine, et al.,
2011).

21
Photo 13: Utilisation de plante pièges
(Deguine, 2011)
1.4.3 Technique d'annihilation des mâles (MAT)
La technique d'annihilation des mâles (Male Annihilation
Technique en anglais) est une stratégie de contrôle qui implique
le déploiement d'une densité de stations de piégeage
contenant un leurre mâle combiné avec un insecticide. L'objectif
est de réduire les populations de mouches des fruits mâles
à des niveaux bas afin d'avoir un taux d'accouplement réduit. Le
MAT est actuellement promu par l'ICIPE et l'IITA en Afrique comme une
composante de la stratégie de lutte intégrée pour les
mouches des fruits ravageuses Bactrocera, Ceratitis et Dacus.
Les leurres sont des paraphéromones tels que le
Méthyl-Eugénol (ME), le Cuelure (CU), Trimedlure (TRI),
l'Acétate de terpinol peuvent être utilisés avec un
insecticide comme le Malathion, le Fipronil, le Spinosad et
déployés dans les vergers et leurs périphéries
(Ekesi & Billah, 2010). Au Sénégal le Malatrap est
utilisé (DPV, 2014). Les abeilles, les coccinelles, les
microguêpes et tous les autres insectes ne réagissent pas à
cette odeur (Deguine, et al., 2011) ; (Manrakhan, et al.,
2009).

Photo 14: Piège en seau de fabrication
locale à plus de 1,5 m du sol (Ndiaye, 2007)
1.4.4. Les stations d'appâts : traitement par
tâche
Une station d'appât est un dispositif distinct qui combine
un leurre ou un appât avec un produit
toxique qui attire et tue les mouches des fruits avec ou sans
retentions des mouches. Les stations pourraient être un dispositif
récupérable ou biodégradable (écales de noix de
coco) qui peut rester sur le terrain. L'attractif qui peut être
utilisé dans les stations d'appâts peut être
spécifique aux mâles (Méthyl-Eugénol, Cuelure...) ou
peut être généralisé (mâle et femelle) avec
l'utilisation par exemple du Mazoferm ou le GF-120 (Ekesi & Billah, 2010) ;
(Zakari-Moussa, et al., 2012) ; (Zakari-Moussa, et al., 2014)
; (Vayssières, et al., 2010).

22
1.4.5. La lutte biologique
La lutte biologique est le choix spécifique et
l'utilisation des organismes bénéfiques (parasitoïdes,
prédateurs, ou des agents pathogènes), également
dénommées « amis des agriculteurs », pour
réduire les dommages causés par un ravageur ou une espèce
liée étroitement à un ravageur. Il existe trois principaux
types d'approches de lutte biologique qui ne s'excluent pas mais se recoupent
souvent (Ekesi & Billah, 2010):
? lutte biologique classique : il s'agit de l'importation des
ennemis naturels exotiques pour contrôler un ravageur exotique ;
? lutte biologique augmentative : il s'agit de
l'élevage en masse et des lâchers supplémentaires d'ennemis
naturels sur le terrain ;
? lutte biologique de conservation : ceci implique la
manipulation de l'environnement de telle manière que l'activité
et l'efficacité des ennemis naturels autochtones naturels comme agent de
lutte biologique est améliorée.
1.4.5.1 Utilisation des parasitoïdes
Les parasitoïdes se référant à un
groupe d'insectes bénéfiques, dont les stades immatures se
développent sur ou dans un insecte-hôte unique (ravageur), pour
finalement l'éliminer. Les parasitoïdes utilisés
appartiennent à l'ordre des Hyménoptères et aux familles
des Braconidae, Figitidae, Diapiridae, Pteromalidae (Ovruski & Schliserman,
2012).
En Afrique, l'une des réussites les plus remarquables
de la lutte biologique classique contre les mouches des fruits est
attribuée à l'utilisation des parasitoïdes des oeufs,
Fopius arisanus, contre bactrocera dorsalis. (Ekesi &
Billah, 2010) (Lux, et al., 2003) (Mouhamed, et al., 2010).
Récemment, un nouveau parasitoïde a été
découvert contre Ceratitis capitata (Wiedemann) aux
Açores, il s'agit de Aphaerata ceratitivora (Hymenoptera,
Braconidae) (Achterberg, et al., 2012) (Ovruski & Schliserman,
2012) (Montoya, et al., 2012) (Garcia & Ricalde, 2013) .


23
Photo 15: Lâchers de parasitoïdes
en Casamance (DPV, 2014)
1.4.5.2. Les prédateurs
Un prédateur est essentiellement un organisme qui se
nourrit de ses proies directement et qui
peut en consommer un grand nombre au cours de sa vie. (Ekesi
& Billah, 2010). A l'IITA, au Bénin, la fourmi tisserande africaine
Oecophylla longinoda utilisé pour la suppression des mouches
des fruits (Mele, et al., 2007). D'autres prédateurs naturels peuvent
jouer un rôle dans le contrôle des mouches comme les Syrphes
(prédateur de pucerons), les coccinelles, les araignées
telluriques avec leurs toiles au niveau du sol (Deguine, et al.,
2011).
1.4.5.3. Les agents pathogènes
Un pathogène est un organisme pathogénique,
généralement une bactérie, un champignon, un
protozoaire ou un virus. Les champignons pathogènes
peuvent être utilisés pour la suppression des mouches des fruits
en ciblant l'adulte ou les stades larvaires à la pupaison. La recherche
à l'ICIPE a identifié un puissant isolat de champignon (isolat
Metarhizium anisopliae ICIPE 20) (Ekesi & Billah, 2010). D'autres
champignons de la même classe (Hyphomycetes) ont été
testés sur différentes espèces de mouches des fruits
(Sanjaya, et al., 2013) (Awuor, 2010) (Toledo, et al., 2006). Il a
été testé aussi l'efficacité d'une souche de
Bacillus thuringiensis sur la mouche méditerranéenne au
Maroc (Aboussaid, et al., 2009) (Alfonso Molina, et al.,
2010) (Che Raghi, et al., 2012) ; (Shi, et al., 2012) ;
(Daniel & Baker, 2013) ; (Ekesi, et al., 2014) ; (Ming-Zhe, et
al., 2014)
1.4.5.4. La Technique de l'Insecte Stérile
(TIS)
C'est une technique de contrôle génétique
où on se sert de l'espèce pour son contrôle. Elle
consiste à produire à grande échelle, les
mouches mâles nuisibles à contrôler et la libération
de ces insectes stériles sur le terrain. Les mouches mâles
stériles s'accouplent avec les mouches

24
sauvages mais ne génèrent pas de descendants.
(MOSCAMED, 2014) (Quilici & Vayssières, 2010) (Juan-Blasco, et
al., 2014).
1.4.6. Traitements post-récolte
1.4.6.1. Effet des traitements à la chaleur
Les traitements thermiques de quarantaine n'ont pas encore
été bien introduits en Afrique de
l'Ouest. Un essai a été conduit au Burkina Faso
en 2012, dont l'objectif est de tuer les oeufs et les larves de la mouche
B. dorsalis présents dans des fruits de qualité
commerciale. Un réservoir équipé d'un
élément chauffant et d'une pompe à eau avec capteur a
été utilisé. Un traitement à l'eau chaude,
entrainant une température à coeur de 46,5 °C pourrait
être la base d'un traitement de quarantaine pour les mouches des mangues
ouest-africaines (Self, et al., 2012). La chaleur peut être aussi obtenue
par utilisation d'air chaud forcé ou de vapeur chaude car une
température supérieure à 45°C tue les larves et les
oeufs des mouches. Ces traitements sont ensuite suivis ou non d'un
refroidissement rapide des fruits qui peut être réalisés
par ventilation (air froid) ou par hydrocooling (eau) (Ducamp Collin,
et al., 2007) .
1.4.6.2. Traitement aux micro-ondes
L'emploi de micro-ondes est aussi une technique permettant
d'augmenter la température à coeur
des fruits (Ducamp Collin, et al., 2007).
1.4.6.3. Traitement par irradiation
Les irradiations aux rayons X ou gamma ont été
utilisées lors du traitement des fruits de
quarantaine contre les mouches des fruits. Les recherches
accomplis à Hawaii ont montré qu'avec une Krad (15-100) de rayons
gamma on peut traiter beaucoup de fruits et légumes infestés par
la mouche méditerranéenne des fruits (Ducamp Collin, et al.,
2007) ; (Nouira, 2008) ; (Rao, et al., 2014).
1.4.7. La lutte intégrée
La lutte intégrée est un système de gestion
des populations de ravageurs qui, dans le contexte
de l'environnement associé et des dynamiques des
populations des espèces nuisibles, met en oeuvre toutes les techniques
appropriées, d'une manière aussi compatible que possible, pour
les maintenir à des niveaux inférieurs à ceux causant des
dommages d'importance économique (FAO 1967). La lutte
intégrée ou Integrate Pest Management (IPM) en anglais, est la
combinaison de ces différentes méthodes de lutte contre les
mouches des fruits pour une bonne production de mangues et l'utilisation de
traitements chimiques avec des pesticides à seuil.

25
1.5. Metarhizium acridum
Metarhizium anisopliae var acridum (Driver et Milner)
a été élevé au rang d'espèce sous le nom de
M. acridum (Driver et Milner) J.F. Bischoff, Rehner et Humber
(Bischoff, et al., 2009). Selon Bischoff et al. 2009, la taxonomie de
M. acridum se présente comme suit :
Règne : Fungi
Division : Ascomycota
Classe : Sordariomycetes
Ordre : Hypocreales
Famille : Clavicipitacea
Genre : Metarhizium
Espèce: Metarhizium acridum
Beauveria bassiana (Bals.) et Metarhizium
anisopliae (Met.) Sorokin sont deux espèces de champignons
entomopathogènes, appartenant au groupe des Hyphomycetes, qui sont les
habitants naturels du sol, où ils se trouvent infecter un large
éventail d'espèces d'insectes qui passent au moins une
étape de leur cycle de vie dans le sol (Toledo, 2006).
Metarhizium acridum infecte une large gamme
d'insectes y inclus des insectes nuisibles et des entreprises ont
développé de biopesticides contenant les spores de ce champignon
à travers le monde. En général, il y a une souche efficace
pour chaque groupe d'insectes, par exemple les termites, les mouches des
fruits, les thrips, les moustiques etc. Il y a deux types de formulations du
Metarhizium : une formulation sèche et une formulation huileuse
(Kooyman, 2010).
1.5.1. Modes d'infection du Metarhizium acridum
La voie la plus commune d'infection par les champignons
entomopathogènes est via le tégument externe bien que l'infection
par le tube digestif et les stigmates soient possible. Le processus est
caractérisé par une série d'évènements
systématiques et intégrés. Il va de l'attachement de la
spore au corps de l'insecte, à sa germination, la
pénétration dans la cuticule, sa croissance et sa
prolifération à l'intérieur de l'hôte (AGRHYMET,
2010). Le développement de la maladie fongique se fait en plusieurs
étapes :

26
1.5.2. Fixation, germination et pénétration
du champignon sur l'hôte
1.5.2.1. Fixation : interactions hydrophobes
La cuticule de l'insecte est le premier obstacle à
franchir par les spores fongiques. Les conidies
et la cuticule sont hydrophobes, ce qui provoque une
interaction passive entre elles. Plusieurs facteurs sont présumés
contribuer à cette interaction notamment la structure de la couche
cuticulaire et la couche de protéines hydrophobes de la paroi
cellulaire. Les protéines hydrophobes produisent de l'hydrophobine qui
va faciliter l'initiation de l'adsorption non spécifique des conidies
à la surface de la cuticule et la formation subséquente
d'appressoriums fongiques.
1.5.2.2. Germination et pénétration
fongique
Pour germer, la plupart des champignons entomopathogènes
ont besoin de nutriments
exogènes. La cuticule, à partir de sa couche
externe, dispose de lipides, d'alcanes, des acides aminés, des sucres
complexes (acétylglucosamines), des alcools secondaires, du glucose, de
la chitine, de l'amidon, des acides gras qui servent de sources
d'éléments nutritifs pour la germination des champignons.
Afin de pénétrer la cuticule pendant la
germination, les champignons utilisent leurs appressoriums pour s'attacher
fermement à la cuticule et utiliser la pression physique ainsi qu'une
batterie d'enzymes (protéases, chitinases et lipases) qui
dégradent et affaiblissent la cuticule. Les hyphes
pénètrent dans la cuticule pour atteindre
l'hémocèle. Une fois dans l'hémocèle, les hyphes se
divisent en parties appelées cellules fongiques qui se multiplient
à travers la formation de bougeons. Pendant la pénétration
de la cuticule, le champignon produit un pigment rouge, l'oosporéine,
qui pousse la cuticule à virer au rouge (Photos 16 et 17) (AGRHYMET,
2010).

Photo 16: Cadavres de B.dorsalis
femelle (position dorsale et ventrale) (Faye, 2014)

27
Photo 17: Mouches mortes mâle et femelle
de C.capitata de coloration rose tuées par
le
Metarhizium acridum (Faye, 2014)
1.5.3. Les réponses immunitaires de l'hôte
1.5.3.1. La réponse humorale
Les phénoxylidases, les lectines, les peptides et les
protéines cuticulaires agissent en réponse
humorale immunitaire pour entraver la germination des conidies au
niveau de leurs de fixation sur la cuticule. Cependant, ce processus n'est pas
encore bien connu.
1.5.3.2. La réponse immunitaire cellulaire
Les B-1-3 glucans produites par les parois de cellules fongiques
activent la réponse immunitaire
cellulaire par des cellules spécialisées qui
reconnaissent et encapsulent ces dernières par phagocytose. Les
hémocytes et les plasmocytes s'agrègent au niveau de la zone de
la

28
pénétration fongique ce qui suggère la
libération d'un signal chimique dans l'hémolymphe au cours du
processus initial de pénétration. Les granulocytes
s'adhèrent aux cellules fongiques pour provoquer la lyse de sa paroi
cellulaire (Awuor, 2010).
Cependant, Metarhizium acridum est capable
d'éviter les hémocytes en exprimant dans les 20 minutes un
gène Mcl qui donne le code d'une protéine qui ressemble à
celui du collagène. Cette dernière migre vers la paroi cellulaire
où elle masque les ß-1-3 glucans afin d'éviter leur
détection par les cellules du système immunitaire de l'insecte
(AGRHYMET, 2010).
1.5.4. La sporulation
La germination va dépendre des conditions environnantes
et aussi de la physiologie de l'hôte (composition biochimique de la
cuticule de l'hôte), qui peuvent la favoriser ou l'inhiber Pour se
développer, les cellules fongiques absorbent les nutriments de
l'hémolymphe et ainsi elles entrent en concurrence avec l'hôte.
Lorsque l'humidité relative est assez élevée, le
champignon pénètre la cuticule en commençant par les
articulations où cuticule est plus mince et sporule à
l'extérieur du cadavre.

A B
Photo 18: Sporulation du Metarhizium
acridum au niveau des articulations en A et de
l'ébauche alaire
de Bactrocera dorsalis en B (Faye, 2014)

29
Chapitre II : Matériels et méthodes
L'étude de l'efficacité de l'entomopathogène
Metarhizium acridum sur les larves et les adultes
des mouches des fruits a été conduite entre le 30
Juin 2014 et le 15 Septembre 2014. Les locaux du laboratoire d'Entomologie, des
Entomopathogènes et de Zoologie Agricole de la Direction de la
Protection des Végétaux (DPV) de Dakar
(Sénégal).
Pour les travaux de laboratoire, chacun des tests lancés a
son propre matériel et sa méthodologie qui lui est propre.
2.1. Conditions expérimentales
Les tests sur les mouches adultes ont été faits en
condition de laboratoire, la température
constante a été réglée à 26
#177; 2 °C et l'humidité relative était comprise entre 55-75
#177; 5 % ont été enregistrées grâce au
thermo-hygromètre (Photo 19). Les tests sur les larves ont
été faits dans les conditions ambiantes.

Photo 19: Thermo-hygromètre (Hobo)
2.2. Matériel
2.2.1. Matériel de préparation,
d'inoculation, de comptage des conidies
Dans le cadre du test de viabilité des spores, de la
préparation des solutions fongiques et du calcul de la concentration du
nombre de conidies par millilitre de solution, il a été
utilisé (Photo 20) :
? pour la préparation du milieu : un erlenmeyer, une
plaque chauffante avec un agitateur magnétique, du Sabouraud Dextrose
Agar (SDA), une spatule, une balance Mettler-Toledo, des boîtes de
Pétri, de l'eau distillée, l'autoclave, des flacons de 200 ml
;
? pour la préparation des solutions fongiques et
inoculation des milieux : une spatule, des tubes des Falcon, de l'eau
distillée, du Tween-80, une micropipette de 40 ul, un portoir, un vortex
;

30
? -pour le calcul de la concentration de spores et le test de
germination : un microscope optique, un hémocytométre de
Neubauer, une micropipette, un compteur.

4
1
2
3
5
6
7
8
12
9
10
11
Photo 20: Matériel pour le test de
germination : 1 Hémocytomètre, 2 micropipette, 3 embouts, 4
microscope, 5 tubes de Falcon et portoir, 6 vortex, 7 lamelles, 8 boîtes
de Pétri, SDA, 10 balance Mettler-Toledo et 11 Tween-80
2.2.1. Matériel d'élevage
Pour la collecte des données sur la température
et sur l'humidité relative en conditions contrôlées, il a
été utilisé un thermo-hygromètre (Hobo) qui
enregistre les données téléchargeables via un ordinateur
(Photo 19). Pour les insectes adultes, des cages en plexiglas
démontables (150 × 150 × 240 mm) (Photo 21) BugDorm - 1 ont
été utilisées avec les trois bords tapissés de
mailles fines et le quatrième bord en plexiglas où se trouve une
ouverture pour les manipulations. Pour le test sur les larves des tentes
d'élevage (60 cm x 60 cm x 60 cm) dont les deux côtés sont
tapissés d'un tissu aux mailles fines et les deux autres, faits d'un
imperméable transparent pour pouvoir compter les individus à
travers (sur l'un de ces côtés se trouve une ouverture pour
permettre la manipulation, l'alimentation des insectes et le

31
nettoyage). Des bocaux confectionnés à partir de
bouteilles d'eau vide ont été utilisés pour contenir le
sable mélangé avec les spores sèches et les mangues
infestées. Les insectes ont été nourris avec du sucre pure
de canne et des flacons avec du coton imbibé d'eau

1
2
Photo 21 : Cages en 1 et tentes en 2
d'élevage au laboratoire 2.2.2. Matériel
d'incubation
Pour l'incubation des cadavres d'insectes, il a
été utilisé des boîtes de Pétri en verre de
10 centimètre de diamètre, du papier buvard, de l'eau de javel,
de l'alcool, de l'eau distillée, un incubateur (Photo 22).

Photo 22: Incubateur
2.2.3. Matériel d'observation
Pour le comptage des spores du test de germination, un
microscope optique à été utilisé. Pour les
observations (Photo 23) concernant la sporulation du champignon sur les
cadavres des

32
insectes, un stéréomicroscope branché
à un écran de télévision a été
utilisé. Ce dispositif a permis d'observer à de forts
grossissements les insectes, de bien voir la germination du champignon sur
leurs corps et de pouvoir prendre des photographies.

Photo 23: Matériel d'observation au
laboratoire 2.3. Matériel biologique
2.3.1. Metarhizium acridum
La formulation sèche des spores du Metarhizium
acridum utilisée dans le cadre de nos tests a été
obtenue de SENBIOTEC SA du Sénégal en 2012. Les spores sont sous
forme de poudre sèche verdâtre et conditionnées dans un
sachet en aluminium plastifié de 300 grammes. Chaque gramme de poudre
contient 5 x 1010 spores avec une viabilité supérieure
ou égale à 85 %, à l'emballage du produit.
2.3.2. La mouche
2.3.2.1. Ceratitis capitata (Wiedemann)
Les mouches proviennent de Hilo, Hawaii, et sont
importées par le laboratoire de Zoologie Agricole de la DPV pour les
besoins de la lutte biologique contre les mouches des fruits au
Sénégal.
Le lot de pupes a été pesé et
séparé dans deux pots en plastique et mis dans une tente
d'élevage.
Après émergence, les adultes de C. capitata
ont été alimentés avec de l'hydrolysat de sucre et
l'eau contenue dans des flacons avec du coton qui sont renouvelés tous
les deux à trois jours.
L'entretien du local, de la tente et des cages
d'expérimentation est fait quotidiennement. Les mouches mortes sont
récupérées à l'aide d'un pinceau. Les cages
utilisées avec le Green

33
Muscle® sont rincées avec de l'eau de
javel et de l'eau pour un prochain usage. Des adultes, de 8 à 12 jours,
actifs pour la reproduction ont été utilisés.
2.3.2.2. Bactrocera dorsalis (Hendel)
Elles proviennent de mangues infestées
récupérées au niveau de vergers fortement infestés
de la Casamance et mises en incubation dans des pots en plastiques contenant du
sable. Les pupes ont été récupérées et mises
dans des cages en plastique. Les adultes ont été mis dans des
cages en plexiglas avec de la nourriture et de l'eau. Le même traitement
avec les Cératites a été respecté comme pour la
Cératite. Les adultes âgés de 10 à 14 jours et
sexuellement actifs ont été utilisés.
2.3. La méthodologie
2.3.1. Test de viabilité des spores du Metarhizium
acridum
Metarhizium acridum est produit et vendu sous
différents noms en Afrique et en Australie. Le produit
élaboré en Afrique, appelé Green Muscle®,
est manufacturé en Afrique du Sud et au Sénégal. Il peut
être fourni sous formes de spores sèches (formulation TC) ou de
concentré miscible à l'huile (formulation OF). Puisque le produit
peut être affecté par des températures
élevées pendant le transport et/ou le stockage, il est toujours
bon de tester la viabilité des pores avant emploi. Un échantillon
des spores sèches est prélevé avant et après
l'application pour déterminer le pourcentage de spores viables
utilisées.
Cet échantillon est dilué avec de l'eau
mélangé avec du Tween 80. La viabilité est mesurée
en estimant le pourcentage de germination des spores après une
incubation de 24 heures entre 25 et 26°C dans 5 boîtes de
Pétri contenant du Sabouraud Dextrose Agar (SDA). Après
l'incubation, le nombre de spores germées et non germées est
noté en utilisant le microscope (X40). Les pourcentages de germination
vont être calculés selon la formule suivante (Mohamed &
Diallo, 2007) :
% de germination = [a / (a + b)] * 100 a= nombre de spore
germées
b= nombre de spores non germées Avec a + b = 100
2.3.1.1. Préparation du milieu de culture

34

35
Le milieu de culture utilisé pour les tests de
viabilités des spores est le Sabouraud Dextrose Agar (SDA). La
préparation d'un litre de milieu de culture a consisté à
peser 45 g de SDA à l'aide d'une balance de précision (Toledo).
La quantité de SDA pesée a été versée dans
un erlenmeyer, chauffée avec une plaque chauffante et
homogénéisée à l'aide d'un barreau
magnétique jusqu'à la dissolution complète du SDA. Le
mélange obtenu est ensuite versé dans une éprouvette
graduée et ajustée à 1 litre avec de l'eau
distillée. Le milieu ainsi obtenu est réparti dans cinq
bouteilles de 250 ml, à raison de 200 ml par bouteille. Les bouteilles
ont été mises dans l'autoclave pour être
stérilisée à la chaleur humide à 121 ° C
pendant 45 minutes, puis refroidies dans un bain marie à 55°C. Une
seule bouteille a été utilisée pour le coulage dans nos 10
boîtes de Pétri et les 4 autres ont été
conservées pour une prochaine utilisation.
2.3.1.2. Préparation de l'inoculant fongique
Deux solutions mères ont été
préparées avec deux paquets différents de Green
Muscle®: l'un venant du congélateur et un second venant
du magasin de stockage. Une quantité de 0,01 g de poudre sèche de
Green Muscle® a été pesée et placée
dans un tube de Facon avec 10 ml d'eau distillée et du Tween 80.
Après homogénéisation à l'aide d'un vortex pendant
5 minutes, la technique de dilutions successives a été
utilisée pour ensuite ensemencer les boîtes de Pétri. La
dilution 10-2 a été utilisée pour le test de
viabilité des spores (Figure 4).
0,01 g de Metarhizium acridum
10 ml 9 ml 9 ml
Dilution = SM = 101 10-1 10-2
Figure 4: Technique des dilutions
successives
A l'aide de l'hémocytomètre, la concentration de
spores / ml a été déterminée pour les dilutions
10-1 et 10.2.
2.3.1.3. Calcul de la concentration en spores avec
l'hémocytomètre Cinq carrés ont
été comptés :
1. Compter le nombre de spores dans chacun des 5
grandes places.
2. Additionner le nombre total de spores comptés dans 5
carrés.
3. Répéter le comptage sur une seconde grille comme
indiqué ci-dessus
4. Calculer le nombre de spores moyen: Soient a
et b = total pour chaque grille.
Soit X = nombre moyen de 5 places.
X = (a + b) / 2
a = comptage des 5 carrés haut
b = comptage 5 carrés bas
X = moyenne des deux niveaux (haut et bas)
5. Utiliser 0,1 pl (microlitre) de suspension de
spores de plus de 25 carrés. Soit c =
concentration de spores par ml
c = X 5 x 104
Soit n = nombre de dilution
C = la concentration de spores dans la solution
d'origine
C = c x 10 n
2.3.1.4. Test de germination
Un volume de 0,1-0,2 ml de la suspension de spores (1 à
2 gouttes de pipette Pasteur) a été étalé sur la
gélose et avant de placer le couvercle sur la boîte de
Pétri. L'utilisation d'un microscope a permis de vérifier que les
spores sont bien réparties c'est-à-dire que les spores
individuelles peuvent être facilement distinguées les unes des
autres. Les boîtes ainsi préparées sont incubées
dans une étuve à 25 - 30 °C pendant 20 à 24 heures,
puis un microscope et un compteur sont utilisés pour le comptage des
spores germées et non germées. Toute spore en herbe devrait
être considérée comme une spore germée. Les spores
germées et non germées ont été comptées en
déplaçant le champ de vision du microscope de façon
à couvrir une large zone de la boîte de Pétri
jusqu'à avoir 100 spores (germées + non germées).
2.3.2. Test de quantification du nombre de spores
collectée par mouche
Cette expérimentation effectuée sur C.
capitata et sur B. dorsalis est destinée à
déterminer le nombre de conidies qu'une seule mouche a pu collecter
après une exposition au substrat traité. Dix-huit mouches (9 par
espèce) mâles et femelles de B.dorsalis et de
C.capitata adultes, contenues dans une cage en plexiglas (150 X 150 X
240 mm), ont été exposées à 0,3 ; 0,15 et 0,075 g
de spores de Metarhizium réparties de façon uniforme sur
un tissu en velours contenu

36
dans trois chambres d'auto-inoculation fait à partir
d'un flacon vide. Les mouches ont séjourné dans la chambre de
contamination respectivement pendant 1, 2 et 3 minutes avec 2
répétitions par temps de séjours. Immédiatement
après l'exposition, 10 mouches vont être placées
individuellement dans des tubes de Falcon contenant 2 ml d'eau
mélangée à 0,05% de Tween-80. Les tubes vont être
agités avec un vortex pendant 5 minutes pour enlever les spores du corps
et des pattes de l'insecte. Le nombre de spores est ensuite estimé en
utilisant un hémocytomètre.
2.3.3. Tests préliminaires de la
pathogénicité des spores du Metarhizium acridum (Maximum
challenge tests)
2.3.3.1. Effet du Metarhizium acridum sur les adultes
de Ceratitis capitata
Vingt mouches adultes, mâles et femelles, de
Ceratitis capitata, contenus dans une cage, ont été
exposées à 0,3 g de spores sèches de Metarhizium
acridum réparties de façon uniforme dans une chambre
d'auto-inoculation à l'aide d'une spatule. La chambre est
composée d'un tube cylindrique en plastique (6,8 cm de longueur et 3,5
cm de diamètre) garnie d'un tissu de velours. Une
extrémité est munie d'un filet de moustiquaire et l'autre
perforée d'un trou qui a servi de source de lumière pour les
mouches (Dimbi et al. 2003). Chaque mouche va séjourner pendant
3 minutes dans la chambre d'inoculation et les 20 mouches sont ensuite
transférées dans une cage. Une cage avec 20 mouches
passées dans une chambre de contamination sans spores de Metarhizium
a servi de témoin. La mortalité est enregistrée
quotidiennement et le ramassage des cadavres de mouches est fait
quotidiennement pendant 6 jours d'après Awuor en 2010. Les mouches
mortes récupérées sont lavées dans de
l'hypochlorure de sodium 2 % pendant une minute, puis dans de l'alcool 70°
C pendant une minute et rincées 3 fois avec de l'eau distillée
avant d'être mises en incubation pendant 3 à 5 jours dans des
boîtes de Pétri contenant du papier buvard imbibé d'eau.
L'expérience a été répétée 2 fois.
L'étude a démarré le 05 Août 2014 et a pris fin le
11 Août 2014.
2.3.3.2. Effet du Metarhizium acridum sur les adultes
de Bactrocera dorsalis
Vingt mouches adultes, mâles et femelles, de
Bactrocera dorsalis, contenues dans une cage, sont exposées
à 0,3 g de spores sèches de Metarhizium réparties
de façon uniforme dans une chambre d'auto-inoculation. Chaque mouche a
séjourné pendant 3 minutes dans la chambre d'inoculation et les
20 mouches ont été ensuite transférées dans une
cage. Une cage avec 20 mouches passées dans une chambre de contamination
sans spores de Metarhizium a servi de témoin. La
mortalité est enregistrée quotidiennement et le ramassage des
mouches mortes va se faire de façon quotidien durant 6 jours. Les
mouches mortes sont lavées dans de l'hypochlorure de sodium 2

37

38
% pendant 1 minute, puis dans de l'alcool 70° C pendant
une minute et rincées 3 fois avec de l'eau distillée avant
d'être mises en incubation pendant 3 à 5 jours dans des
boîtes de Pétri contenant du papier buvard imbibé d'eau.
Les mouches témoins, non contaminées, sont dans deux cages
saines. Le test est répété 2 fois.
2.3.4. Evaluation de l'efficacité de 3 doses
Metarhizium acridum sur les populations de Bactrocera dorsalis et Ceratitis
capitata, détermination de la LT 50 pour chaque dose
2.3.3.3.Conception expérimentale
L'expérimentation a été structurée
de façon à avoir 10 mouches par cage avec 3
répétitions par dose de M. acridum. Dix mouches ont
été choisies au hasard et infectées avec les 3 doses
respectives de M. acridum à savoir 0,3 g ; 0,15 g et 0,075
g.
Les cages ont été disposées dans une
conception complètement aléatoire dans la chambre
expérimentale. La mortalité a été mesurée en
pourcentage de mouches mortes à l'intérieur d'une
répétition. L'analyse à un seul facteur va être
utilisée pour comparer les moyennes où la mortalité a
été la variable d'intérêt et la virulence du M.
acridum le facteur à évaluer afin de déterminer le
temps létal 50 moyen (LT50) pour chaque dose et pour chaque
espèce.

Photo 24: Chambres d'auto-inoculation avec de
la gauche vers la droite les doses de 0,3 g ;
0,15 g et 0,075 g de
Metarhizium acridum et la chambre témoin (Faye, 2014)
2.3.3.4. Procédure expérimentale
a. Chez Ceratitis capitata
Les adultes de C. capitata ont été
contaminées avec du matériel de velours, imprégné
de 0,3 g, 0,15 g et 0,075 g de spores sèches du M. acridum
contenu dans trois chambres d'auto-inoculation. Les mouches ont
été autorisées à séjourner pendant 3 minutes
dans les chambres d'auto-inoculation Après l'installation des 3 cages
témoins où les mouches ont eu à séjourner dans une
chambre d'inoculation à blanc sans spores de la contamination des
mouches a été
faite de façon à débuter avec la plus
faible dose de Metarhizium. Par la suite les mouches
contaminées ont été transférées dans des
cages en plexiglas et alimentées avec du sucre pur et des flacons d'eau
avec du coton imbibé. Chaque dose a été
répétée 3 fois avec 10 mouches par
répétition. Les témoins ont été mis à
l'écart pour éviter toute contamination. La mortalité a
été observée et enregistrée quotidiennement pendant
6 jours à partir de la date de contamination. Afin de vérifier
les mycoses, les mouches mortes récupérées sont
lavées dans de l'hypochlorure de sodium 2 % pendant 1 minute, puis dans
de l'alcool 70° C pendant une minute et rincées 3 fois avec de
l'eau distillée avant d'être mises en incubation pendant 3
à 5 jours dans des boîtes de Pétri contenant du papier
buvard imbibé d'eau. Les mouches ont été
séparées d'une distance de 1 cm pour éviter toute
contamination ou transfert de spores d'un cadavre à l'autre.
? Chez Bactrocera dorsalis
La même procédure avec C. capitata a
été faite avec trois répétitions plus 3 cages
témoins. Les populations adultes de B. dorsalis
utilisées pour ce test sont âgées de 10 à 13
jours.
2.3.5. Transmission horizontale de
l'entomopathogène Metarhizium acridum
2.3.5.1. Transmission horizontale chez Bactrocera
dorsalis (Hendel)
a. Transfert des spores de Metarhizium: du
mâle sur la femelle
Dix mouches mâles adultes de Bactrocera
dorsalis, contenues dans une cage, sont exposées à 0,3 g de
spores sèches de Metarhizium réparties de façon
uniforme dans une chambre d'auto-inoculation pendant 3 minutes. Les mouches
mâles « donneurs » sont ensuite transférées dans
une nouvelle cage d'accouplement contenant 10 mouches femelles «
receveuses ». La mortalité des mâles et des femelles est
enregistrée et le ramassage des mouches mortes est fait quotidiennement
durant 13 jours. L'expérimentation comporte 4 répétitions.
L'étude a démarré le 05 Août 2014 et a pris fin le
19 Août 2014.
b. Transfert inverse des spores de Metarhizium
acridum: de la femelle vers le mâle Dix mouches femelles de
Bactrocera dorsalis ont été contaminées de
façon individuelle. Les mouches ont ensuite séjourné
durant trois minutes dans la chambre d'auto-inoculation contenant 0,3 g de
spores sèches. Ces mouches femelles « donneuses » sont
transférées dans une cage d'accouplement contenant 10 mouches
mâles « receveuses ». Une cage contenant le même nombre
de mouches femelles passées dans une chambre de contamination sans
spores et 10 mouches mâles sains a servi de témoin. La
mortalité va être enregistrée quotidiennement pendant 13
jours. Les mouches témoins, non contaminées, seront dans deux
cages. Le test a été répété 4 fois.

39
2.3.5.2. Transmission horizontale chez Ceratitis
capitata (Hendel)
a. Transfert des spores de Metarhizium: du
mâle sur la femelle
Dix mouches mâles adultes de Ceratitis capitata,
contenu dans une cage sont exposées à 0,3 g de spores
sèches de Metarhizium réparties de façon uniforme
dans une chambre d'auto-inoculation à l'aide d'une spatule. Chaque
mouche mâle a séjourné pendant 3 minutes dans la chambre
d'inoculation et 10 mouches mâles contaminées sont ensuite
transférées dans une nouvelle cage d'accouplement contenant 10
mouches femelles saines. Une cage contenant le même nombre de mâles
passés dans une chambre de contamination sans spores avec 10 mouches
femelles saines est utilisée comme témoin. La mortalité
des mâles et des femelles est enregistrée et le ramassage des
mouches mortes se fait quotidiennement durant 13 jours. Le test a
été répété 4 fois.
b. Transfert inverse des spores de Metarhizium: de
la femelle vers le mâle
Dix mouches femelles de Ceratitis capitata sont
contaminées de façon individuelle. Les mouches ont
séjourné durant trois minutes dans la chambre d'inoculation
contenant 0,3 g de spores sèches. Ces mouches femelles sont ensuite
transférées dans une cage d'accouplement contenant 10 mouches
mâles saines. Une cage contenant le même nombre de mouches femelles
passées dans une chambre de contamination sans spores avec 10 mouches
mâles sains a servi de témoin. La mortalité a
été enregistrée quotidiennement pendant 13 jours. Les
mouches mortes récupérées sont lavées dans de
l'hypochlorure de sodium 2 % pendant 1 minute, puis dans de l'alcool 70° C
pendant une minute et rincées 3 fois avec de l'eau distillée
avant d'être mises en incubation pendant 3 à 5 jours dans des
boîtes de Pétri contenant du papier buvard imbibé d'eau.
Les mouches témoins, non contaminées, seront dans deux cages
saines. Le test a été répété 4 fois.
2.3.6. Effet du Metarhizium acridum sur les larves de
Ceratitis capitata et de Bactrocera dorsalis
2.3.6.1. Ceratitis capitata
La méthode d'étude se fait par la technique de
l'enrobage du sol qui consiste à mélanger des
quantités définies de spores avec 400 g de sable
tamisée dans chaque pot en plastique, puis y placer des mangues
infectées et introduites auparavant dans la tente d'élevage
durant une demi-heure pour permettre aux femelles gravides de C. capitata
d'accomplir la ponte. Les larves de troisième stade de C.
capitata, après leur saut, feront leur pupaison dans le sable
infecté. L'unité expérimentale est constituée par
une mangue piquée par les mouches. Pour chaque dose, il y a 5
répétitions plus des témoins. Les pupes sont
récupérées après tamisage.

40
Cinq formulations de sable mélangé avec le
Metarhizium acridum ont été préparées avec
les doses dose suivantes :
? Une dose de 1,5 gramme de spores sèches ; ? Une dose
de 0,5 gramme de spores sèches ; ? Une dose de 0,3 gramme de spores
sèches ; ? Une dose de 0,15 gramme de spores sèches ;
? Une dose de 0,05 gramme de spores sèches ;
Après 10 jours (durée de la pupaison), un
comptage quotidien des émergences est effectué jusqu'au
21ème jour pour chacune des formulations.

1
2
Photo 25: Récupération des pupes
de B. dorsalis par tamisage (1) et
mise en place des tentes
d'élevage pour B. dorsalis (2)
2.3.6.2. Bactrocera dorsalis
Comme indiqué précédemment avec C.
capitata, la même procédure a été conduite pour
B.
dorsalis. Les mangues (variété Keitt et
Kentt mélangées) introduites dans les pots de sables ont
été sélectionnées à partir de plusieurs lots
de mangues ramassées dans différents vergers infestés de
la Casamance par les agents de la Protection des Végétaux et
rapportées au niveau du laboratoire d'entomologie agricole de la DPV.
Cinq répétitions ont été faites pour chaque dose de
Metarhizium mélangé avec 400 g de sable tamisé
contenu dans un pot et un témoin.
2.3.7. Analyse des données
Le logiciel Excel a été utilisé pour la
saisie des données. L'analyse de la variance des taux de
survie quotidienne a été effectuée avec
le logiciel GenStat 9éme Edition. La séparation des
moyennes a été faite par la méthode de la Plus Petite
Différence Significative (PPDS), lorsque

41
le test de Student-Newman-Keuls (SNK) est significatif au
seuil de 5% au moins. La transformation Arcsinus a été
utilisée afin de normaliser les données de la variance (Zar,
1999). Les moyennes et les intervalles de confiance à 95% ont servi la
présentation des courbes et des graphiques.

42
Chapitre III : Résultats
3.1. Test de viabilité des spores du Metarhizium
acridum
Deux solutions de M. acridum ont été
testées pour déterminer le pourcentage de spores viables. Les
résultats des tests sont présentés dans le tableau 1.
Tableau 1 : Résultats du test de
germination
Metarhizium du magasin (4+ C) Metarhizium
du congélateur (<0 ° C)
%germination 94,8 #177; 0,872 a 95,4 #177; 0,872
a
L'analyse a montré qu'il n'y avait pas une
différence significative entre le Metarhizium issu du magasin et le
Metarhizium du congélateur (F = 0,21 ; p = 0,529). Ce test indique que
les spores de l'inoculum entreposé dans les deux environnements (Magasin
froid et congélateur) sont viables respectivement à 94,8 et 95,4%
alors même que le taux recommandé au fabricant est d'au moins 85
%de spores viables. Pour la suite des travaux, le Metarhizium du
congélateur a été utilisé.
3.2. Test de quantification du nombre conidies
collectées par mouche
Trois chambres d'auto-inoculation ont été
préparées pour ce test dans lesquelles nous avons réparti
respectivement 0,3 g, 0,15 g et 0,075 g de spores sèches de M.
acridum. Le nombre de conidies collectées par mouche a
été estimé pour chacune des deux espèces (Tableau
2) après un temps de séjour d'une, de deux et de trois minutes
dans la chambre.
Tableau 2 : Nombre moyen de conidies
ramassées par une mouche après un temps de séjour d'une,
de deux et de trois minutes dans la chambre d'inoculation
Espèce Dose (g) 1 minute 2 minutes 3 minutes
|
B.dorsalis
|
|
|
|
|
|
|
|
|
|
|
0,3
|
1
|
000
|
000
|
3
|
900
|
000
|
8
|
150
|
000
|
|
0,15
|
|
420
|
000
|
1
|
200
|
000
|
4
|
200
|
000
|
|
0,075
|
|
275
|
000
|
|
625
|
000
|
3
|
200
|
000
|
|
C.capitata
|
|
|
|
|
|
|
|
|
|
0,3
|
1 700
|
000
|
2
|
500
|
000
|
4
|
600
|
000
|
|
0,15
|
1 170
|
000
|
1
|
850
|
000
|
3
|
800
|
000
|
|
0,075
|
750 000
|
1
|
150
|
000
|
2
|
850
|
000
|
3.3. Maximum challenge test de l'effet du Green Muscle
sur Ceratitis capitata (Wiedemann)
L'analyse effectuée pour avoir les moyennes de survie
journalières pendant les 5 jours des tests, a montré que la
survie en fonction des dates est hautement significative à partir de J
2

43
(DF= 4, p < 0,001) (Figure 5). Les courbes montrent une
même tendance pour les deux espèces
(Figures 6 et 7).
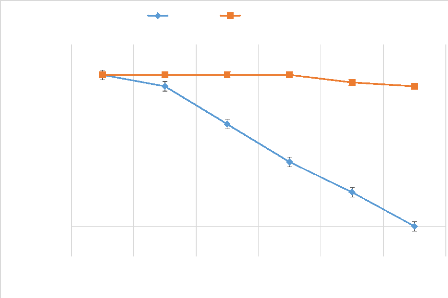
% DE SURVIE
120
100
-20
40
20
80
60
0
J 0
J 1
Traitées Non Traitées
J 2
J 3
J 4
J 5
DF= 4 ; F= 265 ; p < 0,001
Figure 5: Survie de la population de
C.capitata en fonction du temps
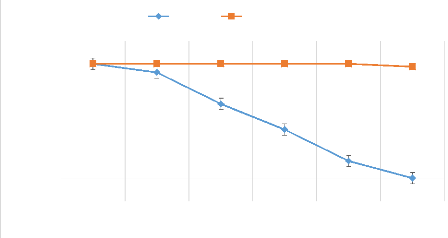
% DE SURVIE
120
100
-20
40
20
80
60
0
J 0
J 1
Traitées Non traitées
J 2
J 3
J 4
J 5
DF= 4 ; F= 11,35 ; p < 0,001
Figure 6:Survie de la population de
B.dorsalis en fonction du temps
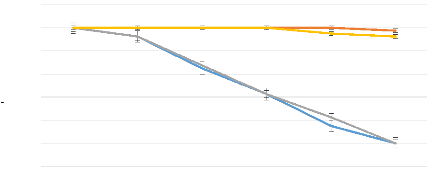
120
J 0 J 1 J 2 J 3 J 4 J 5
% SUrVIE
100
80
60
40
20
0
-20

44
B. Traitées B.N.Traitées C. Traiées
C.N.Traitées
B. dorsalis: DF = 4 ; F = 111,35 ; p < 0,001
C.capitata: DF = 4 ; F = 265 ; p < 0,001
Figure 7: Survie moyenne des populations de
B. dorsalis et de C. capitata en fonction du
temps.
Les tests ont été faits durant 5 jours, du 05 au
10 Août 2014, et les tests de sporulation du 07 au 11 Août 2014.
D'après les résultats des tests de sporulation,
l'efficacité du Green Muscle® est satisfaisante (Tableau 3.).
Tableau 3: Résultats test de sporulation
pour B.dorsalis et C.capitata
|
Tests mycoses
|
mouches sporulées
|
mouches non sporulées
|
Total
|
% de sporulation
|
|
B.dorsalis cage 1
|
18
|
2
|
20
|
90
|
|
B.dorsalis cage 2
|
19
|
1
|
20
|
95
|
|
C.capitata cage 1
|
17
|
3
|
20
|
85
|
|
C.capitata cage 2
|
18
|
9
|
20
|
90
|
1.2. Effets de 3 doses de Metarhizium 5 jours
post-contact
Les moyennes (SE) de survie de B. dorsalis et C.
capitata étaient respectivement de (59 ,42 #177; 1,841 et 58,17
#177; 1,841 au troisième jour. L'analyse de la variance a montré
qu'il y avait une différence hautement significative entre les 3
différentes doses (DF= 80, p < 0,001).
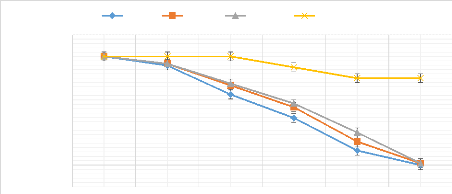
% DE SURVIE
120
100
-20
40
20
60
80
0
J 0
0,3 g 0,15 g 0,075 g Témoin
J 1
J 2
J 3
J 4
J 5

45
DF= 16 ; F= 2,16 ; p = 0,013
Figure 8: Efficacité des
différentes doses de Metarhizium acridium sur les populations
de C.
capitata dans le temps
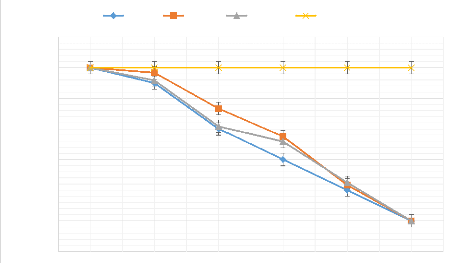
% DE SURVIE
120
100
-20
40
20
60
80
0
J 0
0,3 g 0,15 g 0,075 g Témoin
J 1
J 2
J 3
J 4
J 5
DF= 16 ; F= 2,16 ; p = 0,013
Figure 8: Efficacité des
différentes doses de Metarhizium acridium sur les populations
de B.
dorsalis dans le temps
Le test de Student-Newman-Keuls au seuil de 5% effectué
pour la séparation des moyennes, indique qu'il n'y a aucune
différence significative de l'effet entomopathogène des doses
0,15g et 0,075 g et celles-ci sont significativement différentes de la
plus forte dose (0,3 g). Les figures ci-dessous montrent les différences
de moyenne entre les différentes doses respectivement pour B.
dorsalis et C. capitata.
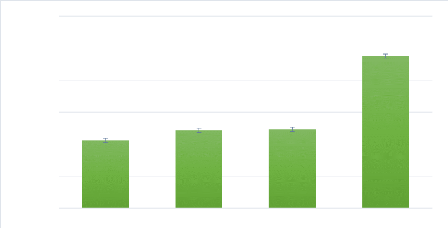
c
100
120
80
b b
% de Survie
40
20
60
0
a
0,3 g 0,15 g 0,075 g 0 g

46
Figure 10: Séparation des moyennes de
survie (#177; SE) des adultes selon la dose de
Metarhizium acridum
(les moyennes suivies par la même lettre ne sont pas
significativement
différentes au seuil 5%)
Les temps létaux 50 (LT50) pour ont été
déterminés pour les deux espèces. La dose 0,3 g est
la plus efficace avec un LT50 de 2,5 #177; 0,1 jours pour
B. dorsalis et 2,8 #177; 0,1 jours chez C. capitata (Tableau
4).
Tableau 4: Temps létal 50 % (LT50) du
Metarhizium acridum sur les populations de
B.dorsalis et de
C.capitata
Doses (g) LT 50 jours (X #177; SE)
|
B.dorsalis
|
C.capitata
|
|
0,3
|
2,5 #177; 0,1a
|
2,8 #177; 0,1a
|
|
0,15
|
3,3 #177; 0,1b
|
3,2 #177; 0,1b
|
|
0,075
|
3,2 #177; 0,1b
|
3,4 #177; 0,1b
|
3.4. Transmission horizontale
3.4.1. Transfert des conidies des mâles vers les
femelles des mouches adultes de Bactrocera dorsalis et de Ceratitis
capitata
Les moyennes (SE) des moyennes de B. dorsalis et C.
capitata étaient respectivement de
39,06 #177; 2,581 et 35,21 #177; 2,581 au troisième jour.
Deux cages témoins ont été mises en place pour les deux
espèces. L'analyse de la variance a montré qu'il y avait une
différence significative pour la combinaison des facteurs Espèce
- Date (DF= 11, p = 0,009). La figure

47
11 montre les moyennes de survie journalière des deux
espèces comparée à la survie des témoins.
Ceratitis Bactrocera C.Témoin B.Témoin
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9 10 11 12
|
|
|
|
|
|
|
|
|
|
|
TEMPS
|
% DE SURVIE
|
120 100 80 60 40 20
0
-20
|
DF= 11 ; F= 2,29 ; p = 0,009
Figure 11: Taux de survie en fonction du temps
des populations de B.dorsalis et de C.capitata
Les temps létaux 50 (LT50) des femelles « donneuses
» et des femelles « receveurs » sont donnés dans le
tableau pour chacune des deux espèces.
Tableau 5: Temps Létaux pour 50% de
survie (LT50) en jours pour les mouches mâles « donneurs » et
les femelles receveuses » avec Metarhizium acridum
LT50 jours (X #177; SE)
B.dorsalis C.capitata
|
Mâle « donneurs »
|
2,4
|
#177; 0,1 a
|
2,5
|
#177; 0,1 a
|
|
Femelle « receveuse »
|
6,7
|
#177; 0,2 b
|
5,9
|
#177; 0,2 b
|
4.2. Transfert des conidies des femelles vers les
mâles
Les moyennes (SE) de survie de B. dorsalis et C.
capitata étaient respectivement de 33,23 #177; 1,210 et 30,83 #177;
1,210 au troisième jour. Deux cages témoins ont été
mises en place pour les deux espèces. L'analyse de la variance a
montré qu'il n'y avait pas une différence significative pour la
combinaison des facteurs Espèce - Date (DF= 11, p = 0,768). Les moyennes
de survies journalières sont données par la figure 12.
Ceratitis Bactrocera C.Témoin
B.Témoin
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
J 11
|
J 12
|
|
|
|
|
|
|
|
|
|
J 9
|
J 10
|
|
J 0J
|
1
|
J 2
|
J 3
|
J 4
|
J 5
|
J 6
|
J 7
|
J 8
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
% DE SURVIE
|
120 100 80 60 40 20 0 -20
|

48
DF= 11 ; F= 0,67 ; p = 0,768
Figure 12: Taux de survie en fonction du temps
des populations adultes de B. dorsalis et de
C. capitata
Les temps létaux 50 (LT50) des mâles «
donneurs » et des femelles « receveuses » sont donnés
dans le tableau ci-dessous pour chacune des deux espèces.
Tableau 6: Temps Létal de 50 % (LT50)
de survie en jours des mouches
LT50 jours (X #177; SE)
|
|
|
|
|
|
B.dorsalis
|
C.capitata
|
|
Femelle « donneuse »
|
2,7
|
#177; 0,1 a
|
2,9
|
#177; 0,1 a
|
|
Mâle « receveur »
|
7,6
|
#177; 0,1 b
|
6,7
|
#177; 0,1 b
|
4.3. Test de sporulation
Les cadavres récupérés des deux
espèces et pour les deux modes de transmission ont été mis
en
incubation dans des boîtes de Pétri et mises dans un
incubateur. Après 72 heures d'incubation, les premières
observations ont été faites à l'aide du
stéréomicroscope pour voir la sporulation du champignon sur les
corps des insectes. Les pourcentages moyens de la sporulation des

49
mouches mortes pour la transmission horizontale (TH) et la
transmission horizontale inverse (THI) sont donnés dans la figure 13.
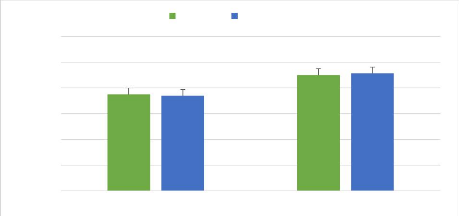
Ceratitis Bactrocera
THI TH
% Sporulation
80
60
0
b b
120
100
40
20
a a
DF= 6 ; F= 0,05 ; p = 0,012
Figure 13: Pourcentages moyens de sporulation
selon le mode de transmission et l'espèce
Les moyennes (#177; SE) en pourcentage de mycose des cadavres
des B. dorsalis et de C. capitata selon le mode de
transmission sont données dans la figure 15. L'analyse de la variance a
montré qu'il n'y avait aucune différence significative entre les
deux espèces pour le même mode de transmission (F= 0,05, p =
0,951) mais une différence significative est observée entre les
deux modes de transmission (DF=1 ; F= 29,82 ; p = 0,012).

Photo 26: Cadavres mâle et femelle de
C. capitata avec sporulation du Metarhizium sur le
corps
des insectes (Faye, 2014)


50
Photo 27: Sporulation du Metarhizium acridum
sur le cadavre d'une mouche mâle de C. capitata (Faye,
2014)

Photo 28: Début de germination du
Metarhizium de couleur blanche sur le cadavre de B. dorsalis
femelle (Faye, 2014)


51
Photo 29: Germination du champignon sur le
cuticule de Bactrocera dorsalis (Faye, 2014) 6. Effets du
Metarhizium acridum sur les larves des mouches des fruits
Les moyennes (SE) du nombre de pupes avortées de B.
dorsalis et C. capitata étaient respectivement de 4,67
#177; 0,960 et 5,43 #177; 0,960. L'analyse de la variance a montré qu'il
y avait une différence hautement significative entre les 5 doses en
fonction des espèces (DF= 5 ; F= 5,58 ; p < 0,001). Le test de
Student-Newman-Keuls au seuil á = 5 % effectué pour la
séparation des moyennes, indique que l'effet entomopathogène des
doses 0,5 g et 0,3 g n'est pas significativement différent ; l'effet de
ces deux doses est par contre significativement différent de celui de la
plus forte dose 1,5 g d'une part et celui des doses 0,15 g et 0,05 g d'autre
part. Il n'y a pas non plus de différence entre ces deux
dernières doses. La figure ci-après montre la moyenne du nombre
de pupes avortées et les différences entre les doses de
l'inoculum.
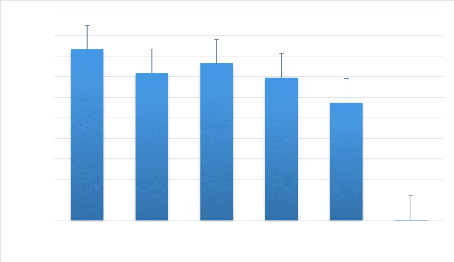
1,5 g 0,5 g 0,3 g 0,15 g 0,05 g 0 g
Nombre de pupes avortées
10
3
9
8
7
6
5
4
2
0
1
b c
b c
8,32
a
d
7,18
7,64
6,96
5,74
0,04
e
b c

52
DF = 5 ; F = 3,74 ; p < 0,001
Figure 14: Moyennes de pupes avortées de
B. dorsalis en fonction de la dose
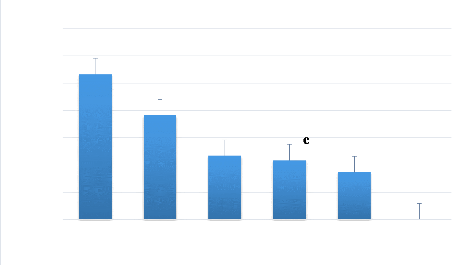
1,5 g 0,5 g 0,3 g 0,15 g 0,05 g 0 g
Nombre de pupes avortées
14
12
10
8
6
4
2
0
3,47
e
0
10,64
b
7,63
c
d
4,67
4,34
a
DF = 5 ; F = 3,74 ; p < 0,001
Figure 15: Moyennes de pupes avortées de
C. capitata en fonction de la dose

Photo 30: Pupes et émergences
avortées de Ceratitis capitata (Faye, 2014)


53
Photo 31: Pupes avortées de
Bactrocera dorsalis (Faye, 2014)

54
Chapitre IV. Discussion
Le test de germination des spores de Metarhizium acridum
a montré que pour les conidies conservées au
congélateur 95,4 % sont viables contre 94,4 % pour celles
entreposées dans le magasin (Tableau 1.). Ces taux sont nettement
supérieurs au taux de spores viables recommandé qui est d'au
moins 85 % à l'emballage pour une bonne application (AGRHYMET, 2010).
Bien que le stock de Metarhizium acridum ait été
livré en Février 2012, les spores ont gardé leur
viabilité grâce à la conservation sous température
basse. Ceci confirme les résultats antérieurs montrant que la
température joue un rôle important dans la durée de
conservation des spores et leur viabilité. En effet, plus la
température de conservation des spores est basse (= 4 °C), plus
longtemps elles peuvent garder leurs pouvoirs infectieux (AGRHYMET, 2010) ;
(Mohomodou, 2013) ; (Manneh, 2013).
Le test de quantification du nombre moyen de conidies
collectées par une mouche, après un temps de séjour d'une,
de deux et de trois minutes dans les chambres d'auto-inoculation (Photos 32 et
33), a montré que quel que soit la dose plus le temps de séjours
s'allonge plus la quantité de spores collectées augmente (Tableau
2.). B. dorsalis collecte le double de la quantité de spores
collectée par C.capitata après un temps de séjour
de trois minutes dans la chambre d'auto-inoculation avec 0,3 g de spores. Les
résultats obtenus sont similaires à ceux trouvés avec
plusieurs isolats de Metarhizium anisopliae (ICIPE 20, ICIPE 62...)
(Awuor, 2010).
Les mouches, mâles et femelles, exposées
directement aux spores du champignon, meurent entre 5 et 6 jours pour les
populations de B. dorsalis et de C. capitata (Figures 9, 10
et 11). Il existe une différence hautement significative entre les
mouches exposées et les témoins (DF= 4, F= 265 p < 0,001). Les
mortalités dues aux spores du champignon ont été
confirmées par les résultats du test de sporulation (Tableau 3.).
Metarhizium acridum a un effet biocide sur les adultes de B.
dorsalis et de C. capitata comme constaté dans les travaux
antérieurs chez les acridiens (Mohamed & Diallo, 2007).
Trois doses décroissantes de Metarhizium acridum
(en partant de la dose de 0,3 g utilisée par Dimbi) ont
été testées chez les populations adultes de B.
dorsalis et de C. capitata. Il a été noté
une différence significative entre les 3 doses appliquées et le
témoin (DF= 16, F= 2,16, p = 0,013). L'effet n'a pas été
différent entre les doses 0,15 g et 0,075 g mais différent de la
plus forte dose (Figure 14) et les LT50 selon la dose le confirment (Tableau
4.). Awuor, en 2010, avait trouvé des résultats similaires chez
B. dorsalis.

55
Les résultats de ce test nous prouvent
l'efficacité du Metarhizium acridum à de faibles doses
qui ont un impact économique pour l'utilisation de ce biopesticide
contre les mouches des fruits.
La transmission horizontale simple du Metarhizium acridum
est le transfert des spores entre des mouches mâles en contact
direct par auto-inoculation et les mouches femelles saines par contact ou par
accouplement. Il existe une différence significative de la survie des
individus dans le temps et selon l'espèce (DF= 11, F= 2,29, p = 0,009)
(Figure17.). Le Temps létal 50 % des mâles « donneurs »
est situé entre 2,4 et 2,5 jours et 5,9 à 6,7 jours pour les
mouches femelles « receveuses » (Tableau 5.). Les résultats
similaires ont été trouvés par Dimbi et al, 2013
chez C.capitata, C.cosyra et C.fasciventris (Dimbi,
et al., 2013) ; (Sookar, et al., 2014).
La transmission horizontale inverse répond au
même principe que la simple sauf qu'ici les mouches femelles sont les
« donneuses » et les mouches mâles les « receveurs »
(Figure 18.). Il n'existe pas de différences significatives entre la
survie des deux espèces en fonction du temps (DF= 11, F= 0,67, p =
0,768). Le temps létal de 50 % de mortalité LT50 compris entre
2,7 et 2,9 jours pour les mouches « donneuses » et 6,7 et 7,6 jours
chez les mouches « receveurs » (Tableau 6.). Les résultats des
tests de mycoses ne présentent pas de différences significatives
entre les deux espèces et pour les deux modes de transmission (Figure
19.). Des résultats similaires ont été trouvés par
Toledo en 2006 et par Dimbi en 2013.
Le test a montré que les mouches sont en mesure de
transmettre les spores à leurs congénères sains. La
mortalité totale des individus est obtenue entre 11 et 12 jours, ce qui
confirme les résultats de Dimbi (Dimbi, et al., 2013) qui a
trouvé une mortalité totale après 10 jours. Le test a
également montré que les mouches mâles étaient plus
efficaces dans le transfert de spores, probablement dû à leur plus
grande mobilité dans leurs recherches de partenaires sexuels (Tableaux 5
et 6.) (Sookar, et al., 2014).
Après les tests sur les adultes, les derniers stades
larvaires sont visés par l'utilisation de l'entomopathogène
Metarhizium acridum. Le champignon est mélangé avec du
sable afin de créer un environnement hostile pour les larves en
pré-pupaison et les pupes.
Comparé au témoin, les 5 doses testées
ont montré une différence significative (DF= 5, F= 3,74, p = 0,0
07) (Figure 11). Pour B. dorsalis l'effet de la dose 1,5 g est
différent de celui des doses 0,5 g, 0,3 g et 0;15 g. Cette
dernière dose n'est toutefois pas différente de la plus faible
dose (0,05 g). Les figures12 nous montrent le nombre moyen de pupes de de
C.capitata avortées en fonction de la dose. Il existe une
différence significative entre les 5 doses testées,
comparées au témoin (DF= 5, F= 3,74, p = 0,0 07). Le pourcentage
de pupes avortées varie pour les deux

56
espèces de 40 à 80 % comparativement au
témoin pour lequel la variation est de l'ordre de 2 à 10 %.
Le test de Student-Newman-Keuls montre que la dose 0,3 g est
différente des doses 0,5 g et 0,3 g et que ces dernières sont
différentes des doses 0,15 g et 0,05 G (Figure 13).Des résultats
similaires ont été trouvé chez Bactrocera zonata
et Bactrocera cucurbitae à Maurice par Sookar et avec un
isolat de (Sookar , et al., 2010) et par Cossentine avec le Metarhizium
brunneum sur les larves pré-pupales de Rhagoletis indifferens
(Cossentine, et al., 2011)
Comparé au témoin, les résultats de ce
test sur les populations de larves pupales de B.dorsalis et de C.
capitata montrent que le Metarhizium acridum n'est pas seulement
efficace contre les populations adultes des mouches mais aussi sur leurs larves
en pupaison.

57
Conclusion générale
Les mouches des fruits (Diptera : Tephritidae) de la mangue et
des agrumes constituent une contrainte majeure à la production et la
commercialisation des fruits et légumes en Afrique de l'Ouest.
La réduction des pertes de rendement en fruits et
légumes dues aux mouches et l'amélioration de la qualité
des fruits en éliminant les larves et les dégâts
causés relèvent d'une importance capitale pour les acteurs des
filières de fruits et légumes.
Cette étude a montré que la transmission
horizontale des spores du champignon entomopathogène Metarhizium
acridum entre les mouches par contact ou lors de l'accouplement est
efficace. L'auto-dissémination des spores du champignon peut être
ajoutée comme une nouvelle stratégie de gestion
intégrée des mouches africaines des fruits. Lorsqu'il est
mélangé au sable, Metarhizium créé un
environnement hostile aux larves et aux pupes qui sont contaminées par
le pathogène et finissent par en mourir.
L'isolat IMI -330 189 de Metarhizium acridum est bien
connu des agriculteurs et des agents de la protection de végétaux
comme un agent biologique alternatif pour le contrôle des acridiens
ravageurs. Les effets nocifs sur les populations non cibles sont
négligeables. Les différents résultats obtenus avec ce
champignon dans notre étude montrent qu'il contrôle aussi bien les
populations adultes que les populations de larves pupales de B. dorsalis
et de C. capitata. De ce fait, il peut être utilisé
comme un produit alternatif de contrôle biologique des populations de
mouches des fruits (Diptera : Tephritidae) en Afrique.
Recommandations
Suite aux résultats obtenus au cours de nos travaux,
l'isolat IMI-330189 de Metarhizium acridum s'avère être
un excellent candidat pour le contrôle des mouches des fruits. Au regard
des résultats obtenus, nous recommandons :
? De poursuivre l'étude sur l'effet de la transmission
verticale c'est-à-dire l'effet du Metarhizium sur la
descendance de la population de mouches des fruits contaminées par le
champignon;
? D'étudier son effet en milieu naturel à
différentes doses par :
i. La mise en place de dispositifs d'auto-inoculation au
niveau des vergers associés à des attractifs (100 / Ha). Une dose
comprise entre 1 - 1,5 g de spores suffit pour recouvrir uniformément le
tissu de velours du piège;
ii. La pulvérisation des sols des vergers avec le
Metarhizium acridum ;

58
iii. Le mélange de spores sèches en poudre avec le
sable. Une formulation en granules du Metarhizium acridum pourrait
faciliter son d'application.
? Etudier la possibilité de l'intégration de
Metarhizium acridum aux appâts et attractifs utilisés
dans le contrôle des mouches ;
? Etudier l'effet du Metarhizium acridum chez les
antagonistes non-cibles des mouches ; ? Poursuivre les travaux en laboratoire
avec d'autres souches et isolats disponibles.

59
Bibliographie
Abanda, F. X. , Quilici, S., Vayssières, J.F.,
Kouodiekong, L., Woin, N.,l., 2008. Inventaire des espèces de
mouches des fruits sur goyave dans la région de Yaoundé au
Cameroun. Fruits, Volume 63, pp. 19-26.
Aboussaid, H., El Messoussi, S. & Oufdou, K., 2009.
Activité insecticide d'une souche arocaine de Bacillus thuringiensis sur
la mouche méditerranéenne: Ceratitis capitata (Wied.)
(Diptera, Tephritidae). Afrique SCIENCE, 05(1), pp. 160-172.
Achterberg, K. V., Teixeira, T. & Oliveira, L., 2012.
Aphaerata ceratitivora sp.n. (Hymenoptera, Braconidae) a new parasitoid of
ceratitis capitata (Wiedemann) from the Azores. Zookeys, 18 sEPTEMBRE,
Volume 222, pp. 1-9.
AGRHYMET, C. R., 2010. L'entomopathogène Metarhizium
acridum : une solution alternative à la lutte chimique contre les
acridiens ravageurs. Niamey: Collection Acridologie
Opérationnelle.
Alfonso Molina, C., Cana-Roca, J., Osuna, A. & Vilchez,
S., 2010. Selection of a Bacillus pumilus Strain Highly Active against
Ceratitis capitata (Wiedemann) Larvae. Applied and Environmental
Microbiology, 76(5), pp. 1320-1327.
Awuor, O. E., 2010. Entomopathogenicity of Hyphomycetes Fungi
to fruit fly Bactrocera invadens (Diptera, Tephritidae) and their
potential for biological control on mango, Nairobi: s.n.
Bai, P. P., Chen, E.R, Guang-Mao, S., Dong, W., Wei, D.D.,
Wang, J.J., 2014. Inhibition of Phenoloxidase Activity Delays
Developpement of Bactrocera dorsalis (Diptera:Tephritidae). Florida
Entomology, 97(2), pp. 477-485.
Berger, B., 2005. Fiche informative sur les organisme de
quarantaine OEPP: Bactrocera dorsalis, s.l.: s.n.
Berger, B., 2005. Fiche informative sur les organismes de
quarantaine: Ceratitis capitata, Europe: CAB-EPPO.
Bischoff, J. F., Rehner, S. A. & Humber, R. A., 2009. A
multilocus phylogeny of the Metarhizium anisopliae lineage.
Mycologia, 101(4), pp. 512-530.
Cayol, J. P., Causse, R. & Barthes, J., 1994. Medfly
Ceratitis capitata as a rot vector in laboratory conditions. Journal
of Applied Entomology, Volume 117, pp. 338-343.
Chan Jr, H. T. et al., 2000. Composition of
Mediterranean fruit fly Thrid Instar Larvae (Diptera, Tephritidae) and diet:
nutrient composition in fresh and spent mass rearing diets. International
Energy Atomic Agency éd. Penang : Tan, Keng-Hong.
Che Raghi, A., Habibpour, B., Mossadegh, M. & Sharififard,
M., 2012. Horizontal Transmission of the Entomopathogen Fungus Metarhizium
anisopliae in Microcerotermes diversus Groups.
Insects, Volume 3, pp. 709-718.
Cossentine, J., Jaronski, S., Thistlewood, H. & Yee, W.,
2011. Impact of Metarhizium brunneum (Hypocreales:Clavicipiacea) on
pre-imaginal Rhagoletis indifferens

60
(Diptera:Tephritidae) within and on the surface of orchard
soil. Biocontrol Science and Technology, 21(12), pp. 1501-1505.
Cugula, D. et al., 2013. Assessement of ripening
stages of Cavendish dwarf bananas as host or no nhost to Bactrocera
invadens. Journal Applied of Entomology, pp. 301-306.
Daniel, C., 2014. Rhagoletis cerasi: Oviposition
Reduction Effects of Oil Products. Insects, Volume 5, pp. 319-331.
Daniel, C. & Baker, B., 2013. Dispersal of Rhagoletis
cerasi in cCommercial Cherry Orchards: Efficacy of Soil Covering Nets for
Cherry Fruit Fly Control. Insects, Volume 4, pp. 168-176.
De Meyer, M., 2000. Systematic revision of the subgenus
ceratitis (Ceratalaspis) MacLeay s.s. (Dipera:Tephritidae). Zoological Journal
of the Linnaean Society, Volume 88, pp. 439-467.
De Meyer, M. et al., 2010. Rapport d'une analyse du
risque phytosanitaire pour Bactrocera invadens, s.l.: EPPO.
De Meyer, M. et al., 2010. Report of a Pest Risk
Analysis for Bactrocera invadens, s.l.: s.n.
Deguine, J. P., Duffourc, V. & Rousse, P., 2011. GESTION
AGROECOLOGIQUE DES MOUCHES DES LEGUMES A LA REUNION (GAMOUR). Réunion
(France): GAMOUR.
Dimbi, S., Maniana, N. K. & Ekesi, S., 2013. Horizontal
Transmission of Metarhizium anisopliae in Fruit Flies and Effects of
Fungal Infection on Egg Laying and Fertility. Fruits, Volume 4, pp.
206-216.
Drew, R. A., Tsuruta, K. & White, I. M., 2005. A new
species of pest fruit fly (Diptera:Tephritidae:dacinae) from Sri Lanka and
Africa. African Entomology, Volume 13, pp. 149-154.
Ducamp Collin, M., Arnaud, C., Kagy, V. & Didier, C.,
2007. Fruit flies: disinfestation, techniques used, possible application to
mango. Fruits, Volume 62, pp. 223-236.
Ekesi, S. & Billah, M. K., 2010. Suppression de la mouche
des fruits (Diptera, tephritidae) d'importance économique en
Afrique. Nairobi: ICIPE Science Press.
Ekesi, S., Mohamed, S. & Chang, C., 2014. A liquid larval
diet for rearing Bactrocera invadens and Ceratitis fasciventris
(Diptera:Tephritidae). International Journal of Tropical Insect Science,
34(Supplement 1), pp. S90-S98.
Ekesi, S., Nderitu, P. W. & Rwomushana, I., 2006. Field
infestation, life history and demographic parameters of the fruit fly
Bactrocera invadens (Diptera: Tephritidae) in Africa. Bulletin of
Entomological Research, 96(4), pp. 379-386.
FAO, 1999. Agriculture trade and food security: Agriculture
factsheet., Rome: Third ministerial conference.
Garcia, F. R. & Ricalde, M. P., 2013. Augmentative
Biological Control Using Parasitoids for Fruit Fly Management in Brazil. Issue
4, pp. 55-70.
Geurts, K., Mwatawala, M. W. & De Meyer, M., 2014.
Dominance of an invasive fruit fly species, Bactrocera invadens, along
an altidinunal transect in Morogoro, Eastern Central Tanzania. Bulletin of
Entomolgical Research, 104(03), pp. 288-294.

61
Grechi, I. et al., 2013. mango-based orchards in
Senegal: diversity of design and management patterns. Fruits, 68(06),
pp. 447-466.
Hill, M. & Terblanche, J., 2014. Niche overlap on
congenric invaders supports a single-specie hypothesis and provides insight
into future invasion risk: implication for global management of the
Bactrocera dorsalis complex.. Publi Library of Sciences (PLoS) ,
9(2).
Juan-Blasco, M. et al., 2014. Estimating SIT-driven
population reduction in the Mediterranean fruit fly, Ceratitis
capitata, from sterile mating. Bulletin of Entomological Research, Avril,
104(02), pp. 233-242.
Kooyman, C., 2010. L'entomopathogène Metarhizium
acridum: une solution alternative à la lutte chimique contre les
acridiiens ravageurs. Collection Acridologie Opérationnelle
n° 10 éd. Niamey: PRéLISS.
Lux, S. A. et al., 2003. A new invasive fruit fly
species from the Bactrocera dorsalis (Hendel) Group detected in East
Africa. Insect Science And its Application, Volume 23, pp. 355-361.
Maiko, R., Idi, A., Bal, A. & Georgen, G., 2007. Etudes
préliminaires sur les diptères nuisibles des mangues au Niger et
pays voisins. Dakar, THE AFRICAN ASSICATION OF INSECTS SCIENTISTS, pp.
62-63.
Manneh, J., 2013. Effet de la durée de conservation et
de la température sur la viabilité et le pouvoir infectieux des
spores de l'entomopatogène Metarhizium acridum sur
Schistocerca gregaria, Niger: s.n.
Manrakhan, A., Venter, J.-H. & Hattingh, V., 2009.
Bactrocera invadens Drew Tsuruta and White the African Invader fly
Action Plan, s.l.: s.n.
Maùsse, S. D. & Bandeira, R. R., 2007. Ecological
relationships between Ceratitis spp. (Diptera, Tephritidae) and other
native fruit tree pest in southern Mozambique. Fruits, 62(047).
Mele, P. V., Vayssières, J. P., Van Telligen, E. &
Vrolijks, J., 2007. Effets of the African weaver ant Oecophylla longinoda in
controlling mango fruits flies (Diptera, tephritidae). Journal of Economic
Entomology, Volume 100, pp. 695-701.
Ming-Zhe, H. et al., 2014. Characterization of
Bactrocera dorsalis Serine Proteases and Evidence for Their Indirect
Role in Insecticide Tolerance. International Journal of Molecular Sciences,
Volume 15, pp. 3272-3286.
Mohamed, E. H. O. T. & Diallo, A., 2007. Field
Demonstration of the Use of Metarhizium anisopliae for, Nouakchott:
Projet GCP/INT/651/NOR.
Mohomodou, H., 2013. Effet des conditions de conservation sur
la viabilité et le pouvoir infectieux des spores de
l'entomopathogène Metarhizium acridum utilisées en lutte
antiacridienne, Niger: s.n.
Montoya, P., Perez Lachaud, G. & Liedo, P., 2012.
Superparasitism in the Fruit Fly Parasitoid Diachasmimorpha longicaudata
(Hymenoptera,: Braconidae) and the Implications for Mass Rearing and
Augmentatative Release. Issue 3, pp. 900-911.

62
Mouhamed, S. A., Ekesi, S. & Hanna, R., 2010. Old and new
host-parasitoid associations: Parasitism of the invasive fruit fly
Bactrocera invadens (Diptera, Tephritidae) and five african fruit fly
species by Fopius arisanus, an Asian Opiine parasitoid. Volume 20, pp.
183-189.
Mwatawala, M. W., De Meyer, M., Makundi, R. H. & Maerere,
A. P., 2006. Seasonality and host utilization of the invasive fruit fly,
Bactrocera invadens (Diptera,Tephritidae) in Central Tanzania. Journal
of Applied Entomology, 130(9/10), pp. 530-537.
Mwatawala, M. W. et al., 2004. A new invasive
Bactrocera species (Diptera:tephritidae) in Tanzania. African
Entomology, Volume 12, pp. 154-156.
N'Depo, O. R. et al., 2009. Abondance des fruits dans
les zones de production fruitières de Côte d'Ivoire:dynamique des
populations de Bactrocera invadens (Diptera: Tephritidae). Fruits,
64(029), pp. 313-324.
Ndiaye, M. & Dabo, M., 2007. Guide pratique de lutte
contre les mouches de fruits dans les vergers de mangue au
Sénégal. DPV édition. DAKAR: International Resources
Group.
Ndiaye, O. et al., 2012. Seasonality and the
importance of fruit fly (Diptera: Tephritidae) host plants in orchards at
niayes and the Thiès Plateau. Fruits, Volume 67, pp.
311-331.
Nouira, M., 2008. Effets d'effet de l'irradiation sur les
paramètres de qualité des mâles stériles de la
Cératite Ceratitis capitata (Wied.) et leur amélioration
par aromathérapie. Sousse (Tunisie)(Choott Mariem): Institut
Supérieur Agronomique.
Ovruski, S. M. & Schliserman, P., 2012. Biological Control
of Tephritid Fruit Flies in Argentina: Historical Review, Current Status, and
Future trends for Developing a Parasitoid mass(Release Program. Insects,
Issue 3, pp. 870-888.
Quilici, S. & Vayssières, J. F., 2010. La lutte
régionale contre les mouches des fruits en Afrique subsaharienne, s.l.:
CIRAD-IITA-WAFFI.
Rao, D., Arguilar-Arguello, S., Montoya, P. &
Diaz-Fletcher, F., 2014. The effect of irradiation and mass rearing on the
anti-predator behaviour of the Mexican fruit fly, Anastrepha ludens
(Diptera: Tephritidae). Bulletin of Entomological Research,
104(02), pp. 176-181.
Rwomushana, I., Ekesi, S., Ogol, C. P. & Gordon , I.,
2008. Hosts plant and host plant preference studies for Bactrocera
invadens(Diptera:tephritidae) in Kenya, a new invasive fruit fly in
Africa. Annals of the Entomological Society of America, Volume 101, pp.
331-340.
Sanjaya, Y., Ocampo, V. & Caoili, B. L., 2013.
Transmission effect of entomopathogenic fungi on population of Tetranychus
kanzawai (Kishida) (Tetranychidae:Acarina). Arthropods, 2(1), pp.
36-41.
Self, G., Ducamp, M. N., Thaunay, P. & Vayssières,
J., 2012. The effects of phytosanitary hot water treatments on West African
mangoes infested with Bactrocera invadens (Dipter:Tephritidae). Fruits,
Volume 67, pp. 439-449.
Shi, Z., Wang, L. & Zhang, H., 2012. Low Diversity
Bacterial Community and the Trapping Activity of Metabolites from Cultivable
Bacteria Species in the Female Reproctuve System of the Oriental Fruit Fly,
Bactrocera dorsalis Hendel (Diptera:Tephritidae). International
Journal of Molecular Sciences, Volume 13, pp. 6266-6278.

63
Sivinski, J. & Aluja, M., 2012. The Roles of Parasitoid
Foraging for Hosts, Food and Mates in augmentative Control of Tephrritidae.
Insects, Issue 3, pp. 668-691.
Sookar , P., Bhagwant, S. & Allymanod, M., 2010. Mortality
in tephritid fruit fly puparia and adults caused by Metarhizium anisopliae,
Paecilomyces fumosoroseus and Beauveria bassiana. Ministry of
Agro Industry Food Production and Security, Agricultural Services.
Sookar, P., Bhagwant, S. & Allymanod, M., 2014. Effect of
Metarhiziam anisopliae on the fertility and fecondity of two species
of fruit flies and horizontal transmission of mycotic infection. Journal of
Insect Science, 14(100), p. 11.
Toledo, J., 2006. Use of Beauveria bassiana and
Metarhizium anisopliae for Fruit Fly control: A novel Approach. Salvador,
Anonyme, pp. 127-132.
Toledo, J. et al., 2006. Use of beauveria
bassiana and Metarhizium anisopliae for fruit fly control: A Novel
Approach, Salvador, Brazil: s.n.
Umeh, V., Garcia, L. & De Meyer, M., 2008. Fruit flies of
citrus in Nigeria: species diversity, relative abundance and spread in major
producing areas. Fruits, Volume 63, pp. 145-153.
Umeh, V., Olaniyan, A., Ker, J. & Andir, A., 2004.
Development of citrus fruit fly control strategies for small-holders in
Nigeria. Fruits, Volume 59, pp. 265-274.
Vannière, H. et al., 2004. La mangue en
Afrique de l'Ouest francophone: les systèmes de production et les
itinéraires techniques. Fruits, Volume 59, pp. 383-396.
Vayssières, J. F. et al., 2014. Annual
population dynamics of mango fruit flies (Diptera:Tephritidae) in West Africa:
socio-economic aspects, host phenology and implication for management.
Fruits, 69(011), pp. 207-209.
Vayssières, J. f. et al., 2011. Preliminary
inventory of fruit fly species (Diptera, Tephritidae) in mango orchards in the
Niayes region, Senegal, in 2004. Fruits, 66(002), pp. 91-107.
Vayssières, J. P. et al., 2005. A new Bactrocera
species in Benin among mango fruit fly (Diptera:Tephritidae) species.
Fruits, Volume 60, pp. 971-977.
Vayssières, J. P., Sinzogan, A. & Adandonon, A.,
2010. Projet Régional de lutte contre les Mouches des Fruits en Afrique
de l'Ouest: Rapport Final/ WAFFI 2 , Cotonou: WAFFI-CIRAD-IITA.
White, I. M. & Elson-Harris, M. M., 1992. Fruit flies of
economic significance: Their Identification and bionomics. CAB
International, p. 601.
Whittier, T. S., Kaneshiro , K. H. & Prescott, L. D.,
1992. Mating behavior Mediterranean fruit fly (Diptera, Tephritidae) in a
natural environnement. Society America, 85(W2), pp. 214-218.
Yang, W. J. et al., 2013. Transcriptional Regulation
of a Chitinase Gene bu 20-Hydroxyecdysone and Starvation in the Oriental Fruit
Fly, Bactrocera dorsalis. International journal of Molecular
Sciences, Volume 14, pp. 20048-20063.
Zakari-Moussa, O. et al., 2014. Gestion
Agro-écologique des mouches des fruits de manguiers dans la partie nord
de la Guinée-Bissau. Journal of Applied Biosciences, 75(06),
pp. 250-258.

64
Zakari-Moussa, O. et al., 2012. GF-120 effects on fruits
fly species (Diptera, tephritidae) in Sahelian agroforestery-based
horticultural cropping systems. Fruits, 67(025), pp. 333-339.
Zar, J. H., 1999. Biostatistical Analysis. Fouth Edition
éd. New Jersey: Prentice-Hall, Inc.
Webographie
Weldon, C., 2014. Ceratitis capitata. (
http://www.cabi.org/isc/datasheet/12367#toPictures)
;(Consulté le 02 10 2014)
MOSCAMED, 2014. MOSCAMED.(
www.moscamed.org.br);(Consulté
le 5 Octobre 2014)
Stewart,J.,2014.PhytosanitaryAlertSystem(.
http://www.pestalert.org/oprDetail.cfm?oprID=57
9) ;(consulté le 13 Octobre 2014).
De Meyer, M., Mohamed, S. & White, I. M., 2007. Africa
Museum. (
http://www.africamuseum.be/fruitfly/AfroAsia.htm)
(Consulté le 2 Octobre 2014).
De Meyer, M. & Aool, W., 2014. CABI
(
http://www.cabi.org/cpc/search/?q=bactrocera+dorsalis)
;(Consulté le 22 Mai 2014)
Autres sites:
Center for Invasive Species and Ecosystem Health
http://www.invasive.org/species/insects.cfm
IAEA tephritid workers database
http://www.tephritid.org/twd/srv/en/home

65
| 


