|
DEDICACE
A notre Père et guide ;
pournous avoirindiqué la bonne voie
et n'avoir cessé de nous rappeler
que la volonté a toujours fait des grands hommes.
A notre Mère ;
pour avoir su attendre avec patience
les fruits de sa bonne éducation.
A notreépouseMaria ;
pour avoir illuminé courageusementet fidèlement
le chemin du futur.
A nos enfants Lin, Léa et
Sara ;
pour toute l'affection familiale.
REMERCIEMENTS
Un tel travail scientifique ne peut se réaliser sans le
concours de beaucoup de personnes qui de près ou de loin ont
contribué à sa conception, sa rédaction et sa correction.
Nous tenons donc à leur exprimer toute notre gratitude.
De prime abord, nous sommes très reconnaissantau
Docteur Léopold MULUMBA-MFUMU KAZADI, Administrateur du
Laboratoire Vétérinaire Central de Kinshasa, visiteur à la
Faculté de Médecine Vétérinaire de
l'Université Pédagogique Nationale. Son encadrement scientifique
et technique dans son laboratoire nous a permis de nous impliqué dans
les manipulations ; lesquelles ont permis de réunir les
données nécessaires de nos recherches.
Nos sincères remerciements s'adressentau Professeur
AlexandreMBAYA NTUMBULA, promoteur de ce mémoire. Sa
disponibilité, ses conseils et ses remarques nous ont été
d'une grande contribution pour l'aboutissement de cette oeuvre.
Nous serons plus qu'ingrat de taire le nom du défunt
Professeur KAZADI LONGESHA, ancien Coordonnateur du Bureau Doctoral pour ses
encouragements à poursuivre nos études approfondies,
c'est-à-dire il n'a cessé de nous inviter à être
très actif et à matérialiser notre rêve. Ce
mémoire est le fruit de ses conseils.
Nos pensées de profonde gratitude vont à tous
les Professeurs de l'Université Pédagogique Nationale qui ont
animé les différents séminaires et forums relatifs
à notre formation.
Nous remercions également Docteur Boniface
LOMBE ainsi que tous les agents et cadres du Laboratoire
Vétérinaire Central de Kinshasa pour leur collaboration et
différents échanges durant toute la période de nos
investigations.
Ne pas reconnaître l'apport et la collaboration des
autorités officielles tant Libanaises que Congolaises pour nos
études, serait une ingratitude de notre part. Qu'elles trouvent en ce
mémoire un symbole de tout leur soutien.
Nous n'avons pas oublié les personnes qui par leur
apport très louable nous ont permis de présenter ce
mémoire sous cette forme, mais qui par modestie ont
préféré que nous taisions leur noms. Nous leur disons
simplement un très grand merci.
Il est difficile de citer sur ces quelques lignes les noms de
tous ceux qui nous ont apporté un soutien ou une contribution
quelconque, c'est ici pour nous l'occasion de dire à tous un très
grand merci. Qu'ils soient donc eux aussi rassurés de notre
sincère reconnaissance.
LISTE DES ABREVIATIONS ET SYMBOLES :
|
% + ve
|
Pourcentage des cas positifs
|
|
nPs
|
Protéines non structurales
|
|
AFSSA
|
Agence Française de Sécurité Sanitaire des
aliments
|
|
ARN
|
Acide ribonucléique
|
|
CDC
|
Center of Disease Control
|
|
CPHL
|
Compagnie Pastorale du Haut Lomami
|
|
ELISA
|
Enzyme Linking Immuno Sorbent Assay
|
|
ENSO
|
El Niño-oscillation australe
|
|
FVR
|
Fièvre de la Vallée du Rift
|
|
Gc (G1)
|
Glycoprotéine C-Glycosylation
|
|
Gn (G2)
|
Glycoprotéine N-Glycosylation
|
|
I-ELISA
|
ELISA indirect
|
|
IEMVT-CIRAD
|
Institut d'Elevage et de médecine
vétérinaire pays tropicaux- Centre de Coopération
Internationale en Recherche Agronomique pour le Développement
|
|
IgG
|
Immunoglobuline Gamma
|
|
IgM
|
Immunoglobuline Mu (u)
|
|
KDA
|
Kilodalton
|
|
NIH
|
National Institutes of Heath
|
|
nm
|
nanomètre
|
|
OIE
|
Office International des Epizooties
|
|
OMS
|
Organisation Mondiale de la Santé
|
|
OVI
|
Onderstepoort Veterinary Institute in South Africa
|
|
pH
|
potentiel d'hydrogène
|
|
ppm
|
partie pour mille
|
|
RNP
|
Ribonucléoprotéine ou NRP en anglais
|
|
RT- PCR
|
Reverse Transcriptase Polymerase Chain Reaction
|
|
VFVR
|
Virus de la Fièvre de la Vallée du Rift
|
LISTE DES TABLEAUX ET FIGURES
|
Titre
N°
|
Titre de tableaux
|
Page
|
|
Tableau I.1
|
Evolution chronologique de la
fièvre...........................
|
16
|
|
Tableau II.1
|
Equipements et réactifs pour Microplaques Elisa et
Embouts pour micropipette........................................
|
52
|
|
Tableau II.2
|
Interprétation des résultats des
tests............................
|
53
|
|
Fig. I.2
|
Codage des segments L, M et S de l'ARN du Bunyavirus.
|
18
|
|
Fig. I.3
|
Coexistence
IgG-IgM.................................................
|
24
|
|
Fig. I.4
|
Moustique, Hôte intermédiaire et vecteur du
virus, Bunyaviru, agent de la fièvre de la Vallée de
Rift. Culex (A) et Aedes
(B).........................................................
|
29
|
|
Fig. I.5
|
Cycle de transmission de la Fièvre de la Vallée
de Rift...
|
31
|
|
Fig. I.1
|
Répartition de la fièvre de la vallée du
Rift en Afrique...
|
32
|
|
Fig. I.6
|
Photo d'un avorton lors d'un foyer de
FVR...................
|
36
|
|
Fig. I.7
|
Photo d'une hépatite nécrosante, foie
décoloré..........
|
36
|
|
Fig. II.1
|
Zone de l'étude dans le Nord de la province du
Katanga..............................................................
|
49
|
|
Fig. III.1
|
Foie d'un foetus de Bovin avorté montrant des larges
foyers
nécrosés...........................................................
|
56
|
|
Fig. III.2
|
Prévalence apparente globale de l'infection dans la
zone étudiée Kit IgG et IgM fourni par OVI.................
|
57
|
|
Fig. III.3
|
Résultat sérologique Kit ELISA IgG bovin (BDSL)
selon la race : le zébu semble être moins susceptible par
rapport à
l'Africander................................................
|
58
|
|
Fig. III.4
|
Résultat sérologique Kit ELISA IgG et IgM (OVI)
par race le Zébu semble très
susceptible...................................
|
59
|
|
Fig. III.5
|
Résultat sérologique Kit ELISA IgG bovin fourni
par BDSL.
|
60
|
|
Fig. III.6
|
Résultat sérologique Kit ELISA IgG et IgM (OVI)
par âge.
|
60
|
|
Fig. III.7
|
Fréquence par âge
regroupé.....................................
|
61
|
RESUME
Depuis quelques années, des signes précurseurs
de la présence d'une maladie zoonique en RD Congo ont été
enregistrés. Maladie presque méconnue et non stigmatisée
chez les praticiens, la FVR a été signalée sous forme
endémique.
Ce mémoire porte sur l' «Occurrence
de la fièvre de la vallée du Rift et étude des cas chez
les Bovins dans le Nord de la Province du Katanga en République
démocratique du Congo. ». Le but poursuivi est
d'évaluer la prévalence apparente de cette zoonose chez la
population bovine dans cette province.
Cette étude présente un triple
intérêt (scientifique, économique et
épidémiologique) car elle permet de mieux connaitre cette
infection et d'assurer une meilleure surveillance et une meilleure protection
non seulement de l'homme mais aussi des Bovins. Mots clefs :
Fièvre, Vallée du Rift,
Zoonose, Bovin.
Nous avons réalisé une étude de cas
portant uniquement sur les Bovins (Zébu et Africander)
dont 351 échantillons provenant de deux lots de
prélèvements sanguins lesquels ont été
analysés par les tests des anticorps IgG et IgM ainsi que le bilan
nécrosique. Ces tests ont permis de détecter la présence
de la maladie et d'apprécier les lésions macroscopiques et
microscopiques. A l'issue de cette étude, il a été
enregistré un taux de prévalence de 40% pour la zone
enquêtée confirmant ainsil'existence de cette zoonose au Katanga.
SUMMARY
For a few years, precursory signs giving a report on the
presence of a zoonic disease in democratic Republic of Congo have been
recorded. Disease almost ignored and not stigmatized in the experts, the FVR
was announced in endemic form.
This memory thus relates to « Occurrence of
the fever of the valley of Rift and study of the cases at the Bovines in the
north of the province of Katanga in Democratic Republic of
Congo. ». The objectives are to appreciate the apparent
prevalence of this zoonose at the bovine population in this province.
This study presents triple interest (scientific, economic and
pidemiologic) because it makes it possible to better know this infection and to
ensure a better monitoring and a better protection not only of the man but also
of the Bovines. Key words : Fever Valley of Rift Zoonose
Bovine.
We carried out a case study relating only to the Bovines
(Zebu andAfricander including 351 samples coming from two
batches of blood taking away which were analyzed by the tests of the antibodies
IgG and IgM as well as the necrosic assessment. These tests made it possible
to detect the presence of the disease and to appreciate the macroscopic and
microscopic lesions. With the exit of this study, it was shown a rate of
prevalence of 40% for the surveyed zone thus confirming the existence of this
zoonose in Katanga.
0. INTRODUCTION
0.1 PROBLEMATIQUE
Depuis l'époque préhistorique, l'homme pratique
l'agropastorale pour subvenir à ses besoins alimentaires. De nos jours,
cette activité, destinée à la domestication des animaux et
des plantes est devenue plus rentable et bénéfique car elle
permet de générer des revenus importants.
En effet, le développement de l'agriculture a toujours
été considéré comme une révolution,
marquée par un nouveau mode de vie. Il est aujourd'hui admis que la
dynamique imposée par le système économique au monde
puisse constamment s'adapter par manque de valeur économique stable.
Ainsi, l'homme est, non seulement au centre de cette
adaptation, mais il est devenu la cible même de tous ces mouvements. Pour
résister ou s'adapter à cette évolution, il est
obligé de soumettre la terre à son autorité, et à
la transformer de manière à tirer le maximum de profit. C'est
dans ce contexte qu'il exploite et pratique plusieurs activités
génératrices de revenus dont l'agriculture et ce, non seulement
au sens des cultures mais aussi à celui de l'exploitation des animaux
domestiques.
L'élevage des animaux comme activité commerciale
suppose un bénéfice et générer donc des revenus.
Cela n'est pas souvent le cas malgré les moyens que mettent en jeu les
éleveurs traditionnels pour éviter d'une part les pertes
conduisant à une diminution du cheptel et d'autre part à son
maintien dans un état stationnaire. A la base d'une telle situation,
quelques facteurs contraignants ont été épinglés
tels que : avortements (visibles ou non) et mortalités des veaux
ainsi que d'autres espèces animales dans le cheptel, etc. (MULUMBA-MFUMU
et al., 2007).
La maîtrise des pathologies survenant dans une
exploitation animale est une difficulté qu'éprouve un grand
nombre de praticiens vétérinaires. Cela, non seulement à
cause de la diversité de pathologies, des espèces, des races, des
maladies liées au type d'exploitation ou à l'âge, mais
aussi des maladies latentes. Certaines maladies sont transfrontalières
à caractère zoonotique ou animales et donc avec un impact sur
l'économie, la santéet la sécurité
alimentaire(MULUMBA-MFUMU et al., op. cit.).
La fièvre de la Vallée du Rift (FVR) appartient
au groupe de maladies zoonotiques transfrontalières. Elle dispose d'un
grand pouvoir de diffusion et ce, avec une gravité particulière,
capable de s'étendre au-delà des frontières nationales
entraînant sur son passage des conséquences graves au sein des
populations animales et humaines. A ce jour, le virus de la Fièvre de la
Vallée du Rift fait partie des agents infectieux potentiels
utilisés comme armes biologiques exploitées dans des cas de
bioterrorisme. C'est ce qui explique, sa reclassification parmi les maladies de
la liste A telle que indiqué par le " National Institutes of Heath
(NIH)" du " Center of Diseas Control (CDC)" aux USA (United
States of American) à côté des pathogénies telles
que la Peste bubonique et le Charbon bactéridien (OMS, 2006-2007).
Presque méconnue ou non stigmatisée par la
plupart des praticiens en République Démocratique du Congo, la
FVR a été signalée sous forme endémique (LEFEVRE,
1986 ; COETZER et al., 1994 et MULUMBA-MFUMU et al., 2007).
La RVF a été détectée pour la
première fois à l'occasion de fortes pluies en 1930-1931. Une
flambée d'avortements et de morts survenus chez des moutons à
laine exotiques dans la vallée du Rift au Kenya, près du lac de
Naivasha avec occurrence chez les humains (OMS, op. cit.) Des foyers ont
ensuite été observés en Afrique Australe
(République Sud Africaine, Namibie, Mozambique, Zambie et Zimbabwe), en
Afrique de l'Ouest (Sénégal), en Afrique du Nord (Soudan,
Egypte), au Moyen Orient (Yémen) ainsi que dans les îles
Comores et Mayotte (SWANEPOEL et al., 1994).
L'émergence de l'épidémie est liée
à des facteurs écologiques, climatiques globaux ou locaux, tel
que le réchauffement du globe causant des condensations et des pluies
abondantes entraînant des inondations et ainsi l'éclosion des
vecteurs de la RFV, moustiques Culex et Aedes. Les
changements en matière de précipitations et de
températures peuvent avoir un effet certain sur le degré de
transmission de cette maladie vectorielle(http://www.fao.org/docrep/006).
En Afrique de l'Est, par exemple, les précipitations
contribuent à la création d'un environnement humide et offrent un
biotope de reproduction aux moustiques vecteurs de la FVR. Les
températures représentent un facteur important dans la mesure
où elles favorisent une croissance rapide des moustiques et une
fréquence élevée pour leur nutrition, car ils sont
hématophages (http://www.fao.org/docrep/006).
La RD Congo est caractérisée par un climat chaud
et humide, avec une pluviosité importante. Elle occupe une position
centrale au coeur de l'Afrique ; elle est couverte par une abondante
végétation et drainée par l'un des plus grands fleuves du
monde, fleuve qui offre des facteurs favorables à la transmission du
virus. Ces facteurs sont amplifiés par des alluvions riveraines qui
proviennent parfois des pays voisins infectées par la FVR. Les maladies
animales constituent le principal obstacle au développement de
l'élevage en RDCongo. Elles causent des pertes importantes à
travers la mortalité et empêchent les investissements dans ce
secteur (MULUMBA-MFUMU et al., 2007).
Depuis quelques années, on a constaté dans le
nord de la province du Katanga une baisse de la fécondité, une
persistance d'un syndrome périnatal caractérisé par des
avortements, des mort-nés et une mortalité élevée
des veaux dont les foies présentaient des foyers de nécrose
à l'autopsie et cela, malgré un programme de vaccination continue
contre la Brucellose(MULUMBA-MFUMU et al., op. cit.).
Ces constats ont suscité les questions
suivantes :
§ Quelle est l'occurrence de la fièvre de la
vallée du Rift chez les Bovins élevés au nord de la
Province du Katanga ?
§ Quels sont les signes précurseurs de la
contamination par cette infection chez les Bovins et les humains dans cette
partie de la RDC ?
Ainsi, le sujet de notre mémoire de DEA est
intitulé « Occurrence de la fièvre de la
vallée du Rift et étude des cas chez les Bovins dans le Nord de
la province du Katanga en République Démocratique du
Congo. ».
0.2 HYPOTHESES DE RECHERCHE
Au vu de ce qui précède et pour répondre
à ce questionnement, deux hypothèses sont
formulées :
§ le taux de prévalence de la fièvre de la
vallée du Rift dans la population bovine du Nord de Katanga est assez
élevé.
§ la baisse des performances reproductrices, la
persistance d'un syndrome périnatal dominée par des avortements
ainsi que quelques cas de cécité enregistrés chez les
humains dans les environs des exploitations bovines du Nord de Katanga sont des
signes précurseurs d'une contamination par la fièvre de la
vallée du Rift.
0.3 BUT ET OBJECTIFS DE L'ETUDE
Le but de cette étude est de ressortir la
prévalence apparente d'une zoonose majeure dans la population bovine du
Nord Katanga.
1° OBJECTIF GLOBAL
Cette étude vise à évaluer le
degré de prévalence de la fièvre de la vallée du
Rift chez les Bovins dans le nord de la Province du Katanga en RD Congo en vue
de proposer une séro-surveillance.
2° OBJECTIFS SPECIFIQUES
Dans cette recherche, les objectifs spécifiques
ci-après sont poursuivis :
§ subdiviser la zone d'étude en trois sites :
Mitshia au nord, Kileka au centre et Lovoy au sud ;
§ effectuer quelques visites sur terrain ;
§ réaliser les analyses de laboratoire sur les
sérums bovins et
§ tirer des conclusions utiles à partir des
résultats obtenus.
0.4 CHOIX ET INTERET DU SUJET
Ce travail présente un triple intérêt,
à savoir : scientifique, économique et sanitaire.
§ Sur le plan scientifique :
étant donné que les maladies animales causent des pertes
importantes et empêchent les investissements dans le secteur agricole en
RDC, ce travail permet une amélioration de la capacité locale de
lutte contre les principales épizooties dont la fièvre de la
vallée du Rift en vue d'une meilleure surveillance et une meilleure
protection de l'homme.
§ Sur le plan économique :
il permet aux éleveurs et aux divers projets d'apporter des solutions
adéquates pour l'amélioration de la production.
§ Sur le plan sanitaire : il
fournit les données de terrain ainsi que les résultats de
laboratoire pouvant permettre l'établissement d'un programme de
contrôle, la sensibilisation et l'éducation de la population et la
gestion des risques de contamination.
0.5 METHODOLOGIE
1° METHODES
Cette recherche est une étude de cas qui porte
uniquement sur les Bovins (Zébu et Africander).
L'approche horizontale a été afin de vérifier les
hypothèses émises. A cet effet, les analyses ont
été réalisées au laboratoire sur deux lots de
prélèvements sanguins des Bovins : le premier
échantillon était constitué de 151 échantillons de
sang et le second de 200 échantillons. Les analyses effectuées
sur les deux cohortes ont été effectuées à
l'intervalle de six mois, c'est-à-dire des prélèvements
des mois de février et août 2008.
2° TECHNIQUES
Avant la descente sur terrain pour la collecte des
données,deux techniques ont été utilisées, à
savoir :
§ les tests des anticorps IgG et IgM,
caractéristiques de l'infection, ont été effectués
pour la détection de la présence ou non du virus ;
§ le bilan nécrosique a permis d'apprécier
les lésions macroscopiques et microscopiques, pouvant aller ou non dans
le sens de la confirmation de la maladie.
Les tests immunologiques et le bilan nécrotique ont
été réalisés grâce à deux kits ELISA
RVF et Kit ELISA indirect.
0.6 DELIMITATION SPATIO-TEMPORELLE
Cette recherche connait une délimitation :
§ sur le plan spatial, cette étude s'est
déroulée dans le Nord de la Province du Katanga, une des onze
provinces de la République démocratique du Congo.
§ sur le plan temporel, elle a couvert les mois de
février et août 2008, mois au cours desquels cette
épizootie avait sévi.
0.7 DIVISIONS DU TRAVAIL
Le présent travail est divisé en trois
chapitres :
§ le chapitre premier est consacré à la
revue de la littérature sur la fièvre de la vallée du
Rift ;
§ le chapitre deuxième présente le milieu,
les matériels et méthodes utilisés lors des investigations
et
§ le chapitre troisième expose et
interprète les résultats obtenus.
Après les résultats, il y a une discussion et
une conclusion.
CHAPITRE I.
REVUE DE LA LITTERATURE SUR LA FIEVRE DE LA VALLEE DU
RIFT
I.1 APPROCHE CONCEPTUELLE
SUR LA FIEVRE DE LA VALLEE DU RIFT
Quelques concepts ont été définis pour
une meilleure compréhension de cette recherche.
1° Africander
L'Africander est une race de Bovin d'Afrique. Cette
race est très voisine de Zébu (Encarta®, 2009).
2° Encéphalite
Une encéphalite est une affection inflammatoire de
l'encéphale dont les causes sont surtout infectieuse et
particulièrement virales. Certaines d'entre-elles à
Arbovirus sont transmises soit par les moustiques, soit par les tiques
(Larousse médicale, 2006).
3° Epidémie
En pathologie médicale, une épidémie est
une extension d'une maladie transmissible à un grand nombre d'individus,
dans une zone géographique déterminée. (Encarta®, op.
cit.).
La dimension d'une épidémie est très
variable, pouvant aller de quelques cas à plusieurs milliers. Elle peut
rester localisée ou peut s'étendre, voire gagner la Terre
entière (pandémie).
La détection précoce d'une
épidémie repose sur un système d'alerte
opérationnel et adapté en sensibilité. L'investigation
doit être conduite rapidement au niveau local ou national, voire
international. On parle également d'une endémie lorsque l'agent
causal de la maladie est présent en permanence au sein d'une population
ou dans une région. Une endémie est généralement
latente, seuls quelques cas se déclarent sporadiquement. Elle peut
néanmoins se manifester, épisodiquement, de façon plus
dense, donnant lieu à une
« endémoépidémie » (Encarta®
2009 ; Larousse médicale, 2006).
4° Epizootie
L'épizootie en pathologie animale est un fléau
épidémique qui touche les animaux (plusieurs troupeaux) et se
répand rapidement sur une zone déterminée (Microsoft
Encarta ® op. cit. [DVD]- Microsoft Corporation, 2008).
5° Etiologie
L'étiologie est l'ensemble des causes d'une pathologie
ou l'étude des causes des états pathologiques.
Certain facteurs sont directement responsables d'une maladie,
comme les agents pathogènes des maladies infectieuses, les toxiques, le
froid, la chaleur, etc. D'autres constituent des facteurs favorisant
l'émergence d'une maladie : hérédité,
âge, sexe, hygiène de vie, conditions de travail, surmenage,
problèmes affectifs.
Certaines maladies ont une seule cause bien définie,
comme le méningocoque dans le cas de la méningite
cérébrospinale. D'autres possèdent plusieurs causes
distinctes, c'est ainsi qu'on invoque pour un cancer, le rôle de facteurs
génétiques (oncogènes), infectieux (virus) et
environnementaux (Larousse médicale, 2006).
3° Fièvre de la Vallée de
Rift
La fièvre de la Vallée du Rift (FVR) est une
zoonose virale touchant principalement les animaux mais pouvant aussi
contaminer l'homme. L'infection provoque une pathologie sévère
tant chez l'animal que chez l'homme, entraînant une morbidité et
une mortalité élevées. Les morts et les avortements dans
les troupeaux infectés par la FVR entraînent des pertes des
revenus
substantielles.(http://www.who.int/mediacentre/factsheets/fs207/fr/index.html).
La fièvre de la Vallée du Rift (FVR) est
également connue sous le nom d'hépatite azootique du mouton, en
raison des lésions caractéristiques et de la sensibilité
particulière des ovins à cette infection. Chez les humains, la
FVR provoque une maladie grave semblable à la grippe, une
encéphalite fatale, une cécité due à une
inflammation de la rétine et souvent des complications
hémorragiques conduisant à la mort.
Longtemps considérée comme affection secondaire,
elle a suscité récemment l'intérêt des
vétérinaires et des médecins en raison des flambées
épizoo-épidémiques survenues dans certains foyers tels
qu'au Soudan, Egypte, Mauritanie, Sénégal, et tout
récemment au Kenya(FONTENILLE et al., 1995 ; FONTENILLE et al.,
1998 ; Encarta®, 2009).
4° Zébu
Le Zébu (du latin Bos indicus) est un
mammifère de la famille des Bovins, originaire du sud de l'Asie, qui
possède une grande bosse musculeuse sur le dos, au-dessus des
épaules. Le Zébu est utilisé en Afrique comme bête
de somme, pour son lait et sa viande. Il est très résistant
à la chaleur et aux maladies tropicales. Il a été
croisé avec d'autres espèces afin d'obtenir des
variétés très résistantes. Le Zébu est
aujourd'hui répandu en Afrique et dans certaines régions du
continent américain, particulièrement en Amérique du
Sud.(Microsoft Encarta ®, 2009 [DVD]- Microsoft Corporation, 2008).
5° Zoonose
La zoonose, aussi appelée Sodoku, est une
maladie de l'animal transmissible à l'homme. Certaine zoonoses sont
également susceptibles d'être transmises de l'homme à
l'animal. Le terme d'anthropozoonose désigne plus spécifiquement
les maladies exclusivement transmises de l'animal à l'homme.
Nombre des zoonoses se transmettent à l'homme par
contact direct avec un animal infecté, qu'il s'agisse d'un animal
domestique (chat, chien, oiseau), ou sauvage (renard). D'autres se contractent
par l'intermédiaire d'un animal vecteur comme le moustique (Larousse
médicale, 2006).
6° Vallée du Rift
La Vallée du Rift (Rift Valley) a une
profondeur qui varie de 390 m au-dessous du niveau de la mer sur le bord de la
mer Morte à environ 1 800 m au-dessus du niveau de la mer sur les
falaises du Kenya. La largeur de la vallée passe de quelques
kilomètres à plus de 160 km. En Afrique de l'Est, la
vallée se divise en une branche orientale et une branche occidentale.
C'est sur cette dernière branche que se situe le lac Tanganyika, un des
plus grands lacs du continent. Le Vallée de Rift comprend
également le lac Tibériade, le Jourdain, le golf d'Aqaba, la mer
Rouge et le golf d'Aden (Rift Valley, Microsoft ® Encarta ® 2009
[DVD]- Microsoft Corporation, 2008).
I.2 REVUE DE LA LITTERATURE
SUR LA FIEVRE DE LA VALLEE DU RIFT
Le virus à l'origine de la fièvre de la
vallée du Rift (FVR) a été isolé pour la
première fois en 1930, à partir d'un foyer observé
près du lac Naivasha, dans la Vallée du Rift au Kenya (Tableau
I.1). Cela fut une épizootie touchant les petits ruminants. Pendant de
nombreuses années, ce virus a été à l'origine
d'épizooties en Afrique orientale et australe affectant principalement
les ruminants domestiques avec une tendance à une forte
susceptibilité chez les ovins.
Des détails sur l'évolution chronologique de la
maladie sont présentés au tableau I.1 ci-dessous.
Tableau I.1 : Evolution chronologique de la
fièvre.
|
ANNEE
|
REGION
|
PAYS
|
RUMINANTS
|
VICTIMES HUMAINES
|
|
1930- 1931
|
Afrique de l'Est
|
Kenya
|
Moutons
|
|
|
1950
|
Afrique Australe
|
|
|
|
|
1973
|
Afrique du Nord
|
Soudan
|
|
|
|
1974-1975
|
Afrique Australe
|
Namibie, Afrique du Sud, Mozambique, Zambie et Zimbabwe
|
|
|
|
1977
|
Afrique du Nord
|
Egypte
|
Ovins, Caprins, Bovins, Buffles et Camélidés
|
600 décès
|
|
1987
|
Afrique de l'Ouest
|
Sénégal et sud de la Mauritanie
|
|
|
|
1993
|
Afrique du Nord
|
Egypte
|
|
|
|
1997-1998
|
Afrique de l'Est
|
Nord-est du Kenya et
Sud-ouest de la Somalie,
|
|
|
|
1998
|
Afrique de l'Ouest
|
Sud de la Mauritanie et Nord du Sénégal
|
|
|
|
2000
|
Moyen Orient
|
Arabie Saoudite et Yémen
|
|
|
|
2006
|
Afrique de l'Est
|
Kenya
|
|
|
|
2007
|
Afrique de l'Est
|
Kenya
|
|
75 personnes meurent sur un total de 183 malades
|
|
2007
|
Afrique de l'Est
|
Somalie
|
|
14 personnes
|
|
2009
|
|
îles des Comores et Mayotte
|
|
|
Source : (
http://fr.wikipedia.org/wiki...la_vall%C3%A9e_du_Rift).
Les humains en contact étroit avec des bêtes
malades ou mortes, étaient contaminés, mais ces cas
étaient peu nombreux et rarement mortels. En 1975, la FVR fut à
l'origine d'une épidémie de fièvre hémorragique
associée à l'encéphalite et ayant entraîné
des cas de mortalité en Afrique du Sud.
(
http://fr.wikipedia.org/wiki...la_vall%C3%A9e_du_Rift).
Depuis son identification en 1930-1931 dans la Vallée
du Rift et son extension dans certains pays de l'Afrique subsaharienne, la
maladie y est revenue, après des périodes
inter-épidémiques allant de 3 à 15 ans pour la
majorité des pays affectés.
Le comportement du virus pendant ce temps mort est encore
très peu connu. On pense qu'il couverait dans les oeufs des vecteurs, en
l'occurrence les moustiques des genres Aedes et Culex et
certaines espèces animales sauvages.
(
http://fr.wikipedia.org/wiki...la_vall%C3%A9e_du_Rift).
Les atteintes de l'Afrique du Nord, du Moyen Orient dans les
années 1977 et 2000, et en Afrique subsaharienne suffisent pour
démontrer que la maladie peut sortir de sa zone natale et progresser
vers d'autres zones voire d'autres continents.
I.3 Etiologie
Le virus en cause est du genre Phlebovirus, de la
famille des Bunyaviridae (Bunyavirus) isolé pour la
première fois en 1930, à partir des foyers des environs du lac
Naivasha (Fig. I.1), dans la région du Rift au Kenya (
http://fr.wikipedia.org/wiki).
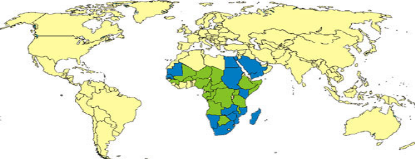
Fig. I.1 : Répartition de la fièvre de la
vallée du Rift en Afrique.
En bleu : Pays où la maladie est
endémique et surviennent des épidémies importantes de
RVF.
En vert : Pays connus pour la survenue
des foyers cliniques.
I.3.1 Morphologie, structure physico-chimique et
réplication du virus
a. Morphologie
Levirus de la Fièvre de la Vallée du Rift
(VFVR),Bunyavirus mesure environ 80 à 120 nm de diamètre
(Fig. I.2).
b. Structure physico-chimique
Le virion, particule virale primaire, est sphérique
avec une symétrie hélicoïdale. Il est pourvu d'une enveloppe
lipidique d'origine cellulaire portant à sa surface des projections de 5
à 10 nm formées de deux glycoprotéinesGn
et Gcautrefoisnommées(G1 et G2) de 65 et 56 KDA
respectivement en termes de poids moléculaire. Les spicules
glycoprotéines sont responsables de la fixation du virus à la
surface des cellules sensibles. Ils sont aussi le support de l'activité
hémagglutinante et la cible de la réponse immunitaire humorale
(Fig. I.2 A et B).
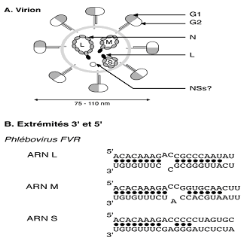
Fig.
I.2 : Codage des segments L, M et S de l'ARN du Bunyavirus.
c. Réplication du virus
Bunyavirusfixé sur les récepteurs des
cellules cibles est internalisé par endocytose.Il est enveloppé
et possède un génome composé de troissegmentsd'ARN simple
de polarité négative (Fig. I.2 B): L pour
(large), M pour
(medium), et S pour
(small). Chaque ARN est sous forme de
ribonucléoprotéine
d'aspect circulaire (NRP ou RNP).
Le segment L code pour la polymérase
L, le segment M pour les deux protéines (Gn et GC)
ainsi que deux protéines non structurales et le segment
S (ambisens) code pour les deux protéines, la
nucléoprotéine N et une protéine non structurale NSs (Fig.
I.2).
I.3.2 Cycle viral
La première étape de synthèse d'ARN est
la transcription primaire qui assure la synthèse des ARNm. Elle
est effectuée par le complexe de transcription associé aux RNP.
Chez les virus de cette famille, la transcriptase utilise un mécanisme
particulier, décrit à l'origine pour les Myxovirus, qui
consiste à initier la synthèse des ARNm avec un
oligoribonucléotide coiffé. C'est la capture de coiffe ou
"cap-snatching".
L'oligonucléotide amorce est
généré par clivage de l'extrémité 5' d'ARNm
cellulaires ; il comprend la coiffe et les 10-18 nucléotides suivants.
Le clivage est effectué par l'activité endonucléasique
associée à la protéine L.
Ainsi, tous les ARNm possèdent à leur
extrémité 5' une coiffe suivie d'une petite séquence
variable de 10 à 18 nucléotides qui représente une
extension par rapport à l'extrémité 3' de la matrice
génomique. Dans la plupart des cas, l'amorce s'apparie avec
lenucléotide en position +1 de l'extrémité 3' de la
matrice mais, parfois, elle s'apparie en position +2 ou +3, est allongée
de quelques bases, se décroche puis se repositionne en position +1 selon
un mécanisme de réalignement de l'amorce.
Le mécanisme de capture de coiffe s'applique aussi au
génome ambisens. Malgré la capacité de
l'ARN de sens génomique à coder pour la protéine NSs, cet
ARN ne sert pas directement d'ARNm. Cette protéine est
synthétisée à partir d'un ARNm spécifique transcrit
en utilisant l'antigénome comme matrice et initié par une amorce
cellulaire.
L'ARNm M est polyadénylé à son
extrémité 3' et le site de terminaison est situé à
quelque 70-140 nucléotides de l'extrémité 5' du
génome. Quant au segment L, il ne possède pas de site de
terminaison de transcription spécifique et son ARNm est un transcrit
complet.
(http://www.john-libbey-eurotext.fr/fr/revues/bio_rech/vir/e-docs/00/03/F8/4E/article.phtml)
LOPEZ et al. (1995) ont montré que le complexe
de transcription du virus de la FVR peut être reconstitué en
exprimant les protéines recombinantes L et N. Ce complexe est capable de
transcrire des ARN exogènes synthétisés in vitro.
Les séquences de l'ARN viral reconnues par le complexe
correspondent aux 14 nucléotides de l'extrémité 3' qui
sont conservés dans les trois segments de tous les Phlebovirus.
Outre la synthèse des ARNm, la transcriptase
synthétise les antigénomes, molécules qui servent de
matrice de réplication pour la synthèse des
génomes. Les molécules génomiques et
antigénomiques ont un ribonucléotide triphosphate à la
position +1 de la séquence virale, ce qui laisse penser que la
réplicase n'utilise pas d'amorces. La nature exacte de cette enzyme
n'est pas connue. La protéine NSs serait une protéine accessoire
ou, si elle est nécessaire, sa fonction est compensée par
d'autres protéines telles que la polymérase L des
Nairovirusou la protéine N des Nairoviruset des
Hantavirus, qui contiennent deux fois plus d'information que celle des
Phlebovirus.
La question du rôle essentiel ou accessoire de la
protéine NSs du VFVR doit être débattue sachant qu'il
existe un mutant naturel Clone 13 dans lequel le gène NSs est
déleté de 70 % et cette délétion interne conserve
en phase de lecture les régions N et C terminales. Pourtant, le virus
n'a pas perdu sa capacité à infecter vertébrés et
moustiques. La possibilité de manipuler le génome de ce virus au
moyen de la génétique inverse, comme cela vient d'être
réalisé par BRIDGEN et ELLIOTT pour le virus Bunyamwera
(prototype du genre Bunyavirus) devrait être la meilleure
approche expérimentale pour aborder ces questions (LOPEZ et
al., 1995).
Bien que le cycle viral se déroule dans le cytoplasme,
des structures filamenteuses contenant la protéine NSs sont
détectées au niveau du noyau des cellules infectées.
Depuis quelques années, certains chercheursont mis en évidence le
rôle essentiel que joue la protéine NSs dans la
pathogénicité du RVFV. Ils ont tout d'abord montré que la
protéine NSs est un facteur de virulence puisque les virus naturellement
délaités de cette protéine ne sont plus pathogènes.
Ils ont aussi démontré que la protéine NSs bloque la
production d'interféron de type I. (BOULOY et al.
cités par Lopez et al., 1995).
L'infection par le VFVR entraîne une inhibition rapide
et importante de la synthèse des ARN cellulaires qui s'accompagne d'une
diminution de la concentration du facteur de transcription TFIIH. En ce qui
concerne ce facteur, outre son rôle dans l'induction de la transcription,
il serait impliqué dans la réparation de l'ADN et probablement
aussi dans la régulation du cycle cellulaire. La protéine NSs, en
limitant la quantité de TFIIH fonctionnel, inhibe la transcription des
gènes cellulaires et permet ainsi au virus d'échapper à la
réponse antivirale de l'hôte (LOPEZ et al., 1995).
I.3.3 Pouvoir pathogène
Le pouvoir pathogène du VFVR est variable
qualitativement ou quantitativement selon l'origine géographique et
selon les souches. En effet, on distingue des souches
viscérotropes, neurotropes ou
pantropes selon le lieu de prédilection.
La variation génétique du VFVR a
été estimée en séquences une partie de l'ARN du
segment N de 22 isolats de diverses espèces hôtes. L'ARN du
segment N de l'isolat égyptien (ZH501), a été
utilisé comme référence pour ces comparaisons.
La plupart des isolats étaient très comparables
à ZH501 aux niveaux des séquences des acides nucléiques et
des séquences déduites des acides aminés. La variation des
séquences des acides nucléiques était de 0 à 4,5%
et celle des acides aminés de 0 à 2,4%. On a identifié des
modifications spécifiques codant les acides aminés qui peuvent
jouer un rôle dans la neutralisation du virus et contribuer à sa
virulence.
Comme d'autres Arbovirus, le VFVR circule du site
d'inoculation aux ganglions lymphatiques via la circulation lymphatique.
Après réplication dans les ganglions lymphatiques, sa
dissémination dans l'organisme est assurée par la circulation
sanguine engendrant une virémie primaire et l'infection des organes
cibles. Un examen sanguin lors d'une atteinte par le VFVR est
caractérisé par une profonde leucopénie, une
élévation des enzymes hépatiques associée aux
lésions hépatiques et une thrombocytopénie.
Le foie, la rate et le cerveau sont des sites de
prédilection pour la réplication du VFVR. Dans les atteintes
aigues, le VFVR affecte principalement le foie ; les cellules
hépatiques entrent rapidement en nécrose générale
ou focale du foie, nécrose qui est caractérisée par une
décoloration du parenchyme hépatique. Les hépatocytes
infectées présentent des inclusions intranucléaires ovales
ou en bâtonnets supposées contenir les protéines NSs
(AFSSA, 2008).
I.3.4 Pouvoir antigène et immunogène
Dans la plupart des infections virales, le VFVR est
supposé induire une réponse immunitaire innée et adaptive.
L'immunité innée assure la défense de l'organisme avant la
mise en place des mécanismes d'activation. La réponse immunitaire
cellulaire est encore mal connue et il est admis que les infections à
Bunyavirus déclenchent une réponse humorale qui joue un
rôle important dans la protection du sujet infecté. La
nucléoprotéine NP est l'immunogène majeure, mais les
anticorps neutralisants, possédant un rôle protecteur, sont
dirigés contre les glycoprotéines Gn et Gc (AFSSA, 2008).
Les anticorps IgM apparaissent d'abord trois à cinq
jours après le déclenchement de l'infection de FVR, au moment
où la virémie s'arrête. Ils persistent durant un à
deux, ou trois à quatre mois chez certains animaux. Les anticorps IgG
apparaissent 10 à 14 jours après le début de l'infection
et persistent pendant au moins un à deux ans, ou durent toute la
vie.Lors de réinfection, des IgM apparaissent (même en
présence d'IgG), mais elles sont éphémères (Fig.
I.3). Cette caractéristique est mise à profit pour le
dépistage d'infections récentes.
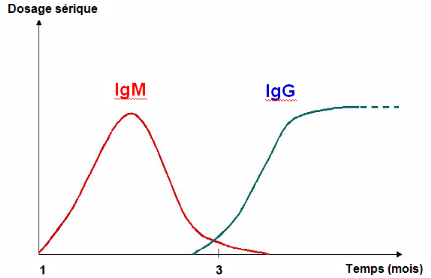
Figure I.3 : Coexistence IgG - IgM
(AFSSA, op. cit.)
I.3.5 Résistance aux agents physiques et chimiques
Les études sur les propriétés
physico-chimiques et la résistance de VFVR tendent à montrer que
ce virus est résistant et stable dans les conditions naturelles (Tableau
I.2). Cette situation contraste quelque peu avec la présence d'une
enveloppe lipidique associée, en général avec les virus
à ARN, à une résistance plutôt faible dans le milieu
extérieur (AFSSA, 2008).
Tableau I.2 : Propriétés physico-chimiques
et résistance du VFVR.
|
AGENTS
|
RESISTANCE / Sensibilité
|
|
Température
|
§ survit plusieurs mois à 4°C.
§ inactivé dans le sérum à 56°C
pendant 120 minutes.
|
|
pH
|
§ résiste aux pH basiques mais est inactivé
à pH <6,2.
|
|
Agents chimiques
|
§ inactivé par l'éther et le
chloroforme.
|
|
Désinfectants
|
§ inactivé par les solutions fortes d'hypochlorite
de sodium ou de calcium (le chlore résiduel doit dépasser 5 000
ppm).
|
|
Résistance
|
§ résiste dans les produits d'excrétion
desséchés et se multiplie dans l'organisme de certains vecteurs
arthropodes.
§ peut résister à un contact avec du
phénol à 0,5 %, à 4°C, pendant 6 mois.
|
Source : (
http://www.oie.int/fr/maladies/fiches/f_a080.htm
I.4
Epidémiologie
I.4.1 Epidémiologie moléculaire
Le séquençage du génome du VFVR a permis
de classer les souches en trois lignées ou
« topo types ». Ces trois lignées
recoupent à peu près la répartition
géographique :
§ la, la lignée d'Afrique
Centrale et de l'Est,
§ lb, la lignée d'Afrique de
l'Ouest,
§ ll, la lignée
égyptienne.
Les souches virales des épidémies
égyptiennes de 1977 et 1993 sont proches, ce qui suggère que la
FVR se maintient sous forme endémique en Egypte (LOPEZ et al., 1995).
Les souches de l'Afrique Centrale et de l'Est restent
apparentées à travers le temps, ce qui montre une grande
stabilité de souche en un même lieu, malgré le passage de
cycles endémiques en cycles épidémiques.
La mise en évidence de souches appartenant à un
groupe donné dans une zone géographique où
prédomine un autre groupe prouve une certaine circulation des souches
selon deux mécanismes possibles :la circulation en forêt
tropicale humide par un hypothétique cycle selvatique. La mise en
évidence du virus chez des moustiques selvatiques, des
singes et desrongeurs est un argument
indéniable.
Les migrations ou le mouvement des animaux ou vecteurs
infectés comme cela a été établi chez certaines
souches de Brucella.Alors que la réponse à la
probabilité d'avoir lieu, une certaine souche issue de la recombinaison
de segments L, M et S de souches de groupes différents dans la nature,
reste inconnue (LOPEZ et al., op. cit.).
I.4.2 Epidémiologie descriptive
Quand les conditions climatiques en Afrique sont favorables,
la FVR évolue sous forme enzootique (on n'en trouver aucune trace)
entrecoupée de temps à autre par des flambées
épizootiques (avortements et mortalité).Introduite pour la
première fois, elle sévit sous forme de foyers
localisés.Dans certains cas, après un premier cycle
d'amplification animale, elle peut atteindre la population humaine et peut se
révéler mortelle.
La FVR est azootique en Afrique sub-saharienne et à
Madagascar et elle est périodiquement signalée en Egypte
(SWANEPOEL et al., 1994 ; OMS, 2006-2007).
Pour que les épidémies se produisent, trois
facteurs doivent être présents :
§ la préexistence ou l'introduction du virus dans
la zone ;
§ la présence d'importantes populations de
ruminants vulnérables et,
§ des conditions climatiques ou environnementales
favorisant un développement massif de la population de moustiques
vecteurs.
I.4.3 Epidémiologie analytique
I.4.3.1 Modes de transmission
La FVR connaît deux modes de transmission :
§ la transmission vectorielle
§ la transmission directe
a. Transmission vectorielle
Le virus peut être transmis par des piqûres de
nombreuses espèces de moustiques appartenant aux genres Aedes,
Anopheles,Culex, Eretmapodites et Mansonia, tous
vecteurs biologiques compétents de la maladie (Fig. I.4). Les moustiques
du genre Aedes sont les hôtes réservoirs du virus (Fig.
I.4A).
(
http://www.oie.int/fr/maladies/fiches/f_a080.htm).
Les moustiques du genre Culex jouent un rôle important
dans l'amplification virale et la contamination humaine, mais la transmission
verticale n'est pas possible. Ceux du genre Aedes assureraient aussi
la survie du virus d'une saison humide à l'autre par le biais d'une
transmission verticale (FONTENILLE et al., 1995 et 1998; DIALLO, 2000).
Les animaux sont contagieux pendant leur période
virémique, qui peut être brève (6 à 18 heures) ou
persister jusqu'à six à huit jours.
Les moustiques infectés peuvent être
transportés sur de longues distances par des vents ou des courants d'air
de basse altitude, ce qui peut conduire à une propagation rapide du
virus de région à région ou même
internationalement.
(
http://www.fao.org/docrep/006/y4140f/y4140f04.htm#bm04.4).
b. Transmission directe
(aux humains essentiellement)
La maladie se transmet aux personnes manipulant des animaux
infectés et de la viande contaminée.
(
http://www.oie.int/fr/maladies/fiches/f_a080.htm).
En effet, les humains peuvent être infectés par
des piqûres de moustique (le plus souvent des Aedes)mais, dans
la grande majorité des cas, l'infection se produit chez l'homme à
la suite d'un contact direct ou indirect avec du sang ou des organes d'animaux
contaminés.
Le virus peut se transmettre lors de la manipulation des
tissus animaux au cours de l'abattage ou de la découpe, pendant les
mises bas et les interventions vétérinaires ou lors de
l'élimination des carcasses ou des foetus. Certains groupes
professionnels, comme les éleveurs, les agriculteurs, les
employés des abattoirs et les vétérinaires, sont donc les
plus exposés au risque d'infection.
Le virus pénètre chez l'homme par inoculation,
en cas de blessure avec un couteau souillé ou de lésion
cutanée, par exemple, ou par inhalation des aérosols produits au
cours de l'abattage des animaux infectés. Ce dernier mode de
transmission a aussi abouti à la contamination de personnes travaillant
dans des laboratoires. Il semble bien que l'homme puisse également
être contaminé en ingérant du lait cru ou non
pasteurisé provenant d'animaux infectés. Des infections humaines
ont été également à la suite de piqûres de
moustiques, le plus souvent des Aedes (Fig. I.4A). De
même, les mouches hématophages,se nourrissant de sang, peuvent
également transmettre le virus de la FVR.
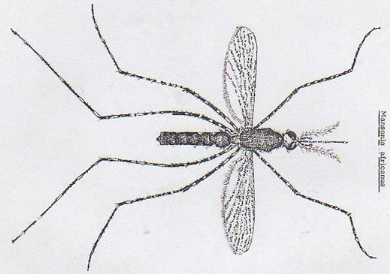
c. Vecteurs
251671040

251664896
251665920
251663872AB
CD
Fig. I.3 : Moustique, Hôte intermédiaire et
vecteur du virus, Bunyavirus, agent de la fièvre de la
Vallée de Rift.
Aedes (A), Anopheles (B) , Culex
(C), et Mansonia (D).
http://www3.ac-nancy-metz.fr/ien-bar/IMG/Image/momes69/insolites/le-moustique-38040.jpg
et LUAMBA, 2008.
FONTENILLE et al. (1995) signale que :
§ les moustiques sont de bons vecteurs biologiques.
§ le moustique Aedes lineatopinnis sert de
réservoir viral.
§ en Amérique du Nord, les moustiques du genre
Aedes, Culex et Anophelessont des vecteurs du
virus.
§ les vecteurs mécaniques, comme les moucherons et
les mouches piqueuses, jouent un rôle important durant les
épidémies d'envergure.
d. Réservoirs
Le VFVR peut passer la saison sèche dans les oeufs en
dormance de certaines espèces d'Aedes. Ces moustiques seraient
un véritable réservoir de la maladie, mais la preuve
expérimentale reste nécessaire pour confirmer cette affirmation.
Avec suffisamment de pluies, les moustiques infectés se
développent et infectent des ruminants (FONTENILLE et al., 1995 et
1998).
Certaines études au Sénégal ont
démontré la présence des anticorps chez certaines
espèces des rongeurs. Les épizooties de FVR ont une
cyclicité associée à des changements bioclimatiques
favorisant la pullulation des vecteurs et sont suivies d'une période
d'immunité chez le bétail qui le protège de la
réinfection. Il est possible que pendant ces périodes, certaines
espèces animales dont les rongeurs jouent le rôle d'hôtes
amplificateurs et de maintien de l'infection. Cependant, la virémie est
plus courte chez les rongeurs que chez les ruminants. Les singes d'Afrique, les
porcs et les carnivores domestiques présentent une virémie
passagère avec séroconversion et sont considérés
comme des culs-de-sac épidémiologiques (FONTENILLE et al.,
1998 ; DIALLO et al., 2000).
Selon FONTENILLE et al. (op. cit.), les sources virales
demeurent donc :
§ Pour les animaux, les espèces
sauvages (ruminants sauvages, buffles, antilopes, gnous,
etc.), domestiques (bovins, ovins, caprins, dromadaires,
différents rongeurs) et les vecteurs (moustiques : Aedes,
Anopheles, Culex, et Mansonia).
§ Pour l'homme : écoulement nasal, sang,
sécrétions vaginales après avortement chez l'animal,
moustiques et viande contaminée. Eventuellement aérosols et lait
cru infectieux (Fig. I.4).
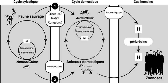
(http://www.fao.org/docrep/006/y4140f/y4140f04.htm#bm04.4)
Fig. I.4 : Cycle de transmission de la Fièvre de
la Vallée de Rift.
I.4.3.2 Répartition géographique
La fièvre de la vallée du Rift est
signalée exclusivement dans les pays africains, notamment lorsque la
pluviosité est importante et que les populations de moustiques vecteurs
sont denses. Les seuls foyers épizootiques enregistrés en dehors
de l'Afriquesubsaharienne ont touché des hommes et des animaux en
Egypte, en 1977-78 et en 1993. Jusqu'à une époque récente,
on pensait que la FVR était limitée à l'Afrique et
Madagascar (Fig. I.1). Elle a pourtant été signalée dans
la région Tihama en Arabie saoudite, dans l'archipel des Comores et au
Yémen en septembre 2000 (NAU, 2009). Des contaminations sont survenues
en laboratoire dans d'autres parties du monde
(
http://www.oie.int/fr/maladies/fiches/f_a080.htm).
I.5 Manifestations cliniques
Les symptômes de la FVR ne sont pas spécifiques
et varient en fonction de l'espèce, de l'état physiologique et de
l'âge des animaux. Ils sont dus à un tropisme particulier du virus
pour les hépatocytes (hépatite nécrosante) et les
cotylédons dans le placenta chez les femelles en gestation.
La durée d'incubation est, elle aussi, très
variable, de quelques heures dans la forme suraiguë à trois
semaines dans la forme subaiguë. Le code zoo sanitaire de l'Office
International des Epizooties (OIE) reconnaît une durée
d'incubation de 30 jours au maximum
(http://agriculture.gouv.fr/guide_epizooties/monographies/f-fvr.htm).
I.5.1 Chez les Ovins
On distingue quatre formes :
§ La forme suraiguë chez les
agneaux nouveaux nés :
o Incubation courte : 12 à 72 h ;
o Symptômes : forte hyperthermie (40-42°C),
anorexie, asthénie musculaire, des douleurs abdominales, mort dans les
36 heures suivant l'inoculation ;
o Mortalité : 90 % chez les animaux de moins d'une
semaine et 20 % chez les animaux de plus d'une semaine.
§ La forme aigue chez les adultes
et les jeunes de plus de trois semaines :
o Incubation : 2 à 5
jours ;
o Symptômes : forte hyperthermie
(40-41°C), écoulement nasal mucopurulent, vomissements ; chez les
femelles gravides, le taux d'avortements peut atteindre 100 %, diarrhée
putride hémorragique et parfois ictère, une lymphadénite,
une colique et une démarche instable ;
o Mortalité : 20 à 30
%.
§ La forme subaiguë se
traduit par des avortements nombreux dans les troupeaux deux semaines
après l'infection
o Symptômes : Une fièvre
biphasique, anorexie, affaiblissement, vomissements et douleurs abdominales,
avec ou sans gastro-entérite hémorragique. Une hépatite et
une jaunisse sont développées dans la plupart des cas.
§ La forme inapparente, est
vraisemblablement très fréquente et est largement
sous-estimée. Elle n'est détectée que
lors d'enquêtes sérologiques et traduit une circulation du virus
à bas bruit.Les chevaux, les chiens et
les chats sont réceptifs (virémie transitoire)
mais ne présentent aucun
symptôme.(http://agriculture.gouv.fr/guide_epizooties/monographies/f-fvr.htm).
I.5.2 Chez les Caprins
La FVR chez les caprins est similaire à celle des ovins
mais pas aussi grave. Il est important de rappeler que les moutons et les
chèvres indigènes en Afrique peuvent ne présenter aucun
des signes susmentionnés et aucun signe clinique si ce n'est quelques
avortements. Les troupeaux comprenant ou voisins d'animaux exotiques atteints
d'une FVR sévère peuvent ne présenter aucun signe
(
http://fr.wikipedia.org/wiki/Fi%C3%A8vre_de_la_vall%C3%A9e_du_Rift).
I.5.3 Chez les Bovins
La maladie évolue différemment selon l'âge
des animaux. Chez les veaux, la forme aigue est fréquente avec
hyperthermie (40-41°C), dépression, faiblesse
générale, refus de se déplacer, diarrhée
fétide, polypnée et dyspnée, mortalité (10-70%).
Chez les adultes, l'avortement est souvent le seul
symptôme mais peut toucher 80 à 90% des femelles gestantes.
Lorsqu'ils sont atteints par une forme aigue, les bovins adultes
présentent de l'hyperthermie (40-41°C) pendant 2 à 4 j,
hyper salivation, asthénie musculaire, diarrhée, de l'anorexie,
le jetage mucopurulent, une diarrhée hémorragique et une baisse
nette de la production de lait. Quand la maladie s'étend sur une
à deux semaines, un ictère net apparaît. La
mortalité dépasse rarement 10%. Des cas tératologiques ont
été aussi signalés chez les avortons (Fig. I.5).(
http://www.oie.int/fr/maladies/fiches/f_a080.htm).
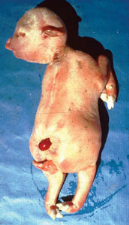
Fig.
I.5 :Avorton d'un veaulors d'un foyer de FVR.
(Collection département EMVT du CIRAD)
Foie décoloré, rouge
jaunâtre
251670016251667968251666944251668992
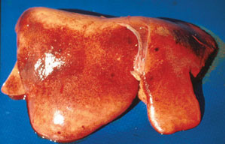
Fig. I.6 : Photo d'une hépatite
nécrosante chez une vache : foie décoloré, rouge
jaunâtre et friable.
(Collection département EMVT du CIRAD)
I.5.4 Chez les Dromadaires
Bien que l'infection soit généralement latente
chez les animaux adultes, les chamelles gestantes peuvent avorter à tout
moment de la gestation et des morts néonatales peuvent se
vérifier. Des taux d'avortement de 70 % des gestantes ont
été observés avec de nombreuses morts au moment de la mise
bas et jusqu'à l'âge de 3 à 4 mois
(http://www.fao.org/docrep/006/y4140f/y4140f04.htm#bm04.5).
I.5.5 Chez les Rongeurs
Infectés expérimentalement, la mortalité
est variable en fonction des espèces : 95 à 100% chez la
souris blanche en fonction de la souche virale, alors que des rongeurs sauvages
du Sénégal tels que Arivants niloticus et Mastomys
erythroleucus semblent insensibles à la maladie avec une simple
séroconversion dans seulement 25% des cas (DIOPet al., 1989).
I.5.6 Chez l'Homme
Chez l'Homme le virus peut se manifester sous l'apparence de
plusieurs syndromes différents. Habituellement les victimes n'ont aucun
symptôme ou seulement une maladie peu bruyante avec de la fièvre,
des
maux de
tête, des
myalgies et des anomalies
hépatiques. Dans un
petit nombre de cas (< 2%) la maladie peut évoluer vers un syndrome
de
fièvre
hémorragique, de
méningo-encéphalite
(inflammation du cerveau), ou encore affecter l'oeil (rétinite). Les
patients qui tombent malades présentent habituellement de la
fièvre, un état de faiblesse généralisée,
des douleurs dorsales, des vertiges, et une perte de poids au début de
la maladie. En règle générale, les patients entrent en
convalescence 2 à 7 jours après le début de la maladie (
http://fr.wikipedia.org/wiki/Fi%C3%A8vre_de_la_vall%C3%A9e_du_Rift).
Dans les formes aigues, après une période
d'incubation de deux à six jours, les patients présentent les
symptômes semblables à ceux de la grippe avec une poussée
soudaine de fièvre, de
l'asthénie, des maux de tête,
des maux de dos, des myalgies, et souvent une
photophobie et des vomissements.
La fièvre est biphasique. La jaunisse
constatée habituellement reflète un certain degré de
dégénérescence du foie. On peut alors confondre la FVR
avec la méningite ou une grippe.
Selon SWANEPOEL et al. (1994) et EVANS et al. (2007), les
complications de la FVR qui se produisent à un faible pourcentage
d'infections humaines incluent :
§ Forme oculaire (la
rétinite): dans ce cas, les symptômes habituels
de la forme bénigne s'accompagnent de lésions rétiniennes,
qui apparaissent en général une à trois semaines
après la manifestation des premiers symptômes. Habituellement, les
patients signalent une baisse de la vision ou une gêne visuelle. La
maladie peut guérir spontanément sans laisser de séquelles
en dix à douze semaines. Chez certains patients cependant, les
lésions se produisent près de la tâche jaune et la
moitié des patients souffriront d'une baisse définitive de leur
acuité visuelle. La létalité est faible pour cette
forme ;
§ Forme hémorragique : cette
forme rappelle les manifestations cliniques de la fièvre
hémorragique d'Ebola, à savoir: deux à
quatre jours après le début de la maladie, le patient
présente les signes d'une atteinte hépatique grave avec
ictère. Des phénomènes hémorragiques apparaissent
ensuite: vomissements de sang, sang dans les selles, purpura ou ecchymoses
(provoqués par des saignements cutanés internes), saignements du
nez ou des gencives, ménorragies et saignements aux points de ponction
veineuse. Le taux de létalité pour ce syndrome
hémorragique est élevé et se situe aux alentours de 50 %.
Le décès survient habituellement trois à six jours
après l'apparition des symptômes. On peut détecter le virus
dans la circulation sanguine pendant une dizaine de jours chez les patients
atteints de la forme ictéro-hémorragique de la FVR ;
§ Méningo-encéphalite:
elle apparaît en général d'une à quatre semaines
après les premiers symptômes de la FVR. On observe dans les
manifestations cliniques d'intenses céphalées, des pertes de
mémoire, des hallucinations, une désorientation, un état
confusionnel, des vertiges, la léthargie et le coma. Les complications
neurologiques surviennent plus tard (après 60 jours). La
létalité est rare chez les patients atteints uniquement par cette
forme, mais des séquelles neurologiques parfois graves sont courantes (
http://www.who.int/mediacentre/factsheets/fs207/fr/index.html).
I.6 LESIONS
Les lésions hépatiques sont semblables chez
toutes les espèces (et ne varient que selon l'âge). Les plus
graves sont observées chez les foetus avortés et les agneaux
nouveau-nés :
§ Nécrose hépatique en foyer ou
généralisée (foyers nécrotiques blancs ou gris
blanchâtre d'environ 1 mm de diamètre),
§ Le foie est moyennement à hautement
hypertrophié, mou, friable avec des plaques de congestion
irrégulières, et hémorragies sous-capsulaires,
§ Foie de couleur brun-jaunâtre chez les avortons,
§ Hémorragies cutanées étendues,
pétéchies ou ecchymoses sur les membranes séreuses
(feuillet pariétal et viscéral),
§ Tuméfaction, oedème, hémorragies
et nécrose des ganglions lymphatiques,
§ Congestion et hémorragies du cortex
rénal, de la vésicule biliaire et de la muqueuse de la caillette
sont courantes,
§ Le contenu intestinal est souvent d'un brun chocolat
foncé et dans certains cas, on observe une entérite
hémorragique, une hypertrophie de la rate,
§ Ictère (faible fréquence).
(
http://www.oie.int/fr/maladies/fiches/f_a080.htm)
I.7 DIAGNOSTIC
I.7.1 Diagnostic de terrain
Les épidémies de FVR doivent toujours être
fortement suspectées lorsqu'il y a une mortalité
élevée d'agneaux et des chevreaux associée à une
augmentation des taux d'avortements chez les ovins, les caprins, les bovins ou
les camélidés. Cela est particulièrement le cas en
présence d'une inondation de surface dans la savane ou les zones
semi-arides après des pluies prolongées (ou dans les zones
irriguées), en présence d'une importante quantité de
moustiques, et si une maladie est constatée simultanément chez
les populations humaines (syndrome pseudo-grippal).
(http://www.fao.org/docrep/006/y4140f/y4140f04.htm#bm04.1).
Le laboratoire est seul en mesure d'assurer
le diagnostic. On peut poser le diagnostic de la FVR aiguë à l'aide
de plusieurs méthodes. Les tests sérologiques, comme le dosage
immuno-enzymatique (méthodes "ELISA" ou "EIA") peuvent mettre en
évidence la présence d'IgM spécifiques pour le virus. On
peut détecter le virus lui-même dans le sang au début de la
maladie ou dans les tissus prélevés postmortem à l'aide de
diverses techniques de propagation virale (cultures de cellules ou inoculation
d'animaux) ou d'épreuves de détection des antigènes par
RT-PCR (http://www.who.int/mediacentre/factsheets/fs207/fr/index.html).
I.7.2 Diagnostic différentiel
Certaines maladies ainsi que toutes les causes d'avortement
chez les ruminants peuvent être confondues cliniquement avec la FVR. Ici,
les maladies à prendre en considérationcomprennent :
§ Fièvre catarrhale du mouton,
§ Maladie de Wesselsbron,
§ Entérotoxémie chez le mouton,
§ Fièvre éphémère,
§ Brucellose,
§ Vibriose,
§ Trichomonose,
§ Maladie de Nairobi,
§ Péricardique fibrineuse (Heartwater
Disease),
§ Chlamydiose ovine (avortement enzootique),
§ Intoxication d'origine végétale ou,
§ Septicémies d'origine bactérienne,
§ Peste bovine et Peste des petits ruminants.
Chez l'humain, les signes cliniques sont variés et le
diagnostic différentiel doit comprendre l'élimination des
possibilités suivantes :
§ Paludisme,
§ Brucellose,
§ Fièvre de Lassa,
§ Fièvre d'Ebola,
§ Fièvre de Marburg,
§ Fièvre hémorragique du Congo ou du
Crimée,
§ Dengue,
§ Dengue hémorragique,
Le recours au laboratoire est indispensable.
I.7.3 Diagnostic de laboratoire
Les prélèvements de choix sont :
§ Sang entier (20ml) provenant d'animaux fébriles
avec un anticoagulant : acide
éthylène-diamine-tétracétique (EDTA) ou
héparine (pénicilline 200 unités et streptomycine
200ug/ml) pour la virologie,
§ Sérum (10ml) provenant d'animaux
présentant une fièvre aigue et ceux convalescents pour la
sérologie,
§ Echantillons de tissus frais provenant d'animaux morts
récemment et de foetus avortés (rate, foie, reins, ganglions
lymphatiques, coeur, cerveau) et placés dans des récipients
stériles,
§ Tissus fixés (rate et foie) dans du formol
tamponné à 10% pour l'histopathologie.
Tous les échantillons doivent être
expédiés à 4°C (sachets réfrigérants).
Si les délais d'expédition dépassent 24 heures, les tissus
frais et les échantillons sérologiques doivent être
congelés à -20°C, puis expédiés avec des
sachets réfrigérants.
Lors de la manipulation et de l'expédition des
prélèvements, toutes les précautions doivent être
prises pour empêcher la contamination des personnels, notamment en
prêtant attention au risque d'aérosolisation de gouttelettes de
sang.(
http://www.oie.int/fr/maladies/fiches/f_a080.htm).
I.7.3.1 Histopathologie
La découverte de lésions histologiques
caractéristiques avec des pan-nécroses dans les foies des jeunes
animaux ou des foetus est caractéristique de la FVR.
(
http://www.oie.int/fr/maladies/fiches/f_a080.htm).
I.7.3.2 Isolement du virus
Le virus de la FVR peut être isolé à
partir du sang total ou d'homogénats de tissus frais par :
a. Injection intracérébrale sur des souris de
lait,
b. Injection intra péritonéale sur des souris ou
des hamsters adultes,
c. Inoculation du virus à des cultures de tissus
(Véro, CER, BHK-21, lignées de cellules de moustiques ou cultures
de cellules primaires de reins et de testicules de veau, d'agneau et de
chèvre).
L'identité du virus isolé est confirmé
par :
§ Une réaction en chaîne de la
polymérase (PCR),
§ Un essai d'immuno-absorption enzymatique (ELISA),
§ Des tests de coloration fluorescente aux anticorps.
§ De séroneutralisation du virus
I.7.3.3 Détection des antigènes
L'antigène de la FVR peut être
détecté par quatre types de tests :
a. Tests d'immunofluorescence directe ou indirecte sur des
calques ou des coupes de foie, de rate ou de cerveau.
b. Tests d'immunodiffusion en gélose (IDG) sur des
tissus frais (diagnostic rapide)
c. Tests ELISA (dosage immunoenzymatique).
d. Tests d'immunohistochimie (HIC) : la coloration
histochimique de coupes congelées ou de tissus fixés au
formol.
e. Technique d'amplification en chaîne par
polymérase RT-PCR (Reverse Transcriptase- Polymérase Chain
Réaction).
I.7.3.4 Détection des anticorps
Deux types de testspermettent de détecter les anticorps
de la FVR :
a. Tests ELISA pour tester la présence d'IgM et d'IgG
(le test ELISA indirect est un test fiable et sensible et peut fournir des
résultats en quelques heures).
b. Test de séroneutralisation du virus.
I.7.3.5 Détection du
matériel génétique viral
a. Un test PCR de rétrotranscriptase est maintenant
disponible pour détecter le matériel génétique
viral.
b. Le séquençage de la région par
protéine-codage NSs du génome peut être utilisé pour
une analyse phylogénétique (prise des empreintes
génétiques) d'isolats du virus.
I.8 TRAITEMENT
I.8.1 Traitement curatif
Aucun traitement spécifique. Traitement symptomatique
est d'application dans les cas sévères chez l'homme.
I.8.2 Traitement prophylactique
a. Prophylaxie sanitaire
Les mesures d'hygiène et la lutte contre les vecteurs
s'avèrent peu efficaces.
b. Prophylaxie médicale
La prophylaxie médicale porte sur :
§ le Vaccin à virus
atténué (souche Smithburn)
o une inoculation confère une immunité de 3
ans.
o pathogénicité résiduelle chez les
femelles gravides (avortements).
o le vaccin est pathogène pour l'homme.
§ le Vaccin à virus inactivé
o Nécessite deux inoculations et un rappel annuel
I.8.3 chez l'homme
§ La FVR étant relativement bénigne et de
courte durée dans la plupart des cas humains, aucun traitement
spécifique ne s'impose pour ces patients. Dans les cas plus graves,
c'est le traitement symptomatique général qui prédomine.
§ On a mis au point un vaccin inactivé à
usage humain, mais il n'est pas homologué et n'est pas proposé
dans le commerce, mais son utilisation est restée expérimentale.
D'autres vaccins candidats sont à l'étude.
(
http://www.who.int/csr/resources/publications/standardprecautions/en/index.html).
CHAPITRE II
MILIEU, MATERIELS ET METHODES
II.1 MILIEU
a. Laboratoire de recherche
La présente recherche a été menée
au Laboratoire Vétérinaire de Kinshasa, Département
technique dans les Services de Pathologie générale et de
Sérologie. Ce Laboratoire est une institution du ministère de
l'agriculture spécialisée dans le diagnostic des maladies
animales, la production des vaccins, l'encadrement des éleveurs,
l'encadrement des étudiants dans le domaine bio - médicale et la
recherche vétérinaire.
b. Description du terrain : Nord de la province du
Katanga
Les données exploitées dans ce travail ont
été récoltées dans la partie Nord de la Province du
Katanga du fait de son accessibilité et de sa population importante en
ruminants domestiques et ce, dans les environs de quelques grandes
exploitations bovines industrielles. Cette zone est située entre le
7ème et 9ème parallèle de latitude
Sud et les 24ème et 28ème méridien
de longitude Est (KEVERS. 1986).
Cette zone jouit d'un climat tropical de type Aw4
caractérisé par deux saisons :
§ une saison de pluies de 8 mois avec une
pluviométrie annuelle moyenne de 1 500 mm et dont les mois de novembre,
décembre, janvier, février et mars sont les plus pluvieuxet
§ une saison sèche qui dure quatre mois.
La moyenne annuelle de température varie entre
22°C et 24°C (30,5°C max. et 15,4°C min.) ces
différentes variations sont sous l'influence des brides du SUD-EST avec
une insolation moyenne journalière de #177; 21°C. Les
précipitations moyennes annuelles sont évaluées à 1
500 mm. Le ranch sol est sablonneux avec une forte infiltration hydrique pour
certains secteurs comme la Lovoy et la Kileka et d'un sol argileux rouge,
très compact à faible infiltration hydrique plus au Nord vers
Kabongo. Les bas fonds sont tapissés d'un sol argileux gris (GILLAIN,
1953 ; MULUMBA-MFUMU, 2007).
La végétation est caractérisée par
une savane de type Soudano-Zambezien (Lovoy et Kileka) et de Guinéen
plus au Nord, parsemée d'arbustes et entre coupée par de galeries
forestières le long des cours d'eau. Les marrais, aussi très
visibles et inondés parfois jusqu'en saison sèche, servent des
pâturages durant la saison sèche en absence d'inondations.
Le réseau hydrographique est abondant et ramifié
par les rivières dont la Lomami, la Lovoy, la Lwembe et la Koholo sont
les plus importantes et le long desquelles sont aménagés des
points d'abreuvement alimentés par plusieurs affluents (Fig. II.1).
Fig. II. 1 : Zone de l'étude dans
le Nord de la province du Katanga.
Subdivision de la zone de l'étude:
§ Site de Lovoy : Sud de la zone
d'étude.
§ Site de Kileka : Centre de la
zone d'étude.
§ Site de Mitshia : Nord de la zone
d'étude
II.2 MATERIELS ET
METHODES
Cette étude horizontale est menée dans le but
de ressortir la prévalence apparente d'une zoonose majeure. Elle fait
suite à des constats cliniques établis après quelques
visites de terrain avec un suivi de résultats d'analyses de laboratoire
à partir des sérums bovins récoltés et
livrés au Laboratoire Vétérinaire de Kinshasa. Les
constats reflètent une baisse de la fécondité, une
persistance d'un syndrome périnatal caractérisé par des
avortements, des mort-nés et une mortalité élevée
des veaux dont les foies présentaient des foyers de nécrose
à l'autopsie et cela, malgré un programme de vaccination continue
contre la Brucellose et ce depuis plusieurs années. Ce syndrome
associé aux facteurs climatique et végétal a fait penser
à la fièvre de la vallée du Rift ; ce constat a fait
initié une séro-surveillance, dans un premier temps, avec comme
objectif la connaissance et la détection des anticorps de la maladie
suspectée et l'évaluation de la prévalence.
Lepremier lot de 151
prélèvements sanguins a été réalisé
sur les deux races de bovins de différents âges ayant
présenté des avortements visibles ou non et/ou
réputés stériles au centre de la zone où l'impact
de la maladie, conformément au syndrome, se faisait plus sentir par
rapport aux deux autres sites (Nord et Sud). Le sang était
collecté dans des tubes vacutainer avec anticoagulant
(Acide Ethylène
Diamine Tétra-acétique ou
EDTA) et conservé au froid dans une glacière
à 4°C. Le sérum fut décanté trois jours
après puis aliquotés dans les cryotubes et conservés
à moins 20°C. Vu le caractère pressant et la
nécessité de poser un diagnostic rapide, ce premier lot fut
envoyé au laboratoire régional de référence
"Onderstepoort Veterinary
Institute OVI" d'Afrique du Sud.
Ledeuxième lot de 200
prélèvements était réalisé six mois
après dans le même site, 40 échantillons au Nord ainsi que
quelques tissus, arrière-faix de vaches et organes des veaux.
Les anticorps IgG et IgM
caractéristiques de l'infection, étaient ensuite
détectés afin de conclure sur la présence ou non de la
maladie.
Le bilan nécrosique (diagnostic
posé sur base de l'altération tissulaire) a permis
d'apprécier les lésions macroscopiques et microscopiques, pouvant
confirmer ou infirmer la maladie.
Tous les sérums ont été testés
pour la détection des anticorps IgG et IgM anti-RVFV et pour ce deux
anticorps, différents kits ont été utilisés,
à savoir :
§ le kit ELISA RVF visant les IgG chez les bovins, fourni
par BDSL au Royaume Uni et,
§ le kit ELISA indirect pour les IgG et IgM chez les
ruminants fourni par OVI en Afrique du Sud.
II.2.1 EQUIPEMENTS ET
REACTIFS
Tableau II.1 : Equipements et réactifs pour
Microplaques Elisa.
|
Microplaques Elisa
|
Embouts pour micropipette
|
|
Substrat ABTS (acide sulfonique 2,2'
-azinodiethylbenzothiazoline)
|
Eau distillée
|
|
Solution d'arrêt (Electran)
|
Couvercles pour microplaques
|
|
Lait en poudre écrémé
|
Incubateur -agitateur
|
|
Tween 20
|
Microplaques
|
|
Poudre de PBS
|
Sérum de la souris anti-VFVR
|
|
Tampon de lavage
|
Ag de VFVR
|
|
Tampon de dilution
|
Ag de contrôle (C++, C+ et C-)
|
|
Tampon de blocage
|
Sérum à tester
|
|
Solution d'arrêt :Sulfate de Sodium Dodecyl
|
Sérums de contrôles
|
|
Lecteur de microplaques ELISA
|
Conjugués (HRPO, )
|
|
Centrifugeuse
|
Souche rNVFVR
|
|
Tubes de centrifugeuse et microtubes
|
pH mètre
|
|
Vortex
|
Tampon de carbonate-bicarbonate
|
|
Dispositif de nettoyage des microplaques
|
Sérum de chèvre anti-humain
|
|
Micropipette de précision
|
Antisérum lapin, Antisérum mouton
|
II.2.2 TESTS
II.2.2.1 RVFELISA Kits,
CATTLE IgG (Kit ELISA IgG bovine - BDSL)
Procédure
Le volume utilisé est de 100 ul/puits, et tous les
lavages sont effectués 3 fois en utilisant 300 ul de tampon de lavage
par puits.
1. Couvrir les plaques avec 100 ul sérum anti-VFVR de
la souris dilué 1:2000 dans
PBS(Phosphate Buffered
Saline) et incuber les plaques couvertes à 4°C
durant une nuit. Laver les plaques à l'eau distillée.
2. Ajouter 200 ul/puits du tampon de blocage et incuber
pendant 1 heure dans une chambre humide à 37°C. Laver les plaques
à l'eau distillée.
3. Ajouter 100 ul de l'Ag de VFVR et Ag de contrôle
dilué 1 :400 dans un tampon de dilution aux lignes A-D 1-12 et aux
lignes E-H 1-12, respectivement et incuber pendant 1 heure dans une chambre
humide à 37°C. Laver les plaques.
4. Ajouter 100 ul du sérum de test et de contrôle
dilués 1 :400 dans un tampon de dilution dans des puits et incuber
pendant 1 heure dans une chambre humide à 37°C. laver les plaques.
Ajouter 100 ul/puits de conjugué anti-bovine IgG
HRPO(Ezyme Horseradish
Peroxydase) dilué 1 :1000 dans un
tampon de dilution et incuber pendant 1 heure dans une chambre humide à
37°C. Laver les plaques à l'eau distillée 6 fois.
5. Ajouter 100 ul d'ABTS/puits. Laisser les plaques pendant 30
minutes à la température ambiante (22-25°C) dans le sombre,
ajouter 100 ul de solution d'arrêt 1x concentré SDS et lire la
densité optique à 405 nm.
Le pourcentage positif (PP) du C+, du C- et du sérum
à tester a été calculé par la formule ci-dessous et
l'interprétation des résultats suivant le tableau II.2.
PP=  
Tableau II.2 : Interprétation des résultats
des tests.
|
Valeur PP
|
Résultat
|
Interprétation
|
|
< 4.0
|
Négatif
|
Pas d'anticorps détectés
|
|
4.0 - 8.0
|
Suspect
|
Tester l'animal de nouveau, de préférence 10
à14 jours après le premier prélèvement
|
|
>8.0
|
Positif
|
Indique la présence des anticorps
|
Ce protocole d'interprétation offre un niveau de
confiance de 99% de tous les résultats de tests en dehors du groupe
suspect.
Pour les bovins, la valeur comprise entre 4.0 - 10.0 doit
être considéré suspect et la valeur supérieure
à 10 est un cas positif.
II.2.2.2 - Kit ELISA
indirect IgM, IgG ruminants - OVI
Procédure
La concentration optimale des réactifs et des
dilutions, la sélection des plaques immunisées et le protocole
des paramètres des IgG et IgMI-ELISA est déterminées par
le biais de procédures standards de titrage en damier (CROWTHER,
1995).
1. Les plaques immunisées (Maxisorb, Nunc, Denmark)
sont couvertes avec la souche rNVFVR dilué 1:500 pour les IgM et 1:2000
pour les IgG I-ELISA dans un tampon de carbonate-bicarbonate de pH=9.6 et
incuber pendant une nuit à 4°C. Laver 3 fois avec le tampon de
lavage composé de PBS à pH7.2 et entre 0.1 - 20%.
2. Les plaques sont bloquées avec 200 ul du lait en
poudre sans matières grasses de 10% (`Elite', Clover SA, Pty, Ltd.) dans
le PBS et incuber dans une chambre humide pendant 1 heure à
37°C , les laver comme indiqué ci-haut.
3. Les sérums de test et de contrôle sont
dilués 1:400 dans PBS contenant 2% de poudre de lait (tampon de
dilution) et 100 ul sont ajoutés sur les plaques. Chaque sérum de
test est testé deux fois et les sérums de contrôle et du
conjugué sont testés quatre fois. Après l'incubation dans
une chambre humide durant 1 heure à 37°C, les plaques sont
lavées 3 fois avec le tampon de lavage.
4. Ajouter 100 ul de HRPOdes conjugués anti-species IgM
et IgG respectivement dans :
§ chèvre anti-humaine u-chain des IgM
(ICN pharmaceuticals) dilués 1:500,
§ chèvre anti-humaine IgG (H+L
chain) (Zymed Laboratories, Inc.) dilués 1 :5000,
§ antisérum lapin dans u chain des IgM
mouton (ICN Pharmaceuticals, Inc.) dilué 1 :500, et
§ IgG lapin anti- mouton (H+L) (Zymed
Laboratories, Inc.) dilué 1 :3000.
Les plaques sont incubées durant 1 heure à
37°C, puis lavées 3 fois.
5. 100 ul du substrat d'Acide
Sulfonique
2,2'-azinodiethylbenzothiazoline (ABTS) est
ajouté dans chaque cupule. Les plaques sont ainsi incubées
à l'obscurité à la température ambiante pour 30
minutes maximum.
6. Les réactions sont stoppées par l'addition de
100 ul de 1% de sulfate de sodium dodecyl (SDS) et la densité optique
(OD) est lire à 405 nm.
Les résultats sont exprimés par le pourcentage
du sérum de contrôle High - positive (PP) en utilisant la
formule :
[(OD moyenne du sérum de test dupliqué/ OD
moyenne du contrôle positif)] x 100.
CHAPITRE III.
RESULTATS ET INTERPRETATION
III.1 RESULTATS
Les résultats des investigations sont
présentés en deux points qui traitent respectivement de la
nécropsie et de la prévalence de la maladie ainsi que de son
caractère original.
III.1.1 Lésion
macroscopique
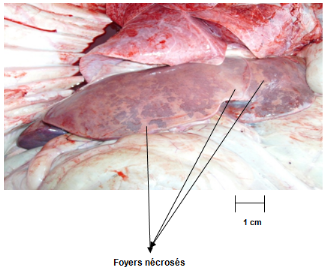
Fig. III.1: Foie d'un foetus de Bovin avorté montrant
des larges foyers nécrosés.
(Observation macroscopique au cours de la recherche)
Les examens post mortem, réalisés sur
les carcasses suspectes ainsi que sur les avortons, ont permis de
déceler les lésions de nécrose hépatiqueet les
foyers congestivo - hémorragiques, éléments majeurs du
tableau lésionnel de la Fièvre de la Vallée du Rift chez
les ruminants (Fig. III.1).
III.1.2 Statut
sérologique des animaux testés pour l'infection au VFVR
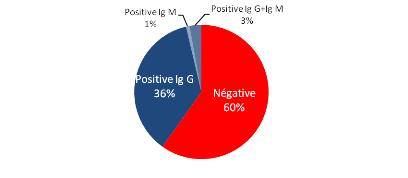 Fig. III.2 : Prévalence apparente globale de l'infection
dans la zone étudiéeKit IgG et IgM fourni (OVI). Fig. III.2 : Prévalence apparente globale de l'infection
dans la zone étudiéeKit IgG et IgM fourni (OVI).
Pourcentage
251662848Les résultats de la figure III.2sur le statut
sérologique de l'échantillonnage, résultats
interprétés selon le tableau III.1 en
annexe,révèlent que 40% de sang des animaux examinés ont
répondu aux anticorps IgG et IgM. Il s'agit d'une réponse de
l'organisme face à une infection vieille et récente au VFVR.
Espèces
251652608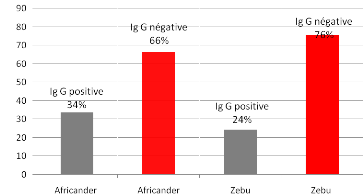
Fig. III.3 : Résultat sérologique Kit ELISA
IgG bovin (BDSL) selon la race : le zébu semble être moins
susceptible par rapport à l'Africander.
Les résultats obtenus avec le kit ELISA indirect IgG
bovin consignés dans la figure III.3 et comparés aux
données du Tableau III.2 en annexemontrent
que :
§ le BDSL met en évidence l'allure de l'infection
dans le cheptel au fil du temps ;
§ l'ancienneté de celle-ci traduite par la
présence des IgG dans le troupeau et
§ le taux d'infection par rapport au nombre testé
dans chaque catégorie (par rapport aux races exploitées)se
manifeste comme suit : 34 % des Africander et 24% des Zébu.
Espèces
251650560
Pourcentage
251651584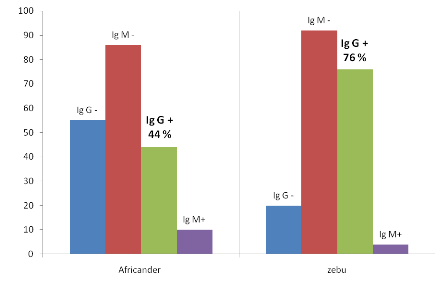
Fig. III.4 : Résultat sérologique Kit ELISA
IgG et IgM (OVI) par race le Zébu semble
très susceptible.
Les résultats obtenus avec le kit ELISA indirect
ruminants IgG et IgM représentés dans la figure III.4 et
comparés avec les données du tableau III.3 en annexemontrent
que la race Zébu est plus susceptible avec 76 % des sujets
infectés contre 44 % chez les Africander.
Age / an
251644416251649536251648512251647488251646464Nombre
total testée
251645440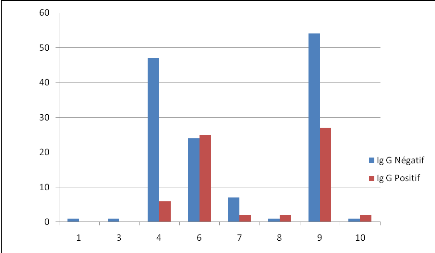
Fig. III.5 : Résultat sérologique Kit ELISA
IgG bovin fourni par BDSL.
(Voir tableau III.4en annexe).
Nombre total testée
251654656
Sujets infectés
251661824251658752251660800251655680251656704251659776251657728Age
/ an
251653632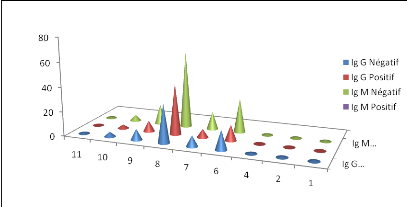
Fig. III.6 : Résultat sérologique Kit ELISA
IgG et IgM (OVI) par âge.
Les résultats sérologiquesobtenus avec le Kit
ELISA IgG et IgM (OVI) par âge, représentés dans la figure
III.6 et comparés aux données du tableau III.5 en annexe montrent
que les sujets entre 5 et 9 ans semblent être les plus
exposés.
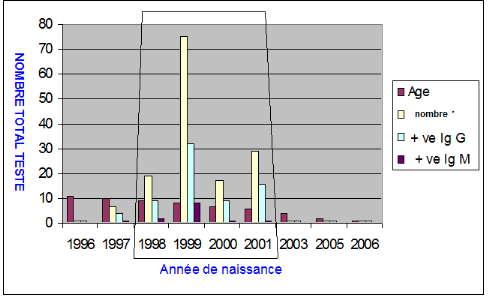
Fig. III.7 : Fréquence par âge
regroupé.
Les sujets entre 5-8 ans semblent être les plus
exposés.
Une autre donnée intéressante qui ressort de
cette étude est quepar rapport à la tranche d'âge,
l'infection touche plus les sujets dont l'âge varie entre 4 et 10 ans
semblent être les plus exposés (Fig.III.5, III.6 et III.7).
DISCUSSION ET CONCLUSION
Les lésions hépatiques ressorties dans la figure
III.1 : foyers nécrotiques blanchâtres avec plaques de
congestions hémorragiques irréguliers et la coloration brun-
jaunâtre sont caractéristiques de cette maladie
http://www.oie.int/fr/maladies/fiches/f_a080.htm).
C'est la raison pour laquelle cette maladie est parfois désignée
sous le nom d'Hépatite enzootique (IEMVT-CIRAD, 1990).
De l'analyse de la figure III.2, qui est la situation
immunologique générale de l'échantillon
étudié, il se dégage une importante observation, en
l'occurrence un pourcentage élevé de positifs : 40 %. Ce
degré de positivité dénote une haute prévalence,
point de départ des études plus fouillées sur la zone
enquêtée, surtout par rapport à l'implication des humains,
chez qui les IgM ont aussi détectés.
Ainsi, la détection des IgM en même temps qu'elle
renseigne sur une infection active même récente, elle permet aussi
de comprendre qu'il pourrait s'agir d'une réinfection,
c'est-à-dire que quelque part dans cette zone enquêtée il
existerait une source active qui ferait introduire des nouveaux virus venant
ainsi se greffer sur une infection existante ce qui crée un
phénomène de surinfection bien connu de nombreux
épidémiologistes.
Pour cette source on pourrait incriminer la présence
des vecteurs dont essentiellement les moustiques Aedes et ou
Culex, ainsi que le réservoir que pourrait être la faune
sauvage, ce qui pourrait faire penser à un cycle selvatique. La
situation écologique des sites telle que décrite dans les
généralités plaide en faveur d'un tel constat. La
coexistence IgG et IgM est donc une preuve de réinfection décrite
déjà par pas mal d'auteurs surtout en ce qui concerne les zones
endémiques ; ce constat marie une situation classique
décrite telle que décrite par le groupe AFSSA (Fig. III.1).
Quant au fort degré de prévalence par rapport
aux sujets de 5 à 9 ans, il pourrait s'expliquer par le fait que dans
pas mal d'exploitations bovines, c'est à cette tranche d'âge
qu'appartiennent le gros du troupeau de reproduction, ces bêtes sont
majoritaires dans le troupeau, de même que lors des
prélèvements faits au hasard pour divers études comme
c'est notre cas. Un prélèvement des échantillons selon un
système de stratification aurait pu mieux nous renseigner à
propos. Une autre hypothèse aussi acceptable est qu'au de la de 9 ans,
on se trouve devant des cas de reforme, en d'autres mots les bêtes de
plus de 9 ans deviennent très rares, et à l'autre
extrémité les tout jeunes animaux sont peu informatifs
épidémiologique ment parlant et donc moins intéressants
lors des prélèvements. Il ne reste dans l'exploitation que ces
animaux de 5 à 9 ans comme sujets âgés, c'est-à-dire
du fait de leur âge, ils ont été exposés aux
piqûres des moustiques et donc au multi-challenge et donc trop
sollicités et donc répondant presque en permanence aux multiples
pénétrations, ce qui amplifierait leur immunité.
La prédominance d'une race par rapport à une au
regard d'un test par rapport à un autre, on peut conclure qu'il s'agit
d'une information sans valeur épidémiologique rassurante dans la
mesure où il y a eu disparité dans le nombre des sujets
testés, et qu'il y a différence des tests (tantôt IgG seul,
tantôt IgG et IgM).
S'il faut parler des kits utilisés, il y a lieu de
conclure qu'ils sont tous bons et de grande valeur, les résultats
(prévalences) qu'ils ont générés : 36 et 32 %
respectivement pour ne considérer que la détection des IgG, les
font placer cote à cote, il s'agit d'une même marge s'il faut
trancher en termes du coefficient de confidence. Nous pouvons quant à
nous prendre le risque de les recommander aux autres enquêteurs ou
diagnosticiens.
A l'issu de nos analyses réalisées au
Laboratoire Vétérinaire de Kinshasa, un fait est vrai ;
c'est que la Fièvre de la Vallée du Rift existe comme l'ont
signalé WANEPOELR.S, COETZER J.A.W en 1994 ainsi que MULUMBA et al. En
1997 à l'état endémique en République
Démocratique du Congo. La forte prévalence, 40% pour la zone
enquêtée, associée aux cas cliniques tels que des
avortements, aux lésions cliniques telles que l'hépatite
nécrosante ainsi qu'aux réalités écologiques du
coin font craindre une épidémie dormante.
Des enquêtes épidémiologiques similaires
sont à encourager dans d'autres zones critiques. Et pour l'actuelle zone
d'intérêt une surveillance active mieux structurée,
impliquant le bétail, les vecteurs, la faune sans oublier les humains
serait plus que souhaitée.
BIBLIOGRAPHIE ET
WEBOGRAPHIE
A. BIBLIOGRAPHIE
1. (AFSSA, 2008).
2. Aperçu de programme de pays 2005-2009 - AIEA- Page
20
3. CROWTHER J.R., 1995: ELISA theory and practice. In: Methods
in Molecular Biology. Humana Press, Totowa, NJ.
4. DIALLO M., LOCHOUARN L., Ba K., SALL A.A., MONOLO M.,
GIRAULT, L. et al., 2000 : First isolation of the Rift Valley Fever Virus from
Culexpoicilipes (Dipteral: Culicidae) in nature. American
Journal of Tropical Medicine and Hygiene 62, (6), 702-704.
5. DIOP G., THIOGONE Y., THONNON J., FONTENILLE D., DIALLON
M., SALL A et al., 1989 : The potential role of rodents in the enzootic cycle
of Rift Valley Fever Virus in Senegal. Microbes and infection 2, (4),
343-346.
6. EVANS A., GAKUYA F., PAWESKA J. T., ROSTAL M., AKOOLO L.,
VAN VUREN P. J., MANYIBE T., MACHARIA J.M., KSIAZEK T.G., FEIKIN D.R., BREIMAN
R. F. et KARIUKI NJENGA M.???????????
7. FONTENILLE D., TRAORE-LAMIZANA M., DIALLO M., THONNON
J., DIGOUTTE J.P. etZELLER H.G., 1998 : New vectors of Rift Valley Fever
in West Africa. Emerging Infectious Diseases 4, (2), 289-293.
8. FONTENILLE D., TRAORE-LAMIZANA M., ZELLER H., MONDO M.,
DIALLO M. et DIGOUTTE J.P., 1995 : Short report : Rift Valley
Fever in Western Africa : Isolations from Aedesmosquitoes during
an interepizootic period. American Journal of Tropical Medicine and Hygiene 52,
(5), 403-404.
9. GILLAIN J., 1953 : Zootechnie Générale,
Tome I, Ministère des colonies, Bruxelles.
10. IEMVT-CIRAD, 12/1990
12. KEVERS. G, 1950 : Contribution à
l'étude Pédo-botanique de la Compagnie Pastorale du
Haut-Lomami ; Bulletin Agricole du Congo Belge.
13. Larousse médicale, 2006
14. LOPEZ N., MULLER R., PREHAUD C. et BOULOY, M., 1995 :
The protein of Rift Valley Fever Virus can rescue Viral ribonucleoproteins and
transcrite synthetic genome like RNA molecules. Journal of Virology 69, (71,
3972-3979).
15. LUAMBA LNJ, 2008 : Entomologie médicale,
à l'usage des étudiants en Sciences fondamentales et en Sciences
de la Santé, Kinshasa, 74p.
16. Microsoft ® Encarta ® 2009 [DVD]- Microsoft
Corporation : Zébu, 2008
17. MULUMBA-MFUMU L.K., MADIKA J. M., LOMBEB., MASSILONGO
S., KATSHIAYI L., MADIDI A., TSHINGUTA C., 2007 : Rift Valley Fever
epidemiology in the Democratic Republic of Congo: a field study about a suspect
mild-infection in cattle in Northern Katanga.
18. NAU Jean-Yves, 2009 : Bulletin Epidémiologique
hebdomadaire (BEH) de l'institut de veille sanitaire (InVS) in Le Monde.
19. OMS (2007), Outbreaks of Rift Valley Fever in Kenya,
Somalia and United Republic of Tansania, December 2006- April 2007,
Relevé épidémiologique hebdomadaire, Section
d'hygiène du Secrétariat de la société des Nations
= Weekly epidemiological record, Health Section of the Secretariat of the
League of Nation 82, (2), 169-178.
20. SWANEPOEL R. et COETZER J. A.W., 1994 : Rift Valley fever
: Infectious Diseases of Livestock: with special reference to Southern Africa.
Edited by J.A.W. COETZER and al., Oxford University press, pp.688-718.
B. WEBOGRAPHIE
1.
http://agriculture.gouv.fr/guide_epizooties/monographies/f-fvr.htm
2.
http://fr.wikipedia.org/wiki/Fi%C3%A8vre_de_la_vall%C3%A9e_du_Rift
3.
http://ist.inserm.fr/basispresse/CPS/CPS2004/20fevrier200pdf
4.
http://www.fao.org/docrep/006/y4140f/y4140f04.htm#bm04.1.
5.
http://www.fao.org/docrep/006/y4140f/y4140f04.htm#bm04.4
6.
http://www.fao.org/docrep/006/y4140f/y4140f04.htm#bm04.4
7.
http://www.fao.org/docrep/006/y4140f/y4140f04.htm#bm04.5
8.http://www3.ac-nancy-metz.fr/ien-bar/IMG/Image/momes69/insolites/le-moustique-38040.jpg
9.
http://www.inspection.gc.ca/francais/sci/bio/anima/disemala/riftf.shtml
10.
http://www.john-libbey-eurotext.fr/fr/revues/bio_rech/vir/e-docs/00/03/F8/4E/article.phtml?fichier=images.htm.
11.
http://www.john-libbey-eurotext.fr/fr/revues/bio_rech/vir/e-docs/00/03/F8/4E/article.phtml
12.
http://www.oie.int/fr/maladies/fiches/f_a080.htm
13.
http://www.who.int/csr/resources/publications/standardprecautions/en/index.html
14.
http://www.who.int/mediacentre/factsheets/fs207/fr/index.html
15.
http://www3.ac-nancy-metz.fr/ien-bar/IMG/Image/momes69/insolites/le-moustique-38040.jpg
TABLE DES MATIERES
|
DEDICACE.......................................................................................
REMERCIEMENTS...............................................................................
LISTE DES ABREVIATIONS ET
SYMBOLES.................................................
LISTE DES TABLEAUX ET
FIGURES...........................................................
RESUME...........................................................................................
SUMMARY........................................................................................
INTRODUCTION
GENERALE................................................................
0.1
PROBLEMATIQUE........................................................................
0.2 HYPOTHESES DE
RECHERCHE.........................................................
0.3 BUT ET OBJECTIFS DE
L'ETUDE.........................................................
1° OBJECTIF
GLOBAL...................................................................
2° OBJECTIFS
SPECIFIQUES............................................................
0.4 CHOIX ET INTERET DU
SUJET...........................................................
0.5
METHODOLOGIE.........................................................................
1°
METHODES..............................................................................
2°
TECHNIQUES...........................................................................
0.6 DELIMITATION SPATIALE ET
TEMPORELLE........................................
0.7 SUBDIVISION DU
TRAVAIL.............................................................
CHAPITRE I. APPROCHE CONCEPTUELLE ET REVUE DE LA LITTERATURE
SUR LA FIEVRE DE LA VALLEE DU
RIFT.................................
I.1 APPROCHE CONCEPTUELLE SUR LA FIEVRE DE LQ VALLEE DE RIFT......
I.2 REVUE DE LA LITTERATURE SUR LA FIEVRE DE LA VALLEE DU RIFT..........
I.3
Etiologie.....................................................................................
I.3.1 Morphologie, structure physico-chimique et réplication du
virus...
I.3.2 Cycle
viral................................................................................
I.3.3 Pouvoir
pathogène...................................................................
I.3.4 Pouvoir antigène et
immunogène..............................................
I.3.5 Résistance aux agents physiques et
chimiques..............................
I.4
Epidémiologie.............................................................................
I.4.1 Epidémiologie
moléculaire.......................................................
I.4.2 Epidémiologie
descriptive.........................................................
I.4.3 Epidémiologie
analytique..........................................................
I.4.3.1 Modes de
transmission............................................................
a. Transmission
vectorielle.......................................................
b. Transmission directe (aux humains
essentiellement)...............
c.
Vecteurs...........................................................................
d.
Réservoirs...........................................................................
I.4.3.2 Répartition
géographique.......................................................
I.5 Manifestations
cliniques...............................................................
I.5.1 Chez les
Ovins..........................................................................
I.5.2 Chez les
Caprins.......................................................................
I.5.3 Chez les
Bovins.........................................................................
I.5.4 Chez les
Dromadaires...............................................................
I.5.5 Chez les
Rongeurs......................................................................
I.5.6 Chez
l'Homme........................................................................
I.6
Lésions.......................................................................................
I.7
Diagnostic...................................................................................
I.7.1 Diagnostic de
terrain..................................................................
I.7.2 Diagnostic
différentiel...............................................................
I.7.3 Diagnostic de
laboratoire..........................................................
I.7.3.1
Histopathologie......................................................................
I.7.3.2 Isolement du
virus..................................................................
I.7.3.3 Détection des
antigènes.........................................................
I.7.3.4 Détection des
anticorps..........................................................
I.7.3.5 Détection du matériel génétique
viral.....................................
I.8Traitement..................................................................................
I.8.1 Traitement
curatif......................................................................
I.8.2 Traitement
prophylactique........................................................
a. Prophylaxie
sanitaire...............................................................
b. Prophylaxie
médicale............................................................
I.8.3 chez
l'homme..........................................................................
CHAPITRE II. MILIEU, MATERIELS ET
METHODES.......................................
II.1
MILIEU.........................................................................................
II.2 MATERIELS ET
METHODES...............................................................
II.2.1 EQUIPEMENTS ET
REACTIFS..........................................................
II.2.2
TESTS.......................................................................................
II.2.2.1 RVFELISA Kits, CATTLE IgG (Kit ELISA IgG bovine -
BDSL).............
II.2.2.2 - Kit ELISA indirect IgM, IgG ruminants -
OVI...........................
CHAPITRE III. RESULTATS ET
INTERPRETATION.........................................
III.1
RESULTATS..................................................................................
III.1.1 Lésion
macroscopique.............................................................
III.1.2 Statut sérologique des animaux testés
par l'infection au VFVR....
DISCUSSION ET CONCLUSION
GENERALE............................................
BIBLIOGRAPHIE ET
WEBOGRAPHIE......................................................
ANNEXE : TABLEAUX DES DONNEES
|
i
ii
iv
v
vi
vii
1
1
5
6
6
6
6
7
8
8
9
9
10
10
15
16
17
18
21
23
24
25
25
26
27
27
27
28
29
30
31
32
33
34
34
35
35
36
39
40
40
41
42
43
43
44
44
44
45
45
45
45
45
45
47
47
50
52
52
52
54
56
56
56
57
62
66
|
ANNEXE : TABLEAUX DES DONNEES
Tableau III.1 : Prévalence apparente globale de
l'infection dans la
zone étudiée. Kit IgG et
IgM fourni par OVI (40%).
|
|
|
Négatif
|
Positif
|
|
|
Année de naissance
|
Age/an
|
Nombre
|
|
IgG
|
IgM
|
IgG + IgM
|
+ ve / âge
|
|
1996
|
11
|
1
|
1
|
0
|
0
|
0
|
0
|
|
1997
|
10
|
10
|
5
|
4
|
0
|
1
|
5
|
|
1998
|
9
|
100
|
63
|
35
|
1
|
1
|
37
|
|
1999
|
8
|
78
|
33
|
37
|
1
|
7
|
45
|
|
2000
|
7
|
26
|
16
|
9
|
1
|
0
|
10
|
|
2001
|
6
|
78
|
40
|
37
|
0
|
1
|
38
|
|
2003
|
4
|
54
|
48
|
6
|
0
|
0
|
6
|
|
2004
|
3
|
1
|
1
|
0
|
0
|
0
|
0
|
|
2005
|
2
|
1
|
1
|
0
|
0
|
0
|
0
|
|
2006
|
1
|
2
|
2
|
0
|
0
|
0
|
0
|
|
Total
|
|
351
|
210
|
128
(36%)
|
3
(0,85%)
|
10
(2,8%)
|
141
|
|
|
|
|
141 / 351 = 40 %
|
|
Tableau III.2 : Résultat sérologique Kit
ELISA IgG bovine (BDSL)
selon la race. Le Zébu semble
être moins susceptible par rapport à
l'Africander.
|
|
|
|
|
|
Race
|
Nombre
|
IgG Négative
|
IgG Positive
|
% + ve
|
|
Africander
|
163
|
108
|
55
|
34%
|
|
Zébu
|
37
|
28
|
9
|
24%
|
|
Total
|
200
|
136
|
64
|
32%
|
Tableau III.3 - Résultat sérologique Kit ELISA
IgG et IgM (OVI)
par race. Le Zébu semble très
susceptible.
|
|
Négatif
|
Positif
|
|
|
Espèce
|
Nombre
|
IgG
|
IgM
|
IgG
|
IgM
|
% +ve
|
|
Africander
|
126
|
69
|
108
|
55
|
12
|
55 (44%)
|
|
Zébu
|
25
|
5
|
23
|
19
|
1
|
19 (76%)
|
|
Total
|
151
|
74
|
131
|
74
|
13
|
74
|
Tableau III.4 - Résultat sérologique Kit ELISA
IgG bovine fourni par BDSL.
|
|
|
|
|
|
|
Année de naissance
|
Age/an
|
Nombre
|
IgG Négatif
|
IgG Positif
|
+ ve/ âge
|
|
1997
|
10
|
3
|
1
|
2
|
2
|
|
1998
|
9
|
81
|
54
|
27
|
27
|
|
1999
|
8
|
3
|
1
|
2
|
2
|
|
2000
|
7
|
9
|
7
|
2
|
2
|
|
2001
|
6
|
49
|
24
|
25
|
25
|
|
2003
|
4
|
53
|
47
|
6
|
6
|
|
2004
|
3
|
1
|
1
|
0
|
0
|
|
2006
|
1
|
1
|
1
|
0
|
0
|
|
Total
|
|
200
|
136
|
64
|
64
|
|
Prévalence
|
Apparente
|
|
64 / 200
|
|
32 %
|
Tableau III.5 : Résultat sérologique Kit
ELISA IgG et IgM (OVI) par
âge sujets entre 5 et 9 ans semblent
être les plus exposés.
|
|
|
Négatif
|
Positif
|
|
|
Année de naissance
|
Age/an
|
Nombre
|
IgG
|
IgM
|
IgG
|
IgM
|
% +if
|
|
1996
|
11
|
1
|
1
|
1
|
0
|
0
|
0
|
|
1997
|
10
|
7
|
4
|
5
|
3
|
1
|
3
|
|
1998
|
9
|
19
|
9
|
16
|
9
|
2
|
9
|
|
1999
|
8
|
75
|
32
|
63
|
42
|
8
|
42
|
|
2000
|
7
|
17
|
9
|
15
|
7
|
1
|
7
|
|
2001
|
6
|
29
|
16
|
28
|
13
|
1
|
13
|
|
2003
|
4
|
1
|
1
|
1
|
0
|
0
|
0
|
|
2005
|
2
|
1
|
1
|
1
|
0
|
0
|
0
|
|
2006
|
1
|
1
|
1
|
1
|
0
|
0
|
0
|
|
Total
|
|
151
|
74
|
131
|
74
|
13
|
74
|

| 


