Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
|
N° d'ordre: 031-2011/FDCA/FAST/UAC
REPUBLIQUE DU BENIN
****
UNIVERSITE D'ABOMEY-CALAVI (UAC)
|
|
i
****
FACULTE DES SCIENCES ET TECHNIQUES (FAST)
****
FORMATION DOCTORALE CHIMIE ET APPLICATIONS
****
MÉMOIRE
Pour l'obtention du Diplôme d'Etudes
Approfondies (DEA)
****
OPTION : CHIMIE MINERALE
THEME :

EVALUATION DE LA CHAINE TROPHIQUE D'UNE AIRE MARINE
PROTEGEE EN RELATION AVEC SA PHYSICO-CHIMIE : CAS DE GBEZOUME DANS LA COMMUNE
DE OUIDAH
Présenté et soutenu par :
Achille Comlan DEDJIHO
Le 30 Mai 2011
Maîtres de mémoire
Prof. Dr. Ir. Emile Didier FIOGBE Maître de
conférences (FAST/ UAC) &
Dr. Daouda MAMA Maître Assistant (FAST/
UAC)
Jury
Président : Prof. Dominique SOHOUNHLOUE Membres :
Prof. Dr. Ir. Emile Didier FIOGBE Dr. Daouda MAMA
Dr. Etienne SAGBO
II
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
Dédicace
Je bénis l'Eternel Dieu qui a inspiré mon
père DEDJIHO Gilbert et ma mère AGBOMASSI Christine à
m'envoyer à l'école.
III
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas de
Gbèzoumè dans la commune de Ouidah.
Remerciements
Mes remerciements vont tout droit à l'endroit du
Ministère de l'Enseignement Supérieur et de la Recherche
Scientifique (MESRS), pour avoir eu confiance en moi en m'accordant la bourse
pour mes études du Diplôme d'Etudes Approfondies (DEA).
Qu'il me soit permis, Professeur Dominique SOHOUNHLOUE,
responsable pédagogique de la formation doctorale CHIMIE ET APPLICATIONS
de la Faculté des Sciences et Techniques (FAST), de vous exprimer ma
profonde gratitude pour m'avoir accepté dans votre école
doctorale, pour votre disponibilité et pour vos grands efforts dont vous
faites preuve pour la promotion de la chimie au Bénin.
Il m'est agréable de vous exprimer ma profonde
reconnaissance, Prof. Dr. Ir. Emile Didier FIOGBE, Maître de
conférences des universités, hydrobiologiste, responsable du
laboratoire : Unité de Recherche sur les Zones Humides (URZH)/ FAST/UAC,
pour vos compétences avérées, vos qualités
scientifiques et humaines que vous m'avez inculquées tout au long de ce
travail.
Qu'il me soit permis, Docteur Daouda MAMA,
Maître-assistant des universités, hydrochimiste à la FAST
/UAC, de vous exprimer ma profonde gratitude pour votre rigueur scientifique,
votre sens de dialogue, vos conseils de chercheur et d'homme de terrain, qui
m'ont permis la réalisation de ce mémoire.
Permettez-moi, Docteur Etienne SAGBO, Directeur du
Laboratoire de Chimie Inorganique et de l'Environnement (LACIE), de vous
exprimer ma profonde reconnaissance pour votre contribution personnelle et vos
conseils de chercheur dans la réalisation de ce mémoire.
Je dois exprimer ma profonde reconnaissance au Professeur
Moussa BOUKARI et au Professeur Abel AFOUDA, pour leur immense contribution
à la promotion du Laboratoire d'Hydrologie Appliquée
(LHA).
Que tout le personnel enseignant de la formation doctorale
CHIMIE ET APPLICATIONS et tous les enseignants de la FAST acceptent mes
sincères remerciements.
Tous mes remerciements aux honorables membres de jury,
pour avoir bien voulu juger ce travail scientifique en vue de son
amélioration.
iv
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas de
Gbèzoumè dans la commune de Ouidah.
Je n'oublie pas de manière particulière, le
Docteur Alphonse da SILVA, enseignant à l'Ecole Nationale
d'Administration et de Magistrature pour ses encouragements.
Qu'il me soit permis, Révérend Père
Nestor ZOCLI, curé de la paroisse Saint Pierre-Claver de
Houéyogbé, de vous témoigner mes sincères
reconnaissances pour vos prières et vos soutiens.
Permettez-moi, Dr. Youssouf ABOU, Dr. Nicaise YALO, Dr.
Abdoulkarim ALASSANE et monsieur Flavien DOVONOU, de vous exprimer ma profonde
gratitude pour votre franche collaboration et vos conseils lors de la
réalisation de ce mémoire.
Même s'il m'arrive de ne plus m'en souvenir, cette
oeuvre témoignera toujours de vos efforts et sacrifices durant le temps
que nous avons passé ensemble. Je voudrais citer messieurs Odilon
CHANGOTADE, Dine NOUROU, Clément ADJAHOUINOU, Honoré HOUEMENOU,
Nestor HOUNDETE et mademoiselle Prucelle ZOHOU pour tout ce qu'ils m'ont
fait.
Un sentiment de joie s'empare de moi chaque fois que vous
me réconfortez et m'encouragez. Je voudrais citer mes frères et
soeurs Isaac, Léa, Sandrine, Camille, Rosette DEDJIHO et Diane TEKPO,
sans oublier mes camarades d'amphi : Marielle AGBAHOUNGBATA, Wilfried KANGBODE,
Arthur CAKPO, Ferdinand GOUDJO, Jacques KINLEHOUME.
Que Messieurs Waris CHOUTI, Fernand ALOU,
Gédéon SAMBIENOU, Lyde TOMETIN, Armel LAÏBI, Sidoine BONOU,
Raymond NATO WEZE et Célestin TCHEKESSI soient ici remerciés pour
leurs conseils, la documentation et la totale disponibilité dont ils ont
fait preuve à mon égard lors de la rédaction de ce
mémoire.
Monsieur Fernand ATCHESSI, c'est une immense joie pour moi
chaque fois que je me souviens de ce que vous m'avez fait.
J'adresse mes sincères remerciements à tous
les enseignants qui m'ont édifié depuis le cours primaire
à AHOULOUME, jusqu'aux collèges d'enseignement
général de BOPA et de HOUEYOGBE.
A tous ceux qui ont porté mains fortes, d'une
manière ou d'une autre à ma formation et à ce travail, je
vous présente ma profonde et sincère gratitude.
v
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
Sommaire
Dédicace ii
Remerciements iii
Liste des figures vii
Liste des tableaux viii
Liste des abréviations ix
Résumé xi
Objectif général 3
Objectifs spécifiques 3
1. Synthèse bibliographique 5
1.1. Chaîne trophique : Définition 5
1.2. Présentation des différents niveaux de la
chaîne trophique. 6
1.2.1. Les producteurs 6
1.2.2. Les consommateurs 6
1.2.3. Les décomposeurs 10
1.3. Le réseau trophique 10
1.4. Le phénomène d'eutrophisation 11
1.5. L'origine de l'eutrophisation 12
1.6. Les degrés de trophie 12
1.7. Les conséquences de l'eutrophisation sur la
chaîne trophique 15
1.8. Facteurs de contrôle de l'eutrophisation 15
1.8.1. Les nutriments 15
1.8.2. Matière organique 17
1.8.3. Climat et hydrologie 17
1.8.4. Géologie et topographie du bassin versant 18
1.8.5. Facteurs humains 18
1.9. Place de la physico-chimie dans la chaîne trophique
et l'eutrophisation 18
1.10. Conclusion 19
2. Matériel et méthodes 22
2.1. Milieu d'études 22
2.1.1. Situation géographique 22
2.1.2. Présentation des points d'échantillonnage
23
2.2. Laboratoires de recherche 25
2.3. Méthodologie 25
vi
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
2.3.1. Périodicité d'échantillonnage 25
2.3.2. Liste du matériel 26
2.3.3. Paramètres physico-chimiques 26
3.3.4. Abondance du zooplancton et du phytoplancton 30
2.3.5. Mesure des tailles et poids des poissons 34
3. Résultats et discussions 37
3.1. Résultats 37
3.1.1. Conditions écologiques 37
3.1.2. Paramètres chimiques 39
3.1.3. Les états trophiques 42
3.1.4. Abondances du phytoplancton et du zooplancton 45
3.1.5. Relation taille-poids des poissons 47
3.2. Discussions 50
3.2.1. Conditions écologiques 50
3.2.2. Paramètres chimiques 51
3.2.3. L'état trophique du plan d'eau 51
3.2.4. Analyse des matrices de corrélation entre les
différents paramètres physico-chimiques 52
3.2.5. Relation taille-poids des poissons 52
Conclusion générale et perspectives 53
Références bibliographiques 56
Annexes 61
vii
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
Liste des figures
Figure 1: Schéma simplifié du fonctionnement
d'un écosystème lacustre 5
Figure 2:Zonation spatiale d'un lac profond 7
Figure 3: Schéma représentant le rôle des
épandages pour l'eutrophisation 12
Figure 4: Schématisation des 4 étapes de
manifestation de l'eutrophisation 14
Figure 5: Cycle simplifié des éléments
nutritifs 19
Figure 6: Cycle des éléments nutritifs, lors
d'apports en excès 19
Figure 7: Présentation de la commune de Ouidah 22
Figure 8a et 8b: Quelques vues partielles de la lagune
côtière de Gbèzoumè. 23
Figure 9: Présentation des différents points
d'échantillonnage. 24
Figure 10: Un chromatographe ionique 28
Figure 11 : Cellule de comptage du zooplancton 31
Figure 12: Cellule de comptage du zooplancton montée
à la loupe 31
Figure 13: Cellule de numération 32
Figure 14: Image d'un quadrillage 32
Figure 15: Un ichtyomètre 34
Figure 16: Image d'un poisson et les différentes
longueurs mesurées 35
Figure 17: Variation de la température à chaque
point d'échantillonnage 37
Figure 18: Variation de la teneur en oxygène dissous
à chaque point d'échantillonnage 38
Figure 19: Evolution de la salinité à chaque
point d'échantillonnage 38
Figure 20: Evolution du potentiel hydrogène à
chaque point d'échantillonnage 39
Figure 21: Evolution de la teneur en nitrites à chaque
point d'échantillonnage 39
Figure 22: Evolution de la teneur en nitrates à chaque
point d'échantillonnage 40
Figure 23: Evolution de la teneur en ammonium à chaque
point d'échantillonnage 40
Figure 24: Evolution de la teneur en phosphates à
chaque point d'échantillonnage 41
Figure 25: Evolution de la demande biochimique en
oxygène à chaque point d'échantillonnage. 41
Figure 26: Evolution de la teneur en chlorophylle a à
chaque point d'échantillonnage 42
Figure 27: Abondance du phytoplancton 46
Figure 28: Abondance des principaux ordres de zooplancton
46
Figure 29: Variation de l'abondance du phytoplancton en
fonction de celle du zooplancton 47
viii
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
Liste des tableaux
Tableau 1: Valeurs des seuils de l'état trophique des
plans d'eau. 13
Tableau 2:Grille de diagnostic du phytoplancton 15
Tableau 3: Grille de lecture de la colonne d'eau 15
Tableau 4: Coordonnées des points
d'échantillonnage 25
Tableau 5: Etat trophique du point d'échantillonnage E1
42
Tableau 6: Etat trophique du point d'échantillonnage E2
43
Tableau 7: Etat trophique du point d'échantillonnage E3
43
Tableau 8: Etat trophique du point d'échantillonnage E4
43
Tableau 9: Etat trophique du point d'échantillonnage E5
44
Tableau 10: Etat trophique du point d'échantillonnage
E6 44
Tableau 11: Etat trophique du point d'échantillonnage
E7 44
Tableau 12: Etat trophique du point d'échantillonnage
E8 45
Tableau 13: Bilan général de l'état
trophique de la lagune côtière de Gbèzoumè 45
Tableau 14: Relation taille-poids de poissons
pêchés dans le cours d'eau de Gbèzoumè. 48
ix
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
Liste des abréviations
Chl a : Chlorophylle a
Ci avec 1 = i = 3, les
différentes campagnes d'échantillonnage
CO2 : Dioxyde de Carbone
Cond: Conductivité
Coul: Couleur
DBO5: Demande Biochimique en Oxygène au bout de cinq
jours
DCO: Demande Chimique en Oxygène
Ei avec 1 = i = 8 : les
points d'échantillonnage
FAST: Faculté des Sciences et Techniques
FAU: Unité Formazine d'Atténuation
GPS: Global Positioning System
H+: Proton
Ifremer : Institut français de recherche pour
l'exploitation de la mer
KOH: Hydroxyde de potassium
LHA: Laboratoire d'Hydrologie Appliquée
Lt max: Longueur totale maximale
Lt min: Longueur totale minimale
Lt: Longueur totale
MES : Matières en suspension
mg O2/L : Milligramme de dioxygène par litre
mg/L : Milligramme par litre
MIB: Macro-invertébrés benthiques
X
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
mL: Millilitre
NH ~: Ion ammonium
NO ~: Ion nitrite
NO ~: Ion nitrate
NT: Azote total
NTU: Nephelometric turbidity unit
OCDE : Organisation de Coopération et de
Développement Économique
pH: Potentiel hydrogène
PO: Ion phosphate
Profon: Profondeur
Pt max : Poids total maximal
Pt min : Poids total minimal
PT : Phosphore Total
Pt: Poids total
PtCo : Platine Cobalte
RSL : Réseau de Suivi Lagunaire
TDS : Total Dissolved Solids (Solides Totaux Dissous)
Temp: Température
Trans: Transparence
Turb: Turbidité
UAC: Université d'Abomey-Calavi
xi
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
Résumé
Les recherches que nous venons de mener ont pour objectif
général de contribuer à la connaissance de l'état
trophique de la lagune côtière de Gbèzoumè au
Bénin, en Afrique de l'Ouest. L'eutrophisation est le
phénomène qui a été diagnostiqué. Ces
manifestations se sentent déjà avec la prolifération des
macrophytes, chez les consommateurs du second ordre (56% d'espèces de
poissons échantillonnés ont un coefficient d'allométrie
inférieur à 3) et par les plaintes des populations riveraines du
fait de la mort des espèces aquatiques.
La méthode chromatographique a été
utilisée pour la détermination des teneurs des nutriments ; la
chlorophylle a été dosée par la méthode de Lorenzen
et, les paramètres physiques tels que la température, la
salinité, l'oxygène dissous et la conductivité ont
été mesurés in situ à l'aide des appareils
multiparamètres appropriés.
Les analyses révèlent que les nutriments
responsables de l'eutrophisation tels que les ions nitrites, nitrates et
phosphates ont affiché dans la colonne d'eau, des teneurs moyennes
respectives supérieures à supérieures à 0,11, 0,52
et 0,75 mg/L. La chlorophylle a est en moyenne à 21,6mg/L.
Mots clés : état
trophique ; paramètres physico-chimiques ; eutrophisation ;
espèces aquatiques ; lagune côtière de
Gbèzoumè.
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
1
Introduction
2
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
Un écosystème lagunaire est composé d'un
biotope (aire géographique où les facteurs écologiques
gardent des valeurs à peu près constantes, qui permettent le
développement de telle ou telle espèce) et d'une biocénose
(ensemble des êtres vivants d'un biotope), d'une grande diversité
(Trinquier, 2009). Il est aussi évident que dans un étang d'eau
comme à l'extérieur, les espèces animales et
végétales, de quel ordre que se soit, ont des prédateurs
qui se nourrissent d'eux. Ainsi, il s'établie une chaîne
alimentaire ou une suite d'êtres vivants qui se nourrissent de ceux qui
les précèdent. Les espèces animales et
végétales vivant dans cet écosystème
s'intègrent alors dans cette chaîne ou réseau alimentaire
qui repose sur la production primaire laquelle est dépendante de
l'énergie lumineuse et de la quantité en sels minéraux
(Trinquier, 2009).
Les recherches menées par Camargo et al.
(2004), ont montré que l'accumulation de nutriments dans les cours
d'eau est l'un des problèmes écologiques le plus répandu
responsable de la pollution de l'eau douce à l'échelle mondiale.
Et, quand on parle d'enrichissement des cours d'eau en nutriments, on pense
directement au phénomène de l'eutrophisation. En effet,
l'eutrophisation est un phénomène qui est
caractérisé par un déséquilibre écologique
avec au départ, une fertilisation excessive en éléments
minéraux et organiques généralement d'origine anthropique.
Cet état de chose entraîne par ailleurs une forte augmentation de
la production organique de la couche superficielle et la diminution de la
teneur en oxygène gazeux dissous. On assiste alors aux
conséquences suivantes :
· diminution de la transparence de l'eau car le nombre de
matières en suspension croît ;
· la malaïgue, une crise anoxique (due à
l'absence d'oxygène gazeux dissous dans l'eau), liée à
l'eutrophisation résultant de conditions météorologiques
et environnementales particulières (Trinquier, 2009),
· la perturbation de la chaîne alimentaire et le
déséquilibre entre les organismes à cause d'un milieu
enrichi en matières nutritives.
Les conditions écologiques explicitées par les
paramètres physico-chimiques en l'occurrence, le potentiel
d'hydrogène, l'oxygène dissous, la température, les
teneurs en nitrites et nitrates interviennent donc dans le maintien de la vie
des espèces halieutiques et par la suite dans le transfère de la
matière vivante dans une chaîne alimentaire.
C'est dans le but d'appréhender l'état trophique
de la lagune côtière de Gbèzoumè et ses
conséquences sur les relations nutritionnelles et physiologiques des
espèces qu'elle abrite que le thème de notre étude
intitulé : «Evaluation de la chaîne trophique d'une aire
marine protégée en relation avec sa physico-chimie : cas de
Gbèzoumè dans la commune de
3
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas de
Gbèzoumè dans la commune de Ouidah.
Ouidah.», trouve sa justification. Pour bien
appréhender ce thème, il est alors fixé un objectif
général explicité en trois objectifs spécifiques
ci-dessous énumérés.
Objectif général :
Contribuer à la connaissance de l'état trophique
de la lagune côtière de Gbèzoumè.
Objectifs spécifiques :
V' parvenir à la connaissance de l'évolution des
valeurs des paramètres physico-chimiques de la lagune
côtière de Gbèzoumè;
V' faire l'état des lieux sur l'abondance et la
diversité du phytoplancton et du zooplancton de ce site de recherche;
V' connaître la diversité ichtyologique des
consommateurs secondaires : cas des poissons.
Activités :
~ pour atteindre l'objectif spécifique 1, nous avons :
- fait une série de trois campagnes de
prélèvement et de traitement des échantillons
d'eau de
ce plan d'eau sur une période de trois mois (octobre, novembre puis
décembre 2010);
- déterminé l'état trophique de chaque point
d'échantillonnage.
V' pour atteindre l'objectif spécifique 2,
nous avons :
- fait des prélèvements, des fixations et des
conservations des échantillons d'eau pour le
phytoplancton et le
zooplancton ;
- déterminé les abondances du phytoplancton et du
zooplancton.
V' pour atteindre l'objectif spécifique 3, nous avons
:
- photographié et identifié toutes les
espèces de poissons pêchées dans ce plan d'eau;
- mesuré le poids total et les longueurs totales,
standards, et à la fourche des poissons;
- établi la relation taille-poids de chacune des
espèces collectées ;
- analysé les valeurs des constantes indicatrices de
l'état physiologique des poissons.
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
4
Synthèse bibliographique
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
1. Synthèse bibliographique
1.1. Chaîne trophique : Définition
Dans un écosystème, le lien qui unit souvent les
êtres vivants est d'ordre alimentaire. Une chaîne trophique ou
chaîne alimentaire représente une suite d'organismes vivants, se
nourrissant les uns des autres; chacun se nourrit de l'organisme qui le
précède dans la chaîne. Le premier maillon d'une
chaîne trophique est appelé producteur. Les producteurs sont
consommés par des consommateurs primaires qui sont à leur tour
consommés par plusieurs maillons successifs de consommateurs. Afin de
boucler la chaîne et d'équilibrer l'écosystème, il
existe également des charognards et des décomposeurs qui
permettent de recycler la matière vivante. Ce lien qui existe entre les
êtres vivants et leurs conditions écologiques se résume
dans la figure 1 suivante :
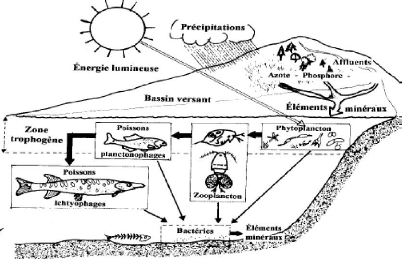
5
Figure 1: Schéma simplifié du
fonctionnement d'un écosystème lacustre (Ramade,
1981)
6
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
1.2. Présentation des différents niveaux de
la chaîne trophique.
1.2.1. Les producteurs
Les producteurs sont des organismes autotrophes ;
c'est-à-dire qu'ils produisent de la matière organique à
partir de la matière minérale et d'une source d'énergie.
Le plus souvent c'est l'énergie solaire qui est utilisée. On
parle alors d'organismes phototrophes ou photosynthétiques. Certaines
bactéries dites chimiotrophes utilisent une énergie chimique.
L'organisme producteur est le premier maillon de la chaîne alimentaire et
est primordial car c'est lui qui fait entrer de l'énergie et de la
matière dans l'écosystème (les autres maillons ne font que
les transformer).
La composition de cette composante biotique dépend d'un
grand nombre de facteurs dont les principaux sont les conditions climatiques
(température, saison, etc.), les ressources trophiques du milieu, la
topographie des fonds et la nature du sédiment (granulométrie,
teneur en matière organique, pH, etc.) selon Triffault - Bouchet
(2004).
Dans les écosystèmes terrestres, les principaux
producteurs sont les végétaux chlorophylliens. Dans les
écosystèmes aquatiques, il s'agit majoritairement des divers
organismes photosynthétiques du phytoplancton. Dans les
écosystèmes abyssaux, où la lumière solaire ne
parvient pas, les producteurs sont des archéobactéries
chimiotrophes.
1.2.2. Les consommateurs
Les consommateurs sont des organismes
hétérotrophes, c'est-à-dire qu'ils consomment de la
matière organique provenant d'un autre organisme vivant. Lorsque
l'organisme consommé est un producteur, son prédateur est
appelé consommateur primaire, également appelé phytophage
ou herbivore. Un organisme qui se nourrit d'un consommateur primaire est
appelé consommateur secondaire ou du second ordre ou bien un carnivore.
Certains animaux se nourrissent indifféremment d'organismes producteurs
ou de consommateurs, ils sont appelés omnivores. Les consommateurs sont
regroupés en deux grands groupes qui sont les vertébrés et
les invertébrés.
1.2.2.1. Les invertébrés
Avant de parler des invertébrés, nous
présentons la zonation d'un lac profond afin de nous situer dans le
développement qui suit.
7
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
On distingue sur la figure ci-dessous, une zone où
prolifèrent des végétaux (ceinture à macrophytes).
C'est la zone littorale. Ensuite, nous avons la zone centrale ou
pélagique (zone de pleine eau) et dans le fin fond se trouve la zone
benthique.
Les écosystèmes limniques désignent
l'ensemble des eaux courantes continentales, lacustres et stagnantes (Ramade,
1994). Cette terminologie est subdivisée en deux : les
écosystèmes lentiques (lacs, étangs, marécages,
gravières, etc.) et les écosystèmes lotiques
(rivières, fleuves, torrents, etc.). Les écosystèmes
lentiques sont définis comme « des étendues d'eau libre
stagnante comblant une dépression naturelle ou artificielle des
continents, n'ayant pas de contact direct avec les océans »
(Meybeck, 1995).
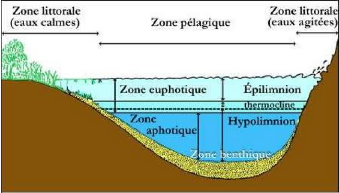
Figure 2:Zonation spatiale d'un lac profond (Guyard,
1997).
On sépare essentiellement pour des raisons pratiques,
les invertébrés des eaux douces en deux grands ensembles: les
micro-invertébrés et les macro-invertébrés. Les
micro-invertébrés dépassent rarement un millimètre
et cet ensemble comprend tous les protozoaires, certains plathelminthes, la
majorité des némathelminthes, les rotifères, les
tardigrades, les crustacés cladocères, ostracodes et
copépodes et les hydracariens. Les macro-invertébrés sont
représentés par des organismes dont la taille (en fin de
développement larvaire) est souvent supérieure à un
millimètre (Illies, 1978).
Le zooplancton joue un rôle déterminant dans les
réseaux trophiques aquatiques. En effet, source de nourriture importante
pour les poissons et les invertébrés prédateurs, il broute
lui-même intensément les algues, les bactéries, les
protozoaires... (Balvay, 1990). Plus de 60 % de la production primaire en
milieu lacustre peut ainsi être transférée aux alevins de
poissons via la seule activité herbivore des espèces
zooplanctoniques (Haberman, 1998). Le
8
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
zooplancton constitue ainsi un intermédiaire essentiel
entre les nutriments entrant dans le système et les niveaux trophiques
supérieurs.
Les bras morts de certains cours d'eaux, pendant la
période estivale, forment des zones humides peu profondes
caractérisées à la fois par cette
hétérogénéité des habitats et par une
température de l'eau pouvant être supérieure à
20°C. Celles-ci sont de plus des zones de refuges pour de nombreuses
espèces animales notamment pour les alevins de poissons (Brochets: Esox
lucius) qui y trouvent les conditions favorables à leur croissance. Les
communautés zooplanctoniques y atteignent en effet de fortes
densités (Nogrady et al., 1993 ; Dodson et Frey, 2000) et
fournissent donc une nourriture abondante aux poissons. Ces milieux jouent
ainsi un rôle primordial dans la régulation des populations des
cours d'eau. Il est important de connaître les mécanismes de
transfert d'énergie entre les différents compartiments de cet
écosystème, et les facteurs qui les contrôlent.
L'étude de ces organismes qui constituent des
communautés biologiques très diversifiées (Shiel, 1995),
est donc nécessaire à l'établissement des modèles
de fonctionnement des systèmes aquatiques, en vue notamment de la
gestion des ressources halieutiques.
On peut supposer qu'en raison de
l'hétérogénéité spatiale des conditions
(température, nourriture, lumière...) dans lesquelles se
déroulent la compétition entre les espèces qui le
composent, le zooplancton intervient différemment sur les bilans de
matière et d'énergie. L'une des premières démarches
pour tester cette hypothèse consiste à inventorier les
espèces présentes et à étudier leur dynamique
spatiale et temporelle (Arfi et Patriti, 1987).
> Les cladocères
Les cladocères sont des animaux de petites tailles dont
les longueurs s'échelonnent entre 0,2 et 3 millimètres et
atteignent exceptionnellement 15 millimètres chez une seule
espèce (Amoros, 1984). Le corps est parfois transparent, translucide ou
parfois coloré. L'ordre des cladocères se subdivise en 11
familles regroupant 65 genres et 450 espèces environ.
Les cladocères sont des petits crustacés
très fréquents dans tous types d'eaux douces à l'exception
des eaux courantes rapides où on ne les trouve que lorsqu'ils sont
entraînés par les courants à partir des zones plus calmes.
L'importance des cladocères est variable selon les
9
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
biotopes. Cette importance peut être mesurée par
le rôle qu'ils jouent dans la nutrition des poissons : elle est bien
connue dans les étangs de pisciculture en Europe (Amoros, 1973). Ils
assurent une fonction très importantes dans les transfères de
matières et d'énergie de bon nombre d'écosystèmes
d'eau douces (Pourriot et al., 1982). La qualité nutritionnelle
des algues joue un rôle important dans les traits d'histoire de vie des
cladocères (Masclaux et Schmaltz, 2006).
En suite au niveau des poissons, ils interviennent non
seulement dans l'alimentation des espèces planctophages ou omnivores
mais également dans celle des alevins et des jeunes de nombreux autres
espèces. Des invertébrés (Hydres, Copépodes,
Insectes) s'en nourrissent aussi. Il existe environ onze familles de
cladocères. Deux des ces familles, les Podonidae et les Cercopagidae,
comprennent des formes uniquement marines. Les autres sont les Leptodoridae,
les Polyphéridae, les Holopépidae, les Bosminidae, les
Chidoridae, les Daphnidae, les Sididae, les Macrothricidae , les Moinidae
etc...qui sont décrits dans (Amoros, 1984).
> Les rotifères
Si l'on en croit Meglitsch (1973), les rotifères ont
des analogies avec les femmes, « parfois belles, souvent capricieuses et
toujours fascinantes ». Ils ont une taille de 0,1 à 1
millimètre et l'apparence générale, avec la
présence de cils vibratiles vers l'avant de l'animal. On dénombre
actuellement environ 2000 espèces de rotifères,
rassemblées en trois sous-classes d'après la structure de leur
glande génitale. Nous avons : les Monogonontes, Digonontes et les
Séisoniens (Pourriot et Francez, 1986).
> Les copépodes
Le terme copépode provient du grec `kope', qui signifie
la rame, et `podos' le pied. Les copépodes sont de petits
crustacés qui se développent dans tous les milieux aquatiques.
Ils sont en nombre d'individus, les animaux les plus abondants de la
planète et représentent l'une des principales composantes du
zooplancton permanent. Les copépodes rassemblent 9 ordres totalisant
plus de 200 familles et plus de 14000 espèces. Deux des 9 ordres sont
constituées d'espèces parasites ou commensales.
Avec plusieurs milliers d'espèces connues,
principalement libres, les harpacticoides, les cyclopoides, et les calanoides
sont les groupes de copépodes les mieux représentés. Les
autres ordres étant moins représentés.
Selon les espèces, les saisons, les milieux ou encore
l'âge des individus, l'alimentation des copépodes est très
variable. Ils peuvent être herbivores, carnivores ou
10
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
omnivores. Les copépodes herbivores se nourrissent
principalement de plancton végétal (diatomées, mais aussi
dinoflagellés, chrysophycées ou cryptophycées) qu'ils
filtrent. Les copépodes carnivores, a contrario, capturent leurs proies
(larves, autres espèces de zooplancton). Les
macroinvertébrés benthiques (MIB) sont des organismes qui vivent
dans le fond d'un cours d'eau ou qui ne s'en éloignent que de peu durant
la majeure partie de leur vie. Dépourvus de colonne vertébrale,
ils sont visibles à l'oeil nu. On retrouve dans cette catégorie
les larves d'insectes aquatiques, quelques insectes aquatiques adultes, les
crustacés, les mollusques et les vers. Les principaux ordres d'insectes
aquatiques appartenant à cette catégorie d'organismes sont les
suivants : Éphémères, Plécoptères,
Trichoptères, Diptères, Coléoptères,
Mégaloptères, Hémiptères, Odonates et
Lépidoptères (Gagnon et Pedneau, 2006).
1.2.2.2. Les vertébrés
La zone littorale et la zone pélagique des
écosystèmes lentiques offrent de multiples habitats aux
vertébrés. Sont recensés ici, des batraciens, des
reptiles, des poissons herbivores et carnivores. La richesse spécifique
des peuplements piscicoles des écosystèmes lentiques des zones
tempérées est le plus souvent très faible (Juget et
al., 1995). La zone littorale des lacs offre des habitats temporaires
à un certain nombre de vertébrés terrestres.
1.2.3. Les décomposeurs
Les micro-organismes, bactéries et champignons,
constituent les composantes des décomposeurs. Deux groupes de
micro-organismes sont distingués selon leur métabolisme : les
organismes autotrophes et les organismes hétérotrophes (Servais
et al., 1995). Les premiers utilisent le CO2 dissous dans l'eau comme
principale source d'énergie, les seconds utilisent directement la
matière organique. L'abondance des micro-organismes croît avec le
degré de trophie des milieux (Servais et al., 1995). Des
variations spatiales et temporelles sont enregistrées en relation avec
la mise en place des stratifications de la colonne d'eau et les cycles de
production primaire des écosystèmes, principale source de
matière organique (Garnier et Lavandier, 1995).
1.3. Le réseau trophique
Un réseau trophique est un système de
circulation de la matière et de l'énergie constitué de
l'ensemble des chaînes alimentaires possibles d'un
écosystème donné. Il s'agit donc d'un concept plus
complexe mais plus proche de la réalité que la simple
chaîne alimentaire linéaire.
11
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
Si l'on prend par exemple la chaîne alimentaire : herbe
< mouton < loup, elle croise de nombreuses autres chaînes qui
dépendent de l'ensemble des espèces présentes dans
l'écosystème et de la diversité de leur régime
alimentaire. On aura par exemple les chaînes : pissenlit < mouton <
loup, herbe < lapin < loup, herbe < mouton < ours. Certaines
chaînes alimentaires du réseau sont plus importantes que d'autres,
exprimant ainsi des référendums alimentaires.
Le réseau trophique lagunaire repose sur la production
primaire qui est dépendante de l'énergie lumineuse et de la
quantité en sels minéraux (Trinquier, 2009). Sur la figure 1
ci-dessus, on observe que sous l'effet, de la lumière solaire et des
sels minéraux, il y a production primaire par les
végétaux. Celle-ci constitue la base alimentaire pour les
consommateurs primaires et pour les autres ordres supérieurs. Chacun de
ces organismes vivants se décompose par les bactéries et autres
agents décomposeurs, après leurs morts afin de restituer la
matière minérale utilisée au départ.
En général, plus la diversité d'un
réseau trophique est grande, plus l'écosystème sera
résistant en cas de perturbation (pollution ou disparition d'un des
maillons).Un écosystème âgé et très stable
montrera des chaînes alimentaires largement dominantes avec des
référendums qui ont parfois évolué en
spécialisations. Ce type d'écosystème (par exemple la
forêt tropicale primaire) est très vulnérable à la
disparition de certains maillons clés spécialisés qui peut
perturber irréversiblement l'ensemble du système.
1.4. Le phénomène d'eutrophisation
Le terme d'eutrophisation vient du grec. Le préfixe
« eu » ajouté à «trophe» signifie « bien
nourri ». Il a été défini par les Directives du
Conseil des Communautés Européennes du 21 mai 1991 en rapport au
traitement des eaux urbaines résiduaires et celle du 12 décembre
1991, relative à l'azote d'origine agricole : «L'enrichissement de
l'eau en éléments nutritifs, notamment des composés de
l'azote et/ou du phosphore, provoquant un développement
accéléré des algues et des végétaux
d'espèces supérieures, qui entraîne une perturbation
indésirable de l'équilibre des organismes présents dans
l'eau et une dégradation de la qualité de l'eau en question
» (91/271/CEE et 91/676/CEE) rapporté par Trinquier (2009). Ce
phénomène est devenu aujourd'hui un problème
environnemental généralisé. En effet, la
prolifération des plantes aquatiques (algues, cyanobactéries et
macrophytes) s'est amplifiée ces dernières décennies avec
l'utilisation accrue de fertilisants chimiques en agriculture et par le
développement de l'élevage intensif (Mama, 2010). La
prolifération sur toute l'année en eau douce eutrophe a
été constatée au niveau des lacs artificiels de
Yamoussoukro en Afrique
12
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
de l'Ouest (Parinet et al., 2004). Dans le lac
Nokoué, les apports massifs de nutriments liés aux multiples
activités ont provoqué l'eutrophisation,
caractérisée par la prolifération de la jacinthe d'eau
(Ogutu - Ohwayo et al., 1997).
1.5. L'origine de l'eutrophisation
L'eutrophisation est un phénomène très
lent à l'échelle géologique car il dépend de
facteurs physiques. Toutefois, l'intervention de l'homme sur les bassins
versants et au niveau des lagunes concourt à accélérer ce
processus. La pratique agricole repose sur l'utilisation d'engrais, de
pesticides et de traitements phytosanitaires. Or les engrais sont
constitués de nitrates, de potassium et d'ammonium, ainsi que de
phosphates de potassium (Lacaze, 1996). Ils apportent des
éléments de base et des oligo-éléments. Ces
épandages sont utilisés car ils permettent d'obtenir de meilleurs
rendements. En contre partie, ils sont responsables d'une pollution des sols,
des nappes phréatiques, des cours d'eau et par conséquent de la
lagune. Il faut savoir que lors des épandages, 80 à 90 % de ce
qui a été épandu est perdu et se retrouve mis en
circulation par l'intermédiaire du cycle de l'eau (Carluer et al,
1996). Les eaux de ruissellement lessivent les terres agricoles qui ont
reçu des épandages d'engrais et de traitement phytosanitaire en
trop grande quantité. Composées de matières azotées
et phosphorées, ces eaux issues du bassin-versant vont venir enrichir le
milieu aquatique (figure 3). L'utilisation de manière plus ou moins
importante d'engrais conduit donc à l'eutrophisation de la lagune.

Figure 3: Schéma représentant le rôle
des épandages pour l'eutrophisation
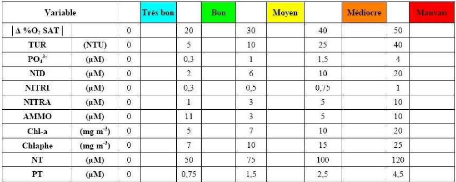
1.6. Les degrés de trophie
Ces définitions mettent en évidence que
l'eutrophisation est une évolution d'un état du milieu vers un
autre. C'est pour cela qu'il est intégré au sein d'une
échelle caractérisée par divers degrés de trophie.
Ces degrés de trophie symbolisent le niveau de richesse des
éléments qui limitent la production primaire (La Jeunesse, 2001).
On distingue quatre degrés de trophie:
- L'oligotrophie : le milieu est pauvre en matières
nutritives.
13
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
- La mésotrophie : c'est un stade intermédiaire
où la teneur en matières nutritives est moyenne. Les organismes
aquatiques sont plus nombreux.
- L'eutrophie : c'est le processus qui nous intéresse
et qui qualifie un milieu riche en matières nutritives.
- La dystrophie : elle fait suite à l'eutrophisation,
le milieu est alors excessivement enrichi en matières nutritives et les
teneurs en oxygène dissous dans l'eau sont très basses.
Le passage d'un milieu oligotrophe à eutrophe
s'accompagne de modifications. Les plans d'eau oligotrophes correspondent
à un milieu jeune où les nutriments sont peu présents; les
eaux sont claires et bien oxygénées. En comparaison, les plans
d'eau eutrophes sont caractérisés par des teneurs en nutriments
abondants, des eaux plus turbides, une prolifération de la
végétation et une domination de matières algales qui
entraînent une consommation d'oxygène (Trinquier, 2009).
Cependant, selon Galvez-Cloutier et al (2002) et
Ryding et Rast, (1994), les plans d'eau peuvent être classés en
cinq degrés de trophie. En effet,on distingue les plans d'eau
«oligotrophes» (peu nourris) et « eutrophes » (bien
nourris). Le terme «mésotrophe » est fréquemment
utilisé pour décrire l'état intermédiaire entre les
deux catégories précédentes. Le tableau 1 donne une
description des différents états trophiques d'un plan d'eau.
Cette description n'a pas une signification précise, mais elle est
couramment employée pour désigner le potentiel trophique d'un
plan d'eau. Des efforts ont été réalisés pour
définir ces termes de manière précise en fixant des seuils
numériques pour certains paramètres caractéristiques de la
qualité d'eau : la concentration en phosphore, en chlorophylle-a et la
transparence au disque de Secchi. La quantification de ces paramètres
permet d'établir la qualité d'une eau.
Tableau 1: Valeurs des seuils de l'état trophique
des plans d'eau.
|
Degré de trophie
|
P total
(ug/L)
|
Chlorophylle
a moyenne
(ug/L
|
Chlorophylle a
maximal (ug/L)
|
Transparence (m)
|
Transparence
(m)
|
|
Ultra-oligotrophe
|
< 4
|
< 1
|
< 2,5
|
>12
|
>6
|
|
Oligotrophe
|
< 10
|
< 2,5
|
2,5 à 8
|
>6
|
>3
|
|
Mésotrophe
|
10 à 45
|
2,5 à 8
|
8 à 25
|
6 à 3
|
3 à 1,5
|
|
Eutrophe
|
35 à 100
|
8 à 25
|
25 à 75
|
3 à 1,5
|
1,5 à 0,7
|
|
Hypereutrophe
|
>100
|
>25
|
>75
|
<1,5
|
<0,7
|
14
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
Source : Ryding et Rast, 1994.
Selon Ramade (1981), les principales phases de
l'eutrophisation des eaux peuvent être schématisées comme
suit : la pollution croissante, la prolifération des algues, la
décomposition anaérobie, et la dégradation extrême
du milieu avec une simplification des
espèces présentes. On remarque que la
première étape n'est pas forcément négative pour
le
milieu, car celui-ci s'enrichit au niveau de chaque maillon de la
chaîne trophique. La seconde étape, par contre, voit une grande
partie de la faune disparaître au profit d'organismes dits
inférieurs.
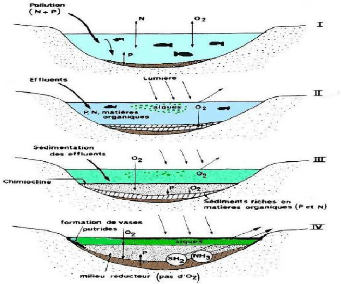
Figure 4: Schématisation des 4 étapes de
manifestation de l'eutrophisation
Trinquier, lors de ces recherches sur : «Le risque
d'eutrophisation des lagunes méditerranéennes : Le cas de la
lagune de Thau (Hérault)» en 2009 avait utilisé des grilles
de données pour détermination de l'état trophique.
Après analyse des données de ces différentes grilles, ses
résultats sont synthétisés dans une autre grille globale.
Cette planche de résultats témoigne de l'état
général de l'écosystème lagunaire par rapport
à l'eutrophisation. Cette fiche synthétique de résultats
est essentielle car elle fait office de bilan de l'état de la lagune de
Thau et elle est restituée lors d'une concertation avec les acteurs
institutionnels locaux. Elle peut être à l'origine d'une prise de
conscience et à l'initiative de mesures pour améliorer
15
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
la qualité de l'eau. Parmi ces grilles, celles qui
concernent notre étude sont présentées ci-dessous.
Tableau 2: Grille de diagnostic du phytoplancton (Source
: Ifremer, 2000).
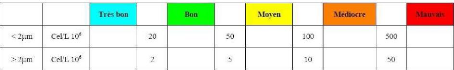
Tableau 3: Grille de lecture de la colonne d'eau (Source
: Ifremer, 2000).
1.7. Les conséquences de l'eutrophisation sur la
chaîne trophique
L'enrichissement du milieu augmente le métabolisme et
la productivité des macrophytes et du phytoplancton. Des algues
prolifèrent. L'équilibre écologique est bouleversé
en raison de la déstabilisation des chaînes alimentaires, plus
précisément l'équilibre entre producteurs et consommateurs
est rompu. Cela se traduit par l'appauvrissement de la diversité
spécifique (Dupré, 2002). Par manque de photosynthèse et
d'oxygène, les biodiversité animale et végétale
meurent (Trinquier, 2009).
1.8. Facteurs de contrôle de l'eutrophisation
1.8.1. Les nutriments
Les nutriments sont nécessaires au métabolisme
des végétaux, organismes autotrophes capables de transformer la
matière minérale en matière organique. Si la croissance
des végétaux n'est pas limitée par un autre
élément (lumière par exemple) ; ce qui n'est pas le cas au
Bénin où la température moyenne est de 25°C. Un
accroissement de la quantité de
16
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
nutriments apportée dans le milieu pourra leur
permettre de se développer davantage. Ainsi en milieu aquatique,
l'augmentation des apports de matière organique et surtout d'azote et/ou
de phosphore est souvent tenue pour responsable des phénomènes de
proliférations des plantes aquatiques. Le phosphore est souvent
considéré comme facteur limitant en eau douce (Smith et
al., 1999), cependant le rôle de l'azote ne doit pas être
sous-estimé. Les plans d'eau en zone tropicale apportent plus des
charges nutritives (Parinet, 2004).
1.8.1.1. Azote
L'azote apporté au milieu provient de trois sources
principales.
a) Rejets domestiques : l'azote est presque en totalité
sous la forme d'azote organique
(urée, acide urique, créatinine) et d'azote
ammoniacal
(N - NH ~). L'urée et les acides aminés
s'hydrolysent rapidement pour donner de l'ammonium. De ce fait, selon le temps
de séjour dans le réseau d'assainissement, l'azote organique sera
plus ou moins ammonifié. Aussi bien que l'on considère le rejet
de 13 à 15g d'azote (NTK) par habitant et par jour soit composé
pour 2/3 de formes organiques (Aminot et al., 1990), la proportion
moyenne des deux composants du NTK obtenue sur six eaux résiduaires
urbaines s'établit à 70% de NH~ ~ et 30% de N organique, les
composés oxydés (NO + NO ~) n'atteignant pas 1%.
b) Rejets industriels : selon l'activité industrielle,
les concentrations d'azote dans le rejet sont très variables. Les
industries les moins polluantes, telles que la fabrication de pâte
à papier produisent des concentrations de 5 à 20mg/L de NTK.
c) Rejets diffus issus du lessivage des sols enrichis en
engrais azotés : les apports d'azote d'origine agricole dus aux eaux de
surface varient de façon considérable d'une région
à une autre, en relation avec la pédologie, l'hydrographie, le
climat, les pratiques culturales, la nature des récoltes et la plus ou
moins bonne maîtrise des agriculteurs de l'emploi des divers engrais
(Mama, 2010).
1.8.1.2. Phosphore
On distingue deux formes principales du phosphore :
a) les phosphates (sous forme HPO~~~ ou
H2PO~ ~ dans les eaux naturelles) correspondent à la fraction de
phosphore qui se trouve sous forme minérale dissoute,
b) le phosphore total (PT) résulte de l'analyse d'eaux
non filtrées. Cette fraction rassemble le phosphore organique et
minéral, dissous et particulaire.
17
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
La majorité des apports de phosphore provient de
sources ponctuelles : rejets urbains ou industriels, déjections animales
provenant d'élevages traditionnels ou industriels. Les rejets
domestiques sont moins importants que dans le cas de l'azote : on
considère qu'un habitant produit journellement entre 3 et 4 g de
phosphore total (PT) dont une moitié provient des excréta et
l'autre de l'utilisation de produits détergents à base de
polyphosphates. Le fait que les apports diffus de cet élément par
lessivage des sols soient minoritaires s'explique par la faible
solubilité du phosphore présent dans les sols et
particulièrement des formes minérales constituées, par des
phosphates de fer et d'aluminium (Mama, 2010).
1.8.2. Matière organique
Les apports importants de matière organique peuvent
être une source de perturbation dans un écosystème
aquatique avec une consommation de l'oxygène dissous lors de la
décomposition de la matière organique. L'origine de
l'excès de ces apports peut être endogène (forte production
primaire), la désoxygénation des eaux se manifestera alors en
profondeur, où le phytoplancton sédimente et où la
lumière est insuffisante pour que la production primaire contribue
à la réoxygénation des eaux. Une augmentation importante
de la mortalité de la faune la plus sensible est alors observée
(Pouriot et Meybeck, 1995).
1.8.3. Climat et hydrologie
Le climat influence la productivité des lacs en
agissant sur l'apport annuel d'eau et d'énergie, sur l'hydrologie du
bassin versant et sur le taux de renouvellement de l'eau, ainsi que sur le
transport des nutriments et sédiments vers le plan d'eau (Moss et
al., 2005). Le climat détermine entre autres la température
de l'eau, la durée de la période de croissance
végétale, la direction et la force du vent, la
pluviométrie et la stratification thermique du plan d'eau. La
disponibilité en énergie solaire est un facteur important du
contrôle de la productivité phytoplanctonique.
Ainsi, l'augmentation de température dans les
systèmes aquatiques liée au réchauffement climatique peut
accélérer le développement des microorganismes et conduire
à une majoration de l'eutrophisation : les blooms algaux sont
observés sur des périodes de temps plus longues. Par ailleurs,
cette augmentation de la température peut induire une augmentation de
l'évaporation et conduire alors à un accroissement des
concentrations en nutriments dans les eaux, ce qui favorisera également
l'eutrophisation (Mama, 2010).
18
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
1.8.4. Géologie et topographie du bassin
versant
Le lac et son bassin versant forment une unité de base
de l'écosystème, puisque les fractions terrestres et aquatiques
du bassin hydrographique sont intimement reliées par le
déplacement de matériaux, des terres vers l'eau. La composition
chimique de l'eau d'un lac dépend donc de la composition
géologique du bassin versant, de sa dimension et de sa topographie. Le
contenu minéral des eaux douces varie considérablement en
fonction des caractéristiques climatiques et géochimiques. En
général, les roches éruptives contiennent de 0,07 à
0,13% de phosphore (sous forme d'apatite). Le pourcentage de phosphore est plus
élevé dans les roches volcaniques proprement dites mais ce sont
les roches sédimentaires qui sont les plus riches par accumulation en
phosphore (Cözar et al., 2007).
1.8.5. Facteurs humains
Les stations d'épuration des eaux usées et les
autres sources ponctuelles du bassin versant sont les sources principales de
nutriments (Edmondson, 1970 ; Moss et al., 2005). Alors que la
structure géologique et la géographie physique du bassin versant
déterminent généralement les caractéristiques
physico-chimiques des eaux, la perturbation et la modification du bassin
versant par l'homme peuvent engendrer un transfert de nutriments vers le plan
d'eau bien plus important que celui dû aux facteurs naturels.
Des changements de techniques de mise en valeur des terres et
l'utilisation d'engrais peuvent modifier considérablement la charge
nutritive des eaux de ruissellement, comme le montre l'étude sur la
relation de cause à effet entre les pratiques d'exploitation des terres
et la qualité de l'eau, menée par le Canada et les Etats-Unis
dans le bassin des grands lacs américains.
1.9. Place de la physico-chimie dans la chaîne
trophique et l'eutrophisation
Le cycle des éléments nutritifs ne peut
fonctionner correctement que dans des conditions d'équilibre
écologique (figure 5). Lorsque les apports en nutriments se multiplient,
le cycle est déréglé (figure 6) : on parle alors
d'eutrophisation (Trinquier, 2009). Les matières dissoutes et les
matières en suspension vont être minéralisées avec
consommation d'oxygène et production de sels nutritifs. Les algues
profitent des sels nutritifs en excès et se développent à
une vitesse plus élevée que celle à laquelle elles
pourraient être consommées par les animaux. Il y a donc
accumulation de biomasse algale, et la décomposition de ces algues va
désoxygéner le milieu.
La respiration nocturne du phytoplancton et la
dégradation de la matière végétale par les
micro-organismes consomment toutes deux l'oxygène de l'eau. Assez
rapidement, la
19
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
raréfaction de l'oxygène dissous dans les eaux a
plusieurs conséquences néfastes : mortalité des poissons,
libération de gaz corrosifs et d'autres substances indésirables,
et modification des valeurs de pH et du potentiel redox (Galvez-Cloutier et
al, 2002).
Lorsque les concentrations en oxygène sont basses, les
bactéries anaérobies peuvent oxyder les molécules
organiques sans consommation d'oxygène. Les produits terminaux
(hydrogène sulfuré H2S, ammoniaque NH3 et méthane CH4)
sont toxiques pour de nombreuses espèces animales. La chaîne
trophique sera ainsi perturbée et déséquilibrée.
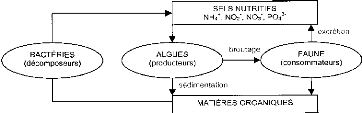
Figure 5: Cycle simplifié des
éléments nutritifs (Galvez-Cloutier et al, 2002).
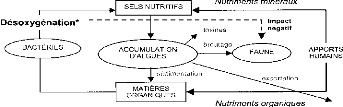
Figure 6: Cycle des éléments nutritifs,
lors d'apports en excès (Galvez-Cloutier et al, 2002).
* La désoxygénation provient de la
surconsommation d'oxygène par les bactéries pour assurer la
décomposition de la matière organique algale en excès
ainsi que la minéralisation des matières dissoutes.
1.10. Conclusion
L'eutrophisation est un phénomène naturel,
malheureusement amplifié par les activités humaines. L'azote et
le phosphore en sont les principaux facteurs. Leur excès dans
l'environnement, d'origine domestique, agricole ou industrielle,
représente un risque toxicologique important pour les usagers de l'eau,
tant au niveau de sa consommation que de son utilisation à des fins
récréatives. Ces apports excessifs de nutriments provoquent
une
20
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
surcroissance algale au sein des lacs puis une disparition de
l'oxygène, qui conduit à la mort des organismes aquatiques et
à la production de gaz toxiques.
Selon MAMA (2010), la prolifération des plantes
aquatiques surtout celle de la jacinthe d'eau est à l'origine de la
formation d'un écran en surface des eaux qui empêche
l'oxygénation du milieu. De plus leur décomposition induit une
augmentation de la quantité de matière organique dans le milieu
dont la dégradation favorise asphixie des espèces halieutiques.
La production de sulfure et de nitrite (toxiques) inhibe le
développement d'autres producteurs primaires et des poissons à
grande sensibilité. Ceci peut provoquer un déséquilibre de
la chaîne trophique (production/ consommation) d'un plan d'eau et
entraîner des conséquences écologiques importantes.
Le niveau trophique des lacs peut être quantifié
à l'aide de divers paramètres et donne une idée de la
qualité de l'eau. L'eutrophisation est aujourd'hui présente sur
tous les continents. La prise de conscience des différents gestionnaires
de l'eau a permis le développement de moyens de lutte contre
l'eutrophisation : moyens préventifs ou curatifs (Galvez-Cloutier et
al, 2002).
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
21
Matériel et méthodes
22
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas de
Gbèzoumè dans la commune de Ouidah.
2. Matériel et méthodes
2.1. Milieu d'études
2.1.1. Situation géographique
Le village de Gbèzoumè, de coordonnées
géographiques (Nord 06°20.587' ; Est 001°57.553'), est
situé au Sud du Bénin, dans la commune de Ouidah et
précisément dans l'arrondissement de Ouakpè-Daho. Il est
repéré sur la carte de la commune de Ouidah (Figure 7).
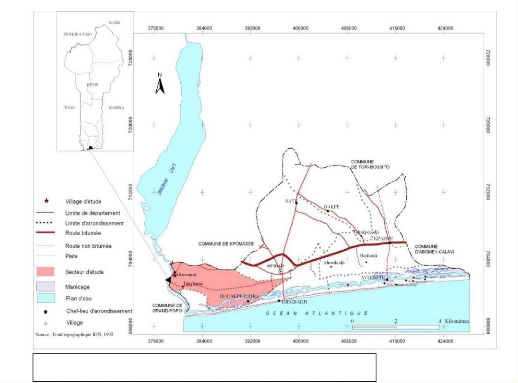
Figure 7 : Présentation de la commune de
Ouidah
Les figures 8a et 8b suivantes nous présentent quelques
vues partielles de la lagune côtière de Gbèzoumè.
23
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.

Figure 8a : Figure 8b :
Figure 8a et 8b: Quelques vues partielles de la lagune
côtière de Gbèzoumè.
2.1.2. Présentation des points
d'échantillonnage
Il a été choisi huit points symbolisés par
E1, E2, E3, E4, E5, E6, E7 et E8 présentés ci-dessous et dont les
coordonnées géographiques sont regroupées dans le tableau
4.
~ E1 est tout près des concessions. Ce point est choisi
afin de déterminer les apports des
activités domestiques de la population.
~ E2 est choisi juste à côté de la
mangrove.
~ E3 est en amont des concessions ; il est choisi pour quantifier
les apports d'avant les
concessions.
~ E4 est un point un peu éloigné de E3 et
situé vers le Nord.
~ E5 est choisi tout près de l'autre rive.
~ E6 est à l'endroit le plus profond.
~ E7 est en aval. Il est pris afin de quantifier les apports
totaux du village.
~ E8 est pris à un niveau particulier. En effet, on
remarque qu'une eau trouble provenant
de la berge habitée par les villageois.
Chacun des points d'échantillonnage est placé sur
la figure 9 :
24
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas de
Gbèzoumè dans la commune de Ouidah.
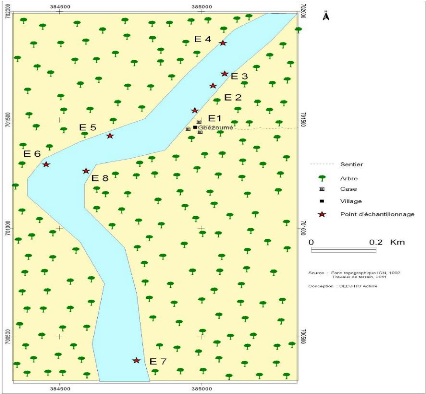
Figure 9: Présentation des différents
points d'échantillonnage.
25
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
Tableau 4: Coordonnées des points
d'échantillonnage
|
Points
d'échantillonnage
|
Nord
|
Est
|
|
E1
|
06°20,716'
|
001°57,625'
|
|
E2
|
06°20,769'
|
001°57,668'
|
|
E3
|
06°20,799'
|
001°57,689'
|
|
E4
|
06°20,916'
|
001°57,647'
|
|
E5
|
06°20,792'
|
001°57,477'
|
|
E6
|
06°20,600'
|
001°57,352'
|
|
E7
|
06°20,131'
|
001°57,557'
|
|
E8
|
06°20,559'
|
001°57,488'
|
2.2. Laboratoires de recherche
Les analyses ont été faites dans deux
laboratoires différents de la Faculté des Sciences et Techniques
de l'Université d'Abomey-Calavi. Il s'agit du Laboratoire d'Hydrologie
Appliquée (LHA) et de l'Unité de Recherche sur les Zones Humides
(URZH).
2.3. Méthodologie
2.3.1. Périodicité
d'échantillonnage
Une série de trois campagnes d'échantillonnage
d'eau est faite dans le dernier trimestre de l'année 2010,
respectivement les 19 octobre, 19 novembre puis 18 décembre. Cette
période est choisie parce qu'elle est une période de transition
entre la fin de la petite saison des pluies et le début de la grande
saison sèche. Elle nous a permis de suivre les variations des
paramètres physico-chimiques. Les mesures de longueurs totales,
standards et à la fourche ainsi que les abondances du phytoplancton et
du zooplancton ont été faites en une seule campagne.
26
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
2.3.2. Liste du matériel
Le matériel suivant a été utilisé sur
le terrain :
· Un conductimètre WTW 340i qui sert à
mesurer à la fois la conductivité, la salinité et les
solides totaux dissous ;
· Un GPS de marque X-extra, pour la prise des
coordonnées géographiques des divers points
d'échantillonnage;
· Un pH/oxi mètre WTW 340i, pour mesurer
l'oxygène dissous et le pH;
· De l'eau distillée ;
· Une grande glacière afin de garder au frais les
bouteilles qui contiennent les échantillons ;
· Un disque de Secchi, pour la transparence ;
· Un appareil photographique numérique de marque
samsung ES65 pour prendre l'image des poissons.
· Un ichtyomètre ;
· Une balance de précision portable utilisée
pour la mesure de poids des poissons ;
· Un filet à plancton ;
· Formol et Lugol
· Un cahier de notes ;
· Un véhicule pour le transport du matériel
;
· Une pirogue conduite par un pêcheur pour nous faire
déplacer sur l'eau,
· Un colorimètre HACH DR/890 multi-paramètres
qui nous a permis de mesurer la couleur, la turbidité et la
salinité.
2.3.3. Paramètres physico-chimiques
Certains paramètres physico-chimiques ont
été mesurés in situ. Il s'agit de : le pH,
l'oxygène dissous, la conductivité électrique, la
salinité et la température.
- Le pH
Le pH (potentiel Hydrogène) mesure la concentration en
ions H+ de l'eau. Il traduit ainsi la balance entre acide et base sur une
échelle de 0 à 14. Il y a neutralité si le pH est
égal à 7 à 25°C. Ce paramètre
caractérise un grand nombre d'équilibre physico-chimique et
dépend de facteurs multiples dont l'origine de l'eau.
27
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
- L'oxygène dissous
L'oxygène est indispensable pour le
développement normal de la plupart des êtres vivants du milieu
aquatique. L'oxygène présent dans l'eau a pour origine,
l'activité photosynthétique des végétaux aquatiques
et la dissolution à partir de l'oxygène atmosphérique. La
teneur en oxygène dissous d'une eau dépend des activités
physiques, chimiques et biologiques qui s'y déroulent. Les organismes
vivants, par leur métabolisme, produisent par photosynthèse et
consomment par respiration et la dégradation des matières
organiques, de l'oxygène (Mama et al, 2009). L'oxygène
dissous et le pH ont été mesurés à l'aide du pH
/Oxi mètre WTW 340i, préalablement calibré.
- La conductivité électrique
La conductivité est une mesure de la capacité
qu'a une eau pour conduire le courant électrique. La conductivité
est liée à un paramètre appelé force ionique,
déterminé par la concentration et la charge de chaque ion
présent dans l'eau.
- La salinité
La salinité est le caractère essentiel de l'eau
de mer. L'océan contient en moyenne 35 grammes de sel par litre.
- La température
Elle est un facteur écologique du milieu. Elle joue un
rôle primordial dans la solubilisation des sels, des gaz et dans la
détermination du pH. D'une façon générale, la
température des eaux superficielles est influencée par celle de
l'air parce qu'elles sont moins profondes. Elle influence la vie des
êtres vivants aquatiques (Mama et al, 2009). Les mesures de la
température, de la salinité, de la conductivité et des
solides totaux dissous (TDS) ont été faites à l'aide du
conductimètre WTW 340i multiparamètre.
- La turbidité, la couleur et les matières
en suspension (MES)
La mesure de la turbidité permet de préciser les
informations visuelles sur l'eau. La turbidité traduit la
présence de particules en suspension dans l'eau (débris
organiques, argiles, organismes microscopiques...). Les MES sont entre autres
les particules non dissoutes, visibles ou non qui traînent dans les eaux.
Les MES, la turbidité et la couleur ont été
mesurées à l'aide du colorimètre HACH DR/890.
28
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
- Les nutriments
Des échantillons d'eau sont pris lors de chaque
campagne et à chaque point dans des bouteilles en plastiques et
gardés au frais dans une glacière jusqu'au laboratoire au moyen
d'un véhicule loué pour la circonstance.
Les teneurs en nutriments tels que les ions nitrites,
nitrates, ammonium, phosphates ont été déterminées
à l'aide du chromatographe ionique de marque ICS-1000 (Figure 10).

Figure 10: Un chromatographe ionique ICS-1000
(LHA/FAST/UAC). - La demande biochimique en
oxygène
Elle est la quantité d'oxygène utilisée,
pendant une période de cinq jours par les microorganismes pour
décomposer la matière organique (végétales,
animales, etc...) présente dans l'eau. Elle s'exprime en milligramme
d'oxygène par litre (mg O2/L). Sa mesure s'est faite par la
méthode respirométrique OxiTop dans une enceinte
thermostatée (ou un DBO-mètre) à 20°C pendant cinq
jours. En effet, 428mL de chaque échantillon sont prélevés
dans des bouteilles en verre muni d'un récipient contenant de KOH afin
d'emprisonner le dioxyde de carbone (CO2) rejeté par les
micro-organismes. L'incubateur enregistre chaque jour la quantité de CO2
et la traduit par un programme qui lui est incorporé en concentration de
dioxygène absorbé.
- La demande chimique en oxygène (DCO)
La demande chimique en oxygène (DCO) est un
paramètre qui permet d'évaluer la charge organique
biodégradable et une partie de la charge non biodégradable. Elle
permet aussi d'apprécier la concentration en matières organiques
ou minérales, dissoutes ou en suspension dans l'eau à travers la
quantité d'oxygène nécessaire à leur oxydation
chimique
29
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
totale. L'oxydation des matières oxydables est faite
par un oxydant chimique (le bichromate de potassium) selon les équations
suivantes :
CrOr + 14H+ + 6e- 2Cr3+ +
7H2O
Matière oxydable CO2 + xe- + xH+
Protocole de la DCO
- Mettre 10 mL d'échantillon dans les matras (Ve)
- Ajouter 5mL de dichromate de potassium
- Ajouter avec précaution 15 mL d'acide sulfurique
contenant AgCl (catalyseur) sous la
hotte en refroidissant sous courant d'eau.
- Ajouter 3 billes de verre (régulation
d'ébullition)
- Porter à ébullition à reflux pendant 2h
sous la hotte après avoir placé les réfrigérants
sur les matras.
- Laisser refroidir puis compléter à environ
75mL avec de l'eau distillée en rinçant
les
réfrigérants.
- Titrer l'excès de dichromate par le sel de Mohr en
présence de ferroïne. Noter le
volume équivalent V2 et VB
pour les blancs.
DCO = 8000xCx(VB--V2)
Ve
- On a alors :
DCO mg O2/L
C : Concentration en mol/L de sel de Mohr
VB, V2 et Ve sont en mL
- La chlorophylle a
La mesure de la chlorophylle a, est utilisée comme
indicateur de la biomasse phytoplanctonique dans les eaux naturelles. La
chlorophylle a représente le plus important pigment chez les organismes
photosynthétiques aérobies (en excluant les
cyanobactéries) et toutes les algues en contiennent. Le contenu
cellulaire en chlorophylle a est de 1% à 2 % en poids sec. Des
échantillons d'eau sont pris sur le terrain dans des bouteilles
recouvertes de tissus noirs afin d'empêcher la lumière d'y
pénétrer pendant son transport.
Au laboratoire, une filtration est faite sur un filtre GF/C de
0,45um, lequel est déposé dans un tube contenant 10 mL
d'acétone à 90%. Après agitation jusqu'à
dissolution du filtre
30
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
et centrifugation de l'extrait pendant dix minutes, nous
sommes passés à la lecture au spectrophotomètre aux
longueurs d'onde de 665nm et 750nm. Une acidification régulière,
(acide chlorhydrique cinq fois normal) est faite après lecture de
l'absorbance Ao jusqu'à ce qu'on atteigne la valeur minimale
Aa de cette dernière. Avec la formule de Lorenzen qui suit,
nous avons pu calculer la concentration en chlorophylle a.
|
1'
[Chla]= 27x((Ao665-Ao750)-(Aa665-Aa750))x
~ !
|
Avec :
Ao665 et Ao750 sont respectivement les
absorbances à 665 nm et 750 nm avant acidification ;
Aa665 et Aa750 sont respectivement les
absorbances à 665 nm et 750 nm après acidification ;
y, le volume de l'acétone 90% utilisé pour
l'extraction en millilitre ;
V, le volume d'eau filtrée en litre;
L, le parcours optique de la cuve utilisée en
centimètre;
27, un facteur déterminé
expérimentalement.
3.3.4. Abondance du zooplancton et du phytoplancton
3.3.4.1. Echantillonnage, fixation et
conservation
L'échantillonnage du zooplancton est fait à
l'aide d'un filet à plancton, d'une ouverture de 25 cm et de mailles de
50um, entraîné sur une distance de cinq mètres. Tout le
volume recueilli est concentré dans une bouteille de 500 mL.
L'échantillon est ensuite fixé sur le terrain, au formol
(à une concentration finale dans l'échantillon de 5%) pour une
conservation à longue durée.
L'échantillon du phytoplancton est fixé sur le
terrain à l'aide d'une solution de Lugol alcalin (dans les proportions
de 2,5mL pour un flacon de 500mL) afin de le garder pendant trois semaines au
maximum. Mais pour une conservation de plus longue durée, une fixation
complémentaire s'impose : l'utilisation de glutaraldéhyde est
préférée à une concentration finale dans
l'échantillon à 0,5% (Cemagref, 2009).
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
2.3.4.2. Zooplancton
Le comptage du zooplancton a été fait selon le
processus suivant : un sous-échantillon de cent millilitres provenant de
l'échantillon filtré sur le terrain est déposé dans
la cellule de comptage (Figure 11) laquelle est montée au microscope
(Figure 12). Le comptage est fait maille par maille et sans
répétition. La même chose est répétée
trois fois de suite pour les échantillons pris à chaque site. Une
moyenne n, des nombres d'espèces comptées est faite afin de
connaître avec précision le nombre d'individus qui se trouvent
dans les cent millilitres.
L'abondance N est enfin obtenue en divisant le nombre n
d'individus par 100 mL (0,1 litre) puis le tout multiplié par le facteur
de concentration (v/V).
N= +
0,1
12 ×
V
Soit : Avec :
V : Volume total d'eau pris sur le terrain en litre (V=
r2xïxL)
v : Le volume concentré, en litres.
V
V
: Le facteur de concentration de l'échantillon d'eau
r : Rayon de l'ouverture du filet à plancton (0,125 m);
L : Distance sur laquelle est tiré le filet à
plancton en mètres (5 m) ;
Ï : La constante ï ;

31
Figure 11 : Cellule de Figure 12: Cellule de comptage
du
comptage du zooplancton zooplancton montée
à la loupe
2.3.4.3. Phytoplancton
La numération cellulaire est la détermination du
nombre de cellules contenues dans un volume précis de liquide. On
exprime le résultat en nombre de cellules par litre. Elle a
été directement réalisée par comptage au
microscopique optique, à l'aide de la cellule de Burker
32
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
(Figure 13). C'est une lame épaisse en verre,
comportant des rigoles et deux quadrillages séparés par une
rigole. La grille centrale (colorée en noir) de chacune des chambres est
subdivisée en 25 petits carreaux ; chaque petit carreaux mesure
0,2mm×0,2mm. L'épaisseur de la chambre est de 0,1mm. Ainsi la
chambre occupée par chaque petit carreaux a un volume de
0,2mm×0,2mm×0,1mm, soit 4×10-9 litre.
Lorsque la suspension cellulaire est trop concentrée,
il est nécessaire de réaliser une dilution préalable. En
effet, lorsque la suspension cellulaire est trop concentrée (grand
nombre de cellules par unité de volume), il est difficile de compter les
individus.
> Remplissage de la cellule de numération
- Humecter les deux plateaux latéraux. Faire
adhérer parfaitement la lamelle aux
plateaux latéraux : pour
cela placer la lamelle sur ces plateaux, puis à l'aide des pouces
posés sur la lamelle, exercer une pression sur la lamelle tout en
pratiquant un mouvement de va et vient jusqu'à perception d'une
résistance.
- Placer la cellule de comptage sur une surface plane.
Homogénéiser la suspension
cellulaire, et prélever
celle-ci à l'aide d'une pipette Pasteur. Remplir la chambre de comptable
par capillarité, en plaçant la pointe de la pipette
légèrement inclinée près de la lamelle sur la
plate-forme centrale quadrillée. Le remplissage doit être fait en
une seule fois, sans bulles d'air, et sans faire déborder le liquide
dans les rigoles. Laisser sédimenter les cellules sur le quadrillage
quelques minutes et passer à la numération.
- Après utilisation, la lame porte-objet et la lamelle
sont immergées dans un bain d'eau
de javel pendant cinq minutes, puis
sont rincées avec de l'eau distillée et essuyées avec du
papier (sans frotter, en particulier au niveau du quadrillage).
33
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
> Numération
- Observer à l'objectif x10 pour repérer la
position du quadrillage et
vérifier
l'homogénéité de la répartition
des espèces à compter (si la répartition est mauvaise,
recommencer).
- Observer ensuite à l'objectif x40 pour réaliser
le comptage (un rectangle par champ).
- Compter les cellules contenues dans 4, 10, 20 ou dans la
totalité des espaces
délimitées.
- Reprendre la même chose pour trois
sous-échantillons différents.
- Pour les espèces chevauchant les lignes de quadrillage,
compter seulement celles qui
chevauchent deux arêtes sur quatre de l'espace
délimitée (en pratique, on choisit de prendre en compte les
cellules chevauchant la ligne horizontale supérieure, et la ligne
verticale droite).
> Calcul des abondances
Après avoir effectué la manipulation, on calcule la
concentration cellulaire de la suspension de cellules étudiée.
Soient :
- na et nb, les moyennes des nombres d'algues des
sous-échantillons, dans 20 carreaux
de 0,2mm×0,2mm, respectivement dans les chambres A et B de
la lame porte-objet ;
- V, le volume total d'eau pris sur le terrain (avec, V=
r2ï×L ; r = 0,125m, le rayon de
l'ouverture du filet
à plancton et L = 5m, la distance sur laquelle le filet à
plancton est entraîné) ; V en litres.
- v, le volume filtré en litre;
- v/V : le facteur de concentration ;
- ï, la constante ï.
N= 0,5X(na+nb)
4X1019 ×
î, V
Le nombre N d'algues dans un litre à chaque point de
prélèvement peut être exprimée par la formule
suivante:
34
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
2.3.5. Mesure des tailles et poids des poissons
Les mesures des tailles et poids des différentes
espèces de poissons pêchées à Gbèzoumè
ont été également faites. Pour ce faire, nous-nous sommes
servis d'un ichtyomètre pour mesurer les longueurs totale, standard, et
à la fourche des poissons afin d'établir la relation
tailles-poids. La relation taille-poids régie par la formule
Pt=a×Ltb, avec a et b des constantes positives non nulles, nous
renseignent sur l'état physiologique de ces espèces
halieutiques.
En effet, l'ichtyomètre est le principal instrument de
mesure pour tous les poissons et céphalopodes. Cette règle
(figure 15) est constituée d'une planche sur laquelle est apposée
une autre règle de graduation en cm. L'une des extrémités
est munie d'une butée qui permet facilement de positionner l'individu au
moment de la mensuration (Badts et Bertrand, 2010). Chaque poisson est
allongé sur la planche avec l'extrémité antérieure
du museau touchant la butée.

Figure 15: Un ichtyomètre (Photo tirée de
Badts et Bertrant, 2010)
Rappelons-nous quelques définitions :
La longueur totale (Lt): C'est la distance mesurée
à partir de l'extrémité antérieure du museau (ou
lèvre supérieure) jusqu'à la pointe postérieure du
plus long rayon de la nageoire caudale lorsque celle-ci est en position «
naturelle ».
La longueur à la fourche (Lf): C'est la distance
mesurée à partir de l'extrémité antérieure
du museau jusqu'à la pointe du rayon médian de la nageoire
caudale.
La longueur standard (Ls) : C'est la distance mesurée
à partir de l'extrémité antérieure du museau
jusqu'à la pointe du pédoncule caudal (la base caudale). Pour
trouver la base caudale, il faut déplacer latéralement la
nageoire caudale contre le corps du poisson ; un sillon apparaît à
la jonction entre l'os hypural et les rayons de la nageoire (Ministère
des pêches et des océans du Canada, 2004, Partie 5).
35
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
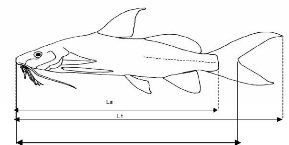
Lf
Figure 16: Image d'un poisson et les différentes
longueurs mesurées
Les longueurs totale, standard et à la fourche des
poissons furent mesurées en cm. Le poids total (non
éviscéré) de chaque poisson a été
mesuré en gramme. Le sexe n'a pas été
différencié. Les relations taille-poids des poissons de
Gbèzoumè ont été analysées en utilisant le
logiciel Microsoft EXCEL. Les paramètres a et b de la relation Pt=
a×Ltb ont été estimés à travers une
transformation logarithmique linéaire de type ln(Pt)= ln(a)+
b×ln(Lt).
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
36
Résultats et discussions
37
Evaluation de la chaîne trophique d'une aire
marine protégée en relation avec sa
physico-chimie : cas de
Gbèzoumè dans la
commune de Ouidah.
3. Résultats et discussions
3.1. Résultats
3.1.1. Conditions écologiques
A l'aide des résultats trouvés lors de
nos recherches, nous avons construit des histogrammes pour
chaque paramètre. S ous l'effet de la sécheresse,
certains points de prélèvement ont disparu. Par
exemple, le point E4 lors de la deuxième campagne, puis
les points E2, E3 et E4 lors de la troisième
campagne.
3.1.1.1. La température
Nous avons constaté que la température a
varié de 29,9°C à 31,4°C pour la première
campagne (C1), de 29 ,9°C à 31,3°C pour la
deuxième campagne (C2 ), puis de 29,6°C à
30,9°C pour la troisième campagne (C3 ). Les
températures les plus élevées ont été
enregistrées aux points E3 et E4
tandis que les plus basses ont été obtenues aux points
E1 et E2.
31,5
30,5
29,5
28,5
31
30
29
E1 E2
T°C C1
E3 E4 E5 E6 E7 E8
T°C T°C C3
Figure 17: Variation de la température à
chaque point d'échantillonnage
3.1.1.2. Les concentrations en oxygène
dissous
Nous avons constaté que les faibles teneurs en
oxygène dissous ont été obtenues aux points
d'échantillonnage E2 , E3 et E4 alors que les
plus fortes teneurs ont été enregistrées surtout
aux points E6, E7 et E8 (au-delà de 7,5 mg/L). Par ailleurs, les
variations de 0,07 mg/L
3,
à 4,43 mg/L pour la C1 , 0,1mg/L à 7,9
mg/L pour la C2 et 2,86 mg/L à 7,85mg/L pour la
C
ont été observées.
38
Evaluation de la chaîne trophique d'une aire
marine protégée en relation avec sa
physico-chimie : cas de
Gbèzoumè dans la
commune de Ouidah.
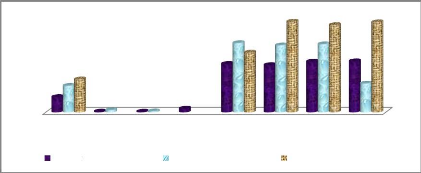
4
8
0
6
2
E1 E2 E3 E4 E5 E6 E7 E8
O2diss mg/L C1 O2diss mg/L O2diss mg/L
C3
Figure 18: Variation de la teneur en oxygène
dissous à chaque point d'échantillonnage
3.1.1.3. La salinité
La salinité enregistrée au cours de la
première campagne a été la plus élevée de
toutes les campagnes avec une accentuation au point
E3 à 1mg/L.
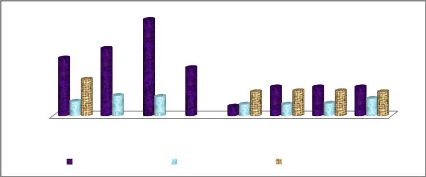
0,8
0,6
0,4
0,2
0
1
E1 E2
Salinité g/L C1 Salinité g/L
Salinité g/L C3
E3 E4 E5 E6 E7
E8
Figure 19: Evolution de la salinité à
chaque point d'échantillonnage
3.1.1.4. Le pH
Les valeurs de pH varient pour la C1 de 6,75
à 7,37 ; de 6,35 à 7,9 pour la C2 puis, de 7,11
à 7,85 pour la C3 . En comparant ses valeurs moyennes
respectives qui sont de 7,09 ; 7,29 et 7,63, nous constatons
qu'elles sont dans la gamme basique faible.
39
Evaluation de la chaîne trophique d'une aire
marine protégée en relation avec sa
physico-chimie : cas de
Gbèzoumè dans la
commune de Ouidah.
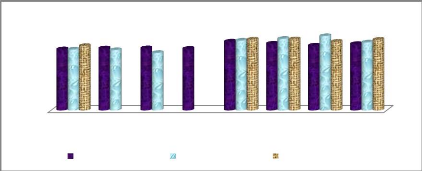
10
4
8
0
6
2
E1 E2
pH C1 pH pH C3
E3 E4 E5 E6 E7 E8
Figure 20: Evolution du potentiel hydrogène
à chaque point d'échantillonnage 3.1.2. Paramètres
chimiques
3.1 .2.1. L'ion nitrite
|
Nous avons constaté que les fortes teneurs en
nitrites ont été en général,
enregistrées
|
à
|
la C1 . Les faibles teneurs ont été, par
contre obtenues à la C 3 . Elles sont respectivement
dans
|
les intervalles de 0,11 à 0,22mg/L à la C1,
de 0,01 à 0,23mg/L à la C la C3.
|
2 et de 0,01 à 0,02mg/L à
|
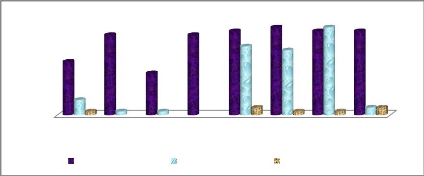
0,25
0,15
0,05
0,2
0,1
0
E1 E2
NO2 mg/L C1 NO2 mg/L NO2 mg/L
C3
E3 E4 E5 E6 E7
E8
Figure 21: Evolution de la teneur en nitrites à
chaque point d'échantillonnage
1.1.1.1. L'ion nitrate
Nous avons constaté que les échantillons
d'eau analysés lors de la C1 sont très riches en
nitrates (0,91 à 2,7mg/L), tandis que les autres n'enregistrent que des
teneurs inférieures à 0,25mg/L.
40
Evaluation de la chaîne trophique d'une aire
marine protégée en relation avec sa
physico-chimie : cas de
Gbèzoumè dans la
commune de Ouidah.
E1 E2 E3 E4 E5 E6 E7 E8
NO3 mg/L C1 NO3 mg/L NO3 mg/L C3
Figure 22: Evolution de la teneur en nitrates à
chaque point d'échantillonnage
1.1.1.2. L'ion ammonium
E1 E2 E3 E4 E5 E6 E7 E8
NH4 mg/L C1 NH4 mg/L NH4 mg/L C3
Figure 23: Evolution de la teneur en ammonium à
chaque point d'échantillonnage
Nous avons constaté qu'à chaque point
d'échantillonnage, les teneurs en ions ammoniums sont les plus fortes
à la C3, contrairement aux décroissances
observées pour les ions nitrites et nitrates.
1.1.1.3. L'ion phosphate
Nous constatons qu'à chaque point de
prélèvement, les teneurs en ions phosphates tout comme celles des
ions nitrites et nitrates ont connu une diminution suivant les temps
d'échantillonnage.
41
Evaluation de la chaîne trophique d'une aire
marine protégée en relation avec sa
physico-chimie : cas de
Gbèzoumè dans la
commune de Ouidah.
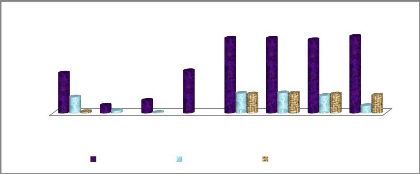
0,5
2,5
1,5
0
2
1
E1 E2
PO4 mg/L C1 PO4 mg/L PO4 mg/L C3
E3 E4 E5 E6 E7 E8
Figure 24: Evolution de la teneur en phosphates à
chaque point d'échantillonnage
1.1.1.4. La demande biochimique en
oxygène
Les analyses faites nous révèlent que
les DBO5 moyennes enregistrées aux points E1
et E2 sont les plus élevées (14,7 et 13,5 mg de
O2 par litre). Cette information indique que ces
deux points sont les plus pollués.
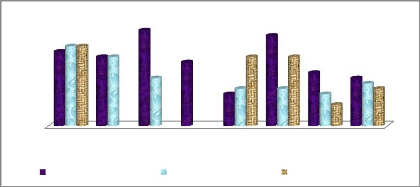
20
15
10
0
5
E1 E2
DBO5 mg/L C1
E3 E4 E5 E6 E7 E8
DBO5 mg/L DBO5 mg/L C3
Figure 25: Evolution de la demande biochimique en
oxygène à chaque point d'échantillonnage.
1.1.1.5. La chlorophylle a
Une comparaison des moyennes de la chlorophylle a, place
les points E2 et E6 en tête, à 23,97 et 44,55mg/L
respectivement. Cela signifie que les algues sont riches en chlorophylle a
en ces deux points.
42
Evaluation de la chaîne trophique d'une aire
marine protégée en relation avec sa
physico-chimie : cas de
Gbèzoumè dans la
commune de Ouidah.
E1 E2 E3 E4 E5 E6 E7 E8
Chl a ug/L C1 Chl a ug/L Chl a ug/L
C3
Figure 26: Evolution de la teneur en chlorophylle a
à chaque point d'échantillonnage
3.1.3. Les états trophiques
L'utilisation des résultats obtenus lors de la
mesure de s paramètres physico -chimiques et le tableau 3, ont
permis l'établissement des tableaux ci-dessous, dans le cadre de
la détermination de l'état trophique de chaque site
d'échantillonnage.
Tableau 5: Etat trophique du point
d'échantillonnage E1
|
E1
|
Très bon
|
Médiocre
|
Mauvais
|
|
Turbidité
|
NTU
|
|
|
57
|
|
PO43-
|
uM
|
|
|
5,37
|
|
NO2 -
|
uM
|
|
|
1,30
|
|
NO3 -
|
uM
|
|
6,13
|
|
|
NH4 +
|
uM
|
|
|
17,22
|
|
Azote total
|
uM
|
25
|
|
|
|
Phosphate total
|
uM
|
|
|
5,80
|
|
Chl a
|
mg/m3
|
|
|
30,9
|
Nous constatons que l'état trophique de
E1 est « Mauvais »
43
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
Tableau 6: Etat trophique du point
d'échantillonnage E2
|
E2
|
Bon
|
Moyen
|
Médiocre
|
Mauvais
|
|
Turbidité
|
NTU
|
|
|
|
52
|
|
PO43-
|
uM
|
|
1,47
|
|
|
|
NO2 -
|
uM
|
|
|
|
2,39
|
|
NO3-
|
uM
|
|
|
7,58
|
|
|
NH4 +
|
uM
|
|
|
|
45,56
|
|
Azote total
|
uM
|
66,43
|
|
|
|
|
Phosphate total
|
uM
|
|
1,94
|
|
|
|
Chl a
|
mg/m3
|
|
|
|
23,97
|
Nous constatons que l'état trophique de E2 est «
Mauvais » Tableau 7: Etat trophique du point
d'échantillonnage E3
|
E3
|
Très bon
|
Moyen
|
Médiocre
|
Mauvais
|
|
Turbidité
|
NTU
|
|
|
|
40,5
|
|
PO43-
|
uM
|
|
|
1,89
|
|
|
NO2 -
|
uM
|
|
|
|
1,30
|
|
NO3 -
|
uM
|
|
|
7,42
|
|
|
NH4 +
|
uM
|
|
|
|
13,33
|
|
Azote total
|
uM
|
21,43
|
|
|
|
|
Phosphate total
|
uM
|
|
1,94
|
|
|
|
Chl a
|
mg/m3
|
|
|
10,02
|
|
Nous constatons que l'état trophique de E3 est «
Médiocre » Tableau 8: Etat trophique du point
d'échantillonnage E4
|
E4
|
Très bon
|
Moyen
|
Mauvais
|
|
Turbidité
|
NTU
|
|
18
|
|
|
PO43-
|
uM
|
|
|
11,89
|
|
NO2-
|
uM
|
|
|
4,57
|
|
NO3 -
|
uM
|
|
|
14,48
|
|
NH4 +
|
uM
|
|
|
11,11
|
|
Azote total
|
uM
|
29,29
|
|
|
|
Phosphate total
|
uM
|
|
|
12,90
|
|
Chl a
|
mg/m3
|
|
7,2
|
|
Nous constatons que l'état trophique de E4 est «
Mauvais »
44
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
Tableau 9: Etat trophique du point
d'échantillonnage E5
|
E5
|
Très bon
|
Bon
|
Moyen
|
Médiocre
|
Mauvais
|
|
Turbidité
|
NTU
|
|
|
|
|
65,67
|
|
PO43-
|
uM
|
|
|
|
|
10,63
|
NO2-
|
uM
|
|
|
|
|
3,04
|
NO3-
|
|
uM
|
|
|
|
7,10
|
|
|
|
NH4 +
|
uM
|
|
|
|
|
12,22
|
|
Azote total
|
uM
|
23,57
|
|
|
|
|
|
Phosphate total
|
uM
|
|
|
|
|
10,97
|
|
Chl a
|
mg/m3
|
|
|
|
12,90
|
|
Nous constatons que l'état trophique de E5 est «
Mauvais » Tableau 10: Etat trophique du point
d'échantillonnage E6
|
E6
|
Bon
|
Moyen
|
Médiocre
|
Mauvais
|
|
Turbidité
|
NTU
|
|
|
|
66
|
|
PO43-
|
uM
|
|
|
|
10,73
|
NO2-
|
uM
|
|
|
|
3,04
|
NO3-
|
|
uM
|
|
|
|
14,03
|
|
|
NH4 +
|
uM
|
|
|
|
51,11
|
|
Azote total
|
uM
|
66,43
|
|
|
|
|
Phosphate total
|
uM
|
|
|
|
10,97
|
|
Chl a
|
mg/m3
|
|
|
|
44,55
|
Nous constatons que l'état trophique de E6 est «
Mauvais » Tableau 11: Etat trophique du point
d'échantillonnage E7
|
E7
|
Bon
|
Médiocre
|
Mauvais
|
|
Turbidité
|
NTU
|
|
|
66
|
|
PO43-
|
uM
|
|
|
10,32
|
NO2-
|
uM
|
|
|
3,26
|
NO3-
|
|
uM
|
|
6,94
|
|
|
|
NH4 +
|
uM
|
|
|
51,11
|
|
Azote total
|
uM
|
61,43
|
|
|
|
Phosphate total
|
uM
|
|
|
10,64
|
|
Chl a
|
mg/m3
|
|
14,7
|
|
45
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas de
Gbèzoumè dans la commune de Ouidah.
Nous remarquons que l'état trophique de E7 est «
Mauvais » Tableau 12: Etat trophique du point
d'échantillonnage E8
|
E8
|
Très bon
|
Médiocre
|
Mauvais
|
|
Turbidité
|
NTU
|
|
|
60
|
|
PO43-
|
uM
|
|
|
9,58
|
|
NO2 -
|
uM
|
|
|
1,96
|
|
NO3 -
|
uM
|
|
6,29
|
|
|
NH4 +
|
uM
|
|
|
32,22
|
|
Azote total
|
uM
|
40,71
|
|
|
|
Phosphate total
|
uM
|
|
|
10,00
|
|
Chl a
|
mg/m3
|
|
15,90
|
|
Nous remarquons que l'état trophique de E1 est «
Mauvais »
Tableau 13: Bilan général de l'état
trophique de la lagune côtière de
Gbèzoumè
|
Stations
|
E1
|
E2
|
E3
|
E4
|
E5
|
E6
|
E7
|
E8
|
Bilan Général
|
|
Colonne d'eau
|
Mauvais
|
Mauvais
|
Médiocre
|
Mauvais
|
Mauvais
|
Mauvais
|
Mauvais
|
Mauvais
|
Mauvais
|
L'analyse de l'état trophique des points
d'échantillonnage révèle qu'il est « Mauvais ».
Le bilan général est que la lagune côtière de
Gbèzoumè est dans un mauvais état par rapport à son
état eutrophe.
3.1.4. Abondances du phytoplancton et du
zooplancton
L'abondance des algues récoltées, dans le cours
d'eau de Gbèzoumè, présente un maximum au point E5 et le
minimum au point E6 avec une moyenne de 15592357 algues par litre, source de
nourritures pour les consommateurs primaires (herbivores).
46
Evaluation de la chaîne trophique d'une aire
marine protégée en relation avec sa
physico-chimie : cas de
Gbèzoumè dans la
commune de Ouidah.

2500000
2000000
1500000
1000000
500000
0
Abondance phytoplancton ( Nombre du d'algues par
litre)
E3 E4 E5 E6 E7 E8
Points d'échantillonnage
Abondance du phytoplancton (Nombre d'algues par
litre)
E1 E2
Figure 27: Abondance du phytoplancton
L'abondance des principaux ordres de zooplancton
révèle que les copépodes viennent en tête avec un
total, par litre, de 53. Ensuite, nous avons les rotifères à 32
puis les cladocères qui sont à 19.
Points d'échantillonnage

15
10
5
0
E1 E2
E3 E4 E5 E6 E7 E8
Rotifères Cladocères Copépodes
Abondance du zooplancton (Nombre d'espèces par
litre)
Figure 28: Abondance des principaux ordres de
zooplancton
Une relation est enfin établie entre les
producteurs et les consommateurs primaires (figure
ci-dessous), de coefficient directeur 51163 et d'un coefficient de
régression R2=0,882. Cette relation exprime
de manière générale, la biomasse de ressources disponibles
afin d'alimenter et de consolider les niveaux trophiques supérieurs de
la chaîne alimentaire.
47
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
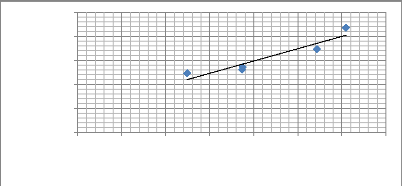
Abondance du phytoplancton
2500000
2000000
1500000
1000000
500000
0
0 5 10 15 20 25 30 35
Abondance du zooplancton
y = 51
R2 = 0,882
163x + 45922
Figure 29: Variation de l'abondance du phytoplancton
en fonction de celle du zooplancton
3.1.5. Relation taille-poids des poissons
Le tableau 14 suivant indique pour chaque espèce, le
nombre de spécimens collectés, les valeurs minimales et maximales
de la taille et du poids, les paramètres a et b estimés ainsi que
le coefficient de corrélation (R2) de la relation
taille-poids. Les effectifs examinés par espèce sont faibles car
les sujets collectés étaient de bonne valeur commerciale. Il en
est de même pour les tailles des poissons qui ne représentent que
celles autorisées par la réglementation des pêches. Nous
avons récolté environ 432 poissons regroupés en
vingt-trois différentes espèces.
Si on ignore: Ethmalosa Liza falcipinnis fimbriata,
Lutjanus goreensis, Schilbe mystus et Synodontis courteti
dont les coefficients de régression sont en dessous de 0,90, les
autres présentent des coefficients R2 élevés
qui varient de 0,9 pour Dolophis cephalopeltis à 0,985 pour
Heterotis niloticus. Les valeurs estimées de b sont autour de 3
pour 44% des espèces de poissons échantillonnés dont
Lutjanus goreensis est présent à 3,326 et Heterotis
niloticus à 3,024. Pour le reste des poissons examinés, la
valeur de b varie de 2,315 pour Synaptura cadenati à 2,902 pour
Sarotherodon melanotheron ; ce qui signifie en termes de croissance,
que le développement du corps (croissance pondérale) est moins
rapide que celui de la taille.
48
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas de
Gbèzoumè dans la commune de Ouidah.
Tableau 14: Relation taille-poids de poissons
pêchés dans le cours d'eau de Gbèzoumè.
|
Nom scientifique
|
Nom local
|
Lt min
|
Lt max
|
Pt min
|
Pt max
|
Nombre
|
a
|
b
|
R2
|
|
Chrysichthys auratus (Geoffroy Saint
Hilaire,
|
Ofin
|
13,1
|
32,5
|
16
|
248
|
27
|
0,0064
|
3,105
|
0,973
|
|
1808)
|
|
|
|
|
|
|
|
|
|
|
Clarias agboyiensis (Sydenham, 1980)
|
Sillule noire, Adinhoué
|
16
|
22,5
|
26
|
69
|
23
|
0,0085
|
2,97
|
0,966
|
|
Cynoglossus senegalensis (Kaup,
1858)
|
Yanli, Affokpakpa
|
11
|
19,8
|
30
|
125
|
10
|
0,015
|
3,032
|
0,956
|
|
Dolophis cephalopeltis (Bleeker,
1863)
|
Todan
|
16
|
21,1
|
40
|
104
|
11
|
0,035
|
2,588
|
0,9
|
|
Elops senegalensis (Regan, 1909)
|
Agbanvi
|
14,7
|
34,2
|
15
|
223
|
11
|
0,0036
|
3,099
|
0,952
|
|
Ethmalosa fimbriata (Bowdich, 1825)
|
Folévi ou ahouè
|
11
|
15,5
|
18
|
59
|
19
|
0,095
|
3,086
|
0,867
|
|
Gerre nigri (Günther, 1859)
|
Lountouivi
|
8,9
|
18,9
|
9
|
90
|
19
|
0,069
|
3,331
|
0,953
|
|
Hemichromis fasciatus (Peters, 1852)
|
Agbatoé
|
7,5
|
18
|
8
|
130
|
22
|
0,0141
|
3,098
|
0,964
|
|
Hepsetus odoe (Bloch, 1794)
|
Zalou
|
13
|
25
|
25
|
160
|
28
|
0,044
|
2,511
|
0,939
|
|
Heterotis niloticus (Cuvier, 1829)
|
Ehoua
|
15
|
28
|
30
|
245
|
21
|
0,0102
|
3,024
|
0,985
|
49
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas de
Gbèzoumè dans la commune de Ouidah.
|
Liza falcipinnis (Valenciennes,
1836)
|
Tafla
|
12,1
|
22,3
|
16
|
70
|
20
|
0,0379
|
2,454
|
0,922
|
|
Liza falcipinnis (Valenciennes,
1836)
|
Houtoévi
|
13,2
|
16,9
|
24
|
75
|
20
|
0,021
|
2,812
|
0,81
|
|
Lutjanus goreensis (Valenciennes,
1830)
|
Ayanto
|
8
|
19,5
|
10
|
99
|
20
|
0,0048
|
3,326
|
0,828
|
|
Monodactylus sebae (Cuvier, 1829)
|
Gadahoungnin, Kplabè
|
10
|
16
|
20
|
130
|
8
|
0,032
|
2,814
|
0,98
|
|
Mulet cephalus (Linné)
|
Guessou
|
13
|
20,6
|
27
|
110
|
21
|
0,0265
|
2,731
|
0,944
|
|
Pamadasys jubelini (Cuvier, 1830)
|
Kokoui
|
11,8
|
24,8
|
19
|
195
|
21
|
0,0111
|
3,025
|
0,978
|
|
Parachanna africana (Steindachner,
1879)
|
Hotrou
|
15
|
24,5
|
30
|
130
|
18
|
0,035
|
2,588
|
0,908
|
|
Sarotherodon melanotheron (Rüppel,
1852)
|
Akpavi
|
11
|
17,5
|
25
|
105
|
25
|
0,0247
|
2,902
|
0,953
|
|
Schilbe mystus (Linné, 1758)
|
Drinmissi, Dahoui
|
12
|
23
|
15
|
80
|
20
|
0,0139
|
2,866
|
0,875
|
|
Synaptura cadenati (Chabanaud, 1848)
|
Afohomè
|
10
|
14,5
|
18
|
60
|
14
|
0,1012
|
2,315
|
0,96
|
|
Synaptura lusitanica (Capello, 1868)
|
Houssimadoui
|
14
|
25,8
|
20
|
120
|
18
|
0,0118
|
2,823
|
0,941
|
|
Synodontis courteti (Pellegrin,
1906)
|
sossogloé
|
11
|
18,2
|
13
|
68
|
21
|
0,0081
|
3,142
|
0,872
|
|
Tilapia guineensis (Bleeker in Günther,
1862)
|
Azéguin
|
8,2
|
16,5
|
11
|
86
|
15
|
0,075
|
2,482
|
0,953
|
50
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
3.2. Discussions
3.2.1. Conditions écologiques
Les valeurs de la température enregistrées lors
des campagnes de prélèvement sont compatibles à celles de
Pouomogne (1998) qui a montré que les températures comprises
entre 24 à 35°C sont favorables à une bonne croissance des
espèces piscicoles couramment élevées. Egna et Boyd (1997)
rapporté par Abou (2001) trouvent qu'une température de 28
à 32°C est optimale pour la croissance des tilapias.
Il est à souligner que les faibles valeurs
d'oxygène dissous sont enregistrées les matins puis les valeurs
élevées en fin de journée, si une expérience se
déroulait tout au long de la journée. En effet, selon la
littérature, cette variation pourrait s'expliquer par les
phénomènes de la photosynthèse et de la respiration. La
nuit, la photosynthèse est quasiment nulle et la respiration est
continuelle. On assiste à une consommation importante d'oxygène
et de production de gaz carbonique, ce qui fait que le taux d'oxygène
enregistré au début de la journée est faible et celui
obtenu à la fin de la journée est généralement
élevé (Akitikpa, 2002). Remarquons aussi que les teneurs moyennes
en oxygène dissous ont accru de la C1 à C3. Selon Mama (2010), le
lac et son bassin versant forment une unité de base de
l'écosystème, puisque les fractions terrestres et aquatiques du
bassin hydrographique sont intimement reliées par le déplacement
de matériaux, des terres vers l'eau. La quantité de
matières organiques drainée vers le plan d'eau est donc forte
à la C1 (fin de la saison des pluies) et il faudrait une importante
quantité d'oxygène dissous à utiliser par les
microorganismes pour la dégrader ; raison pour laquelle la teneur en
oxygène dissous était faible. Ces valeurs obtenues ne sont
guère, en moyenne, dans la gamme défavorable pour la croissance
des espèces de poissons en l'occurrence les tilapias selon Akitikpa,
(2002). Melard (1999) et Kestemont et al. (1989) rapportent qu'une
teneur en oxygène dissous supérieure à 3 mg/L est
favorable pour une bonne croissance des tilapias et claris.
La salinité enregistrée à chaque point
d'échantillonnage se trouvant dans l'intervalle [0,1; 1], nous permet de
dire que l'eau de la lagune côtière de Gbèzoumè est
douce.
Les valeurs de pH obtenues sont bonnes en aquaculture car
situées entre 6,5 à 9 (Boyd, 1990 in Kanangire, 2001).
51
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
3.2.2. Paramètres chimiques
Les teneurs en nitrites enregistrées sauf celles de la
C1, sont en dessous de la limite de détection de pollution,
recommandée pour l'aquaculture qui est de 0,1 mg/L (EIFA, 1970 in
Gominan, 1999). Selon le Ministère de l'Environnement du Québec
(2001), l'azote nitreux (1 mg d'ion nitrite correspondant à 0,3 mg
d'azote nitreux) est, pour les organismes aquatiques comme pour l'homme, la
forme minérale la plus toxique de l'azote.
Les concentrations en ions nitrates connaissent elles aussi
une baisse continuelle. Il est à souligner que dans l'organisme, les
nitrates peuvent se transformer en nitrites, ce qui revient aux mêmes
problèmes de toxicité que pour les nitrites (Ministère de
l'Environnement du Québec, 2001).
La diminution des teneurs en ions nitrites et nitrates est
donc à la base du fort accroissement des teneurs en ions ammoniums
depuis la C1 à la C3, suite aux réactions de
réduction.
Les teneurs en ions phosphates ont tourné pour toutes
les campagnes autour d'une moyenne de 0,75 mg/L. Cette moyenne est au dessus de
la limite 0,03 mg/L, donnée par le ministère de l'Environnement
du Québec (2001) pour la protection de la vie aquatique.
La teneur moyenne de la chlorophylle a pour toutes les
campagnes se trouvent dans la gamme « mauvaise » préfigurant
une eutrophisation selon la grille de lecture de la colonne d'eau (Ifremer,
2000).
3.2.3. L'état trophique du plan d'eau
A part les points E2, E6 et E7 où les teneurs en azote
total sont qualifiées de bon, les autres se retrouvent dans la zone
qualifiée de « très bon ». En revanche, les autres
paramètres responsables du phénomène d'eutrophisation (NO
~ , PO) en particulier, nous affichent des concentrations qui se situent toutes
dans les zones « médiocre » et « mauvais ». Les
concentrations en chlorophylle a indiquent aussi, que les 50% des points
d'échantillonnage se retrouvent dans la colonne qualifiée de
« médiocre » et les 50% autres dans la zone qualifiée
de « mauvais ». Cela peut être dû au fait que les engrais
utilisés par la population riveraine pour l'agriculture, sont des
engrais beaucoup plus phosphatés. La preuve est que les teneurs en
phosphates sont très élevées et classées dans la
gamme « mauvais » induisant la prolifération des algues qui
s'explique par la concentration élevée en chlorophylle a.
52
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
Cette forte prolifération des algues nécessite
aussi une forte consommation d'oxygène dissous par les bactéries
ou le zooplancton pour sa décomposition. Cet état de chose
entraîne l'anoxie (manque d'oxygène dissous) du milieu ; ce qui
peut induire la mort des espèces halieutiques.
3.2.4. Analyse des matrices de corrélation entre
les différents paramètres physico-chimiques
En annexe 6, nous constatons qu'il y a une forte
corrélation entre la DBO5 et la DCO (R= 0,989), car elles sont deux
paramètres intimement liés. La DBO5 croît avec la DCO. En
effet, la DBO5 permet d'évaluer seulement la charge biodégradable
tandis que la DCO permet d'évaluer la charge organique
biodégradable et une partie de la charge non biodégradable. Donc
plus il y a de matières biodégradables, plus la DBO5 et la DCO
croissent. En annexe 7, nous constatons que l'oxygène dissous est
fortement corrélé à la conductivité (R= -0,911),
aux solides totaux dissous (R= -0,868) et à la salinité(R=
-0,944) ; mais si la teneur en oxygène dissous croît, la
conductivité, les solides totaux dissous et à la salinité
décroissent. A travers l'annexe 7, il est révélé
aussi que l'oxygène dissous croît avec le pH (R= 0,977). On y
remarque aussi que la couleur est fortement corrélée avec les MES
(R= 0,971) et la turbidité (R= 0,973). La salinité quant à
elle s'accentue lorsque le milieu devient de plus en plus conducteur (R=
0,921). Par ailleurs, on constate que le pH devient élevé aux
endroits profonds (R= 0,738). On remarque que la conductivité diminue
lorsque l'oxygène dissous, la transparence, les MES, la turbidité
et la couleur croissent.
3.2.5. Relation taille-poids des poissons
L'étude de la relation taille-poids des poissons
échantillonnés, a révélé que seulement, les
66% d'eux ont des coefficients d'allométrie inférieurs à
3. Ce qui soupçonne de manière générale que les
espèces halieutiques de la lagune côtière de
Gbèzoumè croissent plus en taille qu'en poids. Cette remarque
nous confirme les résultats des conditions écologiques et de
l'état de trophie dans les quels vivent ces espèces
halieutiques.
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
53
Conclusion générale et perspectives
54
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
La présente étude est menée sur l'aire
marine protégée de Gbèzoumè, dans la commune de
Ouidah (Bénin) dans le dernier trimestre de l'année 2011. Elle a
pour objectifs spécifiques la connaissance de l'évolution des
paramètres physico-chimiques, l'abondance et la diversité du
plancton, et enfin la diversité ichtyologique des consommateurs
secondaires. Au terme de nos recherches, nous avons abouti aux résultats
suivants :
> Les nutriments responsables de l'eutrophisation tels que
les ions nitrites, nitrates et phosphates ont affiché des teneurs
moyennes respectivement supérieures à 0,11 mg/L, 0,52 mg/L et
0,75 mg/L ;
> La chlorophylle a dosée au niveau du phytoplancton
a excédé en moyenne la concentration de 21,6 mg/L ;
> Les valeurs des températures enregistrées
étant comprises entre 24 et 350C, sont bonnes aux
espèces piscicoles selon Abou (2001) ;
> La salinité se trouve dans l'intervalle [0,1 ; 1]
bien que ce milieu soit proche de la mer ;
> Le pH quant à lui est bon pour l'aquaculture car
situé entre 6,5 et 9, selon Kanangire (2001).
> L'étude de la relation taille-poids des poissons a
révélé par ailleurs que seulement les 66% des 23
espèces échantillonnées ont des coefficients
d'allométrie inférieurs à 3. Cela montre que les
espèces halieutiques de la lagune côtière de
Gbèzoumè croissent plus en taille qu'en poids.
Grâce à la grille de lecture de la colonne d'eau
(Tableau 3), nous avons pu diagnostiquer que l'aire marine de
Gbèzoumè est eutrophe. L'eutrophisation est un problème
auquel est confronté ce milieu. C'est d'ailleurs un problème qui
touche toute la planète terre. Le cas de la lagune côtière
de Gbèzoumè est plus ou moins inquiétant. Toutefois, il
est à reconnaître que l'aire marine de Gbèzoumè
regorge des ressources qu'il faut protéger. Nous suggérons que
d'autres études soient effectuées afin de :
> Etudier la bathymétrie, la mesure par
échosondage des profondeurs marines, pour déterminer la
topographie du sol du milieu aquatique étudié ;
55
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
> Etudier les sources, les teneurs et les effets des traces
métalliques toxiques sur les produits halieutiques dans l'aire marine de
Gbèzoumè
> Etudier les apports en éléments nutritifs
au niveau du bassin versant et dans les sédiments ;
> Comparer les teneurs des polluants chimiques dans la
colonne d'eau et dans les sédiments.
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
56
Références bibliographiques
57
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas de
Gbèzoumè dans la commune de Ouidah.
Abou Y., 2001. Effet d'une couverture
d'Azolla LAM sur la production piscicole du tilapia Oreochromis
niloticus (L.) en étangs dans la banlieue de Cotonou
(Bénin). Mémoire présenté pour l'obtention du
diplôme d'études complémentaire en éco-technologie
des eaux continentales. Facultés Universitaires Notre Dame de la Paix.
Faculté des Sciences. Namur-Belgique. 85p.
Afnor, 1994. Qualité des sols, AFNOR
Edition, 862 p.
Akitikpa I. B., 2002. Essai de mise au point
de formule alimentaires à base d'Azolla et de sous-produits
locaux pour la pisciculture rurale. Mémoire pour l'obtention du
diplôme d'ingénieur des travaux. C.P.U./ U.A.C. 96p.
Aminot A., Guillaud J.F. & Le Guellec A.M., 1990.
Suivi à long terme des apports de matières organiques et
nutritives par les effluents urbains de Morlaix. IFREMER DRO.EL 9030: 42 p.
Amoros C., 1973. Evolution des populations de
cladocères et de copépodes dans trois étangs piscicoles de
la Dombes. Annis limnol., 9, 2: 135-155.
Amoros C., 1984. Introduction pratique
à la systématique des organismes des eaux continentales
françaises. Université Claude-Bernard-Lyon I. Extrait du bulletin
mensuel de la société Linnéenne de Lyon, 53e
année, no 3 et 4.
Arfi R. et Patriti G., 1987. Impact d'une
pollution urbaine sur la partie zooplanctonique d'un
système néritique (Marseille-Cortiou).
Hydrobiology, vol. 144, p. 11-23.
Badts V et Bertrand J., 2010. Guide de la
mensuration des poissons, mollusques, crustacés, reptiles et
mammifères marins en halieutique - V1.4.
Balvay G., 1990. Long-term changes in
zooplankton abundance and water transparency in Lake Geneva. Arch.Hydrobiology,
vol. 207, p. 31-36.
Camargo J. A., Alonso A. et De La Puente M. 2004.
Multimetric assessment of nutrient enrichment in impounded rivers
based on benthic macroinvertebrates. Environmental Monitoring and Publishers,
96, 233-249.
Cemagref, Protocole
standardisé-phytoplancton-septembre 2009.
Cózar A., Bergamino N., Mazzuoli S., Azza N.,
Bracchini L. et Dattilo A.M., 2007. Relationships between wetland
ecotones and inshore water quality in the Ugandan coast of Lake Victoria,
Wetlands Ecol Manage 15 (6) pp. 499-507.
Dodson S. I., Frey D. G., 2000. Cladocera and
other branchiopoda. In: Thorp, J. H., Covich, A. P. (Eds): Ecology and
Classification of North America Freshwater Invertebrates. Academic Press,
London, pp 850-914.
58
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
Dupré N., 2002. Rôle des rejets
des stations d'épuration dans l'eutrophisation des lagunes du
Languedoc-Roussillon - Rapport de DES, pp.27-31.
Edmondson W.T., 1970. Phosphorus, nitrogen
and algae in Lake Washington after diversion of sewage. Science 169:
690-691.
Gagnon et Pedneau J., 2006. Survol Benthos,
guide du volontaire, programme de surveillance volontaire des petits cours
d'eau. CVRB, Québec. Canada.
Garnier J. et Lavandier P., 1995. Le cycle du
carbone in Limnologie générale, Masson, Paris, 688-704.
Gominan O. S. A., 1999. Contribution à
l'étude de l'écologie et de la biologie des espèces de
poisson du genre Clarias (Clariidae) dans la vallée de
l'Ouémé : Habitat, Alimentation, Croissance et Reproduction.
Thèse d'Ingénieur Agronome. FSA/UNB, 110p.
Guyard André, 1997. Cours
d'hydrobiologie (DESS Eaux continentales, pollutions et aménagements).
10p.
Haberman J., 1998. Zooplankton of lake
Vörtjäv. Limnology, vol. 28, p. 49-65.
Ifremer, 2000. Mise à jour
d'indicateurs du niveau d'eutrophisation des milieux lagunaires
méditerranéens - Rapport final-09-2000, Tome I - 236p, Tome II -
196p.
Illies 1978 in Diguingue D., 2001. Etude des
macroinvertébrés benthiques et de l'alimentation d'espèces
de poissons en relation avec le rétrécissement saisonnier de la
surface d'eau du lac de barrage de la comoé. Mémoire de fin
d'études présenté en vue de l'obtention du diplôme
d'ingénieur du développement rural option: eaux et forets.
Université polytechnique de Bobo-Dioulasso (U.P.B). Burkina Faso.
83p.
Juget J.F., Lafont M., Mouthon J. et Gerdeaux D.,
1995. Structure des communautés benthiques et pisciaires in
Limnologie générale, Masson, Paris, 494-513.
Kanangire C. K., 2001. Effet de l'alimentaire
des poisons avec Azolla sur l'écosystème agro-piscicole
au Rwanda. Dissertation présentée en vue de l'obtention du grade
de Docteur en sciences. Faculté Universitaire Notre Dame de la Paix.
Faculté des sciences. Namur-Belgique. 220p.
Kestemont P., Micha J.-C. et Falter U., 1989.
Les méthodes de production d'alevins de Tilapia
nilotica. ADCP/ REP/89/46, PNUD-FAO, Rome, 132p.
La Jeunesse I., 2001. Etude
intégrée dynamique du phosphore dans le système du
bassin-versant. Lagune de Thau - Thèse Doctorat, 290 p.
59
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
Labroue L., Capblancq J. et Dauta A., 1995.
Cycle des nutriments : l'azote et le phosphore in Limnologie
générale, Masson, Paris, 727-764.
Lacaze J.C., 1996. L'eutrophisation des eaux
marines et continentales -Ellipses, pp. 10-59 et pp. 140-162.
Lee S. J., Park J. H. et Ro T. H. 2006.
Ephemeropteran community structure and spatial stability of local populations
of the major species group in the Keumho River. Entomological Research, 36
:98-106.
Mama D., Boukari M. Alassane A., Azokpota E., Orou
Pété S. et Changotadé O., 2009. Evaluation de
l'incidence des activités de teinture sur l'eau et les organiques aux
abords de la lagune de Cotonou. Rapport d'étape LHA/FAST/UAC.
Mama D., 2010. Méthodologie et
résultats du diagnostic de l'eutrophisation du lac Nokoué
(Bénin). Thèse de doctorat de l'université de Limoges
(France). 157p.
Masclaux H. et Schmaltz L., 2006. Effets de
la qualité nutritionnelle sur les traits d'histoire de vie de deux
espèces littorales de Cladocères : Scapholeberis mucronata et
Simocephalus vetulus. Biologos 5: 15-24.
Meglitsch P.A., 1973. Zoologie des
invertébrés. Doin, Paris, 3 vol.
Melard C., 1999. Choix des sites,
qualité de l'eau et systèmes d'élevage en aquaculture.
CEFRA. Université de Liège-Station d'Aquaculture de Tihange.
80p.
Meybeck M., 1995. Les lacs et leur bassin in
Limnologie générale, Masson, Paris, 6-59.
Ministère des pêches et des océans
du Canada, 2004. Modèle de formation pour utilisateurs
d'animaux. Partie 5: Mensuration et pesée des poissons. 5 : 1-9
Moss B., Backer T., Stephen D., Williams A., Balayla
D., Beklioglu M. et Carvalho L., 2005. Consequences of reduced
nutrient loading on a lake system in a lowland catchment: Deviations from the
norm? Freshwater biology, 50, 1687- 1705.
Nogrady T., Wallace R. L., Snell T. W., 1993.
Rotifera: Vol. 1: Biology, Ecology and Systematics. SBP Academic
Publishers, The hague phytosanitaires : apports de la modélisation -
Ingénieries EAT, n°6, pp 3-15.
Ogutu -Ohwayo R., Hecky R.E., Cohen S.A. & Kauf
L., 1997. Human Impacts on the African Great Lakes. Environmental
Biology of Fishes 50, 117-137.
Parinet B., Lhote A. et Legube B., 2004.
Principal Component Analysis: an appropriate tool for water quality
evaluation and management - Application to A tropical lake system. Ecological
Modelling 178, 295 - 311.
60
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
Pouomogne V. 1998. Pisciculture en Milieu
Tropical Africain. Comment produire du poisson à coût
modéré. Presse Universitaire d'Afrique, Yahoundé. 263p.
Pourriot R. et Meybeck M. 1995. Limnologie
générale, Masson Edition, 956p.
Pourriot R. Capblancq J., Champ P. et Meyer J.A.,
1982. Ecologie du plancton des eaux continentales. Masson, Paris, 198
p.
Pourriot R. et Francez A.-J., 1986.
Introduction pratique à la systématique des organismes
des eaux continentales françaises. Extrait du bulletin mensuel de la
Société Linnéenne de Limnologie de Lyon. 55e
année, n° 5. Publié sous l'égide de l'association
Française de Limnologie (avec le concours du Ministère de
l'environnement), 5, 1- 37.
Ramade F., 1981. Eléments
d'écologie : écologie appliquée. 4ème
édition, Paris, Ed. Mc Graw Hill, 578 p.
Ramade F., 1994. Eléments
d'écologie - Ecologie fondamentale, 2ème édition,
Ediscience Internationale, Paris, 488-492.
Servais P., Dufour P., Caumette P., Hirschler A. et
Matheron R., 1995. L'activité bactérienne in Limnologie
générale, Masson, Paris, 253-295.
Shiel R. J., 1995. A guide to identification
of rotifers, cladocerans and copepods from Australian Inland water.
Édit. CRCFE, Identification guide 3, 144p.
Smith V.H., Tilman G.D. et Nekola J.C., 1999.
Eutrophication: impacts of excess nutrient inputs on freshwater,
marine and terrestrial ecosystems. Environ. Poll. 100: 179-196.
Triffault - Bouchet G., 2004. Effets sur les
écosystèmes aquatiques lentiques des émissions de
polluants provenant de différents modes de
valorisation/élimination de déchets. Application à des
mâchefers d'U.I.O.M. (Usine d'incinération d'ordures
ménagères) et à des boues de dragage de canaux.
Présentée en vue d'obtenir le grade de Docteur de
l'Université de Savoie. Spécialité : Biologie et Biochimie
Appliquées. 309p.
Trinquier C., 2009. Le risque
d'eutrophisation des lagunes Méditerranéennes : Le cas de la
lagune de Thau (Hérault). Master 1 professionnel Gestion des
catastrophes et des risques naturels. Université Paul Valéry -
Montpellier III UFR III : Sciences Humaines et Sciences de l'Environnement.
Département de Géographie - Aménagement. 121p.
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas
de
Gbèzoumè dans la commune de Ouidah.
61
Annexes
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas de
Gbèzoumè dans la commune de Ouidah.
Annexe 1 : Suivi de la qualité des eaux de la
lagune côtière de Gbèzoumè
|
PARAMETRES
|
T°C
|
|
|
Cond uS/cm
|
TDS mg/L
|
Salinité g/L
|
pH
|
|
O2diss mg/L
|
|
Campagne
|
C1
|
|
C3
|
C1
|
|
C3
|
C1
|
|
C3
|
C1
|
|
C3
|
C1
|
|
C3
|
C1
|
|
C3
|
|
E1
|
29,9
|
30
|
29,6
|
1490
|
403
|
688
|
623
|
167
|
335
|
0,6
|
0,15
|
0,38
|
6,75
|
6,72
|
7,11
|
1,33
|
2,3
|
2,86
|
|
E2
|
29,9
|
29,9
|
|
1680
|
475
|
|
705
|
197
|
|
0,7
|
0,21
|
|
6,85
|
6,66
|
|
0,08
|
0,2
|
|
|
E3
|
29,8
|
31,3
|
|
2140
|
410
|
|
900
|
168
|
|
1
|
0,2
|
|
6,86
|
6,35
|
|
0,07
|
0,1
|
|
|
E4
|
31,4
|
|
|
1430
|
|
|
600
|
|
|
0,5
|
|
|
6,8
|
|
|
0,33
|
|
|
|
E5
|
30,4
|
30,5
|
30,9
|
1144
|
366
|
565
|
480
|
150
|
277
|
0,1
|
0,12
|
0,25
|
7,6
|
7,7
|
7,82
|
4,2
|
6
|
5,18
|
|
E6
|
30,6
|
31,2
|
30,6
|
1100
|
370
|
572
|
473
|
152
|
280
|
0,3
|
0,12
|
0,26
|
7,37
|
7,9
|
7,85
|
4,1
|
5,8
|
7,85
|
|
E7
|
30,4
|
30,7
|
29,9
|
1120
|
378
|
563
|
471
|
155
|
276
|
0,3
|
0,13
|
0,26
|
7,16
|
8,2
|
7,58
|
4,4
|
5,9
|
7,56
|
|
E8
|
30,5
|
30,7
|
30,5
|
1130
|
440
|
572
|
460
|
181
|
572
|
0,3
|
0,18
|
0,25
|
7,33
|
7,5
|
7,8
|
4,43
|
2,5
|
7,8
|
Annexe 2: Suivi de la qualité des eaux de la
lagune côtière de Gbèzoumè
|
PARAMETRES
|
|
Prof m
|
|
Transparence (cm)
|
MES mg/L
|
Turb FAU
|
Couleur PtCo
|
Chl a g/L
|
|
|
Campagne
|
C1
|
|
C3
|
C1
|
|
C3
|
C1
|
|
C3
|
C1
|
|
C3
|
C1
|
|
C3
|
C1
|
|
C3
|
|
E1
|
1
|
0,8
|
0,4
|
15
|
10
|
5
|
18
|
41
|
63
|
28
|
56
|
87
|
280
|
286
|
670
|
45
|
13,5
|
34,2
|
|
E2
|
0,5
|
0,3
|
0
|
10
|
8
|
|
20
|
54
|
|
32
|
72
|
|
387
|
342
|
|
39,5
|
8,44
|
|
|
E3
|
0,5
|
0,3
|
0
|
15
|
8
|
|
12
|
39
|
|
19
|
62
|
|
270
|
360
|
|
9,9
|
10,1
|
|
|
E4
|
0,5
|
0
|
0
|
15
|
0
|
|
16
|
|
|
18
|
|
|
215
|
|
|
7,2
|
|
|
|
E5
|
1,3
|
1
|
0,8
|
25
|
12
|
9
|
27
|
44
|
67
|
44
|
65
|
88
|
410
|
289
|
640
|
13,5
|
14,4
|
10,8
|
|
E6
|
4,5
|
4
|
3
|
30
|
12
|
8
|
30
|
43
|
69
|
42
|
66
|
90
|
422
|
280
|
770
|
12,6
|
101
|
19,8
|
|
E7
|
2
|
1,5
|
1
|
30
|
13
|
8
|
27
|
43
|
62
|
47
|
63
|
88
|
411
|
299
|
640
|
13,5
|
7,2
|
23,4
|
|
E8
|
2
|
1,5
|
1
|
30
|
12
|
8
|
26
|
37
|
65
|
43
|
60
|
77
|
424
|
269
|
480
|
15,3
|
16,2
|
16,2
|
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas de
Gbèzoumè dans la commune de Ouidah.
Annexe 3 : Suivi de la qualité des eaux de la
lagune côtière de Gbèzoumè
|
PARAMETRES
|
DBO5 mg/L
|
|
|
DCO mg/L
|
NH4 mg/L
|
|
NO2 mg/L
|
NO3 mg/L
|
|
PO4 mg/L
|
|
|
Campagne
|
C1
|
|
C3
|
C1
|
|
C3
|
C1
|
|
C3
|
C1
|
|
C3
|
C1
|
|
C3
|
C1
|
|
C3
|
|
E1
|
14
|
15
|
15
|
18
|
20
|
19
|
0,21
|
0,124
|
0,6
|
0,14
|
0,04
|
0,01
|
0,91
|
0,12
|
0,11
|
1,07
|
0,43
|
0,04
|
|
E2
|
13
|
13
|
|
16
|
18
|
|
1,48
|
0,163
|
|
0,21
|
0,01
|
|
0,91
|
0,02
|
|
0,21
|
0,07
|
|
|
E3
|
18
|
9
|
|
24
|
13
|
|
0,26
|
0,212
|
|
0,11
|
0,01
|
|
0,91
|
0,01
|
|
0,34
|
0,02
|
|
|
E4
|
12
|
|
|
16
|
|
|
0,2
|
|
|
0,21
|
|
|
0,91
|
|
|
1,13
|
|
|
|
E5
|
6
|
7
|
13
|
12
|
11
|
17
|
0,24
|
0,118
|
0,3
|
0,22
|
0,18
|
0,02
|
0,91
|
0,2
|
0,21
|
2
|
0,53
|
0,51
|
|
E6
|
17
|
7
|
13
|
23
|
12
|
17
|
0,27
|
0,117
|
2,36
|
0,23
|
0,17
|
0,01
|
2,27
|
0,15
|
0,2
|
2
|
0,54
|
0,53
|
|
E7
|
10
|
6
|
4
|
14
|
11
|
5
|
0,26
|
0,111
|
2,37
|
0,22
|
0,23
|
0,01
|
0,91
|
0,14
|
0,25
|
1,96
|
0,47
|
0,51
|
|
E8
|
9
|
8
|
7
|
13
|
13
|
9
|
0,26
|
0,139
|
1,33
|
0,22
|
0,02
|
0,02
|
0,91
|
0,04
|
0,22
|
2,05
|
0,2
|
0,48
|
|
PARAMETRES
|
PT mg/L
|
|
NTmg/L
|
|
|
Campagne
|
C1
|
|
C3
|
C1
|
|
C3
|
|
E1
|
0,4
|
0,14
|
0
|
0,4
|
0,14
|
0,5
|
|
E2
|
0,1
|
0,02
|
|
1,72
|
0,13
|
|
|
E3
|
0,15
|
0,01
|
|
0,41
|
0,18
|
|
|
E4
|
0,4
|
|
|
0,41
|
|
|
|
E5
|
0,7
|
0,16
|
0,2
|
0,47
|
0,21
|
0,3
|
|
E6
|
0,7
|
0,16
|
0,2
|
0,8
|
0,18
|
1,88
|
|
E7
|
0,67
|
0,14
|
0,2
|
0,47
|
0,2
|
1,9
|
|
E8
|
0,7
|
0,06
|
0,2
|
0,47
|
0,13
|
1,1
|
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas de
Gbèzoumè dans la commune de Ouidah.
Annexe 4 : Abondance du zooplancton
|
Points de
prélèvement
|
na
|
nb
|
v (L)
|
V (L)
|
Abondance
(Nombre
d'algues par
litre)
|
|
E1
|
3,18
|
1,93
|
0,5
|
245,3125
|
1301910,828
|
|
E5
|
4,17
|
4,37
|
0,5
|
245,3125
|
2175796,178
|
|
E6
|
2,95
|
1,88
|
0,5
|
245,3125
|
1230573,248
|
|
E7
|
2,5
|
2,83
|
0,5
|
245,3125
|
1357961,783
|
|
E8
|
3,81
|
2,98
|
0,5
|
245,3125
|
1729936,306
|
Annexe 5 : Abondance du phytoplancton
|
Points de
prélèvement
|
Ordres
|
n
|
v (L)
|
V (L)
|
Abondance (Nombre d'individus par litre)
|
|
E1
|
Rotifères
|
247
|
0,5
|
245,3125
|
5,02
|
|
Cladocères
|
208
|
0,5
|
245,3125
|
4,24
|
|
Copépodes
|
462
|
0,5
|
245,3125
|
9,41
|
|
E5
|
Rotifères
|
612
|
0,5
|
245,3125
|
12,47
|
|
Cladocères
|
201
|
0,5
|
245,3125
|
4,1
|
|
Copépodes
|
682
|
0,5
|
245,3125
|
13,9
|
|
E6
|
Rotifères
|
200
|
0,5
|
245,3125
|
4,07
|
|
Cladocères
|
90
|
0,5
|
245,3125
|
1,83
|
|
Copépodes
|
321
|
0,5
|
245,3125
|
6,54
|
|
E7
|
Rotifères
|
220
|
0,5
|
245,3125
|
4,48
|
|
Cladocères
|
199
|
0,5
|
245,3125
|
4,06
|
|
Copépodes
|
501
|
0,5
|
245,3125
|
10,21
|
|
E8
|
Rotifères
|
312
|
0,5
|
245,3125
|
6,36
|
|
Cladocères
|
210
|
0,5
|
245,3125
|
4,28
|
|
Copépodes
|
615
|
0,5
|
245,3125
|
12,53
|
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas de
Gbèzoumè dans la commune de Ouidah.
Annexe 6 : Corrélations entre les
différents paramètres chimiques
|
Chla
|
DCO
|
NH4 +
|
NO2 -
|
NO3 -
|
NT
|
3-
PO4
|
PT
|
DBO5
|
|
Chla
|
1
|
.393
|
.548
|
-.213
|
.213
|
.534
|
-.040
|
-.077
|
.373
|
|
DCO
|
|
1
|
-.306
|
-.355
|
.257
|
-.226
|
-.567
|
-.551
|
.989(**)
|
|
NH4 +
|
|
|
1
|
.083
|
.055
|
.972(**)
|
.039
|
.003
|
-.280
|
NO2-
|
|
|
|
1
|
.706
|
.228
|
.717(*)
|
.736(*)
|
-.348
|
NO3-
|
|
|
|
|
1
|
.209
|
.466
|
.490
|
.235
|
|
|
NT
|
|
|
|
|
|
1
|
.045
|
.016
|
-.195
|
|
PO43-
|
|
|
|
|
|
|
1
|
.998(**)
|
-.595
|
|
PT
|
|
|
|
|
|
|
|
1
|
-.577
|
|
DBO5
|
|
|
|
|
|
|
|
|
1
|
* Correlation is significant at the 0.05 level (2-tailed) **
Correlation is significant at the 0.01 level (2-tailed).
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas de
Gbèzoumè dans la commune de Ouidah.
Annexe7: Corrélations entre les différents
paramètres physiques
|
Temp
|
Cond
|
TDS
|
Salinité
|
pH
|
O2diss
|
Profon
|
Trans
|
MES
|
Turb
|
Coul
|
|
Temp
|
1
|
.338
|
.381
|
.034
|
.149
|
.048
|
.152
|
.022
|
-.483
|
-.526
|
-.438
|
|
Cond
|
|
1
|
.961(**)
|
.921(**)
|
_.865(**)
|
_.911(**)
|
-.676
|
_.850(**)
|
_.971(**)
|
_.955(**)
|
_.939(**)
|
|
TDS
|
|
|
1
|
.879(**)
|
_.821(*)
|
_.868(**)
|
-.666
|
_.778(*)
|
_.963(**)
|
_.955(**)
|
_.975(**)
|
|
Salinité
|
|
|
|
1
|
_.958(**)
|
_.944(**)
|
-.643
|
_.812(*)
|
_.845(**)
|
_.795(*)
|
_.794(*)
|
|
pH
|
|
|
|
|
1
|
.977(**)
|
.738(*)
|
.905(**)
|
.767(*)
|
.736(*)
|
.754(*)
|
|
O2diss
|
|
|
|
|
|
1
|
.770(*)
|
.930(**)
|
.809(*)
|
.790(*)
|
.813(*)
|
|
Profon
|
|
|
|
|
|
|
1
|
.725(*)
|
.647
|
.604
|
.723(*)
|
|
Trans
|
|
|
|
|
|
|
|
1
|
.763(*)
|
.789(*)
|
.774(*)
|
|
MES
|
|
|
|
|
|
|
|
|
1
|
.987(**)
|
.971(**)
|
|
Turb
|
|
|
|
|
|
|
|
|
|
1
|
.973(**)
|
|
Coul
|
|
|
|
|
|
|
|
|
|
|
1
|
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas de
Gbèzoumè dans la commune de Ouidah.
Annexe 8: Corrélation entre les différents
paramètres physico-chimiques
|
Temp
|
Cond
|
TDS
|
Salinité
|
pH
|
O2diss
|
Pronf
|
Turb
|
Coul
|
Chla
|
DCO
|
NH4 +
|
NO2 -
|
NO3 -
|
3-PO4
|
DBO5
|
|
Temp
|
1
|
.338
|
.381
|
.034
|
.149
|
.048
|
.152
|
-.526
|
-.438
|
-.329
|
-.142
|
-.279
|
.703
|
.759(*)
|
.657
|
-.190
|
|
Cond
|
|
1
|
.961(**)
|
.921(**)
|
_.865(**)
|
_.911(**)
|
-.676
|
_.955(**)
|
_.939(**)
|
-.469
|
.506
|
-.499
|
.156
|
.353
|
-.361
|
.548
|
|
TDS
|
|
|
1
|
.879(**)
|
_.821(*)
|
_.868(**)
|
-.666
|
_.955(**)
|
_.975(**)
|
-.522
|
.406
|
-.511
|
.098
|
.298
|
-.311
|
.455
|
|
Salinité
|
|
|
|
1
|
_.958(**)
|
_.944(**)
|
-.643
|
_.795(*)
|
_.794(*)
|
-.298
|
.647
|
-.382
|
-.194
|
.134
|
-.649
|
.693
|
|
pH
|
|
|
|
|
1
|
.977(**)
|
.738(*)
|
.736(*)
|
.754(*)
|
.249
|
-.690
|
.439
|
.277
|
.001
|
.709(*)
|
_.754(*)
|
|
O2diss
|
|
|
|
|
|
1
|
.770(*)
|
.790(*)
|
.813(*)
|
.322
|
-.648
|
.464
|
.154
|
-.070
|
.660
|
-.705
|
|
Pronf
|
|
|
|
|
|
|
1
|
.604
|
.723(*)
|
.727(*)
|
-.144
|
.611
|
.117
|
.353
|
.475
|
-.212
|
|
Turb
|
|
|
|
|
|
|
|
1
|
.973(**)
|
.509
|
-.374
|
.546
|
-.327
|
-.475
|
.095
|
-.421
|
|
Coul
|
|
|
|
|
|
|
|
|
1
|
.633
|
-.270
|
.566
|
-.237
|
-.297
|
.170
|
-.328
|
|
Chla
|
|
|
|
|
|
|
|
|
|
1
|
.393
|
.548
|
-.213
|
.213
|
-.040
|
.373
|
|
DCO
|
|
|
|
|
|
|
|
|
|
|
1
|
-.306
|
-.355
|
.257
|
-.567
|
.989(**)
|
|
NH4 +
|
|
|
|
|
|
|
|
|
|
|
|
1
|
.083
|
.055
|
.039
|
-.280
|
NO2-
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
.706
|
.717(*)
|
-.348
|
NO3-
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
.466
|
.235
|
|
|
PO43-
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
-.595
|
|
DBO5
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas de
Gbèzoumè dans la commune de Ouidah.
Evaluation de la chaîne trophique d'une aire marine
protégée en relation avec sa physico-chimie : cas de
Gbèzoumè dans la commune de Ouidah.



