
Institut National de la Jeunesse, de L'Education
Physique et du Sport(INJEPS)
Université D'Abomey-Calavi (UAC)
MEMOIRE
POUR L'OBTENTION DE LA LICENCE PROFESSIONNELLE
EN
SCIENCES ET TECHNIQUES DES ACTIVITES PHYSIQUES ET
SPORTIVES
(STAPS)
OPTION : Education Physique et Sportive (EPS)
Activité anti-oedémateuse de l'extrait
aqueux des
feuilles de Petiveria alliacea ; de moringa
oleifera et de Ocimum gratissimum
Réalisé et Présenté par
:
GBEDINHESSI Dona Géraud Enock
Encadré par : Sous la Supervision du
Dr Wilfrid K. D-D AGBODJOGBE Pr Pierre H. DANSOU
Assistant Professeur titulaire CAMES
Décembre 2017
DEDICACE
A
Mon Père Thomas F. GBEDINHESSI et à ma
Mère Denise G. ALOHOUTADE

II
REMERCIEMENTS
Au Directeur du Laboratoire de la Physiologie de l'effort
(LAPEF) de l'INJEPS, Professeur Pierre H. DANSOU, Titulaire de
CAMES, pour tout ce qu'il a fait pour l'institution et pour notre formation en
particulier ;
Au Docteur Wilfrid K. D-D AGBODJOGBE,
Enseignant Chercheur à l'Institut National de la Jeunesse de l'Education
Physique et du Sport (INJEPS) qui a dirigé ce travail. L'accueil, la
générosité, l'encouragement, la rigueur et le soutien dont
vous avez toujours fait preuve durant le suivi de ce travail nous ont
énormément fascinés. Vous étiez pour moi un
modèle, soyez rassuré ici de ma reconnaissance et mon estime ;
Au Docteur Alban HOUGBEME, pour sa
disponibilité ses conseils et la qualité du suivi. Recevez toute
ma gratitude et ma reconnaissance ;
Au Doctorant Clément GANDONOU du
Laboratoire de Pharmacognosie et des Huiles Essentielles pour la franche
collaboration dont il a fait preuve ;
Au personnel administratif de l'INJEPS dirigé par le
Professeur Kossivi ATTIKLEME, Titulaire de CAMES ;
A tous les enseignants de l'INJEPS qui n'ont
ménagé aucun effort pour contribuer à notre formation ;
A mes Frères et Soeurs, recevez ce
mémoire comme preuve de ma profonde gratitude pour les soutiens et
efforts consentis durant ma formation ;
A tous les stagiaires de l'annexe du Laboratoire de
Pharmacognosie et des Huiles Essentielles sis à Porto-Novo et surtout
OUSSA ZANNOU Noëlie pour leur franche collaboration et le
tutorat sans lesquels ce document ne serait réalisé ;
A nos collègues et amis pour les sympathiques moments
que nous avons passés ensemble. La route est longue mais
l'arrivée sera belle ;
Mes remerciements sont particulièrement adressés
aux honorables membres du jury qui ont accepté apprécier ce
document afin de le rendre plus utile pour la communauté
scientifique.
III
SOMMAIRE
LISTE DES SIGLES ET ABREVIATIONS . Iv
LISTE DES TABLEAUX v
LISTES DES FIGURES vi
LISTE DES PHOTOS . vii
INTRODUCTION 1
REVUE DE LITTERATURE 4
HYPOTHESES ET OBJECTIFS 18
CADRE, MATERIEL ET METHODES 20
RESULTATS 29
DISCUSSION . 34
CONCLUSION ET PERSPECTIVE . 37
REFERENCES 39
TABLE DES MATIERES . 45
ANNEXES a
iv
LISTE DES SIGLES
LAPEF : Laboratoire de la Physiologie de l'Effort
INJEPS : Institut National de la Jeunesse, de l'Education
Physique et du Sport
CBRST : Centre Béninois de la Recherche Scientifique et
Technique
V
LISTE DES TABLEAUX
Tableau I : Exemples de plantes
médicinales douées d'activités anti-inflammatoires . 10
Tableau II : Récapitulatif des
réactions spécifiques de chaque classe de composé
chimique
lors du screening phytochimique . 25
Tableau III : Échelle de toxicité
aigüe des produits chimiques 26
Tableau IV : Echelle de toxicité
aigüe de Hodge et Sterner .. 26
Tableau V : Résultats des analyses
phytochimiques .. 30
Tableau VI : Rendement de décoctions de
feuilles de Petiveria alliacea, de moringa
oleifera et de Ocimum
gratissimum...........................................................................
31
Tableau VII : Effet de l'extrait aqueux des
feuilles de : Petiveria alliaccea, Moringa oleifera et Ocimum gratissimum
sur l'oedème de la patte de rat induit par le formol
1% 33
vi
LISTES DES FIGURES
Figure 1 : Mécanisme d'action des
glucocorticoïdes 9
Figure 2 : Mécanisme d'action des AINS
. 9
Figure 3 : Carte de la ville de Porto-Novo
21
VII
LISTES DES PHOTOS
Photo 1 : la feuille de Petiveria
alliacea 11
Photo 2 : la feuille de Moringa
Oléifera 14
Photo 3 : la Feuille de Ocimum Gratissimum
16
Photo 4 : Rat wistar . 23
INTRODUCTION
2
L'Organisation Mondiale de la Santé (OMS)
éprouve aujourd'hui d'énormes difficultés à couvrir
la santé pour tous, en raison de la persistance et la recrudescence des
maladies chroniques [1]. Parmi ces maladies chroniques, on peut citer les
maladies inflammatoires. L'inflammation est une réaction de
défense de l'organisme à diverses agressions qui peuvent
être d'origine physique, chimique, biologique (réponse
immunitaire) ou infectieuse [2]. Tout organisme normal peut alors souffrir de
l'inflammation. Elle peut se manifester par divers symptômes tels que
l'oedème (tuméfaction ou tumeur), la douleur et la chaleur ou la
fièvre. Pour le traitement, les anti-inflammatoires
stéroïdiens (glucocorticoïdes) et non stéroïdiens
(AINS) comme l'aspirine sont largement prescrits en raison de leur
efficacité dans la prise en charge de la douleur, de la fièvre,
de l'inflammation et des troubles rhumatismaux [2].
Cependant, leur utilisation thérapeutique à long
cours est souvent associée à des effets indésirables tels
que les ulcères gastro-intestinaux et l'insuffisance rénale [3].
Ces effets indésirables sont généralement liés
à l'inhibition des isoenzymes cyclo-oxygénases (COX1 et COX 2)
par les AINS classiques. La COX1 est constitutive et joue un rôle
physiologique en maintenant l'intégrité des tissus, tandis que la
COX2 est inductible, sa synthèse est stimulée par le TNF et
l'interleukine1. L'apparition des AINS sélectifs de la COX2
appelés coxibs vient réduire les effets secondaires
gastrointestinaux, mais ils induisent un risque cardio vasculaire [4].
Dans ce contexte, le recours aux ressources naturelles et plus
particulièrement aux plantes médicinales devient une importante
alternative à explorer avant de découvrir des médicaments
efficaces à moindre effets secondaires [5].
Plusieurs plantes anti-inflammatoires ont été
identifiées telles que Cymbopogon citratus (DC.) Stapf,
Eucalyptus camaldulensis Dehn, Eucalyptus citriodora, Dissotis
rotundifolia, Cissus quadriagularis, Sterculia setigera Del, Aframomum
melegueta K. Schum, Citrus aurantifolia Christm et Panzer [6]. Le
répertoire de ces plantes a été élargi et a
ressorti trois plantes plus utilisées par la population de la Commune de
Porto-Novo. Il s'agit de : Petiveria alliacea, de Moringa oleifera
et de Ocimum gratissimum.
Ces plantes pourraient être utilisées en lieu et
place des produits pharmaceutiques devenant de plus en plus chers pour la
population indigène. Malheureusement, malgré leur grande
utilisation par les populations, les feuilles de dPetiveria alliacea,
de Moringa oleifera et de Ocimum gratissimum ont fait
très peu, objet de travaux scientifiques au Bénin.
La présente étude a pour objectif de donner des
bases scientifiques à l'utilisation de ces trois plantes en
médecine traditionnelle.
3
De ce point de vue, nous nous posons la question de savoir si
ces plantes utilisées sont faiblement toxiques et ont réellement
un effet anti-oedémateuse ? Ainsi, se justifie l'importance de notre
étude sur l'activité anti-oedémateuse des feuilles de
Petiveria alliacea, de Moringa oleifera et de Ocimum
gratissimum.
La présente étude est organisée comme
suit : après l'introduction, nous aurons la revue de littérature
suivie des hypothèses et objectifs de travail, la description du
matériel et des méthodes, la présentation des
résultats et enfin la discussion suivie de la conclusion et
perspectives.
REVUE DE
LITTERATURE
5
L'ossature de cette revue de littérature se
présente : en primo la clarification des concepts et enfin, les
généralités sur les plantes utilisées comme anti
inflammatoire.
I. CLARIFICATION DES CONCEPTS
I.1. La Plante médicinale
Une plante est un organisme vivant qui utilise la
photosynthèse pour fabriquer sa propre nourriture en puisant dans le sol
et dans l'air les éléments nécessaires. Elle est
constituée de cellules dont leur taille et leur forme varient. La
plupart sont composées de racines, tiges, feuilles et d'écorces.
Ce sont des plantes à fleurs qui se reproduisent par graines.
L'utilisation de ces plantes en phytothérapie, améliore la
santé des populations [7].
I.2. La Phytothérapie
La phytothérapie, du grec «phyton» qui
signifie végétal et «therapein» ; soigner, est
étymologiquement l'art de soigner par les plantes. La
phytothérapie emploie les principes actifs végétaux
regroupant les substances végétales. Ainsi, un médicament
à base de plantes, ou phytomédicament, est un médicament
dont les substances actives sont exclusivement des substances
végétales ou préparations à base de plantes, seules
ou en association [8]. Les préparations à base des plantes
végétales sont des produits homogènes obtenus par
décoction, trituration, infusion, macération etc. [8].
I.3. La décoction
La décoction est l'extraction d'une substance contenue
dans une plante aromatique ou médicinale ayant une valeur
thérapeutique. Il faut faire bouillir la plante dans de l'eau pour
récupérer les principes actifs. On obtient ainsi une
décoction. Cette méthode est utilisée en herboristerie, en
cuisine et en brasserie (préparation de la bière) [9].
I.4. L'infusion
C'est la méthode d'extraction la plus courante.
L'infusion consiste à verser de l'eau bouillie à 80° sur des
feuilles ou des fleurs et à les laisser infuser pendant quelques
minutes. Cette méthode permet d'extraire les principes actifs des
plantes ainsi que leurs arômes [10].
I.5.
6
La macération
La macération est une méthode d'extraction
très semblable à celle de l'infusion mais celle-ci est plus
longue. Elle consiste à laisser reposer la ou les plantes dans un
liquide, de l'eau, de l'alcool, de l'huile ou même du vinaigre, afin d'en
extraire les principes actifs [9].
I.6. La trituration
La trituration, action de triturer, est une dispersion d'un
principe actif, réduit en poudre, dans l'excipient, qui est
lui-même pulvérulent ; poudre résultant de cette
opération [10]
I.7. L'inflammation
L'inflammation est une réponse adaptative
engendrée en réponse à des stimuli nocifs telle qu'une
infection ou une agression tissulaire. Elle nécessite une
régulation fine, généralement bénéfique,
elle conduit à l'élimination d'éventuels pathogènes
et au retour à l'homéostasie du tissu lésé. Une
régulation défectueuse peut engendrer des dommages
irréversibles. Une réponse insuffisante conduit à une
immunodéficience pouvant entrainée une infection secondaire ou
même un cancer. Mal contrôlée, l'inflammation peut conduire
à des dommages tissulaires irréversibles locaux ou
généralisés, parfois à un choc septique entrainant
dans les cas les plus graves le décès [11,12].
La réponse inflammatoire est associée au
système immunitaire, qui peut être divisé en deux branches
interconnectées. L'immunité innée, plus ancienne,
présente chez tout organisme pluricellulaire. Les cellules du
système immunitaire inné possèdent des récepteurs
PRR et des voies de signalisation hautement conservés pour
détecter et réagir face à une infection ou à une
blessure. La détection de ces signaux exogènes d'origine
microbienne, les PAMPs, ou endogènes, les alarmines [13], va conduire
à l'initiation de la cascade inflammatoire et à l'activation
d'une réponse immunitaire acquise ou adaptative [12,14]. La
réponse inflammatoire se déroule en quatre étapes : la
reconnaissance des signaux de danger, le recrutement de cellules sur le site
d'infection, l'élimination du pathogène et la résolution
de l'inflammation conduisant à un retour à l'homéostasie
et à la cicatrisation du tissu lésé [12]. En absence d'une
résolution, s'installe une inflammation chronique.
I.8. L'inflammation aigue
Il s'agit de la réponse immédiate à un
agent agresseur, de courte durée (quelques jours voire semaines) ou
d'installation souvent brutale et caractérisée par des
phénomènes
7
vasculoexsudatifs intenses. Les inflammations aiguës
guérissent spontanément ou avec un traitement, mais peuvent
laisser des séquelles si la destruction tissulaire est importante
[14].
I.9. L'inflammation chronique
Elle est définie par la présence de
lymphocytes, macrophages et plasmocytes dans les tissus. Dans de nombreux cas,
la réponse inflammatoire chronique peut persister pendant plusieurs mois
ou années. Elle est considérée comme être
causée par l'engagement persistant des réponses de
l'immunité innée et acquise, comme dans la polyarthrite
rhumatoïde, rejet de l'allogreffe chronique, dans la bérylliose et
dans l'inflammation granulomateuse. Il est prouvé que les macrophages
dans ces lésions produisent une série de médiateurs
pro-inflammatoires qui activent les fibroblastes pour fixer le collagène
et activer les autres macrophages et lymphocytes pour libérer des
médiateurs responsables des réponses inflammatoires.
L'inflammation chronique est initialement déclenchée par des
réponses vasculaires qui impliquent l'apparition de molécules
d'adhésion sur la surface des cellules endothéliales qui vont
spécifiquement entrainer l'adhésion des lymphocytes et des
monocytes, et permettent leur transmigration dans le compartiment
extravasculaire [14]. Tout comme dans la réponse inflammatoire
aiguë, les lymphocytes et les monocytes subissent un processus
d'activation qui favorise l'adhérence et la transmigration de ces
cellules dans le compartiment extravasculaire. En tout type de réponse
inflammatoire, les différences entre les types de molécules
d'adhésion exprimées sur les cellules endothéliales
détermineront le type de leucocytes qui migrent [14].
I.10. Mécanisme d'installation de
l'oedème
Fuite de liquide du compartiment vasculaire vers le compartiment
interstitiel, due à :
- une augmentation de la perméabilité capillaire
(ex : choc septique, choc anaphylactique)
- une augmentation de la pression hydrostatique capillaire
(ex : insuffisance cardiaque)
- une baisse de la pression oncotique ou osmotique plasmatique
(ex : hypoalbuminémie par
dénutrition)
- une obstruction régionale lymphatique [15]
I.11. Pathologies inflammatoires
De nombreuses maladies inflammatoires sont liées
à des mécanismes considérés comme dysimmunitaires,
à savoir les maladies auto-immunes systémiques et
localisées, les maladies auto-inflammatoires, les affections
inflammatoires de mécanisme indéterminé notamment, des
affections iatrogènes ou paranéoplasiques dont le
mécanisme n'est pas auto-immun [14].
8
I.12. Anti-inflammatoires
I.12.1. Anti-inflammatoires non
stéroïdiens
Les anti-inflammatoires non stéroïdiens (AINS)
sont une des classes thérapeutiques les plus utilisées dans le
monde en raison de leurs propriétés anti-inflammatoires,
anti-pyrétiques et antalgiques. Actuellement, il y a plus de 50
différents AINS sur le marché mondial. Le mécanisme
d'action des AINS a été précisé par les travaux de
Vane [16]. Il repose en grande partie sur l'inhibition compétitive,
réversible ou non, de la cyclooxygénase, enzyme qui permet la
production de prostaglandine à partir de l'acide arachidonique. Cette
caractéristique commune à tous les AINS conduit à une
diminution de la production des prostaglandines, importants médiateurs
de l'inflammation. Même si d'autres modes d'action existent, cette
activité explique largement les propriétés
pharmacologiques et thérapeutiques des AINS, mais aussi une partie de
leurs effets secondaires en raison des fonctions physiologiques des
prostaglandines [16]. Ainsi, la production exagérée de
prostaglandines en situation pathologique participe à l'inflammation et
à la douleur, alors que sa production basale permet l'homéostasie
tissulaire. L'inhibition de la synthèse des prostaglandines par les AINS
doit donc s'accompagner d'effets favorables et délétères
[17].
I.12.2. Anti-inflammatoires
stéroïdiens
Elles constituent une vaste famille de médicaments
dérivés du cortisol, principal glucocorticoïde
surrénalien. Les glucocorticoïdes sont des substances
dérivées du cholestérol, dont la production est
stimulée par l'ACTH libérée selon un cycle
nycthéméral par le lobe antérieur de l'hypophyse.
Dans les tissus cibles, les glucocorticoïdes se fixent
à leurs récepteurs des glucocorticoïdes (GR) du cytoplasme
de la cellule. Après quoi, le complexe récepteur-ligand
formé pénètre dans le noyau cellulaire où il se
fixe à de nombreux éléments de réponse aux
glucocorticoïdes dans la région du promoteur des
gènes-cibles. Le récepteur, ainsi fixé à la
molécule d'ADN interagit avec les facteurs de transcription basiques,
provoquant une augmentation de l'expression génique de
gènes-cibles spécifiques. Ce processus est appelé
transactivation et conditionne la plupart des effets secondaires
métaboliques et cardiovasculaires des glucocorticoïdes.
Le mécanisme opposé est appelé
transrépression. Le récepteur hormonal activé interagit
avec des facteurs de transcription spécifiques et prévient la
transcription des gènes-cibles. Les
glucocorticoïdes sont capables d'empêcher la
transcription de tous les gènes immuns, incluant celui codant IL-2
[18].
Les glucocorticoïdes ordinaires ne font pas de
différence entre la transactivation et la transrépression, et
influencent à la fois les gènes immuns "voulus" et ceux "non
voulus" régulant les fonctions métaboliques et cardiovasculaires
[19].
I.12.3. Anti-inflammatoires d'origine
végétale
Les composés phytochimiques qui se retrouvent dans le
règne végétal sont très diversifiés et leur
spectre d'activité est tout aussi large. Certains de ces composés
phytochimiques ont des propriétés anti inflammatoires. Beaucoup
sont présumés agir en bloquant les voies de la
cyclooxygénase et la lipoxygénase ainsi que par d'autres
mécanismes.
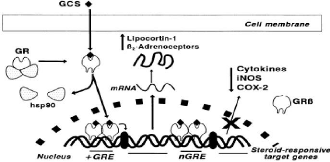
Figure 1. Mécanisme d'action des
glucocorticoïdes [18].
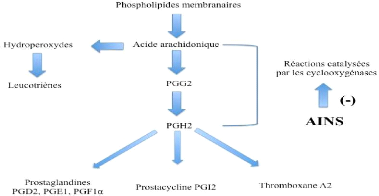
9
Figure 2. Mécanisme d'action des AINS
[16].
10
Exemples de plantes anti-inflammatoires
Tableau I. Exemples de plantes
médicinales douées d'activités anti-inflammatoires
[18].
|
Noms scientifiques
|
Familles
|
Parties
utilisées
|
Noms communs
|
Utilisations
|
|
Z. officinale
|
Zingiberaceae
|
Rhizome
|
Gingembre
|
Arthrose, migraine, rhumatisme
|
|
H. orientalis
|
Ranunculaceae
|
Racines
|
Lenten-rose
|
OEdèmes, rhumatisme
|
|
U. dioica
|
Urticaceae
|
Feuilles,
Racines
|
Ortie
|
Rhinite allergique, eczéma
goutte, rhumatismes
|
|
L. officinalis
|
Rosaceae
|
Feuilles
|
Laurier
|
Fièvre, pharyngite, hémorroïdes
|
|
C. longa
|
Zingiberaceae
|
Rhizome
|
Curcuma
|
Rhumatismes, lupus systémique, psoriasis, infections
rénales
|
N. oleander H. procumbens
|
Apocynaceae
Pédaliacées
|
Fleurs
Tubercule
|
Laurier rose
Griffe du
diable
|
Douleurs, maux de tête
Arthrose, lombalgie, neuvralgie, maux de tête,
fièvre
|
O. biennis
|
|
Onagraceae
|
Graines
|
Onagre bisannuelle
|
Rhumatismes
|
|
|
Pterocarpu erinaceus
|
Fabaceae
|
Feuilles et Racines
|
le Vène,
Palissandre du Sénégal
|
Paludisme, fièvre, rhumatisme
|
II- GENERALITES SUR LES PLANTES UTILISEES COMME ANTI
INFLAMMATOIRE
II.1. GENERALITES SUR PETIVERIA ALLIACEA (HERBE AUX
POULES) II.1.1. Aspect botanique
Petiveria alliacea est une plante de la Famille des
phytolaccacées (phytolaccaceae, pokeweed). Communément
appelée Herbe aux poules, douvant-douvant en français ;
Guinea-hen weed, Congo root, gully root, pipi root, garlique weed, skunk root
en anglais ; Mucura, anamu, erva de tipi, guine en portuguais ; zoroma en fon ;
amlan nyanvun en goun ; oju saju en yoruba et ewe iso en nago, elle est une
plante herbacée érigée ou sous-arbrisseau atteignant 1 m
de haut, à odeur d'ail ; tiges minces, anguleuses, brièvement
poilues lorsque jeunes, glabres par la suite. Feuilles alternes, simples et
entières ; stipules linéaires, de 1,5-2 mm de
11
long ; pétiole de 0,5-1,5 cm de long ; limbe elliptique
à ovale ou oblong, de 5-15 (-20) cm X 2-5(-8) cm, base
cunéiforme, apex aigu a longuement acuminé, glabre à peu
et brièvement poilu. Inflorescence : grappe terminale ou axillaire,
mince, pendante, de 10-30(-40) cm de long, parfois ramifiée ;
bractées de 1,5-2,5 mm de long. Fleurs bisexuées, zygomorphes,
4-mères ; pédicelle de 2-3 mm de long ; sépales libres,
oblongs, de 3-4 mm de long, arrondis, verdâtres ou blancs à roses
; pétales absents ; étamines 4-8, insérées de
façon irrégulière, filets d'environ 2 mm de long ; ovaire
supère, oblong, brièvement poilu, à 4 crochets,
1-loculaire, stigmate sessile, latéral. Fruit : akène
étroitement oblong de 6-8 mm de long, strié, apex 2-lobé,
à crochets recourbés, contenant 1 graine (photo1) [20]

Photo 1. Feuille du Petiveria alliacea
II.1.2. Répartition géographique
Sur son aire de répartition naturelle, Petiveria
alliacea est présent dans les forêts humides et les endroits
perturbés ouverts, depuis le niveau de la mer jusqu'à 1500
d'altitude. En Afrique de l'Ouest, on le trouve à la lisière des
forêts et dans les endroits perturbés à proximité
des habitations. Petiveria alliacea est indigène de
l'Amérique tropicale, et a été introduit en Afrique de
l'Ouest et en Inde. Il s'est naturalisé dans certains endroits du
Bénin et du Nigeria. Au Benin, nous l'avons découvert à
Djavi (Adjarra) où nous avons effectué la récolte pour les
travaux d'expérimentation de notre étude
[21].
II.1.3. Usages
Au Bénin, de façon empirique, la
macération de feuilles de Petiveria alliacea est
appliquée sur le ventre pour déclencher des contractions en cas
d'accouchement difficile ; le liquide des
12
feuilles est instillé en gouttes nasales ou en collyre
pour soigner les violents maux de tête et en gouttes nasales pour soigner
la sinusite [22]. La décoction de feuilles se prend en bain ou en bain
de vapeur en cas d'oedème. Elle s'applique aussi sur les abcès.
Au Nigeria, les guérisseurs yoroubas utilisent la plante entière
lors de cérémonies rituelles. En Amérique tropicale,
Petiveria alliacea est un remède couramment utilisé. On
lotionne la tête avec une purée de feuilles allongée d'eau
pour traiter les céphalées et pour déclencher
l'accouchement. La décoction de feuilles appliquée en externe
sert d'analgésique contre les douleurs musculaires et de traitement des
maladies de peau. L'infusion d'écorce écrasée se boit pour
traiter les coliques, les rhumatismes, le cancer, la syphilis, les rhumes, la
fièvre, la bronchite et l'asthme [22]. Les racines râpées
et trempées dans de l'alcool de canne à sucre ou la
décoction de racine se prennent pour traiter les rhumatismes, les
maladies vénériennes et les vers intestinaux et aussi pour leurs
vertus antispasmodiques, sudorifiques et diurétiques dans les cas
d'infections de l'appareil urinaire. La racine écrasée
mélangée à du citron s'applique sur les morsures de
serpent [22]. A Cuba, on applique le jus des feuilles ou de la plante
entière pour soigner les problèmes de peau, l'arthrose et les
maux de dents et il se prend pour traiter le diabète. Les Colombiens
mastiquent les feuilles pour en revêtir leurs dents et prévenir
les caries. La plante entière se prend en décoction pour traiter
le diabète, le cancer, les fausses couches, les oedèmes et pour
purifier le sang. Au Brésil, les feuilles de Petiveria alliacea
sont utilisées pour soigner la malaria et les rhumatismes. Elle
l'est aussi comme insecticide. La plante s'emploie aussi couramment en magie
[22].
Cette plante est utilisée en tant qu'analgésique
et anti-inflammatoire [22]. Elle est employée aussi contre l'arthrite,
l'affaiblissement de la mémoire et induit les avortements. En dosage
élevée, elle est toxique et doit être utilisée avec
précaution lorsqu'on l'utilise de façon interne [22]. Les
feuilles sont utilisées sous forme de cataplasme à usage externe
pour les maux de tête, les douleurs rhumatismales et d'autres types de
douleur et aussi comme un insecticide [22]. Dans la médecine des plantes
au Guatemala, il est utilisé comme remède traditionnel contre la
sinusite (par inhalation de la poudre faite à base de la racine de la
plante). La décoction faite à base de feuilles est à usage
interne pour soigner les ennuis digestifs, et le fait d'avoir des gaz et de la
fièvre [23]. La décoction à base de feuilles est
employée de manière externe comme analgésique pour les
douleurs musculaires et les maladies de la peau. En Haïti, l'extrait fait
à base de feuilles ou de racines d'anamu écrasées est
inhalé pour soigner les migraines et une macération de ces
feuilles est utilisée comme analgésique en faisant des bains de
bouche pour les douleurs dentaires. Elle serait aussi utilisée contre la
rétention d'eau
13
et pour son action sur les émonctoires. Elle est, en
outre, vésicante, antispasmodique et vermifuge. Les racines ont
été signalées comme odontalgiques. A Porto-Rico, on donne
la décoction de la plante aux nouvelles accouchées, pour
prévenir les accidents des suites de couches [22]. L'infusion des
feuilles est recommandée pour accélérer et faciliter
l'accouchement et contre l'asthénie. Les feuilles servent à la
préparation de bains aromatiques provoquant une sudation
générale qui aboutit à une baisse de température
dans les fièvres rebelles à caractère infectieux. On
utilise aussi cette préparation en lavement contre les fermentations
intestinales. Le jus des feuilles fraîches et écrasées sert
à la désinfection des plaies. La dose employée est de 30 g
par litre d'eau en décoction, à prendre par verre toutes les
heures. En homéopathie, les indications de Petiveria alliacea
sont : les paralysies, la paraplégie avec engourdissements, la
sensation de froid à l'intérieur, froid dans les os [23].
II.2. GENERALITES SUR MORINGA OLEIFERA II.2.1.
Aspect botanique
Moringa oleifera Lam. (Synonyme : Moringa
pterygosperma Gaertner) appartient à la famille
monogénérique des arbustes et arbres des Moringaceae qui comprend
environ 13 espèces [24]. Moringa est un arbre pérenne, à
croissance rapide, qui peut atteindre 7 à 12 mètres de hauteur et
dont le tronc généralement droit (20 à 40 cm de
diamètre) atteint 1,5 à 2 mètres de haut avant de se
ramifier, bien qu'il puisse parfois atteindre les 3 mètres. Les branches
poussent de manière désorganisée et la canopée est
en forme de parasol. Les feuilles, alternes et bi ou tripennées, se
développent principalement dans la partie terminale des branches. Elles
mesurent 20 à 70 cm de long et sont recouvertes d'un duvet gris
lorsqu'elles sont jeunes. De plus, elles ont un long pétiole avec 8
à 10 paires de pennes composées chacune de deux paires de
folioles opposés, plus un à l'apex, ovales ou en forme d'ellipse,
et mesurant 1 à 2 cm de long. Les fleurs mesurent 2,5 cm de large et se
présentent sous forme de panicules axillaires et tombantes de 10
à 25 cm. Elles sont généralement abondantes et
dégagent une odeur agréable [25,26].
Elles sont blanches ou de couleur crème, avec des
points jaunes à la base. Les sépales, au nombre de cinq, sont
symétriques et lancéolés. Les cinq pétales sont
minces et spatulés, symétriques à l'exception du
pétale inférieur, et entourent cinq étamines. Les fruits
forment des gousses à trois lobes, mesurant 20 à 60 cm de long,
qui pendent des branches. Lorsqu'ils sont secs, ils s'ouvrent en trois
parties.
14
Chaque gousse contient entre 12 et 35 graines. Les graines
sont rondes, avec une coque marron semi-perméable. La coque
présente trois ailes blanches qui s'étendent de la base au sommet
à 120 degrés d'intervalle. Un arbre peut produire 15000 à
25000 graines par an. Une graine pèse en moyenne 0,3 g et la coque
représente 25% du poids de la graine [25]

Photo 2. Feuille du Moringa oleifera
II.2.2. Répartition géographique
Originaire du sous-continent indien (Afghanistan, Inde,
Pakistan, Sri Lanka), Moringa oleifera est aujourd'hui cultivé
sur une répartition pantropicale. Elle est cultivée en Afrique et
dans les régions tropicales comme Madagascar. Elle présente un
comportement "envahissant" à Cuba [25]. Elle est répartie
beaucoup plus au sud Bénin, à l'Ouest et à l'Est.
II.2.3. Usages
L'extrait aqueux des feuilles de Moringa oleifera
à des doses de 100, 200 et 300 mg/kg de poids corporel a
montré une activité antihyperglycémiante [27]. Aux
mêmes doses [28], l'extrait brut des feuilles de Moringa oleifera
a une importante action sur la baisse du taux de cholestérol dans
le sérum de rats soumis à un riche régime en graisse ;
cette action pourrait être attribuée à la présence
d'un phytoconstituant bioactif, c'est-à-dire le
â-sitostérol [29]. Les fruits de Moringa font baisser le
taux de cholestérol sérique, de phospholipides, de
triglycérides, de LDL (low density lipoprotein), de VLDL (very low
density lipoprotein) et réduisent le profil lipidique du foie [30].
La racine de Moringa oleifera, à cause du
principe actif (la pterygospermine), est une antibactérienne et anti
fongique puissante [31]. L'extrait aqueux et d'éther de pétrole
de
15
l'écorce de la racine se sont avérés
responsable des activités antibactériennes et antifongiques
[32,33].
L'extrait aqueux des feuilles de Moringa oleifera
possède une activité antioxydante due à la
présence de différentes variétés d'antioxydants
comme l'acide ascorbique, les flavonoïdes, les composés
phénoliques et les caroténoïdes [34]. Des travaux
effectués sur les feuilles de Moringa oleifera ont
montré qu'elles peuvent traiter le SIDA [35].
Les fleurs et les feuilles de Moringa oleifera ont
aussi une activité anthelminthique [36]. Elles servent à traiter
des inflammations, des maladies musculaires, de l'hystérie, des tumeurs,
l'agrandissement de la rate et réduisent le taux de cholestérol
dans le sérum [37]. L'extrait éthanolique de Moringa oleifera
a montré un maximum d'action contre la bactérie responsable
de la fièvre typhoïde [38].
II.3. GENERALITES SUR OCIMUM GRATISSIMUM II.3.1.
Aspect botanique
Ocimum gratissimum est une espèce de plantes
de la famille des Lamiaceae. De nom scientifique Ocimum gratissimum,
appelée en anglais (wild basil, tree basil, East Indian basil, clove
basil); français (Menthe gabonaise); Tchayo en Fon, Efinrin en Yoruba,
elle est une plante herbacée aromatique, vivace, 1-3 m de haut ; tige
érigée, rond-quadrangulaire, très ramifié, glabre
ou pubescent, boisé à la base, souvent avec de l'épiderme
épluchant en bandes. Les feuilles en face ont de pétioles de
2-4,5 cm de long, minces, pubescents ; elle a de petites fleurs. Le fruit est
composé de 4 oeufs secs et à 1 graine enfermés dans le
calice [39, 40].

Photo3. La feuille d'Ocimum gratissimum
avec des fleurs
16
II.3.2. Répartition géographique
O. gratissimum se trouve dans les régions
tropicales et subtropicales, sauvages et cultivées. Sa plus grande
variabilité se produit dans l'Afrique tropicale (d'où elle
provient probablement) et en Inde. En Asie du Sud-Est, il est cultivé
principalement comme culture de jardin domestique, mais seul au Vietnam, il est
cultivé à l'échelle commerciale [41].
II.3.3. Usages
O. gratissimum est cultivé à cause de
sa contenance en l'huile essentielle (feuilles et tiges). En Indonésie
(Sumatra), un thé est fabriqué à partir de feuilles,
tandis qu'en Thaïlande, les feuilles sont appliquées comme
arôme. En Indonésie, le type Eugenol de O. gratissimum
est utilisé dans le lavage cérémonial des cadavres et
est planté dans les cimetières. En Inde, O. gratissimum,
nommé «ram tulsi », est largement utilisé dans les
cérémonies et les rituels religieux. La plante entière et
l'huile essentielle ont de nombreuses applications en médecine
traditionnelle, en particulier en Afrique et en Inde. La décoction de la
plante est utilisée pour le traitement des troubles d'estomac, des maux
de tête et de la grippe. Les graines ont des propriétés
laxatives et sont prescrites contre la gonorrhée. L'huile essentielle
est appliquée contre la fièvre, les inflammations de la gorge,
des oreilles ou des yeux, la diarrhée et les maladies de la peau. Il est
testé comme antibiotique. L'huile essentielle est également un
insectifuge important [41].
La revue documentaire minutieusement effectuée nous a
permis de constater que Petiveria alliacea, Moringa oleifera
et Ocimum gratissimum ont été objet de plusieurs
études scientifiques mais très peu sur l'activité
anti-oedémateuse.
HYPOTHESES &
OBJECTIFS
18
Hypothèses
La réponse à la problématique
posée dans cette recherche nous amène à émettre les
hypothèses suivantes :
- les feuilles du Petiveria alliacea, de Moringa oleifera et
de Ocimum gratissimum sont faiblement toxiques.
- les feuilles du Petiveria alliacea, de Moringa
oleifera et de Ocimum gratissimum ont un effet
anti-oedémateuse ;
Objectif Général : La
présente étude a pour objectif de donner des bases scientifiques
à l'utilisation des feuilles du Petiveria alliacea; de
Moringa oleifera et de Ocimum gratissimum. Au cours de
l'étude, l'activité anti-oedémateuse des décoctions
issues des feuilles ont été évaluées sur le rat
wistar.
De façon spécifique, il s'agit de :
- déterminer la toxicité aigüe de l'extrait
aqueux des feuilles de Petiveria alliacea, de Moringa oleifera
et de Ocimum gratissimum ;
- vérifier l'activité anti-oedémateuse
des feuilles du petiveria alliacea, de moringa oleifera et de
Ocimum gratissimum.
MATERIEL &
METHODES
20
I. CADRE DE L'ETUDE
Il s'agit d'une étude transversale de type
expérimentale. Elle a été réalisée :
Au laboratoire de physiologie de l'effort de l'INJEPS (LA.P. EF),
Porto-Novo.
A l'annexe du laboratoire de pharmacognosie de la FSS et la FAST
situé dans l'enceinte du Centre Béninois de Recherche
Scientifique et Technique (CBRST), annexe de Porto-Novo.
PRESENTATION DE LA ZONE D'ETUDE
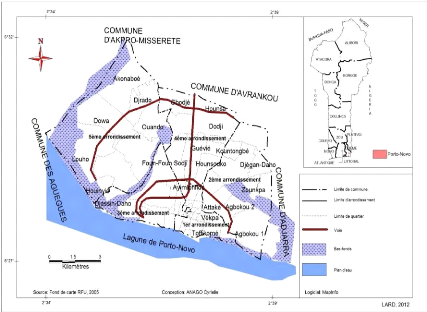
Figure 3. Carte de la ville de Porto-Novo
[42]
situé au sud du Bénin à 30 km de Cotonou,
la ville de Porto-Novo est localisée entre 6°30 de latitude nord et
3°30 de longitude Est. Elle est limitée au Nord par la commune
d'Avrankou, au Sud par la commune de Sèmè-kpodji, à l'Est
par la commune d'Adjarra et à l'Ouest par la commune des
Aguégués. Porto-Novo a gardé, malgré les
aléas de l'histoire et l'ascension de la ville de Cotonou, son statut de
« Capital du Bénin ». Elle couvre une superficie de 52
km2 soit 0,05% du territoire national et compte 223.551 habitants
[43].
21
Le climat est subéquatorial où l'année se
divise en quatre saisons dont deux saisons sèches (mi-Novembre à
mi-Mars et mi-Juillet à mi-Septembre) et deux saisons de pluie (mi-Mars
à mi-Juillet et mi-Septembre à mi-Novembre) qui sont d'ailleurs
des périodes favorables pour la récolte des plantes [44].
Sur le plan pluviométrique, une moyenne de 1200 mm est
enregistrée à Porto-Novo durant ces dernières
années, le niveau le plus élevé de tout le pays. De
Décembre à Janvier, souffle l'harmattan, un vent froid et sec qui
crée une forte amplitude thermique pendant la journée. La
municipalité de Porto-Novo a un relief très peu accidenté
et dispose de trois types de sol : les sols des plateaux, les sols de bas de
pente et les sols des bas-fonds [44].
Ville du 17è siècle créée autour
de trois chasseurs yoruba, elle est devenue progressivement la cité au
trois noms : « Hogbonou », « Adjatchè » et «
Porto-Novo ». Cinq arrondissements y sont installés :
Houèzoumè, Attakê, Djassin, Houinmè et Ouando. De
nos jours, il existe une mosaïque d'ethnies qui cohabite à
Porto-Novo. Les Goun et fon sont majoritaires (66%), suivis des Yoruba (25%) et
des Adja, Mina et Toffin (4%). Les autres ethnies sont composées de
Bariba, Dendi, Yom-Lokpa, Otamari et Peulh etc (5%). Ce brassage ethnique est
aussi à la base de la diversité des activités
économiques de la ville. En effet, les commerçants Yoruba ont
développé l'activité commerciale alors que les Goun et les
Fon s'investissent beaucoup dans l'agriculture et le transport. Quant aux
autres ethnies, elles se retrouvent dans la fourniture des services, dans les
buvettes et restaurants et dans les divers [44].
La vie spirituelle de la municipalité de Porto-Novo est
animée par plusieurs religions. Chacune d'elles prêche pour la
culture de la paix, de la tolérance mutuelle et de la cohésion
locale et nationale. Trois catégories de religions peuvent être
distinguées : la religion traditionnelle (29,20%), la religion
chrétienne (45,70%) et l'islam (25,10%). L'identité culturelle
propre à la ville de Porto-Novo repose sur le triptyque des croyances
ancestrales et le syncrétisme religieux que constituent la croyance en
Dieu suprême, créateur de l'univers et le culte des ancêtres
connu sous l'appellation « Vodoun » en Goun ou « Oricha »
en Yoruba.
II. MATERIEL
II.1. MATERIEL VEGETAL
Le matériel végétal est constitué
des feuilles de Petiveria Alliacea, de Moringa oleifera et de
Ocimum gratissimum qui ont été séchées
pendant trois semaines à l'abri du soleil et de l'humidité
à l'annexe du laboratoire de pharmacognosie de la FSS et la FAST
située dans l'enceinte du Centre Béninois de Recherche
Scientifique et Technique (CBRST), annexe de Porto-Novo. Ensuite, elles ont
été pulvérisées par broyage. La poudre obtenue a
servi à la préparation des extraits.
II.2 Matériel animal
Des rats wistar de masse corporelle de 190 #177; 12 g
(Photo 4) ont été obtenus à l'animalerie du Laboratoire de
Cytogénétique de l'ISBA à Cotonou. Ils ont
été nourris au son de blé, au tourteau de maïs et
à l'eau courante de robinet.
L'enceinte d'élevage a été
régulièrement nettoyée pour garantir un
développement optimal des animaux à l'abri de toute infection.
Les animaux ont été gardés dans des cages
métalliques grillagées de dimension (50 x 30 x 20
cm3), munies de mangeoires et
d'abreuvoirs. Le fond des cages est constitué par un système de
tiroir amovible garni de copeaux de bois recueillant les fèces et les
urines au travers d'une base en treillis.

22
Photo 4. Rat wistar
Source: Kiki, 2017
23
II.3. EQUIPEMENTS-CONSOMMABLES-REACTIFS
La liste des équipements, consommables et réactifs
est disponible en annexes 2. III. METHODE
Nos travaux se sont déroulés en trois phases :
une phase préparatoire, une phase expérimentale et l'analyse
statistique des données.
III.1. PHASE PREPARATOIRE
Elle consiste en : Récolte, séchage, broyage et
obtention de l'extrait aqueux.
III.1.1. Récolte, séchage,
broyage
Ces feuilles ont été récoltées en
février 2017 à djavi dans la Commune d'Adjara et
séchées pendant plusieurs jours dans un endroit sec et à
l'abri des rayons solaires à l'annexe du laboratoire de pharmacognosie
et des huiles essentielles (LAPHE) de la FSS et la FAST. Elles ont
été broyées par des broyeurs « Of flour mills
Nigeria, de type EL MOTOR N 1827 ». Cela a permis d'obtenir une poudre qui
a servi à l'obtention de l'extrait aqueux à chaud de chacune
d'elles.
III.1.2. Obtention des extraits aqueux à
chaud
Les extraits sont obtenus par décoction de 50g de
poudre de feuilles dans 500mL d'eau distillée bouillante pendant 30
minutes grâce à une plaque chauffante. Le mélange refroidi
est ensuite filtré deux fois successivement avec du coton hydrophile.
Le filtrat est enfin soumis à une évaporation
à 50°C à l'aide d'un Rotavapor de marque Stuart type RE300
puis placé dans une étuve Memmet à une température
de 50°C pour fignoler l'évaporation. Enfin, les extraits sont
conservés à 4°C dans un réfrigérateur avant
l'utilisation.
III.2. ANALYSE PHYTOCHIMIQUE (SCREENING)
Le screening phytochimique est basé sur les
réactions (coloration et précipitation) différentielles
des principaux groupes de composé chimiques contenus dans la feuille
selon la méthode de Houghton et Raman [45]. Le protocole est en annexe
2.
Tableau II. Récapitulatif des
réactions spécifiques de chaque classe de composé chimique
lors du screening phytochimique.
Classe de Principe actif Réactifs Spécifiques
Réactions (Observations)
Alcaloïdes
Tanins catéchiques Tanins galliques
Flavonoïdes
Anthocyanes
Leucoanthocyanes Dérivés quinoniques
Saponosides Triterpenoïdes
Stéroïdes
Cardénolides
Dérivés cyanogéniques
Mucilages
Composés réducteurs Coumarines
Dérivés anthracéniques Stupéfiants
Opium
Oses et holosides
Dragendorff (iodobismuthate de
potassium)
Mayer (iodomercurate de potassium) Réactif de stiasny
Saturation d'acétate de Na+ quelques gouttes de
FeCl3 à 1%
Shinoda (réaction à la cyanidine: HCL+Mg)
Acide chlorhydrique à 5% + quelques gouttes d'ammoniaque
diluée au demi Shinoda (alcool chloridrique) Born-Trager
(réaction entre cycle quinoniques en milieu HNO3) Détermination
de l'indice de mousse
Liebermann-Buchard (anhydride
acétique-acide
sulfurique)
Kedde (acide dinitrobenzoique 2% dans l'éthanol + NaOH
(1N)
Dinitrobenzène 1% dans éthanol + NaOH 20%
Gugnard (papier imbibé d'acide picrique) Etude de la
viscosité des infusés et décoctés. Alcool absolu
Liqueur de fehling à chaud
Ammoniaques à 25%
Chloroforme + ammoniaque intense Hydroxyde de potassium à
5% dans l'alcool (réaction de Beam positive) Chlorure ferrique (FeCl3)
à 25%
Acide sulfurique + alcool saturé au Thymol
Précipité rouge
Précipité jaune
Précipité rose
Coloration bleue ou noire
Coloration: orangée, rouge et violette
Coloration rouge qui vire au bleue violacée ou
verdâtre Coloration rouge cerise Coloration rose ou rouge
violacée
Positive si IM = 1cm
Coloration violette à bleue ou verte
Coloration rouge pourpre ou rouge au vin
Coloration bleue
Coloration orange ou marron Précipité floconneux
après une dizaine de minutes
Précipité rouge-brique
Fluorescence intense sous UV à 365 nm
Coloration rouge plus Coloration violette
Précipité rouge
Coloration rouge
24
25
III.3. ETUDE DE LA TOXICITE AIGUE
Tableau III. Échelle de toxicité
aigüe des produits chimiques [46].
DL50 pour le rat ou la souris mg/kg
|
Classe de risque
|
Orale
|
Dermale
|
Indications
|
|
Solides Liquides
|
Solides
|
Liquides de risque
|
|
Ia extrêmement dangereux toxique
|
= 5
|
= 20
|
= 10
|
=
|
40 Très
|
|
Ib très dangereux
|
5-50
|
20-200
|
10-100
|
40-400
|
Toxique
|
|
II modérément dangereux
|
50-500
|
200-2000
|
100-1000
|
400-4000
|
Nocif
|
|
III peu dangereux
|
< 500
|
< 2 000
|
< 1 000
|
< 4 000
|
Attention
|
Tableau IV. Echelle de toxicité
aigüe de Hodge et Sterner [47].
Classe de toxicité DL50 rat, sourismg/kg Dose pour un
enfant de 12,50 kg
Extrêmement toxique < 1 8 mg le fait d'en
gouter
Très 1 à 50 500 mg le fait d'avaler une
petite
gorgée
Moyennement 50 à 500 5 g le fait d'avaler une
cuillerée à café
Faiblement 500 à 5000 60 g le fait d'en consommer
un
coquetier
Pratiquement non 5000 à 15 000 180 g
Relativement sans danger >15 000 >180g
III.4. PHASE D'EXPERIMENTATION
Seul l'extrait aqueux à chaud est utilisé pour la
suite des travaux afin de nous conformer aux méthodes de
préparation de la pharmacopée béninoise.
26
Evaluation de l'activité
anti-oedémateuse
Protocole expérimental
Test de l'activité
anti-oedémateuse
L'oedème est provoqué par l'injection, dans
l'aponévrose de la plante de la patte gauche des rats, de 0,1 mL de
solution de formol à 1%. Par la méthode de l'immersion avec le
dispositif de Bhatt [47] modifié, les mesures du volume de la patte
gauche sont effectuées à 0, 30, 60, 120, 180, 240, 300 et 360
minutes après l'injection [48]. Trente minutes avant l'induction de
l'oedème, les animaux à traiter reçoivent par voie orale
300 mg/kg et 500 mg/kg de poids corporel d'extrait de Petiveria alliacea,
Moringa oleifera et de Ocimum gratissimum sous un volume constant
de 7 mL d'eau distillée. L'indométacine, à la
dose de 100 mg/kg, est utilisée comme produit de
référence.
Les rats répartis en 6 lots de 5, ont été
pesés puis mis à jeun 12 heures avant
l'expérimentation.
Le volume de la patte est déterminé par la
méthode d'immersion ce qui provoque une augmentation du niveau d'eau. Ce
niveau est ramené à sa position initiale dans la grande seringue
3 à l'aide d'autres seringues 1 et 2. Le volume de la patte qui
correspondant à la quantité d'eau déplacée est
directement lu sur la seringue 1.
Les différents traitements ont été
administrés par gavage : - Lot 1 : eau distillée à raison
de 10 mL/kg (contrôle) ;
- les lots 2, 3 et 3 : solution respective d'extrait aqueux de
Petiveria alliacea, de Moringa oleifera et de Ocimum gratissimum
à la dose de 300 mg/kg ;
- les lots 4, 5 et 6 : solution d'extrait aqueux de
Petiveria alliacea, de Moringa oleifera et de Ocimum gratissimum
à la dose de 500 mg/kg ;
- le lot 7 : solution d'indométacine à 100
mg/kg.
? Le volume de l'oedème VT à un temps tf
donné est :
VT = Vtf - Vt0
Vt0 = le volume initial de la patte
Vtf= le volume de la patte au temps tf
? Le pourcentage d'augmentation P du volume de la patte est
donné par la formule :
27
P = 100 x VT / Vt0
? L'activité anti-oedémateuse a été
évaluée par le calcul du pourcentage d'inhibition PI de
l'oedème selon la formule :
PI = 100 (Vte - Vtt) / Vte
Vte = Volume de l'oedème chez les rats témoins Vtt
= Volume de l'oedème chez les rats traités
III.5. ANALYSES STATISTIQUES
Nous avons fait dans un premier temps, un test ANOVA, pour
comparer les valeurs. Dans un second temps, le test "t" de Student-Fischer avec
un logiciel SPSS. Les différences sont hautement significatives, si
t> 1,96 ; elles sont calculées par rapport aux témoins. Les
chiffres qui figurent dans les tableaux représentent les moyennes des
valeurs et les erreurs Standards Moyennes (EMS).

RESULTATS
29
I. RESULTATS DE LA PHASE PREPARATOIRE I.1. Etude
phytochimique
Les résultats des analyses phytochimiques sont
consignés dans le tableau V ci-dessous.
Il ressort de l'analyse phytochimique des feuilles de
Petiveria alliaccea, Moringa oleifera et Occimum
gratissimum qu'elles renferment plusieurs composés chimiques tels
que : Stérols, triterpènes, tanins hydrolysables, tanins
condensés, non hydrolysables (composés polyphénoliques),
mais aussi des hétérosides, flavonoïdes et des
alcaloïdes.
Tableau V. Résultats des analyses
phytochimiques
|
Groupes chimiques
|
|
P. alliacea,
|
|
M. oleifera
|
|
O. gratissimum
|
|
Alcaloïdes
|
|
+
|
|
+
|
|
+
|
|
Tanins catéchiques
|
|
+
|
|
+
|
|
+
|
|
Tanins galiques
|
|
+
|
|
+
|
|
+
|
|
Flavonoïdes
|
|
+
|
|
+
|
|
+
|
|
Anthocyanes
|
|
+
|
|
+
|
|
+
|
|
leucoanthocyanes
|
|
+
|
|
+
|
|
+
|
|
Dérivé quinoniques
|
|
-
|
|
-
|
|
-
|
|
Saponosides
|
|
+
|
|
-
|
|
-
|
|
Triterpénoides
|
|
+
|
|
-
|
|
+
|
|
Stéroides
|
|
+
|
|
-
|
|
+
|
|
Dérivé cyanogéniques
|
|
-
|
|
+
|
|
+
|
|
Mucilages
|
|
-
|
|
+
|
|
+
|
|
Coumarines
|
|
-
|
|
-
|
|
-
|
|
Composé réducteur
|
|
+
|
|
-
|
|
-
|
|
Anthracéniques libres
|
|
-
|
|
-
|
|
-
|
|
O-hétérosides
|
|
+
|
|
-
|
|
-
|
|
C-hétérosides
|
|
+
|
|
-
|
|
-
|
|
Hétéro cardiotoniques
|
|
+
|
|
-
|
|
-
|
|
H.E
|
|
+
|
|
+
|
|
+
|
|
Absent : (-)
|
|
Présent : (+)
|
|
|
|
|
I.2.
30
Rendement des extractions
L'extraction aqueuse à chaud faite à partir de
50 g de poudre brute de la feuille du Petiveria alliacea, de
moringa oleifera et de Ocimum gratissimum nous a permis
d'obtenir les résultats suivants.
A l'issue de l'extraction aqueuse à chaud faite
à partir de 50 g de poudre brute de la feuille du Petiveria
alliacea, de moringa oleifera et de Ocimum gratissimum,
il a été obtenu 16%,13% et 7% respectivement pour les
différentes poudres brutes de feuilles. Le plus grand rendement a
été obtenu avec la poudre brute de la feuille de Petiveria
alliaccea, suivi de celle de Moringa oleifera et de Ocimum
gratissimum.
Tableau VI. Rendement de décoctions
de feuilles de Petiveria alliacea, de moringa oleifera et de
Ocimum gratissimum
Noms Scientifiques Parties utilisées Rendement
%
Petiveria alliacea 16
Moringa oleifera F 13
Ocimum gratissimum 7
I.3. Etude de la toxicité aigue
Aucun effet indésirable patent et aucun
décès n'ont été enregistrés pendant les 14
jours d'observation clinique régulière des deux lots de dose
séquentielle de 300 mg/kg et de ceux de 2.000 mg/kg de poids corporel de
l'animal, ceci pour les extraits aqueux de Petiveria alliacea, de
Moringa oleifera et de Ocimum gratissimum.
Lors du déroulement de l'expérimentation,
l'absence d'effets indésirables à la dose séquentielle de
2000 mg/kg du poids corporel de l'animal a entrainé la fin de
l'essai.
31
II. RESULTATS DE LA PHASE EXPERIMENTALE II.1. Evaluation
de l'activité anti-oedémateuse
Effet de l'extrait aqueux des feuilles de
Petiveria alliacea, de Moringa oleifera
et de Ocimum gratissimum sur l'oedème de
la patte de rat induit par le formol 1%
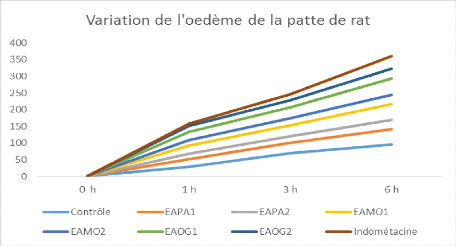
L'administration de l'extrait aqueux des feuilles de
Petiveria alliacea à la dose de 300 mg/kg prévient de
manière significative (p<0,05) l'oedème de la patte de rat
induite par le formol 1%. L'augmentation du pourcentage de l'oedème
inflammatoire de la patte est de 22,9#177;3,1 ; 30,8#177;7,2 et 46,6#177;12,0
comparée au groupe contrôle traité avec l'eau
distillée dont l'augmentation de l'oedème est de 28,1#177;2,0 ;
69,7#177;1,1 et 95,2#177;6,0 respectivement aux temps T1h, T3h et T6h
après injection du formol 1%.
A la dose de 500 mg/kg per os, l'extrait aqueux des feuilles
de Petiveria alliacea montre une meilleure prévention de
l'oedème de la patte induite par le formol 1% comparée à
la dose de 300 mg/kg. Les pourcentages d'augmentation de l'oedème
inflammatoire de la patte sont moins importants, ils sont de : 16,7#177;2,0 ;
20,3#177;1,1 et 17,1#177;0,01 respectivement aux temps T 1h, T 3h et T 6h
après injection du formol 1% (Tableau VII).
L'administration de l'extrait aqueux des feuilles de
Moringa oleifera à la dose de 300 mg/kg prévient de
manière significative (p<0,05) l'oedème de la patte de rat
induite par le formol 1%. L'augmentation du pourcentage de l'oedème
inflammatoire de la patte est de 23,9#177;4,1 ; 31,80#177;7,2 et 47,7#177;13,1
comparée au groupe contrôle.
A la dose de 500 mg/kg per os, l'extrait aqueux des feuilles
de Moringa oleifera montre une meilleure prévention de
l'oedème de la patte induite par le formol 1% comparée à
la dose de 300 mg/kg. Les pourcentages d'augmentation de l'oedème
inflammatoire de la patte sont moins importants, ils sont de : 17,7#177;2,0 ;
21,2#177;1,1 et 28,25#177;0,2 respectivement aux temps T1h, T3h et T6h
après injection du formol 1% (Tableau VII).
L'administration de l'extrait aqueux des feuilles de
Ocimum gratissimum à la dose de 300 mg/kg prévient de
manière significative (p<0,05) l'oedème de la patte de rat
induite par le formol 1%. L'augmentation du pourcentage de l'oedème
inflammatoire de la patte est de 24,10#177;4,1 ; 32,1#177;3,2 et 48,8#177;13,2
comparée au groupe contrôle.
A la dose de 500 mg/kg per os, l'extrait aqueux des feuilles
de Ocimum gratissimum montre une meilleure prévention de
l'oedème de la patte induite par le formol 1% comparée à
la dose de 300 mg/kg. Les pourcentages d'augmentation de l'oedème
inflammatoire de la patte sont
32
moins importants, ils sont de : 18,10#177;3,0 ; 21,3#177;2,1
et 28,4#177;0,3 respectivement aux temps T1h, T3h et T6h après injection
du formol 1% (Tableau VII).
Tableau VII. Effet de l'extrait aqueux des
feuilles de : Petiveria alliaccea, Moringa oleifera et Ocimum
gratissimum sur l'oedème de la patte de rat induit par le formol
1%.
% d'augmentation du volume de la patte induite par le formol
1%
|
Lots
|
Doses
|
0h
|
|
1h
|
3 h
|
6h
|
|
Contrôle
|
10 mL/kg
|
0
|
|
28,1#177;2,0
|
69,75 #177; 1, 1
|
95,24 #177; 6,0
|
|
300 mg/kg
|
0
|
|
22,94#177;3,1
|
30,81#177;7,2*
|
46,65#177;12,0
|
|
EAPA
|
|
|
|
|
|
|
|
500 mg/kg
|
0
|
|
16,73#177;2,0
|
20,32#177;1,1*
|
27,15#177;0,1
|
|
300 mg/kg
|
0
|
|
23,94#177;4,1
|
31,80#177;7,2
|
47,75#177;13,1
|
|
EAMO
|
|
|
|
|
|
|
|
500 mg/kg
|
0
|
|
17,70#177;2,0
|
21,22#177;1,1
|
28,25#177;0,2
|
|
300 mg/kg
|
0
|
|
24,10#177;4,1
|
32,10#177;3,2
|
48,87#177;13,2
|
|
EAOG
|
|
|
|
|
|
|
|
500 mg/kg
|
0
|
|
18,10#177;3,0
|
21,36#177;2,1
|
28,40#177;0,30
|
|
Indométacine
|
100 mg/kg
|
|
0
|
6,12#177;8,1
|
19,08#177;7,2*
|
37,86#177;7,0*
|
Les données sont exprimées en moyenne #177; erreur
standard à la moyenne (e.s.m.). Significativité à
*P<0,05 par raort au contrôle. n=5
EAPA = Extrait aqueux de Petiveria alliaccea EAMO =
Extrait aqueux de Moringa oleifera EAOG = Extrait aqueux de Ocimum
gratissimum

DISCUSSION
34
L'objectif de notre travail était d'établir une
base scientifique de l'utilisation de Petiveria alliacea, de
Moringa Oleifera et de Ocimum gratissimum en médecine
traditionnelle.
La présente étude a prouvé que les
décoctés des feuilles de ces trois plantes possèdent des
propriétés pharmacologiques anti-inflammatoires. Selon
l'échelle de toxicité de Hodge et Sterner [45] et de l'OMS [50],
nos extraits sont faiblement toxiques et sont classés dans la classe III
des substances chimiques.
Les résultats du criblage chimique ont montré
que les feuilles de : Petiveria alliacea, Ocimum gratissimum et
Moringa oleifera renferment de stérols et triterpènes,
de tanins hydrolysables et de tanins condensés, non hydrolysables
(composés polyphénoliques), mais aussi des
hétérosides, flavonoïdes et des alcaloïdes. Ces
résultats sont également conformes à ceux obtenus par
Akinmoladun et al. [26], Aissi et al. [51], Folkard et al. [52],
Kpètèhoto et al. [39]. Les terpènoïdes sont
potentiellement doués de propriétés anti-inflammatoires,
antimycosiques et parfois analgésiques [53]. Les flavonoïdes, de
par leurs activités antiradicalaires et chélatantes, sont
doués de propriétés antioxydantes,
antihypercholestérolémiantes, anti-aggrégant plaquettaires
[52]. Les tanins sont des antimicrobiens, des antifongiques [53]. Ces
composés, notamment les flavonoïdes, possèderaient une
action inhibitrice sur l'inflammation [54,56] qui passerait par l'inhibition de
la formation des principaux médiateurs pro- inflammatoires du
métabolisme de l'acide arachidonique via l'inhibition des cyclo-
oxygénases et lipooxxygénase [57,58].
La présence d'alcaloïdes, des polyphénols
révélés dans les différents extraits de la plante
serait à l'origine de leurs utilisations comme anti inflammatoire [40].
Ces résultats permettent de valider l'usage de ces plantes dans le
traitement des inflammations.
L'oedème induit par l'injection du formol 1% est un
modèle animal largement utilisé pour évaluer
l'activité anti-inflammatoire des substances. L'injection du formol 1%
provoque la libération de plusieurs médiateurs chimiques qui sont
responsables du processus inflammatoire. Cette réponse inflammatoire est
biphasique. La phase initiale qui dure environ une heure est due à la
libération de l'histamine et de la sérotonine. La bradykinine est
libérée au cours de la seconde phase et la biosynthèse des
prostaglandines intervient au-delà de la troisième heure [54].
L'administration per os des extraits aqueux des feuilles s'est
révélée efficace, de façon dépendante
à la dose (300 et 500 mg/kg), dans la prévention de
l'oedème inflammatoire au formol 1%. Toutefois, cet effet
anti-oedémateuse est faible sur la phase initiale de l'oedème
mais important dans la phase tardive (6 h).
35
Les décoctés des feuilles ont inhibé
l'oedème de manière dose-dépendante et à toutes les
phases. Ainsi, les décoctés des feuilles pourraient avoir une
action antagoniste à l'histamine, à la bradykinine, à la
sérotonine et à la biosynthèse des prostaglandines. La
forte inhibition de l'oedème a été observée
à la troisième heure pour les différents extraits aqueux
à la dose de 500 mg/kg.
Cela suggère que l'action inhibitrice du
décocté des feuilles s'exercerait davantage sur les
cyclo-oxygénases qui sont responsables de la synthèse des
Prostaglandines.
Nos résultats et la nature biphasée de
l'oedème de la patte induit par le formol 1% observés, permettent
de proposer que l'activité significative dans la suppression de la
deuxième phase de l'inflammation puisse être due aux
médiateurs impliqués dans la phase tardive de l'oedème de
la patte de rat. Ceci suggère une probable implication des voies de la
cyclo-oxygénase et de la lipooxygénase dans l'activité de
l'extrait aqueux des feuilles de Petiveria alliacea, Ocimum gratissimum
et Moringa oleifera.

CONCLUSION &
PERSPECTIVES
37
Cette présente étude a montré que l'extrait
aqueux des feuilles de Petiveria alliacea, de Moringa oleifera
et de Ocimum gratissimum sont faiblement toxiques et ont un effet
anti-inflammatoire sur le modèle de l'oedème inflammatoire induit
par le formol 1% chez le rat. Cette activité serait plus importante
à dose élevée et pourrait être lié à
l'inhibition des cyclo-oxygénases et lipoxygénases dans la phase
tardive de l'oedème inflammatoire au formol 1%. Ces résultats
justifient l'utilisation de Petiveria alliacea, de Moringa
oleifera et de Ocimum gratissimum en médecine
traditionnelle africaine dans la prise en charge du processus inflammatoire.
Les résultats obtenus lors de cette étude sont
intéressants, mais des études complémentaires sont
nécessaires pour comprendre les mécanismes moléculaires et
cellulaires de ces effets. Ces études doivent être aussi
orientées vers la détermination des principes actifs dans les
extraits de Petiveria alliacea, de Moringa oleifera et de
Ocimum gratissimum et l'évaluation de leurs effets sur les
signalisations impliquées dans le processus inflammatoire, ainsi que les
enzymes impliquées dans la production des espèces
oxygénées réactives.
L'extrait aqueux de Petiveria alliacea, de
Moringa oleifera et de Ocimum gratissimum a des
propriétés anti-inflammatoires. Les effets, dose et temps
dépendant de ces extraits d'origine naturelle permettent de conclure
qu'elle a également des propriétés
anti-sérotoniques et antihistaminiques. Les propriétés
anti-inflammatoires de Petiveria alliacea, de Moringa oleifera
et de Ocimum gratissimum seraient liées à la
présence de flavonoïdes et de saponines présents dans ces
extraits qui ne sont pas toxiques. Les flavonoïdes sont en effet des
antioxydants tandis que les saponines sont des inhibiteurs des prostaglandines.
Selon la littérature, plus la DL50 est élevée, moins les
extraits de la plante sont toxiques. Selon l'échelle de Hodge &
Sterner [4 3], nos extraits sont faiblement toxiques et sont de la classe IV
des substances chimiques. Toutefois, d'autres investigations devraient
être entreprises pour garantir leur qualité, valider leur
innocuité et leur efficacité.
Une purification de l'extrait aqueux de la feuille la plus
efficace pourrait permettre d'isoler le ou les principes actifs responsable (s)
de ces effets. Et plus tard, la détermination des mécanismes
moléculaires impliqués devrait suivre.
En conséquence, des expériences
ultérieures utilisant des fractions riches en saponosides et en
flavonoïdes sont envisagées pour confirmer cette hypothèse
et comprendre le mécanisme d'action des principes actifs de ces
plantes.

REFERENCES
1.
39
OMS, Stratégie de l'OMS pour la médecine
traditionnelle pour 2014-2023. Genève (Suisse), 2013, 75 p
2. Gaziano JM, Gibson CM. Potential for drug-drug
interactions in patients taking analgesics for mild-to-moderate pain and
low-dose aspirin for cardioprotection. Am J Cardiol. 2006; 97: 23-9
3. Corrado B, Marco T, Colucci R, et al. Role of coxibs in
the strategies for gastrointestinal protection in patients requiring chronic
non-steroidal anti-infllammatory therapy. Pharm Res. 2009; 59: 90-100
4. Zeilhofer HU. Prostanoids in nociception and pain. Bioch
Pharmacol. 2007; 73 :165-74.
5. Chebaibil A, Filali FR, Amine A, Zerhouni M. Effet
bactéricide (in vitro) des extraits aqueux des feuilles du grenadier
marocain (Punica granatum L.) sur des bactéries multirésistantes
aux antibiotiques. International Journal of Biological and Chemical Sciences.
2011 ; 59 : 90-100
6. J.D. Gbenou, J.F. Ahounou, P. Ladouni, W.K.D.D.
Agbodjogbe, R. Tossou, P. Dansou, M. Moudachirou. Propriétés
Antiinflammatoires des extraits aqueux de Sterculia Setigeria Delile et du
mélange Aframomum melegueta k. Schum-Citrus aurantifolia christm et
Panzer. International Journal of Biological and Chemical Sciences. Vol5, No2,
2011 P: 634-641.
7. Olivier B. Y a-t-il une place pour la phytothérapie
dans la prévention des maladies cardiovasculaires ? [Thèse]
Université Joseph Fourier, faculté de pharmacie de grenoble. 2014
; p : 44-60.
8. Horde P. Décoction - Définition.
Sante-médecine. Juin 2014 ; p : 22-30
9. Garden A. Infusion, macération, décoction,
quelles différences. Sante-médecine. Juin 2000 ; p : 17-22
10. Larousse, 2016.
11. Nathan. Points of control in inflammation.
Sante-médecine. Dec 2002; p: 19-26
12. Barton GM. A calculated response: control of inflammation
by the innate immune system. J. Clin. Invest. 2008; 118, 413-420
13. Michael AS, Thompson CG, Abramovitz M. Artemia sauina
as a testorganism for a bioassay. Sci. 1956; 123: 467-505.
14. Ruslan M. Origin and physiological roles of inflammation.
NATURE. July 2008; Vol 454,24
15. (Page consultée le 13/02/2018). En ligne :
16. Gael N, Myriam B, Isabelle D, Carole B, Axel K, Sophie V.
Lack of hepcidin gene expression and severe tissue iron overload in upstream
stimulatory factor 2 (USF2) knockout mice. PNAS. July 17, 2001, vol.98
no.15
17. Blain H, Vuillemin A, Blain A, Jeandel C. Les effets
préventifs de l'activité physique chez les
40
personnes âgées, La Presse Médicale, 24 juin
2000, 29, n° 22
18. Barnes PJ, Anti-inflammatory Actions of Glucocorticoids:
Molecular Mechanisms. Clinical Science, Jun 01, 1998,94(6)557-572
19. Henzen C, Traitement aux glucocorticoïdes : risques
et effets secondaires, Forum Med Suisse. 7 mai 2003, No 19
20. La Lettre d'Oto-rhino-laryngologie et de chirurgie
cervico-faciale. La Presse Médicale. Septembre 2002, no 275
21. Jiofack T, Fokunang C, Guedje N, Kemeuze V, Fongnzossie
E, Nkongmeneck BA et al. Ethnobotanical uses of medicinals plants of two
ethnoecological regions of Cameroon. IJMMS. 2010; 2 (3): 60-79.
22. Alaranta A, Alaranta H, Heliövaara M, Alha P, Palmu
P, Helenius I, Allergic Rhinitis and Pharmacological Management in Elite
Athletes, Medicine & Science in Sports & Exercise. 2005. 37(5):
707-711
23. Sinusite : les approches complémentaires. (Page
consultée le 28/05/17). En ligne :
http://www.passeportsante.net/fr/Maux/Problemes/Fiche.aspx?doc=sinusite-pm-approches-complementaires
24. Olson ME, Combining Data from DNA Sequences and
Morphology for a Phylogeny of Moringaceae (Brassicales), Systematic Botany.
2002; 27(1):55-73.
25. Bennett RN, Mellon FA, Foidl N, Pratt JH, Dupont MS,
Perkins L et al. Profiling Glucosinolates and Phenolics in Vegetative and
Reproductive Tissues of the Multi-Purpose Trees Moringa oleifera L.
(Horseradish Tree) and Moringa stenopetala L. . Agric. Food
Chem., 2003, 51 (12), pp 3546-3553
26. Aissi AK, Pazou EY, Ahoyo TA, Fah L, Fanou B, Koumolou L et
al. Evaluation of Toxicological Risk Related to Presence of Lead and Cadmium in
Moringa oleifera Lam. Leaves Powders Marketed in Cotonou (Benin). Food and
Nutrition Sciences. 2014, 5, 770-778
27. Edoga CO, Njoku OO, Amadi EN, Afomezie PI. Effect of
Aqueous Extract of Moringa Oleifera on Serum Protein of Trypanosoma Brucei-
Infected Rats, International Journal of Science and Technology. January 2013,
Volume 3, No.1
28. Manohar M, Tian M, Moreau M, Park S-W, Woo Choi H, Fei Z
et al. Identification of multiple salicylic acid-binding proteins using two
high throughput screens. Front. Plant Sci. January 2015, p: 12.
29. Ghasi S, Nwobodo E, Ofili JO. Hypocholesterolemic effects
of crude extract of leaf of Moringa
41
oleifera Lam in high-fat diet fed wistar rats. Journal
of Ethnopharmacology. January 2000, Volume 69, Issue 1, Pages 21-25
30. Mehta LK, Balaraman R, Amin AH, Bafna PA, Gulati OD, Effect
of fruits of Moringa oleifera on the lipid profile of normal and
hypercholesterolaemic rabbits. Journal of Ethnopharmacology. June 2003, Volume
86, Issues 2-3, Pages 191-195
31. Ruckmani K, Kavimani S, Jayakar B, Anandan R, Anti-ulcer
activity of the alkali preparation of the root and fresh leaf juice of moringa
oleifera lam. Anc Sci Life. 1998 jan-mar; 17(3): 220- 223.
32. Chitravadivu C, Bhoopathi M, Balakrishnan V, Elavazhagan T,
Jayakumar S. Antimicrobial activity of Laehiums prepared by herbal
venders, South India. American-Eurasian, Journal of Scientific Research. 2009,
vol. 4, pp. 142-147
33. Nikkon F, Saud ZA, Rahman MH, Haque ME. In vitro
antimicrobial activity of the compound isolated from chloroform extract of
Moringa oleifera Lam. Pakistan Journal of Biological Sciences. 2003, 6(22),
1888-1890.
34. Anwar F, Ashraf M, Bhanger MI. Interprovenance variation in
the composition of Moringa oleifera oilseeds from Pakistan. Journal of the
American Oil Chemists' Society, January 2005, Volume 82, Issue 1, pp 45-51.
35. Lipipun V, Kurokawa M, Suttisri R, Taweechotipatr V,
Pramyothin P, Hattori M, Shiraki K. Efficacy of Thai medicinal plant extracts
against herpes simplex virus type 1 infection in vitro and in vivo. Antiviral
Res. 2003, 60 :175-180.
36. Trapti R, Vijay B, Komal M, Aswar PB, Khadbadi. Comparative
studies on anthelmintic activity of Moringa oleifera and Vitex negundu. Asian
Journal of Research Chemistry. 2009, 2(2),181-182
37. Siddhuraju P, Becker K. Antioxidant properties of various
solvent extracts of total phenolic constituents from three different
agro-climatic origins of drumstick tree (Moringa oleifera Lam.). J. Agric. Food
Chem. 2003, 15: 2144-2155.
38. Doughari JH, Pukuma MS, De N. Antibacterial effects of
Balanites aegyptiaca L. Drel. and Moringa oleifera Lam. on Salmonella typhi.
African Journal of Biotechnology. October 2007, Vol. 6 (19), 4 pp. 2212-2215
39. Orwa C, Mutua A, Kindt R, Jamnadass R, Anthony S,
agroforestree Database: a tree reference and selection guide version 4.0. World
Agroforestry Centre, Kenya.2009, p: 60
40.
42
Kpètèhoto WH, Hessou S, Dougnon VT, Johnson RC,
Boni G, Houéto EE et al. Etude ethnobotanique, phytochimique et
écotoxicologique de Ocimum gratissimum Linn (Lamiaceae) à
Cotonou. Journal of Applied Biosciences. 2017, 109 : 10609-10617
41. (Page consultée le 09/09/17). En ligne :
http://uses.plantnet-
project.org/en/Ocimum
gratissimum (PROSEA)
42. (Page consultée le 15 juin 2017). En ligne :
http://www.izf.net/ancien/pages/porto-novo/3462,04
: 44
43. Institut National de la Statistique Appliquée en
Economie (INSAE). Recensement Général de la Population et de
l'Habitat. Cotonou : MDAEP, INSAE, 2013. P : 40
44. Gandonou M. Monographie de la ville de Porto-Novo. 2006 ;
66.
45. HOUGHTON PJ, RAMA A. Laboratory Handbook for the
fractionation of natural axtracts. Pharmacognosy Research Laboratory,
Department of pharmacy, king's College, London. 1998; 212 p.
46. Hodge HG, Sterner JH. Determination of substance acute
toxicity by LD50. American Industrial Hygien Asssociation.1943. 1093-101.
47. Harwig J, Scott P. Brine shrimp (Artemia salina L.)
larvae as a screening system for fungal toxins. Appl.Microbial. 1997; 21:
1011-16.
48. Bhatt KR, Mehta RK, shrivastava PN. A simple method of
recording anti-inflammatory effects on rat paw oedema. Indian Journal of
Physiology and Pharmacology. 1977, Vol2, No4, P:399400.
49. Abena AA, Gbenou JD, Yayi E, Moudachirou M, Ongoka R,
Ouamba JM et al. Comparative Chemical and Analgesic Properties of Essential
Oils of Cymbopogon nardus (l) Rendle of Benin and Congo. African Journal of
Traditional, Complementary and Alternative Medicines. 2007, Vol4, No3,
P:267-272.
50. Organisation Mondiale de la Santé (OMS).
Médecine traditionnelle : Rapport du secrétariat. Conseil
exécutif. 111è sessions. Point 5.7 de l'ordre du jour provisoire.
EB 111/9 du 12 Décembre 2002. 28 p
51. Afolabi C, Akinmoladun E, Ibukun O, Afor E, Obuotor EM,
Farombi EO. Phytochemical constituent and antioxidant activity ofextract from
the leaves of Ocimum gratissimum. Scientific Research and Essay. May 2007, Vol.
2 (5), pp. 163-166
52. Folkard S, Åkersted T, Macdonald I, Tucker P,
Spencer M. Beyond the three-process model of alertness: Estimating phase, time
on shift and successive night effects. J BiolRhythms. 1999, 14(6):577-587.
53.
43
Bah S, Diallo D, Dembele S, Paulsen BS. Ethnopharmacological
survey of plants used for the treatment of schistosomiasis in Niono District,
Mali. J. Ethno pharmacol. 2006; 105: 387-99.
54. Jedlicka, Klimes J. Determination of Water- and
Fat-Soluble Vitamins in Different Matrices Using High-Performance
LiquidChromatography. Chemical Papers. 2005, 59 (3) 202-222.
55. Sene M, Ndiaye M, Barboza FS, Diatta W, SARR A, Ndiaye-Sy
A et al. Activité anti-inflammatoire de l'extrait aqueux des feuilles de
Elaeis guineensis Jacq. (ARECACEAE) sur l'oedème aigu de la patte de rat
induit par la carraghènine. Int. J. Biol. Chem. 2016, Sci. 10(6):
2568-2574
56. Sani YM, Musa AM, Pateh UU, Haruna AK, Yaro AH, Sani MB.
Phytochemical Screening and Preliminary Evaluation of Analgesic and Anti-
Inflammatory Activities of the Methanol Root Extract of Cissus Polyantha.
Bayero Journal of Pure and Applied Sciences. 2014, 7(1): 19-23.
57. Banerjee S, Chanda A, Adhikari A, Das AK, Biswas S.
Evaluation of phytochemical screening and anti-inflammatory activity of leaves
and stem of Mikania scandens (L.) wild. Annals of Medical and Health Sciences
Research, 2014, 4(4): 532-536.
58. Kim HP, Kun HS, Chang HW, Kang SS. Anti-inflammatory
plant flavonoids and cellular action mechanisms. J. Pharmacol. Sci., 2004,
96(3): 229-245.

TABLE DES
MATIERES
47
1
1E'TJI?4 IEE 4
I. CLARIFICATION DES CONCEPTS 5
1.1. Plante
médicinale..............................................................5
1.2. La
Phytothérapie...............................................................5
1.3. La
décoction...................................................................5
1.4.
L'infusion.......................................................................5
1.5. La
macération..................................................................6
1.6. La
trituration.......................................................................6
1.7. L'inflammation 6
1.8. L'inflammation
aigue.........................................................7 1.9.
L'inflammation chronique ..................................................7
1.10. Pathologies
inflammatoires.................................................7 1.11.
Anti-inflammatoires.........................................................8
1.11 .1. Anti-inflammatoire non stéroldiens
..................................8 1.11.2. Anti-inflammatoires
stéroldiens.........................................8 1.11.3.
Anti-inflammatoires d'origine
végétale...............................9
|
II- GENERALITES SUR LES PLANTES UTILISEES COMME ANTI-
|
10
|
INFLAMMATOIRE
.............................................................
11.1. FE TI VERIA ALLIA
CEA............................................................10 11.2. MORINGA
OLEIFERA.............................................................13
11.3. OCIMUM
GRATISSIMUM................................................15
48
HYPOTHESES ET OBJECTIFS . 18
MATERIEL ET METHODES 20
I. CADRE DE L'ETUDE 21
II. MATERIEL . 23
II.1. Matériel végétal
23
II.2. Matériel animal 23
II.3. Equipements-Consommables-Réactifs
23
III. METHODOLOGIE 24
III.1. Phase préparatoire 24
III.1.1. Récolte, séchage, broyage
24
III.1.2. Obtention des extraits 24
III.2. Analyse phytochimique (Screening)
24
III.3. Etude de la toxicité aigüe .
26
III.4. Phase d'expérimentation 26
III.5. Traitement statistique 28
RESULTATS . 29
I. RESULTATS DE LA PHASE PREPARATOIRE 30
I.1. Etude phytochimique . 30
I.2. Rendement des extractions 31
I.3. Etude de la toxicité aigüe
31
II. RESULTATS DE LA PHASE EXPERIMENTALE
32
49
II.1. Evaluation de l'activité anti-inflammatoire .
32
DISCUSSION 34
CONCLUSION ET PERSPECTIVES . 37
REFERENCES 39
TABLE DES MATIERES . 45
ANNEXES a

ANNEXES
b
Annexe 1 : Equipements, consommables.
Appareils utilisés au cours de nos
expérimentations : Balance automatique de type METTLER 3000,
Rotavapor R2000, Réfrigérateur (WESPOINT), Agitateur (VOLTEX),
Agitateur va et vient, Plaque chauffante, Etuve (MEMMERT), Agitateur
magnétique (KILA-WERKE), Extracteur de type Clavenger, Distillateur,
Ultrason, Pléthysmomètre (APELEX 05-7150, Allinde, Bagneux,
France).
Instruments utilisés : Eprouvette,
Tubes à essai stériles, Flacons en verre, Etiquettes, Marqueurs,
Coton, Pipettes, Erlenmeyer, Bécher.
Annexes 2 : Equipement utilisé au
laboratoire et protocole expérimentale du screening
Appareil et instruments : Erlenmeyer, Ballon
à fond rond, Tubes à essais, Pipettes graduées, Plaque
chauffante, Balance électronique, Eau de mer provenant de l'océan
atlantique, Béchers pour recueillir le filtrat, Bocaux pour conserver
les extraits, Chronomètre, Broyeur à couteau pour
pulvériser les feuilles
Réactifs : Acide chlorhydrique,
Réactifs de Meyer, Ammoniaque 5%, Ether chloroformique, Chlorure
ferrique à 1%, Réactif de STIASNY, Acétate de sodium,
Poudre de magnésium, Alcool chlorhydrique, Chloroforme, Alcool
éthylique, Acétate de plomb, Solution aqueuse de phosphate
sodique, Sulfate de sodium anhydre, Acide acétique, Acide sulfurique,
acide 2-[2-(2,6-dichlorophenyl) amnophényl] éthanoïque
(diclofenac), formol 1%, d'acide acétylsalicylique.
Protocole expérimental ayant trait au screening
phytochimique
1) Recherche des alcaloïdes
Elle s'est faite grâce à deux tests :
a. Test général en milieu acide
On mélange 5g de la poudre à 25ml d'acide
chlorhydrique dilué à 5%. Le mélange est
macéré pendant 24heures. On recueille 1mL du filtrat auquel on
ajoute 5 gouttes de réactif de MAYER. En cas présence
d'alcaloïdes, on observe un précipité jaune ou louche dans
le tube.
C
b. Extraction des alcaloïdes
On met 5g de poudre dans 5mL d'ammoniaque dilué au
demi. A ce mélange, on ajoute 25ml d'éther chloroformique et on
laisse macérer pendant 24heures dans un flacon bouché. Le filtrat
est séché sur du sulfate sodique anhydre et ensuite
épuisé avec 5mL d'acide chlorodrique à 5% deux fois de
suite. Au filtrat épuisé, on ajoute 5 gouttes de réactif
de MAYER. En cas de présence d'alcaloïde, le filtrat
précipite ou devient dans le tube.
2) Recherche des composés
polyphénoliques
Dans un erlenmeyer, on met 5g de poudre auxquels on ajoute
100mL d'eau bouillante. Le mélange infusé est laissé 15
minutes sous agitation continue, puis filtré. Ce filtrat réparti
en 2 portions servira aux recherches ci-après :
a) Recherche des tanins
A la première portion du filtrat, nous ajoutons
quelques gouttes de chlorure ferrique à 1%. L'observation d'une
coloration bleu-foncée, verte ou noire indique la présence des
tanins.
Recherche des tanins catéchiques
A 30mL de la seconde portion, nous ajoutons 15mL de
réactif de STIASNY et chauffons le mélange au bain-marie à
90°C pendant 15 minutes. L'apparition d'un précipité rose
indique la présence des tanins catéchiques.
Recherche des tanins galliques
Après récupération du filtrat, celui-ci
a été saturé d'acétate sodique additionné de
quelques gouttes de chlorure ferrique à 1%. Une teinte bleue ou noire
indique la présence de tanins galliques.
b) Recherche de flavonoïdes
A 5mL de la deuxième portion, nous ajoutons 5mL
d'alcool chlorhydrique (réactif de SHINODA) et une pincée de
poudre de magnésium : c'est la réaction de la cyanidine, dite
réaction de SHINODA. L'apparition d'une coloration orangée
(flavones), rouge (flavonols) ou violette (flavonones) indique la
présence de flavonoïdes.
c) Recherche des anthocyanes
Nous additionnons quelques gouttes d'acide chlorhydrique
à 5% à 1mL de la deuxième portion. Ce mélange est
ensuite alcalinisé par ajout de quelques gouttes d'ammoniaque
dilué
d
au demi. Une coloration rouge qui s'accentue et vire au
bleu-violacé ou verdâtre indique la présence
d'anthocyane.
d) Recherche de leuco-anthocyane
A 5mL de la deuxième portion, nous ajoutons 5mL du
réactif de SHINODA. Le mélange est ensuite chauffé pendant
15 minutes au bain-marie à 90°C. L'observation d'une coloration
rouge cerise ou violacée indique la présence de
leuco-anthocyane.
3) Recherche des dérivés
quinoniques
Dans un erlenmeyer, nous mélangeons 2mL d'HCI à
5% et 2g de poudre. A ce mélange, nous ajoutons 20mL de chloroforme et
nous laissons en agitation continue pendant 24 heures. Après
macération, nous ajoutons 5mL d'ammoniaque au mélange
précédent : c'est la réaction de BORN-TRAGER. Une
coloration rose ou rouge violacée indique une réaction
positive.
4) Recherche des saponosides
Ils sont mis en évidence par l'indice de mousse qui
est fourni par le degré de dilution d'un décocté aqueux de
la drogue qui, dans des conditions déterminées, donne une mousse
persistante.
Le décocté de 1g de poudre est
préparé pendant 30 minutes dans 100mL d'eau distillée avec
une ébullition modérée. Le filtrat refroidi puis
ajusté à 100mL est réparti dans 10 tubes à essais
(hauteur 16cm x 16cm de diamètre) en série arithmétique de
raison 1/10ème de concentration du décocté
(successivement 1, 2, 3...10mL de décocté, ajuster le volume de
chaque tube à 10mL avec de l'eau distillée). Après 30
agitations dans le sens de la longueur pendant 15 secondes (deux agitations par
seconde, après avoir bouché avec le pouce), le tube est
laissé au repos pendant 15 minutes. La hauteur de la mousse est
mesurée. Si elle est =1cm dans l'un des tubes, la dilution dans ce tube
est l'indice de mousse cherché. Sinon, l'indice est supérieur
à 100 (négligeable).
5) Recherche de triterpénïdes et de
stéroïdes y compris les cardénolides
Pour cette recherche, nous ajoutons à 1g de poudre 10mL
d'alcool éthylique à 70°C et nous agitons pendant 30
minutes. A ce mélange, nous ajoutons 10mL d'eau distillée puis
2mL d'acétate de plomb à 10% à volume égal V/V.
Après 15 minutes de repos, nous ajoutons au filtrat 2mLde solution
aqueuse de phosphate disodiquephosphate disodique à 10%. Après
15000 minutes de repos, le filtrat est recueilli dans une ampoule à
décanter et extrait à trois
e
reprises avec 5mL de chloroforme (CHCL3). Les solutions
chroniques sont séchées sur du sulfate de sodium anhydre puis
divisées en trois portions et évaporées à
siccité (bain de sable).
a) Recherche de triterpénoïdes
La première portion est solubilisée par
quelques gouttes d'acide acétique. Au mélange obtenu, nous
ajoutons 3mL d'un mélange d'anhydride acétique-acide sulfurique.
Une coloration violette, bleue ou verte indique la présence de
triterpénoïdes.
b) Recherche de stéroïdes
A la deuxième portion, nous ajoutons 2gouttes d'une
solution alcoolique à 2% d'acide dinitrobenzoique et 2 gouttes
d'hydroxyde de sodium à 1N. L'apparition d'une coloration rouge pourpre
ou rouge au vin indique la présence de stéroïdes. C'est la
réaction de KEDDE (également pour les cardénolides).
c) Recherche de cardénolides
Réaction de RAYMOND pour les cardénolides : elle
consiste à ajouter à troisième portion successivement 2
gouttes d'une solution alcoolique à 1% de
métadinitronenzène et 2 gouttes de NaOH à 20%. Une
coloration bleue indique une réaction positive.
6) Recherche de dérivés
cyanogénpoiques
A 15mL d'eau distillée on ajoute 2g de la poudre puis
bouché immédiatement et laissé en macération
pendant 1 heure. Le col de l'erlenmeyer est recouvert de papier imbibé
d'acide picrique et on chauffe pendant quelques minutes. L'apparition d'une
coloration marronne indique le dégagement de HCN.
7) Recherche des mucilages
Nous avons introduit 1mL de décocté à
10% dans un tube à essai et ajouté 5mL d'alcool absolu.
L'appariton d'un précipité floconneux indique la présence
de mucilage après une dizaine de minutes.
8) Recherche de coumarine
A 20mL d'éther on ajoute 1g de poudre puis boucher
immédiatement dans un petit erlenmeyer et laisser en macération
pendant 24 heures. Le filtrat a été ajusté à 20mL
avec l'éther. 5mL de filtrat ont été
évaporés dans une capsule à l'air libre. Au résidu
obtenu, nous avons ajouté 2mL d'eau chaude et partagé la solution
dans deux tubes à essai. Dans l'un des
f
tubes, nous avons ajouté 0,5mL d'ammoniaque à
25%. Le second tube représente le témoin. Nous observons la
fluorescence des deux tubes à essai sous UV à 365nm. Une
fluorescence intense dans le test indique la présence de coumarines.
Ou
10g de poudres sont mis dans un erlen de 500mL. On y verse
180mL d'éthanol et 20mL d'eau distillée. On met l'erlen sous
agitation magnétique pendant une nuit. Après filtration, la
solution est concentrée à l'évaporateur rotatif
jusqu'à siccité. L'extrait hydro-éthanolique
concentré est traité, dans une capsule de porcelaine, avec une
goutte de solution saturée de chlorhydrate d'hydroxylamine 10% et une
goutte de solution alcoolisée de KOH (7,5% de KOH dans
l'éthanol). Ce mélange est chauffé pendant 2 minutes.
Après refroidissement, on ajoute une petite quantité d'HCI 0,5N
et de FeCL3 1%. Un test positif consiste en une coloration violette.
9) Recherche des composés
réducteurs
Le décocté à 10% est obtenu par
ébullition modérée pendant 3 minutes d'un mélange
de 50mL d'eau distillée et de 5g de poudre.
Après refroidissement, le filtrat a été
ajusté à 50mL avec de l'eau distillée. 5mL de filtrat sont
introduits dans un tube à essai. Après le chauffage au bain-marie
à 90°C pendant quelques minutes, on ajoute 1mL de réactif de
fehling (liqueur de fehling A + liqueur de fehling B à volume
égal). On réchauffe le filtrat quelques minutes après.
L'observation d'un précipité rouge vif indique la présence
de composés réducteurs.
10) Recherche des dérivés
anthracéniques a) Anthracéniques libres
A 1g de poudre, on ajoute 10mL de chloroforme et on chauffe
prudemment pendant 3 minutes au bain-marie. Après filtration à
chaud, le mélange est complèté à 10mL avec le
chloroforme. 1mL de l'extrait chloroformique est additionné de 1mL
d'ammoniaque dilué à 1/2 puis agité. L'apparition d'une
coloration rouge plus ou moins intense indique la présence
d'anthracéniques libres.
g
b) Anthracéniques combinés
O-hétérosides
A une partie du résidu épuisé par le
chloroforme, on ajoute 10mL d'eau distillée et 1mL d'acide chlorhydrique
concentré. Le tube à essai maintenu au bain marie bouillant
pendant 15 minutes est ensuite refroidi sous un courant d'eau. L'hydrolysat est
obtenu après filtration et ajustement à 10mL. On
prélève 5mL de l'hydrolysat qu'on agite avec 5mL de chloroforme.
La phase organique soutirée est introduite dans un tube à essai
et additionnée de 1mL d'ammoniaque dilué au Y2 puis agité
(on garde la phase aqueuse). La présence d'anthracénique est
révélée par la coloration rouge plus ou moins intense.
Si la réaction est négative ou faiblement
positive, on recherche les O-hétérosides à génines
réduites. Pour ce faire on prélève 5mL d'hydrolysat qu'on
additionne de 3 à 4 gouttes de FeCl3 (chlorure ferrique) à 10%.
Le mélange chauffé au bain-marie pendant 5 minutes est ensuite
refroidi sous courant d'eau puis agité avec 5mL de chloroforme. A la
phase chloroformique soutirée et introduite dans un tube à essai,
on ajoute 1mL d'ammoniaque au 1/2 puis on agite. Une coloration rouge plus ou
moins intense signe la présence des O-hétérosides à
génines réduites.
C-hétérosides
A la phase aqueuse conservée plus haut, on ajoute 1mL
de FeCl3 à 10%. Le mélange est porté à
ébullition au bain-marie bouillant pendant 30 minutes puis refroidi.
Après agitation avec 5 minutes de chloroforme, la phase chloroformique
est soutirée et recueillie dans un tube à essai. On y ajoute 1mL
d'ammoniaque dilué à Y2 et on agite. Une coloration rouge plus ou
moins intense signe la présence de génines de
C-hétérosides.



