|
UNIVERSITE EVANGELIQUE EN AFRIQUE

B.P. : 3233/BUKAVU
FACULTE DES SCIENCES AGRONOMIQUES ET
ENVIRONNEMENT
EFFETS DE LA SUBSTITUTION DE LA FARINE DE POISSONS PAR
LA FARINE DE GRAINES DE MORINGA (Moringa oleifera) SUR LA CROISSANCE
ET LA SURVIE DE TILAPIA DU NIL (Oreochromis niloticus)
Par: Pùsùhémo AMURI
M'TANIELWA
Mémoire présenté pour l'obtention du
diplôme
d'ingénieur agronome, A0.
Option: Zootechnie
Directeur: Prof. Dr. BALUKU BAJOPE
Co-directeurs:Ass. Ir. AKILIMALI Justin
Ass. ALUNGA LUFUNGULA
Georges (Msc)
Année académique: 2014-2015
PRELUDE
L'archer est un modèle de sage. Quand il a manqué
le milieu de la cible, il en cherche la cause en lui-même.
L'expérience est une lanterne attachée dans notre dos, qui
n'éclaire que le chemin parcouru
(Confucius)
L'imagination est plus importante que la connaissance. La
connaissance est limitée alors que l'imagination englobe le monde
entier, stimule le progrès, suscite l'évolution;
La connaissance s'acquiert par l'expérience. Tout le
reste n'est que de l'information;
Une personne qui n'a jamais commis d'erreurs n'a jamais
tenté d'innover.
(Albert Einstein, 1879-1955)
Pùsùhémo AMURI
M'TANIELWA
DEDICACE
A l'Eternel Dieu vivant, notre Créateur,
Miséricordieux juste pour son amour et sa protection dont nous sommes
toujours bénéficiaires;
A vous nos parents, Yona AKAL'AMISI NGAMA M'TANIELWA et
AVIDJAWA AMURI, pour votre amour, votre tendresse, votre volonté de
faire de nous une personne utile dans la société et pour
d'énormes sacrifices consentis pour mon éducation.
A vous nos frères et soeurs pour votre chaleur
fraternelle.
A vous nos oncles, tantes, cousins, neveux, nièces,
etc. pour votre sympathie.
A la future mère de nos enfants pour nos joies et nos
peines futures.
Pùsùhémo AMURI
M'TANIELWA
REMERCIEMENTS
Au terme de ce travail, il nous est particulièrement
agréable de remercier tous ceux qui ont, d'une manière ou d'une
autre, contribué à sa réalisation.
En premier lieu nos très sincères remerciements
s'adressent à l'Eternel Dieu pour sa protection, son amour et sa
grâce qu'il nous a témoignés gratuitement tout au long de
notre parcours universitaire.
Nous restons particulièrement reconnaissantsau
Professeur Dr. BALUKU BAJOPE qui, malgré ses multiples occupations, a
accepté de dirigé ce travail.
Aux Assistants: Ir. Justin AKILIMALI pour avoir
été avec nous, jours et nuits, entrain de codirigé ce
travail, et Ass. ALUNGA LUFUNGULA Georges pour avoir accepté de nous
encadrer dans le laboratoire et avoir mis à notre disposition toutes les
infrastructures du laboratoire pour la réalisation de nos
expérimentations.
A notre PapaYONA NGAMA M'TANIELWA et toutes ses femmes
BATUULYA IBRAHIMU Mizehituni, TABISHA WABENYE Rohosafi et BERTA ANYEMU, nous
disons grand merci pour vos contributions tant morale, matérielle que
financière.
A nos frères et soeurs TAMALA M'TANIELWA Bahi et
ENGELELA M'TANIELWANgoy pour l'amour fraternel que vous avez envers nous; nous
nous adressons particulièrement à notre soeur MARIE EHONGA et son
mari ALANGA, pour tout ce que vous avez contribué dans la
réalisation de ce travail.
A son excellence BAKWALUFU AMISI KAPOKELA LEZA, sa femme maman
NYOTA SHABANI Safina et tous les membres de cette famille, pour votre
contribution dans la réalisation de ce travail. Nous pensons très
particulièrement à notre soeur Jolie LUSIA AMISI et son mari
MANACEE SUMAHILI pour leur éventuelle
générosité.
A maman MWASI YA OLENGO, son mari MPENDWA WA WAHISEE DOLLARS
et tous les enfants de cette famille, pour leur participation active dans nos
travaux.
A nos amis et connaissances M'MBUMBI ALAMBE Zétrouwest,
NYENGELA SALEH Negsh, NEBO MBUKA, BAKARI LUKUBE Balus, JACQUE BOMBOKO
Justinpour l'amour que vous nous avez montré tout au long de ce
parcours.
A tous les rois de Dieu de mission Mahelo AMANI BI'ESSE, nous
exprimons notre gratitude, pour l'esprit de notre Dieu qui règne dans
vous.
Que, tous ceux qui nous ont aidé, mais non cités
dans cette longue liste trouvent ici l'expression de notre grande
reconnaissance.
Pùsùhémo AMURI
M'TANIELWA
SIGLES ET ABBREVIATIONS
CEP:coefficient d'efficacité protéique
ED: énergie digestible
ENSSTAK : école nationale supérieure des
sciences et des techniques agronomiques de Kétou
FAO: organisation des nations unies pour l'agriculture et
l'alimentation
FB : fibre brute
GPM : gain de poids moyen.
GPQ: gain de poids quotidien
INRA : institut national de recherche agronomique
ISP:Institut Supérieur Pédagogique
Kcal: kilocalorie
OMS:organisation mondiale de santé
PB : protéine brute
PD: protéine digestible
PFRDV : Pays à faible revenu et à
déficit vivrier
RDC: République démocratique du Congo
REGIDESO: Régie de Distribution de l'eau
TCA : taux de conversion alimentaire ou Indice de
consommation
TCS ou SGR: taux de croissance
spécifique ou
TS: taux de survie
UAC : Université d'Abomey Calavi
UEA: Université évangélique en Afrique
UERHA: Unité d'enseignement et de
recherche en hydrobiologie appliquée
LISTE DES TABLEAUX
Tableau 1 : Quelques critères de
qualité d'eau pour la pisciculture des
Tilapias..................5
Tableau 2 : Besoins quantitatifs en acides
aminés essentiels de O. niloticus (g/16g N)........7
Tableau 3 : Besoins en vitamines des tilapias
.........................................................8
Tableau 4:composition (%MS) des
feuillesfraîches de Moringa................................11
Tableau 5 : Proportions des
ingrédients dans les aliments produits
..............................18
Tableau 6. Estimation du prix de revient
d'un kilogramme d'aliment...........................19
Tableau 7. Estimation du coût
alimentaire de production d'un kg de poisson ................20
Tableau 8: Composition analytique des
aliments expérimentaux..................................22
Tableau 9. Répartition des individus
d'O.niloticus dans les structures d'élevage............23
LISTE DES FIGURES
Figure 1 : Instruments de filtration, de
regulation thermique et dispositifs d'elevages
Figure 2 : Différentes
étapes de préparations des aliments
Figure 3 :Processusd'analyses au
laboratoire de la faculté d'agronomie de l'UEA
Figure 4 : Evolution de la
température moyenne journalière au cours de
l'expérience
Figure 5 :Evolution du pH moyen journalier au
cours de l'expérience
Figure 6 :Evolution de l'oxygène
dissous moyen journalier au cours de l'expérience
Figure 7 :Taux de survie
enregistrés
Figure 8 :Taux de croissance
spécifique enregistrés par traitement à la fin de
l'expérience
Figure 9 : Taux de conversion
alimentaire enregistrés par traitement à la fin de
l'expérience
RESUME
La présente étude réalisé au
laboratoire de l'UERHA de l'ISP/Bukavu, est une contribution à
l'amélioration de la productivité du secteur piscicole dans la
province du Sud-Kivu, par la mise au point d'un aliment performant
fabriqué à partir des produits végétaux et des sous
produits agro-industriels locaux. Trois régimes alimentaires ont
été formulés dans lesquels la farine de poisson
(source habituelle de protéines) a été remplacée
par celle de Moringa à 100% (Régime1), à 50%
(Régime2) et à 00% (Régime3). Ces régimes ont
été testés chez les alevins d'Oreochromis
niloticus, d'un poids moyen initial de 2,3 #177; 0,7g,
répartis dans six aquariums (bocaux), pendant 30 jours. Les alevins
étaient nourris à une ration journalière de 10% de leur
biomasse initiale par jour, repartis en 3 repas. La pesée des poissons
se faisait une fois chaque semaine pour réajuster la ration
journalière en fonction de la biomasse réelle. À l'issue
de cette investigation, les résultats ci-après ont
été obtenus: les taux moyen de survie étaient de
91,5#177;1,2%, 100#177;0% et 100#177;0% respectivement pour les poissons
nourris avec le régime1, 2 et 3 ; les taux de Croissance
Spécifiques (TCS ou SGR) de 2,6#177;0,6, 0,8#177;0 et de
0,4#177;0,1%/j, respectivement pour le régime1, 2 et 3 ;les taux de
conversion alimentaire (TCA) de 2,2#177;0,9, 3,2#177;0,1 et
4,3#177;1,1respectivement pour le régime 1, 2 et 3. Du point de vue du
coût de la production des aliments, nous avons trouvé que le
régime1 présente le coût inférieur (0,59 $/kg),
suivi du régime2 (0,81 $/kg) et du régime3 (1,03 $/kg).
Nous recommandons la poursuite de telles expériences
pour le développement de la pisciculture au Sud-Kivu.
Mots-clés: substitution, farine de
poisson, graines de Moringa, croissance, survie,
Oreochromisniloticus
ABSTRACT
The present research realised in UERHA of ISP/Bukavu is a
productivity ameliorating contribution of piscicole sector in south-Kivu region
of a performant aliment made by vegetable products and under regional
agro-industries products. Three alimentary regimes were formuled in which the
fishes flour (current proteins sources) was remplaced by the moringa flour at
100% (First regime), 50% (second regime) and at 00% (thirdregime) of
incorporation. These regime wene tested for alevins of Oreochromis niloticus
with the middle initial weight of 2, 3 #177; 0,7g in six
aquariums within 30 days. The alevins wene fed the daily ration of 10% of their
initial biomasse shaved in 3 feedings. The fishs wene balanced for adjusting
the daily ration in fact of realy biomasse. At the issue of this investigation,
the global resultants were obtained as followed: the survival pourcent wene
91,5#177;1,2%, 100#177;0% and 100#177;0% respectly for the first, second and
third regime. Concerning zootechnics settings, the following resultants wene
obtained: the specific growth pourcent (TCS or SGR) for the three regimes are
2,6#177;0,6; 0,8#177;0 and 0,4#177;0,1% daily restectly for the first, the
second and the third regime. Concerning production cost of aliments, we have
found that the first show an inferior cost (0,59 $/kg), followed by the
second(0,81 $/kg)and the third (1,03 $/kg).
Key-words: substitution, fish's flour,
moringa crops, growth, survial Oreochromis niloticus
INTRODUCTION GENERALE
Les pêches de capture et l'aquaculture ont produit en
2008 environ 142 millionsde tonnes de poissons. Sur ce total, 115 millions de
tonnes étaientdestinées à la consommation humaine, soit
une offre apparente par habitant de17 kg de poissons, ce qui représente
un record absolu. En 2008, les disponibilités de poissons par habitant,
hors Chine, étaient estimées à 13,7 kg,(FAO, 2010)
À l'échelle mondiale, le poisson a assuré
à plus de 1,5 milliard de personnes près de 20% de leurs apports
moyens en protéines d'origine animale et à 3,0 milliards de
personnes, 15% de leurs apports en protéines d'origine animale. En 2007,
les disponibilités moyennes apparentes de poisson étaient de 15,1
kg par personne et par an dans les pays en développement et de 14,4 kg
dans les pays à faible revenu et à déficit vivrier
(PFRDV). Dans les PFRDV, où la consommation de protéines
d'origine animale est relativement faible, le poisson contribue de
manière appréciable à l'apport total en protéines
d'origine animale jusqu'à hauteur de20,1%, et sa contribution est
probablement sous-estimée dans les statistiquesofficielles, qui ne
prennent pas pleinement en compte la production des pêchesartisanales et
de subsistance, (FAO, 2010).
L'offre mondiale de poisson pour l'alimentation humaine, 11,3
kg/personne en 1980, a atteint le niveau record de 18,8 kg/personne en 2011
(FAO, 2012).
Les captures de pêche sont restées stables depuis
30 ans autour de 90 millions de tonnes dont 60 à 67 millions de tonnes
utilisées pour l'alimentation humaine. La hausse de la demande a donc
été couverte par les produits d'élevage dont la production
mondiale a connu un essor spectaculaire, passant de moins de 4 millions de
tonnes en 1980 à 63 millions de tonnes en 2011, (FAO, 2012).
L'élevage intensif de poissons ne s'est
développé qu'à partir des années 1960, avec
l'apport de nourriture sous forme d'aliments composés. Les farines et
huiles de poisson ont été utilisées comme
ingrédients majoritaires des aliments aquacoles, notamment pour les
espèces de haut niveau trophique comme les salmonidés (truites,
saumons) et les poissons marins (MEDALE, et al., 2013).
Aujourd'hui, 46 % des poissons sur le marché mondial
proviennent de l'élevage, alors que cette part ne représentait
que 9% en 1980. L'aquaculture poursuit donc son essor à un rythme plus
rapide que celui de tous les autres secteurs de production alimentaire
d'origine animale. Cet essor prodigieux est le résultat des recherches
et d'innovations dans la maîtrise de la conduite des élevages et
surtout dans l'alimentation (FAO, 2008).
Ces progrès spectaculaires de l'aquaculture sont moins
visibles dans certaines régions du globe. L'Afrique subsaharienne
continue d'occuper une place mineure (0,16 %) en dépit de son potentiel
naturel (IGA-IGA, 2008). La RDC possède un important potentiel de
ressources naturelles et minérales. Son économie est fortement
tournée vers l'exportation des produits miniers. L'agriculture reste la
principale activité en milieu rural, mais souffre d'une insuffisance
voire d'absence de mécanisation, (MASTAKI, 2006).
Bien que le pays dispose d'énormes potentialités
agricoles, les populations demeurent largement exposées aux risques
d'insécurité alimentaire. Son accroissement démographique
de l'ordre de 3,3% par an en moyenne, avec comme fait nouveau, une population
urbaine représentant environ 34% de la population totale, induit une
très forte augmentation de la
La province du Sud-Kivu est l'une des provinces de la RDC
frappées par l'insécurité alimentaire. Son taux de
malnutrition sévère est le plus élevé soit 57,8% en
2010 (ULIMWENGU, 2011). Elle accuse le plus faible apport en calories du pays,
soit 1560 calories par jour et par habitant en 1997, soit un déficit de
32,14 % par rapport à la norme de l'OMS. Cette norme est de 2700 par
jour et par habitant (http://www.mangerbouger.fr/) et un écart à
la moyenne nationale de -15 % et cela, malgré l'importance de sa
population agricole évaluée à 83,9% (MASTAKI, 2006).
Face à ces problèmes, le développement de
l'aquaculture, et plus particulièrement de la pisciculture, est une des
solutions pour y pallier. Pour SIDDHURAJU et BECKER (2003), la contrainte
majeure à l'émergence de la pisciculture, dans beaucoup de pays,
est le coût de l'alimentation. L'utilisation de la farine de poisson
comme principale source de protéines dans les aliments destinés
à l'aquaculture est à l'origine du coût onéreux de
ces aliments et ainsi les pisciculteurs se heurtent à des
problèmes de rentabilité. Une pisciculture durable
nécessite donc, l'utilisation de sources de protéines autres que
les farines de poissons.
Le Sud-Kivu a un grand potentiel pour le développement
de la pisciculture pouvant permettre à résoudre tant soit peu le
problème de malnutrition extrêmement aigu dans la région.
Cependant, l'un des freins majeurs pour la promotion de cette activité
reste le manque d'aliments de bonne qualité nutritionnelle et facilement
accessibles aux pisciculteurs. (MASILYA, 2011).La farine de poissons,
étant en général, la composante majeure des aliments en
aquaculture, cette source conventionnelle de protéines représente
40 à 60 % des protéines totales dans les aliments traditionnels
pour les poissons (IGA-IGA, 2008). Son prix d'achat élevé a
orienté notre étude vers la recherche des sources alternatives de
protéines, en particulier vers celles qui ne sont pas directement
utilisables pour la consommation humaine et habituellement
réputées riches ou très riches en protéine.
L'étude est ainsi bâtit sur trois questions
essentielles:
ü Serait-il possible de remplacer partiellement ou
totalement la protéine animale par la protéine
végétale dans les aliments de poissons ?
ü Quel serait le taux de substitution des graines de
Moringa auquel il fallait remplacer la farine de poisson ?
ü Cette substitution n'aurait-elle pas un impact
négatif sur les paramètres de croissance et de taux de survie des
tilapias ?
Les hypothèses qui ont été émises
sont les suivantes :
· La farine de graines de Moringa remplacerait avec
succès une proportion significative des protéines issues de
farine de poissons, avec des bénéfices nutritionnels,
économiques et environnementaux considérables.
· Il existerait un taux de substitution auquel la farine
de graines de Moringa remplacerait la farine de poisson avec succès.
· La possibilité de remplacer la farine de
poissons par la farine de graines de Moringa serait un moyen efficace pour
résoudre les problèmes de rentabilité en pisciculture et
améliorerait les paramètres de croissance de tilapia.
L'objectif global de cette étude est de contribuer
à l'amélioration de la productivité du secteur piscicole
au Sud-Kivu. De cet objectif global, découlent les objectifs
spécifiques suivants:
· Mettre en place un aliment performant (qui assure une
croissance optimale tout en garantissant un produit sain et de qualité)
et à un prix accessible (prix stable et modéré), à
partir des produits végétaux et des sous-produits
agro-industriels.
· déterminer le taux optimum de substitution de la
farine de poisson par celle de graine de Moringa oleifera dans la
formulation d'aliments destinés aux tilapias et déterminer la
valeur nutritive des différents aliments fabriqués.
· Evaluer les paramètres de croissance et le taux
de survie des tilapia soumis à 3 niveaux de substitution de la farine se
poisson par celle de Moringa.
Le choix de ce sujet a été dicté par les
problèmes observés dans nos milieux, notamment le faible
rendement piscicole lié au manque d'aliment de meilleure
qualité.La présente étude permet de proposer aux
pisciculteurs locaux un aliment performent composé sur base des produits
et sous-produits locaux.
CHAPITRE I. GENERALITES SUR LE TILAPIA
1.1. DESCRIPTION ET SYSTEMATIQUE
Le terme tilapia est un terme générique qui
englobe 1524 espèces mais du point de vue systématique, les
tilapias appartiennent à la classe des Téléostéens,
à l'ordre des Perciformes, à la famille des Cichlidés et
à la sous-famille des Tilapiinés, un groupe de poissons
exclusivement africain. (TREWAVAS, 1983).
Trois genres sont reconnus depuis la dernière
révision taxonomique dont : Tilapia, Sarotherodon et Oreochromis
(TREWAVAS, 1983).
Outre des caractéristiques anatomiques, le
critère pour la distinction de ces 3 genres est basé sur la
biologie reproductive :
v Incubation des oeufs sur substrat avec garde biparentale,
macrophytophages: Tilapia;
v Incubation buccale avec garde biparentale ou paternelle,
planctonophages: Sarotherodon ;
v Incubation buccale avec garde uniparentale maternelle,
planctonophages: Oreochromis.
Pratiquement tous les tilapias de grande taille appartiennent
au genre Oreochromis;au sein de cet ensemble, le tilapia du Nil,
Oreochromis niloticus, représente l'espèce la plus
importante, non seulement pour son taux de croissance élevé ou
son adaptabilité à une grande diversité de conditions
d'élevage, mais aussi en raison de la demande élevée des
consommateurs pour ce poisson (AUGUSTE, 2013).
L'espèce O. niloticus, retenue pour notre
étude, est facilement reconnaissable grâce aux bandes verticales
régulières noires qui existent sur la nageoire caudale. La teinte
générale est grisâtre, relativement foncée chez
l'adulte. Le dos est vert-olive, les flancs sont pâles et le ventre
blanchâtre(TREWAVAS, 1983).
1.2.EXIGENCES ECOLOGIQUES
De nombreuses études de terrain et de laboratoire
montrent que O. niloticus est une espèce relativement eurytope,
c'est-à-dire, adaptée à de larges variations des facteurs
écologiques du milieu aquatique et colonisant des milieux
extrêmement variés. Dans l'habitat naturel, cette espèce
peut supporter des températures comprises entre 14 et 31 °C, mais
l'intervalle de tolérance thermique observé en laboratoire est
plus large: 8 et 40°C, pendant plusieurs heures. Les meilleures
performances de croissance sont observées entre 22 et 28°C.
(IGA-IGA, 2008). A 15 et à 30°C, la reproduction s'arrête et
le grossissement sera très ralenti (LIETAR, 1984).De plus, O.
niloticus peut survivre dans des eaux dont la salinité est proche
de 30 % et dont le pH variede 8 à 11. MELARD (1986) confirme que cette
espèce survit également durant plusieurs heures à des
teneurs en oxygènedissous très faibles, de l'ordre de 0,1 ppm. Le
preferendum physico-chimique est présenté dans le tableau 1
ci-après
Tableau 1 : Quelques critères de qualité de
l'eau pour la pisciculture des Tilapias
|
Paramètres physico-chimiques de
l'eau
|
Valeurs
|
|
Gamme de température (°C)
|
8 à 40
|
|
Limite létale en oxygène (mg/l)
|
2 à 3
|
|
pH : gamme de tolérance
|
5 à11
|
|
Concentration létale en CO2 (mg/l)
|
>72,6
|
|
Concentration létale en
NH3-NH4+ (mg/l)
|
> 4 à pH 7,3 - 7,5
|
|
Turbidité (ppm)
|
13000
|
|
Salinité %0
|
< 20 - 35
|
Source : BALARIN ET HATTON (1979).
1.3. ANATOMIE ET PHYSIOLOGIE DU TUBE DIGESTIF
L'appareil digestif d'O. niloticusest simple et peu
spécialisé. On distingue schématiquement et dans l'ordre
antéropostérieur: les dents (maxillaires et pharyngiennes),
l'oesophage, un estomac en forme de sac, et un long et sinueux intestin
caractéristique des animaux à chaîne alimentaire courte.
Une étude histologique de l'estomac de O. niloticus
révèle une structure autorisant une grande possibilité de
distension, d'où une accommodation facile en cas de larges variations
dans la quantité des particules ingérées. L'intestin est
différencié en un duodénum antérieur court,
à parois minces, et une section postérieure très longue,
avec un plus petit diamètre. La longueur totale de l'intestin entier
varie de 5 à 8 fois la longueur du corps (MORIARTY, 1973).
Dans l'estomac, la digestion se fait en deux temps; les
cellules épithéliales sécrètent d'abord des mucines
neutres et absorbent les composés aisément digestibles tels que
les disaccharides et les acides gras courts. Ensuite, le milieu devient de plus
en plus acide alors que le pH habituel d'une forte activité digestive
chez la plupart des poissons est de 2 - 2,2 ; on enregistre dans un
estomac de O. niloticus,en pleine digestion, des pH de 1,25. Dans ces
conditions, la chlorophylle est décomposée et la lyse des parois
cellulaires des algues bleues est possible. La digestion se poursuit par la
suite dans l'intestin à un pH de 6,8 à 8,8 (MORIARTY, 1973).
La prise alimentaire en milieu contrôlé a lieu
essentiellement en période éclairée, et
l'ingéré met 9 à 11 heures pour traverser le tube digestif
chez l'adulte et moins de 2 heures chez le juvénile (BOWEN, 1982).
1.4. REGIME ALIMENTAIRE
Plusieurs travaux relatifs aux contenus stomacaux d'O.
niloticusrévèlent qu'en milieu naturel l'espèce est
essentiellement phytoplanctonophage, mais peut aussi ingérer des algues
bleues, du zooplancton ainsi que des sédiments riches en
bactéries et diatomées (MORIARTY, 1973).
En milieu artificiel (système de pisciculture), cette
espèce est pratiquement omnivore, valorisant divers déchets
agricoles (tourteaux d'oléagineux, drèches de brasserie, etc.),
tirant parti des excréments de porcs ou de volailles, de déchets
ménagers, acceptant facilement des aliments composés sous forme
de granulés ou pulvérulents.
Il convient de relever que l'acidité gastrique
particulièrement forte chez O. niloticus lui permet
d'être parmi les rares espèces à pouvoir digérer les
cyanophycées (abondantesource de protéines), sans concurrence
notable avec d'autres espèces piscicoles dansl'écosystème
aquatique (LAUZANNE, 1988).
Cette capacité phénoménale d'adaptation
à diversaliments et déchets est à la base de sa haute
potentialité pour la pisciculture.
Le spectre alimentaire de ce tilapia est donc très
large: c'est une espèce opportuniste, qui est capable de se nourrir
à partir des aliments les moins digestibles. Le degré
d'opportunisme de l'espèce est très grand et son régime
alimentaire est souvent plus proche de celui des poissons omnivores ou
détritivores que des herbivores stricts (BOWEN, 1982).
1.5. BESOINS NUTRITIONNELS DE TILAPIAEN ELEVAGE INTENSIF
A. Les besoins en
protéines
Il existe une abondante littérature sur les besoins ou
les teneurs optimales en protéines des rations destinées aux
tilapias. Selon la taille des poissons et la teneur énergétique
des rations, les taux de protéines brutes recommandés peuvent
varier de 25 à plus de 35 % (DE SILVA et al., 1985). JAUNCEY
et ROSS (1982) suggèrent un optimum de 40 % avec un rapport
protéines : énergie (P/E) de 27,75 mg/kJ. WANet al.
(1985), qui utilisent des régimes purifiés contenant de la
caséine et de la cellulose en teneurs variables, rapportent que la
meilleure croissance d'alevins de O. niloticus (3 - 10 g) est
réalisée avec un régime à 40 % de protéines
et contenant un niveau d'énergie digestible suffisant pour le poisson.
Les niveaux d'ingestion pour une croissance maximale avec un tel régime
sont estimés à 502 - 543 kJ d'énergie digestible et 1,6 -
1,7 g d'azote/kg de poids vif/jour (soit un rapport PD/ED de 20 mg/kJ).
KAUSHIKet al. (1993) trouvent des valeurs proches de
ces dernières: le maximum de croissance est obtenu avec un régime
à 32 % de protéines brutes et un rapport PD/ED de 18mg/kJ, le
besoin optimum en protéines étant estimé à
10-12g/kg de poids vif/jour.
Les travaux relatifs aux besoins en acides aminés des
tilapias sont peu nombreux. Les besoins en acides aminés essentiels sont
présentés dans le tableau 2 ci-après.
Tableau 2 : Besoins quantitatifs en acides aminés
essentiels de O. niloticus (g/16g N)
|
Acides aminés essentiels Besoins quantitatifs
|
(g/16gN)
|
|
Arginine
|
4,1
|
|
Histidine
|
1,7
|
|
Isoleucine
|
3,1
|
|
Leucine
|
3,4
|
|
Lysine
|
4,6
|
|
Méthionine + cystine
|
3,2
|
|
Phénylalanine + tyrosine
|
5,6
|
|
Thréonine
|
3,8
|
|
Tryptophane
|
1,0
|
|
Valine
|
5,6
|
Sources : SANTIAGO et LOVELL (1988), adapté par
KAUSHIKet al. (1993)
B. Besoins en lipides
L'apport de lipides dans l'alimentation des poissons est
d'abord indispensable pour satisfaire les besoins en acides gras essentiels,
acides gras non synthétisés par l'organisme et nécessaires
au métabolisme cellulaire (pour la synthèse des prostaglandines
et composés similaires) ainsi qu'au maintien de
l'intégrité des structures membranaires.
Les lipides servent aussi de vecteur lors de l'absorption
intestinale des vitamines liposolubles (vitamines A, D, E, K) et des pigments
caroténoïdes.
Enfin, les lipides, généralement bien
digérés, jouent également un rôle majeur pour la
fourniture d'énergie, rôle d'autant plus important chez les
poissons que la majorité de ces derniers digèrent mal les
glucides complexes (GUILLAUMEet al., 1999).
La quantité de lipides à apporter pour un
régime dépend de la source de matières grasses et de
l'équilibre protéines/énergie du régime. En
utilisant des régimes isocaloriques à teneurs en lipides
variables, DE SILVA et al. (1985) mettent en évidence une
épargne des protéines chez l'alevin du tilapia rouge, qui
augmentait avec l'incorporation croissante des lipides dans le régime,
jusqu'à un maximum de 18 %. Dans une étude portant sur
l'hivernage des tilapias, VIOLAet al. (1983) observent que la
supplémentation du régime en acides gras polyinsaturés
n'engendre des dépôts que dans les viscères. Des
observations semblables sont rapportées par HANLEY (1991) pour O.
niloticus.TAKESHIet al. (1983) ont montré que chez les
tilapias, le besoin en acides gras de la série oméga 6 (acide
linoléique 18: 2n-6) est plus important. Ils évaluent ce besoin
à 0,5 % du régime. Ce chiffre nous est également
rapporté par KAUSHIKet al. (1993). Les mêmes auteurs ont
par ailleurs montré que l'apport d'acides gras autres que le 18 : 2n-6
ne stimule pas la croissance chez O. niloticus.
C. Besoins en vitamines et
minéraux
Si les besoins sont connus avec une précision notable
chez les salmonidés où ils ont été établis
à partir de régimes purifiés, les études
réalisées sur des tilapias sont plutôt limitées,
bien que quelques données existent. Dans la plupart des cas, les
nutritionnistes et les fabricants d'aliments en sont réduits à
utiliser les normes établies pour les salmonidés. Un vaste
travail de détermination des besoins reste donc à faire, bien que
tout porte à croire que les différences interspécifiques
ne soient pas très grandes. TACONet al. (1982)ont
proposé un prémix vitaminique pour tilapia sur la base des
besoins connus chez les salmonidés (tableau3).
Les tilapias, à l'instar de tous les poissons, ont
besoin de minéraux qui sont des constituants de certains tissus
(formation squelettique surtout) ou de certaines molécules, servant de
cofacteurs enzymatiques et participant à l'équilibre ionique
intra- et extracellulaire ainsi qu'à la régulation des fonctions
endocrines. Ces besoins sont en partie satisfaits grâce à leur
capacité d'absorber des minéraux contenus dans l'eau. Les besoins
en quelques vitamines sont indiqués dans le tableau 3
ci-après :
Tableau 3 : Besoins en vitamines des tilapias
|
Vitamines
|
Besoins en (g/kg aliment)
|
|
Thiamine (Vit. B1)
|
-
|
|
Riboflavine (Vit. B2)
|
6
|
|
Pyridoxine (Vit. B6
|
-
|
|
Acide pantothénique (Pantothénate)
|
10
|
|
Inositol
|
-
|
|
Biotine (Vit. H)
|
-
|
|
Acide folique
|
-
|
|
Acide para-N-benzoïque
|
-
|
|
Choline
|
26 - 125
|
|
Niacine (AC. nicotinique ou Vit. P.P.)
|
-
|
|
Cyanocobalamine (Vit. B12)
|
-
|
|
Rétinol (Vit. A)
|
-
|
|
Acide ascorbique (Vit. C)
|
50
|
|
Cholécalciférol (Vit. D3)
|
-
|
Sources : TACONet al. (1982).
D. Besoins en
énergie
L'efficacité dans l'utilisation des nutriments d'un
régime chez le poisson est généralement
appréciée en termes de pourcentage de rétention des
protéines ou d'énergie. KAUSHIKet al. (1993) estiment
les besoins énergétiques d'entretien de O. niloticus
à 70 kJ/kg de poids vif/j (à température comprise
entre 28-30°C). Par rapport aux autres espèces, O. niloticus
fixe de manière générale, avec une meilleure
efficacité, les protéines ingérées. Les mêmes
auteurs rapportent que le taux de fixation des protéines et
d'énergie est supérieur à 55% chez cette espèce,
contre 30-50 % chez la truite arc-en-ciel, le poisson-chat américain ou
la carpe.
La rétention de l'énergie sous forme non
protéique serait par contre beaucoup plus faible chez le tilapia (30-41
%).
1.6. CROISSANCE ET REPRODUCTION
1.6.1. Croissance
En général, O. niloticus est connue
pour sa croissance rapide, elle présente un indice de croissance plus
performant que les autres espèces de tilapia. Sa durée de vie est
relativement courte (4 à 7 ans), sa vitesse de croissance est
extrêmement variable selon les milieux, et peut atteindre jusqu'à
un poids de 5Kg. Dès que les individus atteignent l'âge de
maturité, les sujets mâles présentent une croissance plus
rapide que les femelles et atteignent une taille nettement supérieure,
dans de petites surfaces, (RUWET et al., 1975).
1.6.2. Reproduction
Pour ce qui est de la reproduction, dans les milieux naturels,
la taille de première maturation d'O. niloticusvarie
généralement entre 14 et 20 cm. Toutefois, cette taille de
maturité peut varier au sein d'une même population en fonction des
conditions fluctuantes du milieu (déficit alimentaire qualitatif et
quantitatif, dimensions réduites du milieu, etc.). En conditions
stressantes de pisciculture rurale mal conduite, O.niloticus peut se
reproduire dès l'âge de trois mois, à un poids
inférieur à 50 g, (RUWET et al., 1975).
La période de reproduction de cette espèce est
exponentiellement continue pendant toute l'année, si la
température de l'eau est supérieure à 22°C, et il
peut se reproduire tous les 30 à 40 jours. Ainsi, quand mâles et
femelles sont élevés ensemble, la population s'accroît
rapidement et l'on peut obtenir, en fin de cycle, beaucoup d'individus «
nains », difficilement commercialisables. Parmi les méthodes
préconisées pour pallier ce défaut, l'association à
un prédateur Hemichromis fasciatus apparaît dans
l'état actuel des connaissances comme la solution la plus
adaptée.
Toutes ces caractéristiques de O. niloticus
démontrent, non seulement la plasticité de l'espèce
à s'adapter à des conditions diverses, mais expliquent aussi sa
haute résilience, à savoir : sa capacité à
revenir rapidement, après perturbation, à un seuil optimum de
densité dans son milieu naturel,(RUWET et al., 1975).
CHAPITRE II. GENERALITES SUR LE MORINGA (Moringa oleifera)
2.1. ORIGINE ET CLASSIFICATIONBOTANIQUE
Moringa oleifera appartient à une famille
monogénérique d'arbres et arbustes, les Moringacées. Il
semble être originaire des régions d'Agra et de Oudh, au Nord-est
de l'Inde, au Sud de la chaîne de montagne de l'Himalaya. Moringa
oleifera est mentionné dans le « ShushrutaSanhita »,
écrit au début du premier siècle avant J-C, sous le nom de
« Shigon ». Mais, il semble que la culture de cet arbre en Inde ait,
en fait, été établie il y a plusieurs milliers
d'années. Les Indiens savaient que les graines, qu'ils utilisaient en
médecine, contenaient de l'huile comestible. Il semblerait
également que la plupart des gens connaissaient sa valeur en tant que
fourrage ou comme légume, (ODEE, 1998).
2.2. EXIGENCES ECOLOGIQUES
Cet arbre se rencontre, à l'état naturel,
jusqu'à 1000 m d'altitude; il pousse relativement bien sur les versants,
mais est plus répandu dans les zones de pâturages et les bassins
des rivières. Il pousse rapidement, jusqu'à 6 ou 7 mètres
en un an, même dans des zones recevant moins de 400 mm de
précipitations annuelles, (NIKOLOUS et al., 2001) .
Dans la langue Dravidienne (sud de l'Inde), on trouve diverses
appellations locales pour désigner cet arbre, mais la plupart
dérivent du nom générique « Morunga ». En
anglais, on le connaît sous les noms de « Horseradishtree »,
« Drumsticktree », « Never die tree », « West Indian
Ben tree », ou encore « Radishtree », (NIKOLOUS et al.,
2001) ).
2.3. AIR DE DISRIBUTION
Moringa oleifera est aujourd'hui cultivé
à travers le Moyen-Orient, ainsi que tout le long de la ceinture
tropicale. Il a été introduit en Afrique de l'Est au début
du 20ème siècle. Au Nicaragua, le « Marango » (nom
local de Moringa oleifera) a été introduit dans les
années 1920, comme plante ornementale et utilisé dans les haies
vives. Bien qu'étant répertorié dans les inventaires
forestiers à travers tous les pays, c'est dans la partie occidentale
qu'il est le plus répandu et qu'il se développe le mieux. Il n'y
est pas cultivé, mais on le connaît pour ses capacités de
résistance à la sécheresse et aux maladies,(NIKOLOUSet
al., 2001).
2.4. IMPORTANCES
2.4.1. Importance pratique
Les nombreuses propriétés valorisables de cette
plante en font un sujet d'étude très intéressant: la forte
teneur en protéines des feuilles, des brindilles et du tronc; la forte
teneur en protéines et en huile des graines; la forte teneur des graines
en polypeptides ayant la capacité de former des agrégats avec
diverses particules en suspension dans l'eau; la présence, dans les
feuilles, de facteurs de croissance; et enfin, la forte teneur en sucres et en
amidon de la plante en elle-même.
De plus, la plupart des organes de l'arbre ne contiennent pas
de toxines qui pourraient restreindre leur utilisation dans l'alimentation
humaine ou animale (NIKOLOUSet al., 2001) .
Pour la simplicité et la clarté du texte, le
terme « Moringa » nous l'utilisons pour désigner Moringa
oleifera dans la suite de notre travail.
2.4.2. Importance
socio-économique
Moringa est l'un des arbres tropicaux les plus utiles. Il se
propage relativement facilement, aussi bien de manière
végétative que sexuée, et il est peu exigeant en eau et
matières minérales. Ainsi, sa production et son entretien sont
aisés. L'introduction de cette plante au sein d'une ferme, dans un
environnement riche en biodiversité, peut être
bénéfique à la fois pour l'exploitant et pour
l'écosystème environnant,
(http://www.moringanews.org).
2.5. MORPHOLOGIE ET CARACTÉRISTIQUES PHYSIOLOGIQUES
Moringa est un arbre pérenne, à croissance
rapide, qui peut atteindre 7 à 12 mètres de hauteur et dont le
tronc mesure 20 à 40 cm de diamètre.
v Tronc: le tronc est
généralement droit, mais il est parfois très peu
développé. En général, il atteint 1,5 à 2
mètres de haut avant de se ramifier, bien qu'il puisse parfois atteindre
les 3 mètres.
v Feuilles: les feuilles, alternes et bi ou
tripennées, se développent principalement dans la partie
terminale des branches. Elles mesurent 20 à 70 cm de long, sont
recouvertes d'un duvet gris lorsqu'elles sont jeunes, ont un long
pétiole avec 8 à 10 paires de pennes composées chacune de
deux paires de folioles opposés, plus un à l'apex, ovales ou en
forme d'ellipse, et mesurant 1 à 2 cm de long (MORTON, 1991).
v Fleurs: les fleurs mesurent 2,5 cm de large
et se présentent sous forme de panicules axillaires et tombantes de 10
à 25 cm. Elles sont généralement abondantes et
dégagent une odeur agréable. Elles sont blanches ou couleur
crème, avec des points jaunes à la base. Les sépales, au
nombre de cinq, sont symétriques et lancéolés. Les cinq
pétales sont minces et spatulés, symétriques à
l'exception du pétale inférieur, et entourent cinq
étamines.
v Fruits: les fruits forment des gousses
à trois lobes, mesurant 20 à 60 cm de long, qui pendent des
branches. Lorsqu'ils sont secs, ils s'ouvrent en trois parties. Chaque gousse
contient entre 12 et 35 graines.
v Graines: les graines sont rondes, avec une
coque marron semi-perméable. La coque présente trois ailes
blanches qui s'étendent de la base au sommet à 120 degrés
d'intervalle. Un arbre peut produire 15000 à 25000 graines par an. Une
graine pèse en moyenne 0,3g et la coque représente 25% du poids
de la graine (MAKKAR et BECKER, 1997). La composition analytique des feuilles
et des graines de moringa est données dans le tableau 5
ci-après.
Tableau 4 : Composition chimique (% MS) des feuilles
fraîches et des fruits de Moringa
|
Fraction
|
MS (%)
|
PB
|
FB
|
Ca
|
P
|
|
Feuilles fraîches
|
18,7
|
29,0
|
19,1
|
2,06
|
0,24
|
|
Fruits
|
10,7
|
20,7
|
27,0
|
-
|
-
|
Légende : MS : matières
sèches ; PB : protéine brute ; FB : fibre
brute ; Ca : l'élément calcium ; P :
l'élément phosphore
Source : (MARCH 1994)
CHAPITRE III. MILIEU, MATERIELS ET METHODES
3.1. MILIEU D'ÉTUDE
Les étapes
importantes pour la matérialisation de ce travail ont été
réalisées successivement à la station piscicole de
Nyakabera (une station piscicole du Service National d'Aquaculture), pour la
capture des alevins d' O. niloticus, au laboratoire de l'UERHA de l'
ISP/Bukavu, pour la préparation des aliments et l'élevage
proprement-dit et enfin au laboratoire de la faculté d'agronomie de
l'UEA/Bukavu pour la détermination de la composition chimique des
aliments expérimentaux.
L'UERHA dispose de deux structures expérimentales: une
écloserie et d'un circuit fermé pour l'élevage larvaire.
La présente expérimentation s'est déroulée dans le
circuit fermé constitué de 6 aquariums.
Chacun des aquariums est muni d'un système autonome
d'alimentation (robinet) et d'évacuation d'eau, protégé
par des crépines. La circulation d'eau permet ainsi un cycle continu
d'approvisionnement en eau riche en oxygène dissous (O2) et
l'évacuation de déchets de bassins.
L'eau utilisée était celle de distribution
fournie par la REGIDESO. Avant d'être utilisée dans le circuit
fermé, elle était stockée pendant au moins 24heures dans
un bac de réserve. Cette opération avait pour but
d'éliminer, par évaporation, le chlore pouvant être
nuisible aux poissons.
Par la suite, l'eau est mise en circulation continue par une
pompe électrique à immersion, placée dans le bac de mise
en charge. Cette pompe assure la distribution d'eau dans les 4 aquariums
contenant les poissons.
De là, l'eau est envoyée, par gravitation, par
des tuyaux vers le filtre mécanique (vortex,) qui, à son tour, la
dirige vers le bac de décantation, ensuite vers le bac de mise en charge
et le cycle recommence.
Pour prévenir d'éventuelles maladies aux
poissons maintenus dans les aquariums, l'eau passe par une série
d'étapes de son traitement, à savoir : la filtration
mécanique, la filtration biologique, l'aération, le chauffage.
Ø La filtration: au sens large du
terme, la filtration comprend toutes les opérations biologiques ou
physico-chimiques qui permettent la réutilisation de l'eau et parfois
son recyclage (MICHEL, 2008).
Pour notre cas, l'eau alimentant notre circuit fermé
passe par 3 étapes de traitement (Figure1), résumées
comme suit:
- Traitement aux U.V.: placés à
la sortie de la pompe à immersion du bac de mise en charge, les UV
éliminent les bactéries pouvant être pathogènes pour
les poissons avant que l'eau n'entre dans les aquariums.
- Un filtre mécanique (le
vortex) : il est situé à la sortie de l'eau dans
les aquariums et joue le rôle de filtration mécanique par
décantation. Les grosses particules des matières organiques
issues des aquariums, sont évacuées à l'extérieur
par une purge effectuée deux fois par semaine.
- Un filtre biologique : des fragments
de tuyaux PVC emballés dans un sac ont été utilisés
comme filtre biologique. Les matières azotées y subissent, sous
l'action de bactéries, différents stades de dégradation
successifs. Les nitrites, déchets plus toxiques sont transformés
en nitrates qui sont moins toxiques.
Ø Un système d'aération
d'eau : une pompe électrique à vide était
adaptée comme source de production d'oxygène dans le circuit.
Ø Une résistance
chauffante :Placée également dans le bac de
récupération, la résistance électrique munie d'un
thermostat était utilisée pour maintenir la température de
l'eau du circuit à #177;24°C.
Les instrumentss de filtration, de regulation thermique et les
dispositifs d'elevages sont présentés dans la fugure1
ci-après:
a

b

  
Figure1 : Les instrumentss de
filtration, de regulation thermique et les dispositifs d'elevages :
a) Circuit fermé.
b) Stérilisateur à U.V.
c) Filtre mécanique (vortex).
d) Filtre biologique (PVC découpés).
3.2. MATÉRIELS ET
MÉTHODES
3.2.1. Fabrication de l'aliment
pour poissons
3.2.1.1.Collecte des ingrédients et production de
spaghettis
Les principaux ingrédients (fretins, drèche de
la brasserie, tourteau palmiste, huile végétale OKI),
utilisés dans le cadre de ce travail étaient achetés
localement sous-forme brute, exception faite pour les graines de moringa
récoltées gratuitement à Uvira. Avant de les utiliser dans
la formulation d'aliment proprement dite, ces ingrédients, sauf l'huile
végétale OKI, étaient pesés pour obtenir, d'abord
le poids frais avant séchage et ensuite, le poids sec après
séchage au soleil pendant au moins deux semaines. Le taux
d'humidité relatif de nos ingrédients était calculé
selon la formule décrite ci-après.
Humidité relative (%) =
(PF-PS/PF)*100
Où PF= poids frais; PS= poids
sec
Une fois séchés, les ingrédients
étaient broyés séparément et manuellement dans un
mortier. Les graines de moringa étaient passées au
moulin, ce qui a permis d'obtenir une farine utilisée dans le cadre
de ce travail. Afin d'obtenir une farine raffinée, la farine obtenue
après les deux modes de broyage (moulin et mortier) était
tamisée. Cette opération nous a permis de séparer les
déchets solides de la farine pure proprement-dite, ce qui nous a permis
aussi d'estimer la proportion des déchets par rapport au reste de la
farine propre, raffinée, par la formule ci-après:
Taux de perte(%) =
((PF-PFP)/PF)*100
Avec : PF= Poids frais des
ingrédients ; PFP =poids final de la farine pure
raffinée
Signalons que l'additif alimentaire (prémix
vitaminique) et l'huile d'arachide OKI achetées localement
étaient utilisés directement dans le mélange avec les
autres ingrédients sans aucune forme de traitement. Les
différentes étapes de préparations sont illustrées
dans la figure 2 ci-après.
 a) a) b) b) c) c) d) d)
Figure 2: Les
différentes étapes de préparations des aliments:
a. Pesée des
ingrédients ; b. aspect
d'ingrédients avant mélange ; c.
mélange de la farine des graines de moringa avec celle de manioc ;
d. production de l'aliment sous forme de spaghettis
avec la machine; e. séchage d'aliment produit
au soleil.
3.2.1.2. Pesée et
formulation proprement-dite de l'aliment
A l'aide d'une balance électronique de marque OHAUS CS
200 de 0,001g de précision, tous les ingrédients ont
été pesés séparément selon les proportions
indiquées dans le tableau 5, avant leur utilisation dans la formulation
proprement-dite.
Le pourcentage de remplacement de la farine de poisson (source
de protéine habituellement utilisée) par celle de graine de
moringa est de 100%, 50% et 00%. L'ajustement des proportions calculées
à partir du carré de Pearson pour le cas d'un aliment à
35% de protéine théoriquement nous a permis de trouver les
proportions présentées dans le tableau 5 ci-après.
Tableau 5. Proportions des ingrédients dans les
aliments produits à un taux de remplacement de lafarine de poisson par
celle de graine de Moringa oleifera équivalent à 100%,
50% et 00%.
|
INGREDIENTS
|
REGIMES ALIMENTAIRES
|
|
Régime1 (100% Moringa)
|
Régime2 (50% Moringa)
|
Régime3 (00%Moringa )
|
|
Graine Moringa oleifera
|
215
|
107,5
|
0
|
|
Farine Poisson
|
0
|
107,5
|
215
|
|
Drèche de la Brasserie
|
215
|
215
|
215
|
|
Tourteau Palmiste
|
118
|
118
|
118
|
|
Farine de Manioc
|
333
|
333
|
333
|
|
Huile d'arachide OKI
|
118
|
118
|
118
|
|
Prémix Vitaminique
|
1
|
1
|
1
|
|
TOTAL (en g)
|
1000
|
1000
|
1000
|
Légende : Régime1 : 100% farine
des graines de Moringa et 0% farine de poisson ;
Régime2 : 50% graines de moringa et 50% farine de poissons ;
Régime3 : 100% farine des poissons et 0% graines de
moringa.
Après pesée, nous avons procédé
par la préparation du bouillon à base de la farine de manioc
(considérée comme base ou liant de notre aliment) et de celle de
graine de moringa. Pour ce faire, la farine de manioc et celle de graine de
moringa étaient versées dans environ 900 ml d'eau dans une
casserole pour permettre la cuisson sur une plaque chauffante (réchaud)
pendant environ 20minutes. La cuisson par la chaleur permet de réduire
les facteurs antinutritionnels que contiennent habituellement la farine de
manioc et celle de graine de moringa. Les autres ingrédients (la
farine de poissons, le tourteau palmiste, le drèche de la brasserie,
l'huile de palme et le prémix vitamique) étaient par la suite
ajoutés progressivement dans le bouillon obtenu après
chauffage.La patte obtenue après mélange homogène des tous
les ingrédients était passée à la machine de
marque Wtrtr pour la production des spaghettis qui
étaient ensuite séchées au soleil pendant environ 4jours
avant d'être découpées en petits morceaux et
conservés dans des bocaux propres et secs.
3.2.1.3. Estimation du prix de revient d'un
kilogramme d'aliment
Le prix du kg d'aliment a été
déterminé à partir du prix des matières
premières disponibles sur le marché local et du pourcentage
d'incorporation de différents ingrédients dans la formulation. La
démarche est résumée dans le tableau 6 ci-dessous :
Tableau 6 : Estimation du prix de revient d'un kilogramme
d'aliment
|
Prix d'ingrédients en FC
|
Quantité d'ingrédients dans le
régime1 et son prix
|
Quantité d'ingrédients dans le
régime2 et son prix
|
Quantité d'ingrédients dans le
régime3 et son prix
|
|
Farine de poissons : 2600Fc/Kg
|
0,00g = 0,00Fc
|
107,5g = 2600Fc/1000g x 107,5g = 279,5 Fc
|
215g= 2600Fc/1000gx 215g = 559 Fc
|
|
Farine de graine de Moringa: 500Fc/Kg
|
215g = 500Fc/1000g x 215g = 107,5g Fc
|
107,5g = 500Fc/1000g x 107,5g = 53,75g Fc
|
0,00g = 0,00 Fc
|
|
Drèche de brasserie : 200Fc/Kg
|
215g = 200Fc/1000 x 215 = 43 Fc
|
215g = 200Fc/1000g x 215g = 43 Fc
|
215g = 200Fc/1000g x 215g = 43 Fc
|
|
Tourteaux palmiste : 400Fc/Kg
|
118g = 400Fc/1000g x 118g = 47,2 Fc
|
118g = 400Fc/1000g x 118g = 47,2 Fc
|
118g = 400Fc/1000g x 118g = 47,2 Fc
|
|
Farine de manioc : 600Fc/Kg
|
333g = 600Fc/1000g x 333g = 199,2 Fc
|
333g = 600Fc/1000g x 333g = 199,2 Fc
|
333g = 600Fc/1000g x 333g = 199,2 Fc
|
|
Forfait (pour main d'oeuvre) en Fc/Kg
|
150 Fc
|
125 Fc
|
100 Fc
|
|
TOTAL
|
1Kg = 546,9 Fc
|
1Kg = 747,65 Fc
|
1Kg = 948,4 Fc
|
Source : nos calculs sur base de prix des
ingrédients sur le marché et le forfait pour transport des
ingrédients, usure du matériel, électricité et main
d'oeuvre.
Il ressort de ce tableau que le prix d'un Kg d'aliment pour
les trois régimes préparés varie entre
546,9FC (soit 0,59 $) et 948,4 FC (soit 1,03
$). Le régime1 est caractérisé par un coût
relativement moins cher (546,9FC/kg ou 0,59 $/kg) suivi du
régime2 (747,65FC/kg ou 0,81$/kg) et enfin du
régime3 (948,4 FC/kg ou de 1,03$/kg).
3.2.1.4. Estimation du coût alimentaire de
production d'un kilogramme de poisson
Le coût alimentaire de production d'un kg de poisson a
été estimé en multipliant le prix du kg d'aliment par le
TCA défini comme le rapport aliment consommé sur gain de
poids.
Tableau 7 : Estimation du coût alimentaire de production
d'un kg de poisson
|
Régime alimentaire
|
Prix du kg d'aliment Fc
|
TCA
|
Coût de production d'un kg de poisson
|
|
en Fc
|
en $ USD
|
|
Régime1
|
546,9 Fc
|
2,2#177;0,9
|
1203,18
|
1,9
|
|
Régime2
|
747,65 Fc
|
3,2#177;0,1
|
2392,48
|
2.6
|
|
Régime3
|
948,4 Fc
|
4,3#177;1,1
|
4078,12
|
4,4
|
Il ressort de ce tableau que, le régime1 produit 1Kg de
poisson à 1203,18 Fc soit 1,9$, le régimes2 produit 1Kg de
poisson à 2392,48Fc soit 2.6$ et le régime3 produit 1Kg de
poisson à 4078,12Fc soit 4,4$.
3.2.2. Analyses chimiques des aliments formulés
Les analyses chimiques des aliments ont eu lieu au laboratoire
de chimie agroalimentaire de la faculté d'agronomie et environnement de
l'Université évangélique en Afrique. Les protéines
étaient calculées à partir de l'azote total obtenu par la
méthode spectrophotométrique. Les différentes
étapes décrites, en annexe, ont permis d'obtenir le taux de
protéine brute et de cendre, par les formules ci-dessous:
v Azote total
X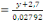 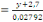
Où y = absorbance
A= x =concentration de l'azote dans l'extrait de la
solution.
N(%)=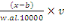 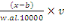
Où :
N= azote
v = volume total jusqu'à la fin du processus (en
ml)
b=concentration de l'azote dans le blanc (94,84mg N/L)
w= masse de la poudre (en g)
al=aliquote du digestat prélevé
Protéine brute (P en %)  % d'Azote totale X 6,25 (facteur de conversion protéique) % d'Azote totale X 6,25 (facteur de conversion protéique)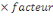 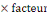
v Détermination de la Cendre Totale (C.T)
C.T (%)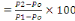 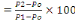
Où Po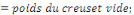 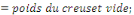
P1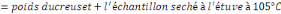 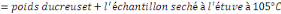
P2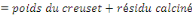 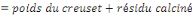
Certains matériels utilisés dans l'analyse
chimique des régimes expérimentaux sont illustrés dans la
figure 3 ci-après :




(a)
(b)
(c)
(d)
(h)
(g)
(e)




(f)
Figure 3 : Processus d'analyses
au laboratoire de la faculté d'agronomie de l'UEA :
a. Broyagedes
échantillons moulus ; b. Pesée des
échantillons ; c. Préparation des
échantillons dans l'HeerlenMeyer ; d. Ajout de la
Chloroforme dans les échantillons ; e. le
Spectrophotomètre ; f.Etuve ;
g. Solution de diazote 1 et 2 ;
h.Chloroforme.
La composition chimique des régimes produits est
présentée dans le tableau 8 ci-après :
Tableau 8: Composition analytique des régimes
expérimentaux
|
Composantes déterminés
|
Régime1
|
Régime2
|
Régime 3
|
|
Matières sèches (%)
|
84,7%
|
87,1%
|
92,3%
|
|
Protéines brutes (% MS)
|
24,3%
|
24,1%
|
15,0%
|
|
Cendres (% MS)
|
5,00%
|
6,67%
|
7,78%
|
Légende : MS : matière
sèche.
3.2.3. TRAVAUX DE LA PHASE
PRE-EXPPERIMENTALE
3.2.3.1. Préparation du circuit fermé
La préparation du processus d'élevage a
consisté au nettoyage de tout le circuit; pour ce faire, l'ancienne eau
a été totalement vidée et remplacée par une
nouvelle. Nous avons rempli progressivement les bacs et les aquariums par l'eau
de distribution et l'avons laissée en circulation pendant plus ou moins
24heures dans le circuit fermé avant l'empoissonnement. Cette
opération avait pour but d'éliminer, par évaporation, le
chlore que contient l'eau de la REGIDESO utilisée (MICHEL, 2008).
3.2.3.2.Sélection des alevins
Les alevins d'Oreochromis niloticus d'un poids moyen
de 2,3 #177; 0,7 g utilisés dans le cadre de ce
travail ont été pêchés dans les étangs de la
station piscicole de Nyakabera, situés à Mbobero, dans la commune
de Bagira, Collectivité - chefferie de Kabare. Pour éviter les
stress susceptibles d'occasionner la mortalité des alevins pendant le
triage, le transport et avant l'élevage proprement-dit, les alevins
pêchés (surtout le Tilapia) ont été gardés
à jeun dans des happas pendant environ 48 heures, à Nyakabera
même, avant de les transporter au laboratoire de l'UERHA/ ISP-Bukavu.
Les opérations de triage et de mensurations de
poissons se sont déroulées dans une solution d'anesthésie
(Phenoxyéthanol à environ 0,03%), ce qui nous permis de
sélection manuellement les individus ayant les mêmes
caractéristiques en termes de taille et de les peser au moyen d'une
balance électronique de marque (0,001g de précision) pour en
écarter ceux de grande taille et poids élevé.
Au total, 71 individus d'O. niloticusétaient
répartis dans 4 aquariums selon les modalités reprises dans le
tableau 8 ci-après:
Tableau 9. Répartition des individus d'O.niloticus
dans les structures d'élevage.
|
Espèce
|
N° Code Aquarium
|
Capacité en (l)
|
Nombre individus
|
Densité d'empoissonnement (Ind/l)
|
Poids moyen (g)
|
Biomasse (g)
|
|
O.niloticus
|
B1
|
180
|
39
|
0,2
|
2,4
|
93,6
|
|
B2
|
160
|
32
|
0,2
|
2,7
|
86,4
|
3.2.4. TRAVAUX DE LA PHASE
EXPERIMENTALE PROPREMENT DITE
3.2.4.1. Détermination de la ration
journalière et alimentation des poissons.
La ration journalière (10% de la biomasse totale),
obtenue à partir du nombre d'individus dans chacun des bassins ainsi que
de leurs poids moyens était divisée en trois repas. Les trois
repas étaient ensuite distribués manuellement aux poissons
à l'intervalle de 5 heures (soit à environ 8heures, 13 heures et
à 15heures), selon l'appétibilité.
Durant toute la phase expérimentale, nous avons
veillé à ce que la quantité de nourriture pesée et
distribuée aux poissons soit réellement notée dans un
carnet.
3.2.4.2. Contrôle de croissance et mensuration des
poissons
Une fois par semaine, les individus de chacun des bassins
étaient pêchés individuellement pour nous permettre de
mesurer leur poids. Pour faciliter la manipulation des poissons, nous avons
utilisé le phénoxyéthanol à raison 1ml pour
10litres d'eau. Les poissons retirés des bacs et maintenus dans
l'anesthésie pendant quelques minutes étaient mesurés un
à un; ensuite, ils étaient remis dans l'eau fraîche pour
retrouver leur mobilité. A l'aide d'une balance de précision,
marque OHAUS CS 200, nous avons pesé les poissons pour connaitre leur
poids individuel. A partir de ce poids individuel, une moyenne était
calculée, ce qui nous a permis de réajuster la ration en fonction
de la biomasse réelle dans le bassinMEDALE, et al., 2013)..
3.2.4.3. Entretien du circuit fermé
Pour assurer l'entretien du circuit fermé, les
opérations suivantes ont été réalisées
régulièrement à chaque fois que cela était
nécessaire:
· le siphonage quotidien des bacs entre 6 heures et
7heures pour éviter la pollution du milieu par les fèces des
poissons et les restes de nourriture;
· le renouvellement régulier de l'eau pour
éviter la pollution et améliorer sa qualité;
· le nettoyage régulier des bacs pour
éviter l'encrassement des restes de nourriture sur les parois.
3.2.4. 4. Mesure des paramètres physico-chimiques de
l'eau
Au cours de l'élevage, nous avons réalisé
les mesures des paramètres physico-chimiques directement dans les bacs
à l'aide d'une sonde multiparamétrique, marque PROFESSIONAL PLUS,
à une fréquence d'une fois par semaine. Pour ce faire, la sonde
était plongée directement dans chaque bac et permettait de
mesurer in situ la température (en °C), l'oxygène dissous
(en mg/l), le pH et la conductivité de l'eau (en uS/cm). Les
données recueillies à l'aide de la sonde étaient
traitées en Excel pour en dégager les informations sous forme des
graphiques.
3.3. DETERMINATION DES PARAMETRES DE CROISSANCE ET DIFFERENTS
INDICES
Pour
estimer la croissance des poissons au cours de l'expérimentation et
caractériser l'efficacité d'utilisation des aliments mis en
essai, les différents paramètres zootechniques et indices
ci-après ont été calculés :
1. Le Taux de survie (TS en %) : la
survie est calculée selon la formule :
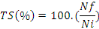
Où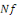 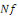 : nombre final d'individus : nombre final d'individus
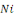 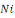 : Nombre initial d'individus : Nombre initial d'individus
2. Le taux de croissance spécifique
(TCS ou SGR en %)
Ce coefficient permet d'évaluer le poids gagné
par le poisson chaque jour, en pourcentage de son poids vif. Il est
exprimé en pourcentage par jour selon la formule :
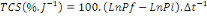
Où: Pi= Poids initial (g), Pf= Poids final (g),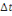 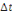 = durée d'élevage en jours. = durée d'élevage en jours.
3. Le taux de conversion alimentaire (TCA
ou FCR)
C'est un paramètre utilisé pour évaluer
l'efficacité de l'aliment. Il est obtenu par le rapport entre la
quantité de nourriture consommée (distribuée) et le gain
de poids chez les poissons. Plus le régime est performant en termes de
croissance, et moins la quantité de nourriture requise pour produire un
gain d'unité est importante, ce qui se traduit par un TCA plus petit. Ce
critère est également désigné comme «
l'Indice de Conversion ou Indice de consommation IC». Il est
calculé à l'aide de la formule:
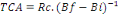
Où : Rc = Quantité de l'aliment
consommé (g) et Bf et Bi = Biomasses finale et initiale (g)
Les données brutes ont été
encodées et traitées dans le logiciel Excelpour avoir des
informations sous forme de graphiques, l'analyse statistique a
été effectuée à l'aide du logiciel STATISTICA.
Ainsi, les différentes moyennes des paramètres
étudiés étaient comparées deux à deux.
CHAPITREIV. RESULTATS ET DISCUSSION
4.
1. PRESENTATION DES RESULTATS
A.
Paramètres physico-chimiques de l'eau
Les paramètres physico-chimiques moyens de l'eau
observés au cours de l'expérimentation sont
présentés dans les tableaux de l'annexe 1,2 et 3,lesquels nous
ont permis de tracer les graphiques suivants :
A.1. Température
La
figure 4 ci-après montre l'évolution journalière de la
température au cours de l'expérience.
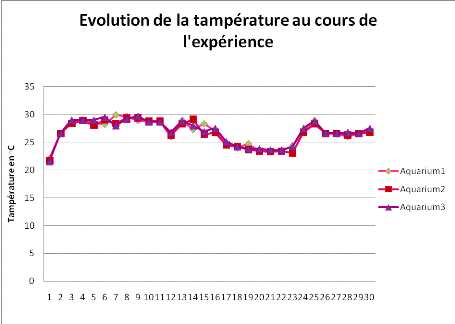
Figure 4. Evolution journalière de la
température (°C) dans les bacs d'élevage
De façon générale, la figure 4
montre une évolution uniforme de la température dans tous les
bacs; de faibles valeurs (environ 22°C) sont observées au
départ, suivies d'une augmentation (au tour de 29°C) et enfin d'une
baisse (au tour de 23°C). On remarque, en outre, que l'évolution
de la température est caractérisée par quelques
fluctuations dont la plus importante est celle du 17ème au
24ème jour d'expérience. Cette instabilité
serait due, d'une part, aux coupures intempestives du courant électrique
et d'autre part, au renouvellement de l'eau occasionnant son refroidissement.De
façon générale, tout au long de l'expérience, la
température de l'eau est située au dessus de 23°C.
A.2. pH
La figure 5 ci-après montre l'évolution
journalière du pH au cours de l'expérience.
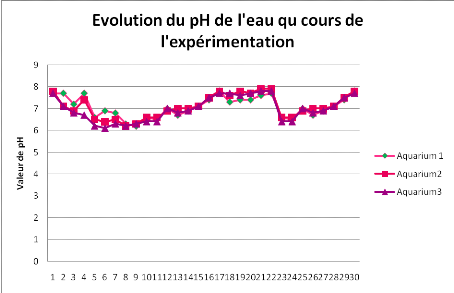
Figure 5. Evolution journalière
du pH dans les bacs d'élevage
La figure 5 montre que le pH de l'eau dans les bassins
expérimentaux a connu des valeurs supérieures (autour de 7,8) au
début d'expérience, suivies d'une chute de valeurs (pH autour de
6) entre 6 et 10ème jour, suivie enfin d'une augmentation de
valeurs à partir de 12ème jour. Durant toute la
période expérimentale, le pH de l'eau est resté entre 6 et
8. .
A.3. Oxygène dissous
La figure 6 ci-après montre l'évolution de
l'oxygène dissous au cours de l'expérience.
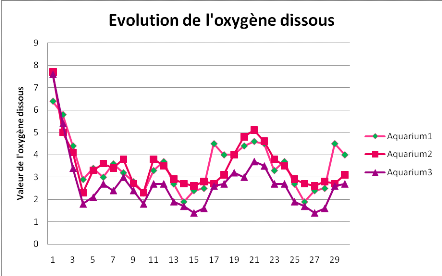
Figure 6. Evolution de l'Oxygène dissous dans les
différents bacs.
De la figure6, on remarque de valeurs élevées
d'oxygène au début de l'expérience (autour de 7,8 mg/l),
suivi d'une chute à partir du 4ème jour. On remarque
de fluctuations importantes tout au long de l'expérience (entre 2 et 5
mg/l). Les fluctuations seraient liées en partie aux ruptures du courant
électrique entrainant l'arrêt de l'aération par pompe
électrique que nous avons utilisée pour cette fin.
B. Paramètres de survie,
de croissance et de conversion alimentaire
Les moyennes des paramètres du taux de survie, de
paramètre de croissance et de conversion alimentaire
présentés dans le tableau de l'annexe 4, ont permis de tracer les
graphiques ci-après :
B.1. Taux de survie
La figure 7 présente les taux de survie
enregistrés au niveau des différents traitements au cours de
l'expérience.
b
b
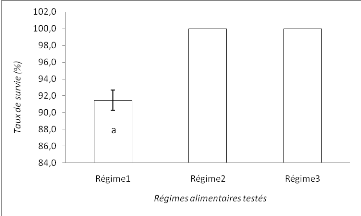
Figure 7 : Taux
de survie enregistrés par traitement à la fin de
l'expérience.
Il ressort de cette figure que le taux de survie moyen est
compris entre 91,5#177;1,2 % pour le régime1et 100% pour les
régimes 2 et 3. Les régimes 2 et 3 présentent un taux de
survie significativement meilleur (p > 0,05) que le régime1.
B.2. Taux de croissance spécifique
La figure 8 présente les taux de croissance
spécifique apporté par chaque régime
b
b
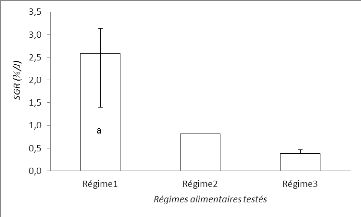
Figure 8 : Taux de croissance
spécifique enregistrés par traitement à la fin de
l'expérience
De cette figure il ressort que le SGR est compris entre
2,6#177;0,6 et 0,4#177;0,1% de poids/jour.
Les poissons nourris par le regime1 présentent un poids
moyen significativement supérieur (2,6#177;0,6%/j) pare rapport aux
régimes 2 et 3 (0,8#177;0 %/j et 0,4#177;0,1%/j), qui ont
présenté de taux de croissance similaires.
B.3. Taux de conversion alimentaire
La figure 9 présente les taux de conversion alimentaire
obtenus par les différents régimes:
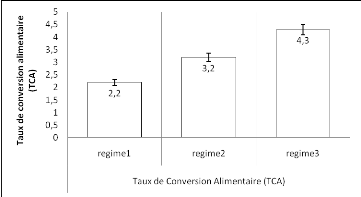
Figure 9: Taux de Conversion Alimentaire
(TCA) ou Indice de Conversion (IC) enregistrés au cours de
l'expérience.
De ce graphique, il ressort que le taux de conversion alimentaire
a varié entre 2,2#177;0,9, 3,2#177;0,1 et 4,3#177;1,1. La valeur du
TCA significativement basse a été observée avec le regime1
(2,2#177;0,9), suivi du regime2 (3,2#177;0,1) et du regime3 (4,3#177;1,1). Le
teste montre une différence significative entre tous les
régimes.
4.2. DISCUSSION DES RÉSULTATS
Ø Paramètres physico-chimiques de l'eau
Au cours de l'expérience, la température a
varié entre 26,9 #177; 2,7 et 27,2 #177; 2,9°C. Ces valeurs de
températures trouvées se trouvent dans la gamme de valeurs
recommandées pour l'espèce utilisée (24-28°C), Des
telles températures seraient à la base d'une bonne utilisation de
la nourriture en accélérant le métabolisme et la
croissance (MELARD,1986), cité par IGA-IGA (2008).Nos résultats
sont comparables à ceux trouvés par ALUNGA (2010), en circuit
fermé avec une moyenne de 28,6 #177; 0,29°C.
Les valeurs moyennes de pH mesurées dans les aquariums
variaient entre 7,0 #177; 0,6 et 7,1 #177; 0,6. Ces valeurs,
légèrement alcalines, seraient favorables à la croissance
des poissons car les eaux légèrement alcalines seraient plus
productives en aquarium (MUDOSA, 1988). Ces valeurs se trouvent dans la gamme
de tolérance recommandée (entre 5 et 11) pour le Tilapia (BALARIN
et HATTON, 1979 cités par IGA-IGA, 2008).
Les valeurs moyennes d'oxygène dissous sont
situées entre 3,1 #177; 1,3 et 3,7 #177;1,2 mg/l. Ces valeurs
trouvées sont situées autour de la gamme de valeurs acceptables
pour l'espèce utilisée (> ou égal à 3mg/l)
(BALARIN et HATTON, 1979 cités par IGA-IGA, 2008; MELARD (1986)
cité par IGA-IGA, 2008).
Les fluctuations de l'oxygène observées au cours
de l'expérience seraient liées à plusieurs
paramètres, entre autres, la température de l'eau, les
matières organiques dissoutes (DE GRAAF, 1974).
Dans le cas de notre expérience, les variations de
l'oxygène dissous seraient liées aux coupures du courant qui
survenaient chaque 16h pour revenir à 18h,entraînant ainsi la
baisse de la température. Ces résultats sont similaires de ceux
trouvés par COCHE (1976) cité par VINKE (1985), sur les essais de
prégrossissement d'O. niloticus en étangs et cages
flottantes en Côte d' Ivoire en milieu lotique. Il a constaté que
la concentration de l'oxygène était parfois < 3 mg/l. Ces
similitudes peuvent être dues du fait que nous avons créé
les conditions presque identiques de celles du milieu naturel.
Ø Taux de Survie
Nous avons trouvé les taux de survies variant entre
91,5#177;1,2% et 100%. Le faible taux de survie a été
enregistré avec le régime1(91,5#177;1,2%). Comme IGA-IGA (2008)
suggère que le taux de survie de 90 % est la norme
généralement admise en élevage, nos
résultats(91,5#177;1,2% et 100%) sont donc très
intéressants parce qu'ils se situent dans la norme admise. Le petit taux
de mortalité serait dû au stress des manipulations. Aucun des
aliments ne présente donc de toxicité pour le tilapia O.
niloticus. Nos résultats sont comparables à ceux obtenus par
VINCKE (1985), soit (90%) en Côte-d'Ivoire, en travaillant sur le
grossissement de T. nilotica en cages flottantes à
différentes densités dans le lac Kossou. Des taux de survie
presque similaires, variant entre 87,1 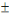 5,99 et 90,7 5,99 et 90,7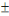 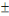 6,663 %, ont été observés par AZAZA et al
(2005), en travaillant sur la même espèce, mais dans les bassins
des eaux géothermales à 29°C en Tunisie. 6,663 %, ont été observés par AZAZA et al
(2005), en travaillant sur la même espèce, mais dans les bassins
des eaux géothermales à 29°C en Tunisie.
Ø SGR ou TCS
Le taux de croissance spécifiquea été de
2,6#177;0,6, 0,8#177;0 et 0,4#177;0,1 %/j, respectivement pour le
régime1, 2 et 3.Le TCSobtenu avec le régime1
(2,6#177;0,6 %/j) est supérieur à ceux de régimes 2
et 3. Il est aussi supérieur à (1,04 #177; 0,07 à 1,56
#177; 0,08 %/j) trouvés par IGA-IGA en 2008, en travaillant sur deux
régimes alimentaires dont le régime R1 été
majoritairement constitué de la drêche de brasserie et le
régime R2 formulé en incorporant une gamme plus large de
sous-produits d'origine agricole. Nos résultats obtenus avec le
régime 1 se rapprochent de ceux trouvés par JAUNCEY(1982), avec
des régimes plus équilibrés (taux de croissance
spécifique de (3 %/j). Ils sont supérieurs à ceux
trouvés par YACOUBA (2008) (1,13#177;0,03 et 1,80#177;0,33 %/j), en
travaillant sur les alevins de poids moyen de 0,7#177;0,06 g dans les
étangs (22-25 °C) à la ferme piscicole de BLONDEY,
Côte-d'Ivoire, soumis à trois régimes test formulés
à base des sous-produits agricoles (tourteau de soja, tourteau de coton,
son de maïs, son de mil, son de riz, son de blé). Ce TCS semble
être du au taux faible en cellulose brute de graines de moringa par
apport à la farine des poissons, parce que VIOLA etal. (1988),
suggèrent que la cellulose des régimes alimentaires à
l'état brute est peu digestible chez la plupart des
téléostéens. Toutefois, selon les mêmes auteurs, le
tilapia utiliserait efficacement les polysaccharides complexes et la
cellulose(jusqu'à une teneur de 10%) pour couvrir ses besoins
énergétiques.
Ø Taux de conversion alimentaire
Nous avons trouvé les valeurs de TCA de
2,2#177;0,9 ; 3,2#177;0,1 et 4,3#177;1,1 respectivement pour le
régime 1, 2 et 3. La valeur la plus faible a été
enregistrée avec le régime1, tandis que la plus
élevée a été enregistrée avec le
régime3. Ces résultats suggèrent que les poissons ont
mieux valorisé le régime1 et accessoirement le régime2. Le
régime1 apparait donc comme le meilleur aliment. Ces taux de conversion
alimentaire obtenus (2,2#177;0,9,3,2#177;0,1 et 4,3#177;1,1) se rapprochent
aux valeurs recommandées, 1,5 et 2 (MEVEL, 1999 ; STEVEN et
al., 2009), se rapprochent aussi à ceux trouvés par
PALUKU en 2014, (1,7#177; 0,3 et 2,1#177; 0,1), en travaillant dans les
mêmes conditions de température, de pH et d'oxygène dissous
que celles de notre travail, et à ceux trouvés par IGA-IGA en
2008, (2,57 #177; 0,59 ; 1,56 #177; 0,37 ; 1,41 #177; 0,24),en
travaillant dans une structure implantée en pleine eau (structure
hors-sol), sur deux régimes alimentaires dont le régime R1 qui a
été majoritairement constitué de la drêche de
brasserie et le régime R2 formulé en incorporant une gamme plus
large de sous-produits d'origine agricole, à la température
moyenne de 25°C. MANDIKI (2008), cité par ALUNGA (2010), montre
que, plus le régime est performant en termes de croissance, moins la
quantité d'aliment requise pour produire un gain d'unité de poids
est importante, ce qui se traduit par son indice TCA plus petit. Ces
résultats s'expliqueraient probablement par un apport
énergétique et protéique élevé des graines
de moringa par apport aux régime2 et régime3 fabriqués.
Ø Approche économique
Il est question ici d'établir la comparaison des
résultats économiques obtenus dans l'utilisation des trois
régimes, qui ont donné des performances zootechniques très
différents; ceci afin d'identifier l'aliment le plus rentable. Pour ce
qui est de notre étude, comme il s'agit d'un essai de production, nous
avons omis volontaire les autres charges inhérentes à
l'exploitation, pour ne confronter que le coût des aliments à la
valeur de la production induite.
Il ressort des résultats du tableau 9 que, produire un
kilogramme de poisson avec le régime2 coûte environ 2 fois plus
cher qu'avec le régime1, et produire un kilogramme de poisson avec le
régime3 coûte environ 3 fois plus cher qu'avec le régime1,
alors qu'en termes de croissance des poissons, les performances
apportées par régime1 sont supérieures aux performances
apportées par le régime2 et le régime3.
CONCLUSIONS ET RECOMMANDATIONS
L'objectif majeur poursuivi par cette étude
était celui d'identifier parmi les trois aliments formulés, celui
qui soit zootechniquement et économiquement intéressant
c'est-à-dire, qui assure une croissance optimale tout en garantissant un
produit sain et de qualité, d'un prix accessible, prix stable et
modéré; ceci pour tenter de résoudre le problème de
rentabilité que connaissent actuellement les pisciculteurs au Sud-Kivu,
afin de contribuer à l'amélioration de la productivité du
secteur piscicole d'une part et d'autre part, contribuer à la lutte
contre la malnutrition.
À l'issue de cette investigation, des résultats
encourageants, bien que préliminaires, ont été obtenus. Au
vu des performances de croissance, de conversion alimentaire et surtout du
coût de production d'un kilogramme de poisson, nous pouvons, dans
l'état actuel des connaissances, considérer le régime1
comme étant le plus intéressant en termes de rapport
qualité/prix, car le meilleur aliment est celui qui couvre au mieux et
au moindre coût les besoins nutritionnels de l'animal et qui optimise les
résultats économiques. Quoique sommaire, ce calcul montre
l'intérêt économique à utiliser Régime1
plutôt que les deux autres, parce qu'il a été produit
à moins cher et il a apporté les meilleurs performances que les
deux autres. Le régime1 est donc zootechniquement et
économiquement le plus performent.
A ces points, nos hypothèses ont été
confirmées avec le régime1.
On essayera dans ce cas, en formulant l'aliment, de tenir
autant que possible compte des besoins nutritionnels du poisson; la couverture
des besoins en nutriments déficients sera assurée par la
production « endogène » du milieu, que l'on cherchera à
renforcer.
Eu égard au ce qui précède, nous
recommandons comme suit:
v à l'Etat congolais: d'assurer la
sécurité politique dans les zones propices à la
pisciculture pour que les paysans et les opérateurs économiques
s'impliquent avec rigueur dans ce secteur ;
v au gouvernement provincial : d'aménager les
stations piscicoles et les centres de recherche en hydrobiologie de la
province, afin que le nombre de stations soit augmenté à travers
la province pour contribuer au développement de la pisciculture.
v à l'Université évangélique en
Afrique : de mettre en place un laboratoire d'aquaculture pour que des
nombreuses études pouvant contribuer à l'amélioration du
secteur piscicole soient faites. Nous reconnaissons que nos lacs (Kivu et
Tanganyika) renferment des nombreuses espèces de poissons parmi
lesquelles certaines peuvent encore faire l'objet d'une pisciculture intensive,
mais moins d'équipements existent dans la province pour pouvoir mener
des études pareilles.
v aux pisciculteurs : de travailler en contact permanant
avec les spécialistes de la pisciculture et les agents de vulgarisation
pour l'échange des expériences pouvant également conduire
à la réussite.
PERSPECTIVES DE RECHERCHES
Les perspectives consécutives à cette
étude sont multiples.
· Il serait tout d'abord intéressant
d'étudier la manière dont seraient modifiés nos
résultats si les juvéniles d'O. niloticus étaient
élevés en bassins extérieurs, l'apport d'une nourriture
endogène au plan d'eau permettant peut-être d'obtenir des
résultats meilleurs encore,
· Il serait également intéressant
d'observer l'impact possible du régime1 sur les capacités
reproductives d'adultes d'O. niloticusnourris toute sa vie avec ces
derniers, afin de s'assurer que les bons paramètres de croissance et
d'efficacité alimentaire observés avec notre aliment peuvent
encore survenir chez les adultes à la reproduction ;
· Il serait également intéressant de mener
une étude pareille avec des régimes alimentaires formulées
à base des feuilles ou des écorces de Moringa
oleifera ;
· Il serait aussi très important de tester ces
régimes alimentaires sur les autres espèces de poissons
habituellement élevé dans notre milieu (Clarias gariepinus,
Tilapia rendalli Tilapia melanopleura etc.)
REFERENCES BIBLIOGRAPHIQUES
ALUNGA LUFUNGULA G., Formulation, Fabrication de
4régimes alimentaires et Evaluation de leurs effets sur la croissance
des juvéniles des Clarias, Master Complémentaire en Aquaculture,
ULG, 2009-2010.
ASIT DAS B.et RRAJA KATLIA (1996). Physiological adaptative
mechanisms of catfish (Siluroidei) to environmental
changes.Aquatic Living Ressources, 9: 135-143.
AUGUSTECHOCHA M., 2013, cours de limnologie, ichtyologie et
aquaculture, G2 agronomie, Unité de Recherche en AquacultureUNILU,
LUBUMBASHI, RDC. 108 p.
BALARIN JOHN D., etJOHN HATTONP., 1979.
Tilapia: A guide to their biology and culture in Africa. Unit of Aquatic
Pathobiology, Stirling Unive+rsity, 174 p.
BOWEN STEPHENH., 1982. Feeding digestion and growth -
qualitative consideration.In: Pullin R.S.V., Lowe-McConnell R.h.
(éds.), The biology and culture of tilapias, 141-156, ICLARM conf.
proceedings, 7, Manila, Philippines.
DE SILVA S.S.etPERERA M.K., 1985. Effects of dietary protein
level on growth, food conversion, and protein use in young Tilapia nilotica
at four salinities. Trans. Am. Fish. Soc., 583-589.
EKOUE ADOUVIC., 2013, Effets de la substitution de la farine
de poisson par la farine des graines de Néré (Parkia
biglobosa) et de la farine du tourteau de soja (Glycine maxima)
sur la croissance et la survie des juvéniles de Clarias gariepinus
(Burchell, 1822). ENSSTA/UAC, Bénin. 43p
EPIPHANE HOSSOUE., 2002. Effets de la pépinière
d'Azolla sur les performances zootechniques de Clarias gariepinus en
étang. Mémoire présenté pour l'obtention du
diplôme
FAO, 2003, Informations sur la Sécurité
Alimentaire en RDC, Un Réseau pour le Suivi de la Sécurité
Alimentaire, Infosec No,.30.
http://www.internaldisplacement.org/8025708F004CE90B/(httpDocuments)/13F0085513E
916802570B70059040C/$file/Infosec+30.pdf
FAO, 2006.Programme national de sécurité
alimentaire, république du Burundi. In: www.fao.org,
consulté le 09/04/2015.
FAO, 2012,Global Aquaculture Production Volume and Value
Statistics Database Updated to 2012, FAO Fisheries and Aquaculture department,
March 2014.
FAO, 2012. La situation mondiale des pêches et de
l'aquaculture 2012. Rome. 241p. (
http://www.fao.org/docrep/016/i2727f/i2727f
00.htm)
GUILLAUME J., KAUSHIK S. etal., 1999.Nutrition et
alimentation des poissons et crustacés. INRA Editions.489 p.
HALL G.M., 2010, Fishmeal production and
sustainability, fish processing: sustainability and new opportunities, p.
207-235.
HANLEY F., 1991. The digestibility of food
stuffs and the effects of feeding selectivity on digestibility determinations
in tilapia, Oreochrornisniloticus(L.).Aquaculture,
66:163-179.
HOFFMAN, L. C. et PRINSLOO, J. F., 1995.
Genetic and nutritional influence on the total lipid fatty acid profile of
Clariasgariepinusmuscle.Aquat. Living Resour.,
8: 415-421.
IGA-IGA ROBERT, 2008. Contribution à la mise au point
d'aliments pour tilapia Oreochromis niloticus à base d'intrants
locaux : cas du Gabon,Mémoire de fin d'études Pour l'obtention du
Master en Sciences Agronomiques et Agroalimentaires, IRAF, Libreville, Gabon,
47pages.
JAUNCEY K.etROSS B., 1982. A guide to tilapia feeds and
feeding.Institute of Aquaculture, University of Stirling, Scotland.111 p.
JONATHAN RICHIR, 2004. Valorisation des sous-produits
agro-industriels dans l'alimentation du poisson-chat africain, clarias
gariepinus au Rwanda :Mémoire présenté pour
l'obtention du grade de licencié en Sciences biologiques à la
faculté universitaire notre dame de la paix Namur ; faculté
des sciences, 87p
KANANGIRE C. K. 2001. Effet de l'alimentation des poissons
avec Azolla sur l'écosystème agro piscicole au Rwanda.
Dissertation présentée en vue de l'obtention du grade de Docteur
en Sciences. Facultés universitaires Notre -Dame de la paix, Namur,
Belgique. 220p.
KAUSHIK S. J., GUILLAUME J., et al., 1993. Estimation
of protein and energy needs for maintenance and growth of Nile tilapia
(Oreochromisniloticus) using different criteria. In :
Proceedings Abstracts EIFAC Workshop on Methodology for Determination of
Nutrient Requirements in fish, 29 June-1 July 1993, Eichenau, Germany, p.
19.
LAUZANNE L., 1988. Les habitudes alimentaires des poissons
d'eau douce africains, pp. 221-242. In : Lévêque C.,
Bruton M. N. et Ssentongo G. W. (éds.), Biologie et écologie des
poissons d'eau douce africains. ORSTOM Paris, 508 p.
LAZARD J., MORISSENS P. et al., 1990. Méthodes
artisanales d'aquaculture du tilapia en Afrique. Nogent-Sur-Marne,
CIRAD/C.T.F.T., 82 p.
LIETAR CARLOS, 1984, l'élevage du
tilapia nilotica : Manuel pour les Animateurs Piscicoles en RCA, cours de
formation n?2, Bangui/RCA, 31p
MAKKAR, H.P.S. et BECKER, K., 1997. Nutrients
and antiquality factors in different morphological parts of the Moringa
oleifera tree.Journal of Agricultural Science, Cambridge 128,
311-322.
MASILYA MULUNGULAP., 2011. L'avenir de la pêche au lac
Kivu (RDC) : Que faire de Lamprichthys tanganicanus, un poisson
récemment introduit au lac Kivu, Thèse de doctorat en Sciences
(Biologie) Université de Namur, 425p
MASTAKI NAMEGABE J.L., 2006. Le rôle des goulots
d`étranglement de la commercialisation dans l`adoption des innovations
agricoles chez les producteurs vivriers du Sud-Kivu (Est de la
R.D.Congo) : Dissertation présentée en vue de l'obtention du
grade de docteur en sciences agronomiques et ingénierie
biologique,Gembloux, 267 pages
MAZID M.A., 1979. Growth response of Tilapia
zillifingerlings fed isocalorie diets with variable protein levels.
Aquaculture, 18:115-122.
MÉDALE F., LE BOUCHER R., et al., 2013, Des
Aliments à base de végétaux pour poissons
d'élevage, INRA Prod. Anim. 26(4), 303-316.
MEDALE F., QUILLET E. et al., 2013, INR, Production
Animale.Des aliments à base de végétaux pour les
poissons d'élevage. 303-316
MELARD CH., 1986. Les bases biologiques de l'élevage
intensif du tilapia du Nil. Cahiersd'Ethologie appliquée, Fasc.
3, Vol. 6, 224p.
MICHEL CHRISTIAN, 2008, Aquariologie, ULG Liège p77,
174-185.
MINAGRI, 2010. Programme National de Sécurité
Alimentaire (P.N.S.A), Kinshasa, RDC, 115 Pages.
MOHAMED SALAH A., ABDELMOULEH KRAÏEM A. et al.,
2005. Elaboration d'aliments secs pour le Tilapia du Nil Oreochromis niloticus
(L., 1758) en élevage dans les eaux géothermales du Sud tunisien,
Bull. Inst. Natn. Scien. Tech. Mer de Salammbô, Vol. 32, 2005 23.
MORIARTY C.D., 1973. The physiology of digestion of blue-green
algae in the cichlid fish Tilapia nilotica.J. Zool. 171:
25-40.
NAYLOR R.L., HARDY R.W.et al., 2009. Feeding
aquaculture in an era of finite resources.P. Natl. Acad. Sci. USA 106, 15103-
15110.
NIKOLOUSFOIDL, MAKKARH.P.S.,et al., Potentiel de
développement des produits du Moringa : potentiel de Moringa
oleifera en agriculture et dans l'industrie, novembre 2001, Dar es Salaam,
Tanzanie, 20p.
PAUGY TEUGELS D., et LEVEQUE C. 2003. Les poissons des eaux
douces et saumâtres de l'Afrique de l'Ouest. Editions IRD. Publication
scientifiques de Muséum. MRAC, 2004.
POLE AQUIMER, 2012. technologie-recherche :
l'alimentation des poissons d'élevage 1-13p
POUMOGNE PANSERAT V., 1998. Pisciculture en Milieu Tropical
Africain. Comment produire du poisson à coût modéré.
Presse universitaire d'Afrique, Yaoundé.
ROBERT MANDIKI, 2010. Alimentation et Nutrition des Poissons,
Master en Aquaculture, FUNDP, Namur 2007 19p p10-13.
RUWET BEHAR J. C., DUPONT NIVET M., et al., 1975.
Biologie et élevage des tilapias. FAO/CIFA Tech. Pap., 4 : 332-364.
SANTIAGO COGAN S., etLOVELL ROBERT T., 1988. Effects of
varying dietary crude protein levels on growth and spawning frequency of T.
nilotica breeders.AOD.SEAFDEC. Ann. Rep., 30 p.
SIDDHURAJU, P., et BECKER, K., et al., 2002. Effect
of soacking andionizing radiation on various antinutritional factors of seeds
from different species ofan unconventional legume, Sesbania and a
common legume, green gram (Vignaradiata). Food Chemistry,
79: 273-281.
STEVEN CRAIG et LOUIS HELFRICH A., 2009. Understanding Fish
Nutrition, Feeds, and Feeding, VirginaCooprative Extension, publication
420-256.
TACON AUBIN J. et JACKSON QUILLETA., 1982. Utilization of
conventional and unconventional protein sources in practical fish feeds. In
: Nutrition and Feeding in Fish, Cowey, C.B., Mackie, A.M. and Bell, J.G.,
(éds.). Academic Press, London, pp. 11 9-1 45.
TREWAVAS E., 1983. Tilapiine Fishes of the Genera
Sarotherodon, Oreochromis and Danakilia.British
Museum Nat. Hist., 583p.
UYS WATANABE W. 1999. Aspects of nutritional physiology and
diatary requirements of juvenile and adult sharptooth catfish,
Clariasgariepinus (Pisces: Clariidae). PhD. Thesis, Rhodes University,
Csrahamstown, 190 p.
UYS WATANABE W., et HECHT T., 1985. Evaluation and preparation
of an optimal dry feed for the primary nursing of
Clariasgariepinuslarvae (pisces: Clariidae).
Aquaculture, 47:
VIOLA S. et ARIELI Y., 1983. Nutrition studies with tilapia
(Sarotherodon). 1. Replacement offishmeal by soybean-meal in feeds for
intensive tilapia culture. Bamidgeh, 35, 9-17, 1983. VIOLA S., MOKADY S.,
et al.,1988. Effects of polyunsaturated fatty acids in feeds of
tilapia and carp. 1. Body composition and fatty acid profiles at different
environmental temperatures. Aquaculture, 75 (1988):127-137.
WAN K., TAKECHI T., et al., 1985. Effect of dietary
protein levels on growth of Tilapia nilotica. Bull. Jap. Soc. Sci.
Fish., 51, 133-140. Optimum protein and digestible energy levels in diets
for Tilapia nilotica. Bull. Jap. Soc. Sci. Fish., 51,
141-146.
YACOUBA BAMBA, ALLASSANE OUATTARA,et al., 2008,
Production de Oreochromis niloticus avec des ingrédients à base
des sous-produits agricoles, Vol5 n°1 : 89-99 p90-99.
ANNEXES
ANNEXE 1 : les valeurs de la température au cours
de l'expérience
|
N°
|
TEMPERATURE (°C)
|
|
|
Ex1
|
Ex2
|
Ex3
|
|
1
|
22,0
|
21,7
|
21,5
|
|
2
|
26,5
|
26,6
|
26,6
|
|
3
|
28,7
|
28,4
|
29,0
|
|
4
|
29,0
|
28,9
|
29,0
|
|
5
|
28,5
|
28,1
|
29,0
|
|
6
|
29,2
|
29,0
|
29
|
|
7
|
29
|
29
|
27,0
|
|
8
|
29
|
29
|
28,2
|
|
9
|
29
|
29
|
28,7
|
|
10
|
28,8
|
28,8
|
29
|
|
11
|
28,9
|
28,8
|
29
|
|
12
|
26,0
|
26,3
|
26,8
|
|
13
|
28,9
|
28,3
|
28,8
|
|
14
|
29
|
29,1
|
30,0
|
|
15
|
30,0
|
29,4
|
29
|
|
16
|
27,0
|
26,8
|
27,5
|
|
17
|
24,7
|
24,5
|
25,1
|
|
18
|
24,0
|
24,2
|
24,2
|
|
19
|
23,7
|
23,7
|
23,8
|
|
20
|
23,4
|
23,4
|
23,8
|
|
21
|
23,3
|
23,3
|
23,6
|
|
22
|
23,5
|
23,4
|
23,6
|
|
23
|
28,9
|
28,3
|
28,8
|
|
24
|
29,3
|
29
|
30,0
|
|
25
|
30,0
|
29
|
29
|
|
26
|
27,0
|
26,8
|
27,5
|
|
27
|
24,7
|
24,5
|
25,1
|
|
28
|
28,9
|
28,8
|
29
|
|
29
|
26,0
|
26,3
|
26,8
|
|
30
|
28,9
|
28,3
|
28,8
|
|
Max
|
29
|
29
|
29
|
|
Min
|
22,0
|
21,7
|
21,5
|
ANNEXE 2 : les valeurs du pH au cours de
l'expérience
|
N°
|
Ph
|
|
|
Ex.1
|
Ex2
|
Ex3
|
|
1
|
7,7
|
7,8
|
7,7
|
|
2
|
7,7
|
7,1
|
7,1
|
|
3
|
7,2
|
6,9
|
6,8
|
|
4
|
7,7
|
7,4
|
6,7
|
|
5
|
6,6
|
6,5
|
6,2
|
|
6
|
6,9
|
6,4
|
6,1
|
|
7
|
6,8
|
6,5
|
6,3
|
|
8
|
6,3
|
6,2
|
6,2
|
|
9
|
6,2
|
6,3
|
6,3
|
|
10
|
6,6
|
6,6
|
6,4
|
|
11
|
6,5
|
6,6
|
6,4
|
|
12
|
7,0
|
6,9
|
7,0
|
|
13
|
6,7
|
7,0
|
6,8
|
|
14
|
6,9
|
7,0
|
6,9
|
|
15
|
7,1
|
7,1
|
7,1
|
|
16
|
7,4
|
7,5
|
7,5
|
|
17
|
7,8
|
7,8
|
7,7
|
|
18
|
7,3
|
7,6
|
7,7
|
|
19
|
7,4
|
7,8
|
7,6
|
|
20
|
7,4
|
7,7
|
7,7
|
|
21
|
7,6
|
7,9
|
7,8
|
|
22
|
7,7
|
7,9
|
7,8
|
|
23
|
6,6
|
6,5
|
6,2
|
|
24
|
6,9
|
6,4
|
6,1
|
|
25
|
6,8
|
6,5
|
6,3
|
|
26
|
6,3
|
6,2
|
6,2
|
|
27
|
6,2
|
6,3
|
6,3
|
|
28
|
6,6
|
6,6
|
6,4
|
|
29
|
6,5
|
6,6
|
6,4
|
|
30
|
7,0
|
6,9
|
7,0
|
|
Max
|
7,8
|
7,9
|
7,8
|
|
Min
|
6,2
|
6,2
|
6,1
|
|
ANNEXE 3 : valeurs moyennes journalières de
l'oxygène dissous (mg/l)
|
|
N°
|
Oxygène dissous
|
|
Ex1
|
Ex2
|
Ex3
|
|
1
|
6,4
|
7,7
|
7,6
|
|
2
|
5,8
|
5,0
|
5,4
|
|
3
|
4,4
|
4,1
|
3,4
|
|
4
|
2,9
|
2,3
|
1,8
|
|
5
|
3,4
|
3,3
|
2,1
|
|
6
|
3,0
|
3,6
|
2,7
|
|
7
|
3,6
|
3,4
|
2,4
|
|
8
|
3,2
|
3,8
|
3,0
|
|
9
|
2,8
|
2,7
|
2,4
|
|
10
|
2,3
|
2,3
|
1,8
|
|
11
|
3,3
|
3,8
|
2,7
|
|
12
|
3,7
|
3,5
|
2,7
|
|
13
|
2,7
|
2,9
|
1,9
|
|
14
|
1,9
|
2,7
|
1,7
|
|
15
|
2,4
|
2,6
|
1,4
|
|
16
|
2,5
|
2,8
|
1,6
|
|
17
|
4,5
|
2,7
|
2,6
|
|
18
|
4,0
|
3,1
|
2,7
|
|
19
|
4,0
|
4,0
|
3,2
|
|
20
|
4,4
|
4,8
|
3,0
|
|
21
|
4,6
|
5,1
|
3,7
|
|
22
|
4,5
|
4,6
|
3,5
|
|
23
|
3,7
|
3,5
|
2,7
|
|
24
|
2,7
|
2,9
|
1,9
|
|
25
|
1,9
|
2,7
|
1,7
|
|
26
|
2,4
|
2,6
|
1,4
|
|
27
|
2,5
|
2,8
|
1,6
|
|
28
|
4,5
|
2,7
|
2,6
|
|
29
|
4,0
|
3,1
|
2,7
|
|
30
|
4,0
|
4,0
|
3,2
|
|
Max
|
6,4
|
7,7
|
7,6
|
|
Min
|
1,9
|
2,3
|
1,4
|
ANNEXES 4 :
Synthèses des résultats des paramètres
étudiés au cours de l'expérience.
|
Paramètres étudiés
|
Régime1
|
Régime2
|
Régime3
|
|
Taux de survie en %
|
91,5#177;1,2
|
100#177;0
|
100#177;0
|
|
SGR ou TCS en %/j
|
2,6#177;0,6
|
0,8#177;0
|
0,4#177;0,1
|
|
TCA
|
2,2#177;0,9
|
3,2#177;0,9
|
4,3#177;1,1
|
TABLE DES MATIERES
PRELUDE
i
DEDICACE
ii
REMERCIEMENTS
iii
SIGLES ET ABBREVIATIONS
iv
LISTE DES TABLEAUX
v
LISTE DES FIGURES
vi
RESUME
vii
ABSTRACT
viii
INTRODUCTION GENERALE
1
CHAPITRE I. GENERALITES SUR LE TILAPIA
4
1.1. DESCRIPTION ET SYSTEMATIQUE
4
1.2. EXIGENCES ECOLOGIQUES
4
1.3. ANATOMIE ET PHYSIOLOGIE DU TUBE DIGESTIF
5
1.4. REGIME ALIMENTAIRE
6
1.5. BESOINS NUTRITIONNELS DE TILAPIAEN ELEVAGE
INTENSIF
6
A. Les besoins en protéines
6
B. Besoins en lipides
7
C. Besoins en vitamines et minéraux
8
D. Besoins en énergie
9
1.6. CROISSANCE ET REPRODUCTION
9
1.6.1. Croissance
9
1.6.2. Reproduction
9
CHAPITRE II. GENERALITES SUR LE MORINGA (Moringa
oleifera)
11
2.1. ORIGINE ET CLASSIFICATIONBOTANIQUE
11
2.2. EXIGENCES ECOLOGIQUES
11
2.3. AIR DE DISRIBUTION
11
2.4. IMPORTANCES
12
2.4.1. Importance pratique
12
2.4.2. Importance socio-économique
12
2.5. MORPHOLOGIE ET CARACTÉRISTIQUES
PHYSIOLOGIQUES
12
CHAPITRE III. MILIEU, MATERIELS ET METHODES
14
3.1. MILIEU D'ÉTUDE
14
3.2. MATÉRIELS ET MÉTHODES
16
3.2.1. Fabrication de l'aliment pour poissons
16
3.2.1.2. Pesée et formulation
proprement-dite de l'aliment
17
3.2.2. Analyses chimiques des aliments
formulés
20
3.2.3. TRAVAUX DE LA PHASE PRE-EXPPERIMENTALE
22
3.2.4. TRAVAUX DE LA PHASE EXPERIMENTALE PROPREMENT
DITE
23
3.3. DETERMINATION DES PARAMETRES DE CROISSANCE ET
DIFFERENTS INDICES
24
1. Le Taux de survie (TS en %) : la
survie est calculée selon la formule :
24
2. Le taux de croissance spécifique
(TCS ou SGR en %)
24
3. Le taux de conversion alimentaire (TCA ou
FCR)
24
CHAPITRE IV. RESULTATS ET DISCUSSION
26
4. 1. PRESENTATION DES RESULTATS
26
A. Paramètres physico-chimiques de l'eau
26
A.1. Température
26
A.2. pH
27
A.3. Oxygène dissous
27
B. Paramètres de survie, de croissance et de
conversion alimentaire
28
4.2. DISCUSSION DES RÉSULTATS
31
Ø Paramètres physico-chimiques
de l'eau
31
Ø Taux de conversion alimentaire
32
CONCLUSIONS ET RECOMMANDATIONS
34
PERSPECTIVES DE RECHERCHES
36
REFERENCES BIBLIOGRAPHIQUES
37
ANNEXES
42
ANNEXE 1 : les valeurs de la
température au cours de l'expérience
42
ANNEXE 2 : les valeurs du pH au cours de
l'expérience
43
ANNEXE 3 : valeurs moyennes
journalières de l'oxygène dissous (mg/l)
44
ANNEXES 4 : Synthèses des
résultats des paramètres étudiés au cours de
l'expérience.
45
TABLE DES MATIERES
47
|
|



