II.2.3) Extraction des gommes de Triumfetta cordifolia
Les gommes ont été extraites en milieu aqueux
sur le 2ème lot des tranches d'écorces
découpées à l'étape précédente. Les
écorces (4g/150mL) ont été introduites dans un
réacteur de 3 L contenant de l'eau distillée chauffée
à 50 °C. Au cours de l'infusion, le mélange a
été agité pendant 1 H par une pâle croisée
d'un agitateur mécanique. L'extrait obtenu (extrait brut) est ensuite
filtré à l'aide d'un tamis de maille égale à 500
um. Ensuite, le filtrat a été récupéré et
centrifugé à 3600 rpm pendant 20 min pour éliminer les
particules en suspension afin d'obtenir une solution homogène qui
constitue l'extrait brut de gommes (Ndjouenkeu et al.,1996). La figure
15 récapitule le procédé d'extraction des
gommes.
Tranche d'écorce
(4g/150ml)/ 5×1cm2
|
Eau distillée (50 °C)
|
|
Extraction (1 H)
|
?
|
Agitateur mécanique
|
|
|
|
|
|
Résidus des écorces
|
|
|
Filtration
|
|
|
|
|
|
|
|
|
? Tamis de 500 um
|
|
|
|
|
|
|
Centrifugation [3600 rpm, 20 min]
|
|
(Pour éliminer les matières insolubles)
|
|
|
|
Extrait brut de gomme
|
|
|
Figure 15: schéma du procédé
d'extraction des gommes (Ndjouenkeu et al., 1996)
II.2.4. Purification des gommes de Triumfetta
cordifolia
l'extrait a été purifiée par la
méthode de Kim et d'Appolonia (1976) selon la figure 16 où les
protéines contenues dans l'extrait brut ont été
hydrolysées par la pepsine à 2 g/L et précipitées
par l'acide trichloracétique 10% (m/v) puis supprimées par une
centrifugation. La purification a été complétée par
une dialyse de la solution pendant 48heures (avec un changement d'eau toutes
les 8 H) pour éliminer les molécules de faibles masses
Par NONGNI JIOGHO Yannick 23
Etude en réacteur agité du traitement des eaux
destinées à la consommation par un biofloculant : T.
cordifolia
Par NONGNI JIOGHO Yannick 24
moléculaires et les minéraux libres. Sur les
extraits (bruts et purifiés), les polysaccharides, les protéines
et les cendres ont été dosés en utilisant les
méthodes décrites ci-dessous.
Solution extraite (1 L)
HYDROLYSE (Pepsine 2 g/L)
PRECIPITATION
(L'acide
trichloracétique 10% (m/v)
CENTRIFUGATION [5000 rpm, 20 min]
DIALYSE (48 H)
LAVAGE A L'EAU DISTILLEE
Solution de gomme purifiée
Figure 16: Schéma du procédé de
purification de l'extrait de la solution de T. cordifolia (Kim et
Appoliniare, 1976)
? La Dialyse
Pour ce faire, une première étape consistait
à préparer les membres de dialyse, cette préparation se
faisait comme suit :
? Couper 20 cm de la membrane
? Plonger dans un bécher contenant de l'eau
distillée
? Placer dans un bain marie et s'assurer que la
température du bain ainsi
que de l'eau distillée dans laquelle baigne les membranes
soit de 60 °C
? Attendre entre 4 et 6 H avant de sortir les membranes,
prêtes à
l'utilisation.
Etude en réacteur agité du traitement des eaux
destinées à la consommation par un biofloculant : T.
cordifolia
Par NONGNI JIOGHO Yannick 25
Une fois les membranes prêtes, nous avons
procédé à la dialyse qui est la première
étape de la purification. Sa méthode est la suivante :
· Prélever 50 mL de notre extrait ;
· Introduire dans les membranes de dialyse ayant une
extrémité attachée ;
· Attacher la seconde extrémité de la
membrane ;
· Placer dans un liquide de dialyse (de l'eau
distillée pour notre cas précis), à température
ambiante (23 °C environs) ;
· Changer le liquide de contre-dialyse tous les 8 H durant
les deux jours de la
dialyse.
II.2.5.) Caractérisation chimique des
écorces et des extraits de gommes de T. cordifolia a)
Caractérisation chimique des écorces
L'analyse des échantillons de T.cordifolia
portait sur la détermination de la teneur en
cendres, matières sèches ; le dosage des sucres
totaux, le dosage des gommes et le dosage de certains éléments
minéraux (Ca++, Mg++, CaCO3).
= Matière sèche
Elle est obtenue en pesant 3g d'écorce sur une capsule
et le mettre à l'étuve à 105 °C pendant 24 H. Le
calcul de la matière sèche (MS) en pourcentage est fait de la
façon suivante.
%MS = (M3--M1)
(M2--M1) X 100 [1]
Où M1 est la masse de la capsule à vide, M2 la
masse de la capsule plus la prise d'essai frais et M3 la masse de la capsule
contenant l'écorce séchée.
= Cendres totales
Les cendres sont obtenues après incinération
d'une masse d'échantillon humide et déterminées selon la
méthode normée (AOAC, 1990). 10g de poudre d'écorce
introduites dans des creusets en porcelaine ont été
séchées à 105 °C #177; 2 °C jusqu'à poids
constant, puis incinérés dans un four à moufle à
une température de 550 °C et en atmosphère oxydante
jusqu'à l'obtention des cendres blanches. La teneur en cendres a
été calculée par la formule ci-dessous :
Etude en réacteur agité du traitement des eaux
destinées à la consommation par un biofloculant : T.
cordifolia
Par NONGNI JIOGHO Yannick 26
TC = (M3--M1)
(M2--M1) X 100% [2]
Où M1 est la masse du creuset en porcelaine vide, M2 la
masse du creuset plus la prise d'essai séchée à 105
°C et M3 la masse du creuset contenant le résidu
incinéré.
? Teneurs en sucres solubles, sucres totaux et en
gommes
Les sucres solubles et les sucres totaux ont été
extraits de la poudre d'écorces puis dosés selon la
méthode colorimétrique au DNS (l'acide 3,5-dinitrosalicylique) de
Fischer et Stein (1961) selon le principe fondé sur le fait qu'en milieu
alcalin et à chaud, le DNS réagit avec les sucres libres et passe
de sa forme oxydée jaune à sa forme orangée
présentant un maximum d'absorption à 540 nm. La coloration
développée est proportionnelle à la concentration en
sucres du milieu.
? Extraction des sucres
Les sucres libres sont extraits en mélangeant 0,5 g de
poudre et 5 mL d'éthanol dans un bécher de 10 mL. Le
mélange agité pendant une heure puis centrifugé à
5000 rpm pendant 15 min et le surnageant est recueilli dans une fiole
jaugée de 50 mL. L'opération est répétée 3
fois sur le résidu avec le même volume de solvant. Les
différents extraits sont mélangés dans une fiole dans
laquelle on rajoute 1 mL de sulfate de zinc (2 g/100 mL) de pureté
égale à 99% et 1 mL de ferrocyanure de potassium (10,6 g/100 mL)
à 99% pour la défécation des protéines. Le
mélange est ensuite filtré à l'aide d'un papier filtre
WATMAN numéro 2, Le volume du filtrat est complété
à 50 mL avec de l'eau distillée.
Les sucres totaux sont extraits par hydrolyse acide de la
poudre d'écorce. A cet effet, dans un Erlenmeyer muni d'un bouchon avec
tube de dégagement et contenant 5 mL d'acide sulfurique (2,5 M), est
introduit 0,2 g de poudre d'écorces. Le mélange est porté
au bain-marie à 97,7 °C pendant deux heures, puis refroidi à
température ambiante. 10 mL d'éthanol à 70 %, 1 mL de
sulfate de zinc (2 g/100 mL) et 1 mL de ferrocyannure de potassium (10,6 g/100
mL) y sont ajoutés pour la défécation des
protéines. Le mélange est ensuite filtré dans une fiole de
50 mL et le volume du filtrat est complété à 50 mL avec de
l'eau distillée.
? Dosage des sucres libres
Dans un tube à essai sont ajoutés : 0,5 mL
d'extrait, 1,8ml d'eau distillée et 0,4ml de
solution de DNS. En même temps, une série de
solutions d'étalonnage de concentrations comprises entre 0,25 mg/mL et
1,5mg/ml est préparée dans des tubes à
Etude en réacteur agité du traitement des eaux
destinées à la consommation par un biofloculant : T.
cordifolia
Par NONGNI JIOGHO Yannick 27
essai, à partir d'une solution-mère de glucose
à 2 mg/mL. L'ensemble des tubes est incubé dans un bain-marie
bouillant (100 °C) pendant 5min, puis refroidi sous un courant d'eau, et
leur densité optique lue contre un blanc à 540 nm à l'aide
d'un spectrophotomètre UV Visible de marque JENWAY.
? Dosage des sucres totaux
En milieu acide et à chaud, les pentoses (C5) et
hexoses (C6) subissent une cyclisation pour donner respectivement le furfural
et l'hydroxyméthylfurfural. Les composés ainsi formés
réagissent avec le phénol pour donner un complexe coloré
jaune-orange présentant une absorption maximale à 450 nm (Figure
17).
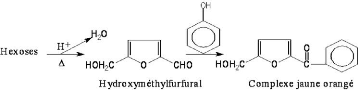
Figure 17 : Equation de la réaction des oses avec
le phénol en milieu acide et à chaud
L'étalonnage est réalisé à l'aide
d'une solution de glucose 1 g.L-1. Pour le mode
opératoire, introduire successivement dans une
série de fioles de 50 mL les réactifs comme mentionnés
dans le tableau 4:
Tableau 4: Etalonnage des solutions de glucose et dosage
d'extrait et d'écorce de T.cordifolia
|
N° des tubes
|
1
|
2
|
3
|
4
|
5
|
6
|
Inconnus
|
|
Etalon de glucose 1 g.L-1 (mL)
|
0
|
0,25
|
0,5
|
0,75
|
1
|
1,25
|
0
|
|
Echantillon à doser (mL)
|
/
|
/
|
/
|
/
|
/
|
/
|
0,5
|
|
Eau distillée (mL)
|
10
|
9,75
|
9,5
|
9,25
|
9
|
8,75
|
9,5
|
|
Phénol aqueux 50% (mL)
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
|
Acide sulfurique (d=1,83) (mL)
|
5
|
5
|
5
|
5
|
5
|
5
|
5
|
Laisser reposer 10 minutes, agiter, puis incuber au bain-marie
à 30°C pendant 20 minutes
Glucose (mg) 0 25 50 75 100 125
DO à 490 nm
La concentration en sucres des différents extraits est
exprimée en équivalent
glucose en mg/mL et la teneur en sucres exprimée par
rapport à la matière sèche de la poudre.
Etude en réacteur agité du traitement des eaux
destinées à la consommation par un biofloculant : T.
cordifolia
Par NONGNI JIOGHO Yannick 28
La teneur en polysaccharides, représentative des gommes,
est obtenue par différence entre la teneur en sucres totaux et celles en
sucres libres.
?Teneur en minéraux
Les teneurs en calcium, magnésium, carbonate de calcium
ont été déterminées par la méthode
colorimétrique décrite par Rodier (1978).
?Carbone total
Le carbone organique est dosé par la méthode
WalkleyBlack (Braun et Jaag, 1970; Tchobanoglous et al., 1993). En
effet, nous avons introduit dans un erlenmeyers de 500 mL, 0,25 g de chaque
floculant végétal, 10 mL de bichromate de potassium 1 N, 20 mL
d'acide sulfurique concentré. Une heure plus tard, nous avons introduit
dans le mélange 200 mL d'eau déminéralisée, 10 mL
d'acide phosphorique concentré et dix gouttes de férroine.
L'excès de bichromate de potassium a été dosé par
une solution de sulfate ferreux 0,5 N. Les teneurs en carbone total sont
calculées en tenant compte du fait que 76 à 77 % du carbone
organique total sont oxydés (Braun et Jaag, 1970; Flyhammar, 1997). Le
taux de carbone organique mesuré peut être calculé suivant
la formule citée plus bas.
Le pourcentage de carbone organique total est calculé par
l'expression :
%C = (A--B)x10x0,004x100 [3]
m xA
Où A = V(FeSO4) utilisé (mL) pour l'essai à
blanc (10 mL de bichromate de potassium); B = V(FeSO4) utilisé pour
l'échantillon (mL);
m = masse de l'échantillon (g).
b) Caractérisation chimique des extraits de gomme
?La matière sèche
Elle a été déterminée selon la
méthode précédente.
?Carbone total
Il a été dosé par la méthode
WalkleyBlack décrit précédemment. ?Teneur en
minéraux
Etude en réacteur agité du traitement des eaux
destinées à la consommation par un biofloculant : T.
cordifolia
Par NONGNI JIOGHO Yannick 29
Les teneurs en sulfate et fer ont été
déterminées par la méthode colorimétrique
décrite par Rodier (1978).
II.3. Conduite de l'opération de
coagulation/floculation
Une série de cinq béchers (1000 mL) d'un
floculateur numérique de marque Fischer (équipé d'une
palette rectangulaire située à 1/3 du fond de la taille de
bécher) contenant chacun 800 mL de suspension synthétique, a
été soumis à deux minutes d'agitation rapide (250
tours/min), puis des quantités croissantes de floculant (sulfate
d'aluminium, sulfate de fer, extrait purifié d'écorce de T.
cordifolia) y sont introduites. Le contenu de chaque bécher a
été ensuite soumis à trois minutes d'agitation rapide (250
tours/min) et vingt minutes d'agitation lente (60 tours/min) (Lartiges et
al., 1997 ; Bouchard et Serodes, 2002; Hernandez 2006; Sadiq et Rodriguez,
2004). À la fin de l'agitation, on a permis à la suspension
d'agrégats de se décanter pendant 30 minutes dans un cône
gradué d'Imhoff. Cinquante millilitres (50 mL) de surnageant ont
été siphonnés de 250 mm en dessous de la surface libre de
l'eau décantée. Des analyses ont été ensuite
effectuées sur le surnageant (pH final, turbidité
résiduelle, conductivité finale). Le volume de boue a
été mesuré en lisant les marques de repère du
côté du cône d'Imhoff. La dose optimale de chaque coagulant
ou floculant est déterminée par la mesure de la turbidité
de l'eau décantée. Les résultats de ces mesures ont
donné des courbes de variation de la turbidité de l'eau en
fonction de la dose du coagulant ou du floculant ajouté.
II.4. Analyse des solutions traitées mesure de la
turbidité résiduaire
La détermination de la turbidité
résiduaire a été réalisée suivant la
méthode proposée par (Rodier, 2009) dont le principe est
décrit comme suit : un faisceau lumineux traverse la cuve de mesure,
lorsque l'appareil est mis en marche. La lumière diffusée
latéralement par les particules en suspension présent dans la
solution est reçue par une cellule de mesure décalée.
Le taux d'abattement c'est à dire le pourcentage
d'élimination des colloïdes de nos échantillons s'est fait
selon l'équation de Lee et al., 1995, donnée par :
Turbidité Initiale--Turbidité
finale
Activité Ai= x 100 [4]
Turbidité Initiale
mesure du pH final
Etude en réacteur agité du traitement des eaux
destinées à la consommation par un biofloculant : T.
cordifolia
Par NONGNI JIOGHO Yannick 30
La mesure du pH final se faite grâce à un kit
portable. Le protocole consiste à laisser décanter le contenu des
béchers pendant 30 min après avoir déstabilisé les
colloïdes en jars test, par la suite prélevé 50 mL du
surnageant de chaque béchers et procédé à la mesure
des pH finaux à l'aide d'un kit d'analyse. Il s'agira dans un premier
temps de nettoyer l'électrode de verre du pH-mètre avec de l'eau
distillée puis, plonger celle-ci dans les 50 mL d'eau contenu dans des
tubes et régler en outre l'appareil en entrant les données sur sa
mémoire concernant le paramètre à mesurer (pH).
mesure du volume de boue
Le protocole consiste à récupérer le
contenu des béchers de 1L après agitation lent du jars test puis
à incliner le cône Imhof d'un angle d'environs 45 O y introduire
l'eau traitée. Laisser décanter pendant 30 min puis
évaluer le volume de boues par simple lecture visuelle du volume
occupé par les boues au niveau des cônes Imhof gradués.
II.5. Modélisation statistique de la floculation
avec T. cordifolia via un plan d'expérience
? Facteur influençant sur le procédé
de coagulation/floculation
Avant de passer à la modélisation statistique de
la coagulation/floculation, des études préliminaires ont
été effectuées pour définir les domaines
expérimentaux des facteurs influençant la coagulation/floculation
et définir un cahier de charges qui permettra de trouver une zone de
compromis dans lequel on pourrait avoir des meilleures conditions optimales de
coagulation/floculation.
? pH:
? La vitesse d'agitation : ? Dose du coagulant.
? Domaine d'étude
Les bornes des facteurs ont été définies
en fonction des essais d'optimisation rencontrés dans la
littérature (Narayan et al., 2013 ; Fatombi et al.,
2009 ; Hashim et al., 2013). Le domaine expérimental
défini pour cette étude est donné dans le tableau 5. Les
niveaux haut et bas de chaque facteur sont définis comme l'indique le
tableau 5 ci-contre
Etude en réacteur agité du traitement des eaux
destinées à la consommation par un biofloculant : T.
cordifolia
Par NONGNI JIOGHO Yannick 31
Tableau 5: Domaine d'étude
|
|
VARIBLE REELLE
|
VARIABLE CODEE
|
|
Facteurs
|
Nom
|
Niveau
|
Niveau
|
Valeur au
|
Niveau
|
Niveau
|
Valeur
|
|
|
bas
|
haut
|
centre
|
bas
|
haut
|
au centre
|
|
A
|
PH
|
5
|
8
|
6,5
|
-1
|
+1
|
0
|
|
Vitesse
|
|
|
|
|
|
|
|
B
|
d'agitation
|
100rpm
|
250rpm
|
175rpm
|
-1
|
+1
|
0
|
|
C
|
Dose de T. cordifolia
|
1mL
|
5mL
|
3mL
|
-1
|
+1
|
0
|
? Réponses
Les réponses suivies au cours de la
coagulation/floculation sont la turbidité, le pH et la
conductivité. Ces analyses ont été effectuées sur
le surnageant obtenu après la coagulation/floculation à
différentes conditions de coagulation/floculation. Le taux d'abattement
de la turbidité est d'autant meilleur que sa valeur est plus
élevée. On cherchera donc des conditions optimales de ce
procédé qui conduiront à une forte valeur de cette
réponse. L'objectif est d'obtenir une eau clarifiée ayant un taux
d'abattement de turbidité résiduelle au moins égal
à 96 %. Les réponses obtenues ont été
analysées et les courbes ont été tracées à
l'aide des logiciels Statgraphics Centurion Xv.II et Sigma Plot. Le
modèle issu de cette analyse est soumis à des tests de
validation.
? Choix du plan expérimental
Nous nous attendions à des variations des
réponses correspondant à un modèle du second degré.
Après avoir examiné notre problème en détail, on a
retenu un plan de Box-Behnken qui permettra d'établir le modèle
désiré et ne nécessite qu'un nombre restreint d'essais. Le
modèle est de la forme suivante :
~~ = 13o + ? /3L x + ? f3~~ x + ? f311x1x~ + e [5]
Où Y1est la réponse prévue, f.? la
constante, f.?, 1.?2, f.?3, les coefficients linéaires, f i, ~~~, f.?33,
les coefficients carrés, f.?12, f.?13, , f.23 les
coefficients d'interactions et x1, x2, X3,; x1x2, x1x3, , X2X3, , et
x ~, x ~, x ~, sont les niveaux des variables indépendantes. e
étant l'erreur.
Etude en réacteur agité du traitement des eaux
destinées à la consommation par un biofloculant : T.
cordifolia
Par NONGNI JIOGHO Yannick 32
?Validation des modèles
Afin de mettre sous forme d'équation le
phénomène observé et permettre de prédire les
réponses dans le domaine défini pour l'étude, il est
important de valider les modèles empiriques obtenus. Pour ce faire,
l'exécution du modèle a été mesurée en
comparant les valeurs des réponses prévues et celles
observées. En plus du coefficient de régression linéaire
(R2), d'autres procédures et outils mathématiques ont
été utilisés. Ainsi, l'Analyse Absolue de la
Déviation Moyenne (AADM) qui renseigne sur l'erreur moyenne des
manipulations, le facteur de Biais (Bf) ainsi que les facteurs d'Exactitude Af1
(Ross, 1996) et Af2 (Baranyi et al., 1999) ont été
déterminés selon les expressions suivantes:
Analyse Absolue de Déviation Moyenne (AADM)
~~
~ ~~~~~~ ~~~
? ( )
~~~ ~~ ~~~
[6]
AADM =
Avec : Yi exp la réponse expérimentale
etYi cal la réponse calculée à partir du
modèle pour une expérience i ; p étant le nombre total
d'expériences.
Facteur de Biais (Bf)
Bf = 10B [7]
Le Biais B est donné par la relation :
~
~ = ? log(é
~~~~ ) [8]
Facteurs d'Exactitudes (Af1et Af2)
Afl = 10A1 [9]
Avec A1 et A2 les exactitudes qui sont déterminées
selon les relations suivantes :
~
~
~~ = ? ~log(~~~é~
~~~~ )~ et ~~ = ~~ ~ ? ~log(~~~é~
~~~~ )~ [10]
Ainsi, un modèle est considéré comme
parfait si le facteur de Biais et les facteurs d'exactitude sont égaux
à l'unité, et l'AADM égale à Zéro.
Bf = Afi = Af2= 1 et AADM = 0
Les représentations graphiques des surfaces de
réponses des modèles postulés ont été
réalisées. A cet effet, le logiciel STATGRAPHICS Centurion XV.II
a été utilisé.
Etude en réacteur agité du traitement des eaux
destinées à la consommation par un biofloculant : T.
cordifolia
Par NONGNI JIOGHO Yannick 33
? Expérimentation
Tableau 6 : Matrice d'expériences et
résultats expérimentaux
|
N°
essai
|
|
Variable réelles
|
|
|
Variable codées
|
|
|
A
|
B
|
C
|
A
|
B
|
C
|
|
1
|
8
|
175
|
1
|
1
|
0
|
-1
|
|
2
|
8
|
175
|
5
|
1
|
0
|
1
|
|
3
|
6,5
|
100
|
1
|
0
|
-1
|
-1
|
|
4
|
5
|
175
|
1
|
-1
|
0
|
-1
|
|
5
|
5
|
100
|
3
|
-1
|
-1
|
0
|
|
6
|
5
|
175
|
5
|
-1
|
0
|
1
|
|
7
|
6,5
|
175
|
3
|
0
|
0
|
0
|
|
8
|
8
|
250
|
3
|
1
|
1
|
0
|
|
9
|
5
|
250
|
3
|
-1
|
1
|
0
|
|
10
|
6,5
|
250
|
1
|
0
|
1
|
-1
|
|
11
|
6,5
|
250
|
5
|
0
|
1
|
1
|
|
12
|
8
|
100
|
3
|
1
|
-1
|
0
|
|
13
|
6,5
|
100
|
5
|
0
|
-1
|
1
|
|
14
|
6,5
|
175
|
3
|
0
|
0
|
0
|
|
15
|
6,5
|
175
|
3
|
0
|
0
|
0
|
? Analyse statistique
L'analyse de la variance (ANOVA) a été
utilisée pour déterminer l'influence de chaque facteur ainsi que
le degré de signification de chacun de ces effets. Elle examine la
signification statistique de chaque effet en comparant la moyenne au
carré contre une évaluation de l'erreur expérimentale. La
signification de chaque facteur est déterminé par le test de
Fisher qui est défini comme étant le rapport du carré
moyen de la régression (CMR) sur l'erreur expérimentale (EE)
(F=CMR/EE), représentation de la signification de chaque variable
commandée sur le modèle examiné. Les équations de
régression ont été également soumises au test de
Fisher pour déterminer le coefficient de régression
R2. Par ailleurs, les calculs ont été effectués
avec le logiciel d'optimisation STATGRAPHICS Centurion XV.II. Le niveau de
confiance accepté est (1 - á) = 95%.
Etude en réacteur agité du traitement des eaux
destinées à la consommation par un biofloculant : T.
cordifolia
Par NONGNI JIOGHO Yannick 34
| 


