|
Département de pharmacie
Laboratoire d'Hydrologie- Bromatologie
Mémoire pour l'obtention du diplôme d'étude
médicale spécialisée en Hydrologie-Bromatologie

Niveau de la contamination par des germes
dans les cuisines de deux cités
universitaires
de la ville de Mostaganem
Présenté par
Dr BENDANI Mohammed
Composition du Jury
|
Pr HADJOUDJ OUAHIBA Présidente Faculté de
médecine d'Alger
Dr SAOUD ZAHIA Examinatrice Faculté de
médecine d'Alger
Dr SEMOUD ANISSA Examinatrice Faculté de
médecine d'Annaba
Dr TAIDIRT ZINEB Examinatrice Faculté de médecine
d'Alger
Encadreur
Pr GAOUAR ZAKARIA LOTFI Faculté de médecine
d'Oran
Janvier 2020
|
Remerciements
D'abord je remercie Dieu le tout puissant de
m'avoir donné courage, santé, souffle et patience pour accomplir
ce travail.
Un merci très spécial à mes
chers parents pour leur amour, aide, soutient et encouragements que Dieu les
garde en bonne santé.
J'adresse mes sincères remerciements
à Mr Benalioua le chef de service du laboratoire d'hygiène de
Mostaganem pour son accueil et son soutien en m'apportant courage et confiance
durant mon travail.
J'adresse mes sincères remerciements à
mon encadreur Pr GAOUAR professeur à la faculté de
médecine d'Oran, je remercie vivement Pr GAOUAR pour avoir
accepté d'examiner ce travail, qu'il trouve ici toute ma
gratitude.
J'adresse aussi mes sincères remerciements
au personnels du laboratoire d'hygiène de Mostaganem Pour leurs
encouragements pendant l'élaboration de mon travail. Et que toute
personne ayant participé de prés ou de loin à la
réalisation de ce mémoire trouve ici l'expression de ma profonde
sympathie.
Mohammed
RESUME
m411mm

RESUME
RE S U M E
Résumé
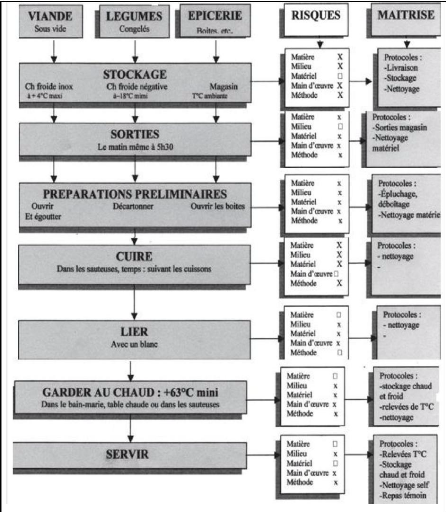
Dans la restauration universitaire en particulier, les grandes
quantités de denrées préparées quotidiennement font
que les règles élémentaires d'hygiène sont souvent
négligées. Ceci est particulièrement vrai dans nos pays
où la main d'oeuvre a souvent un faible niveau de formation.
L'étude de la qualité sanitaire de ces restaurants collectifs
permettra d'évaluer sa qualité hygiénique.
Dans le but d'analyser la qualité
bactériologique des denrées alimentaires dans les restaurants
universitaires, nous avons étudié 20 prélèvements
de repas servis aux étudiants, et 34 prélèvements à
partir des mains et des surfaces dans deux restaurants universitaires de la
wilaya de Mostaganem.
Nos objectifs ont consisté à déterminer
l'évolution de la qualité hygiénique et microbiologique
des denrées alimentaires et des plats finis servis aux étudiants
et identifier les différents germes en cause (coliformes fécaux,
Staphylocoques aureus et Salmonella). Les résultats
ont été interprétés suivant les normes et les
critères algériens légaux.
Nous avons mis en évidence la présence de
Staphylococcus dans 31 échantillons et la présence de
coliformes thermotolérants dans 23 échantillons.
Mots-clés: Restauration
universitaire - Analyse Bactériologique - Qualité
Hygiénique - Microbiologie - Denrées alimentaires -
Mostaganem - d'altération - bactérie - toxi-infection
alimentaires collectives.
ABSTRACT
Abstract
In university catering in particular, the large quantities of
food prepared daily mean that basic rules of hygiene are often neglected. This
is particularly true in our countries where the workforce often has a low level
of training. The study of the sanitary quality of these collective restaurants
will make it possible to evaluate its hygienic quality.
In order to analyze the bacteriological quality of foodstuffs
in university restaurants, we studied 20 samples of meals served to students,
and 34 samples taken from hands and surfaces in two university restaurants in
the wilaya of Mostaganem.
Our objectives were to determine the evolution of the hygienic
and microbiological quality of foodstuffs and finished dishes served to
students and to identify the different germs involved (fecal coliforms,
Staphylococcus aureus and Salmonella). The results were interpreted according
to Algerian legal norms and standards.
We found Staphylococcus in 31 samples and the presence of
thermotolerant coliforms in 23 samples.
Keywords: University catering -
Bacteriological analysis - Hygienic quality - Microbiology - Foodstuffs -
Mostaganem - Alteration - Bacteria - Collective food poisoning.
ÕÎáã
Õ Îáã
|
Çðíãæí
|
åÏÇÏÚÅ
ãÊí íÐáÇ
|
ãÇÚØáÇ
|
äã
ÉÑíÈßáÇ
ÊÇíãßáá
ÇÑÙä
|
ÕæÕÎáÇ
|
åÌæ ìáÚ
ÉíÚãÇÌáÇ
ãÚÇØãáÇ
|
í
|
|
ðÇÈáÇÛ
|
ËíÍ
ÇäÏáÇÈ í
|
ÕÇÎ
|
áßÔÈ ÇÐå
.äÇíÍáÇ äã
ÑíËß
|
í
ÇåáÇãåÅ
|
ãÊí
ÉÇÙäáá
ÉíÓÇÓáÇ
ÏÚÇæÞáÇ
|
äÅ
|
ÉíÚÇãÌáÇ
ãÚÇØãáÇ
åÐåá ÉíÍÕáÇ
ÉÏæÌáÇ
ÉÓÇÑÏ ÍíÊÊÓ .
ÖÎäã
ÉáãÇÚáÇ
ìæÞáÇ ìæÊÓã
äæßí Çã
ÉíÚãÇÌáÇ
ãÚÇØãáÇ í
ÉíÆÇÐÛáÇ
ÏÇæãáá
ÉíÌæáæíÑÊßÈáÇ
ÉÏæÌáÇ
áíáÍÊ áÌ äã .
ÉÇÙäáÇ ÉÌÑÏ
ãííÞÊ
í
ÍæØÓáÇæ
íÏíáÇ äã
ÉÐæÎã ÉäíÚ 43 æ
ÈáÇØáá
ÉãÏÞãáÇ
ÊÇÈÌæáÇ äã
ÉäíÚ 02 ÇäÓÑÏ
ÉíÌæáæíÈæÑßíãáÇæ
ÉíÍÕáÇ
ÉÏæÌáÇ ÑæØÊ
ÏíÏÍÊ í
ÇäÇÏå ÊäÇß
.ãäÇÛÊÓã
ÉíáÇæÈ
äííÚãÇÌ
äíãÚØã
|
ÊÇäæáæÞáÇ
í
|
( ÉíäÚãáÇ
ÉáÊÎãáÇ
ãíËÇÑÌáÇ
ÏíÏÍÊæ
ÈáÇØáá
ÉãÏÞãáÇ
ÉÒåÇÌáÇ
ÞÇÈØáÇæ
ÉíÆÇÐÛáÇ
ÏÇæãáá
|
.)
.
ÉíÑÆÇÒÌáÇ
ÉíäæäÇÞáÇ
ÑííÇÚãáá
ÇðÞæ
ÌÆÇÊäáÇ
ÑíÓÊ ãÊ
áÇíäæãáÓáÇæ
ÉíÈåÐáÇ
ÉíÏæÞäÚáÇ
ÊÇÑæßãáÇæ
ÉíÒÇÑÈáÇ
. íÚÇãÌáÇ
íÆÇÐÛáÇ
ããÓÊáÇ
|
-
ÇíÑíÊßÈáÇ
|
- ÑííÛÊáÇ
|
-
|
.ÉäíÚ 04 í
ÉíÑÇÑÍáÇ
ÊÇíäæáæÞáÇ
ÇäÏÌææ ÉäíÚ 43
í ÉíÏæÞäÚáÇ
ÊÇÑæßãáÇ
ÇäÏÌæ
ãäÇÛÊÓã -
ÉíÆÇÐÛáÇ
ÏÇæãáÇ -
ÉÞíÞÏáÇ
ÁÇíÍáÇ ãáÚ -
ÉíÍÕáÇ
ÉÏæÌáÇ -
íÌæáæíÑÊßÈáÇ
áíáÍÊáÇ -
íÚãÇÌáÇ
ãÇÚØáÇ :
ËÍÈáÇ
ÊÇãáß
LISTE DES FIGURES
Figure 01: Diagramme de fabrication. Cuisson en
ragoût ..11
Figure 02: Numération aérobie
mésophile signification dans les aliments
cuites prêts à consommer (Pascal et al.,
2009) 13
Figure 03: Distribution des résultats
d'une surveillance bactériologique bactériologique
(Pascal et al., 2009) 14
Figure 04. Procédure de la marche en
avant (Cosson et al., 2003) .16
Figure 05 : La méthode HACCP (Cosson
et al., 2003) ..35
Figure 06: Incidence Mensuelle des TIAC
Année 1999-2009 En Algérie (INSP, 2009). 45
Figure 07: Incidence Mensuelle des TIAC
Année 2009 En Algérie (INSP, 2009) 45
Figure 08 : Prélèvement sur
surfaces, plats, équipements, 50
Figure 09: L'aspet de la flore aérobie
mésophile totale sur gélose plate cuout agar (PCA)
apres incubation pendant 72 h à 30° C .62
Figure 10 : Les tubes de VBL après 24
heures (test de présomption) 63
Figure 11 : Les tubes d'EPEI après
l'addition de kovacs (test de confirmation) ..63
Figure 12 : L'aspect des colonies des coliformes
thermotolérants sur milieu VRBL
après incubation pendant 24 heures à 45°C
64
Figure 13 : le milieu d'enrichissement Giolitti
de Cantoni après 24 heures(staphylocoques)......64
Figure 14 : colonies suspectes de staphylocoques
après l'isolement et la purification
sur milieu chapman 65
Figure 15 : Test de catalase pour des souches de
Staphylococcus (St3) 67
Figure 16 : Teste de coagulase pour les souches
de Staphylococcus aureus 67
Figure 17 : Isolement sur milieu SS
(salmonella-shegella) après 24 heures
(colonies suspectes de salmonelle) à partir d'un repas
cuit. 68
Figure 18 : Isolement sur milieu SS
(salmonella-shegella) après 24 heures
(colonies suspectes de salmonelle) à partir des mains de
cuisinier. 69
LISTE DES FIGURES
Figure 19 : Milieu Milieu Urée Indole
incubé 24 heure à 37°C avant et après
l'addition de réactif de kovacs 69
Figure 20 : Milieu TSI après
incubation 24 heure à 37°C (pour les souches
des entérobactéries isolées à
partir des surfaces et des mains) ..70
Figure 21 : Milieu Manitol Mobilité
après l'incubation 24 heure à 37°C .70
Figure 22 : Milieu Citrate de Simmons
après l'incubation 24 heure à 37°C 71
Figure 23 : Test de l'ONPG après
l'incubation 24 heure à 37°C 71
Figure 24: Interprétation globale des
résultats d'analyse microbiologiques des aliments 77
Figure 25: Histogramme comparatif globale
78
Figure 26 : Histogramme du niveau de
contamination par les coliformes thermotolérants 79
Figure 27: Histogramme du niveau de
contamination des S. Aureus 80
Figure 28 : Histogramme
d'interprétation de la propriété des deux restaurants
universitaire(Site A et Site B) 81
LISTE DES TABLEAUX
|
Tableau 01: Les causes de contaminations
exogènes
|
5
|
|
Tableau 02 : pH de croissance de quelques
microorganismes
|
9
|
|
Tableau 03 : Choix de l'agent nettoyant
(Hyginov, 1995)
|
.24
|
|
Tableau 04 : Liste des produits chimiques
autorisés en désinfection (Maris, 1995)
|
26
|
|
Tableau 05 : Spectre d'activité des
principaux désinfectants (Isoard, 1988)
|
27
|
|
Tableau 06 : Description des différentes
techniques d'entretien (Hyginov, 1995)
|
29
|
|
Tableau 07 : Températures maximales des
denrées congelées (Delaunay, 2011) ...
|
32
|
|
Tableau 08 : Températures maximales des
denrées réfrigérées (Delaunay, 2011)
|
33
|
Tableau 09 : Tableau
récapitulatif des prélèvements des denrées
alimentaires 49
Tableau 10 : Nombre et nature des
prélèvements dans les sites A et B .50
Tableau 11: critères
bactériologiques : surfaces et mains .61
Tableau 12: Resultat des tests catalase et
coagulase des souches staphylocoques 66
Tableau 13 : Résultats des tests
biochimiques effectué pour les souches isolées sur milieu SS
72
Tableau 14: Les résultats d'analyses des
repas chauds et froids qui ont été
prélevés au niveau de la Restaurant universitaire
CHAMOUMA .73
Tableau 15 : Les résultats d'analyses des
repas chauds et froids qui ont été
prélevés au niveau du restaurant de KHAROUBA.
73
Tableau 16 : Les analyses microbiologiques des
échantillons des surfaces et des mains
qui ont été prélevés au niveau de la
Restaurant universitaire CHAMOUMA. 74
Tableau 17 : Les analyses microbiologiques des
échantillons des surfaces et des mains qui
ont été prélevés au niveau de la
Restaurant universitaire KHAROUBA 75
Tableau 18 : Interprétation des
résultats pour les échantillons prélevés .77
Tableau 19 : Niveau de contamination par les
coliformes thermotolérants 78
Tableau 20 Niveau de contamination par S.Aureus
dans les repas au niveau des
deux sites de l'étude 79
Tableau 21 :
Interprétation des résultats pour les
échantillons prélevés à partir
des surfaces et les mains 80
ABREVIATIONS
Abs: Absence.
ADH: L-arginine.
ADN : Acide Désoxyribonucléique.
BN : Bouillon nutritif.
°C : degré Celsius.
C.T : Coliformes totaux.
C.th : Coliformes thermotolérentes.
C: Chloramphenicol.
CMI : Concentration Minimale Inhibitrice.
CS: Colistin.
D/C: double concentration.
EPEI : milieu Eau Peptonée Example d'Indole. FMAT : Flores
Mésophiles Aérobies Totaux.
FRU : D-fructose. g
: gramme.
GLU : D-glucose.
GM: Gentamicin. h
: heure.
H2O2 : peroxyde d'hydrogène.
H2S : Hydrogène Sulfuré.
HACCP: Hazard Analysis Critical Control Point. HCl : acide
chlorhydrique.
Jora : Journal Officiel Algérienne.
L: Lincomycine.
LAC : D-lactose.
LMA : Laboratoire de Microbiologie Appliquée.
MAL : D-maltose.
MAN : D-mannitol.
MDG: méthyl-áDglucopyranoside.
ABREVIATIONS
MEL : D-mélibiose. MH:
gélose Mueller Hinton. ml :
millilitre. mn : minute.
MNE : D-mannose.
N : Normalité.
NA: Nalidixie acid.
NAG: N-acétyl-glucosamine.
NI : Nitroxolin.
NIT : nitrate de potassium.
NPP : Nombre le Plus Probable.
OMS : Organisation Mondiale de la Santé.
ONPG: Ortho-Nitrophényl- -D-Galactopyranoside.
Ox : Oxalate de di-méthylpara-
phénylène.
OX1: Oxacillin.
PAL : ß-naphtyl phosphate.
PCA : milieu Plate Couot Agar.
PI: Pipemidic acid.
PT : Pristinamycin.
RAF : D-raffinose.
S. aureus : Staphylococcus aureus.
S/C: Simple Concentration. SAC : D-saccharose.
SFB: Sélénite F Broth.
SM : Suspension Mère.
SNV : Sciences de la Nature et de la Vie. SP: Spiramycine.
SS : milieu Salmonella-Shigella. Staph.a : Staphylococcus
aureus.
TSE: Tryptone Sel Eau.
ABREVIATIONS
TSI : Triple sugar iron.
UFC : Unité Formant colonies. URE : Urée.
VBL : milieu Vert Brillons Liquide.
VF : milieu Viande foie.
VP : sodium pyruvate.
VRBL : Milieu Lactosée Biliée au cristal Violet et
au Rouge
neutre XLT : xylitol.
XYL : D-xylose.
INTRODUCTION
La qualité d'un aliment est une association de quatre
composantes : hygiénique, nutritionnelle, hédonique et une
qualité de service. Le but de la cuisine collective, est de
confectionner un grand nombre de repas bien définis. C'est un lieu qui
doit être organisé pour produire en chaud ou froid soit des menus
équilibrés sur une journée, soit des plats
préparés pour un repas principal. La restauration collective est
une branche industrielle qui a pour activité de servir des repas hors
domicile. Actuelle, ce type de restauration collective se divise en trois
secteurs principaux : l'enseignement (restauration scolaire et universitaire),
la santé et le social (restauration hospitalière, maisons de
retraite, établissements pénitentiaires) et le travail
(restauration d'entreprises et d'administrations). La restauration collective
est également appelée catering (mot anglais signifiant
`restauration, ravitaillement') elle désigne l'approvisionnement en
repas d'un grand groupe de personnes (Dillis, 2010).
La cuisine (endroit où l'on traite les aliments) et ses
annexes (stockage, frigo, vaisselle,...) constituent la partie principale de
l'établissement. De la conception de ces locaux dépendra
fatalement la possibilité ou non de préparer les repas dans les
meilleures conditions d'hygiène possibles.
Le transfert aux denrées de la contamination
microbienne peut se réaliser directement par simple contact ou
indirectement par mise en jeu d'un vecteur comme la main. Le risque est
majoré pour toutes les surfaces et le matériel dits
«alimentaires », c'est à dire habituellement au contact direct
des denrées comme par exemple les plans de travail, la batterie de
cuisine, les petits ustensiles et certains appareils tels les
batteurs-mélangeurs, mixeurs, hachoirs, éplucheuses. Les surfaces
et le matériel qui ne se trouvent habituellement pas au contact des
denrées participent également au microbisme ambiant. Par
ailleurs, un contact accidentel entre les denrées et ces surfaces est
théoriquement possible suite à une utilisation fautive.
L'analyse des sources de contaminations surajoutées, au
crible de la règle des « 5 M » conduit à examiner le
rôle du milieu et du matériel. Les différentes surfaces
ainsi que l'ensemble de l'équipement représentent autant de
supports pour l'implantation et le développement de micro-organismes
indésirables, qu'ils soient pathogènes pour l'homme ou agents
d'altération des denrées. Cependant, les plats cuisinés
sont obtenus à partir de denrées alimentaires diverses, ayant
chacune une flore spécifique.
INTRODUCTION
Nos objectifs consistent à déterminer
l'évolution du taux de contamination des denrées alimentaires et
des plats finis servis aux étudiants dans différents sites
universitaires et identifier les différents germes mis en cause (flore
aérobie mésophile, coliformes totaux et thermotolérants,
anaérobies sulfito-réducteurs, staphylocoques aureus et
Salmonella).
Dans la première étape de notre travail, nous
nous sommes intéressée à une revue bibliographique, dans
laquelle nous apportons un certain nombre de données récentes sur
le sujet. Ensuite, dans la deuxième étape nous décrivons
notre mode opératoire des analyses microbiologiques, et enfin, dans
troisième étape nous fournissons et interprétons nos
résultats avec la discussion et des perspectives.
SOMMAIRE
Remerciements
Résumé
Résumé en anglais Résumé en arabe
Table des matières Liste des tableaux Liste des figures
Abréviations
Introduction 01
CHAPITRE I : Synthèse Bibliographique
1. L'HYGIENE ET LA SECURITE DES ALIMENTS 03
1.1.Définitions de l'hygiène et la
sécurité des aliments 03
1.2.Notion de qualité hygiénique 03
1.3.Différences entre l'hygiène des aliments et
l'hygiène alimentaire 03
1.3.1. Hygiène des aliments 04
1.3.2. Maîtrise de la sécurité des aliments
04
1.3.2.1. L'origine de contamination et facteurs favorisants 04
A. Facteurs extrinsèques 07
B. Facteurs intrinsèques 07
2. LA MICROBIOLOGIE DES PLATS CUISINES 10
2.1. L'activité des plats cuisinés 10
2.2. Présentation des plats cuisinés 12
2.3. Technologie des plats cuisinés 12
2.3.1. Obligation de moyens hygiéniques 13
2.3.2. Obligation de résultats hygiéniques 13
2.4. Surfaces de contact des plats cuisinés et les
ustensiles 14
2.5. Applications à la sécurité des aliments
15
SOMMAIRE
3. L'HYGIENE ET LA SECURITE ALIMENTAIRE DANS LES RESTAURATIONS
COLLECTIVES 15
3.1. Conception générale 15
3.1.1. Principes généraux de l'hygiène dans
les industries agro-alimentaires 15
3.1.1.1. Principe de « la marche avant » 15
3.1.1.2. Séparation des secteurs 17
3.1.1.3. Non-entrecroisement des courants de circulation 17
3.1.1.4. Aménagement rationnel 17
3.1.1.5. Utilisation précoce et
généralisée du froid et de la chaleur 17
3.1.1.6. Ordre, nettoyage et désinfection
appropriés 18
3.1.1.7. Personnel compétant 18
3.1.2. Principe de construction 18
3.2. Différents types de locaux 19
3.2.1. Locaux techniques 19
3.2.1.1. Magasins 19
3.2.1.2. Locaux de préparation 19
3.2.1.3. Locaux pour poubelles 20
3.2.1.4. Locaux administratifs 20
3.2.2. Réfectoire 20
3.2.2.1. Cabinets d'aisances 20
3.2.2.2. Les vestiaires 21
3.3. Hygiène des locaux 21
3.3.1. Entretien physique 21
3.3.2. Entretien hygiénique 21
3.3.3. Lutte contre les nuisibles 21
3.4. Equipement 21
3.4.1. Machines et appareils 22
3.4.2. Entretien des équipements 22
3.4.3. Petit Matériel 22
3.5. Nettoyage et Désinfection 22
3.5.1. Nettoyage 23
3.5.2. Agents de nettoyage 24
3.5.3. Désinfection 25
3.5.4. Agents de désinfection 27
3.5.5. Mécanismes de la désinfection 28
3.5.6. Protocole de nettoyage et de désinfection 28
SOMMAIRE
3.6. Personnel 30
3.6.1. Etat de santé 30
3.6.2. Hygiène corporelle 30
3.6.3. Propreté vestimentaire 30
3.6.4. Formation professionnelle 31
3.7. Denrées alimentaires 31
4. PLAN HACCP 34
5. TOXI-INFECTION ALIMENTAIRE COLLECTIVE 36
5.1. Définition 36
5.2. Physiopathologie 36
5.3. Les principaux germes pathogènes responsables des
TIAC 37
5.3.1. Salmonellose 37
5.3.1.1. Maladie humaine 37
5.3.1.2. Aliments impliqués 38
5.3.2. Staphylococcus aureus et enterotoxines
staphylococcique 38
5.3.2.1. Maladie humaine 38
5.3.2.2. Aliments impliqués 39
5.3.3. Clostridium perfringens 39
5.3.3.1. Maladie humaine 39
5.3.3.2. Aliments impliqués 40
5.3.4. Clostridium botulinum 40
5.3.4.1. Maladie humaine 41
5.3.4.2. Aliments impliqués 41
5.3.5. Listeria monocytogenes 41
5.3.5.1. Maladie humaine 41
5.3.5.2. Aliments impliqués 42
5.3.6. Bacillus cereus 42
5.3.6.1. Maladie humaine 42
5.3.6.2. Aliments impliqués 43
5.3.7. Campylobacter 43
5.3.7.1. Maladie humaine (Campylobactériose)
44
5.3.7.2. Aliments impliqués 44
5.4. Evolution de TIAC en Algérie 45
SOMMAIRE
PARTIE PRATIQUE
OBJECTIF 46
CHAPITRE II : matériels et méthodes
1. Echantillonnage 47
2. Matériel de prélèvement 47
3. Matériel de laboratoire 48
4. Les Analyses microbiologiques 48
4.1.Nombre et nature des prélèvements des
denrées alimentaires 48
4.2.Nombre et nature des prélèvements des surfaces
et les mains 49
5. Prélèvements des échantillons 50
5.1.Ecouvillonnage 50
5.2.Prélèvement des échantillons des
denrées alimentaires 51
6. Les germes recherchés pour les analyses des
denrées alimentaires 51
7. Les germes recherchés pour les analyses des surfaces
et les mains 51
8. Techniques d'analyses bactériologiques des
denrées alimentaires 51
8.1.Préparation de l'échantillon pour l'analyse
51
8.2.Recherche des flores mésophiles aérobies totaux
à 30°C (FMAT) 52
8.3.Recherche des coliformes totaux à 37°C (teste de
présomption) 53
8.4.Recherche des coliformes fécaux à 44°C
(test de confirmation) 53
8.5.Recherche des Staphylococcus aureus 54
8.5.1. Enrichissement à 37°C 54
8.5.2. L'isolement à 37°C 54
8.5.3. Identification des résultats 54
8.5.3.1. Prés-identification des staphylococcus
54
8.5.3.2. Identification biochimique 56
9. Recherche des salmonelles 56
9.1. Pré enrichissement non sélectif 56
9.2. Enrichissement à 37°C 56
9.3. Isolement à 37°C 57
9.4. Lecture des boites et caractérisation des suspects
57
9.4.1 Test d'urée-indole 57
9.4.2 Test de TSI à 37°C 58
9.4.3 Test de mannitol-mobilité à 37°C 58
9.4.4 Test du citrate perméase à 37°C 58
SOMMAIRE
9.4.5 Test à l'oxydase 58
9.4.6 Test à l'ONPG (Orthonitrophényl
â-D-Galactopyranoside) 59
9.4.7 Coloration de Gram 59
10. Techniques d'analyses pour le contrôle
bactériologique des écouvillons 60
CHAPITRE III : Résultats et Discussion
1. Résultats 61
1.1. Critères microbiologique 61
1.2. Résultats Obtenus 62
1.2.1. les coliformes 62
1.2.1.1.Les denrées alimentaires 62
A. Test de présomption 62
B. Test de confirmation 63
1.2.1.2.Les surfaces et les mains 64
1.2.2. les Staphylococcus aureus 64
1.2.3. Les Salmonelles 68
2. Interprétation des résultats 75
2.1.Les denrées alimentaires 76
2.2.Les surfaces et les mains 80
DISCUSSION 82
CONCLUSION 84
Références bibliographiques 85
Annexes milieux de culture 96
Chapitre I
Synthèse
Bibliographique

CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
3
1. L'HYGIENE ET LA SECURITE DES ALIMENTS
La sécurité alimentaire est une expression qui
désigne la sécurité des approvisionnements alimentaires en
quantité et qualité (Becila, 2009). De ce fait,
on est tenu à ne pas à confondre ; La sécurité
alimentaire et l'hygiène alimentaire avec l'hygiène et la
sécurité des aliments. Ces termes sont mal utilisés dans
le langage courant.
1.1.Sécurités alimentaires
Sous le terme sécurité alimentaire est entendue :
la garantie que les aliments n'entraînent pas
de conséquences néfastes pour la santé du
consommateur quand ils sont préparés et ingérés, en
tenant compte du but et de la manière de les consommer (Becila ,
2009).
1.2.Notion de qualité hygiénique
La qualité hygiénique est la mesure dans
laquelle un aliment ou un service répond aux besoins et attentes qui ont
été communiquées, qui vont de soi ou qui ont
été imposées (par le consommateur et la loi). Quant aux
produits alimentaires, il s'agit en règle générale de la
sécurité, de la santé et du bien-être du
consommateur (Becila, 2009). C'est aussi l'aptitude d'un
produit à bien nourrir l'homme. Cette dernière à trois
composantes essentielles: la qualité hygiénique, la
qualité organoleptique et la qualité nutritionnelle
(Bolnot, 2004).
1.3.Différences entre l'hygiène des aliments
et l'hygiène alimentaire
L'hygiène alimentaire est le plus souvent
utilisée abusivement pour désigner les règles
d'hygiène à respecter dans le souci d'accroître la
sécurité des aliments. Or, l'hygiène alimentaire est une
expression médicale se rapportant au choix raisonné des aliments,
c'est à dire que l'on devrait utiliser cette expression d'hygiène
alimentaire pour les règles de nutrition et de diététique.
Par conséquent, le texte de base se rapportant à l'hygiène
des aliments est celui du Codex Alimentarius, complété ensuite
par les textes européens et français.
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
4
1.3.1. Hygiène des aliments
L'hygiène alimentaire correspond à une
alimentation saine répondant aux besoins de l'organisme, et n'engendrant
pas de problèmes de santé. Désigne l'ensemble des
conditions et mesures nécessaires pour assurer la sécurité
et la salubrité des aliments à toutes les étapes de la
chaîne alimentaire (Cirillo et al., 2004).
L'hygiène des aliments assure la sécurité et la
salubrité des aliments, elle englobe plusieurs domaines tous aussi
importants les uns que les autres, L'hygiène du personnel,
L'hygiène des locaux (nettoyage, désinfection, matériaux,
agencement...), Les conditions de stockage, de manipulation, de transport
(nettoyage, désinfection, matériaux) et Les matières
premières (Alli, 2004)
1.3.2. Maîtrise de la sécurité des
aliments
La garantie d'une sécurité des aliments
irréprochable passe par la maîtrise de la qualité
hygiénique des aliments. Les techniques appropriées de
sécurité alimentaires et la manipulation des aliments doit
être pratiquée afin de protéger le consommateur contre les
conséquences graves. Les maladies d'origine alimentaire ont fait des
milliers de décès et d'hospitalisations (Yasuda,
2010).
1.3.2.1. L'origine de contamination et facteurs
favorisants
L'accident alimentaire d'origine biologique est le
résultat d'une contamination et dans le cas de bactéries, d'un
développement bactérien (Bornert, 2000). Nos
aliments proviennent de notre environnement immédiat, mais aussi, de
plus, de pays divers (importation). Nous exigeons que nos aliments soient sans
danger pour notre santé. Cependant, il arrive que ces aliments soient
contaminés en cours de production, de transformation, de transport et de
manipulation par des substances potentiellement dangereuses pour la
santé (Panisset et al., 2003). La
contamination des aliments est la première condition qui rend un produit
susceptible de rendre son consommateur malade. Cette condition est facilement
remplie car les sources de contamination sont omniprésentes
(Carbonel, 2007). On distingue 2 origines de contaminations
d'origines endogène et exogène :
Le tableau (1) suivant, illustre les contaminations d'origine
exogène qui ont lieu du stade de la production à celui de la
consommation.
5
Tableau 1: Les causes de contaminations
exogènes (Carbonel,2007).
|
Vecteurs
|
Modalités de transmission
|
Description et solutions proposées
|
|
L'homme
|
Vecteur passif ou transporteur (mains, peau)
|
L'homme est au centre de la contamination. C'est un vecteur
passif. Les vêtements qu'il porte, ses mains salies par des sources
bactériennes en font un transporteur de germes, présent à
chaque étape de la préparation.
|
|
Vecteur actif (individu infecté)
|
L'homme est aussi un vecteur actif. L'homme lui-même est
l'hôte de nombreux germes. C'est le cas lors de maladies respiratoires
(rhume, angine, sinusite à Staphylocoques et Streptocoques). Les
maladies respiratoires doivent être craintes parce que la transmission
par voie aérienne est facile. C'est aussi le cas de maladies de
l'appareil digestif. La méfiance doit être de rigueur pour les
personnes en bonne santé : elles peuvent être porteuses de germes
dangereux, notamment lorsqu'elles sortent d'une épisode de maladie.
|
|
Les animaux
|
Insectes
|
Les insectes (les mouches notamment) sont de très bons
vecteurs de Shigelles et Salmonelles.
|
|
Rongeurs
|
Les rongeurs (rats et souris) sont vecteurs de germes
pathogènes.
|
|
Animaux domestiques
|
Les animaux domestiques sont vecteurs de nombreux germes
pathogènes
|
|
Sol et terre
|
Légumes, chaussures
|
Le sol et la terre sont d'abord craints pour le
Clostridium botulinum mais peuvent être la source de contamination
par le Bacillus, moisissures et levures.
|
|
L'eau
|
|
Pseudomonas et autres germes Gram- se retrouvent souvent dans les
eaux potables. L'eau étant utilisée à la fois pour la
préparation des produits et pour le nettoyage, on veillera à
éviter de conserver de l'eau potable trop longtemps mais plutôt
favoriser le renouvellement de la source.
|
|
L'air
|
Poussières, vaporisation des liquides sales
(nettoyage), vaporisation des
liquides humains (éternuements,
mouchage)
|
Trois facteurs majeurs déterminent la microbiologie de
l'air ambiant : la densité de personnel, le type d'activité et la
circulation de l'air.
|
6
|
Vecteurs
|
Modalités de transmission
|
Description et solutions proposées
|
|
Vecteurs animés
|
|
|
|
Autres aliments
|
Contamination croisée
|
Les contaminations croisées sont des contaminations
entre des aliments différents. Ces contaminations offrent aux
bactéries de nouvelles conditions de développement et ce nouveau
milieu peut favoriser leur croissance. En particulier, il convient de
prévenir tout croisement entre les matières premières
vecteurs de microorganismes et les produits finis (cuits),
décontaminés. Une bonne manière de s'en protéger
est de respecter les principes de marche en avant et de toujours filmer les
aliments lors de leur stockage.
|
|
Déchets
|
|
Les déchets et sous-produits doivent être
enlevés dès que possible des zones de travail et être
conservés au frais avant leur enlèvement. Le principe de la
séparation des flux permet d'éviter l'entrecroisement de
déchets et des aliments
|
|
Surfaces
|
|
Les surfaces sont une donnée à prendre en compte au
plus tôt, dès la conception des bâtiments. Les surfaces du
sol et des murs ainsi que les surfaces de travail et les équipements
doivent être pris en compte : La présence de fissures et de
rugosités sont autant de nids bactériens.
|
|
Linge
|
|
Les tissus, de par leur structure, constituent un milieu
parfait pour les bactéries qui s'y installent. Pour éviter ce
problème, des tabliers jetables sont fournis en cuisine et le linge de
travail ne doit pas être utilisé en dehors de la zone de travail
Les torchons et autres tissus multi-usages sont proscrits. On veillera à
placer des torchons à base de papier et à usage unique.
|
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
7
Le développement des microorganismes : La contamination
seule suffit rarement à provoquer un accident sanitaire ou une
dégradation de la qualité organoleptique du produit.
Elle doit généralement être suivie d'une
phase de multiplication bactérienne qui dépend de plusieurs
facteurs (Leclerc, 2003) à savoir : facteurs
extrinsèques (température, durée de conservation) et
facteurs intrinsèques.
A. Facteurs extrinsèques
Température
La sensibilité des micro-organismes à la
température en fait un aspect clé de leur développement.
Quand à la température c'est un facteur sensible sur lequel le
professionnel peut facilement agir. Ce facteur est en effet très
utilisé pour réguler le développement des microorganismes
(Mcswane et al., 2000).
L'oxygène
Les réactions d'oxydoréduction règlent
le métabolisme des microorganismes. Dans ce contexte, l'oxygène a
un rôle prépondérant. Ce facteur concerne notamment les
conditionnements de 5ème gamme, sous vide d'air. Ces conditionnements
sont assez peu utilisés en restauration rapide, sauf pour les plats
préparés (Robert et al., 2003).
B. Facteurs intrinsèques
L'activité de l'eau
L'eau est essentielle à la survie et au
développement de tous les microorganismes. Dans les aliments, une partie
est dite « libre » c'est-à-dire qu'elle est disponible pour
les microorganismes. L'autre partie est liée aux constituants des
aliments et ne peut être utilisée..
Pour évaluer cette tolérance, on se
réfère à l'Aw, ou activité de l'eau. Dans
la majorité des produits sensibles (viande, lait, fruits,
légumes), l'Aw convient au développement
bactérien et n'apparaît donc pas comme un obstacle
(Vallerian, 1999).
Le potentiel d'oxydoréduction
Un faible potentiel d'oxydoréduction favorise le
développement de microorganismes.
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
8
La structure physique:
Le broyage ou le hachage des aliments augmente la surface de la
nourriture et brise les cellules.
La présence d'agents antimicrobiens naturels:
On trouve des agents antimicrobiens naturels dans plusieurs
aliments. Ceux-ci inhibent la croissance de certains micro-organismes. Par
exemple, les épices contiennent souvent ce genre d'agent (La sauge et le
romarin sont les deux épices les plus antimicrobiennes).
Le Ph
La majorité des bactéries se développe
dans des milieux dont le pH est compris entre 4,5 à 9. Pour ces
bactéries, le pH optimal est proche de la neutralité (entre 6,5
et 7,5). Clostridium ou Pseudomonas sont sensibles au pH.
Salmonelles, E.Coli, et les Staphylocoques y sont
peu sensibles.
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
9
Tableau 02 : pH de croissance de quelques
microorganismes (Carlier, 1983 ; Jay,
1992;
Buchanan.
et al, 1990).
|
Micro-organismes
|
Minimum
|
Optimum
|
Maximum
|
|
Moisissures
|
1,5 à 3,5
|
4,5 à 6,8
|
8,0 à 11,0
|
|
Levures
|
1,5 à 3,5
|
4,0 à 6,5
|
8,0 à 8,5
|
|
Bactéries
|
4,5
|
6,5 à 7,5
|
11,0
|
|
Bactéries acétiques
|
2,0
|
5,4 à 6,3
|
9,2
|
|
Bactéries lactiques
|
3,2
|
5,5 à 6,5
|
10,5
|
|
Lb. Plantarum
|
3,5
|
5,5 à 6,5
|
8
|
|
Lc. Cremoris
|
5,0
|
5,5 à 6,0
|
6,5
|
|
Lc. lactis
|
4,1 à 4,8
|
6,4
|
9,2
|
|
Lb. acidophilus
|
4,1 à 4,8
|
5,5 à 6,0
|
6,5
|
|
Pseudomonas
|
5,6
|
6,6 à 7,0
|
8,0
|
|
P. aeruginosa
|
4,4 à 4,5
|
6,6 à 7,0
|
8,0 à 9,0
|
|
Entérobactéries
|
5,6
|
6,5 à 7,5
|
9,0
|
|
S. typhi
|
4 à 4,5
|
6,5 à 7,2
|
8,0 à 9,6
|
|
E. coli
|
4,3
|
6,0 à 8,0
|
9,0
|
|
Staphylococcus
|
4,2
|
6,8 à 7,5
|
9,3
|
|
Clostridium
|
4,6 à 5,0
|
|
9,0
|
|
C. bolutinum
|
4,8
|
|
8,2
|
|
C. perfringens
|
5,5
|
6,0 à 7,6
|
8,5
|
|
C. sporogenes
|
5 à 5,8
|
6,0 à 7,6
|
8,5 à 9,0
|
|
Bacillus
|
5,6
|
6,8 à 7,5
|
9,4 à 10,0
|
|
L. monocytogenes
|
4,3 à 5
|
6,5 à 7,5
|
|
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
10
2. LA MICROBIOLOGIE DES PLATS CUISINES
Il s'agit de préparation culinaire comportant des
denrées animales ou d'origine animale, cuites ou précuites, dont
la consommation est différée soit dans le temps, soit dans
l'espace (Jorf, 1974).
2.1.L'activité des plats cuisinés
Les plats cuisinés visent la suppression de toutes les
opérations en amont de la cuisine préparation et la
réduction du délai de préparation au minimum grâce
au simple réchauffage de quelques minutes, au bain marie, four
micro-onde, plaques ou fours traditionnels, en évitant les odeurs. Ce
délai est nul pour les préparations consommées froides
comme les entrées, les sauces variées et la quasi-totalité
des desserts. Ils ont la qualité d'être facilement « juste
à temps » dans les repas à plusieurs grâce aux
portions multiples à partager qui facilitent la convivialité,
et/ou les « repas de famille », et d'offrir aux consommateurs une
immense variété de choix et donc un degré de
liberté élevé (Rozier et al.,
1980).
La figure suivante illustre le diagramme de fabrication dans le
cas de différents ragouts Boeuf, sauté de veau, couscous,
etc...
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
11
Figure 01 : Diagramme de fabrication de plats
cuisinés en ragoût (Corpet, 2005).
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
12
2.2.Présentation des plats cuisinés
Parmi les plats cuisinés, on distingue : les plats
à base de poisson ou de viande épicés et parfois
associés à des légumes.
De manière générale suivant leur
présentation, les plats cuisinés regroupent :
· Les plats cuisinés chauds : maintenir à
une température d'au moins 65°C depuis la cuisson jusqu'à la
consommation.
· Les plats cuisinés froids : refroidir
rapidement à une température de 10°C à coeur en moins
de 2 heures après la fin de la cuisson (Rozier et al,
1985).
· Les plats surgelés : traités par
abaissement rapide de température à - 40°C pour bloquer
l'activité microbienne, de longue conservation à -18°C. On
peut citer : légumes prêts à l'emploi, plats
cuisinés à base de poissons, de viandes, les sauces diverses, les
pâtes cuisinées surgelées... (Rozier et al,
1980).
Les plats cuisinés sont sujets à l'action des
microorganismes (Stephan, 2007). Ces microorganismes peuvent
être naturellement présents dans les denrées alimentaires
sans présenter aucun danger. En revanche, leur multiplication de
manière anormale à des concentrations ne garantissant plus
l'innocuité des denrées qui peut être occasionnée
par des facteurs environnementaux extérieurs : rupture de la
chaîne du chaud ou du froid, non-respect des règles
d'hygiène élémentaire, cuisson insuffisante, etc
(Gérin et al., 2003).
2.3.Technologie des plats cuisinés
Les plats cuisinés conservés par la chaleur
doivent être placés dès la fin de la cuisson dans des
récipients munis de couvercle et maintenus à des
températures supérieures à 65°C. Les plats
cuisinés conservés par le froid ; après préparation
et conditionnement, sont refroidis à 10°C en un délai
maximum de 2 heures, conditionnement y compris. Dès la fin du
refroidissement, le stockage se fait par la réfrigération
(O°C à 3°C) ou mise en congélation ou en
surgélation (inférieure ou égale à -18°C).
La fabrication des plats cuisinés à l'avance
constitue une longue chaîne de précautions. Elles ont
été définies par l'arrêté du 26 juillet 1974
de la réglementation française. Il est imposé aux
fabricants une obligation de moyens et une obligation de résultats
résumées comme suit.
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE

13
2.3.1. Obligation de moyens hygiéniques
Les locaux seront disposés de telle sorte qu'on puisse
respecter les principes de la marche en avant, de la séparation nette
des secteurs sains (propres) et des secteurs souillés (règle des
5 S). La construction des murs, des sols, des plafonds fera appel à des
matériaux résistants à l'usage et faciles à
nettoyer et à désinfecter. L'usage de l'outil est d'une
très grande importance, car aussi bien conçus que soient les
installations, les matériels, la qualité hygiénique
dépendra (Diouf, 1992).
2.3.2. Obligation de résultats
hygiéniques
Les plats cuisinés à l'avance doivent
présenter, jusqu'à leur consommation, des caractéristiques
microbiologiques précises qui sont définis par
l'arrêté du 21 décembre 1979, relatif aux critères
microbiologiques auxquels doivent satisfaire certaines denrées
alimentaires d'origine animale (Diouf, 1992).
Figure 02 : numération aérobie
mésophile signification dans les aliments cuites prêts à
consommer (Pascal et al., 2009).

CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
14
Figure 03 : distribution des résultats d'une
surveillance bactériologique (Pascal et al.,
2009).
2.4.Surfaces de contact des plats cuisinés et les
ustensiles
Les biofilms microbiens qui restent sur les surfaces
après le nettoyage ont une grande préoccupation dans l'industrie
agro-alimentaire (Zottola et Sasahara, 1994). Des
méthodes de mesure de l'efficacité du nettoyage de
l'environnement de production sont nécessaires dans les locaux de
fabrication d'aliments à haut risque. Des plaques de gélose de
contact peuvent être utilisé pour le contrôle de
l'hygiène (NCFA, 1987 ; Tebbut 1991). Des commerciaux
plaques de gélose de contact sont également utiles pour le
contrôle de l'hygiène des locaux alimentaires (Rahkio et
Korkeala, 1997). Ils sont principalement utilisés pour les
bactéries indicatrices de surveillance. Pour les micro-organismes
spécifiques, tels que Listeria et Salmonella, des
milieux d'enrichissement sélectif doivent être choisis. La
méthode de mesure de la bioluminescence adénosine-5'-triphosphate
(ATP) donne des résultats en quelques minutes, ce qui rend ce
système très approprié pour le suivi en ligne dans les
programmes 0HACCP (Poulis et al. 1993, Vanne et al.
1996, De Boer et Beumer 1999). Cependant, l'ATP mesurée ne
proviennent pas de bactéries seulement, mais le total ATP à
partir de toute matière organique à la surface. Une occasion
importante pour l'avenir peut être la mise à disposition de la
spécificité des agents pathogènes aux essais ATP
(Stewart, 1997).
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
15
2.5.Applications à la sécurité des
aliments
La sécurité des aliments est un défi qui
demande des efforts quotidiens aux professionnels. Pour ce faire, ils mettent
en application les enseignements sur le développement bactérien.
En restauration collectif, les facteurs à maîtriser se rassemblent
dans les "5 M": le Milieu (les locaux), le Matériel, la Main-d'oeuvre,
la Matière (matières premières, produits finis) et les
Méthodes (règles de fonctionnement) selon un raccourci
mnémotechnique classique. Ces cinq facteurs sont liés entre eux,
à l'image des « maillons d'une chaîne » au sein de
laquelle la faiblesse d'un élément n'est pas compensée par
le renforcement d'un autre. Cette notion illustre la nécessité de
la cohérence de la prestation (Corpet D, 2005). La
sécurité au long de la chaîne de production alimentaire
(transformation, stockage et préparation) est d'une grande importance
pour le maintien de la qualité hygiénique des aliments
préparés et servis aux restaurants collectives (Bobhate P
et al., 2011).
3. L'HYGIENE ET LA SECURITE ALIMENTAIRE DANS LES
RESTAURATIONS COLLECTIVES
3.1.Conception générale
La qualité hygiénique est très
dépendante de l'entretien des locaux et du matériel ainsi que de
la conception des locaux et de l'organisation de la production.
3.1.1. Principes généraux de
l'hygiène dans les industries agro-alimentaires
La conception des locaux, et particulièrement de la
zone de production, doit intégrer les préoccupations de
sécurité des aliments au cahier des charges. Quatre grands
principes viennent régir l'organisation de la cuisine (Corpet,
2005).
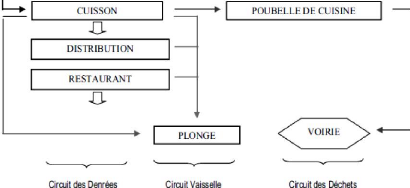
3.1.1.1.principe de « la marche avant »
Depuis l'entrée dans les locaux jusqu'au départ
vers le lieu de consommation, les denrées doivent progresser selon le
principe de la "marche en avant", c'est-à-dire sans jamais effectuer de
retour en arrière. Ce principe vise à prévenir des
contaminations croisées : contaminations entre produits "propres" ou
sensibles (produits cuits, assainis, prêts à consommer) et
produits "sales" (produits bruts, matières premières non
préparées) (Arnaud-thuillier et Libert,
1991).
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE

16
Figure 04. Procédure de la marche en avant
(Cosson et al., 2003).
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
17
3.1.1.2. La séparation des secteurs
En fonction du degré de contamination des produits qui
y circulent, les différents locaux d'une cuisine de préparation
peuvent être séparés schématiquement en plusieurs
secteurs. Le « secteur souillé » comprend les zones de
stockage (chambres froides et réserves) et de livraison, et les locales
poubelles. Le secteur sain correspond dans la restauration à la zone
d'assemblage de l'offre ou « laboratoire ». Cette zone est la
dernière étape avant le service. Enfin, on distingue parfois des
zones tampons (plonge, légumerie) qui permettent de réaliser la
transition des matières entre une zone saine et une zone souillée
(Namkoisse, 1990).
3.1.1.3. Non-entrecroisement des courants de
circulation
Le circuit sale représenté par exemple par le
transport des matières premières brutes, des déchets de
toute nature (poubelles, emballages...) (Diabate, 1991). Ceci
est valable tant pour le personnel principal vecteur de germes que pour les
denrées, les produits finis (plats cuisinés ou denrées
prêtes à la consommation). La circulation doit se faire dans un
sens. Selon les possibilités matérielles et financières,
les quatre derniers principes sont recommandés (Ndiaye,
1992).
3.1.1.4. Aménagement rationnel
Les espaces doivent être aménagés de
manière rationnelle avec des formes faciles à nettoyer, une pente
du sol supérieure à un pour cent et l'absence d'angles vifs. Les
dimensions doivent être suffisamment grandes pour permettre le travail et
laisser des espaces autour de chaque machine. Les matériaux doivent
pouvoir être lavés facilement et la circulation de l'air doit
être maîtrisée avec un renouvellement de l'air
intérieur et une filtration de l'air extérieur (Carbonel,
2007).
3.1.1.5. Utilisation précoce et
généralisée du froid et de la chaleur
Des contaminations souvent faibles sont inévitables
durant la fabrication. D'où la nécessité d'agir tôt,
pour éviter le développement rapide de ces contaminations, par le
froid ou par la chaleur (Roudaut et Lefrancq,
2005).
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
18
Le froid sera utilisé précocement et de
façon continue de la production jusqu'à la consommation. La
chaleur, précocement appliquée sur les produits paucimicrobiens,
donnera de meilleurs résultats (Rosset et
Beaufort, 1983).
3.1.1.6. Ordre, nettoyage et désinfection
appropriés
Le nettoyage et la désinfection de façon
régulière, systématique et efficace dans des locaux
où règne un ordre méticuleux s'avèrent
nécessaires (Ndiaye, 1992).
3.1.1.7. Personnel compétant
Ceci devait être une exigence car le manipulateur se
révèle être aujourd'hui l'élément principal,
ou l'une des principales sources de contamination des aliments, soit
directement comme vecteur actif ou indirectement comme vecteur inactif
(Corpet, 2005). Le rôle du personnel est
déterminant dans la maîtrise de la sécurité des
aliments. Ses qualifications, sa sensibilisation aux aspects liés
à l'hygiène et son état de santé sont des
éléments fondamentaux. De ce fait, la formation professionnelle
est une nécessité absolue et réglementaire.
La surveillance médicale est le second pivot de la
maîtrise du risque alimentaire par le personnel, susceptible d'être
excréteur de micro-organismes potentiellement responsables de
toxi-infections alimentaires collectives (Gartner et
Durrèche, 2001).
3.1.2. Principe de construction
L'implantation des locaux sera choisie en fonction des
agglomérations et des sources de pollutions, autant celles provenant de
l'établissement et perturbant l'environnement que celles pouvant y
pénétrer. Cet établissement doit être facile
d'accès pour les voitures (GBPH, 1999).
Dans les locaux il ne doit pas avoir de tuyaux
d'évacuation des eaux usées ou pluviales ou aboutissant à
des fosses d'aisance, Les locaux, dans leur disposition, doivent permettre le
respect du principe des 5S et de celui de la marche en avant tout en ayant des
dimensions suffisantes (Corpet, 2005).
Les matériaux choisis seront imputrescibles, isolants,
résistants et facilement lavables. Le sol, les murs et cloisons seront
revêtus, sur une hauteur d'au moins deux mètres, de
matériaux durs, résistants aux chocs, imperméables,
imputrescibles, d'entretien facile.
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
19
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
Le sol aura une pente suffisante pour permettre
l'écoulement des eaux vers un siphon grillagé anti-odeurs et
anti-rongeurs.
Entre le sol et les murs et les murs entre eux, les gorges
seront arrondies pour faciliter l'entretien. Pour le travail, il faudra un
éclairage artificiel adéquat et ne modifiant pas les couleurs.
L'apport de lumière naturelle doit être maximal. L'aération
et la ventilation devront être adéquates pour permettre
l'évacuation rapide des odeurs, fumées, vapeurs ou
buées.
La climatisation devra être à une
température compatible avec le travail. Les locaux recevront une
fourniture d'eau potable froide et chaude sous pression, et d'énergie,
adaptée à chaque activité. L'eau froide doit avoir un
débit de 61/S environ et l'eau chaude un débit de l'ordre de 31/S
(Rosset et al., 1983) .
Les portes des accès extérieurs seront soit
à fermeture automatique, soit en plastique souple. Les tuyauteries
seront calorifugées (Rosset et al., 1983).
3.2. Différents types de locaux
Ils seront orientés de façon à ce que les
denrées ne soient pas exposées au soleil. Ils prendront
l'orientation Nord ou Nord-Est.
3.2.1. Locaux techniques 3.2.1.1. Magasins
Le stockage prolongé des denrées doit être
prévenu par une bonne rotation en faisant sortir en premier lieu, les
plus anciennes.
Les produits alimentaires ne doivent jamais être
entreposés sur le sol ou mélangés avec des produits non
alimentaires.
Il est nécessaire que ces locaux possèdent un
système de lutte contre la poussière et les nuisibles
(Rosset et al., 1983).
3.2.1.2. Locaux de préparation
Les locaux et les annexes doivent être de dimensions
suffisantes afin que les activités professionnelles puissent s'y exercer
dans des conditions d'hygiène convenables. Les locaux et les postes de
travail doivent être disposés de façon à
réaliser une progression continue des différentes
opérations.
20
Les locaux et les annexes ne doivent pas communiquer
directement avec les vestiaires, les cabinets d'aisance ou les salles d'eau.
Ils doivent avoir de l'eau chaude à au moins + 65°C.
Les locaux ou les emplacements particuliers doivent être
réservés pour l'entreposage des emballages et le
conditionnements, et pour le dépôt momentané des
récipients contenant des déchets (france,
1974).
3.2.1.3. Locaux pour poubelles
La prévention des contaminations nécessite une
bonne organisation du travail, afin de limiter et de gérer les
allées et les venues du personnel dans le local des déchets.
L'évacuation de ces derniers doit se faire en dehors de la
période de préparation des plats en cuisine et avant la
désinfection des locaux. La formation du personnel doit insister sur la
nécessité de respecter un sens de circulation afin
d'éviter la contamination de secteurs propres après le passage
dans des secteurs souillés (Dajon , 2004).
3.2.1.4.Locaux administratifs
Ce local administratif, lorsqu'il existe, s'avère
souvent de faible superficie, plus ou moins bien éclairé et
ventilé. Il contient un bureau parfois équipé d'un
ordinateur et de son écran. On pourra demander à consulter
certains documents volontiers archivés à cet endroit : plan de
nettoyage, d'échantillonnages, résultats bactériologiques,
fiches de données de sécurité etc... (Courthiat
et al., 1996).
3.2.2. Réfectoire
Un local clair, aéré et chauffé est mis
à disposition du personnel pour qu'il puisse prendre ses repas. Il est
muni d'appareils permettant de réfrigérer les aliments et de les
réchauffer et de produire l'eau chaude nécessaire au nettoyage de
la vaisselle (Godefroy, 1985).
3.2.2.1.Cabinets d'aisances
Il convient de mettre à disposition du personnel, les
moyens d'assurer la propreté individuelle avec des postes d'eau potable,
des lavabos, des toilettes, des vestiaires et des armoires individuelles. Dans
les établissements occupant un personnel mixte, des installations
nettement séparées doivent être prévues pour le
personnel masculin et le personnel féminin (Dajon,
2004).
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
21
3.2.2.2.Vestiaires
Les établissements doivent posséder des locaux
aménagés en vestiaires. Suffisamment spacieux, ils sont
réservés à l'usage du personnel et conçus de
manière à éviter la contamination des vêtements de
travail. Les armoires doivent être individuelles, fermant à
clés, munies d'une tablette pour la coiffure, d'une tringle porte-cintre
et à double compartiment avec deux patères séparant
vêtements de ville et de travail. Les effets personnels et les
vêtements ne doivent pas être laissés dans les zones de
manipulation des aliments (Aubaille et al.,
1992)..
3.3. Hygiène des locaux
3.3.1. Entretien physique
Les locaux doivent être en bon état : les
fissures et trous dans le mur et le sol, les carrelages défaits, le sol
glissant et les peintures écaillées doivent être
absents.
3.3.2. Entretien hygiénique
Le nettoyage et la désinfection seront réguliers et
systématiques.
Le balayage à sec doit être interdit. Les
déchets, rebuts et détritus de toutes sortes seront
déposés aussi tôt dans des récipients
étanches munis de couvercles, vidés et nettoyés au moins
une fois par jour (Sommar, 1992). Les extincteurs
installés dans ces locaux seront autant que possible à base de
produits neutres sans danger sur le plan alimentaire (Sommar,
1992).
3.3.3. Lutte contre les nuisibles
Ces nuisibles sont les carnivores domestiques, les oiseaux,
les rongeurs, les insectes, à l'origine de contaminations microbiennes
mais aussi d'autres types de déprédations.
Pour combattre les rongeurs dans les locaux, il faudra une
hygiène et une climatisation, les raticides à base
d'anticoagulant pour les rongeurs et les insecticides à base de
pyrétbrinoides pour les insectes (Bell, 2003).
3.4. Equipement
L'entretien des machines et des équipements peut
nécessiter des vérifications périodiques. Ainsi les
installations de ventilation doivent être vérifiées
annuellement. Les conduits d'évacuation
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
22
dans les cuisines doivent être entretenus
régulièrement et ramonés au moins une fois par trimestre.
Le circuit d'extraction d'air, de buées et de graisse doit être
nettoyé au moins une fois par an. Les filtres amovibles sont
nettoyés aussi souvent qu'il est nécessaire et au minimum une
fois par semaine (Dajon, 2004).
3.4.1. Machines et appareils
Les machines et outils de travail devront être
constitués de matériaux autorisés pour les usages
alimentaires. Une facilité de démontage des pièces mobiles
permettra un nettoyage et une désinfection aisée en tout endroit
(Namkoisse, 1990).
3.4.2. Entretien des équipements
La propreté est de rigueur. Il faut assurer constamment
le démontage et le nettoyage, des filtres d'aspiration de buées
et de fumées des hottes (Alassane, 1998).
3.4.3. Petit Matériel
Il s'agit des tranchoirs, des couteaux, des hachoirs, des
crochets à viande et des louches. Après chaque utilisation ce
matériel doit être démonté éventuellement et
trempé dans une solution détergente pendant quelques instants
puis brossé et rincé. Il sera ensuite entreposé dans un
lieu propre à l'abri des souillures et des poussières
(Drieux, 1978).
Ce matériel doit être bien entretenu et
remplacé dès qu'il ne satisfait plus aux règles
d'hygiène (Rosset R et al., 1983).
3.5. Nettoyage et Désinfection
Maintenir la propreté dans l'établissement de
travail est un objectif sanitaire et de service : il est important pour avoir
une sensation de propreté. Cette propreté est une condition de
base pour la maîtrise de la sécurité des aliments. Au
même titre que l'organisation de la cuisine et de la production,
l'organisation du plan de nettoyage est une étape de base dans la
démarche de création d'une enseigne (Merouze et
Tondusson, 1997).
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
23
3.5.1. Nettoyage
Le nettoyage est une opération d'élimination des
salissures (particulières, biologiques, liquides, etc.) à l'aide
d'un procédé faisant appel, dans des proportions variables, aux
facteurs suivants : action physico-chimique (détergence), action
chimique (par exemple action des enzymes), action mécanique (jets,
brosses), temps d'action et températures (Isoard,
1988).
On admet généralement que le nettoyage
résulte de quatre mécanismes, seules ou combinés,
contribuant à séparer la souillure de la surface et à la
disperser dans le détergent (BellonFontaine et Cerf, 1988)
:
1. Solubilisation: Les substances
contaminantes sont absorbées par le liquide de nettoyage et s'y
dissolvent ;
2. Emulsification: Les molécules
tensioactives du détergent s'adsorbent à la surface des produits
contaminants et abaissent leur tension superficielle. Le film encrassant se
rétracte sur lui-même et les gouttelettes formées sont
entraînées dans la solution ;
3. Micellisation: Les molécules
tensioactives forment des micelles hydrophiles à l'extérieur et
hydrophobes à l'intérieur. Les molécules hydrophobes des
substances contaminantes forment des gouttelettes qui sont emprisonnées
dans les micelles et sont entraînées avec elles ;
4. Action mécanique : L'énergie
cinétique du liquide de nettoyage contribue à l'arrachement
d'agrégats de substances contaminantes.
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
24
Tableau 03 : Choix de l'agent nettoyant (Hyginov,
1995)
|
Composants de la
souillure
|
Agent nettoyant
|
|
Sucres solubles
|
Famille
|
Exemples d'agents
|
Caractéristiques
|
|
Alcalins
|
Soude
Potasse
|
· Solubilisant
· Saponifiant
|
Autres glucides
|
Alcalins
|
|
· Solubilisant
· Saponifiant
|
|
|
· Hydrolysant
· Désagrégeant
|
Protéines
|
Alcalins
|
Soude
Potasse
|
· Solubilisant
· Saponifiant
|
|
Lipases
|
· Hydrolysant
· Désagrégeant
|
Matières grasses
|
Tensioactifs
|
· Anioniques
· Cationiques
· Non ioniques
|
· Mouillant
· Emulsifiant
|
|
Lipases
|
· Hydrolysant
· Désagrégeant
|
Minéraux
|
Acides
|
· Chlorhydrique
· Nitrique
· Phosphorique
|
· Solubilisant
|
|
Séquestrants (Chélatants)
|
· EDTA
· Polyphosphates
· Gluconate
|
· Séquestrant
|
Tartre Eonologique
|
Alcalins
|
Soude
|
· Solubilisant
|
|
3.5.2. Agents de nettoyage
Les produits de nettoyage sont le plus souvent
formulés avec plusieurs principes actifs, généralement un
composé alcalin ou acide agissant respectivement sur les souillures
organiques et les dépôts minéraux, des agents tensioactifs
responsables de l'action détergente, des
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
séquestrants et des chélatants, des
anti-moussants et enfin des inhibiteurs de corrosion (BellonFontaine
& Cerf, 1988).
Au stade expérimental, quelques substances sont
connues pour améliorer le détachement des biofilms. C'est le cas
de l'EDTA et de l'EGTA qui chélatent les cations et en particulier le
calcium dont le rôle dans la cohésion du biofilm a
été démontré (Turakhia & Characklis,
1989). Les enzymes protéolytiques et glycolytiques peuvent
aussi partiellement détacher les biofilms (Wiatr,
1991).
Le choix d'un détergent dépend des
paramètres liés à son utilisation, à savoir, la
nature de la souillure, le support, la qualité de l'eau, la
température de nettoyage et l'action mécanique et/ou le
procédé de nettoyage (Vasseur, 1999) (Tab.
4).
3.5.3. Désinfection
La norme NF T 72-101 (Afnor, 1981)
définit le terme de désinfection comme une
opération, au résultat momentané, permettant
d'éliminer ou de tuer les micro-organismes et/ou d'inactiver les virus
indésirables portés par des milieux inertes contaminés, en
fonction des objectifs fixés.
25
*
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
26
Tableau 04 : Liste des produits chimiques
autorisés en désinfection (Maris, 1995).
Famille chimique
|
|
Exemples (s)
|
|
Mode d'action
|
Produits cholorés Dérivés
iodés
|
·
|
Hypochlorites alcalins
|
·
|
Dénaturation des protéines
|
|
Chlorure d'iode
|
·
·
|
Halogénation des composés soufrés des
protéines
Blocage de la chaine respiratoire
|
Oxydants Aldéhydes
|
?
|
Peroxyde d'hydrogène
|
·
|
Oxydation non sélective des
constituants organique
|
|
Formaldéhyde
|
·
·
|
Dénaturation des protéines par
formation de points méthylène Alkylation des
acides nucléiques
|
|
Glutaraldéhyde
|
·
|
Les groupements aldéhydes interférent avec les
groupements aminés des
cellules microbiennes
|
Ammoniums Quaternaires Amphotères
Biguanidine
|
·
|
Chlorure de
benzalkonium
|
·
|
Le cation réagit avec les groupements
ioniques des acides aminés et entraine des
perturbations stérique
|
|
Amines grasse
|
·
|
Antagonistes des acides aminés
|
|
Autres
|
·
|
Lésions membranaires et fuite du
matériel cellulaire
|
Acide peracétique Composés
phénolique
|
·
|
|
·
|
Oxydation des protéines et lipides des
micro-organismes
|
|
Hexachlorophenol
|
·
|
Inactivation des enzymes
transmembranaires
|
Ozone
|
|
|
·
|
Oxydation
|
|
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
27
Tableau 05 : Spectre d'activité des
principaux désinfectants (Isoard, 1988)
Désinfectants
|
Bactéries
|
Mycobactér ies
|
Spores
|
Moisissures
|
Levures
|
Virus phages
|
|
G(+)
|
|
+++
|
+++
|
|
++
|
++
|
++
|
++
|
Alcools
|
++
|
++
|
|
0
|
++
|
++
|
+
|
Alcool à70°
|
++
|
++
|
0
|
+
|
+
|
++
|
+
|
Aldéhydes : Glutaraldéhyde
|
+++
|
+++
|
++
|
+
|
+++
|
++
|
++
|
Ammoniums quaternaires
|
+++
|
+*
|
0
|
0
|
+
|
+
|
+
|
Ampholères
|
+++
|
+
|
|
0
|
+
|
+
|
0
|
Biguanidine
|
++
|
++
|
|
0
|
(+)
|
(+)
|
0
|
Chloroexidine
|
+++
|
++
|
+
|
0
|
+
|
+
|
0
|
Chlore
|
+++
|
+++
|
++
|
++
|
++
|
++
|
++
|
Dérivés mercuriels
|
++
|
++
|
0
|
0
|
+
|
+
|
|
Dérivés phénoliques
|
Activité variable selon le composé
|
Eau oxygénée
|
+++
|
+++
|
|
+
|
+
|
+
|
0
|
Iode
|
+++
|
+++
|
++
|
++
|
++
|
++
|
++
|
|
* : Inactif sur pseudomonas sp. 0 : Activité
nulle (+) : Activité inconstante
+ : Activité moyenne ++ : Bonne activité +++ :
Très bonne activité
3.5.4. Agents de désinfection
Il existe à l'heure actuelle de nombreux agents de
désinfection tant chimiques (Tab 5) Que physiques :
Les agents chimiques : Classés en six grands groupes
(les halogènes, les oxydes et peroxydes, les aldéhydes, les
agents tensioactifs, les acides et bases et les alcools) (Annexe 2), ils sont
souvent inadaptés en tant que désinfectants, car ils agissent
trop lentement ou ne développent qu'une action inhibitrice
(Vasseur, 1999). Le choix du désinfectant dépend
principalement de son spectre d'activité (Tableau 5), alors que
l'efficacité de la désinfection est conditionnée par la
concentration du produit, le mode d'application, la température et le
temps d'application.
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
28
3.5.5. Mécanismes de la désinfection
L'inactivation des micro-organismes résulte de
dénaturation, de lyse, d'altération, etc. d'un ou plusieurs
éléments vitaux de la cellule tels la membrane, la paroi, le
chromosome, les plasmides, les enzymes, etc. (Briandet, 1999).
Dans le cas de la désinfection chimique, la première
étape des interactions entre le désinfectant et la cellule
bactérienne consiste en la fixation du produit sur la capsule ou la
paroi cellulaire de celle-ci et au franchissement de ces enveloppes. On assiste
alors ensuite, soit à une altération de la membrane cytoplasmique
qui assure les fonctions essentielles à la vie des bactéries
(production d'énergie, transport actif des nutriments, etc.), soit
à une atteinte des constituants intracellulaires, telles que les
protéines de structure; phénomène qui provoque une
désorganisation du métabolisme, une fuite des substances, la
dégénérescence de la cellule et finalement sa mort
(Pieto & Bardoneschi, 1990). Notons en outre que les
cibles sont variables selon le groupe auquel appartient le désinfectant
(Molinier, 1985).
3.5.6. Protocole de nettoyage et de
désinfection
Les procédures de nettoyage et de désinfection
doivent être précisées car chaque surface et chaque
matériel présentent des caractéristiques
particulières. Il s'agit à la fois d'assurer une bonne
opération de nettoyage et de prévenir toute dégradation du
matériel.
29
CHAPITRE I
Tableau 06: Description des différentes
techniques d'entretien (Hyginov, 1995)
|
Définition
|
Objectifs
|
Matériel
|
Matériel Pratique
|
Essuyage humide
|
Opération de
récupération
des salissures
non
adhérentes
sur les surfaces autres
que les sols
|
· Eliminer les
salissures.
· Limiter leur mise en suspension dans
l'atmosphère.
|
· Chiffonnette
réutilisable (si possible en microfibre) ou à
UU.
.
|
· Plier la chiffonnette en 6 parties (6 faces de
nettoyage).
· Essuyer en 1 seul passage (du
haut vers le bas, du
propre le sale.
· Déplier au fur et à mesure
la
chiffonnette.
· Changer la chiffonnette aussi
souvent que
nécessaire.
|
Balayage humide
|
Opération de
récupération
des salissures non
adhérentes sur les sols
secs et lissés
|
· Eliminer jusqu'à
90 % des salissures.
· Limiter leur mise
en suspension dans
l'atmosphère.
|
· Balai.
· Gaze pré imprégnée à
UU ou bandeau
réutilisable.
· Solution d, d/D sols ou
surfaces hautes.
|
· Poser la gaze sur le sol.
· Placer le balai dessus, « la clipper ».
· Ne jamais soulever le balai.
· Changer la gaze aussi souvent que nécessaire.
· Travailler selon les méthodes dites :
· « au poussé » utilisée pour les
couloirs,
· Ou à la « godille » utilisée pour
les chambres.
1- Détourage.
2- Commencer au fond de la pièce et revenir sur le seuil
de la porte.
|
|
|
Lavage à plat
|
Action chimique et Mécanique permettant
d'éliminer les
salissures adhérentes
sur les sols.
|
· Obtenir une
propreté visuelle
(détergent)
· Obtenir une
propreté bactériologique
en réduisant le
nombre de micro organismes
présents sur le sol
(d/D) ou les
surfaces hautes.
|
· Balai,
· Frange ou bandeau pour semelle de lavage à plat de
préférence et si possible en microfibre.
|
· Poser le bandeau ou frange sur le sol.
· Placer le balai dessus.
· « clipper ».
· Ne jamais soulever le balai.
· Travailler selon les méthodes dites :
« au poussé » utilisée pour les
couloirs,
Ou à la « godille »
utilisée pour les
chambres (idem
cidessus).
|
* d : détergent., ** d/D :
détergent/Désinfectant.
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
30
3.6. Personnel
Le personnel doit être considéré comme le
moteur même de cette machine d'hygiène (Chouman et
al., 2010). Sans un comportement hygiénique de sa part, il
ne peut vraiment pas y avoir de salubrité. Les locaux, le
matériel, et les denrées sont beau être propres, l'homme
demeure pour eux le principal facteur de contamination et de
dissémination des microbes.
Aussi, son hygiène doit-elle être rigoureusement
surveillée (Udgiri et Masali,
2007).
3.6.1. Etat de santé
L'état de santé des employés est un
élément clé de la sécurité des aliments
(Zeru K et al., 2007). Un employé malade ou
présentant une blessure peut transmettre des germes infectieux. Toute
personne malade doit porter un masque lors de la préparation des
produits et toute blessure des mains et des bras doit être
protégée par un pansement. Par ailleurs, il est important de
rester vigilant après un épisode de maladie, un individu pouvant
se révéler porteur sain de germes infectieux (Mcswane
et Kumie, 2000).
3.6.2. Hygiène corporelle
Elle comprend la toilette du corps, de la chevelure de
façon régulière et la toilette fréquente des mains
avant chaque reprise de travail et après chaque contact avec une surface
ou un objet sale. En particulier à la sortie des cabinets d'aisance,
après s'être mouché ou avoir gratté une plaie,
effectué des manipulations dans le local des poubelles, le personnel
doit se laver les mains avec une solution antiseptique (Çekal,
2008).
Pour un nettoyage plus efficace des mains, il faudrait avoir des
ongles courts, bien les brosser et d'interdire le port de bijoux (bagues,
bracelets) pendant le travail (Billon, 1987).
3.6.3. Propreté vestimentaire
Les vêtements sont un vecteur actif de contamination des
produits dans la chaîne de production. Les vêtements de ville
transportent en effet des microorganismes humains et telluriques. Afin
d'éviter une contamination par des agents pathogènes
apportés de l'extérieur par le personnel, il est obligatoire que
le personnel change ses vêtements de ville contre une tenue de travail au
vestiaire dès l'entrée sur le lieu de travail. Les chaussures
doivent être propres et fermées. Les
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
31
opérations salissantes (préparation des salades
et denrées « telluriques ») nécessitent le port d'un
tablier. Enfin, le linge doit être de nature à éviter
l'ancrage de microorganismes (éviter plis, boutons et utilisation de
coton et polyester). Les cheveux doivent être propres, attachés et
recouverts par un calot changé à chaque service (Cekal,
2008).
3.6.4. Formation professionnelle
La formation du personnel aux règles de
l'hygiène est essentielle et doit comporter un enseignement
adapté aux auditeurs car un règlement, même strictement
suivi, perd beaucoup d'efficacité quand il n'est pas compris la plupart
des gestes dangereux étant commis par ignorance ou par négligence
(Cekal, 2008).
3.7.Denrées alimentaires
On ne doit accepter aucun produit contaminé, ou
supposé tel, par des parasites le rendant impropre à la
consommation humaine (Zeru K et Kumie, 2007).
Les matières premières et ingrédients
entreposés doivent être conservés dans des conditions
adéquates. Ces conditions ont pour objet, d'une part, d'éviter
toute détérioration néfaste et d'autre part, de
protéger les denrées contre toute contamination susceptible de
les rendre impropres à la consommation humaine (Zeru K et Kumie,
2007).
Il est impératif de lutter contre les organismes
nuisibles et d'empêcher que les animaux domestiques aient accès
aux endroits de stockage ou de préparation (Ferreira,
2006).
On ne doit pas conserver de produits à des
températures qui pourraient entraîner un risque pour la
santé. La chaîne du froid (maintien entre 0 et 4°C) ne doit
en aucun cas être interrompue. On peut toutefois soustraire ces produits
du froid pour une courte durée à des fins pratiques
(Ferreira, 2006).. Les exploitants doivent disposer de locaux
adaptés, suffisamment vastes pour l'entreposage séparé des
matières premières, comme des produits transformés, et
disposer d'un espace d'entreposage réfrigéré suffisant
(Sommar, 1992).
Le respect de la chaîne du chaud s'impose : un aliment
doit être rapidement monté en température supérieure
à 63°C et y être maintenu.
La descente thermique doit être la plus rapide possible
pour atteindre la température de conservation à froid
(3°C).
Les denrées alimentaires conservées ou servies
à basse température doivent être
réfrigérées dès que possible après le stade
de traitement thermique ou, en l'absence d'un tel traitement, après
le
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
32
dernier stade de l'élaboration, à une
température n'entraînant pas de risque pour la santé
(Delaunay, 2011).
La décongélation des denrées alimentaires
doit être effectuée de manière à réduire le
risque de développement de micro-organismes pathogènes ou la
formation de toxines. Pendant la décongélation, les
denrées alimentaires sont soumises à des températures qui
n'entraînent pas de risque pour la santé : la
décongélation à l'air ambiant est prohibée. Tout
liquide résultant de la décongélation susceptible de
présenter un risque pour la santé est évacué d'une
manière appropriée.
Les substances dangereuses et/ou non comestibles, y compris
les aliments pour animaux, doivent faire l'objet d'un étiquetage
approprié et être entreposées dans des conteneurs
sûrs et séparés (Delaunay, 2011)
Tableau 07 : Températures maximales des
denrées congelées (Delaunay, 2011).
|
NATURE DES DENRÉES
|
TEMPÉRATURE de
conservation au stade
de
l'entreposage ou du transport
|
TEMPÉRATURE de conservation dans les
établissements de remise directe ou de restauration
collective
|
|
Glaces, crèmes glacées
|
- 18 °C
|
- 18 °C
|
|
Viandes hachées et préparations de viandes
congelées
|
- 18 ° C
|
- 18 °C
|
|
Produits de la pêche congelés
|
- 18 ° C
|
- 18 °C
|
|
Poissons entiers congelés en saumure destinés
à la fabrication de conserves
|
- 9° C
|
- 9 °C
|
|
Autres denrées alimentaires congelées
|
- 12 °C
|
- 12 °C
|
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
33
Tableau 08 : Températures maximales des
denrées réfrigérées (Delaunay,
2011).
|
NATURE DES DENRÉES
|
TEMPÉRATURE de
conservation au stade
de
l'entreposage ou du
transport
|
TEMPÉRATURE de conservation dans
les
établissements de remise directe ou de
restauration
collective
|
|
Viandes hachées
|
+ 2° C viande hachée +
4°
préparation viande
|
+ 2 °C
|
|
Abats d'ongulés (d'élevage ou sauvage)
|
+ 3°C
|
+ 3 °C
|
|
Préparations de viandes
|
+ 4 °C
|
+ 4 °C
|
|
Viandes séparées mécaniquement
|
+ 2 °C
|
+ 2 °C
|
|
Viandes de volailles (y compris petit
gibier d'élevage à plumes), de
lagomorphes (y compris petit gibier
d'élevage
à poils), de ratites et de petit gibier sauvage
|
+ 4 ° C
|
+ 4 °C
|
|
Viandes d'ongulés domestiques, viandes de gibier
ongulé (d'élevage ou sauvage)
|
+ 3° C
|
+ 7 °C pour les carcasses entières et pièces
de gros + 4 °C pour les morceaux de découpe
|
|
Produits de la pêche frais, produits de la pêche
non transformés décongelés, produits de crustacés
et de mollusques cuits et réfrigérés
|
Température de la glace
fondante : 0 à + 2 °C.
|
+ 2 °C
|
|
Produits de la pêche frais conditionnés
|
Température de la glace
fondante : 0 à + 2 °C.
|
Température de la glace fondante 0 à + 2
°C
|
|
Ovoproduits à l'exception des produits UHT.
|
+ 4 °C
|
+ 4 °C
|
|
Lait cru destiner à la consommation
|
+ 4 °C
|
+ 4 °C
|
|
Lait pasteurisé
|
Température définie sous la responsabilité
du fabricant ou du conditionneur
|
Température définie sous la
responsabilité
du fabricant ou du conditionneur
|
|
Fromages affinés
|
Température définie sous la responsabilité
du fabricant ou du conditionneur
|
Température définie sous la
responsabilité
du fabricant ou du conditionneur
|
|
Autres denrées alimentaires très
périssables
|
Température définie sous la responsabilité
du fabricant ou du conditionneur
|
+ 4 °C
|
|
Autres denrées alimentaires périssables
|
Température définie sous la responsabilité
du fabricant ou du conditionneur
|
+ 8 °C
|
|
Préparations culinaires élaborées à
l'avance
|
+ 3 °C
|
+ 3 °C
|
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
34
4. PLAN HACCP
Dans le cadre du plan de maîtrise sanitaire, le plan
HACCP a son application strictement limitée à la
sécurité des aliments et repose sur le fait que
les mesures de maîtrise ont des effets mesurables sur le produit fini
(Legnani et al., 2004).
Terme anglais, « HACCP » est
l'abréviation de Hazard Analysis Critical Control Points et est
généralement traduit par analyse des dangers et points critiques
pour leur maîtrise.
L'HACCP est une méthode basée sur la
prévention qui est décrite en sept principes et douze
étapes dans le Codex Alimentarius.
C'est un système simple et logique de maîtrise et
de gestion des risques alimentaires, que le danger soit chimique,
microbiologique ou physique, permettant :
- d'identifier et d'évaluer les risques associés
à chaque étape de production ;
- de définir les moyens nécessaires à leur
maîtrise et à leur surveillance ;
- de s'assurer que ces moyens sont mis en oeuvre efficacement. La
méthode HACCP est basée sur 7 principes:
1- Analyser les dangers
2- Déterminer les points critiques pour la maîtrise
(CCP)
3- Établir les limites critiques pour chaque CCP
4- Établir un système de surveillance pour chaque
CCP
5- Établir des mesures correctives
6- Établir des procédures de
vérification
7- Établir un système d'enregistrement et de
documentation
Les facteurs de contamination et de prolifération
microbienne sont identifiés à partir de la méthode des 5M
(principe 1 de la méthode HACCP). Cette méthode
énumère les sources possibles de la contamination qui sont les
suivantes :
- La matière première qui peut contenir des
micro-organismes et être une source de contamination par rapport à
un autre produit
- Le matériel : prend en compte les plans de travail et
ustensiles en contact avec les matières premières pouvant
être source de contamination par manque de désinfection
- La méthode : techniques opérationnelles
appliquées par le personnel de cuisine
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
35
- Le milieu : représente l'air, le sol, les murs,
plafonds, surfaces...
- La main d'oeuvre : représente le personnel qui est
porteur de germes (tenue, hygiène corporelle) et est susceptible de
contaminer les denrées alimentaires.




Figure 05 : La méthode HACCP (Cosson et al.,
2003).
5. CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
36
TOXI-INFECTION ALIMENTAIRE COLLECTIVE
5.1. Définition
Une toxi-infection alimentaire collective (TIAC) est
définie par l'incidence de deux cas ou plus, d'une maladie similaire,
à symptomatologie gastro-intestinale le plus souvent, dont la cause peut
être rapportée à une même origine alimentaire
(Delmas et al., 2006).
Le diagnostic d'une toxi-infection alimentaire collective est
immédiatement évoqué lorsque plusieurs personnes
appartenant à une même collectivité sont subitement
victimes d'une « indigestion ». Mais l'unité de temps
(simultanéité des cas) et l'unité de lieu (focalisation
des cas) ne sont pas constamment observées. Dans plus de 90 % des cas,
c'est devant une gastroentérite aiguë typique, associant de
façon variable nausées, crampes épigastriques,
vomissements, diarrhée, fièvre, hypotension, que se pose le
diagnostic. Les formes sévères avec déshydratation
s'observent aux âges extrêmes de la vie, justifiant un taux
d'hospitalisation compris entre 5 et 10 %. Mais il existe aussi des formes
atypiques pouvant égarer le diagnostic (Hance et al.,
1998).
5.2. Physiopathologie
Trois mécanismes principaux sont responsables de
l'activité pathogène des agents responsables des TIAC:
· Action invasive par colonisation ou
ulcération de la muqueuse intestinale avec inflammation. La localisation
est habituellement iléo-colique et la destruction villositaire
importante. Les selles sont alors glaireuses, riches en polynucléaires,
parfois sanglantes.
· Action cytotoxique avec production
d'une toxine protéique entraînant une destruction cellulaire.
· Action
entérotoxinogène, entraînant une stimulation de la
sécrétion. La toxine, libérée par certaines
bactéries au sein même de l'aliment, est responsable du tableau
clinique : la multiplication bactérienne intra-intestinale étant
soit absente soit tout à fait secondaire.
Il n'y a pas de destruction cellulaire ou villositaire. La
diarrhée est aqueuse, il n'y a pas de leucocytes, ni de sang dans les
selles. La fièvre est absente ou modérée. Le risque de
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
37
déshydratation aiguë est important. La
diarrhée cesse en 3 à 5 jours, dès que la population
entérocytaire s'est régénérée ou a
retrouvé une fonction normale (Malvy et al,
1998).
5.3. Les principaux
germes pathogènes responsables des TIAC
5.3.1. Salmonella
Bacille Gram négative, aéro-anaérobie,
appartenant à la famille des Enterobacteriaceae. S. Enteritidis
et S. Typhimurium prédominent dans le domaine alimentaire
(D'Aoust, 2001). Le réservoir principal de
Salmonella est constitué par le tractus gastro-intestinal des
mammifères et des oiseaux. Les salmonelles présentes dans les
matières fécales des animaux, peuvent contaminer les
pâturages, les sols et l'eau.
5.3.1.1.Maladie humaine
(Salmonellose)
Il n'existe pas de publications relatives à la relation
dose-effet (Colin, 2009).
Concernant la dose-réponse, l'OMS indique que la dose
de S. Enteritidis provoquant des troubles chez 50% des consommateurs
est de l'ordre de 10 000 bactéries mais ne conclut pas sur le
caractère extrapolable de cette relation aux sérotypes
(Anderson et al., 2002).
La durée d'incubation est de 12 à 36 heures.
Cliniquement, les salmonelloses se manifestent par une
diarrhée fébrile accompagnée de vomissements et de
douleurs abdominales. Elles peuvent entraîner des
bactériémies et se compliquer de septicémies ou de
localisations secondaires extra-digestives qui font la gravité de la
maladie. Les signes vont durer spontanément 2 à 3 jours pour
disparaître rapidement.
Le diagnostic sera confirmé par la coproculture qui
identifiera la souche. L'antibiothérapie ne modifie pas
l'évolution clinique et peut au contraire contribuer à prolonger
le portage de la souche. Elle n'est donc pas indiquée en règle
générale, sauf chez le sujet présentant un déficit
immunitaire, chez le jeune enfant, chez la personne âgée, chez le
sujet porteur d'une prothèse vasculaire ou articulaire, chez le
drépanocytaire et enfin dans les formes cliniques sévères,
avec altération de l'état général. Les
antibiotiques utilisés sont soit l'amoxicilline, le cotrimoxazole ou
mieux des fluoroquinolones systémiques pour une durée de 5 jours
(Garcia et Heredia, 2009).
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
38
5.3.1.2.Aliments impliqués
Lors de différentes enquêtes relatives aux
déclarations de TIA, les principaux aliments impliqués sont
principalement les oeufs et ovoproduits, ainsi que les viandes (volailles
principalement) (Colin, 2009). Cependant les cas
décrits dans la littérature font état de nombreux autres
aliments responsables. Des résultats d'investigations
d'épidémies à Salmonella indiquent des
épidémies liées à la consommation de Cantal au lait
cru (Haeghebaert et al., 2002), et de poudre de lait
infantile (Brouard et al., 2006).
Les souches de Salmonella sont relativement sensibles
aux traitements physiques. Une investigation montre le rôle important de
la viande de boeuf hachée insuffisamment cuite dans la survenue des
salmonelloses, et la nécessité de bien cuire la viande
(Loury et al., 2009).
5.3.2. Staphylococcus aureus et enterotoxines
staphylococciques
Coque à Gram positif, non sporulé, immobile,
aéro-anaérobie facultatif. S. aureus, espèce type
du genre Staphylococcus produit de nombreuses toxines dont les
entérotoxines staphylococciques (SEs) responsables
d'épidémies liées à S. aureus A. Les
staphylocoques sont des bactéries ubiquitaires présentes sur la
peau, les muqueuses et la sphère rhinopharyngée des animaux et en
particulier chez l'Homme (Dellaras, 2007). Les staphylocoques
ont également été isolés de l'environnement
naturel, domestique de l'Homme, hospitalier et des ateliers de
préparation alimentaire. La présence de ce germe dans
l'environnement est vraisemblablement due à une contamination par
l'Homme ou les animaux (De Buyser et Hennekinne, 2009).
5.3.2.1.Maladie humaine
L'incubation est généralement courte et varie de
1 à 4 heures. Les symptômes sont déclenchés par
l'ingestion d'aliments contenant le germe à la suite d'une manipulation
des aliments par un sujet porteur d'une staphylococcie cutanée ou
rhinopharyngée (Bennett, 2005; Dinges et al.,
2000).
Elles se distinguent sur le plan clinique par des vomissements
précoces suivis d'une diarrhée abondante sans fièvre. Des
signes de choc peuvent survenir. (Bergdoll, 1989; Kérouanton
et al., 2007).
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
39
5.3.2.2.Aliments impliqués
S. aureus peut être isolé d'aliments
très variés. Les aliments les plus « à risque »
sont : les viandes, volailles et jambon, cuits et tranchés, salades
composées, gâteaux à la crème, plats cuisinés
manipulés après cuisson (plus l'aliment est manipulé, plus
le risque est élevé); les aliments fermentés à
acidification lente permettant la croissance de S. aureus durant la
fermentation, par exemple le fromage (Ostyn et al., 2010)
.
Les plats ayant nécessité des manipulations
humaines et secondairement, les produits laitiers ont été les
aliments les plus fréquemment associés aux intoxinations à
staphylocoque rapportées en France (De Buyser et Hennekinne,
2009).
5.3.3. Clostridium perfringens
Bacille Gram positif, immobile, sporulé,
anaérobie stricte mais aérotolérant. C. perfringens
secrète de nombreuses toxines et enzymes hydrolytiques dont
l'enterotoxine, synthétisée au cours de la sporulation,
responsable de d'intoxination alimentaire. Selon les principales toxines
produites, les souches de C. perfringens sont classiquement
classées en cinq toxinotypes (Type A à E).
Clostridium perfringens type A est le type
responsable des TIAC chez l'homme. Le sérotypage permet de
caractériser la souche responsable de l'épidémie
(Avignon et al, 2001).
Contrairement aux spores, l'enterotoxine est thermolabile ;
elle est détruite en solution saline par un chauffage de 5 minutes
à 60°C (Poumeyrol et Popoff, 2006).
5.3.3.1.Maladie humaine
Les symptômes apparaissent entre 6 et 24 heures,
généralement 10 à 12 heures, après l'ingestion du
repas contaminé. Ils se traduisent surtout par de la diarrhée et
de violents maux de ventre, parfois de nausées.
Les aliments ou préparations culinaires responsables
d'intoxination alimentaire contiennent au minimum 105 formes
végétatives vivantes de C. perfringens
entérotoxinogènes par gramme (Poumeyrol et Popoff,
2006).
Clostridium perfringens étant normalement
présent dans les selles, la certitude diagnostique repose non pas sur la
coproculture, mais sur la numération de bactéries dans l'aliment
suspecté
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
40
(Labbé, 2000). L'identification du germe
dans les aliments consommés et les selles des malades nécessite
des conditions strictes d'anaérobiose.
5.3.3.2.Aliments impliqués
Ce sont les préparations à base de viande qui
sont les plus fréquemment à l'origine d'intoxination alimentaire.
Le plus souvent, il s'agit de préparations culinaires
réalisées à l'avance et en grande quantité. Les
aliments les plus typiques sont des viandes en sauce, cuisinées en grand
volume et à l'avance, qui n'ont pas été refroidies
suffisamment vite entre le moment de leur préparation et celui où
elles atteignent la température ambiante. Les préparations en
forte teneur en amidon, comme les haricots sont également à
risque.
Les matières premières sont faiblement
contaminées (sous le seuil de risque d'intoxination 105/g).
La cuisson détruit la plupart des formes végétatives, mais
pas ou peu les spores.
L'ébullition favorise les conditions
d'anaérobiose suffisante pour la croissance de C. perfringens
(dégazage). Les préparations en grand volume sont propices
à cet effet (réoxigénation plus lente que dans les petits
volumes).
Etant donné que C. perfringens se multiplie
rapidement dans un milieu à base de viande ou d'amidon dans un
intervalle de température entre 50 et 30°C, un maintien des
préparations culinaires pendant plusieurs heures dans cette gamme de
température rend possible une prolifération de cette
bactérie au-delà du seuil critique.
La mesure principale concerne la maîtrise de la
température de conservation des plats cuisinés dans l'intervalle
+10 et +63°C. Les plats cuisinés à l'avance doivent
être conservés soit à des températures
supérieures à 63°C, soit inférieures à
10°C.
Le réchauffage des plats cuisinés à
l'avance doit se faire à une température d'au moins 75°C
(Poumeyrol et Popoff, 2006).
5.3.4. Clostridium botulinum
Clostridium botulinum est un bacille à Gram
positif (faible) aux extrémités arrondies. Il est mobile (6
à 20 cils péritriches). Il n'est pas capsulé. Le
réservoir est ubiquitaire. C. botulinum entraîne des
toxi-infections graves. Cette bactérie est responsable d'une
neuro-intoxication (Charles et Jean , 2005) .
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
41
5.3.4.1.Maladie humaine
La durée d'incubation est de 2 heures à 8 jours,
en général entre 12 et 36 heures.
Cliniquement, parfois précédés de
nausées et de vomissements, les signes sont d'ordre neurologique :
diplopie troubles de l'accomodation, dysphagie, sécheresse des muqueuses
; et dans les cas graves, paralysies motrices pouvant atteindre les muscles
respiratoires. Fait important, il n'y a ni fièvre, ni signe
méningé ou d'atteinte du système nerveux central.
Evolution : le botulisme est une toxi-infection grave. Le type
toxémique influence le pronostic. Le type A est plus
sévère que le type B et le E que le A. Les autres facteurs
déterminants sont: l'âge, la durée d'incubation (plus grave
si plus court), la race (plus sévère chez les asiatiques), la
survenue de complications infectieuses, ou d'atteintes des voies
respiratoires (Shapiro et al., 1998).
5.3.4.2.Aliments impliqués
Les aliments contaminés sont habituellement les
conserves n'ayant pas subi une cuisson préalable suffisante: conserves
domestiques, poissons fumés, La neurotoxine protéique produite
est thermolabile (Lund et Peck, 2001; Sharma
et Whiting, 2005).
5.3.5. Listeria monocytogenes
Listeria monocytogenes est un bacille à Gram
positif ubiquiste et environnemental, résistant et pouvant se multiplier
à basse température (réfrigérateur)
(Farber, J et al., 2000). Après colonisation
temporaire du tube digestif à partir d'aliments fortement
contaminés, comme certains fromages à pâte molle à
base de lait non pasteurisé (Malvy et al,
1998).
5.3.5.1.Maladie humaine
La listériose peut se manifester sous forme sporadique
ou épidémique. La listériose de l'adulte est typiquement
à symptomatologie neuroméningée. La listériose de
la femme enceinte survient avec contamination foetale par voie sanguine
transplacentaire ou transmembraneuse à partir du liquide amniotique
infecté par des abcès placentaires. Elle est difficile à
dépister, voire asymptomatique, et révélée par ses
conséquences obstétricales. En l'absence de traitement, les
conséquences sont redoutables pour l'enfant (avortements précoces
surtout du 2e trimestre, accouchements prématurés,
seulement 20 % de naissances à terme. Les principes du traitement
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
42
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
comprennent l'administration d'une pénicilline A
(amoxicilline) et de cotrimoxazole, voire un aminoside dans les formes
sévères (Malvy et al, 1998).
5.3.5.2.Aliments impliqués
Toutes les grandes catégories d'aliments, qu'il
s'agisse du lait et des produits laitiers, de la viande crue et des produits
carnés, des végétaux, ou encore des poissons ou
crustacés et des plats préparés peuvent être
contaminés par cette bactérie, avec des fréquences et des
taux de contamination variables. La fréquence de contamination par
L. monocytogenes, ainsi que le niveau de contamination, varient selon
les catégories d'aliments, qu'il s'agisse d'aliments crus ou
transformés. Les aliments cuits peuvent également rester
contaminés à la suite d'un traitement thermique insuffisant ou
être contaminés par une contamination croisée
posttraitement (Lailler, 2006) .
5.3.6. Bacillus cereus
B. cereus est un bacille à Gram positif,
sporulé, aéro-anaérobie facultatif. Il fait partie d'un
ensemble d'espèces apparentées, souvent regroupées dans la
littérature sous le terme «Bacillus cereus sensu lato
».
B. cereus sensu lato a été
récemment subdivisé en 7 groupes génétiques, les
espèces traditionnelles se répartissant chacune dans un ou
plusieurs groupes (Guinebretiere et al., 2008). Le
groupe VI, le plus psychotrophe n'a pas pour l'instant été
associé à des TIA. B. cereus est retrouvé sous
forme de spores dans le sol (104- 105 spores/g de
sol).
5.3.6.1.Maladie humaine
B. cereus est à l'origine de deux types de
maladies transmises par les aliments (Efsa, 2005).
D'une part une maladie caractérisée par des
symptômes diarrhéiques, accompagnés de douleurs
abdominales, de nausées, parfois de fièvre, survenant
généralement dans les 8 à 16 heures après
l'ingestion de l'aliment contaminé. D'autre part une maladie
caractérisée par des symptômes émétiques,
survenant généralement dans les 1 à 5 heures après
l'ingestion de l'aliment contaminé, pouvant être suivis de
diarrhées.
43
Les TIA diarrhéiques à B. cereus sont
le plus souvent associées à une population égale ou
supérieure à 105 UFC/g d'aliments consommés,
bien que des épidémies associées à des aliments
contenant 103 UFC/g aient été décrites
(Efsa, 2005).
La dose de céréulide suffisante pour provoquer
des symptômes émétiques serait de l'ordre de 5 à 10
ìg par kg de masse corporelle. Une telle quantité de
céréulide peut être retrouvée dans les aliments
lorsque la souche atteint une concentration supérieure ou égale
à 106 UFC/g (Efsa, 2005).
5.3.6.2.Aliments impliqués
Une large gamme d'aliments à été
impliquée dans des TIA à B. cereus (Efsa, 2005).
Il s'agit le plus souvent d'aliments ayant subi un traitement
thermique et consommés après un délai ayant permis la
multiplication de la bactérie, comme des plats cuisinés par
exemple. Des cas liés à la consommation de jus d'orange, de
graines germées et de préparations infantiles ont aussi
été décrits (Nguyen-The, 2009).
De par son abondance dans le sol et la résistance de
ses spores, B. cereus peut contaminer pratiquement toutes les
catégories d'aliments. Les spores de B. cereus possèdent
de fortes capacités d'adhésion aux surfaces en acier inoxydable
et peuvent s'accumuler dans les équipements de transformation des
aliments (Efsa, 2005).
Le céréulide étant très
résistant à la chaleur, il ne sera pas détruit par une
deuxième cuisson de l'aliment.
A l'exception des aliments ayant reçu un traitement
thermique suffisant, et non recontaminés après traitement, la
présence de spores est inévitable. Dans ce cas la première
mesure de maîtrise est d'éviter que la bactérie ne se
multiplie et n'atteigne une population pouvant provoquer des symptômes
diarrhéiques, ou produire le céréluide.
5.3.7. Campylobacter
Bacilles Gram négatif, mobile, thermotolérant.
Les oiseaux, sauvages et domestiques sont considérés comme les
principaux réservoirs de Campylobacter jejuni et, dans une
moindre mesure, de C. coli. Cependant d'autres réservoirs de
Campylobacter ont été décrits : les bovins, les
porcins et les petits ruminants, mais aussi les animaux de compagnie
(Colin, 2006).
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
44
5.3.7.1.Maladie humaine
(Campylobactériose)
La maladie la plus fréquemment observée est une
entérite aigüe, causée par une infection intestinale,
pouvant se compliquer par une bactériémie, des localisations
secondaires et un syndrome post-infectieux. La durée d'incubation est
comprise entre 1 et 10 jours. L'affection entérite se manifeste
particulièrement par des diarrhées, des douleurs abdominales, des
selles sanguinolentes, de la fièvre et parfois des nausées et des
vomissements. C. jejuni est particulièrement associé
à ce type d'infection entérique (Colin,
2006).
5.3.7.2.Aliments impliqués
Du fait de l'existence de réservoirs animaux «
naturels », les Campylobacter peuvent être à l'origine de la
contamination de nombreuses catégories de denrées alimentaires
(viandes, lait). Pour les cas sporadiques, de nombreuses études
cas/témoins identifient les produits à base de viandes de
volailles comme le principal facteur de risques.
Au cours de la transformation, du transport et de la
distribution des aliments, le nombre de Campylobacter
thermotolérants viables a tendance à diminuer. D'une
manière générale, la congélation arrête la
croissance de ces bactéries et détruit vraisemblablement une
faible partie de la population bactérienne. Par contre, ces
bactéries survivent aux températures de
réfrigération, mais sont très sensibles à la
chaleur ; on peut considérer que les traitements thermiques
supérieurs à 60°C permettent leur destruction.
Du fait des origines et des disponibilités de
dissémination tout au long de la chaîne alimentaire, les mesures
de maîtrise s'articulent essentiellement autour de la mise en place de
bonnes pratiques d'hygiène tant au niveau des élevages que des
abattoirs et ateliers de transformation des denrées d'origine animale
(Jund, 2010).
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
45
5.4.Evolution de TIAC en Algérie
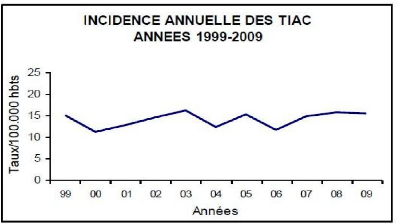
Figure 06: Incidence Mensuelle des TIAC
Année 1999-2009 En Algérie (INSP, 2009).

Figure 07: Incidence Mensuelle des TIAC Année
2009 En Algérie (INSP, 2009).
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
46
Le taux d'incidence des intoxications alimentaires collectives
est stable avec 15,43 cas pour 100.000 habitants, en 2008 il était de
15,75. Les incidences mensuelles enregistrées durant l'année ont
varié entre 0,21 et 2,90 cas pour 100.000 habitants, et les incidences
les plus importantes ont été observées entre avril et
juillet 2009, avec un pic de 2,90 en juillet 2009.
En nombre absolu, on retrouve plus du cinquième des cas
enregistrés par la wilaya de Constantine (1169 cas). Cette wilaya a
enregistré une nette augmentation de son incidence qui est passée
de 41,27 à 119,89 cas pour 100.000 habitants. Les pics d'incidence ont
été déclarés en février (44,24), en mai
(54,81) et en juillet (9,65). La wilaya d'Illizi a enregistré
l'incidence régionale la plus élevée avec 127,79 cas pour
100.000 habitants. Le pic épidémique a été
notifié en juin avec 74,12 cas pour 100.000 habitants. La wilaya d'El
Bayadh enregistre une nette augmentation de son incidence qui passe de 3,59
à 63,84 cas pour 100.000 habitants (INSP, 2009).
Les autres wilayas les plus touchées sont Tissemsilt
(42,72), Ouargla (42,40), El Oued (37,21) et Bouira (36,43). Ce sont les 10-29
ans qui enregistrent les incidences selon l'âge les plus
élevées.
PARTIE
PRATIQUE

46
OBJECTIF
Les mauvaises conditions d'hygiène dans la cuisine des
restaurants des cités universitaires sont la cause de toxi-infections
alimentaires collectives. Les germes responsables de ces TIAC peuvent
être retrouvés dans le plat servi aux consommateurs, dans les
ustensiles de cuisine, les plans de travail pour la préparation des
repas ou sur les mains du personnel des cuisines.
Objectif :
Le présent travail a pour objectif principal d'estimer
la qualité bactériologique des ustensiles de cuisine et des repas
cuisinés dans deux cités universitaires de la ville de Mostaganem
afin d'en juger de leurs conformité par rapport aux normes.
Démarche générale de l'étude :
1-Prélèvement d'échantillons au niveau de
deux cités universitaires 2-Analyses microbiologiques des
échantillons prélevés.
Le non-respect des conditions d'hygiène dans la cuisine
des restaurants universitaires peut exposer les étudiants à des
TIA qui peuvent porté préjudice à leur santé. Les
conditions d'hygiène concernent aussi bien les plats cuisinés et
les ustensiles de cuisines, que le personnel des cuisines.
Chapitre II
Matériel et Méthodes

Microscope milieu du 18ème siècle
CHAPITRE II
MATERIELS ET METHODES
47
Les échantillons ont été
prélevés au niveau de deux cités universitaires de la
ville de Mostaganem :
1-La cité universitaire de jeunes filles CHAMOUMA d'une
capacité de 2000 lits 2-La cité universitaire de garçon
KHAROUBA d'une capacité de 1500 lits.
Pour garder l'anonymat, des lettres alphabétiques (A,
B) ont été attribuées à chacun de ces blocs, les
prélèvements ont été effectués selon un plan
d'échantillonnage comportant cinq échantillons par
prélèvement conformément aux dispositions de
l'arrêté ministériel du 27 Mai 1998 (Annexe 02).
1. Echantillonnage
Les échantillons sont obtenus par la méthode
classique en respectant les textes officiels qui stipulent que les plats
cuisinés devraient être prélevés à l'avance
d'au moins un plat (unité individuelle) par semaine dans la cadre du
contrôle systématique des établissements de
préparation. L'importance est de veiller à la
représentativité de l'échantillon,
plus
particulièrement lorsque le produit présente une grande
hétérogénéité. Le produit doit être
brassé avant le prélèvement et celui-ci doit porter sur
les différents éléments (viandes, légumes, sauces)
composant le plat Abouda (2011).
2. Matériel de prélèvement
Pour assurer l'hygiène des prélèvements
récoltés, nous utilisons différents matériels :
- Les flacons stériles d'une contenance de 500 g.
- Les écouvillons.
- Une glacière contenant des carboglaces (outres
congelées) pour le transport des
échantillons sous régime de froid.
CHAPITRE II
MATERIELS ET METHODES
3. Matériel de laboratoire
Ce sont les éléments utilisés dans tous les
laboratoires d'analyse bactériologique de produits
alimentaires.
- Bec bunsen
- Matériel de stérilisation et d'incubation.
-
Balance de précision pour la pesée (de marque KERN
PLS 510-3, Max 510g d 0,001g)
48
- "Stomacher" pour le broyage et l'homogénéisation
et le broyage (Seward, Stomacher
400 Circulator).
- Verrerie : Tubes à vis stériles, erlenmeyer, les
lames, flacon de 500 ml, boîtes de pétri,
béchers,
pipettes, étaleurs.
- Spatules métalliques stériles.
- Portoirs.
- Bain-marie pour la régénération des
milieux.
- Milieux de culture et les réactifs (annexe
1).
4. Les Analyses microbiologiques
A travers les analyses bactériologiques des
différentes composantes de la cuisine centrale, on estime évaluer
la qualité hygiénique des plats chauds et des plats froids
(salades) ainsi que la propreté des surfaces de travail et des locaux
(paillasse, table de travail...), des ustensiles (plateaux, spatule,
marmite...) et des mains du personnel entrant en contact avec les aliments.
4.1. Nombre et nature des prélèvements des
denrées alimentaires
A partir des deux (2) sites A, B nous avons
prélevé vingt (20) échantillons de denrées
alimentaires dans les conditions d'asepsie.
Le tableau suivant (Tableau 09) précise
la nature des denrées alimentaires prélevées.
49
CHAPITRE II
Tableau 09: Tableau récapitulatif des
prélèvements des denrées alimentaires dans les 2 sites.
|
Restaurants
|
Repas
|
Date de prélèvement
|
|
Site A
|
Salade de carotte
|
04/02/2019
|
|
Pate en sauces
|
06/02/2019
|
|
Lentilles
|
11/02/2019
|
|
Salade verte
|
13/02/2019
|
|
Lentille
|
18/02/2019
|
|
Salade verte
|
20/02/2019
|
|
Lentille
|
25/02/2019
|
|
Salade verte
|
27/02/2019
|
|
Haricot
|
04/03/2019
|
|
Salade verte
|
06/03/2019
|
|
Site B
|
L'haricot
|
01/04/2019
|
|
Salade verte
|
03/04/2019
|
|
Salade de carotte
|
08/04/2019
|
|
Spaghetti
|
10/04/2019
|
|
Lentilles
|
15/04/2019
|
|
Salade de riz
|
17/04/2019
|
|
Haricot blanc
|
22/04/2019
|
|
Salade de riz
|
24/04/2019
|
|
Spaghetti
|
29/04/2019
|
|
Salade de betterave
|
06/05/2019
|
4.2. Nombre et nature des prélèvements des
surfaces et les mains
A partir des deux sites A et B, nous avons
prélevé stérilement trente quatre (34) échantillons
prélevés constituaient les surfaces et les mains.
Le tableau suivant (Tableau 10)
précise la nature et le nombre des prélèvements
dans les sites A et B.
Tableau 10 : Nombre et nature des
prélèvements dans les sites A et B.
|
sites
|
Nombre et nature des
prélèvements
|
|
Vestiaires des cuisiniers
|
surfaces
|
mains des manipulateurs
|
plats vides
|
équipements et
chariots
|
|
Site A
|
02
|
04
|
05
|
02
|
04
|
|
site B
|
02
|
04
|
05
|
02
|
04
|
CHAPITRE II
MATERIELS ET METHODES
5. Prélèvements des
échantillons
Le niveau de risque de contamination par les surfaces
choisies, la représentativité des échantillons ainsi que
le temps nécessaire pour les prélever, ont été les
paramètres importants à considérer pour assurer un bon
échantillonnage. Nous avons jugé obligatoirement important de
prélever d'une manière aseptique dans le but d'avoir des analyses
de haute qualité.
Ainsi l'expérimentateur doit veiller à respecter
d'abord son hygiène corporelle (surtout les mains) et vestimentaire.
Selon Abouda (2011), il faudrait aussi éviter de faire
des prélèvements dans des zones de courant d'air.

a b

C
50
Figure 08 : Prélèvement sur surfaces,
plats de consommation, équipements et chariots, vestimentaires et les
mains des cuisiniers.
a)Ustensiles utilisés comme
assiette et méthode de séchage ; b) Surfaces
(paillasse, sol) et chariots ;
c)mains et vestiaire de
cuisinier.
5.1.Ecouvillonnage
Pour assurer un bon prélèvement des surfaces
comme les mains des personnels, les équipements qui sont en contact avec
la préparation des aliments et les surfaces des locaux, nous avons eu
recours à la méthode d'écouvillonnage humide que nous
avons trouvée plus efficace que l'écouvillonnage à
sec (Decade, 2005). Cette analyse se fait par des
écouvillons stériles en tube plastique.
CHAPITRE II
MATERIELS ET METHODES
51
5.2. Prélèvement des échantillons des
denrées alimentaires
En utilisant des cuillères, les
prélèvements des plats chauds et des plats froids sont mis dans
des flacons stériles lors de dressage. Le transfert des
échantillons est assuré à des températures voisines
de +4°C puis acheminés dans une glacière contenant des
boites eutectiques préalablement congelées.
6. Les germes recherchés pour les analyses des
denrées alimentaires
Les germes recherchés sont différenciés dans
chaque repas prélevé (JORA N°35 du 27 mai 1998 (annexe 02).
Les principaux germes recherchés au niveau du laboratoire
d'hygiène alimentaire de Mostaganem.
-la flore aérobie mésophile qui reflète
la qualité microbiologique générale d'un aliment
(Hygis, 1988) ;
-les coliformes fécaux et les coliformes totaux,
-les germes anaérobies sulfitoréducteurs
(Clostrodium), les Staphylocoques auréus et les
salmonelles
7. Les germes recherchés pour les analyses des
surfaces et les mains
Nous avons recherché les principaux germes
pathogènes (les coliformes fécaux, Staphylococcus et
Salmonella). Ces micro-organismes peuvent se fixer sur un support dans
certaines conditions et le coloniser.
8. Techniques d'analyses bactériologiques des
denrées alimentaires
8.1. Préparation de l'échantillon pour
l'analyse
A proximité du bec bunsen, la technique se déroule
comme suit :
- Vingt cinq grammes (25 g) de chaque échantillon sont
pesés à l'aide de la balance de
précision,
- Ils sont transférés d'une manière
aseptique dans un sac de stomacher stérile,
CHAPITRE II
MATERIELS ET METHODES
52
- Ils subissent un broyage dans 225 ml d'eau peptonée
tamponnée stérile, constituant
ainsi la suspension mère (SM) (Haeghebaert,
2002),
- La SM est laissé au repos pendant 15 à 30 mn
pour la revivification. La densité de cette
solution est voisine de 1
(ce qui correspond à 1 g d'aliment dans 1ml de solution).
- Des dilutions décimales allant de 10-2
à 10-4 dans l'eau distillée stérile sont
préparées à
partir de l'échantillon broyé
(SM). Le facteur de dilution varie d'un échantillon à un autre.
On obtient ainsi deux suspension mères (10-1) :
- La première servira l'analyse bactériologique
courante.
- La deuxième (sera incubé pendant 24h à
37°C) servira à la recherche de salmonelle.
Lors de la réalisation des dilutions décimales,
entre chaque dilution, il est impératif de changer la pipette. Par
contre, lors de l'ensemencement, il est recommandé de commencer par la
plus haute dilution pour ne pas changer de pipettes
(recommandations Institut pasteur, 1999).
8.2.Recherche des flores mésophiles aérobies
totaux à 30°C (FMAT)
Le protocole expérimental de recherche des flores
mésophiles aérobies totaux à 30°C (FMAT) se fait
à partir des tubes de dilution 10-2 et 10-3.
- Un millilitre (1 ml) de suspension est prélevé
puis transféré dans des boites de pétri
stériles contenant (25 ml) de gélose standard
pour dénombrement ou plate Couot Agar (PCA).
- La gélose est fondue puis refroidie à
40-50°C environ.
- Elle est ajoutée dans chaque boite puis
homogénéisé avec le prélèvement par des
mouvements circulaire de va-et-vient en forme de 8.
- Après refroidissement et solidification, la boite est
incubée à l'étuve à 30°C en
position
retournée.
Toutes ces opérations se déroulent dans le
cône de stérilité engendrée par 1 bec bunsen
allumé. La lecture est faite après 48 à 72 heures
d'incubation par dénombrement des colonies blanchâtres
poussées en profondeur. Le résultat est exprimé en nombre
de germes/g d'aliment.
Expression des résultats :
Pour déterminer le nombre estimé de la flore
aérobie mésophile totale dans un gramme d'aliment il faut donc
retenir les dénombrements de boîtes contenant entre 30 et 300
colonies,
CHAPITRE II
MATERIELS ET METHODES
53
obtenues (Guiraud, 2003). Pour chaque
micro-organisme caractéristique, le nombre de microorganismes par gramme
d'échantillon est exprimé selon la relation (Joffin et
leyral, 2006).
N: Nombre d'UFC par g ou par ml de produit
initial; Ó C: Sommes des colonies des boites
interprétables;
V : Volume de solution déposée
(ml);
n1 : Nombre de boites considérées
à la première dilution retenue;
n2 : Nombre de boites considérées
à la deuxième dilution retenue; d1 : Facteur de
la première dilution retenue.
8.3.Recherche des coliformes totaux à 37°C
(test de présomption)
La technique utilisée est celle de Mac Grady (NPP :
nombre le plus probable), méthode de dénombrement des coliformes
en milieu liquide (Institut pasteur, 1999).
- Une série de tubes munis d'une cloche de durham
contenant 10ml de VBL est préparée
(milieu sélectif liquide) à raison de deux tubes
par dilution.
- A partir des dilutions décimales allants de
10-3 à 10-1 est transféré à
l'aide d'une pipette
graduée 1ml dans chacun des deux tubes
correspondant à une dilution donnée.
- Le gaz présent dans les cloches est chassé.
- Le milieu et l'inoculum est bien mélangé.
8.4.Recherche des coliformes thermotolérants
à 44°C (test de confirmation)
En se référant à la technique de Mac
Kenzie, méthode de dénombrement des coliformes
thermotolérants à partir des réactions positives du test
de présomption :
- On procède au repiquage des tubes de VBL
trouvés positif lors de dénombrement des
coliformes totaux,
- A partir de ces tubes, on transfert aseptiquement au moyen
d'une pipette pasteur,
quelques gouttes à la fois dans :
CHAPITRE II
MATERIELS ET METHODES
54
? Un tube contenant 10ml de VBL muni d'une cloche de Durham et ?
Un tube contenant 5ml d'EPEI.
- On chasse le gaz présent dans les cloches, et on
mélange bien le milieu et l'inoculum.
- Après l'incubation, on ajoutera à chaque tube
d'EPEI 2 à 3 gouttes du réactif de Kovacs
(Institut pasteur, 1999).
8.5.Recherche des Staphylococcus aureus
Pour la recherche des Staphylococcus aureus, on a
suivi la méthode d'enrichissement sélectif sur milieu Giolliti
Cantoni (Bouillon d'enrichissements sélectif) mélangé
aseptiquement et soigneusement avec son additif tellurite de potassium
(ampoule).
8.5.1. Enrichissement à 37°C
On prélève aseptiquement 1ml de chacun des
dilutions 10-1, 10-2 et 10-3 qu'on transfert
par la suite au moyen des pipettes graduées dans des tubes contenant
25ml de bouillon Gioliti Cantoni.
8.5.2. L'isolement à 37°C
A partir des tubes ayant viré au noir (afin de
s'assurer qu'il s'agit bien d'un développement de
staphylococcus pathogène), on ensemence aseptiquement en strie
la surface du milieu Chapman. Ce dernier est un milieu sélectif
permettant l'isolement et l'enrichissement des staphylococcus
pathogène. Il est préalablement coulé en boites
pétri et solidifié.
8.5.3. Identification des résultats
En cas de présence de colonies typiques ou
caractéristiques (colonie avec un halo jaunes lumineux, mannitol
positif) sur le milieu Chapman (Afnor, 2004), on peut
procéder à des tests confirmatifs pour s'assurer qu'il s'agit
bien de staphylococcus aureus.
8.5.3.1.Prés-identification des
Staphylococcus
Les souches pures de cocci Gram+ doivent tout d'abord être
soumises à une pré-identification en procédant aux tests
de catalase, Staphylocoagulase et DNase Test Agar.
Catalase
Elle a pour but de classifier des bactéries
aérobies et plus spécialement de différencier.
CHAPITRE II
MATERIELS ET METHODES
55
CHAPITRE II
MATERIELS ET METHODES
Il s'agit d'une enzyme qui a la propriété de
décomposer l'eau oxygénée avec dégagement
d'oxygène.
A l'aide d'un ance, on prélève aseptiquement une
colonie typique suspectée d'être celle de staphylococcus
aureus et on la mélange avec quelques gouttes d'une solution
fraiche de H2O2 placée sur lame, un dégagement gazeux abondant
sous forme de bulle traduit la décomposition de l'eau
oxygénée sous l'action de la catalase (Guiraud,
2000)
Staphylocoagulase
Elle a pour but de déterminer la
pathogénicité d'une staphylococcus qui secrète
une enzyme la staphylocoagulase qui a la propriété de coaguler le
plasma.
- A partir d'un Chapman déjà ensemencé,
on prend aseptiquement une colonie ayant
fermenté le mannitol.
- On la met dans un tube contenant le bouillon coeur-cervelle.
- On va placer à l'étuve de température
37°C pendant 18 à 24 heures.
- Dans des conditions d'asepsie, 0,5ml de culture (colonie +
BHIB) mis au contact avec
0,5ml de plasma du lapin (remplacer par plasma d'humain)
dilué au 1/5 dans un tube à hémolyse.
- L'ensemble est incubé à 37°C et
examiné toutes les 1/2 heures pendant une demi-
journée.
La coagulation se traduit par la prise en masse du contenu du
tube qui peut être retourné
(Guiraud, 2000).
Test de DNase
On ensemence le milieu de DNase à partir d'une culture
pure (de 18 à 24 heures) de staphylocoque sur milieu BN dans une bande,
ou déposer la croissance en un point, à l'aide d'un ensemenceur
à anse. Il est possible d'ensemencer jusqu'à quatre souches de
Staphylocoques sur une même boîte de Pétri. Il est
recommandé d'inclure un témoin positif, par exemple : S.
aureus. Incuber les boîtes de Pétri en conditions
aérobies pendant 18 à 24 h entre 35 et 37 °C. Si des souches
d'autres espèces de bactéries ou de champignons sont
testées, ensemencer conformément aux conditions requises.
Après incubation, recouvrir les boîtes de Pétri avec
une quantité suffisante de solution d'acide chlorhydrique (HCl) 1 N.
Attendre 2 min afin de permettre à l'acide de pénétrer
toute la surface du milieu (Kateete et al, 2010).
56
Une fois que l'acide a été appliqué et
laissé pénétrer dans le milieu, les microorganismes
positifs à la DNase, comme Staphylococcus aureus ou
Serratia marcescens, sont entourés de zones claires d'ADN
dépolymérisé, tandis que les parties du milieu plus
éloignées de la bande d'ensemencement sont opaques et
blanchâtres, sous l'effet de l'ADN polymérisé. Les colonies
de microorganismes négatifs à la DNase ne présentent pas
de zones plus claires en périphérie des colonies.
8.5.3.2.Identification biochimique
Elle est proposée par microméthode sur la
galerie API spécifiques de ces germes. A partir d'une culture pure (de
18 à 24 heures) de staphylocoque sur gélose de Chapman, on doit
préparer une suspension bactérienne homogène. Son
opacité doit être égale à 0,5 de Mac Farland dans
une ampoule de milieu API Staph Medium, par comparaison à un
témoin d'opacité du Mac Farland Standard.
On ensemence la galerie en respectant le mode
opératoire du fabricant. Incuber à 37°C pendant 18 à
24 heures (Delarras, 2007).
9. Recherche des salmonelles
La recherche des Salmonelles s'effectue plusieurs
étapes : 9.1.Pré enrichissement non
sélectif
L'un des deux flacons de la solution mère (25g de
viande préalablement broyée +flacon de TSE de 250ml) est
incubé pendant 24h à 37°C et va être utilisé
pour la Recherche des salmonelles (Dennaï et al.,
2001).
9.2.Enrichissement à 37°C
Le lendemain, dans des conditions d'asepsie un enrichissement
est effectué sur le bouillon SFB (bouillon d'enrichissement
sélectif), en simple et en double concentration additionné
d'acide de sodium (pour SFB S/C et SFB D/C), et repartie à raison de
100ml par flacon, soit :
-
100ml (du milieu incube au 1er jour) pour le SFB
D/C.
CHAPITRE II
MATERIELS ET METHODES
57
|
-
|
100ml (du milieu incube au 1er jour) pour SFB S/C.
|
9.3.Isolement à 37°C
Sur le milieu sélectif salmonella-shigella
(permettant l'isolement et la différenciation des
entérobactérie pathogènes), à partir de chacun des
milieux d'enrichissements (S/C et D/C) précédents, on effectue
aseptiquement des isolements par des ensemencements en stries au moyen d'une
anse de surface du milieu salmonella-shigella avec leur additif
préalablement coulé en boites pétri et solidifié
(Dennaï et al., 2001).
9.4.Lecture des boites et caractérisation des
suspects
A partir des boites de salmonella-shigella
incubées précédemment, on prépare
aseptiquement une suspension bactérienne en mettant cinq colonies
considérées comme typique (blanchâtre avec ou sans centre
noir) dans 5ml d'eau physiologique stérile qu'on incube quelque heures
à 37°C. Cette suspension servira à la réalisation des
tests confirmatifs et biochimiques qui se déroule comme suit :
9.4.1.Test d'urée-indole
Nous avons introduit environ 1 ml de ce milieu dans un tube
à vis stérile. Par la suite nous l'avons ensemencé avec
une souche pure, prélevée sur gélose
salmonella-shigella. Après incubation à 37°C
pendant 24 heures, une lecture est faite.
La couleur du milieu reste inchangé pour les souches
suspectes, et sont dites uréase négative (non productrices
d'uréase). Dans le cas contraire, il vire au rose.
Pour la mise en évidence de la production d'indole,
nous avons ajouté quelque goutte du réactif de Kovacs dans les
tubes du milieu urée-indole. La dégradation du tryptophane est
marquée par l'apparition d'un anneau jaune, pour les salmonelles
qui sont dites indole négatif.
Dans le cas contraire, nous avons un anneau rouge (Indole
positif) (Farmer et al., 1980).
CHAPITRE II
MATERIELS ET METHODES
58
9.4.2.Test de TSI à 37°C
Il a pour but l'identification rapide des
entérobactéries, la gélose TSI permet de mettre en
évidence la fermentation du lactose ou de glucose (avec ou sans
dégagement gazeux), du saccharose et la production d'hydrogène
sulfuré (H2S), a l'aide d'un fil de platine, on ensemence aseptiquement
la suspension bactérienne par piqure au fil droit et en stries sur la
tranche de la gélose TSI inclinée en tube à essai
(Yazgi, 2002).
9.4.3. Test de mannitol-mobilité à
37°C
Il a pour but de différencier rapidement les
entérobactéries, l'agar Mannitol-Mobilité permet
de chercher simultanément la mobilité l'utilisation de mannitol
et la réduction des nitrates.
On ensemence aseptiquement la suspension bactérienne
par piqure centrale et profonde au moyen d'un fil de platine sur l'agar
Mannitol-Mobilité en tube à essai.
9.4.4. Test du citrate perméase à
37°C
Il a pour but de mettre en évidence le citrate
perméase chez la bactérie suspecte.
Il s'agit de déterminer si un micro-organisme est
capable ou non de dégrader la citrate qui est le premier composant
intervenant dans le cycle de kreps (métabolisme de glucide) et son
utilisation indique le fonctionnement probable de ce cycle dans le germe
étudié.
On réalise aseptiquement à l'aide d'une ance un
ensemencement en stries de suspension bactérienne sur la tranche du
milieu Citrate de Simmons en tube à essai.
9.4.5. Test à l'oxydase
Sous l'action d'une cytochrome-oxydase, le
di-méthyl-para-phénylène diamine, incolore, est
transformé en une semi-quinone violacée qui s'oxyde rapidement
pour donner un composé noirâtre.
- Réactif (à conserver à + 4°C et
à l'obscurité)
Solution aqueuse à 1% de chlorhydrate ou d'oxalate de
di-méthylpara- phénylène diamine dont on imbibera un
papier buvard blanc. Ou disques de papier buvard imprégnés de
cette substance dans le commerce.
CHAPITRE II
MATERIELS ET METHODES
59
- Placer le disque Ox sur une lame porte-objet et l'imbiber avec
une goutte d'eau.
Prélever à la pipette boutonnée une
parcelle de culture et la poser sur le disque. La présence d'oxydase
entraînera une coloration violette.
9.4.6. Test à l'ONPG (Orthonitrophényl
-D-Galactopyranoside)
Le test à l'ONPG est une technique basée sur
l'action directe de l'enzyme sur une molécule
chromogène pouvant être
l'ortho-nitrophényl- -D-galactopyranoside ou le 2-naphtol- -
Dgalactopyranoside (Carbonnelle et al., 1987).
préparer une suspension épaisse de
bactéries prélevées obligatoirement sur milieu
lactosé dans 0,25 ml d'eau distillée en tube à
hémolyse Ajouter 0,25 ml de solution d'ONPG ou un disque
imprégné d'ONPG prêt à l'emploi (ou encore un
demi-disque) (Farmer et al., 1980). Le test de l'ONPG
(analogue de lactose) a pour but de faire éclater les bactéries
par choc osmotique dans de l'eau distillée stérile. Dans ces
conditions l'enzyme, si elle existait dans la bactérie est
libérée dans le milieu et réagit avec l'ONPG
entraînant un changement de couleur. Dans le cas contraire un test
négatif confirme que la souche était effectivement
dépourvue de béta-galactosidase.
9.4.7. Coloration de Gram
Elle pour but la taxonomie ou la classification
bactérienne. Cette technique reposant sur les caractéristiques
membranaires et de parois des bactéries (Guezlane,
2008). Cette coloration se traduit par les étapes suivantes
:
· Réaliser un frottis bactérien: sur une
lame propre on dépose une goutte d'eau distillée, puis à
l'aide de l'anse à ensemencement on prélève un peu de la
crème bactérienne (culture jeune), on sèche la lame avec
la flamme bleue du bec bunsen et on la fait passer deux à trois fois au
sein de la flamme.
· Colorer au violet de gentiane (1 minute): est un
colorant basique qui se fixe sur les composants du cytoplasme bactérien,
à ce moment toutes les bactéries sont de couleur violette. Laver
à l'eau distillée.
· Mordançage au lugol (30 secondes): est un
mordant qui renforce l'adhésion du violet de gentiane au niveau du
cytoplasme bactérien. Laver à l'eau distillée.
· Décoloration rapide avec de l'éthanol
à 95° (10 secondes): les bactéries Gram ont une paroi mince
et riche en lipide, ce qui permet le passage de l'alcool qui va entraîner
avec lui le
CHAPITRE II
MATERIELS ET METHODES
60
violet de gentiane et les cellules vont devenir transparentes.
Laver rapidement avec de l'eau distillée.
· Colorer avec la fuchsine (1minute): cette étape
sert à colorer les bactéries (Gram-) qui se sont
décolorées lors du traitement précédent, de ce fait
les bactéries Gram- seront colorées en rose et les Gram+ en
violet. Laver à l'eau distillée.
Après séchage de la lame observer avec l'ajout
d'huile à immersion (objectif xl00).
10. Techniques d'analyses pour le contrôle
bactériologique des écouvillons
Il s'agit d'obtenir une suspension homogène dense dans
un tube à hémolyse contenant 1ml d'eau physiologique
stérile et ceci à partir de l'écouvillon
échantillonné.
? En premier lieu déposer deux gouttes sur milieu
Chapman (premier cadran), étaler sur
ce cadran, faire un isolement à l'anse à partir de
ce cadran et incuber 24h à 37°C.
? En second lieu : Déposer deux gouttes sur milieu VRBL
(vert brillon de bromocrisole),
étaler sur ce cadran, faire un
isolement à l'anse à partir de ce cadran et incuber 24h à
44°C.
? En troisième lieu, mettre le reste de la suspension
dans un bouillon Sélénite simple
concentration (tube) et
incuber 24h à 37°C (Abouda, 2011). on effectue
aseptiquement des isolements par des ensemencements en stries au moyen d'une
anse de surface du milieu salmonella-shigella avec leur additif
préalablement coulé en boites pétri et
solidifié (Dennaï et al., 2001).

Chapitre III
Résultats et
Discussions
CHAPITRE III
RESULTATS ET DISCUSS ION
61
1.Résultats
1.1.Critères microbiologique
Les critères microbiologiques applicables aux
différents repas analysés (chauds et froids) selon le journal
Officiel de la république Algérienne n°35 sont
mentionnés dans l'annexe 02
Tenant compte des germes recherchés et comme il s'agit
de matériel de surface, ou des mains qui peuvent être en contact
direct avec l'aliment, les critères microbiologiques seront : la
présence ou l'absence des germes.
Le tableau suivant (Tableau 11)
présente les critères bactériologiques des
surfaces et des mains (JORF, 1979 ; Innorpi, 1988 ; Abouda, 2011)
Tableau11: critères bactériologiques,
surfaces et mains (JORF, 1979 ; Innorpi, 1988 ; Abouda, 2011)
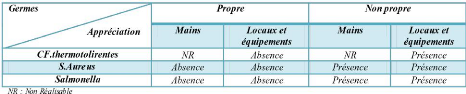
CHAPITRE III
RESULTATS ET DISCUSS ION
1.2.Résultats Obtenus
La photo suivante montre les colonies FMAT
blanchâtres lenticulaires poussant dans le milieu CPA.
62
Figure 09 : L'aspect de la flore aérobie
mésophile totale sur gélose plate Couot Agar (PCA) après
incubation
pendant 72 h à 30° C.
.
1.2.1. les coliformes
Vivant normalement dans l'intestin de l'homme et des animaux
à sang chaud, ces marqueurs peuvent être un indice de la
présence des germes pathogènes.
1.2.1.1.Les denrées alimentaires
Sont considérés comme positifs les tubes
présentant à la fois :
- Un dégagement gazeux supérieur à 1/10 de
la hauteur de la cloche.
- Un trouble microbien accompagné d'un virage de
l'indicateur de pH, ce qui témoigne de la fermentation du lactose
présent dans le milieu.
A. Test de présomption
La Photo (a) montre le virage de couleur
des quelques tubes contenant milieu VBL (résultat positif) La Photo
(b) montre la production de gaz dans les cloches de durham ou
le résultat positif.
|
CHAPITRE III
|
RESULTATS ET DISCUSS ION
|
|
|

Virage de couleur avec la
Production de gaze dans la cloche
a
b
Figure 10 : Les tubes de VBL après 24 heures
(test de présomption).
B. Test de confirmation
Les tubes sur le portoir au dessus montrent la formation
d'un anneau rouge qui remonte en surface du milieu EPEI dans chaque tube
après l'addition du réactif de kovacs ( résultat
positif).
|
Anneau rouge remonte en surface
|
|
63
Figure 11 : les tubes d'EPEI après
l'addition de kovacs (test de confirmation).
Quand aux résultats de recherche des coliformes
(totaux, thermotolérants), ils sont mentionnés dans les tableaux
(14, 15, 16 et 17).
CHAPITRE III
RESULTATS ET DISCUSS ION
1.2.1.2.Les surfaces et les mains
La photo suivante montre L'aspect des colonies des
coliformes thermotolérants sur milieu VRBL après incubation
pendant 24 heures à 45°C.
|
Colonies Caractéristiques couleur violette
entourée d'un halo Violet
|
|
Figure 12 : L'aspect des colonies des coliformes
thermotolérants sur milieu VRBL après incubation pendant 24
heures à 45°C.
1.2.2. les Staphylococcus aureus
La présence de ces Cocci Gram+, au sein des repas (chauds
ou froids) au niveau des surfaces et des mains des manipulateurs dans les
restaurants universitaires constitue un risque pour la santé des
étudiants.
Les boites présentant des colonies de taille moyenne,
lisses, brillantes et pigmentées en jaunes seront
considérées comme positives. A partir des colonies jaunes, nous
avons procédés aux tests biochimiques (catalase et coagulase)
La figure 13 montre le
résultat positif de la présence des staphylococcus traduit par le
noircissement des tubes de milieu Giolitti Cantoni.
64
Figure 13 : le milieu d'enrichissement Giolitti de
Cantoni après 24 heures (staphylocoques).
CHAPITRE III
RESULTATS ET DISCUSS ION
La figure 14 présente les
colonies de staphylococcus pures de couleur jaune dans le milieu
sélectif chapman
Figure 14: Les colonies suspectes de staphylocoques
après l'isolement et la purification sur milieu
chapman.
.
65
Le tableau suivant (Tableau 12) résume
les résultats obtenus des tests de la coagulase et de la catalase sur
des colonies isolées à partir du milieu de Chapmann.
CHAPITRE III
RESULTATS ET DISCUSS ION
66
Tableau 12: Résultat des tests de la
catalase et de la coagulase sur les colonies suspectes obtenues par cultures
à partir des denrées alimentaires, des surfaces et des mains.
|
Les souches
|
Catalase
|
Coagulase
|
|
Après 3Heures
|
Après 24Heures
|
|
St1
|
+
|
+/-
|
+
|
|
St2
|
+
|
+
|
+
|
|
St3
|
+
|
+
|
+
|
|
St4
|
+
|
+
|
+
|
|
St5
|
+
|
+
|
+
|
|
St6
|
+
|
+
|
+
|
|
St7
|
+
|
-
|
-
|
|
St8
|
+
|
+/-
|
+
|
|
St9
|
+
|
+
|
+
|
|
St10
|
+
|
+
|
++
|
|
St11
|
+
|
+/-
|
+
|
|
St12
|
+
|
+
|
+
|
|
St13
|
+
|
+
|
++
|
|
St14
|
+
|
+
|
+
|
|
St15
|
+
|
+
|
+
|
|
St16
|
+
|
+/-
|
+
|
|
St17
|
+
|
+
|
+
|
|
St18
|
+
|
+/-
|
+
|
|
St19
|
+
|
++
|
++
|
|
St20
|
+
|
++
|
++
|
|
St21
|
+
|
++
|
++
|
|
St22
|
+
|
+/-
|
+
|
|
St23
|
+
|
++
|
++
|
|
St24
|
+
|
+
|
+
|
|
St25
|
+
|
+
|
+
|
|
St26
|
+
|
+
|
+
|
|
St27
|
+
|
++
|
++
|
|
St28
|
+
|
+
|
+
|
|
St29
|
+
|
+
|
+
|
|
St30
|
+
|
+
|
+
|
|
St31
|
+
|
+
|
++
|
CHAPITRE III
RESULTATS ET DISCUSS ION
La photo suivante (Figure 15) illustre le
résultat positif de test de catalase qui montre la présence de
staphylococcus par la dégradation d' H2O2 traduit par la
formation des bulles.
Figure 15 : Test de catalase pour des souches de
Staphylococcus (St3).
La figure 16 illustre le
résultat positif de test de coagulase, après 2h de l'ajout de la
souche on observe la formation d'un amas de plasma.
67
Figure 16: Test de coagulase pour les souches de
Staphylococcus (St3) réalisé sur plasma humain.
CHAPITRE III
RESULTATS ET DISCUSS ION
1.2.3. Les Salmonelles
Etant une bactérie particulièrement dangereuse,
la recherche de Salmonella dans les échantillons
prélevés (les plats cuisinés, les surfaces et les mains)
à partir des restaurants universitaires est indispensable. Après
les analyses bactériologiques et biochimiques des différents
échantillons nous avons remarqué l'absence de colonies incolores
blanchâtres caractéristiques de Salmonella dans le milieu
SS (Salmonella-Shegella).
La figure 17 montre les colonies
suspectes de salmonelle sur milieu SS (salmonella-shegella) après 24
heures à partir d'un repas cuit.
|
Colonies blanchâtres à centre noir
|
|
68
Figure 17 : Isolement sur milieu SS
(salmonella-shegella) après 24 heures (colonies suspectes de salmonelle)
à partir d'un repas cuit.
CHAPITRE III
RESULTATS ET DISCUSS ION
La figure 18 montre les colonies
suspectes de salmonelle sur milieu SS (salmonella-shegella) après 24
heures à partir des mains de cuisinier.
|
Colonies blanchâtres à centre
noir
|
|
Figure 18: Isolement sur milieu SS
(salmonella-shegella) après 24 heures (colonies suspectes de salmonelle)
à partir des mains de cuisinier.
Les tests biochimiques
La figure 19 montre le virage de
la couleur du milieu urée indole au rose et la formation de l'anneau
rouge après 24 heure d'incubation à 37°C avant et
après l'addition de réactif de kovacs.

Formation d'un anneau
Virage couleur de l'urée au rose
rouge
69
Figure 19 : Milieu Urée Indole incubé
24 heure à 37°C avant et après l'addition de réactif
de kovacs.
CHAPITRE III
RESULTATS ET DISCUSS ION
La figure 20 montre le virage de
la couleur et la précipitation noir de sulfure de fer du Milieu TSI
après incubation 24 heure à 37°C

Virage de couleur
et Précipitation
noir de
sulfure de
fer
Figure 20 : Milieu TSI après incubation 24
heure à 37°C (pour les souches des entérobactéries
isolées à partir des surfaces et des mains).
La figure 21 montre le virage de
la couleur au jaune du Milieu Manitol Mobilité après incubation
24 heure à 37°C (pour les souches des entérobactéries
isolées à partir des surfaces et des mains).

Virage du couleur au jaune
70
Figure 21 : Milieu Manitol Mobilité
après incubation 24 heure à 37°C (pour les souches des
entérobactéries isolées à partir des surfaces et
des mains).
CHAPITRE III
RESULTATS ET DISCUSS ION
La figure 22 montre le virage de
l'indicateur de pH au bleu du Milieu Citrate de Simmons après incubation
24 heure à 37°C (pour les souches des entérobactéries
isolées à partir des surfaces et des mains).

Virage de l'indicateur de pH au bleu
Figure 22 : Milieu Citrate de Simmons après
incubation 24 heure à 37°C (pour les souches des
entérobactéries isolées à partir des surfaces et
des mains).
La figure 23 montre le virage de
l'indicateur de pH au jaune ( Test de l'ONPG après incubation 24 heure
à 37°C pour les souches des entérobactéries
isolées).
|
Virage de l'indicateur de pH au
jaune
|
|
71
Figure 23 : Test de l'ONPG après incubation
24 heure à 37°C (pour les souches des entérobactéries
isolées).
CHAPITRE III
RESULTATS ET DISCUSS ION
72
Le tableau suivant (Tableau 13) résume
les résultats des tests biochimiques effectués pour les souches
isolées sur milieu SS..
|
Uréase
|
Indole
|
H2S
|
Citrate perméase
|
Mobilité
|
ONPG
|
|
E1
|
+
|
-
|
++
|
+
|
+
|
+
|
|
E2
|
+
|
-
|
++
|
+
|
+
|
+
|
|
E3
|
+
|
-
|
++
|
+
|
+
|
+
|
|
E4
|
+
|
-
|
++
|
+
|
+
|
+
|
|
E5
|
+
|
-
|
+
|
-
|
+
|
+
|
|
E6
|
+
|
-
|
++
|
+
|
+
|
+
|
|
E7
|
+
|
-
|
+
|
+
|
+
|
+
|
|
E8
|
+
|
-
|
+
|
+
|
+
|
+
|
|
E9
|
+
|
-
|
+
|
-
|
+
|
+
|
|
E10
|
+
|
-
|
+
|
+
|
+
|
+
|
|
E11
|
+
|
-
|
+
|
-
|
-
|
+
|
|
E12
|
+
|
-
|
+
|
+
|
+
|
+
|
|
E13
|
+
|
-
|
+
|
+
|
+
|
+
|
|
E14
|
+
|
-
|
+
|
+
|
+
|
+
|
|
E15
|
+
|
+
|
-
|
+
|
+
|
+
|
|
E16
|
+
|
-
|
+
|
+
|
+
|
+
|
|
E17
|
+
|
-
|
+
|
+
|
+
|
+
|
|
E18
|
+
|
-
|
-
|
+
|
+
|
+
|
|
E19
|
+
|
-
|
++
|
+
|
+
|
+
|
|
E20
|
+
|
-
|
++
|
+
|
+
|
+
|
|
E21
|
+
|
-
|
++
|
-
|
+
|
+
|
|
E22
|
+
|
-
|
++
|
-
|
+
|
+
|
|
E23
|
+
|
-
|
+
|
+
|
+
|
+
|
|
E24
|
+
|
-
|
+
|
+
|
+
|
+
|
|
E25
|
+
|
+
|
+
|
+
|
+
|
+
|
|
E26
|
+
|
-
|
-
|
-
|
+
|
+
|
|
E27
|
+
|
-
|
-
|
-
|
+
|
+
|
|
E28
|
+
|
+
|
-
|
-
|
+
|
+
|
|
E29
|
+
|
-
|
+
|
-
|
-
|
+
|
|
E30
|
+
|
-
|
+
|
-
|
+
|
+
|
|
E31
|
+
|
-
|
+
|
+
|
+
|
+
|
|
E32
|
+
|
-
|
+
|
-
|
+
|
+
|
Tableau 13 : Résultats des tests
biochimiques effectués sur les souches isolées dans le milieu
SS.
CHAPITRE III
RESULTATS ET DISCUSS ION
73
Le tableau suivant (Tableau 14)
résume les résultats d'analyses des repas chauds et froids qui
ont été prélevés au niveau de la Restaurant
universitaire CHAMOUMA.
Tableau 14 : Les résultats d'analyses des
repas chauds et froids qui ont été prélevés au
niveau de la Restaurant universitaire CHAMOUMA.
|
Les
échantillons
|
Staph.a à 37°C
|
C.th à44°C
|
Salmonelles
|
|
01
|
Abs
|
/
|
Abs
|
|
02
|
Abs
|
Abs
|
Abs
|
|
03
|
Abs
|
/
|
Abs
|
|
04
|
Abs
|
/
|
Abs
|
|
05
|
Abs
|
/
|
Abs
|
|
06
|
4,2.102
|
130
|
Abs
|
|
07
|
Abs
|
/
|
Abs
|
|
08
|
Abs
|
4.104
|
Abs
|
|
09
|
Abs
|
/
|
Abs
|
|
10
|
Abs
|
130
|
Abs
|
|
Le tableau suivant (Tableau 15)
résume Les résultats d'analyses des repas chauds et froids qui
ont été prélevés au niveau du restaurant de
KHAROUBA.
Tableau 15 : Les résultats d'analyses des
repas chauds et froids qui ont été prélevés au
niveau du restaurant de KHAROUBA.
|
Les
échantillons
|
Staph.a à 37°C
|
C.th à44°C
|
Salmonelles
|
|
01
02
03
04
05
06
07
08
09
10
|
Abs
Abs
Abs/ Abs Abs Abs Abs Abs Abs abs
|
2,6.104
|
Abs Abs Abs Abs Abs Abs Abs Abs Abs abs
|
|
Abs
3.104
|
|
/ / / / / /
|
CHAPITRE III
RESULTATS ET DISCUSS ION
Le tableau suivant (Tableau 16)
résume Les analyses microbiologiques des échantillons dessurfaces
et des mains qui ont été prélevés au niveau de la
Restaurant universitaire CHAMOUMA.
Tableau 16 : Les analyses microbiologiques des
échantillons des surfaces et des mains qui ont été
prélevés au niveau de la Restaurant universitaire CHAMOUMA.
|
Prélèvements
|
Germes recherchés
|
|
CF.Fécaux
|
S.Aureus
|
Salmonella
|
|
Mains de cuisinier
|
MP1
|
/
|
+
|
-
|
|
MP2
|
/
|
+
|
-
|
|
Mains de distributeur
|
DP1
|
/
|
-
|
-
|
|
DP2
|
/
|
+
|
-
|
|
DP3
|
/
|
+
|
-
|
|
Vestiaire de cuisinier
|
VP1
|
-
|
+
|
-
|
|
VP2
|
+
|
+
|
-
|
|
Plats de consommation
|
PP1
|
-
|
+
|
-
|
|
PP2
|
-
|
+
|
-
|
|
Postes de distributions
|
PDP1
|
+
|
+
|
-
|
|
PDP2
|
+
|
+
|
-
|
|
Paillasses de travail
|
PTP1
|
+
|
+
|
-
|
|
PTP2
|
+
|
+
|
-
|
|
Equipements
|
EP1
|
-
|
-
|
-
|
|
EP2
|
-
|
+
|
-
|
|
Chariots
|
HP1
|
+
|
+
|
-
|
|
HP2
|
+
|
+
|
-
|
74
Le tableau suivant (Tableau 17)
résume Les analyses microbiologiques des échantillons des
surfaces et des mains qui ont été prélevés au
niveau de la Restaurant universitaire KHAROUBA.
CHAPITRE III
RESULTATS ET DISCUSS ION
Tableau 17: Les analyses microbiologiques des
échantillons des surfaces et des mains qui ont été
prélevés au niveau de la Restaurant universitaire KHAROUBA.
|
Prélèvements
|
Germes recherchés
|
|
CF.Fécaux
|
S.Aureus
|
Salmonella
|
|
Mains de cuisinier
|
MI1
|
/
|
+
|
-
|
|
MI2
|
/
|
+
|
-
|
|
Mains de distributeur
|
DI1
|
/
|
-
|
-
|
|
DI2
|
/
|
+
|
-
|
|
DI3
|
/
|
+
|
-
|
|
Vestiaire de cuisinier
|
VI1
|
+
|
+
|
-
|
|
VI2
|
+
|
+
|
-
|
|
Plats de consommation
|
PI1
|
+
|
+
|
-
|
|
PI2
|
+
|
+
|
-
|
|
Postes de distributions
|
PDI1
|
+
|
+
|
-
|
|
PDI2
|
+
|
+
|
-
|
|
Paillasses de travail
|
PTI1
|
+
|
-
|
-
|
|
PTI2
|
+
|
+
|
-
|
|
Equipements
|
EI1
|
+
|
+
|
-
|
|
EI2
|
+
|
+
|
-
|
|
Chariots
|
HI1
|
+
|
+
|
-
|
|
HI2
|
+
|
+
|
-
|
75
2. Interprétation des résultats
L'interprétation des résultats d'examens s'effectue
au regard des limites numériques définies par les critères
microbiologiques. Ces critères sont fixés par des
arrêtés ministériels (Bornert G, 2000).
CHAPITRE III
RESULTATS ET DISCUSS ION
76
2.1.Les denrées alimentaires
1. Interprétation selon un plan à trois classes :
L'interprétation des résultats s'effectue selon un
plan à trois classes, dans le cas ou la valeur c est
différente de zéro (0). Les résultats
s'expriment de la
façon suivante :
-si le résultat de l'analyse est inférieur ou
Égal à m, le résultat du critère microbiologique
est satisfaisant
-si le résultat de l'analyse n'excède pas M et
si le nombre d'unités de l'Échantillon donnant un résultat
supérieur à m et compris entre 1 et c , le résultat du
critère microbiologique est acceptable ;
-si le résultat de l'analyse excède M ou si le
nombre d'unités de l'Échantillon donnant un résultat
compris entre m et M est supérieur à c, le résultat du
critère microbiologique est non satisfaisant.
Les paramètres n, c, m et M utilisés dans les
annexes du présent arrêté représentent :
n : nombre d'unité constituant
l'Échantillon ;
m: nombre de germes présents dans un
gramme ou un millilitre de produit analysé, qui correspond à la
valeur en dessous de laquelle la qualité du produit est
considérée comme satisfaisante ;
M : nombre de germes présents dans un
gramme ou un millilitre de produit analysé, qui correspond à la
valeur au dessus de laquelle la qualité du produit est
considérée comme inacceptable
CHAPITRE III
RESULTATS ET DISCUSS ION
Le tableau suivant (Tableau 18) présente
l'interprétation des résultats pour les échantillons des
denrées alimentaires prélevées.
Tableau 18 : Interprétation des
résultats pour les échantillons des denrées alimentaires
prélevées.
|
Satisfaisant
|
Acceptable
|
Non Satisfaisant
|
|
nombre
|
Pourcentage
%
|
nombre
|
Pourcentage
%
|
nombre
|
Pourcentage
%
|
|
Site A
|
07
|
70 %
|
02
|
20 %
|
01
|
10 %
|
|
Site B
|
08
|
80 %
|
00
|
00 %
|
02
|
20 %
|
|
Total
|
15
|
75 %
|
02
|
10 %
|
03
|
15 %
|
Ces résultats nous donnent un pourcentage
élevé des repas satisfaisants par rapport aux repas acceptables
et non satisfaisants.
La figure 24 illustre les
résultats globaux des analyses microbiologiques des aliments.
75 %
Résultats
10%
15 %
Satisfaisant Acceptable
Non Satisfaisant
77
Figure 24 : Interprétation globale des
résultats des analyses microbiologiques des aliments.
CHAPITRE III
RESULTATS ET DISCUSS ION
L'histogramme suivant (figure 25) illustre
une comparaison globale entre deux sites des restaurants
universitaires.
|
80 70
60 50 40 30 20
10
0
|
|
satisfaisant
acceptable
non satisfaisan
78
Figure 25 : Histogramme comparatif globale entre
deux sites des restaurants universitaires.
site A site B
70 et 80% des échantillons pour les sites A et B sont
satisfaisants. Tandis que 10 % des échantillons sont acceptables pour le
site A. alors que les échantillons non satisfaisants au niveau du site A
est 20% et de même pourcentage pour le site B.
Le tableau suivant (Tableau 19)
résume Niveau de contamination par les coliformes thermotolérants
dans les repas au niveau des deux sites de l'étude.
Tableau 19 : Niveau de contamination par les
coliformes thermotolérants dans les repas au niveau des deux
sites de l'étude.
|
Satisfaisant (%)
|
Acceptable (%)
|
Inacceptable (%)
|
|
Site A
|
70
|
20
|
10
|
|
Site B
|
80
|
00
|
20
|
|
Total
|
75
|
10
|
15
|
CHAPITRE III
RESULTATS ET DISCUSS ION
L'histogramme suivant (figure 26)
résume Niveau de contamination par les coliformes
thermotolérants dans les repas au niveau des deux sites de
l'étude.
|
80 70
60 50 40 30 20
10
0
|
|
site A site B
satisfaisant
non satisfaisan
79
acceptable
Figure 26: Histogramme du niveau de contamination
par les coliformes thermotolérants.
70% et 80% des échantillons satisfaisants, 20 % des
échantillons sont acceptables pour le site A et 20% et 10% des
échantillons sont non satisfaisants respectivement pour les sites A et B
.
Le tableau suivant (Tableau 20) résume le
niveau de contamination par S.Aureus dans les repas
au niveau des quatre deux de l'étude.
Tableau 20 : Niveau de contamination par
S.Aureus dans les repas au niveau des deux sites de
l'étude.
|
Satisfaisant (%)
|
Acceptable (%)
|
Inacceptable (%)
|
|
Site A
|
90
|
10
|
00
|
|
Site B
|
100
|
00
|
00
|
|
Total
|
95
|
05
|
00
|
CHAPITRE III
RESULTATS ET DISCUSS ION
L'histogramme suivant (figure 27)
résume le niveau de contamination par les S. Aureus.
satisfaisant
acceptable
non satisfaisan
100
40
90
30
20
80
70
60
50
10
0
80
site A site B
Figure 27 : Histogramme du niveau de contamination
par les S.Aureus.
2.2.Les surfaces et les mains
Le tableau suivant (Tableau 21) présente
Interprétation des résultats pour les échantillons
prélevés à partir des surfaces et des mains.
Tableau 21 : Interprétation des
résultats pour les échantillons prélevés à
partir des surfaces et des mains.
|
P ropre
%
|
Non propre
%
|
|
Mains
|
Locaux et
équipements
|
Mains
|
Locaux et
équipements
|
|
Site A
|
20
|
00
|
80
|
100
|
|
Site B
|
20
|
00
|
80
|
100
|
CHAPITRE III
RESULTATS ET DISCUSS ION
20% des échantillons prélevés à
partir des mains dans les deux sites sont propres et 80% sont non propres, tous
les échantillons prélevés à partir des Locaux et
des équipements sont non propre dans les deux sites.
L'histogramme suivant (figure 28) illustre
l'interprétation de la propreté des deux restaurants
universitaires (Site A et Site B).
|
100 90
80 70 60 50 40
30 20 10
0
|
|
site A site B
mains propres
mains non propr
équipements
propres
équipements non
propres
81
Figure 28 : Histogramme d'interprétation de
la propreté des deux restaurants universitaires (Site A et Site
B).
82
DISCUSSION
La sécurité et la qualité
hygiénique des plats servis aux consommateurs dépendent des
contaminations initiales des matières premières (Ilboudo
et al., 2009), des possibilités de contaminations
surajoutées à chaque étape du processus
d'élaboration, de la possibilité de contamination
résiduelle lorsqu'un traitement assainissant est appliqué et
enfin des possibilités de multiplication des micro-organismes
présents dans la denrée (Anonymous, 1982 ; Ewen et Todd,
1985 ; Goktan et Tunçel, 1987 ; Inal, 1992). Une politique
d'hygiène mal adaptée se traduira par une augmentation de la
contamination biologique avec possibilité de développement de
micro-organismes pathogènes (salmonelles, coliformes, staphylocoques)
avec un risque de toxi-infection alimentaire (Barro et al.,
2002 ; Goussault, 1983 ; Rosset et al.,
1983).
Dans le cadre de cette étude, la recherche des
coliformes dans les plats servis aux étudiants a donné des
résultats peu satisfaisants. La présence de cette
catégorie de germes donne une idée sur la contamination globale
(Commission hygiène du Geco ; 1983).
Les coliformes thermotolérants sont des germes
témoins de la qualité hygiénique des aliments à
côté des coliformes à 30 °C et des Staphylococcus
aureus (Catsaras et Grebot, 1984).
Le dénombrement des coliformes
thermotolérants dans les repas révèle que 75% des
échantillons sont satisfaisant, 10% sont acceptables et 15% sont non
satisfaisant .Ces pourcentages ne sont pas en accord avec ceux trouvés
par Goussault (1983) (5 %) et très important par
rapport à ceux trouvés par Alassane (1998)
(3,57%), où leurs travaux ont été réalisés
dans les mêmes conditions.
La présence des salmonelles et des staphylocoques
dans les aliments témoigne de leur insalubrité. Les analyses
réalisées sur les repas pour le dénombrement des
Staphylococcus aureus donnent des résultats satisfaisants à
95 %, contrairement aux résultats trouvés par Kruy et
al (2001) (12,4 %). Toutefois, l'absence totale de
salmonelles dans les échantillons est à prendre souvent
avec prudence, car selon la nature du milieu d'isolement et la présence
éventuelle de germes compétiteurs comme les coliformes et les
proteus, cette recherche peut s'avérer faussement
négative.
83
DISCUSSION
Les analyses microbiologiques appliquées sur les
échantillons prélevés dans les différentes surfaces
et les mains des cuisiniers ainsi que les distributeurs au niveau des deux
sites universitaires A et B donnent des résultats conformes à 20%
et non conformes à 80%, résultats très important par
rapport à ceux trouvés par Kruy et al (2001)
(36.2%). Ces résultats alarmants
témoignent du manque d'hygiène au niveau des surfaces
utilisées pour la préparation des plats cuisinés, ainsi
que le manque d'hygiène du personnel des cuisines.
Sur les 20 prélèvements de
repas servis aux étudiants et les 34 prélèvements
réalisés sur les mains et les surfaces dans les deux restaurants
universitaires de la ville de Mostaganem, nous avons mis en évidence la
présence de Staphylococcus dans 31 échantillons et la
présence de coliformes thermotolérants dans 23
échantillons.
84
CONCLUSION
Dans notre pays, la restauration collective prend une ampleur
chaque jour grandissante particulièrement en milieu universitaire.
Lorsque les conditions d'hygiène de cette restauration ne sont pas
respectées, il en résulte que les repas présentent un
risque considérable du fait de la présence possible de
microorganismes pathogènes pour le consommateur. La distribution de
repas aux collectivités nécessite de ce fait un contrôle
particulier afin de protéger la santé des convives.
La préparation des repas de bonne qualité
microbiologique exige le respect de nombreuses règles d'hygiène
à plusieurs niveaux : matières premières mises en jeu,
environnement de préparation (matériel, conservation, locaux,
personnel) et savoir-faire.
Les résultats de cette étude ont
révélé qu'il était nécessaire
d'améliorer l'équipement déficient des cuisines dans les
deux restaurants universitaires de la ville de Mostaganem. Par ailleurs, il
faut former le personnel de la restauration qui souvent ignore les
règles élémentaires d'hygiène. Cette formation doit
être axée sur les bonnes pratiques d'hygiène depuis la
constitution du repas jusqu'à sa distribution. En outre, il faut
renforcer la mise en place et le contrôle d'un programme de
nettoyage-désinfection de tous les ustensiles entrant dans la
préparation des repas pour les étudiants.

Références
ibliographiques
-
-

85
REFERENCES BIBLIOGRAPHYQUE
- Abouda Y, 2011 : La qualité
bactériologique en restauration hospitalière, un paramètre
de gestion de risque infectieux. Science Lib Editions Mersenne ISSN
21114706, 3 ; N ° 110301.
- AFNOR (Association Française de
Normalisation), 2004: Analyse microbiologique méthodes
horizontales Paris. Association Française de Normalisation (AFNOR) :1,
521.
- Alassane A, 1998 : Contribution à
l'étude de l'hygiène dans la restauration collective au centre
des oeuvres universitaire (COUD). Thèse de médecine
vétérinaire, Dakar, n° 26.
- Alli A, 2004: Food Quality Assurance:
Principles and Practices. FLORIDA 33431: CRC Press.
- Anderson W., Ebel E., M. Fazil A., Kasuka F., Kelly
L., Lammerding A., Morales R., Schlosser W., Snary E., Vicari A., Yamamoto S,
2002 : Evaluation des risques liés à Salmonella
dans les oeufs et les chairs de poulet. OMS.
- André M., Campos M., Borges L., Kipnis A.,
Pimenta F., Serafini A, 2008: Comparison of Staphylococcus
aureus isolates from food handlers, raw bovine milk and Minas Frescal
cheese by antibiogram and pulsed-field gel electrophoresis following smal
digestion. Food Control 19: 200-207.
- Anonymous, 1982: Guidelines for
Organization and Management of surveillance of foodborne Diseases. WHO.
Cenova.
- Arnaud-thuillier H., Libert B., 1991:
Visite des restaurants d'entreprise, guide méthodologique pour
le médecin du travail. Fiche Medico-Technique N° 38.
- Aubaille C., Bordes D., Derrien H., Fieschi J.,
Gourmelen A., Isaute E., Joseph M., Quinsat C., Soler C, 1992 : Le
plan d'activité commun à plusieurs médecins. Exemple :
hygiène et ergonomie en restauration collective. Archive des
Maladies Professionnelles, 309-310.
- Avignon A., Barbe P., Basdevant A., Bresson J.,
Colette C., Constans T., Cosnes J., Crenn P., Delarue J. & al.,
2001 : cahiers de nutrition et de diététique.
Collège des Enseignants de Nutrition. Société de nutrition
et de diététique de langue française 36, 2S1-2S163.
86
REFERENCES BIBLIOGRAPHYQUE
- Bayard J., Vignal J, 1987 :
Cuisine centrale. Municipale d'Etampe Riva,
N° 224, P. 19 - 24.
- Bajzík P., Bobková A., Bobko M.,
Zeleòáková L., Lopaovský L., Èapla J,
2012: Ratings of the hygienic conditions and verification professional
competence employee in common food services. Journal of Microbiology,
Biotechnology and Food Sciences 717-724.
- Becila A, 2009 : Préventions des
altérations et des contaminations microbiennes des aliments,
mémoire de magistère. Université Mentouri -
Constantine.
- Bell C, 2003: Pest control: insects and
mites, hygiene in food processing. Woodhead, Cambridge, pp. 335-379.
- Bennett R, 2005: Staphylococcal enterotoxin
and its rapid identification in foods by enzymelinked immunosorbent assay-based
methodology. Journal of Food Prot. 68:1264-1270.
- Bergdoll M, 1989: Staphylococcus
aureus, foodborne Bacterial Pathogens. Marcel Dekker, New York and Basel,
pp. 463-523.
- Billon J, 1987 : contamination des aliments
par personnel dans les industries alimentaires. RTVA, 231, 4-6.
- Bobhate P., Shrivastava S., Seth P, 2011:
Profile of catering staff at a tertiary care hospital in Mumbai.
Australasian Medical Journal, vol.4, 2011, n° 3, p. 148-154.
- Bolnot F, 2004 : La maîtrise de la
qualité et les signes de qualité. Polycopié. Ecole
Nationale Vétérinaire d'Alfort, observatoire risques et aliments.
17p.
- Bornert G, 2000 : La place des analyses
microbiologiques de denrées alimentaires dans le cadre d'une
démarche d'assurance-sécurité, Groupe de Secteurs
Vétérinaires Interarmée, 151, 8-9,
805-812.
- Bornert G, 2000 : La place des analyses
microbiologiques de denrées alimentaires dans le cadre d'une
démarche d'assurance-sécurité. Revue Médecin
Vétérinaire, 151, 8-9, 805-812.
- Brouard C., Espie E., Weill F-X., Brisabois A.,
Kerouanton A., Michard J., 2Hulaud D., Forgue A-M., Vaillant V., De
Valk H, 2006 : Epidémie de salmonellose à Salmonella
enterica sérotype Agona liée à la consommation de
poudres de lait infantile. France, janvier-mai 2005. Bulletin
Epidémiologique Hebdomadaire, n°33, p.248-250.
- Brunet D., Maincent M, 1983 : Pratiques
culinaires et hygiène. 1. T.S.V, 127 - 134.
87
REFERENCES BIBLIOGRAPHYQUE
- Buchanan R., Philips J, 1990: Response
surface model for predicting the effects of temperature, pH, NaCl content,
sodium nitrite concentration and atmosphere on the growth of L.
monocytogenes. Journal of Food Protection, 53, 370-3.
- Carbonel X 2007 : Problématique de
la sécurité des aliments en phase de création d'une chaine
de restauration rapide, thèse de doctorat vétérinaire.
École Nationale
Veterinaire d'alfort.
- Carbonnelle B., Denis F., Marmonier A., Pinon G.,
Vargues R, 1987 :
Bactériologie Médicale : Techniques usuelles.
SIMEP SA. Paris, 121-137 ; 146-155. - Carlier V, 1983
: Étude de quelques paramètres du pH ultime des viandes
de bovins.
RTVA, 185, 3.
- Catsaras M., Grebot D, 1984 : Multiplication
des salmonelles dans la viande hachée. Bull Académie
Vétérinaire France, 57 : 501-2.
- César M, 2006 : Analyse
bactériologique des aliments en milieu rural au Laos. Mémoire de
licence en Sciences Biomédicales, la faculté de Médecine
de l'Université Nationale du Laos.
- Charles N., Jean L, 2005 :
Bactériologie Médicale, Masson Paris 187p-192p.
- Chouman K., Giglio Ponsano E., Michelin F,
2010: Microbiological quality of food from self-service
restaurants. Rev Inst Adolfo Lutz, 69(2):261-6.
- Cirillo T., Agozzino E., Cocchieri R., Del Prete U,
2004 : Perception of biological risk and food choices in university
students in Naples. Italian journal of public health ; 62P - 67P
- Colin P, 2009 : Fiche de description de
danger microbiologique transmissible par les aliments : Salmonella.
Afssa.
- Commission hygiène du Geco, 1983 :
Nettoyage et désinfection en restauration. Sols surfaces-
matériels-vaisselle-linge. In : La Restauration. Paris : Informations
techniques des services vétérinaires.
- Corpet D, 2005 : Maîtrise de
l'hygiène (restaurant & industrie) hygiène en restauration
hors foyer. polycopié. Ecole Nationale
Vétérinaire de Toulouse, Unité pédagogique de
l'hygiène et l'industrie des denrées alimentaires d'origine
animale, 26p.
- Corpet D, 2005 : Qualité des aliments.
Polycopié. Ecole Nationale Vétérinaire de Toulouse.
Unité pédagogique de l'hygiène et l'industrie des
denrées alimentaires d'origine animale, 11p.
88
REFERENCES BIBLIOGRAPHYQUE
- Corpet D, 2005 : TIAC, risques sanitaires
des aliments dangers chimiques & toxiinfections alimentaires collectives.
Polycopié. Ecole Nationale Vétérinaire de
Toulouse. Unité pédagogique de l'hygiène
et l'industrie des denrées alimentaires d'origine animale,
28p.
- Cosson C., Bolnot F., Tronchon P, 2003 :
« Sécurité alimentaire » en milieu hospitalier
: de la logique de crise à la logique de progrès. Nutrition
clinique et métabolisme, 17 ; 242-251
- Courthiat M., Boitel L., Chau N., Julliard G, 1996 :
Conditions de travail et risques professionnels dans la restauration.
Documents pour le médecin du travail, 43, 315322.
- Crosby P, 2004 : Définition de la
qualité. AUPETIT (P) Assurance qualité & ISO 9000. Module C3
Conservatoire National des Arts et Métiers, 88p.
- D'Aoust J, 2001: Salmonella.
Guide to Food-borne Pathogens. Wiley, New York, pp. 163-192.
- Dajon J, 2004 : Guide de visite
d'entreprise de restauration, mémoire pour la délivrance du
diplôme d'études spécialisées de médecine du
travail. Université de Montpellier I.
- De Boer E and Beumer R, 1999: Methodology
for detection and typing of foodborne microorganisms. Journal of food
Microbiol. 50: 119-130.
- De Buyser L., Hennekinne A, 2009 :
Fiche de description de danger microbiologique transmissible par les
aliments, Staphylococcus aureus et enterotoxines staphylococciques.
Afssa.
- Decade C., Marty L., Demontrond D., Manuel C.,
Cabrit R., Mann G, 2005:
Gestion du risque infectieux d'origine alimentaire dans les
unités de soins. XVI Eme Congres National de la Sfhh. Reims.
- Delarras C, 2007 : Microbiologie pratique
pour laboratoire d'analyses ou de contrôle sanitaire. La Voisier.
Paris.376p - 377p.
- Delaunay J, 2011 : Les règles
d'hygiène en restauration. Chambre de commerce et d'industrie
d'Alençon.
- Dellaras C, 2007 : Microbiologie pratique
pour le laboratoire d'analyses ou de contrôle sanitaire. Lavoisier Tec et
Doc. Paris. PP 476.
89
REFERENCES BIBLIOGRAPHYQUE
- Delmas G., Gallay A., Espie A., Haeghebaert S.,
Pihier N., Weill F., De Valk H., Vaillant V., Desenclos J, 2006 : Les
toxi-infections alimentaires collectives en France entre 1996 et 2005. BEN 51-
52 418-422.
- Dennaï N., Kharrati B., El Yachioui M, 2001:
Appréciation de la qualité microbiologique des carcasses
de bovins fraîchement abattus. Médecine
Vétérinaire, 145, 270-274.
- Diabate V, 1991 : Contribution à
l'étude de l'hygiène de la Restauration Collective en Côte
d'ivoire cas du Centre Hospitalier Universitaire (CHU) de Cocody d'abidjan,
thèse de Médecine Vétérinaire. Université
Cheikh Anta Diop de Dakar, N° 05.
- Dinges M., Orwin P, & Schlievert P,
2000: Exotoxins of Staphylococcus aureus. Clin Microbiol
Rev. 13:16-34.
- Diouf F, 1992 : Contribution à
l'étude de la qualité hygiénique des aliments vendus sur
la voie publique (AVP) dans la région de dakar. Université Cheikh
Anta Diop - Dakar.
- Drieux H, 1978 : Aspects hygiénique
de la production et de la transformation des aliments d'origine animale.
R.T.V.A, N° 133 : 29 - 36.
- Efsa, 2005: Opinion of the Scientific Panel
on Biological Hazards on Bacillus cereus and other Bacillus
spp in foodstuffs. The Efsa Journal, n°175, p1-48.
- Ewen C., Todd D, 1985: Economie loss from
foodborne disease outbreaks associated with food servise establishments,
journal Food Prot, 48(2): 169-180.
- Farber J. & Peterkin P, 2000:
Listeria monocytogenes, the microbiological safety and
quality of food, Vol. 2. Aspen Publishers, Gaithersburg, MD, pp. 1178-1232.
- Farmer J., Asbury M., Hickman F., Brenner J, 1980:
Enterobacter sakazakii: A new species of
«Enterobacteriaceae» isolated from clinical
specimens. International urnal of systematic bacteriology, p 569-584
Vol. 30, N°3.
- Ferreira M, 2006 : Restauration
d'entreprise, Aide-mémoire juridique. L'Institut national de recherche
et de sécurité paris.
- France, République Arrêté
ministériel du 26 Juin 1974 relatif à la mentation des
conditions d'hygiène relatives préparation, la conservation, la
distribution vente des plats cuisinés à l'avance. Journal
officiel de la République Française. Paris, 16 Juillet 1974.
- Garcia S & Heredia N, 2009:
Microbiologically safe foods, foodborne pathogens and toxins: An
Overview. John Wiley & Sons, p15-36p.
90
REFERENCES BIBLIOGRAPHYQUE
- Ghezzi, S, 2011: Analyzing Food Safety
Cultures: A means to improve food safety in the catering sector. A thesis
submitted to the graduate faculty of auburn university in partial fulfillment
of the requirements for the degree of master of science. Auburn, Alabama.
- Godefroy M, 1985, Guide professionnel de la
restauration. Jacques Lanore, 1- 457.
- Gontier A, 2009 : La qualité micro
biologique en restauration collective, le portage à domicile. Licence
professionnelle hôtellerie tourisme. Université de Toulouse le
Mirail
- Goussault B, 1983 : Importance et
rôle du contrôle microbiologique dans la restauration collective.
Informations Techniques des Services Vétérinaires,
Paris, 447p.
- Goussault B, 1983 : Importance et
rôle du contrôle microbiologique dans la restauration collective,
la restauration. Paris : Informations techniques des services
vétérinaires.
- Guide des bonnes pratiques d'hygiene en restauration
collective à caractère social, 1999: U.P.R.M.
- Guiraud J, 2000 : microbiologie
alimentaire. Ed dunot, paris.
- Haeghebaert S., Le querrec F., Gallay A., Bouvet P.,
Gomez M., Vaillant V,
2002 : Les toxi-infections alimentaires en
France en 1999 et 2000. B.E.H, 23 : 105109
- Haeghebaert S., Sulem P., Deroudille L., Bagnis O.,
Vanneroy-Adenot E., Pouvet P., Grimont F., Brisabois A., Le Querrec F., Hervy
C., Espie E., De Valk H., Vaillant V, 2002 : Deux
épidémies de salmonellose à Salmonella enteridis
en 2001. Bulletin Epidémiologique, n°5, p. 1-2.
- Hance P., Teyssou R., Nicand E., Buisson Y,
1998 : Sources alimentaires des diarrhées bactériennes.
Toxi-infections alimentaires collectives. Médecine thérapeutique
/ Pédiatrie. Volume 1, N°1, 25-30.
- Hobbs B, 1974: Food poisoning and food
hygiene. 3° edition, London.
- Hygis, V, 1988 : Hygiène
hospitalière, manuel de lutte contre l'infection nosocomiale. Ed. C
& R La Madeleine, p 411.
- Ilboudo A., Savadogo A., Barro N., Ouedraogo M.,
Traore A, 2009: Qualité hygiénique de la viande
utilisée en restauration collective dans trois restaurants
universitaires d' Ouagadougou (Burkina Faso). Cahiers Santé
vol. 19, n° 4.
- Inal T, 1992: Bensin hijyeni (Hayvansal
Gidalarda Saghk Kontrolu) (food hygiene Health inspection of food Obtained from
Animals). Final Ofset, Istanbul.
91
REFERENCES BIBLIOGRAPHYQUE
- INNORPI, 1988 : Norme Tunisienne relative
aux spécifications microbiologiques interprétation des
résultats d'analyses. NT 16.39.
- Institut National de Santé Publique (INSP),
2009 : Situation epidémiologique de
l'année 2009 sur la base des cas déclares
à L' I .N.S.P, R.E.M. Vol XVIII, N° 5. -
Institut pasteur, 1999 : Guide pratique d'analyse
microbiologique des denrées
alimentaires.
- Isoard, P. 1988 : Guide de la
biocontamination. 1ère ed. Lavoisier, Paris.
- Jay J, 1992: Modern food microbiology. Van
nostrand reinhold compagny, New York.
- Journal Officiel de la République
Française, 1974 : Hygiène alimentaire dans les
établissements publics scolaires et universitaires. Mesures de
prophylaxie, n· 1411, 38P.
- Journal officiel de la République
Française, Arrêté du 21 Décembre 1979,
Échantillon pour laboratoire et technique de prise d'essai
publié le 19 Janvier 1980.
- Jund A, 2010 : Mise en place du Plan de
Maîtrise Sanitaire sur l'UCP du Grand Sauvoy, mémoire de Master
Microbiologie. Université Henri Poincaré Nancy 1.
- Kateete D., Kimani C., Katabazi F., Okeng A., Okee
M., Nanteza A., Joloba M., Najjuka F., 2010: Identification of
Staphylococcus aureus, DNase and Mannitol salt agar improve the efficiency
of the tube coagulase test. Annals of Clinical Microbiology and
Antimicrobials, 9:23.
- Kérouanton A., Hennekinne J., Letertre C,
2007: Characterization of Staphylococcus aureus strains
associated with food poisoning outbreaks in France. International Journal
of Food Microbiology, 115, 369-375.
- Khodja M, 2012: Hygiène et
qualité au
menu. la dépêche de kabyle le
journale des hommes libres.
- Kruy S., Soares J., Ping S., Flye Sainte-Marie F.,
2001: Qualité microbiologique de l'aliment «glace,
crème glacée, sorbet» vendu dans les rues de la ville de
Phnom Penh. Bull Soc Pathol Exot, 94, 5, 411-414.
- Labbé R, 2000: Clostridium
perfringens, the microbiological safety and quality of food. Aspen
Publishers. Gaithersburg. MD, pp. 1110- 1135.
- Lailler R, 2006 : Fiche de description de
danger transmissible par les aliments, Listeria monocytogenes.
Afssa.
92
REFERENCES BIBLIOGRAPHYQUE
- Layrat V, et Vierling E, 1996 Microbiologie
et Toxicologie des aliments. DOIN, Paris France. Alfort, 99.
- Lebreton V, Simon L, Lestreit J, May I,
1998: Assurance qualité des préparations
stériles, évaluation des techniques de prélèvements
microbiologiques sur des surfaces. Journal de Pharmacie Clinique, 17,
4, 227-31.
- Leclerc N, 2003 : L'assurance
qualité en restauration collective: Dispositif de lutte contre les
toxi-infections alimentaires collectives. Exemple d'application dans une
cuisine centrale. thèse de doctorat
vétérinaire, École Nationale Veterinaire d'alfort.
- Legnani P., Leoni E., Berveglieri M., Mirolo G., Alvaro
N, 2004: Hygienic control of mass catering establishments,
microbiological monitoring of food and equipment. Food Control, 15;
205-211.
- Leroy S., Lebert I., Chacornac J., Chevallier I., Talon
R, 2001 : Saucissons secs fermiers du Massif central.
Identification et caractérisation de la flore d'intérêt
technologique : bactéries lactiques et staphylocoques à coagulase
négative. Viandes Prod. Carnés Vol 25 (5).
- Leveau J, Larpent J, Bouix M, 2010 :
Sécurité microbiologique des procédés
alimentaires, Techniques de l'Ingénieur, traité Agroalimentaire.
F 1 120 - 1.
- Lopez E., Contrini M., Sanz M,
1997: Perspectives on Shiga-like toxin infections in
Argentina. Journal of Food Protection 60,
1458-1462.
- Loury P., Guillois-Becel Y., Le Mao A., Briand A.,
Le Hello S., Jourdan-Da Silva N., Vaillant V, 2009 : Cas groupé
de salmonellose à Salmonella enterica sérotype Putten.
Nord-ouest de la France, juillet-août 2008. Bulletin
Epidémiologique Hebdomadaire, n°30, p.329-331.
- Lund B., Peck M, 2001: Clostridium
botulinum. Guide to Food-borne Pathogens. Wiley. New York,
p69-p85.
- Malvy D., Djossou F., Le Bras M, 1996 : Les
toxi-infections alimentaires collectives aspects cliniques et
épidémiologiques.
- Mcswane D., Rue N., Linton, R. 2000.
Essentials of food safety and sanitation. New Jersey: Prentice Hall Inc.
- Merouze R, Tondusson O, 1997 : Bonnes
pratiques d'hygiène et plans de nettoyage des outils de maîtrise
des risques. Ed. BPI, 160p.
93
REFERENCES BIBLIOGRAPHYQUE
- Namkoisse E, 1990 : Hygiène de la
restauration collective au centré des oeuvres universitaires de Dakar
(COUD) ; cas du nouveau restaurant dit "ARGENTIN" ou de 3000 places,
thèse de Médecine Vétérinaire. Dakar, N°
17.
- NCFA, 1987: Total number of microbes,
determination with the swab method or contact plate method on utensils in
contact with food. Method N° 5. Nordic Committee on Food Analysis, Espoo.
Finland
- Ndiaye A, 1992: étude de
l'hygiène de la restauration collective au centre régional des
oeuvres universitaires. Université Cheikh Anta Diop DAKAR, N°28.
- Nguyen-The C, 2009 : Fiche de description
de danger microbiologique transmissible par les aliments : Bacillus
cereus. Afssa.
- Niangaly A., Diarra S., Coulibaly D., N'Diaye S,
2006 : Etude des toxi-infections alimentaires collectives en
république du mali ministère de la sante mali.
- Ostyn L., De Buyser M., Guillier F., Groult J., Salah
S., Delmas G., Hennekinne J., 2010 : Première preuve
d'une épidémie due à une intoxication alimentaire à
Staphylocoques type entérotoxine E. France, 2009.
Eurosurveillance. Volume 15, n°13.
- Panisset J., Dewaily E., Doucet-Leduc H,
2003: Contamination alimentaire, edisem Tec & doc. ction Vale
Paris.
- Pascal D., Françoise P., Renée R, 2009
: Lignes directrices et normes pour l'interprétation des
résultats analytiques en microbiologie alimentaire, bibliothèque
nationale du Canada ISBN 978-2-550-56811-7.
- Poulis J., de Pijper M., Mossel D., Dekkers P, 1993:
Assessment of cleaning and disinfection in the food industry with the
rapid ATP-bioluminescens technique combined with the tissue fluid contamination
test and a conventional microbiological method. Journal of Food
Microbiol. 20: 109-116.
- Poumeyrol M., Popoff M, 2006
: Fiche de description de danger microbiologique transmissible par les
aliments : Clostridium perfringens. Afssa.
- Rahkio T., Korkeala H, 1997: Use of
Hygicult- tpc in slaughterhouse hygiene control. Acta vet. scand. 38:
331-338.
- Raquel M., Jayme L., Kipnis A., Pimenta F., Serafini A,
2008: Comparison of Staphylococcus aureus isolates from food
handlers, raw bovine milk and Minas Frescal cheese by antibiogram and
pulsed-field gel electrophoresis following smaI digestion. Food Control 19;
200-207.
94
REFERENCES BIBLIOGRAPHYQUE
- Reynolds A., Harrison M., Rose-Morrow R., Lyon C,
2001: Validation of Dry
Cured Ham Process for Control of Pathogens. Journal of
Food Science vol 66; N° 9. - Robert N., Joseph D.,
Hounhouigan T, 2003 : les aliments, transformation,
conservation et qualité. Bckhuys Publishers Gmb.
ISBN 90-5782-124-9.
- Rosset R., Beaufort A, 1983
: Des cuisines 4 étoiles. Programmation, conception et
réalisation des locaux de cuisine collective. Paris: LT.S.V: 167-118.
- Rosset R., Lebert F., Bouvier N, 1983 :
L'analyse microbiologique interprétation des résultats.
Informations techniques des services vétérinaires Paris.
- Rosset R., Lebert F., Poumeyrol G., Morelli E, 1983
: Aptitude au nettoyage des matériels utilisés en
restauration collective. I.T.S.V, 235 - 239.
- Roudaut H., Lefrancq E, 2005 : Alimentation
théorique. Wolters Kluwer France, 1629-7954 séries science des
aliments, 283p.
- Rozier J, 1986 :
Qualité hygiénique des aliments. R.T.V.A, (214):7- 12p
- Rozier J., Carlier V., Bolnot F, 1980 :
Plats cuisinés et l'avance R.T.V.A, 6p.
- Rozier J., Carlier V., Bolnot F, 1985 :
Bases microbiologiques de l'hygiène des aliments, S.E.P.A.L.C.
École Nationale Vétérinaire d'alfort, 230P.
- Seydi M., Syllak S., Musabyemyemarya B, 2004 :
Niveau de contamination bactérienne des cuisses de poulets
congelés importés au Sénégal. Revue. RASPA, 2 (3-4)
: 24 1-244
- Shapiro R., Hatheway C., Swerdlow D, 1998:
Botulism in the United States: a clinical and epidemiologic review. Annals
of Internal Medicine 129, 221-227.
- Sharma S., Whiting R, 2005: Methods for
detection of Clostridium botulinum toxin in foods. Journal Food
Prot. 68:1256-1263.
- Silue N, 2005 : Thermorésistance de
trois serotypes de salmonella dans l'oeuf et les gésiers de
poulets. Mémoire DEA Biotechnologies Université Cocody
d'Abidjan.
- Sommar B, 1992 : Etude de l'hygiène
de la restauration collective dans l'armée sénégalaise,
thèse de médecine vétérinaire. Université
cheikh Anta Diop Dakar.
- Stephan S, 2007 : Contribution a
l'étude de la qualité bactériologique des aliments vendus
sur la voie publique de dakar. Université Cheikh Anta Diop De Dakar.
- Stewart G, 1997: Challenging food
microbiology from a molecular perspective. Microbiology. 143: 2099-2108.
- Sylla K, 2000 : Contribution à
l'étude comparée des conditions de réception, stockage et
préparation des denrées alimentaires d'origine animale en
restauration collective :
95
REFERENCES BIBLIOGRAPHYQUE
cas particulier des restaurants du centre des oeuvres
universitaires de Dakar (COUD), Sénégal. Thèse
Médecine Vétérinaire. Dakar ; 2.
- Sylla K., Seydi M, 2003 : Etude de la
qualité hygiénique du poisson utilisé en restauration
collective universitaire à Dakar (Sénégal). Revue
Africaine de Santé et de Productions Animales, RASPA Vol.1 N0 1,
- Tebbutt G 1991: An assessment of cleaning
and sampling méthods for food-contact surfaces in premises preparing and
selling high-risk foods. Epidemiol. Infect. 106: 319-327.
- Udgiri RS et Masali K, 2007 : A Study on
the Health Status of Food Handlers Employed in Food Establishments in Bijapur
City. Indian Journal of Community Medicine, Vol. 32, Issue 2.
- Vallerian S 1999. Contribution à
l'étude de la maîtrise de la qualité hygiénique dans
la restauration rapide. Thèse de doctorat vétérinaire,
Toulouse.
- Vanne L., Karkowski M., Karppinen S and Sjöberg
A 1996: HACCP-based food quality control and rapid detection methods
for microorganisms. Food Control 7: 263276.
- Yasuda T 2010: Food safety regulation in
the United States: An empirical and theoretical examination. In Independent
Review, vol. 15, p. 201-226.
- Yazgi H, 2002: KIA ve Triptofanli Buyyon
Besiyerindeki Biyokimyasal Ozelliklerine Gore Enterik Bakterilerin
Tanmlanmasnda Klasik Yontemlerin Modifikasyonu, Turk Mikrobiyol Cem Derg
32: 260-264.
- Zeru K., Kumie A, 2007 : The sanitary
conditions of food establishments in Mekelle Town, Tigray, North Ethiopia.
Ethiop journal Health Dev ;21(1)
- Zottola E., Sasahara K, 1994: Microbial
biofilms in the food processing industry - Should they be a concern? Int.
Journal Food Microbiol, 23: 125-148.
96
ANNEXES
Annexe 1
Milieu VRBL (Violet Red Bile Lactose)
Composition:
Peptone de viande 7g
Extrait de levure 3g
Lactose 10g
Sels biliaires 2g
Chlorure de sodium 5g
Cristal violet 0.002g
Rouge neutre 0.03g
Agar 18g
Eau distillée 1000 ml pH = 7.3
Préparation :
Dissoudre 45g de la composition précédente dans un
litre d'eau distillée; répartir dans des flacons de 225ml;
autoclaver 15min à 121°C.
Salmonella-Shigella (Gélose SS)
Isolement des Salmonella et des Shigella.
Composition
Peptone: .5,0 g
Extrait de viande .5,0 g
Lactose 10,0 g Citrate de sodium 10,0 g Citrate de fer III
1,0 g Sels biliaires 8,5 g
Vert brillant 3,3 mg
97
ANNEXES
Rouge neuter 25 mg
Thiosulfate de sodium 8,5 g
Agar 12,0 g pH = 7,3 Préparation
63 g de poudre dissous par ébullition.
Se reporter à la notice en raison de variations de la
composition (Formule moins inhibitrice des Shigella à 5,5 g de sels
biliaires par exemple).
Ne pas autoclaver.
Triple sugar iron
Milieu utilisé pour l'identification des
entérobactéries. Il permet de voir si la bactérie est
capable de réduire le sulfate.
Composant
Peptones de caséine 15g
Peptones de viande 5g
Extraits de viande .3g
Peptones de levure 3g
NaCl ...5g
Lactose 10g
Saccharose ...10g
Glucose ..1g
Citrate ammoniacal de Fer (III) .0,5g
Thiosulfate de sodium 0,5g
Rouge de phénol 0,024g
Agar 12g
Citrate de Simmons
Composition
Citrate de sodium ....1,0 g
Bleu de bromothymol 0,08g
Chlorure de sodium .5,0 g
Sulfate de magnésium .0,2 g
Hydrogénophosphate de potassium .1,0 g
98
ANNEXES
Dihydrogénophosphate d'ammonium ..1,0 g
Agar-agar 15,0 g pH = 7,1
Préparation
23 g par litre. Stérilisation classique par autoclavage.
Conditionnement en tubes inclinés.
Gélose Chapman
Il est utilisé pour l'isolement des
Staphylococcus.
Composition
Peptone : 10,0 g
Extrait de viande de boeuf : 1,0 g
Chlorure de sodium : 75,0 g
Mannitol : 10,0 g
Rouge de phénol : 0,025 g
Agar-Agar : 15,0 g
Eau distillée : 1 Litre pH = 7,4
Préparation
111 g par litre de milieu Autoclavage classique.
Bouillon coeur-cervelle
Milieu polyvalent riche utilisé pour la coagulase et la
DNAse des Staphylococcus.Il peut aussi servir dans la recherche de
streptococcocus résistant enteroccocus dans la galerie
de sherman. Composition
Protéose-peptone 10,0 g
Infusion de cervelle de veau ..12,5 g
Infusion de coeur de boeuf 5,0 g
Glucose .2,0 g
Chlorure de sodium ..5,0 g
Hydrogénophosphate de sodium ..2,5 g
pH = 7,4
Préparation
37 g par litre. Stérilisation classique.
99
ANNEXES
Bouillon nutritif
Composition
Tryptone 10,0 g
Extrait de viande 5,0 g
Chlorure de sodium 5,0 g
Eau distillée : 1Litre
pH du milieu prêt-à-l'emploi à 25°C :
7,2 #177; 0,2.
Préparation
Mettre en solution 20,0 g de milieu déshydraté dans
1 litre d'eau distillée ou déminéralisée.
Stériliser à l'autoclave à 121°C
pendant 15 minutes.
100
ANNEXES
Annexe 2
Selon l'arrêté interministériel du 24 Janvier
1998 modifiant et complétant l'arrêté du 23 Juillet 1994
relatif aux spécifications microbiologiques de certaines denrées
alimentaires.
|
PRODUITS
|
N
|
C
|
m
|
|
1. Plats cuisinés à l'avance à base
de viandes et de poissons:
|
|
|
|
|
- Germes aérobies à 30°
|
5
|
2
|
3.105
|
|
- Coliformes
|
5
|
2
|
103
|
|
- Coliformes fécaux
|
5
|
2
|
10
|
|
- Staphylococcus aureus
|
5
|
2
|
102
|
|
- Clostridium sulfito-réducteurs à 46°C
|
5
|
0
|
30
|
|
- - Salmonella.
|
5
|
0
|
absence
|
|
2. Plats cuisinés à base de légumes
produits végétaux crus en saucés:
|
|
|
|
|
-St.aureus -Salmonella.
|
5
5
|
2
0
|
102
absence
|



Photos du matériel de laboratoire utilisé
pour les expérimentations.



Bec bunsen Balance de précision Broyeur
Bain-marie Incubateurs Sachets Stomacher
| 


