II.3 Aspect physique de l'oxydation thermique du silicium
Le Silicium (Si) peut être oxydé thermiquement
comme nous avons fait dans notre travail mais aussi par anodisation
électrochimique et par réaction chimique dans un plasma.
L'oxydation thermique est le procédé le plus important et le plus
utilisé en technologie des dispositifs en silicium.
L'oxydation thermique de Si est réalisée dans
des fours cylindriques entre 900 et 1200 °C par voie
humide dans un flux de vapeur d'eau pure ou par voie sèche dans un flux
d'oxygène pur sec, les flux étant de l'ordre de
10-2 ms-1. Les réactions de base sont
:
Si + O2 - SiO2 (2.1)
Si + 2H2O - SiO2 + 2H2 (2.2)
Néanmoins, le processus d'oxydation est
compliqué. Les paramètres thermiques, géométriques,
et hydrodynamiques doivent être sous contrôle précis.
Pendant l'oxydation, l'interface SiO2-Si se déplace progressivement dans
le silicium en consommant une épaisseur de silicium égale environ
à la moitie de la couche d'oxyde produite (figure II.7). L'oxyde
formé est amorphe avec une structure relativement ouverte propice
à la diffusion de l'espèce oxydante.
eSi épaisseur de Si consommé
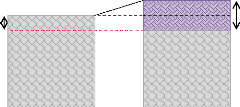
eox épaisseur de l'oxyde formé
Si polycristallin
Figure II.7. Représentation de
l'épaisseur de SiO2 et de Si consommé.
Pour estimer l'épaisseur de Si consommé, tout
d'abord on calcul la masse de celui-ci comme suit :
mSi = dSi VSi = dSi S eSi (2.3)
Ainsi, on peut évaluer la masse de SiO2 formé
à partir du substrat de Si :
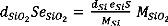
(2.4) - (2.5)
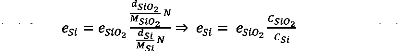
(2.5) - (2.6)
Avec :
dSi : masse volumique de Si égale à 2.33
g/cm3. MSi : masse molaire de Si égale à
28.08 g/mole. dSiO2 : masse volumique de SiO2 égale à
2.3 g/cm3.
MSiO2 : masse molaire de SiO2 égale à
60.08 g/mole. CSi : concentration de Si égale à 5 x
1022 atomes/cm3.
CSiO2 : concentration de SiO2 égale à 2.3
x 1022 molécules/cm3.
N : nombre d'Avogadro égale à 6.023 x
1023. eSi : épaisseur de Si consommé.
eSiO2 : épaisseur de SiO2 formé.
Nous présenterons un modèle cinétique de
l'oxydation thermique qui rend compte de certains mécanismes et
propriétés prédominants. Comme cela est
représenté à la figure II.8, on considère la couche
oxydé en régime de croissance. Elle sépare le milieu
oxydant où la concentration d'équilibre à la surface vaut
C0 de la surface du silicium où la concentration Ci
est déterminée par la diffusion de l'agent oxydant à
travers la couche d'oxyde. Dans le gaz
oxydant, la concentration d'équilibre à la surface
de l'oxyde est proportionnelle à la pression partielle
[29].
Gaz
oxydant oxyde silicium
Concentration C
C0 Ci
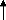
Concentration C
C0
Figure II.8. Représente l'oxydation
thermique du Si : a) modèle cinétique, b) croissance de l'oxyde
thermiquement dans les deux cas limites controlés par respectivement la
réaction de surface et la diffusion.
0 di d épaisseur x

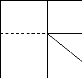
a)
b)
k -* 0 (limité par la réaction de
surface)
D -*0 (limité par la diffusion)
La diffusion des molécules oxydantes à travers la
couche d'oxyde est caractérisée par un coefficient de diffusion
D. pour une épaisseur de couche x, le flux F1
peut s'écrire :
Et en tenant compte de l'hypothèse qu'a l'interface SiO2 -
Si, le taux de réaction est proportionnel aux concentrations des
réactants de sorte que le flux à l'interface s'écrit :
F2 = k Ci (2.8)
Où k est la constante de taux de réaction
chimique de surface pour l'oxydation. A l'état stationnaire, F = F1
= F2 et Ci peut être éliminé :
Le nombre volumique N de molécules de SiO2
dans l'oxyde de silicium vaut 2.2 x 1028 m-3. On
admet que l'on incorpore à chaque molécule de SiO2 une
molécule O2 ou deux molécules H2O. Ainsi, le nombre volumique de
molécules oxydantes N1 dans l'oxyde vaut 2.2 x 1028 m-3
pour l'oxydation sous oxygène sec et le double pour l'oxydation
dans la vapeur d'eau.
L'équation de continuité permet d'écrire
pour le flux oxydant atteignant l'interface oxydesilicium :
C'est une équation différentielle pour le taux
de croissance de la couche d'oxyde. Compte tenu d'une épaisseur d'oxyde
initiale di (due à la formation naturelle sur le silicium), la
solution de l'équation différentielle (2.10) est de la forme :
x2 + Ax = B (t + ô) (2.11)
où A = 2D/k, B = 2DC0/N1 et B/A =
kC0/N1. La constante ô = (di 2 + 2D di/k)Ni/DC0
exprime le changement d'origine de l'échelle de temps qui tient compte
de la couche d'oxyde initiale d'épaisseur di. La solution de
l'équation (2.11) pour exprimer la variation de l'épaisseur de la
couche d'oxyde en fonction du temps est standard.
Deux comportements asymptotiques s'en dégagent et
décrivent le début de l'oxydation. (t petit) d'une part
et la croissance d'une couche d'oxyde déjà épaisse,
(t grand) d`autre part. Pour t petit, le terme
linéaire dans la relation (2.11) est le plus important. La solution est
de la forme :
B/A est appelé constante de taux de croissance
linéaire. L'épaisseur de la couche d'oxyde augmente
proportionnellement au temps de réaction t. la croissance est
limitée par le taux de réaction chimique à l'interface
k. c'est le mécanisme le plus lent (k -)0 dans la
figure II.8. (b)). Pour des couches épaisses, t est grand ; le
terme parabolique dans la relation (2.11) prédomine ; la solution est de
la forme :
Où B est la constante de taux de croissance
quadratique. L'épaisseur de la couche d'oxyde augmente comme la racine
du temps de réaction . C'est la diffusion qui limite la croissance de
l'oxyde (D - 0 dans la figure II.8. (b)).
Dans tous les cas, l'oxydation thermique est un processus
activé thermiquement. La constante de taux de croissance linéaire
dépend de l'orientation cristalline de la surface de silicium
oxydée. L'énergie d'activation de l'ordre de 2 eV pour
l'oxydation sèche et humide est comparable à l'énergie de
la liaison chimique Si - Si qui doit être rompue.
La constante de taux de croissance quadratique est
indépendante de l'orientation de la surface de silicium.
L'énergie d'activation vaut 1,24 eV pour l'oxydation
sèche et 0,71 eV pour l'oxydation humide.
Les propriétés électriques de l'oxyde
thermique produit sous oxygène sec sont supérieures à
celles de l'oxyde fait sous vapeur d'eau. Les oxydes minces, comme les oxydes
de grille, sont donc préparés par oxydation sèche, tandis
que pour les oxydes de champ d'isolation ou de passivation qui exige des
couches d'oxyde épaisse, elles sont faites par voie humide
[29].
| 


