![]()
Il faut maitre en évidence que Les produits
toxiques a effets intentionnels sont de deux sortes : les toxiques
d'origine naturelle tel que les venins, et les toxiques d'origine
anthropogéniques en particulier les pesticides, qui donnent lieu a une
production et a une dissémination de masse. Notre étude va
examiner en premier lieu ces pesticides et leurs toxicités.
Les pesticides, leur mode d'action ainsi que leur
toxicité ont rarement faire l'objet d'une anticipation rationnel sur
l'activité de substances encore non expérimenté sur les
espèces cibles.
La toxicologie a d'abord procédé surtout
par criblages selon les critères d'activité finale de
molécules dont la synthèse a parfois été
effectué pour d'autres raisons, ou comme sous produit d'une autre
fabrication puis au fur et a mesure que des analogies d'action apparaissent
pour des familles chimiques, sur des cibles physiologiques identifiables ,la
recherche s'oriente vers l'analyse des mécanismes moléculaires
qui sous-tendent les fonctions altérées, et progressivement, des
modes d'action caractéristiques des familles définies des
pesticides sont identifiés.
Le principe des relations quantitatives
structure /activité constitue alors une voie de rationalisation de
la recherche appliquée.
La recherche découvre en permanence la
toxicité des pesticides surtout pour ceux utilisés depuis
longtemps.
La biodiversité des espèces et des
règnes conduit probablement a une diversité dans les modes
d'action des pesticides ainsi l'apparition de différents
phénomènes de toxicité environnementale et sanitaire.
Chapitre1. Généralités
1-1-Définition des pesticides :
Les pesticides sont, en terme
générique utilisé pour désigner toutes les
substances naturelles ou de synthèse capables de contrôler,
d'attirer, de repousser, de détruire ou de s'opposer au
développement des organismes vivants (microbes, animaux ou
végétaux) considérés comme indésirables pour
l'agriculture, l'hygiène publique (par exemple les cafards dans les
habitations), la santé publique (les insectes parasites (poux, puces) ou
vecteurs de maladies telles que le paludisme et les
bactéries
pathogènes de l'
eau
détruites par la chloration, la santé vétérinaire,
ou les surfaces non-agricoles (routes, aéroports, voies ferrées,
réseaux électriques...)., ils sont l'un des rares substances qui
sont à la fois toxiques et délibérément
rejetés dans l'environnement [50].
Les pesticides sont présents dans presque tous
les milieux de l'environnement y compris les eaux de surface, les eaux
souterraines, l'air ambiant, la poussière, le sol, le brouillard, la
pluie, et la glace [50].
Les pesticides sont diffusés partout, car les
résidus de pesticides ont été trouvés dans plus de
70 % des fruits et légumes, plus de 60 % des échantillons de
blé et de 99% pour cent de lait, Ils sont également
présents dans les organes de presque tous les adultes et les enfants
[50].
Le terme « pesticide » couvre un
champ plus vaste et général que les expressions
« produit phytosanitaire » ou « produit
phytopharmaceutique » car il englobe tous les produits
destinés à lutter contre tous les dits nuisibles, ou
indésirables (ex : les champignons qui pourraient attaquer une
charpente) et les médicaments vétérinaires destinés
à protéger les animaux domestiques, gibiers ou de compagnie (par
exemple, le collier antipuces pour chien) [50].
1-2-Histoire des pesticides :
Les pesticides ont été reconnus depuis
longtemps :
Ø Dès avant 2500 BCE, les humains ont
utilisé des pesticides pour protéger leurs récoltes. Le
premier pesticide utilisé est par l'époussetage du soufre
élémentaire utilisé dans la Sumeria environ 4500 ans.
Ø Par le 15ème siècle, les produits
chimiques toxiques comme l'arsenic, le mercure et le plomb ont
été appliquées à des cultures pour tuer les
parasites.
Ø Au 17ème siècle, le sulfate de nicotine
a été extrait de feuilles de tabac pour l'utilisation d'un
insecticide.
Ø Le 19ème siècle a vu l'introduction de
deux autres pesticides naturels, pyrèthre, qui est dérivé
de chrysanthèmes, la roténone et qui est dérivé de
la racine des légumes tropicaux.
Ø En 1939, Paul Müller a découvert que le
DDT est un insecticide très efficace. Il est rapidement devenu le plus
largement utilisé des pesticides dans le monde.
Ø Dans les années 1940, les fabricants ont
commencé à produire de grandes quantités de pesticides de
synthèse et leur utilisation s'est généralisée.
Ø Certaines sources estiment les années 1940 et
1950 pour le début de l'ère des pesticides.
Ø L'usage des pesticides a augmenté de 50 fois
depuis 1950 et 2,3 millions de tonnes (2,5 millions de tonnes
impériales) de pesticides industriels sont maintenant utilisés
chaque année.
Ø Soixante-cinq pour cent de tous les pesticides dans
le monde sont utilisés dans les pays développés, mais
l'utilisation dans les pays en développement est de plus en plus
élevée [51].
1-3-Utilisations et sources potentielles
d'émission dans l'environnement :
Tableau1. Utilisations et sources potentielles
d'émission dans l'environnement des principales classes de pesticides
[1,2].
|
Herbicides
|
Insecticides
|
Fongicides
|
Autres
|
|
Glyphosate
|
+
|
|
|
|
|
Acides phénoxycarboniques
|
+
|
|
|
|
|
Acides phtaliques
|
|
|
+
|
|
|
Acylalanines
|
|
|
+
|
|
|
Amides
|
|
+
|
+
|
|
|
Azoles
|
|
|
+
|
|
|
Aryloxyacides
(Phytohormones)
|
+
|
|
|
|
|
Benzilates
|
|
+
|
|
|
|
Benzimidazoles
|
|
|
+
|
|
|
Benzoylurées
|
|
+
|
|
|
|
Carbamates
|
+
|
+
|
+
|
+
|
|
Chloro-acétanilides
|
+
|
|
|
|
|
Cuivre inorganique
|
|
|
+
|
|
|
Cyclodiènes organochlorés
|
|
+
|
|
|
|
Diazines
|
+
|
|
|
|
|
Dicarboximides
|
|
|
+
|
|
|
Dinitroanilines
|
+
|
|
|
|
|
Dithiocarbamates
|
|
|
+
|
+
|
|
Huiles minérales
|
|
+
|
|
|
|
Morpholines
|
+
|
|
|
|
|
Organochlorés
|
|
|
+
|
|
|
Organophosphorés
|
|
+
|
|
|
|
Oxime-carbamates
|
|
+
|
|
+
|
|
Phosphates d'éthyle
|
|
+
|
|
|
|
Pyréthrinoïdes
|
|
|
+
|
|
|
Soufre inorganique
|
|
+
|
|
|
|
Thiocarbamates
|
|
+
|
+
|
|
|
Triazinomes
|
+
|
|
|
|
|
Urées
|
+
|
|
+
|
|
1-4-Les facteurs influençant la toxicité
des pesticides :
Ø La dose.
Ø Les modalités de l'exposition.
Ø Le temps pendant lequel la personne est
exposée.
Ø Le degré d'absorption.
Ø La nature des effets de la matière active et
de ses métabolites.
Ø L'accumulation et la persistance du produit dans
l'organisme.
Ø La "sensibilité" personnelle
(antécédents, patrimoine génétique, etc.)[52].
1-5-Les voies d'exposition aux pesticides :
Les pesticides peuvent être absorbés par
les voies orales cutanées, et respiratoires, les cas d'intoxication les
plus graves se produisent lorsque le produit est ingérer
accidentellement, les enfants sont les plus souvent victimes de ce type
d'intoxication car ils ont tendance à porter les objets et leurs doigts
a la bouche. Mais les adultes qui fument et qui mangent sans s'être
lavés les mains, après avoir manipulé les pesticides,
peuvent être également affecté, chez les utilisateurs des
pesticides, la voie cutanée constitue généralement la
principale voie d'entrée des pesticides dans l'organisme.
On peut être exposés aux pesticides :
Ø Par la consommation d'eau ou d'aliments contenant des
résidus de pesticides.
Ø Par l'inhalation d'un air contaminé, en
particulier à proximité (voire à distance, si la
circulation atmosphérique pousse le nuage) d'un épandage
aérien où l'exposition peut être très importante.
Ø En manipulant des pesticides pour le traitement des
végétaux, au jardin ou à la maison.
Ø Les foetus et les nouveau-nés peuvent
être exposés à la plupart des pesticides à travers
le placenta ou par le biais du lait maternel [20].
Tableau 2. Les principales voies d'exposition aux pesticides
[1,2].
|
Mode d'exposition
(importance relative,
+ à +++)
|
Voie digestive
|
Consommateurs exposés par le
biais des résidus présents dans
l'alimentation (fruits et légumes)
++
|
|
Voie pulmonaire
|
Pénétration dans les poumons
par les poussières émises par
les formulations solides, par les
gouttelettes, brouillards et vapeurs
émis lors des aspersions.
Voie la plus redoutable car les
produits sont acheminés rapidement
au sang par l'intermédiaire de l'air
pulmonaire.
+++
|
|
Voie cutanée
|
Pénétration des produits à travers la
peau accélérée par les formulations
huileuses ou additionnées de
solvants.
Les plaies sont autant de passages
facilités.
+ (+++ applicateur)
|
1-6- Les personnes exposées aux
pesticides :
1-6-1-Les enfants :
Plusieurs études concluent que les enfants sont
plus vulnérables aux pesticides que les adultes, en effet les enfants
sont susceptibles d'être exposer de façons plus importante aux
pesticides en raison des caractéristiques propres de leur physiologie,
ce qui fait en sorte que par rapport aux adultes, et absorbent d'avantages de
pesticides par kilogramme de poids corporelle, de plus leur comportement
exploratoire les porte a voir, toucher sentir et parfois même de gouter
tout ce qui leur tombe des mains [24].
1-6-2-Les agriculteurs :
Les agriculteurs utilisent parfois des doses largement
supérieures à ce qui était autrefois nécessaire.
Certains produits sont normalement interdits, mais utilisés par
dérogation.
La Mutualité Sociale Agricole (MSA) analyse les
cas déclarés auprès de la médecine du travail. Un
manipulateur de produits phytosanitaires sur six est incommodé par leur
utilisation, dans 2 cas sur 3, il s'agit de salariés. Les produits en
cause sont par ordre d'importance :
Ø Des fongicides (32 % des cas),
Ø Des insecticides (30 %),
Ø Des herbicides (19 % des cas).
13% des agriculteurs recensés dans une banque de
données spécialisée indiquent avoir été
hospitalisés après une utilisation de pesticides et 27% d'entre
eux ont dû avoir un arrêt de travail.
L'OMS estime à 1 000 000 le nombre
d'empoisonnements dans le monde et à 20 000 les décès qui
s'ensuivent. Les paysans des pays en voie de développement sont
proportionnellement les plus touchés (Public Health Impact of Pesticides
used in Agriculture - OMS 1989) des produits interdits d'usage dans les pays
industrialisés sont encore vendus dans ces pays. En septembre 2001,
environ 500 paysans qui travaillaient dans des champs de coton, en Inde, sont
morts suite à une forte exposition aux pesticides qu'ils
répandaient. Pour se protéger, ils recouvraient seulement leur
bouche et leur nez d'un bout de tissu (AFP du 31 juillet 2002).
Les symptômes les plus fréquents
concernent les muqueuses (40 % des cas), les voies digestives (24 % des cas),
et respiratoires (20 % des cas).Dans 60 % des cas, l'utilisateur n'était
pas protégé.
Les intoxications les plus graves sont liées
aux insecticides (organophosphorés, carbamates), aux fongicides
(dicarboximides) et herbicides (ammoniums quaternaires et amino-phosphates). Il
s'agit souvent de cas d'intoxication aiguë
Une étude canadienne menée auprès
de 2000 agriculteurs a révélé une association
significative entre le diagnostic d'asthme et l'utilisation de pesticides.
Mais les pesticides peuvent aussi provoquer une
bronchite chronique, un oedème pulmonaire et participer à une
perturbation endocrinienne, à la carcinogenèse.... [53].
1-6-3-Les citoyens :
Les personnes qui habitent à proximité de
vergers traités ont un taux de pesticides dans leurs urines très
augmenté après les épandages, alors qu'ils ne sont pas
allés sur zone et n'ont pas été en contact avec les fruits
traités. On peut donc en conclure que la contamination s'est
effectuée par l'air, via les poumons, et/ou la peau.
Sachant que les pesticides circulent dans
l'atmosphère, quelle que soit notre zone de résidence, il est
impossible de s'y soustraire. Ainsi, par la respiration les pesticides en
suspension dans l'air pénètrent dans les poumons. Même si
on ne sait pas encore évaluer la part des pesticides inhalés par
chacun, la présence chronique de faibles doses dans l'atmosphère
concerne tous les Terriens [53].
1-6-4-Les personnes ayant une susceptibilité
particulière :
Il apparait que de plus en plus de personnes souffrent
d'hypersensibilité aux pesticides en raison d'une exposition importante
ou chronique dans le passé. Si on ne peut pas toujours identifier les
causes de leur problèmes, il n'en demeure pas moins que ces personnes ne
peuvent souvent plus tolérer dans leur environnement la présence
de contaminent.
Des personnes hypersensibles risquent d'être
fortement empoisonnées dans les milieux ou la présence des
pesticides est importante, et même pour les asthmatiques et les personnes
âgées qui sont beaucoup plis fragiles et sensibles aux pesticides
[20].
1-6-5-Les femmes enceintes et leur foetus :
Certains études soulèvent la
possibilité qu'il y est un lien entre l'exposition des femmes enceintes,
et parfois de leurs conjoins a certains pesticides d'usage courant et la
survenue d'anomalies congénitales ou l'augmentation de nombre des
mort-nés.
Des récentes études ont montrés
qu'on peut trouver du 2,4 D dans le sperme d'utilisateur professionnel, ce qui
pourrait augmenter de façon significative l'indice d'avortement
spontanés chez leur conjointe [20].
1-7-Principaux pesticides :
On peut classer les pesticides selon leur mode d'action
: herbicides, insecticides, fongicides...
Ou selon leur composition chimique : carbamates (amides),
organochlorés, triazines...
Ils peuvent être dommageables pour la santé
et l'environnement à cause de leur toxicité, notamment chronique
en cas de persistance et d'accumulation dans les tissus organiques.
9 substances sont listées comme dangereuses
prioritaires selon la DCE 2006, 47 substances sont inscrites au Plan
Interministériel de Réduction des Risques liés aux
Pesticides (PIRRP).
On détermine les principales classes suivantes de
pesticides : les insecticides, les herbicides, les fongicides, les
rodenticides, les molluscicides et les fumigants [1].
Chapitre2. Principales classes
des pesticides
I-Insecticides:
I-1-Définition :
Des produits utilisés pour tuer les insectes et
les animaux par la perturbation des processus vitaux par action chimique. Les
Insecticides peuvent être des produits chimiques organiques ou
inorganiques. La source principale est la fabrication de produits chimiques,
bien que quelques-uns sont issus de plantes [11].
Les insecticides sont classés par leurs
structures chimiques et par leurs modes d'action en plusieurs familles dont on
va citer les plus importantes :
I-2-Classification :
I-2-1-Les insecticides organophosphorés :
Classés parmi insecticides les plus couramment
utilisés aujourd'hui, ils sont utilisés dans l'agriculture,
à la maison, dans les jardins, et dans la pratique
vétérinaire [25].
L'exposition aux même organophosphorés par
de multiples voies ou à plusieurs organophosphorés par de
multiples voies peuvent conduire à de graves toxicités additives
[41].
Il est important de comprendre, cependant, qu'il existe
un large éventail de la toxicité de ces agents et la grande
variation est par l'absorption cutanée, ce qui implique des
identifications spécifiques et de gestion très important
[25].
I-2-1-1-Classification :
I-2-1-1-1-Organophosphorés aliphatiques
: acéphate, déméton, dichlorvos, dicrotophos,
diméthoate, éthion, formothion, malathion, mévinphos,
monocrotophos, naled, ométhoate, phorate, phosphamidon, trichlorfon,ils
sont généralement hautement toxiques et peu stables [54].
I-2-1-1-2-Organophosphorés à cycle
phényl : bromophos, chlorfenvinphos, fénitrothion,
fenthion, fonofos, isofenphos, parathion, parathion éthyl, parathion
méthyl, phosalone, profénofos,
protiophos,ils sont plus stables que le groupe
précédent (meilleure rémanence) [54].
I-2-1-1-3-Organophosphorés à
hétérocycle : chlorpyrifos, diazinon,
étrimfos, isoxation, quinalphos, méthidation, phosmet,des
produits issus de ces 3 groupes sont regroupés ci-dessous selon leur
mode d'action :
I-2-1-1-4-Produits de contact :
bromophos, diazinon, fénitrothion, malathion, dichlorvos, fonofos,
parathion, phosmet, profénofos, téméphos,
hepténophos, mevinphos, trichlorfon, phosalone [54].
I-2-1-1-5-Produits systémiques
: diméthoate, formothion, isofenphos, triazophos,
monocrotophos, ométhoate, phosphamidon, thiométon, vamidothion
[54].
I-2-1-2-Quelque substances de la famille:
Tableau 3. Présentation de quelques substances
organophosphorés [5].
|
Quelques substances de la famille
|
N° CAS
|
Code SANDRE
|
Molécule
|
Produits de dégradation
|
|
Chlorfenvinphos
|
470-90-6
|
1464
|
|
|
|
Chlorpyrifos-éthyl
|
2921-88-2
|
1083
|
|
3, 5, 6-trichloro-2-pyridinol (TCP)
|
|
Malathion
|
121-75-5
|
1210
|
|
malaoxon
|
|
Parathion (éthyl)
|
56-38-2
|
1232
|
|
paraxon
|
|
Parathion (méthyl)
|
Parathion (méthyl)
|
1233
|
|
|
I-2-1-3-Utilisations et sources potentielles
d'émission dans l'environnement :
I-2-1-3-1-Organophosphorés :
Consommation de 5 000 T/an dans l'U.E. (1996).
I-2-1-3-2-Chlorpyrifos-éthyl :
Maïs, traitement du sol dont 1200 T/an en France.
I-2-1-3-3-Parathion : Insecticide de
contact, traitement des sols et des parties
I-2-1-3-4-Chlorfenvinphos :
Mélange de deux isomères (E) et (Z) ; utilisé sur les
aériennes des végétaux.
I-2-1-3-5-Malathion :
Non-systémique, insecticide et acaricide [5].
I-2-1-4-Mode d'action des
organophosphorés :
Ce sont des esters de l'acide phosphorique ou de
l'acide thiophosphorique, représentés respectivement par le
dichlorvos et la parathion, cette famille d'insecticides a pour cible
principale les acétylcholinestérases (toute espèces
vivantes confondues) dont elle inhibe irréversiblement
l'activité. Toute fois le mode d'action des organophosphorés est
plus complexe, et d'autres effets son régulièrement
découvert, qui sont souvent liés au premier. Pour le principal
effet c'est une Action toxique liée à l'inhibition des
cholinestérases, enzymes présentes au niveau du SNC, muscles,
globules rouges et plasma. Leur rôle est de détruire
l'acétylcholine, libérée lors du passage de l'influx
nerveux, L'enzyme est essentielle au contrôle normal de la transmission
des impulsions nerveuses à partir de fibres nerveuses et musculaires
lisses des cellules, les cellules glandulaires, ainsi que dans le
système nerveux central (SNC) [25].
La perte de l'enzyme permet l'accumulation de l'ACh
périphériquement au jonctions neurofacteurs (effets
muscariniques), au niveau des jonctions nerf-muscle, ganglions et autonome
(effets nicotiniques), ainsi centralement au niveau des jonctions nerveuses
cholinergiques avec les muscles lisses et des cellules de la glande, la
concentration élevée de ACh provoque la contraction musculaire,
aussi l'excès d'ACh peut être excitatrices (cause secousses
musculaires), mais aussi d'affaiblir ou de paralyser la dépolarisation
de la cellule par la fin de la plaque [41].
L'accumulation de l'acétylcholine qui provoque
l'intoxication, les concentrations actives sur les
acétylcholinestérases (exprimés par la constante
d'inhibition ki) se traduisent en dernier lieu par des mortalités (DL50)
dont les valeurs ne leur sont pas nécessairement
corrélées. Chez les insectes, les valeurs de ki sont de l'ordre
10à-3 à 10à-5M, et les DL50 de l'ordre de 1 à
3mg /kg, parmi les autres effets connus on figure la charge des
neuro-hormones [25].

Figure 1. Mode d'action des
antichloinestérases [1].
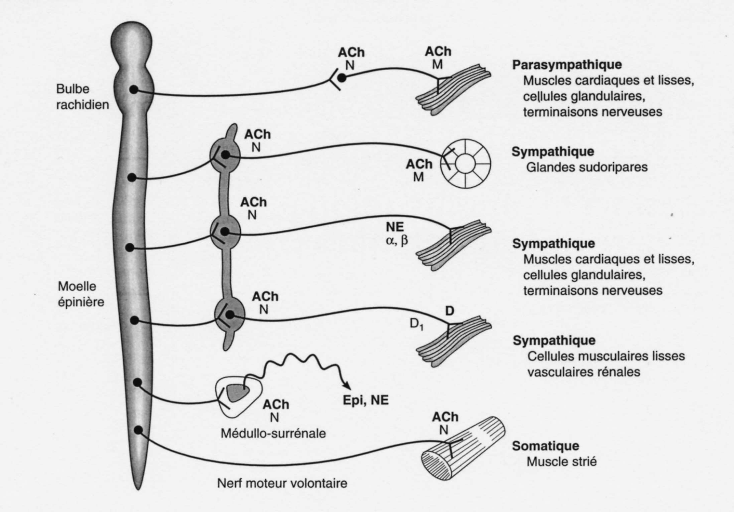
Figure 2. Fonctions de
l'acétylcholine [1].
I-2-1-5-Données toxicologiques et
normes :
Tableau 4. Données toxicologiques et normes pour
quelques insecticides organophosphorés [5].
|
Caractéristique
|
Chlorfenvinphos
|
Chlorpyrifos-éthyl
|
Malathion
|
Parathion
|
|
Toxicité
|
|
|
|
|
|
DL50
|
rat 15 mg/kg pc
lapin >300 mg/kg pc
|
rat 66-195 mg/kg pc
caille 13 mg/kg pc
moineau 122 mg/kg pc
|
perdrix 601 mg/kg pc
rat 1375-2800 mg/kg pc
|
rat
éthyl 4 mg/kg pc
|
|
Toxicité sublétale
|
|
|
|
|
|
DJA (OMS)
|
0,0005 mg/kg pc/j
|
0,01 mg/kg pc/j (EU)
|
0,02 mg/kg pc/j
|
éthyl 0,005 mg/kg pc/j
|
|
DHA (JEFCA)
|
|
|
|
|
|
Ecotoxicité
|
|
|
|
|
|
CE50
|
algue (96h) : 1600 ug/L
daphnie (48h) : 0,1 ug/L
crevette (48h) 250ug/L
huître 4j 600 ug/L
poisson 2,8 ug/L
|
algue 46 ug/L
daphnie 0,014 ug/L
anguille (96h) : 0,54 ug/L
|
algue 4060 ug/L
daphnie 0,5 ug/L
mollusque 1,7 ug/
poisson 4,1 ug/L
|
|
|
NOEC
|
algue 246 ug/L
daphnie 21j : 0,1 ug/L
moule 4j : 7600 ug/L
truite 21j : 38 ug/L
|
algue 27 ug/L
daphnie 0,056 ug/L
crevette 35j : 0,0046 ug/L
poisson 0,14 ug/L
|
algue 811 ug/L
0,06 ug/L
poisson 21 ug/L
|
méthyl :
algue 830 ug/L
daphnie 0,166 ug/
poisson 12 ug/L
|
|
PNEC eau douce
|
0,1 ug/L
|
0,033 ug/L
|
0,006 ug/L méthyl
|
0,0166 ug/L
|
|
PNEC eau marine
|
0,1 ug/L
|
0,033 ug/L
|
|
|
|
PNEC sédiment
|
|
|
|
|
|
Normes et seuils
|
|
|
|
|
|
NQEp eau surface intérieure
|
néant
|
néant
|
néant
|
néant
|
|
NQEp eau de transition
|
néant
|
néant
|
|
|
|
NQEp eau marine
|
néant
|
néant
|
|
|
|
Baignade et loisirs
|
néant
|
néant
|
néant
|
néant
|
|
Norme sol
|
néant
|
néant
|
néant
|
néant
|
|
Rejets
(VL émission/j)
|
néant
|
néant
|
néant
|
néant
|
I-2-1-6-Exposition humaine et risques pour la
santé :
Tableau 5. Exposition humaine aux quelques insecticides
organophosphorés et risque pour la santé [5]
|
|
Chlorfenvinphos
|
Chlorpyrifos-éthyl
|
Malathion
|
Parathion
|
|
Mode
d'exposition
(importance
relative,
+ à +++)
|
Voie digestive
|
++
Résidus présents dans l'alimentation
|
|
Voie pulmonaire
|
+++
Pénétration dans les poumons lors de
l'épandage ou l'aspersion
|
|
Voie cutanée
|
+++
Pénétration à travers la peau
accélérée par les formulations huileuses ou comportant des
solvants
|
|
Organes
et/ou
fonction
atteints
|
|
troubles visuels, asthme, nausées, vomissements,
diarrhée, asthénie, hyper salivation, sueurs, fasciculation
musculaire, tachycardie, atteintes nerveuses
périphériques
|
I-2-1-7- Symptômes de toxicité :
1-Nausées, vomissements, diarrhées.
2-Myosis, bradycardie et hypotension, dyspnée
asthmatiforme, paralysie permanente des muscles respiratoires.
3-Tachycardie, hypertension.
4-Coma convulsif, paralysie des centres respiratoires.
5-Neuropathies périphériques (dysfonctionnement
musculaire : faiblesse musculaire)
6-Modifications du comportement, affectivité,
mémoire et vigilances [6].
I-2-1-8-Voies d'exposition :
Les organophosphorés sont efficacement
absorbés par inhalation, ingestion, et par pénétration a
travers la peau, il ya des différences considérables on comparant
l'absorption de ces différents itinéraires. Par exemple, la DL 50
du parathion par voie orale chez le rat est de 3-8 mg / kg, ce qui est
très toxique, et essentiellement équivalente à
l'absorption cutanée par une DL50 qui est de 8 mg/kg. D'autre part, la
toxicité du phosalone est beaucoup plus bas par voie cutanée
(avec une DL50 de 1500 mg / kg) que par la voie orale (avec une DL50 de 120 mg
/ kg), en général, les agents hautement toxiques sont plus
susceptibles d'avoir élevé la toxicité cutanée par
rapport aux agents modérée toxiques [5].
I-2-2-Insecticides carbamates :
Ce sont des esters de l'acide
N-méthylcarbamique COH(O) NH2, largement utilisés dans les
maisons, les jardins, et de l'agriculture, les carbamates varient dans leur
spectre d'activité, dans la toxicité pour les mammifères
et aussi leur persévérance [11].
Les carbamates sont utilisés comme des
pulvérisations pour tuer les insectes en affectant leur cerveau et leur
système nerveux. Ils sont utilisés sur les cultures et à
la maison pour tuer les coquerelles, les fourmis, les puces, les criquets, les
pucerons, l'échelle, les aleurodes, les dentelles et farineux. Certains
carbamates dans le contrôle des moustiques. Certains carbamates sont
trouvés dans l'eau souterraine à des niveaux suffisamment
élevés pour susciter des préoccupations [25].
Ils agissent en inhibant l'AchE, mais leur effets sur
l'enzyme sont beaucoup plus facilement réversible que ceux des
organophosphorés, parmis les insecticides de cette famille, on peut
citer le carbaryl (sevin), l'aldicarbe (temik), le carbofuran, le methomyl et
le propxur (baygon) [11].
I-2-2-1-Classification :
I-2-2-1-1-les méthyl carbamates à
structure cyclique phényl: Aminocarbe, BPMC, carbaryl,
isocarbe, isoprocarbe (MICP), methiocarbe, metolcarbe (MTMC), mexacarbe,
promecarbe, propoxur .
I-2-2-1-2-les méthyl et dimethyl carbamates
à structure hétérocyclique: Bendiocarbe,
carbofuran, dimetilan, dioxacarbe, pirimicarbe .
I-2-2-1-3-Les méthyl carbamates à
chaîne alliphatique: Aldicarbe, methomyl, oxamyl,
thiodicarbe .
Exemples : Benfuracarbe, diallate, dimétan,
éthiophencarbe, fénoxycarbe, formetanate, formetanate
hydrochloride, mercaptodimethur, thiofanoxe [54].
I-2-2-2-Quelques substances de la famille:
Tableau 6. Présentation de quelques substances de la
famille des carbamates [1].
|
Quelques substances
de la famille
|
N° CAS
|
Code SANDRE
|
Molécule
|
Métabolites
|
|
Aldicarbe
|
116-06-3
|
1102
|
|
Aldicarbe sulfoxyde
Aldicarbe sulfoné
|
|
Carbendazime
|
10605-21-7
|
1129
|
|
2-aminobenzimidazole
|
|
Carbofuran
|
1563-66-2
|
|
|
1130
|
|
Méthomyl
|
16752-77-5
|
1218
|
|
|
|
Triallate
|
2303-17-5
|
1281
|
|
|
I-2-2-3-Utilisations et sources potentielles
d'émission dans l'environnement :
I-2-2-3-1-Aldicarbe : Insecticide et
nématocide à usage agricole. Autorisé pour le traitement
des sols de certaines cultures (pépinières, cultures florales,
betteraves, bananiers).
I-2-2-3-2- Carbendazime : Fongicide
sur céréales, légumes, colza.
I-2-2-3-3-Carbofuran : Insecticide et
nématocide.
I-2-2-3-4-Méthomyl:
Insecticide.
I-2-2-3-5-Triallate: Herbicide.
I-2-2-3-6-Manèbe : Fongicide
[1]
I-2-2-4-Mode d'action des carbamates :
L'une des principales cibles des carbamates est
l'activité acétyl cholinesterasique, comme pour les
organophosphorés, mais de manière moins puissante puisque dans ce
cas , le complexe carbaryl-enzymatique est hydrolysable avec libération
de CO2, le methyl amine et de l'enzyme régénérer, on
observe donc les mêmes sortes de perturbations neuro-hormonales que pour
les organophosphorés, mais le degrés d'inhibition est
atténué en proportion de la vitesse de
régénération de l'enzyme, la conformation des dimension
des molécules a la topologie du site actif de l'enzyme est
déterminante pour l'obtention d'une haute activité
anti-cholinestérasique, alors le mode d'action des insecticides
carbamate est très similaire à celui de la insecticides
organophosphorés car ils inhibent les enzymes cholinestérase.
Cependant, ils diffèrent dans l'action de la organophosphorés
composés que l'effet inhibiteur sur le cholinestérase est
brève [25].
L'inversion de l'effet des carbamates est tellement
rapide que les mesures du cholinestérase dans le sang des êtres
humains ou d'autres animaux exposés à des carbamates sont
susceptibles d'être inexactes et toujours dans la direction de
l'apparence de la normale [11].
Pour évaluer l'exposition aux carbamates, il est
nécessaire que l'échantillon du sang est recueilli dans la
même journée que l'exposition a eu lieu et que l'analyse est
effectuée dès que possible afin de minimiser tout inversion de
l'échantillon recueilli [41].
Dans les insectes, les effets des carbamates sont
principalement celles de l'empoisonnement du système nerveux central
où les réactions sont cholinergiques pensé à
prendre place. Toutefois, l'insecte n'est pas la jonction neuromusculaire
cholinergique, comme il l'est chez les mammifères [25].
Quelques exemples d'activités de carbamates sont
indiqués dans le tableau suivant :
Tableau 7. Mode d'action de quelques insecticides carbamates
[25].
|
Composés
|
Effets
|
|
Carbamates en général
|
Inhibition des AchE eb milieu marin
|
|
Carbaryl associé a des organo-phosphorés
|
Hypocalcémie aux dose DJA
|
|
Carbofuran
|
Embryotoxicité a 0.2mg /kg
|
|
Carbaryl
|
Action sur les récepteurs AhR des TCDD
|
|
Carbaryl-thirame
|
Altération de la composition en acides aminés
de cerveau (dose sublétales)
|
|
Méthomyl (Lannate)
|
Génotoxique chez Vicia faba
|
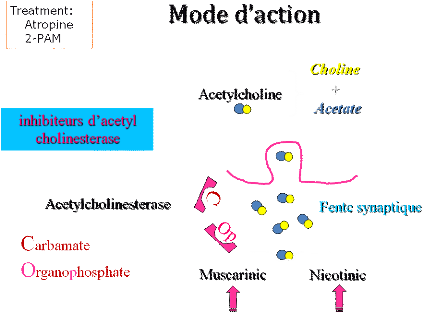
Figure 3. Mode d'action des insecticides inhibiteurs
de l'acétyl cholinestérase (organophosphorés, carbamates)
[32].
I-2-2-5-Données toxicologiques et
normes :
Tableau 8. Données toxicologiques et normes pour
quelques insecticides carbamates [1].
|
Caractéristique
|
Aldicarbe
|
Carbendazime
|
Carbofuran
|
Méthomyl
|
Triallate
|
Manèbe
|
|
Toxicité
|
|
|
|
|
|
|
|
DL50
|
rat
0,3-0,9 mg/kg pc
poulet 9 mg/kg pc
|
rat 6400 mg/kg
pc
|
rat 8 mg/kg pc
chien 15 mg/kg
pc
canard
0,24 mg/kg pc
|
chien 20 mg/kg pc
rat
17-23 mg/kg pc
colombe
10 mg/kg pc
|
rat 1100 mg/kg pc
|
rat >5000 mg/kg pc
canard
> 1500 mg/kg pc
|
|
Toxicité sublétale
|
|
|
|
|
|
|
|
DJA (OMS)
|
|
|
0,002 mg/kg
pc/j
|
0,03 mg/kg pc/j
|
|
|
|
DHA (JEFCA)
|
|
|
|
|
|
|
|
Ecotoxicité
|
|
|
|
|
|
|
|
CE50
|
algue 96h >50 mg/L
daphnie (48h)
0,2-0,4 mg/L
crevette (96h)
0,02-0,07 mg/L
truite (96h) :
0,6 mg/L
truite 21j : 0,6 ìg/L
|
algue 72h
300 mg/L
daphnie (96h)
891 mg/L
truite (96h)
0,8 mg/L
|
algue 20 mg/L
daphnie (48h)
0,02-0,04 mg/L
truite (96h)
0,1-1 mg/L
|
algue 60 mg/L
daphnie (48h)
0,03mg/l daphnie 21j :
16-35 ìg/L
truite 3,4 mg/L
|
algue 0,12 mg/L
daphnie
0,09 mg/L
truite 96h
1,2 mg/l
|
algue 0,01 mg/L
daphnie
0,52mg/L
poisson
0,27 ìg/L
|
|
NOEC
|
|
Invertébrés
0,03 mg/L
|
|
|
|
|
|
PNEC eau douce
|
|
0,15 ìg/L
|
|
|
|
7 ìg/L
|
|
PNEC eau marine
|
|
|
|
|
|
|
|
PNEC sédiment
|
|
|
|
|
|
|
|
Normes et seuils
|
|
|
|
|
|
|
|
NQEp eau surface intérieure
|
néant
|
néant
|
néant
|
néant
|
|
|
|
NQEp eau de transition
|
néant
|
néant
|
|
|
|
|
|
NQEp eau marine
|
néant
|
néant
|
|
|
|
|
|
Rejets
(VL émission/j)
|
néant
|
néant
|
néant
|
néant
|
néant
|
Néant
|
I-2-2-6- Exposition humaine et risques pour la
santé :
Tableau 9. Exposition humaine aux quelques insecticides
carbamates et risques pour la santé [1].
|
|
Aldicarbe
|
Carbendazime
|
Carbofuran
|
Méthomyl
|
Triallate
|
Manèbe
|
|
Mode
d'exposition
(importance
relative,
+ à +++)
|
Voie digestive
|
+++
|
++
|
+++
|
++
|
-
|
++
|
|
Voie pulmonaire
|
+++
|
+++
|
+++
|
+++
|
+++
|
+++
|
|
Voie cutanée
|
++++
|
+
|
+
|
+
|
+
|
+++
|
|
Organes
et/ou
fonctions
atteints
|
Irritants par voie cutanée ou inhalation.
Troubles visuels, gêne respiratoire, asthénie,
troubles digestifs, faiblesse musculaire. Les carbamates
insecticides sont dangereux et touchent plus
particulièrement le système nerveux. Exemple :
Aldicarbe : troubles digestifs, asthénie, myosis, hyper
lacrymation, sueurs profuses, mictions involontaires,
bradycardie, hypotension, dyspnée, douleurs
thoraciques, crampes musculaires, mouvements involontaires,
troubles respiratoires, troubles neurologiques.
|
I-2-2-7- Symptômes de toxicité :
Comme les organophosphorés les intoxications, les
signes et les symptômes se fondent sur la stimulation excessive
cholinergique. Contrairement à l'intoxication organophosphorés,
l'intoxication par les carbamate tende à être de plus courte
durée, car l'inhibition du tissu nerveux AChE est réversible, et
les carbamates sont plus rapidement métabolisés. Pour des
symptômes de toxicité on peut citer :
Ø Début des symptômes : Maux de
tête, salivation, nausées, vomissements, douleurs abdominales, et
diarrhée sont souvent importantes. incoordination musculaire, secousses
musculaires, troubles de l'élocution et sont signalés.
Ø La dépression, qui se manifeste par le coma,
convulsions et hypotonie, et effets nicotiniques.
Ø L'hypertension et dépression
cardio-vasculaire. Dyspnée, bronchospasme, Malaise, faiblesse
musculaire.
Ø Des étourdissements et la transpiration sont
fréquemment signalés.
Ø Les saisies de bradycardie sont moins
fréquentes que dans les intoxications par les organophosphorés
[7].
I-2-2-8-Voies d'exposition:
Les carbamates sont absorbés par inhalation et par
ingestion et quelque peu par pénétration à travers la
peau, même si celle-ci tende à être la voie la moins
toxique. Pour ainsi, le carbofuran a une DL 50 par voie orale pour le rat de
5mg/kg, comparativement à une DL50 de 120 mg / kg par voie
cutanée, ce qui fait que l'ingestion par voie orale est d'environ 24
fois plus toxique que la voie cutanée [7].
I-2-3-Insecticides organochlorés :
Ils comprennent des dérivés de l'Ethane,
des Cyclodiénes et les hexachlorocyclohexane, l'un de ces produits (par
exemple le DDT ont été introduits dans les années 40 et
largement utilisés en agriculture et dans les programmes de lutte
sanitaire, en raison de leur toxicité relativement faible et de leur
persistance, qui autorisent un nombre d'applications plus réduits, cette
persistance fut bientôt reconnue comme un inconvénient plus que
comme un avantage. Le Méthoxychlore et le DDT sont des
dérivés chlorés de l'Ethane, Mais le Methoxychlore est
beaucoup moins toxique et moins persistant que le DDT.
L'Endrine insecticide Cyclodiéne, est
extrêmement toxique, l'Adrine et le dieldrine le sont moins et le
chlordane l'Heptachlore et le Mirex encore moins, le Lindane isomère
gamma de l'hexachlorocyclohexane (HCH) est encore utilisés actuellement,
car il s'accumule moins que les autre isomères [11].
I-2-3-1-Classification :
I-2-3-1-1-Groupe du DDT :
DDD, DDT, Perthane, Métoxychlore, Dicofol0
I-2-3-1-2-Groupe du HCH : Lindane.
I-2-3-1-3-Groupe du chlordane :
Chlordane, Heptachlore, Aldrine, Dieldrine, Endrine, Chlordécone,
Perchlordécone, Diénochlore [37].
I-2-3-2-Quelque substances de la famille:
Tableau 10. Quelques substances de la famille des
organochlorés [2].
|
Quelques substances de la famille
|
Abréviation ou
synonyme
|
N° CAS
|
Code SANDRE
|
Molécule
|
Exemples de
produits de
dégradation
|
|
Endosulfan alpha
|
Endosulfan.a
|
959-98-8
|
1178
|
|
endosulfan diol
sulfate d'endosulfan
|
|
Endosulfan bêta
|
Endosulfan.b
|
33213-65-9
|
1179
|
|
|
Hexachlorocyclo-hexane gamma
|
HCH gamma, Lindane
|
58-89-9
|
1203
|
|
|
|
Dichloro diphényl trichloréthane op'
|
DDT op'
|
789-02-6
|
1147
|
|
DDD op 1143
DDE op 1145
|
|
Dichloro diphényl trichloréthane pp'
|
DDT pp'
|
50-29-3
|
1148
|
DDD pp 1144
DDE pp 1146
|
|
Hexachloro-benzène
|
HCB
|
118-74-1
|
1199
|
C6H6
|
|
I-2-3-3-Utilisations et sources potentielles
d'émission dans l'environnement :
I-2-3-3-1-DDT : Autrefois
commercialisé en mélange de deux isomères,
différant par la position d'un atome de chlore (DDT pp et DDT op).
Interdit depuis 1987 en agriculture.
I-2-3-3-2-Lindane : 1396 T. de
substance active utilisées en 1997. Interdit en grande culture depuis
1998. Interdiction totale d'utilisation et de production prévue fin
2007.
I-2-3-3-3-Endosulfan : production
européenne en 2005, 4000 T. Utilisation en France en 1999, 70,8 T.
Synthétisé en mélange de deux isomères : endosulfan
alpha et endosulfan bêta.
I-2-3-3-4- HCB : produit par
combustion de transports routiers et fumées d'incinération de
déchets (18 kg en France en 2005) [2].
I-2-3-4-Mode d'action des organochlorés:
Depuis le DDT prototype de la série, les
organochlorés comportent une variété de molécules
aux structures hétérogènes, le tableau suivant
résume un ensemble non exhaustif de propriétés
communément reconnues [25].
Tableau 11. Mode d'action de quelques insecticides
organochlorés [25].
|
Composés
|
Cibles
|
|
Endrin, dieldrin
|
Lésions des cellules neurosecretrices
|
|
DDT
|
Conduction nerveuse Ca++dépendante
Activation de la tyrosine décarboxylase thymuline avec
déficit immunitaire et vulnérabilité a l'infection virale
(phoques)
Surcharge de l'AMPc et GMPc
|
|
ã -HCH
|
Lésions des cellules neurosecrétrices
|
|
Et ä-HCH
|
Altération de la synthese de phosphtidyl inositol,et
libération de l'acetyl choline
|
|
toxaphene
|
Surcharge en AMPc et GMPc
|
Les isomères de l'hexachlorocyclohexane (HCH)
sont des analogues structuraux de ceux de l'inositol (hexa hydroxy
cyclohexane), ce qui justifie leur interaction avec les
phénomènes neuro-hormonaux de localisation membranaire, les
familles des organochlorés constitue, toute fois, un ensemble
hétérogène ,qui s'étend a d'autres
organo-halogénés(bromés, iodés...)[41].
Les mécanismes moléculaires d'action ont
été plus clairement analysés pour le DDT et ses analogues
que pour les autres organochlorés, des relations quantitatives
structure/activités ont été établies pour plus
d'une dizaine de substituant sur le carbone tertiaire ou sur les cycles, en
position para, avec pour variables de structures les volumes de Van Der Waals
ou des indices de lipophilicité, sous certaines contraintes de
conditions stériques [41].
Le DDT est banni depuis les années 1970, en
particulier en raison de sa trop grande persistance dans la nature, et de ses
facultés de bioaccumulation dans les tissus adipeux animaux et humains,
progressivement, les autres organochlorés sont également
retirés du marché, bien qu'une utilisation plus au moins
clandestine subsiste pour tous les composants de la famille: l'étude de
leur mécanismes d'action n'a donc pas été aussi
approfondie, parmi les données récentes, trois mécanismes
sont confirmés, sans avoir donné de relations quantitatives
exploitables :
Ø La fixation des dérivés alicycliques
sur le site de la picrotoxine du canal ionophore du chlore, ce qui inhibe le
flux d'ions Cl- dans le nerf.
Ø La fixation sur un autre site commun aux
barbituriques et benzodiazépines.
Ø L'altération du fonctionnement de la
transmission dans le sens de l'arrêt de l'excitation se traduit par un
phénomène d'hyper excitation [25].
I-2-3-5-Données toxicologiques et
normes :
Tableau 12. Données toxicologiques et normes pour
quelques insecticides organochlorés [2].
|
Caractéristique
|
Endosulfan
|
Lindane
|
DDT
|
HCB
|
|
Toxicité
|
|
|
|
|
|
DL50
|
rat 50 mg/kg pc
lapin 360 mg/kg pc
|
veau 5 mg/kg pc
rat 88-300 mg/kg pc
lapin 30-200 mg/kg p
|
|
|
|
Toxicité sublétale
|
|
|
|
|
|
DJA (OMS)
|
0,006 mg/kg pc/j
|
0,01 mg/kg pc/j
0,001 mg/kg pc/
|
0,02 mg/kg pc/j
|
|
|
DHA (JEFCA)
|
|
|
|
|
|
Ecotoxicité
|
|
|
|
|
|
CE50
|
algue 72h > 560 ìg/L
gammare 96h 5,8 ìg/L
crevette 72h 0,04 ìg/L
truite 96h 0,3 ìg/L
|
algues 780 ìg/L
daphnie (24h) 645 ìg/L
invertébrés marins
0,17 ìg/L
truite (96h) 1,7 ì/L
|
espèces aquatiques
0,35-1 ìg/L
daphnie (48h) 1,1 ìg/L
crevette 0,4 ìg/L
saumon (96h) 0,004 ìg/L
|
algues eau douce 10 ìg/L
invertébrés eau douce 4,7 ìg/L
invertébrés eau marine 4,7 ìg/L
poissons eau douce 7 ìg/L
|
|
PNEC eau douce
|
0,005 ìg/L
|
0,02 ìg/L
|
|
0,013 ìg/L
|
|
PNEC eau marine
|
0,0005 ìg/
|
0,002 ìg/L
|
|
L 0,013 ìg/L
|
|
PNEC sédiment
|
|
rivière 10 ìg/kg ps
mer 1,1 ìg/kg ps
|
|
16,9 ìg/kg ps
|
|
Normes et seuils
|
|
|
|
|
|
NQEp eau surface intérieure
|
0,005 ìg/L
|
0,1 ìg/L
|
DDT total 0,025 ìg/L
DDT pp 0,01 ìg/L
|
0,03 ìg/L
|
|
NQEp eau de transition
|
0,005 ìg/L
|
0,02 ìg/L
|
DDT total 0,025 ìg/L
DDT pp 0,01 ìg/L
|
0,03 ìg/L
|
1-2-3-6- Exposition humaine et risques pour la
santé :
Tableau 13. Exposition humaine aux quelques insecticides
organochlorés et risques pour la santé
[2].
|
|
Endosulfan
|
Lindane
|
DDT
|
HCB
|
|
Mode
d'exposition
(importance
relative,
+ à +++)
|
Voie digestive
|
+
|
++
|
+++
|
+
|
|
Voie pulmonaire
|
+
|
+
|
-
|
+
|
|
Voie cutanée
|
+
|
+
|
-
|
-
|
|
Organes
et/ou
fonctions
atteints
|
|
Système nerveux
Malaises, nausées
|
Système nerveux
Vomissements, diarrhées, perte
de sommeil, allergies, paralysies
|
Système nerveux
|
Porphyrie entraînant des
lésions cutanées
|
I-2-3-7- Symptômes de toxicité :
Les insecticides organochlorés sont des
molécules très lipophiles. Les différents
organochlorés s'accumulent ainsi dans les tissus riches en graisses des
organismes vivants (tissu adipeux, foie, système nerveux central) et
sont lentement éliminés (lorsque on cesse toute exposition). Ils
passent dans le lait (conséquence de la mobilisation des graisses),
franchissent la barrière placentaire et peuvent être, par cette
voie, retrouvés chez le foetus [26].
I-2-3-7-1-Toxicité
aiguë :
Du point de vue de leur toxicité aiguë, les
insecticides organochlorés produisent une stimulation du système
nerveux central, entraînant des convulsions épileptiformes, des
changements de comportement, une perturbation de l'équilibre des
sensations, la dépression de centres vitaux, spécialement ceux
contrôlant la respiration. A plus fortes doses, des nausées et des
vomissements peuvent apparaître [26].
I-2-3-7-2-Toxicité
chronique :
De nombreux effets ont été décrits
chez l'homme et/ou chez l'animal mais leur signification à long terme
est incertaine. Par exemple, des modifications paroxystiques
électro-encéphalographiques chez des travailleurs chroniquement
exposés à ces substances ont été signalées.
A plus fortes doses, des troubles neurologiques centraux (tremblements,
convulsions) et périphériques (polynévrite, allongement
des vitesses de conduction nerveuses) ont également été
reportés, ainsi que des altérations biologiques au niveau du
foie, telles l'induction d'enzymes microsomales et la prolifération du
réticulum endoplasmique lisse. Certains pesticides organochlorés
peuvent induire chez l'animal des troubles de la reproduction [26].
I-2-3-8-Voies d'exposition:
À des degrés divers, les organochlorés
sont absorbés dans l'intestin et aussi par les poumons et à
travers la peau, l'efficacité de l'absorption cutanée est
variable. Hexachlorocyclohexane, y compris le lindane, les cyclodienes
(aldrine, dieldrine, endrine, chlordane, heptachlore), et l'endosulfan sont
absorbés de manière efficace à travers la peau, tandis que
l'efficacité d'absorption cutanée du DDT, le dicofol, marlate,
toxaphène, mirex sont sensiblement faible. Le Lindane est
documenté par un taux de 9,3% d'absorption cutanée, et il est
absorbé de façon plus efficace, même à travers la
peau abrasée [1].
I-2-4-Les insecticides
organo-chloro-phosphorés :
Sans constituer une véritable famille
séparée, certains composés présentent une structure
intermédiaire entre celle des organophosphorés et celle des
organochlorés, ces composés présentent des
activités anti-cholinestérasiques utilisées dans la lutte
contre les insectes, les acariens, et les vers parasites (les helminthicides,
nématocides) [11].
I-2-4-1-Classification :
I-2-4-1-1-Les acaricides :
Un acaricide est une substance active ou une
préparation phytopharmaceutique ayant la propriété de tuer
les acariens présents dans les cultures fruitiers, la viticulture, les
cultures du houblon et les cultures des plantes d'ornement [13].
I-2-4-1-1-1-Quelques classes des
acaricides :
Tableau 14. Quelques classes des acaricides [28].
I-2-4-1-1-2-Formules chimiques de quelques
acaricides :
Tableau 15. Formules chimiques de quelques acaricides [6].
|
Substance
|
Formule chimique
|
Structure chimique
|
|
aldicarb
|
C7H14N2O2S
|
|
|
dinex
|
C12H14N2O5
|
|
|
amitraz
|
C19H23N3
|
|
|
fluazuron
|
0H10Cl2F5N3O3
|
|
I-2-4-1-1-3-Mode d'action des
acaricides :
En protection des cultures, 28 substances actives
acaricides sont homologuées et commercialisées, 13 sont
classées comme spécifiques, les 15 non spécifiques (dont 4
utilisées pour le seul traitement des denrées stockées)
étant essentiellement des insecticides neurotoxiques. Appartenant
à I7 familles chimiques, elles agissent avec 12 modes d'action
différents [55].
Les acaricides spécifiques agissent pour la
plupart en tant qu'inhibiteurs de croissance ou des mécanismes de
respiration cellulaire. Les acaricides sont principalement utilisés en
arboriculture fruitière et vigne (I9 produits), sur cultures
légumières, 2 produits sont autorisés, et 8 en cultures
ornementales, seules 4 substances, déjà anciennes, sont
disponibles pour les grandes cultures. Pour demain, 7 molécules plus ou
moins prometteuses sont listées: bifénazate, flufenzine,
spirodiclofen, spiromésifen, pyrimidifen, acéquinocyl et
fluacrypyrim : appartenant pour la plupart à de nouvelles familles
chimiques, elles apporteront de nouveaux modes d'action. Toutes ces
molécules, anciennes ou nouvelles, sont susceptibles d'être
rapidement confrontées à l'apparition de résistances, les
acariens représentant, sur ce plan, un risque maximal au sein des
arthropodes. Il faut donc utiliser au mieux ces produits avec les
stratégies classiques de gestion des résistances (alternance,
limitation du nombre des applications), dans ce contexte, un monitoring est
aujourd'hui demandé systématiquement par le Comité
d'Homologation pour toutes les nouvelles substances acaricides [55].
I-2-4-1-1-4-Symptômes de
toxicité :
Ø Des lésions importantes mais temporaires aux
yeux pour cela il faut éviter tout contact avec les yeux ou les
vêtements.
Ø L'exposition prolongée ou fréquente
peut causer des réactions allergiques cutanées chez certaines
personnes. Dangereux en cas d'inhalation ou d'absorption cutanée.
Ø Ne pas inhaler le brouillard de pulvérisation.
Éviter tout contact avec la peau. L'ingestion peut s'avérer
fatale.
Ø Ce pesticide est toxique pour les poissons et la
faune. Ne pas contaminer l'eau en éliminant l'eau de lavage ou de
rinçage de l'équipement. Ce produit est très toxique pour
les abeilles exposées au traitement direct ou aux résidus
déposés sur les cultures ou les mauvaises herbes en floraison.
Ø Si des abeilles visitent l'endroit à traiter,
ne pas appliquer ce produit sur des cultures ou des mauvaises herbes en
floraison, ni aux endroits où la dérive de pulvérisation
pourrait les atteindre [17].
I-2-4-1-2-Nématocides :
Un nématocide est un type
d'insecticides chimiques utilisés pour tuer les nématodes (vers
ronds) [11].
Nematophagous fungi, est un type de champignons
carnivores, peut être utile dans le contrôle des nématodes,
Paecilomyces est un exemple [1].
Avant 1985, la persistance d'halocarbure DBCP a
été largement utilisé comme fumigant nématocide et
le sol. Toutefois, il est interdit d'utiliser, après avoir
été liés à la stérilité chez les
travailleurs de sexe masculin [11].
I-2-5-Les avermectines :
Les avermectines sont issues de la culture de
Streptomyces avermitilis. Huit composés naturels ont
été isolés: A1a, A1b, A2a,
A2b, B1a, B1b, B2a et B2b, Les
composés A possèdent un groupement méthoxyle sur
le carbone numéro 5, alors que les composés B portent
une groupement hydroxyle, la liaison entre les atomes de carbone 22 et
23 est double dans le cas des composés1, elle est simple dans
la structure des composés 2, enfin, les composés a
possèdent un substituant butyle en position 25 alors qu'il
s'agit d'un isopropyle dans le cas des composés b, Les
homologues a et b ont une activité presque identique.
Leur séparation au cours de la fermentation à grande
échelle est difficile et sans intérêt, de sorte que, dans
la littérature, on considère quelques fois que quatre types
d'avermectines : A1, A2, B1 et B2 [18].
I-2-5-1-Classification :
I-2-5-1-1-L'ivermectine (22,23-dihydro-avermectine
B1) :
A été la première avermectine
commercialisée. Elle est obtenue par hydrogénation
sélective de la double liaison 22-23 de l'avermectine B1, sa
DL50 est estimée à 30 mg/kg chez la souris [18].
I-2-5-1-2-L'abamectine (avermectine
B1) :
Est aussi un produit de fermentation de S. avermitilis.
Sa production est plus simple que celle de l'ivermectine. Elle est plus
active sur les nématodes que l'ivermectine mais un peu moins efficace
sur quelques arthropodes, bien que son utilisation en protection des cultures
soit en relation avec son activité acaricide et insecticide [18].
I-2-5-1-3-La doramectine (25-cyclohexyl-avermectine
B1) :
Est un produit de fermentation d'une souche mutante de
S. avermitilis en présence de l'acide cyclohexanecarboxylique,
il est très lipophile et sa demi-vie tissulaire est beaucoup plus
longue [18].
I-2-5-1-4-L'éprinomectine
[4'-(épiacétylamino)-4'-désoxy-avermectine
B1] :
Est issue de la fermentation S. avermitilis,
comme l'ivermectine et l'abamectine. Elle a été
sélectionnée parmi plus de 500 lactones macrocycliques en vue
d'obtenir le spectre et la marge de sécurité les plus larges
avec, en particulier, les concentrations les plus faibles dans le lait,
permettant ainsi son emploi chez les vaches laitières en production
[18].
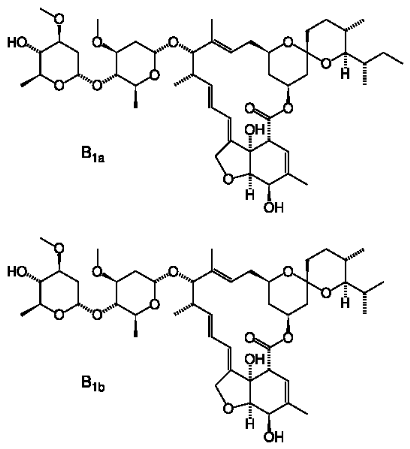
Figure 4. Structures chimiques des
invermectines B1a, B1b [23].
Tableau 16. Efficacité des avermectines naturelles
contre six espèces de nématodes chez le mouton [18].
|
Structure
|
Dose
(mg/kg)
|
Hc
|
Oc
|
Ta
|
Tc
|
Csp
|
Oec
|
|
Avermectine A1
|
0,1
|
2
|
2
|
0
|
0
|
2
|
0
|
|
Avermectine A2
|
0,1
|
3
|
3
|
3
|
3
|
0
|
3
|
|
Avermectine B1
|
0,1
|
3
|
3
|
3
|
3
|
3
|
3
|
|
Avermectine B2
|
0,1
|
3
|
3
|
3
|
3
|
2
|
3
|
Hc : Haemonchus contortus
Oc : Teladorsagia circumcincta ;
Ta : Trichostrongylus axei
Tc : Trichostrongylus colubriformis
;
Csp : Cooperia spp
Oec : Oesophagostomum
columbianum.
Code
d'efficacité :
0 : < 50 % ; 1 : 50-74 % ;
2 : 75-90 % ; 3 : > 90 %
I-2-5-2-Mode d'action des avermectines :
Les avermectines agissent en interférant avec la
fonction des synapses neuromusculaires. Les effets antiparasitaires connus des
avermectines sont :
Ø la paralysie des muscles pharyngiens.
Ø la paralysie des muscles somatiques.
Les effets paralysants sur les muscles pharyngiens sont
associés à l'interaction des avermectines et des
récepteurs des canaux de chlorure dépendants du glutamate
(ClGlu), le rôle physiologique du ClGlu dans le pharynx est de
régulariser l'action du glutamate libéré par les
motoneurones pharyngiens, le glutamate exogène inhibe le pompage du
pharynx, qui est imité par l'ivermectine. Par contre, la paralysie des
muscles somatiques est associée aux récepteurs des canaux de
chlorure dépendants de l'acide 4-aminobutanoïque, l'action des
avermectines est qu'elles accroissent la perméabilité des muscles
aux ions chlorure, ce qui à son tour réduit le potentiel
excitateur et la résistance à la pénétration des
tissus. En présence d'avermectines, l'acide 4-aminobutanoïque est
libéré, se lie aux membranes musculaires, et comme
résultat, les canaux de chlorure demeurent ouverts. Cette charge
négative est maintenue au motoneurone, et la membrane devient
hyperpolarisée, bloquant les signaux pour une réaction
excitatrice ou Inhibitrice [18].
I-2-5-3-Toxicité des avermectines :
Divers impacts létaux et sublétaux ont
été observés sur des organismes non visés
exposés aux avermectines. Le risque principal est celui de la
neurotoxicité, qui chez la plupart des espèces de
mammifères peut se manifester par une dépression du systême
nerveux central (SNC), avec pour conséquence une ataxie, comme on aurait
pu s'y attendre du fait de la potentialisation des synapses inhibitrices du
système GABA-ergique. En général on utilise les pesticides
sous forme de spécialités contenant plusieurs substances, ces
préparations sont classées par l'Agence de protection de
l'environnement des États-Unis comme toxiques de catégorie IV,
c'est-à-dire très faiblement toxiques. Ceci signifie que bien que
fortement toxiques pour les insectes, Les préparations de pesticides
contenant de l'avermectine ne devraient généralement pas avoir
d'effet nuisible pour les mammifères en mode normal d'utilisation. Par
exemple, on peut déterminer pour une telle préparation une DL50
par voie orale de 650 mg/kg chez le rat (toxicité classée en
catégorie III : basse toxicité) [1].
Extrapolé à l'homme pour un poids de 80
kilogrammes, la DL50 est de 52 g correspondant à une faible
toxicité [18].
I-2-6-Les pyréthroides :
Insecticides dits « de troisième
génération », cette famille de pesticide dérive de
l'acide chrysanthémique, un insecticide naturel présent dans les
variétés sauvages de pyrèthres, la sélection a
affaibli les facultés de résistance de ces plantes aux insectes,
en même temps que la chimie multipliait par mille ou davantage la
toxicité de ses dérivés vis-à-vis des
invertébrés. Dotés d'une toxicité
considérable et agissante par contact, ils tuent presque
instantanément les insectes par effet choc neurotoxique, permettant de
les utiliser à des doses très réduites (10 à 40 g
de matière active par ha). Comme les organochlorés, ils tuent
l'insecte en bloquant le fonctionnement des canaux sodium indispensables
à la transmission de l'influx nerveux [53].
Réputés peu toxiques pour l'homme, on leur
attribue le coefficient de sécurité (rapport des toxicités
pour les insectes et pour les mammifères) le plus élevé
parmi les insecticides chimiques. Très biodégradables, ils ne
persistent pas dans le milieu édaphique, mais ils sont très
toxiques pour certains organismes aquatiques (poissons) ainsi que pour les
auxiliaires de l'agriculture (dont les abeilles). Ils possèdent des
propriétés diverses. Une molécule donnée
présente de nombreux isomères aux degrés
d'activités variés. La synthèse industrielle cherche
à ne produire que l'isomère le plus actif de la molécule.
Exemples: bifenthrine, bioresméthrine, deltaméthrine,
dépalléthrine, éthofenprox, fenpropathrine,
cyperméthrine, fenvalérate, esfenvalérate, cyfluthrine,
alphamétrine, tralométhrine, fluvalinate, perméthrine,
lambda-cyhalothrine, flucythrinate, téfluthrine, tralométhrine,
zetacyperméthrine, bétacyfluthrine [54].
I-2-6-1-Mode d'action des pyréthroides :
Très tôt il apparut que l'essence de
pyrèthre prolonge la conduction nerveuse, en induisant des
décharges répétées, les mécanismes
moléculaires impliquent une altération ou fonctionnement des
canaux sodiques et potassiques. La synthèse organique a conduit
l'industrie a développée deux classes principales de
dérivés, les pyrèthres de type 1, qui sont des esters de
l'acide chrysanthémique et ceux du type2 qui comportent un radical
cyanhydrique, parmi les composés de type 1 figurent
tétraméthrine, l'allétrine, la phénothrine ,la
perméthrine, et parmi les dérivés du type 2: la
cyperméthrine, la deltaméthrine, la fenvalérate, la
cyphénothrine. La stéréospécificité
structurale des molécules conduit a des différences de mode
d'action, sans que des corrélations générales aient
été clairement étables la lipophilicité des
molécules expliquent explique globalement leur implication dans la
perturbation des phénomènes membranaires. La deltaméthrine
provoque chez les insectes cibles un dérèglement
général hormonal, avec rupture de l'homéostasie
glucido-lipidique [2].
Le radical cyclopropane joue certainement un rôle a
part dans la toxicité des pyréthroides, ses
propriétés de franchissement des barrières
cérébrales et de perturbations neuronales lui confèrent
des propriétés anesthésiques ,qui pourrait étre
impliquées dans le phénomène ,de « Knock
down » KD qui immobilise les insectes avant que les processus
thanatogénes n'aillent a leur terme, curieusement on trouve
également un cyclopropane dans des molécules herbicides de
conception récente ainsi que dans nombre de médicament, les
effets respectifs des pyréthroides de type 1 et 2ont fait l'objet de
nombreux travaux, sans aboutir a des résultats parfaitement
tranchés [2].
La sélectivité des pyréthroides
s'exprime de manière uniquement quantitative, par les valeurs
comparées des DL50 et les concentrations actives sur la conduction
nerveuse mesurées chez divers organismes [1].
I-2-6-2-Symptômes de toxicité :
I-2-6-2-1-Les pyréthroides de type
1 :
Comportement agressif, tremblement, prostration,
hyperthermie. Convulsions non atténuées par le diazépam
I-2-6-2-1-1-Insectes :
Agitation permanente, incoordination, prostration et
paralysie.
I-2-6-2-1-2-Rongeurs :
Agressivité envers les congénères,
hyper-réactivité, tremblement et prostration (syndromeT).
Certains composés moins actifs chez les rongeurs. Inhibition des ATPases
Ca++.
I-2-6-2-2-Les pyréthroides de
type2 :
Salivation intense, mastication, comportement de creuser,
convulsions cloniques et toniques, choreoathétose (mouvement
incoordonnées, amples, rapides ou lents) Convulsion corrigées par
le diazepam.
I-2-6-2-2-1-Insectes :
Incoordination, convulsion, hyperactivité.
I-2-6-2-2-2-Rongeurs :
Convulsion, sécrétions salivaire mais non lacrymales (syndrome
CS). Inhibition des ATPases Ca++/Mg++ [25].
I-2-6-3-Données toxicologiques et
normes :
Tableau 17. Données toxicologiques et normes pour
les pyréthroides de type 1,2 [25].
|
Classe
|
Insectes DL50
orale
|
DE tissus nerveux
|
Rongeurs
DL50 orale
|
DL50
cérébrale
|
|
Type 1
|
0.1-60mg /kg
|
0.3 pM à 10nM
|
0.6-10g/kg
|
1 -120 mg/kg
|
|
Type 2
|
0.01-0.4 mg /kg
|
>1uM
|
100-500 mg/kg
|
8-20ng /kg
|
I-2-7-Insecticides d'origine
végétale :
En Europe, ils ont connu un développement important
entre les deux guerres, avant d'être éclipsés par les
insecticides de synthèse. Des cultures à grande échelle de
plantes à propriété insecticide furent menées dans
les années 50. Ces insecticides sont extraits de diverses plantes par
macération, infusion ou décoction [1]. En voici quelques exemples
:
I-2-7-1-Classification :
I-2-7-1-1-Les
roténones :
Elles sont extraites de racines, feuilles ou graines
de légumineuses (Derris spp en Asie du Sud-Est et
Lonchocarpus spp en Amérique du Sud). Elles sont très
toxiques pour les poissons et certains insectes qu'elles paralysent (inhibition
du complexe mitochondrial I, c'est-à-dire de la chaîne
respiratoire à échelle cellulaire) mais sont
réputées inoffensives pour les abeilles et peu toxiques pour les
animaux à sang chaud. Leurs effets résiduels sont
réputés faibles. C'est un insecticide de contact, utilisé
contre les insectes suceurs et broyeurs (pucerons, teignes, mouches des fruits,
altises, noctuelles) [54].
I-2-7-1-1-1-Préparation:
Des racines de Derris elliptica de 2,6 cm de
diamètre sont lavées puis broyées avec un peu d'eau et de
savon (1 part de savon, 4 parts de racines et 225 d'eau). La solution obtenue
par filtrage est utilisée immédiatement. Attention ! Les
roténones provoquent par contact de sévères lésions
des régions génitales [54].
I-2-7-1-2-La nicotine
Extraite au niveau des feuilles et des tiges du tabac,
Nicotiana tabacum (Solanaceae). Cet alcaloïde agit par
inhalation, ingestion et contact. La nicotine a des propriétés
acaricides, insecticide et fongicide. La nicotine se dégrade en 3-4
jours. C'est une substance très toxique pour l'homme, les
mammifères et les poissons. Sa DL 50 est de 50 mg/kg. Elle peut
être inhalée et absorbée directement à travers la
peau : il faut donc éviter tout contact lors de sa manipulation. Le
traitement est plus efficace s'il se déroule à température
élevée (>30°C). Il ne faut pas consommer les cultures
traitées avant un délai de 4 jours [54].
I-2-7-1-2-1-Préparation:
La bouillie se prépare en arrosant 1 kg de tiges
et de feuilles avec 15 l d'eau plus une poignée de savon (agent
mouillant). Après 24 h, ce mélange est filtré et
prêt à l'emploi [54].
I -2-7-1-3-La ryanoline :
Cette substance est extraite de Ryania
speciosa, de la famille des Flacourtiaceae et se rencontre en
Amérique du Sud. On utilise les tiges, les racines et la sciure de
tronc. Le produit agit par contact et l'effet est lent mais très
puissant, les insectes cessant de se nourrir, de se déplacer et de se
reproduire. C'est un insecticide sélectif par ingestion. Le ryania est
peu toxique pour les vertébrés et l'effet dure au champ 5
à 9 jours. On obtient de bons résultats envers les larves de
Lépidoptères [54].
I-2-7-1-3-1-Préparation:
Les racines les feuilles ou les tiges sont
séchées puis moulu finement. 30 à 40 g de poudre sont
mélangés à 7 à 8 litres d'eau. Puis le liquide
obtenu par filtrage est pulvérisé, tous les 10 à 14 jours
en arboriculture [54].
I-2-7-1-4-Les dérivés du
pyrèthre
Des composées du genre Chrysanthemum accumulent
dans leurs capitules des substances insecticides, les pyréthrines.
Tanacetum cinerariifolium est l'espèce la plus employée.
Les fleurs, rappelant par leur forme les marguerites, sont broyées et
séchées. La poudre obtenue est diluée au 1/10ème
dans de l'eau. L'effet est augmenté par l'addition d'adjuvants, tel que
le piperonyl butoxyde. Peu toxiques, les pyréthrines sont très
vite dégradées dans la nature. Elles sont actives contre de
nombreux insectes avec un effet choc [54].
II-Les Herbicides:
II-1-Définition:
Un produit herbicide est défini comme une
préparation
ayant la propriété de tuer les
végétaux. Le
terme « désherbant » est un synonyme d'herbicide. En
protection des
cultures, les herbicides sont employés pour lutter contre les
adventices, ou
mauvaises herbes,
destinées à détruire ou à limiter la croissance des
végétaux, qu'ils soient herbacés ou ligneux. Ils peuvent
être utilisés, selon leur mode d'action, en pré ou
post-levée. On distingue :
Ø Les désherbants sélectifs, les plus
nombreux.
Ø Les débroussaillants et désherbants
totaux.
Ø Les défanants qui détruisent la partie
aérienne des végétaux. Ils sont par exemple
utilisés pour la récolte mécanique de la pomme de terre ou
de la betterave.
Ø Les anti-germes, qui empêchent le
démarrage de la végétation de, par exemple, les oignons ou
pommes de terre destinés à l'alimentation [73].
II-2-Modes d'action:
Les modes d'action des herbicides sont fondés
sur :
Ø La perturbation de la
photosynthèse.
Ø L'
inhibition de la
synthèse des
lipides.
Ø L'inhibition de la synthèse des
acides
aminés.
Ø La perturbation de la régulation de l'
auxine.
Ø L'inhibition de la division cellulaire à la
métaphase.
Ø L'inhibition de la synthèse des
caroténoïdes
(pigments protecteurs des chorophylles),
Ø L'inhibition de la synthèse de l'
enzyme PPO
(protoporphyrinogène oxydase) conduisant à la synthèse des
chlorophylles.
Ø La dérégulation des pH entre les
différents compartiments cellulaires ou découplants,
Ø La perturbation de la croissance [74].
II-3- Les caractéristiques :
Les caractéristiques d'un produit herbicide
portent sur la désignation de la (ou des) matière(s) active(s),
le nom du produit commercial, le fabricant et éventuellement du
distributeur local, la teneur de la (ou des) matière(s) active(s) dans
le produit, le type de formulation, le mode d'emploi, la dose d'emploi et la
culture cible, le teneur en matière(s) active(s) s'exprime en g/l pour
les formulations liquides et en pourcentage (%) pour les formulations
solides[73].
La dose d'emploi en produit commercial s'exprime en l/ha
pour les formulations liquides et en kg/ha (ou parfois en g/ha) pour les
formulations solides. La dose d'emploi en matière active s'exprime
toujours en g/ha [73].
II-4-Classification selon la voie de
pénétration dans les végétaux :
Les herbicides se distinguent par rapport à
leur voie de pénétration dans les végétaux et
à leur déplacement dans la plante :
II-4-1-Herbicides à pénétration
racinaire : Appliqués sur le sol, ils
pénètrent par les organes souterrains des végétaux
(racines, graines, plantules), ce sont les traitements herbicides de
prélevée, effectués avant la levée de la plante
considérée (culture ou mauvaise herbe). Exemple : le
métolachlor applicable en culture de cotonnier ou de maïs [75].
II-4-2-Herbicides à
pénétration foliaire : Appliqués sur le
feuillage, ils pénètrent par les organes aériens des
végétaux (feuilles, pétioles, tiges), ce sont les
traitements herbicides de post-levée, effectués après la
levée de la plante considérée (culture ou mauvaise herbe).
Exemple : le paraquat en désherbage total [75].
II-4-3-Herbicides de contact :
Herbicides qui agissent après pénétration plus ou moins
profonde dans les tissus, sans aucune migration d'un organe à un autre
de la plante traitée.
II-4-4-Herbicides systémiques :
Herbicides capables d'agir après pénétration et migration
d'un organe à un autre de la plante traitée. Les herbicides
agissent sur différents processus de croissance et de
développement des plantes : ils perturbent le fonctionnement
de :
Ø la physiologie de la plante : la photosynthèse
ou la perméabilité membranaire.
Ø la croissance : la division cellulaire,
l'élongation, etc.....
Ø la biosynthèse des constituants cellulaires :
lipides, pigments caroténoïdes, acides aminés, etc....
L'efficacité d'un herbicide dépend de la
dose épandue : on définit une dose limite d'efficacité qui
peut varier en fonction de la plante ciblée et de la période
d'application. Le spectre d'efficacité correspond à l'ensemble
des espèces maîtrisées par un produit à une dose
donnée [75].
II-5-Classification selon leur
toxicité :
II-5-1-Herbicides Toxiques:
II-5-1-1- Les Chlorates :
Les chlorates sont principalement utilisés dans
les herbicides. En cas d'intoxication, une
méthémoglobinémie importante peut se développer. La
gravité des symptômes est déterminée par le taux de
méthémoglobinémie. Les symptômes principaux sont la
cyanose, la dyspnée, la perte de conscience et les convulsions. Le
traitement est purement symptomatique. Le bleu de méthylène n'est
pas actif dans ce type d'intoxication [75].
II-5-1-1-1-Modes d'action:
Les chlorates sont de puissants oxydants. Ils
produisent 3 réactions principales au niveau des
érythrocytes :
Ø Une dénaturation de l'hémoglobine.
Ø Une altération de la membrane cellulaire.
Ø Une oxydation de l'hémoglobine.
Les deux premières réactions provoquent
l'hémolyse. Les conséquences de l'hémolyse sont de loin
les plus graves. L'oxydation de l'hémoglobine est à l'origine de
la méthémoglobinémie [75].
II-5-1-1-2-Exemple de
chlorate :
II-5-1-1-2-1-Le chlorate de
sodium :
Le chlorate de sodium aussi appelé chlorate de
soude (
Na
Cl
O3) est
utilisé comme
désherbant et il
est également utilisé dans le domaine de la
pyrotechnie. Car les
chlorates sont des oxydant plus puissant que les nitrates, quoi que plus
sensible également. Ensuite, au niveau puissance oxydante, on arrive aux
perchlorates, dont le plus connu : le
perchlorate
d'ammonium(NH4ClO4) est utilisé comme comburant de certaines
fusées (militaires notamment). Le '
perchlorate
de potassium(KClO4) est lui autorisé en pyrotechnie (dans certain
pays) car même étant plus puissant que les chlorates, ils sont
moins sensibles (à la friction et aux chocs notamment) [73].

Figure 5. Chlorate de sodium [35].
II-5-1-1-2-2-Utilisation :
Les principales applications des chlorates de sodium
sont les suivants :
Ø Désherbage
Ø Blanchiment de pâtes à papier
Ø Industrie textile
Ø Intermédiaire de synthèse [73].
II-5-1-1-2-3-Symptômes de
toxicité :
Ø Vomissements, diarrhée, douleur abdominale
Ø Dyspnée, cyanose, tachycardie
Ø Ataxie, coma, convulsions Sang brun chocolat,
hémolyse à corps de Heinz [79].
II-5-1-1-2-3-Normes de toxicité:
II -5-1-1-2-3-1-Dose létale:
La plus petite dose létale connue chez l'adulte est
de 15 g de chlorate de sodium et de 7 g de chlorate de potassium. Pour les
enfants, la plus petite dose létale de chlorate de potassium serait de
1g [80].
II-5-1-1-2-3-2-Dose toxique:
L'ingestion de moins de 20 allumettes (leurs sommets
colorés) n'est pas dangereuse pour un enfant, le cas d'un enfant de 13
ans ayant trempé son doigt dans de la poudre de chlorate de sodium a
été décrit avec développement d'une
méthémoglobinémie, un ictère et une insuffisance
rénale [80].
II-5-1-2-Paraquat:
II-5-1-2-1-Définition:
Le paraquat est un
Biocide
pesticide
herbicide. Il appartient
à une famille chimique (les pyridines) qui comprend d'autres produits
Phytosanitaires
possédant des propriétés similaires le Diquat, le
Cyperquat. C'est l'un des
herbicides les plus
utilisés au monde, vendu dans plus de 120 pays (selon son fabricant).
Bien que très toxique, pour son faible coût et sa facilité
d'utilisation, il sert en
agriculture,
floriculture et dans certains boisements à désherber ou
préparer le sol pour une centaine de cultures de céréales (
maïs,
blé,
orge,
seigle,
riz..), de
soja,
pomme de terre,
fruits (
pomme,
orange,
banane), de plantes
destinées à la fabrication de boissons (
café,
thé,
cacao) et des cultures
traitées (
coton,
huile de palme,
Canne à
sucre et
caoutchouc).
Il vise à protéger les semis contre la concurrence d'un large
éventail de plantes pluriannuelles dites nuisibles, les "mauvaises
herbes", qui réduisent le rendement et la qualité de la
récolte par compétition pour l'espace, l'eau, les nutriments, et
la lumière. Il est aussi de plus en plus utilisé pour
préparer le semis direct, notamment là où les adventices
sont devenus résistants au
glyphosate (mais avec le
risque de générer de nouvelles résistances au paraquat,
cette fois) [83].

Figure 6. Structure chimique
du paraquat [36].
II-5-1-2-2-Utilisations et
caractéristiques:
Le composé est l'un des herbicides les plus
employés couramment au monde. Par action très rapide, non
sélectif, et conduit à la mort des plantes vertes nuisibles suite
a un contact. Il est redistribué au sein de l'usine mais ne nuit pas
à l'écorce mûre [87].
Être un herbicide, le paraquat protège des
récoltes en commandant un éventail d'herbes éternelles
annuelles et certaines qui réduisent le rendement de récolte et
la qualité par la concurrence la récolte pour l'eau, les
aliments, et la lumière [87].
Les caractéristiques principales qui distinguent
le paraquat non sélectif d'herbicide de contact ou d'autres substances
actives utilisées dans des produits phytopharmaceutiques sont :
Ø Le paraquat est non sélectif.
Ø Le paraquat a une action très rapide.
Ø Le paraquat est plus rapide dans les minutes
d'application.
Ø Le paraquat devient biologiquement inactif lors du
contact avec le sol [87].
II-5-1-2-3- Mode d'action :
Afin de bien comprendre les
propriétés agronomiques uniques du paraquat, il est important de
comprendre comment il fonctionne. Le paraquat n'est pas systémique, il
ne dessèche que les parties vertes des plantes avec lesquelles il entre
en contact, il tue les mauvaises herbes annuelles mais épargne les
plantes ligneuses et les racines de plantes vivaces. Une fois en contact avec
le sol, le paraquat est rapidement désactivée. Ces
caractéristiques expliquent pourquoi on l'appelle herbicide de
précision. Le paraquat n'agit que sur les parties sur lesquelles il est
appliqué, puis désactivé en moins d'une heure, limitant
ainsi considérablement l'exposition des parties non-ciblées ou de
l'environnement en général. Le dessèchement rapide des
parties vertes nécessite la présence de lumière et
d'oxygène. Des études ont démontré que les
molécules du paraquat envoient les électrons des centres fer
soufre dans le phytosystème I du chloroplaste. Les molécules
ainsi réduites du paraquat réagissent avec l'oxygène pour
former des superoxydes (O2) qui produisent à leur tour des radicaux
hydroxyles attaquant les membranes cellulaires de la plante. Résultat,
les feuilles brunissent, parfois en moins de 30 minutes après le
traitement, en cas de fort ensoleillement, le dessèchement complet
s'observe au bout de quelques jours [83].
Figure 7. Mécanisme de
toxicité cellulaire du paraquat [9].
II-5-1-2-4-Toxicité (Effets sur la
santé et sécurité):
Le paraquat est dangereux par sa forte toxicité
aiguë par ingestion, même à faible dose. Il est à
l'origine de controverse notamment aux Antilles ou il tend à remplacer
le
chlordécone
qui est à l'origine d'une large pollution des sols et eaux
superficielles. Les principaux symptômes de toxicité
sont :
Ø Atteinte digestive caustique, avec diarrhée
pouvant conduire à des risques de déshydratation en cas
d'ingestion importante.
Ø Atteinte rénale de type insuffisance
rénale fonctionnelle (réversible).
Ø Si ce premier cap difficile est surmonté, une
fibrose pulmonaire irréversible s'installe, aboutissant à une
mort douloureuse par
hypoxie en quelques jours ou
semaines (aucun antidote connu).
Ø L'absorption cutanée après des contacts
prolongés avec des solutions concentrées peut suffire à
provoquer la mort par fibrose pulmonaire.
Ø Essentiellement a un effet irritant de la peau, des
muqueuses oculaires et respiratoires [82].
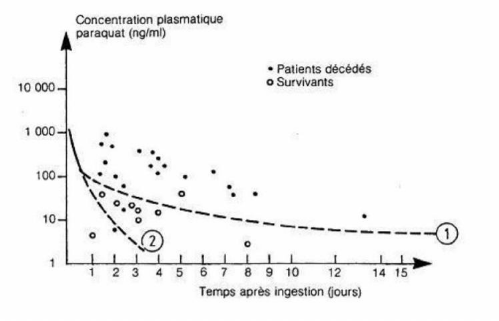
Figure 8. Évolution de 30 patients
intoxiqués, en fonction des concentrations plasmatiques de paraquat
mesurés 24 h après l'ingestion [9].
II-5-1-3-Diquat:
II-5-1-3-1-Définition:
C'est un
herbicide de la famille
des bipyridiliums. Il agit comme défoliant et donc utilisé comme
herbicide mais également comme aide à la récolte (coton,
pomme de terre). Il agit en acceptant un électron dans le processus de
la photosynthèse, ce qui forme de puissants agents oxydants. Ces agents
attaquent les membranes des cellules végétales et conduites
à la mort de la plante [88].
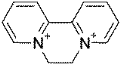
Figure 9.
Structure chimique du diquat [37].
II-5-1-3-2-Exposition:
On ne dispose d'aucune information sur les
concentrations de diquat dans l'eau potable ou les eaux superficielles du
Canada. L'apport quotidien maximal de diquat dans les aliments, calculé
à l'aide des limites maximales de résidus tolérées
par la Direction des aliments du ministère de la Santé nationale
et du Bien-être social est, en théorie, de 0,03 mg/jour. La limite
maximale de résidus dans toutes les cultures pour lesquelles l'usage du
diquat est homologué est de 0,1 mg/kg. On dispose de peu de
données sur les teneurs réelles de diquat décelées
dans les denrées alimentaires. Dans des essais réalisés
sous surveillance au Canada, où le diquat a été
appliqué au blé et à l'avoine à raison de 0,28 et
de 0,56 kg d'ions diquat par hectare, des concentrations moyennes de 0,05 mg/kg
(plage de <0,02 à 0,08) et de 0,07 mg/kg (plage de 0,02 à
0,12) de résidus ont été respectivement trouvées
dans le blé desséché d'une part, et de 0,33 mg/kg (plage
de 0,14 à 0,51) et de 0,80 mg/kg (plage de 0,14 à 1,4),
respectivement, dans l'avoine desséchée, d'autre part [89].
II-5-1-3-3-Toxicité de
diquat :
II-5-1-3-3-1- Effets sur la santé :
Le diquat est faiblement absorbé à partir
du tube digestif après l'ingestion. La majeure partie d'une dose orale
unique de 45 mg/kg p.c. par jour de diquat marqué radioactivement a
été éliminée par des rats en quatre jours, 6 pour
cent de la dose a été décelée dans les urines et 89
pour cent dans les fèces, en majeure partie sous forme intacte. Le
métabolite monopyridone, décelé principalement dans les
fèces, atteint 5 pour cent de la dose, alors que le métabolite
dipyridone, métabolite urinaire mineur, représente environ 0,1
pour cent de la dose. On croit que la toxicité serait attribuable au
composé mère plutôt qu'à ses métabolites. On
n'a pas noté d'accumulation de diquat dans les tissus de rats ayant
reçu 25 ppm dans leur régime alimentaire pendant huit semaines
[88].
Des rapports indiquent qu'une dose orale unique de 6
à 12 g d'ions diquat est fatale aux êtres humains. L'intoxication
des êtres humains par le diquat peut provoquer des lésions
à la paroi du tube digestif, au cerveau, au foie, aux reins et aux
poumons [88].
L'ingestion chronique de diquat a provoqué la
formation de cataractes chez des rats et des chiens, effet qui n'a jamais
été signalé chez les êtres humains exposés.
Des groupes de 35 mâles et de 35 femelles de rats Wistar ont reçu
des aliments renfermant 0, 15, 25 ou 75 ppm d'ion diquat pendant deux ans ou
moins. Bien que l'on n'ait constaté aucun effet significatif sur le
poids corporel, la consommation d'aliments ou le taux de mortalité des
groupes traités, on a noté une hausse sensible de la formation de
cataractes dans le groupe exposé à la plus forte dose (75 ppm)
comparativement au groupe témoin. Aucune différence significative
dans le nombre de cataractes n'a été observée chez les
rats ayant consommé 15 et 25 ppm d'ion diquat comparativement aux
témoins, bien que, dans le groupe ayant absorbé 25 ppm d'ion
diquat, l'apparition des cataractes s'est produite plus tôt que chez les
témoins. L'apport alimentaire sans effet sur la formation de cataractes
a été établi à 15 ppm d'ion diquat, soit
l'équivalent de 0,75 mg/kg [89].
II-5-1-4-Dinitrophénol:
II-5-1-4-1-Définition:
Dinitrophénol est un poison du
Métabolisme
cellulaire. Il
découple la
phosphorylation
oxydative en transportant les
protons à travers la
membrane
mitochondriale, ce qui
conduit à une augmentation rapide de la consommation d'
Énergie sans
formation d'
ATP. Les
dinitrophénols constituent une classe de composés chimiques, qui
comprend six molécules, dont aucune n'existe à l'état
naturel, et qui sont donc tous des produits de synthèse.
Dinitrophénol est un solide cristallin jaune, qui a une odeur
douceâtre de moisi. Il est très volatil, il se sublime lorsqu'il
est légèrement chauffé et dégage alors de la
vapeur. Il est modérément soluble dans l'eau (ses sels de sodium
sont des cristaux solubles dans l'eau), l'
Acétate
d'éthyle, l'
Acétone, le
Chloroforme, la
Pyridine, le
Tétrachlorure
de carbone, le
Toluène,
l'alcool, le
Benzène, et les
solutions aqueuses alcalines. Il forme des sels explosifs avec les produits
alcalins et l'
ammoniaque, et émet
des fumées toxiques d'oxydes d'azote quand il est chauffé
jusqu'à décomposition. Il est incompatible avec les métaux
lourds et de leurs composés [88].
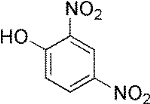
Figure 10.Structure chimique du
dinitrophénol[38].
II-5-1-4-2-Modes d'action:
Dans les cellules vivantes, le dinitrophénol agit
comme un transporteur de protons (
ionophores), un agent qui
peut transporter les
protons (ions
hydrogène) à travers les membranes biologiques. Il contrarie le
gradient des protons dans les
mitochondries et les
membranes des
Chloroplastes et
provoque l'effondrement du
gradient
électrochimique que la cellule utilise pour produire
l'énergie chimique de la plupart des molécules d'
ATP. Au
lieu de produire de l'ATP, l'énergie du gradient de protons est perdue
en
chaleur. Les
cellules compensent la baisse du rendement de l'ATP en oxydant davantage les
réserves stockées sous forme de
Glucides et de
graisses.
Le Dinitrophénol est souvent utilisé dans la
recherche en
Biochimie pour explorer le
fonctionnement de l'osmose chimique et des autres mécanismes
protéiques de transport membranaire [89].
II-5-1-4-3-Symptômes de
toxicité :
Ø Action rapide (< qq heures).
Ø Vomissements.
Ø Hyperthermie (> 40°C)
Ø Polydipsie.
Ø Polypnée.
Ø Oligurie.
Ø Déshydratation.
Ø Coma, convulsions [89].
II-5-1-4-4-Toxicité dans
l'environnement:
Le Dinitrophénol est considéré
comme un important contaminant de l'environnement par l'
Agence
de protection de l'environnement des États-Unis (EPA). Il a
été retrouvé dans 61 des 1400 sites prioritaires qui on
besoin d'être dépollués de leurs déchets
industriels. Il peut contaminer l'atmosphère à partir des gaz
d'échappement des véhicules automobiles, de la combustion de
certaines substances industrielles, et de la réaction de l'azote de
l'air atmosphérique avec d'autres produits chimiques. Le site majeur de
dégradation est le sol, où il est métabolisé par
les micro-organismes, mais les effets du Dinitrophénol sur les
micro-organismes
Anaérobies
sont encore mal connus. Certaines études suggèrent qu'il
existerait une toxicité pour les organismes anaérobies à
cause de la réduction de la production de méthane [99].
II-5-2-Herbicides Peux ou Moyennement Toxiques:
II-5-2-1-Caractéristiques :
II-5-2-1-1- Doses
létales :
Ø Généralement > 1000 mg/kg.
Ø Toxicité indirecte (plantes) =>
"délai attente 15 jours ».
Ø Peu de risques après épandage dans les
conditions normales d'emploi [88].
II-5-2-1-2-Symptômes de
toxicité :
· Peu spécifique.
· Vomissement, diarrhée
· Ataxie, parésie, raideur/tremblements [88].
II-5-2-2-Classification :
II-5-2-2-1-Triazine (Atrazine):
II-5-2-2-1-1-Définition:
L'atrazine est un herbicide de synthèse
de la classe des triazines qui est utilisé de manière assez
importante au Canada principalement pour détruire les mauvaises herbes
dans la culture du mais, mais également dans celle du lin, et pour
détruire totalement toute végétation dans les secteurs non
cultivés et industriels. L'atrazine se présente sous la forme
d'une poudre cristalline incolore, avec une solubilité dans l'eau
moyennement faible (30mg/L à 20°C) et une faible volatilité.
Son adsorption aux particules du sol est faible, ce qui se traduit par
potentiel important de contamination des eaux souterraines et de surface
(Santé Canada, 1993) de plus ce risque est accentué du fait de
sa longue demi-vie dans le sol et dans les eaux souterraines: Environ 40 et
jusqu'à 200 jours respectivement (Agency for Toxic Substance Registy,
1999). Dans les sols, l'atrazine est dégradée par action
microbienne aérobie et par hydrolyse, en ses résidus principaux,
soit en ordre décroissant la biethyl -atrazine (DEA), la
déisopropyl -atrazine (DIA), la diaminochloro-atrazine (DACA), ainsi que
l'hydroxy-atrazine [88].
Dans l'eau, L'atrazine est hydrolysée et
biodégradée en ces mêmes métabolites, mais le
résidu DACA est plus important que le DIA (United States Environmental
Potection Agency 2002a). Plusieurs pays en ont limité l'utilisation
(Organisation Mondiale De La Santé ,2000) [88].
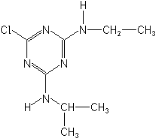
Alors qu'elle a été interdite dans
l'Union Européenne, l'atrazine est utilisé dans un grand nombre
de pays pour le traitement en pré et post-émergence des
mauvaises herbes dans de
nombreuses cultures annuelles ou pérennes. L'atrazine se lie à la
plastoquinone, une
protéine de
transport du
système de
photosynthèse, inhibant le
transport
d'électrons. L'atrazine est l'un des herbicides les plus couramment
utilisés [88].
Figure 11.Structure chimique de
l'atrazine [39].
II-5-2-2-1-2-Utilisation de
l'atrazine :
Introduit en 1958, cet herbicide sélectif de
pré et post émergence est utilisé dans la culture du
blé et du mais, c'est une chlorotriazine appartenant au groupe des
triazines .Dans cette famille on trouve également la cyanazine, la
propazine et la simazine. L'atrazine se présente sous forme de cristaux
incolores de faible solubilité dans l'eau (30mg/Litre à
20°C). Ce composé est stable en milieu neutre,
légèrement acide ou alcalin [90].
II-5-2-2-1-3-Mécanisme
d'action :
L'atrazine est absorbé par les plantes
principalement par les racines mais aussi par les feuilles. Elle empêche
l'assimilation du gaz carbonique en bloquant ainsi la photosynthèse. La
plante utilise alors ses réserves nutritives jusqu'à
épuisement. Puis meurt [88].
II-5-2-2-1-4-Devenir chez l'homme et les
animaux :
Après ingestion, l'atrazine est rapidement
absorbé par le tractus gastro-intestinal. Une faible partie est
excrétée par les fèces en moins de 72 heures. La majeure
partie (80%) est absorbée, passe dans la circulation
générale et est éliminée par voie rénale
(65%). Une faible proportion (15%) est retenue au niveau de certains tissus
(foie, rein et surtout poumon). Le métabolisme varie selon
l'espèce animale: en général on observe une
déalkylation par perte du groupement isopropyle chez le rat ou
éthyle chez le poulet et une hydroxylation au niveau de l'atome de
chiore mais l'atrazine inchangée reste le produit majoritaire, notamment
chez le porc [90].
II-5-2-2-1-5-Toxicité
expérimentale :
II-5-2-2-1-5-1-Toxicité
aigue :
L'atrazine est un composé faiblement toxique sur
le plan expérimental. La DL50 par voie orale se situe aux environs de
2g/kg pour les animaux de laboratoire et au-delà de 10g/kg pour les
oiseaux. Bien qu'elle ait été reconnue comme
légèrement irritante pour l'oeil et la peau chez l'homme dans les
ateliers de fabrication, elle se révèle non irritante pour l'oeil
à légèrement irritante pour la peau chez le lapin. Par
contre elle s'est révélée comme sensibilisant
cutané chez le cobaye [91].
II-5-2-2-1-5-2-Toxicité à
terme :
Des signes de toxicité manifeste (détresse
respiratoire et paralysie des membres) apparaissent. Chez des rats recevant une
dose orale de 20 mg/kg/jour durant 6 mois. Une étude sur deux ans chez
le chien recevant quotidiennement par voie orale une dose de 75 mg/kg/jour
permet de constater chez ces animaux une diminution de la consommation de
nourriture entraînant une baise de la croissance pondérale et sur
le plan symptomatologique, l'apparition de tremblements et une raideur de
l'arrière-train [91].
II-5-2-2-1-5-3-Effets sur la
reproduction :
Seule l'ingestion de fortes doses (supérieures
à 0,5g/kg) entraîne la mort des foetus, chez le rat [91].
II-5-2-2-1-5-4-Mutagenèse :
L'atrazine a été testé dans plus de
50 études différentes de mutagenèse utilisant des plantes,
des animaux ou des systèmes microbiens : tous ces travaux indiquent
que l'atrazine seul ou ses métabolites ne sont pas mutagènes
[91].
II-5-2-2-1-5-5-cancérogenèse :
L'atrazine s'est révélé non
cancérogène chez deux lignées de souris
différentes. Par contre, des tumeurs mammaires ont été
observées chez le rat et la souris Sprague-Dawley après
administration d'atrazine durant toute leur vie. Cette observation chez le rat
femelle suggère t'elle que l'atrazine puisse être
considérée comme un agent cancérogène. La
découverte de tumeur n'a porté en fait que sur une seule
étude, pour le groupe recevant la plus forte dose et sue une
lignée de rats qui présente une forte tendance à
développer des tumeurs mammaire. Le CIRC a conclu que les preuves de
cancérogénicité de cette substance sont insuffisants chez
l'homme et limitées chez l'animal de laboratoire et la ainsi
classée dans le groupe 2b. Notons cependant que de récentes
études épidémiologiques chez l'homme laissent entendre que
l'exposition aux herbicides triaziniques pourrait contribuer à augmenter
le risque ou cancer du sien chez la femme [91].
II-5-2-2-1-6-Etudes éco
toxicologiques :
L'atrazine est légèrement toxique pour les
oiseaux et les poissons ou elle peut s'accumuler jusqu'à 11 fois par
rapport au milieu. Par ailleurs, elle n'est pas toxique pour les abeilles
[90].
II-5-2-2-1-7-1-Devenir dans
l'environnement :
Dans l'air et les eaux superficielles, l'atrazine est
partiellement décomposé sous l'action des radiations
ultraviolettes d'origine solaire. Dans les sols, l'atrazine est d'abord
hydrolysé (plus facilement dans les environnements acides ou alcalins
qu'en milieu neutre) plus dégradée sous l'action des
bactéries. L'atrazine est modérément à fortement
mobile dans les sols surtout s'ils sont pauvres argiles ou en matières
organique. Elle peut persister plus longtemps dans les sols ou les conditions
écologiques sont défavorables (climats froids et secs). Comme
elle ne s'adsorbe pas fortement aux particules du sol et que sa demi-vie est
longue (60 à plus de 100 jours), on la détecte fréquemment
dans les eaux de surface, parfois à des teneurs plus
élevées que celles des autres pesticides [90].
II-5-2-2-2-Urée Substituées
(Diuron):
II-5-2-2-2-1-Définition:
Est un
désherbant
très utilisé, en
viticulture notamment,
ou comme
anti-algue et
anti-mousse. De la famille des halogéno'
phénylurées
(N-(3,4-dichlorophényl)-N'-(diméthyl)-urée)
c'est-à-dire du groupe dit des urées substituées, il
appartient à la vaste famille chimique des
pesticides. Sa
solubilité dans l'eau (42 ppm) est moyenne mais suffisante pour qu'on le
trouve dans les eaux superficielles ou de
nappes, ou
après
évaporation
dans les
pluies, brumes,
brouillards. Selon le
fabricant, son temps de demi-vie dans les
sols serait
d'environ un an (372 jours), mais des variations importantes semblent possibles
en fonction de la nature du sol (
pH,
oxygénation, richesse en
matière
organique et en organisme vivant, humidité, altitude, exposition au
soleil ou non, etc.) [90].
II-5-2-2-2-2-Quelques substances de la famille des
urées substituées :
II-5-2-2-2-2-1-Diuron : Utilisé
en agriculture, par les particuliers et les services techniques (communes,
SNCF, industries).
II-5-2-2-2-2-Isoproturon :
Utilisé seulement en agriculture.
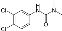
Autres matières actives de cette famille principalement
utilisées: néburon, monolinuron [100].
Figure 12. Structure
chimique du Diuron [40].
II-5-2-2-2-3-Toxicité:
Absorbé par
inhalation ou contact, il
peut induire des
dermites irritatives, de
légères brûlures et des irritations oculaires, ainsi qu'une
sensibilisation
cutanée en cas de contacts répétés. L'ingestion
induit des brûlures digestives, des
vomissements et
diarrhées au
delà de 50 g ingérés par un adulte. Des effets
délétères ont été détectés sur
le
spermatozoïde
humain, et plus encore suite à exposition à l'un de ses
sous-produits de dégradation [100].
II-5-2-2-2-4-Exposition humaine et risques pour la
santé :
Tableau 18. Exposition humaine aux urées
substituées et risques pour la santé [41].
|
Voie d'exposition
|
Diuron
|
Isoproturon
|
|
Mode
d'exposition
(importance
relative,
+ à +++)
|
Voie digestive
|
++
|
++
|
|
Voie pulmonaire
|
+++
|
+++
|
|
Voie cutannée
|
+
|
+
|
|
Organes
et/ou
fonctions
atteints
|
|
Peau (irritation)
Système respiratoire
Sang (anémie, globules rouges anormaux),
vessie, reins
|
Peau (irritation)
Système respiratoire
Anémie hémolytique, foie
(dégénérescence)
|
II-5-2-2-2-5-Données toxicologiques et
normes :
Tableau 19. Données toxicologiques et normes pour les
urées substituées [41].
|
Caractéristique
|
Diuron
|
Isoproturon
|
|
Toxicité
|
|
|
|
DL50
|
rat 437 mg/kg pc
|
rat >2000 mg/kg pc
caille 1931 mg/kg pc
|
|
Toxicité sublétale
|
|
|
|
DJA (UE)
|
0,007 mg/kg pc/j
|
0,015 mg/kg pc/j
|
|
ADI (USA)
|
0,002 mg/kg pc/j
|
0,0062 mg/kg pc/j
|
|
Ecotoxicité
|
|
|
|
CE50
|
microalgues 24 ìg/L
algues 1,9 ìg/L
gammare 160 ìg/L
huître 1800 ìg/L
truite 710 ìg/L
|
microalgues 13 ìg/L
algues 13 ìg/L
daphnie 580 ìg/L
huître 250 ìg/L
truite arc-en-ciel 18 000 ìg/L
poisson-chat 9000 ìg/L
|
|
NOEC
|
microalgues 0,46 ìg/L
algues 1,96 ìg/L
daphnie 56 ìg/L
palourde 1000 ìg/L
poisson 33,4 ìg/L
|
algues 3,2 ìg/L
daphnie 64 ìg/L
chironome 500 ìg/L
poisson 1000 ìg/L
|
|
PNEC eau douce
|
0,2 ìg/L
|
0,32 ìg/L
|
|
PNEC eau marine
|
0,2 ìg/L
|
0,32 ìg/L
|
|
PNEC sédiment
|
|
|
|
Normes et seuils
|
|
|
|
Bruit de fond
|
sans objet
|
sans objet
|
|
NQEp eau surface intérieure
|
0,2 ìg/L
|
0,3 ìg/L
|
|
Limite de qualité eau potable
Recommandation OMS
|
0,1 ìg/L total pesticides 0,5 ìg/L
4,5 ìg/L
|
0,1 ìg/L total pesticides 0,5 ìg/L
9 ìg/L
|
|
Baignade et loisirs
|
néant
|
Néant
|
|
Chair coquillages,
crustacés, poissons
|
néant
|
Néant
|
|
Norme sol
|
néant
|
Néant
|
|
Norme boues
|
néant
|
Néant
|
|
Rejets industriels
|
néant
|
Néant
|
II-5-2-2-3-Aminophosphantes :
II-5-2-2-3-1-Caractéristiques, utilisations
et toxicité :
Ø Herbicides systémiques non sélectifs
absorbés par les feuilles et véhiculés jusqu'aux racines
par la sève.
Ø Inhibent la biosynthèse des acides
aminés aromatiques ou de la glutamine, perturbant le métabolisme
de la plante.
Ø Mise sur la marche en 1974 par la firme Monsanto du
glyphosate.
Ø Depuis c'est le produit le plus diffusé a
l'échelle mondiale aussi bien chez les professionnels que chez les
jardiniers amateurs.
Ø Monsanto développe des plantes
génétiquement modifiées pour résister au
glyphosate, pour le moment ils ont réussi pour le colza.
Ø Le gros avantage, c'est qu'il a remplacé le
paraquat considéré comme le plus toxique
Ø Le glyphosate est un acide faible, ayant des
propriétés caustiques faibles.
Ø Les cibles de produits sont des enzymes
spécifiques du monde végétal (voie de l'acide Shikimique),
ce qui explique le quasi absence de toxicité chez les
mammifères
Ø Malgré une structure proche des insecticides
organophosphorés il n `y a aucune activité anticholinesterasique
mais les adjuvants présents dans la solution peuvent être
très toxique, en particulier les surfactants, POEA et ALKYLAMINE.
Ø Le POEA altère la perméabilité
capillaire et interfère avec le métabolisme
énergétique cellulaire mitochondrial.
Ø Les intoxications accidentelles sont en
général bénignes, se limitant a des troubles digestifs.
Ø L'ingestion de 30mlest le plus souvent
asymptomatique.
Ø Mais les prises supérieures à 150 ml
peuvent être mortelles, une prise de 250ml étant associé
à un décès prévisible.
Ø Lésions caustiques de l'oesophage, rarement au
delà du stade 2b (ulcérations circonferencelles)
Ø Piglottite.
Ø Choc mixte hypovolémique et
cardiogénique.
Ø Tachycardie sinusale.
Ø OEdème pulmonaire lésionnel.
Ø Cytolyse hépatique.
Ø Nécrose tubulaire.
Ø Coma, convulsions.
Ø Le dosage est possible en chromatographie des acides
aminés sur résine échangeuse d'ions.
Ø Les intoxications sévères ont un dosage
supérieur à 1g/l.
Ø Le charbon actif adsorbe le glyphosate, mais pas les
tensio-actifs
Ø Endoscopie si lésions buccales.
Ø La dialyse épure le glyphosate, mais pas le
surfactant.
Ø Aucune donnée sur l'homeofiltration.
Ø Traitement symptomatique [17].
III-Fongicide :
III-1-Définition :
Un fongicide est un
produit
phytosanitaire conçu exclusivement pour tuer ou limiter le
développement des
champignons
parasites des
végétaux.
Les produits à usages médicaux sont dénommés des
antimycosiques.
On distingue :
Ø les produits préventifs empêchant le
développement des spores à la surface de la plante.
Ø les produits curatifs qui stoppent le
développement du champignon déjà installé dans la
plante.
Pendant longtemps, les seuls fongicides disponibles
furent des produits agissant par contact et ne pouvant donc être
utilisé qu'à titre préventif. Ils agissent en effet sur
les spores du champignon avant que celles-ci n'aient pu émettre des
filaments pénétrant les tissus de l'hôte.
Les premières fongicides systémiques
apparurent à la fin des années 60. Ils présentent
l'avantage d'avoir une action à la fois préventive et
curative.
Actuellement, les fongicides employés proviennent
de l'association d'une trentaine de matières actives regroupés en
plusieurs familles chimiques [111].
III-2-Nécessité des fongicides :
Les maladies sont choses courantes en
production maraichère et certaines peuvent avoir des
répercussions économiques importantes tant au niveau du rendement
que de la qualité du produit. Dans certains cas, l'application de
fongicides durant la période de croissance permet de réduire les
pertes en entrepôt [11].
Généralement les fongicides sont mieux
utilisés dans le cadre d'un programme de lutte intégrée
qui peut comprendre une bonne rotation de culture, le choix de
variétés tolérantes, une date de semis ou de
récolte judicieuse, une fertilisation adéquate, la gestion du
microclimat (ex. densité de semis), la gestion des débris de
culture, et l'utilisation d'indicateurs de risque et l'application de
fongicides. Depuis quelques années, plusieurs fongicides ont fait leur
apparition sur le marché et les producteurs d'oignon peuvent profiter
d'une vaste gamme de fongicide (voir Tableau 1). L'avenue de fongicides ayant
de nouvelles propriétés a suscité l'apparition d'un tout
nouveau vocabulaire parfois difficile à comprendre. On peut dire d'un
fongicide qu'il est localement systémique, pénétrant,
translaminaire, etc. Bien qu'il n'y ait pas de consensus quant au vocabulaire
à utiliser pour décrire un fongicide, on peut tout de même
dégager certains concepts [10].
III-3-Mouvement dans la plante : déplacement du
fongicide dans la plante :
Une fois appliqué sur une plante ou dans le sol,
les fongicides restent à la surface de la plante ou
pénètrent dans la plante. On peut donc tout de suite distinguer
deux grands groupes :
III-3-1- Les fongicides de surface (contact) :
Qui n'est pas absorbés par la plante
III-3-2-Les fongicides
pénétrants :
Qui sont absorbés par la plante. On distingue 3
types de fongicide pénétrants:
Ø Systémique local ou trans-laminaire.
Ø Systémique à diffusion ascendante
(mobile dans le xylème, diffusion acropétale).
Ø Systémique complet (diffusion ascendante et
descendante, diffusion acropétale et basipétale) .
Lorsqu'un fongicide de surface est appliqué, les
gouttelettes s'étendent sur la feuille mais ne pénètrent
pas dans la feuille. Les feuilles qui émergent après
l'application ne sont donc pas protégées et le fongicide est
lessivé par la pluie et parfois désactivé par le soleil.
Lorsqu'un fongicide pénétrant et trans-laminaire est
appliqué, les gouttelettes s'étendent sur la feuille et
pénètrent dans la feuille. Ces fongicides pénètrent
dans la plante sous la cuticule au niveau du point de contact entre la plante
et la gouttelette de fongicide, mais ne voyagent pas dans la plante. Comme le
fongicide ne se déplace que localement dans la plante, les feuilles qui
émergent après l'application ne sont pas protégées
mais le fongicide n'est pas lessivé par la pluie une fois
pénétré dans la plante. Un fongicide
pénétrant, systémique à diffusion ascendante peut
être appliqué au sol. Il est alors absorbé par les racines
ou sur le feuillage pour une absorption foliaire. Une fois appliqué, le
fongicide se déplace vers le haut de la plante (apex, point de
croissance) avec la sève montante. Les feuilles qui émergent
après l'application sont donc protégées et le fongicide ne
peut pas être lessivé par la pluie. Les fongicides
pénétrants complètement systémique sont
généralement appliqués sur le feuillage, mais peuvent
également être appliqué dans le sol. Lorsque le fongicide
est absorbé par la plante, il se déplace vers le haut (apex) et
le bas (racine) de la plante avec la sève montante et descendante. Les
feuilles qui émergent après l'application sont donc
protégées et le fongicide ne peut pas être lessivé
par la pluie. [10]
III-4-Mode d'action : effet de la matière active
sur une activité métabolique vitale à la croissance du
champignon :
Il y a une multitude de modes d'action des fongicides.
Les fongicides peuvent altérer la membrane des cellules des champignons,
désactiver des enzymes ou des protéines, interférer avec
des processus de respiration ou de production d'énergie. Certains
fongicides interfèrent avec des cycles métaboliques important
pour la survie du champignon comme la production de stérol. Pour choisir
un fongicide il n'est pas nécessaire de connaître exactement le
mode d'action de tous les fongicides, mais il est important de savoir que tous
les fongicides appartenant au même groupe chimique (Tableau 1) ont le
même mode d'action. Il est préférable d'utiliser des
fongicides qui ont différents modes d'action pour éviter le
phénomène de résistance ou `d'accoutumance' du champignon
[10].
Il est important de noter que les fongicides affectent
une ou plusieurs activités métaboliques du champignon. Les
fongicides qui agissent sur un seul site métabolique sont
généralement efficaces seulement sur certains champignons, mais
il est plus facile pour le champignon de développer de la
résistance. D'autre part, les fongicides qui agissent sur plusieurs
sites métaboliques sont plus difficiles à contourner pour les
champignons et le développement de résistance est rare [10].
III-5-Activité et rôle du fongicide selon
son effet sur la croissance du champignon :
Les fongicides peuvent avoir un effet préventif en
détruisant le champignon avant que celui-ci ne pénètre
dans la plante. On appelle souvent ces fongicides `antigerminatif '. Les
fongicides de contact (ou de surface) sont généralement
utilisés comme préventifs. Les fongicides peuvent
également avoir un effet curatif en détruisant le champignon
après que celui-ci ait pénétré dans la plante. La
durée et l'intensité de l'effet curatif varient selon le
fongicide et la température. Certains fongicides ont un effet
antisporulant en détruisant la reproduction du champignon suite à
une infection [10].
III-6-Toxicité des fongicides :
On a soumis des justifications acceptables pour
l'exemption des exigences d'essais en matière de toxicologie
environnementale relative aux oiseaux, mammifères sauvages, poissons
d'eau douce, d'estuaire et de mer, arthropodes terrestres et aquatiques,
microorganismes, plantes aquatiques et plantes terrestres non visées.
Ces justifications se fondaient sur l'exposition minimale liée aux
usages proposés pour les produits, la nature répandue de T.
harzianum, le manque d'effets nocifs signalés dans la documentation
publiée et l'incapacité de T. harzianum de
s'établir dans des environnements aquatiques non pollués.
Même si des biotypes agressifs de T. harzianum ont
déjà été identifiés comme agent responsable
de la « maladie de la moisissure verte » dans les
champignonnières commerciales, on considère que de tels risques
sont faibles si l'on n'utilise pas ces produits dans les
champignonnières et si la matière végétale
traitée n'est pas utilisée comme substrat par les producteurs de
champignons. On a refusé l'épreuve de toxicité orale
aiguë chez les oiseaux. Cependant, on ne considère pas ces
données nécessaires pour évaluer les risques de la souche
KRL-AG2 de T. harzianum puisqu'on s'attend à ce que le
potentiel d'exposition de ces organismes par voie orale soit minime puisque le
produit est utilisé en serre. L'ingrédient de formulation
identifié dans le fongicide biologique en poudre mouillable RootShield
Drench et le fongicide biologique RootShield Granules ne pose pas de risque
environnemental si les produits sont utilisés aux concentrations et
doses d'application proposés [10].
III-6-1-Effets possibles sur la santé:
III-6-1-1-Yeux: Ce produit peut causer
une irritation modérée des yeux avec lésion
modérée de la cornée. Les poussières peuvent
irriter les yeux.
III-6-1-2-Contact cutané: Un
contact bref peut causer une légère irritation de la peau avec
rougeur locale.
III-6-1-3-Absorption cutanée:
Un contact prolongé avec la peau risque peu d'entraîner
l'absorption de quantités nocives.
III-6-1-4-Ingestion: L'ingestion de
petites quantités de ce produit par suite de manipulation normale ne
devrait pas causer de lésions; toutefois, l'ingestion de plus grandes
quantités pourrait en causer.
III-6-1-5-Inhalation: Les
poussières peuvent causer une irritation des voies respiratoires
supérieures (nez et gorge) et des poumons [22].
III-7-Données sur la toxicité:
III-7-1-Absorption cutanée: DL
50 cutanée aiguë (lapin) >5000 mg/kg.
III-7-2-Ingestion: DL 50
orale aiguë (rat): estimée à >1600 mg/kg.
III-7-3-Inhalation: Indisponible
III-7-4-Sensibilisation:
Données indisponibles
III-7-5-Effets chroniques: Au cours
d'études animales, le myclobutanil a eu des effets sur le foie, les
testicules, la glande surrénale, les reins et la glande thyroïde.
Une exposition excessive répétée à la silice
cristalline peut causer la silicose, une maladie progressive et invalidante des
poumons [10].
III-7-6-Cancer:
Le myclobutanil n'a pas causé de cancer chez les
animaux de laboratoire. Cette formulation contient de la silice cristalline qui
est classée comme étant cancérogène par l'OSHA. La
silice cristalline est classée comme étant
cancérogène par le CIRC et le NTP. On a constaté que la
silice cristalline cause le cancer chez les animaux de laboratoire et les
humains. On a observé de la fibrose pulmonaire et des tumeurs aux
poumons chez les rats exposés au dioxyde de titane au cours de deux
études d'inhalation portant sur toute la vie. On croit que ces effets
sont dus à une surcharge des mécanismes normaux de
dégagement des voies respiratoires causée par les conditions
extrêmes des études. Il n'y a pas eu d'incidence inhabituelle de
maladies respiratoires chroniques ni de cancer des poumons chez les
travailleurs exposés au dioxyde de titane en milieu de travail. Le
dioxyde de titane n'a pas causé de cancer chez les animaux de
laboratoire au cours d'études alimentaires durant toute leur vie
[10].
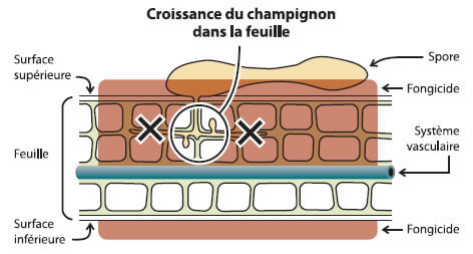
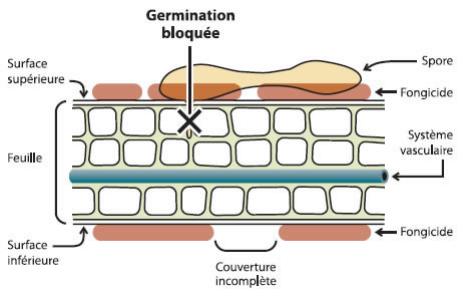
Figure 13. Mode d'action général des
fongicides [33,34].
III-8-Classification selon leur mode
d'action :
III-8-1-Les multi sites :
III-8-1-1- Définition :
Un organisme multi site est un organisme qui
possède un siège central identifié où des
activités sont planifiées, contrôlées et
gérées ainsi que d'un réseau de sites (sièges
locaux ou succursales) où ces mêmes activités sont
partiellement ou entièrement réalisées. Le système
de management de la qualité de l'organisme doit être
géré de façon centralisée. Il est défini,
mis en place et surveillé en permanence par le siège central. En
cas de besoin, celui-ci doit pouvoir mettre en oeuvre des actions correctives
dans n'importe quel site. La revue de direction est initiée par le
siège central. Tous les sites concernés (siège central
compris) doivent participer à des programmes d'audit interne. Le
siège central doit démontrer sa capacité à
recueillir et analyser les données de tous les sites, ainsi que son
autorité et sa capacité à initier des changements
organisationnels qui s'imposent, notamment sur les points suivants :
Ø Documentation et changements relatifs au
système.
Ø Revue de direction.
Ø Plaintes.
Ø Evaluation des actions correctives.
Ø Planification d'un audit interne et évaluation
des résultats [113].
III-8-1-2-Exemple des multisites :
III-8-1-2-1-Bravo
(Chlorothalonil) :
Ø La spécialité : BRAVO 720 SC
Ø Matière active : 720 g/l de
chlorothalonil
Ø Classe / famille : Fongicide / D.Phtalique
Ø Homologation : E01-03-005 APV du 01/01/03
au31/12/06
Ø Maladie : Mildiou
Ø Culture : Tomate et Pomme de terre
Ø Dose d'application : 200 ml PC/hl
Ø Époque et fréquence :
d'application Une fois que les conditions sont favorables au
développement de la maladie. Répéter les traitements si
nécessaires tous les 7 à 10 jours [113]
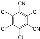
Figure 14. Structure chimique du
bravo [42].
III-8-1-2-1-1-Spectre
d'action :
Bravo contrôle beaucoup plus de maladies
comparé à la plupart des fongicides multisites. Son large spectre
d'action permet à l'agriculture de contrôler plusieurs maladies
par un seul produit. En outre, Bravo est le partenaire idéal pour
complémenter d'autre matière active dans les programmes de
management de la résistance aux fongicides.
Tableau 19. Spectre d'action de bravo comparé à
d'autre classe de fongicides [114].
|
champignon
fongicide
|
Bravo
|
Strobilurin
|
EBI
|
Dicarboximide
|
Benzimidazotes
|
|
Ascomycètes
|
+
|
+
|
+
|
+
|
+
|
|
Basidiomycètes
|
+
|
+
|
+
|
+
|
+
|
|
Deutéromycètes
|
+
|
+
|
+
|
+
|
+
|
|
Oomycètes
|
+
|
+
|
-
|
-
|
-
|
III-8-1-2-1-2-Mode d'action de
Bravo :
Bravo est un fongicide pour la prévention des
maladies fongiques, c'est un puissant inhibiteur de la germination des spores
et zoospores, il n'a pas de propriétés curatives, l'application
doit être fait avant l'apparition de l'infection [114]
III-8-1-2-1-3-Distribution sur la surface des
feuilles :
Bravo se colle aux feuilles, demeure et résiste
à la pluie - nombres de pathogènes contrôlés par
Bravo prolifèrent sous des conditions d'intenses précipitations
(pluie ou arrosage), nécessitant une grande résistance au
lessivage.
Ø Les études ont démontré que les
propriétés uniques de la formulation de Bravo permettent au
chlorothalonil une adhésion tenace sur les feuilles.
Ø Chlorothalonil n'est pas systémique et ne se
déplace pas du site d'application vers d'autres parties de la plante,
ainsi une bonne application de Bravo® implique un contrôle efficace
et persistant.
Ø Bravo n'est pas absorbé par les racine [114] .
III-8-1-3-Mode d'action des fongicides
multisites :
Représentent les produits minéraux
à base cuivre et de soufre, les organomercuriques, les dithiocarbamates,
les phtalimides, les hydroxyquinolienes, les guanidinesetc. Ils sont
réservés à la protection externe préventive, leur
activité antifongique inhibe essentiellement la production et/ou les
transferts d'énergie chez les champignons, et leurs effets sont plus
marqués sur la germination des spores que sur la croissance
mycélienne (associés au catabolisme des substances de
réserves: lipides et glucides). Certains d'entre eux: organomercuriques,
dithiocarbamates, mané, etc. interfèrent dans les processus
respiratoires, et peuvent inactiver les enzymes et les coenzymes
impliqués. Les principales réserves d'énergie étant
constitués de lipides et de polysaccharides, il apparaît que la
coenzyme-A-sulfhydril (CoASH) représente un site privilégie de
tels fongicides, de même que la triose phosphate
déshydrogénase et le système pyruvate
déshydrogénase. Le même auteur, signale également
que, d'autres fongicides multisites (dinitrophénol), sont toxiques pour
l'agent pathogène, et agissent comme découplant de la
phosphorylation, entraînant une augmentation de la respiration,
corrélative à une diminution de la production d'ATP [11].
III-8-2-Les unisites :
III-8-2-1-Définition :
Ce sont des substances systémiques
pénétrant par les racines ou les feuilles, et sont
réparties dans la plante par l'intermédiaire du système
vasculaire. Ces composés sont dépourvus de toxicité
vis-à-vis du parasite et agissent sur un nombre très
limité de cibles (oligosites), souvent sur une seule (unisites) [10].
III-8-2-2-Mode d'action :
III-8-2-2-1-Sites d'action sur la
respiration :
Les fongicides cis-crotonanilides
présentent une activité spécifique vis-à-vis des
basidiomycètes, ils interagissent chez le parasite avec une
protéine mitochondriale contenant du fer et inhibent de la sorte une
enzyme de la chaîne respiratoire. Ces fongicides sont essentiellement
utilisés en céréales pour combattre les maladies
charbonneuses et les caries de l'épi [11].
III-8-2-2-2-Effet sur les
membranes :
Le cytoplasme cellulaire est séparé du
milieu extérieur par une membrane qui comprend des protéines, des
phospholipides et des stérols jouant un rôle stabilisateur de la
structure membranaire : régulation de certaines enzymes
membranaires, des échanges avec le milieu extérieur, ainsi que de
la biosynthèse des parois cellulaires, chez la plupart des champignons
(Ascomycètes, Basidiomycètes et champignons imparfaits),
l'ergostérol est le principal stérol membranaire, alors que le
cholestérol et le sitostérol sont surtout présents chez
les mammifères et le stigmastérol chez les plantes
supérieures. Les inhibiteurs de la synthèse
d'érgostérol (I.B.E) montrent un spectre de toxicité
très large à l'égard des appartiennent aux groupes des
triazoles, des imidazoles, des trichloéthylformamides et des
morpholines, les fongicides agricoles agissant sur la biosynthèse des
stérols (I.B.S) n'ont pas tous les mêmes cibles enzymatiques, et
peuvent être classés en deux groupes :
III-8-2-2-2-1-Groupe 1 : Les
matières actives provoquant l'accumulation des stérols
méthylés en C4 et C14 par inhibition de la C14
déméthylase.
III-8-2-2-2-2-Groupe2 : Les
fongicides inhibant la synthèse des stérols, en provoquant
l'accumulation des stérols non méthylés comportant une ou
deux doubles liaisons.
III-8-2-2-3-Inhibition de la synthèse des
parois :
Il s'agit de l'inhibition de la
synthèse des chitines, des glucanes, etc. Selon SEMAL (1989), ce groupe
renferme :
Ø Les produits organo-phosphorés, qui
empêchent le transfert des précurseurs de chitine au travers de la
membrane en inhibant la synthèse de certains phospholipides
membranaires.
Ø Les polyoxines, qui inhibent la synthèse de la
chitine en agissant comme compétiteurs de la chitine synthase.
Ces composés sont inactifs sur les oomycètes,
qui sont dépourvus de chitine [11].
III-8-3-Les antimitotiques :
III-8-2-1-Mode d'action :
La plupart des composés
antimitotiques n'altèrent pas la duplication de l'ADN, mais perturbent
la ségrégation des chromosomes en empêchant la formation
et/ou le fonctionnement des fuseaux achromatiques. Ces composés toxiques
sont spécialement actifs sur la croissance mycélienne, mais ont
peu d'effet sur la germination des spores. Les principaux fongicides de ce type
appartiennent à la famille des benzimidazoles, des thiophanates et des
phénylcarbamates. Le carbendazime (métabolite des benzimidazoles
et des thiophanates) se fixe sur une protéine (la tubuline) constituant
des microtubules des microtubules des fuseaux achromatiques. La
spécificité du carbendazime vis-à-vis des champignons
résulte de sa faible affinité pour les tubulines des plantes
supérieures et des animaux, et la résistance de certaines souches
aux carbendazimes est due à la présence, chez ces derniers de
tubulines modifiées [11].
III-8-2-2-Les principaux agents
antibiotiques :
III-8-2-2-1-Les mécanismes
d'action :
Certains médicaments anti-cancéreux sont
dits "cycle dépendant": ils sont actifs sur toutes les cellules,
à condition que celles-ci soient dans le cycle cellulaire. Ils sont
à l'opposé inactifs sur les cellules en G0. Parmi ces
médicaments, on retient par exemple les agents alkylants
(Cyclophosphamide). D'autres médicaments anti-cancéreux
n'agissent que sur des cellules se trouvant à une phase donnée du
cycle cellulaire. Ces agents sont dits "phase dépendant". C'est le cas
par exemple des poisons du fuseau (Vincristine) Avant l'administration des
médicaments "phase ou cycle dépendant", il est intéressant
que le maximum de cellules se trouve dans le cycle cellulaire, et ne soit donc
plus en phase G0. Ceci est réalisé par un phénomène
dit de "recrutement" qui consiste à faire entrer des cellules
temporairement au repos dans le cycle cellulaire. Ceci est possible par
réduction du volume tumoral grâce à un traitement
chirurgical, radiothérapique ou chimique (par exemple Adriamycine) Si
l'on donne un médicament "phase dépendant", il est
nécessaire que le maximum de cellules soit dans cette phase. Le terme
utilisé ici est celui de "synchronisation". Celle-ci est possible
grâce à l'administration d'un médicament bloquant les
cellules à une phase déterminée avant l'administration du
2ème produit "phase dépendant [115].
III-8-2-3-Rôle des antimitotiques :
Les antimitotiques ont pour fonction d'empêcher
les divisions cellulaires en agissant directement sur leur dynamique,un tissu,
un organe, tient sa forme et sa fonction du fait que des signaux permettent le
maintient intègré de l'ensemble (c'est l'homéostasie). Le
cancer est une maladie qui provient d'une dérégulation des
signaux qui permettent de contrôler les divisions cellulaires. La tumeur
est, toujours en gros, la résultante d'une hyperproliferation cellulaire
qui prend de la place et empêche les organes de fonctionner,
l'idée du traitement antimitotique est d'empêcher les cellules de
se multiplier. Pour reprendre l'idée du train c'est un peu comme si on
avait perdu le pilote. Comme on ne peut plus communiquer avec lui alors on
arrête le train de façon brutale. Le hic des antimitotiques c'est
qu'ils font plus qu'arrêter le train. Ils empêchent toute cellule
de se diviser, les "malades" comme les normales. Un peu comme si au lieu
d'arrêter un train on arrêtait tous les trains. C'est une sorte de
traitement de la dernière chance où l'on cible large. Le but est
de se dire que les des agréments induits seront moins pires (et pourront
être récupérés par la suite) que la mort du patient.
Ce sont des molécules qui bloquent le cycle cellulaire. Certaines en
particulier inhibent la polymérisation du fuseau mitotique. D'autres
types d'action aussi, dégâts à l'ADN, inhibition de la
synthèse des bases, interaction avec les polymérases [116].
III-8-2-4-Toxicité :
III-8-2-4-1-Les poisons du fuseau : le
succès des antimitotiques comme
anticancéreux :
De nombreuses substances issues de
plantes agissent sur les microtubules. Cette action est probablement à
la base des vertues médicinales attribuées à ces plantes
depuis des siècles. Nous nous intéresserons ici aux
anti-mitotiques, dont les dérivés synthétiques restent
encore aujourd'hui des médicaments de choix dans le traitement des
cancers. Les alcaloïdes de la pervenche (vincristine et vinblastine
étant les prototypes) sont utilisés depuis plus de 40 ans
notamment dans le traitement des hémopathies, des substances issues de
l'écorce de l'if, les taxanes, font partie des drogues de
référence des cancers du sein. Les vinca alcaloïdes et les
taxanes ont des sites de fixation distincts et des effets opposés sur la
polymérisation de la tubuline in vitro. In vivo,
l'effet se traduit par un ralentissement ou un arrêt de la mitose entre
métaphase et anaphase, avec parfois apparition de figures de mitoses
anormales, il existe aussi d'autres poisons du fuseau qui n'ont jamais atteint
le stade clinique. Un bon exemple est la colchicine, utilisée
traditionnellement en
cytogénétique
pour obtenir des étalements de chromosomes métaphasiques, plus
faciles à caryotyper, un de leurs effets secondaire, la
neurotoxicité, trouve son explication dans le lien entre microtubules et
transport axonal [117].
IV-Autres pesticides :
IV-1-Les rodenticides :
IV-1-1-Définition :
Une grande variété de matériaux
sont utilisés comme rodenticides , ces rodenticides sont
présents sous la forme de granulés, de grains, ou de plaquettes
généralement de couleur rose,un produit rodenticide (du latin,
rodere, ronger) est une substance active ou une préparation ayant la
propriété de tuer certains rongeurs, considérés
comme nuisibles par l'homme, les rodenticides sont utilisés dans
l'environnement domestique, en milieu rural et dans l'industrie agroalimentaire
pour lutter contre les souris, les surmulots, les taupes (qui ne sont pas des
rongeurs mais des insectivores), les ragondins, les campagnols. Ils sont
commercialisés sous forme de poudres de piste, de concentras huileux,
d'appâts près à l'emploi et, plus rarement, en fumigations
dans les galeries creusées par les rongeurs, ils posent des risques pour
empoisonnements accidentels pour plusieurs raisons [22].
Premièrement, comme agents spécifiquement
conçue pour tuer mammifères, souvent leur toxicité est
très similaire pour l'objectif rongeur et pour les humains. (Warfarine
et d'autres anticoagulant rodenticides étaient initialement
développé pour surmonter ce problème en créant des
composés qui étaient hautement toxique pour rongeurs, surtout
après expositions répétées, mais beaucoup moins
toxique pour les humains.) [22].
Deuxièmement, depuis rongeurs habituellement part
environnements avec l'homme et d'autres mammifères, le risque
d'exposition accidentelle est partie intégrante de l'affectation des
appâts pour les rongeurs.
Enfin, comme les rongeurs ont développé
une résistance à des rodenticides, il y a un besoin permanent de
développer de nouveaux et potentiellement plus toxiques rodenticides.
Comme les rongeurs sont devenus résistantes à warfarine
appâts, par exemple, le développement de "superwarfarins" a accru
le risque d'humains.
Il est important d'être familier avec les
habitudes de consommation et le développement de plus composés
toxiques et de s'efforcer d'identifier l'agent utilisé afin d'instituer
le plus approprié de gestion pour ces empoisonnements [22].
IV-1-2-Mode d'action :
(warfarine, '
coumachlore,
'
coumatétralyl,
'
bromadiolone,'
difenacoum...)
et de l''
indane
dione-1,3 ('
chlorophacinone,
'
diphacinone,'
difenacoum...).
Ce sont des antivitamines K. La vitamine K joue un rôle clé dans
les phénomènes de la coagulation sanguine de tous les animaux.
Les rongeurs sont particulièrement sensibles à ces produits qui
provoquent des hémorragies par suite du faible volume sanguin de
l'animal et de son rythme cardiaque élevé. La mort survient par
anémie
aiguë, provoquée par les
hémorragies
accidentelles survenant quelques jours à 2 semaines après
l'ingestion. L'
antidote est la '
vitamine
K1. Ce type de rodenticide est un poison d'accumulation
présenté en mélange avec un appât et il est
nécessaire que le rongeur consomme plusieurs doses durant plusieurs
jours. La mort survient habituellement 3 à 10 jours après la
première prise. Ces produits sont souvent utilisés dans le cadre
de campagne de dératisation. est produite, à partir de la
vitamine K oxydée, par une vitamine K époxyde réductase et
une vitamine K réductase pouvant être inhibées par la
warfarine. Donc, la warfarine bloque une voie de réduction de la
vitamine K qui est nécessaire pour l'activation des facteurs de
coagulation par carboxylation. La vitamine K peut aussi être
réduite par une autre voie impliquant la réductase
NADP-dépendante, peu sensible à la warfarine .La vitamine K est
liposoluble et sa concentration sérique est diminuée en
présence de malabsorption des graisses, de malnutrition ou d'un
traitement antibiotique [54].
('
alpha-chloralose,
'
crimidine,
strychnine). Ils
entraînent rapidement la mort après un coma ou des spasmes
musculaires. Pas d'antidote; traitement symptomatique: anti-convulsivants et
ventilation.
Ø Les '
cardiotoxiques :
glucosides cardiaques ('
scilliroside),
provoquant la mort par arrêt cardiaque. Pas d'antidote; traitement
classique de l''
intoxication
digitalique.
Ø Les '
cytotoxiques,
poisons cellulaires tels que le phosphure de zinc, d'aluminium, de calcium,
sources d'hydrogène phosphoré (ou phosphure d'hydrogène)
qui est un gaz hautement toxique (
hypotension,
oedème
pulmonaire, convulsions ...). Ce groupe de substances provoque une mort
violente. Le phosphure de zinc est un produit plus stable que ces voisins et
qui, mélangé à un appât, est ingéré
par l'animal. Il libère alors dans l'organisme le phosphure
d'hydrogène qui entraîne la mort quelques heures après
l'ingestion [54].
IV-1-2-3-Les '
hypercalcémiants:
('
calciférol,
cholécalciférol),
souvent associés au coumafène.
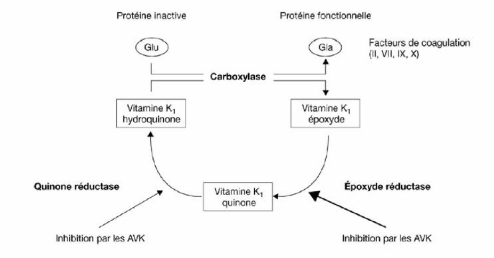
IV-1-2-4-les gaz lacrymogènes comme la
chloropicrine:
Mort par oedème pulmonaire aigu. [54]
Figure 15. Mode d'action des rodenticides
anticoagulants [9].
IV-1-2-Toxicité :
Les poisons utilisés couramment dans les campagnes
de dératisation sont des rodenticides anticoagulants. Ce sont des
antagonistes de la vitamine K, qui joue un rôle clé dans la
coagulation sanguine. Toute coagulation devient impossible, on observe des
hémorragies incontrôlables et finalement mortelles, leur action
est d'autant plus dangereuse que les produits actuellement utilisés sont
à action retardée: lorsque les premiers symptômes
apparaissent, il est déjà très tard..., exemples :
coumafène, bromadiolone, difenacoum, brodifacoum[25].
Chez l'adulte, la prise accidentelle de produits
rodenticides à base d'anticoagulants n'entraîne
généralement pas -à moins d'absorption massive à
but suicidaire- de troubles de la coagulation, ni d'hémorragie. Par
contre, chez l'enfant, des hémorragies graves peuvent survenir. Ces
produits agissent en abaissant le taux de prothrombine dans le sang,
nécessaire à la formation du caillot sanguin, entraînant
ainsi des hémorragies internes, les symptômes apparaissent
après quelques jours pour une dose élevée, après
quelques semaines pour des prises répétées : sang dans les
urines, saignement de nez, hémorragie gingivale, sang dans les selles,
anémie, faiblesse, la mort peut survenir dans les 5 à 7 jours qui
suivent[25].
IV-1-3-Divesrses classes de rodenticides :
Les rodenticides appartiennent à des familles chimiques
très diverses :
IV-1-3-1-Rodenticides d'origine naturelle :
IV-1-3-1-1-Scilliroside :
IV-1-3-1-1-1-Définition :
C'est un rodenticide sélectif extrait d'une
plante :la scille rouge (Urginea maritima) dont le principe actif
est un glycoside :la Scillirosid, sa sélectivité provient
du fait que les rongeurs sont incapables de vomir contrairement aux autres
espèces animales chez les quelles la scille engendre des vomissements.
La Scilliroside est un solide cristallin jaune. Il est hygroscopique et non
corrosif. Scilliroside est sensible à la chaleur et doivent être
utilisées à des températures inférieures à
80 ° C. Sa durée est de un à cinq ans si elle est
protégée de la lumière forte et à faible pH
[22].
IV-1-3-1-1-2-Mode d'action :
Les propriétés toxiques de la scille
rouge sont connues depuis l'Antiquité et sont probablement dues à
glycosides cardiaques, pour plusieurs raisons, de mammifères autres que
les rongeurs ne sont pas susceptibles d'être empoisonné. La
scille rouge est intensément nausées, de sorte que les animaux
qui vomi (rongeurs ne le font pas) sont peu susceptibles de conserver le
poison. Le glycoside n'est pas efficacement absorbé dans l'intestin, et
glycoside est rapidement excrété. Injection des glycosides
conduit à des effets typiques de la digitaline: modifications de
l'impulsion de conduction cardiaque et des arythmies [3].
IV-1-3-1-2-Strychnine :
IV-1-3-1-2-1-Définition :
Est une toxine naturelle du fruit (
Strychnos
nux-vomica), qui provoque des convulsions violentes direct par une
action excitatrice sur les cellules du système nerveux central,
principalement de la moelle épinière. La mort est causée
par des interférences convulsives avec la fonction pulmonaire, par la
dépression du centre respiratoire activité, ou les deux [22].
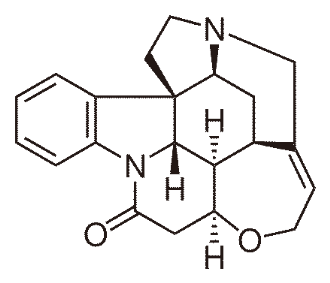
Figure 16. Structure chimique
de la Strychnine [45].
IV-1-3-1-2-2-Mode d'action :
La strychnine est un stimulant du système nerveux
central. Elle accroît le goût, l'odorat et la vue. À dose
moyenne, elle augmente l'amplitude respiratoire. À dose létale,
0,2 mg/kg pouvant suffire : spasmes musculaires au bout de 10 à 20
minutes en commençant par la tête et le cou, fortes douleurs,
convulsions, arrêt cardiaque, puis la mort par asphyxie. Les meilleurs
antidotes sont les barbituriques [22].
IV-1-3-2-Les rodenticides minéraux :
IV-1-3-2-1-Le sulfate de thallium :
IV
-1-3-2-1-1-Définition :
Le thallium est utilisé largement comme un
rodenticide, il est inodore et insipide, et pour cela il ne donne pas signal de
sa présence, son utilisation a été limité depuis en
US depuis 1975, comme un protecteur de maison contre les rongeurs, la
conductivité électrique du thallium change à l'exposition
à la lumière infrarouge, et ce composé est utilisé
dans les photocellules [18].
IV-1-3-2-1-2-Mode d'action :
Le thallium est aisément absorbés par
toute les voies, il se distribue facilement dans tous l'organisme, et peut
traversés la barrière placentaire, son élimination est en
majeur partie urinaire et gastro-intestinale, elle peut durée plusieurs
semaines après une prise unique, les autres vois d'élimination
(fèces, phanères, sueur) sont des voies d'élimination
secondaire. Le thalium interfère avec l'activité de potassium,
inhibant les échanges d'ion au niveau des membranes cellulaires
(inhibition des pompes k+ATP ase dépendantes). Il inhibe aussi diverses
enzymes et interfère avec les phosphorylations oxydatives suite a sa
combinaison avec des groupes thiols dans les mitochondries [18].
IV-1-3-3-Rodenticides anticoagulants :
Ce sont des dérivés de la coumarine qui
inhibent la synthèse de la prothrombine in vivo.
IV-1-3-3-1-Warfarine :
IV-1-3-3-1-1-Définition :
La warfarine est le prototype de l'anticoagulant. C'est
le premier anticoagulant rodenticide a d'abord été
présenté et enregistré pour une utilisation aux
États-Unis en 1952. La warfarine est utilisée pour
contrôler des rats et des souris dans la maison et autour des maisons,
des animaux et des locaux agricoles, commerciaux et industriels. Il est sans
odeur et sans goût et efficace dans de très faibles doses. Action
n'est pas rapide, habituellement environ une semaine est nécessaire
avant une réduction marquée de la population de rongeurs est
perceptible [22].
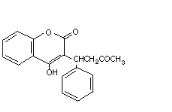
Figure 17. Structure
chimique de la warfarine [46].
IV-1-3-3-1-2-Mode d'action :
Le warfarin exerce deux actions :
Ø Inhibition de la formation de la prothrombine par
interférence avec le métabolisme de la vitamine K.
Ø Altération de la perméabilité
capillaire.
Les rongeurs n'ont pas tendance à devenir des
appâts-timide après une dégustation de la warfarine, ils
continuent à consommer jusqu'à ce que son anti-coagulation
propriétés ont produit la mort par hémorragie interne. Le
contenu de la prothrombine, le sang est réduit et une hémorragie
interne est induite. L'ingestion répétée est
nécessaire pour produire des symptômes de toxicité. Cela
peut être utilisé rodenticide année après
année dans un rongeur problème. Les souris sont plus difficiles
à contrôler que les rats, et de prendre le contrôle complet
mai une période plus longue.
3
4
11
13
Récemment, des souches résistantes à des rats et des
souris sont en développement [22].
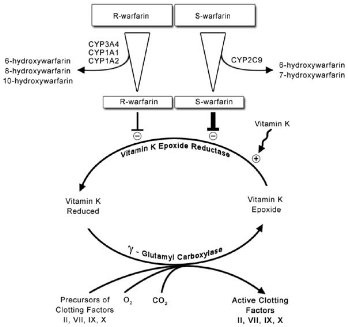
Figure 18. Mode d'action des
warfarines [22].
IV-1-4-Autres rodenticides :
IV-1-4-1-Le cholécalciférol :
IV-1-4-1-1-Définition :
Est la forme active de la vitamine D (vitamine D3).
Son effet toxique est probablement une combinaison d'actions sur le foie, les
reins et, éventuellement, les myocardes, les deux derniers étant
le résultat de toxicité de l'hypercalcémie [18].
IV-1-4-1-2-Toxicité :
Les symptômes précoces et les signes de la
vitamine D dans l'hypercalcémie induite par l'homme sont la fatigue,
faiblesse, maux de tête et des nausées. Polyurie, polydipsie, une
protéinurie, et azotémie résultat tubulaire rénale
aiguë de blessure par l'hypercalcémie. Cela est la cause de la
mort. Hypercalcémie prolongée résultats en fin de compte,
lithiase rénale et néphrocalcinose. Azotémie se produit en
tant que dommages tubulaire rénale progresse [18].
IV-2-
6
12Les
molluscicides :
IV-2-1-Définition :
Les Molluscicides sont les pesticides utilisés
dans l'agriculture ou le jardinage, pour commander spécifiquement des
espèces
de mollusque de parasite du. Ces pesticides sont prévus pour viser
certain lingot et espèces de
l'escargot
qui peuvent endommager des récoltes en les mangeant partiellement. Ces
substances incluent la
métaldéhyde,
le Methiocarb et le sulfate en aluminium, les Molluscicides devraient cependant
être employé
avec prudence, car
elles peuvent être nocives aux animaux de non-cible [4].
IV-2-2-Quelques substances de la famille :
IV-2-2-1-Métaldéhyde :
IV-2-2-1-1-Définition :
Le métaldéhyde est une
substance
active de
produit
phytosanitaire (ou
produit
phytopharmaceutique, ou
pesticide), qui
présente un effet
molluscicide, et qui
est employé pour tuer des
limaces et autres
gastéropodes
[57].
Le métaldéhyde est un composé
très
toxique y compris pour
l'Homme. Il est généralement utilisé sous forme de
comprimés et il convient donc d'éviter de l'ingérer. Il
est en outre inflammable [58].
Figure 19. Structure
chimique métaldéhyde [49].
IV-2-2-1-2-Toxicité :
D'un point de vue toxique, son action est mal connue. En
effet, bien qu'il soit facilement hydrolysé en
acétaldéhyde
notamment et que l'acétaldéhyde est un
neurotoxique bien
connu, les effets sur l'organisme du métaldéhyde ne correspondent
pas à ceux de l'acétaldéhyde. On remarquera cependant que
cette action existe cependant en plus d'autres tel un effet irritant bien
marqué. Les effets les plus marqués sont une sorte d'
ébriété
et une
hypersalivation.
Plus généralement, le metaldéhyde est un
aldéhyde
c'est-à-dire un composé de formule R-CHO, de forme cyclique et
dont le 2e substituant est en position méta sur le polymère R.
Dans la position méta les substituants sont liés à des
carbones adjacents sur le polymère cyclique [58].
IV-3-Les fumigants :
IV-3-1-Définition :
Les fumigants sont des gaz qui diffusent dans la
masse alimentaire en fonction de leur densité :si la densité
est faible ,la pénétration du gaz est grande ,lorsque le
traitement a cassé ,les fumigants utilisés doivent
s'échapper du produit, cette capacité est fonction de leur
pouvoir de désorption ,résultante des propriétés
d'attraction et d'adsorption entre le fumigant et l'aliment ainsi que de la
lipophilie du fumigène :plus il est liposoluble ,plus la
désorption est difficile. Enfin, certains fumigènes
réagissent avec certains substrats contenus dans les aliments .si la
preuve de la formation de dérivés toxique n'a pas encore
été faite, l'on sait que certains nutriments .en particulier les
vitamines peuvent être atteints, les principaux fumigeant utilisés
en agriculture font l'objet d'arrêtés déterminant leurs
conditions d'emploi, les mesures de sécurité à prendre
pour les professionnels et les doses d'emploi maximales [19].
IV-3-2-Les classes des fumigants :
IV-3-2-1-L'oxyde d'éthylène :
Très inflammable, ce produit dangereux est
maintenant interdit d'utilisation [19].
IV-3-2-2-L'acide cyanhydrique :
Il est principalement insecticides, son coût est
peu élevé mais sa toxicité très grande : il
peut réaliser dans l'aliment des liaisons covalentes assez solides avec
certains métaux .de ce fait son emploi très
limité est réservé à des traitements
particuliers : locaux et matériels de transports servant au
stockage à la transformation et au conditionnement de
végétaux ou de produits animaux, locaux d'élevage, mais
dans tous les cas vidés de leurs contenus [19].
IV-3-2-3- Le bromure méthyle :
Peu coûteux il est insecticide fongicide et micro
biocide il est fortement liposoluble : sa désorption, qui est de
deux à trois jours pour le blé est plus longue dans les grains
déagineurs par exemple. Le brome s'ajoute à celui dés
aliments la DJA du brome inorganique est de 1mg/kg certains aliments tels
arachides, noies....peuvent présentes des teneurs en brome
résiduel supérieur aux normes. La réglementation
précise les végétaux dont le traitement au bromure de
méthyle est autorisé et les teneurs maximales
Ø Les exprimées unions Br. en mg/kg il s'agit
en particulier :
Ø Des salades, tomates, pommes de terre nouvelles et
autre légumes frais ;
Ø Des légumes secs et champignons
séchés ;
Ø Des fruits frais, fruits secs, graines
déagineuses et fruits amylacés ;
Ø Des céréales ;
Ø Du cacao, dut hé des plantes aromatique set
des plantes à infusion ainsi des épices [13].
Chapitre3. Effets toxiques des
pesticides
1-Effets toxiques sur l'environnement :
1-1-Pollution des milieux :
Depuis plus d'un quart de siècle, on
sait que l'utilisation de certains pesticides, provoque de profondes
modifications de l'écosystème dans lequel on les introduit
[70].
1-1-1-les sols :
Ils sont contaminés pour de nombreuses
années sur des dizaines de millions d'hectares à l'échelle
européenne. Les pesticides peu dégradables, ou présents
dans un sol acide ou pauvre en bactéries, se stabilisent en se liant
à certains constituants du sol. Par exemple, sous monoculture de
blé traité à l'atrazine, après 1 mois, presque 50 %
de l'atrazine se retrouvent sous forme de résidu lié. Le sol,
sous certaines conditions (réchauffé, érodé,
acidifié, dégradé, amendé...) peut restituer les
pesticides ou leurs sous-produits durant plusieurs années ou
décennies [71].
La dégradation par des micro-organismes du sol et
la dégradation chimique (réactions chimiques, l'hydrolyse par
exemple). Ces processus sont plus importants à haute température
et dans un sol humide. Les produits de dégradation (métabolites)
peuvent aussi avoir des effets polluants pour l'environnement. Pour exemple, le
phénamiphos (nématicide organophosphoré utilisé
pour le traitement d'une grande variété de cultures,
légumes et fruits en particulier) se dégrade en sulphoxyde et
sulphone qui ont le même pouvoir pesticide que le phénamiphos. La
demi-vie dans le sol de la molécule mère (10 jours) est plus
petite que celle de ses produits dérivés (70 jours) [8].
1-1-2- Les eaux de surface et souterraines :
L'Institut Français de l'Environnement dans son
rapport sur la contamination des eaux par les pesticides en France a
révélé l'ampleur du problème. L'ensemble des cours
d'eau étudiés est l'objet d'une contamination par les pesticides
(à 6% près) et 75% des points surveillés en eaux
souterraines sont altérés par la présence de pesticides.
Parmi les substances les plus fréquemment identifiées, on
retrouve, d'année en année, les herbicides de la famille des
triazines (y compris les produits de dégradation), aussi bien dans les
cours d'eau que dans les eaux souterraines. Ce sont également en
majorité des triazines (environ 10 tonnes par an) qui contaminent les
zones estuariennes et côtières du littoral, les grands fleuves
français les alimentant)[70]. .
Le ruissellement conduit
à la pollution des eaux de surface et la lixiviation (Entraînement
par les eaux de drainage) entraîne, elle, la pollution des eaux
souterraines. Toutefois les deux phénomènes sont
étroitement dépendants l'un de l'autre. Le ruissellement est le
mouvement de l'eau (contenant des matières actives dissoutes et en
suspension ainsi que les matières adsorbés sur des
sédiments) à la surface du sol. Les substances sujettes à
ce phénomène sont celles qui restent à la surface du sol,
qui sont absorbées et qui résistent à la
dégradation et à la volatilisation [8].
Les matières actives ayant tendance à
être lessivées sont les substances solubles. De nombreuses
études ont été menées sur l'eau et le sol (on se
soucie de la qualité de l'eau, on mesure son contenu en produit
phytosanitaire , des listes de produits à surveiller en priorité
sont donc établies par les experts du comité de liaison eau
produits antiparasitaires, une valeur limite de 0.1 ìg/l à ne pas
dépasser en milieu naturel a été fixé au niveau
européen) mais ce n'est que depuis les années 60 que des travaux
sur l'air et les phénomènes dans l'atmosphère sont
lancés [8].
1-1-3-l'atmosphère :
Il ya un grand nombre de
pesticides présent dans l'atmosphère, Ils s'y trouvent à
cause de leur épandage (de 30 à 75% des produits
épandus sont transférés), le taux de transfert
dépend de plusieurs facteurs tels : les caractéristiques du
produit (solubilité, volatilité, capacité à se
dégrader), le type de sol, les pratiques agricoles, le type de
pulvérisation, les conditions climatiques, les pesticides sont
véhiculés par les flux atmosphériques, car les travaux de
géochimistes et écologues américains ont confirmé
que des pesticides peuvent contaminer de vastes zones en voyageant dans
l'atmosphère, avant de retomber avec les intempéries ou sous
forme de dépôts secs. Les eaux de pluie sont chargées de
pesticides car le transfert des polluants de l'atmosphère à la
pluie se fait au niveau du nuage [70].
Les gouttelettes de pluie se chargent de produits qui
peuvent avoir une origine locale. Le plus souvent, les traces de biocides
trouvées dans les nuages résultent d'un transport à
moyenne ou longue distance. Des pluies faibles et brèves
présentent des teneurs plus élevées,
particulièrement s'il s'agit de pluies printanières ou de
début d'été précédées d'une longue
période sèche, la recherche des pesticides dans l'air coûte
très cher et nécessite des protocoles très complexes, les
teneurs estimées étant très faibles, de l'ordre du
nanogramme (milliardième de gramme par mètre cube). Pour cette
raison, on les recherche de préférence dans l'eau. En France,
l'INRA de Rennes a effectué entre 1995 et 1996 des mesures dans les eaux
de pluie (Environnement magazine de mai 2000). Les prélèvements
ont été effectués dans plusieurs sites, le transport des
pesticides par l'atmosphère peut être illustré avec le cas
de Trémargat, village du centre Bretagne : les mesures effectuées
révélaient des taux proches des maxima admissibles en atrazine et
en alachlore, avec un taux atteignant la valeur de 100 ng/l en dinoterbe
(pesticide actuellement interdit). Au final, 6 pesticides étaient
détectés dans une eau de pluie dont on aurait pu attendre une
pureté maximale, les brouillards et autres phénomènes de
particules d'eau en suspension, ne sont pas épargnés. Ils
présentent généralement des taux 30 à 100 fois plus
importants en pesticides que les pluies (les gouttelettes les plus fines sont
celles qui concentrent le plus les pesticides) [71].
1-1-4- Les lieux d'habitation :
Certains produits domestiques (produits de traitement des
bois ou tissus, insecticides, produits antiparasitaires...) contiennent des
matières actives nocives par contact, inhalation ou ingestion. Ils
imprègnent murs, rideaux, coussins, moquettes et poussières,
exposant les enfants à des doses souvent supérieures à
celles des adultes. Des études nord-américaines mettent en
évidence la présence de 1 à 18 pesticides dans l'air des
maisons étudiées [70].
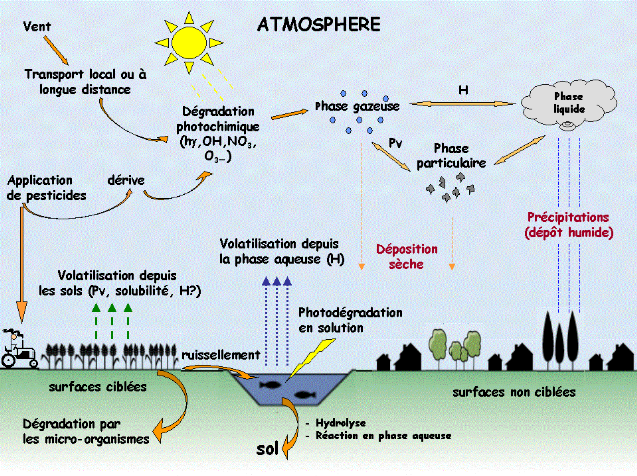
Figure 20. Devenir des pesticides dans
l'environnement [68].
1-2-Effets sur les espèces :
Les pesticides ont constitué un énorme
progrès dans la maîtrise des ressources alimentaires, mais le
revers de la médaille est apparu très rapidement ; des
phénomènes de résistance chez les insectes, puis
l'apparition de troubles de la reproduction chez les oiseaux ont montré
de façon spectaculaire les limites et les dangers pour l'environnement
de leur utilisation sans discernement. Le célèbre livre de Rachel
Carson, Printemps silencieux (1962), qui dénonçait avec
force les dégâts provoqués par les insecticides
organochlorés, a fait prendre conscience à la communauté
scientifique et à l'opinion publique des dangers des pesticides. Trente
ans après, le dilemme existe toujours entre la nécessité
de construire un système de développement durable pour
l'humanité dans un environnement de moins en moins contaminé,
tout en assurant une lutte efficace contre les ravageurs des cultures et les
vecteurs de maladies [120].
Dans ce débat, la recherche a son rôle
à jouer et le comité Ecologie et gestion du patrimoine naturel
(EGPN) du SRETIE lançait un appel d'offres sous le titre Impacts des
pesticides sur la faune et la flore sauvages pour inciter des travaux de
recherche dans ce domaine. Ces travaux terminés, à l'issue d'une
journée de restitution des résultats organisée à
Lyon le 6 février 1991, il est apparu intéressant, au-delà
des interventions spécialisées, de reprendre les principaux
éléments de la discussion, de mettre en lumière les
constats et dégager des perspectives, les textes rédigés
pour la plupart par des participants à cet appel d'offres, sont
ordonnés autour de deux points essentiels : que savons-nous exactement
aujourd'hui de la contamination de l'environnement et des effets des pesticides
sur les biocénoses ? Comment évaluer demain le risque
environnemental lié à l'emploi des pesticides ? [120].
1-2-1-Effets sur la Flore :
A l'évidence, les herbicides sont les
produits les plus nocifs pour les plantes non-cultivées. Mais la
microflore est aussi atteinte et dans certaines zones, on peut suspecter un
lien de cause à effet entre l'utilisation des pesticides et, par
exemple, la disparition de lichens. Les pesticides auraient également
une responsabilité dans le dépérissement forestier :
pour Hartmut Frank, écotoxicologue de l'Université de
Tübingen, les sols des parcelles les plus touchées
présentent de fortes concentrations en trichloroacide acétique,
jusqu'à 0,4 mg/m3 sur des zones où il n'a jamais
été appliqué (communication orale) [121].
1-2-2-Effets sur la Faune :
La faune est exposée aux pesticides en mangeant
des aliments ou de l'eau contaminés, en respirant les vapeurs des
pesticides ou en absorbant les pesticides à travers leur peau. Les
prédateurs peuvent être empoisonnés en mangeant des animaux
qui ont été exposés aux pesticides. Beaucoup
d'insecticides affectent le système nerveux des animaux sauvages, ce qui
peut interférer avec leur capacité à survivre ou à
se reproduire. Les pesticides peuvent aussi passer à travers le placenta
ou affecter les oeufs des oiseaux ou des reptiles, ce qui cause des
affaiblissements ou des défauts qui apparaissent plus tard dans la vie.
Les herbicides, utilisés pour tuer les mauvaises herbes, affectent les
plantes qui sont importantes pour la survie de la faune. Les poissons, les
amphibiens et les insectes aquatiques sont spécialement susceptibles
à la contamination de l'eau par les pesticides. Ceci affecte aussi les
animaux comme les canetons qui sont dépendants de ces créatures
pour survivre [121].
1-2-2-1-Évaluation du danger :
On effectue des essais d'écotoxicité,
généralement en laboratoire, sur des espèces
représentatives et compatibles avec le contexte expérimental
(biologie connue, espèces peu sujettes à des variations
génétiques, espèces d'une maintenance facile et de faible
coût, espèces ayant un rôle important dans les
biocénoses). De nombreuses études permettent donc d'identifier
les dangers à court, moyen et long terme pour les espèces non
cibles. Les effets que peut avoir un pesticide sur les organismes autres
que sa cible sont de deux types:
Ø La toxicité aiguë ou létale qui
est liée à une pollution majeure et ponctuelle du milieu
provoquant la mort des organismes.
Ø La toxicité chronique qui est le plus souvent
liée à une exposition prolongée à de faibles
concentrations de polluants qui vont induire des effets directs ou indirects
sur les organismes et les populations (modification de comportement, de
fertilité...). A long terme la toxicité chronique peut conduire
à des malformations congénitales, voire à la mort
prématurée des individus ou des populations.
Les pesticides s'accumulent au fil de la chaîne
trophique pour se concentrer dans les derniers maillons de cette chaîne,
d'où les effets indirects que peuvent avoir les pesticides sur certain
organisme. La présence de produits phytosanitaires dans le milieu
naturel est de nature à nuire aux espèces non cibles et
représentatives de groupes faunistiques et floristiques exposés.
Les éventuels effets de la substance sont évalués
[122].
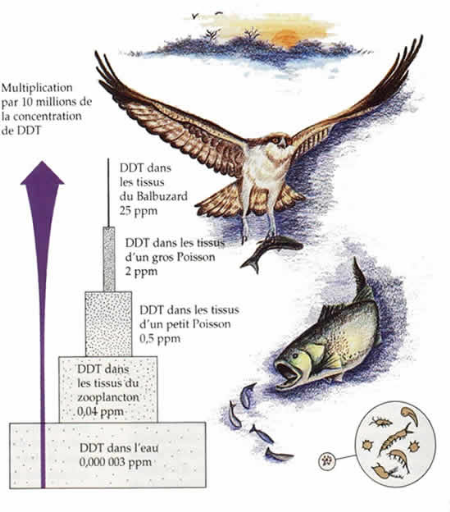
Figure 21. Exemple de l'accumulation du DTT (organochloré
interdit) dans la chaîne trophique [123].
1-2-2-1-1-La toxicité aquatique
:
Poissons (salmonidés, cyprinidés),
daphnies, algues ; globalement, il faut noter que les poissons et les
organismes aquatiques sont sensibles à la toxicité de certains
pesticides à de très faibles concentrations (de l'ordre du
microgramme par litre, soit 0.000001 g de produit phytosanitaire présent
dans 1 litre d'eau ou 0.001ppm). On peut estimer plusieurs types de
toxicité : la toxicité aviaire, la toxicité apicole,
la toxicité sur les insectes non cibles ,la toxicité pour les
organismes du sol, la toxicité pour les auxiliaires non cibles [122].
1-2-2-2-Les oiseaux :
1-2-2-2-1-Les pesticides les moins toxiques pour
les oiseaux:
Certains pesticides sont beaucoup plus spécifiques
et moins toxiques pour les oiseaux, mais il faut toujours les utiliser avec
soin. Par exemple, les pyréthrines de synthèse sont plus
sélectives que les organophosphorés et les carbamates et ne sont
normalement pas très toxiques pour les oiseaux ou les mammifères.
Mais attention, ils sont particulièrement toxiques pour les poissons,
les batraciens et les invertébrés terrestres et aquatiques. La
sélectivité est bien souvent un concept relatif. En
général, les microbes spécifiques d'un ravageur
ou qui s'attaquent à un nombre limité d'insectes
apparentés, ainsi que les insectes prédateurs ou
parasites lâchés en grands nombres sur un ravageur
particulier constituent les moyens les plus sélectifs de lutter contre
les insectes nuisibles et sont ceux qui perturbent le moins le milieu naturel.
Le Bacillus thurigiensis kurstaki (Btk) est un microbe employé
communément pour détruire l'intestin de la chenille. Les
chenilles nuisibles comprennent la spongieuse, la tordeuse des bourgeons de
l'épinette et la pyrale du maïs. La plupart des herbicides et
fongicides ne sont pas trop toxiques pour les oiseaux ou d'autres animaux.
Toutefois, en laboratoire (mais pas encore en milieu naturel), plusieurs
d'entre eux se sont révélés nuisibles à la
reproduction des oiseaux. De plus, plusieurs de ces produits sont toxiques pour
les poissons et les vers de terre, de sorte que certains oiseaux risquent de
trouver moins de nourriture dans la nature après leur application
[124].
1-2-2-2-2-Effets sur les
oiseaux :
Un pesticide peut tuer l'oiseau directement,
l'empoisonner sans le tuer ou avoir un effet indirect sur lui en
réduisant sa nourriture ou la couverture végétale qui
l'abrite [124].
1-2-2-2-2-1-L'empoisonnement létal :
Les insectes et la végétation qui ont
été pulvérisés d'insecticides peuvent receler
suffisamment de résidus pour tuer des oiseaux affamés. Une
mortalité massive, comme celles décrites dans l'encadré 1,
peut survenir même lorsque les pesticides sont appliqués de
manière responsable, selon les instructions inscrites sur
l'étiquette, c'est pourquoi il importe de surveiller le
rendement du produit et de signaler tout problème. Il suffit d'une ou
deux petites granules des organophosphorés ou carbamates les plus
toxiques pour tuer un petit oiseau. En outre, la quantité de
résidus de pesticide qui reste dans l'estomac des oiseaux et
mammifères empoisonnés peut être suffisante pour provoquer
la mort des prédateurs et nécrophages comme l'aigle et la
corneille. [124]
1-2-2-2-2-2-L'empoisonnement
sublétal :
L'empoisonnement n'entraîne pas toujours une mort
immédiate. L'oiseau empoisonné perd parfois du poids, ce qui
diminue sa capacité de combattre d'autres stress, comme les
intempéries. L'oiseau peut aussi moins chanter et ainsi, ne plus attirer
de partenaire ni défendre son territoire. Il pourrait élever une
plus petite famille, apporter moins de nourriture aux oisillons ou avoir un
comportement anormal avec son partenaire. Un oiseau affaibli risque aussi
d'être moins en mesure d'échapper à un prédateur ou
de se défendre contre lui. Les conséquences ne sont pas toujours
faciles à prédire. Des oiseaux chanteurs qui ont fait leur nid
dans de l'herbe pulvérisée de carbofuran, un insecticide toxique,
ont survécu et élevé leurs petits sans problème,
mais des goélands ont péri et des Chevêches des terriers
ont abandonné leurs nids et disparu dans les mêmes conditions
(voir encadré 1). Les espèces capables d'éliminer
l'insecticide de leur organisme avant qu'une dose létale ou
débilitante ne soit acquise sont celles qui arrivent à survivre
[124].
1-2-2-3-Les reptiles :
L'auteur de « L'homme en voie
de disparition », Theo Colborn (L'homme envoie de disparition,
édition TERRE VIVANTE) a mis en évidence la déficience des
organes sexuels des alligators du lac Apopka (Floride) qui fut longtemps
pollué par un insecticide.
1-2-2-4-Les mammifères :
1-2-2-4-1- Les Batraciens :
1-2-2-4-1-1- les grenouilles
Les agents
polluants chimiques,
surtout dans les bassins où les têtards se développent,
interviennent largement dans l'apparition de malformations (membres
supplémentaires, yeux mal formés). Ces polluants ont des effets
variables sur les grenouilles : certains atteignent et altèrent le
système
nerveux central, alors que d'autres, comme l'
atrazine, un
herbicide, causent un
arrêt du processus de production et de sécrétion des
hormones entraînant ainsi la stérilité des adultes. Des
études expérimentales ont montré que l'exposition à
d'autres
herbicides comme le
Roundup ou à certains
insecticides comme le
malathion ou le
carbaryl provoque une nette
hausse de la mortalité chez les têtards. Des études
additionnelles indiquent que les amphibiens se développant en milieu
terrestre sont également vulnérables au Roundup et plus
particulièrement à l'un de ses composants, le POEA (
Polyoxyéthylèneamine)
qui est un agent
tensioactif mouillant
(favorisant la dispersion des gouttelettes sur les plantes traitées) et
non pas un
pesticide. Des
années 1950 aux années 1970, les populations d'amphibiens de la
région méditerranéenne, déjà très
touchées par les destructions d'habitats, peuvent être fortement
affectées par l'utilisation excessive d'insecticides. Après
l'épandage d'insecticides dans les marais d'Ayga de par la
municipalité de
Hyères, 5 000
rainettes
méridionales ont été trouvées mortes le
8
mars
1958. Cette
pulvérisation des localités touristiques françaises de la
Côte d'Azur a
pratiquement éliminé les populations locales de
triton palmé,
de
triton marbré
et de
salamandre
tachetée [125].
Les pesticides s'étendent bien au-delà des
zones cultivées, jusqu'à des zones vierges de toute
activité humaine, comme on a pu l'observer dans le
Parc national
de Yosemite en
Californie et ailleurs
dans de nombreuses analyses de
pluies. Outre l'empoisonnement
direct par les
pesticides (insecticides
en particulier, souvent mortellement dangereux pour d'autres
animaux à sang
froid que les
insectes), ces
produits
chimiques peuvent agir comme
perturbateurs
endocriniens. Ils imitent les
hormones naturelles et
peuvent produire de subtils effets sublétaux. Par exemple, certaines
substances chimiques imitent l''
oestrogène et
empêchent les jeunes mâles de se développer normalement. L'
atrazine, mise sur le
marché en
1958, est connu pour augmenter
des maladies d'origines fongiques et virales chez les amphibiens depuis les
années 1990.
Elle entraîne un effet immunosuppresseur de 20 % sur certaines
larves de
salamandre lorsqu'elle
est combinée à un engrais tel que le
nitrate de sodium
[125].
1-2-2-5-Les Insectes :
1-2-2-5-1- Les Abeilles.
1-2-2-5-1-1-Les modes de contamination des
mellifères par les insecticides :
Les insecticides prennent deux chemins principaux pour
atteindre leur cible. Ils peuvent traverser le tégument des
mellifères lorsque ceux-ci se trouvent sous le jet d'un appareil de
traitement ou lorsqu'ils marchent sur les résidus du produit
déposé sur les végétaux. Ils sont également
ingérés lors de la consommation du nectar contaminé au
fond des corolles. Cette contamination est d'autant plus forte que
l'insecticide peut avoir des propriétés endothérapiques,
pénétrant ainsi facilement dans les vaisseaux conducteurs de
sève. Les abeilles domestiques consomment également de l'eau ou
du miellat de pucerons pollués. Il existe un mode insidieux de
contamination : le transport au nid, par les butineuses, des aliments
pollués, nectar ou pollen, qui vont servir à nourrir, soit des
congénères adultes, ce qui arrive régulièrement
chez l'Abeille domestique, soit des larves. Les molécules toxiques
agissent généralement en désorganisant la conduction de
l'influx nerveux ; cependant des produits d'une génération
nouvelle (« régulateurs de croissance ») inhibent la
synthèse de constituants du tégument et, de ce fait, ne
perturbent que les larves.
Il est évident que les
effets des intoxications des mellifères seront, en fonction de la
matière active, tantôt immédiats, tantôt
différés. S'il y a effet immédiat, les conséquences
sont visibles après quelques heures et durant 2 à 4 jours,
aboutissant parfois à l'extinction totale de la population. Dans le cas
des insecticides régulateurs de croissance, les effets peuvent
être lents à apparaître : par exemple on a vu que la
mortalité larvaire maximale, dans un rucher butinant un verger
traité au phénoxycarbe, n'était enregistrée qu'au
17e jour. Cette matière active, inoffensive pour les adultes,
était transmise par les ouvrières nourrices récoltant
nectar et pollen contaminés aux larves, qui, très sensibles,
n'ont pu arriver au terme de leur développement de 3 semaines. Il est
des cas où les effets létaux sont encore plus retardés ;
ainsi, lorsque l'insecticide est intégré à des provisions
de pollen qui sont stockées plusieurs mois dans la ruche. Un tel
stockage survient facilement avec les insecticides « encapsulés
» qui se présentent sous l'aspect de microsphères creuses et
poreuses en matière synthétique, laissant diffuser lentement la
matière active tout en la protégeant. Ces microsphères ont
la même taille que certains grains de pollen, soit quelques dizaines de
microns de diamètre et elles adhèrent sans difficulté
à la pilosité recouvrant le corps des butineuses. Les
méfaits des insecticides encapsulés sur les larves durent tant
que les provisions de pollen sont utilisées. Un autre mode de transport
des insecticides a été observé en champ de luzerne chez la
Mégachile utilisée à grande échelle pour la
pollinisation de cette culture en Amérique du Nord. Elle confectionne
son nid en tapissant des cavités tubulaires avec des morceaux de feuille
de luzerne découpés. Ce comportement constructeur particulier,
propre à ce genre, provoque l'intoxication des larves lorsque ces
dernières sont sensibles à l'ingestion de certains résidus
qui contaminent les provisions en contact très étroit avec les
feuilles. Le symptôme typique d'empoisonnement est le
dépeuplement rapide des nids suite à la mort des adultes ou des
larves. Les adultes peuvent mourir à l'entrée du nid ou dans le
cas de certaines intoxications au sein même de la culture traitée.
D'autres symptômes ont été identifiés : ce sont des
réactions sublétales. On peut les obtenir
expérimentalement par application de faibles doses de produit. Le signe
le plus bénin est l'hyperactivité. Les comas réversibles
surviennent dans le cas d'intoxication avec les pyréthrinoïdes. Le
retour à une activité normale des insectes comateux est
lié à la dégradation interne des molécules
insecticides grâce à certains enzymes. Chez la Mégachile de
la luzerne, on a enregistré des baisses de fécondité des
femelles à la suite d'applications sublétales de trichlorfon, de
deltaméthrine et de fenvalérate. La longévité des
ouvrières d'Abeille domestique est réduite après des
traitements au carbaryl, au diazinon et au malathion. Le fenthion rend les
colonies incapables de produire les reines nécessaires à la
multiplication de l'espèce par essaimage. Quant au parathion, il
occasionne à faible dose des pertes de l'orientation des butineuses en
raison du dérèglement du système de transmission des
informations concernant l'emplacement des ressources de nourriture. Ces
observations convergentes montrent que lorsqu'un traitement phytosanitaire est
exécuté sur une culture visitée par des pollinisateurs,
ces derniers subissent des pertes immédiates ou différées
qui affectent les adultes ou les larves. Très souvent se greffent sur
ces troubles assez visibles des perturbations physiologiques sublétales
atteignant insidieusement le potentiel de reproduction des insectes
mellifères ou leur comportement alimentaire [126].
2-Effet sur la santé :
Tous les pesticides sont potentiellement dangereux pour
l'homme, la toxicité dépendant du mode de
pénétration dans l'organisme. Dans la littérature
scientifique, l'exposition à certains pesticides a été
liée chez l'homme à des cancers associés à la
suppression immunitaire, des réactions allergiques, des réponses
auto-immunes, la suppression de la fonction immunitaire et une plus grande
sensibilité aux agents pathogènes [13].
2-1-Intoxication aigue :
Les intoxications aiguës par les pesticides sont
celles où, quelques heures après une exposition importante, des
symptômes apparaissent rapidement. Les signes d'exposition
observés sont très divers et parfois difficiles à
reconnaitre. On a souvent tendance à attribuer les malaise ressentis a
d'autres causes qu'une intoxication par les pesticides, car ils ne sont pas
toujours spécifiques, les symptômes les plus fréquents sont
les malaises généraux comme des maux de tète, des
nausées (parfois avec des vomissements) des étourdissements, de
la fatigue, une perte d'appétit, des irritations de la peau et des yeux.
Mais dans le cas d'une intoxication plus sévère, comme lors d'une
exposition importante a un pesticide inhibiteurs des cholinestérases,
les symptômes pouvant être observés sont : crampes
abdominales, diarrhée, transpiration excessive, difficulté
d'attention, nervosité, vision embrouillé, difficultés
respiratoires, convulsions et même coma. L'Organisation Mondiale de la
Santé (OMS) a estimé qu'il y a chaque année dans le monde
1 million de graves empoisonnements par les pesticides, avec quelque
220 000 décès [59].
2-2-Intoxication chronique :
L'intoxication chronique survient normalement suite a
l'absorption répétée de faibles doses de pesticides, le
délai avant l'apparition des symptômes ou d'une maladie peut
parfois être long, les effets sur la santé peuvent même se
manifester seulement après plusieurs années, ce qui rend le lien
difficile a faire [1].
Les symptômes d'une intoxication chronique sont
souvent difficile a reconnaitre ,ils peuvent parfois s'apparenter aux effets
d'une intoxication aigue ,de plus ,des études suggèrent que
l'exposition a long terme aux pesticides pourrait favoriser le
développement des cancers ,provoquer des déficits immunitaires
et augmenter le nombre des mort-nés et d'avortement spontanées
,certains pesticides pourrait avoir des effets perturbateurs du système
endocrinien en interférant avec le processus hormonal .ils peuvent ainsi
occasionner des changements dans la croissance ,le développement ,la
reproduction, ou le comportement des organismes eux-mêmes ou sur les
générations suivantes. Parmi les pesticides
soupçonnés d'avoir de tels effets ,notons ,le 2-4D ,un herbicides
très largement utilisés dans l'entretien des pelouses ,le
malathion ,la perméthrine ,deux insecticides ,et le benomyl ,un
fongicide[20] .
2-2-1-Neurotoxicose chronique :
De faibles quantités de pesticides peuvent
altérer les fonctions et le développement du système
nerveux, chez le foetus, l'enfant et l'adulte comportemental, et par
conséquent le potentiel des individus exposés in
utéro...Cette perte de potentiel...peut prendre la forme d'anomalies
comportementales ou physiques. Elle peut se manifester par une capacité
intellectuelle réduite, une moindre adaptabilité sociale, une
réactivité aux stimuli de l'environnement amoindrie,...etc.
[59].
Le Docteur Porter explique plus en détail les
mécanismes d'une telle perturbation « Au vingtième jour
de sa grossesse quand le tube neural du foetus se referme, si elle
reçoit une dose de pesticides...son niveau d'hormone thyroïdienne
monte ou descend, l'hormone traverse le placenta et peut altérer le
développement du cerveau du foetus de manière
irréversible. »[59]
2-2-1-1-Altération des capacités
intellectuelles :
Le docteur Guillette a observé des populations
d'enfant exposés à des pesticides .Elle a noté chez eux
une moins bonne coordination motrice, une mémoire à trente
minutes moins bonne et de moins bonnes aptitude
dans l'épreuve de dessin
d'une personne. [62]
Le Docteur Guillette a également observé
des comportements agressifs plus fréquents chez ces enfants
exposés aux pesticides. En France une étude
suggère des effets négatifs sur les fonctions cognitives des
adultes soumis à une exposition chronique de faibles doses de pesticides
employés en viticulture [62].
D'autres études montrent que les
effets neuro-cognitifs des pesticides organophosphorés sur les
populations exposées professionnellement sont : troubles de la
mémoire, anxiété, irritabilité et dépression
[62].
2-2-1-2-Relation entre maladie de Parkinson et
exposition aux pesticides:
Ø En effet, pour certains pesticides, la
neurotoxicité est le mécanisme même de leur mode
d'action:inhibition de l'activité anticholinestérasique.
Ø De nombreux pesticides ont un rôle inducteur ou
inhibiteur de systèmes enzymatiques de détoxification des
xénobiotiques et pourraient de ce fait perturber les métabolismes
de neurotoxines endogènes ou exogènes.
Ø Il pourrait s'agir d'un facteur de confusion,
d'autres facteurs de l'environnement rural pourraient être
impliqués.
Ø L'acétylcholine et la dopamine sont des
neurotransmetteurs qui permettent le passage de l'information entre les
cellules nerveuses.
Ø Au cours de la maladie de Parkinson, on observe une
destruction des neurones de la substance noire qui produisent normalement la
dopamine. Il en résulte un déficit en dopamine et donc un
déséquilibre entre les quantités de dopamine et
d'acétylcholine,
D'où l'apparition de tremblements,
rigidité, perte de coordination.
Ø Les produits phytosanitaires peuvent également
entraîner un déséquilibre entre les quantités de
dopamine et d'acétylcholine dans l'organisme, grâce à leur
activité antichlolinestérasique.
Ø L'acétylcholinestérase est un enzyme
normalement présent chez l'homme qui entraîne la destruction de
l'acétylcholine, évitant ainsi une action excessive de celle-ci.
L'inhibition de cet enzyme acétylcholinestérase provoque un
déséquilibre entre les quantités de dopamine et
d'acétylcholine.
Ø Dans le cadre d'intoxication aigue chez des personnes
exposées à des doses importantes de pesticides, on observe cette
neurotoxicité.
Ø Les organophosphorés, les carbamates, les
anciens organochlorés: DDT,...peuvent provoquer des convulsions
épileptiformes. Les pyréthrinoïdes peuvent provoquer des
paresthésies, des convulsions à dose massive. Les
dérivés de l'urée peuvent être à l'origine de
troubles neurologiques centraux [61].
2-2-2-Effet sur le système endocrinien :
Les pesticides peuvent affecter le système
endocrinien par plusieurs mécanismes selon la nature de la
substance :
Ø Imiter la bonne hormone en s'insérant
parfaitement dans le récepteur hormonal (les oestrogènes
synthétiques tel que certains pesticides comme le DDT agissent de cette
façon, comme imitateur hormonal) [55].
Ø Bloquer l'hormone naturelle en occupant
elle-même tous les récepteurs. Aucun message ne parvient alors aux
cellules (La vinclozolin et les pyréthrinoïdes sont des pesticides
qui font partie de cette catégorie et agissent comme des inhibiteurs
hormonaux) [63].
Les pesticides perturbateurs endocriniens peuvent agir
différemment selon l'âge ou la phase de développement de
l'organisme touché ; l'exposition in utero serait de loin la plus
préoccupante et pourrait entraîner de graves conséquences
à un moment ou un autre, de la naissance à l'âge adulte.
Des expositions régulières même à faibles doses sur
de très longues périodes à des pesticides perturbateurs
endocriniens pourraient également causer des dommages importants
[63].
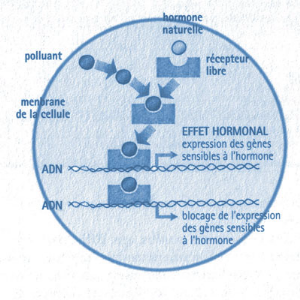
Figure 22. Effets des pesticides sur le
systéme endocrinien [63 ].
2-2-3-Anomalies congénitales :
Le foetus en développement et le
bébé sont extrêmement sensibles aux effets des pesticides,
L'exposition du foetus à des pesticides à certaines
périodes de la grossesse peut conduire à un avortement
spontané, à des retards de croissance, des handicaps à la
naissance. L'exposition du foetus à des perturbateurs endocriniens
(comme certains pesticides) est même soupçonnée de
modifier le sexe de l'enfant à naître. En effet des
chercheurs se sont aperçus que la proportion de bébés
mâles, par rapport à l'ensemble des nouveau-nés,
était en train de décliner doucement depuis 20 ans dans de
nombreux pays industrialisés ou en voie d'industrialisation. Ces
équipes de scientifiques pensent que ce changement est causé par
l'exposition du foetus à toute une série de produits chimiques
perturbateurs endocriniens tels que certains pesticides suspectés
d'être Perturbateurs Endocriniens. Entre la 6ème et la 9ème
semaine de grossesse l'embryon mâle poursuit sa
différenciation sexuelle, sous l'influence des hormones
sécrétées par les gonades (glande génitale
mâle). Si une substance étrangère à l'embryon vient
perturber ce processus hormonal à ce stade, la
transformation peut être arrêtée et un
bébé femelle peut naître, Ces chercheurs ont
révélé d'autres problèmes telles que des
malformations du pénis et des testicules à la naissance,
l'augmentation de la fréquence du cancer des testicules, le
déclin de la quantité et de la qualité du sperme à
ces mêmes causes environnementales [64].
De nombreuses autres études
épidémiologiques montrent que l'exposition professionnelle ou par
l'environnement des familles aux pesticides peut amener des retards de
croissance, des anomalies congénitales et même des fausses couches
[64].
Ainsi une étude réalisée par
Santé Canada a montré que le risque de fausse couche et de
prématurité était plus grand dans les familles dans
lesquelles le père avait manipulé certains pesticides. Le risque
de fausse couche était 1,9 fois supérieur si le père avait
manipulé des thiocarbamates, du carbaryl et d'autres pesticides. Le
risque d'accouchement prématuré était de 1,7
à 2,4 fois plus élevé si le père avait
manipulé des pesticides comme l'atrazine, le glyphosate (la fameuse
molécule du Round-Up) ou des pesticides organophosphorés par
exemple [64].
Une étude de 2001 conduite en Californie montre
que la mort du foetus due à une anomalie congénitale est plus
fréquente chez les mères qui vivent pendant leur grossesse dans
une aire de 9 miles* carrés autour d'un endroit où l'on a
pulvérisé des pesticides. La mort du foetus due à une
anomalie congénitale est plus fréquente encore si
l'exposition de la mère aux pulvérisations de pesticides a eu
lieu entre la 3ème et la 7ème semaine de grossesse [64].
2-2-4-Déficits immunitaires :
Des études ont mis en évidence que les
bébés nourris au sein avaient accumulé des
quantités d'organochlorés (pesticides à base de chlore)
dans leur organisme, dont du DDE et de la dieldrine (deux pesticides
persistants). Ces enfants développaient 10 à 15 fois
plus d'otites que les enfants du sud du Québec, Cet exemple montre que
les pesticides peuvent avoir un effet négatif sur le système
immunitaire humain [65].
Si les épidémiologistes se sont souvent
intéressés à des maladies comme le cancer, les
problèmes de reproduction...en relation avec l'exposition aux
pesticides, les effets destructeurs de ces substances sur le système
immunitaire sont encore principalement étudiés sur des animaux de
laboratoires ou des cultures de cellules (à l'exception notoire de l'ex
URSS où des chercheurs ont fait des études sur les
conséquences pour la santé des utilisateurs de pesticides
professionnels)[65].
Un rapport scientifique a récemment
analysé et résumé les résultats de plus de 100
études expérimentales sur les conséquences de diverses
familles de pesticides sur le système immunitaire. La majorité de
ces études ont mis en évidence des effets immunosuppresseurs des
pesticides étudiés [65].
Dans la littérature scientifique, l'exposition à
certains pesticides à été liée chez l'homme
à :
Ø Des
cancers associés
à la suppression immunitaire.
Ø Des réactions allergiques (dermites, asthme,
anaphylaxie).
Ø Des réponses auto-immunes
Ø La suppression de la fonction immunitaire et une plus
grande sensibilité aux agents pathogènes [65].
2-2-5-Problèmes de reproduction :
La fertilité masculine dans les pays
développés n'a cessé de décroître depuis un
demi-siècle, comme le prouvent de nombreuses études. Les
concentrations du sperme en spermatozoïdes diminuent
régulièrement depuis 60 ans [66].
Des études montrent la relation entre le fait
d'être exposé aux pesticides et une baisse de la fertilité
masculine [66].
Une étude récente doit retenir notre
attention. Des scientifiques de l'INSERM de Rennes et du Kremlin Bicêtre,
associés à d'autres de l'hôpital Garibaldi à
Rosario, en Argentine, ont étudié une population de 225 argentins
issus d'une des régions agricoles les plus productives (où les
pesticides sont fortement utilisés)qui avaient consulté pour
problème d'infertilité entre 1995 et 1998[66].
Les scientifiques ont cherché s'il existait une
relation entre l'exposition à certains agents environnementaux (dont des
pesticides) et ces situations d'infertilité. Les résultats furent
publiés en 2001. Ils montrent que l'exposition aux pesticides (et
à certains solvants) est associée à des concentrations en
spermatozoïdes bien en dessous de la limite de la fertilité
[66].
Chez les femmes également l'exposition aux
pesticides est un facteur de risque d'infertilité important. Ainsi une
étude publiée en 2003 a mis en évidence dans une
population de femmes ayant des problèmes d'infertilité que le
facteur de risque le plus important était la préparation et
l'utilisation de pesticides et particulièrement d'herbicide, le risque
d'infertilité étant multiplié dans ce cas par 27 [66].
2-2-6-Développement de certains cancers :
En effet, certains types de cancers augmentent
particulièrement rapidement. C'est le cas du Lymphome non-Hodgkinien
(LNH), du cancer du cerveau ou de la vessie,etc.qui sont souvent
descancersliésàl'expositionàdespesticides. Ainsi la «
Lymphoma Foundation of America » (Fondation Américaine contre le
Lymphome) vient de faire paraître un fascicule listant toutes les
études épidémiologiques disponibles sur la relation entre
lymphome (cancer des lymphocytes) et pesticides. Sur les 99 études
épidémiologiques, 75 indiquent une relation positive entre
l'exposition à des pesticides et l'atteinte par un lymphome. Plus
généralement nous disposons depuis une vingtaine d'années
de dizaines d'études épidémiologiques menées aux
USA et ailleurs qui montrent que les utilisateurs de pesticides sont plus
souvent atteints par certains cancers (estomac, prostate, vessie, cerveau,
lèvres, LNH, leucémies, ...) que la population
générale. Les enfants d'utilisateurs, et notamment
d'agriculteurs, sont également touchés[67].
Des études épidémiologiques
existent qui démontrent maintenant également que l'exposition
environnementale aux pesticides tend à augmenter le risque de
développer certains cancers. Ainsi, les dérivés de l'acide
chlorophénoxyacétique ont été associés avec
un risque accru de LNH parmi des résidents de zones de culture du riz en
Italie du nord [67].
Une étude écologique conduite aux USA dans
une région fortement contaminée par des herbicides
organochlorés et triazines montre une augmentation significative du
risque de cancer du sein,un surcroît de cancers de la thyroïde a
été observé dans une population exposée à
des mélanges de pesticides organochlorés contenant de fort taux
d'hexachlorobenzène , etc. Il semble que les enfants soient encore plus
sensibles à ce risque que les adultes car ils sont plus exposés
en proportion aux substances cancérigènes et ils sont
également physiologiquement plus sensibles aux pesticides
cancérigènes. Les cancers de l'enfant les plus souvent
associés dans les études avec une exposition aux pesticides sont
surtout les leucémies, les tumeurs du cerveau, les sarcomes, les
lymphomes et les tumeurs de Wilm (tumeur rénale). A ce jour en Europe 92
substances actives pesticides sont classées cancérigènes
possibles ou probable soit par l'UE ou l'Agence de Protection de
l'Environnement des Etats Unis (US-EPA) [67].
![]()
Les risques sur la santé de l'homme (et de
l'animal) sont aujourd'hui bien démontrés dans le cas
d'expositions importantes et/ou prolongés aux pesticides (intoxications
volontaires ou accidentelles, utilisateurs ou famille des utilisateurs), sont
en plus en plus élevés.
En ce qui concerne les risques à long terme et
les risques liés à la consommation des résidus des
pesticides, des résultats d'études complémentaires
(beaucoup en cours) sont attendus ... bien que des rapports accablants existent
déjà.
Dans l'attente, le principe de précaution ne
devrait-il pas s'imposer, pour une réduction de l'utilisation des
pesticides et tout particulièrement pour les plus toxiques
d'entre-deux.

| 


