|
Année Universitaire 2012/2013
ÊÜÜÜÜÜÜÜÜÜíÈÚÜÜÜÔáÇ
ÊÜÜÜÜÜÜÜÜÜÜÜíÜØÇÑÜÞæÜÜíÏáÇ
ÊÜÜÜÜíÑÆÇÓÜÜÜÜÌáÇ
ÊÜÜÜÜíÑìåÜÜÜÜæÌáÇ
REPUBLIQUE ALGERIENNE DEMOCRATIQUE ET POPULAIRE
íæÜÜáÜÚÜáÇ
ËÜÍÜÈÜáÇæ
íÜÜÜáÇÜÚÜáÇ
äÜÜíÜáÜÜÚÊáÇ
ÉÑÇÒæ
MINISTERE DE L'ENSEIGNEMENT SUPERIEUR ET DE LA RECHERCHE
SCIENTIFIQUE
ØÇìÜÜÜÜÜÛáÇÈ
íÜÜÜÌÜÜÜÜíÜáÜË
ÑÇÜÜÜÜøæÚ
ÊÜÜÚÜåÇÜÌ
UNIVERSITE AMAR TELIDJI LAGHOUAT
ãìÜÜÜÜÜÜáÜÜÚÜáÇ
ÊÜÜÜÜÜÜíÜáÜÜß
FACULTE DES SCIENCES
DEPARTEMENT Sciences de la Matière

Mémoire de Licence
Domaine : Sciences de la matière
Filière : Chimie Option : Chimie
Par :
GUERRADI Ismahane HECHACHNA Aicha
THEME
L'utilisation industrielle du charbon actif
Soutenu publiquement devant le jury composé de
:
Mr. FERHAT Mahmoud M.C.A Président
Mme. MOUATTAH Dalila M.A.B Examinateur
Mlle. BATANA Fatima Zohra M.A.B Rapporteur
SOMMAIRE
Dédicaces
Remerciements
Liste des abréviations
Liste des figures Liste des tableaux
I. Introduction . 1
II. Adsorption et adsorbants .
3
II.1. Phénomène d'adsorption
3
II.2. Adsorbants . 4
II.2.1. Zéolites 4
II.2.2. Alumines . 5
II.2.3. Argiles . 5
II.2.4. Gels de silice 5
II.2.5. Adsorbants à base de polymères ..
6
II.2.6. Charbon actif . 6
III. Charbon actif 7
III.1. Historique . 7
III.2. Définition 7
III.3. Différents types de charbon actif
8
III.3.1. Charbon actif en grain (CAG) 8
III.3.2. Charbon actif en poudre (CAP) .. 8
III.4. Caractéristiques du charbon actif ..
9
III.5. Préparation du charbon actif ..
11
III.5.1. Activation des charbons actifs . 13
III.6. Utilisations du charbon actif 14
IV. Utilisation industrielle du charbon actif .
15
IV.1. Traitement des eaux par charbon actif ..
15
IV.1.1. Traitement préliminaire .. 15
IV.1.2. Traitement primaire (physicochimique)
16
IV.1.3. Traitement secondaire (biologique)
17
IV.1.4. Filtration sur charbon actif . 18
IV.2. Traitement des gaz par charbon actif .
20
IV.2.1 Définition des Composés Organique Volatils
(COV) . 20
IV.2.2 Sources d'émission de COV .. 21
IV.2.3. Impact sur l'homme et l'environnement
22
IV.2.4 Procédés de traitement des COV .
22
IV.2.4.1 Techniques de récupération
22
V. Conclusion générale 26
REFERENCES BIBLIOGRAPHIQUES
Remerciements
Avant toute chose, Nous remercierons ALLAH
le tout
puissant, de nous avoir donnée la force et la
patience pour
mener à terme ce travail
Nous exprimons notre profonde reconnaissance et nos
sincères
remerciements à Mademoiselle BATANA Fatima
Zohra pour
l'aide qu'elle nous a apportée et pour
l'intérêt constant qu'elle
nous a cessé d'accorder pour l'orientation de ce
travail.
Nous sommes très honorées que monsieur
FERHAT Mahmoud
et Mademoiselle MOUATTAH Dalila aient
accepté d'être
membres de notre jury et nous tenons à leur exprimer
notre
reconnaissance pour l'attention qu'ils ont portés
à notre travail.
Nos remerciements vont aussi à Mademoiselle
Abdelali
Khadidja Nesrine pour son aide
précieux.
Nous remercierons nos collègues et nos amies pour
les
sympathiques moments qu'on a passé ensemble.
Aux enseignants et personnels de Département de
sciences de
la matière de Laghouat.
Enfin, nous ne saurions oublier touts les personnes qui
ont
participé de prés ou de loin à la
réalisation de ce travail.
LISTE DES FIGURES
Figure III.1 : Structure poreuse du charbon
actif 8
Figure III.2 : Structure des pores du charbon
actif . 9
|
Figure III.3 : Représentation de la
surface interne et externe d'un matériau poreux (adsorbant)
|
11
|
Figure IV.1 : Les étapes du
prétraitement 16
Figure IV.2 : Les étapes de
décantation et la coagulation-floculation 17
Figure IV.3 : Le traitement biologique
18
Figure IV.4 : Style RS de filtration sur
charbon actif .. 19
Figure IV.5 : Style SP de filtration sur
charbon actif .. 20
Figure IV.6 : Sources d'émissions de
COV 21
Figure IV.7 : Procédés de
traitement des effluents gazeux contenant des COV . 23
Figure IV.8 : Adsorption en lit fixe (deux
adsorbeurs montés en parallèle) 24
LISTE DES TABLEAUX
Tableau II.1 : Différences entre
physisorption et chimisorption . 4
Tableau III.1 : Différents types de
charbon actif 9
Tableau III. 2 : Surfaces spécifiques
de quelques matériaux adsorbants 10
Tableau III. 3 : Différentes
matières premières pour préparer le charbon actif ..
12
LISTE DES ABREVIATIONS
CA : Charbon Actif.
CAG : Charbon Actif en Grain.
CAP : Charbon Actif en Poudre.
CFC : Chlorofluorocarbures.
COV : Composés Organiques Volatils.
IUPAC : International Union of Pure and
Applied Chemistry.
LDL : Low Density Lipoproteins
MES : Matières En Suspension.
Page 1
I. Introduction
Un grand nombre de rejets industriels, agricoles et
domestiques véhiculent des polluants à des quantités
variables et présente un risque sanitaire et environnemental majeur ce
qui constitue un grand souci pour les autorités publiques.
L'impact de ces polluants sur l'ensemble de l'environnement et
sur la santé en particulier est devenu une préoccupation majeure
dans les régions industrialisées pour l'ensemble de la population
et une préoccupation pour les autorités publiques. La
préservation des milieux récepteurs est un enjeu capital pour
notre société et notamment pour les générations
futures.
L'application des normes en vigueur a nécessité
le développement de procédés pour traiter efficacement les
effluents gazeux et liquides.
Actuellement, un grand nombre de techniques de traitement des
effluents gazeux et liquides sont utilisées, elles différent les
unes des autres et incluent, par exemple, l'adsorption, l'électrolyse,
la condensation, l'oxydation, la biofiltration, les techniques
membranaires...etc.
Parmi les procédés utilisés, l'adsorption
sur des matériaux poreux, comme les zéolites ou les charbons
actifs, offre des avantages en termes d'efficacité, de facilité
de mise en oeuvre et de coût.
Pour cette étude, nous avons choisi les charbons actifs
qui sont des matériaux poreux à une surface très
réactive, issus du traitement thermique de précurseurs
organiques, sous atmosphère contrôlée. Ils se
présentent sous forme de poudre, de granulés ou de fibres.
Les polluants sont adsorbés sélectivement
à la surface du charbon actif qui, une fois saturé, est
régénéré par simple chauffage ou lavage, les
molécules désorbées peuvent alors être
transformées ou stockées.
Leur faible coût et les grandes quantités
disponibles placent les charbons actifs au premier rang du marché
mondial des adsorbants.
Page 2
Cette étude se subdivise en trois parties :
- Dans la première partie, nous avons défini le
phénomène d'adsorption ainsi que les différents
adsorbants,
- La seconde partie a été consacrée pour
étudier le charbon actif,
- Et la dernière partie étudie le rôle du
charbon actif dans l'industrie, d'une part, dans le traitement des eaux et,
d'autre part, dans le traitement des gaz.
Page 3
II
II. Adsorption et adsorbants
II.1. Phénomène d'adsorption
L'adsorption peut être définie comme
l'opération fondamentale de Génie chimique qui exploite
l'aptitude de certains solides à concentrer spécifiquement
à leur surface les constituants d'une solution permettant ainsi leur
séparation [1].
L'adsorption est un phénomène de surface et un
processus appliqué dans le domaine de la séparation solide -
liquide. Elle est basée sur des interactions spécifiques
(thermodynamique et / ou cinétique), privilégiée et
sélective, entre la surface d'un matériau (adsorbant) et une
substance chimique (adsorbat).
On distingue deux types d'adsorption qui sont le plus souvent
mis en jeu simultanément [2] :
? Adsorption physique
(physisorption)
L'adsorption physique ou adsorption de van der Waals est un
phénomène réversible qui résulte des forces
intermoléculaires d'attraction entre les molécules du solide et
celle de la substance adsorbée.
Ce phénomène contrôlé par la
diffusion des molécules atteint son équilibre rapidement
(quelques secondes à quelques minutes) mais peut se prolonger sur des
temps très longs pour les adsorbants microporeux en raison du
ralentissement de la diffusion de l'adsorbat dans ses structures de dimensions
voisines du diamètre des molécules de l'adsorbant
[3].
? Adsorption chimique
(chimisorption)
L'adsorption chimique ou adsorption activée
résulte d'une interaction chimique qui se traduit par un transfert
d'électrons entre le solide et l'adsorbat. Il y a alors formation d'un
composé chimique à la surface de l'adsorbant. Ce type
d'adsorption se développe à haute température et met en
jeu une enthalpie de transformation élevée
[1,3].
Le tableau II.1 récapitule les différences qui
existent entre l'adsorption physique et l'adsorption chimique.
Page 4
II
Tableau II.1 : Différences entre
physisorption et chimisorption [4]
|
Physisorption
|
Chimisorption
|
|
Type de liaison
|
Van der Waals (électrostatique)
|
Ionique ou covalente
|
|
Energie de liaison
|
Faible
|
Forte
|
|
Réversibilité
|
Facile
|
Difficile
|
|
Type de couche
|
Poly-moléculaire
|
Mono-moléculaire
|
|
Chaleur d'adsorption
(Kj/mol)
|
50
|
100 à 500
|
II.2. Adsorbants
Au sens strict, tous les solides sont des adsorbants. Cependant,
seuls les adsorbants ayant une surface spécifique suffisante (surface
par unité de masse) peuvent avoir des intérêts
pratiques.
Les adsorbants industriels ont généralement des
surfaces spécifiques au-delà de 100 m2.g-1,
atteignant même quelques milliers de m2.g-1
[5].
Certains adsorbants ont leurs surfaces fonctionnalisées
par des groupements oxygénés permettant la formation de liaisons
hydrogènes, tandis que d'autres possèdent une structure ionique
responsable d'un champ électrique intense dans les pores.
Les principaux adsorbants sont les alumines, les gels de
silices, les zéolites, les argiles et les charbons actifs. Il en existe
également d'autres : les résines, les polymères ...etc.
[6].
II.2.1. Zéolites
Une zéolithe (du grec Zéo : bouillir et lithos :
pierre) est un minéral appartenant à la famille des
aluminosilicates hydratés. Il existe deux sortes de zéolithes :
les zéolithes naturelles et les zéolithes synthétiques.
Les zéolithes sont des aluminosilicates cristallins et
poreux, résultant de l'assemblage de tétraèdres SiO4 et
AlO4 joints par les atomes d'oxygène qu'ils partagent. Cette
structure
Page 5
II
cristalline crée un réseau de pores de tailles
uniformes qui distingue les zéolites des autres adsorbants microporeux
[3].
Leur surface spécifique ne dépasse pas 900 m2.
g-1, ce qui limite la capacité d'adsorption. Ainsi, les
zéolithes sont moins sensibles à la chaleur que les charbons
actifs [7].
Le domaine d'application des zéolites est très
étendu : traitement des effluents urbains, purification du gaz
naturel...etc.
La production mondiale annuelle de zéolites est de
150000 tonnes par an. Ils sont les principales concurrentes des charbons actifs
sur le marché des adsorbants [6].
II.2.2. Alumines
Les alumines activées (Al2O3, 0,5H2O) sont obtenues par
déshydratation de la gibbsite, bayerite. Elles sont principalement
microporeuses et leur surface spécifique atteint 350
m2.g-1. Cette surface présente des
impuretés propices à la chimisorption de certaines
molécules.
Les alumines se présentent commercialement sous forme
de billes de quelques millimètres de diamètre. Elles adsorbent
préférentiellement les espèces polaires contenues dans les
gaz et les liquides. Elles sont utilisées pour sécher des gaz ou
de l'air, éliminer des traces d'alcool, d'éther, ou encore les
hydrocarbures ou les acides.
La production mondiale annuelle d'alumines
s'élève à 75000 tonnes par an [6].
II.2.3. Argiles
Le terme d'argile désigne non seulement une formation
rocheuse et la matière première qui en résulte, mais il
définit aussi un domaine granulométrique comprenant des
particules minérales, dont le diamètre des grains est
inférieur à deux micromètres (< 2 ìm).
En tant que matière première brute, l'argile est
donc un mélange de minéraux argileux et d'impuretés
cristallines sous forme de débris rocheux de composition infiniment
diverse [3].
II.2.4. Gels de silice
Le gel de silice (SiO2, nH2O) est un polymère d'acide
silicique préparé à partir des silicates de sodium.
L'intérieur de chaque graine de silice est composé d'atomes de
silicium reliés entre eux par des très fortes polarités du
gel de silice.
Page 6
II
La structure du gel de silice possède une surface
spécifique d'environ 300 à 800 m2.g-1. Sa
surface interne se répartie en un nombre infini des pores
microscopique.
Le gel de silice est principalement utilisé comme phase
stationnaire pour la chromatographie en phase liquide, il peut également
être utilisé comme desséchant ou comme réactif
[3].
II.2.5. Adsorbants à base de polymères
Les adsorbants à base de polymères organiques
tels que les polystyrènes, les esters polyacryliques ou les
résines phénoliques. Ce sont généralement des
matériaux mésoporeux qui ont trouvé des applications pour
l'élimination des composés organiques et la purification des eaux
[5].
II.2.6. Charbon actif
Le charbon actif est un produit adsorbant obtenu à
partir de matières premières riches en carbone. Il a une
caractéristique essentielle qui est l'existence d'un réseau
très développé de micropores, lesquels sont à
l'origine de leur pouvoir adsorbant très important.
Par conséquence, le charbon actif constitue l'adsorbant
le plus fabriqué et le plus utilisé industriellement
[6].
Page 7
III
III. Charbon actif
III.1. Historique
L'exploitation des propriétés filtrantes du
charbon de bois pour la purification et en médecine débute avec
les égyptiens en l'an 1500 avant Jésus Christ. Quant aux anciens
hindous, ils filtraient déjà leur eau avec des charbons pour la
rendre potable.
L'industrialisation du charbon actif proprement dit commence
au début du XXème siècle pour répondre aux besoins
des raffineries de sucre. Le charbon actif est alors utilisé comme
décolorant.
La production des charbons actifs s'intensifie pendant la
première guerre mondiale en raison de la prolifération des gaz
toxiques et du développement des masques à gaz.
Aujourd'hui, la production mondiale annuelle en charbons
actifs atteint 420 000 tonnes. Le faible coût des charbons actifs et leur
caractère non sélectif leur assurent leur place sur le
marché des adsorbants, en dépit de l'apparition récente
des nombreux concurrents décrits précédemment et en
particulier des zéolites, les principales rivales des charbons actifs
qui présentent les mêmes propriétés que les charbons
actifs en termes de conductivité et de résistance à la
chaleur avec une répartition de taille de pores très
étroite [6].
III.2. Définition
Le charbon actif est un carbone microporeux inerte qui a subi un
traitement pour augmenter sa surface. Il possède ainsi une très
grande surface spécifique pouvant aller de 100 à 2000
m2 .g-1 d'où sa grande capacité
d'adsorption.
La structure du charbon actif est proche de celle du graphite,
ordonnée sous la forme d'un empilement de couches successives planes
d'atomes de carbone disposés en hexagones réguliers
[8].
Le charbon actif est un adsorbant non spécifique avec
une structure poreuse bien développée formée
majoritairement par des micropores et des mésopores de différents
diamètres [6], comme représenté sur la
figure III.1.
Page 8
III

Figure III.1 : Structure du charbon actif vu sous un
microscope électronique [8].
III.3. Différents types de charbon actif
III.3.1. Charbon actif en grain (CAG)
La forme granulaire du charbon est caractérisée
par une taille des particules supérieure à 1 millimètre (?
1 mm), un faible diamètre des pores, une grande surface interne et une
externe relativement faible. Il en résulte que les
phénomènes de diffusion à l'intérieur des pores
prennent une grande importance dans le processus d'adsorption.
III.3.2. Charbon actif en poudre (CAP)
Le charbon actif en poudre présente une
granulométrie inférieure à 100 micromètres (? 100
um) avec un diamètre moyen situé entre 15 et 25 um. Ils ont une
large surface externe et une faible profondeur de diffusion ce qui engendre une
vitesse d'adsorption très rapide [3].
Le tableau suivant récapitule les différents types
de charbon actif
Tableau III.1 : Différents types de
charbon actif
|
Type de charbon actif
|
Forme
|
|
Charbon actif en poudre
|
|
|
Charbon actif en grain
|
|
III.4. Caractéristiques du charbon actif
? Volume poreux et taille des pores
Un solide poreux peut être défini à partir
du volume de substance adsorbée, nécessaire pour saturer tous les
pores ouverts d'un gramme de solide, habituellement exprimé en
(cm3.g-
1).
Selon la classification IUPAC (International Union of Pure and
Applied Chemistry), les tailles de pores sont réparties en 3 groupes,
(figure III.2) [8] :
y' Les micropores : si le
diamètre est inférieur à 2 nanomètres (? 2 nm),
y' Les mésopores : si le
diamètre est compris entre 2,5 nanomètres et 50
nanomètres, y' Les macropores : si le
diamètre excède 50 nanomètres (? 50 nm).
[6]
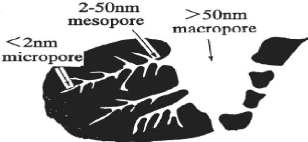
Figure III.2 : Structure des pores du charbon actif
[9].
Page 9
Page 10
III
? Surface spécifique
La surface spécifique d'un adsorbant est une surface
par unité de masse. Elle est généralement exprimée
en m2.g-1. Son estimation est conventionnellement
fondée sur des mesures de la capacité d'adsorption de l'adsorbant
en question, correspondant à un adsorbat donné
[10].
Pour les charbons actifs, cette surface varie entre 100 et 2000
m2.g-1.
Le tableau ci-dessous résume quelques surfaces
spécifiques de certains adsorbants
Tableau III. 2 : Surfaces spécifiques de
quelques matériaux adsorbants [9]
|
Matériaux adsorbants
|
Surfaces spécifiques
(m2.g-1)
|
|
Alumine activée
|
200-400
|
|
Tamis moléculaires carbonés
|
300-600
|
|
Adsorbants à base de polymère
|
100-700
|
|
Zéolites
|
500-800
|
|
Gel de silice
|
600-800
|
|
Charbons actifs
|
400-2000
|
Il est nécessaire de distinguer la surface interne de
la surface externe d'un adsorbant. La première est la surface
microporeuse représentée par les parois des micropores ; elle
peut atteindre plusieurs mètres carrés par gramme.
La deuxième est la surface non microporeuse qui
comprend les parois des mésopores et des macropores, ainsi que la
surface des feuillets aromatiques [10], comme
représenté sur la figure III.3.
Page 11
III
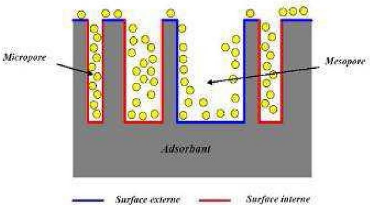
Figure III.3 : Représentation de la surface
interne et externe d'un matériau
poreux (adsorbant) [10].
? Densité apparente
Elle rend compte de la masse de matériau contenue dans
un volume donné, comprenant le volume d'air interstitiel. Une valeur
élevée de densité apparente indique une meilleure
qualité de charbon actif. Elle est exprimée en kg.
m-3.
? Granulométrie
Elle conditionne la vitesse d'adsorption, plus le grain est
petit, plus le transfert vers le centre est rapide [8].
III.5. Préparation du charbon actif
En général, le charbon est un matériau
carboné poreux, il peut être préparé à partir
de plusieurs types de matières premières telles l'anthracite, les
schistes bitumineux, le bois, la lignine, la coque de noix de coco, la coque
d'amande, le grignon et les noyaux d'olives, la pulpe de pomme, les
pépins d'oranges, les noyaux de dattes, les grains de café, les
noyaux d'abricots, les polymères et les déchets carbonés
[9].
Le tableau suivant montre les différentes matières
premières pour préparer le charbon actif.
Page 12
III
Tableau III. 3 : Différentes
matières premières pour préparer le charbon actif.
|
Matières premières
|
Forme
|
Pourcentage en Carbone
|
|
Lignite
|
|
Environ 70% de carbone
|
|
Charbon bitumineux
|
|
|
|
Anthracite
|
|
Environ 95% de carbone
|
|
Les noyaux de dattes
|
|
|
|
Les noyaux des olives
|
|
|
Page 13
Page 14
III
III.5.1. Activation des charbons actifs
Les charbons actifs sont produits à partir de deux
méthodes d'élaboration différentes : l'activation physique
(deux traitements thermiques successifs : la carbonisation et l'activation) et
l'activation chimique (un seul traitement thermique suivi de la mise en contact
avec un agent activant).
a. Activation physique : elle se déroule
en deux étapes :
V' La carbonisation de la matière
première : elle permet l'élimination des atomes
autres que le carbone (N, H, O, S) contenus dans la matière
première pour donner un matériau carboné avec une
structure poreuse rudimentaire appelée carbonisât.
Cette étape du procédé est
réalisée dans une atmosphère inerte à des
températures inférieures à 1 000°C (comprises entre
600°C et 900°C en fonction de la matière première).
Elle fournit des matériaux ayant une structure poreuse limitée
(surface spécifique comprise entre 10 m2. g-1 et 100
m2. g-1), qui est ensuite développée durant
le processus d'activation.
V' L'activation physique : est une
oxydation ménagée du carbonisât réalisée
à haute température (entre 700°C et 1 000°C) par un gaz
oxydant pendant un temps donné en fonction de la porosité
désirée. Les gaz les plus utilisés sont la vapeur d'eau
(H2O) et le dioxyde de carbone (CO2).
b. Activation chimique
L'activation chimique est généralement
réalisée en plusieurs étapes mais elle ne comporte qu'un
seul traitement thermique.
Dans un premier temps, il s'agit de mettre en contact l'agent
activant et la matière première, les agents oxydants les plus
utilisés sont l'acide phosphorique (H3PO4), la potasse (KOH) et le
chlorure de zinc (ZnCl2).
Les mélanges solides obtenus subissent un traitement
thermique, sous un flux de gaz inerte (généralement l'azote)
à des températures comprises entre 500°C et 900 °C.
Les conditions du traitement thermique dépendent du
précurseur et de l'agent activant utilisé. Le CA est ensuite
lavé (par exemple à l'acide nitrique HNO3) puis rincé
à l'eau distillée jusqu'à l'obtention d'un filtrat neutre
[11].
III.6. Utilisations du charbon actif
Les domaines d'application des charbons actifs sont nombreux et
variés :
Médecine
· Chélateur dans un grand nombre d'intoxications,
· Epuration digestive et abaissement du taux de
cholestérol total et en particulier du taux des LDL.
· anti-diarrhéique dans les cas des
diarrhées.
· Aigreurs d'estomac, aérophagies, flatulences.
· Dans les cas de gastro-entérites, de gastralgies
et dans les états d'infection de l'intestin accompagnés de
constipation.
Agroalimentaire
· Décoloration des eaux et autres liquides
alimentaires tels que les boissons gazeuses.
· Décoloration des édulcorants (glucose,
saccharose), des acides organiques issus de procédés
fermentaires, des acides aminés et des vitamines.
· Purification des huiles végétales et
animales,
· Abattement de toxines dans les jus de fruits.
· Détachage des vins blancs, comme le Champagne
produit à partir de raisin noir.
· Décoloration du sucre.
Industrie chimique
· Stockage de l'hydrogène (nano-fibres de charbon
actif ou de dérivés du charbon),
· Support pour métaux catalytiques ultra
divisés (platine ou nickel sur charbon actif),
· Elimination des hydrocarbures dans l'eau,
· Extraction de l'or des minerais (fixation sur le charbon
actif),
· Balais (frotteurs) dans les générateurs et
moteurs (utilisation de plus en plus rare),
· Traitement des effluents liquides,
· Traitements des gaz (Composés Organiques Volatils
COV) [12].
Page 15
Page 16
Page 17
IV
|
Utilisation industrielle du charbon actif
|
IV. Utilisation industrielle du charbon actif
Le charbon actif est d'un très grand
intérêt industriel vu son utilisation pour la gestion et le
contrôle des déchets polluants aqueux et gazeux [9].
Les charbons actifs utilisés pour la séparation en phase
liquide ont des tailles de pores distribuées autour ou
supérieures à 3 nanomètres (nm) tandis que ceux
utilisés en phase gazeuse ont des tailles de pores inférieures
[5].
IV.1. Traitement des eaux par charbon actif
Les eaux usées sont constituées d'eau, de
matières de vidange, de déchets organiques et de
détergents [13].
En général, le traitement des eaux usées
se fait en plusieurs étapes, ce traitement a pour objectif de
débarrasser l'eau de certaines matières organiques,
matières solides, nutriments, organismes pathogènes et autres
polluants.
Les eaux usées peuvent subir trois traitements
[13] :
IV.1.1. Traitement préliminaire
La première étape consiste à retirer les
débris et les déchets grossiers de l'eau dès qu'elle entre
dans l'usine, c'est-à-dire du bois, des vêtements, du plastique,
du verre, du métal, du sable ou du gravier.
Cette étape de traitement ne permet d'éliminer
que 10 à 15 % de la pollution initiale des eaux usées selon les
trois étapes suivantes [13, 14], (figure IV.1) :
? Dégrillage
À l'arrivée dans la station, les eaux
usées passent à travers des grilles dont les barreaux retiennent
les déchets solides les plus grossiers (papiers, matières
plastiques...). Il s'agit d'une simple étape de séparation
physique [15, 16].
? Dessablage
Les sables et graviers susceptibles d'endommager les
installations en aval (ensablement des conduites, des bassins, usure des pompes
et autres organes métalliques...) se déposent au fond de bassins
conçus à cet effet. Ils sont récupérés de
différentes façons [17].
|
IV
|
Utilisation industrielle du charbon actif
|
? Déshuilage et dégraissage
Il se fait par injection de fines bulles d'air qui permettent
de faire remonter les huiles et les graisses en surface d'où elles sont
éliminées [16].
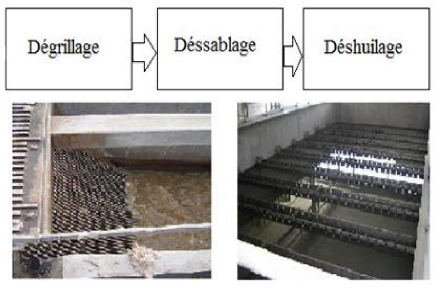
Figure IV.1 : Les étapes du
prétraitement.
IV.1.2. Traitement primaire (physicochimique)
Les eaux usées entrent dans un bassin de
décantation, le plus souvent de forme cycloniques et y restent pendant
plusieurs heures [18] pour que les matières solides
puissent se déposer dans le fond ; l'accumulation de ces matières
entraîne la formation d'une couche de boues dite boues primaires.
Les matières solides plus légères, comme
les matières grasses, les huiles et les graisses, restent à la
surface pour former un chapeau de boue [13].
Les performances de la décantation peuvent être
améliorées par l'adjonction de produits chimiques ou coagulants
(sulfate d'alumine, chlorure ferrique) [17] qui provoquent le
regroupement ou bien l'agglomération des particules encore
présentes en flocons. Ceux-ci s'agglomèrent et se déposent
au fond du bassin par décantation [16], comme le
résume la figure IV.2.
|
IV
|
Utilisation industrielle du charbon actif
|
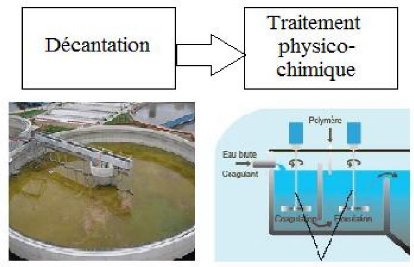
Figure IV.2 : Les étapes de décantation
et la coagulation-floculation.
IV.1.3. Traitement secondaire (biologique)
Après décantation, l'effluent est introduit dans
des bassins équipés de dispositifs d'aération (turbines,
insufflation d'air...) où des microorganismes naturellement
présents dans l'effluent qui décomposent les contaminants
organiques (figure IV.3).
Ces microorganismes exercent également un effet physique
de rétention de la pollution par leur propension à se rassembler
en films ou flocons.
Les techniques de traitements biologiques les plus couramment
employées sont :
- Les boues activées,
- Les lits bactériens (bactéries fixées),
- Les biofiltres,
- Les procédés membranaires sont utilisés
depuis quelques années [13, 17].
Page 18
Page 19
IV
|
Utilisation industrielle du charbon actif
|

Figure IV.3 : Le traitement biologique.
IV.1.4. Filtration sur charbon actif
Après les traitements préliminaires, primaires et
secondaires, l'eau subit une filtration. Le système de filtration est
composé de filtres avec des tailles différentes qui se composent
de gravier ou sable et la plupart du temps de charbon actif.
Les filtres à charbon actif retiennent les matières
en suspension (MES) et les micropolluants comme les pesticides et leurs
sous-produits, les composés à l'origine des goûts et des
odeurs.
Cette filtration sur charbon actif peut avoir lieu après
la désinfection également car ils retiennent également les
sous-produits de désinfection [16].
Afin d'assurer la filtration sur charbon actif, il existe des
paniers de rétention qui sont conçus entièrement en acier
inoxydable et sont d'une construction de haute qualité.
Ils sont facilement rechargeables avec des agents de sorption
(charbon actif).
Le vidage et remplissage du panier s'effectue de manière
simple et rapide en tournant la poignée située sur le haut du
couvercle, ceci implique le vissage et dévissage du couvercle. Il existe
deux types de système ou style de paniers de filtration :
|
IV
|
Utilisation industrielle du charbon actif
|
? Style RS (Style de Recirculation)
:
Le flux entre par le haut du panier, par le couvercle
perforé, remplit de charbon actif. Le flux se déplace radialement
en traversant le charbon actif et ressort au travers de la paroi, qui est
perforée et doublée d'une toile Inox [19] comme
le schématise la figure IV.4.
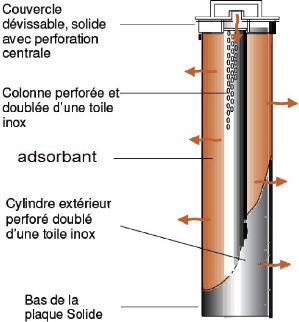
Figure IV.4 : Style RS de filtration sur charbon actif
[19].
? Style SP pour Procédure Simple Passe (Une
fois) :
Le fluide pénètre par le haut par un couvercle
perforé et traverse le lit de charbon actif. Le débit se
déplace vers le bas en traversant la couche de charbon et ressort par la
plaque de fond, perforée et doublée d'une toile à inox
[19], (figure IV.5).
Page 20
IV
|
Utilisation industrielle du charbon actif
|
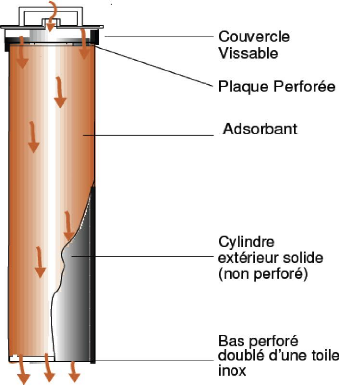
Figure IV.5 : Style SP de filtration sur charbon actif
[19].
IV.2. Traitement des gaz par charbon actif
IV.2.1 Définition des Composés Organique
Volatils (COV)
Les composés organiques volatils sont tous les
composés contenant du carbone (C) et de l'hydrogène (IT) à
l'exception du méthane (CIT4) (selon la loi Française).
L'hydrogène peut être substitué
partiellement ou totalement par des atomes de chlore (Cl), d'oxygène
(O), de soufre (S), d'azote (N) ou de phosphore (P) et se trouvant à
l'état de gaz ou de vapeur dans les conditions normales de
température et de pression (20°C et 1 atm)
[20].
|
IV
|
Utilisation industrielle du charbon actif
|
Page 21
Les principales familles de COV sont :
Les solvants, les hydrocarbures aromatiques, les cétones,
les alcools, les esters, les composés chlorés, les
composés azotés et les composés soufrés...
[21].
IV.2.2 Sources d'émission de COV
Il existe un grand nombre de sources de pollution appartenant
à de multiples secteurs. La Figure IV.6 présente un inventaire
des principales sources de COV [21].
|
|
|
Sources
|
|
|
|
|
|
|
|
|
|
|
|
|
Transport
|
Combustion
fixe
|
|
Déchets
solides
|
Divers
|
|
Procédés
industriels
|
|
Moteurs
Véhicules
Avions
Trains
Evaporation
des stations de
stockage des
hydrocarbures
|
|
Stockage
Carburant
Centrales Fuel
|
|
Chimie
Pharmacie
Métallurgie
Minerais
Pétrochimie
|
|
Incinération
Feux ouverts
Décharges
|
|
Feux de forêts, de produits agricoles
Produits
d'entretien
|
Figure IV.6 : Sources d'émissions de COV
[21].
Page 22
IV
|
Utilisation industrielle du charbon actif
|
IV.2.3. Impact sur l'homme et l'environnement
Les émissions de COV ont un impact direct et important
sur l'homme et l'environnement du fait de leur toxicité.
A chaque COV correspond une toxicité différente
même si des similitudes, telles que les propriétés
irritantes, sont observées [20].
Différents phénomènes induits par les COV
se produisent dans les deux couches les moins élevées de
l'atmosphère et conduisent à une pollution environnementale : la
destruction de la couche d'ozone stratosphérique par des composés
chlorés et l'effet de serre dû à une classe
particulière de COV, les chlorofluorocarbures (CFC)
[21].
Parmi les COV les plus dangereux, nous pouvons citer le
benzène reconnu responsable de la contraction de leucémies
[20].
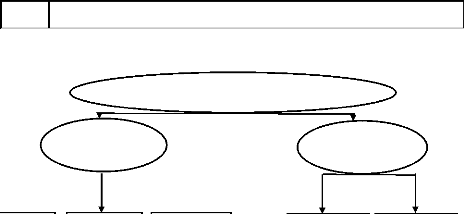
IV.2.4 Procédés de traitement des COV
Les procédés de traitement des effluents gazeux
contenant des COV à l'échelle industrielle sont classés
par rapport à leur caractère destructif ou
récupératif des polluants [22].
IV.2.4.1 Techniques de récupération
Parmi les techniques de récupération qui nous
intéresse dans cette étude, l'adsorption et plus
précisément sur charbon actif (figure IV.7).
L'adsorbant le plus utilisé et le plus efficace pour le
traitement des gaz chargés en COV est le charbon actif (CA).
L'adsorption sur CA est une technique utilisée dans 23
% des installations mises en place permettant le traitement des COV en fin de
procédé industriel.
IV
Utilisation industrielle du charbon actif
Procédés de traitement des COV
Procédés destructifs
Procédés
récupératifs
Page 23
Oxydation
thermique
|
|
Oxydation
catalytique
|
|
Biofiltration
|
|
Condensation
|
Membrane
|
|
|
|
|
|
|
|
Absorption
|
Adsorption
|
|
|
|
|
|
|
|
|
|
|
|
Régénératif
|
|
Récupératif
|
Biofiltre
|
|
Transfert
physique
|
Lit fixe
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Récupératif
|
|
Régénératif
|
|
Percolant
|
|
|
|
|
|
|
|
|
|
|
|
Lit mobile
|
|
|
|
|
|
Transfert
chimique
|
|
|
|
Fluidisé
|
Biolaveur
|
|
|
Lit fluidisé
|
|
|
Figure IV.7 : Procédés de traitement des
effluents gazeux contenant des COV [22].
L'opération d'adsorption peut être mise en oeuvre
dans différents équipements :
a. Lits fluidisés
Les adsorbeurs sont conçus pour travailler à
contre-courant tant en adsorption qu'en désorption. Tandis que le
mélange gazeux est injecté en bas de colonne, l'adsorbant est
introduit en haut de la colonne, via un gaz porteur. L'adsorbant est ensuite
régénéré avant d'être réintroduit dans
la colonne [7, 21].
b. Lits circulants et lits rotatifs (systèmes
continus)
Un lit circulant est constitué d'un lit en mouvement
descendant à contre-courant du gaz dont certaines sections sont en mode
adsorption et d'autres en mode désorption.
Page 24
IV
|
Utilisation industrielle du charbon actif
|
Le gaz circule de bas en haut dans les différentes
sections. Certaines configurations de lit circulant utilisent un mode en
courants croisés où le lit circule verticalement de bas en haut
et l'air à traiter horizontalement.
Parmi elles, le lit rotatif constitué de lits en forme
de secteurs contenant des granules d'adsorption montés sur un dispositif
tournant. Notons que ces derniers sont principalement utilisés pour
concentrer les COV préalablement à l'utilisation d'une autre
technique [7].
c. Lits fixes
régénératifs
Plusieurs lits fonctionnent en parallèle dont un est en
mode adsorption et les autres en mode désorption. C'est la configuration
la plus courante (figure IV.8) [7, 21].
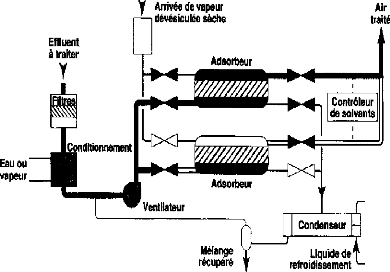
Figure IV.8 : Adsorption en lit fixe (deux adsorbeurs
montés en parallèle) [21].
La technique d'adsorption peut conduire à des
efficacités de l'ordre de 95 %. Cette technique est applicable dans une
très large gamme de débits (100-100000 m3/h).
Page 25
IV
|
Utilisation industrielle du charbon actif
|
Un des avantages majeurs à son utilisation est que la
concentration résiduelle est à peu près
indépendante de la concentration initiale, ce qui permet de traiter des
effluents de composition variable et d'effacer les pointes de concentration.
En revanche, elle présente différents
inconvénients dont les principaux sont : un possible empoisonnement de
l'adsorbant, la présence éventuelle d'une réaction
secondaire entre l'adsorbant et l'adsorbat et la sélectivité de
l'adsorbant limitant la composition du mélange gazeux
[21].
Page 26
V. Conclusion
A la lumière de notre modeste investigation, nous avons
pu étudier les différents adsorbants utilisés en
industrie, et essentiellement le charbon actif.
Ainsi, cette étude nous a permis, d'une part,
d'étudier les différents types du charbon actif, ses
caractéristiques et sa préparation, et d'autre part, nous avons
pu mettre en évidence les différents processus
d'élimination des polluants contenus dans l'eau et le traitement des
composés organiques volatils contenus dans l'air par adsorption sur
charbon actif ; cette technique est utilisée dans 23% des installations
mises en place.
On peut conclure que l'application industrielle du charbon
actif dans l'adsorption de certains polluants chimiques susceptibles
d'être présents dans les effluents industriels liquides et gazeux
est importante vue sa grande surface spécifique, sa disponibilité
et son faible coût.
Références bibliographiques
[1] : A.K. Mellah,2012,
Adsorption de produits pharmaceutiques sur le charbon actif en poudre
en vue de leur élimination, Mémoire de Magister, Ecole
Nationale Polytechnique, Alger.
[2] : A. Tahar, J.M. Choubert, P. Molle, M. Coquery,
2010, Matériaux adsorbants pour La rétention et le
traitement de substances pharmaceutiques phytosanitaires, Office
national de l'eau et des milieux aquatiques, Cemagref.
[3] : N. Yahiaoui, 2012, Etude de l'adsorption
des composés phénoliques des margines d'olive sur carbonate de
calcium, hydroxypatite et charbon actif, Mémoire de Magister,
Université de Tizi Ouzou.
[4] : F.Z. Batana, 2011, Etude de la
mobilité du cadmium à travers un sol, Mémoire de
Magister, Ecole Nationale Polytechnique, Alger.
[5] : L. Ming Sun, F. Meunier, 2003,
Adsorption, aspect théorique, Edition technique de
l'ingénieur, J 2730.
[6] : L. Meljac, 2004, Etude d'un
procédé d'imprégnation de fibre de carbones
activés-modélisation des interactions entre ces fibres et le
sulfure d'hydrogène, Thèse de Doctorat,
Université de Jean Monnet, St-Etienne.
[7] : S. Marsteau, 2005, Adsorption,
traitements des gaz dangereux captés sur les lieux de travail,
Edition 4263, Département Ingénierie des Procédés,
Institut
National de Recherche et de Sécurité (INRS).
[8] : J. Omlin, L. Chesaux, 2010, Evaluation de
charbons actifs en poudre (CAP) pour l'élimination des micropolluants
dans les eaux résiduaires urbaines, Ecole Polytechnique
Fédérale de Lausanne.
[9] : A. Elabed, 2007,
Réactivité thermique et cinétique de
dégradation du bois d'arganier application à l'élaboration
de charbon actif par activation chimique à l'acide
phosphorique, Thèse Doctorat, Université Mohammed V,
Maroc.
[10] : M .A. SLASLI, 2002,
Modélisation de l'adsorption par les charbons microporeux:
Approches théorique et expérimentale, Thèse de
Doctorat, Université de Neuchâtel.
[11] : T. Ferrera de Oliveira,
2011, Etude d'un procédé de dépollution base sur
le couplage ozone / charbon actif pour l'élimination des phtalates en
phase aqueuse, Thèse de Doctorat, Université
d'Orléans.
[12] :
www.asseau.com/fr103_9.html
[13] : Dans une goutte d'eau, eaux
usées, Centre de traitement, 2010, Edition Environnement,
Nouvelle Ecosse.
[14] : A. T. Baytraktarn,
Introduction aux traitements des eaux usées, Edition
traitement des eaux usées.
[15] : J. Saint-André,
environnement, la station d'épuration, Ecole Henri
Morange.
[16] : Présentation sur le traitement pour eau
potable, 2005, Ecoles des Ponts, Paris Tech (ENPC).
[17] : H. Aussel, C. Le Bâcle, G.
Dornier, Le point des connaissances, le traitement des eaux
usées, 2004, Edition 5026, Institut National de Recherche et de
Sécurité (INRS).
[18] : S. Donna, N. Rebecca, J. Emma, G.
Shay, 2004, United States Geological Survey: Environmental Factors and
Chemical and Microbiological Water- Quality, Fondation de l'Eau Potable
Sûre.
[19] : Systèmes de filtration pour le traitement
de l'eau, Edition Dubuisson Filtration.
[20] : R. Beauchet, 2008,
Oxydation catalytique de divers composés organiques volatils
(COV) à l'aide des catalyseurs zéolithiques,
Thèse de Doctorat, Université de Poitiers.
[21] : D. Bourgois, 2007,
Elimination des vapeurs de polluants organiques par absorption dans des
solvants visqueux et non volatils, Thèse de Doctorat,
Faculté Polytechnique de Mons.
[22] : N. Mhiri, 2009, Etude
d'un procédé propre couplant l'absorption gaz / liquide
microstructurée avec la distillation pour le traitement d'air
chargé par un composé organique volatil, thèse de
Doctorat, Institut National Polytechnique de Lorraine.
| 


