|
UNIVERSITE DE KINSHASA
251661312
FACULTE DES SCIENCES AGRONOMIQUES
Département de Phytotechnie
B.P 117 KIN XI

Efficacité de deux extraits de plantes à
action biocides (Tephrosia vogelii et Zingiber officinale) sur la croissance in
vitro de Mycosphaerella fijiensis , agent causal de la maladie des raies noires
du bananier
Par :
MUKENDI Joël
Gradué en Sciences Agronomiques
Mémoire présenté et défendu
en vue de l'obtention du titre d'Ingénieur Agronome.
Orientation :
Phytotechnie
Directeur: Professeur Adrien KALONJI MBUYI
Année académique :
2010-2011
TABLE DES MATIERES
TABLE DES MATIERES ii
LISTE DES FIGURES iii
LISTE DES TABLEAUX iv
DEDICACES v
REMERCIEMENTS vi
RESUME vii
INTRODUCTION 1
CHAPITRE I : REVUE DE LA LITTERATURE 4
I.1. Généralités sur la Cercosporiose
noire du bananier 4
I.1.1. Historique et répartition géographique
4
I.1.2. Agent pathogène 4
I.1.3. Symptomatologie 5
I.1.4. Epidémiologie 7
I.1.4.1. Infection 8
I.1.4.3 Période d'incubation 8
I.1.4.4 Conidiophores et conidies 8
I.1.4.5 Périthèces et les ascospores 8
I.1.4.6 Capacité d'adaptation 9
I.1.5. Dégâts 9
I.1.6. Stratégies de lutte 9
I.2. Aperçu sur les plantes bio pesticides
utilisées 10
I.2.1. Tephrosia vogelii 10
I.2.2. Zingiber officinale 11
CHAPITRE II. MATERIEL ET METHODES 13
II.1. Matériel 13
II.1.1. Matériel végétal 13
II.1.2. Matériel de laboratoire 13
II.2. Méthodes 13
II.2.1. Identification du M. fijiensis sur les
échantillons récoltés 13
II.2.2. Isolement de M. fijiensis sur milieu PDA
14
II.2.2.1. Préparation de milieu de culture pour isolement
14
II.2.2.2. Mise en culture de Mycosphaerella
fijiensis 14
II.2.3. Purification de souches 14
II.2.4. Ensemencement du M. fijiensis sur milieu de
culture incorporé de jus de plante 15
II.2.4.1. Préparation de milieu 15
II.2.4.2. Extraction et incorporation du jus de plantes
biopesticides dans le milieu de culture 15
II.2.5. Paramètres observées 16
CHAPITRE III. RESULTATS ET DISCUSSION 17
III.1.1. Identification de Mycosphaerella
fijiensis sur les feuilles de bananier infectée 17
III.1.2. Effet de l'extrait de Tephrosia vogelii sur la
croissance radiale de Mycosphaerella figiensis 18
III.1.3. Effet de l'extrait de Zingiber officinale
sur la croissance radiale de Mycosphaerella fijiensis 19
III.1.4. Effet de mélange d'extraits de
Tephrosia vogelii et Zingiber officinale
Mycosphaerella fijiensis 20
III.1.5. Effets comparatifs des extraits de Tephrosia
vogelii et Zingiber officinale sur la croissance
radiale moyenne de Mycosphaerella fijiensis 21
III .1.6. Pigmentation du milieu de culture
ensemencé 23
CONCLUSION ET PERSPECTIVES 24
REFERENCES BIBLIOGRAPHIQUES 25
ANNEXES 29
LISTE DES FIGURES
Figure 1. : Stade des tirets
Figure 2 : Stade des lésions
Figure 3 : Stade de nécroses aux centres
Figure 4 : Stade de desséchement
Figure 5 : Stade de nécroses isolées
Figure 6 : Stade des nécroses coalescentes
Figure 7 : Cycle infectieux de Mycosphaerella
fijiensis
Figure 8 : Images des feuilles de Tephrosia
vogelii
Figure 9 : Rhizomes de Zingiber
officinale
Figure 10 : Observation microscopique des conidies et
conidiophores de Paracercospora fijiensis phase anamorphe de M.
fijiensis isolés sur les feuilles de bananier infectées
Figure 11 : Croissance radiale de Mycosphaerella
fijiensis sur le milieu de culture PDA incorporé de jus de
Tephrosia vogelli.
Figure 12 : Croissance radiale de Mycosphaerella
fijiensis sur le milieu de culture PDA incorporé de jus de
Z. officinale.
Figure 13 : Croissance radiale de Mycosphaerella
fijiensis sur le milieu de culture PDA incorporé de jus de
mélange Tephrosia vogelii et Z. officinale.
Figure 14 : Croissance radiale de
Mycosphaerella fijiensis sur le milieu de culture PDA
incorporé de jus de Z. officinale et de T. vogelii et
de mélange de deux jus.
LISTE DES TABLEAUX
Tableau 1. Pigmentation du milieu de culture ensemencé
DEDICACES
A mes très chers
Parents Clément MUKENDI NKONKU et Rose BAKANKINA, pour tant d'amour,
soutien tant spirituel, moral que financier et sages conseils.
A mes frères et soeurs : Dr. Mike MULUMBA, Ir.
Olivier TSHIBANGU, David TSHIASUMA, Didier NKASHAMA, Emmanuel KABENGELE, Angel
KULONDI, Ruth MUENDA, Nicole KAPINGA, Isabelle MASENGU, Rebecca KASSA.
A mes neveux et nièces : Israël MWAMBA,
Winner MAMBA, Rose BANKAKINA et Isabelle MUSHIYA pour votre assistance et
affection indescriptibles.
Joël MUKENDI
REMERCIEMENTS
Nous signons par ce travail la fin de notre
deuxième cycle d'études universitaires en Sciences Agronomiques
à l'Université de Kinshasa. De ce fait, nous voudrions remercier
toute personne qui de près ou de loin a contribuée à notre
formation et à la réalisation de ce travail.
Nous remercions, en premier lieu, l'Eternel Dieu, le
Maitre de temps et des circonstances. Ensuite, les autorités
académiques ainsi que le corps professoral et administratif de
l'Université de Kinshasa en générale et de la
Faculté des Sciences Agronomiques en particulier.
Nous présentons notre sentiment de gratitude
à l'endroit du Professeur Adrien KALONJI MBUYI WA MBOMBO qui en
dépit de ses multiples occupations a bien voulu assurer la direction de
ce travail.
Nous remercions également la Clinique des Plantes
de Kinshasa (CPK) et le Centre Agronomique et Vétérinaire
Tropicale de Kinshasa (CAVTK), particulièrement l'Ir. Lyna MUKWA FAMA
TONGO et Monsieur Max MULAND KAYIJ. Nous n'oublions pas le Professeur Patrick
TSHILENGE DJIM KANANA, les ingénieurs Marcel MUENGULA, Luc LUNKANDA et
Greg MAMBA pour leur encadrement, encouragement et conseil
scientifique.
Nous tenons à exprimer toute notre reconnaissance
à Guthrie BASOLO LUVILUKA, Alain ILUNGA KABASELE, Tantine BOLEMBO, Alva
BAMANA, Danny LOFINDA, Cédric KALONJI, Dier NDEMI, Daddy KEGBA, Fabrice
IMPION, Christian MOSEMBO, Ruth BADUBAYE, Niclette MFUTU, Gradie MUHONGO,
Guelord NSUANDA, John MAKADI, Laurent NDIMA, Fils LUWAWU, Lama MUNUNGANI, Fifi
KUMUTIMA, Fiston MPIEBAM, Rodrigue MIKWENE et Jean Claude MUWO.
Que toutes les personnes non citées, dans ce texte
mais ayant apportée une contribution tant matérielle, morale que
financière au long de notre parcours de formation, trouve, ici, le
couronnement de ses efforts et notre sincère gratitude.
RESUME
Le bananier est la quatrième grande culture au monde.
En République Démocratique du Congo, elle occupe en termes
d'importance, la troisième place après le manioc et le maïs.
Ces dernières années sa culture est menacée par les
maladies virales, bactériennes et fongiques qui ont
entraîné l'usage abusif des pesticides de synthèse. Le
souci de la protection de l'environnement, de la protection de la santé
des consommateurs a conduit à l'adoption des alternatives à
l'usage des pesticides chimiques. La lutte biologique au moyen des extraits des
plantes ou des organismes vivant est de plus en plus utilisée pour
diminuer l'incidence des affections du bananier. L'objectif de la
présente étude a été de tester l'efficacité
de deux extraits des plantes à action biocide sur la croissance in
vitro de Mycosphaerella fijiensis, agent causal de la
maladie des raies noires du bananier.
Les essais in vitro menés par ensemencement de
M. fijiensis sur des milieux de cultures contenant des
quantités différentes de Tephrosia vogelii, de
Zingiber officinale et de la combinaison des extraits
de T. vogelii et Zingiber officinale (50%
et 50%) ont montré qu'à une quantité 0,5 ml
du mélange d'extrait de Tephrosia vogelii et
Zingiber officinale, ainsi qu'à celle de 3ml de
l'extrait de Tephrosia vogelii, la croissance du champignon
est nulle. Deux tendances ont été ainsi remarquées :
la première tendance renseigne que, pour les extraits incorporés
séparément : plus la quantité augmente et moins
s'observe le développement du champignon. Tandis que la seconde tendance
indique que, pour le mélange des extraits de Z. officinale et
T. vogelii, plus la quantité augmente et plus on observe une
croissance radiale du champignon M. fijiensis. L'étude n'a pas
permis d'en trouver une explication du mécanisme d'action.
INTRODUCTION
Le
bananier (Musa sp.) est une plante essentiellement alimentaire
cultivé pour son fruit consommé comme banane fraiche (banane
dessert) ou cuite (banane plantain et autre banane à cuire) ou
même consommé comme fritte. Mûre, la banane peut servir
à la fabrication de la farine. Verte, elle est utilisée pour
préparer des cossettes séchées, mais aussi on y extrait du
jus (Mboho, 2007).
La
banane est un fruit hautement énergétique (Anonyme, 2010a). Selon
Sivirihauma (2008), les fruits de banane contiennent entre 25 et 30 % d'eau,
1.6% des protéines, 0.5% des lipides, 25% des glucides et 0.8% de
cendres. Les bananes sont riches en Ca, P et en vitamines A, B et C. Elle
contient certains composés vitaminés U (contre les
ulcères) et la sérotonine qui augmente la pression sanguine.
La banane constitue non seulement un aliment, mais aussi une
véritable source de revenu (Teycheney et al., 2007). Nyabyenda
(2005) indique que sur le plan africain, la production de bananes et plantains
est assurée principalement par l'Ouganda, le Rwanda, la
République Démocratique du Congo (RDC) et le Cameroun. Cependant,
on assiste depuis quelques décennies à une diminution de la
production dans les grandes zones productrices. Selon Lassoudière
(2010), en 1971, la production africaine de bananes et plantains
représentait 47% (soit 9,5Mt) de la production mondiale, a baissé
jusqu'à atteindre 29 % (soit 31,1Mt) en 2005. Ce qui se traduit par une
baisse de 18% d'apport de la production africaine dans la production mondiale.
Cette baisse de production est liée d'une part au
non respect des pratiques phytosanitaires, à la baisse de
fertilité du sol, à l'utilisation des techniques culturales non
appropriées, à l'absence des cultivars résistants et
à la dégénérescence des cultivars ; et d'autre
part, à l'explosion des maladies et ravageurs (Ndungo, 2008).
D'après Jones (2000a), les maladies et ravageurs constituent une menace
grandissante pour les petits et grands producteurs, et peuvent provoquer des
pertes catastrophiques. Selon le même auteur, des nombreux
systèmes de production de bananes sont menacés par des
épidémies provoquées par des champignons
phytopathogènes.
Parmi les maladies qui menacent la culture de banane, la
maladie des raies noires (MRN) ou Cercosporiose noire causée par
Mycosphaerella fijiensis est la contrainte la plus
dévastatrice et la plus agressive rencontrée chez le bananier
(Stierle et al., 1991 ; Mourichon et al., 1997 ; Ploetz et
Pegg 2000 ; Champion, 2009). Les attaques de la MRN se traduisent par la
diminution de la surface photosynthétique des feuilles, provoquant ainsi
le mûrissement précoce des fruits et des pertes de rendement
atteignant parfois 50% (Mourichon et al., 1997).
La lutte contre la MRN est essentiellement chimique.
Cependant, cette méthode de lutte a un coût élevé et
la fréquence d'application entraîne l'apparition des souches
résistantes aux fongicides. En plus, l'impact des traitements a des
profondes répercussions sur l'environnement et sur la santé
humaine (Anonyme, 2010a). L'agent pathogène a un potentiel
élevé d'adaptation à des conditions nouvelles de climat,
fongicides ou de génotypes de la plante hôte (Ploetz, 2000). Ceci
est amplement démontré par la perte d'efficacité de
certains groupes de fongicides chimiques tels que les triazoles et
benzimidazoles utilisés dans la lutte chimique (Guzmán et al.
2000 ; Romero, 2000).
La recherche de nouveaux produits d'origine naturelle ne
polluant pas l'environnement et disponible à moindre coût
représente un élément important de l'agriculture durable
(Sanchez Rodriguez et al., 2002). Actuellement, des chercheurs et producteurs
travaillent ensemble pour développer des solutions alternatives et
innovantes permettant de réduire l'utilisation des pesticides dans la
protection des bananeraies (Anonyme, 2010b).
Des études antérieures menées sur des
biopesticides ont démontré des vertus biocides de plantes telles
que Zingiber officinale et de Tephrosia
vogelii dans la lutte contre quelques champignons comme
Alternaria solani (Luyeye, 2010) sur la tomate,
Helminthosporium oryzae sur le riz, Colletotrichum
gloesporiodes sur le manguier, et Cercospora sp. sur
l'arachide (Stoll, 2002). L'hypothèse de cette étude se fonde sur
le fait que si les champignons précités ne peuvent se
développer sur des milieux de culture contenant des extraits de
Z. officinale et T. vogelii, il est
également vrai que M. fijiensis ne peut s'y développer.
Le présent travail s'est fixé comme objectif
d'évaluer l'efficacité des extraits de Z. officinale et
T. vogelii sur la croissance Mycosphaerella fijiensis en
culture in vitro. Outre l'introduction, notre travail est
subdivisé en trois chapitres. Le premier chapitre traite de la revue de
la littérature, le second chapitre développe le matériel
et méthodes, et le troisième chapitre présente les
résultats et leur discussion. A la lumière des résultats
obtenus, une conclusion et quelques suggestions mettront un point final au
présent travail.
CHAPITRE I. REVUE DE LA LITTERATURE
I.1. Généralités sur la maladie des raies
noires du bananier
I.1.1. Historique et répartition géographique
La
maladie des raies noires a été identifiée pour la
première fois aux îles Fidji en 1963 (Rhodes, 1964), il semble que
cette maladie ait été présente bien avant en Asie et dans
le Pacifique. Certaines études sur la diversité de cette
espèce pathogène indiquent une origine en Papouasie-Nouvelle
Guinée. Après sa découverte au Honduras en 1972, la
maladie s'est disséminée dans toute l'Amérique Centrale et
dans le Nord de l'Amérique du Sud. Elle est également
présente en Afrique, en Asie, dans le Pacifique et une partie des
Caraïbes. Sur le continent africain, M. fijiensis a
été observé d'abord en Zambie en 1973, puis s'est
répandu dans plusieurs pays d'Afrique de l'Est, de l'Ouest et Centrale.
Elle est présente dans toutes les basses terres tropicales humides
(Ploetz et Pegg 2000). L'aire de répartition de Mycosphaerella
fijiensis s'étend progressivement à toutes les zones de
production de bananes (Ploetz et Pegg, 2000; Mourichon, 2003).
En République Démocratique du Congo (RDC),
Sebasigari et Stover (1988) avaient signalé la présence de la MRN
dans la région montagneuse de l'Est du Zaïre. Classiquement, dans
les zones de basses altitudes où est déjà présente
l'espèce M. musicola, l`extension de M. fijiensis
conduit, dans un premier temps, à une période de
coévolution des deux espèces sur le même hôte, suivie
par un remplacement de Mycosphaerella musicola par
Mycosphaerella fijiensis. Toutefois, l'activité
parasitaire de M. fijiensis (durée d'évolution des
symptômes, sporulation) diminue progressivement en altitude, la maladie
de Sigatoka (MS) se maintient, ainsi, dans les seules régions d'altitude
(Fouré et Lescot, 1988 ; Mourichon et Fullerton, 1990 ;
Mouliom Pefoura et Mourichon, 1990).
I.1.2. Agent pathogène
La Maladie des Raies Noires (MRN), aussi connue sous le nom de
Cercosporiose noire ou Black Sigatoka est causée par un champignon
ascomycète Mycosphaerella fijiensis (Ploetz et Pegg
2000 ; Mourichon, 2003) appartenant à la famille des
Mycosphaerellacae. II est hétérothallique et
présente une forme imparfaite Cercospora fijiensis
décrite récemment comme Paracercospora fijiensis
(Deighton, 1976). Cette forme asexuée permet, grâce à la
morphologie des conidiophores et des conidies, de le distinguer de l`autre
espèce : Cercospora musae ou Paracercospora musae,
agent responsable de la maladie de Sigatoka jaune(MS) ou Cercosporiose jaune
(Deighton, 1979).
I.1.3. Symptomatologie
En champs, il est parfois difficile de distinguer sur base des
symptômes externes, la MRN et la MS. Ceux-ci ne permettent pas
d'établir clairement quelle est celle qui a la plus forte incidence
quand les deux coexistent. Au microscope, M. fijiensis et M.
musicola se distinguent principalement par les caractéristiques
morphologiques différentes de leurs stades anamorphes, en particulier au
niveau des conidiophores et des conidies. Paracercospora
fijiensis possède sur ses conidiophores et conidies, des
cicatrices appelées « hile », absentes chez
Pseudocercospora musae (Aguirre et al., 1998b).
Généralement, après une période d'incubation, les
symptômes de la MRN présentent 6 stades évolutifs
(Mourichon, 2003).
La
durée d'évolution des symptômes (du stade 1 au stade 6) est
très variable, généralement de 21 à 120 jours, et
dépend du cultivar, du stade de la plante hôte et de
l'environnement. Dans le cas d'une attaque très violente, on peut ne pas
observer tous ces stades. Une forte densité de stade 2 sur le limbe peut
provoquer, par coalescence, l'apparition de plages nécrotiques et le
dessèchement rapide de la feuille (Mourichon, 2003 ; Fouré,
1982). La répartition des symptômes sur les feuilles est assez
variable. L'attaque a lieu souvent en bout de feuille, symétriquement
à la nervure centrale. On peut observer toutefois une densité
élevée de tirets le long du bord du limbe gauche. La
densité des stries et des taches, réparties symétriquement
et situées près de la nervure centrale, diminue lorsqu'on
s'éloigne de cette dernière. Fréquemment, des taches
à différents stades sont observées sur une même
feuille. L'évolution est variable mais peut être très
rapide dans le cas de variétés très sensibles à la
Cercosporiose noire (Mourichon, 2003).
Les
différents stades peuvent se résumer comme suit : au stade
1, on observe sur la face inférieure du limbe de la 3ème ou
4ème feuille totalement déployée, des petits points
anguleux brun rouge, de 0,5 mm de diamètre ; au stade 2, ces points
deviennent des tirets parallèles aux nervures secondaires, mesurant 1
à 2 mm, plus visibles sur la face inférieure des feuilles (Figure
1). Les tirets présentent des contours bien définis et
délimités (selon les cultivars) de coloration brun rouge. Ce
stade est très visible lorsque la feuille est observée par
transparence ; au stade 3, les tirets s'allongent et changent de couleur
pour former des lésions nécrotiques à halo jaune et centre
gris clair (Figure 2) ; au stade 4, les tirets s'élargissent et
deviennent des taches fusiformes ou elliptiques entourées d'une zone
brun clair ; au stade 5, le centre noir des taches se nécrose
(Figure 3) ; au stade 6 (stade terminal de croissance du champignon), le
centre des taches se dessèche, tourne au gris clair, s'entoure d'un
anneau noir étroit bien défini encerclé d'un halo jaune
vif (Figures 4, 5 et 6). La feuille se dessèche mais les taches restent
visibles car le halo noir persiste (Mourichon, 2003).

Fig. 2. Stade de lésions

Fig. 1. Stade des tirets

Fig. 3. Stade de nécrose au centre

Fig. 4. Stade 6 : stade de dessèchement

Fig. 6. Stade des nécroses coalescentes à la face
supérieure de la feuille

Fig. 5. Stade des nécroses isolées à la face
supérieure de la feuille
I.1.4. Epidémiologie
Le M. fijiensis se propage par trois modes: le
transport de matériel végétal infecté (des rejets
infectés et des feuilles malades utilisées dans l'emballage de
nourriture ou d'autres produits), la dissémination d'ascospores
(produites lors de la reproduction sexuée) et la dissémination de
conidies (produites lors de la reproduction asexuée) (Gauhl et
al., 2000). Alors que les conidies se dispersent surtout sur de courtes
distances, sur la plante elle-même et sur les plantes avoisinantes, les
ascospores viables peuvent être transportées par le vent sur
quelques centaines de kilomètres (Parnell et al., 1998). La
libération d'ascospores est forte en temps de pluie du fait de la
présence d'une pellicule d'eau résiduelle à la surface des
feuilles, dont la face inférieure présente plus de
nécroses. Les feuilles sèches qui restent collées à
la plante représentent donc une excellente source d'inoculum (Gauhl,
1994). En ce qui concerne la température, on estime que les ascospores
de M. fijiensis germent entre 10 et 38 °C, sachant que la
température optimum de germination est de 27 °C et que la vitesse
relative de croissance des tubes germinatifs diminue fortement pour des
températures inférieures à 20 °C (Pérez, 1996).
Pour ce qui est de l'effet du vent, Stover (1984) et Gauhl (1994) ont
observé que la concentration des conidies dans les plantations est plus
élevée dans les couches d'air les plus basses que sur le
feuillage alors que la concentration des ascospores dans l'air est la
même ; ceci confirme l'importance des ascospores dans le cycle de la
maladie (Figure 7).
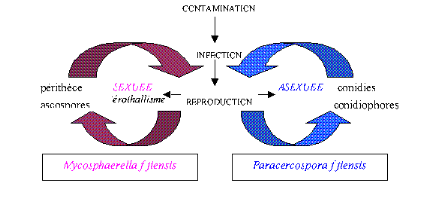
Fig. 7.
Cycle infectieux du M. fijiensis (Mourichon et al., 1997)
I.1.4.1. Infection
Les
spores (conidies et ascospores) germent 2 à 3 heures après leur
contact avec une surface foliaire humide. Dans des conditions artificielles, de
l'eau libre est nécessaire à l'infection par les ascospores. Pour
les conidies, une humidité relative est suffisante. Les
températures minimale, optimale et maximale pour la mise en place du
processus infectieux sont respectivement de 12°C, 27°C et 37°C.
Aucun développement n'a lieu en dessous de 11°C et au dessus de
38°C (Mourichon, 2003).
I.1.4.2. Période d'incubation
Une
fois l'infection établie, des hyphes de M. fijiensis
émergent des stomates de la surface inférieure des feuilles
et colonisent les stomates. La durée d'incubation la plus rapide en
conditions favorables est de 10 à 14 jours, mais varie
considérablement en fonction des variétés hôtes. La
durée de l'incubation est également fonction des conditions
climatiques (Mourichon, 2003).
I.1.4.3. Conidiophores et conidies
Les
conidies sont des spores fragiles et leur durée de vie ne peut
excéder 2 à 3 semaines tandis que, les ascospores sont plus
adaptées à des périodes de conservation restant toutefois
inférieures à 3 mois. Les conidiophores et les conidies sont
produits du stade 2 jusqu'à l'apparition des premières
nécroses (stade 4). Ils se développent dans des conditions
d'humidité élevée. Les conidies sont
détachées des conidiophores par l'eau principalement
(rosée, pluies) et plus rarement le vent. L'eau est le principal moyen
de dissémination des conidies d'une plante à l'autre (Mourichon,
2003).
I.1.4.4. Périthèces et les ascospores
Selon
Mourichon (2003), les périthèces sont abondants dès les
stades 4 et 5. Leur production est généralement plus importante
sur la face supérieure des feuilles. Les ascospores sont
éjectées des périthèces pendant les périodes
de pluie ou pendant la nuit avant l'aube au moment de la rosée
(alternances périodes sèches / humides). Les conditions de survie
sont mal connues.
I.1.4.6 Capacité d'adaptation
Le
M. fijiensis présente un niveau important de diversité
génétique. Cette diversité est liée à
l'important niveau des recombinaisons que lui confère son mode de
reproduction sexuée très présente dans la nature. Cette
propriété est une caractéristique biologique très
importante, pouvant se traduire par une plasticité de cette
espèce et donc une adaptabilité à différents
environnements (Mourichon, 2003).
I.1.5. Dégâts
La
Maladie des raies noires (MRN) provoque une importante diminution de la surface
photosynthétique par un dessèchement
généralisé du système foliaire. Elle affecte
beaucoup de cultivars résistants à la Cercosporiose jaune ou
Maladie de Sigatoka (MS), tels ceux du sous-groupe des bananiers plantains
(AAB). Dans les cas extrêmes où le cultivar est
très sensible, toutes les feuilles du plant peuvent être
détruites avant que le régime ne mûrisse. Les bananiers
survivent mais les rendements sont très faibles et les régimes
mûrissent prématurément et de façon inégale.
La réduction de la durée de vie verte rend le transport et la
conservation des fruits improbables (Mourichon, 2003).
La MRN
et la MS peuvent entraîner une défoliation sévère,
mais étant donné que M. fijiensis est plus
pathogénique sur une plus grande gamme d'hôtes, la MRN revêt
un caractère de gravité plus important que la MS. Les maladies de
feuilles font mourir les feuilles, réduisent le poids de régimes
et fruits de bananes ; les régimes affectés par le
mûrissement prématuré au champ contiennent des mouches du
fruit qui réduisent davantage leur valeur commerciale (Tshilenge, 2010).
Les pertes de production dues au M. fijiensis peuvent atteindre, dans
certains cas, plus de 50 % (Mourichon et al., 1997).
I.1.6. Stratégies de lutte
Dans
les exploitations bananières, le traitement contre la MRN est fortement
dépendant des fongicides. Leur action est complétée par
quelques pratiques culturales telles que l'élimination des feuilles et
rejets attaqués, le drainage, le contrôle des mauvaises herbes et
la nutrition minérale, visant à réduire les sources
d'inoculation et à éviter la réunion de conditions
favorables au développement de l'agent pathogène (Marín et
Romero, 1992). L'emploi des fongicides systémiques permet de lutter
efficacement contre cette maladie dans les plantations commerciales, mais leurs
effets sur l'environnement restent préoccupants. La solution la plus
appropriée à long terme est certainement la résistance
génétique, surtout pour les petits exploitants qui ne peuvent
avoir accès à une lutte chimique pour des raisons
économiques (Mourichon et al., 1997).
I.2. Aperçu sur les
plantes bio pesticides utilisées
I.2.1. Tephrosia vogelii
Connu sous le nom vernaculaire de Bwalu, mbaka
(kongo), Bubawu (Tshiluba), Tephrosia vogelii est aussi appelé
plante à poissons, appartient à la famille de Fabaceae.
C'est un buisson largement répandu en Afrique tropicale, où il
est utilisé comme plante de jachère afin d'améliorer la
fertilité du sol et de limiter l'érosion (Stoll, 2002). Le
Tephrosia vogelii (figure 8) est un arbuste très
ramifié d'environ 4 m de hauteur. La plante fixe l'azote et n'a pas
besoin d'inoculation préalable (Latham et Konda, 2006).
Cette plante peut être cultivée en haie avec un
espacement de 1 m (Stoll, 2002). On peut le planter directement dans un champ
en utilisant de nouvelles graines (Latham et Konda, 2006).

Figure 8. Images des feuilles de Tephrosia
vogelii
Les feuilles moulues sont utilisées comme
stupéfiant pour le poisson, ainsi le poisson reste comestible. Les
feuilles mortes représentent une bonne source d'azote. En Zambie, on
laisse cet arbre en jachère pendant trois ans ; le rendement des
cultures est alors élevé. Au Malawi, la culture de
Tephrosia en jachère pendant un an a donné un rendement
qui a augmenté de 20%. Après deux ans de jachère, le
rendement a augmenté de 40 % (Latham et Konda, 2006).
Les feuilles contiennent des flavonoïdes qui ont
des effets marqués sur le développement et le comportement des
insectes. Les parties de la plante possédant des
propriétés insecticides sont les feuilles et les racines. Les
teneurs les plus élevées en principes actifs sont observés
dans les feuilles et varient d'une plante à l'autre (Stoll, 2002). Selon
le même auteur, les modes d'action de T. vogelii sont :
anti-appétant, insecticides, acaricides, ovicides, toxiques pour les
poissons ; toxicité par contact et par ingestion.
Les feuilles et les graines sont des insecticides efficaces
contre les aphides, les thrips et les insectes qui perforent la tige du
maïs. (Stoll, 2002).
I.2.2. Zingiber officinale
De son nom usuel Tangawisi (lingala), gingembre
(français), Zingiber officinale est une plante
dressée, herbacée, persistante, appartenant à la famille
de Zingiberaceae. Cette plante peut atteindre 1 m de hauteur et pousse
à partir d'un rhizome (figure 9) Elle est souvent cultivée comme
une plante annuelle et est récoltée 9 à 10 mois
après sa plantation (Latham et Konda, 2006).
Le gingembre est connu en Asie où sa culture est
répandue depuis de milliers d'années. Il s'accommode à un
grand nombre de types de sols. Ses feuilles sont étroites et
linéaires, avec l'extrémité rétrécie et
terminant en pointe. Les fleurs sont jaunes verdâtres avec des parties
pourpre foncées. Le gingembre est planté à partir d'un
morceau de racine fraîche ayant au moins un bourgeon. L'espacement entre
les plantes est de 20 à 30 cm. On le plante à une profondeur de 7
cm. Les nouvelles pousses apparaissent après 10 ou 20 jours. Les
rhizomes sont épais, lobés et de couleur jaune. Les parties de la
plante possédant des propriétés fongicides sont les
rhizomes. Le gingembre est utilisé comme fongicide, insecticide et
nématicide (Stoll, 2002).

Figure 9. Rhizomes de Zingiber officinale
Le plant est mûr quand les feuilles deviennent jaunes.
Les racines fraîches sont sucées ou mâchées pour
calmer la soif. La racine possède également des vertus
aphrodisiaques. Dans d'autres contrées, la racine est principalement
utilisée comme condiment (Latham et Konda, 2006).
CHAPITRE II. MATERIEL ET METHODES
II.1. Matériel
II.1.1. Matériel végétal
Le
matériel végétal utilisé dans cette étude
était constitué d'une part, des échantillons de feuilles
de bananier et plantain présentant les symptômes de la MRN, et
d'autre part, des rhizomes de Z. officinale et des feuilles de T.
vogelii. Les feuilles de bananier plantain ont été
récoltées sur le site de Kinsiona, situé au quartier
Kimwenza dans la commune de Mont-Ngafula. Les feuilles
échantillonnées étaient constituées de 2
dernières feuilles déployées et de la feuille cigare. Sur
les feuilles échantillonnées, les tissus végétaux
ont été récoltés sur les zones situées au
niveau du front d'avancement des symptômes (zone d'attaque du
champignon). Les échantillons ont ensuite été
placés dans des enveloppes type kraft et acheminés au laboratoire
de la Clinique des Plantes de Kinshasa (CPK) pour les analyses.
II.1.2. Matériel de laboratoire
Les matériels de laboratoire utilisés
étaient constitués de milieu de culture PDA (Potato dextro
agar), le microscope, Bi-oculaire, la hotte à flux laminaire,
l'autoclave, l'étuve, la balance de précision, les lames
porte-objet, les lames couvre-objet, les boîtes de Pétri en verre,
les erlenmeyer, une pipette, les scalpels , le bec bunsen, le bleu de
lactophenol, l'alcool éthylique, la streptomycine sulfate, le mortier,
l'eau distillée.
II.2. Méthodes
II.2.1. Identification du Mycosphaerella fijiensis sur les
échantillons récoltés
Sur
les échantillons, l'identification du M. fijiensis a
été rendue possible grâce à la méthode de
scotch suivant les étapes ci-après :
- A
l'aide d'un binoculaire, bien observer la surface du tissus malade ;
-
Poser un morceau de scotch sur l'échantillon, gratter
légèrement et retirer doucement le scotch de manière
à prélever les structures observées à la loupe
binoculaire ;
- Sur
une lame porte-objet, déposer une goutte de bleu lactophenol et
déposer le morceau de scotch contenant les structures
prélevées, puis y rajouter une seconde goutte de bleu lactophenol
et couvrir la solution avec la lame couvre-objet ;
-
Chauffer l'ensemble de la préparation à la flamme et
observer la lame chauffée au microscope ;
-
Fixer l'image du champignon sur un microscope et observer les structures
(conidies et conidiospores) du champignon au moyen des fiches
d'identification CMI (Commonwealth Mycological Institute) et des
compendiums d'identification des agents phytopathogènes.
II.2.2. Isolement de M. fijiensis sur milieu PDA
II.2.2.1. Préparation de milieu de culture pour
isolement
Le milieu de culture pour l'isolement était
préparé avec 9,75g de PDA mélangé à 250 ml
d'eau, dans un erlenmeyer. La solution a été autoclavée
à 125°C pendant 15 minutes et 1,4 bar. Après l'autoclavage,
0,025g de streptomycine ont été dissouts dans 250ml de milieu
préalablement préparé. Le mélange a
été secoué et bien mélanger. Sous hotte à
flux laminaire, le milieu de culture a finalement été
coulé sur des boîtes de Pétri et immédiatement
emballer et placer au frigo, à 4°C pour sa solidification pendant
48 heures. L'ajout de la streptomycine sulfate visait à éviter la
contamination du milieu de culture par des bactéries.
II.2.2.2. Ensemencement de Mycosphaerella fijiensis
Après identification du M.
fijiensis, des fragments de feuilles de 1 cm de diamètre
préalablement nettoyés à l'alcool éthylique puis
rincés à l'eau distillée, ont été
déposés sur milieu de culture PDA dans les boîte de
Pétri. Les boîtes de Pétri contenant le milieu de culture
sur lesquelles l'agent pathogène a été isolé, ont
été placées dans un étuve à 30 °C
pendant une semaine en vue de favoriser la croissance mycélienne.
II.2.3. Purification de souches
Après croissance du champignon, de nouveaux
milieux de culture ont été préparés pour servir au
repiquage. Ce dernier visait à obtenir une culture pure du M.
fijiensis ; il a été réalisé en
prélevant un morceau de culture PDA contenant le mycélium du
champignon et en le déposant dans des nouvelles boites de Pétri
contenant des milieux de culture nouvellement préparés.
II.2.4. Ensemencement du M. fijiensis sur milieu de culture
incorporé de jus de plantes
II.2.4.1. Préparation de milieu
Nous avons utilisé presque la même
procédure détaillée ci-haut mais, cette fois-ci en
utilisant 4 erlenmeyer avec 4,875 g de milieu de culture PDA, 125ml d'eau
distillée, chacun.
II.2.4.2. Extraction et incorporation du jus de plantes
biopesticides dans le milieu de culture PDA
Les jus
de Z. officinale et T. vogelii ont été obtenus
grâce à la méthode d'extraction suivante :
- Nettoyer les rhizomes de
Z. officinale et feuilles de T. vogelii ;
- Eplucher les rhizomes de Z. officinale, puis
prélever 20 g de rhizomes et 20 g de feuilles de T.
vogelii ;
- Broyer séparément les 20 g de rhizomes de Z.
officinale et les 20 g de feuilles de T. vogelii dans
le mortier en porcelaine ;
- Ajouter 100ml d'eau distillée dans le mortier et
extraire le jus en pressant les particules des feuilles et rhizomes
broyés;
- Récolter à l'aide d'une pipette, le jus ainsi
extrait et mettre séparément, dans un tube à essai, le jus
de chacune de plantes et du mélange;
- Les jus des plantes extrait ont été
incorporé dans 125ml de milieu PDA de manière
séparée puis en mélange, suivant les quantités de
0,5ml, 1ml, 2ml et 3ml et coulé dans des boîtes de pétri.
- Les fragments des mycéliums du champignon M.
fijiensis issu de la culture pure ont ensuite été
ensemencés dans le milieu PDA (préparé comme
indiqué précédemment) dans lequel on y avait
incorporé les extraits des plantes (Z. officinale et T.
vogelii).
Pour évaluer l'action fongicide des différents
extraits des plantes à différentes quantités, un
témoin (milieu PDA sans incorporation) avait été
utilisé. Les milieux ensemencés ont été mis en
observation durant une période de 5 semaines.
II.2.5. Paramètres observés et analyses
statistiques
Pour évaluer l'efficacité de deux extraits des
plantes sur la croissance in vitro de Paracercospora
fijiensis phase anamorphe de Mycosphaerella fijiensis, la
croissance radiale à la 1ère , 2ème,
3ème, 4ème et 5ème
semaine après ensemencement a constitué la variable
observée.
La prise des mesures sur la croissance radiale était
effectuée hebdomadairement sur la face inférieure de la
boîte de Pétri, du centre vers la périphérie.
En vue de comparer les différents traitements, les
différentes quantités des traitements utilisées et
apprécier l'effet de chacun d'eux sur la croissance, les
différentes données récoltées sur la croissance
radiale du champignon ont été soumises à l'analyse de la
variance en utilisant le logiciel statistix 8 (Free version). Le test de la
plus petite significative ou the Least Significant Difference (LSD) a servi
à la comparaison des moyennes au seuil de probabilité de 5%.
Excel (office 2007) a servi à la présentation de certains
résultats.
CHAPITRE III. RESULTATS ET DISCUSSION
III.1.1. Identification de Mycosphaerella fijiensis
à partir des feuilles de bananier infectée
Après 5 semaines d'ensemencement, les mycéliums
ont été abondants formant ainsi une colonie noire, du centre vers
la périphérie de la boîte de Pétri. Les observations
microscopiques ont révélé la présence de conidies
et conidiophores de Paracercospora fijiensis phase anamorphe de
Mycosphaerella fijiensis à partir des
échantillons des feuilles infectées et après les
isolements. Les observations sur les morphologies des conidies ont
révélé que la présence des hiles (points
d'insertion) bien marqués sous formes des deux point noires sur une des
ses extrémités (figure 10).

Figure 10. Observation microscopique des conidies de
Paracercospora fijiensis phase anamorphe de M. fijiensis
isolées partir des feuilles de bananier infectées
III.1.2. Effet de l'extrait de Tephrosia
vogelii sur la croissance radiale de Mycosphaerella
fijiensis
La figure 11 rapporte la croissance radiale de M.
fijiensis sur le milieu de culture PDA incorporé d'extrait de
T. vogelii.
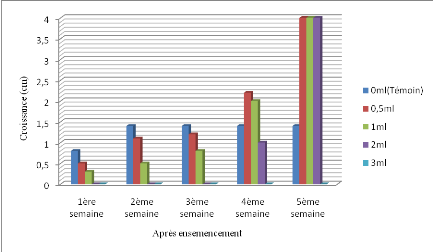
Figure 11. Croissance radiale de Mycosphaerella
fijiensis sur le milieu de culture PDA incorporé de jus de
Tephrosia vogelii
A la lecture de la figure 11, il apparaît qu'une allure
progressive de croissance radiale pour les quantités 0,5ml, 1ml et 2ml
qui tout s'est stabilisé à 4cm de développement à
la 5ème semaine. A la quantité 0,5ml on a noté
une croissance de 0,5cm à la première semaine suivie de
1,1cm ; 1,2cm ; 2,2cm respectivement, à la
2ème, 3ème et à la
4ème semaine. A la quantité 1ml on a noté 0,3cm
à la première semaine suivie de 0,5cm, 0,8cm et 2cm
respectivement, à la 2ème, 3ème et
4ème semaine. Pour la quantité de 2ml, nous avons
enregistré un développement de 1cm à la
4ème semaine qui se stabilise à 4 cm. Tandis
qu'à 3ml la croissance du pathogène était nulle. Alors que
sur le témoin, nous avons enregistré une croissance de 0,8cm
à la première semaine suivie de 1,4cm de la deuxième
jusqu'à la 5ème semaine.
III.1.3. Effet de l'extrait de Zingiber officinale sur
la croissance radiale de Mycosphaerella fijiensis
La figure 12 présente la croissance radiale de
Mycosphaerella fijiensis sur le milieu de culture
incorporé de jus de Zingiber officinale.
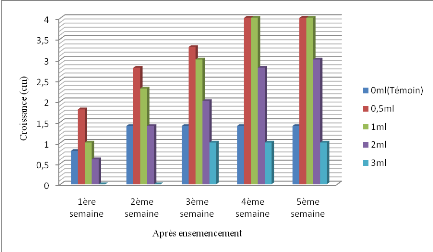
Figure 12. Croissance radiale de Mycosphaerella
fijiensis sur le milieu de culture PDA incorporé de jus de
Zingiber officinale
De l'analyse de cette figure il ressort une croissance
progressive du champignon à toutes les quantités d'extraits
incorporés au milieu PDA. Il a été remarqué un
début de croissance mycélienne dès la première
semaine après ensemencement sur presque toutes les quantités
soit 1,8cm pour la quantité 0,5ml ; 1cm pour 1ml et 0,6cm pour 2ml
y compris le sur le témoin soit 0,8cm. Sauf sur la quantité de
3ml, à laquelle le développement du champignon n'a
été remarqué qu'à la 3ème semaine
avec une croissance de 1cm et s'y stabilise jusqu'à la
5ème semaine. Il est aussi à noter qu'une
stabilité de croissance du champignon a été
remarquée sur le témoin à partir de la
2ième semaine avec 1,2cm et à la quantité de
0,5ml et 1ml à partir de la 4ème semaine
jusqu'à la 5ème semaine avec une taille de 4cm.
III.1.4. Effet de mélange d'extraits de
T.Vogelii et de Z. officinale sur la croissance radiale de Mycosphaerella
fijiensis
La figure 13 ci - après présente la croissance
radiale de Mycosphaerella fijiensis sur le milieu de culture
incorporé de mélange d'extraits de T. vogelii et Z.
officinale.
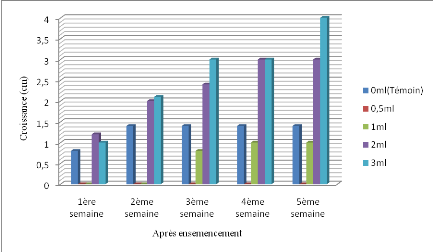
Figure 13. Croissance radiale de Mycosphaerella
fijiensis sur le milieu de culture PDA incorporé de jus de
mélange Tephrosia vogelii et Zingiber
officinale
De l'analyse de la figure 13 ci - haut, il ressort qu'à
la quantité de 0,5ml la croissance du champignon est nulle de la
1ère à la 5ème semaine après
ensemencement suivie de la quantité 1ml du 1ère
à la 2ème semaine. Une croissance progressive du
pathogène aux quantités 2ml et 3ml dès la
1ère semaine avec une croissance respective de 1,2cm et 1cm
et sur le témoin avec une croissance de 0,8cm à la
première semaine suivie de 1,4cm, taille à la quelle la
croissance s'est stabilisée. Donc, une croissance qui tend à
progresser au fur et à mesure que la quantité de jus augmente.
Et, il a lieu de noter une croissance du champignon de 0,8cm à la
quantité 1ml de jus à partir de la 3ème
semaine suivie 1cm à la 4ème et
5ème semaine.
III.1.5. Effets comparatifs des extraits de T. vogelii
et de Z.officinale sur la croissance radiale moyenne de Mycosphaerella
fijiensis.
La figure 14 présente la croissance radiale moyenne de
M. fijiensis sur différentes quantités d'extraits des
plantes à actions biocides de toutes les semaines d'observation
après l'ensemencement.

Fig.14. Croissance radiale de Mycosphaerella fijiensis
sur le milieu PDA incorporé de jus de Z. officinale et de
T. vogelii et de mélange de deux jus
A la lecture de la figure 15, il apparaît que la
croissance radiale moyenne du champignon M. fijiensis dépend de
la quantité d'extraits de plantes utilisées. Avec la
quantité 0.5 ml, nous avons enregistré une croissance radiale de
3.18 cm dans le milieu incorporé de Z. officinale et 1.8 cm
dans le milieu incorporé de T. vogelii et une croissance nulle
dans le milieu incorporé du mélange d'extraits. A la
quantité 1 ml, la croissance radiale du M. fijiensis
était de 2.86 cm chez Z. officinale, suivie de 1.52 cm
chez T. vogelii et 0.56 cm pour le mélange Z. officinale
et T. vogelii. Lorsqu'on incorporait 2 ml de jus, nous avions
noté une croissance radiale de 2.16 cm chez Z. officinale,
2.32 cm pour le mélange Z. officinale et T.
vogelii, et 1 cm chez T. vogelii. L'incorporation de 3
ml d'extrait dans le milieu PDA correspondait une croissance radiale à
2.6 cm pour le mélange Z. officinale et T. vogelii,
et 0.6 cm pour Z. officinale ; alors que chez T.
vogelii la croissance du champignon était nulle.
Chez le témoin qui est le milieu PDA utilisé
sans incorporation, nous avons enregistré une croissance de 1,28 cm du
champignon Mycosphaerella fijiensis.
L'analyse de la figure 14 indique de manière
générale deux tendances. La première tendance renseigne
que, pour les extraits incorporés séparément : plus
la quantité augmente et moins s'observe le développement du
champignon. La seconde tendance indique que, pour le mélange des
extraits de Z. officinale et T. vogelii, plus la
quantité augmente et plus on observe une croissance radiale du
champignon M. fijiensis.
Ces deux tendances peuvent être dues à l'effet
synergique entre les deux extraits qui, en combinaison, ils parviennent
à inhiber la croissance mycélienne de Paracercospora
fijiensis forme anamorphe Mycosphaerella fijiensis,
à une faible quantité. Tandis que, isolés, ils en
parviennent qu'a des quantités élevées.
Il a été observé aussi que le
développement du champignon dans le milieu témoin est moindre en
comparaison aux milieux incorporés des extraits des plantes. Ce constat
peut s'expliquer par le fait qu'en laboratoire, certains parasites perdent leur
pathogénicité lorsqu'ils sont repiqués maintes fois sur un
milieu synthétique (Corbaz, 1990).
Au seuil de probabilité de 5%, l'analyse de la variance
a révélée une différence significative entre les
différents traitements (LSD = 0.63) et entre les différentes
quantités de traitements utilisées (LSD = 0.85). Ce qui montre
que les plantes à action biocide utilisées possèdent une
efficacité in vitro remarquable sur la croissance de
Mycosphaerella fijiensis.
L'hypothèse évoquée sur le fait que
Mycosphaerella fijiensis ne peut également pas se
développer sur des milieux de culture contenant l'extrait de Z.
officinale et T. vogelii, comme d'autres champignons
précités s'est confirmer, au regard des résultats
obtenus.
L'extrait de Tephrosia vogelii paraît
plus efficace, au regard de résultats obtenus, par rapport à
celui de Zingiber officinale sur la croissance de
Mycosphaerella fijiensis. En ce que, nous avons
enregistré la croissance nulle du champignon à la quantité
3ml de l'extrait de Tephrosia vogelii pendant toute la
période d'observation contrairement au Zingiber
officinale où, même en croissance tardive, à
certaines quantités, le champignon s'est quand même
développé (figure 13). En plus, le Tephrosia
vogelii avait dominé même sur la pigmentation du milieu
lors de l'incorporation dans le milieu de culture PDA.
III.1.6. Pigmentation du milieu de culture
ensemencé
Les résultats relatifs à la pigmentation du
milieu de culture ensemencé sont illustrés par le tableau 1.
Tableau 1. Pigmentation du milieu de culture
ensemencé
|
Traitements
|
Pigmentation
|
|
Témoin
|
Blanchâtre
|
|
Z. officinale
|
Jaune
|
|
T. vogelii
|
Brunâtre
|
|
Z. officinale + T. vogelii
|
Brunâtre
|
L'analyse du tableau 1 montre que la pigmentation du milieu de
culture PDA était de coloration blanchâtre pour le témoin
et jaune pour le milieu incorporé d'extrait de Z. officinale.
Les milieux incorporés de T. vogelii et celui incorporé
du mélange Z. officinale + T. vogelii étaient
brunâtre. Cette pigmentation renseigne sur la concentration du produit. A
l'examen de ce résultat le Tephrosia vogelii parait
prédominant, en affectant la coloration du milieu de culture. Ce qui
pourrait expliquer dans une certaine mesure, l'efficacité
observée de Tephrosia vogelii contre le
développement de Paracercospora fijiensis phase anamorphe de
Mycosphaerella fijiensis.
CONCLUSION ET PERSPECTIVES
La présente étude visait à évaluer
l'efficacité des extraits de Z. officinale et T.
vogelii sur la croissance in vitro de M.
fijiensis, agent responsable de la maladie des raies noires du
bananier. La méthodologie utilisée visait d'ensemencer le
champignon M. fijiensis sur un milieu PDA incorporé des
extraits des plantes précitées. Quatre
différentes quantités d'extrait de Z. officinale et
T. vogelii et un témoin (sans incorporation) avaient
été utilisées à cet effet.
Les résultats de cette étude ont
révélée que la croissance du M. fijiensis est
affectée par l'incorporation d'extrait des plantes. En
générale, la croissance radiale du champignon a
présenté deux tendances. La première tendance renseigne
que pour les extraits incorporés séparément, plus la dose
augmente et moins s'observe le développement du champignon. La seconde
tendance indique que pour le mélange des extraits de Z.
officinale et T. vogelii, plus la dose augmente et plus on
observe une croissance radiale du champignon M. fijiensis.
A la lumière de la première tendance
évoquée par les résultats de cette étude, on
retiendra que le Z. officinale et le T. vogelii regorgeaient
une activité fongicide pouvant être exploité dans la lutte
contre le M. fijiensis. L'analyse de la seconde tendance
révélée par nos résultats pourrait s'expliquer par
la neutralisation réciproque ou à la synergie des effets
fongicides par les substances contenues dans les deux plantes
utilisées.
L'hypothèse évoquée sur le fait que
Mycosphaerella fijiensis ne peut également pas se
développer sur des milieux de culture contenant l'extrait de Z.
officinale et T. vogelii, comme d'autres champignons
précités s'est confirmer, au regard des résultats
actuels.
Les résultats de cette étude s'avèrent
intéressants dans la mesure où il met en évidence la
possibilité d'utiliser le Z. officinale et le T.
vogelii dans la protection biologique du bananier contre le M.
fijiensis agent causal de la maladie des raies noires. De ce fait, nous
suggérons d'autres études qui s'attèleront sur
l'efficacité de ces extraits de plantes aux différentes autres
quantités contre le même pathogène, les molécules
actives de ces plantes qui agissent sur le nuisible, les mécanismes
d'action et à la préparation des formulations des produits
à base de ces plantes ainsi que, le mode de leur utilisation en
champ.
Références bibliographiques
1. Aguirre, M.C., Castaño-Zapata J., &
Zuluaga, L.E., 1998. Método rápido de diagnóstico
de Mycosphaerella musicola Leach y M.
fijiensis Morelet, agentes causales de la Sigatoka
amarilla y Sigatoka negra. Agronomía 8
(2) : 26-30pp.
2. Anonyme, 2010a. Étude de cas sur la
Banane - Guide Numéro 1 (French). Nouvelles stratégies à
court et moyen termes pour réduire l'utilisation des pesticides dans les
cultures de bananes.
3. Anonyme, 2010b. Étude de Cas
sur la Banane - Guide Numéro 2 (French). Les cercosporioses des
bananiers (Mycosphaerella spp) : vers une lutte
intégrée.
4. Corbaz, R., 1990. Principe de
phytopathologie et de lute contre les maladies. Presses polytechniques et
universitaires romandes, 284p.
5. Deighton, F.C., 1979. Studies
on Cercospora and allied genera. VII. New
species and redisposition. C.M.I. Mycological paper, 144p.
6. Fouré, E. et Lescot, T., 1998.
Variabilité génétique des Mycosphaerella
inféodé au genre Musa. Mise en évidence de la
présence au Cameroun sur Bananier et plantain d'une
cercosporiose (Mycosphaerella musicola) au
comportement pathogène atypique. Fruits 43: 407-415pp.
7. Fouré, E., 1982. Les
cercosporioses du bananier et leurs traitements. Etudes de la
sensibilité variétale des bananiers et plantains à
Mycosphaerella fijiensis Morelet au Gabon (Maladie des raies noires).
I. Incubation et évolution de la maladie. Fruit 37 : 749-771pp.
8. Gauhl, F., 1994. Epidemiology and ecology
of black Sigatoka (Mycosphaerella fijiensis Morelet) on plantain and
banana in Costa Rica, Central America. PhD. thesis originally presented in
German. INIBAP, Montpellier, France. 120pp.
9. Gauhl, F., C. Pasberg-Gauhl et D.R. Jones.
2000. Black leaf streak. Disease cycle and epidemiology. in
Disease of bananas, Abaca and Enset (D.R. Jones, éd.). 56-62pp,
CABI, Wallingford.
10. Guzmán M., A. Jiménez, R. Vargas et
R. Romero. 2000. Caracterización de cepas de M. fijiensis,
causante de la Sigatoka negra, con menor sensibilidad a funguicidas
triazoles. P. 64 in Reunión ACORBAT 2000. Memorias.
11. Jones, D.R., (ed.) 2000a. Diseases of
Banana, Abacá and Enset. CABI Publishing. Wallingford, Oxon,
UK. 544pp.
12. Lassoudière, A., 2010. L'histoire
du bananier, Ed Quae, 384p.
13. Latham, P. et Konda ku Mbuta, 2006.
Quelques plantes utiles de la province Bas-Congo, République
Démocratique du Congo. Deuxième édition. 330p.
14. Luyeye G., 2010. Etude de
l'efficacité de biofongicide a base de Thitonia
diversifolia et gingembre (Z. officinale) sur l'Alternaria
solani, Agent causal de l'Alternariose de la tomate, travail de fin de
cycle, ISAV/KIMWENZA, (Inédit).
15. Marín, V.D. et C.R. Romero. 1992.
El combate de la Sigatoka negra en banano. Corporación Bananera
Nacional. Costa Rica. Boletín No. 4. 22 p.
16. Mboho, K ., 2007. Contribution a
l'étude des maladies et ravageurs du bananier et bananier plantain en
territoire de Beni - Lubero (cas de Munoli, Maboya, Nzenga et Bingo),
Mémoire, inédit, UCG, Butembo, 61p.
17. Mouliom Pefoura A. et Mourichon X., 1990.
Développement de Mycosphaerella musicola (maladie de
Sigatoka) et M. fijiensis (maladie des raies noires) sur bananiers et
plantains. Etude du cas particulier des productions d'altitude. Fruits 45 :
17-24pp.
18. Mourichon, X. et Fullerton R. A., 1990.
Geographical distribution of the two species Mycosphaerella
musicola Leach (Cercospora musae) and M.
Fijiensis Morelet (Cercospora fijiensis),
respectively agents of Sigatoka and Black leaf streak diseases in Bananas and
plantains. Fruits 45p.
19. Mourichon, X., 2003. Analyse du risque
phytosanitaire. BAN-c2 : Mycosphaerella
fijiensis. CIRAD.
20. Mourichon, X., Carlier J. et Fouré E.,
1997. Les cercosporioses : Maladie des raies noires (cercosporiose
noire), Maladie de Sigatoka (cercosporiose jaune) in Maladie des Musa.
Fiche technique n°8. INIBAP, Parc Scientifique Agropolis 34397 Montpellier
Cedex 5, France, 4 p.
21. Ndungo , V., 2008. Notes du cours
d'amélioration des plantes, 2ème grade,
UCG /Butembo, (inédit).
22. Nyabyenda, P., 2005. Plantes
cultivées en région tropical d'altitude d'Afrique. Presses
agronomiques de Gemboux. 224p.
23. Parnell M., P.J.A. Burt et K. Wilson.
1998. The influence of exposure to ultraviolet radiation in simulated
sunlight on ascospores causing black Sigatoka disease of banana and plantain.
International Journal of Biometeorology 42:22-27pp.
24. Pérez, L., 1996. Manual para el
control integrado de Sigatoka negra (Mycosphaerella fijiensis) y
Sigatoka amarilla (Mycosphaerella musicola Leach ex Mulder) en banano
y plátano. Proyecto TCP/CUB/4454. 27pp.
25. Ploetz, R.C. et K.G. Pegg. 2000.
Fusarium wilt. 143-159pp, in Diseases of Banana, Abaca and
Ensete (D.R. Jones, éd.). CABI Publishing. Wallingford, UK.
26. Rhodes, P.L., 1964. A new banana disease
in Fidji. Commonow. Phytopath. News 10 :
38-4 1pp.
27. Romero, R. 2000. Podemos evitar o
disminuir el riesgo de desarrollo de resistencia a los funguicidas en las
poblaciones de M. fijiensis. in Reunión ACORBAT 2000.
Memorias. Mesa redonda Sigatoka negra.118p.
28. Sanchez Rodriguez R., J.A. Pino Algora, C. Vallin
Plous, M.E. Pérez Rodriguez, Y. Iznaga Sosa et F. Malpartida Romero.
2002. Action du fongicide naturel F20 contre la Cercosporiose noire
(Mycosphaerella fijiensis Morelet) chez le bananier plantain (AAB) et
le bananier (AAA). INFOMUSA 11(1):14-16.
29. Sebasigari, K. et Stover, R.H., 1988.
Banana Diseases and Pests in East Africa: Report of a survey in November 1987.
INIBAP, 15p.
30. Sivirihauma, V., 2008. Notes du
cours d'Agriculture Spéciale, 2ème graduat,
UCG/Butembo (inédit).
31. Stierle, A., R. Upadhyay, J. Hershenhorn, G.
Strobel et G. Molina. 1991. The phytotoxins of Mycosphaerella
fijiensis, the causative agent of black Sigatoka disease of bananas and
plantains. Experientia 47:853-858.
32. Stoll, G., 2000. Protection naturelle des
végétaux en zones tropicales. Margraf Verlag. 376 p.
33. Stoll, G., 2002. Protection naturelle des
végétaux en zones tropicales. Honberg. 372 p.
34. Stover, R., 1984. Las manchas producidas
por las Sigatokas en hojas de bananos y plátanos. Curso
internacional de reconocimiento, diagnostico y control de Sigatoka negra del
plátano y banano. 14-18 mai, Tulenapa, Colombie. 15pp.
35. Swennen, R. et Vuylsteke, D., 2001.
Bananier. In: RAEMARKERS, H.R (éd.). Agriculture en Afrique tropicale.
Direction Générale à la Coopération Internationale
(DGCI), Bruxelles.
36. Teycheney, P.Y., Lockhart, B.E.L., Acina, I. et
Candresse, T., 2007. Detection of Banana mild manioc virus and Banana
virus x by polyvalent degenerate olizonucleotide RT-PCP
(PDO-RT-PCP). Journal of biological Methods. 142p:41-49pp.
37. Tshilenge, P., 2010. Notes de cours de
phytopathologie spéciale, Ièr grade, Faculté des Sciences
Agronomiques, Université de Kinshasa, (Inédit).
Annexes
Evolution comparative de la croissance radiale de
Mycosphaerella fijiensis sur le milieu de culture PDA, Zingiber
officinale, Tephrosia vogelii et mélange (Zingiber
officinale et Tephrosia vogelii)
Durée d'observation : 5 semaines
|
Croissance radiale (cm)
|
|
|
Traitements
|
Doses
(ml)
|
1ère Sem
|
2ème Sem
|
3ème Sem
|
4ème Sem
|
5ème Sem
|
Somme
|
Moyenne
|
|
PDA
|
0
|
0,8
|
1,4
|
1,4
|
1,4
|
1,4
|
6,4
|
1,28
|
|
PDA+
Zingiber
officinale
|
0,5
|
1,8
|
2,8
|
3,3
|
4
|
4
|
15,9
|
3,18
|
|
1
|
1
|
2,3
|
3
|
4
|
4
|
14,3
|
2,86
|
|
2
|
0,6
|
1, 4
|
2
|
2,8
|
3
|
10,8
|
2,16
|
|
3
|
0
|
0
|
1
|
1
|
1
|
3
|
0,6
|
|
PDA+
Tephrosia
vogelii
|
0,5
|
0,5
|
1,1
|
1,2
|
2,2
|
4
|
9
|
1,8
|
|
1
|
0,3
|
0,5
|
0,8
|
2
|
4
|
7,6
|
1,52
|
|
2
|
0
|
0
|
0
|
1
|
4
|
5
|
1
|
|
3
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
|
PDA+ mélange (Z. et T.)
|
0,5
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
|
1
|
0
|
0
|
0,8
|
1
|
1
|
2,8
|
0,56
|
|
2
|
1,2
|
2
|
2,4
|
3
|
3
|
11,6
|
2,32
|
|
3
|
1
|
2,1
|
3
|
3
|
4
|
13,1
|
2,62
|
| 


