SOMMAIRE
Introduction
Générale...............................................................................01
CHAPITRE I : Microflore intestinale et
probiotiques
I.1. La microflore intestinale
saine .................................................................02
I.1.1. Composition de la microflore
intestinale humaine ..................................02
I.1.2. Fonctions de la microflore colique
...................................................03
I.2. Les probiotiques
...................................................................................04
I.2.1 Définition des
probiotiques................................................................04
I.2.2. Propriétés et critères de
sélection des probiotiques ..................................04
I.2.3. Types de micro-organismes probiotiques
.............................................05
I.2.4. Pharmacologie des probiotiques
.........................................................06
I.2.4.1. Principes
actifs........................................................................07
I.2.4.2. Pharmacocinétique des
probiotiques...............................................07
I.2.4.3. Mécanismes d'action des probiotiques
...........................................10
CHAPITRE II : Effets biologiques des probiotiques
chez l'homme
II.1. Vertus thérapeutiques des probiotiques en
santé
humaine ...............................12
II.1.1.
Gastroentérologie.........................................................................12
II.1.1.1. Amélioration de la digestion du
lactose.........................................12
II.1.1.2. Prévention des diarrhées dues à
certaines bactéries ou à certains virus
pathogènes
........................................................................13
II.1.1.3. Infection par Helicobacter pylori et
complications............................14
II.1.1.4. Maladies inflammatoires et troubles
intestinaux................................14
II.1.2. Affections du tractus urogénital
.......................................................15
II.1.2.1. Vaginose
bactérienne...............................................................15
II.1.2.2. Candidose
vaginale.................................................................16
II.1.2.3. Infections
urinaires.................................................................16
II.1.3. Allergies
...................................................................................17
II.1.4. Maladies
cardiovasculaires .............................................................17
II.1.5. Action
anticancérigène .................................................................18
CHAPITRE III : Hyperlipidémie et
probiotiques
III.1. Définition et caractéristiques
d'hyperlipidémie ..........................................19
III.1.1.
Hypercholestérolémie ...................................................................19
III.1.2.
Hypertriglycéridémie....................................................................20
III.2.
Physiopathologie.................................................................................21
III.2.1. Pathogénie des
hyperlipidémies ......................................................21
III.2.2.
Classification .............................................................................21
III.2.2.1. Les hyperlipidémies
primitives...................................................21
III.2.2.2. Les hyperlipidémies
secondaires.................................................22
III.3. Stratégies
thérapeutiques ....................................................................22
III.3.1. Régime
diététique .......................................................................22
III.3.2. Traitement à base de
probiotiques ....................................................23
III.3.3. Traitement médicamenteux
...........................................................24
Conclusion
générale..................................................................................25
Références Bibliographiques
TABLE DES ILLUSTRATIONS
Liste des tableaux
Tableau 1 : Proposition de
critères de sélection des probiotiques à application
intestinale...05
Tableau 2 : Principales souches probiotiques
commercialisées en Europe .....................06
Tableau 3 : Pourcentage de
récupération de probiotiques vivants dans les selles
.............08
Tableau 4 : Les
différents types de
lipoprotéines....................................................................20
Tableau 5 : Classification
des hyperlipidémies primitives selon De
Genne...........................21
Tableau 6 : Les
hyperlipidémies
secondaires..........................................................................22
Tableau 7 : Les principaux
classes
d'hypolipémiants.............................................................24
Liste des figures
Figure 1 : L'appareil digestif de
l'homme et leur microflore intestinale...............................03
Figure 2 : Approche pharmacologique des
effets des probiotiques..................................07
Figure 3 : Structure d'une
lipoprotéine..................................................................................19
INTRODUCTION GENERALE
S'alimenter est essentiel pour la croissance et la survie des
êtres vivants. Cependant, il existe des nutriments qui, bien que
contribuant comme source d'énergie ou apport de molécules de
base, contiennent également des composants additionnels qui
améliorent la résistance aux maladies et participent par leurs
propriétés à l'état de la santé
générale des individus (Cuibai, 2008).
L'idée d'administrer de nouveaux micro-organismes afin
de moduler la flore endogène ou d'utiliser leurs
propriétés métaboliques a conduit au concept de
probiotiques. Ceci conduit au développement de nombreux
médicaments probiotiques dans les années 1950-60;
néanmoins l'incertitude sur la capacité de tels micro-organismes
de survivre à leur passage dans l'estomac, et l'absence de
données rigoureuses sur l'efficacité clinique de beaucoup de
produits, avaient conduit à leur disparition progressive grâce
à de nombreux travaux rigoureux et une approche pharmacologique
(Marteau et Rambaud, 1998).
L'objectif commun des études est de définir les
propriétés des probiotiques, leur sécurité et leurs
applications dans l'alimentation et dans le domaine clinique, ainsi, notre
présente étude se penche sur la vérification de
l'efficacité des probiotiques dans l'une des manifestations
pathologiques qui est l'hyperlipidémie. En d'autre terme dans quelle
mesure les probiotiques, peuvent être utilisés comme des
hypolipémiants chez l'animal ou l'être humain?.
La présente synthèse bibliographique s'articule
autours de trois principaux chapitres ; dont le premier présente la
relation entre la microflore intestinale et les souches probiotiques on tenons
compte de leur pharmacocinétique, qui sera suivi immédiatement
par un deuxième chapitre qui aborde les effets
bénéfiques montrés au niveau sanitaire et on finira par un
dernier chapitre qui mit le point sur le concept probiotique en faveur d'une
hyperlipémie, qui sera strictement réservée à
notre expérimentation.
CHAPITRE I :
Microflore intestinale et probiotiques
I.1. La microflore intestinale saine :
I.1.1. Composition de la microflore intestinale humaine
:
L'existence d'une flore associée à l'intestin
est connue depuis plus d'un siècle, elle est évaluée
à près de 1013 à 1014 cellules,
représentant 400 à 500 espèces et sous-espèces.
C'est environ 10 fois le nombre total de cellules du corps humain. Le tube
digestif du nouveau-né, stérile à la naissance, est
colonisé en moins de 48 heures par des milliards de bactéries
capables de le coloniser (Moreau, 2005).
La microflore normale est définie par la
présence constante de certaines espèces dans l'intestin. Chez un
individu donné, il existe également des variations quantitatives
et qualitatives en fonction de la région intestinale. En effet, les
populations bactériennes présentes dans la lumière du tube
digestif augmentent progressivement de l'estomac jusqu'aux selles (figure
1) (Ait-Belgnaoui, 2006).
L'estomac contient toujours une flore plus faible lorsque le
pH est acide chez l'homme, en fait, seul les micro-organismes à Gram
positif aérobies ou anaérobies facultatives
acidotolérantes sont capables d'y survivre. Cependant, des
bactéries anaérobies strictes résistantes à
l'acidité gastrique peuvent s'y implanter, c'est notamment le cas d'
Helicobacter pylori capable de se loger dans la sous-couche du mucus
(Moreau, 2005).
A l'inverse, l'intestin grêle n'est pas un organe
où les bactéries peuvent se multiplier chez un sujet sain. Il
constitue une région de transite, mais il est possible de rencontrer des
bactéries appartenants aux genres Lactobacillus,
Streptococcus, et à quelques espèces de la famille des
enterobacteriaceæ à des concentrations faibles jusqu'à
l'iléon où elles apparaissent à coté des
espèces anaérobies à Gram négatif appartenant au
genre Bacteroides (Ait-Belgnaoui, 2006).
Cependant, dans le côlon, il faut distinguer 4 types de
flores. La flore dominante qui est la plus nombreuse se localise
essentiellement au niveau du côlon où le taux de colonisation
de
chacun des groupes bactériens qui la compose atteint
109 à 1011 germes/ gr ou ml de contenu
intraluminale avec très peu de variations
inter-individuelles, elle est composée essentiellement de germes
anaérobies, et les principales familles représentants cette flore
sont celles des Bifidobactéries et des
lactobacilles. Par contre, la flore sous dominante se localise au
niveau du côlon à des taux inférieurs à ceux des
germes de la flore dominante soit 106 à 108 germes
/ gr ou ml de contenu intraluminal, elle est composée de germes
aéro-anaérobies facultatifs (Entérobactéries,
Streptocoques). En outre, la flore fécale qui est
facilement accessible pour l'analyse, elle renferme de nombreuses
espèces mortes et n'est pas représentative des différentes
niches écologiques de l'écosystème microbien digestif
(Drasar et Barrow, 1985).


Figure 1. L'appareil digestif de l'homme et sa
microflore intestinale
(Balfour Sartor, 2008).
I.1.2. Fonctions de la microflore colique :
La relative stabilité de l'écosystème
intestinal suggère la présence de mécanismes de
régulation et de défense propres à l'hôte ou
à la microflore résidente. Ainsi, il apparaît que
l'utilisation de modèles animaux axéniques (animaux
inoculés avec des souches bactériennes connues) a permis de
réaliser des progrès considérables dans l'étude des
fonctions de la flore intestinale (Raibaud et
al., 1980).
L'une des fonctions importantes exercées par la flore
intestinale est la maturation et la stimulation du système immunitaire
de l'hôte. Le système immunitaire local associé à la
muqueuse digestive ainsi que le système immunitaire
général sont fortement stimulés ou parfois inhibés,
par certaines bactéries de la flore du tube digestif. En fait, plusieurs
études ont montré que la flore intestinale stimule
l'activité phagocytaire, la sécrétion des cytokines par
les macrophages, ou la stimulation des lymphocytes
intraépithéliaux (Ait-Belgnaoui,
2006).
De même, il est connu qu'elle joue d'autres fonctions
métaboliques citons la production d'acides gras à courte
chaîne, de vitamines (vitamine K, B12), ainsi la dégradation des
hydrates de carbone non absorbés aboutissant à la production
d'acides organiques assimilables par l'hôte et de gaz. De plus elle
hydrolyse les lipides alimentaires non absorbés grâce aux lipases
bactériennes (Drasar et Barrow, 1985).
I.2. Les probiotiques :
I.2.1. Définition des probiotiques :
Le terme «probiotique» est un mot relativement
nouveau qui signifie «en faveur de la vie» et qui
est actuellement utilisé pour désigner des bactéries
associées à des effets bénéfiques chez l'homme et
les animaux (FAO/OMS, 2001).
La Food and Agriculture Organization des Nations unies (FAO)
et l'organisation mondiale de la santé (OMS) ont établi
récemment des lignes directrices pour l'utilisation du terme
« probiotique » dans les aliments (FAO/OMS 2002)
et formulé la définition :
« micro-organismes vivants qui, lorsqu'ils sont
administrés en quantités adéquates, exercent une action
bénéfique sur la santé de l'hôte qui les
ingére » (Marteau et Seksik, 2005).
I.2.2. Propriétés et critères de
sélection des probiotiques:
Afin de satisfaire à la définition des
probiotiques, les micro-organismes doivent survivre, persister temporairement
dans le tractus digestif et montrer une activité qui doit se traduire
par des effets positifs pour l'hôte. Or, toutes ces
propriétés sont propres à chaque souche et ne peuvent
être extrapolées à une autre souche de la même
espèce. Les micro-organismes potentiellement probiotiques doivent donc
être sélectionnés selon différents critères
décrits dans le tableau 1 (Izquierdo,
2009).
Tableau 1. Proposition de critères de
sélection des probiotiques à application intestinale (Rousseau,
2004).
|
CRITERES DE
SECURITE
|
§ souche pour l'usage humain d'origine humaine
(isolée du tractus intestinal d'un homme sain) ou alimentaire
(utilisée dans les produits fermentés).
§ souche déposée dans une collection de
cultures reconnue internationalement.
§ souche caractérisée par des techniques
phénotypiques et génotypiques.
§ historique de non pathogénicité.
§ pas de déconjugaison excessive des sels biliaires
au risque d'induire des lyses cellulaires.
§ pas de transmission possible de gènes de
résistance aux antibiotiques.
§ pas de dégradation excessive du mucus.
|
|
CRITERES FONCTIONNELS
|
§ tolérance à l'acidité et aux enzymes
gastriques.
§ tolérance à la bile et aux enzymes
digestives.
§ adhésion aux cellules intestinales et persistance
dans le tractus gastrointestinal.
§ Immunostimulation.
§ production de substances antimicrobiennes et antagonisme
vis-à-vis des pathogènes.
§ effets sur la santé documentés.
|
|
CRITERES TECHNOLOGIQUES
|
§ stabilité au cours des procédés de
production et dans le produit fini.
§ conservation des propriétés probiotiques
après production.
|
Le nombre de cellules viables recommandée est de
109 à 1010 bactéries afin d'avoir en
général 108 à 109 bactéries
vivantes accédant au duodénum et capables d'exercer leurs effets.
L'apport de probiotiques doit être régulier, car des études
ont montré qu'ils disparaissent du tractus au bout de 1 à 2
semaines après arrêt de l'administration. En effet, quand
Lactobacillus rhamnosus GG a été donné à
76 volontaires sous différentes formes (poudre lyophilisée ou
produit fermenté) à raison de 5.1010 à
5.1011 cellules par jour pendant 28 jours, la souche a
été retrouvée dans les fécès dès les
premiers jours. Mais après l'arrêt de l'administration, elle a
disparu des fécès chez 10 % des patients au bout de 4 jours et
chez 70 % au bout de 7 jours (Rousseau, 2004).
I.2.3. Types de micro-organismes probiotiques :
Les principaux micro-organismes probiotiques connus à
ce jour sont des bactéries (lactobacilles, bifidobactéries,
propionibactéries, Escherichia coli et entérocoques), et
des levures (Saccharomyces boulardii), présentes ou non dans la
microflore intestinale résidente. Les bifidobactéries sont
utilisées commercialement moins que les lactobacilles. La souche la plus
étudiée est Bifidobacterium animalis lactis Bb12
(tableau 2) (Cuibai, 2008).
Tableau 2. Principales souches probiotiques
commercialisées en Europe
(Izquierdo, 2009).
|
Espèces de
lactobacilles
|
Firme
|
Autres bactéries lactiques
|
Firme
|
|
Lb. acidophilus La5
Lb. acidophilus NCFM
Lb. bulgaricus 2038
Lb. casei CRL431
Lb. casei DN114001
Lb. casei Shirota
Lb. johnsonii La1
Lb. plantarum 299v
Lb. reuteri
Lb. rhamnosus GG
|
Chr Hansen
Rhodia
Meiji Milk
Chr Hansen
Danone
Yakult
Nestlé
ProViva
BioGaia
Valio
|
Streptococcus thermophilus 1131
Enterococcus faecium SF68
|
Meiji Milk
Cernelle
|
|
Espèces de
bifidobactéries
|
Firme
|
Autres microorganismes
|
Firme
|
|
Bf. breve Yakult
Bf. lactis Bb12
Bf. longum BB536
Bf. animalis N173010
|
Yakult
Chr Hansen
Morinaga
Danone
|
Sc. boulardii
Ultra-levure®
|
Biocodex
|
I.2.4. Pharmacologie des probiotiques :
Le mode d'action des probiotiques est de mieux en mieux
compris grâce à une approche pharmacologique (Marteau et
Seksik, 2005). Les probiotiques peuvent être
considérés comme un moyen de véhiculer des principes
actifs qu'ils contiennent jusqu'à leurs cibles d'action dans le tractus
digestif (Marteau et Rambaud, 1998). Ils peuvent avoir des
effets soit directs soit indirects en agissant via des modifications de
l'immunité et de la flore. En effet Ils agissent en particulier en
inhibant les bactéries indésirables, en neutralisant les produits
toxiques, en améliorant la digestibilité de la ration alimentaire
et en stimulant l'immunité. Ils sont également une source de
vitamines (essentiellement du groupe B), et des sels minéraux
assimilables (Robin et Rouchy, 2001).
Leur étude pharmacologique a trois objectifs :
identifier les constituants actifs des micro-organismes en transit,
décrire leur pharmacocinétique jusqu'aux cibles (survie,
capacité d'adhésion et de colonisation, devenir des principes
actifs) et démontrer les effets spécifiques
bénéfiques ou néfastes (figure 2)
(Marteau et Rambaud, 1998).

Figure 2. Approche pharmacologique des effets des
probiotiques dans le tractus digestif (Marteau et Rambaud, 1998).
I.2.4.1. Principes actifs :
Les principes actifs des probiotiques ne sont pas les
mêmes pour tous les effets. Certains sont bien établis, notamment
des enzymes qui peuvent être actives dans l'intestin (ex. : la
lactase des bactéries lactiques). Certains autres sont reconnus par le
système immunitaire ; ils incluent des peptides formylés,
des lipo-polysaccharides, des peptidoglycanes composants de la paroi cellulaire
et des nucléotides, notamment l'ADN dinucléotide cytosine
phosphoryl choline (CpG). Certains principes actifs peuvent être
naturellement présents dans des probiotiques et d'autres peuvent y
être introduits par des techniques de génie
génétique (Marteau et Seksik, 2005).
I.2.4.2. Pharmacocinétique des
probiotiques :
a. Survie :
Dans la mesure où on ignore souvent la nature exacte
des principes actifs, c'est le plus souvent la capacité du
micro-organisme à survivre aux différents étages du tube
digestif qui est étudiée (tableau 3)
(Marteau et Rambaud, 1998).
Les concentrations de probiotiques parvenant vivants dans
l'intestin dépendent de leur résistance intrinsèque, de
facteurs liés à l'hôte et du vecteur alimentaire ou
galénique dans ou avec lequel ils sont ingérés
(Marteau et Seksik, 2005). Plusieurs études ont
montré que certains probiotiques sont détruits dès leur
passage dans l'estomac par l'acide gastrique et par la bile, alors que d'autres
traversent l'intestin grêle et parfois le côlon à hautes
concentrations (Roy, 2006).
La survie des probiotiques ingérée à
différents niveaux du tractus gastro-intestinal diffère entre les
souches. Elle peut être mesuré in vivo en utilisant des
techniques de collection fécale et d'intubation intestinale, ou
identification de la souche sur des biopsies mucosales. En effet, tout les
modèles in vitro peut aider à prédire le destin
des souches ingérées (Marteau, 2001).
Tableau 3. Pourcentage de récupération de
probiotiques vivants dans les selles après leur ingestion (Marteau et
Rambaud, 1998).
|
Probiotiques
|
% de survie*
|
Référence
|
|
Bifidobactérium sp.
Lb. plantarum souche NCIB 8826
Lb. acidophilus
Lb. rhamnosus souche GG
- gastroprotégé
- lait fermenté
- capsules
Lb. salivarius souche UCC118
Lactococcus lactis TC 165.5
Sc. boulardii
Lb. reuteri capsules
|
30
25
2-5
1-5
1
1
2
0,2
0,1-2
0,36
0,01
|
Gastroenterology 1992 ; 102 : 875-8
Résultat personnel
J Dairy Sci 1978 ; 61 :1-10
Dig Dis Sci 1992 ; 37 : 121-8
Microb Ecol Health Dis 1993 ; 6 : 119-22
Microb Ecol Health Dis 1993 ; 6 : 119-22
Int J Food Microb 1995 ; 25 :199-203
Résultat personnel
Appl Environ Microbiol 1995 ; 61 :2771-6
Biopharm Drug Disp 1989 ; 10 : 353-64
Microb Ecol Health Dis 1995 ; 8 : 41-50
|
* résultat calculé
à partir d'un poids de selles théorique de 150 g/jour.
La récupération fécale des
bactéries semble être directement proportionnelle à la dose
administrée. La persistance dans les fèces semble dépendre
du nombre de doses de bactéries administrées plutôt que du
nombre de bactéries dans une dose. Des survies significatives bien que
plus faibles atteignant des concentrations de 106 Unité
Formant Colonies par gramme (UFC/g) ont été observées avec
des Lb. acidophilus, Lb. reuteri et Lb. rhamnosus
particulièrement la souche GG (Marteau et Seksik,
2005).
b. Capacité d'adhésion :
Aujourd'hui, la capacité des souches à
adhérer à la muqueuse intestinale est l'un des principaux
critères de sélection, ainsi, selon plusieurs études
pharmacocinétiques cliniques, il semble que la culture probiotique doit
être continuellement ingérée pour qu'un effet probiotique
exogène continu soit obtenu (Izquierdo, 2009).
Certains probiotiques ont une capacité
d'adhérence à l'épithélium digestif, ce qui peut
être étudié in vitro avec des lignées
cellulaires telles que CaCO2 (une lignée cellulaire humaine
d'origine intestinale), et/ou au mucus intestinal. Cette
propriété pourrait constituer un avantage écologique
favorisant les chances d'interrelations étroites avec
l'épithélium entérocytaire et le système
immunitaire local (Marteau et Rambaud, 1998). Par
conséquent, les méthodes d'études in vivo sont
difficiles à étudier, puisque cela nécessite des biopsies
de l'intestin ou des méthodes de marquage des souches probiotiques
permettant d'évaluer leur installation dans la muqueuse intestinale
(Izquierdo, 2009).
c. Colonisation :
La colonisation est définie comme la possibilité
du probiotique de persister dans une niche d'écosystème pour une
période plus longue que celle qu'un marqueur inerte ingéré
au même moment (Marteau et Seksik, 2005).
La possibilité d'une colonisation durable de
l'écosystème digestif par un probiotique était
jusqu'à peu considérée comme impossible en raison d'un
grand déséquilibre de force en faveur de
l'écosystème endogène. La majorité des travaux a
confirmé ce concept. Néanmoins, deux études ont
montré que des souches adhérentes de Lb. plantarum et
Lb. rhamnosus pouvaient coloniser de manière prolongée
la muqueuse jéjunale et/ou rectale chez quelques sujets (Marteau
et Rambaud, 1998). Les probiotiques pourraient agir en limitant
l'implantation des germes pathogènes par compétition au niveau
des sites de fixations pour la colonisation (Robin et Rouchy,
2001).
d. Pouvoir d'inhibition :
Les lactobacilles et les bifidobactéries ne sont pas
connus pour produire des antibiotiques. La plupart, sinon toutes les
bactéries, sont capables de produire des molécules qui peuvent
être inhibitrices pour elles-mêmes et/ou pour d'autres
bactéries. Les substances à effet bactéricide produites
par les bactéries sont variées et comprennent le peroxyde
d'hydrogène,
l'acide lactique, les acides organiques et les
bactériocines. Il serait le plus souhaitable, pour le futur, de mettre
sur pied une fiche technique exhaustive énumérant les souches
cibles de chaque bactériocine connue (Roy, 2006).
I.2.4.3. Mécanismes d'action des
probiotiques :
Les mécanismes d'action des probiotiques
impliqués dans les effets bénéfiques exercés par
ces bactéries sur l'hôte sont complexes, souvent multiples et
dépendent de la souche bactérienne considérée. Les
effets des probiotiques sont classiquement attribués à une
modulation directe (du chyme, la flore, ou la muqueuse intestinale) ou
indirecte de la flore endogène ou du système immunitaire local.
Ceci suggère qu'un contact direct de ces probiotiques avec les
différents constituants de la barrière intestinale, tels que la
microflore endogène, le mucus intestinal, les cellules
épithéliales, les immunocytes, est nécessaire
(Ait-Belgnaoui, 2006).
a. Effets directs :
Les effets directs des probiotiques dans la lumière
intestinale ou la paroi sont les plus faciles à étudier et
prédire. L'utilisation des bactéries lactiques
génétiquement modifiées contenant des épitopes
vaccinaux afin de les libérer dans l'intestin, fait l'objet de plusieurs
travaux par les chercheurs. En effet, Les auteurs ont montré que
l'administration orale de Lactococcus lactis
génétiquement modifié pour secréter de l'
interleukine 10 (IL-10), améliorait des colites expérimentales
induites chez l'animal par le dextran-sulfate ou l'invalidation du gène
de l'IL-10 ; une étude humaine est en cours aux Pays-Bas. Ainsi,
plusieurs probiotiques et particulièrement Sc. boulardii ont
des effets directs sur la muqueuse intestinale (Marteau et Seksik,
2005).
b. Effets sur la flore endogène et
indirects par son intermédiaire :
Les effets des probiotiques sur la composition de la flore
endogène sont paradoxalement assez mal connus si l'on excepte la survie
du probiotique lui-même. Il a été montré que
l'ingestion de certaines souches de lactobacilles ou de bifidobactéries
pouvaient modifier de manière reproductible certaines activités
enzymatiques bactériennes fécales, telles que la
ß-glucuronidase, l'azoréductase ou la nitroréductase. Les
tentatives de modulation de la production d'acides gras à courte
chaîne ou du pH intracolique par des probiotiques, sont en revanche
jusqu'ici restées infructueuses (Marteau et Seksik,
2005).
c. Effets sur la barrière muqueuse et
immunologique et effets indirects par cet
intermédiaire :
De nombreuses études réalisées chez
l'animal, ont montré que l'administration orale de divers probiotiques
pouvait moduler la barrière immunitaire muqueuse et/ou
systémique. Les travaux pionniers ont montré que l'ingestion de
très fortes quantités de bactéries du yaourt augmentait la
capacité des lymphocytes du sang circulant à
sécréter diverses cytokines, notamment
l'interféron-ã. Les conséquences cliniques de cet effet
biologique sont douteuses (Marteau et Seksik, 2005).
Plusieurs essais randomisés contrôlés ont
montré que la souche de Lb. rhamnosus GG administrée
à des enfants atteints de gastro-entérite à rotavirus,
augmentait les cellules circulantes capables de sécréter des
immunoglobulines. Au moment de la convalescence, 90% des nourrissons du groupe
recevant le probiotique contre seulement 46% recevant le placebo avaient
développé une réponse anticorps spécifique
immunoglobulines A (IgA) contre les rotavirus. Les mêmes auteurs ont
rapporté que l'immunogénicité d'un vaccin oral
anti-rotavirus pouvait être très discrètement
augmentée par l'administration simultanée de Lb.
rhamnosus GG (Marteau et Rambaud, 1998).
De manière générale, l'hôte
distingue les signaux émis par les micro-organismes grâce à
des récepteurs dits toll-like récepteurs
(TLRs) présents sur les cellules immunitaires et les
cellules épithéliales intestinales. L'ADN bactérien et des
oligo-nucléotides contenant des Cpg non méthylés stimulent
les lymphocytes alors que l'ADN eucaryote et les oligo-nucléotides
méthylés ne le font pas. La stimulation des cellules dendritiques
par l'ADN Cpg est associée à la production de cytokines de type
TH1 (Ait-Belgnaoui, 2006).
Chapitre II :
Effets biologiques des probiotiques chez l'homme
II.1. Vertus thérapeutiques des probiotiques en
santé humaine :
L'évaluation des probiotiques n'échappe pas
à la règle désormais générale dite de
« l'evidence-based medicine » ou de «
médecine fondée sur les preuves » qui exige que toute
affirmation scientifique soit caractérisée par un niveau de
preuves. Beaucoup des allégations concernant les probiotiques il y a une
vingtaine d'années n'étaient pas fondées sur un haut
niveau de preuve aussi ont-elles été rejetées. Elles ont
même conduit à discréditer l'ensemble du sujet scientifique
aux yeux de beaucoup. Néanmoins depuis cette époque et le
développement de l'approche pharmacologique, les essais de bonne
qualité méthodologique se sont multipliés. Ce sont ces
derniers qui sont analysés dans les paragraphes ci-dessous
(Marteau et Seksik, 2005).
II.1.1. Gastroentérologie :
II.1.1.1. Amélioration de la digestion du
lactose :
Le premier effet démontré avec un haut niveau de
preuve a été l'amélioration de l'intolérance au
lactose et de sa malabsorption par des bactéries lactiques et tout
particulièrement celle du yaourt (Marteau et Seksik,
2005).
Chez les personnes souffrant d'intolérance au lactose,
un déclin de la production de la lactase est observé
au-delà de la petite enfance. La deuxième cause
d'intolérance (intolérance secondaire) est
représentée par les maladies, dont la conséquence est une
réduction de la surface de digestion absorption intestinale ou une
accélération du transit jéjunal, comme les
résections intestinales, les gastro-entérites, la maladie
coeliaque ou les gastrectomies (Izquierdo, 2009).
Les premiers essais ont montré que les sujets
intolérants au lactose toléraient le plus souvent le yaourt qui
pourtant contient bien du lactose. En pratique clinique, le remplacement du
lait par du yaourt conduit à une meilleure absorption et une meilleure
tolérance chez les sujets présentant une intolérance
primaire au lactose (due au déclin physiologique de la lactase avec
l'âge), mais aussi en présence d'intolérance secondaire
à des entéropathies comme au cours de diarrhées
persistantes ou après résection intestinale étendue
(Marteau et Rambaud, 1998).
Plusieurs travaux explicatifs ont montré que la lactase
de bactéries lactiques participait à la digestion du lactose dans
l'intestin. Un travail quantitatif a montré que les sujets
déficients en lactase digéraient (et absorbaient) 90% du lactose
contenu dans 400 g de yaourt et qu'environ un cinquième de la
quantité de lactase présente dans le yaourt parvenait encore
active jusqu'à la toute fin de l'intestin grêle après un
repas (Marteau et Seksik, 2005).
De plus, de nombreuses études ont montré que la
lactase véhiculée par certaines bactéries lactiques,
notamment celle du yaourt dont la membrane est facilement lysée par les
acides biliaires, participait dans l'intestin à la digestion du lactose,
ce qui permet d'expliquer l'excellente digestion du lactose du yaourt (90 %)
chez les sujets déficients en lactase (Marteau et
al., 1990).
II.1.1.2. Prévention des diarrhées dues
à certaines bactéries ou à certains virus
pathogènes :
La diarrhée d'origine infectieuse est un grave
problème sanitaire mondial, responsable chaque année de la mort
de plusieurs millions de personnes. Si la majorité des
décès se produit parmi les enfants des pays en
développement, on estime que jusqu'à 30% de la population
même dans les pays développés souffre chaque année
de diarrhée d'origine nutritionnelle. Les probiotiques pourraient
constituer un important moyen de réduire ces problèmes
(Azizpour, 2009).
L'effet bénéfique de probiotiques a parfaitement
été démontré à l'aide de Lb. rhamnosus
GG et Bifidobacterium lactis BB-12 pour la prévention et
avec le traitement de la diarrhée aiguë causée
principalement par des rotavirus chez les enfants. Cependant, Il y a de bonnes
preuves in vitro que certaines souches probiotiques peuvent inhiber la
croissance et l'adhérence d'une gamme d'entéropathogènes,
et des études sur les animaux ont indiqué des effets
bénéfiques contre des agents pathogènes tels que
Salmonella. Il ressort de certaines études de la
diarrhée du voyageur, où l'on suppose que certains des agents
pathogènes responsables sont de nature bactérienne, que les
effets bénéfiques peuvent augmenter avec l'administration de
probiotiques (Marteau et Rambaud, 1998).
Un problème grave associé au traitement
antibiotique est l'apparition de la diarrhée, souvent causée par
Clostridium difficile (C. difficile). La raison d'utiliser
des probiotiques est donc que chez ces patients, l'administration de
micro-organismes commensaux exogènes (c'est-à-dire de
probiotiques) est nécessaire pour ramener la microflore à un
état qui reflète le plus fidèlement la flore normale avant
la thérapie antibiotique. Il faut reconnaître que
la preuve d'effets thérapeutiques contre C. difficile, et
d'autres troubles a été obtenue à l'aide de certaines
souches probiotiques, telles que Lb. rhamnosus GG (FAO/OMS,
2001).
Plusieurs études randomisées
contrôlées sur l'homme ont montré l'efficacité des
souches probiotiques pour prévenir ou atténuer les perturbations
digestives liées à la prise d'antibiotiques et les
diarrhées nosocomiales infantiles dues surtout à des rotavirus.
Cependant, ces effets ne sont pas universels et les probiotiques ne semblent
pas être efficaces en toutes circonstances (Izquierdo,
2009).
II.1.1.3. Infection par Helicobacter pylori et
complications :
Concernant les applications des probiotiques, on a
également découvert qu'ils sont actifs contre Helicobacter
pylori, un agent pathogène responsable de la gastrite de type B,
d'ulcères peptiques et du carcinoïde gastrique. Les données
in vitro et sur les animaux indiquent que les bactéries
lactiques peuvent inhiber la croissance des agents pathogènes et
diminuer l'activité des uréases nécessaire pour que
l'agent pathogène reste dans le milieu acide de l'estomac. Les
données concernant l'homme sont limitées, mais il y a des preuves
d'un effet induit par Lb. johnsonii La1 (Azizpour,
2009).
II.1.1.4. Maladies inflammatoires et troubles
intestinaux :
Les maladies intestinales inflammatoires, telles que la
pochite et la maladie de Crohn, ainsi que le syndrôme du colon irritable,
peuvent être causés ou aggravés par des altérations
dans la flore intestinale incluant l'infection (Shanahan,
2000).
De nombreux travaux ont permis de découvrir que
certains micro-organismes de la flore intestinale pouvaient jouer un rôle
délétère pro-inflammatoire au cours des maladies
inflammatoires du tube digestif. Dans une étude, l'ingestion de
Lactobacillus GG entraîne une amélioration notable de
l'état clinique chez des enfants souffrant de la maladie de Crohn. De
même des effets cliniques bénéfiques ont été
observés chez des patients affectés par une colite
ulcéreuse après ingestion de produits fermentés contenant
Lactobacillus GG à1010 bactéries/jour
(Cuibai, 2008). Cependant plusieurs essais randomisés
ont suggéré l'efficacité partielle de certaines souches
probiotiques, d'autres ont été négatives (Marteau
et Seksik, 2005).
II.1.2. Affections du tractus urogénital :
A l'exception des maladies sexuellement transmissibles, la
quasi-totalité des infections du vagin et de la vessie sont dues
à des micro-organismes qui proviennent de l'intestin. Il y a une forte
corrélation entre la présence de commensaux,
particulièrement de lactobacilles dans le vagin, et la santé, et
une absence de ces micro-organismes chez les patients souffrant d'infections
génito-urinaires (Reid et Bruce, 2001).
Le bouleversement de la flore vaginale normale est dû
à des antibiotiques à large spectre, à des spermicides,
à des hormones, a des substances alimentaires et à des facteurs
non encore complètement compris. Quelques éléments
prouvent que les micro-organismes probiotiques ingérés comme
aliments et les préparations topiques ont un rôle dans la
prévention des troubles de l'appareil génito-urinaire
(Azizpour, 2009).
II.1.2.1. Vaginose bactérienne :
La vaginose bactérienne est une maladie
d'étiologie inconnue attribuable au développement excessif de
diverses espèces de bactéries anaérobies et
associée à la disparition des lactobacilles qui dominent
normalement dans le vagin. De nombreuses femmes souffrant de vaginose
bactérienne sont asymptomatiques mais risquent de plus graves
complications telles que l'endométriose, les infections pelviennes et
les complications de l'accouchement, y compris de l'accouchement
prématuré (Reid et al.,
2001).
Certaines preuves cliniques laissent à penser que
l'administration par voie orale ou vaginale de lactobacilles peut
éradiquer la vaginose bactérienne asymptomatique et
symptomatique. On a eu recours à l'administration orale de Lb.
acidophilus et de yogourt dans la prévention et la thérapie
de la candidose vaginale, bien qu'aucune donnée sur son
efficacité n'ait encore été fournie. On a supposé
que les lactobacilles devraient produire du peroxyde d'hydrogène, mais
étant donné que ces micro-organismes sont plus sujets à
être tués par les spermicides, l'association de deux souches ou
plus, dont une produisant du peroxyde d'hydrogène et l'autre
résistant aux spermicides, pourrait être plus
thérapeutique (FAO/OMS, 2001).
II.1.2.2. Candidose vaginale :
La candidose vaginale est une maladie très commune,
souvent accélérée par l'utilisation d'antibiotiques,
l'exposition à des spermicides ou à des changements hormonaux non
encore complètement élucidés. Contrairement à la
vaginose bactérienne et aux infections urinaires, la candidose vaginale
n'est pas nécessairement due à la perte de lactobacilles
(Azizpour, 2009).
Peu de souches de Lactobacillus sont capables
d'inhiber la croissance et l'adhérence de Candida albicans ou
d'autres espèces de Candida, et il n'y a pas de preuves solides
indiquant que l'administration par voie vaginale de lactobacilles puisse
éradiquer l'infection par les levures. Toutefois, il y a lieu de croire
que l'ingestion de lactobacilles et l'emploi vaginal peuvent réduire le
risque de rechutes et de nouvelles études sont justifiées compte
tenu du fait que cette maladie est très répandue et
débilitante (FAO/OMS, 2001).
II.1.2.3. Infections urinaires :
Plusieurs centaines de millions de femmes sont touchées
chaque année par des infections urinaires. L'uropathogène
Escherichia coli qui se développe dans l'intestin est
responsable jusqu'à 85% des cas. La bactériurie asymptomatique
est également commune chez la femme et est parfois suivie d'infections
urinaires symptomatiques (Azizpour, 2009).
Il y a des preuves, y compris des données
randomisées et contrôlées, qui indiquent que des
gélules vaginales de souches de Lactobacillus GR-1 et B-54
lyophilisées appliquées une fois par semaine
préparées avec adjonction de lait écrémé
(Reid et al., 1995) et l'ingestion
une fois par jour par voie orale d'une capsule de souches de Lactobacillus
GR-1 et RC-14 peuvent restaurer une flore vaginale dominée par
les lactobacilles et réduire le risque de réapparition des
infections urinaires (Reid et al.,
2001).
II.1.3. Allergies :
Dans un essai randomisé et contrôlé
à double insu contre placebo, l'administration de Lb. rhamnosus
GG à des femmes enceintes pendant quatre semaines avant
l'accouchement, puis à des nourrissons à haut risque d'allergie
pendant six mois, entraîne une réduction importante de la maladie
atopique précoce. Cette étude illustre le potentiel des
micro-organismes probiotiques de moduler la réponse immunitaire et
d'empêcher l'apparition d'allergies (Kalliomaki et
al., 2001).
L'allergie alimentaire du nourrisson se traduit souvent par
l'eczéma atopique. Lors d'une étude clinique sur 27 enfants
nourris au sein et souffrant d'eczéma atopique, les enfants ont
reçu au sevrage soit une formule infantile hypoallergénique soit
la même formule supplémentée avec Lb. rhamnosus GG
et Bifidobacterium lactis Bb-12. Après 2 mois de traitement, la
supplémentation avec les bactéries lactiques a permis une
amélioration plus rapide de l'état atopique dans ce groupe
comparé au groupe placebo (Isolauri et
al., 2000).
Les mécanismes précis n'ont pas
été élucidés, mais l'on s'appuie sur la
capacité des lactobacilles de neutraliser l'augmentation de la
perméabilité intestinale, de renforcer les réponses des
IgA spécifiques de l'intestin, d'encourager la fonction de
barrière des intestins par le rétablissement de microbes normaux,
et de renforcer la transformation du facteur de croissance bêta et la
production d'IL-10 ainsi que des cytokines qui favorisent la production
d'anticorps IgE (FAO/OMS, 2001).
II.1.4. Maladies cardiovasculaires :
Il a déjà été
démontré que l'emploi de lactobacilles probiotiques et des
sous-produits du métabolisme a des effets bénéfiques sur
le coeur, y compris pour la prévention et la thérapie de diverses
cardiopathies ischémiques et abaisse le cholestérol
sérique. Bien que la consultation FAO/OMS estime que ces
résultats sont importants, il est nécessaire de poursuivre les
travaux de recherche et particulièrement les études sur l'homme
avant de pouvoir affirmer que les probiotiques exercent des effets
bénéfiques sur l'appareil cardiovasculaire (Azizpour,
2009).
II.1.5. Action anticancérigène :
Il a déjà été
démontré que les probiotiques peuvent prévenir ou retarder
l'apparition de certains cancers. Cela vient de la connaissance que les membres
de la microflore intestinale peuvent produire des cancérogènes
tels que les nitrosamines. Par conséquent, l'administration
de lactobacilles et de bifidobactéries pourrait
théoriquement modifier la flore, réduisant les niveaux de
ß-glucuronidase et des carcinogènes (Hosoda
et al., 1996).
En outre, deux essais randomisés contrôlés
ont montré que l'administration orale de Lb. casei diminuait de
manière significative le risque de récidive de tumeur
superficielle de vessie chez l'homme (Marteau et Rambaud,
1998).
Des études in vitro avec Lb. rhamnosus
GG et des bifidobactéries et une étude in vivo
utilisant des souches de Lb. rhamnosus GG et LC-705 ainsi que
Propionibacterium sp. ont montré une diminution dans la
disponibilité d'aflatoxines cancérogènes dans la
lumière intestinale (Oatley et al.,
2000).
Dans un autre côté, bien qu'il n'y ait pas de
preuves expérimentales directes de la suppression des cancers par la
consommation de cultures probiotiques ; il existe de nombreuses preuves
indirectes basées sur des études de laboratoires, ce qui ouvre
des perspectives pour l'application des probiotiques dans la prévention
de certains types de cancer et encouragent la recherche dans ce domaine
(Izquierdo, 2009).
Chapitre III :
Hyperlipidémie et probiotiques
III.1. Définition et caractéristiques
d'hyperlipidémie :
Le terme d'hyperlipidémie ou d'hyperlipémie
désigne une concentration anormalement élevée de lipides
dans le sérum ou le plasma. L'hyperlipidémie postprandiale est
physiologique, surtout après un repas riche en matières grasses
mais une hyperlipidémie à jeun est en revanche une indication
d'anomalie du métabolisme lipidique. Les lipides ne circulent pas libres
dans le sang : ils sont associés à des phospholipides et des
protéines, dans des complexes macromoléculaires : les
lipoprotéines (figure 03) (Jeusette
et al.,
2004).
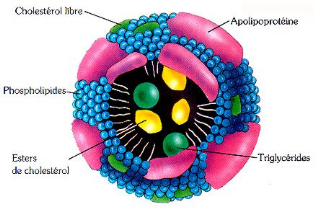
Figure 3. Structure d'une lipoprotéine
(Saïle et Taki, 2007).
III.1.1. Hypercholestérolémie :
Tout comme les autres lipides sanguins, le cholestérol
n'est pas soluble dans le sang. Pour y circuler et être acheminé
aux cellules, il a besoin d'être transporté par des substances
appelées lipoprotéines. Le tableau
4, illustre les deux principaux types de
lipoprotéines.
Les HDL, on les associe au « bon
cholestérol ». Elles entraînent le cholestérol
vers le foie et ont un effet nettoyant dans les vaisseaux sanguins.
La quantité de HDL- cholestérol ne doit pas être
inférieure à environ 1millimole (mmol), soit 0,4 g/l pour les
hommes ou 0,5 g/l pour les femmes. Cependant les LDL, on les associe au
« mauvais cholestérol ». Si elles sont trop
abondantes dans le sang, elles peuvent se déposer sur les parois des
artères et y pénétrer. La quantité de
LDL-cholestérol doit être inférieure à 4,1 mmol/l
soit 1,6 g/l (Morin et al.,
2003).
Tableau 4. Les différents types de
lipoprotéines (Lüllmann et Mohr, 2003).
|
Site de formation
|
Densité
|
Durée de vie dans le plasma (h)
|
Diamètre nm
|
|
Chylomicron
|
Epithélium intestinal
|
< 0,95
|
0,2
|
500
|
|
VLDL
|
Fois
|
0,95-1,006
|
3
|
100-200
|
|
LDL
|
Sang
|
1,006-1,063
|
50
|
25
|
|
HDL
|
Fois
|
1,063-1,210
|
/
|
5-10
|
|
VLDL : very low density lipoprotein / LDL: low density
lipoprotein / HDL: High density lipoprotein
|
On parle d'hypercholestérolémie à partir
de 6,5mmol soit 2,5g/l, au dessus de ce taux, on estime le risque
cardiovasculaire en fonction des facteurs de risques associés. Dans les
cas limites, on dose séparément le HDL-cholestérol, qui
protègent contre le risque de maladies coronarienne, et le
LDL-cholestérol qui, au contraire, l'accroît et dont le taux
constitue, par conséquent, le meilleur indicateur d'un risque
cardiovasculaire, et de la nécessité d'un traitement
(Morin et al.,
2003).
III.1.2.
Hypertriglycéridémie :
On parle d'Hypertriglycéridémie lorsque la
concentration plasmatique des triglycérides (TG) excède 2,3
mmol/L (200 mg/dL) chez l'adulte et 1,6 mmol/L (140 mg/dL) chez les sujets de
moins de 20 ans (Delzenne, 2008). Elle est donc toujours
associée à une augmentation soit du taux de chylomicrons, soit du
taux de VLDL dans le sérum (Morin et
al., 2003).
Un nombre croissant d'études démontre que
l'hypertriglycéridémie, particulièrement en période
postprandiale, est un risque important de développement de maladies
cardiovasculaires. Des études épidémiologiques
prospectives, et des études cliniques de cas, révèlent que
l'importance de la durée de l'hypertriglycéridémie
postprandiale sont deux facteurs clés dans l'évolution de
l'athérosclérose, tant chez la femme que chez l'homme. Plusieurs
mécanismes ont été proposés pour expliquer cette
relation (Delzenne, 2008).
III.2. Physiopathologie :
III.2.1. Pathogénie des
hyperlipidémies :
L'excès de production des lipides sanguins peut
résulter de plusieurs mécanismes : il peut s'agit d'une
augmentation de biosynthèse des TG par l'hépatocyte par
augmentation du flux des substrats : hyperglycémie, acides gras
(antigènes) circulant, oestrogènes à fortes doses,
glucocorticoïdes. Comme il peut être relatif à un
excès de production de l'apoprotéine B après avoir une
mutation génétique du récepteur des LDL qui conduit
à une augmentation du cholestérol total (souvent très
élevé, > 3 g/l) et du LDL-cholestérol également
très élevé (> 2,20 g/l en moyenne). Cependant
l'anomalie du métabolisme intravasculaire des lipoprotéines est
liée soit à un défaut d'activité de la
lipoprotéine lipase par anomalie intrinsèque et ou
extrinsèque, soit à un défaut d'activité d'autres
enzymes LCAT (lécithine cholestérol anyltransférase), CETP
(cholestérol transférase protéine) ou la lipase
hépatique (El Gandaoui et
al., 2007).
III.2.2. Classification :
III.2.2.1. Les hyperlipidémies
primitives :
Deux classifications sont reconnues au plan international,
celle de Frederickson qui repose sur les données de
l'électrophorèse et est définie par le type de
lipoprotéine dont la concentration plasmatique est augmentée. La
deuxième classification est la classification de De
Gennes qui est plus simplifiée. Elle se base uniquement sur le
taux du cholestérol total et des triglycérides (tableau
5) (El Gandaoui et
al., 2007).
Tableau 5. Classification des
hyperlipidémies primitives selon De Gennes
(El Gandaoui et
al., 2007).
|
Classification de De Gennes
|
|
Groupe
|
Sérum à jeun
|
Rapport
|
Correspondance classification Frederickson
|
|
Hypercholestérolémie
essentielle
|
Clair
|
CHT / TG >2.5g/l
|
II a
|
|
Hypertriglycéridémies
majeures
|
Lactescent
|
TG / CHT >2.5g/l
|
I - IV - V
|
|
Hyperlipidémie mixte
|
Opalescent
|
CHT/TG ou TG/CHT
0.4 - 2.5 g/l
|
II b - III
|
III.2.2.2. Les hyperlipidémies
secondaires :
Elle est secondaire à un état physiologique
(grossesse), pathologique (rénale, hépatique, endocrinien ou
maladies générale) ou à une prise médicamenteuse
(El Gandaoui et
al., 2007). Elles sont
résumées dans le tableau ci-dessous.
Tableau 6. Les hyperlipidémies secondaires
(Nuoffer, 2005).
|
Hyperlipidémies
|
Etat pathologique
|
|
Hypercholestérolémies
|
- Hypothyroïdie
- Anorexie mentale
- Hépatopathies cholestatiques
- Syndrome de Cushing
- Syndrome néphrotique, insuffisance rénale,
dialyse
|
|
Hypertriglycéridémies
|
- Obésité
- Diabète sucré
- Glycogénoses du type I
- Pancréatite
|
|
Hyperlipidémies combinées
|
- Obésité
- Diabète sucré
- Glycogénoses du type I
- Hépatite
- Syndrome néphrotique, insuffisance rénale,
dialyse
- Médicaments: b-bloquants, corticoïdes,
oestrogènes, thiazides
- Lupus érythémateux disséminé
|
III.3. Stratégie thérapeutique :
III.3.1. Régime diététique :
Dans tous les cas où il y a indication de traitement,
la première mesure à proposer consiste à modifier
l'alimentation des patients. Le traitement diététique repose sur
la réduction globale de l'apport en graisses, l'augmentation du rapport
des acides gras insaturés, la réduction de l'apport en
cholestérol, un régime normolipidique, un régime
hypocalorique en cas de surpoids, et la réduction de l'apport en
certains sucres rapides et en alcools (Thissen, 1999).
Le plus souvent, une activité physique
régulière et progressive est conseillée. Le traitement
d'une maladie sous-jacente (diabète, etc.) doit également
être entrepris. En dehors de certaines formes primitives qui doivent
être traitées d'office, un traitement médicamenteux
à base d'hypolipidémiants ne doit être envisagé
qu'après l'échec d'un régime correctement suivi
(Morin et al., 2003).
III.3.2. Traitement à base de
probiotiques :
Chez les gallinacés, des études
ont montré l'effet positif de l'apport des probiotiques dans la ration
sur le métabolisme des lipides sanguins. Le paramètre le plus
étudié est le taux de cholestérol. Alors chez le lapin,
peu d'études ont montré que l'ingestion du yaourt réduit
la cholestérolémie des animaux. Par ailleurs, chez le rat, assez
de travaux scientifiques ont montré une nette influence des probiotiques
sur le métabolisme lipidique (Idoui, 2008).
Des tests in vitro ont montré une
réduction du taux du cholestérol dans un milieu de culture avec
certains Lactobacillus. Plusieurs hypothèses ont
été mises pour expliquer ce fait, comme l'assimilation du
cholestérol par les bactéries ou l'hydrolyse des sels biliaires
conjugués (Izquierdo, 2009). Cependant
Taranto et al., en 1998 ont mis en
évidence l'effet hypocholestérolémiant de Lb. reuteri
CRL1098 consommé à 104 cellules par jour pendant
7 jours par des souris hypercholestérolémiques dont la teneur
totale en cholestérol a diminué de près de 40 % à
la fin du traitement.
Dans une autre étude, les concentrations en acides
biliaires et la proportion d'acides biliaires déconjugués dans
des échantillons sanguins et de contenu digestif ont été
comparées chez des souris gnotoxéniques sans lactobacilles et
chez ces mêmes souris colonisées avec des souches de lactobacilles
(Lb. delbrueckii et Lb. fermentum ). La proportion de sels
biliaires déconjugués et l'activité « bile salt
hydrolase » (BSH) sont considérablement augmentées dans le
contenu de l'intestin grêle des animaux hébergeant des
lactobacilles (Drouault et Corthier, 2001).
Des études ont été
réalisées sur des humains pour tester l'influence de la
consommation des produits laitiers fermentés sur le taux de
cholestérol sanguin, mais les résultats n'ont jamais
été concluants (Izquierdo, 2009). Gilliland a
montré que plusieurs bactéries, notamment Lb. acidophilus
et Bf. longum, sont capables de limiter le taux de
cholestérol sanguin chez des porcs nourris avec un régime riche
en cholestérol. Ces mêmes bactéries sont capables
d'assimiler le cholestérol in vitro en présence de
taurocholate de sodium. Une partie de ce cholestérol assimilé
(environ 20%) a notamment été retrouvée dans la membrane
cellulaire de ces bactéries lactiques (Drouault et Corthier,
2001).
III.3.3. Traitement médicamenteux :
Il existe différents médicaments pour diminuer
le taux de lipides plasmatiques, avec des mécanismes d'action et des
effets différents sur les LDL et les VLDL (Lüllmann et
Mohr, 2003). En fait les hypolipémiants
peuvent être classés selon leurs différents modes d'action
en 04 groupes de produits démontrés dans le tableau
7.
Tableau 7. Les principaux classes
d'hypolipémiants
(Morin et
al., 2003 ; Lüllmann et Mohr,
2003).
|
Catégories
|
Médicaments
|
Mode d'action
|
|
Fibrates
|
Bézafibrates
ciprofibrate
finofibrates
gemfibrozil
|
- Stimulent la destruction des lipides dans les vaisseaux
sanguins et inhibent la synthèse du cholestérol par le foie.
- augmentation de l'excrétion biliaire
du cholestérol.
|
|
Statines
|
Atorvastatine
Fluvastatine
Pravastatine
Rosuvastatine Simvastatine
|
- Empêchent l'action d'une enzyme (HMG-CoA
réductase) intervenant dans la synthèse du cholestérol
à partir d'une substance appelée acétyl-coenzyme A (ou
acétyl-CoA).
- Augmentation des récepteurs des LDL
|
|
Les résines échangeuses
d'ions
|
Cholestyramine
|
- Bloquent le passage des acides biliaires dans le sang par la
paroi intestinale.
- Une réduction de la quantité de
cholestérol.
|
|
L'inhibiteur sélectif de l'absorption
intestinale du cholestérol
|
ézétimibe
|
- Se localise au niveau de la bordure en brosse de l'intestin
grêle et inhibe l'absorption du cholestérol, entraînant une
diminution des apports au foie du cholestérol intestinal.
|
|
Tiadénol
|
Fonlipol
|
-Baisse des lipides, des triglycérides et du
cholestérol sanguins par le blocage de la synthèse
endogène hépatique et intestinale et diminution de
l'excrétion biliaire du cholestérol marqué
exogène.
|
CONCLUSION GENERALE
L'écosystème intestinal constitue un
intermédiaire entre les aliments et l'hôte. Depuis plusieurs
années, l'impact des probiotiques sur la nutrition et la physiologie de
l'hôte a fait l'objet de nombreuses études. En effet, le concept
de probiotique appliqué à l'écosystème intestinal
est ainsi original et séduisant. Il satisfera sûrement les adeptes
des traitements dits naturels qui souhaitent éviter l'utilisation
excessive d'antibiotiques. Cependant, de nombreuses études in vivo
sont encore nécessaires afin de valider leur efficacité en
tant que traitement préventif ou curatif.
Ce modeste travail a aboutit dans un premier temps à
l'identification de la notion des probiotiques au temps des bons
bactéries et de visualiser leurs pharmacocinétique notamment au
niveau intestinale. En effet, il est important de noter que la
détermination de ces paramètres pharmacocinétiques permet
d'améliorer de plus en plus les performances gastriques des êtres
humais oú on essaye de comprendre certains mécanismes
d'interaction hôtes/probiotiques.
Ensuite on a signalé un grand nombre d'études
sur les probiotiques, mais elles sont de qualité variable qui expriment
les effets bénéfiques des probiotiques portaient sur des sujets
souffrant d'une multitude de problèmes médicaux, notamment le
cancer, des maladies cardiaques, intestinales, urogénitales et des
troubles du système immunitaire.
Au-delà, certains travaux scientifiques
élaborent actuellement plusieurs stratégies visant à
maintenir l'hypothèse que la consommation de laits fermentés
enrichis en probiotiques puisse moduler le taux de cholestérol sanguin
et de rendre une hyperlipidémie à la normale. Ce qui sera notre
point à prouver et notre but attendu lors d'expérimentation.
Références bibliographiques
Ait-Belgnaoui A. (2006).
Influence d'un traitement probiotique (Lactobacillus
farciminis) sur les altérations de la sensibilité
viscérale liées au stress : rôle de la barrière
épithéliale colique (Thèse de doctorat). Unité
de Neuro-Gastroentérologie et Nutrition, INRA Toulouse ; p.
1-191.
Azizpour K., Bahrambeygi S., Mahmoodpour S.
et Azizpour A. (2009). History and basic of probiotics. Res J Biol Scc
; 4(4): 409-426.
Balfour Sartor R. (2008). Microbial
influences in inflammatory bowel diseases. Gastroenterology ;
134 (2): 577-594.
Cuibai F. (2008).
L'influence de la lactoferrine, de probiotiques et du SM3 (extrait enrichi en
sphingolipides) sur des fonctions immunitaires de la souris (Thèse de
doctorat). INRA-Agro. Paris- Tech ; p. 1-193.
Delzenne N. Modulation nutritionnelle du
métabolisme des triglycérides. (2008). In : Roberfroid M.
B., Coxam V. et Delzenne N. Aliments fonctionnels. Paris: Lavoisier
Tec&Doc; p.
Drasar B.S. et Barrow P.A. (1985). Intestinal
Microbiology - Aspects of Microbiology 10 - Van Nostrand
Reinhold Co. Ltd U.K.
Drouault S. et Corthier G. (2001). Effets des
bactéries lactiques ingérées avec des laits
fermentés sur la santé. Vêt. Res ;
32: 101-117.
El Gandaoui S., El Ghomari H., Chadli A. et
Farouqui A. (2007). Les hyperlipidémies : étiologies et
traitement. La Chronique Ibn Rochd ; 2 :
39-45.
FAO/OMS. « Consultation mixte d'experts
FAO/OMS sur l'évaluation des propriétés sanitaires et
nutritionnelles des probiotiques dans les aliments, y compris le lait en poudre
contenant des bactéries lactiques vivantes ». Corboda-Argentine,
octobre 2001. Available from. URL:
http://www.who.int/foodsafety/publications/en.
Hosoda M., Hashimoto H., He D., Morita H. et
Hosono A. (1996). Effect of administeration of milk fermented with
Lactobacillus acidophillus LA-2 on faecal mutagenicity and microflora in human
intestine. J Dairy Sci ; 79: 745-749.
Idoui T. (2008). Les
bactéries lactiques indigènes : Isolement, identification et
propriétés technologiques. Effets probiotiques chez le poulet de
chair ISA15, le lapin de souche locale et le rat Wistar
(Thèse de Doctorat). Université d'Oran ; p.
1-196.
Isolauri E., Arvola T., Sutas Y., Moilanen E.
et Salminen S. (2000). Probiotics in the management of atopic eczema. Clin
Exp Allergy ; 30(11):1604-1610.
Izquierdo E. (2009). Les
protéines bactériennes en tant que biomarqueurs de
l'activité probiotique (Thèse de doctorat). IPHC
Strasbourg ; p. 1-230.
Jeusette I., Istasse L. et Diez M. (2004).
Métabolisme lipidique et hyperlipémies chez le chien. Ann.
Méd. Vét ; 148 : 79-89.
Kalliomaki M., Salminen S., Arvilommi H.,
Kero P., Koskinen P. et Isolauri E. (2001). Probiotics in primary prevention of
atopic disease: A randomised placebo-controlled trial. Lancet ;
357: 1076-1079.
Lüllmann H. et Mohr K. Atlas de proche
de pharmacologie. Paris: Flammarion Médecine-Sciences ; 2003.
Marteau P., Flourié B., Pochart P.,
Chastang C., Desjeux J.F. et Rambaud J.C. (1990). Effect of the microbial
lactase (EC 3.2.123) activity in yogurt on the intestinal absorption of
lactose: an in vivo study in lactase deficient humans. Br J Nutr;
64: 71-79.
Marteau P. et Rambaud J-C. (1998).
Probiotiques en gastroentérologie: bases rationnelles, effets
démontrés et perspective. Hépato-Gastro;
5 (4) : 267-273.
Marteau P. (2001). Safety aspects of
probiotic products. Scand. J. Nutr; 45:
22-24.
Marteau P. et Seksik P. Probiotiques et
alicaments. (2005). In : Luquet F. M. et Corrieu
G. Bactéries lactiques et probiotiques. Paris:
Lavoisier Tec&Doc ; p : 255-289
Moreau M-C. Bactéries lactiques
probiotiques et immunité. (2005). In : Luquet F.
M. et Corrieu G. Bactéries lactiques et probiotiques.
Paris: Lavoisier Tec&Doc ; p. 211-253.
Morin Y., Wainsten J-P. et Lemaire V.
Larousse Médicale. Larousse/VUEF 2003, 1219p.
Nuoffer J-M. (2005).
Athérosclérose et hyperlipidémies primaires - un
problème pédiatrique?. PAEDIATRICA ;
16(6): 34-37.
Oatley J.T., Rarick M.D., Ji G.E. et Linz
J.E. (2000). Binding of aflatoxin B1 to bifidobacteria in vitro. J Food
Prot; 63: 1133-1136.
Raibaud P., Ducluzeau R., Dubos F., Hudault
S., Bewa H. et Muller M. C. (1980). Implantation of bacteria from the digestive
tract of man and various animals into gnotobiotic mice. Am J Clin
Nutr; 33: 2440-2447.
Reid G., Bruce A. W. et Taylor M. (1995).
Instillation of Lactobacillus and stimulation of indigenous organisms to
prevent recurrence of urinary tract infections. Microecol Ther;
23: 32-45.
Reid G., Bruce A. W., Fraser N., Heinemann
C., Owen J. et Henning B. (2001). Oral probiotics can resolve urogenital
infections. FEMS Microbiol Med Immunol; 30: 49-52.
Reid G. et Bruce A. W. (2001). Selection of
Lactobacillus strains for urogenital probiotic applications. JID ;
183: 77-80.
Robin J. M. et Rouchy A. (2001).
Les probiotiques. Nutrithérapie
info; 6: 1-4.
Rousseau V. (2004). Evaluation
d'oligosaccharides à effet prébiotique vis-à-vis de la
microflore vaginale (Thèse de doctorat). INSA Toulouse ;
p. 1- 186.
Roy D. (2006).
Innocuité, qualité et efficacité des probiotiques.
Résumé du rapport « Développement d'une
expertise de pointe et de méthodes efficaces et
rigoureuses en matière d'innocuité,
qualité et efficacité des
probiotiques. AISA ; Available from. URL: http//
www.aisa-ahif.org/index.php?menu=dossier_reglementaire.
Saïle R. et Taki H. (2007).
Cholestérol, lipoprotéines et athérosclérose : de
la biochimie à la physiopathologie. Les Technologies De
Laboratoire; 2 : 4-11.
Shanahan F. (2000). Probiotics and
inflammatory bowel disease: Is there a scientific rationale?. Inflamm Bowel
Dis; 6(2): 107-115.
Taranto M. P., Medici M., Perdigon G., Ruiz
Holgado A. P. et Valdez G. F. (1998). Evidence for Hypocholesterolemic Effect
of Lactobacillus reuteri in Hypercholesterolemic Mice. J Dairy
Sci ; 81(9): 2336-2340.
Thissen J-P. (1999). Les normes du
cholestérol. Louvain Med; 118: 139-144.
| 


