|
République Démocratique du
Congo
Ministère de l'Enseignement Supérieur et
Universitaire

UNIVERSITE DE KINSHASA
FACULTE DES SCIENCES
Département de Chimie
B.P. 190 KINSHASA XI

Activité anti drépanocytaire et Stabilité
physico-chimique des anthocyanes extraits des bulbes d'Hypoxis
angustifolia et des feuilles d'Ipomoea batatas
A >
B

Yannick TULA MOBOLUA
Gradué en sciences chimiques.
Mémoire présenté et
défendu en vue de l'obtention du titre de licencié en
sciences
Groupe : Chimie
Option : Chimie-physique
Directeur : Prof. Pius MPIANA
TSHIMANKINDA.
Co-directeur : Prof. Jean KAYEMBE SUNGULA.
ANNEE ACADEMIQUE : 2011 -
2012
IN MEMORIAM
A mes chers défunts grands-parents MOBOLUA IYELA
et MATSHO MA IYANGA et à mon défunt père Carlos NGOMA
à qui le destin a arraché l'âme si tôt avant de jouir
de leurs semences qui continuent leur production. Mes larmes ne cesseront de
couler en leurs souvenirs
DEDICACE
A l'Eternel Dieu qui est ma lumière, mon salut et le
soutien de ma vie.
A ma mère Eveline AMBA BOPENDA pour tant d'affections
et ton grand amour, ta patience et tes prières.
A mes oncles FATAKI BAKONZO et BOKUMBE MOBOLUA pour tant des
sacrifices à mon égard, veuillez trouver dans ce travail le fruit
de vos efforts, vos encouragements, vos investissements et votre
détermination.
A mon oncle IYANGA MOBOLUA pour votre soutien matériel
et moral.
Au Pasteur Gédéon DIASILUA et au bishop Billy
MUTOMBO pour vos prières, que ce travail en soit la
réponse.
A ma conseillère Sarah MOSENGO MBEMBE la Rose.
A vous tous, mes frères, soeurs et cousins pour votre
amour, votre patience et votre affection : Trésor MOLA, Fabrice
BOSALA, Angelo MAMPUYA, Marchedi NGAPILA, Radi NGAPILA, Grâce AMBA,
Israël BOKUMBE, Steven BOKUMBE, Alexia BOKUMBE, Raïs FATAKI, Juseters
FATAKI, Dan et Schéma IYANGA, Annie MASAKA, Guy DIMBALA ainsi que tous
les membres de la famille MOBOLUA.
Je dédie ce travail.
Yannick TULA MOBOLUA
REMERCIEMENTS
Au terme de notre cycle de licence en sciences chimiques,
qu'il nous soit permis de nous acquitter de l'agréable devoir de
reconnaissance envers ceux qui de près ou de loin ont contribué
à notre formation.
Nos remerciements s'adressent aux Professeurs Pius MPIANA
TSHIMANKINDA et Jean KAYEMBE SUNGULA qui, malgré leurs multiples
occupations, ont acceptés d'assurer la direction et la codirection de ce
travail, respectivement.
Nos remerciements s'adressent également aux Professeurs
Blaise MBALA, Oscar SHETONDE, Teddy SUNDA, Crispin MULAJI et aux Chefs des
Travaux Damien TSHIBANGU et Dorothée TSHILANDA pour leurs conseils,
remarques et suggestion.
Nous disons également merci aux Assistants Blaise
KIMBADI, Emanuel ATIBU Philippe TSALU et Yannick MANKOTO pour leurs
conseils et suggestions.
Nous tenons à remercier sincèrement les
autorités académiques de l'Université de Kinshasa, tous
nos Professeurs en général et ceux du département de
chimie en particulier, les Chefs de Travaux, Assistants et Techniciens de
Laboratoire de la Faculté des Sciences pour leur contribution à
notre formation.
Que tous nos amis et ainés trouvent ici l'expression de
notre gratitude. Il s'agit particulièrement de : Akim KAMBULU,
Carlos MPIANA, Cris MK, DEDIEU KIBONGE, Fiston KASONGO, Glody NANY, Joe MATETE,
Olivier BAYAKA, Patrick MAKANGA, Tardelli TSASA, Winnie LIFAEFI,...
Que nos compagnons de lutte avec qui nous avons partagé
des moments inoubliables durant notre parcours à l'Université de
Kinshasa, soient honorés pour leur amour et collaboration, nous
citons : Beaudrique NSIMBA, Bob NTUMBA, Cédric MATUMONA, Chico
IBONGO, Christian INGONGOMO, Christian LOTIGO, Claudine MANDESI, Domaine
MWANANGOMBO, Gédéon BONGO, Guelor MAVEVUA, Kifline KIFUANI,
Jacques MALALA, Jenny PONDO, Jenny MANZA, Jimmy UPASULA, Jules MAMBU, Julien
MOPONGO, Laurent KIALA, Nice KINDOMBE, Patricia KUKU, Patrick WALEBO, Paul
MANAYALA, Reagan MUTOMBO, Pedro MIGUEL, Steve MBOKOLO,.....
Que tous ceux qui nous ont soutenu mais n'ont pas
été cités nommément, trouvent ici l'expression de
notre profonde gratitude.
Yannick TULA MOBOLUA
INTRODUCTION
La drépanocytose est une maladie
héréditaire et génétique du sang dans laquelle
l'hémoglobine A normale est remplacée par l'hémoglobine S
drépanocytaire. Au niveau moléculaire il s'agit d'une mutation
ponctuelle entrainée par la substitution, sur la chaine â de la
globine en position 6, d'un acide glutamique (chargé
négativement) par la valine (neutre). Cette mutation diminue
l'affinité de l'hémoglobine pour l'oxygène et
réduit sensiblement la solubilité de l'hémoglobine S dans
sa forme non oxygénée (désoxy HbS). Ainsi, lorsque la
pression partielle en oxygène baisse, l'hémoglobine S devient
très peu soluble. Elle se polymérise avec d'autres
molécules de l'hémoglobine S et cristallise dans le globule rouge
qui se déforme alors en faucille. La falciformation prédispose
les érythrocytes à une hémolyse précoce (MPIANA et
al, 2008).
Les pertes en vies humaines dans le monde dues à la
drépanocytose sont estimées à environ 5
millions de personnes par an. Dans certaines régions d'Afrique,
les porteurs du trait drépanocytaire représentent jusqu'à
20% de la population avec une prévalence en Afrique centrale de 25
à 30% (MPIANA et al, 2007-2010).
Deux pourcents de la population congolaise sont touchés
par cette maladie, soit plus d'un million de personnes. Du point de vue
génétique, il s'agit d'une maladie létale car très
peu d'individus atteignent l'âge de la reproduction (MPIANA et
al, 2010).
En effet, 80% d'enfants anémiques non suivis
médicalement meurent avant leur cinquième anniversaire (MPIANA et
al, 2007a- 2010). Plusieurs modes de traitement ont
été envisagés en vue de soulager les malades.
Il s'agit entre autre de la greffe médullaire
allogénique, de la génothérapie, de la transfusion
sanguine répétée, ou la prise de l'hydroxyurée, une
molécule qui remettrait en activité les gènes de
l'hémoglobine foetale (l'HbF) dont la présence dans
l'érythrocyte interfère avec la polymérisation de l'HbS.
Cependant, il s'avère que ces traitements sont non
seulement très onéreux ou cytotoxiques, mais ils peuvent
également constituer un risque certain d'infection au VIH quand l'on
sait qu'il n'existe pas encore des laboratoires spécialisés pour
la traçabilité des produits sanguins en milieux ruraux africains
(MPIANA et al ,2007b ; MPIANA et al, 2007c).
Ainsi, la phytothérapie se présente actuellement
comme une alternative pouvant offrir un soulagement aux anémiques
(MPIANA et al, 2010).
En effet, les substances naturelles constituent une source
éventuelle de nouveaux types de médicaments pouvant lutter contre
plusieurs maladies en général et contre l'anémie
falciforme en particulier.
Au Cameroun, le professeur ETAME a mis sur le marché un
phytomédicament destiné aux drépanocytaires
« Itémadya » qui se présente sous forme d'un
sirop (ETAME, 2007).
Depuis quelques années, l'équipe de recherche du
professeur MPIANA PT a inventorié et a évalué
l'activité antifalcémiante de quelques plantes utilisées
contre la drépanocytose en médecine traditionnelle congolaise
à Kinshasa, à Kisangani et à Lubumbashi par les
tradipraticiens. Plusieurs d'entre elles ont montré une activité
antifalcémiante in vitro (MPIANA et al 2007a ;
MPIANA et al, 2008 ; MPIANA et al, 2010).
Cette équipe a également démontré
que cette activité serait due aux anthocyanes (Mpiana et al
2007 - 2010).
C'est ainsi que nous nous sommes proposés dans ce
travail :
Ø d'extraire les anthocyanes des bulbes
d'Hypoxis angustifolia et des feuilles d'Ipomoea
batatas ;
Ø de tester in vitro leur activité
antifalcémiante ;
Ø d'évaluer la stabilité de ces
anthocyanes vis à vis de :
o la lumière ;
o la température ; et,
o le pH.
L'intérêt de ce travail réside dans le
fait qu'il contribuera à promouvoir l'utilisation des plantes
médicinales locales pour les soins contre cette grave maladie.
Comme, 54 % des territoires de la République
Démocratique du Congo sont couverts par la forêt tropicale, cela
fait de ce pays un réservoir des plantes médicinales et de la
biodiversité (www.greenpeace.org, 2012).
Outre l'introduction et la conclusion, ce travail comprend
trois chapitres. Le premier chapitre traite des
généralités sur : le sang ; la
drépanocytose ; les plantes médicinales ; et les
anthocyanes. Le deuxième chapitre décrit les matériels et
méthodes utilisés, tandis que le troisième chapitre
présente les résultats obtenus, leurs interprétations
ainsi que leurs discussions.
Chapitre I
LES GENERALITES
I.1. LE
SANG
I.1.1.Définition
Le sang est un liquide rouge, visqueux circulant dans les
artères et les veines sous l'action de la pompe cardiaque. Il est plus
dense que l'eau (d=1,05), possède une saveur salée et un pH
voisin de la neutralité (pH=7,40 #177; 0,02). En moyenne, le corps
humain contient cinq à six litres de sang, chaque jour plus de
100 000 battements du coeur propulsent celui-ci à travers tous nos
vaisseaux sanguins (SCHALFFER et al 2004).
I.1.2.
Composition et fonction du sang
Le sang est composé d'un liquide jaunâtre
appelé plasma, dans lequel baignent des millions de cellules, notamment
les globules rouges (érythrocytes) qui lui donnent sa couleur, les
globules blancs (leucocytes) et des plaquettes (thrombocytes).
Il contient également des sels minéraux
(Na+, K+, Ca2+, CO32- ou
HCO3-), des protéines (albumine, globuline,...),
des substances organiques (glucose, hormones, enzymes, lipides, des
aminoacides) mais aussi des résidus (urée et
créatine).
Le sang assume de nombreuses fonctions qui sont toutes
liées de près ou de loin au transport de substances, à la
régulation de certaines caractéristiques physiques du milieu
interne et à la protection de l'organisme (Encarta, 2009).
I.1.3.
Les globules rouges
Les globules rouges sont des cellules sanguines de
loin plus nombreuses, en forme biconcave mesurant approximativement 7,5um de
diamètre. Ils sont produits par la moelle osseuse avec une durée
de vie moyenne de 120 jours puis dégradés et
éliminés par la rate. Chez l'homme et chez la plus part des
mammifères, les globules rouges sont dépourvus de noyau
cellulaire, caractéristique qui les rendent très bien
adaptés au transport de l'oxygène. Cette fonction est possible
grâce aux molécules d'hémoglobine qu'ils contiennent
(ELAINE T. MARIEB, 1999).
I.1.4.
Hémoglobine
I.1.4.1. Présentation et fonction
(SCHALFFER et al, 2004)
L'hémoglobine (Hb) est une protéine
majoritaire des globules rouges. La molécule d'hémoglobine
est faite de l'assemblage de 4 chaînes polypeptidiques formant ainsi une
structure appelée tétramère.
Dans chaque tétramère de l'hémoglobine,
on trouve deux chaînes á constituées de 141 acides
aminés et deux chaînes â constituées de 146 acides
aminés et sont intimement liées à une molécule de
l'hème.
Chaque chaîne de l'hémoglobine est
elle-même constituée d'une partie protéique appelée
globine et d'une autre partie non protéique appelée
l'hème. Cette dernière renferme un atome de fer ferreux
(Fe++) dont le rôle dans la fixation de l'oxygène est
primordial (on dit que l'oxygène est ligand de fer).
En tant que pigment principal du sang, l'hémoglobine
est idéalement adaptée à la fixation, au transport et la
délivrance de l'oxygène au niveau tissulaire. Elle transporte de
l'oxygène des poumons aux tissus périphériques où
elle prend en charge une partie du dioxyde de carbone pour la ramener aux
poumons.
I.1.4.2. Types d'hémoglobines
(SCHALFFER & al, 2004)
Il existe deux types d'hémoglobines :
1° Les hémoglobines
normales
A° les hémoglobines embryonnaires et
foetales
L'hémoglobine foetale (HbF), détectable à
partir de la cinquième semaine après la conception, est le
constituant hémoglobinique principal de la vie. Cette hémoglobine
est synthétisée au niveau du foie et de la rate dès le
premier stade de la gestation. En outre les embryons et les foetus ont des
hémoglobines différentes. Peu après la conception, des
embryons synthétisent des chaînes î (de la même
famille que les chaînes á) et les chaînes å (de la
même famille que les chaînes â), ils sont donc de la forme
î2å2. Au cours du développement
î est remplacé par á et å par â.
B° l'hémoglobine adulte
(HbA)
L'hémoglobine A représente plus de 95% de la
totalité des hémoglobines. Il existe en outre un constituant
mineur de l'hémoglobine A2, dont la synthèse
débute dans la période néo-natale et qui est
exprimé à un taux d'environ 2,5%. Les hémoglobines (HbA et
A2) sont synthétisées au niveau de la moelle osseuse.
2° Les hémoglobines pathologiques ou Hb
anormales
Ces Hb diffèrent de l'Hb A normale, soit par des
anomalies dans la répartition des chaînes (on connait des Hb ayant
4 chaînes á ou 4 chaînes â), soit des anomalies dans
la séquence de la chaîne á ou de la chaîne â.
C'est le cas de l'hémoglobine S (Hb S) où
l'acide glutamique normalement présent en position 6 de la chaîne
â est remplacé par la valine, cette unique différence
suffit à altérer les propriétés physiologiques de
l'hémoglobine.
I.2. LA
DREPANOCYTOSE
I.2.1.
Définition (Anonyme, 2012 ; MPIANA et al, 2008)
La drépanocytose est une maladie
héréditaire et génétique du sang dans laquelle
l'hémoglobine A normale est remplacée par l'hémoglobine S
drépanocytaire. Le globule rouge atteint prend la forme d'une feuille de
houx, de faucille et se solidifie.
La transmission se fait sur le mode autosomique
récessif. C'est-à-dire que les deux exemplaires du même
gène (un de chaque parent) doivent être porteurs de l'anomalie
pour que la maladie s'exprime. Dans ce cas, les parents ne sont
généralement pas affectés par la drépanocytose,
mais ils sont porteurs du trait et possèdent un gène normal qui
compense le gène muté.
Si l'on dispose du statut AA : il n'ya pas de risques. Si
l'on dispose du statut A/S (que l'on décèle par un test
simple : le test d'Emmel), l'individu n'est pas malade mais porteur. Si
deux porteurs conçoivent un enfant, celui-ci sera soit AA, AS ou SS.
L'enfant aura un risque sur quatre d'être drépanocytaire. Le
schéma ci-dessous représente le mode transmission de la
drépanocytose.
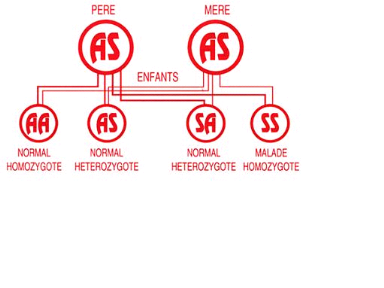
Schéma I-1 : Mode de transmission de la
drépanocytose.
I.2.2.
Base moléculaire de la drépanocytose
Au niveau moléculaire il s'agit d'une mutation
ponctuelle entrainée par la substitution, sur la chaine â de la
globine en position 6, d'un acide glutamique (chargé
négativement) par la valine (neutre). Cette mutation diminue
l'affinité de l'hémoglobine pour l'oxygène et
réduit sensiblement la solubilité de l'hémoglobine S dans
sa forme non oxygénée (désoxy HbS). Ainsi, lorsque la
pression partielle en oxygène baisse, l'hémoglobine S devient
très peu soluble. Elle se polymérise avec d'autres
molécules de l'hémoglobine S et cristallise dans le globule rouge
qui se déforme alors en faucille. La falciformation prédispose
les érythrocytes à une hémolyse précoce (MPIANA et
al, 2008).
I.2.3.
Symptômes de la drépanocytose (MPIANA et al, 2007a- 2010).
L'affection se signale chez le nourrisson mais n'est
d'ordinaire pas manifestée à la naissance parce que les globules
rouges du nouveau-né contiennent encore 50-90% d'hémoglobine
foetale. Les symptômes de cette maladie peuvent apparaître
dès l'âge de six mois
Les manifestations aigues habituelles de la
drépanocytose sont de trois ordres :
§ Anémie
hémolytique : les globules rouges des
drépanocytaires sont de forme anormale. Celles-ci prennent une forme de
faucille, et sont arrêtées par le filtre que représente la
rate, où elles sont détruites. Cette destruction entraine une
baisse du nombre d'hématie et donc une anémie
régénérative ;
§ Infections : elles sont
fréquentes chez les drépanocytaires, surtout les infections
à pneumocoques chez les jeunes enfants.
§ Crise vaso-occlusives : des
caillots bouchent un certain nombre d'artères, entrainant des douleurs
intenses et brutales dans certaines parties du corps (les hanches, pieds,
abdomens) les crises peuvent être très douloureuses.
Les manifestations chroniques de la drépanocytose
associent un retard de taille et de poids ainsi que des déficits
nutritionnels.
I.2.4.
Dépistage
Il existe deux tests de dépistage notamment : le
test de présomption et le test de confirmation.
§ Test de
présomption :
L'observation au microscope, du sang frais placé entre
lame et lamelle, avec ou sans addition d'un réducteur. A cet effet les
globules rouge de l'homozygote prennent la forme en faucilles.
§ Test de confirmation :
L'électrophorèse de l'hémolysât de
globules rouges qui montre chez l'homozygote, une bande unique d'une
hémoglobine migrant anormalement lentement et chez
l'hétérozygote la présence de deux bandes
d'hémoglobine dont la plus rapide est l'hémoglobine A et l'autre
l'hémoglobine S.
I.2.5.
Traitements
1° Greffe de la moelle osseuse
Les hématies sont produites à partir de cellules
souches dans la moelle osseuse. En détruisant la moelle osseuse des
malades et en la remplaçant par celle d'un donneur compatible, il y a
possibilité d'obtenir une guérison. Environ 200 greffes ont
été réalisées dans le monde chez des
drépanocytaires permettant d'obtenir la guérison dans 85 % de
cas. Il faut cependant un donneur apparenté le plus proche
possible : un frère ou une soeur ; il y a la
possibilité pour les parents de recourir à une fécondation
in vitro. Cette voie de traitement du bébé
médicalement est très encadrée par les lois de la
bioéthique. Signalons que ce traitement est utilisé en
médecine orthodoxe.
2° Phytothérapie
L'impact positif des plantes médicinales dans le
traitement de la drépanocytose n'est plus à démontrer
à l'heure actuelle. En effet, au Nigeria l'équipe de recherche du
Professeur SOFOWORA a extrait de Fagara zanthoxyloïdes les
principes actifs responsables de l'action anti drépanocytaire, il s'agit
de l'acide hydroxyl méthoxy benzoïque et du Zanthoxylol (SOFOWORA,
1975).
Au Bénin quelques chercheurs ont mis au point le VK500
qui est un médicament sous forme des gélules issues d'un
mélange des plantes (GALACTEROS, 2005).
En République Démocratique du Congo au
laboratoire des substances naturelles et chimie médicinale du
département de chimie, les investigations phytochimiques de
l'équipe de recherche du professeur MPIANA de l'université de
Kinshasa a confirmé l'activité antifalcémiante de plus de
60 plantes Congolaises. Cette activité serait due aux anthocyanes
(MPIANA et al, 2007a, b, c et d ; MPIANA et al, 2008a,
b, c ; MPIANA et al 2009, MPIANA et al, 2010).
3° Préventions (MPIANA et
al 2010)
Boire fréquemment de l'eau environ 3 litres d'eau par
jour ; veiller à ne pas manquer l'oxygène donc éviter
les endroits mal aérés notamment les altitudes de plus de 1500
m ; se donner et respecter une bonne hygiène de vie ;
éviter tout ce qui peut ralentir ou bloquer la circulation du
sang (pas de vêtements trop serrés).
I.3. LES
PLANTES MEDICINALES
I.3.1.
Définition
Les plantes médicinales sont des plantes qui
contiennent une ou plusieurs substances ou vertus pouvant être
utilisées à des fins thérapeutiques. La macération,
l'infusion et la décoction sont des modes d'extraction pour la
préparation des produits destinés à la
phytothérapie (MPIANA et al, 2007a-2010).
I.3.2.
Quelques groupes chimiques des plantes médicinales
Les grands groupes des substances naturelles comprennent
les glucides, les lipides, les acides aminés,
les enzymes et les acides organiques.
Toutes ces substances sont considérées comme des
métabolites primaires parce qu'elles interviennent dans la
croissance et le développement des plantes. Par contre les
composés phénoliques notamment les tanins,
les flavonoïdes dont les anthocyanes, les
terpènes, les stéroïdes, les
alcaloïdes et les antibiotiques sont
considérés comme des métabolites secondaires. En
effet, tous ces composés n'interviennent pas dans la croissance et le
développement des plantes.
I.3.3.
Position systématique et description botanique des plantes
utilisées.
1°Hypoxis
angustifolia
Ø Position systématique
Règne : Végétal ;
Classe : Dicotylédones ;
Ordre : Liliales ;
Famille : Hypoxidaceae ;
Genre : Hypoxis ;
Espèce : Hypoxis angustifolia.
Noms vernaculaires
Kikongo (RDC) :.Nidioko dingumbi ;
Lingala (RDC) : Litungulu ya zamba.
Ø Brève description
C'est un arbuste de 15 à 16 m de haut, couvert de
poiles blancs corne subcylindrique de 5-4 cm de long et 1-3 cm de
diamètre. Fleurs nombreuses, inflorescences linéaires de 12-55 cm
de long et 1-5 cm de large. 2 à 4 cm de fleurs solitaires de 8 à
40 cm de long ; bractées de 4 à 16 mm de long. Graines
globuleuses de 1mm de diamètre. Feuilles relictes, linéaires
à bractée de 4 cm/2 cm, fleurs blanchâtres. Bulbe de 4 cm
rouge, hampes de 10 cm.

Figure I-1: Hypoxis angustifolia
Lam.
Ø Usages médicaux traditionnels
et distribution
géographiques :
Les bulbes pilés sont utilisés comme
suppositoire contre les hémorroïdes. Les bulbes seraient aussi
toxiques pour le bétail.
Habitat : prairie et steppes, le plus souvent dans les
régions marécageuses. Les extraits totaux aqueux et
éthanoliques des bulbes de l'Hypoxis angustifolia
possèdent une activité antifalcémiante in vitro
(MPIANA et al, 2007)
2° Ipomoea
batatas
Ø Position systématique
Règne : Végétal ;
Sous-règne : Tracheobionta ;
Classe : Magnoliospida ;
Sous-classe : Asteridae ;
Ordre : Solanales ;
Famille : Convolvulacéae ;
Genre : Ipomoea ;
Espèce : Ipomoea batatas (feuilles de patate
douce).
Nom vernaculaire:
Lingala : Matembele ya Mbala.
Ø Brève description
C'est une plante vivace à tiges rampantes pouvant
atteindre 2,5 à 3 m de long. Les
feuilles alternes sont
entières, au
pétiole
relativement long et au
limbe de forme
variable à bord sinué ou denté ou bien lobé,
formant 5 à 7 lobes aigus, à nervation palmée.
Les
fleurs à
corolle soudée, de
couleur violette ou blanche, sont très semblables à celles du
liseron qui appartient au
même genre. Elles apparaissent à l'aisselle des feuilles,
isolées ou groupées en cymes de quelques fleurs. La
fructification de cette plante est très rarement observée en
culture.
Elle produit des
tubercules de forme plus
ou moins allongée, voir arrondie, à la peau fine. Suivant la
variété, la couleur de la peau du tubercule va du blanc au jaune,
à l'orange ou au violet. Le tubercule est très riche en
amidon ; sa saveur
sucrée et sa texture farineuse rappellent un peu celles de la
châtaigne.

Figure I-2: feuilles de patate douce (Ipomoea
batatas).
Ø Usages et culture
La patate douce est cultivable même sur les sols
pauvres, mais elle préfère un sol profond, frais et riche en
humus. Ce genre comprend des milliers de variétés. Elle est
cultivée pour son tubercule qui contient de la fécule et des
glucides donnant une saveur sucrée, riche en vitamine A, E et C. Selon
la variété, la chaire peut être blanche, jaune ou orange.
Elle est la base de l'alimentation dans certains pays, les feuilles riches en
protéines sont également consommés comme épinards,
ou utilisées comme fourrage.
La patate douce est consommée bouillie, frite ou
braisée, elle est utilisée pour la fabrication de fécules,
de sirop ou d'alcool.
I.4.
LES ANTHOCYANES
I.4.1.
Définition
Les anthocyanes sont des pigments hydrosolubles qui colorent
les plantes en bleu, rouge, mauve, rose ou orange. Ils appartiennent à
la famille des molécules appelées poly phénols
(flavonoïdes) (MALIEN, 2004).
I.4.2.
Localisation et biosynthèse des anthocyanes
A l'origine de la couleur des fleurs, des fruits et des baies
rouges ou bleues, ils sont généralement localisés dans les
vacuoles des cellules épidermiques, qui sont des véritables
poches remplies d'eau.
Si la coloration des fleurs et des fruits est leur rôle
le plus connu, on trouve également les anthocyanes dans les racines,
tiges, feuilles et graines.
Les anthocyanes sont des pigments présents uniquement
dans le cytoplasme des plantes terrestres mais absents dans les plantes
aquatiques et chez les animaux.
Les flavan-3,-4-cis diol ou leucocyanidines sont les
précurseurs de la biosynthèse des anthocyanes. Cependant, les
mécanismes et les enzymes impliqués dans cette biosynthèse
ne sont à ce jour pas totalement connus (MALIEN, 2004).
I.4.3.Constituants chimiques des anthocyanes
Très largement distribués dans la nature, ces
pigments existent toujours sous la forme d'hétérosides. Les
anthocyanosides, les génines correspondants (les anthocyanidols) sont
des dérivés du noyau flavylium (2-phényl-benzopyrilium).
Ces derniers sont des substances glucidiques qui peuvent être
décomposées par hydrolyse. Tous les anthocyanidols ont un
hydroxyle en position 3 et les plus répandus d'entre eux sont di ou tri
substitués sur le noyau B par les groupes hydroxyle et methoxyle (-OH,
-OCH3) (MALIEN, 2004).
Habituellement les positions 5, 7 et 4' sont
substituées par des hydroxyles phénoliques libres, indispensables
à la formation des formes quinonoïdes.
La molécule d'anthocyane est constituée de trois
portions à savoir :
1° Le noyau flavylium (le
chromophore)
Il constitue la molécule de base qui est le cation
flavylium appelé également 2-phényl-1-benzopyrilium. La
charge positive est habituellement localisée sur l'atome
d'oxygène. Cette notation oxonium n'est qu'une convention
d'écriture car, en réalité la charge positive est
délocalisée sur la structure entière (ONYAMBOKO, 2012)

Figure 1-3: structure du cation flavylium ou
2-phényl-1-benzopyrilium
2° Les sucres
Les anthocyanes sont souvent glucosylés, le plus
souvent en position 3 et 5, et les sucres les plus fréquents sont
monosaccharides : glucose, galactose, rhamanose et arabinose et/ou des di
et tri saccharides formés par combinaison de monosaccharides
cités ci-haut.
Dans la nature tous les groupes hydroxyles d'un anthocyane ne
sont pas glucosylés, un groupe hydroxyle libre étant
nécessaire pour générer toutes les gammes des couleurs
responsables de pigmentation de fleurs et de fruits.
3° Les acides acylés
Les sucres à leur tour peuvent être acylés
par les acides : l'acide para- coumarique, l'acide caféique,
l'acide ferulique, l'acide cinnamique ou encore l'acide malonique.
I.4.4.Propriétés physico-chimiques
Comme tous les flavonoïdes, les anthocyanes
possèdent deux bandes caractéristiques d'absorption dans le
domaine U.V-Visible (MARKHAM K. R., 1982). Le tableau ci-dessous donne les
bandes d'absorption d'anthocyanes dans l'U.V-Visible.
Tableau I-1: bandes caractéristiques
d'absorption d'anthocyanes dans le domaine U.V-Visible.
|
Bande I (UV)
|
Bande II (Visible)
|
|
270-280 nm
|
465-560 nm
|
Les pigments d'anthocyanes sont solubles dans l'eau, les
alcools et instables en milieu neutre ou alcalin.
Ces pigments sont sensibles à plusieurs
paramètres physico-chimiques tels que : la température, la
lumière et le pH ainsi qu'aux oxydations enzymatiques, etc.
Si les pigments anthocyaniques sont protégés
naturellement dans leur environnement cellulaire végétal, une
fois extraits, ils deviennent très instables.
Les anthocyanes ou anthocyanines sont aussi connues pour leurs
propriétés anti-oxydantes, favorables à la santé et
notamment contre le vieillissement cellulaire en améliorant
l'élasticité et la densité de la peau (MPIANA et
al, 2010).
I.4.5.
Réactivité des anthocyanes, effet de pH
Le premier facteur agissant sur le changement de couleur d'un
anthocyane donné est l'effet de pH. La variation de structure de
l'anthocyane en fonction du pH est une particularité de ces
molécules.
Dans la solution aqueuse d'anthocyane à pH très
acide, ces molécules ont une coloration qui décroît quand
le pH augmente vers la neutralité. Ces changements de couleur sont dus
à des équilibres chimiques entre différentes formes que
peut prendre l'anthocyane.
L'étude cinétique de ces équilibres par
le professeur Brouillard a permis d'établir le mécanisme
suivant:

Schéma I-2 : l'effet de pH sur la
réactivité des anthocyanes.
Le passage d'une forme à l'autre fait intervenir
plusieurs types d'équilibres chimiques réversibles (R.
BROUILLARD, 1977).
I.4.6.
Les réactions de transfert de protons
Ce sont des équilibres acido-basiques, très
rapides (temps de relaxation de l'ordre de la microseconde), qui transforment
le cation flavylium AH2+ en bases quinoniques AH par
perte de proton. La réaction n'est possible qu'en présence d'un
groupement hydroxyle libre en position 4', 5 ou 7.
Ces bases quinoniques sont thermodynamiquement instables, et
se transforment en hémiacétal et en chalcone par
l'intermédiaire de la forme AH2+.
En présence d'un deuxième groupement hydroxyle,
une deuxième déprotonation est possible, conduisant aux bases
quinoniques ionisées A-. Les transferts de protons sont
conditionnés par le pH (les formes tautomères AH
prédominent à des pH compris entre 3,5 et 6,0 et les formes
tautomères A- apparaissent à des pH supérieurs
à 6,0 (R. BROUILLARD, 1977).
Chapitre II
MATERIELS ET METHODES
II.1.Récolte et conditionnement du matériel
végétal
Le matériel végétal constitué des
bulbes d'Hypoxis angustifolia a été
récolté à SANGA MAMBA dans la commune de NGALIEMA et celui
des feuilles d'Ipomoea batatas a été
récolté à MATADI MAYO dans la commune de Mont NGAFULA.
Ces échantillons
récoltés ont été identifiés à
l'herbarium de l'institut national des études et recherches
agronomiques (INERA) situé au département de biologie à la
faculté des sciences de l'université de Kinshasa.
Les échantillons ont été
séchés à la température du laboratoire à
#177;27°C pendant deux semaines puis pulvérisés au broyeur
de marque Warning commercial (Moulinex).
II.2.Screening chimique
Dix grammes de poudre sont macérés dans 100 ml
d'eau distillée pendant 24 heures, puis filtrés. Le filtrat
constitue l'extrait aqueux.
Dix gramme de poudre sont macérées dans 50 ml de
méthanol pendant 24 heures. Après filtration on recueille un
filtrat organique.
II.3. Extraction des anthocyanes
Pour extraire les anthocyanes, nous avons pesé
séparément 100 g de poudre à l'aide d'une balance dans
chacun des deux échantillons que nous avons ensuite macéré
dans 500ml de méthanol acidifié à 1% avec HCl pendant
48heures à la température ambiante. Les macérés
obtenus ont été filtrés plusieurs fois puis
delipidés au du n-hexane et les extraits anthocyaniques obtenus ont
été séché à l'étuve à
40°C pendant 48 heures. Le schéma II-1 suivant donne la
procédure d'extraction des anthocyanes.
Poudre des feuilles d'Ipomoea batatas ou
d'Hypoxis angustifolia
Macération dans le méthanol acidifié (HCl
1%) pendant 48 heures
Filtration plusieurs fois avec des papiers filtres
Filtrat
Marc à écarter
Concentration du filtrat à l'évaporateur rotatif
Délipidation dans le n-hexane
Phase n-hexanique à écarter
Phase méthanolique
Séchage du concentré à l'étuve
à 40°C
Extrait d'anthocyanes
Schéma II-1 : Schéma
d'extraction des anthocyanes
II.4. Activité biologique
Les solutions d'extraits totaux (1mg/ml) sont
préparées en dissolvants 5mg d'extraits totaux dans 5 ml d'eau
physiologique (NaCl 0,9%).
Pour chaque solution d'extraits, on confectionne les
préparations microscopiques en mélangeant respectivement une
goutte de sang, une goutte de méta-bisulfite de sodium
(Na2S2O5) à 2% et une goutte de la
solution de drogue.
Cette préparation est
recouverte par une lamelle, et les bords des lamelles sont enduits avec de la
paraffine en surfusion en vue de créer les conditions d'hypoxies
(MPIANA et al, 2007a, 2007b MPIANA et al, 2010b,
2010c, 2010d).
Après incubation, les
différentes préparations sont examinées au microscope
optique de marque L1200B, au grossissement 40X puis digitalisées
à l'aide d'un appareil photographique de marque SAMSUNG/6.O MEGA
PIXELS.
II.5. Spectroscopie
UV-VISIBLE
On exprime l'absorbance par la loi de Lambert-Beer
par : A= ålc
Où å est le coefficient
d'extinction molaire.
Les mesures d'absorbance effectuées ont
été tirées d'un spectrophotomètre de marque
GENESY 20 thermo Spectrum.
II.5.1. Evaluation de la
stabilité photochimique et thermique
1° Principe de la méthode
Les essais de stabilités photochimiques et thermiques
sont respectivement réalisés en exposant les extraits au
rayonnement UV et la chaleur. Lors de la dégradation, la molécule
passe de l'état natif (forme naturelle) à l'état
dégradé (structure décomposée).
Cette décomposition de la
molécule a pour conséquence la modification de la composition du
milieu et de ses propriétés physico-chimiques, notamment son
absorption.
Les anthocyanes sont des molécules facilement
modifiables par des paramètres physico-chimiques. La modification de
l'absorption par la solution des anthocyanes est exploitée en
spectrophotométrie UV-Visible pour étudier sa
dégradation.
Mode opératoire
Ø Préparer 5 mg/ml de la solution aqueuse des
extraits d'anthocyanes et le placer dans les tubes à essai.
Ø Exposer à la lumière UV (365 nm)
à différentes longueurs d'ondes pendant des intervalles des temps
différents ou à l'étuve MEMMERT à
différentes températures la solution préparée.
Ø Après les traitements de la solution, mesurer
les absorbances pour chaque solution traitée.
2° Modèle théorique de la cinétique
de dégradation thermique des anthocyanes
La dégradation des anthocyanes, sous l'action de la
chaleur, peut être considérée comme une réaction
chimique au cours de laquelle une molécule d'anthocyane A
est décomposée irréversiblement, en une ou
plusieurs molécules désignées par
B selon le schéma suivant :
 (II-1) (II-1)
Où k est la constante de
vitesse.
La réaction de la dégradation est une
réaction de décomposition. Elle est d'ordre 1 et son
équation de vitesse est donnée par :
 (II-2) (II-2)
Où CA, k et t sont
respectivement la concentration de A, la constante de vitesse et le
temps de dégradation. En résolvant cette équation
différentielle on obtient :
 (II-3) (II-3)
Avec  la concentration initiale de A. la concentration initiale de A.
A la longueur d'onde où seule l'espèce
A absorbe, l'équation de Lambert-Beer s'écrit :
 (II-4) (II-4)
Alors
 (II-5) (II-5)
et  (II-6) (II-6)
La combinaison des équations (II-3), (II-4), (II-5) et
(II-6) donne :
 (II-7) (II-7)
E
O
t
Eo
 (II-8) (II-8)
Figure II-1: Evolution de
E en fonction de temps d'exposition à la chaleur selon la
relation II-8
Mais il se peut que le produit de dégradation absorbe
également à la même longueur d'onde que A. Dans ce
cas, l'équation de Lambert-Beer peut s'écrire
 (II-9) (II-9)
 (II-10) (II-10)
où
 (II-11)
(II-11)
 (II-12) (II-12)
où

on peut écrire

avec
 (II-13) (II-13)
où

 (II-14) (II-14)
Tenant de (14), l'équation (3) devient
 (II-15) (II-15)
où
 (II-16) (II-16)
ou encore

 (II-17) (II-17)
E
O
t
A >
B
E
O
t
B >
A
L'évolution de E en fonction du temps donne
les figures suivantes :
II.5.2. Evaluation de l'effet du pH
Pour
évaluer l'effet de pH sur la stabilité des anthocyanes, environ
100 ml de la solution anthocyanique sont repartis dans deux béchers
à raison de 50 ml par bécher. Le premier bécher sert
d'addition acide et le second d'addition basique. Pour l'addition acide nous
avons utilisé la solution HCl 1M et NaOH 1M pour l'addition basique.
Dans
chaque bécher nous avons ajouté goutte à goutte l'acide ou
la base jusqu'à environ 2 ml dans chaque bécher. Les valeurs
exactes de pH sont mesurées à l'ajout de chaque goutte à
l'aide d'un pH-mètre de marque pH ep+/HANNA en vue de
connaitre la valeur de pH obtenue.
A
chaque valeur de pH nous avons pris le spectre visible en vue d'étudier
l'effet de pH sur la stabilité des anthocyanes.
Chapitre III
RESULTATS ET DISCUSSIONS
III.1. Résultats du screening chimiques
Les résultats du screening chimique sont
résumés dans le tableau III-1 suivant.
Tableau III-1 : résultats du screening
chimiques de nos deux matériels végétaux.
|
Groupes chimiques recherchés
|
Réactifs utilisés
|
Observations
|
Résultats
|
|
H.angustifolia
|
I. batatas
|
|
Alcaloïdes
|
DRAGGENDOFF
|
Apparition d'un composé orangé à rouge
|
Positif
|
négatif
|
|
Composés phénoliques
|
BURTON
|
Coloration bleue intense
|
Positif
|
Positif
|
|
Anthocyanes
|
HCl 20%
|
A froid, la solution vire au rose et à chaud, il se
développe une coloration rouge violacée.
|
Positif
|
Positif
|
|
Flavonoïdes
|
SHINODA, Mg et alcool isoamylique.
|
Formation d'un film mince dans la couche surnageant de
coloration orangée.
|
Positif
|
Positif
|
|
Leuco anthocyanes
|
SHINODA et alcool isoamylique.
|
Le surnageant vire au rose foncée.
|
Négatif
|
Positif
|
|
Quinones dans la phase aqueuse
|
BORNTRÄGGER
|
Formation d'un complexe mauve
|
Positif
|
Positif
|
|
Quinones dans la phase organiques
|
BORNTRÄGGER
|
Apparition d'une coloration allant de l'orange à rouge
vif.
|
Positif
|
positif
|
|
Tanins
|
FeCl3 2%
|
Apparition d'une coloration verdâtre.
|
Négatif
|
Positif
|
|
Saponines
|
Test de mousse
|
Formation d'une mousse persistante.
|
Positif
|
Positif
|
|
Triterpenoïdes
|
LIEBERMANN
|
Apparition d'une coloration violète.
|
Positif
|
Négatif
|
|
Diterpénoïdes
|
H2SO4
|
Apparition d'une coloration mauve.
|
Positif
|
Négatif
|
|
Stéroïdes
|
LIEBERMANN
|
Apparition d'une coloration verte
|
Négatif
|
Positif
|
|
Coumarines
|
Lampe UV
|
Une fluorescence
|
Négatif
|
Positif
|
Il ressort du tableau III-1 que les bulbes d'Hypoxis
angustifolia contiennent des alcaloïdes ; des quinones, des
saponines, des triterpenoïdes ; des composés
phénoliques (des anthocyanes, des flavonoïdes, des tanins) et l'on
note l'absence totale des leuco anthocyanes, des stéroïdes et des
coumarines alors que les feuilles de Ipomoea batatas contiennent
alcaloïdes ; des coumarines ; des stéroïdes ;
des composés phénoliques(des anthocyanes, des flavonoïdes,
des leuco-anthocyanes) et l'on note l'absence totale des diterpenoïdes et
des triterpenoïdes.
La présence des anthocyanes dans les deux plantes est
une indication très intéressante. En effet MPIANA et ses
collaborateurs ont récemment démontré (2007 à 2010)
que l'activité antifalcémiante de quelque plantes congolaises
serait due aux anthocyanes, c'est pourquoi nous avons extrait et
évalué l'effet des anthocyanes sur la morphologie des
drépanocytes en condition d'hypoxie.
III.2. Rendement de
l'extraction
De 100 g de poudre d'Ipomoea batatas nous avons
obtenus 9,02 g d'extrais totaux d'anthocyanes sous une forme pâteuse soit
un rendement de 9,02% et de 100 g de poudre d'Hypoxis
angustifolia nous avons obtenus 5,05 g d'extraits totaux d'anthocyanes
sous une forme pâteuse soit un rendement de 5,05%. Le
méthanol acidifié permet d'améliorer le rendement
d'extraction des anthocyanes.
III.3. Effet des extraits d'anthocyanes sur la morphologie des
drépanocytes
L'effet antifalcémiante des extraits totaux a
été évalué grâce au test d'Emmel. Les figures
1, 2, 3 et 4 donnent les micrographies optiques des érythrocytes
falciformes avant et après traitement aux extraits totaux
d'anthocyanes.
Figure III-1 : Morphologie des drépanocytes du
sang témoin
Figure III- 2 : Morphologie des drépanocytes
traités aux anthocyanes d'I. batata (1mg/ml)
 
Figure III- 3 : Morphologie des drépanocytes du
sang témoin
Figure III- 4 : Morphologie des drépanocytes
traités aux anthocyanes d'H. angustifolia (1mg/ml)
 
Il ressort des figures III-1 et III- 3 que la majorité
des érythrocytes ont une forme falciforme confirmant que
l'échantillon est effectivement un sang SS.
Les figures III-2 et III-4 montrent qu'après
traitement, la quasi-totalité des érythrocytes reprennent la
forme normale biconcave. En effet, la modification de la forme des globules
rouges du sang SS est due essentiellement à la polymérisation de
la désoxy HbS.
Les anthocyanes, connues pour leur interaction avec les
protéines provoqueraient une réaction compétitive avec la
réaction de polymérisation.
Ce qui aurait pour conséquence le rétablissement
de la forme normale des globules rouges. Ces résultats confirment ceux
déjà obtenus avec les anthocyanes extraits d'autres plantes
utilisées en médecine traditionnelle congolaise contre la
drépanocytose (MPIANA et al, 2007a, b, c et d ; MPIANA et
al, 2008a, b, c ; MPIANA et al 2009, MPIANA et al 2010).
III.4. Spectres Visible des extraits d'anthocyanes
Les figures ci-dessous donnent les spectres visibles des
extraits totaux d'anthocyanes de deux plantes en solution aqueuse.

Figure III-5 : Spectre visible d'extraits totaux
d'anthocyanes d'Hypoxis angustifolia.

Figure III-6 : Spectre visible d'extraits totaux
d'anthocyanes d'Ipomoea batatas.
Il ressort dans ces figures que les extraits totaux
d'anthocyanes d'Hypoxis angustifolia présentent une absorption
maximale autour de 520 nm tandis que les extraits totaux d'anthocyanes
d'Ipomoea batatas présentent une bande d'absorption maximale
autour de 525 nm. Il est en effet connu que dans le domaine du visible
les anthocyanes donnent une bande comprise entre 465-560nm. Cette bande serait
due aux transitions ð ?ð* du noyau flavylium (K. R. MARKHAM, 1982). Ces
résultats montrent donc que les anthocyanes extraits de deux plantes
donnent des spectres conformes à ceux de la littérature. Ce qui
confirme que les extraits étudiés renferment des anthocyanes.
III.5. Effet de la lumière sur la stabilité des
extraits d'anthocyanes d'Hypoxis angustifolia et Ipomoea batatas
Etant donné que les bulbes d'Hypoxis
angustifolia et les feuilles d'Ipomoea batatas sont
généralement exposées au soleil après
récolte, nous avons voulu, également dans ce travail,
évaluer l'influence de la lumière sur la stabilité des
anthocyanes extraits de ces deux plantes. Pour y parvenir, nous avons pris des
spectres visibles à différents temps d'irradiation à la
lampe UV. Les figures ci-dessous donnent les spectres des extraits totaux
d'anthocyanes à différents temps d'irradiation.

Figures III-7 : Spectres visibles des extraits
totaux d'anthocyanes d'Hypoxis angustifolia avant et
après irradiation à différents temps sous la lampe UV
(à 366nm).

Figures III-8 : spectres visibles des extraits
totaux d'anthocyanes d'Ipomoea batatas avant et après
irradiation à différents temps sous la lampe UV (à
366nm).
Ces spectres montrent que l'exposition de la solution
d'anthocyanes à la lampe UV à différents temps modifie les
spectres des anthocyanes. Ces modifications spectrales indiquent
l'instabilité des anthocyanes vis-à-vis de la lumière en
général et de la lumière UV en particulier.
Il convient d'indiquer que la bande d'émission maximale
de la lumière solaire étant autour de 630 nm (MPIANA et
al, 2010), l'utilisation de la lumière UV (plus
énergétique) permet de provoquer une dégradation
accélérée des anthocyanes afin de simuler une probable
exposition au soleil pendant une durée plus longue.
Il ressort en effet de ces figures que, plus le temps
d'irradiation augmente, plus l'intensité de la bande
caractéristique diminue. Ce qui montre que la lumière induit les
modifications dans la structure des anthocyanes. Ces résultats
confirment ceux de MPIANA et ses collaborateurs sur l'instabilité des
anthocyanes extraits de plusieurs plantes utilisées contre la
drépanocytose en médecine traditionnelle congolaise (MPIANA et
al, 2009).
III.6. Effet de la chaleur sur la stabilité des
extraits d'anthocyanes d'Hypoxis angustifolia et Ipomoea batatas
Les extraits totaux d'anthocyanes d'Hypoxis
angustifolia et d'Ipomoea batatas ont
été mis à l'étuve à différentes
températures pendant des intervalles de temps bien
déterminés afin de voir l'influence de la chaleur sur leur
stabilité.
Les figures III-9 et III-10 ci-dessous donnent les spectres
visibles des extraits totaux d'anthocyanes de ces deux plantes avant et
après une heure de traitement thermique à différentes
températures d'exposition à l'étuve.

Figure III-9 : Spectres visibles des extraits
totaux d'anthocyanes d'Hypoxis Angustifolia
différentes températures d'exposition pour un temps constant
d'une heure

Figure III-10 : Spectres visibles des extraits
totaux d'anthocyanes d'Ipomoea batatas à
différentes température d'exposition pour un temps constant d'une
heure.
Ces figures montrent les modifications spectrales quand on
soumet les solutions d'anthocyanes à un traitement thermique aux
températures de 27°C, 100°C et 120°C pour une
durée d'une heure. En effet, pour une même concentration en
anthocyanes, on remarque une baisse d'absorbance à la longueur d'onde
maximale avec l'augmentation de la température. Pour les anthocyanes
d'Hypoxis angustifolia on observe même un
« red shift » puis finalement une disparition de la bande
caractéristique. Ce qui traduit une forte sensibilité des
anthocyanes vis-à-vis de la température.
Les spectres des figures III-9 et III-10 montrent clairement
une dégradation des anthocyanes à la chaleur. C'est pourquoi il
est nécessaire de conserver la solution d'anthocyanes à de
faibles températures et d'éviter des traitements comme la
décoction ou l'infusion pour les recettes en médecine
traditionnelle. Il convient de noter que ce comportement a déjà
été observé pour les anthocyanes extraits d'autres plantes
(MPIANA et al, 2007a, b, c et d ; MPIANA et al, 2008a,
b, c ; MPIANA et al 2009, MPIANA et al 2010).
Nous avons ensuite effectué une étude
cinétique de la thermodégradation de ces anthocyanes
c'est-à-dire suivre l'évolution de l'absorbance des extraits
totaux d'anthocyanes en fonction du temps à température
constante.
La longueur d'onde a été fixée à
520nm pour les extraits d'anthocyanes d'Hypoxis angustifolia
et à 525nm pour les extraits d'anthocyanes d'Ipomoea
batatas à différentes températures et à
différents temps. Les températures de 100 et 120 °C soit 373
et 393 K ont été retenues pour cette étude
cinétique. Les figures III-11, III-12, III-13 et III-14 donnent les
courbes d'évolution de l'absorbance en fonction du temps pour les deux
extraits anthocyaniques aux deux températures choisies.

Figure III-11 : Evolution de l'absorbance des
extraits anthocyaniques d'Hypoxis angustifolia en fonction du temps de
traitement thermique à 100°C à 520 nm.

Figure III-12 : Evolution de l'absorbance des
extraits anthocyaniques d'Hypoxis angustifolia en fonction du temps de
traitement thermique à 120°C à 520 nm.

Figure III-13 : Evolution de l'absorbance des
extraits anthocyaniques d'Ipomoea batatas en fonction du temps de
traitement thermique à 100°C à 525 nm.

Figure III-14 : Evolution de l'absorbance de la
solution anthocyaniques d'Ipomoea batatas en fonction du
temps de traitement thermique à 120°C à 525 nm.
Les figures III-11, III-12, III-13 et III-14 montrent une
diminution de l'absorbance des extraits d'anthocyanes en fonction du temps de
traitement thermique à 100°C (373 K) et 120°C (393K). La
diminution est rapide au début et va en ralentissant quand le temps
augmente. Cette diminution est plus prononcée à 120°C
qu'à 100°C indiquant que la thermo dégradation est plus
rapide à température élevée.
Ces courbes donnent la cinétique de
thermodégradation pour les extraits d'anthocyanes d'Hypoxis
angustifolia et d'Ipomoea batatas à la
longueur d'onde maximale et aux deux températures fixées. Les
points sur les courbes représentent les points expérimentaux
tandis les lignes représentent les courbes calculées en se basant
sur le modèle théorique pour une cinétique de premier
ordre où le réactif et le produit ont une certaine absorbance
à la longueur d'onde de travail (voir équation
II-17).
En effet, bien que les molécules d'anthocyanes n'ont
pas été isolées afin de connaître leurs masses
moléculaires pouvant nous permettre de calculer leurs
concentrations ; leur cinétique de thermodégradation peut
être obtenu en suivant tout simplement l'évolution de l'absorbance
en fonction du temps. En effet, selon la loi de lambert-Beer, l'absorbance de
ces solutions est directement liée à leur concentrations (MPIANA
et al, 2010 ; MPIANA et al, 2009). Ce qui peut nous
permettre d'évaluer les constantes de vitesse de
thermodégradation de ces anthocyanes. Les valeurs des constantes de
vitesse obtenues sont données dans le tableau suivant:
Tableau III-2 : Valeurs de constantes de vitesse
de thermodégradation
|
Extrait d'anthocyane
|
Température (K)
|
Constante de vitesse ( s-1)
|
|
Hypoxis angustifolia
|
373
|
26 10-3
|
|
393
|
38 10-3
|
|
Ipomoea batatas
|
373
|
28 10-3
|
|
393
|
51 10-3
|
Ces valeurs sont de même ordre de grandeur que celles
obtenues pour la cinétique de dégradation des anthocyanes
extraits d'autres plantes médicinales, notamment Justicia
secunda soient 15,7. 10-3 s-1 à 377 K et 16,7.
10-3 s-1 à 401 K (KASONGA, 2011). Mais elles sont
légèrement supérieures à celles de Mpiana et ses
collaborateurs pour les anthocyanes extraits de Ocimum basicum L.
(3,04. 10-4 s-1 à 373 K) et de Annona
senegalensis (8,7. 10-4 s-1 à 353 K et 11,0.
10-3 s-1 à 373 K) (MPIANA et al,
2010 ; MPIANA et al, 2011).
Il convient de noter que la thermodégradation des
anthocyanes extraits des fruits comestibles est par exemple
généralement étudiée pour simuler les conditions de
préparation de différents jus. Selon Cisse et ses collaborateurs,
la constante de thermodégradation des anthocyanes extraits des jus
d'orange est de l'ordre de 1,6 10-4 s-1 et des
anthocyanes des jus de roselle (H.sabdariffa L.) est quant à
elle de l'ordre de 0.7 10-4 s-1. Pour les extraits totaux
d'anthocyanes dont on ne connait pas encore la composition, les
paramètres de l'anthocyane généralement majoritaire, la
malvidine, sont utilisés dans les différents calculs (CISSE et
al, 2009).
III.7. Effet du pH sur la stabilité des extraits
d'anthocyanes d'Hypoxis angustifolia et d'Ipomoea batatas
Pour évaluer l'effet de pH sur les extraits totaux
d'anthocyanes nous, avons suivi l'évolution de l'absorbance en fonction
du pH à une longueur d'onde fixe. Les deux longueurs d'onde d'absorption
maximale ces deux extraits totaux d'anthocyanes ont été choisies
comme longueur d'onde de travail.
Les figures ci-dessous montrent l'influence du pH sur la
densité optique des extraits totaux d'anthocyanes d'Hypoxis
angustifolia et d'Ipomoea batatas respectivement
à 520 et 525 nm.

Figure III-15 : Evolution de l'absorbance en
fonction du pH des extraits d'anthocyanes d'Hypoxis
angustifolia à 520 nm.

Figure III- 16: Evolution de l'absorbance en
fonction du pH des extraits d'anthocyanes d'Ipomoea batatas
à 525 nm.
Il ressort clairement de ces figures que le pH modifie
sensiblement l'absorption des extraits d'anthocyanes à ces deux
longueurs d'onde d'absorption maximale. Cette modification des spectres
d'absorption des anthocyanes extraits d'Hypoxis angustifolia
et d'Ipomoea batatas indique l'influence de ce
paramètre physico- chimique sur la stabilité des anthocyanes.
Ces courbes donnent l'allure des courbes de titrage d'un
polyacide par une base. En effet, il est connu que les anthocyanes participent
à plusieurs équilibres acido-basiques (R. BROUILLARD, 1977). En
effet, le cation flavylium qui est le noyau de base d'anthocyanes peut
être symbolisé par AH2+. Il peut se
transformer en bases quinoniques AH par perte de proton par une réaction
très rapide avec un temps de réaction de l'ordre de la
microseconde. Une telle réaction n'est possible qu'en présence
d'un groupement hydroxyle libre en position 7, 4' ou 5 (voir
Schéma I-2).
Ces bases quinoniques sont thermodynamiquement instables, et
se transforment en hémiacétal et en chalcone par
l'intermédiaire de la forme AH2+. En
présence d'un deuxième groupement hydroxyle, une deuxième
déprotonation est possible, conduisant aux bases quinoniques
ionisées A-. Les transferts de protons sont
conditionnés par le pH (les formes tautomères AH
prédominent à des pH compris entre 3,5 et 6,0 et les formes
tautomères A- apparaissent à des pH supérieurs
à 6,0 (R. BROUILLARD, 1982).
CONCLUSION
L'objectif de ce présent travail était
d'apporter une contribution à l'étude de l'activité anti
drépanocytaire des anthocyanes extraits des bulbes d'Hypoxis
angustifolia et des feuilles d'Ipomoea batatas et de voir
l'effet de la lumière, de la température et du pH sur la
stabilité de ces pigments.
Le screening chimique que nous avons réalisé sur
ces plantes a révélé les que bulbes de Hypoxis
angustifolia sont très riches en composé phénoliques
(des anthocyanes, des flavonoïdes, des tanins), des alcaloïdes,
saponines, triterpenoïdes et l'on note l'absence totale des leuco
anthocyanes, des stéroïdes et des coumarines ; alors que les
feuilles de Ipomoea batatas sont très riches composés
phénoliques (des anthocyanes, des flavonoïdes, des leuco-
anthocyanes) et l'on note l'absence totale des diterpenoïdes et des
triterpenoïdes.
La poudre des feuilles d'Ipomoea batatas a
donné 9,02% d'extraits totaux d'anthocyanes sous forme d'une masse
pâteuse tandis que celle des bulbes d'Hypoxis angustifolia a
donné 5,05% d'extraits totaux d'anthocyanes.
Les tests in vitro de l'activité
antifalcémiante ont montré qu'en présence de metabisulfite
de sodium (Na2S2O5) 2%, les extraits totaux
d'anthocyanes d'Hypoxis angustifolia et d'Ipomoea
batatas, les drépanocytes reprennent la forme normale biconcave.
Ainsi les anthocyanes seraient effectivement responsables de cette
activité comme c'est le cas pour les autres plantes anti
drépanocytaires utilisée en médecine traditionnelle en
République Démocratique du Congo.
Les anthocyanes extraits d'Hypoxis
angustifolia et d'Ipomoea batatas sont instables au
rayonnement UV, à la chaleur et au pH. La cinétique de la
thermodégradation des anthocyanes extraits de ces deux plantes a
été étudiée. Elle répondrait au
modèle cinétique d'ordre un et les valeurs des constantes de
vitesse ont été calculées.
Ainsi, au terme de ce travail, nous avons montré que
les feuilles d'Ipomoea batatas ou patate douce, une plante
alimentaire bien connue, possèdent une activité
antifalcémiante in vitro. Comme pour les cas d'autres plantes
congolaises déjà étudiées, les anthocyanes seraient
parmi les métabolites responsables de cette propriété
pharmacologique.
Il est donc souhaitable qu'une étude soit
réalisée sur ces deux plantes en vue d'évaluer
l'activité anti drépanocytaire à l'aide d'autres tests
biologiques.
Nous suggérons également que les tests
bio-guidés soient réalisés afin de déterminer les
molécules responsables de l'activité biologique et que leur
structures soient élucidées. Une étude de la
stabilité physico-chimique de ces molécules pourrait aussi
être réalisée.
Références
Bibliographie
§ BOKOTA MT. Etude de l'activité
antifalcémiante et de la stabilité physico-chimique des
anthocyanes de quelques espèces des genres Justicia, Ficus et
Annona récoltées dans le districs de la Tshopo et de
l'Ituri en RD Congo. Thèse de Doctorat, Faculté des Sciences,
Université de Kisangani, 2012.
§ BONGENDE, P. Essai d'évaluation in
vitro de l'activité antidrépanocytaire des feuilles
d'Alchornea cordifolia, Mémoire de licence, Département
de Biologie, Faculté des sciences, Université de Kinshasa, 2005.
§ BROUILLARD R. Chemical structure of anthocyanins. p1-40.
In: P. Markakls (ed.) anthocyanins as Food Colors. Academic Press,
New York, USA1982.
§ BROUILLARD R ET DELAPORTE R, J.
Am. Chem. Soc., (1977), 99, 8461-8468.
§ CISSE M, VAILLANT F, Acosta O, Dhuique-Mayer C, Dornier
M. Thermal Degradation Kinetics of Anthocyanins from Blood Orange, Blackberry,
and Roselle Using the Arrhenius, Eyring, and Ball Models, J. Agric. Food
Chem, 2009,57 : 6285-6291.
§ HARBORNE JB.Comparative Biochemistry of the Flavonoids,
Academic Press, New York, (1967): 1-30.
§ KASONGA KT.. Contribution à l'étude
chimique des anthocyanes extraits des feuilles de Justicia secunda
Vahl(Acanthaceae) sur le comportement de l'hémoglobine S,
Mémoire de DEA, Faculté des Sciences, Université de
Kinshasa, 2011.
§ MALIEN A.C., colorant à base
d'anthocyanes : Composition en pigments et mécanismeschimiques
associés à la stabilité de la couleur, Thèse de
doctorat, Université de Sorbonne, 2001.
§ MARKHAM K. R., Techniques of Flavonoid Identification,
Academic Press, London (1982), 36-51.
§ MATA GN. Contribution à l'étude de
l'activité antidrépanocytaire et de la stabilité thermique
des anthocyanes extraites des feuilles de Hymenocardia acida Tul
(Hymenocardiaceae), mémoire de licence, departement de chimie,
faculté des sciences, Université de Kinshasa, 2006.
§ MIDI, D.F. Etude de l'activité
anti-drépanocytaire et de la stabilité photochimique des
anthocyanes des écorces des racines d'annona senegalensis,
Mémoire de Licence, Département de Chimie, Faculté des
sciences, 2006.
§ MOHAMMAD ABYARI, REZA HEIDARI and RASHID JAMEI. The
effect of Heating, UV Irradiation and pH on Stability of Siahe Sardasht Grape
Anthocyanin-copigment Complex.Journal of Biological Sciences,
2006:6(4), 638-645.
§ MARIEB E.N., Anatomie et physiologie humaine,
édition renouveau Pédagogique Inc, Paris, 1999 : pp
637638.
§ MPIANA PT, NGBOLUA KN, MUDOGO V, TSHIBANGU DST, ATIBU
EK, MBALA BM, KAHUMBA B, BOKOTA MT, MAKELELE LT. The potential effectiveness of
medicinal plants used for the treatment of sickle cell disease in the
Democratic Republic of Congo folk medicine: A review. In: V.K. Gupta
and G.D. Singh, Traditional and Folk herbal Medicine , Daya Publishng
House, New , 2012,1:1-11
§ MPIANA PT, NGBOLUA KN, MUDOGO V, TSHIBANGU DST, MBALA
BM, ATIBU EK, TSHILANDA DD, DIANZENZA E, KAKULE MK. Antisickling properties,
thermal and photochemical degradation of the anthocyanins extracted of
Annona senegalensis from D R Congo .Int. J. Biol.Chem.Sci.
2012,6(5) 2241-2251
§ MPIANA PT, NGBOLUA KN, MUDOGO
V, TSHIBANGU DST, ATIBU EK, TSHILANDA DD and MISENGABU NM. Anti sickle
erythrocytes haemolysis properties and inhibitory effect of anthocyanins
extracts of trema orientalis (ulmaceae) on the aggregation of human
deoxyhemoglobin s in vitro. J Med Sci, 2011,
11(3):129-137
§ MPIANA PT. Biophysique Médicale, tome I,
2ème Edition revisée Resud Edition, Kinshasa, 2010.
§ NGBOLUA KTN, Evaluation de l'activité
anti-drépanocytaire et antipaludique de quelques taxons
végétaux de la R.D. Congo et Madagascar. Thèse de
Doctorat, Departement de biologie, Faculté des Sciences,
Université de Kinshasa, 2012.
§ ONYAMBOKO, Substances naturelles. Notes de cours
L2 chimie, Departement de chimie, Faculté des siences
2011-2012.
§ MPIANA P .T., L.K. MAKELELE, R.W.OLEKO ,
M.T.BOKOTA, D.S.T. TSHIBANGU, K.N. NGBOLUA, M.B. MBALA, E.K. ATIBU and S.M.
NSIMBA, , Antisickling activity of medicinal plants used in the management of
Sickle cell Disease in Tshopo district, D.R.Congo, Australian Journal of
Medical Herbalism 22(4),132-137, 2010.
§ MPIANA P.T., V. MUDOGO, K.N. NGOLUA, D.ST. TSHIBANGU
and E.K. ATIBU, In vitro Antisickling Activity of Anthocyanins
Extracts from Morinda lucida Benth (Rubiaceae), In: V.K. Gupta and
G.D. Singh, Medicinal Plants: Phytochemistry, Pharmacology and
Therapeutics, Daya publishing house, Delhi, p 330-337, 2010.
§ MPIANA P.T., V.MUDOGO,
D.S.T.TSHIBANGU, K.N.NGBOLUA, P.K.MANGWALA, E.K. ATIBU, M.K.KAKULE, L.K.
MAKELELE and M.T.BOKOTA, Antisickling Activity and Thermodegradation of an
Anthocyanin fraction from Ocimum basilicum L. (Lamiaceae),
Comp.Bio.Nat. Prod. Vol.3: Effects, safety & clinical Evaluation (part II)
VK Gupta (Ed): STUDIUM PRESS LLC, USA, 279-287,
2010.
§ MPIANA
P.T., K.N.NGBOLUA, E.K. ATIBU, T.M KASONGA, M.T. BOKOTA. V.MUDOGO, , In
vitro effects of anthocyanins extracts from Justicia secunda VAHL
on the solubility of hemoglobin S and membrane stability of sickle
erythrocytes. Blood transfusion, 8:248-254,
2010.
§ MPIANA P.T., M.T. BOKOTA,MBL NDJELE, V MUDOGO, DST
TSHIBANGU, KN NGBOLUA, EK ATIBU,JTK KWEMBE and LK MAKELELE, Antisickling
activity of three species of justicia from Kisangani (DR Congo): J.tenella,
J. gendarussa and J.insularis , Int.J.Biol. Chem. Sci. ,
4(6)1953-1961, 2010.
§ MPIANA PT, V. MUDOGO , Y.F. KABANGU, D.S.T. TSHIBANGU,
K.N. NGBOLUA, E.K.ATIBU, K.P. MANGWALA, M.B. MBALA, L.K. MAKELELE., M.T.
BOKOTA, Antisickling Activity and Thermostability of Anthocyanins Extract from
a congolese plant, Hymenocardia acida Tul. (Hymenocardiaceae), Int. J.
Pharmacol. 5 (1), 65 - 70, 2009.
§ MPIANA P.T., V.MUDOGO, D.S.T.TSHIBANGU, K.N.NGBOLUA,
E.K. ATIBU, J.N. KANKOLONGO, A.K. MBONGO. Antisickling activity and
photodegradation effect of anthocyanins extracts from Alchornea
cordifolia (SCHUMACH & Thonn.) and
Crotalaria retusa, Ann. Afr. Med 2(4)
239-244, 2009.
§ MPIANA P.T.,V.MUDOGO, D.S.T.TSHIBANGU, K.N.NGBOLUA,
E.K. ATIBU E K.N.NGBOLUA , E.K KITWA, AB KANANGILA, L.K. MAKELELE,
Activité antifalcémiante et thermodégradation d'une
fraction d'anthocyanes extraite de Zizuphus mucronata, Ann. Afr.
Med ,2(2) 91- 97 ,2009.
§ MPIANA P.T., E.K.BALANGANYI , A.B.
KANANGILA , E. M. KALONDA, K.N. NGBOLUA, D.S.T.
TSHIBANGU, E.K. ATIBU et J.B.S. LUMBU, Activité
antidrépanocytaire et thermodégradation des anthocyanes extraits
de Sterculia quinqueloba et Ficus capensis, Int. J. Biol. Chem.
Sci. 3(3): 551-560, 2009.
§ MPIANA P.T., V.MUDOGO, D.S.T.TSHIBANGU, K.N.NGBOLUA,
E.K. ATIBU, E.K.KITWA and A.B.KANANGILA. Antisickling activity of
anthocyanins extracts of Vigna unguiculata ( L.)Walp.
Recent Progress in Medicinal Plants.25, 91-98, 2009.
§ MPIANA P.T., V.MUDOGO, D.S.T.TSHIBANGU, K.N.NGBOLUA,
D.D. TSHILANDA and E.K. ATIBU. Antisickling activity of anthocyanins
of Jatropha curcas L. Recent Progress in Medicinal Plants.25,
101-108, 2009.
§ MPIANA P.T., EK KITWA, AB KANANGILA, DST TSHIBANGU, KN
NGBOLUA, EK ATIBU, EM KALONDA. Influence de la photodégradation sur
l'activité antifalcémiante des anthocyanes extraits de quelques
plantes de Lubumbashi (RD Congo). Ann. Fac. Sci. 1 : 45-53 ,
2009.
§ MPIANA PT, EK KITWA, AB KANANGILA, DST TSHIBANGU, KN
NGBOLUA, EK ATIBU, EM KALONDA. Activités antifalcémiantes de
quelques plantes médicinales de Lubumbashi (RD Congo). Ann. Fac.
Sci 1 :103-112, 2009.
§ MPIANA P.T., V.MUDOGO, D.S.T.TSHIBANGU, E.K.KITWA,
A.B.KANANGILA , J.B.S. LUMBU, K.N.NGBOLUA, E.K. ATIBU and M.K. KAKULE.
Antisickling activity of anthocyanins from Bombax pentadrum,Ficus
capensis anv Ziziphus mucronata: Photodegradation effect.
Ethnopharmacology, 120,413-418, 2008.
§ MPIANA P.T., V.MUDOGO, K.N.NGBOLUA, D.S.T. TSHIBANGU,
O.M. SHETONDE, M.B.MBALA. In vitro antisickling activity of
anthocyanins from Ocimum basilicum L.(Lamiaceae). International
journal of pharmacology 3(4)371-374, 2007.
§ MPIANA. P.T, V. MUDOGO, D.S.T. TSHIBANGU, O.M.
SHETONDE, K.N. NGBOLUA & M.B.MBALA. Antisickling activity of some Congolese
plants, in: Drug discovery from African flora, The 12th Symposium of
the Natural Product Research Network for Eastern and Central Africa, July
22-26; University of Makerere, Kampala, Uganda, p.45 (PS-6),
2007.
§ MPIANA P.T., V.MUDOGO, D.S.T. TSHIBANGU, K.N.NGBOLUA,
O.M. SHETONDE, K.P. MANGWALA and B.K. MAVAKALA. In vitro antisickling
activity of anthocyanins extract of a Congolese plant: Alchornea
cordifolia M.Arg. J.Med.Sci 7(7)1182-1186,
2007.
§ MPIANA P.T., D.S.T. TSHIBANGU, O.M. SHETONDE,
K.N.NGBOLUA. In vitro antidrepanocytary activity (anti-sickle cell
anemia) of some congolese plants, Phytomedecine 14,192-195,
2007 .
§ TORSKANGERPOLL K. and OYVIND M.ANDERSEN. Colour
stability ofanthocyanin in aqueous solutions atvarious pH values. Journal
of Food Chemistry, 89, 427-440, 2005.
§ TSHILANDA DD, Contribution à l'étude de
l'activité antifalcémiante et détermination de la
structure des huiles essentielles de Ocimum basilicum, Mémoire
de DEA, Departement de chimie, Faculté des Sciences, Université
de Kinshasa ,2011.
§ SCHAFFLER, A.et MENCE, N.
AnatomiePhysiologieBiologie, 2ème édition, Maloine,
Paris, p. 239, 2004.
§ SOFOWORA EA & W.A. Isaac, LIoydia, 38 :169,
1971.
1. Webographie
§ Anonymes,
http://www.diffusciences.com/
pages/med.acces/encyclo/leSang.html, 2012.
§ Anonymes, http:// www.greenpeace.org, 2012.
§ ENCARTA, 2009, Encyclopédie Microsoft.
§ ETAME, E., le 17 juillet 2007, un médecin
camerounais va en guerre contre la drépanocytose, Yaoundé,
http : // www. Cameroun-info.net.
§ GALACTEROS, F., 2004, Et la drépanocytose,
Journal Afrik. http : // www. Afrik.com / article 7027 (le
25/08/20012).
TABLE DES MATIERES
DEDICACE
i
REMERCIEMENTS
ii
INTRODUCTION
1
Chapitre I
LES GENERALITES
3
I.1. LE
SANG..................................................................................................................................................
4
I.1.1.Définition
4
I.1.2. Composition et fonction du
sang
4
I.1.3. Les globules rouges
4
I.1.4. Hémoglobine
5
I.2. LA
DREPANOCYTOS....................................................................................
6
I.2.1. Définition
(Anonyme, 2012 ; MPIANA et al, 2008)
6
I.2.2. Base moléculaire de la
drépanocytose
7
I.2.3. Symptômes de la
drépanocytose (MPIANA et al, 2007a-
2010).
7
I.2.4. Dépistage
8
I.2.5. Traitements
8
I.3. LES PLANTES
MEDICINALES........................................................................................................
9
I.3.1. Définition
9
I.3.2. Quelques groupes chimiques des
plantes médicinales
9
I.3.3. Position systématique et
description botanique des plantes utilisées.
10
I.4. LES
ANTHOCYANES........................................................................................................................
13
I.4.1. Définition
13
I.4.2. Localisation et
biosynthèse des anthocyanes
13
I.4.3.Constituants chimiques des
anthocyanes
13
I.4.4.Propriétés
physico-chimiques
14
I.4.5. Réactivité des
anthocyanes, effet de pH
15
I.4.6. Les réactions de transfert de
protons
16
Chapitre II
MATERIELS ET METHODES
...............
3
II.1.Récolte et conditionnement du
matériel
végétal.............................................................................
17
II.2.Screening chimique
17
II.3. Extraction des
anthocyanes
17
II.4. Activité
biologique
18
II.5. Spectroscopie UV-VISIBLE
19
II.5.1. Evaluation de la stabilité
photochimique et thermique
19
1°Principe dela
methode.........................................................................................19
2° Modèle théorique de la
cinétique de dégradation thermique des
anthocyanes......................
20
II.5.2. Evaluation de l'effet du
pH...........................................................................................................
22
Chapitre III
RESULTATS ET
DISCUSSIONS.....................................................................................................................
3
III.1. Résultats du screening
chimiques
23
III.2. Rendement de
l'extraction
24
III.3. Effet des extraits d'anthocyanes sur
la morphologie des drépanocytes
24
III.4. Spectres Visible des extraits
d'anthocyanes
25
III.5. Effet de la lumière sur la
stabilité des extraits d'anthocyanes d'Hypoxis
angustifolia et Ipomoea batatas
27
III.6. Effet de la Chaleur sur la
stabilité des extraits d'anthocyanes d'Hypoxis
angustifolia et Ipomoea batatas
28
III.7. Effet du pH sur la stabilité
des extraits d'anthocyanes d'Hypoxis angustifolia et
Ipomoea batatas
34
CONCLUSION......................................................................................................................................................
36
Références...............................................................................................................................................................
38
1. Bibliographie
38
2.Webographie
42
TABLE DES
MATIERES...................................................................................................................................
43
ANNEXE.................................................................................................................................................................
45
ANNEXE
Tableau 1 : Données spectrales des extraits
totaux d'anthocyanes.
|
Hypoxis angustifolia
|
Ipomoea batatas
|
|
ë (n m)
|
Absorbance
|
ë (n m)
|
Absorbance
|
|
500
|
0,955
|
500
|
1,036
|
|
505
|
1,040
|
505
|
1,225
|
|
510
|
1,550
|
510
|
1,305
|
|
515
|
1,650
|
515
|
1,350
|
|
520
|
1,801
|
520
|
1,400
|
|
525
|
1,700
|
525
|
1,770
|
|
530
|
1,600
|
530
|
1,520
|
|
535
|
1,551
|
535
|
1,410
|
|
540
|
1,410
|
540
|
1,330
|
|
545
|
1,350
|
545
|
1,330
|
|
550
|
1,311
|
550
|
1,295
|
|
555
|
0,998
|
555
|
1,225
|
|
560
|
0,855
|
560
|
1,205
|
|
565
|
0,815
|
565
|
1,150
|
|
570
|
0,735
|
570
|
1 ,101
|
|
575
|
0,700
|
575
|
1,091
|
|
580
|
0,660
|
580
|
1,085
|
|
585
|
0,580
|
585
|
1,055
|
|
590
|
0,525
|
590
|
1,005
|
|
595
|
0,475
|
595
|
0,995
|
|
600
|
0,475
|
600
|
0,965
|
Tableau 2 : Données spectrales des extraits
d'anthocyanes avant et après irradiation sous la lampe UV à
différents temps.
|
Hypoxis angustifolia
|
Ipomoea batatas
|
|
ë (n m)
|
Absorbance
|
|
Absorbance
|
|
ND
|
30min
|
60min
|
90min
|
120min
|
ë (n m)
|
ND
|
30min
|
60min
|
90min
|
120 min
|
|
500
|
0,955
|
0,930
|
0,926
|
0,915
|
0,890
|
500
|
1,036
|
1,005
|
1,000
|
0,978
|
0,968
|
|
505
|
1,040
|
0,960
|
0,948
|
0,920
|
0,889
|
505
|
1,225
|
1 ,210
|
1,101
|
1,000
|
0,976
|
|
510
|
1,550
|
0,978
|
0,950
|
0,925
|
0,879
|
510
|
1,305
|
1,295
|
1,201
|
1,105
|
0,987
|
|
515
|
1,650
|
1,101
|
1,09
|
0,952
|
0,868
|
515
|
1,350
|
1,300
|
1,291
|
1,221
|
0,995
|
|
520
|
1,805
|
1,201
|
1,100
|
0,985
|
0,878
|
520
|
1,40
|
1,391
|
1,300
|
1,290
|
1,165
|
|
525
|
1,702
|
1,46
|
0,997
|
0,975
|
0,950
|
525
|
1,77
|
1,521
|
1,445
|
1,389
|
1,258
|
|
530
|
1,609
|
1,405
|
0,965
|
0,961
|
0,948
|
530
|
1,52
|
1,411
|
1,315
|
1,285
|
1,151
|
|
535
|
1,559
|
1,345
|
0,859
|
0,849
|
0,890
|
535
|
1,41
|
1,309
|
1,295
|
1,207
|
1,105
|
|
540
|
1.410
|
1,29
|
0,825
|
0,800
|
0,790
|
540
|
1,33
|
1,295
|
1,281
|
1,165
|
0,985
|
|
545
|
1,350
|
1,235
|
0,815
|
0,798
|
0,789
|
545
|
1,33
|
1,290
|
1,201
|
1,091
|
0,975
|
|
550
|
1,310
|
1,175
|
0,775
|
0,765
|
0,762
|
550
|
1,295
|
1,189
|
0,999
|
1,035
|
0,969
|
|
555
|
0,998
|
0,951
|
0,752
|
0,745
|
0,761
|
555
|
1,225
|
1,150
|
0,998
|
1,03
|
0,899
|
|
560
|
0,855
|
0,831
|
0,740
|
0,735
|
0,759
|
560
|
1,205
|
1,149
|
0,997
|
1,015
|
0,891
|
|
565
|
0,815
|
0,821
|
0,691
|
0,685
|
0,675
|
565
|
1,15
|
1,003
|
0,996
|
1,055
|
0,885
|
|
570
|
0,735
|
0,700
|
0,651
|
0,648
|
0,639
|
570
|
1 ,10
|
1,001
|
0,995
|
0,985
|
0,871
|
|
575
|
0,700
|
0,691
|
0,672
|
0,645
|
0,634
|
575
|
1,091
|
0,998
|
0,991
|
0,975
|
0,791
|
|
580
|
0,669
|
0,64
|
0,610
|
0,605
|
0,604
|
580
|
1,085
|
0,995
|
0,983
|
0,950
|
0,783
|
|
585
|
0,580
|
0,520
|
0,510
|
0,500
|
0,595
|
585
|
1,055
|
0,978
|
0,974
|
0,945
|
0,775
|
|
590
|
0,525
|
0,495
|
0,481
|
0,479
|
0,565
|
590
|
1,005
|
0,977
|
0,971
|
0,93
|
0,745
|
|
595
|
0,475
|
0,456
|
0,435
|
0,425
|
0,525
|
595
|
0,995
|
0,976
|
0,969
|
0,925
|
0,735
|
|
600
|
0,475
|
0,440
|
0,410
|
0,400
|
0,489
|
600
|
0,965
|
0,975
|
0,965
|
0,925
|
0,729
|
ND : Non Dégradé
Tableau 3 : Données spectrales des extraits
d'anthocyanes avant et après 1 heure traitement thermique.
|
Hypoxis angustifolia
|
Ipomoea batatas
|
|
ë (n m)
|
Absorbance
|
ë (n m)
|
Absorbance
|
|
27°C
|
100°C
|
120°C
|
27°C
|
100°C
|
120°C
|
|
500
|
0,955
|
0,935
|
0,922
|
500
|
1,036
|
0,972
|
0,968
|
|
505
|
1,04
|
0,995
|
0,949
|
505
|
1,225
|
1,205
|
1,190
|
|
510
|
1,55
|
1,200
|
0,958
|
510
|
1,305
|
1,295
|
1,195
|
|
515
|
1,65
|
1,228
|
0,965
|
515
|
1,350
|
1,309
|
1,279
|
|
520
|
1,8
|
1,308
|
0,980
|
520
|
1,40
|
1,350
|
1,307
|
|
525
|
1,7
|
1,408
|
1,009
|
525
|
1,77
|
1,435
|
1,309
|
|
530
|
1,60
|
1,417
|
1,025
|
530
|
1,52
|
1,435
|
1,387
|
|
535
|
1,55
|
1,390
|
1,023
|
535
|
1,41
|
1,089
|
1,075
|
|
540
|
1,41
|
1,208
|
0,922
|
540
|
1,33
|
1,083
|
0,953
|
|
545
|
1,35
|
1,065
|
0,921
|
545
|
1,33
|
0,982
|
0,950
|
|
550
|
1,31
|
0,954
|
0,915
|
550
|
1,295
|
0,981
|
0,940
|
|
555
|
0,998
|
0,943
|
0,915
|
555
|
1,225
|
0,980
|
0,935
|
|
560
|
0,855
|
0,831
|
0,805
|
560
|
1,205
|
0,979
|
0,934
|
|
565
|
0,815
|
0,809
|
0,805
|
565
|
1,150
|
0,978
|
0,930
|
|
570
|
0,735
|
0,708
|
0,704
|
570
|
1 ,101
|
0,977
|
0,925
|
|
575
|
0,7
|
0,696
|
0,698
|
575
|
1,091
|
0,971
|
0,921
|
|
580
|
0,66
|
0,684
|
0,692
|
580
|
1,085
|
0,975
|
0,920
|
|
585
|
0,58
|
0,568
|
0,684
|
585
|
1,055
|
0,945
|
0,915
|
|
590
|
0,525
|
0,515
|
0,675
|
590
|
1,005
|
0,925
|
0,910
|
|
595
|
0,475
|
0,414
|
0,407
|
595
|
0,995
|
0,912
|
0,905
|
|
600
|
0,475
|
0,413
|
0,365
|
600
|
0,965
|
0,912
|
0,900
|
Tableau 4 : Variation de l'absorbance des extraits
d'anthocyanes en fonction du temps de traitement thermique pour T= 100°C
et 120°C autour des ëmax.
|
Hypoxis angustifolia
|
Ipomoea batatas
|
|
T= 100°C
|
T= 120°C
|
T= 100°C
|
T= 120°C
|
|
ëmax= 520nm
|
ëmax= 520nm
|
ëmax= 525nm
|
ëmax= 525nm
|
|
Temps en minutes
|
Densité optique
|
Temps en minutes
|
Temps en minutes
|
Temps en minutes
|
Densité optique
|
Temps en minutes
|
Temps en minutes
|
|
0
|
1,77
|
0
|
1,34
|
0
|
1,65
|
0
|
1,20
|
|
5
|
1,74
|
5
|
1,30
|
5
|
1,60
|
5
|
1,16
|
|
10
|
1,65
|
10
|
1,22
|
10
|
1,54
|
10
|
1,12
|
|
15
|
1,60
|
15
|
1,18
|
15
|
1,49
|
15
|
1,10
|
|
20
|
1,56
|
20
|
1,13
|
20
|
1,45
|
20
|
1,10
|
|
25
|
1,52
|
25
|
1,09
|
25
|
1,40
|
25
|
1,08
|
|
30
|
1,49
|
30
|
1,06
|
30
|
1 ,36
|
30
|
1,06
|
|
40
|
1,41
|
40
|
1,001
|
40
|
1,31
|
40
|
1,02
|
|
50
|
1,39
|
50
|
0,998
|
50
|
1,28
|
50
|
0,998
|
|
60
|
1,35
|
60
|
0,993
|
60
|
1,26
|
60
|
0,992
|
Tableau 5 : Donnés spectrales relatives
aux effets du pH sur la stabilité des anthocyanes autour des
ëmax.
|
Hypoxis angustifolia
|
Ipomoea batatas
|
|
pH
|
Absorbance
|
pH
|
Absorbance
|
|
2,2
|
0,902
|
2,3
|
0,901
|
|
2,4
|
0,903
|
2,7
|
0,901
|
|
2,6
|
0,903
|
3,2
|
0,901
|
|
3,0
|
0,902
|
3,2
|
0,901
|
|
3,3
|
0,902
|
3,4
|
0,904
|
|
4,0
|
0,903
|
4,0
|
0,906
|
|
4,3
|
0,905
|
4,3
|
0,907
|
|
4,6
|
0,906
|
4,9
|
0,907
|
|
5,0
|
0,907
|
5,2
|
0,91
|
|
5,9
|
0,915
|
5,9
|
0,919
|
|
6,4
|
0,915
|
6,3
|
0,921
|
|
6,8
|
0,915
|
6,8
|
0,921
|
|
7,1
|
0,941
|
7,3
|
0,935
|
|
8,3
|
1,000
|
8,4
|
0,991
|
|
9,2
|
1,010
|
9,1
|
0,991
|
|
10,4
|
1,020
|
10,2
|
0,991
|
|
11,3
|
1,030
|
11,6
|
1,001
|
|
12,1
|
1,020
|
12,1
|
1,002
|
|
12,7
|
1,030
|
12,9
|
1,004
|
|
13,4
|
1,030
|
13,2
|
1,004
|
|
|



