|

UNIVERSITE DE YAOUNDE I FACULTE DES
SCIENCES
The University of Yaoundé I Faculty of
Sciences
Département de Biologie et Physiologie
Animales
Department of Animal Biology and Physiology
Bio-écologie des anophèles de part et
d'autre de la falaise des Mbô et leur implication dans la transmission du
paludisme d'altitude
MEMOIRE
Présenté et soutenu en vue de l'obtention du
Diplôme d'Etudes Approfondies (DEA)
deBIOLOGIE ANIMALE
Option : Parasitologie
Par :
TENE FOSSOG Billy
Maître es Sciences
Sous la direction
de :
|
Dr. Timoléon TCHUINKAM
Chargé de Cours
Université de Dschang
|
Dr. Frédéric SIMARD
Chargé de recherche
IRD, Montpellier
|
Pr. Thomas NJINE
Professeur
Université de Yaoundé I
|
Année académique 2006-2007














DEDICACE
Je dédie ce travail à :
· Mesparents, Mr et Mme FOSSOG,
·
Messoeursetmonfrère :Viviane,LauretteetVerlaine ;
Pour toute l'affection et les sacrifices consentis
à mon égard, que ce travail en soit le couronnement.
REMERCIEMENTS
Ce travail a été réalisé à
l'OCEAC (Organisation de Coordination pour la lutte contre les Endémies
en Afrique Centrale), dans le Laboratoire de Recherche sur le Paludisme de
l'IRD (Institut de Recherche pour le Développement) avec le soutien
financier du programme JEA (Jeunes équipes associées) du
Département Soutien et Formation (DSF) de l'IRD. J'exprime ici ma
profonde gratitude à l'endroit de ces deux organisations (IRD et OCEAC)
qui offrent un grand appui académique et logistique aux jeunes
étudiants Africains.
Au moment où ce travail s'achève, il m'est
agréable d'adresser ma profonde gratitude à tous ceux qui ont
contribué à sa réalisation, tout
particulièrement :
· Monsieur le Secrétaire Général de
l'OCEAC, le Dr Jean-Jacques MOKA, Son Directeur de Cabinet Mr Fulgence
LIKASSI-BOKAMBA et autres collaborateurs, pour m'avoir accordé un stage
académique dans cette institution ;
· Pr Thomas NJINE pour avoir accepté de diriger ce
travail,qu'il reçoive ici toute ma reconnaissance ;
· Dr Fréderic SIMARD qui m'a accepté au
sein du laboratoire de l'OCEAC et a toujours fait preuve d'une grande
humilité envers tous les jeunes stagiaires ;
· Dr Timoléon TCHUINKAM qui m'a accueilli au sein
de sa jeune équipe de recherche JEA-IRD, dénommée
"Paludisme d'altitude",et a été l'instigateur de ce travail. Son
attention et ses conseils, malgré ses nombreuses occupations, ont
été très utiles ;
· Les enseignants du Département de Biologie et
Physiologie Animales de l'Université de Yaoundé I, en particulier
ceux de l'option Parasitologie dont je suis un humble produit.
· Dr Isabelle MORLAIS dont les suggestions et conseils
précis m'ont permis de surmonter de bien grandes difficultés,
soyez assurée de toute ma reconnaissance ;
· Dr Clément KERAHet Parfait AWONO pour leurs
disponibilité et suggestions importantes pour la réalisation de
ce document ;
· Dr Josiane ETANG et Christophe ANTONIO-NKONJIOpour
leurs conseils et encouragements ;
· Les techniciens du laboratoire de paludisme MM. Roger
BEYENE, Rose NYAMBAN et Sylvie KEMLEU pour m'avoir initié aux
différentes techniques entomologiques et de biologie
moléculaire ;
· Mes ainés du laboratoire : Mouhamadou
CHOUAIBOU, Elyzée NCHOUTPOUEN, Collince KAMDEM, Philippe NWANE, Cyrille
NDO et Jacqueline DOMFANG pour leur assistance technique et leurs
suggestions ;
· Mes camarades Basile KAMGANG, Sandrine NSANGO, Wilson
TOUSSILE pour leur collaboration ;
· Les étudiants de la JEA-IRD de Dschang :
Espérance LELE, Aimé TATENG et Bénédicte MAKE pour
leurs appui et disponibilité lors des missions de terrain ;
· La dynamique équipe des "captureurs" volontaires
de Dschang et Santchou ainsi que ceux qui ont accepté que les captures
se fassent dans leur domicile ;
· Mes camarades de promotion NAGA NDONGO, Gui LEKEFACK,
Ida MBARGA, Emmanuel ELANGA et tous les autres que je n'oublie pas, pour leur
collaboration ;
· Mes amis Alex KWAYA, Arnold BITJA, Charles FOKOUE,
Didier NJAMEN, Dimitri BOGNING,Gislain MBA, Lamine MOUNDI, Patrick YWONGet
YOMBO AKADApour leurs encouragements ;
· Tous ceux dont les noms ne sont pas cités ici,
et qui de près ou de loin on participés à la
réalisation de ce travail.
Je ne saurai terminer sans remercier le Seigneur Dieu qui m'a
fourni toute l'énergie et l'intelligence nécessaires à
l'accomplissement de tout ceci.
RESUME
Les hautes terres africaines sont reconnues comme zones
à risque d'épidémies palustres, ce qui est surprenant car
le climat froid des zones d'altitude rallonge le cycle extrinsèque des
parasites et limite le développement des vecteurs. En vue d'examiner le
cas des Hauts plateaux Bamiléké dans l'ouest Cameroun, nous nous
sommes proposés d'étudier les variations des populations
anophéliennes présentes de part et d'autre de la falaise des
Mbô et les changements du niveau de transmission du paludisme le long de
ce transect altitudinal.
La collecte des spécimens a été
réalisée dans deux localités : Santchou dans la
plaine inondable des Mbô à 750m d'altitude et Dschangsur le
plateau à 1400m d'altitude, les deuxséparées par une
falaise forestière. Elle a été
réaliséeà chacune des 4 saisons de l'annéepar
pulvérisation intra domiciliaire de pyrèthre et capture nocturne
sur volontaires, pendant 2 ans.
A Dschang, 9 espèces anophéliennesont
été récoltées : An. gambiaes.s.,An.
funestus, An. paludis,An. hancocki, An. nili, An. coustani, An.
wellcomei, An. ziemannietAn. moucheti. A Santchou, 10
espèces ont été récoltées dont 8 des
espèces précédentes (à l'exception de An.
moucheti)auxquelles s'ajoutentAn. namibiensis et An.
pharoensis.
L'espèceAn. gambiaes.s. (exclusivement de
forme moléculaire S)a été le vecteur principal toute
l'année, avec une fréquence de 84,46% à Santchou et 90,30%
à Dschang et des indices sporozoïtiques (Is) de 1,80 et 2,35
respectivement, déterminés par le test ELISA-CSP. Elle
était secondée parAn. funestus dont les
fréquences sont respectivement de4,73% et 7,83% et l'Is de 1,02 et 4,20.
Cette dernière a joué un rôle assez important dans la
transmission en saison sèche à Dschang avec un Is
supérieur à celui de An. gambiae (4,20 et 2,35
respectivement) lorsque l'agressivité de An. gambiae
était minimale.Les autres espèces dont les fréquences
étaient inférieures à 6,5%n'étaient pas porteuses
du parasite.
L'agressivité moyenne a été plus
élevée dans la plaine (9,34 p/h/n) que sur le plateau
(5,29 p/h/n), mais le taux d'inoculation entomologique n'a pas
présenté une aussi grande différence ;respectivement
51,84 pi/h/anavec une transmission saisonnière et 47,68
pi/h/an avec une transmission pérenne. La baisse de
température en altitude a rallongé la durée du cycle
gonotrophique d'un jour pour les 2 vecteurs, ce qui a doubléla
durée de l'espérance de vie infectante par rapport à la
plaine. Malgré cela, ces deux vecteurs réussissent à
maintenir le niveau de stabilitédu paludisme à 3,43 à
Santchou c'est-à-dire au dessus du seuil de stabilité qui est de
2,5 ; et à 2,04 à Dschang donc une stabilité
intermédiaire.
Mots clés :Altitude,
Cameroun,Paludisme, Transmission, An. gambiae,An. funestus
ABSTRACT
There is a consensus that malaria is a growing problem in
African highlands. This is surprising because the cold climate of high altitude
areas lengthens the extrinsic cycle of the parasites and limits the development
of vectors. In this report, we examined the case of the Beamlike highlands in
the Western Cameroon.In this case, we proposed to study the variations of the
anopheline populations present on both sides of the Mbô cliff and the
changes in the level of malaria transmission along this altitudinal transect.
Routine entomological collections were carried out in two
localities: Santchou in the easily flooded plain of Mbô at 750m above sea
level and Dschang in highlands (1400m altitude), both separated by a forest
cliff. They were madeonce at each season by indoor spray catches and human
landing catches, during two years.
Nineanopheline species were collectedin Dschang: An.
gambiae s.s., An. funestus, An. paludis, An. hancocki, An. nili, An. coustani,
An.wellcomei,An. ziemanni and An. moucheti. In Santchou, 10
species were listed including 8 of the preceding species (except An.
moucheti) to which were added An. namibiensis and An.
pharoensis.
Anophelesgambiae s.s.(exclusively of S molecular
form) was the principal vector throughoutthe year, with a frequency of 84.46%
in Santchou and 90.30% in Dschang and sporozoïterates of 1.80 and 2.35
respectively, determined by CSP-ELISA test. He was assisted byAn.
funestus whose frequencies were respectively 4.73% and 7.83% and
sporozoïterate of 1.02 and 4.20. The latter played a rather significant
role in the transmission in dry season in Dschang with a sporozoïterate
higher than that of An. gambiae (4.20 and 2.35 respectively) when the
aggressiveness of An. gambiae was minimal. The other species whose
frequencies were lower than 6.5% were not carrying the parasite.
Average aggressiveness was higher in the plain (9.34
bite/men/night) than on the plateau (5.29 b/m/n), but the
entomological inoculation rate did notpresentsuch a great difference;
respectively 51.84 infectiousbite/men/yearwith a seasonal transmission
and 47.68 ib/m/ywith a perennial transmission. The fall of temperature
in altitude lengthened the gonotrophic duration of the cycle of the 2
vectorsfor a day, which doubled the duration of the infecting life expectancy
compared to the plain. In spite of that, these two vectors succeed in
maintaining the level of malaria stability at3.43 in Santchou i.e. above the
threshold of stability which is 2.5; and to 2.04 in Dschang thus an
intermediate level of stability.
Key words: Highlands, Cameroon, Malaria,
Transmission, An. gambiae, An. funestus
SOMMAIRE
Dédicace
i
Remerciements
ii
Résume
iv
Abstract
v
Sommaire
vi
Liste des figures
ix
Liste des tableaux
x
Liste des abréviations
xi
INTRODUCTION
1
Chapitre 1 :
GENERALITES.
4
1.1. LE PALUDISME
5
1.1.1. Historique du paludisme
5
1.1.2. La transmission du paludisme
5
1.1.3. La maladie
6
1.2. LES AGENTS PATHOGENES
6
1.2.1. Position systématique des
Plasmodiums
6
1.2.2. Les Plasmodiums humains
7
1.2.3. Cycle évolutif de Plasmodium
falciparum
8
1.2.3.1. Chez l'hôte vertébré
(homme)
8
1.2.3.2. Chez l'hôte
invertébré (moustique vecteur)
9
1.3. LES VECTEURS
11
1.3.1. Position systématique des
anophèles
11
1.3.2. Généralités
11
1.3.3. Cycle de vie des Anophèles
13
1.3.3.1. Les oeufs
13
1.3.3.3. Les larves
13
1.3.3.3. Les nymphes
13
1.3.3.4. Les adultes
14
1.3.4. Les principaux vecteurs du paludisme au
Cameroun
14
1.3.4.1. Le complexe Anopheles
gambiae
16
1.3.4.2. Le groupe Anopheles funestus
17
1.3.4.3. Le groupe Anophelesmoucheti
17
1.3.4.4. Le groupe Anopheles nili
17
1.4. TECHNIQUES D'ECHANTILLONNAGE DES
CULICIDES
18
1.4.1. Collecte des stades
pré-imaginaux
18
1.4.2. Récolte des moustiques endophiles
(faune résiduelle)
18
1.4.2.1. Récolte à l'aspirateur de
moustiques endophiles
18
1.4.2.2. Capture au pyrèthre de moustiques
endophiles
18
1.4.3. Capture des moustiques exophiles
18
1.4.4. Capture sur volontaires humains et sur
appâts animaux
19
1.5. MESURE DES INDICES ENTOMOLOGIQUES ET
EPIDEMIOLOGIQUES
19
1.6. LE CONTRÔLE DU PALUDISME
22
1.6.1. La lutte antivectorielle
22
1.6.1.1. Lutte contre les stades larvaires
22
1.6.1.2. Lutte contre les adultes
22
1.6.2. La prise en charge des malades
23
1.7. HYPOTHESES ET OBJECTIFS DE L'ETUDE
24
Chapitre 2 :
MATERIEL ET METHODES.
25
2.1. SITES D'ETUDE
26
2.1.1. Dschang
26
2.1.2. Santchou
28
2.2. COLLECTE DES MOUSTIQUES
30
2.2.1. La capture sur volontaires
30
2.2.2. La capture par pulvérisation
intra-domiciliaire d'insecticide
30
2.3. IDENTIFICATION DES MOUSTIQUES
30
2.3.1. Identification morphologique
31
2.3.3. Identification moléculaire
31
2.3.3.1. Identification des membres du complexe
An gambiae
31
2.3.3.2. Détermination des formes
moléculaires de An. gambiae s.s.
33
2.4. DETERMINATION DE L'INFESTATION DES
ANOPHELES
34
2.5. ANALYSE DES DONNEES
35
Chapitre 3 :
RÉSULTATS ET DISCUSSION
36
3.1. LA FAUNE ANOPHELIENNE
37
3.1.1. Composition spécifique de la faune
anophélienne
37
3.1.2. Productivité des différentes
techniques de capture
37
3.1.3. Variations saisonnières des
populations anophéliennes
39
3.2. STRUCTURE DU COMPLEXE ANOPHELES
GAMBIAE
39
3.2.1. Composition du complexe Anopheles
gambiae
39
3.2.2. Formes moléculaires de Anopheles
gambiae s.s.
39
3.3. VARIATIONS DE LA COMPOSITION SPECIFIQUE ET
DES INDICES ENTOMOLOGIQUES AVEC L'ALTITUDE
39
3.3.1. Variation de la composition
spécifique de la faune anophélienne
39
3.3.2. Le cycle d'agressivité
41
3.3.3. Comparaison des indices
sporozoïtiques
43
3.3.4. Effet de l'altitude sur
l'agressivité, le taux d'inoculation entomologique et l'indice de
stabilité
43
3.4. DISCUSSION
46
3.4.1. Composition de la faune
anophélienne
46
3.4.2. Comparaison des populations de vecteurs
à différents niveaux altitudinaux
46
3.4.3. Composition du complexe An.
gambiae
48
3.4.4. Les niveaux de transmission du
paludisme.
49
CONCLUSION ET PERSPECTIVES
51
RÉFÉRENCES BIBLIOGRAPHIQUES
53
ANNEXES
61
LISTE DES
FIGURES
Figure 1 : Cycle de développement du
Plasmodium chez l'Homme et l'Anophèle vecteur
2
Figure 2 : Comparaison des principaux genres
de Culicidés.
12
Figure 3 : Cycle biologique des
Anophèles
15
Figures 4 (a et b) : Anophèle femelle
à jeun (a) et Anophèle femelle gorgée (b)
15
Figure 5 : Répartition des cases de
captures à Dschang
27
Figure 6 : Carte de la région de la
plaine des Mbô
29
Figure 7 : Programmation du thermocycleur pour
la PCR complexe An. gambiae
32
Figure 8 : Schéma du principe de la
technique "ELISA sandwich"
34
Figure 9 : Densités des
anophèles en fonction du mode de récolte des échantillons
à Dschang et Santchou d'août 2004 à novembre 2006
37
Figure 10 : Profil de migration des
différents membres du complexe An. gambiae
40
Figure 11 : Profil de migration sur gel
d'agarose des spécimens de forme moléculaire M et S de An.
gambiae s.s.
40
Figure 12 : Cycles d'agressivité des
principaux vecteurs du paludisme à Santchou et Dschang d'août 2004
à novembre 2006.
42
LISTE DES
TABLEAUX
Tableau 1 : Localisation des sites de capture
en fonction de l'urbanisation à Dschang
2
Tableau 2 : Localisation des sites de capture
en fonction de l'urbanisation dans la plaine
28
Tableau 3 : Composition spécifique de
la faune anophélienne de Dschang et Santchou d'août 2004 à
novembre 2006
38
Tableau 4 : Variations saisonnières de
la faune anophélienne à Dschang et Santchou d'août 2004
à novembre 2006
38
Tableau 5 : Variation nocturnes des
densités et fréquences des principaux vecteurs du paludisme avec
l'altitude à Santchou et Dschang d'août 2004 à novembre
2006.
42
Tableau 6 : Comparaison des indices
sporozoïtiques (Is) de P. falciparum détectés par
le test ELISA-CSP chez les anophèles respectivement à Santchou et
Dschang d'août 2004 à novembre 2006
44
Tableau 7 : Influence de l'altitude sur le
taux d'inoculation entomologique et l'indice de stabilité à
Santchou et Dschang d'août 2004 à novembre 2006
45
LISTE DES
ABREVIATIONS
ul : microlitre
ACm : anticorps monoclonal
ACT : Artemisinin-based Combination
Therapy
ADN : Acide
désoxyribonucléique.
Ae. : Aedes
An. : Anopheles
ARN : Acide ribonucléique.
CNV : Capture nocturne sur
volontaires
CPI : Capture par pulvérisation
intradomiciliaire d'insecticide
CSP : Circumsporozoïtique
dNTP : dinucléotide
triphosphate
ed : Eau distillée
EDTA : Ethylene Diamine Tetra-acetic
Acid
ELISA : Enzyme Linked ImmunoSorbent
Assay
MINSANTE : Ministère de la
Santé du Cameroun
MSP : Ministère de la
Santé Publique du Cameroun
OCEAC : Organisation de Coordination
pour la lutte contre les Endémies en Afrique
Centrale
OMS : Organisation Mondiale de la
Santé
P. Plasmodium
p/h/n : Piqûres
par homme et par nuit
pi/h/an :
Piqûres infectantes par homme par an
PCR : Polymerase Chain Reaction
pH : Potentield'hydrogène
RADP : Random amplified polymorphic
DNA
RFLP : Restriction Fragment Length
Polymorphism
s.l. : sensu lato
s.s. : sensu stricto
STR : Short tandem repeat
TBE : Tris-borate-EDTA
TEMED : N, N, N', N' tetra methyl
ethylene diamine
Tp : Taux de parturité
Tris-HCl : Tris-hydrochloryde
UNICEF : United Nations Children's Fund
INTRODUCTION
En Afrique tropicale, lepaludisme est l'une des
endémies parasitaires les plus répandues etla plus grandes causes
de morbidité et de mortalité, surtout chez les nouveau-nés
et les enfants de moins de 5ansqui, avec les femmes enceintes,
représentent les groupes les plus atteints. En 2003, le paludisme a
menacé environ 2,5 milliards de personnes dans le monde et a
causé le décès de 1 à 2,5 millionsd'entre eux
(OMS/UNICEF, 2003). Plus de 80 des décès par paludisme se
produisent en Afrique subsaharienne où l'on estime que 60 de la
population est exposée au risque palustre et près de deux
millions de personnes en meurent par an (OMS, 2005).
Son impact au Cameroun est considérable :
- 2 millions de cas ;
- 45% de consultations médicales ;
- 35 à 40% de décès dans les formations
sanitaires ;
- 50% de morbidité et 40% de décès chez
les enfants de moins de 5 ans ;
- 40% de dépenses annuelles des ménagespour la
santé (Samé Ekobo, 2005; MSP, 2001).Cette affection est une
érythrocytopathie due à la multiplication et au
développement d'un hématozoaire du genre Plasmodium
Garnham, 1966dont 4 espèces infectent l'homme (Carter, 1998).
Ce protozoaire sanguicole esttransmis à l'homme par
piqûresinfectantes de femelles des moustiques du genre Anopheles
Meigen, 1918dont ondénombre près de 3500 espèces reparties
à travers le monde (Eldrige, 2005). Ces Culicidés constituent
l'un des groupes de vecteurs les plus importants en santé
publique :ils sont impliqués dans la transmission de plusieurs
autres infections telles que la fièvre jaune, la dengue, les filarioses
lymphatiques... (Rodhain, 1999).
La mise au point d'un vaccin efficace contre le paludisme a
été envisagée depuis de nombreuses années, mais les
recherches ont été rapidement entravées du fait de la
grande variabilité génétique de P.
falciparumWelch, 1897et de son fort polymorphisme (Farooq et Mahajan,
2004; Smith et Milligan, 2005). Par conséquent, la lutte contre cette
parasitose repose essentiellement sur deux méthodes : l'une,
préventive, par la mise en place des opérations de lutte
antivectorielle et de protection contre les vecteurs, et l'autre curative, par
la prise en charge des cas, ce qui suppose le diagnostic précoce et
l'administration d'antipaludéensefficaces. Les différentes
méthodes de lutte développées jusqu'ici contre la maladie
se heurtent aux phénomènes de résistance de plus en plus
fréquents, d'une part chez les plasmodiums vis-à-vis des
antipaludéens et d'autre part chez les anophèles vis-à-vis
des insecticides.
De ce point de vue, la connaissance des vecteurs et surtout de
leurs structures génétiques est très importante pour la
lutte antivectorielle qui représente un volet primordial dans le combat
contre le paludisme. Il est donc important de connaître avec
précision la biodiversité et la dynamique des populations de
vecteurs afin d'optimiser les stratégies de lutte, en particulier dans
les régions présentant des risques élevés
d'épidémie. Ces régions potentiellement
épidémiques se caractérisent parle niveau de
stabilité/instabilité de la maladie, notions introduites par Mac
Donald (1957). On définit ainsi :
- des zones de paludisme stable où la transmission est
pérenne ou à fluctuation saisonnière mais dont les
modalités sont stables au fil des annéeset le risque
d'épidémie faible car le degré de prémunition de la
population est élevé ;
- des zones de paludisme instable avec une modalité de
la transmission variante dans le temps, par conséquent la population
acquiert peu ou pas d'immunité et peut être sujette à des
poussées épidémiques (Mouchet et al., 2004).
Parmi les zones présentant des risques
d'épidémie palustre, on peut citer les régions de haute
altitudequi à cause de la topographie composée de collineset de
plateaux, présentent un environnement peu propice au
développement des vecteurs et des parasites (Minakawa et al.,
2002). Depuis les années 1920, des épidémies palustres ont
été périodiquement déclarées en hautes
altitudes en Afrique de l'est (Garnham 1945, Fontaine et al., 1978).
En 1991, les premières résurgencesde paludisme ont
été observées dans les plateaux centraux du Burundi,
auparavant indemnes et, en octobre 2000, une grande épidémie y a
été observée avec 3 millions de cas, dont 10 à 15%
de morts (Aubry, 2007).Dans les hautes terres de l'est du Kenya, les
résurgences du paludisme ont augmenté de fréquence et
d'intensité au cours des 15 dernières années,
contrairement aux années 1980 (Githeko and Ndegwa 2001, Zhou et
al., 2004). Au Cameroun, aucune épidémie palustre n'a encore
été déclarée. Cependant, Lindsay et Martens (1998)
ont déclaré que les hautes terres africaines doivent être
reconnues comme des régions sensibles si l'on considère l'effet
possible du réchauffement climatique sur la transmission palustre
(Ndenga et al., 2006). C'est dans cette optique que nous nous sommes
proposé d'étudier la situation du paludisme d'altitude dans les
hautes terres Ouest Camerounaises.
Notre travail consistera à :
· caractériser spécifiquement et comparer
en fonction de l'altitude les populations de vecteurs du paludismede part et
d'autre de la falaise des Mbô,
· étudierleniveaude transmissiondu paludisme dans
cette zone de l'Ouest Cameroun et en déduire l'impact de la variation
d'altitude.
Chapitre 1
Chapitre 1 :GENERALITES.
1.1.LE PALUDISME
1.1.1.Historique du paludisme
Originellement appelé Malaria, nom tiré de
l'italien mal-aria ou "mauvais air",le mot paludisme tire son étymologie
du latin palus signifiant marais car, dans le passé, le
paludisme était fréquent dans les marais Pontins autour de Rome
où il était aussi connu sous le nom de "fièvre romaine".
C'est une maladie très ancienne,la première trace du paludisme
étant la présence d'ADN de Plasmodium falciparum chez
les momies datant de 3200 avant Jésus Christ (Miller 1958). Cette
maladie est probablement originaire d'Afrique et a suivi les migrations
humaines vers les côtes de la Méditerranée, jusqu'enInde et
en Asie du Sud-est.Elle a sévi en Europe du sud et sur le pourtour de la
méditerranée jusqu'au début du XXe
siècle mais elle y a été éradiquée
grâce à la disparition des vecteurs suite aux efforts de
démoustication et à l'élévation du niveau de vie.
Hippocrate, parlant de "fièvre atrabilaire" (en référence
à la bile noire), a donné une description extrêmement
précise de l'accès fébrile et de sa
périodicité. C'est la quinine qui à partir de 1663 fera
l'unanimité pour la combattre (Wéry, 1995) mais de nos jours,
suite au développement de résistances contre les antimalariques
par les parasites, de nouvelles molécules ont été
créées. Selon les estimations actuelles, 49 de la population
mondiale vit sous la menace du paludisme. Il tue plus d'un million de personnes
chaque année. On estime que 3,2 milliards d'êtres humains vivant
dans 107 pays et territoires, sont confrontés à ce risque (O.M.S,
2005).
1.1.2.La transmission du paludisme
L'infection palustre correspond à l'inoculation du
parasite à un organisme. Quatre modes de transmission du paludisme
à l'homme sont possibles (Mouchet et Carnevale, 1991) :
- la transmission par piqûre infectante d'un
anophèle ;
- la transmission par voie transplacentaire, responsable du
paludisme congénital ;
- la transmission par transfusion sanguine (plus rarement de
nos jours) ;
- la transmission accidentelle par des instruments
infectés.
Le facteur limitant de la distribution du paludisme dans le
monde concerne la transmission du parasite d'homme à homme,
c'est-à-dire par les vecteurs (Mouchet et al., 2004).
L'introduction d'un sujet porteur duparasitedans une région où il
n'y a pas de vecteurs pour assumer la transmission aboutit à une impasse
parasitaire. L'homme sert d'hôte vertébré
intermédiaire, d'amplificateur et de victime mais à lui seul, il
ne peut pas entretenir la maladie.
Pour qu'un anophèle soit un bon vecteur de plasmodiums
humains, il doit présenter :
- une compatibilité génétique
vecteur/parasites, permettant la tolérance du parasite,
- une longévité du vecteur supérieure
à la durée du cycle extrinsèque du parasite,
- l'anthropophilie et l'endophiliedu vecteur (Mouchet et
Carnevale, 1991).
1.1.3.La maladie
Le paludisme se caractérise principalement par des
périodes d'accès de fièvre ou accès palustres.
L'infection palustre présente trois stades d'évolution :
- une phase d'incubation après la piqûre
infectante ; elle correspond au développement des schizontes dans
le foie. Elle est généralement asymptomatique,
- une phase d'invasion avec fièvre parfois
accompagnée de céphalées et parfois de myalgies et
d'hépatomégalie,
- une phase d'état avec fièvre intermittente,
pendant la schizogonie érythrocytaire. La fièvre est
rythmée et due à l'éclatement des schizontes mûrs et
au déversement dans le sang de l'hypnozoïne qui est un pigment
pyrogène.
Chacun des agents pathogènes présente des
particularités quant aux symptômes et à la
périodicité des accès. En absence de traitement efficace,
on peut subir des fièvres tierces ayant une périodicité de
48 heures (P. falciparum, P. vivax, P. ovale) et des fièvres
quartes ayant une périodicité de 72 heures (P.
malariae). L'usage d'antipaludiques adéquats permet d'interrompre
l'évolution de l'infection.En cas de non traitement ou d'échec
thérapeutique, des complications peuvent survenir : on peut aboutir
à une fièvre bilieuse avec hémoglobinurie, des atteintes
cérébrales, des mortalités foeto-maternelles chez la femme
enceinte ou la mort du malade.
1.2.LES
AGENTS PATHOGENES
1.2.1.Position systématique
des Plasmodiums
Les agents responsables du paludisme sont des parasites
hématophages du genre Plasmodiumdécouverts en 1880 par
Laveran(Mouchet et al., 2004).La position systématique de ce
parasite est la suivante :
Embranchement : Protozoaires
Sous-embranchement : Apicomplexa
Classe :
Sporozoaire
Ordre : Coccidiomorphes
Sous-ordre :
Haemosporidae
Famille : Plasmodiidae
Genre : PlasmodiumGarnham, 1966
La famille des Plasmodiidae réduite au seul
genre PlasmodiumGarnham, 1966a été subdivisée en
10 sous-genres en fonction de leurs hôtes : trois sont parasites de
mammifères, quatre parasites d'oiseaux et les trois autres parasites de
reptiles. Tous les parasites de mammifères sont transmis par des
anophèles.
1.2.2.Les Plasmodiums humains
Quatre espèces de plasmodiums sont responsables des
infections palustres humaines.Ces plasmodiums humains diffèrent entre
eux par plusieurs caractéristiques épidémiologiques,
biologiques et cliniques spécifiques(Mouchet et al., 2004). Ce
sont :
P. falciparumWelch, 1897 est
l'espèce la plus répandue. Elle est présente chez 80%
à 90% des sujets parasités. Cette espèce est fortement
implantée en Afrique tropicale et y sévit de façon
permanente, avec des recrudescences durant les saisons pluvieuses favorisant la
pullulation des vecteurs. Sa durée d'incubation est de 7 à 15
jours et sa longévité inférieure à un an. Elle est
à l'origine de la fièvre tierce maligne, la plus
meurtrière. C'est un parasite d'hématies de tous les âges,
la schizogonie érythrocytaire se faisant dans les organes profonds. En
cas de complications le stade de neuropaludisme peut être atteint.
P. malariaeLaveran, 1881se rencontre
dans toute la région Afro-tropicale à des fréquences
très variables, de 2% à 45%. Elle est généralement
plus fréquente dans les zones forestières. Elle est à
l'origine de la fièvre quarte bénigne à recrudescence
tardive. Sa longévité est d'environ 21 jours et elle s'attaque
principalement aux hématies vieilles. Sa recrudescence peut aller
jusqu'à 10 à 20 ans, par réactivation de formes
érythrocytaires latentes (pas d'hypnozoïtes).C'est la seule
espèce commune à l'homme et aux animaux, plus
précisément aux chimpanzés.
P. vivaxGrassi et Feletti, 1890 est
répandue en zone équatoriale. Elle est responsable de la
fièvre tierce bénigne, la plus répandue. Son incubation
dure environ 15 jours et peut s'étendre jusqu'à 7 mois. C'est un
parasite d'hématies jeunes et il ne peut pas s'attaquer aux sujets Duffy
négatifs1(*) ;
les Mélano-africains sont donc réfractaires à ce parasite.
On peut observer des rechutes pendant une période de deux ans dues
à l'existence d'hypnozoïtes.
P. ovaleStephens, 1922a une
localisation essentiellement africaine. Longtemps confondue à la
précédente, elle remplace P. vivax chez les sujets Duffy
négatifs. Elle cause une fièvre tierce bénigne. Sa
longévité est de 15 jours et on note des rechutes pouvant durer 5
ans, dues à la présence d'hypnozoïtes hépatiques
(Danis et Mouchet, 1991 ; Mouchet et al., 2004).
1.2.3.Cycle évolutif de
Plasmodium falciparum
1.2.3.1.Chez l'hôte vertébré (homme)
L'homme est contaminé par piqûre infectante de
l'anophèle femelle(figure 1). Les formes infectieuses
(sporozoïtes) sont mobiles et contenues dans la salive du moustique (1).
Les sporozoïtes sont injectés dans le tissu sous cutané, ils
passent environ 45 minutes dans le sang et atteignent le foie. Chaque
sporozoïte pénètre dans un hépatocyte et il devient
une forme incapable de se déplacer qui sera obligatoirement
endocellulaire. Le cycle se déroule ici en deux phases : une phase
hépatique (exo-érythrocytaire) et une phase sanguine
(endo-érythrocytaire). L'homme est considéré comme
hôte intermédiaire car la phase sexuée du cycle du parasite
se déroule chez le moustique.
Schizogonie hépatique ou
exo-érythrocytaire
Un cycle de reproduction asexuée se déroule dans
les hépatocytes parasités (2) : le sporozoïte se
transforme en un trophozoïte endocytoplasmique qui grossit et dont le
noyau se divise de nombreuses fois. Après une durée moyenne de 8
à 15 jours, le cytoplasme de l'hépatocyte est envahi par une
masse contenant plusieurs milliers de noyaux qu'on appelle schizonte (3).
L'hépatocyte parasité sera dilaté et ponctué de
milliers de points bleus d'où son appellation de "corps bleu". A
maturité, chaque noyau s'individualise avec un peu de cytoplasme du
parasite pour donner plusieurs milliers de mérozoïtes (ou
cryptozoïtes) ; l'hépatocyte parasité éclate (4)
et les mérozoïtes libérés (5) pénètrent
dans la circulation des capillaires le jouxtant, chacun va
pénétrer dans une hématie.
La durée du cycle de reproduction asexuée dans
l'hépatocyte est variable(8 à 15 jours) suivant les
espèces. Le processus de reproduction se déclenche
immédiatement dans tous les hépatocytes parasités pour les
espèces P. malariae et P. falciparum. Ce processus
peut être retardé dans certains hépatocytes qui restent en
attente (d'où leur nom d'hypnozoïtes), pour une durée allant
de 1 à 18 mois chez les espèces P. vivax et P.
ovale.
Schizogonie érythrocytaire ou
endo-érythrocytaire
Dans chaque hématie envahie par un
mérozoïte (6) va se dérouler un cycle de reproduction
asexuée. Il se consiste en un passage par les formes trophozoïte
jeune (forme en anneau), trophozoïte âgé (forme
amoeboïde) (7), schizonte jeune (nombre variable de noyaux) puis schizonte
mûr à nombre de noyaux défini (8). Les schizontes se
chargent de pigment malarique ou hémozoïne. Chaque noyau s'entoure
d'une portion de cytoplasme et forme un schizonte mûr ou corps en rosace
(9). La durée du cycle et le nombre de mérozoïtes obtenus
sont caractéristiques de chaque espèce.
A l'issue de chaque cycle, les hématies
parasitées éclatent de façon généralement
synchrone (10) et les mérozoïtes libérés envahissent
des hématies saines ; plusieurs cycles se succèdent.
Après environ une semaine, certains mérozoïtes vont se
distinguer en commençant le cycle sexué du parasite; les uns vont
devenir des gamétocytes mâles, les autres vont devenir des
gamétocytes femelles (11). Les gamétocytes restent en attente
dans leurs hématies ; la durée de vie des gamétocytes
est de quelques jours mais de nouveaux gamétocytes sont produits
à la fin de chaque schizogonie érythrocytaire. La morphologie et
les affinités tinctoriales de toutes les formes érythrocytaires
sont caractéristiques de chaque espèce et servent à son
identification lors du diagnostic microscopique.
1.2.3.2.Chez l'hôte invertébré (moustique
vecteur)
Au cours de la piqûre, l'anophèle
ingèredes hématies parasitéeschez un sujet malade.Seuls
les gamétocytes (formes sexuées) évolueront et deviendrons
des trophozoïtes.
Dans l'estomac de l'anophèle, les gamétocytes
mâles subissent l'exflagellation et donnent des gamètes
mâles mobiles. Chaque gamétocyte femelle mûrît pour
donner un gamète femelle volumineux, arrondi et immobile. La
fécondation de chaque gamète femelle par un gamète
mâle (12) donne autant de zygotes appelés ookinètes (13)
d'aspect vermiforme (10 um x 3 - 4 um). Les ookinètes s'insinuent entre
les cellules de la paroi stomacale du moustique (14) et vont se localiser
à la face externe de l'estomac où ils deviennent des oocystes
(15,16). La durée totale entre le repas contaminant du moustique et la
sortie des ookinètes est de l'ordre de 24 heures.
À l'intérieur de l'oocyste vont se former des
sporocystesqui donneront plusieurs centaines de sporozoïtes (16).
L'oocyste est sphérique et sa taille passe d'environ 8um à
environ 60 à 80um pendant sa maturation. La maturation de l'oocyste (ou
sporogonie) dure de 4 à 21 jours suivant les conditions climatiques pour
P. falciparum. A maturité les oocystes éclatent et les
sporozoïtes sont libérés dans l'hémolymphe (17).En 24
heures environ, la majorité d'entre eux va se concentrer dans les
glandes salivaires (18). L'anophèle sera infectieuse, en fonction des
conditions climatiques, 8 à 21 jours après le repas sanguin
contaminant et le restera au maximum deux mois (Mouchet et al., 2004).
Etant le siège de la phase sexuée du cycle, le moustique est
considéré comme étant l'hôte définitif du
parasite.
 Adapté de :http ://
ebischoff.free.fr/Paluz.html Adapté de :http ://
ebischoff.free.fr/Paluz.html
Figure
1 :Cycle de développement du Plasmodium chez
l'Homme et l'Anophèle vecteur
1.3.LES VECTEURS
1.3.1.Position systématique
des anophèles
D'après Harbach (2004),les anophèles se
positionnent d'un point de vue systématique comme suit :
Règne : Animal
Embranchement : Arthropodes
Sous-embranchement : Antennates
Classe : Insectes
Section : Oligonéoptères
Super-ordre : Mécoptéroïdes
Ordre : Diptères
Sous-ordre : Nématocères
Famille : Culicidae
Sous-famille : Anophelinae
Genre : AnophelesMeigen, 1918.
1.3.2.Généralités
Les moustiquesconstituent parmi les diptères
nématocères la famille des Culicidae ou
Culicidés. Cette famille est composée d'environ 3450
espèces et sous-espèces appartenant à 38 genres (Graham
et al., 1995).Les moustiques sont repartis dans le monde entier et
principalement au niveau de la ceinture équatoriale ainsi qu'une partie
de la zone tempérée où les températures sont assez
chaudes. On les retrouve jusqu'à 5500 m d'altitude dans certaines
régions et aussi à 1250 m sous le niveau de la mer dans des mines
(Service, 1993). Ce sont des insectes mesurant en moyenne 3 à 8mm de
long, certaines espèces pouvant atteindre 19mm de long.
Les Culicidaesont divisés en trois
sous-familles et 37genres : Toxorhynchitinae
(1genre),Culicinae (33genres) et Anophelinae (3genres). La
différenciation entre genres se fait suivant des critères
taxonomiques (figure 2). Certaines différences sont visibles
même dès les stades larvaires(Danis et Mouchet, 1991).
Sur plus de 500 espèces d'anophèles connues,
environ70 peuvent assurer la transmission du paludisme mais juste une vingtaine
sont considérées comme vecteurs majeurs du paludisme, les autres
jouant un rôle secondaire de manière localisée (Mouchet
et al., 2004). La faune anophélienne d'Afrique comporte 145
espèces d'anophèles dont 16 sont impliquées dans la
transmission du paludisme à l'homme. Cinq vecteurs sont d'importance
majeure : An. gambiae s.s., An. funestuslargement
répandus, An. moucheti et An. nili présents
dans les régions forestières et An. arabiensis
présent en zones de savanes (Gillies et De Meillon, 1968 ;
Antonio-Nkondjio etal., 2006). A ceux-ci s'ajoutent d'autres
espèces plus ou moins localisées.
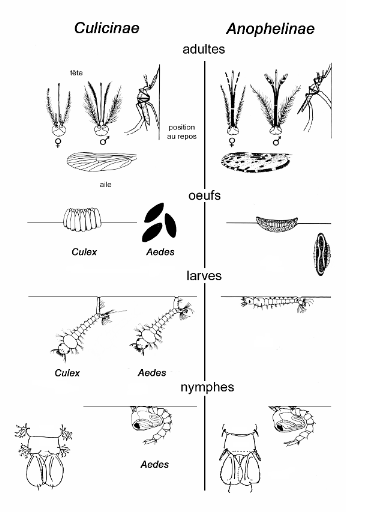
Source : Lane &Croskey,1993 .
Figure 2 : Comparaison des principaux
genres de Culicidés.
1.3.3.Cycle de vie des
Anophèles
Les Culicidés ont un mode de développement de
type holométabole (à métamorphose complète), les
larves ayant une morphologie et un mode de vie très différents de
ceux des adultes : les stades pré-imaginaux sont aquatiques alors
que les adultes sont aériens. Le cycle de vie présente quatre
stades évolutifs : l'oeuf, les larves, la nymphe et l'adulte
(figure 3).
1.3.3.1.Les oeufs
En fonction des espèces, les femelles de moustiques
pondent 30 à 300 oeufs par cycle gonotrophique. Les oeufs
d'anophèles mesurent 0,6 à 0,8 mm de long. Incurvés et
munis de flotteurs latéraux remplis d'air, ils sont
déposés à la surface de l'eau au moment de la ponte. Ces
oeufs ne supportent généralement pas la dessiccation mais ceux de
certains moustiques à l'exemple de Aedes haemagogus et Ae.
albopictus ont un chorion étancheleur permettant de supporter la
dessiccation durant plusieurs semaines (Rodhain, 1999). L'éclosion a
lieu en général au bout de 36 à 48h mais il arrive que sur
la boue humide ou en eau très froide elle soit différée de
quelques jours (Danis et Mouchet, 1991).
1.3.3.3.Les larves
Les larves de moustiques se distinguent de celles des autres
insectes par l'absence d'appendices locomoteurs et la forme du thorax (bulbeux,
plus large que la tête et l'abdomen)(Service, 1995). Leur abdomen porte
des plaques dorsales sclérifiées et des soies palmées
caractéristiques des anophèles.Ces soies contribuent au maintien
de la larve juste sous la surface de l'eau, dans une position typique aux
anophèles : parallèle à la surface, face dorsale vers
le haut. Ces larves sont recouvertes d'un tégument rigide et
inextensible composé de sclérotine et de chitine qui leur impose
une croissance par mues. Les larves respirent l'air atmosphérique
grâce à leurs spiracles dorsaux. Elles sont détritivores,
se nourrissant d'éléments planctoniques comme les levures, les
bactéries, les protozoaires... La durée totale dela vie larvaire
est d'environ 8 à 12 jours(Danis et Mouchet, 1991).Il existe
quatre stades larvaires,la nymphose (dernière mue) transforme la larve
du quatrième stade en une nymphe.
1.3.3.3. Les nymphes
Elles ont une forme en virgule, la tête et le thorax
étant fusionnés pour former le céphalothorax. Elles
possèdent deux trompes respiratoires situées dorsalement sur le
céphalothorax et leur permettant de respirer l'air atmosphérique.
L'abdomen comporte huitsegments bien visibles et leur contraction brusque
permet le déplacement des nymphes. Elles ne se nourrissent pas pendant
toute la durée du stade et subissent à la fin un remaniement
important. Ces transformations morphologiques et physiologiques marquent le
passage du stade nymphal au stade adulte. L'émergence dure environ 15
min et, en élevage, on a constaté que les larves
mâlesémergent en moyenne 24 heures avant les larves femelles
(émergence protandrique) (Rodhain et Perez, 1985).
1.3.3.4. Les adultes
L'adulte présente trois parties bien distinctes :
tête, thorax et abdomen. Après l'émergence, ces insectes
doivent se reposer pendant 12 à 24 heures pour que leur exosquelette se
durcisse et que les organes se mettent en place. L'adulte ou imago a une
biologie orientée principalement vers la fonction de reproduction, ce
qui nécessite une nutrition appropriée. Ces adultes prennent un
premier repas de sève de plante ou de jus sucré sur le nectar des
fleurs pour satisfaire leurs besoins énergétiques.On peut
distinguer le cas des mâles de celui des femelles quant à leur
éthologie et leur écophysiologie :
- Les moustiques mâles ont les antennes plumeuses qui
ont un rôle olfactif intervenant dans la recherche des femelles. Ce
caractère permet de distinguer à l'oeil nu les deux sexes. Ils ne
sont pas hématophages et, de ce fait, ils ne se déplacent pas
loin de leurs gîtes. Leur longévité est relativement
faible : une semaine à 10 jours(Rodhain et Perez, 1985).Apres le
troisième jour, les mâles essaiment au crépuscule puis
s'accouplent (Danis et Mouchet, 1991).
- Les femelles ont des antennes glabres et ne s'accouplent le
plus souvent qu'une seule fois dans la vie (Cléments, 1992).
Contrairement aux mâles, elles sont hématophages et se
nourrissent,en plus du jus de plantes, du sang d'animauxvertébrés
qu'elles prélèvent par piqûres. On parle aussi de gorgement
(figures 4 a et b). Les substancesalimentaires résultant de la
digestion du sang absorbé sont utilisées en partie pour la
nutrition, la régulation thermique, mais surtout pour la maturation des
oeufs. Les femelles ont une durée de vie de troissemaines à trois
mois, parfois beaucoup plus (Rodhain, 1999).Les bons vecteurs du paludisme se
caractérisent par une longévité supérieure à
deux semaines, durée nécessaire à leur
développement et à l'exécution du cycle extrinsèque
du parasite.
1.3.4.Les principaux vecteurs du paludisme au Cameroun
Au Cameroun, cinq espèces sont
considérées comme vecteurs majeurs du paludisme. Il s'agit
d'An. gambiae s.s., An. arabiensis,An. funestus,An. nili etAn.
moucheti (Njan Nloga etal., 1993; Fontenille et Simard, 2004).
D'autres espèces telles que An. paludis, An. pharoensis, An.
hancocki, sont considérés comme des vecteurs d'importance
locale car présents juste dans quelques régions (Fontenille
etal., 2000; Antonio-Nkondjio etal., 2006). A ceux-ci
s'ajoute An. ovengensis, découverte récemment au Sud
Cameroun (Awono-Ambene etal., 2004).
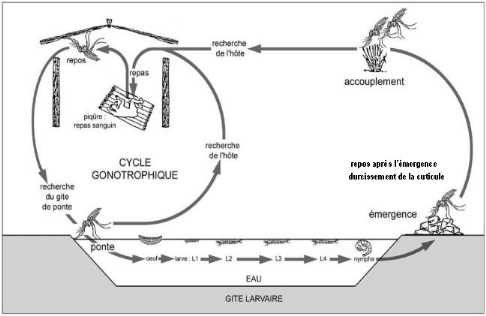
Adapté de : Mouchet et Carnevale 1991
Figure 3 :Cycle biologique des
Anophèles
b
a

Source :
http://www.infoscience.fr/dossier/moustique/moustique_som.html
Figures 4 (a et b) :Anophèle
femelle à jeun (a) et Anophèle femelle gorgée (b)
1.3.4.1. Le complexe Anopheles gambiae
Initialement considéré comme étant une
seule espèce, An. gambiae s.l.est actuellement reconnu par tous
les biologistes comme étant un complexe d'espèces. Il regroupe en
son sein sept espèces bien définies dont la découverte a
commencé lors d'études sur la transmission de gènes de
résistance aux insecticides (Davidson, 1962 ; 1964) et dont les
croisements produisent des mâles stériles (White 1985 ; Hunt
et al., 1998).Ce sont :
- An. arabiensis Patton, 1904
- An. bwambae White, 1985
- An. gambiae sensu strictoGiles, 1902
- An. melasTheobald, 1903
- An. merus Doenitz, 1902
- An.quadriannulatus A Theobald, 1911
- An.quadriannulatus BHunt et al., 1998
(Mouchet et al.,2004).
Les espèces de ce complexe sont présentes dans
les régions de forêt dégradées ou de savanes humides
et occupent ainsi toute la ceinture équatoriale africaine.Au Cameroun,
on les retrouve dans toutes les régions (Fontenille et al.,
2000, Wondji et al., 2005).Les travaux de cytogénétique
de Colluzi et al., (1979) ont permis de montrer que ces espèces
sont génétiquement distinctes et caractérisées par
des inversions chromosomiques stables associées à des adaptations
aux conditions climatiques (aridité, température...).
Considérée comme « un des meilleurs,
sinon le meilleur vecteur du monde » (Mouchet et al., 2004),
An. gambiae s.s. est l'espèce la plus répandue de la
planète. Les larves se développent dans les collections d'eau
claires, peu profondes, ensoleillées et sans végétation.
Ce sont par exemple des empreintes de pas, des traces de pneus de voitures, des
flaques ou des rizières irriguées. Il a ainsi été
démontré par Muirhead-Thompson (1945) en Sierra Leone que si l'on
mettait de l'ombre sur un gîte de ponte, il n'était plus
utilisé par les femelles de An. gambiae (Mouchet et
al., 2004).Au sein de l'espèceAn. gambiae s.s., des
travaux de biologie moléculaire ont permis d'identifier deux formes
moléculaires : M et S (Della-Torréet al., 2000).
Elles sont associées aux différentes formes chromosomiques de
cette espèce et présentent probablement un isolement reproductif.
En effet, aucun hybride M/S n'a été retrouvé dans la
nature tant en Côte d'ivoire (Chandre et al., 1999)qu'au Burkina
(Della-Torréet al., 2005) et au Cameroun (Wondji et
al., 2005).C'est une espèce très anthropophile, avec des
indices sporozoïtiques en général supérieurs à
3%. En journée, ces insectes se posent dans des gîtes de repos qui
peuvent être soit des habitations (endophilie), soit sous des abris
extérieurs (exophilie) tel que les arbres et arbustes, les hangars
ouverts...
1.3.4.2. Legroupe Anopheles
funestus
Ce groupe comprend 9 espèces difficiles à
différencier morphologiquement(Gillies et de Meillon, 1968 ;
Gillies et Coetzee, 1987). Ces espèces sont assez mal connues et ne
peuvent être différenciées que par de très discrets
caractères sur les larves ou les adultes(Fontenille et al.,
2003). An. leesoni, An. confusus, An. fuscivenosus, An.
rivulorumetAn brucei sont identifiables au stade larvaire alors
que les espèces du sous-groupe funestus : An. funestus
s.s.(vecteur à capacité vectorielle assez
élevée), An. parensis, An. vaneedeni et An.
aruni peuvent être identifiées par de petites
différences morphologiques chez les adultes (Gillies et Coetzee,
1987).
Les espèces de ce groupe sont essentiellement
zoophiles, à l'exception de An. funestuss.s.(seule
espèce chez qui des plasmodiums humains ont été
retrouvés), et très rarement An. rivulorum en Tanzanie
(Wilkes et al., 1996).
1.3.4.3. Le
groupeAnophelesmoucheti
Anopheles moucheti est un vecteur important du
paludisme dans les localités situées le long des cours d'eau
à courant lent en Afrique équatoriale. Il est largement
présent dans le massif forestier centrafricain, du Cameroun à
l'Ouganda. Les formes pré-imaginales se développent dans les
cours d'eau à faible courant et riches en débris
végétaux (Fontenille et al., 2003). Les études
effectuées dans le groupe An. moucheti ont permis d'identifier
3 formes morphologiques :
- An. moucheti mouchetiEvans 1925, (forme typique)
- An. moucheti nigeriensisEvans 1931,
- An. moucheti bervoetsiD'Haenens 1961 (Gillies et De
Meillon, 1968).
1.3.4.4. Le groupe Anopheles
nili
Il est largement répandu en Afrique tropicale (Kamau
et al., 2002) etest un vecteur important de plasmodiums dans certaines
zones rurales forestières en Afrique centrale. Les larves de An.
nili se développent aux abords des rivières et des fleuves
abritant de la végétation. Plusieurs auteurs ont
suggéré que An. nili est un groupe d'espèces
(Carnevale et al., 1992;Brunhes et al., 1999). Sur la base de
critères morphologiques, quatre espèces ont été
décrites :
- An. nili s.s.
- An. somalicus
- An. carnevalei signalé au Cameroun et
en Côte d'ivoire (Brunhes et al., 1999)
- An. ovengensisrécemment décrite au
Sud Cameroun (Awono-Ambene et al., 2004).
Très rarement capturé au repos à
l'intérieur des habitations, An. ovengensis serait plutôt
exophile tout comme An. somalicus, contrairement aux 2 autres qui sont
endophiles (Awono-Ambene et al., 2004).
1.4. TECHNIQUES
D'ECHANTILLONNAGEDES CULICIDES
1.4.1.
Collecte des stades pré-imaginaux
La méthode de collecte utilisée est celle du
«dipping» (Service, 1993). Elle consiste à prélever
l'eau du gîte à l'aide d'une louche ou d'un petit bac, puis y
rechercherles larves de moustiques. Ces larves sont alors collectées et
conservées dans des bocaux contenant de l'eau provenant de leurs
gîtes respectifs (lorsque les conditions précises d'élevage
ne sont pas connues) jusqu'à l'émergence.
1.4.2. Récolte des moustiques endophiles (faune
résiduelle)
Cette méthode de collecte fournit des spécimens
vivants pouvant permettre la réalisation des tests de sensibilité
et essais biologiques tel que des observations sur la mortalité des
moustiques dans les maisons traitées par un insecticide ou avec des
moustiquaires imprégnées. Elle permet aussi de faire des mesures
quantitatives parmi lesquelles :
- la diversité
spécifique des moustiques endophiles(se reposant à
l'intérieur des habitations),
-la mesure des densités
d'endophilie de chaque espèce,
-les changements saisonniers dans la
densité des moustiques se reposant à l'intérieur.
1.4.2.1. Récolte à
l'aspirateur de moustiques endophiles
Cette technique consiste à attraper directement les
moustiques au repos à l'aide d'un aspirateur. Ce type de récolte
fournit des informations sur les lieux de repos habituels, les densités
par habitation au repos et les variations saisonnières des
densités.
1.4.2.2. Capture au
pyrèthre de moustiques endophiles
Elle implique la pulvérisation spatiale d'insecticides
à l'intérieur descases pour assommer les moustiques se reposant
à l'intérieur et les ramasserensuite.Le choix de l'insecticide
utilisé est très important car ce dernier doit agir assez
rapidement pour ne pas laisser le temps aux moustiques de s'échapper et
sans les endommager.
1.4.3.
Capture des moustiques exophiles
Les données de collecte exophiles sont importantes pour
évaluer l'impact de la lutte antivectorielle et fournir des informations
sur les espèces se reposant habituellement à l'extérieur.
Cette capture se pratique dans les lieux de repos naturels ou dans des abris
spécialement aménagés à cette intention, abrisqui
ont l'avantage de fournir des échantillonnages plus
représentatifs pour un travail quantitatif. Les pièges à
insectes sont le plus souvent utilisés ici.
1.4.4. Capture sur volontaires humains et sur appâts
animaux
Cette technique consiste à capturer les moustiques au
moment où ils se posent sur un vertébré pour le repas de
sang. Elle permet d'étudier le niveau du contact homme/vecteur par
l'estimation de paramètres entomologiques tels que le taux de
piqûres (agressivité des vecteurs), le rapport d'endophagie ou
d'exophagie du vecteur.Elle permet également d'avoir une idée
sur :
-la composition spécifique de
la faune anophélienne anthropophage ;
- la détermination des
espèces localesvectrices du paludisme ;
- le rythme
nycthéméral des différentes espèces ;
La capture sur homme permet d'obtenir directement
"l'agressivité" des moustiques,toutes les autres méthodes de
récolte ne fournissant que des données d'interprétation
moins fiables. Le Goff et al., (1997) ont remarqué en zone
forestière du sud Cameroun que les densités anophéliennes
évaluées par homme-nuit ont été 1,6 fois plus
élevées dans les captures directes que celles obtenues avec les
moustiquaires pièges simples, celles-ci étant 4,7 fois plus
élevées que celles obtenues avec la méthode de la double
moustiquaire décrite par l'OMS (2003). Ainsi, malgré les
reproches des comités d'éthique, cette technique reste
nécessaire lors des premières enquêtes. Afin de pallier aux
risques d'infection, tous les captureursreçoivent un traitement
présomptif.
1.5.
MESURE DES INDICES ENTOMOLOGIQUES ET EPIDEMIOLOGIQUES
L'estimation quantitative de la transmission se fait par un
certain nombre d'indices mathématiques calculés à partir
des données recueillies lors des enquêtes entomologiques.Les trois
principaux paramètres qui interviennent dans les formules fondamentales
de la transmission du paludisme sont : le taux d'inoculation
entomologique, la capacité vectorielle et l'indice de stabilité
(MacDonald, 1957 ;Garret-Jones et Shidrawi, 1969).
Le taux d'agressivité(ma)
Il permet d'établir un rapport entre le taux
d'anthropophilie et la densité anophélienne. Il s'exprime en
nombre de piqûres par homme par unité de temps. Il s'obtient en
capturant les anophèles venant piquer l'homme et en divisant le nombre
de moustiques collectés par le nombre de sujets utilisés, par
unité de temps : piqûres par homme par heure (p/h/h)
ou par nuit (p/h/n) (Boudin et al., 1998).
L'Indice sporozoïtique (Is)
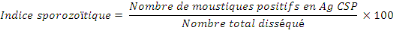
C'est le pourcentage d'anophèles porteurs
d'antigènes circumsporozoïtiques (Ag CSP). Les sporozoïtes
s'observent directement à l'état frais au microscope optique
après dissection des glandes salivaires des moustiques ou par la
recherche de l'antigène circumsporozoïtique grâce à la
technique ELISA. L'Is (obtenu par microscopie) peut ensuite être
comparé à l'Indice circumsporozoïtique (Ics) obtenu par
ELISA.
Taux d'inoculation entomologique (TIE ou
he)
Il représente le nombre de piqûres infectantes
que reçoit un homme pendant un intervalle de temps donné. C'est
le produit du nombre de piqûre par homme par nuit (taux
d'agressivitéma) par l'indice sporozoïtique (Is)
(Hamad et al., 2002). heest exprimé
en nombre de piqûres infectantes par homme et par an (pi/h/an).
Cette valeur est un bon indicateur de l'intensité de la transmission
dans un contexte de grande densité anophélienne (Beier et
al., 1999). Cependant, il ne peut pas être considéré
comme une mesure exacte de la transmission car toutes les piqûres
d'anophèles infectées n'aboutissent pas toujours à des
infections humaines.
Taux de parturité (Tp)
C'est le pourcentage de femellespares (ayant pondu au moins
une fois ? nullipares). C'est un paramètre qui permet de quantifier la
proportion de la population potentiellement infectante pendant une
période donnée, sachant que seules les anophèles pares
sont susceptibles d'être infectantes. Plus ce taux est
élevé, plus la population est âgée et
épidémiologiquementdangereuse
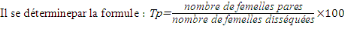 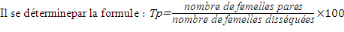 (Denitova, 1963) (Denitova, 1963)
Taux quotidien de survie (P)
Il peut être estimé à partir de la
proportion entre le nombre de femelles nullipares et pares dans la mesure
où la durée des cycles gonotrophiques2(*)(x) est liée au
taux de parturité. Mouchet et Carnevale (1991)ont estimé le cycle
gonotrophique de An. gambiaedans la région forestière du
sud Cameroun à 2 à 3 jours.
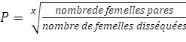 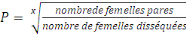 (Davidson, 1954). (Davidson, 1954).
Dans nos calculs nous avons retenu x = 3 jrs à
Santchou et 4 jrs à Dschang en nous basant sur les travaux de Tchuinkam
(2007). Si le taux quotidien de survie est inférieur à 50% alors
moins de 1% des Anophèles sont aptes à survivre durant 8
jours, durée nécessaire pour le développement complet du
parasite. Pour P. falciparum (qui requiert 10 à 12 jrs au moins
pour compléter son cycle extrinsèque) le taux minimum
nécessaire est 65% (Bruce-Chwatt, 1980a).
Les indices de stabilité (St)
Les notions de stabilité et d'instabilité ont
été introduites par MacDonald (1957) et ont permis d'identifier
deux zones :
Les zones de paludisme stable
présentent une transmission élevée, saisonnière ou
étalée sur la majeure partie de l'année, identique d'une
année à l'autre. Dans ces zones, les populations ont un certain
degré de prémunition contre la maladie et il n'y a presque pas
d'épidémies mais juste des pics saisonniers dus à la
pullulation des vecteurs. Les personnes atteintes sont principalement les
enfants de moins de 5 ans et les femmes enceintes.
Dans les régions de paludisme
instable, la transmission est généralement faible
et variante d'une année à l'autre. Le vecteur y est peu
anthropophile, son espérance de vie est faible. La population acquiert
peu ou pas d'immunité et de ce fait, les infections palustres se
traduisenttrès souvent par des cas cliniques. Ces régions peuvent
être sujettes à des poussées épidémiques.
Toutes les classes d'âge sont affectées (Mouchet et al.,
2004).
L'indice de stabilité prend en considération 2
facteurs principaux : l'espérance de vie (1/-lnP), et l'indice
d'anthropophilie (a)
a = indice d'anthropophilie
p = taux quotidien de survie
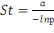 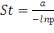 (Mac Donald, 1957) (Mac Donald, 1957)
- Si St< 0,5 le paludisme est instable,
pouvant provoquer des épidémies.
- Si 0,5 = St = 2,5 le paludisme est de
stabilité intermédiaire.
- SiSt> 2,5 le paludisme est stable
La capacité vectorielle (CV)
avec : ma² = taux de piqure sur homme au
carré
x = durée du cycle sporogonique du parasite
px/logep = espérance de vie
infectante
Selon les régions et les saisons, les vecteurs du
paludisme peuvent être plus ou moins efficaces. Les principaux
paramètres permettant l'évaluation de la capacité
vectorielle sont : l'aptitude du vecteur à s'infecter, son aptitude
à assurer le développement du parasite et l'aptitude à le
transmettre (Rodhain et Perez, 1985). La capacité vectorielle exprime
à la fois le degré de coadaptation entre vecteur et parasite et
le fonctionnement du système ainsi formé dans un environnement
donné. Cette notion a été quantifiée par Mac Donald
(1957) puis Garret-Jones (1964) et représente le nombre de nouvelles
inoculations attendues par jour (Garret-Jones et Shidrawi, 1969).On la calcule
en utilisant la formule ci-après :
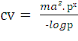 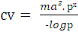 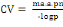 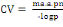 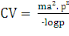 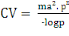 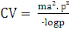 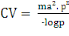
1.6. LE CONTRÔLE DU
PALUDISME
La lutte contre cetteendémie se fait suivant deux
approches différentes :
-empêcher l'inoculation du parasite à l'hommeen
éliminant les vecteurs ou en évitant leurs piqûres(lutte
antivectorielle) ;
-bloquer ledéveloppement du parasite dans l'organisme
de l'homme (prise en charge précoce des cas).
L'absence d'un vaccin efficace de nos jours fait de la lutte
antivectorielle la principale méthode préventive contre le
paludisme.
1.6.1. La lutte antivectorielle
La lutte antivectorielle vise principalement à
réduire la transmission et par conséquent l'incidence du
paludisme en agissant sur la population des vecteurs à ses
différents stades de développement.
1.6.1.1. Lutte contre les
stades larvaires
Elle consiste en premier àéliminerles conditions
propices à la vie pré-imaginale : le drainage des marais et
l'utilisation d'huile de naphte pour la destruction des larves sont des mesures
anciennes de lutte antilarvaire (Gentilini et Nozais, 1991). A celles-ci il
faut ajouter l'aménagement et l'assainissement de l'environnement, la
destruction des petits réservoirs d'eau (les pneus de voitures, les
boîtes de conserves, les bouteilles) et les petites flaques d'eau pouvant
servir de gîtes larvaires.
En second lieux, on peut effectuer la lutte biologique qui
passe par l'utilisation des entomopathogènes larvaires tel que
Bacillus thuringiensis H14 et des poissons larvivores tels que
Gambusia affinis en eaux claires et Poecilia reticulata
(guppy) en eaux polluées. En Somalie l'utilisation de
Oreochromis spilurus a donné des résultats encourageants
(Mouchet et al., 2004).
La lutte chimique peut également être
envisagée. Elle présente l'avantage d'être rapide et
efficace mais pourrait avoir des effets secondaires peu
appréciés. Les larvicides sont pour cela utilisés (Walker,
2002).
1.6.1.2. Lutte contre les
adultes
Se protéger contre les piqûres de moustiques sert
non seulement à éviter les nuisances mais également les
infections. Parmi les moyens de lutte, onpeut citer :
Ø Les moustiquairesdont
l'utilisation remonte aux temps des pharaons en Egypte, sur les bords du Nil
(Bruce-Chwatt, 1980b). L'acceptation des moustiquaires par les
populations est liée surtout aux nuisances culicidiennes ;
celles-ci représentent l'élément motivant des populations,
moins sensibles à l'évocation des risques du paludisme (Mouchet
et al., 2004). Les moustiquaires imprégnées sont
aujourd'hui considérées comme un moyen de protection durable,
applicable à large échelle à toutes les tranches
d'âge de la population, avec un succès
épidémiologique confirmé, car utilisées
correctement et maintenues en bon état, elles procurent une protection
totale aux dormeurs.
Ø Les pulvérisations
intradomiciliaires d'insecticidessont très efficaces si
leur utilisation est adéquate. Pendant toute la période
d'éradication du paludisme, les pulvérisations intradomiciliaires
ont été à la base de la lutte antipaludique (Mouchet
et al., 2004).L'efficacité de cette technique dépend du
lieu de repos des vecteurs. En région d'altitude, ces derniers
deviennent très endophiles pour se protéger du froid. Bien que
l'aspect préventif de cette lutte ne soit souvent pas le souci majeur
des populations, elle contribue de façon non négligeable à
la réduction de la transmission du parasite car les insecticides de
contact réduisent non seulement la densité, mais aussi la
longévité des anophèles.
Ø L'utilisation de produits
répulsifs ouinsectifugesqui sont des substances chimiques
visant à repousser les insectes ou à les empêcher
d'attaquer l'homme et les animaux. Ils provoquent chez l'insecte une
altération de la conduite de repérage de l'hôte,
aboutissant à une déviation du vol, l'éloignant de sa
cible(Combemale, 2001). Le choix d'un répulsif est difficile car il
n'existe pas de molécule universellement active pour éloigner les
moustiques. Les répulsifs couramment utilisés sont soitd'origine
naturelle surtout les huiles essentielles, l'essence de citronnelle en Europe,
soit de synthèse avec le diméthylphtalate,
l'éthylexanediol, le diéthyltoluamide (DEET) insectifuge de
référence ou les nouvelles molécules le 35/35,la
pipéridine, le baye repel ou KBR 3023 (Combemale, 2001). Des produits
locaux ont souvent été utilisés : l'huile de palme en
Guinée, la fumée de diverses essences, l'huile essentielle de
Ceylan et de Javacontenant de la Citronella (Mouchet et al.,
2004).
Ø Des techniques du génie
génétique : dispersion de mâles
stériles, modifications génétiques sur les vecteursetc.
sont en cours de perfection ;cependant, les scientifiques craignent
l'impact biologique et environnemental que ces méthodes peuvent avoir
à long terme.
1.6.2. La prise en charge des malades
Le premier traitement efficace contre le paludisme fut
découvert au 17ème siècle en Amérique du
Sud : l'écorce du Quinquina. Par la suite, le principe
actiffût isolé de cette écorce et reçu le nom de
Quinine. Il existe de nos jours de nombreux produits de synthèse (Amino
4 quinoléines, Amino 8 quinoléines,Aminoalcools...)qui sont
actifs sur différents stades du parasite. Le traitement en masse des
sujets infectés est impossible car il existe plusieurs souches de
parasites et, au sein de chaque souche, plusieurs capacités d'adaptation
et de résistance. Le traitement des sujets en équilibre avec leur
infection risque de diminuer leur immunité et d'en faire ensuite la
cible d'une souche plus virulente et accentuer la chimiorésistance.
Il est donc nécessaire d'accentuer la prophylaxie
individuelle avec un suivi de chaque malade et s'assurer de sa bonne
guérison afin de limiter le développement des résistances.
Les antimalariques sont choisis par les spécialistes en fonction des
efficacités régionales.
1.7.
HYPOTHESES ET OBJECTIFS DE L'ETUDE
La causalité complexe d'une épidémie de
paludisme comporte une multitude de variables qui ne sont pas totalement
indépendantes, en ce sens qu'elles s'associent
généralement à un certain nombre d'ensembles qui une fois
connus, peuvent être utiles pour prévoir l'évolution et
l'impact probable des variables qui les composent et par voie de
conséquence, pour savoir comment les maîtriser. Comme variable, la
séparation des groupes d'individus d'une population dans des
régions présentant des caractéristiques différentes
entre autres, peut avoir des effets sur leur morphologie et leur physiologie.
En général, chaque espèce se différencie de son
groupe d'origine lorsqu'elle s'en trouve séparée par une
barrière écologique. Les modifications sont alors dues aux
adaptations des populations à leur microclimat. La présence d'une
falaise forestière entre Dschang et Santchoucorrespondant àune
variation brusque d'altitude avec des variations des conditions climatiques,
pourrait avoir un effet sur la structure et la dynamique des vecteurs. Dans la
suitedu travail, il s'agira de :
· Déterminer la composition spécifique des
populations de vecteurs de part et d'autre de la falaise ;
· Comparer la composition des membres du complexeAn.
gambiae dans la plaine et sur le plateau ;
· Déterminer le niveau d'infection des
anophèles par les plasmodiums dans les deux sites altitudinaux ;
· Calculer les indices entomologiques de transmission et
en déduire le niveau de stabilité du paludisme dans les deux
zones d'étude.
Chapitre 2
Chapitre
2 :MATERIEL ET METHODES.
2.1.
SITES D'ETUDE
Notre étude a été réalisée
dans deux villes assez proches (22 Km à vol d'oiseau)
dudépartement de la Menoua, province de l'Ouest, se caractérisant
par une brusque variation d'altitude entre elles, variation due à la
présence d'une grande falaise nommée "falaise des Mbô"
d'une hauteur de 650m. Ce sont : Dschang (chef-lieu du département)
situé à 1400m d'altitude et, au bas de la falaise, Santchou
(arrondissement) situé à 750m d'altitude.
2.1.1.
Dschang
C'est une ville située au sud-ouest du plateau
Bamiléké, à 5°27' Nord et 10°04' Est,
délimitée au sud par la falaise des Mbô et au nord-est par
les monts Bamboutos. La population est composée d'autochtones, en
majorité cultivateurs,et de nombreux étudiants. Cette
localité se trouve en zone de climat tropical de montagnes. Sa
végétation est de type savane arborisée, partiellement
éclairée par des zones d'urbanisation. Les températures
moyenne sont plutôt basses (18°C 6). La pluviométrie moyenne
annuelle est de 1900 mm/anavec une humidité relative moyenne de 75%.
Elle présente un faible réseau hydrographique et un lac de
retenue qui, associé à la topographie de la région, offre
de bons sites larvaires malgré le relief accidenté, comme
indiqué par l'enquête transversale de Garde et al. (1991)
et les travaux de Tchuinkam (2007).
Les différentes saisons existant dans cette
localité sont :
· La saison
sèchereprésentée par deux
périodes :
- La petite saison sèche qui va de juin à
juillet ;
- La grande saison sèche de décembre à
mars ;
· La saison des pluies elle
aussi représentée par deux périodes :
- La petite saison des pluies entre avril et mai ;
- La grande saison des pluies du mois d'août à
celui de novembre (Brenghes et Eouzan, 1979).
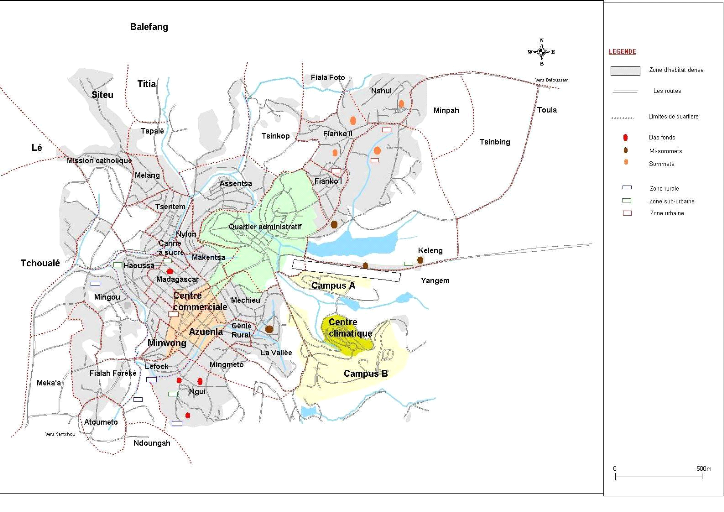
La figure 5 donne la répartition des cases en
fonction de la topographie et de l'urbanisation à Dschang. Elles sont
reparties dans trois zones :
- La zone rurale où les populations sont moins
concentrées, l'habitat est le plus souvent en briques de terre (non
crépie), et l'accès aux services utilitaires (eau et
électricité) est faible ;
- La zone suburbaine avec des constructions en brique de
terre, en semi dur ou en dur ; la concentration humaine augmente ;
- La zone urbaine où les constructions sont pour la
plupart en matériaux définitifs, le niveau de salubrité
est meilleur que dans les autres zones et les gîtes larvaires sont
pollués.
Site de capture
0 500m
500 km
Dschang
Santchou
Source : Département
de Géographie, Université de Dschang
Figure 5 :
Répartition des cases de captures à DschangTableau 1 :
Localisation des sites de capture en fonction de l'urbanisation
à Dschang
|
Degré d'Urbanisation
|
Quartiers
|
|
Zone Urbaine
|
Paidground, Nkeleng
Côte d'azur
|
|
Zone Suburbaine
|
Madagascar, Ngui Nord,
Foto, Mission catholique Est
|
|
Zone rurale
|
Mission catholique Nord,
Ngui Ouest
|
2.1.2. Santchou
Située à la frontière sud de la Menoua
à 5°25' Nord et 10°10' Est, elle est limitée au
sud par les chaînes montagneuses du Manengouba et au nord par une falaise
la limitant de la région de Foréké, du côté
de Dschang. C'est une zone relativement plane et inondée en saison de
pluies et serpentée par la rivière Nkam. La
végétation est constituée d'une savane arbustive avec
quelques régions boisées isolées le long des ruisseaux. La
température moyenne est de 25°C 3, l'humidité relative 80%
et la pluviométrie moyenne annuelle 2200 mm/an.La répartition des
saisons est semblable à celle de Dschang,soit quatre saisons par an
(archives SEMRY).
L'approvisionnement en eau courante n'étant pas encore
assuré, la population consomme l'eau des puits etforages, ce qui
augmente la prévalence des maladies du péril fécal et
réduit la santé publique et conséquemment la
résistance individuelle au paludisme. Les gîtes larvaires sont
constitués par les eaux de puits, des flaques d'eau, des eaux
d'inondations et des rizicultures.
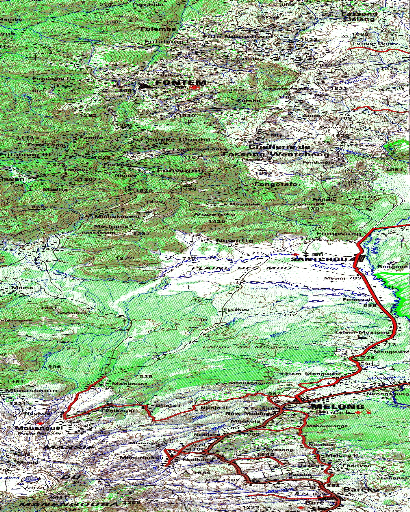
A Santchou (figure 6), les habitations choisies pour
les captures nocturnes sont réparties en fonction du niveau
d'urbanisation. Lecentre-ville de Santchou représente la zone urbaine et
les cases y sont choisies en fonction de l'éloignement de l'axe routier
(tableau 2).La zone suburbaine est représentée par les quartiers
périphériques avec des habitations isolées et
entourées de quelques bosquets etla zone rurale par un regroupement de
cases situées dans les plantations au bas de la falaise.Les maisons de
capture ont été choisies en fonction de la proximité des
gîtes permanents ou temporaires et surtout, de la coopération des
habitants.
Tableau 2 : Localisation des sites de
capture en fonction de l'urbanisationdans la plaine
|
Degré
d'Urbanisation
|
Quartiers
|
|
Zone urbaine
|
Cassalafarm, Madagascar et "Nouveau quartier"
|
|
Zone Suburbaine
|
Fombap
|
|
Zone rurale
|
Ntengué
|
Route Principale
Route secondaire
Cours d'eau
Piste
Courbe de niveau altitudinale
Source : CNC Yaoundé
Figure 6 :Carte
de la région de la plaine des Mbô
2.2.COLLECTEDES MOUSTIQUES
Les descentes sur le terrain ont été faites une
fois par saison afin d'avoir une diversité sur toute une année.
Deux techniques de capture ont été utilisées :
2.2.1. La capture sur volontaires
Pour ce faire, les aspects éthiques ont
été pris en compte tout au long du processus de
préparation de notre étude pour garantir aux "captureurs" et
résidents des habitations retenues une juste information sur leur
participation et leurs droits dont le respect est assuré pendant toute
la période, ainsi que de leur libre consentement. Aussi, tous les
volontairesont reçuaprès les captures un traitement
présomptif à base d'une combinaison
Amodiaquine-Artésunate.
La capture est faite de nuit car les anophèles ont une
activité nocturne. Les "captureurs"étaient de jeunes hommes de 18
à 30 ans qui, après avoir été formés,
collectaienteux-mêmes les moustiques dans leurs domiciles,certains
à l'intérieur des habitations et d'autres à
l'extérieur. Deux équipes étaient utilisées :
la première travaillant de 18h à 01h et la seconde de 01h
à 06h. Leur équipement était composé d'un
réveil, de sacs marqués par tranches horaires,d'une torche
à pilesetde tubes à hémolyse pour contenir les moustiques.
Ils attrapaient les moustiques au moment de la piqûre à l'aide des
tubes qu'ils bouchaient ensuite avec du coton. Ces tubes étaient
numérotés en fonction des lieux de captures et des tranches
horaires puis rangés au frais.
2.2.2. La capture par pulvérisation intra-domiciliaire
d'insecticide
Cette méthode encore appelée "Capture au
pyrèthre*(*)" (WHO,
1975)permet de récolter les espèces endophiles et d'avoir des
spécimens semi-gravides. Les pulvérisations étaient
réalisées dans le maximum de domiciles entre 15h et 17h. A
l'intérieur des chambres, des draps blancs étaient
étalés sur toute la surface du sol (pour faciliter la
visualisation) et les ouverturesétaient fermées. Après
avoir mis à l'abri les aliments et ustensiles susceptibles,
l'insecticide était pulvérisé. Après le
knock-down*(*)* et
la dissipation de l'insecticide, les moustiques assommésétaient
ramassés et rangés dans des boîtes pour l'identification et
les analyses ultérieures.
2.3. IDENTIFICATION DES
MOUSTIQUES
L'identification des moustiques se fait en deux phases :
- l'identification morphologique est faite juste après
les récoltes et permet de distinguer les différentes groupes ou
complexes d'espèces ;
- l'identification moléculaire faite au laboratoire
permet de discriminer les complexes d'espèces qui ne peuvent pas
être différenciées morphologiquement.
2.3.1.
Identification morphologique
L'identification morphologique des moustiques se faisait au
courant de la nuit ou tôt le matin après les captures sous une
loupe binoculaire (×40) en s'aidant des clés d'identification des
anophèles de Gillies et De Meillon (1968) et Gillies et
Coetzee(1987).Les moustiques appartenant au genre
Anophelesétaient rangés dans des tubesde 1,5 ml
contenant du sillicagel (déssicant) recouvert d'une couche de coton. Ces
tubes numérotés étaient alors conservés dans une
glacière contenant des "iceblocs" avant d'être rangés
à -20°C.
2.3.3. Identification moléculaire
Les analyses approfondies sont effectuées au
laboratoire de paludologie de l'OCEAC à Yaoundé. Les
échantillons ramenés du terrain sont conservés au
congélateur à -20°C. Après l'identification
morphologique, ceux appartenant au complexe An. gambiaesont
utilisés pour les analyses génétiques.
2.3.3.1. Identification des
membres du complexeAn gambiae
Elle se fait par des analyses comparatives du matériel
génétique des spécimens. La première partie du
travail consiste à isoler ce matériel génétique
(ADN), ensuite l'amplifiersuivant la technique de PCR(polymerase chain
reaction), et enfin la migration de l'ADN amplifié sur gel
d'agarose.
Extraction de l'ADN
Principe : La technique
d'extraction est basée sur la notion de solubilité
différentielle des molécules entre deux phases non miscibles.
L'extraction se fait par la technique de précipitation par l'alcool
décrite par Cornel et Collins (1996), sur deuxà trois pattes par
moustique.
Protocole : Pour chaque
échantillon, les pattes sont placées dans unmicrotube
stérile de 1,5 ml contenant 50 ul de tampon de broyage(Annexe 1, Tableau
A). A l'aide d'un broyeur à piles, les pattes sont entièrement
macérées et le broyat est incubé pendant 30 min dans un
bain sec à 65°C. On y ajoute ensuite 13ul d'acétate de
potassium 8M et on homogénéise aussitôt la solution
grâce à un Vortex. Ce mélange est ensuite incubé 30
min dans la glace pour précipiter les débris cellulaires, puis
centrifugé à 1400 tours/min à 4°C pendant 15 min. Le
surnageant est transféré dans un autre tube auquel on ajoute 200
ul d'éthanol 100% à -20°C et on laisse au repos à
température ambiante pendant 5 min pour que l'ADN puisse
précipiter au fond du tube.
Une nouvelle centrifugation à 14000 tours/min pendant
20 min permet la formation d'un culot d'ADN peu visible au fond du tube.
Après avoir vidé l'éthanol, le culot est rincé avec
200 ml d'éthanol 70% et passé au séchoir sous vide
(speed-vac). L'ADN ainsi isolé est reconstitué dans 100ul d'eau
distillée stérile et laissé à 4°Cpendant au
moins 12h.
Amplification de l'ADN
Principe : L'amplification des
différents loci est faite suivant la technique de polymérisation
en chaîne (PCR) de Scott et al., 1993. Elle consiste à
utiliser des amorces qui s'hybrident à des sites complémentaires
(séquences flanquâtes) situés de part et d'autre de la
séquence d'ADN cible. Cela requiert la présence de composantes
regroupées dans un "milieu réactionnel" (Tableau B, Annexe 1).
Protocole :
Quatre amorces différentes ont été
utilisées pour la réalisation de la PCR : une amorce
universelle (UN) et trois spécifiques (GA, AR, et ML) dont la
séquence, la taille attendue et la localisation sont
présentées en annexe 2. L'amplification se déroule dans un
thermocycleur (Applied Biosystems system 2700) selon le programme
illustré en figure 6 en 3 étapes :
· la dénaturation de l'ADN
à haute température (94°C) pour séparer les 2 brins
de l'ADN
· l'hybridation des amorces
spécifiques à une température propre au type
d'amorce : 56°C,
· l'élongation des brins d'ADN
néoformés par l'enzyme de polymérisation à
72°C.
Ces cycles se répètent 35 fois3(*) et le nombre de copies de la
séquence choisie subit une augmentation exponentielle car chaque nouveau
brin formé sert de matrice à la synthèse d'un autre brin.
De manière théorique, le nombre final de copies devrait
être de 2n (n étant le nombre de cycles), mais le
rendement est plus faible en pratique. A la fin de la réplication, la
température s'abaisse à 4°C pour éviter toute
dénaturation de l'ADN.
94°C94°'30"
4°C8
56°C30"
72°C72°C
20"10'
35 cycles
Figure 7 :Programmation du thermocycleur pour la
PCR complexe An. gambiae
Détermination des génotypes :
migration électrophorétique
Principe : Les acides
nucléiques sont des macromolécules polyanioniques, de charge
négative en milieu basique. Placés dans un champ
électrique, ils vont se déplacer vers l'anode, mais leurs charges
respectives étant à peu près équivalentes, c'est
leur masse moléculaire qui va déterminer la vitesse de migration
entre les mailles du gel. Plus ils sont légers, plus ils migrerontvite.
Le gel d'agarose permet la séparation de fragments de taille comprise
entre 0,5 et 20 kb.
Préparation du gel :
Pour un gel d'agarose à1,5%, nous mesurons un
volume(V) de tampon TBE 1X (tris-borate-EDTA)
correspondant à laplaque (moule) à utiliser (le choix d'une
plaque est fonction du nombre de puits qu'elle comporte et donc du nombre
d'échantillons à faire migrer). On y ajoute une masse d'agarose
(m)proportionnelle à la concentration attendue :
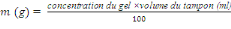 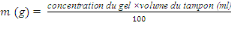 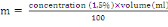 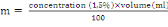
L'ensemble est passé aux micro-ondes jusqu'à
ébullition puis refroidi à 50° environet on y ajoute5ul de
BET (bromure d'éthidium). Cette solution est coulée dans lemoule
auquel on ajoute des peignes pour former les puits. Après la
polymérisation à température ambiante (1h), les peignes
sont retirés et la plaque est placée dans une cuve de migration
remplie de TBE 1X.
Distribution et migration des
échantillons :A l'aide d'une micropipette, des
gouttelettes de 2ul de bleu de charge (bleu de bromophénol 0,25% + bleu
de xylène cyanol 0,25% + sucrose 4% + ED) sont déposées
sur un morceau de parafilm.Elles permettront de maintenir l'ADN au fond des
puits et faire apparaître les bandes sous UV. Ensuite, 10ul de chaque
échantillon d'ADN amplifié sont mélangés au bleu de
charge puis déposés au fond de chaquepuits. A ces
échantillons sont ajoutés les 3 témoins positifs (An.
gambiae s.s., An. melaset An.arabiensis),le témoin négatif,
ainsi que le marqueur de taille (5ul de 100bp ladder). La cuve est enfin
branchée à un générateur de courant continu
(100volts) pendant 1h30min.
Lecture et interprétation :
Après migration, le gel est photographié sous
lumière ultraviolette. Des bandes correspondant à l'ADN ayant
migré sont visibles grâce à la fluorescence des
molécules de BET fixées sur l'ADN. La correspondance avec les
bandes des témoins positifs et celles du marqueur de taille permet de
déterminer l'espèce (en fonction des tailles attendues).
2.3.3.2. Détermination
des formes moléculaires de An. gambiae s.s.
Ø 5' ... GCG C ... 3'
3' ... C GCG ... 5'
Principe :
L'endonucléase Hhal (Haemophilus haemoliticus),enzyme
de restriction, digèreles moléculesd'ADN et entraine leur rupture
au niveau des sitesderestriction présentéecomme suit :
Protocole : Les produits de
l'amplification sont distribués (10ul) dans des microtubes de 0,2ml
contenant 15ul du "Master MIX" préalablement préparé sur
glace (Tableau C, Annexe 1). Cet ensemble est placé à
l'étuve (37°C) pendant au moins 3h ou toute une nuit.
Après digestion, on fait migrer le produit sur un gel
d'agarose à 2% avec des témoins positifs (An. gambiae M
et S) et le marqueur de tailles. L'ensemble sera photographié
sous UV. Les tailles attendues sont 727 pb pour la forme M et 475 pb pour la
forme S.
2.4. DETERMINATION DE
L'INFESTATION DES ANOPHELES
La mise en évidence de l'infestation des
anophèles femelles par Plasmodium a été faite par
la technique ELISA (Enzyme Linked ImmunoSorbent Assay) qui permet
de détecter la protéine circumsporozoïte de
Plasmodium (CSP) dans l'organisme des anophèles. La technique
utilisée est celle de Burkot et al., (1984)
améliorée par Wirtz et al., (1987).
Principe : Elle consiste
à coupler la protéine CSP à un anticorps monoclonal de
capture (ACm) anti-circumsporozoïte(anti-CSP) préalablement
fixé sur la paroi des puits d'une plaque. Le complexe
antigène-anticorps formé est ensuite révélé
par un anticorps monoclonal anti-CSP couplé à la peroxydase
(marqué). L'adjonction d'un substrat qui sera dégradé sous
l'action de l'enzyme induit une réaction colorée visible et dont
la densité optique sera mesurée par spectrophotométrie
(figure 7).
Puits de la plaque
fixation
Ac
Ac : anticorps
Ag : antigène
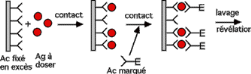
Figure 8 :Schéma du principe de
la technique "ELISA sandwich"
Protocole ELISA-CSP
monospécifique : La tête et le thorax de chaque
moustique sont coupés et placés dans des tubes
numérotés. On y ajoute 20ul de Np40 (détergent qui
facilite la destruction des tissuspar hydrolyse des protéines
membranaires) et le tampon de broyage "Blocking Buffer" (BB) à raison de
2x190ul par tubes et on les broie. Ces broyats sont conservés pendant
1hà -20°C.
Chaque plaque ELISA (Plaque de Nunc à 96
puits) est sensibilisée à raison de 50ul d'ACm de capture par
puits et laissée une nuità +4°C, ce qui permet l'adsorption
de l'ACm sur les parois de la plaque. Le lendemain, les plaques sont
vidées, puis sans les laver, 200ul de tampon BB sont mis dans chaque
puits pour saturer les sites de fixation libres des ACm. Après 1h
d'incubation à température ambiante, les plaques sont
vidées de nouveau et 50ul du broyat de moustique sont ajoutésdans
chaque puits. La colonne de négatifsne reçoit que du BB et pour
les puits des témoins positifs, 50ul de protéine
circumsporozoïtique de l'espèce (P. falciparum) sont
utilisés (annexe 3).
Après 2h d'incubation les plaques sont vidées et
lavées 2 fois au PBS/Tween20. Ensuite on ajoute une solution d'ACm
conjugué à la peroxydase (50ul/puits) préparée 10
min à l'avance. Après 1h d'incubation à température
ambiante, les plaques sont de nouveau vidées et lavées 4 fois au
PBS/Tween 20. Le substrat préparé 5 min avant la fin de
l'incubation est distribué à raison de 100ul/puits. Les plaques
sont alors conservées 30 minutes à l'obscurité. La
dégradation du substrat sous l'action de la peroxydase se traduit par
une coloration bleue.
Cette réaction est stoppée en ajoutant 50ul
d'acide sulfurique 4N par puits, ce qui change la coloration bleue en une
coloration jaune. La lecture s'effectue au moyen d'un spectrophotomètre
à 450 et 650 nm. L'intensité seuil des positifs est fixée
à deux fois la moyenne des témoins négatifs. La
composition des réactifs et les quantités utilisées sont
présentées en annexe 4.
2.5. ANALYSE DES DONNEES
Toutes les données ont été
cataloguées à l'aide du logiciel Excel version 2007 qui nous a
également permis de faire les analyses statistiques (moyennes,
fréquences...). Le test khi-deux (÷2) calculé
avec le logiciel EPI INFO version 6 a été utilisé pour
comparer les fréquences spécifiques et autres indices
entomologiques obtenus dans chaque localité.
Chapitre 3
Chapitre
3 :RÉSULTATS ET DISCUSSION
3.1. LA FAUNE ANOPHELIENNE
3.1.1.
Composition spécifique de la faune anophélienne
Durant les deux années de récoltes de
spécimens, entre août 2004 et novembre 2006, un total de 5084
anophèles a été récolté. En plus de
celles-ci nous avons obtenu un grand nombre de moustiques appartenant aux
genres Culex et Aedes, mais celles-ci n'ont pas
été prises en compte dans la présente étude. Au
total, 11 espèces d'anophèles ont été
répertoriées dans les deux sites.An. gambiae, An.
funestuset An. paludissont les espèces les plus abondantes
avec comme fréquences respectives 86,37%, 5,74%, et 4,29%. Les autres
espèces ont présenté des fréquences relativement
faibles, inférieures à 1,5% (Tableau 3).
3.1.2. Productivité des
différentes techniques de capture
Cinquante une (51) nuits de capture, totalisant 264
hommes-nuits ont été réalisées à Santchou et
3424 anophèles reparties en 10 espèces ont été
collectées. La capture au pyrèthre a représenté
17,23% de la densité totale et 3 espèces seulement y sont
représentées : An. gambiae,An. funestus et An.
nili. Au cours des captures nocturnes, les 10 espèces
répertoriées ici ont été retrouvées et le
rendement en nombre (0,82 soit 82,77%) a été la plus
élevé.
A Dschang, 51 nuits de captures nocturnes, totalisant 288
hommes-nuits, ont été réalisées. Au terme de
celles-ci, 1660 anophèles ont été capturés
appartenant à 9 espèces. Anopheles gambiae s.l.. et
An. funestus ont été les seules espèces
capturées en journée, au repos dans les habitations (par
pulvérisation) mais à des taux bien faibles : 6,80% pour
An. gambiae s.l.. et 3,08% pour An. funestus. Ce qui donne au
total 06,39% pour la capture diurne par pulvérisation contre 93,61% pour
la capture nocturne.
La capture sur volontaires(CNV) a été la plus
rentable avec 4387 anophèles capturés (86,31% du
total)(figure 8). Elle a permis de recenser toutes les onze
espèces citées plus haut. La capture par pulvérisation
(CPI) a permis d'avoir 696 anophèles (13,69%) appartenant à 3
espèces. La différence de densité anophélienneentre
les deux sites a été significative pources deux méthodes
aussi bien pour les captures par pulvérisation (÷2 =
87,57 ; P < 0,005) que pour les captures sur hommes (÷2
= 8,02 ; P = 0,0046).
Capture par pulvérisation
Capture sur volontaires

Figure
9 :Densités des anophèles en fonction du mode de
récolte des échantillons à Dschang et Santchou
d'août 2004 à novembre 2006
Tableau
3 :Composition spécifique de la faune anophélienne
de Dschang et Santchou d'août 2004 à novembre 2006
|
Espèce
|
|
Santchou
|
|
Dschang
|
|
Total(%)
|
|
CNV
|
CPI
|
|
CNV
|
CPI
|
|
|
An. coustani
|
|
3
|
0
|
|
3
|
0
|
|
6 (0,12)
|
|
An. funestus
|
|
120
|
42
|
|
126
|
4
|
|
292 (5,74)
|
|
An. gambiae
|
|
2347
|
545
|
|
1397
|
102
|
|
4391 (86,37)
|
|
An. hancocki
|
|
1
|
0
|
|
4
|
0
|
|
5 (0,10)
|
|
An. moucheti
|
|
0
|
0
|
|
6
|
0
|
|
6 (0,12)
|
|
An. namibiensis
|
|
26
|
0
|
|
0
|
0
|
|
26 (0,51)
|
|
An. nili
|
|
52
|
3
|
|
1
|
0
|
|
56 (1,10)
|
|
An. paludis
|
|
211
|
0
|
|
7
|
0
|
|
76 (4,29)
|
|
An. pharoensis
|
|
1
|
0
|
|
0
|
0
|
|
1 (0,02)
|
|
An. wellcomei
|
|
5
|
0
|
|
2
|
0
|
|
7 (0,14)
|
|
An. ziemanni
|
|
68
|
0
|
|
8
|
0
|
|
218 (1,49)
|
|
Sous-total(%)
|
|
2834 (82,77)
|
590 (17,23)
|
|
1554(93,61)
|
106(06,39)
|
|
5084
|
|
Total (%)
|
|
3424 (67,35)
|
|
1660 (32,65)
|
|
CNV : Capture nocturne sur hommes volontaires ;
CPI : capture par pulvérisation d'insecticides
Tableau 4 :
Variations saisonnières de la faune anophélienne
à Dschang et Santchou d'août 2004 à novembre 2006
|
Espèces
|
|
Saisonssèches (%)
|
|
Saisons des pluies(%)
|
|
Total (%)
|
|
An. coustani
|
|
4 (0,57)
|
|
2 (0,05)
|
|
6 (0,12)
|
|
An. funestus
|
|
97 (13,92)
|
|
195 (4,44)
|
|
292 (5,74)
|
|
An. gambiae
|
|
564 (80,92)
|
|
3827 (87,24)
|
|
4391 (86,37)
|
|
An. hancocki
|
|
1 (0,14)
|
|
4 (0,09)
|
|
5 (0,10)
|
|
An. moucheti
|
|
0 (0,00)
|
|
6 (0,14)
|
|
6 (0,12)
|
|
An. namibiensis
|
|
0 (0,00)
|
|
26 (0,59)
|
|
26 (0,51)
|
|
An. nili
|
|
21 (3,01)
|
|
35 (0,80)
|
|
56 (1,10)
|
|
An. paludis
|
|
1 (0,14)
|
|
217 (4,95)
|
|
76 (4,29)
|
|
An. pharoensis
|
|
1 (0,14)
|
|
0 (0,00)
|
|
1 (0,02)
|
|
An. wellcomei
|
|
4 (0,57)
|
|
3 (0,07)
|
|
7 (0,14)
|
|
An. ziemanni
|
|
4 (0,57)
|
|
72 (1,64)
|
|
218 (1,49)
|
|
Total
|
|
697(13,71)
|
|
4387(86,29)
|
|
5084 (100)
|
3.1.3. Variations
saisonnières des populations anophéliennes
Les récoltes de spécimens ont été
étalées pendant toutes les saisons de la région. La
distribution des différentes populations entre les deux types de saisons
n'est pas homogène (Tableau 4). Certaines espèces à
l'instar de An. moucheti et An. namibiensis n'ont pas du tout
été capturées en saison sèche. Ainsi,
lepourcentagede la populationen saison sèche (13,71%)a été
bien plus faible que celui de la saison des pluies (86,29%). Malgré une
baisse de densité en saison sèche, An. funestus et
An. nili montrent plutôt une augmentation importante de leur
fréquence dans la population totale. An. pharoensis n'a
été retrouvé qu'en saison sèche mais sa
densité très faible (1 seul individu) rend ce résultat
difficilement interprétable.
3.2. STRUCTURE DU COMPLEXE
ANOPHELES GAMBIAE
3.2.1. Composition du complexe
Anopheles gambiae
Le test "PCR complexe gambiae" effectué sur un
total de 430 spécimens a révélé la présence
d'une seule des 3 espèces du complexe présentes au Cameroun
soitAn. gambiae s.s.(390pb)à Santchou comme à Dschang.
La révélation sur gel d'agarose de quelques spécimens est
illustrée par la figure 9.
3.2.2. Formes moléculaires
de Anopheles gambiae s.s.
Sur un total de 312 An. gambiae s.s. testés,
nous avons obtenu 309 résultats positifs, tous de forme
moléculaire S avec un poids moléculaire de 475 pb après
amplification,et 3 résultats négatifs. Aucun échantillon M
(727 pb)n'a été retrouvé dans les deux sites. Le profil de
migration est présenté enfigure 10.
3.3.VARIATIONS DE LA COMPOSITION
SPECIFIQUE ET DES INDICES ENTOMOLOGIQUES AVEC L'ALTITUDE
3.3.1. Variation de la
composition spécifique de la faune anophélienne
Les captures ont été plus productives dans la
région de basse altitude (Santchou) avec 67,35% de l'effectif total,
qu'en haute altitude (Dschang)avec 32,65% du total (Tableau 3).
A
Santchou : L'espèce la plus
abondante a été An. gambiaes.l.avec 84,46% de l'effectif
(n = 2892individus), suivie de loin par An. paludisavec
6,16% (n = 211) et An. funestus avec 4,73%
(n = 162).An. namibiensis, An. ziemanni et An. nili
ont été plus rares avec des fréquences
inférieures à 2%. Les autres An. coustani, An. hancocki, An.
pharoensiset An. wellcomei ont été
récoltés à raison de moins de 5 individus par
espèce.
Sens de migration
Mt G G G G G G G
G Tn Mt Ta Tg
Puits de dépôt
Bande d'ADN
Gel d'agarose
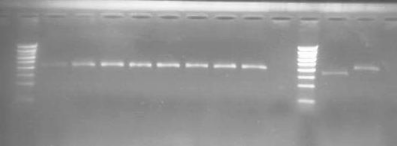
G : échantillon d'ADN
de An. gambiae s.s. ;Mt : marqueur de tailles ;
Ta : témoin
An. arabiensis (315pb) ; Tg :
témoin An. gambiae (390pb) ; Tn :
témoin négatif.
Figure 10 : Profil de migration des
différents membres du complexe An. gambiae
Sens de migration
Mt Tn S S S S S S
S S Mt Tm Ts
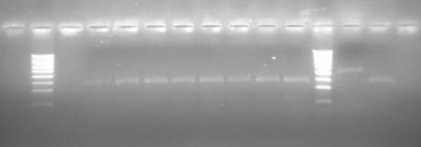
Mt : marqueur de
tailles ; S : échantillon d'ADN de forme
moléculaire S ; Tm : témoin pour forme
moléculaire M (727 pb) ; Tn : témoin
négatif ; Ts : témoin pour forme
moléculaire S (475 pb)
Figure 11 :Profil de migration sur gel
d'agarose des spécimens de forme moléculaire M et S de An.
gambiae s.s.
A Dschang :An.
gambiaes.l.est l'espèce la plus représentée avec
90,30%de l'effectif (n = 1499individus), suivie de Anopheles
funestus,7,83% (n = 130). Toutes les autres espèces
à savoir An. coustani, An. hancocki, An. moucheti, An. nili, An.
paludis, An. wellcomei et An. ziemanni ont eu des effectifs
inférieures à 10 individus (fréquence < 0,50%).
Au final,la population anophélienne a été
deux fois plus importante à Santchou (67,35% de l'effectif total)
qu'à Dschang (32,65%).Si l'on compareles variations de fréquences
de l'ensemble des espèces en fonction de l'altitude, on remarque que
ladifférence de leur distribution dans les deux populations est
très significative (÷² = 141,20 ; P < 0,005).
Huit espèces anophéliennes se sont
révélées communes aux deux sites. Parmi elles, An.
gambiae s.l.a présenté une fréquence relativement
stable dans les deux sites altitudinaux (86,46% à Santchou et 90,30%
à Dschang) ; An. funestus a été plus
fréquente en altitude (7,83%) que dans la plaine (4,73%) ; An.
nili, An. paludis et An. ziemannisont plus présentes dans
la plaine (respectivement 1,61%, 6,16% et 1,99%) qu'en altitude (0,06%, 0,42%
et 0,48%). Trois espèces sont isolées :An.
namibiensis et An. pharoensis à Santchou et An.
moucheti à Dschang.
3.3.2. Le cycle
d'agressivité
Bien que nous ayons enregistré 11 espèces
d'anophèles sur le site d'études, seules An. gambiae
et An. funestusseront considérées dans la suite,car
ayant des effectifsreprésentatifs et comparables. Les autres
espèces ont des densités bien faibles. L'agressivité
présente une augmentation continue de 18h à l'intervalle
02h-03hpour les deux espèces (figure 11), avec une
différence significative entre la première tranche de la nuit
(18h-00h) et la seconde(00h-06h) pour An. gambiae (÷² =
16,52 ; p = 4,81.10-5) mais pas pour An. funestus
(÷² = 2,55 ; p = 0,11) (Tableau 5).
La fréquence horaire maximale de piqûres pour
An. gambiae (19,20%) a été enregistrée avec une
heure de retard dans la plaine (02h-03h à Santchou) contrairement en
haute altitude où elle est plus faible (15,64%, 01h-02h). Cette
disposition reste la même pour An. funestuschez qui le pic
d'agressivité dans la plaine se situait à 01h-02h et
représentait 22,12% tandis qu'il était avec une heure d'avance en
altitude (00h-01h)avec une fréquence de 24,61%.
La valeur la plus élevée du nombre de
piqûres par heure pour An. gambiae (n = 265 à Santchou,
02h-03h) est pratiquement 10 fois supérieure à celle de An.
funestus (n = 28 à Dschang, 24h-01h).Dans la même
lancée, environ 90% des piqûres par nuit sont faites par An.
gambiae contre sensiblement 09% seulement pour An. funestus.
Il faut également noter que An. gambiaeen
altitude présente encore un niveau d'agressivité notable à
06h du matin avec une fréquence supérieure à la moyenne
(10,62%), ce qui n'est pas le cas pour An. funestus dont la
densité est pratiquement nulle à cette heure-là.
Nombre de piqûres par
heure
Tranches horaires
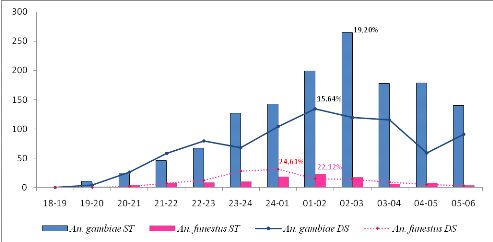 DS : Dschang (1400m) ; ST : Santchou (750m) DS : Dschang (1400m) ; ST : Santchou (750m)
Figure 12 :
Cycles d'agressivité des principaux vecteurs du paludisme
à Santchou et Dschangd'août 2004 à novembre 2006.
Tableau 5 : Variation nocturnes des
densités et fréquences des principaux vecteurs du paludisme avec
l'altitudeà Santchou et Dschangd'août 2004 à novembre
2006.
|
|
Tranches de la nuit
|
|
|
18h-00h
|
|
00h-06h
|
|
Espèces
|
Sites
|
|
nombre collecté
|
fréquence
|
|
nombre collecté
|
fréquence
|
|
An. gambiae
|
Santchou
|
|
276
|
20,00%
|
|
1104
|
80,00%
|
|
Dschang
|
|
235
|
27,42%
|
|
622
|
72,58%
|
|
An. funestus
|
Santchou
|
|
30
|
28,85%
|
|
74
|
71,15%
|
|
Dschang
|
|
49
|
38,89%
|
|
77
|
61,11%
|
3.3.3. Comparaison des indices
sporozoïtiques
Anopheles gambiae et An. funestus sont les
seules à présenter un intérêt
épidémiologique en raison de la présence des
antigènes sporozoïtaires dans leurs glandes salivaires.
Après les tests ELISA effectués sur 1911 anophèles
à Santchou et 1172 à Dschang, nous n'avons obtenu que 29 positifs
dans chaque site, ce qui nous donne comme indicessporozoïtiques (Is)1,52%
et 2,47% respectivement (Tableau 6). La différence de répartition
des spécimens positifs entre les deux zones n'est pas significative
autant pour An. gambiae (÷² = 0,95 ; P = 0,32)que
pour An. funestus(÷² = 1,36 ; P = 0,24).Le rapport
des Is des deux sites montre qu'à Dschang, il est sensiblement 1,5 fois
supérieur à celui de Santchou.
3.3.4. Effet de l'altitude sur l'agressivité, le taux
d'inoculation entomologique et l'indice de stabilité
Les agressivités moyenne (ma) obtenue sur 264
hommes-nuits à Santchou et 288 hommes-nuits à Dschang a
été de 9,34 et 5,29p/h/n(piqûres par homme et
par nuit)respectivement à Santchou et Dschang, avec des valeurs
plus grandes pour An. gambiae en rapport avec sa densité
(Tableau 7).A partir de ces valeurs et de l'indice sporozoïtique
(Is), on obtient les taux d'inoculation entomologique (he). Cette
valeur, contrairement à l'Is, baisse avec l'augmentation de
l'altitude :51,84pi/h/anà Santchou et
47,68pi/h/an en haute altitude. Cependant, contrairement à
An. gambiaedont l'he varie peu, l'espèce
An. funestus présente une augmentation 4 fois supérieure
de son taux d'inoculation entomologique en altitude.
Les taux de parturité (Tp) ont
été déterminés après dissections des ovaires
des anophèles femelles des deux sites d'étude. Ces valeurs ont
permis de calculer le taux quotidien de survie (P) ainsi que l'indice
de stabilité (St) (Tableau 7). Ce taux de survie est
suffisamment élevé dans les deux sites (> 88%) pour
permettre le développement du parasite.L'indice de stabilité est
assez élevé aux 2 niveaux d'altitude (> 2,5) pour indiquer une
stabilité de paludisme mais on note qu'il a une valeur beaucoup plus
grande à Dschang (7,43) qu'à Santchou (3,01).
Tableau 6 :
Comparaison des indices sporozoïtiques(Is) de P. falciparum
détectés par le test ELISA-CSPchez les anophèles
respectivement à Santchou et Dschangd'août 2004 à novembre
2006
|
Espèce
|
|
Santchou
|
|
Dschang
|
|
Total des 2 sites
|
|
Nombre testés
|
Nombre positifs
|
Is (%)
|
|
Nombre testés
|
Nombre positifs
|
Is (%)
|
|
Nombre testés
|
Nombre positifs
|
Is (%)
|
|
An. coustani
|
|
3
|
0
|
0
|
|
3
|
0
|
0
|
|
6
|
0
|
0
|
|
An. funestus
|
|
98
|
1
|
1,02%
|
|
119
|
5
|
4,20%
|
|
217
|
6
|
2,76%
|
|
An. gambiae
|
|
1559
|
28
|
1,80%
|
|
1022
|
24
|
2,35%
|
|
2581
|
52
|
2,01%
|
|
An. hancocki
|
|
1
|
0
|
0
|
|
4
|
0
|
0
|
|
5
|
0
|
0
|
|
An. moucheti
|
|
0
|
0
|
0
|
|
6
|
0
|
0
|
|
6
|
0
|
0
|
|
An. namibiensis
|
|
16
|
0
|
0
|
|
0
|
0
|
0
|
|
16
|
0
|
0
|
|
An. nili
|
|
42
|
0
|
0
|
|
1
|
0
|
0
|
|
43
|
0
|
0
|
|
An. paludis
|
|
134
|
0
|
0
|
|
7
|
0
|
0
|
|
141
|
0
|
0
|
|
An. pharoensis
|
|
1
|
0
|
0
|
|
0
|
0
|
0
|
|
1
|
0
|
0
|
|
An. wellcomei
|
|
5
|
0
|
0
|
|
2
|
0
|
0
|
|
7
|
0
|
0
|
|
An. ziemanni
|
|
52
|
0
|
0
|
|
8
|
0
|
0
|
|
60
|
0
|
0
|
|
Total des espèces
|
|
1911
|
29
|
1,52%
|
|
1172
|
29
|
2,47%
|
|
3083
|
58
|
1,88%
|
Tableau 7 : Influence de l'altitude sur
le taux d'inoculation entomologique et l'indice de stabilitéà
Santchou et Dschangd'août 2004 à novembre 2006
|
Localité
|
Espèces
|
|
Effectifs
|
ma (p/h/n)
|
Is
|
(he)
|
|
Tp (%)
|
x
|
a
|
P
|
|
Ev (jours)
|
|
St
|
|
CNV
|
CPI
|
(pi/h/an)
|
|
|
|
|
Santchou
|
An. gambiae
|
|
2347
|
545
|
8,89
|
1,80%
|
58,41
|
|
73,50
|
2,5
|
0,38
|
89,41%
|
|
5,97
|
|
3,33
|
|
An. funestus
|
|
120
|
42
|
0,45
|
1,02%
|
1,69
|
|
78,26
|
3,5
|
0,24
|
90,24%
|
|
11,17
|
|
2,27
|
|
Total
|
|
2467
|
587
|
9,34
|
1,52%
|
51,84
|
|
73,69
|
3
|
0,32
|
91,32%
|
|
7,24
|
|
3,43
|
|
Dschang
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
An. gambiae
|
|
1397
|
102
|
4,85
|
2,35%
|
41,61
|
|
83,90
|
3,5
|
0,27
|
89,14%
|
|
16,72
|
|
2,20
|
|
An. funestus
|
|
126
|
4
|
0,44
|
4,20%
|
6,71
|
|
84,38
|
4,5
|
0,13
|
90,33%
|
|
22,34
|
|
1,20
|
|
Total
|
|
1523
|
106
|
5,29
|
2,47%
|
47,68
|
|
83,96
|
4
|
0,22
|
90,74%
|
|
16,80
|
|
2,04
|
a = indice d'anthropophilie;Ev = espérance de
vie infectante des vecteurs ; he (pi/h/an) = taux d'inoculation
entomologique ; Is : Indice sporozoïtique ; ma = taux
d'agressivité ;P = taux quotidien de survie ; St = indice de
stabilité ; Tp = taux de parturité ; x = durée
du cycle gonotrophique.
3.4. DISCUSSION
3.4.1. Composition de la faune anophélienne
Ce travail nous a permis d'identifier les espèces
anophéliennesprésentes respectivement au pied et au sommet de la
falaise des Mbô. L'espèce An.
gambiaereprésenteplus de 85% de la faune anophéliennede la
zone d'étude. Cerésultat est similaire à ceuxde Shililu
et al., (1998) à Mumias, ville située à 1500m
d'altitude dans l'ouest du Kenya ; et à ceux de Bødkeret
al., dans les hautes terres de Tanzanie. A cette espèce se joignent
An. funestus(5,74%) dans les deux sites et An. paludis(4,29%)
plus présente à Santchou. La faible densité des autres
espèces rend leur rôle potentiel dans la transmission du
paludismeen altitude négligeable. Le nombre élevé
d'enquêtes nous a permis de recenser un effectif important
d'espèces anophéliennes : 11 au total, soit 10 à
Santchou et 9 à Dschang. Ces résultats complètent ceux de
Garde et al., (1991) qui n'avait recensé que 3espèces
à Dschang (An. gambiae, An. coustani et An. funestus)
au cours de 3 nuits de captures (au mois de mai)et Kengne (2000) qui en avait
noté 7 en 6 mois de captures (entre mai et octobre).
3.4.2. Comparaisondespopulations de vecteurs à
différents niveaux altitudinaux
L'agressivité anophélienne a été
plus élevée à Santchou (750m d'altitude)où elle
représente sensiblement le double de celle de
Dschang(1400md'altitude) : 9,34 et 5,28 p/h/n respectivement.La
montée en altitude diminuerait donc les capacités reproductrices
et la survie des moustiques. Il faut remarquer que la région de Santchou
est plane et inondable, présentanten saisons des pluies de nombreuses
flaques d'eau stagnantes propices à la ponte et au développement
larvaire, ce qui n'est pas le cas à Dschang où on observe un
relief plutôt accidenté. Cet élément,associés
aux variations des facteurs climatiques liés à la
différence d'altitude (taux d'oxygène de l'air, niveau des
précipitations, température, pression osmotique,
humidité...), peuvent expliquer cette grande différencedans les
densitésanophéliennes.
Anopheles gambiae est la seule espèce à
présenter une bonne adaptation aux deux niveaux altitudinaux. Elle
présente une densité très élevée en altitude
et dans la plaine, ce qui fait d'elle le principal vecteur de toute la
région.
L'effet de l'altitude se fait ressentir de façon
significative sur les densités de trois espèces : An.
nili, An. paludis et An. ziemanni.Ces espèces sont
présentes dans les deux sites mais leursfréquences en altitude
sont très faibles. Il ne faut cependant pas négliger l'effet des
conditions géographiques telles que la disponibilité des
gîtes et la présence des hôtes préférentiels
de certaines espèces sur leur distribution dans ces deux sites.
Un seul individu de An. nili a été
retrouvé à Dschang contre 55 à Santchou. L'absence de
cours d'eau à régime régulier servant de gîtes
larvaire à cette espèce (Gillies et Coetzee, 1987 ;
Carnevale et al., 1992) à Dschangpourrait en être la
cause.
An. namibiensis présent à Santchou est
absent sur les hautes terres. Cette espèce présente une mauvaise
adaptation aux conditions altitudinales.
La présence de An. mouchetiexclusivement
à Dschang et en faible nombre serait liée aux types de points
d'eau présents ici. En effet, les lacs des bas-fonds aux abords couverts
de végétation qui reçoivent des ruisseaux àfaible
débit fournissent des gîtes propices pour cette espèce
(Fontenille et al., 2003).
An. funestus est la seule espèce dont la
population ne varie que faiblement entre les deux sites. Elle présente
même une augmentation de fréquence en haute altitude pendant la
saison sèche. Cela montre une bonne adaptation aux hautes terres
lorsqu'il y a des gîtes appropriés.C'estégalement le cas
à l'Ouest du Kenya où elle a été retrouvée
avec l'espèceAn. gambiae jusqu'à 1700m d'altitude
(Minakawa et al., 2004).
Les autres espèces ont été plutôt
accidentelles, avec des effectifs assez faibles : An. pharoensis
etAn. wellcomei (présent mais exophile au Soudan) sont plus
inféodés à l'Afrique de l'ouest et de l'est, et An.
hancocki qui a une plus grande tendance à la zoophagie et
l'exophilie (Mouchet et al., 2004).
La composition de la faune résiduelle (capturée
par pulvérisation) constituée principalement de An.
gambiae et An. funestus révèle que ce sont
là les seuls vecteurs endophiles des deux localités
étudiées. Les autres espèces présentes dans
l'échantillon ont plutôt présenté une bonne tendance
à l'endophagie etexophilie, car présentes uniquement lors des
captures nocturnes qui se sont faites à l'intérieur des cases.
C'est précisément le cas de An. nili, An. paludis et An.
ziemanni qui ont des effectifs assez élevés en CNV mais
presque nuls en CPI. Mouchet et al., (2004) reconnaissent
également An. paludis comme moustique exophile ayant une forte
tendance à l'exophagie. Les autres espèces à l'instar de
An. hancocki, An. coustani An. moucheti et An. namibiensis
ont des effectifs faibles ne permettant pas de tirer des conclusions.
La disponibilité des gîtes larvaires conditionne
la densité des adultes. C'est l'une des raisons pour lesquelles au cours
de la saison sèche, les effectifs baissent considérablement dans
chacune des localités.
Pendant la saison sèche, les gîtes disponibles en
altitude sont les petits ruisseaux et les lacs de retenue. Ils sont propices
pour le développement larvaire de An. funestus d'où sa
présencecontinue pendant toute l'année. Cette espèce va
donc suppléer à la baisse d'agressivité de An.
gambiaedue à la baisse de sa population en saison sèche
(12,42% de son effectif annuel).
La forte baisse de la densité de An. gambiae
s'explique par la disparition des gîtes qu'elle affectionne : les
traces de roues, les flaques d'eau claires et peu profondes dans les
dénivellations de terrain, les traces de pas, les boîtesde
conserve etc. ces gîtes sont asséchés en saison
sèche, surtout à Santchou où le sol est sablonneux donc
très perméable.D'autres espèces subissent aussi le coup de
la "sècheresse", c'est le cas de An. paludis, et An.
ziemanni dont les fréquences en saison sèche
représentent moins de 6% des effectifs totaux. An. namibiensis, et
An. moucheti absentes en captures en saison sèche sont plus
adaptées à la saison des pluies. Ceci s'explique la concentration
d'agents polluants dans leurs gîtes larvaires en saison
sècheoù par leur assèchement.
Le cycle d'agressivité des vecteurs a été
sensiblement le même dans les deux sites, il indique que le maximum de
piqûres se fait au cours de la deuxième partie de la nuit. Ces
observations sont conformes aux schémas habituels du cycle
d'agressivité nocturne des anophèles (Gillies et De Meillon,
1968 ; Dossou et al., 1998). Cette période correspond aux
moments de sommeil profond des habitants qui présentent alors un moindre
risque pour les moustiques.
3.4.3. Composition du complexe An. gambiae
Au Cameroun, le complexe An. gambiae est
représenté par trois espèces : An. gambiae s.s.
présente dans les zones de forêt et de savane humide, An.
arabiensis qui présente une distribution localisée dans la
région septentrionale à climat sec et An. melas
inféodée aux eaux saumâtres et présente dans la
région côtière(Mouchet et al., 2004).
Dans nos sites d'étude, seule An. gambiae s.s.
a été identifiée. Ces résultats sont conformes
aux précédents de Wondji (2003) et Tchuinkam et al.,
(2004), mais diffèrent de ceux obtenus à altitude semblable
au Kenya par Gimnig et al., (2001) et Koenraat et al., (2004)
où une sympatrie entre An. gambiae s.s. et An.
arabiensis a été notée. Deux raisons peuvent
expliquer cette disparité :le climat de la région (froid et
humide) qui n'est pas propice au développement de An.
arabiensis plus fréquent dans les zones de savane chaudes et arides
(Colluzi et al., 1979 ; Colluzi et al., 1985 ;
Edilloet al., 2002). Par ailleurs, les populations humaines au
Cameroun sont installées à des altitudes inférieurespar
rapport au Kenya (1200m au Mont Cameroun et 1800m à Nduttitsa par
Dschang) et cette absence d'hôtes limite la propagation des vecteurs dans
ces régions d'altitude du pays.
L'étude des formes moléculaires de An.
gambiae s.s. a révélé la présence de la seule
forme moléculaire S. Ceci suit les résultats de Wondji et
al., (2005) qui n'avait retrouvé qu'un seul individu de forme
moléculaire M à Dschang comme à Santchou sur des effectifs
de 118 et 56 respectivement. La forme M est plus fréquente dans les
régions où le couvert végétal et peu
dégradé à l'exemple de la zone forestière du sud
Cameroun. L'adaptation de la forme S aux zones à
végétation et pluviométriefaibles (Colluzi et al.,
1979) expliquerait sa présence dans notre zone d'étude. La
théorie d'un isolement(voire d'une exclusion) écologique entre
ces deux formes (Tourré et al., 1998, Wondji et al.,
2002) est égalementréaffirméepar ces résultats.
3.4.4. Les niveaux de transmission du paludisme.
La tête et le thorax seuls ont été
utilisés pour le test ELISA, ceci pour limiter la surestimation de
l'infestation par rapport à la présence effective de parasites
dans les glandes salivaires. Seuls An. gambiae et An.
funestus ont présenté des spécimens positifs au test
ELISA CSP. Ce sont donc les seuls vecteurs majeurs du paludisme dans la
région. An. paludis bien qu'ayant une fréquence
supérieure à celle de An. funestus à Santchou,
(respectivement 6,16% et 4,73%) et An. ziemanni (1,99%) n'ont pas
présenté d'individu porteur de protéine CSP dans
l'échantillon récolté. Ces espècesauraient doncune
implication négligeable dans la transmission du paludisme comme l'a
rappelé Antonio-Nkondjio (Antonio-Nkondjio et al., 2006).
Dans la plaine, An. gambiae est le vecteur majeur du
paludisme, avec une agressivité élevée, un Is
supérieur à celui de An. funestus et ainsi un taux
d'inoculation représentant 97% du total de ce site (58,41
pi/h/an contre 1,69 pi/h/an). C'est donc, statistiquement,
l'espèce responsable de la majeure partie des infections humaines ici.
En altitude, An. gambiaepossède la plus grande
densité mais l'espèce An. funestus montre une proportion
d'individus infectés (Is) deux fois plus grand (4,20% contre 2,35%). Son
rôle dans la transmission, qui se traduit ici par un taux d'inoculation
plus de trois fois supérieur à celui de la plaine, n'est pas
à négliger. En observant les variations saisonnières des
densités spécifiques, on peut noter que pendant la saison
sèche, la fréquence de An. funestus croît de
façon significative. Au cours de cette période, cette
espèce suppléé donc à la déchéance de
An. gambiae et contribue ainsi à maintenir la transmission
à un niveau stable au cours de l'année.
Malgré l'agressivitéanophélienne plus
faible en altitude, l'indice sporozoïtique est plus élevé
à Dschang (2,47%) qu'a Santchou (1,52%). Cetteplus forte
prévalence plasmodiale chez le vecteur peut s'expliquer par la migration
des populations des basses terres plus impaludées vers les hautes
terres. Cette migration est catalysée par la création d'une
université dans la ville de Dschangen 1993, ce qui a occasionné
l'immigrationde nombreuses personnes parmi lesquelles probablement des porteurs
asymptomatiques et facilité l'importation des parasites. Le niveau de
transmission est resté cependant élevé à Santchou
(51,84 pi/h/an) par rapport à Dschang (47,68 pi/h/an)
car le taux d'agressivité est très faible en altitude.
Le taux de survie (P) des anophèles calculé est
suffisant dans les deux sites pour permettre aux parasites d'effectuer
entièrement leur cycle intrinsèque : 91% et 90%
respectivement en aval et en amont, valeurs supérieures au seuil de 65%
définit par Bruce-Chwatt (1985). Cependant, la durée du cycle
extrinsèque du plasmodium étant rallongée ici par la basse
température, la transmission s'en trouve affectée et
réduit l'efficacité des vecteurs (Bødker et al.,
2003 ; Githeko et al., 2001).
L'indice de stabilité est supérieur à 2,5
dans le sitede Santchou (3,43), traduisant une stabilité de la
transmission du paludisme, ce qui n'est pas le cas à Dschang où
on note un niveau de stabilité intermédiaire (0,5 < Is <
2,5) avec un indice de stabilité de 2,04. En effet, dans la zone de
plaine, la présence de vastes zones marécageuses et du fleuve
Nkam qui serpente la plaine permet aux vecteurs de se reproduire abondamment en
saisons pluvieuses mais le sol étant sablonneux, les gîtes sont
rares en saison sèche ce qui se traduit par une baisse de
l'agressivité anophélienne. Ce schémas reste le même
tous les ans et induit une stabilité de la transmission du
paludisme.Dans le site de haute altitude, l'indice de stabilité est
inférieur au niveau minimum de stabilité mais n'en est cependant
pas bien éloigné. Ceci s'expliquerait par le fait queAn.
funestus s'associe au vecteur majeur An. gambiae en saison
sèche, rendant la transmission plus ou moins continue au cours de
l'année. Ces résultats sont compatibles aux prévisions des
zonesd'altitudes où on s'attendà retrouver un paludisme instable
présentant des résurgences en périodes de pullulation de
vecteurs (Fontenille et al., 1990 ; Mouchet et al.,
2004).
En altitude, la baisse de la température et de
l'hygrométrie sont à l'origine du rallongement du cycle
gonotrophique (Rhodain et Perez, 1985). Les valeurs de la durée du cycle
gonotrophique sont d'un jour supérieur avec l'altitude pour les deux
espèces (Tchuinkam et al., 2007). Ces valeurs, associées
à des taux de parturité aussi élevés, augmentent
considérablement l'espérance de vie infectante dans le site
altitudinal. Il est donc indispensable pour les vecteurs de vivre plus
longtemps pour pouvoir transmettre le parasite. En effet, comme le cycle
gonotrophique (nombre de jours entre deux repas de sang) est plus long en
altitude, le moustique prendra moins de repas de sang au cours de sa vie.
Ainsi, la transmission réelle du parasite est réduite dans la
ville de Dschang.
Le réchauffement climatique actuel peut agir sur ces
constantes car une augmentation de la température moyenne va entrainer
un raccourcissement du cycle extrinsèque du parasite ainsi que du cycle
gonotrophique du vecteur. On notera alors une fréquence d'inoculation
des parasites bien supérieure à celle qui sévit
actuellement et les populations étant peu ou pas prémunies, un
TIE subitement plus élevé pourrait entrainer des risques
d'épidémie.
CONCLUSION ET PERSPECTIVES
Cette étude entomologique et moléculaire avait
pour objectif de faire ressortirl'impact d'une dénivellation
altitudinale brusque sur la composition spécifique de la faune
anophélienne et caractériser la transmission du paludisme dans
unerégion de l'Ouest Cameroun. Elles'est déroulée dans
deux sites géographiquement rapprochés mais séparés
par une falaisequi créé une différence climatique
importante entre eux : Santchou (750m) etDschang (1400m d'altitude).
L'agressivité anophélienne baisse avec la
montée en altitude pour la plus part des espèces. An.
gambiaes.s. s'est révélé être le principal
vecteur dans les deux sites où il a présenté les plus
grands taux d'inoculation entomologiques. Il est secondé par An.
funestus qui joue un rôle important en saison sèche en
altitude. Ces deux espèces ont été les seules porteuses
des parasites. Cependant, si la montée en altitude entraine une
réduction importante des populations anophéliennes, elle pas le
même impact sur le degré d'infection des vecteurs qui se
révèle être plus élevé sur le plateau.
Bien que la différence des taux de parturité ne
soit pas significative, l'augmentation de la durée du cycle
gonotrophique qui intervient exponentiellement dans la formule de
l'espérance de vie infectante fait que celle-ci soit plus longue en
altitude que dans la plaine.
Il est probable eu égard à la fragilité
du climat dans cette zone, que le réchauffement climatique global
auxquels s'ajoutent l'urbanisation sans cesse croissante et le bitumage
récent de la route Dschang-Santchou modifient ce faciès
écologique et offrent de nouvelles conditions écologiques et
dynamiques aux différents acteurs de la transmission,ce qui pourrait
affecter le niveau d'endémie palustre.
En perspectives, nous nous proposons pour compléter ce
travail, de :
· étendre cette étude à d'autres
sites du pays : la région du Mont Cameroun où sont
présents des sites à haute altitude, afin de confirmer si
nécessaire les résultats obtenus ;
· étudier la structuration
génétique des populations de An. gambiae et An.
funestusde ces deux localités afin dedéterminer et analyser
les modifications génétiques adaptatives des anophèles aux
climats de hautes altitudes.
|
RÉFÉRENCES
BIBLIOGRAPHIQUES
|
Antonio-Nkondjio C., Simard F, Awono-Ambene HP., Toto
JC, Tchuinkam T & Fontenille D., 2006. Complexity of malaria
vectorial system in Cameroon: contribution of secondary vectors to malaria
transmission. J. Med. Entomo.;sous presse.
Awono-Ambene, H.P.; Kengne, P.; Simard, F.;
Antonio-Nkondjio, C.; Fontenille, D. 2004. Description and bionomics
of Anopheles (Cellia) ovengensis (Diptera:
Culicidae), a new malaria vector species of the Anopheles nili group
from South Cameroon. J. Med. Entomo.; 41(4), 561-568.
Aubry Pierre, 2007. Paludisme,
actualités, 2006. Med. Trop.;65, 3-6.
Beier J.C., Killeen G.F., Githure J.I., 1999.
Entomologic inoculation rates and Plasmodium falciparum malaria
prevalence in Africa. Am. J. Trop. Med. Hyg.; 61, 109-113.
Bødker R., Akida J., Shayo D., Kisinza W.,
Msangeni H. A., Pedersen E. M., and Lindsay S. W., 2003. Relationship
between altitude and intensity of malaria transmission in the Usambara
mountains, Tanzania. J. Med. Entomo.; 40(5), 706-717.
Boudin C., Bonnel S., Tchuinkam T., Gougna L. C.,
Gounoue R., Manga L., 1998.L'évaluation des niveaux de
transmission palustre : méthodologies et paramètres.
Med. Trop. ; 58, 69-75.
Bruce-Chwatt L. J., 1980a. Essential
Malariology. W. Heinemann,Medical Books Ltd. London, 166-210.
Bruce-Chwatt L. J., 1980b. The rise
and fall of malaria in Europe. London : Oxford University Press;
124-136.
Brunhes J.; Le Goff G.; Geoffroy B.,
1999.Afro-tropical anopheline mosquitoes. III. Description of three
new species: An. carnevalei sp nov. An. hervyi sp nov. and An. dualaensis
sp nov. and resurrection of An. rageaui. J. Am. Mosq.
Control. Assoc. ; 15,552-558.
Carnevale P. et Mouchet J.,
1990. Formation continue : techniques
d'enquêtes entomologiques pour l'étude du paludisme.Bull. liais.
doc. OCEAC ; (91-92), 79-83.
Carnevale P., Le Goff G., Toto JC., Robert V.,
1992.Anopheles nili as the main vector of human malaria in
villages of southern Cameroon. Med. Vet. Entomol. ; 6, 135-138.
Carter R., Schofield L., mendis K., 1992. HLA
effects in malaria: increased parasite-killing immunity or reduced
immunopathology? Parasitology today ; 8, 41-42 & 57.
Chandre F., Darriet F., Manga L., Akogbeto M., Faye
O., Mouchet J., Guillet P., 1999. Status of pyrethroid resistance in
Anopheles gambiae s.l.Bull. OMS ; 77: (3), 230-234.
Clements, A.N. 1992. The biology of
mosquitoes. Chapman & Hall. London ;128-134, 241-253.
Coetzee M., Craig M. and Le Suer D. 2000.
Distribution of African Malaria Mosquitoes Belonging to the Anopheles
gambiae Complex. Parasitology today ; 16. (2), 74-77.
Colluzi M., Sabatini A., Petrarca V., and Di Deco M.
A., 1979.Chromosomal différenciation and adaptation to human
environments in the An. gambiae complex. Trans. Roy. Soc. Trop.
Med. Hyg.; 73,483-497.
Coluzzi M., Petrarca V., Di Deco M. A., 1985.
Chromosomal inversion intergradation and incipient speciation in Anopheles
gambiae . Bol. Zool.; 52, 45-63.
Combemale P., 2001.La prescription des
répulsifs. Med. Trop.; 61, 99-103
Cornel A., Collins F. H., 1996. PCR of
ribosomal DNA Intergenic Spacer Regions as a method for identifying mosquitoes
in the Anopheles gambiae complex. Meth. Mol. Biol. ; 50,
321-332.
Danis M. et Mouchet J., 1991. Paludisme,
Universités Francophones UREF. Edition marketing ELLIPSE,23-58.
Davidson G., 1954. Estimation of the survival
rate of Anopheline mosquitoes in nature. Nature ; 174,
792-793.
Davidson G., 1962.
Anopheles gambiae complex. Nature ; 196,
894-905.
Davidson G., 1964. The five
mating-types in a An. gambiae complex. Revisita di
Malariologia ; 13, 167-183.
Della Torre A., Fanello C., Akogbeto M. Dossou Yovo
J., Flavia G., Petrarca V., Coluzzi M., 2001. Molecular evidence of
incipient speciation within Anopheles gambiae s.s. in West Africa.
Insect biochemistry and molecular Biology ;10, 9-18.
Della Torre A., Zhijian Tu, Vincenzo Petrarca.,2005.
On the distribution and genetic differentiation of Anopheles
gambiae s.s. molecular forms ;Insect biochemistry and molecular
Biology ; 35, 755-759.
Dossou-Yovo J., Diarrassouba S., Doannio J., Darriet
F. & Carnevale P., 1998. Le cycle d'agressivité
d'Anophelesgambiaes.s. à l'intérieur des maisons et la
transmission du paludisme dans la région de Bouaké (Côte
d'Ivoire). Entomologie médicale ; 1953, 66-73.
Edillo F. E., Toure Y. T., Lanzaro G. C., Guimogo D.,
and Taylor C. E., 2002. Spatial and habitat distribution of
Anophelesgambiae and Anopheles arabiensis (Diptera Culicidae)
in Banam bani Village, Mali. J. Med. Entomo.;39 (1), 70-77.
Eldrige F. B., 2005. Mosquitoes, the
Culicidae. In Marquardt C. W., Black C. W., Freier E. J., Hagedorn H. H.,
Hemingway J., Higgs S., James A. A., More G. C., 2005. Biology of Disease
Vectors, ElsevierAcademic Press, 2;95-101.
Fanello C., Santolamazza F. and Della Torre A.,
2002. Simultaneous identification of species and molecular forms of
the Anopheles gambiae complex by PCR-RFLP. Med. Vet.
Entomol.; 16, 461-464.
Farooq U. and Mahajan R. C. 2004.Drug
resistance in malaria. Vector Borne Diseases ; 41:45-53.
Fontaine R. E., Pull J. H., Payne D., 1978.
Evaluation of fenithrothion for the control of malaria. Bull. WHO; 56,
445-452.
Fontenille D. and Simard F. 2004.
Unravelling complexities in human malaria transmission dynamics in Africa
through a comprehensive knowledge of vector populations. Comp. Immunol.
Microbiol.& Inf. Diseases ; 27,357-375.
Fontenile D., Cohuet A., Awono-Ambene H. P.,
Antonio-Nkondjio C., Wondji C. S., Kengne P., Dia I., Boccolini D., Duchemin J.
B., Rajaonarivelo V., Dabire R., Adja-Akre, Ceainu C., Le Goff G., Simard
F.,2003.Systématique et biologie des Anophèles
vecteurs de paludisme en Afrique : Données récentes. Med.
Trop. ; 63,247-253.
Fontenille D., Lepers J.P. Campbell G.H.,
Rakotoarivony L. Coluzzi M., Coulanges P. 1990. Malaria vectors and
their role in transmission, in Ntsoa in the highland Plateaux of Madagascar
from 1988 to 1990. Arch.Inst. Pasteur, Madagascar ;57(l), 335-368.
Fontenille D., Wanji S., Djouaka R., Awono Ambene H.
P., 2000.Anopheles hancocki, vecteur secondaire du paludisme
au Cameroun. Bull. Liais. Doc. OCEAC ; 33 (2),23-26.
Garde X., Njan A., Toto J-C., Carnevale P., Robert V.,
1991. Entomologie et paludisme : Résultats d'une enquête
entomologique à Dschang (Cameroun). Ouest santé ;
3,3-12.
Garnham P. C., 1945. Malaria epidemics at
exceptionally high altitudes in Kenya. Br. Med. J.; 2,45-47.
Garnham P. C., 1966.Malaria parasites and
others haemosoridia. Oxford : Blackwell Scientific
publication, 144 p.
Garret-Jones C., 1964. Prognosis for
interruption of malaria transmission through assessment of the mosquito
vectorial capacity. Nature ;204, 1173-1175.
Garret-Jones C. and Shidr-awi GR., 1969.
Malaria vectorial capacity of a population of Anophelcs gambiae.Bull.
WHO ; 40, 531-545.
Gentilini M. et Nozais J. P., 1991. Histoire
du paludisme. In Danis M. & Mouchet J. (eds). Paludisme. Edition
Marketing/Ellipses, Paris ;17-20.
Gillies M. T. andCotzee M., 1987. A
supplement to the Anophelinae of Africa South of the Sahara (Afrotropical
region). The South African Institute for Medical Research ;55,
43-62.
Gillies M. T. and De Meillon B., 1968. The
Anophelinae of Africa south of the Sahara (Ethiopian zoogeographical
region) The South African Institute for Medical Research;2,
101-143.
Githeko A. K. And W. Ndegwa, 2001. Predicting
malaria epidemics using climate data in Kenyan highlands: a tool for decision
makers. Global Change Hum. Health ; 2, 54-63.
Hamad A., Amel A., Abd el Hamid, 2002. A
marked seasonality of malaria transmission in two rural sites in eastern
Sudan.Vector Borne Diseases ; 38:34-41.
Harbach R. E., 2004. The classification of
genus Anopheles (Diptera: Culicidae): a working hypothesis of
phylogenetics relationship. Bull. Ent. Res.;94, 537-553
Hunt R.H., Coetzee M., Fettene M., 1998. The
Anopheles gambiae complex: a new species from Ethiopia. Trans.
Roy. Soc. Trop. Med. Hyg.;231-235.
Kamau L., Hunt R., Coetzee M., 2002.Analysis
of the population structure of Anopheles funestus (Diptera: Culicidae)
from western and coastal Kenya using paracentric chromosomal inversion
frequencies. J. Med. Entomo.; 39,78-83
Kengne Honoré, 2000. Etude de la
transmission entomologique du paludisme dans quatre quartiers de la ville de
Dschang. Mémoire de Maîtrise en Biologie Animale de
l'université de Dschang. Cameroun ; 56p.
Koenraadt C. J. M., Githeko A. K., Takken W.,
2004. The effects of rainfall and evapo-transpiration on the temporal
dynamics of Anopheles gambiae s.s. and Anopheles arabiensis
in a Kenyan village. Acta Tropica ; 90,141-153
Lane P. R. and Crosskey R. W., 1993. Medical
insects and arachnids. Chapman and Hall, London, 723p
Lindsay, S. W.,and Martens W. J., 1998.
Malaria in the African highlands: past, present and future. Bull. WHO;
76,33-45.
MacDonald G., 1957. The epidemiology and
control of malaria. Oxford University Press Edition, London ;201p.
Miller M., 1958. Observations on the natural
history of malaria in the semi-resistant West African, Trans. Roy. Soc.
Trop. Med. Hyg.;52, 152-168.
Minakawa N., Sonye G., Mogi M., Githeko A., Yan G.,
2002. The effects of climatic factors on the distribution and
abundance of Malaria vectors. J. Med. Entomo. ; 39 (6), 833-841.
Minakawa N., Sonye G., Mogi M., Yan G., 2004.
Habitat characteristics of Anopheles gambiae ss larvae in Kenyan
highland. Med. Vet. Entomol.; 18 (3),301-305.
[Minsanté] Ministère de la santé
du Cameroun,2002. Plan stratégique de lutte contre le paludisme
au Cameroun, 17p.
Mouchet J., Carnevale, P., 1991. Les vecteurs
et la transmission. In Danis, M., Mouchet, J. (eds). Paludisme.
Edition Marketing/Ellipses, Paris ;35-58.
Mouchet J., Carnevale P., Coosemans M., Julvez J.,
Manguin S., Richard-Lenoble D. et SircoulonJ., 2004.
Biodiversité du paludisme dans le monde. Edition John Libbey ;
12-37, 64-84, 114-117.
[MSP] Ministère de la Santé Publique,
2001. Plan National Stratégique de Lutte contre le Paludisme.
Yaoundé, Draft 1 ; 42-53.
Muirhead-Thompson R. C., 1945. Studies on the
breeding places and control of Anopheles gambiae var. melas
in coastal district of Sierra Leone. Bull. Entomol. Res.;
36,185-252.
Ndenga B., Githeko A., Omukunda E., Munyekenye G.,
Harrysonne A., Wamai P., Mbogo C., Minakawa N., Zhou G., And Yan Guiyun,
2006. Population dynamics of malaria vectors in western Kenya
highlands. J. Med. Entomo.; 43(2),200-206.
Njan Nloga A., Robert V., Toto J-C., et Carnevale P.,
1993.Anopheles moucheti, vecteur principal du paludisme au
Sud-Cameroun. Bull. liais. Doc. OCEAC, 26 (2) ;69-72.
[OMS] Organisation Mondiale de la Santé,
2003. Evaluation de la santé. In: Rapport sur la
santé dans le Monde : La vie au 21e siècle, une
perspective pour tous.World Health Organisation (Ed),
Genève, suisse ; 43-65.
[OMS] Organisation Mondiale de la Santé,
2005.Rapport mondial sur le paludisme 2005 : Paludisme, situation
dans le monde ; 1-3.
[OMS/UNICEF] Organisation Mondiale de la
Santé/Organisation des nations unies pour l'enfance (2003). Le
rapport sur le paludisme en Afrique. WHO/CDS/MAL/2003 ; 1093, 120p.
Rodhain François, 1999. Les maladies
à vecteurs, Collection entomologiqueQue
sais-je ? Presse universitaires de
France ;3-47.
Rodhain F. et Pérez C., 1985.
Précis d'entomologie médicale et vétérinaire,
Notion d'épidémiologie des maladies à vecteurs.
Maloine s. a.;77-152.
Samé Ekobo A., 2005. Aspect
épidémiologique du paludisme au Cameroun. Malaria research and
control in Cameroon. Journal of the Cameroon Academy of
Sciences ; 5,3-24.
Service M. W., 1993.Mosquito Ecology: Field
sampling methods, 2nd edition, Elesevier, Ampplied Science
Publisher, London ; 988p.
Shililu J. I., Maier W.A., Seitz H.M., and Orago A.S.,
1998. Seasonal density, sporozoite rates and entomological in
oculation rates of Anopheles gambiae and Anopheles funestus in a high-altitude
sugar cane growing zone in Western Kenya. Trop. Med. Int.
Health ; 3,706-710.
Smith P. G. and Milligan P. J., 2005. Malaria
vaccine: 3 or 6 months' protection? Lancet ;365, 472- 473.
Tchuinkam Timoléon, 2007. Biologie et
épidémiologie de la transmission homme-moustique de
Plasmodiumfalciparum : rôle de la
gamétocytémie, influence des antimalariques et implications pour
le paludisme d'altitude. Thèse d'Etat, Université de
Yaoundé I.
Tchuinkam T., Wandji S. et Fondjo E.,2004.
Biodiversité des Anophèles et dynamique de la transmission du
paludisme en zones d'altitude au Cameroun. Rapport du projet ;
5-9, 34-35.
Walker Kathleen, 2002. A Review of Control
Methods for African Malaria Vectors. Environmental Health Project, Activity
Report ; 108,12-28.
Wéry Marc, 1995. Protozoologie
médicale. De Boeck & Lacier, Bruxelles ;137-178.
White, G.B. 1985.Anopheles bwambae sp. n.
A malaria vector in the Semliki Valley, Uganda, and is relationships whit
other sibling species of the Anopheles gambiae complex (Dipteria:
Culicidae). Systematic Entomology ; 10,510-522.
[WHO] World Health Organization, 1975. Manual
on practical entomology in malaria, PartII. Methods and techniques. No.13,
WHO. Geneva, Switzerland.
Wilkes T. J., Matola Y. G., Charlwood J. D., 1996.
Anopheles rivulorum, a vector of human malaria in Africa.
Med. Vet. Entomol.; 10,108-110.
Wondji Charles Sinclair, 2003.
Variabilité et structure génétique despopulations
d'Anopheles gambiae (Gilles, 1902), vecteur du paludisme au Cameroun.
Thèse de Doctorat 3em cycle, Université de
Yaoundé I ; 180p.
Wondji C., Simard F. and Fontenille D., 2002.
Evidence for genetic differentiation between the molecular forms M and S within
the Forest chromosomal form of Anopheles gambiae in an area of
sympatry. Insect Molecular Biology ;11(1),11-19
Wondji C., Frédéric S., Vincenzo P.,
Josiane E., Federica S., Alessandra D. T. And Didier F., 2005. Species
and populations of the Anopheles gambiae complex in Cameroon with
special emphasis on chromosomal and molecular forms of Anopheles gambiae
s.s.J. Med. Entomo.; 42(6),998-1005
Wirtz R.A., Zavala F., Charoenvit Y., Campbell G.H.,
Burkot T.R., Schneider I., Esser K.M., Beaudoin R.L., Andre R.G.,
1987. Comparative testing of monoclonal antibodies against
Plasmodium falciparum sporozoites for ELISA development. Bull
WHO ; 65,39-45.
Zhou G., N. Minakawa, A. K. Githeko and G. Yan.
2004. Association between climate variability and malaria epidemics in
the East African highlands. Proc. Natl. Acad. Sci. U.S.A ;
101,2375-2380.
ANNEXE1
Tableau
A :Composition du Tampon de broyage (Cornel et Collins, 1996)
|
Réactifs
|
Concentration finale
|
Quantité (Pour 100
ml)
|
|
NaCl
|
0,08 M
|
1,6 ml (5 M NaCl)
|
|
Sucrose
|
0,16 M
|
5,48g
|
|
EDTA
|
0,06 M
|
12 ml (0,5 M EDTA pH 8)
|
|
Tris-HCl
|
0,10 M
|
10 ml (1 M Tris-HCl pH 9)
|
|
SDS
|
0,05%
|
5 ml (10% SDS)
|
|
Eau distillée stérile (ED)
|
q.s.p
|
71,4 ml
|
Tableau B : Milieu réactionnel
pour PCR complexe An. gambiae (Fanello et al.,2002)
|
Réactif
|
Concentration initiale
|
Concentration finale
|
Volume/tube
|
|
Tampon (+MgCl2)
|
10X
|
1X
|
2,50 ul
|
|
dNTPs
|
5mM
|
0,2mM
|
1,00 ul
|
|
Amorces
|
UN
|
10uM
|
5pmoles
|
0,50 ul
|
|
GA
|
10uM
|
5pmoles
|
0,50 ul
|
|
AR
|
10uM
|
5pmoles
|
0,50 ul
|
|
ML .
|
10uM
|
5pmoles
|
0,50 ul
|
|
Taq DNA polymérase
|
5UI/ul
|
0,25UI
|
0,05 ul
|
|
H2O distillé
|
|
q.s.p
|
17,45 ul
|
|
ADN
|
|
|
2,00 ul
|
|
Total
|
|
|
25,00 ul
|
Amorces : AR : arabiensis,GA : gambiae,ML:
melas, UN : universelle ;UI : Unités
internationales ;
Tableau C :
Composition du "Master MIX" pour la digestion enzymatique de l'ADN de
An. gambiae s.s. (Fanello et al., 2002).
|
Réactif
|
Concentration initiale
|
Concentration finale
|
Volume partube(ul)
|
|
Tampon
|
10X
|
1X
|
2,50
|
|
Enzyme Hhal
|
10UI/ul
|
0,1UI/ul
|
0,25
|
|
ddH2O
|
|
|
12,25
|
|
ADN
|
|
|
10,00
|
X : Concentration de la solution tampon ;
UI : unités internationales ;ddH2O : Eau
bi-distillée
ANNEXE 2 :
-Séquences des amorces utilisées pour
l'identification des espèces du complexe Anopheles
gambiae
|
Amorce
|
Séquence
|
Taille du fragment
amplifié
|
|
Universelle (UN)
|
5' GTGTGCCCCTTCCTCGATGT 3'
|
|
|
An. arabiensis (AR)
|
5'AAGTGTCCTTCTCCATCCTA 3'
|
315 pb
|
|
An. gambiae (GA)
|
5'CTGGTTTGGTCGGCACGTTT 3'
|
390pb
|
|
An. melas (ML)
|
5'TGACCAACCCACTCCCTTGA 3'
|
464pb
|
-Représentation schématique du test
diagnostic de 3 espèces membres du complexe
Anophelesgambiaed'après Scott et al., (1993)
UN
AR
GA
ML
-
Région conservée du génome (cheztoutes
les espèces)
Régions variables et séquences
spécifiques d'espèce
+
An. arabiensis
An. melas
An. gambiae
ANNEXE 3
1 2 3 4 56 7 8910 11 12
A
B
C
D
E
F
G
H
Moustique à tester (1 spécimen par puits)
Témoins négatifs(PBS ou BB)
Témoin positifP. falciparum
Figure A : Plaque de Nunc à 96
puitsutilisée pour les tests ELISA monospécifique
Echantillon positif
Puits de dépôt
témoins
Numéro de la plaque
Figure B : Photo d'une plaque montrant un
résultat de test ELISA
ANNEXE 4
Réactifs et quantité pour
ELISA-CSP
PBS (Phosphate Buffered Saline)
Reconstituer le PBS en poudre Sigma : 9,7 g dans un litre
d'eau distillée
NP40/BB = Nonidet P40 pour une plaque 2ml =
25ul NP 40 + 2 ml BB (blocking buffer), agiter
(préparer pour 5 plaques 10 ml + 125 ul NP 40)
BB (blocking buffer) : Dans un litre
PBS, ajouter :
1) 5 gde Caséine
2) 0,1 g de Thiomérosal
3) 0,04 g de phenol red
4) 10 g de BSA
Laisser sur l'agitateur deux heures
PBS/TWEEN 20 - 500 ul de Tween 20 dans 1 l de
PBS, agiter
Substrat de Peroxydase = pour 3
plaques :
· 5 mg d'Ortho-tolidine dans 0,25ml de
N,N-diméthylformamide
· 30 ml de Tampon citrate
· 12ul de H2O2 à 10% (ou 4
ul 0 30%, ou 6ul à 20% ).
Tampon Citrate pH4
- Préparer le Tampon Citrate pH4 : pour 1
litre :
Acide citique,
Hydroxyde de Sodium 4,48g
- Dissoudre la soude dans 200ml d'eau bidistillée, puis
l'acide citrique dans cette solution. Ajouter 400ml d'eau bidistillée.
Ajuster le pH à 4 avec l'acide Chlorhydrique 1N. Compléter
à 1 l avec l'eau bidistillée.
Reconstitution des anticorps monoclonaux
lyophilisés (acm)
· milieu reconstitution = ½ volume H2O +
½ volume Glycérol
- 1,0 mg ACm + 2 ml milieu reconstitution
- 0,5 mg ACm + 1 ml milieu reconstitution
- 0,25 mg ACm + 0,5 ml milieu reconstitution
Quantité d'ACm
nécessaire :
- Sensibilisation : ACm capture dans du
PBS
- Capture pour une plaque
P. falciparum : 15 ul/5 ml
PBS
- Révélation : ACm conjugués
à peroxydase dans BB
- Conjugues pour une plaque
P. falciparum : 7,5 ul/5ml BB
ANNEXE 5
Abstract présenté au "CIS-SOCAB-CCAM
Scientific Symposium", 22-25 Avril 2007
Titre :Variations altitudinale et
latitudinale de la composition spécifique du complexe An. gambiae
au Cameroun
Auteurs :Billy TENE FOSSOG,
Timoléon TCHUINKAM, Samuel WANDJI, Etienne FONDJO, Thomas NJINE, Mpoame
MBIDA, Didier FONTENILE, Frédéric SIMARD.
Introduction :
Considéré comme étant le meilleur vecteur
du paludisme au monde, An. gambiae sl a été
élevé au rang de complexe d'espèce et subdivisé en
7 sous-espèces dont An gambiae ss Giles 1902, An
arabiensis Patton 1905et An melas Théobalt 1903
présentes au Cameroun. Toutefois, leur distribution n'est pas
homogène sur tout le térritiore. Nous avons étudié
la repartition des membres de ce complexe suivant un transect altitudinal et
latitudinal dans 3 régions cibles situées le long de la "ligne du
Cameroun".
Méthodologie :
Les zones d'étude sont présentées dans le
tableau ci-dessous. Les récoltes d'échantillons y ont
été faites suivant 3 méthodes: le "dipping" pour les
larves, la capture sur homme et les pulvérisations intra domiciliaires
de pyrèthre pour les adultes. Les échantillons
récoltés ont été identifiés
morphologiquement (espèces) puis génétiquement (sous
espèces). Les analyses génétiques ont été
faites sur des extraits d'ADN amplifiés suivant des techniques de PCR
spécifiques (PCR complexe et PCR M/S) puis migrés sur gel
d'agarose pour comparaisons.
|
Région
|
Mont Cameroun
|
Hauts plateaux
|
Monts Mandara
|
|
Site
|
Debundscha
|
Mutengéné
|
Meanja
|
Likoko
|
Buea
|
Santchou
|
Dschang
|
Godola
|
Mokolo
|
|
Altitude
|
50 m
|
220m
|
300m
|
800m
|
1200m
|
750m
|
1400m
|
450m
|
900m
|
Résultats :
An. gambiae sl est présent dans tous les sites
étudiés mais sa population décroît avec la
montée en altitude et en latitude. Au niveau de la plus faible altitude
et latitude (Debundscha), An melas a été retrouvé
bien que à une faible proportion de 6,8% en association avec An
gambiae ss , mais cette espèce disparaît dès qu'on
s'éloignement de la côte, confirmant ainsi son adaptation aux eaux
saumâtres. Loin des côtes (altitudinalement et latitudinalement),
les populations d'An gambiae sl sont composées exclusivement de
An gambiae ss, jusqu'à une certaine altitude et latitude. Au
nord du pays, An. arabiensis est apparu en proportion
supérieure à An. gambiae ss (93% et 60% respectivement)
(Graphe 1).
La composition des formes moléculaires M et S de An
gambiae ss varie également en altitude et en latitude.. La forme M
est prédominante aux basses altitudes (100% à Debundscha) et se
fait remplacer progressivement avec la montée en altitude (50% à
Mutengéné, 14% à Godola) jusqu'à disparaître
complètement Buea et à Dschang, où il y a plutôt
100% de forme S (Graphe 2).
Interprétation :
La plasticité de An gambiae sl lui
confère une grande capacité d'adaptation, puisqu'il est
présent sur tout le long du transect altitudinal, avec
prédominance d'aval en amont de : An melas, An gambiae
ss - M, An gambiae ss -S et probablement An arabiensis
dans les sommets. Cette composition spécifique du complexe varie
également avec la latitude mais dans un rapport de distance 1000 fois
moins vite qu'avec l'altitude. Elle serait fonction des conditions climatiques
et des types de gîtes larvaires présents.
Les 2 formes moléculaires peuvent dans certains sites
être sympatriques ; seulement même dans ces conditions, on
observe pas d'hybride. La nature de la pression de sélection reste donc
à déterminer pour cerner le processus de spéciation en
cours. Elle est probablement de nature écologique et se retrouverait
à mi-altitude et à mi-latitude.

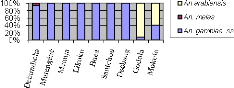
Graphe 1 : variation de la composition
spécifiqueGraphe 2 : Proportion des formes
moléculaires avec la
en fonction de l'altitude latitude
Références : Mouchet
et al., : biodiversité du paludisme dans le monde,
2004 ;
C. WONDJI et al, J. M. Ent, 2005,
D. FONTENILLE, med. Trop, 2003
* 1L'antigène Duffy
sur la paroi de l'érythrocyte est nécessaire à la
pénétration du mérozoïte de P. vivax
* 2intervalle entre 2 repas
de sang
* * Plante dont les fleurs
produisent une poudre insecticide
* ** Temps nécessaire
pour que l'insecticide agisse sur les moustiques
* 3Au-delà de 35
cycles, l'enzyme de réplication (la Taq polymérase) est
dénaturée
| 


