|
UNIVERSITE MARIEN NGOUABI
****************
Ecole
Nationale Supérieure d'Agronomie
et de Foresterie
|
|
UNMG ENSAF
Année : N° d'ordre :____
RAPPORT DE FIN DE FORMATION
Pour l'obtention du diplôme de licence
Professionnelle
Parcours : Phytotechnie et Biodiversité
Mention :
Productions Végétales
Présenté par : BAKALA
NKAYA Maurice
TITRE

Effets du substrat et du prétraitement sur la
germination des graines de Morinda citrifolia L. (Noni)
en pépinière
Maître de stage : Dr. Chrissy Garel MAKOUANZI EKOMONO
Maitre-Assistant CAMES en
Génétique et Amélioration des
Plantes de l'Université Marien Ngouabi, ENSAF
Directeur Scientifique de l'Institut national de Recherche
Forestière (IRF)


Dédicaces
Je dédie ce modeste travail :
A ma mère, TSOKO Emilienne qui a éclairé
mon chemin et qui m'a encouragé et soutenu tout au long de mes
études.
A mon oncle et sa femme, BOUSTOKI KOMBO Théodore et
KILATIKA Alphonsine pour leur soutien et conseil.
A ma famille, pour l'amour et le soutien. A mes très
chers amis.
A tous les étudiants de ma promotion.
II
Remerciements
Ce travail est le fruit de trois années d'études
passées à l'Ecole Nationale Supérieure d'Agronomie et de
Foresterie (ENSAF) et de trois mois de stage passé à l'Institut
national de Recherche Forestière (IRF) au cours duquel j'ai appris des
connaissances pratiques et théoriques nécessaire à mon
initiation dans la vie professionnelle.
Je tiens à remercier tous mes formateurs à
l'ENSAF, particulièrement le Pr. Parisse AKOUANGO,
Directeur de l'ENSAF ; le Dr Felix KOUBOUANA,
Directeur-adjoint ; le Dr Paul MOPOUNDZA, Chef de
Département des Licences le Dr Pierre MBETE, Chef du
bureau des Stages, le Dr Gilles Freddy MIALOUNDAMA, Chef de
parcours Licences professionnelle Phytotechnie et Biodiversité.
Mes remerciements s'adressent également à
l'endroit du Dr Victor KIMPOUNI, Directeur
Général de l'Institut national de Recherche Forestière,
pour m'avoir accueilli au sein de cette structure, pour sa rigueur et ses
conseils scientifiques judicieux tout au long de la réalisation de mon
travail.
J'adresse ma plus profonde gratitude et mon plus profond
respect à mon encadreur, le Dr Chrissy Garel MAKOUANZI EKOMONO,
Directeur Scientifique et chef du département
Amélioration Génétique de l'IRF, d'avoir accepté
encadré ce travail, pour ses conseils constructifs, son
dévouement et sa disponibilité tout au long de ces mois de
travail.
Je remercie Dr Jean Pierre KAMPE, Chef du
Département sylviculture et Dynamique Forestière de l'IRF.
Je remercie Mme DIPAKAMA Claude Melaine,
Directrice de la zone de recherche de Brazzaville de l'IRF, pour son
assistance et ses conseils rationnels tout au long de la réalisation de
notre travail.
Mes sincères remerciements à Mme
Noémy LOUBAKI, Responsable de la
pépinière pour son accompagnement tout au long de la
réalisation de ce travail.
Je remercie M. Degrâce OKO, agent de
l'IRF pour son soutien moral et technique durant mon stage.M. Nestroy
MPOUKI et Mme Jobercia MOULAMBI, techniciens
supérieurs à l'IRF pour leur conseil et soutien technique durant
mon stage. Grand merci à M. Jules NKOUNKOU et M.
Kévin MANGANE, agents de l'IRF pour leur assistance
tout au long de la réalisation de mon travail.
Je remercie tout le personnel de l'IRF, pour l'accueil et
l'ambiance chaleureuse qu'il a installé au sein de la structure et
durant mon stage.
Je tiens aussi à remercier mes amis et anciens de
l'ENSAF, et toutes personnes qui ont contribué de près ou de loin
à l'élaboration de ce rapport, particulièrement M.
Jeansy Alvérick Duvaress KIMBEMBE et M. Bernon
Pie Nicaise BASSONGA pour leurs soutiens et conseils.
III
Liste des figures
Figure 1:Organigramme de l'IRF 4
Figure 2:Arbuste du Noni 8
Figure 3:Fruits du Noni à différents stade de
maturation (Nelson, 2003) 8
Figure 4:Fruit vert du Noni (Nelson, 2003) 9
Figure 5:Fruit mûr du Noni (Nelson, 2003) 9
Figure 6:Graine du Noni (Nelson, 2003) 9
Figure 7:Vue aérienne de la Cité Scientifique de
Brazzaville (ex-OROSTOM) 17
Figure 8:Courbe ombrothermique de Brazzaville (ANAC, 2020)
18
Figure 9: Les graines de Noni 18
Figure 10:Dissociation des graines avec la pulpe 19
Figure 11:Séchage des graines au soleil 19
Figure 12:Préparation du premier substrat 20
Figure 13:Préparation du substrat deux 21
Figure 14:Remplissage des caissettes 21
Figure 15:Graine bien scarifiée (Nelson, 2003) 22
Figure 16:Graine mal scarifiée (Nelson, 2003) 22
Figure 17:Semis des graines 22
Figure 18:Illustration du dispositif
expérimental 23
Figure 19:Taux de germination des graines suivant les
différents prétraitements et substrats 26
Figure 20:Courbe de la cinétique de germination du
substrat un 28
Figure 21:Courbe de la cinétique de germination du
substrat deux 28
Figure 22:Diagramme des délais de germination en
fonction du substrat et du prétraitement 29
Liste des tableaux
Tableau 1:Différentes unités de
recherche de chaque département scientifique fonctionnel de
l'IRF 5
Tableau 2:Classifications botaniques (Nicolas, 2004)
7
Tableau 3:Test de Shapiro-Wilk 25
Tableau 4:test de Levene 25
Tableau 5:ANOVA non paramétrique a deux facteurs selon
le test de Scheirer-Ray-Hare 27
Tableau 6: Durée de germination suivant les
prétraitements et les substrats 29
iv
Table des matières
Introduction 1
Objectifs de l'étude 2
Chapitre I : Présentation de la structure
d'accueil du stage 3
I.1. Statut 3
I .2. Ressources de l'IRF 3
I.3. Missions de l'IRF 3
I.4. Domaines de compétences de l'IRF
3
I.5. Organisation de l'IRF 4
Chapitre II: Revue bibliographique 6
II.1. Origine et distribution de Morinda citrifolia
L. (Noni) 6
II.2. Ecologie de Morinda citrifolia L. (Noni)
6
II.3. Différentes dénominations de
Morinda citrifolia L. (Noni) 6
II.4. Classifications botanique de Morinda
citrifolia L. (noni) 7
II.5. Description biologique de Morinda citrifolia
L. (Noni) 7
II.6. Produits commerciaux de Morinda citrifolia
L. (Noni) 9
II.7. Composition physico-chimique de Morinda
citrifolia L. (Noni) 9
II.8. La graine et la germination 9
II.8.1. Définition de la graine 9
II.8.2. Définition de la germination
10
II.8.3. Types de germination 10
II.9. Conditions de la germination 10
II.9.1. Conditions externes de germinations
10
II.9.2. Conditions internes de germinations
11
II.10. Etapes de la germination 11
II.11. Dormance des graines 11
II.11.1. Dormance primaire 12
II.11.2. Dormance secondaire 12
II.11.3. Levée de dormance 12
II.12. Fiche technique de Morinda citrifolia L.
(Noni) 13
II.12.1.Les préférences et
tolérances environnementales de Morinda citrifolia L. (Noni)
13
II.12.2. Le traitement des semences 14
II.12.3. Le stockage des graines 14
II.12.4. Le mode de propagation du Noni 14
II.13. La mise en culture du Noni 14
II.13.1. Le traitement des semences avant la plantation
14
V
II.13.2. Le semis des graines 15
II.13.3.Le repiquage des plants 15
II.13.4. La propagation à partir de boutures de
tige 15
II.14. La sensibilité aux ravageurs et aux agents
pathogènes 15
II.14.1. Les insectes nuisibles 16
II.14.2. Les pathogènes et maladies biotiques
16
Chapitre III: Matériel et méthodes
17
III.1. Présentation du milieu d'étude
17
III.1.1. Situation géographique 17
III.1.2. Climat 17
III.1.3. Matériel végétal
18
III.2. Méthodologie 19
III.2.1. Collecte des fruits 19
III.2.2. Préparation du substrat 19
III.2.3. Remplissage des caissettes 21
III.2.4. Prétraitement des graines 21
III.2.5. Semis des graines 22
III.2.6. Dispositif expérimental 23
III.2.7. Suivi de la germination 23
III.2.8. Les paramètres mesurés
24
III.2.9. Traitement et analyse des données
24
IV.1. Résultats 26
IV.1.1. Germination des semences 26
IV.1.1.1. Comparaison du taux de germination (TG) en
fonction du substrat et du
prétraitement 26
IV.1.1.2. Comparaison des courbes de germination suivant
le substrat et le prétraitement 27
IV.1.1.3. Comparaison des délais de germination
suivant le substrat et le prétraitement 28
IV.1.1.4. Comparaison des durées de germination
suivant le substrat et le prétraitement 29
IV.2.Discussion 30
IV.2.1. Effet du substrat et du prétraitement sur
le taux de germination 30
IV.2.2. Effet du substrat et du prétraitement sur
la cinétique de germination 30
IV.2.3.Effet du substrat et du prétraitement sur
le délai de germination 31
IV.2.4. Effet du prétraitement et du substrat sur
la durée de germination 31
Conclusion et perspectives 32
Références bibliographiques 33
1
Introduction
L'utilisation des plantes médicinales est en plein
essor dans la plupart des pays du monde. Cette utilisation est principalement
fondée sur l'idée que les plantes sont un moyen naturel pour se
traiter et pauvre de tout risque. A travers les siècles, les traditions
humaines ont su développer la connaissance et l'utilisation des plantes
médicinales (Dibong et al., 2011 ; Bouacherine et Benrabia,
2017). Les industries pharmaceutiques sont de plus en plus
intéressées par l'étude ethnobotanique des plantes (Dibong
et al., 2011). Tout homme veut avoir une santé saine pour vivre
le plus longtemps possible. La médecine par les plantes est l'une des
préoccupations les plus anciennes de l'humanité ; l'homme
attaqué et affaibli par la maladie a toujours cherché dans les
plantes des remèdes pour réparer les imperfections de son
organisme (Mabika, 1983). Compte tenu de leur apport dans l'usage
médicinal, ces plantes se trouvent au centre de plusieurs
activités liées aux produits forestiers non ligneux.
De plus, les produits forestiers non ligneux ont
éveillé un intérêt considérable dans les pays
en voie de développement au cours de ces dernières années
pour leur contribution à l'économie des ménages et la
conservation de la biodiversité végétale (Betti,
2002).
Morinda citrifolia L. est une plante
médicinale aux vertus miraculeuses mais pourtant peu connue en Afrique.
Son utilisation traditionnelle depuis de nombreux siècles a permis
d'orienter plus facilement les recherches sur les structures chimiques qui ont
été mises en évidence. Ces dernières années,
les méthodes d'extraction et d'isolement ont permis de
répertorier de nombreux composés susceptibles d'expliquer les
diverses activités biologiques de Morinda citrifolia L., en
particulier 1'activité anti-tumorale (Nicolas, 2004). Les
nombreux brevets déposés concernant la production de
compléments alimentaires illustrent bien l'intérêt
croissant porté à Morinda citrifolia L. (Nicolas,
2004). Ces découvertes boostent sa valeur commerciale et
poussent les agriculteurs à se lancer dans la production de son
fruit.
Cependant, les graines de Morinda citrifolia L. ont
un problème de dormance tégumentaire limitant ainsi leur culture
commerciale (Cambie et Ash, 1994 ; Ponnaiyan et Vezhavendan, 2005
; Elakkuvan et Manivannan, 2010). Les graines non traitées
ont besoin de plusieurs mois (jusqu'à plus de 6 mois) pour germer
(Nelson, 2003 ; Ponnaiyan et Vezhavendan, 2005 ; Elakkuvan et
Manivannan, 2010), mais l'utilisation des prétraitements peut
réduire cette dormance tégumentaire (Nelson, 2005 ;
Ponnaiyan et Vezhavendan, 2005). La phase de
pépinière constitue une étape cruciale dans la production,
la domestication et la mise en place des plantations. Sur ce, la
présente étude se propose d'étudier les effets du substrat
et du prétraitement sur la germination des graines de Morinda
citrifolia L. en pépinière.
2
Objectifs de l'étude
L'objectif général de cette étude est de
déterminer les effets du substrat et du prétraitement sur la
germination des graines de Morinda citrifolia L. en
pépinière. Deux objectifs spécifiques découlent de
cet objectif général :
1. déterminer l'effet du substrat sur les
paramètres de germination des graines de Morinda citrifolia L.
;
2. déterminer l'effet du prétraitement sur les
paramètres de germination des graines de Morinda citrifolia L.
;
Ce rapport est subdivisé en quatre chapitres hormis
l'introduction et la conclusion. Le premier chapitre est consacré
à la présentation de la structure d'accueil. Le deuxième
chapitre présente la revue bibliographique. Le troisième chapitre
traite des matériel et méthodes qui décrivent la
méthodologie adoptée pour la réalisation de
l'étude. Le quatrième chapitre présente les
résultats et la discussion qui en découle.
3
Chapitre I : Présentation de la structure
d'accueil du stage
I.1. Statut
L'Institut national de Recherche Forestière (IRF) est un
établissement public administratif à caractère
scientifique créé par la loi n° 23-2012 du 24 septembre 2012
et institué par décret n° 58-2016 du 26 février 2016
portant approbation des statuts de l'Institut national de Recherche
Forestière.
I .2. Ressources de l'IRF
Les ressources de l'IRF proviennent des :
· Subventions de l'Etat ;
· Prestations de l'Institut ;
· Contributions du fonds de soutien à la recherche
scientifique ;
· Dons et legs.
I.3. Missions de l'IRF
Les missions de l'IRF sont :
· Organiser, conduire et exécuter toute recherche
fondamentale et appliquée visant la promotion du développement
forestier durable ;
· Mettre en oeuvre une programmation scientifique autour
des axes prioritaires pour le développement du pays ;
· Effectuer des expertises scientifiques dans son champ de
compétence ;
· Participer à la valorisation des résultats
de ses recherches et de son savoir-faire ;
· Contribuer à l'élaboration de la politique
de recherche dans les domaines relevant de sa compétence ;
· Apporter son concours à la formation, à la
recherche et par la recherche ;
· Publier et diffuser les résultats de ses travaux
et concourir au développement des connaissances et de l'information
scientifique.
I.4. Domaines de compétences de l'IRF
Les domaines de compétence de l'IRF sont :
· Aménagement forestier ;
· Sylviculture ;
· Agroforesterie ;
· Génétique forestière ;
· Technologie du bois ;
· Produits forestiers non ligneux ;
· Conservation et gestion de la biodiversité ;
· Changement climatique ;
· Appui à la mise en place des plantations
forestières privées ou communautaires ;
· Environnement : érosion hydrique, pollutions
des sols et des eaux, études d'impact environnemental et social (EIES),
évaluation environnementale...
I.5. Organisation de l'IRF
L'institut national de Recherche Forestière est
administré par un comité de direction et géré par
une direction générale. Il dispose de deux organes consultatifs :
le conseil scientifique et le conseil d'établissement. Le comité
de direction de l'IRF (encore inexistant) est l'organe délibérant
sur l'orientation de la politique de recherche de l'institut, le programme
annuel d'activités, le budget, les statuts, les rapports
d'activités, le programme des investissements, les règlements
intérieur et financier, les comptes administratifs et financiers, les
mesures de redimensionnement de l'institut, etc.
La direction générale de l'IRF, outre le
secrétariat de direction, le service juridique et le service de la
coopération, comprend :
· La direction scientifique ;
· La direction de l'administration et des ressources
humaines ;
· La direction financière et comptable ;
· La direction du patrimoine et de l'équipement ;
· La direction de la communication et des systèmes
d'information ;
· Les zones de recherche.
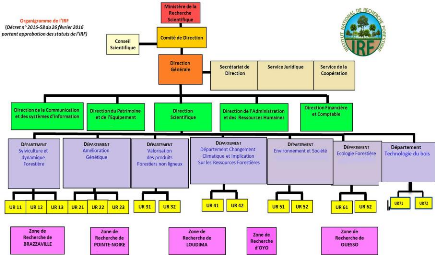
4
Figure 1 : Organigramme de
l'IRF
5
Les départements scientifiques sont structurés
en unités de recherche. Le tableau présente les
différentes unités de recherche par département
fonctionnel.
Tableau 1: Différentes unités de
recherche de chaque département scientifique fonctionnel de
l'IRF
N°
|
Départements
|
Unités de recherche (UR)
|
1
|
Sylviculture et
Dynamique Forestière
|
UR 11 : Connaissance et fonctionnement des
écosystèmes
forestiers
UR 12 : Dynamique et fonctionnement des plantations
forestières
UR 13 : Dynamique des systèmes agroforestiers
|
2
|
Amélioration Génétique
|
UR 21 : Arboriculture fruitière
UR 22 : Caractérisation de la diversité
génétique des essences forestières
UR 23 : Multiplication végétative des essences
à reproduction sexuée complexe
|
3
|
Valorisation des
Produits Forestiers Non Ligneux
|
UR 31 : Caractérisation et valorisation des arbres
fruitiers
sauvages
UR 32 : Caractérisation des PFNL d'origine animale et
végétale
|
4
|
Changement
Climatique et
Implication sur les
Ressources
Forestières
|
UR 41 : Extrêmes climatiques et fonctionnement des
écosystèmes forestiers
UR 42 : Impacts des activités anthropiques sur les
écosystèmes forestiers
|
5
|
Environnement et
Société
|
UR 51 : Arbres et foresterie urbaine
UR 52 : Biens et services environnementaux
|
6
|
Ecologie Forestière
|
UR 61 : Diversité faunistique des
écosystèmes forestiers
UR 62 : Diversité et structure des peuplements dans
les
écosystèmes forestiers
|
7
|
Technologie du Bois
|
UR 71 : Caractérisation physiques et mécaniques
du bois des essences forestières
UR 72 : Caractérisation chimique du bois des essences
forestières
|
|
La présente étude s'est déroulée
dans le département Amélioration Génétique,
précisément au sein de l'unité de recherche «
Arboriculture fruitière ».
6
Chapitre II: Revue bibliographique
II.1. Origine et distribution de Morinda citrifolia L.
(Noni)
Le Noni est originaire de l'Asie du Sud-Est plus
précisément de l'Indonésie et de l'Australie. Bien qu'il
puisse se disperser naturellement par des graines flottantes qui reprennent vie
après de longs mois de voyage à travers l'océan, les
hommes ont joué un rôle très important dans sa
dissémination. Les Marquisiens et les Tahitiens ont été
parmi les premiers, les Hawaïens les derniers à avoir
été approchés par les voyageurs polynésiens qui
exportèrent le Noni dans ces îles. Que ces plantes de Noni aient
été importées au-delà de la plus lointaine
contrée de Polynésie témoigne de leur importance. En effet
Morinda citrifolia L. est présente en Australie, en Malaisie et
dans le sud-est de l'Asie, notamment la Chine. Sa localisation dans certaines
régions d'Afrique ou dans les Caraïbes ne peut être que due
à l'homme (Dixon et al., 1999 ; Nicolas, 2004 ; Malik et
al., 2009).
II.2. Ecologie de Morinda citrifolia L. (Noni)
Le Noni se développe facilement sur les sols sableux
et côtiers mais s'adapte aussi sur d'autres sols rocailleux, volcaniques
et à moyenne salinité ; C'est un arbre qui tolère 1'ombre,
il pousse aussi bien sous la canopée de la forêt qu'en terrain
découvert. On le rencontre souvent en bordure de la mangrove
côté interne de la frange côtière. Il est bien
sûr maintenant cultivé dans de vastes plantations comme arbre
d'ornement mais aussi comme arbre producteur de fruits comestibles et source de
médicaments traditionnels. On le trouve en association symbiotique avec
la fourmi tisserande (Oecophylla smaragdina) qui se nourrit et
entretient son nid sur 1'arbuste et en retour protège le Noni contre les
insectes prédateurs (Nelson, 2003 ; Nelson, 2005 ; Ollier, 2006).
II.3. Différentes dénominations de
Morinda citrifolia L. (Noni)
Morinda citrifolia L. peut prendre diverses
appellations suivant sa localisation (Nicolas, 2004).
-Inde: Indian Mulberry
-Chine : Ba ji tian
-Tahiti: Nono
-Hawaï: Noni
-Sud-Est asiatique: Nhau
-Iles Samoa : Nonu
-Australie: Cheese fruit
-Malaisie: Mengkudu
Congo: Noni
7
Autres appellations : great morinda, morinda, ananas de la
souris, racine jaune, pain des éléphants, pomme à cochon,
casse douleur, la rhubarbe des Caraïbes, bilimbi, pomme macaque, pomme de
singe (Hénaff, 2009 ; Nelson, 2005).
II.4. Classifications botanique de Morinda citrifolia
L. (noni)
Les différentes classifications (tableau 2)
n'apportent que de nouveaux critères morphologiques pris en compte pour
différencier les plantes. Par contre, la classification basée sur
des critères génétiques permet d'utiliser des techniques
scientifiques plus élaborées. Les liens de parenté entre
les différentes plantes sont mis en évidence grâce à
l'étude de leurs gènes (Nicolas, 2004).
Tableau 2: Classifications botaniques (Nicolas,
2004)
|
Cronquist
(1981)
|
Takhtajan
(1983)
|
Thorne (1992)
|
les
critères
génétiques
|
Embranchement
|
Dicotylédones
|
Dicotylédones
|
Dicotylédones
|
Dicotylédones
|
Ordre
|
Rubiales
|
Rubiales
|
Rubiales
|
Gentianales Lindl.
|
Famille
|
Rubiacées
|
Rubiacées
|
Rubiacées
|
Rubiacées
|
Sous-Famille
|
|
|
Rubioideae
|
|
Tribu
|
|
|
Morindeae
|
|
Genre
|
|
|
Morinda
|
|
Espèce
|
|
|
Citrifolia
|
|
Classe
|
Astéridées
|
Gentianae
|
|
Euastéridées
|
|
II.5. Description biologique de Morinda citrifolia L.
(Noni)
Morinda citrifolia L. est un arbuste d'au moins 6 m
de hauteur et de treize centimètre ou plus de diamètre de la tige
(figure 2). L'écorce est grise ou marron d'aspect lisse à
légèrement rugueux, la partie externe du bois, tendre, est d'un
jaune foncé. Les petites branches sont d'un vert très clair et
présentent une section carrée. Les feuilles, opposées,
sont reliées à la tige par un solide pétiole d'un (1)
à deux (2) cm de long. Les limbes, d'un vert sombre et brillant ont une
forme elliptique ou ovale: 14 à 30 cm de long sur 8 à 18 cm de
large. Ils possèdent des nervures très marquées et
saillantes. Les fleurs blanches tubulaires sont groupées en
inflorescences dans la zone axillaire foliaire. Les tubules floraux
pentalobés font environ 6 mm de long. Apres fécondation, les
ovaires se soudent et chaque capitule donne naissance à un syncarpe
globuleux qui constitue le fruit. Il peut être arrondi ou allongé
avec la forme et les dimensions d'une pomme de terre (5 à 10 cm de long
et 3 à 4 cm de large). Sa surface est
bosselée, dessinée de formes polygonales avec
une tâche sombre formant comme un oeil au centre de chacun de ces
polygones (figure 3) (Garnier, 1997 ; Ollier, 2006 ; Hénaff, 2009).

8
Figure 2: Arbuste du Noni Figure 3:Fruits du Noni
à différents
stade de maturation (Nelson, 2003)
Les différents stades de maturité sont :
- Stade 1 : épiderme vert foncé et fruit
très dur (figure 4) ;
- Stade 2 : épiderme vert-jaune et fruit très dur
;
- Stade 3 : épiderme jaune pâle et fruit
très dur ;
- Stade 4 : épiderme jaune pâle et fruit assez dur
;
- Stade 5 : épiderme blanc et fruit mou (figure 5).
Le passage du stade 4 au stade 5 se fait très
rapidement, généralement en quelques heures et en même
temps que la pulpe se ramollit, passant du jaune pâle au blanc, il se
développe une odeur nauséabonde de fromage rance. Le fruit
mûr est comestible mais avec un goût fade à amer. Un fruit
peut contenir jusqu'à 260 graines, de couleur brune, a une forme aplatie
et fait 4 à 9 mm de long (figure6). L'enveloppe de la graine est faite
de couches de fibres de cellulose extrêmement dures. La graine
possède une chambre d'air balleuse et ovoïde ainsi qu'une sorte de
pale, en pointe, aplatie et bicouche. L'embryon est situé dans la
graine, entre la chambre d'aire et le bout en pointe de la pale. Cet embryon
est aplati, huileux et relativement petit (Garnier, 1997 ; Nelson, 2005).

9
Figure 4:Fruit vert du Noni (Nelson, 2003)
Figure 5:Fruit mûr du Noni (Nelson,
2003)
|
Figure 6:Graine du Noni (Nelson, 2003)
|
|
II.6. Produits commerciaux de Morinda citrifolia L.
(Noni)
Les principaux produits commerciaux à base de Noni
comprennent les boissons (jus de fruits, boissons à base de jus), les
poudres de fruits (pour la fabrication de jus reconstitué ou de boissons
à base de jus, à base de fruits secs mûrs ou non
mûrs), les articles de toilette (lotions, savons, etc.) poudres de
feuilles (pour encapsulation ou pilules) (Hénaff, 2009).
II.7. Composition physico-chimique de Morinda
citrifolia L. (Noni)
Un certain nombre de composants majeurs ont été
identifiés dans la plante tels que: la scopolétine, l'acide
octoanoïque, le potassium, la vitamine C, les terpénoïdes, les
alcaloïdes, les anthraquinones (comme le nordamnacanthal, la morindone, la
rubiadine et la rubiadine -1-méthyl éther, anthraquinone
glycoside), â-sitostérol, carotène, vitamine A, flavone
glycosides, acide linoléique, alizarine, acides aminés, acubine,
L- asperuloside, acide caproïque, acide caprylique, acide ursolique,
rutine et une proxéronine putative (Hénaff, 2009).
II.8. La graine et la germination
II.8.1. Définition de la graine
La graine résulte du développement d'un ovule
fécondé ; elle contient l'embryon et les substances nutritives.
Elle constitue une structure de protection qui permet à la plante de
résister pendant des périodes plus ou moins longues face aux
conditions défavorables saisonnières (température
extrêmes, sécheresse) pendant lesquelles la plante serait
incapable de pousser, ni même parfois de vivre. Les graines peuvent ne
jamais se développer si les conditions climatiques défavorables
se prolongent (Ammari, 2011).
10
II.8.2. Définition de la germination
La germination est définie comme la somme des
événements qui conduisent la graine sèche à germer,
elle commence par la prise d'eau et se termine par l'allongement de l'axe
embryonnaire (Dardour et al., 2003). Elle se manifeste par le passage
de la graine de la vie latente à la vie active sous l'effet des facteurs
favorables ; selon Mazliak (1982) c'est un processus physiologique
dont les limites sont le début de l'hydratation de la semence et le tout
début de la croissance de la radicule. Une semence n'est
considérée comme ayant germé que lorsqu'elle a
donné un plant capable de croître normalement, c'est-à-dire
quand le plant devient autotrophe (Harrington, 1962). Cette notion de
germination varie selon les disciplines.
II.8.3. Types de germination
On distingue deux types de germination : la germination
épigée et la germination hypogée. La germination
épigée est caractérisée par un soulèvement
des cotylédons hors du sol car il y a un accroissement rapide de la
tigelle. Le premier entre noeud donne l'epicotyle et les premières
feuilles au-dessus des cotylédons (ce sont les feuilles primordiales)
tandis que chez les plantes à germination hypogée les
cotylédons restent dans le sol (Ammari, 2011).
L'étude sur la germination de Morinda citrifolia
L. (Noni) réalisée par Elakkuvan et Manivannan (2010)
a montré que les graines de Noni germent en soulevant les
cotylédons hors du sol (germination épigée).
II.9. Conditions de la germination
La germination des graines est favorisée si est
seulement si deux types de condition sont respectés : les conditions
externes et internes.
II.9.1. Conditions externes de germinations
La graine exige la réunion de conditions
extérieures favorables à savoir : l'eau, l'oxygène, la
température et la lumière (Soltner, 2007).
- L'eau
Selon Chaussat et Ledeunff (1975) la germination
exige obligatoirement de l'eau celle-ci doit être apportée
à l'état liquide, elle pénètre par capillarite dans
les enveloppes elle est remise en solutions dans les réserves de la
graine pour être utilisée par l'embryon et provoque le gonflement
de leurs cellules donc leur division.
- L'oxygène
La germination exige obligatoirement l'oxygène
(Soltner, 2007). Selon Mazliak (1982) une faible
quantité d'oxygène peut être suffisante pour permettre la
germination. D'après Meyer et al. (2004)
11
l'oxygène est contrôlé par les enveloppes
qui constituent une barrière mais en même temps une
réserve.
- La température
La température à deux actions : soit directe
par l'augmentation de la vitesse des réactions biochimiques c'est la
raison pour laquelle il suffit d'élever la température de
quelques degrés pour stimuler la germination (Mazliak, 1982) ; soit
indirecte par l'effet sur la solubilité de l'oxygène dans
l'embryon (Chaussat et Ledeunff, 1975).
- La lumière
La lumière agit de manière différente
sur les espèces. Elle inhibe la germination des graines à
photosensibilité négative et stimule celles à
photosensibilité positive (Anzala, 2006). Les espèces
indifférentes à la photosensibilité sont rares (Heler
et al., 2000).
II.9.2. Conditions internes de germinations
Lorsque des graines arrivées à maturité,
sont placées dans des conditions optimales de température
d'humidité et d'oxygénation pour leur croissance ; et ne germent
pas, plusieurs causes sont à envisager : la dormance de l'embryon ou les
inhibitions de la germination. Les conditions internes de la germination
concernent la graine elle-même, elle dit être vivante mure apte
à germer (non dormance) et saine (Dardour et al., 2014)
II.10. Etapes de la germination
Les étapes de la germination sont :
1ère étape : Une graine
placée dans de bonnes conditions commence par gonfler, car elle absorbe
de l'eau: c'est l'imbibition.
2ème étape : La peau de la
graine éclate, la radicule du germe apparaît, s'enfonce dans le
sol, et se couvre de poils absorbants : l'émergence de la racine.
3ème étape : La tigelle
grandit, puis sort de terre en entraînant avec elle les deux
cotylédons; on dit alors que la graine lève.
4èmé étape : Les cotylédons
s'écartent, les deux premières feuilles s'ouvrent et grandissent
pendant que la tige s'allonge. Les cotylédons se rident peu à
peu, car leur chair farineuse fournit les aliments nécessaires à
la croissance. Vides, ils se détachent et tombent (Bewley, 1997).
II.11. Dormance des graines
Chez de nombreuse plantes, la germination des graines n'est
pas immédiate, et nécessite le passage par une période de
repos pendant laquelle la germination est inhibée par divers
mécanismes. La dormance est acquise en fin de maturation de la graine,
elle est un stade important dans le cycle de vie des plantes. C'est un
état provisoire dans lequel des graines viables ne peuvent pas germer
même dans des
12
conditions favorables, cet état se caractérise
par une absence virtuelle d'activité métabolique et /ou par un
manque virtuel de développement et de croissance (Mbaye et al.,
2002). Elle correspond à une inaptitude pour les graines de germer
même dans des conditions favorables (Bewley, 1997).
Il existe deux types de dormance : la dormance primaire et la
dormance secondaire.
II.11.1. Dormance primaire
Elle se manifeste dès la récolte parce qu'elle
s'installe pendant la formation de la graine. Cette forme de dormance peut
être d'ordre tégumentaire ou embryonnaire. Dans certain cas on
observe les deux types de dormance combinée.
? Dormance tégumentaire
Les téguments assurent normalement la protection des
graines mais dans de nombreux cas ils peuvent empêcher la germination en
jouant un rôle de :
- barrière physique: résistance
mécanique imperméable à l'eau ;
- barrière chimique: piégeage de l'oxygène
par des composées phénoliques, présence d'inhibiteurs de
germination dans les téguments (Baskin et Baskin, 1998).
? Dormance embryonnaire (dormance
morphologique)
La dormance morphologique est due à la présence
d'un embryon « sous développé au moment de la
dissémination des graines. La germination ne peut avoir lieu tant que
l'embryon n'est pas arrivé au terme de sa croissance (Baskin et Baskin,
1998).
II.11.2. Dormance secondaire
La dormance secondaire ou induite est imposée à
la graine après la récolte, lors de la conservation dans de
mauvaises conditions : des températures excessives, le manque
d'oxygène ou un éclairement continu. Elles sont aussi de type
tégumentaire ou embryonnaire (Baskin et Baskin, 1998).
Selon Elkkuvan et Manivannan (2010) les graines de Noni ont
une dormance dite primaire, elle est due à son tégument (dormance
tégumentaire) qui joue un rôle de barrière physique contre
l'eau et l'air empêchant ainsi sa germination.
II.11.3. Levée de dormance
La levée de dormance, est accomplie par divers
mécanismes incluant des interactions complexes entre l'environnement et
les facteurs internes (Finkelstein et al., 2008). Plusieurs techniques
variant selon l'espèce et la nature de la dormance, sont prescrites pour
lever la dormance avant le semis ou les tests de germination : stratification
froide (vernalisation) ou chaude (estivation), la scarification
(mécanique, chimique ou physique), l'élimination des
téguments et l'élimination des substances inhibitrices sont des
procédés proposés (Bacchetta et al., 2006).
13
Les principales techniques utilisées pour lever la
dormance des graines de Morinda citrifolia L. (Noni) sont : La
scarification (mécanique, physique ou chimique), traitement avec de
l'eau chaude à différente température, traitement à
l'acide sulfurique, traitement à l'acide gibbérellique,
traitement à l'acide butyrique (Ponnaiyan et Vezhavendan, 2005 ; Singh
et al., 2006 ; Elakkuvan et Manivannan, 2010).
II.12. Fiche technique de Morinda citrifolia L.
(Noni)
II.12.1.Les préférences et tolérances
environnementales de Morinda citrifolia L. (Noni)
- Climat
Le Noni peut croitre dans les températures annuelles
comprises entre 38° à 12°C. Dans une plage d'altitude de 1
à 500m, en fonction de la latitude et de l'environnement (Nelson, 2005 ;
Ollier, 2006).
- Sols
Le Noni tolère un large éventail de conditions
de drainage, y compris des sols gorgés d'eau de façon
saisonnière, mais la préférence va aux sols libres et bien
drainés. Il peut croître dans une large gamme de niveaux
d'acidité et d'alcalin. Le Noni tolère les sols peu profonds,
salins, sodiques et infertiles (Nelson, 2003 ; Nelson, 2005 ; Ollier, 2006).
- Sécheresse
Le Noni mature peut facilement résister à la
sécheresse pendant 6 mois ou plus. Les Nonis sauvages poussant dans des
conditions arides peuvent passer toute leur vie dans des conditions de
sécheresse perpétuelle (Nelson, 2005).
- Ensoleillement et Ombrage
Le Noni peut pousser dans une large gamme d'intensités
lumineuses, de 0% à plus de 80% d'ombre. Mais pousse bien en plein
soleil (Ollier, 2006).
- Engorgement
Résiste et prospère même dans les
piscines à marée saumâtre. Il peut également
tolérer des conditions d'inondation pendant une longue période
(Nelson, 2003 ; Nelson, 2005).
- Brouillard salin
Très résistant au sel et tolérant aux
embruns salins de l'océan. Le Noni est tolérant à
l'extrême salinité en général et on pense qu'il peut
tirer un avantage nutritionnel des minéraux contenus dans l'eau de mer
(Nelson, 2003).
- Collection de graines
Les fleurs de Noni fleurissent toute l'année et ses
fruits tombent également toute l'année. Les fruits sont
récoltés lorsqu'ils commencent à blanchir ou même
lorsqu'ils sont devenus complètement mous, translucides et d'une odeur
caractéristique. Pour la production de graines, plus le fruit n'est
mûr, mieux c'est. Récoltez des plantes qui ont des
caractéristiques souhaitables, telles que de gros fruits pour la
14
production de fruits, ou une croissance vigoureuse des
feuilles pour les haies, etc (Ponnaiyan et Vezhavendan, 2005 ; Singh et
al., 2006 ; Elakkuvan et Manivannan, 2010).
II.12.2. Le traitement des semences
Laissez le fruit mûrir complètement
jusqu'à ce qu'il devienne doux et translucide. Cela peut prendre 3
à 5 jours si seuls les fruits semi-mûrs ont été
récoltés. Une fois que les fruits sont complètement
ramollis, appuyez-les contre un tamis ou une passoire avec des trous
légèrement plus petits que les graines. La chair molle et
fibreuse sera lentement retirée des graines au fur et à mesure
qu'elles sont frottées contre le tamis. L'élimination
complète de la chair adhérente peut prendre 15 minutes. Rincer
périodiquement la pulpe à l'eau permet d'éliminer la
chair. Les graines ont une bulle d'air emprisonnée à
l'intérieur, donc contrairement à la plupart des graines, les
graines de Noni saines flottent dans l'eau et permettent de faire le tri entre
les bonnes et mauvaises (Nelson, 2003 ; Ollier, 2006 ; Elakkuvan et Manivannan,
2010).
II.12.3. Le stockage des graines
Si les graines doivent être stockées, la chair
doit être complètement enlevée, puis les graines
séchées à l'air et stockées dans un sac en papier
dans une pièce fraîche. On ne sait pas combien de temps les
graines restent viables; cependant, un an est considéré comme une
durée de stockage raisonnable. La germination est élevée
pour les graines fraîches, souvent supérieure à 90%
(Ponnaiyan et Vezhavendan, 2005 ; Singh et al., 2006 ; Elakkuvan et
Manivannan, 2010).
II.12.4. Le mode de propagation du Noni
Le Noni est relativement facile à propager. Il peut
être multiplié à partir de graines, de boutures de tiges ou
de racines et de couches aériennes (Nelson, 2003). La méthode de
multiplication préférée est le semis. Bien que le
bouturage permet de contourner le problème de dormance des graines, il
est peu conseillé car les clones obtenus sont fragiles et moins
résistants (Nelson, 2003 ; Elakkuvan et Manivannan, 2010).
II.13. La mise en culture du Noni
II.13.1. Le traitement des semences avant la
plantation
Sans prétraitement, les graines de Noni germent
sporadiquement en 6-12 mois. Le passage des graines aux prétraitements
avant le semis pour réduire l'impact du tégument tenace de Noni
est conseillé, bien qu'il ne soit pas obligatoire, peut raccourcir le
temps nécessaire à la germination des graines et augmenter le
pourcentage global de germination. La méthode la plus utilisée
est la scarification, elle peut être obtenue par toute méthode
physique qui abrase, endommage, pénètre ou coupe le
tégument de la graine. Une méthode simple consiste à
placer les fruits mûrs dans un mélangeur et à pulser le
15
mécanisme de mélange plusieurs fois pour couper
les graines de Noni avant de les séparer (Nelson, 2003 ; Elakkuvan et
Manivannan, 2010).
II.13.2. Le semis des graines
Après la récolte et l'entretien des graines,
elles sont semées dans les pots ou sur les platebandes. Dans un milieu
de culture (terreau) qui retient l'humidité, stérile et exempte
d'agents pathogènes. Couvrir légèrement avec 5 à 10
mm de terreau. Gardez l'humidité avec un pulvérisateur afin de ne
pas déranger les graines. La germination des graines peut être
rapide et uniforme (20 jours) en plein soleil, à mi-ombre et à
une température d'environ 38 O C. Sa germination peut être
influencée par l'environnement, la variété ou le
génotype (Nelson, 2003 ; Elakkuvan et Manivannan, 2010).
II.13.3.Le repiquage des plants
Les plants de Noni (s'ils ne sont pas directement
ensemencés dans le sol) peuvent être repiqués environ 2-12
mois après la germination. Les jeunes plants de Noni (âgés
de 8 à 12 semaines; 10 à 15 cm de hauteur) peuvent
nécessiter plus de soins et peuvent être plus vulnérables
aux fluctuations environnementales et aux attaques de ravageurs que les plants
plus âgés. Les plants plus âgés, cultivés en
plein soleil dans des pots de 2 ou 3 litres pendant 24 à 36 semaines,
sont préférés pour leur vigueur et leur capacité
à s'établir rapidement. Même les semis plus
âgés (âgés de 1 à 3 ans) peuvent être
repiqués s'ils sont sains et ne sont pas liés de manière
significative aux racines. Pour les semis plus âgés,
détachez doucement les systèmes racinaires à la main
après les avoir retirés de leurs pots ou contenants. Afin de
permettre la pénétration des rayons solaires et de l'air les
plants de Noni sont plantés à 1,5 mètre entre ligne et
à 1,5 mètre sur ligne (Nelson, 2003 ; Elakkuvan et Manivannan,
2010).
II.13.4. La propagation à partir de boutures de
tige
La taille des boutures de tige est arbitraire, mais les
boutures de 20-40 cm sont préférables et efficaces. Les boutures
de tige peuvent s'enraciner en 3 semaines et être prêtes à
être repiquées en 6 à 9 semaines. Comme pour les plantes
dérivées de graines, les boutures de tige enracinées
peuvent être cultivées dans des pots pendant 26 semaines ou plus
avec d'excellents résultats une fois plantées (Nelson, 2003 ;
Elakkuvan et Manivannan, 2010).
II.14. La sensibilité aux ravageurs et aux
agents pathogènes
Noni est susceptible d'être attaquée par un
large éventail d'organismes nuisibles et pathogènes. Cependant,
les dommages dépendent du ravageur ou du pathogène et de
l'environnement. Lorsqu'il est cultivé dans un écosystème
naturel boisé et diversifié, le Noni souffre
généralement de quelques problèmes ou dommages importants
de ravageurs et de maladies. Inversement, lorsqu'il est cultivé
16
dans un système agricole monoculture moderne, le Noni
est beaucoup plus susceptible d'être attaqué par plusieurs
ravageurs et de maladies et avec une plus grande intensité que dans les
écosystèmes naturels. En outre, le Noni cultivé en
monoculture sur des terres précédemment utilisées pour les
cultures de fruits ou de légumes a tendance à être
exposé à de nouveaux ravageurs et agents pathogènes qui
peuvent ne pas être présents ou abondants dans les
écosystèmes forestiers ou naturels (Nelson, 2003 ; Nelson, 2005 ;
Ollier, 2006).
II.14.1. Les insectes nuisibles
Le Noni est sensible aux attaques et aux dommages
causés par une gamme d'insectes, tels que les pucerons (par exemple, le
puceron du melon, Aphis gosypii ), les écailles (par exemple,
l'échelle verte, Coccus viridis ), les charançons
(espèces non identifiées), les mineuses ( espèces non
identifiées), les mouches blanches (par exemple, la mouche blanche de
Kirkaldy, Dialuerodes kirkaldyi ), les chenilles (par exemple, la
chenille du croton, Achaea janata ), les thrips (par exemple, les
thrips des serres, Heliothrips haemorroidalis), et une espèce
non identifiée de mite ériophyidé. Une utilisation
excessive d'engrais peut attirer des insectes se nourrissant de sève
(par exemple, pucerons, mouches blanches, écailles) qui provoquent une
accumulation de fumagine sur les feuilles de Noni. Les dommages causés
par les insectes peuvent être plus graves dans les endroits relativement
secs ou peu pluvieux ou dans les plantations en plein soleil en tant que
monoculture expansive (Nelson, 2003 ; Nelson, 2005).
II.14.2. Les pathogènes et maladies biotiques
Dans les zones humides, à fortes pluies ou
inondées, le Noni est sujet à certaines maladies des plantes
causées par des champignons (taches foliaires (Colletot- richum
sp. et autres); brûlures des tiges, des
feuilles et des fruits (Phytophthora sp.; Sclerotium Rolfsii). Noni
est très sensible aux attaques et aux dommages causés par
plusieurs espèces de nématodes (Meloidogyne spp.), qui
peut être réduite au minimum en évitant les sols agricoles
utilisés précédemment et les plantations dans des endroits
plus rocheux, si possible. Certaines maladies foliaires causées par des
champignons (taches foliaires et brûlure) peuvent inhiber de
manière significative la croissance des feuilles et le
développement des fruits (Nelson, 2003 ; Nelson, 2005).
17
Chapitre III: Matériel et méthodes
III.1. Présentation du milieu
d'étude
III.1.1. Situation géographique
Cette étude a été réalisée
à la pépinière de l'Institut National de Recherche
Forestière (IRF), située
dans l'enceinte de la Cité Scientifique de
Brazzaville, ex-ORSTOM (15°14' de longitude Est et 4°16'
de latitude Sud), implantée sur un plateau de 309 m
d'altitude, avec une superficie de 22,48 hectares.
La Cité Scientifique de Brazzaville (figure 7) est
située dans l'arrondissement
n°1(Makélékélé).
Elle est limitée :
? Au Nord par le quartier Diata ;
? Au Sud sur l'Avenue de l'auberge Gascogne ;
? A l'Est par le jardin d'essais;
? A l'Ouest par le quartier Château d'eau.
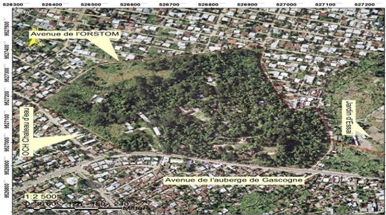
Figure 7:Vue aérienne de la Cité
Scientifique de Brazzaville (ex-OROSTOM)
III.1.2. Climat
Le climat de l'îlot forestier de la Cité
Scientifique de Brazzaville (ex-OROSTOM) fait partie du climat de Brazzaville,
qui est un climat équatorial de type bas-congolais qui règne sur
le sud-ouest du Congo (Samba-Kimbata, 1978). Il connait des
précipitations modérées dont la répartition
mensuelle fait apparaître une saison sèche très
marquée de quatre (4) à cinq (5) mois (mai - septembre),
encadrée par deux (2) périodes des pluies dont celle de
février à mai est la plus abondante (Codou, 1976; Vennetier,
1977 ; Moukolo, 1992; Nzila, 1993). Les pluies commencent
très faiblement en septembre, s'établissent en octobre et se
terminent en mai.
La courbe ombrothermique (figure 8) ci-dessous est obtenu
à partir des données fournies par l'ANAC. Il montre la variation
des températures maximales et des précipitations de 2009 à
2019.
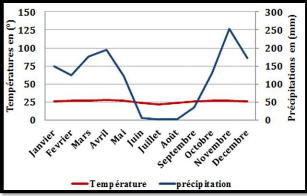
Figure 8: Courbe ombrothermique de Brazzaville (ANAC,
2020)
III.1.3. Matériel végétal
Le matériel végétal utilisé pour la
réalisation de notre étude, est constitué des graines de
Morinda citrifolia L. (figure 9) dont les fruits ont été
récoltés sur un (1) pied de Noni présent à la
pépinière de l'IRF de Brazzaville. Ces fruits ont
été collectés dans la période allant de Juillet
à Août 2020.

18
Figure 9: Les graines de Noni
19
III.2. Méthodologie
III.2.1. Collecte des fruits
Les fruits ont été collectés
après leur chute puis mis en conservation en attente de la
maturité physiologique (c'est-à-dire lorsque la chaire devient
tendre et que la couleur vire au blanc). Après trois (3) jours, nous
avions émiettés les fruits dans un seau rempli d'eau pour les
débarrasser de leur chair et fibres collantes (figure10). Les graines
ainsi obtenue ont été séchées au soleil pendant un
jour (figure11).
|
|
Figure 10:Dissociation des graines avec la
pulpe
|
Figure 11:Séchage des graines au
soleil
|
|
III.2.2. Préparation du substrat
Deux types de substrats ont été utilisés
pour le semis des graines :
? Premier substrat
Le premier substrat était composé de sable
blanc et de la terre humifiée (figure 12c), tamisée afin de les
débarrasser des éléments grossiers (figure 12a et e), puis
stérilisés séparément par chauffage pendant 6
heures dans une cuve pour éliminer les microorganismes (figure 12b et
figure 13b). Apres refroidissement, les deux composantes ont été
mesurées à l'aide d'un seau de 11 litres avec les proportions de
50% de terre humifiée + 50% de sable blanc, ensuite
mélangées dans une brouette à l'aide d'une pelle
jusqu'à l'obtention d'un mélange homogène (figure 12d).
Après cela, le mélange a été humidifié avec
de l'eau (figure 12f).
? Deuxième substrat

a
b
c
20
Le second substrat était préparé à
l'instar du premier substrat mais avec les compositions différentes.
Composé de la terre humifiée et de la sciure de bois (figure
13c), la terre humifiée a été stérilisée
(figure 13b) puis mélangé avec la sciure de bois à des
proportions suivantes 75% terre humifiée + 25% sciure de bois à
l'aide d'un seau de 11 litres (figure 13d). La sciure n'a pas été
stérilisée.

a
d e f
b
c
Figure 12: Préparation du premier
substrat

d
e
f
21
Figure 13: Préparation du substrat
deux
III.2.3. Remplissage des caissettes
Nous avons rempli les caissettes à alvéole
amovible avec les deux types substrats à raison de 70 alvéoles
par caissette (figure14). Au total huit (8) caissettes ont été
remplies (quatre caissettes par substrat).

Figure 14:Remplissage des caissettes
III.2.4. Prétraitement des graines
Afin de déterminer les conditions optimales de
germination, nous avons effectué des essais de
germination en pépinière, en utilisant
différents prétraitements:
- Prétraitement avec de l'eau plate
(macération)
Un lot de 70 graines a été plongé dans un
seau contenant de l'eau plate pendant 1 heure 37
minutes jusqu'à ce que les graines s'imbibent d'eau.
- Prétraitement à scarification des
graines
22
La scarification des graines a consisté à
sectionner les téguments de 70 graines sans blessé l'embryon
(figure 15).

Figure 15: Graine bien scarifiée (Nelson, 2003)
Figure 16:Graine mal scarifiée (Nelson, 2003)
- Traitement témoin
Comme traitement de référence, 70 graines n'ont
subi aucun prétraitement dans le but de comparer les paramètres
de germination avec les prétraitements précités.
- Prétraitement avec de l'eau chaude
:
Ce prétraitement a consisté à faire
bouillir de l'eau jusqu'à 100°c. Après ébullition 70
graines ont été plongées dans un récipient
contenant de l'eau bouillante pendant 10 minutes.
III.2.5. Semis des graines
Après le remplissage des caissettes les graines ont
été semées horizontalement avec une profondeur de deux (2)
fois la taille de la graine.

Figure 17: Semis des graines
III.2.6. Dispositif expérimental
Nous avons mis en place un dispositif sans
répétition d`expérience constitué de deux blocs
avec 4 prétraitements (figure 18). Chaque bloc était
composé de quatre (4) caissettes contenant 70 alvéoles amovibles.
Au total 560 graines ont été semées à raison de 280
graines par bloc à raison de 70 graines par traitement et par caissette.
Les différents prétraitements sont:
- Traitement 1 (T1) : graines non traitées ;
- Traitement 2 (T2) : graines scarifiées ;
- Traitement 3 (T3) : graines dont trempées dans de l'eau
bouillante pendant 10 minutes ;
- Traitement 4 (T4) : graines trempées dans de l'eau
plate pendant (macération) pendant 1heure 37 minutes.

T1
T2
T3
T4

T1
T2
T3
T4
23
Figure 18 : Illustration du dispositif
expérimental
III.2.7. Suivi de la germination
Les graines ne germent pas toutes en même temps. De ce
fait nous avons observé régulièrement les semis tout au
long de l'expérience entre 9 heure et 10 heure. Le suivi de la
germination a consisté à noter les dates de germination ainsi que
le nombre des graines germées.
III.2.8. Les paramètres mesurés
Les paramètres retenus pour évaluer le
comportement des graines au court de la germination ont été
apprécies à travers les variables suivantes :
· Le taux de germination des graines
(TG)
Selon Mazliak (1982), c'est le pourcentage de germination
maximale ou le taux maximal obtenu dans les conditions choisies par
l'expérimentateur. Il correspond au nombre de graines germées par
rapport au nombre total de graines ; dans notre étude une graine a
été considérée comme ayant germée lorsqu'il
y'a levée des semis c'est-à-dire lorsqu'il y a apparition des
premières feuilles à la surface du sol. Il a été
exprimé en pourcentage.
* 100
Nombre total de graines semées (N)
TG =
Nombre de graines germées(n)
· La cinétique de germination
La cinétique de germination (CG), renseignant sur
l'évolution des taux cumulés de germination (TCg) des graines
semées en fonction du temps (Hajlaoui et al., 2007), a
été déterminée par la formule suivante :
Nombre de graines nouvellement germées
(ni)
TCg =
* 100
Nombre total de graines semées(N)
· 24
Durée de germination
La durée de germination a été
déterminée comme le temps (en jours) imparti entre les
premières graines germées et la fin de la germination.
· Le délai de germination (DG) ou temps de
latence
Le DG a été déterminé par
l'intervalle de temps qui sépare l'ensemencement et les premières
levées.
III.2.9. Traitement et analyse des données
L'effet du substrat et du prétraitement devrait
être déterminé par une analyse de variance (ANOVA) à
deux facteurs sans répétition au seuil de 5%.
Pour les valeurs quantitatives avant de réaliser
l'ANOVA il faut vérifier la loi de normalité et de
l'homogénéité des variances. Pour cela le test de
normalité utilisé est le test de Shapiro-Wilk au seuil de 5% et
le test de l'homogénéité des variances utilisé est
le test de Levene au seuil de 5%.
25
Tableau 3: Test de Shapiro-Wilk
Donnée : Germination
W = 0,5801 ; P- Valeur< 2,2 e -16
Ce test nous montre que la P-valeur calculée est
largement inférieure à 0,05 (5%) ce qui signifie que les
données ne suivent pas la loi normale.
Tableau 4: Test de Levene
Df F-Valeur Pr (>F)
Groupe 5 1,9621 0,0847
258
Codes de signification : 0'KKK' 0,001'KK' 0,01'K' 0,05'.' 0,1 ` `
1
Ce test nous montre que la P-valeur calculée est
supérieure à 0,05 (5%) ce qui signifie que les variances sont
homogènes.
Les résultats obtenus lors de nos deux tests montrent
que nos données ne suivent pas la loi normale. Les effets du substrat et
du prétraitement des graines de Morinda citrifolia L. ont
été déterminés en appliquant le test de
Scheirer-Ray-Hare au seuil de 5% qui est un ANOVA non paramétrique
à deux facteurs avec l'aide du logiciel RStudio (version 4.0.2), selon
le modèle linéaire généralisé (GLM) suivant
: Y = u + T + S + ?
Avec : Y= symbolise la variable de
réponse ; u = valeur moyenne générale
calculée ; S = est le vecteur des effets du substrat ;
T = est le vecteur des effets du traitement ;?
= est le vecteur de l'erreur résiduelle (la normalité et
l'homogénéité des variances). Les courbes et diagrammes
ont été réalisés à l'aide du logiciel Excel
2010.
26
Chapitre IV: Résultats et discussion
IV.1. Résultats
IV.1.1. Germination des semences
IV.1.1.1. Comparaison du taux de germination (TG) en
fonction du substrat et du prétraitement
La figure 19 présente les résultats du TG des
graines de Morinda citrifolia L. suivant les différents
prétraitements et substrats. Le taux de germination a été
de 50% pour l'ensemble du dispositif. Le pourcentage de germination le plus
élevés a été enregistré avec les graines
semées dans le substrat deux (2) (75% terre humifiée + 25% Sciure
de bois) soit un pourcentage de 68% des graines germées avec un taux de
96% pour le traitement témoin, 89% et 86% pour la scarification et la
macération. Les plus faibles taux de germinations ont été
enregistrés avec le substrat un (1) soit 32% des graines germées
avec des taux respectifs de 34%, 41%, et 51% pour les traitements
témoin, la scarification et la macération. On a aussi
relevé que les graines traitées avec de l'eau chaude n'ont pas
germées dans les deux types de substrat.
|
100%
|
96%
|
|
89%
|
|
|
90%
|
86%
|
|
|
80%
|
|
|
|
|
|
|
|
|
70%
|
|
|
|
|
|
|
|
60%
|
|
|
|
|
|
|
|
51%
|
|
|
|
|
|
|
50%
|
|
|
|
|
|
|
|
|
|
|
|
41%
|
|
|
|
|
40%
|
|
|
|
|
|
|
34%
|
|
|
30%
|
|
|
|
|
|
|
|
|
|
|
20%
|
|
|
|
|
|
|
|
|
|
|
10%
|
|
|
|
|
|
|
|
|
|
|
0% 0%
|
|
|
|
|
|
|
|
|
|
0%
|
|
|
|
|
|
|
|
|
E. Chaude Macération Scarification Temoin
TG S1 TG S2
Taux de germination
Figure 19 : Taux de germination des graines suivant les
différents prétraitements et substrats
27
L'analyse de variances de la germination (Tableau 5) montre
qu'il n'y a pas de différences significatives entre les substrats
(p-valeur = 0,09861), de même pour les traitements utilisés
(P-valeur = 0,86651) et pour l'effet d'interaction substrats x traitements
(P-valeur = 0,60239).
Tableau 5:ANOVA non paramétrique a deux facteurs
selon le test de Scheirer-Ray-Hare
|
Df
|
SCE
|
H
|
P- Valeur
|
|
Substrats
|
1
|
11961
|
2,72793
|
0,09861
|
|
Traitements
|
2
|
1256
|
0,28656
|
0,86651
|
|
Substrats x Traitements
|
2
|
4445
|
1,01371
|
0,60239
|
|
Résiduelles
|
258
|
|
|
|
SCE : Somme des carrés des écarts ; Df :
degré de liberté
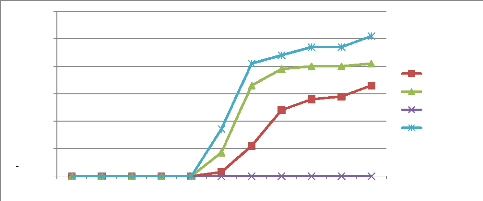
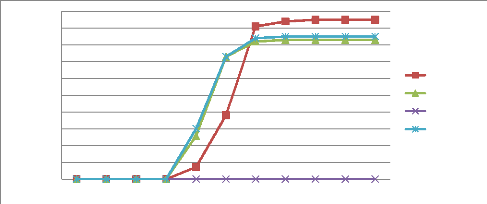
IV.1.1.2. Comparaison des courbes de germination
suivant le substrat et le prétraitement
Les figures 20 et 21 représentent l'évolution de
la germination de Morinda citrifolia L. en fonction du temps pour
l'ensemble des prétraitements. Ces courbes montrent que la
cinétique de germination varie distinctement selon les
prétraitements utilisés et selon le type de substrat. Elles se
présentent sous forme des courbes sigmoïdes avec trois zones bien
distincte. Pour la figure 20 la première phase correspond aux cinq (5)
premières semaines après le semis et se caractérise par
des très faibles taux de germination 3%, 3% et 1% respectivement pour la
macération, la scarification et le témoin. Le début de la
deuxième phase est identique pour la macération et la
scarification, elle correspond à l'intervalle allons de cinq à
sept semaines avec des taux de germination de 41% et 33%, pour le témoin
avec un taux de 28% et un intervalle allons de la cinquième semaine
à la huitième. La troisième phase débute à
la septième et à la huitième semaine selon les
prétraitements, elle est caractérisée par la fin de
germination avec des taux de 51%, 41% et 33% pour la macération, la
scarification et le témoin. Par contre, on observe que la germination
s'est produite dès la quatrième (4) semaine après le semis
pour la figure 21 ce qui correspond à la première phase et avec
les taux cumulés de germination inférieure à 5% pour tous
les prétraitements sauf avec les graines traitées avec de l'eau
chaude. La phase deux intervient entre la quatrième et la
septième semaine avec des taux de 84%, 82% et 91% pour la
macération, la scarification et le témoin. A la onzième
semaine qui correspond à la fin de la phase trois on observe les taux
cumulés de germination les plus élevés. Le traitement des
graines avec de l'eau chaude a enregistré un taux cumulé de
germination de 0% dans les deux figures.
Taux cumulé de germination
40%
60%
50%
30%
20%
10%
0%
1 2 3 4 5 6 7 8 9 10 11
Temoin Scarification E. chaude Macérétion
28
Figure 20: Courbe de la cinétique de germination
du substrat un
Taux cumulé de germination
100%
40%
90%
80%
70%
60%
50%
30%
20%
10%
0%
1 2 3 4 5 6 7 8 9 10 11
Temoin Scarification E. Chaude Macération
Figure 21: Courbe de la cinétique de germination
du substrat deux
IV.1.1.3. Comparaison des délais de germination
suivant le substrat et le prétraitement
Le nombre de jours entre l'ensemencement et les
premières germinations des graines de Morinda citrifolia L.
suivant les prétraitements et les substrats présenté dans
la figure 22 montre que le délai moyen globale de germination est de 34
jours. Le délai le plus court (30 jours) est obtenu avec les graines
scarifiées semées dans le substrat deux (2). Cependant, les
délais les plus longs ont été enregistrés dans le
substrat un (1) soit 38 jours pour les graines témoins et
scarifiées. Pour le substrat un (1), le délai de germination le
plus court a été observé avec la macération soit 35
jours après le semis. Pour le substrat deux (2) les graines
macérées et les graines témoins ont respectivement les
délais de germination de 31 et 32 jours après le semis.
|
51
|
|
|
|
|
|
|
|
41
|
|
38
|
|
|
38
|
|
|
35
|
|
30
|
32
|
31
|
|
|
|
|
31
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
21
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
01-sept-20
|
01-sept-20
|
27-août-20
|
06-sept-20
|
08-sept-20
|
07-sept-20
|
|
23-juil-20
|
23-juil-20
|
22-juil-20
|
06-août-20
|
06-août-20
|
06-août-20
|
|
Scarification (1)
|
Temoin (1)
|
Macération (1)
|
Scarification (2)
|
Temoin (2)
|
Macération (2)
|
Nombre de jours
Figure 22: Diagramme des délais de germination en
fonction du substrat et du prétraitement
IV.1.1.4. Comparaison des durées de germination
suivant le substrat et le prétraitement
Le tableau 6 présente les durées de germination
des graines de Morinda Citrifolia L. suivant les traitements et le
type de substrat. Avec une période d'observation de 35 jours, la
durée moyenne générale de germination était de 27
jours. La durée de germination la plus courte a été
enregistré dans le substrat deux (2) soit 21 jours pour les graines
macérées et la durée de germination la plus longue a
été enregistrée dans le substrat un (1) soit 31 jours pour
le témoin et la scarification. Nous avons aussi relevé que la
durée de germination du traitement « macération » du
substrat un (1), soit 24 jours est presqu'identique avec celle observée
dans le substrat deux (2) pour les prétraitements scarification et
témoin, soit respectivement 23 et 24 jours.
Tableau 6: Durée de germination suivant les
prétraitements et les substrats
Type de substrats
Sable blanc + Terre humifiée Terre humifiée +
Sciure de bois
(Substrat 1) (Substrat 2)
Type de traitements
29
Témoin 31 jours 24 jours
|
Macération 24 jours 21 jours
|
Scarification 31 Jours 23 jours
ND = Non déterminé
30
IV.2.Discussion
IV.2.1. Effet du substrat et du prétraitement sur le
taux de germination
Les résultats de la présente étude ont
révélé un taux global de germination de 50%. Le taux de
germination le plus élevé a été observé dans
le substrat deux avec des taux supérieurs à 50% (96%, 89% et 86%)
et les plus faibles taux dans le substrat un, soit des taux inférieurs
à 50% (51%, 41% et 34%). Cela peut être expliqué par le
fait que le substrat deux (2) a une forte capacité de rétention
d'eau et une bonne porosité comparativement au substrat un (1).
Contrairement aux études de Nelson (2003) sur la germination des graines
de Noni les traitements non pas eu d'influence significative sur la
germination. A ce sujet, plusieurs études similaires ont
été réalisées sur la germination des arbres
forestiers. Elles ont montré que la germination peut être
liée à certaines contraintes et que le taux de germination peut
être fonction du prétraitement et du substrat utilisé
(Batlle et Tous, 1997). Les résultats obtenus lors de notre étude
corroborent partiellement avec plusieurs études réalisées
à des conditions presque similaires. Ces études sur la
germination du Noni ont montrées les taux de germination
inférieure à 50% chez les témoins soit 16%, 21,66% et 25%
(Ponnaiyan et Vezhavendan, 2005 ; Singh et al., 2006a, 2006b) et les taux
supérieurs à 50% dans les autres traitements. Ce qui confirme les
résultats obtenus avec le témoin du substrat un (1) et contredit
celui obtenu avec le substrat deux (2), cette différence peut être
expliquée par le type de substrat et par les conditions
particulières (milieu d'étude et méthodologie) dans les
différents cas. En effet, ces auteurs ont utilisé un
mélange de terre + sol + compost non stérilisé.
L'étude de la germination des graines de Noni réalisée par
Elakkuvan et Manivannan (2010) a montré un taux de germination
supérieur à 50% chez le témoin soit 54% mais dans les
conditions de germination différentes, ce taux avait été
obtenu avec des graines soumises à germination dans des boites à
pétri, ce que soutient l'hypothèse de l'influence du milieu de
germination sur le taux de germination cité par Batlle et Tous (1997).
Les graines traitées à l'eau chaude n'ont pas germé dans
les deux type de substrat, cet résultat peut être expliqué
selon l'hypothèse que les graines ont trop reçu la chaleur ce qui
a conduit à la destruction de l'embryon, car les études
réalisées par Ponnaiyan et Vezhavendan (2005) ; Singh et
al.(2006a) ; Elakkuvan et Manivannan (2010) nous montrent que plus les graines
sont traitées à des températures élevés plus
le taux de germination diminue, selon Elakkuvan et Manivannan (2010) le
traitement des graines de Noni à l'eau chaude et celle traitée
à l'acide sulfurique diminue la capacité germinative des graines
due aux dommages causé à l'embryon.
IV.2.2. Effet du substrat et du prétraitement sur la
cinétique de germination
Les résultats montrent que la cinétique de
germination varie selon les prétraitements et le type de substrat. Elles
se présentent sous forme des courbes sigmoïdes avec trois zones.
L'analyse des deux
31
figures nous montre que la germination ne varie pas trop en
fonction des prétraitements dans chaque figure. La courbe varie
distinctement lorsque nous comparons les deux figures, la figure 23 a
montré les plus faibles taux cumulés de germination que celui de
la figure 24. Cela peut être dû à cause du substrat
utilisé dans chaque figure. On n'a également observé que
les courbes de la figure 24 ont atteint les taux cumulés de germination
constante à la troisième zone des courbes tandis que les courbes
de la figure 24 montrent les taux cumulés croissant dans la
troisième zone des courbes. Ces différences peut être
expliqué sur le fait que les graines semées dans le substrat un
(1) n'ont pas fini de germer car l'étude n'a pas été
mené jusqu'au bout alors que les graines semées dans le substrat
deux (2) ont presque toutes germées avant l'arrêt des
observations.
IV.2.3.Effet du substrat et du prétraitement sur le
délai de germination
Les résultats montrent que les délais de
germination dans tous les cas oscillent autour d'un mois après le semis
soit 30 à 38 jours. Ce temps de latence est dû à la nature
coriace du tégument de la graine qui rallonge dans certains cas le
délai de germination des graines à plus d'un mois, voire
même entre six (6) à un an (1) pour les graines non
traitées (Nelson, 2006). Les résultats de Nelson (2006)
s'opposent aux notre qui n'ont pas montrés de différences entre
les témoins et les autres prétraitements. Nous ne pouvons
expliquer avec exactitude les causes de cette différence entre nos
résultats et celui de Nelson (2006) mais plusieurs hypothèses
peuvent essayer d'expliquer ces différences parmi lesquelles nous
pouvons citer les conditions dans lesquelles les deux expériences ont
été menées, les conditions climatiques et le type de
variété utilisée. Les études de la germination de
Morinda citrifolia L. réalisées par Ponnaiyan et
Vezhavendan (2005), Singh et al. (2006a, 2006b) viennent corroborer la
nôtre sur le délai de germination d'environ un mois dans plusieurs
types de traitement même le témoin. Ce temps de latence d'environ
un mois peut être expliqué par le fait que ce délai
correspond au temps moyen qu'il faut aux graines de Noni pour percée le
tégument.
IV.2.4. Effet du prétraitement et du substrat sur la
durée de germination
La durée de germination des graines de Morinda
citrifolia L. trouvée au cours de cette étude est meilleure
lorsque les graines sont semées dans le substrat deux (2). En effet,
pour la majorité des prétraitements, les graines semées
dans le substrat un (1) ont une durée de germination plus longue que
celles semées dans le substrat deux (2). Le substrat deux (2) favorise
donc une meilleure germination des graines que le substrat un (1) d'une part et
que certaines graines sont toujours inactives mais vivantes d'autre part,
d'où ces statistiques peuvent toutefois changer on fonction des graines
qui vont germées après le temps imparti à
l'expérimentation. Car, selon plusieurs auteurs les graines de
Morinda citrifolia L. peuvent avoir une durée de vie
supérieure à un an dans des conditions de germination (Nicolas,
2004 ; Nelson, 2006).
32
Conclusion et perspectives
Cette étude a porté sur l'effet du substrat et
du prétraitement sur la germination des graines de Morinda
citrifolia L. (Noni). Les objectifs spécifiques étaient de
déterminer les effets du substrat et du prétraitement sur la
germination des graines. Ces effets ont été
appréciés en considérant les paramètres de
germination suivant : le taux, la cinétique, le délai et la
durée de germination. Il ressort du test de Scheirer-Ray-Hare que les
substrats et les prétraitements utilisés n'ont pas eu d'effet
significatif sur le taux de germination des graines de Morinda citrifolia
L. (Noni). La comparaison des taux de germination en fonction du substrat
a montré un meilleur taux de germination pour le substrat deux (2) soit
68% et un taux plus faible soit 32% pour le substrat un (1). La même
tendance a été observée pour la cinétique de
germination qui a révélé le meilleur taux cumulé de
germination avec le substrat deux (2) soit 95% et 51% pour le substrat un (1).
Contrairement au taux et à la cinétique de germination,
l'observation de la durée et du délai de germination ne
présente pas des différences ; pour la durée de
germination, le substrat deux (2) a révélé les
durées de germination moyennement proche avec des taux de germination
plus important que celui enregistré dans le substrat un (1) soit 23 et
29 jours. Avec un délai de gémination moyen comprise entre 30 et
38 jours ce paramètre ne présente pas de différence. Sur
la base de cette étude nous pouvons conseiller le substrat deux (2)
comme un substrat approprié pour obtenir de meilleurs résultats
en ce qui concerne la germination des graines de Noni. Nous pouvons
également déconseiller l'utilisation du traitement des graines
avec de l'eau chaude à des fortes températures pour éviter
la destruction de l'embryon.
Afin de compléter ce travail, il serait
intéressant de refaire cet essai de germination en diversifiant les
types de prétraitements et substrats, et en augmentant les
paramètres à observer sur un dispositif en blocs
complètement randomisés afin de bien apprécier les effets
du substrat et du prétraitement sur la germination des graines du Noni.
Il serait également intéressant de poursuivre les travaux
jusqu'au stade croissance initiale et même au stade plein champ, pour
déterminer si oui ou non le substrat et/ou le prétraitement ont
une influence sur la croissance des plants.
33
Références bibliographiques
Agence Nationale de l'Aviation Civile., 2020.
Fiche de température et précipitation moyenne de la
période allant de 2009 à 2019. Direction de la
météorologie, station de Maya-Maya (Brazzaville). Anzala
F.J., 2006. Contrôle de la vitesse de germination chez le
maïs (Zea mays) : étude de la voie de biosynthèse
des acides aminés issus de l'aspartate et recherche de QTLs Thèse
de Doctorat. Université d'Angers, Angers, 148p.
Ammari S., 2011. Contribution à
l'étude de germination des graines des plantes sahariennes
broutées par dromadaire, Mémoire d'ingéniorat en
écologie, Faculté Sciences de la Nature et de la Vie et Science
de la Terre et de l'Univers, Université de Tlemcen, Algérie
46p.
Bacchetta G., Bellettip P., Brullo S., Cagegllil R.,
Carasso V., Casas J. L. et Venora G., 2006. Manuel pour la
récolte l'étude, la conservation et la gestion ex situ du
matériel végétal. Rome. Italie :Bacchetta G., Sanchez
B.,A.,Jimez -Alfaro B.F.G.,Mattana E.,Piotto B.,et vire-varie M., 217p.
Baskin C.C. et Baskin J.M., 1998. Seeds: ecology,
biogeography, and evolutions of dormancy and germination.
(2èmeEd)Academic .Press, San diego, CA. 666
p.
Batlle I. and Tous J., 1997. Carob tree
ceratonia siliqua L. Promoting the conservation and use of
underutilized and neglected crops. 17. Institute of Plant Genetic and Crops
Plant Research. Gatersleben/International Plant Resources Institute. Rome.
Italy, 123p.
Betti J.L., 2002. Usages traditionnels des
plantes médicinales et traitement des maux de dos dans la réserve
de biosphère du Dja/Cameroun. In history of health and diseases: Living
and curing old age in the world/Old age in the world, Gueri A &
Consiglière S (ed). Genoa/Italy, p117-154.
Bewley J.D., 1997. Seed germination and
dormancy. Plant cell 9.p1055-1066.
Bouacherine R. et Benrabia H., 2017.
Biodiversité et valeur des plantes médicinales dans la
phytothérapie: Cas de la région de Ben Srour (M'sila),
Mémoire Master en Biologie, Faculté des sciences,
Université Mohamed BOUDIAF - M'SILA, Algérie, 95p.
Cambie R.C. et Ash J., 1994. Fijian Medicinal
Plants.Csiro, Australia, 45p.
Chaussat R., et Ledeunff Y., 1975. La
germination des semences. Ed. Bordars, Paris, 232p.
Codou A., 1976. Géographie: la
République populaire du Congo, Hatier, Collection
André-journaux.79p.
Dardour M., Daroui E. A., Boukroute A., Kouddane N. E.
et Berrichi A., 2014. Etude de prétraitements des graines de
Brachychiton populneus (Schott & Endl.) R. Br. et B.
acerifolius F. Muell. en faveur de la germination, J. Mater. Environ. Sci,
5(6), p1877-1884.
34
Dibong S. D., Mpondo M. E., Ngoye A., Kwin M. F. Et
Betti J. L., 2011. Ethnobotanique et
phytomédecine des plantes médicinales de Douala, Cameroun.
Journal of Applied Biosciences, 37 p2496 - 2507.
Dixon A.R., Mc Millen H., and Etkin N.L., 1999.
Ferment this: The transformation of noni, a traditional Polynesian
medicine (Morinda citrifolia, Rubiaceae). Economic Botany, 53(1).
p51-68. Finkelstein R., Reeves W., Ariizumi T.,
and Steber C., 2008. Molecular aspects of seed
dormancy. Annual review of plant Biology. 59 p387-415.
Elakkuvan S. and Manivannan K., 2010. An
improvised method for breaking the dormancy of noni seeds [Morinda
citrifolia var. Citrifolia (L.)], Plant Archives,10(2).
P875-880
Garnier C., 1997. Note technique n°11 du
département de la Recherche Agronomique Appliquée.,
consultéle 20 Août 2020
http://www.agriculture.gov.pf/UserFiles/La%20culture%noni(1)
Hajlaoui H., Denden M. et Bouslama M., 2007.
Etude de la variabilité intraspécifique de
tolérance au stress salin du pois chiche (Cicer arietinum L.)
au stade germination, Tropicultura, 25(3), p168-173. Harrington J. F.,
1962. The effect of temperature on the germination of several kinds of
vegetable seeds, XVI.th.Hort. Congrees. Bruxelle, Belgique,2, p435-441.
Heler R., Esnault R., et Lance C., 2000.
Physiologie végétale et développement, Ed. Dunod,
Paris. 366p.
Hénaff M., 2009. Le Noni (Morinda
citrifolia) de la tradition au marché de la santé : Usages
et analyse phytochimique d'une panacée tahitienne. Thèse en
pharmacie, faculté en pharmacie, Université de Nantes, Nantes,
France, 174p.
Mabika K., 1993. Plantes médicinales
et médecine traditionnelle au Kasaï-Occidental. Thèse
inédite, Faculté des Sciences, UNIKIS, République
Démocratique du Congo. 510 p.
Malik A.R., Wani S. H. et Dar B.N., 2009.
NONI (Morinda citrifolia L.) -A hope in a bottle, New
Biology: Current Developments/Frontiers in Life Sciences, p338-353.
Mazliak P., 1982. Croissance et
développement. Physiologie végétale. Tome2.Harmann, Paris.
465 p. Mbaye N., Diop A.T., Guèye M., Diallo A.T., Sall C.E. et
Samb P.I., 2002. Etude du comportement germinatif et essais de
levée de l'inhibition tégumentaire des graines de Zornia
glochidiata Reichb. ex DC., légumineuse fourragère.
RESSOURCES ALIMENTAIRES. Revue Elev. ed. vet. Pays trop. 55 (1), p47-52
Meyer S., Reeb C., et Bosdeveix R.,
2004. Botanique, biologie et physiologie végétale.Ed.
Moline, Paris, 461p.
Moukolo N., 1992. Etat des connaissances
actuelles sur l'hydrographie du Congo Brazzaville, Hydrologie, 1, p41-58.
35
Nelson S.C., 2003. Noni cultivation and
production in Hawaii. Proceedings of the 2002 Hawaii Noni Conference, S.C.
Nelson (ed.), Univrsity of Hawaii at Manoa, College of Tropical Agriculture and
Human Resources, p33-50.
Nelson S. C., 2005. Noni seed handling and
seedling production. Fruits and nuts, 10, p1-4.
Nicolas T., 2004. Morinda citrifolia
L.: The noni gold rush, These en pharmacie, Université Joseph
Fourier, Faculté de Pharmacie de Grenoble, Grenoble, France, 113p.
Nzila J.D., 1993. La qualité des eaux
et les maladies d'origine hydrique au Congo. Mémoire D.U. Environnement
et Santé publique, Université de Montpellier I, Montpellier,
France. 33p.
Ollier C., 2006. Le noni aux risques de
l'analyse phytothérapie, 4(1), p31-42
Ponnaiyan P. et Vezhavendan S., 2005. The
effect of growth regulators and its combination with nicking on the germination
of Indian Mulberry (Morinda citrifolia L.), International Journal of
Noni Research, 1(1), p23-26.
Pawlus A.D. and Kinghorn A.D., 2007. Review
of the ethnobotany, chemistry, biological activity and safety of the botanical
diertary supplement Morinda citrifolia (noni). Journal of pharmacy and
pharmacology, 59(1) p1587-1609
Samba-Kimbata M.J., 1978. Le climat du bas
Congo. Thèse de Doctorat 3eme cycle, Université de Bourgogne,
Dijon, 260p.
Singh D.R., Medbi R.P., Manju S. D'souza A., 2006a.
Morphological and compositional studies of Morinda citrifolia
grown in Andaman and Nicobar Islands, International Journal of Noni
Research, 1(2), p14-17.
Singh D.R., Medbi R.P., Manju S. D'souza A., 2006b.
Seed germination studies Morinda citrifolia, International
Journal of Noni Research, 1(2), p23-28.
Soltner D., 2007. Les bases de la production
végétale, Tome III, la plante. Ed. Collection sciences et
techniques agricoles.Paris, 304p.
Vennetier P., 1977. Atlas de le
République du Congo. Ed. Jeune Afrique, Paris 67p.



