|
Année académique 2021-2023

|
UNIVERSITE DE KAMINA
B.P. 279
FACULTE DE MEDECINE
|
|
DEPARTEMENT DE PEDIATRIE

Profil épidémio clinique et prise en
charge de l'ictère néonatal à Lubumbashi : « CAS DE
l'HGPR/JASON SENDWE »
SEMBILE MONGA ELITE
Mémoire présenté et défendu en vue
d'obtention du grade de Docteur en Médecine.
II


UNIVERSITE DE KAMINA
B.P. 279
FACULTE DE MEDECINE
DEPARTEMENT DE PEDIATRIE

Année académique 2021-2023
Profil épidémio clinique et prise en charge
de l'ictère
néonatal à Lubumbashi : « CAS
DE
L'HGPR/JASON SENDWE » De janvier 2020 à décembre
2022
SEMBILE MONGA ELITE
Mémoire présenté et défendu en vue
d'obtention du grade de Docteur en Médecine.
Directeur : CT Dr ILUNGA MAKINKO PAUL

EPIGRAPHE
« Devant un ictère cholestatique, la
hantise est de méconnaitre une atrésie des voies biliaires qui
doit être opérée avant la 6ème semaine de
vie »
Marc Bellaïche
SEMBILE MONGA ELITE
II
DEDICACE
A mon père MONGA KALENDA Vaneer et à ma
mère MULOMBA WA DJIBU Mimie, ce travail est sans doute le fruit de tous
les sacrifices que vous avez faits en ma faveur. Autant de phrases et
d'expressions aussi éloquentes soit-elles ne sauraient exprimer ma
gratitude et ma reconnaissance envers vous qui êtes les deux personnes
les plus chères à mon coeur. Vous avez su m'inculquer le sens de
la responsabilité, de l'optimisme et de la confiance en soi face aux
difficultés de la vie. Vos conseils ont toujours guidé mes pas
vers la réussite. Votre patience sans fin, compréhension et
encouragement sont pour moi le soutien indispensable que vous avez toujours su
m'apporter. Je vous dois ce que je suis aujourd'hui et ce que je serai demain
et je ferai toujours de mon mieux pour rester votre fierté et ne jamais
vous décevoir. Que Jéhovah le tout puissant vous préserve,
vous accorde la santé, le bonheur, la quiétude de l'esprit ainsi
qu'une longue vie.
SEMBILE MONGA ELITE
III
AVANT - PROPOS
De prime à bord, nous disons merci au grand Dieu
créateur de l'univers et de la terre, JEHOVAH ! Lui que je louerai, Qui
m'accorde la sagesse et l'intelligence.
Nos remerciements s'adressent aux autorités de
l'université de Kamina et particulièrement à celles de la
faculté de médecine pour nous avoir transmis diverses
connaissances médicales.
Nos remerciements s'en vont également :
Au chef de travaux Docteur MAKINKO pour avoir accepté
la direction de ce travail en dépit de la multitude d'occupations.
A mes frères et soeurs : ASTRID KAZADI, VALENTIN DJIBU,
VANESSA, CELESTIN, VERO, trouvez ici l'expression de mon affection.
Nos vifs remerciements aux amis et collègues qui,
longtemps, sont restés à côté de nous, partageant
ensemble les moments de peine et de joie : LOTANGA PASCAL, DELLORD NKONGOLO,
GALILEE OMARI...
A tous ceux qui, de loin ou de près dont leurs noms ne
figurent pas ci-haut, se sentent aussi remerciés.
IV
LISTE DES ABREVIATIONS
HGPR : Hôpital général provincial de
référence
O MS : Organisation mondiale de la santé
CHU : Centre hospitalier universitaire
RDC : République Démocratique du Congo
GR : Globule rouge
Hb : Hémoglobine
GS : Groupe sanguin
Rh : Rhésus
Ac : Anti corps
CRP : C-Réactive protéine
PT : Photothérapie
EST : Exsanguino transfusion
BT : Bilirubine totale
BD : Bilirubine directe
BI : Bilirubine indirecte
CPN : Consultation prénatale
Kg : Kilogramme
g : Gramme
Jr : Jour
ml : Millilitre
% : pourcentage
Etc. : Etcetera
= : supérieur ou égal
= : inférieur ou égal
< : inférieur
> : supérieur
= : égal
V
LISTE DES TABLEAUX ET FIGURES
Tableau I : Répartition des cas selon les
années
Tableau II : Répartition des cas selon la
période d'apparition de l'ictère
Tableau III : Répartition des cas selon la
maturité du nouveau-né
Tableau IV : Répartition des cas en fonction des
antécédents d'infections génito-urinaires
chez les mères
Tableau V : Répartition des cas selon le mode
d'accouchement
Tableau VI : Répartition des cas selon le poids de
naissance
Tableau VII : répartition des cas selon le mode
d'alimentation
Tableau VIII : Répartition des cas selon les signes
cliniques associés
Tableau IX : Répartition des cas selon les groupes
sanguins des mères
Tableau X : Répartition des cas selon les groupes
sanguins des nouveau-nés
Tableau XI : Répartition des cas selon les
Rhésus des mères
Tableau XII : Répartition des cas selon les
Rhésus des nouveau-nés
Tableau XIII : Répartition des cas selon le type
d'ictère
Tableau XIV : Répartition des cas selon la prise en
charge
Tableau XV : Répartition des cas selon
l'évolution
Tableau XVI : Répartition des cas selon le
séjour à l'hôpital
Figure 1. DIAGRAMME RECAPITULATIF DEGRADATION DES GLOBULES
ROUGES
Figure 2. Appareil de photothérapie intensive
Figure 3. Appareil de photothérapie Conventionnelle
Figures 4 et 5. Courbes d'indication de la
photothérapie et exanguino-transfusion
Figure 6. Organigramme de l'hôpital
général JASON SENDWE
Figure 7. Fréquence de l'ictère
néonatal
Figure 8. Répartition des cas selon le sexe
Figure 9. Répartition des cas selon la provenance
Figure 10. Répartition des cas selon le suivi des
CPN
Mots clés : profil,
épidémiologie, clinique, prise en charge, ictère,
néonatal.
VI
RESUME Introduction
L'ictère est de loin le plus fréquent des
symptômes observés à la période néonatale,
puisque la littérature médicale le rapporte chez environ deux
tiers des nouveau-nés. La présente étude visait à
déterminer le profil épidémiologique, clinique et
thérapeutique intra hospitalier de l'ictère néonatal.
Méthode
Ainsi, pour atteindre les objectifs que nous nous sommes
fixés, nous avons recouru à la méthode descriptive
transversale rétrospective appuyée par la technique d'analyse
documentaire pour collecter les données.
Résultats
La prévalence de l'ictère néonatal est de
18,1%. Nous avons constaté une prédominance pour le sexe masculin
avec 57,8% et un sexratio de 1,36 en faveur des garçons. La commune de
Kampemba était la plus représentée avec 23,90%, La
majorité des nouveau-nés icteriques, soit 60,6% étaient
issus des grossesses non suivies. Les prématurés ont
représenté 30,3% des nouveau-nés atteints par
l'ictère. L'ictère néonatal était plus d'apparition
tardive (> 48h) que précoce. L'allaitement au lait maternel
était prédominant. 35.16% des cas étaient associés
à la fièvre ; et 22,6% à la pâleur. Nous avons
remarqué qu'au cours de notre étude, la majorité des
mères et des nouveau-nés étaient du groupe sanguin O et du
rhésus Positif. Le rhésus négatif n'a atteint que 3,6%
chez les mères. L'ictère à bilirubine indirecte
était représenté dans 41,90 % des cas.
L'antibiothérapie a été utilisée chez tous les
nouveau-nés tandis que la photothérapie a été
réalisée dans 30.88% des cas. L'évolution était
favorable dans 71.25% des cas.
Conclusion
Les résultats trouvés nous conduisent à
conclure que l'ictère néonatal est une pathologie non
négligeable nécessitant un diagnostic étiologique
précoce et une prise en charge adéquate afin de prévenir
les éventuelles complications.
De par le risque de survenue de l'ictère
nucléaire, l'ictère néonatal demeure une
préoccupation la plus fréquente en néonatologie. La
fréquence de cette complication
1
INTRODUCTION
L'ictère néonatal est une pathologie
caractérisée par une coloration jaunâtre des
téguments et des muqueuses consécutives à un excès
de bilirubine dans le sang. Il est visible à partir d'un taux de 70
umol/L de bilirubine (Marc Bellaïche, 2017).
L'ictère peut-être soit à bilirubine libre
(ou non conjuguée) soit à bilirubine conjuguée. La
bilirubine libre est aussi appelée bilirubine indirecte, elle est
liposoluble. La bilirubine conjuguée est hydrosoluble et connue sous le
terme de bilirubine directe. Les ictères à bilirubine libre sont
de loin les plus fréquents en période néonatale en raison
du métabolisme particulier de la bilirubine à cet âge, et
ont un risque de neurotoxicité par la liposolubilité de la
bilirubine libre qui traverse facilement les noyaux gis centraux (Bourillon A.
Pédiatrie, 2003).
Les nouveau-nés présentent très souvent
une hyper bilirubinémie se manifestant par un ictère (coloration
jaune des téguments et des muqueuses), un phénomène
fréquent puisqu'il concerne 60 à 80% des nouveau-nés mais
le plus souvent transitoire. L'absence des complications et l'évolution
spontanément favorable dans la majorité des cas peuvent conduire
à sa négligence. (CORTEY A, 2013)
C'est pourquoi, bien que physiologique, l'ictère
néonatal ne doit pas pour autant être négligé. Il
mérite une attention particulière car il peut relever des
étiologies variées des significations différentes au point
de devenir pathologique, exposant ainsi l'enfant à des complications
neurologiques ou être témoin d'une affection grave dont la
rapidité du diagnostic et de prise en charge conditionne la chance de
succès. (HASSNA Tairan, 2009)
L'ictère est de loin le plus fréquent des
pathologies observées à la période néonatale,
puisque la littérature médicale le rapporte chez environ deux
tiers des nouveau-nés. L'ictère à bilirubine libre
concerne 60% des nouveau-nés à terme et 90% des
prématurés (obladen, 2008).
Le diagnostic clinique de l'ictère est habituellement
facile mais il ne permet pas toujours de juger de son intensité, en
raison d'une sous-estimation fréquente. L'anamnèse reste
fondamentale et doit rechercher des situations à risque ; telles que des
incompatibilités sanguines foeto-maternelles, l'existence d'un contexte
évocateur d'une infection foeto-maternelle, la
prématurité, les antécédents familiaux
d'hémolyse, de traumatisme obstétrical, et l'utilisation de
médicaments. L'appréciation de la gravité doit être
faite aussi sur le plan biologique par la mesure de la concentration de
bilirubine.
Il s'agit d'une manifestation banale au cours de la
première semaine de vie, mais qui peut toutefois atteindre dans certains
cas une intensité telle qu'elle fait courir le risque de l'ictère
nucléaire, une complication de haute gravité, due à la
toxicité de la bilirubine pour le système nerveux. Il ne se
manifeste pas chez les nouveau-nés à terme dont la concentration
de Bilirubine sanguine totale demeure inférieur à 34 umol/L, et
il est très rare si cette concentration ne dépasse pas 42 umol/L.
Au-dessus de ce taux, le risque de toxicité augmente progressivement
(Arieh R, 2008).
2
redoutable au niveau mondial est très variable entre
18,1% en Egypte et 1% en Chine (Gamaleldin R, 2011 ; weiy k, 2012). Quelques
rares études existantes ont rapporté une fréquence
intra-hospitalière de 3,7% au Madagascar (Rabesanndratan N, 2011).
En Grande-Bretagne une incidence de 7,1/100 000 cas
d'hyperbilirubinémie libre supérieure à 300 mg/l est
rapportée. Au Danemark un taux de 45/100 000 est retrouvé pour
les nouveaunés (NNE) présentant un taux de bilirubine totale
supérieure à 260 mg/l. Dans ces deux études, le taux
d'ictère nucléaire est proche de 1/100 000 NN ; le même
chiffre a été recensé aux USA (1/100 000 naissances).
(Manning D, 2007 ; Djere JV, 2008)
En France, la fréquence de l'ictère
néonatal est estimée à 60% chez les nouveau-nés
à terme (90% chez le prématuré). Environs 6-10% des
nouveau-nés à terme ont une bilirubinémie > 130 mg/l,
Il constitue 2% à 8% de la fréquentation des services d'urgences
pédiatriques en France (Claude I, 2012)
Au Maroc, elle est estimée à 8.8 % des
hospitalisations pendant 2 ans entre 2002 et 2003 dans le CHU HASSAN II de
Fès et à 25,2 % des hospitalisations au CHU Mohammed VI de
Marrakech entre 2005 et 2006. (Elbaqqali L,2004).
En République Démocratique du Congo (RDC),
Kabamba A. et al rapportent une incidence de 24 cas d'ictères par an,
nettement le double de celle de 12 cas annuels observés par Tady et al
aux cliniques universitaires de Kinshasa (Kabamba MA, 2014 ; Tady MB, 1973).
A Lubumbashi, une étude menée en 2017 avait
révélé une fréquence de l'ictère
néonatale qui s'élevait à 23% au sein de l'hôpital
général provincial de référence Jason sendwe
(Diangienda M, 2017).
A l'heure actuelle, l'ictère néonatal demeure
une pathologie dont la fréquence dans la population est évidente.
Il s'avère à cet effet qu'une attention particulière y
soit accordée enfin d'avoir des éclaircissements précis
sur ladite pathologie. C'est dans cette perspective que nous nous posons les
questions suivantes :
+ Quelle est la fréquence de l'ictère
néonatal à Lubumbashi ?
+ Quelle est la catégorie néonatale la plus
touchée par l'ictère ?
+ Quelle est le type d'ictère néonatal le plus
fréquent ?
+ Quelle est la prise en charge appliquée ?
Voilà les questions auxquelles nous avons hâte de
trouver des réponses adéquates par
de procédures scientifiques.
OBJECTIF GENARAL
La présente étude vise à
déterminer le profil épidémiologique, clinique et
thérapeutique intra hospitalier de l'ictère néonatal.
Pour l'atteinte de l'objectif général, les
objectifs spécifiques ont été définis :
+ Déterminer la fréquence de l'ictère
néonatal à l'HGPR SENDWE,
+ Identifier la catégorie de nouveau-nés la plus
touchée par l'ictère néonatal + Déterminer le
devenir immédiat des nouveau-nés ictériques.
+ Identifier la prise en charge de l'ictère
néonatal à l'HGPR SENDWE.
3
METHODES ET TECHNIQUES
Ainsi, pour atteindre les objectifs que nous nous sommes
fixés, nous avons recouru à la méthode descriptive
transversale rétrospective appuyée par la technique d'analyse
documentaire pour collecter les données.
CHOIX ET INTERET DU SUJET
Le choix et l'intérêt du présent sujet sont
relatifs à l'incidence la plus élevée des cas
d'ictères néonataux dans notre milieu, ainsi que peu
d'étude qui sont menées jusqu'à présent sur ladite
pathologie.
DELIMITATION SPATIO TEMPORELLE
Nous avons mené nos recherches à l'hôpital
général provincial de référence Jason sendwe sur un
sujet qui s'intitule : « profil épidémiologique, clinique,
et prise en charge de l'ictère néonatal à Lubumbashi
». Cas de l'HGPR JASON SENDWE, de janvier 2020 à décembre
2022.
SUBDIVISION DU TRAVAIL
Hormis l'introduction et la conclusion, le présent
travail renferme en son sein deux grandes parties : la première est
consacrée au cadre théorique, elle traite sur les
généralités ainsi que les notions théoriques sur
l'ictère néonatal. La deuxième consistera en des
considérations pratiques ; elle traite de la présentation du
milieu de recherche, des matériels et méthodes, de la
présentation des données et enfin la discussion des
résultats.
4
PREMIERE PARTIE : LES CONSIDERATIONS THEORIQUES CHAPITRE
I : DEFINITION DES CONCEPTS
1.1.Profil : c'est l'aspect ou la représentation
d'une chose.
1.2.Epidémiologie : c'est l'étude
de la fréquence et la distribution des cas d'une maladie dans une
population (OMS, 2009)
1.3.Clinique : la Clinique représente
l'ensemble de méthodes de diagnostic par l'observation directe et sans
l'aide des moyens de laboratoire, du malade alité (Duhamel, 1963)
1.4.Prise en charge : c'est l'action de
prodiguer des soins à une personne présentant une pathologie.
(OMS, 2009)
1.5.Ictère:
L'ictère est une pathologie caractérisée par
une coloration jaunâtre des téguments et des muqueuses
consécutive à un excès de bilirubine dans le sang. Il est
visible à partir d'un taux de 70 umol/L de bilirubine (Marc
Bellaïche, 2017).
1.6.Néonatal : c'est ce qui est relatif
au nouveau-né. Le nouveau-né est compris dans une période
allant de 0 à 28 jours (Bourillon A. Pédiatrie, 2003).
5
CHAPITRE II : ICTERE NEONATALE
2.1.DEFINITION
L'ictère néonatal est une pathologie
caractérisée par une coloration jaunâtre des
téguments et des muqueuses consécutive à un excès
de bilirubine dans le sang. Il est visible à partir d'un taux de 70
umol/L de bilirubine (Marc Bellaïche, 2017).
2.2.EPIDEMIOLOGIE
En France l'incidence n'est pas connue
précisément, elle est estimée à 60% chez les
nouveau-nés à terme (90% chez le prématuré).
Environs 6-10% des nouveau-nés à terme ont une
bilirubinémie > 220 ìmol/l. Au Royaume Uni, en 2001,
l'incidence est de 5,5/1000 naissances d'ictère sévère
(Bilirubinémie supérieure à 350ìmol/l).174 cas
d'ictères nucléaires ont été recensés aux
USA (1/100 000 naissances) et le même chiffre d'incidence est
avancé en Europe. L'incidence des choléstases néonatales
est estimée à 1/2500 naissances. En République
Démocratique du Congo (RDC), Kabamba A. et al rapportent une incidence
de 24 cas d'ictères par an, nettement le double de celle de 12 cas
annuels observés par Tady et al aux cliniques universitaires de Kinshasa
(Kabamba MA, 2014 ; Tady MB, 1973).
2.3.RAPPEL PHYSIOLOGIQUE ET METABOLIQUE DE L'HEMOLYSE
NORMAL, DE LA SYNTHESE ET DE L'ELIMINATION DE LA BILURIBINE
L'hémolyse est une destruction des globules rouges (GR)
arrivés au terme de leur vie circulatoire de 120 jours, associée
à la libération puis au catabolisme de l'hémoglobine ;
c'est un phénomène irréversible du au vieillissement des
GR qui subissent une mort physiologique par sénescence (Hamouda.H,
2020).
2.3.1. MECANISME DE L'HEMOLYSE PHYSIOLOGIQUE
(Hamouda.H, 2020).
Le GR est une cellule anucléée qui nait avec un
équipement enzymatique non renouvelable dont l'intégrité
de sa structure lui permet d'assurer sa fonction et de baigner dans un
environnement plasmatique favorable.
L'hémolyse est liée au vieillissement du GR et
cette sénescence est marquée par la diminution de
l'équipement enzymatique due à l'absence de renouvellement qui a
pour conséquence la diminution de la protection de la membrane et l'Hb
contre l'oxydation irréversible et la présence d'Hb oxydée
(corps de Heinz) qui faciliterait leur phagocytose par les macrophages de la
rate.
6
Plusieurs hypothèses sont proposées pour
expliquer la fin de vie des GR :
+ Modification des flux ioniques, avec augmentation du Ca++ et
diminution du potassium intracellulaire, induisant une déshydratation et
une diminution de la déformabilité
+ Diminution de la charge négative de la membrane, par
perte progressive d'acide sialique sur la partie externe des
glycoprotéines membranaires, facilitant la phagocytose par les
macrophages.
+ Hypothèse immunologique : Présence de faibles
quantités d'Ac anti protéine et anti glycolipides, se fixant
préférentiellement sur les GR âgés, facilitant leur
phagocytose par les macrophages.
Les hématies âgées subissent des
modifications importantes :
+ Le changement de forme : sphération : + La
déformabilité est moindre,
+ La densité augmente,
+ La fragilité s'accroît,
+ La sensibilité aux oxydants augmente, + L'utilisation du
glucose est moindre, + La méthémoglobine augmente.
2.3.2. SIEGE DE L'HEMOLYSE :
En fonction du siège, on distingue L'hémolyse
intra-tissulaire et L'hémolyse intravasculaire.
2.3.2.1.L'hémolyse
intra-tissulaire:(85%)
Les globules rouges âgés, après une
durée de vie normale de 120 jours, sont séquestrés dans le
système réticuloendothéliale puis phagocytés par
les macrophages du système des phagocytes mononuclés.
Chez le sujet normal, la majorité des globules rouges
sont détruits dans les macrophages de la moelle osseuse (minimum 50%).
Le reste de l'hémolyse se répartit dans l'organisme, en
particulier dans la rate et le foie.
7
2.3.2.2.L'hémolyse infra-vasculaire
Représente environ 15% de l'hémolyse
physiologique, par lyse osmotique des GR vieillis ou fragmentation (diminution
de déformabilité) dans les capillaires de taille
réduite.
2.3.3. CONSEQUENCES D'HEMOLYSE (Hamouda.H,
2020).
? Au niveau du macrophage :
L'hémoglobine va être catabolisée : La partie
globinique est hydrolysée en acides aminés qui rejoignent le pool
métabolique général. La partie héminique est
dégradée par une hème-oxygénase, présente
dans les macrophages, qui ouvrent le cycle tétrapyrolique qui
libère :
? Le fer : Les 2/3 du fer passe dans la circulation où
il est repris par la transferrine, le 1/3 restant demeure dans les macrophages
sous forme de ferritine et d'hémosidérine.
? La biliverdine est réduite en bilirubine. La
bilirubine est libérée dans le plasma ; elle est insoluble dans
l'eau, et se lie à l'albumine qui la transporte aux hépatocytes,
elle est dite bilirubine non conjuguée ou indirecte ou libre.
? Au niveau des hépatocytes :
La bilirubine non conjuguée se dégage de
l'albumine et se lie à la ligandine (Y et Z), qui par diffusion
facilitée, atteint le pôle apical de l'hépatocyte. La BNC
subit en suite une glucurono-conjugaison nécessitant la
glycuronyltransférase pour donner la bilirubine conjuguée ou
bilirubine Directe qui est hydrosoluble.
La bilirubine hydro soluble est excrétée dans
les canaux biliaires, elle sera transformée par les bactéries
intestinales en urobilinogène et stercobilinogène qui s'oxydent
en urobiline et stercobiline. La plus grande partie est éliminée
dans les selles. Une petite quantité d'urobiline est
réabsorbée par l'intestin et passe dans les urines et est
transportée vers le rein où elle est éliminée par
les urines qu'elle colore.

8
Figure 1. DIAGRAMME RECAPITULATIF DEGRADATION DES
GLOBULES ROUGES (Hamouda.H, 2020).
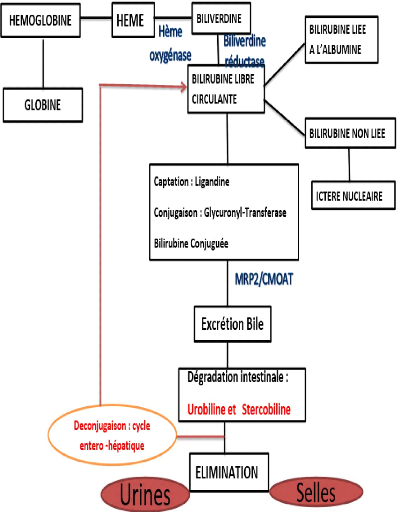
9
2.4.ETIOPATHOGENIE DE L'ICTERE NEONATALE
2.4.1. ICTERE A BILURIBINE LIBRE
Les ictères à bilirubine libre sont
causés par : une hyper production de la bilirubine par hémolyse,
un défaut de transport plasmatique de la bilirubine indirecte, une
anomalie de captation hépatique de la bilirubine indirecte, et une
conjugaison inadéquate.
2.4.1.1.Hyper production de la bilirubine par
hémolyse
Cette hyperproduction émane de plusieurs pathologies entre
autre :
? Une incompatibilité foeto-maternelle
(Bourillon A. Pédiatrie, 2003).
Dans le système ABO L'hémolyse ne débute
habituellement pas en période anténatale. Elle ne se distingue
pas, généralement, de l'ictère simple dans son aspect
clinique, mais une anémie hémolytique est habituellement
associée à l'ictère. Elle survient chez un enfant de
groupe A, ou plus rarement B, né d'une femme de groupe O,
éventuellement dès la première grossesse. Sa
gravité est modérée mais variable. Le test de Coombs est
négatif ou légèrement positif. La présence d'une
incompatibilité dans le système ABO ne peut être
affirmée que par la mise en évidence d'hémolysines
irrégulières anti-A ou anti-B - de type IgG - dans le sang
maternel. Elle peut entraîner ultérieurement une anémie
prolongée. II n'y a pas de prophylaxie pour ce type
d'incompatibilité.
Dans les systèmes sanguins autres qu'ABO Elles sont
facilement affirmées par la positivité du test de Coombs direct
chez le nouveau-né. Historiquement, la première étiologie
est l'incompatibilité Rhésus anti-D. Cette situation
d'incompatibilité était généralement
démasquée à partir de la deuxième grossesse
seulement, chez des nouveau-nés Rhésus positif nés de
mères Rhésus négatif et de pères Rhésus
positif (homozygotes ou hétérozygotes). La prévention
efficace de cette pathologie par l'administration d'immunoglobulines
spécifiques anti-D aux femmes Rhésus négatif, dans toutes
les circonstances possibles d'immunisation (accouchement, avortement,
amniocentèse, métrorragies, traumatisme abdominal pendant la
grossesse, etc.), a fait considérablement régresser la
fréquence de l'affection.
Chez les mères n'ayant pas reçu de
prévention efficace, le diagnostic est en général connu en
anténatal. Les autres incompatibilités s'observent chez des
enfants de mère Rhésus positif, et dès la première
gestation. Elles concernent les sous-groupes du système Rhésus
(c, E) ou d'autres systèmes sanguins (Kell, Duffy, Kidd). En revanche,
les anti-Lewis, anti-H et anti-HI ne donnent pas d'hémolyse en
période néonatale.
10
Dans tous les cas, il s'agit cliniquement d'ictères
précoces, intenses et accompagnés de stigmates d'hémolyse
: hépatosplénomégalie, anémie
régénérative.
Il existe parfois un syndrome oedémateux diffus du
foetus, qui réalise au maximum une anasarque foetoplacentaire (qui a pu
être observée en prénatal et avoir d'emblée
orienté le diagnostic et le traitement anténatal). Le test de
Coombs est toujours positif. Ceci permet de faire facilement le diagnostic
d'une incompatibilité rhésus anti-D au vu du simple
résultat des groupes sanguins standards de la mère et de
l'enfant. Sinon, des examens plus spécialisés sont
nécessaires pour déterminer dans quel groupe ou sous-groupe
sanguin se situe l'incompatibilité. Le risque maximal de ces
incompatibilités foeto-maternelles est le décès in utero
puis chronologiquement, l'anémie néonatale immédiate, et
enfi n l'ictère au cours des premiers jours de vie.
? Anomalies de l'hémoglobine
La drépanocytose ne donne habituellement pas
d'hémolyse en période néonatale car le nouveau-né a
essentiellement de l'hémoglobine foetale. Certaines
alphathalassémies peuvent avoir une symptomatologie néonatale
(Tady MB, 1973).
? Les enzymopathies
? Déficience en
glucose-6-phosphate-deshydrogénase (G6PD) (Tady MB, 1973).
Les troubles hémolytiques apparaissent habituellement
s'il y a présence d'un agent précipitant (oxydant), toxique,
médicamenteux ou infectieux (Le type africain est la déficience
type A). La déficience en G6PD est en définitive un
déficit en NADPH. Les réactions réductrices induites par
le NADPH sont de trois ordres essentiellement :
V' Réduction du GLUTATHION par la GLUTATHION-REDUCTASE
dont le coenzyme agissant comme transporteur d'hydrogène est le NADPH
(nicotinamide adénine di-nucléotide phosphate).
V' Réduction de la méthémoglobine par la
méthémoglobine réductase, avec le NADPH comme coenzyme.
V' L'action possible, par un mécanisme non
expliqué, du NADPH sur l'intégrité de la membrane
érythrocytaire.
11
? Déficit en pyruvate-kinase
C'est une affection autosomale récessive. Le
déficit est celui d'un enzyme qui intervient en fin de
métabolisme du glucose dans le GR
? Certaines erythropathies
? Maladie de MINKOWSKI-CHAUFFARD
(MICROSPHEROCYTOSE
HEREDITAIRE)
C'est une maladie à transmission autosomique dominante,
se manifestant par une anémie hémolytique constitutionnelle due
à une anomalie du cytosquelette sous-membranaire et des protéines
d'ancrage du globule rouge. Elle entraîne donc, un ictère
précoce avec une splénomégalie modérée
(INTERNES DE TOURS, 2004)
2.4.1.2.Défaut de transport plasmatique de la
bilirubine indirecte
Chez un nouveau-né malade, la capacité de
liaison de l'albumine est plus basse que chez un nouveau-né sain, et le
taux d'albumine plasmatique est souvent plus bas, il en résulte une
capacité de liaison beaucoup plus faible. D'autres facteurs tels que
l'administration d'acides gras, le pH, et l'administration de certains
médicaments ont été incriminés pour affecter la
liaison de la bilirubine à l'albumine (Siméoni U, 2006). Certains
médicaments ayant une forte affinité pour l'albumine peuvent
entrer en compétition avec le site de fixation de la bilirubine à
l'albumine.
Robertson et al ont étudié les effets de
nombreux médicaments utilisés en néonatologie sur le
déplacement de la bilirubine liée à l'albumine. Les
médicaments considérés comme dangereux sont ceux qui
augmentent de plus de 20% la concentration de bilirubine libre. La liste de ces
médicaments comprend plusieurs antibiotiques de la famille des
béta-lactamines dont la ceftriaxone qui est remplacée en pratique
par le cefotaxime, et d'autres antibiotiques de la famille des
sulfamidés qui sont peu utilisés en néonatalogie
(Siméoni U, 2006).
2.4.1.3.Anomalie de captation hépatique de la
bilirubine indirecte
La ligandine est faiblement synthétisée au cours
de la vie foetale, sa synthèse augmente au cours des premiers jours de
vie, elle est inductible par le phénobarbital. La bilirubine est
transportée jusqu'au réticulum endoplasmique où a lieu la
conjugaison. Certains médicaments ont cette capacité à
pouvoir entrer en compétition entre la liaison de la bilirubine à
la ligandine (Y, Z) (Tady MB, 1973).
Il se manifeste comme un ictère d'allure «
apparemment physiologique » qui persiste au-delà du 14 ° jour
de vie et qui souvent apparait vers lors de la 1° semaine de vie.
12
2.4.1.4.Anomalie de conjugaison de la
bilirubine
La conjugaison hépatique de la bilirubine indirecte
nécessite l'uridine-diphospho-glucuronyl-transférase (UDPGT). La
synthèse de l'UDPGT est déterminée par un gène
localisé sur le chromosome 2 (locus 2q37).
Ce gène est composé de 4 exons communs, de 13
exons variables (A1 à A13) et d'un promoteur qui régule son
expression. La complexité de cette carte génomique peut expliquer
en partie la fréquence des ictères néonatals d'origine
indéterminée, par exemple on a mis en évidence des
mutations de l'exon A1 et du promoteur qui peut affecter la conjugaison de la
bilirubine, c'est le cas de la maladie de Gilbert et le syndrome de
Criggler-Najjar. (Odièvre M, 2008).
Pendant la période foetale, entre 17 et 30 SA,
l'activité de I'UDPGT au niveau du foie est seulement à 0,1% des
valeurs de l'adulte et cette activité augmente à 1% entre 30 et
40 SA. D'où l'utilisation du passage transplacentaire comme voie
prédominante de l'élimination de la bilirubine. A la naissance
l'activité de l'UDGPT s'accroît au cours des premières
semaines de vie pour atteindre une activité identique à celle de
l'adulte entre 6 et 14 semaines d'âge postnatal. (Shelley c, 2003).
Notons que certains facteurs peuvent entraver une conjugaison
hépatique de la bilirubine notamment : les infections dues au syndrome
TORSCH pouvant entrainer des hépatites néonatales, les
déficits enzymatiques complets ou partiels (maladie de crigler Najjar et
la maladie de Gilbert), certains laits maternels contiennent du PREGNANDIOL qui
entraine un effet compétitif de la bilirubine avec le PREGNANE 3
alpha-20 Betâ-diol au niveau de la conjugaison. En plus, il y aurait une
activité très élevée de lipoprotéine-lipase
dans le lait de mère d'où une grande richesse des acides gras
libres (Tady MB, 1973).
? L'ictère au lait maternel.
C'est un ictère nu chez un nouveau-né nourri
exclusivement au sein et dont l'état général est
excellent. Il touche 2 à 4 % des nouveau-nés nourris au sein. Un
allaitement maternel insuffisant, mal mis en place peut engendrer un
état de déshydratation aggravant l'hyper bilirubinémie.
13
L'augmentation de la réabsorption de la bilirubine par
l'intestin (augmentation du cycle entérohépatique de la
bilirubine) est le mécanisme le plus important responsable de
l'ictère associé à l'allaitement maternel (Odièvre
M, 2008)
L'ictère au lait de mère survient chez environ 2
à 3 % des nouveau-nés allaités. Il apparaît vers le
5 ou 6ème jour de vie ou prolonge un ictère simple.
Il s'agit d'un ictère modéré et totalement
isolé, tant cliniquement que biologiquement. L'ictère persiste
plusieurs semaines, tant que le nouveau-né est nourri par sa
mère. Il disparaît en quelques jours si l'allaitement est
interrompu. (Odièvre M, 2008)
? Syndrome de Criggler Najjar
Ce syndrome est dû à un déficit
congénital en glucuronyl transférase. Ils existent 2 types,
causés par une ou plusieurs mutations.
? Criggler Najjar de type 1.
Dans le type 1, il existe presqu'une absence totale de
l'enzyme et les nouveaux nés développent une hyper
bilirubinémie dans les 2 ou 3 premiers jours de vie qui nécessite
une exsanguino-transfusion durant la 1° semaine de vie. Le diagnostic du
Criggler Najjar repose sur l'analyse de sérum et de la bile
prélevée au niveau du duodénum et analysée par la
chromatographie liquide à haute performance (HPLC) et le dosage de
l'enzyme dans les tissus hépatiques prélevés par biopsie,
la non réponse au traitement par le phénobarbital et par
l'analyse moléculaire du gène UGT1A1. (Odièvre M,
2008).
? Criggler Najjar type 2 (ou syndrome
d'Arias)
Dans ce type, l'hyper bilirubinémie est moins
sévère, bien qu'elle puisse entrainer dans certains cas un
ictère nucléaire. Dans ce syndrome les malades, enfants ou
adulte, répondent bien au traitement par le phénobarbital avec
une diminution nette de bilirubine indirecte au bout de 7 à 10 jours.
C'est la réponse à cette thérapeutique qui permet de
différencier entre le Type 1 et le type 2. (Odièvre M,
2008).
? Le syndrome de Gilbert
Ce syndrome est une affection totalement bénigne et
très fréquente (3 à 10 % de la population). Il
s'accompagne d'une hyper bilirubinémie, légère ou
modérée ou chronique ou récurrente sans atteinte
hépatique ou hémolyse. Il doit être considéré
comme un polymorphisme non
pathogène.la transmission peut
être autosomale dominante ou autosomale récessive. Il est
diminué par les inducteurs enzymatiques comme le phénobarbital ou
le méprobamate Le diagnostic de syndrome de Gilbert repose sur : des
signes compatibles (l'ictère ne peut être marqué et
persistant ; les tests hépatiques doivent être rigoureusement
normaux ou être clairement expliqués par une autre affection s'ils
sont anormaux). (Siméoni U, 2006)
14
2.4.2. ICTERE A BILURIBINE DIRECTE
2.4.2.1.Défaut d'élimination intestinale
de la bilirubine et stimulation du cycle entero-hépatique
Chez l'adulte, la bilirubine conjuguée est
réduite en stercobiline et en urobiline par des bactéries
intestinales, une faible fraction est hydrolysée en bilirubine non
conjuguée, puis est réabsorbée dans la circulation portale
via le cycle entéro-hépatique.
Chez le nouveau-né, la flore intestinale est quasiment
réduite et la réduction de la bilirubine en stercobiline et
urobiline ne peut se faire. Le méconium contient d'importantes
quantités de bilirubine qui peuvent être réabsorbées
si l'élimination méconiale est retardée.
Ainsi, le défaut d'élimination intestinale de la
bilirubine et stimulation du cycle entero-hépatique peuvent être
due à :
o L'atrésie des voies biliaires
o La lithiase de la voie biliaire principale
o L'élimination méconiale retardée
o L'occlusion intestinale néonatale
o La flore bactérienne insuffisante.
2.5.MANIFESTATIONS CLINIQUES DE L'ICTERE
NEONATAL
? En fonction de la période d'apparition des
manifestations cliniques, on distingue l'ictère précoce qui
survient avant 48 heures, l'ictère tardif (2-10 jours), et
l'ictère prolongé s'il persiste au-delà de 10 jours.
? Selon le type de bilirubine, l'ictère à
bilirubine indirecte présente (une coloration jaune des muqueuses et
téguments associée à des urines et selles normales) ;
celle à bilirubine directe présente (une coloration jaune des
muqueuses et téguments associée à des urines
foncées et selles décolorées) ; et l'ictère
à bilirubine mixte présente (une coloration jaune des muqueuses
et téguments associée à des urines foncées et
selles normales, et est souvent présente dans les infections).
? L'ictère physiologique est un ictère nu,
apparaissant après 48heures, toujours à bilirubine indirecte, pas
de signes d'accompagnement, les selles et les urines sont
normales, et disparait vers le 5ème jour. C'est
un diagnostic d'exclusion.
? L'ictère pathologique apparait avant 48heures,
intéresse tous les types de bilirubine, toujours accompagné des
signes (pâleur, fièvre...), les selles et les urines peuvent
être altérés.
Le dépistage de l'ictère est clinique. Il
comporte l'évaluation de la coloration cutanéomuqueuse du
nouveau-né. Il est préférable d'observer l'enfant à
la lumière naturelle et il est possible d'utiliser la compression de la
peau à la racine du nez.
15
PARACLINIQUE
2.5.1. Le bilirubinomètre transcutané
2.5.1.1.Principe
Un flash de lumière blanche arrive à la peau
à travers une fibre optique qui en capte aussi le reflet. La
lumière est modifiée par les pigments présents dans la
peau (essentiellement la bilirubine mais aussi l'hémoglobine).
L'appareil mesure la quantité de lumière retenue par la
bilirubine et la transforme en un index numérique (DI MAIO M., 1998).
2.5.1.2.Règles d'utilisation
La mesure se fait au niveau du front et du thorax pour tenir
compte de la progression céphalo-caudale de l'ictère. Si l'enfant
pleure au moment de la mesure frontale, la crispation de la peau peut
altérer le résultat. 2 à 3 mesures sont
réalisées et seule est retenue la valeur moyenne pour chaque
site. Le résultat est reporté sur une courbe permettant
l'interprétation et la surveillance de l'évolution. Ce test de
dépistage ne peut pas être utilisé en cours de
photothérapie ni dans les 12 heures suivant l'arrêt de la
photothérapie car il n'existe plus d'équilibre entre la
bilirubine plasmatique et la bilirubine cutané. Il est recommandé
de désinfecter la tête de lecture avant et après chaque
utilisation. De plus, un contrôle continu de l'étalonnage doit
être réalisé.
2.5.1.3.Influence de la pigmentation
cutanée
Il est possible d'utiliser le bilirubinomètre
transcutané (BTC) quel que soit la pigmentation cutanée du
nouveau-né. Cependant, il faut savoir que le résultat est
majoré chez les enfants à peau pigmentée par rapport aux
enfants à peau blanche pour un même taux de bilirubine totale.
Pour limiter l'influence de la pigmentation, il convient donc de faire une
mesure précoce (avant 4h de vie). Elle sera ensuite utilisée
comme valeur de référence pour les mesures ultérieures.
2.5.2. La bilirubinémie
Le dosage de la bilirubine totale et conjuguée dans le
sang est réalisé lorsque les valeurs trouvées au BTC sont
au-dessus de la courbe d'interprétation. Le résultat donné
par le laboratoire est interprété sur des courbes
spécifiques, en fonction de l'âge de l'enfant et du contexte
clinique. Le dosage de la bilirubinémie permet de déterminer la
nécessité et le moyen de traitement.
2.5.3. Le bilan étiologique
Il s'agit d'un bilan comportant :
? La détermination du groupe sanguin
phénotypé ? Le Test de Coombs
16
? La numération formule sanguine
? Le dosage des réticulocytes si c'est un ictère
hémolytique
? La bilirubine totale et conjuguée
? Le dosage de la protéine C réactive (CRP)
? L'échographie hépatique
Ces dosages, mis en corrélation avec le contexte clinique
de la naissance de l'enfant, permettent d'orienter sur le type d'ictère
(hémolytique, non hémolytique, ...) et son étiologie
(allo-immunisation ABO, ...) (RONAYETTE D, 2008).
2.6.PRISE EN CHARGE DE L'ICTERE NEONATAL
L'attitude thérapeutique face à un ictère
néonatal est relativement difficile à protocoliser de
façon précise. Elle dépend, notamment, de la
précocité de l'ictère et de l'étiologie
suspectée. Le niveau plasmatique de la bilirubine et/ou de ses fractions
permet la mise en place de mesures thérapeutiques adaptées : la
photothérapie, la perfusion d'albumine ou l'exsanguino-transfusion
(RONAYETTE D, 2008).
2.6.1. La perfusion d'albumine
Elle est efficace dans la prévention de la
neurotoxicité de la bilirubine. Son association à la
photothérapie permet une diminution plus précoce et plus rapide
de la bilirubine plasmatique non liée. Il s'agit de perfuser de
l'albumine à 20% préalablement diluée de moitié
dans du sérum glucosé à 5%, à la dose de 1 à
1,5 g/kg. Cette méthode peut être proposée lorsque
l'albuminémie du nouveau-né est inférieure à 30 g/L
(RONAYETTE D, 2008 ; BARRE D, 2002).
2.6.2. Les immunoglobulines polyvalentes
Depuis quelques années, des études
réalisées valident l'utilisation des immunoglobulines
polyvalentes intraveineuses (IgIV) dans le traitement des ictères par
alloimmunisation, notamment rhésus ou ABO. En effet, ces travaux ont
montré une diminution du recours à l'exsanguino-transfusion, de
la durée de photothérapie et de la durée
d'hospitalisation. Par ailleurs, la tolérance est excellente avec des
effets indésirables rares. Depuis 2004, l'American Academy of Pediatrics
recommande leur utilisation à la dose de 0,5g/kg (renouvelable dans les
12h en cas de nécessité) dans les ictères néonataux
hémolytiques par allo-immunisation ABO ou rhésus non
contrôlés par une photothérapie intensive, ou lorsque des
signes de gravité sont présents. (MONPOUX C, 2009).
2.6.3. La photothérapie
C'est le traitement symptomatique de référence
de l'ictère néonatal à bilirubine non conjuguée.
Son utilisation permet de diminuer le risque de toxicité
cérébrale ainsi que le recours à l'exsanguino-transfusion
qui est devenue exceptionnel. Il existe différentes modalités
d'administration : intense, conventionnelle, continue ou discontinue. Plusieurs
courbes sont disponibles ; chaque unité doit choisir celles qu'elle
utilise, tout en se basant sur la clinique
17
· PT Conventionnelle CONTINUE (toute la journée
interruption pour la tétée)
· PT Conventionnelle SEQUENTIELLE (8 heure /jr)
· PT INTENSIVE (usage de turbine, pas plus de 6h)
La durée moyenne de vie des tubes pour
photothérapie est d'environ 2000 heures ; des mauvaises conditions
d'utilisation telle une surchauffe peuvent réduire cette durée de
vie (Joséphine M, 2010).
? Mécanisme d'action
Pour que la bilirubine puisse être
éliminée dans la bile, il faut qu'elle soit soluble. Or la
bilirubine libre native n'est pas ionisée et très peu soluble
dans les conditions physiologiques (. La photothérapie entraîne la
transformation de la bilirubine non conjuguée liposoluble en
photo-isomères ionisés hydrosolubles. Ces derniers sont
facilement éliminés par la bile ainsi que dans les urines et les
selles. L'action se fait sur la bilirubine présente sous
l'épiderme à une profondeur de 2 millimètres (BARRE D,
2002).
? Facteurs influençant l'efficacité ?
L'intensité du flux lumineux
L'efficacité de la photothérapie augmente en
fonction de l'intensité lumineuse, jusqu'à un point de saturation
situé aux alentours de 40 uW/cm2/nm. L'intensité
lumineuse diminue avec l'augmentation de la distance entre la source lumineuse
et la peau de l'enfant. La distance lampe-enfant doit être
inférieure à 40 centimètres (BARRE D, 2002).
? Le type de lumière
Les longueurs d'ondes habituellement utilisées sont
dans le spectre du bleu, comprises entre 420 et 480 nm. Les systèmes
à fibre optique ont une puissance de spectre qui est inférieure
à celle des systèmes traditionnels (BARRE D, 2002).
La lumière bleue pose toutefois le problème de
la surveillance de la couleur du nouveau-né sous photothérapie et
est très désagréable pour les soignants. La lumière
verte, plus tolérable, pénètre plus profondément et
serait susceptible d'interférer sur la liaison bilirubine-albumine. Ceci
explique pourquoi la lumière blanche reste encore très
utilisée.
? La surface cutanée
exposée
L'efficacité de la photothérapie est
proportionnelle à la surface cutanée exposée. Cela a
conduit à développer une technique de photothérapie dite
intensive visant à obtenir le maximum d'intensité lumineuse sur
la plus grande surface corporelle possible. Il existe trois niveaux de
photothérapie selon l'irradiance : les dispositifs en berceau ou
maternisés (< 1 mW/cm2), la photothérapie classique (1
à 2 mW/cm2) et la photothérapie intensive (= 3 mW/cm2).
18
? Les dispositifs en berceau avec fibres optiques ou tube
fluorescent à lumière bleue (type Bilibed® Medela) ne
dispensent la lumière que dans le dos mais au contact du
nouveau-né. Ils autorisent donc l'utilisation du BTC sur la face
ventrale du bébé durant la photothérapie. Ils ont peu
d'effet sur l'hydratation et la température du nouveau-né et ne
nécessitent pas de monitorage ou de protection oculaire. Le seul
problème est celui de leur efficacité car ces systèmes
délivrent de faibles doses de lumière et le spectre des fibres
optiques est peu efficace sur la bilirubine cutanée
? La photothérapie classique ou conventionnelle
utilise une source lumineuse constituée de tubes (6 à 8), si
possible de lumière bleue. Seule la face ventrale du bébé
est placée sous photothérapie, mais l'efficacité peut
être améliorée en augmentant la surface exposée avec
un miroir placé sous le nouveau-né et un hamac translucide.
(BARRE D, 2002)
? La photothérapie intensive, avec une irradiance plus
élevée et une surface exposée plus importante et plus
proche de la source lumineuse, est beaucoup plus efficace. Elle permet de
baisser le taux de bilirubine totale de 20 % en moyenne en 4 heures voire 30 %
en 2 à 5 heures. Son efficacité permet de limiter le recours
à l'exsanguino-transfusion (EST) en cas d'hémolyse
sévère. Elle a été indiquée et
réalisée chez 6 nouveaux-nés de notre série (BARRE
D, 2002)
? Les risques induits par la photothérapie ?
Risque de malaise grave voire de décès
Le nouveau-né doit être surveillé par
monitorage continu de la fréquence cardiaque et de la fréquence
respiratoire.
? Le syndrome du bébé
bronzé
Ce syndrome se voit chez les nouveaux nés qui ont une
choléstase et qui sont sous photothérapie. Il est dû
à une accumulation au niveau de la peau et du sérum de
porphyrines. L'aspect couleur bronze disparait au bout de 2 mois. Ce n'est pas
tous les nouveau-nés qui ont une choléstase qui
développent ce syndrome. Chez Les nouveaux nés qui
développent ce syndrome sous photothérapie,
l'exsanguino-transfusion doit être envisagée si les taux de
bilirubine sont assez élevés pour nécessiter une
photothérapie intensive. (BARRE D, 2002)
? La diarrhée
Les nouveau-nés qui reçoivent une
photothérapie ont une augmentation de l'incidence de la diarrhée
et les selles prennent un aspect sombre avec un tin verdâtre.
? Risques ophtalmologiques
Ils correspondent aux risques de lésions
rétiniennes liées à l'altération des cellules en
cônes et bâtonnets de la rétine par l'énergie
lumineuse importante, fournie lors d'une séance de photothérapie.
Ceci explique la nécessité de bien protéger les yeux de
l'enfant avec des lunettes adaptées et non occlusives.
19
? Risques d'hyperthermie
Il existe un risque d'hyperthermie pendant la
photothérapie. Il est donc important de surveiller la température
cutanée ou centrale du nouveau-né régulièrement.
? Risque de déshydratation
Le risque de déshydratation existe. Pour le
prévenir, il est nécessaire de s'assurer d'apports hydriques
suffisants.
? Risque mutagène et
gonadique
Une exposition à des radiations de longueurs d'ondes
comprises entre 350 et 450 nm est inductrice de risques mutagènes voire
cancérigènes. Il existerait donc une possibilité de
cassure chromosomique, notamment au niveau des gonades. Par conséquent,
il faut protéger les organes génitaux par une couche (la plus
petite possible) (RONAYETTE D, 2008).

Figure 2. Appareil de photothérapie intensive
Figure 3. Appareil de photothérapie
Conventionnelle
2.6.4. L'exsanguino-transfusion (EST)
L'exsanguino-transfusion (EST) a été introduite
la première fois dans la fin des années 1940 pour diminuer la
mortalité causée par les incompatibilités rhésus.
Elle Constitue le traitement de dernier recours pour les
hyperbilirubinémies sévères ne répondant pas aux
autres thérapeutiques ou associées à des signes
neurologiques. C'est une technique qui permet l'échange volume à
volume de 1,5 à 2 masses sanguines d'un individu par du sang d'un
donneur exempt de bilirubine (Murki S, 2011).
20
2.6.4.1.Mécanisme d'action
Elle agit en épurant la bilirubine libre, les globules
rouges recouverts d'anticorps immuns et en corrigeant l'anémie. Cette
technique remplace le sang du malade par un sang provenant d'un ou plusieurs
donneurs, par soustractions et injections successives de petits volumes de sang
dans la veine ombilicale.
2.6.4.2.Conditions de
réalisation
L'enfant devra être surveillé durant tout l'examen
:
? Réchauffement
? Aspiration gastrique préalable
? Contention
? Oxygénation surveillée et monitorage
cardiaque
2.6.4.3. Technique
La voie d'abord utilisée est la veine ombilicale qui
sera cathétérisée. Le sang utilisé est du sang
total ou reconstitué, de moins de 48 heures, de groupe O rhésus
négatif ou de groupe compatible avec la mère et l'enfant, et
vérifié au lit de l'enfant. Le sang est réchauffé
à température ambiante. La quantité échangée
est, en général, de 2 à 3 masses sanguines, une masse
sanguine étant de 80 ml/kg de poids. La quantité injectée
doit être égale à la quantité soustraite.
L'échange se fait par cycles de 3 ml/kg lentement. Il faut environ 30
minutes pour une masse sanguine complète (Murki S, 2011).
L'utilisation de substances adjuvantes est nécessaire
durant sa réalisation : L'injection de 1 ml de gluconate de calcium
à 10% pour 100 ml de sang échangé par le cathéter,
la stimultanément à sa réalisation, il faut, au moyen
d'une voie veineuse périphérique, apporter en continu du
sérum glucosé à 10% contenant les électrolytes en
bonne concentration.
2.6.4.4.Complications
Comme toute technique invasive, l'exsanguino-transfusion expose
à plusieurs risques
? Un risque infectieux, qui peut être
évité par une asepsie stricte et l'évitement de suturer
à la fin de l'opération, il vaut mieux comprimer jusqu'à
l'obtention d'une bonne hémostase.
? L'utilisation de cathéters artériels expose
à un risque thromboembolique essentiellement au niveau de l'aorte
abdominale et aux membres inférieurs.
? Complications cardio-respiratoires : détresse
respiratoire, apnée, troubles du rythme cardiaque, voir un arrêt
cardio-respiratoire.
2.6.5. Antibiothérapie
L'antibiothérapie est le traitement étiologique
des ictères infectieux en période néonatale, le choix de
la molécule dépend de nombreux paramètres :
sensibilité du germe, concentration plasmatique et urinaire du
médicament et pouvoir bactéricide, toxicité (en
particulier rénale) et tolérance.
21


Figures 4 et 5. Courbes d'indication de la
photothérapie et exanguino-transfusion
22
2.7.LES COMPLICATIONS DE L'ICTERE NEONATAL
(Marc Bellaïche, 2017).
Le pronostic de l'ictère dépend de
l'étiologie et de l'efficacité de la prise en charge. En effet,
les ictères infectieux exposent au risque de sepsis, tandis que les
ictères hémolytiques exposent aux risques
d'hyperbilirbinémie grave avec ictère nucléaire. En cas
d'hyperbilirbinémie intense, la bilirubine peut franchir la
barrière hématoencéphalique et se déposer sur les
noyaux gris centraux et entrainer leur nécrose : c'est l'ictère
nucléaire. Ce risque est augmenté par la
prématurité, une infection mais aussi toute molécule qui
diminue le transport de la bilirubine par l'albumine.
Le retentissement neurologique est de deux sortes :
l'encéphalopathie bilirubinique aigue et chronique :
L'encéphalopathie bilirubinique aigue
caractérisée par :
· La léthargie
· L'hypotonie et mauvaise succison
· Un cri aigu monocorde
· L'hypertonie avec attitude en opisthotonos et/ou
convulsions, dans les formes sévères.
L'encéphalopathie bilirubinémique
chronique ou ictère nucléaire :
· D'apparition plus tardive
· Convulsions
· Mouvements choréo-athétosiques
· Retard mental
· Paralysie oculomotrice : regard en coucher de soleil
· Attitude en opisthotonos
· Troubles sensoriels : hypoacousie à rechercher
devant un ictère sévère par potentiels
évoqués auditifs.
23
DEUXIEME PARTIE : PARTIE PRATIQUE CHAPITRE III :
PRESENTATION DU LIEU DE STAGE
Notre étude a été menée au sein de
l'hôpital général provincial de référence
Jason
Sendwe.
SITUATION GEOGRAPHIQUE ET PRESENTATION
Situé dans la zone de santé de Lubumbashi,
l'hôpital général provincial Jason Sendwe est situé
dans la partie Est de la commune de Lubumbashi. Il est limité au nord
par l'avenue Sendwe au sud par l'avenue des écoles à l'Est par le
lycée Wema à l'ouest par l'avenue Likasi. Cet hôpital
d'intérêt public comprend deux grandes parties à savoir :
la partie pavillonnaire et partie à Etage dans lesquelles nous trouvons
plusieurs services hospitaliers.
APERCU HISTORIQUE DE L'HOPITAL Jason
SENDWE
L'hôpital général provincial de
référence Jason Sendwe appelé jadis Hôpital prince
LEOPOLD fut construit en 1928. Les mobiles qui avaient poussé les
autorités de l'époque à construire cet hôpital
propre aux indigènes furent à la fois d'ordre social et
humanitaire c'est-à-dire la lutte contre les maladies endémiques
dues à la poussée démographique, afin d'éviter la
contagion dans l'hôpital reine ELISABETH (Hôpital pour blancs) cet
Hôpital dont l'édification n'a pas été une
tâche fut construit en deux phases à savoir.
La première phase : cette phase de construction
consacrée à la partie pavillonnaire fut exécutée en
1928. Elle comptait à sa construction 350 lits. Elle arbitre plusieurs
services hospitaliers, techniques ainsi que les services
généraux.
La seconde phase quant à elle portera sur la
construction de l'édifice à étages 1958. Toute fois une
aile sera construite avant l'accession de notre pays à
l'indépendance. Les travaux seront interrompus suite aux
événements malheureux qui avaient suivi l'indépendance du
pays.
Il fut signalé que c'est un hôpital de l'Etat qui
sera géré jusqu'en 1962 par l'Etat lui-même. En 1962, suite
à l'installation du camp de réfugiés de triste
mémoire entre la Ruashi où se trouvé l'hôpital
universitaire de l'université officiel du Congo et La ville, les
autorités de l'université seront incapables d'accomplir la
formation des étudiants en médecine et se verront obliger de
déménager pour s'installer à l'hôpital Sendwe. Il y
a partir de cette date une gestion bicéphale avec direction de
l'état à côté de celle de l'université.
Notons que cette même année sera celle de
l'inauguration du bâtiment à étages. A partir de 1974, la
direction de l'Hôpital sera confiée à la Gécamines,
pour des raisons d'ordre social dont la plus importante fut le souci du
président de la république de permettre à la
24
population de la ville de bénéficier d'une
médecine et soins de bonne qualité à un prix moins cher.
Deux ans plus tard l'université quittera pour aller s'installer à
l'ancienne clinique reine ELISABETH actuellement cliniques universitaires.
Compte tenu de la difficulté d'ordre économique
qui ont entraîné la faillite de la Gécamines,
l'autorité politique en concentration avec le gouvernorat de province du
Katanga, l'université de Lubumbashi, la Gécamines et le consulat
de la Belgique, avait jugé bon de reprendre la gestion de
l'hôpital et la confié à l'université de Lubumbashi
qui a repris la direction à partir du 30 septembre 2005.
L'hôpital Sendwe avec sa capacité de 1200 lits
est classé en deuxième position après l'hôpital
général de Kinshasa il dessert pour ainsi dire la population de
toutes les communes de Lubumbashi, mais aussi celle venant de tout le reste du
Katanga de deux Kasaï et du sud Kivu. Vu son importance bien que disposant
1200 lits il connaît un pourcentage d'occupation de plus de 100%
3. SUR LE PLAN ADMINISTRATIF
Pour mieux assurer la gestion, l'hôpital Sendwe
fonctionne avec deux structures :
2 La structure administrative et
3 La structure médicale
A. LA STRUCTURE ADMINISTRATIVE
Elle est dirigée par un comité composé
d'un médecin directeur et d'un administrateur gestionnaire financier.
Elle s'occupe de l'administration courante de l'hôpital, elle coordonne
les différents services, elle engage et affecte le personnel soignant
suivant la formation de chacun. Elle fonctionne sous la direction du
médecin directeur. Plusieurs médecins directeurs se sont
succédés à la tête du dit hôpital depuis sa
création.
B. LA STRUCTURE MEDICALE
Elle est dirigée par un médecin directeur qui
coordonne les services médicaux. C'est un secteur très vaste qui
comprend plusieurs services spécialisés à savoir :
· La chirurgie
· La gynécologie
· La médecine interne
· La pédiatrie
· L'hôpital du jour qui comprend les dispensaires :
ophtalmologie, ORL,
gynécologie, pédiatrie, médecine interne
· Les urgences et
· PMI

Pédiatrie
Médecine interne
Gynéco-obstétrique
Dispensaire
pédiatrie
Dispensaire MI
Dispensaire GO
Pavillon clinique
Urgence
Autres services Chirurgie
|
Spécialités
|
Médicaux technique
|
|
|
|
|
|
|
|
|
Imagerie médicale
|
|
|
|
|
Gynécologie
|
Chirurgie
infantile
|
|
Dentisterie
|
Laboratoire
|
|
|
|
|
|
|
|
Ophtalmologie
|
|
|
|
|
|
|
|
Dermatologi
MIH
MIF
Pédiatrie 13
Pédiatrie 12
Mat 1
Soins intensifs
Néonatologie
Pédiatrie 9
Mat 2
Dispensaire
25
4. ORGANIGRAMME DE L'HOPITAL SENDWE
COMITE DE GESTION

DIRECTEUR NURSING
Gestion des ressources
Services techniques
Patrimoine
Buanderie
MEDECIN DIRECTEUR GESTIONNAIRE
Cuisines
MEDECIN DIRECTEUR ADJOINT
Intendance
Trésorier
Facturation
Mouvement hospitalier
Caisse
Pharmacie
Budget contrôle
Comptabilité
MEDECIN CHEF DE STAFF

MEDECIN DIRECTEUR
SECRETAIRE DE DIRECTION
26
CHAPITRE IV : MATÉRIELS ET METHODOLOGIE
4.1 Type et période de l'étude
Nous avons fait recours à une étude descriptive
transversale appuyée par la technique d'analyse documentaire pour la
récolte des données de Janvier 2020 à décembre
2022, soit une période de 3 ans.
4.2 Population d'étude
Afin de pouvoir bien explorer ce travail, notre étude
s'est intéressée à 1806 nouveau-nés qui
étaient hospitalisés dans le service de néonatologie
durant notre période d'étude.
4.3 Echantillon
Pour l'atteinte de nos objectifs, nous avons effectué
un tirage de 327 cas des nouveau-nés avec ictère.
4.4 Critères d'inclusion
Dans cette étude nous avons inclus tous les
nouveau-nés ayant présenté un ictère
néonatal dans le service de néonatologie de l'HGPR Jason Sendwe
pendant la période d'étude et dont les données
étaient exploitables.
4.5 Critères de non-inclusion
N'ont pas été inclus dans cette étude,
tous nouveau-nés n'ayant pas présenté l'ictère
et ceux dont les dossiers étaient incomplets.
4.6 Collecte des données
La collecte des données a été faite sur
une fiche d'enquête pré établie (présentée
en
annexe) à partir des dossiers des malades.
4.7 Variables étudiées
Nous avons étudié les variables ci-après
:
> Les caractéristiques sociodémographiques : le
sexe, le lieu de provenance ;
> Les caractéristiques cliniques : la période
d'apparition de l'ictère, l'âge néonatal, le
suivi des CPN, les antécédents d'infections
uro-génitales, le mode d'accouchement, le
poids de naissance, le mode d'alimentation et les signes
cliniques associés
> La paraclinique : le groupe sanguin de la mère et du
nouveau-né, le rhésus de la mère
et du nouveau-né, le type de bilirubine, la CRP, le taux
de bilirubine
> La prise en charge
> La durée d'hospitalisation ; >
L'évolution.
27
4.8 L'analyse statistique
Nous avons utilisé les logiciels Microsoft Word,
Microsoft Excel et Epi info version 7.2.0.1 pour l'encodage et l'analyse des
données.
4.9 Difficultés Rencontrées
Au cours de notre recherche, nous avons été
buté contre certaines difficultés entres
autres :
? L'absence parfois des données sur certaines fiches
d'où nous avons été obligés de recourir aux
registres pour enrichir les informations.
? L'éparpillement des fiches des malades au sein de
notre lieu de récolte des données, ce qui nous a
coûté une très longue période de travail.
28
CHAPITRE V : PRESENTATION DE RESULTATS
5.1 FREQUENCE GLOBALE DE L'ICTERE NEONATAL
La figure ci-dessous montre une prévalence de
l'ictère néonatale qui s'élève à 18,1%
contre 82,9% pour les autres pathologies ; soit 327 cas d'ictère
néonatal sur un total de 1806 cas.

82,9%
18,1%
Cas d'ictère autres pathologies
Figure 7. Fréquence de l'ictère
néonatal
Tableau I : Répartition des cas selon les
années
Année Effectif Pourcentage
2020 125 38,23%
2021 98 29,97%
2022 104 31,8%
Total 327 100%
Il ressort de ce tableau que l'année 2020 était la
plus représentée par l'ictère néonatal avec 125 cas
soit 38,23% suivi de l'année 2022 avec 104 cas soit 31,8%.
29
5.2 CARACTERISTIQUES SOCIODEMOGRAPHIQUES DES
PATIENTS
La lecture de cette figure montre une prédominance
pour le sexe Masculin avec 189 cas, soit 57,8% contre 138 cas, soit 42,2% pour
le sexe féminin, et un sexratio de 1,36 en faveur des garçons.

42,20%
Masculin Féminin
57,80%
Figure 8. Répartition des cas selon le
sexe
La figure ci-dessous révèle que la commune de
KAMPEMBA est la plus touchée par l'ictère néonatale avec
23,90% suivie de la commune de KAMALONDO avec 20,50%.
23,90%
20,50%
15,90%
12,50%
7,60%

3,70%

9,80%
6,10%
KAMALONDO KATUBA KAMPEMBA KENYA LUBUMBASHI RUASHI ANNEXE
IMPRECICES
Figure 9. Répartition des cas selon la
provenance
30
5.3 ASPECT CLINIQUE
Tableau II : Répartition des cas selon la
période d'apparition de l'ictère
Période d'apparition Effectif
Pourcentage
<48 heures 119 36,4%
=48 heures 208 63,6%
Total 327 100%
Il ressort de ce tableau que 63,6% des cas d'ictères sont
apparus au-delà de 48 heures alors que 36,4% sont apparus avant 48
heures.
Tableau III : Répartition des cas selon la
maturité du nouveau-né
Maturité Effectif Pourcentage
Prématurés 125 30,3%
Nouveau-nés à terme 228 69,7%
Total 327 100%
Ce tableau stipule que les nouveau-nés à terme
sont plus touchés par l'ictère néonatal avec 69,7% contre
30,3% pour les prématurés.
La lecture de ce tableau montre que 54,74% et des
nouveau-nés ictériques sont issus des grossesses avec
notion d'antécédents d'infections génito-urinaires.
31
La figure que voici stipule que 198 cas, 60,6% des
nouveau-nés ictériques était issus des grossesses non
suivies.

60,6%
39,4%
CPN suivies CPN non suivies
Figure 10. Répartition des cas selon le suivi
des CPN
Tableau IV : Répartition des cas en fonction des
ATCD d'infections génito-urinaires chez les mères
Antécédents Effectif
Pourcentage
OUI 179 54,74%
NON 148 45,26%
Total 327 100%
32
Tableau V : Répartition des cas selon le mode
d'accouchement
Année Effectif Pourcentage
Eutocique 260 79,5%
Dystocique 67 20,5%
Total 327 100%
Il ressort de ce tableau que l'ictère néonatal a
touché 79,5% des nouveau-nés issus d'un accouchement eutocique et
20,5% issus d'un accouchement dystocique.
Tableau VI : Répartition des cas selon le poids
de naissance
Poids de naissance Effectif Pourcentage
< 2500g 121 37%
2500-3500g 140 42,8%
> 3500g 66 20,2%
Total 327 100%
Ce tableau montre que 42,8% des nouveau-nés
ictériques avaient un poids de naissance compris entre 2500-3000
grammes.
33
Tableau VII : répartition des cas selon le mode
d'alimentation
Alimentation Effectif Pourcentage
Lait maternel 221 67,6%
Lait maternisé 56 17,1%
Lait mixte 50 15,3%
Total 327 100%
Il ressort de ce tableau que 67,6% des nouveau-nés
atteints par l'ictère néonatal étaient nourris au lait
maternel tandis que 17,1% étaient nourris au lait maternisé.
Tableau VIII : Répartition des cas selon les
signes cliniques associés
Signes associés* Effectif Pourcentage
Hépatomégalie 45 13,76%
Fièvre 115 35,16%
Pâleur 74 22,6%
Selles décolorées 35 10,7%
Signes neurologiques 10 3%
Au vu de ce tableau, nous constatons que 115
nouveau-nés ictériques avaient la fièvre comme signe
associé alors que la pâleur était rencontrée dans 74
cas.
*Un nouveau-né pouvait avoir plusieurs signes
associés alors que certains nouveau-nés n'avaient pas de signes
accompagnateurs.
34
5.4 ASPECT PARACLINIQUE
Tableau IX : Répartition des cas selon les
groupes sanguins des mères
Groupe sanguin Effectif Pourcentage
Groupe sanguin A 60 18,35%
Groupe sanguin B 94 28,75%
Groupe sanguin O 148 45,25%
Groupe sanguin AB 25 7,65%
Total 327 100%
Il ressort de ce tableau que le groupe sanguin O est le plus
représenté chez les mères avec 148 cas, soit 45,25%.
Tableau X : Répartition des cas selon les groupes
sanguins des nouveau-nés
Groupe sanguin Effectif Pourcentage
Groupe sanguin A 45 13,76%
Groupe sanguin B 81 24,77%
Groupe sanguin O 188 57,49%
Groupe sanguin AB 13 3,98%
Total 327 100%
Ce tableau stipule que le groupe sanguin O est le plus
représenté chez les nouveau-nés avec 188 cas, soit
57,49%.
35
Tableau XI : Répartition des cas selon les
Rhésus des mères
Rhésus Effectif Pourcentage
Rhésus positif 315 96,33%
Rhésus négatif 12 3,67%
Total 327 100%
Dans ce tableau, nous constatons que le rhésus positif
est le plus représenté avec 315 cas, soit 96,33%.
Tableau XII : Répartition des cas selon les
Rhésus des nouveau-nés
Rhésus Effectif Pourcentage
Rhésus positif 322 98,47%
Rhésus négatif 5 1,53%
Total 327 100%
Dans ce tableau, nous remarquons que le rhésus positif
est le plus représenté avec 322 cas, soit 98,47%.
36
Tableau XIII : Répartition des cas selon le type
d'ictère
Type d'ictère Effectif Pourcentage
Ictère à bilirubine directe 61 18,7%
Ictère à bilirubine indirecte 137 41,9%
Ictère à bilirubine mixte 88 26,9%
Non déterminé 41 12,5%
Total 327 100%
Au regard de ce tableau, nous remarquons une prédominance
pour l'ictère à bilirubine indirecte avec 137 cas, soit 41,9%.
5.5 PRISE EN CHARGE
Tableau XIV : Répartition des cas selon la prise
en charge
Prise en charge Effectif Pourcentage
Antibiothérapie 327 100%
Photothérapie 101 30,88%
Exsanguino 2 0,6%
Hydratation 327 100%
Ce tableau nous renseigne que 100% des nouveau-nés
ictériques avaient reçus une antibiothérapie alors que 101
ont bénéficiés d'une photothérapie et 2
nouveau-nés l'exsanguino-transfusion.
37
5.6 CARACTERISTIQUES EVOLUTIVES
Tableau XV : Répartition des cas selon
l'évolution
Evolution Effectif Pourcentage
Favorable 233 71,25%
Décès 76 23,25%
Non précise 18 5,5%
TOTAL 327 100%
Dans ce tableau, nous constatons que 71,25% des
nouveau-nés ictériques ont évolués favorablement
tandis que 23,25% sont décédés.
Tableau XVI : Répartition des cas selon le
séjour à l'hôpital
Séjour Effectif Pourcentage
< 7 Jours 87 26,6%
7-14 Jours 199 60,9%
> 14 Jours 41 12,5%
TOTAL 327 100%
Ce tableau stipule que 60,9% des nouveau-nés
ictériques ont eu un séjour hospitalier de 7-14 tandis que 26,6%
des nouveau-nés ont quitté l'hôpital avant 7
jours.
38
CHAPITRE VI : DISCUSSION
Notre étude a révélé une
prévalence de l'ictère néonatale qui s'élevait
à 18,1%. N'étant pas nationale, cette prévalence est
inférieure à celle trouvée par Taoufik BEN HOUMICH lors de
son étude au Maroc sur l'ictère néonatal au centre
hospitalier universitaire de janvier 2014 à décembre 2015 qui
avait trouvé une prévalence de 21,3%. (M.Taoufik, 2017). Elle est
Cependant supérieure à celles de 4,9%, 3,7% et 4,6%
observées respectivement à Mbuji-Mayi (Kabamba MA), Madagascar
(Rabesanndratan N,2011) et Etats-Unis (Watchko JF,2009).
Le sexe masculin prédomine avec 57,8% contre 42,2%
pour le sexe féminin, soit un sexratio de 1,36 en faveur des
garçons. Ces résultats se rapprochent à ceux de Many qui
avait également trouvé une prédominance pour le sexe
masculin avec 59,3% et un sexratio de 1,4 lors de son étude sur le
profil clinique et déterminant de l'ictère nucléaire du
nouveau-né à l'hôpital provincial du Nord-Kivu en
république démocratique du Congo (Many R, 2016). Taoufik BEN
HOUMICH avait également trouvé une prédominance masculine
avec 56,2% et un sexratio de 1,28. (M. Taoufik, 2017).
La commune de Kampemba était la plus
représentée avec 23,90%. Cette fréquence s'expliquerait
par le fait de la proximité géographique entre ladite commune et
l'hôpital général de référence Jason sendwe.
Nos résultats rejoignent ceux rapportés par Diangienda en 2017,
soit 26,27%. (Diangienda M, 2017).
La présente étude a révélé
que 63,6% des cas d'ictères étaient apparus au-delà de 48
heures alors que 36,4% étaient apparus avant 48 heures. L'étude
de HASSNA TAIRAN évoque un taux de 92.3 % d'ictère d'apparition
entre 36h et une semaine ; MONGA KALENGA : 39,2% au 3ème jour de vie.
Par là nous comprenons que l'ictère pathologique fait l'objet
d'un véritable problème de santé parce que tout
ictère néonatal apparaissant avant 48 heures est ipso facto
pathologique. (Hassan T, 2009 ; Monga K, 2010)
Les nouveau-nés à terme étaient plus
touchés par l'ictère néonatal avec 69,7% contre 30,3% pour
les nouveau-nés prématurés. Taoufik BEN avait
également trouvé une prédominance de l'ictère
néonatal pour l'âge gestationnel compris entre 37-41 semaines
d'aménorrhée. Ces résultats se rapprochent de ceux de
KABENGELA KABAMBA en 2015 à Lubumbashi qui avait trouvé 77,87%
des nouveau-nés à terme. (M. Taoufik, 2017 ; KABENGELA, 2015).
39
Ceci pourrait être explicité par le fait que
hormis l'immaturité hépatique que présentent les
nouveau-nés, plusieurs autres étiologies seraient à la
base de l'ictère néonatal.
Nous avons répertorié 60,6% des
nouveau-nés ictériques qui étaient issus des grossesses
non suivies. L'étude de BARKAT et ses collaborateurs a rapporté
32 % des nouveau-nés ictériques chez qui leurs mères
n'avaient pas suivi les consultations prénatales. Taoufik ben quant
à lui avait trouvé 53,59% pour les grossesses mal suivies et
20,36% pour les grossesses non suivies. (M. Taoufik, 2017). Bref, les
consultations prénatales sont d'une importance très capitale par
le fait qu'elles permettent un bon suivi des grossesses et préviennent
la survenue de certaines pathologies en période néonatale
à l'instar de l'ictère néonatal.
Notre étude a montré que 54,74% des
nouveau-nés ictériques étaient issus des grossesses avec
notion d'antécédents d'infections génito-urinaires.
Diangienda quant à lui a répertorié 48,08%
d'antécédents d'infections urogénitales au
troisième trimestre de la grossesse. Ceci peut s'expliquer par le fait
que les infections urogénitales au 3ème trimestre favoriseraient
des infections néonatales qui seraient responsables de l'ictère
chez le nouveau-né. (Diangienda M, 2017)
Une proportion de 67,6% des nouveau-nés atteints par
l'ictère néonatal étaient nourris au lait maternel tandis
que 17,1% étaient nourris au lait maternisé. De multiples
études ont démontré au cours des 25 dernières
années une forte association entre l'allaitement maternel et
I'hyperbilirubinemie du nouveau-né. L'étude de Schneider
[Schneider, 1986] met en évidence un risque 3 fois plus important pour
les nouveau-nés recevant un allaitement maternel d'avoir une BT >120
mg/l par rapport aux enfants recevant un allaitement artificiel, et un risque 6
fois plus important d'avoir une BT >150mg/l. L'association de plusieurs
mécanismes (augmentation du cycle entéro hépatique,
diminution de la glucurono-conjugaison) est probablement à l'origine de
l'ictère au lait de mère (Gourley GR,2002).
Dans notre étude, la fièvre avait touché
115 nouveau-nés ictériques et est considérée comme
le signe accompagnateur le plus fréquent, suivi de la pâleur qui
représentait 74 cas. L'étude de Diangienda avait
révélé 25.42% des cas d'ictères qui étaient
associés à la fièvre et 7.20% à la pâleur.
HASSNA TAIRAN par contre avait trouvé les anomalies neurologiques dans
45,7% des cas ; pour MONGA Joséphine, c'était la pâleur qui
prédominait avec 15,7%. Dans notre cadre, la prédominance de la
fièvre et la pâleur peut s'expliquer par la présence des
infections néonatales ainsi que des anémies hémolytiques
qui seraient en majeur partie responsables de la survenue de
l'ictère.
40
Nous avons répertorié 3,67% des mères
avec rhésus négatif. Berkoud quant à lui a
enregistré 11% des mères qui étaient du rhésus
négatif lors de son étude au Maroc en 2017. Ceci nous
amène à dire que la proportion de l'ictère néonatal
par incompatibilité rhésus foeto maternel est faible par le fait
que le rhésus négatif représente un pourcentage
très réduit dans la population mondiale. (Berkoud N, 2016)
L'ictère à bilirubine indirecte a
représenté 41,9%. Ces résultats sont inférieurs
à ceux présentés par Diangienda qui avait trouvé
62,29% des cas. Les deux résultats se rallient aux données
épidémiologiques décrites par rapport à la
prédominance de l'ictère à bilirubine non conjuguée
(bourillon A, 2003).
Tous les nouveau-nés ictériques avaient
reçus une antibiothérapie alors que 30,88% des cas avaient
bénéficiés d'une photothérapie. Taoufik lors de son
étude au Maroc avait mentionné 64,1% des photothérapie
réalisées et 54,1% d'antibiothérapie administrées.
Dans notre cadre, l'antibiothérapie se justifie par le fait qu'en-dehors
de l'ictère néonatal, la plupart des nouveau-nés pouvaient
avoir un risque infectieux ou une infection néonatale associée
qui sont des indications d'une antibiothérapie. (M. Taoufik, 2017)
L'issue était favorable dans 71,25% des cas tandis que
23,25% des cas étaient décédés. Taoufik et Berkoud
ont fait mention d'une proportion élevée de guérison, soit
87,8% et 98,46%. (M Taoufik, 2017 ; Berkoud, 2016). Le taux élevé
des décès dans notre étude pourrait s'expliquer par
l'existence d'autres pathologies associées à l'ictère
néonatal, le manque de moyens pour certains nouveau-nés entravant
au fait la mise en place des investigations avancées et
spécialisés.
41
CONCLUSION
Nous voici arrivés au terme du présent travail
qui a porté sur une étude rétrospective du profil
épidémiologique, clinique, et prise en charge de l'ictère
néonatal à Lubumbashi, Cas de l'HGPR JASON SENDWE, de janvier
2020 à décembre 2022, soit une période de trois ans.
Les résultats trouvés nous conduisent à
conclure que l'ictère néonatal est une pathologie non
négligeable par sa prévalence importante qui est de 18,1%. Durant
notre étude, nous avons constaté une prédominance pour le
sexe masculin avec 57,8% et un sexratio de 1,36. La commune de Kampemba
était la plus représentée avec 23,90%, La majorité
des nouveau-nés icteriques, soit 60,6% étaient issus des
grossesses non suivies. Les prématurés ont
représenté 30,3% des nouveau-nés atteints par
l'ictère. L'ictère néonatal était plus d'apparition
tardive (> 48h) que précoce. L'allaitement au lait maternel
était prédominant. 35.16% des cas étaient associés
à la fièvre ; et 22,6% à la pâleur. Nous avons
remarqué qu'au cours de notre étude, la majorité des
mères et des nouveau-nés étaient du groupe sanguin O et du
rhésus Positif. Le rhésus négatif n'a atteint que 3,6%
chez les mères. L'ictère à bilirubine indirecte
était représenté dans 41,90 % des cas.
L'antibiothérapie a été utilisée chez tous les
nouveau-nés tandis que la photothérapie a été
réalisée dans 30.88% des cas. L'évolution était
favorable dans 71.25% des cas.
SUGGESTIONS ET RECOMMENDATIONS
D'après ce qui précède, nous
suggérons ce qui suit :
? Aux autorités politico-sanitaires de pouvoir bien
équiper :
· L'HGRP JASON SENDWE des matériels de
laboratoire pouvant servir à un dosage rapide de la
bilirubinémie
· Le service de néonatologie en matériels
fiables sûrs notamment des bilirubinometres transcutanés et des
appareils de photothérapie correspondant à la capacité
d'accueil de service de néonatologie.
? Aux personnel soignants:
· D'accepter et appliquer les directives de la prise en
charge de l'ictère néonatal,
· D'assurer un diagnostic précoce et
étiologique, et d'instaurer un traitement adéquat. ? Aux parents,
nous demandons de :
· Suivre régulièrement les consultations
prénatales qui sont d'une importance très capitale car elles
peuvent prévenir plusieurs facteurs de risque pouvant engendrer la
survenue de l'ictère néonatal
· De faciliter la tâche aux personnels soignants
en mettant en jeu les moyens financiers permettant une meilleure prise en
charge des nouveau-nés avec ictère néonatal.
42
RÉFÉRENCES
Arieh R, Ada T, Amir K, Miri H, David B. Is Visual Assessment
of Jaundice Reliable as a Screening Tool to Detect Significant Neonatal
Hyperbilirubinemia? The Journal of Pediatrics 2008 ; p782-87.
BARKAT A, Mdagri A, BelahssenA, BassriB, Hamadani S, Lamadour
N, ictère à bilirubine indirecte. Centre national de
référence en néonatologie CHU de rabat, Novembre 2003.
BARRE D., La photothérapie. Le cahier technique, 2002 ;
n°23 : p.11-20.
BERKOUD NAIMA, ictère néonatal à
l'hôpital tlemcen, mémoire de fin d'étude,
Université Abou bekr Belkaid, septembre 2016 [en ligne].
Bjerre JV, Petersen JR, Ebbesen F. Surveillance of extreme
hyperbilirubinaemia in Denmark. A method to identify the newborn infants. Acta
Paediatr 2008;97(8):1030-4.
Bourillon A. Pédiatrie pour le praticien. Masson 2003;4
ed: p681
Claudet I, De Montis P, Debuisson C, Marechal C, Honorat R,
Grouteau E. Analysis of neonate admissions to the pediatric emergency
department. Arch Pediatr 2012 ;19(9):900-6.
CORTEY A. Ictères et hyper bilirubinémies du
nouveau-né. [En ligne] CNRHP. Mars 2011. [Référence du 15
janvier 2013] 213.218.138.82/
www.3cfr.fhpmco.fr/dragon-media/8mars
2011Icteresethyperbilirubinémiesdunouveaune.pdf
DI MAIO M., LANGEVIN L., Prise en charge de
l'hyperbilirubinémie du nouveau-né à terme en
maternité. Archives Pédiatriques, 1998 ; n°5 :
p.1156-1161
Diangienda M, PROFIL EPIDEMIOCLINIQUE, THERAPEUTIQUE ET
EVOLUTIF DE L'ICTER NEONATAL (Cas de l'hôpital Sendwe du 01 janvier au 31
décembre 2017).
Dr HAMOUDA H. HEMOLYSE NORMALE ET PATHOLOGIQUE,
Université Ferhat Abbes. Faculté de médecine de
Sétif 2020.
DUHAMEL G, chronique des pasquier, les maitres, 1937, p.269
Elbaqqali L. Les ictères néonatals à
bilirubine non conjuguée expérience du service de
pédiatrie au HASSAN II Fès : étude rétrospective du
Janvier 2002 à Décembre 2003.Thèse en médecine
2004.
Gamaleldin R, Iskander L, Seoud L, Aboraya H. Et al. Risk
factors for neurotoxicity in newborns with severe neonatal hyperbilirubinemia.
Pediatrics 2011; 128 (4): 925-31
Gourley GR: Breast-feeding, neonatal jaundice and kernicterus.
Semin Neonatol 2002, 7(2): 135-141.
HASSNA Tairan, ictère néonatale, expérience
du chu Mohammed VI de Marrakech, thèse pour l'obtention de doctorat de
médecine, 2009 [en ligne]
INTERNES DE TOURS. Maladie de Minkowski-Chauffard. Faculté
de Médecine de Tours, entre 2003 et 2004 (18 octobre 2009)
http://fmc.med.univtours.fr/Pages/Hémato/DES/B8.pdf
Joséphine MONGA KALENGA, étude de l'ictère
néonatal à bilirubine libre dans les Cliniques Universitaires de
Lubumbashi, faculté de Médecine Unilu, décembre 2009
à Aout 2010.
43
Kabamba MA, Mukulu O, Kasongo KB, Mulangu MA, Mutombo MA, Dibwe
MJ et al. Ictères pathologiques de nouveau nés à
l'hôpital Bonzola de Mbuji-Mayi en RDC. Pan Afr Med. 2014 ; 19 : 302
KABENGA KABAMBA Henry, ictère néonatal
pathologique, aspect clinique, thérapeutique et évolutif cas des
Cliniques universitaire, Mémoire de fin d'étude septembre 2015,
Inédit
M. Taoufik BEN HOUMICH, L'ictère néonatal au CHU
Mohammed VI de janvier 2014 à décembre 2015.
Manning D, Todd P, Maxwell M, Jane Platt M. Prospective
surveillance study of severe hyperbilirubinaemia in the newborn in the UK and
Ireland. Arch Dis Child Fetal Neonatal Ed 2007 ;92(5):F342-6.
Many R. profil clinique et déterminant de l'ictère
nucléaire du nouveau-né à l'hopital provincial du
Nord-kivu.2016.
Marc bellaïche, pédiatrie 10ème
édition, Ikb,2017.
MONPOUX C., DAGEVILLE C., Immunoglobulines polyvalentes
intraveineuses et ictère néonatal par alloimmunisation
érythrocytaire. Archives Pédiatriques, 2009; n°9: p.
1289-1294
Murki S, Kumar P. Blood exchange transfusion for infants with
severe neonatal hyperbilirubinemia. Semin Perinatol 2011 ;35(3) :175-84.
Obladen. M Soins intensifs aux nouveau-nés. Springer
(2) Paris 2008 : p333-57
Odièvre M. Ictère au lait de mère. In :
journées parisiennes de pédiatrie. Paris :
FlammarionMédecineSciences,2008 : 85-94
OMS, rapport sur la santé du monde, 2009
Rabesanndratan N, Rasaminamanana NG, Tetto TH et al. Aspects
épidémio-cliniques des urgences médicales en
néonatologie à Mahajanga au Madagascar. Rev Anest Rean et Med
Urg. 2011 ;3 (1) :27-31
Rabesanndratan N, Rasaminamanana NG, Tetto TH et al. Aspects
épidémio-cliniques des urgences médicales en
néonatologie à Mahajanga au Madagascar. Rev Anest Rean et Med
Urg. 2011 ; 3 (1) : p27-31
RONAYETTE D. Ictère du nouveau-né. Ecole de
Sages-femmes, octobre 2008
Shelley c springern Davd, J, Annibale Kernicterus in E
medicine (Web site) February 14, 2003
Siméoni U : Hépatologie et ictère. In :
Soins aux nouveau-nés. Edited by Masson, 2ème édition edn.
Paris ; 2006. 491 -506.
Tady MB, contribution à l'étude
étiologique des ictères néonataux à kinshasa.
Mémoire de spécialisation en Pédiatrie. Université
de Kinshasa, 1973.
Watchko JF, Zhili L ; Reese H ; Amy S ; Walker M. complex
multifactorial nature of significant hyperbilirubinemia study group.
Paediatrics. 2009.
Wei K, Yang Y, Yao Y, Du LZ, Wang A, Wong R et al.
Epidemiologic survey on hospitalized neonates in China. Transl. Pediatr. 2012 ;
(1) 15-22
Pâleur cutanéomuqueuse oui non
44
ANNEXES
FICHE DE RECOLTE DES DONNEES
I. IDENTITE
Sexe : Masculin Féminin Lieu de naissance
Age Jours Motif de consultation
Date d'entrée Date de sortie ou de
décès
Provenance de la mère
II. ANTECEDENTS ? Antécédents
anténataux
III. Avortements Oui
|
Non
|
|
MFIU Oui
|
Non
|
|
Accouchements prématurés Oui
Grossesse
Suivie Non suivie
Anamnèse infectieuse : positive
Nature de l'infection : Génitale
|
Non
Mal suivie
négative
Urinaire Autre
|
Diabète HTA : Autres
? Antécédents périnataux
Lieu d'accouchement Age gestationnel SA
Durée du travail Aspect du liquide amniotique .
Mode d'accouchement : Eutocique Dystocique
Allaitement : lait maternel lait maternisé
III. EXAMEN CLINIQUE Examen cutanéomuqueux
|
Intensité : franc
|
Sub-ictère
|
Délai d'apparition Jours
Mode d'installation Aigu progressif chronique
45
Examen digestif et urinaire
Selles : Normales décolorées
Urines : Normales Foncées
IV. EXAMENS COMPLEMENTAIRES
· BT (mg/L)
· BNC (mg/L)
· BC(mg/L) :
· ABO/Rh
· GB
· Hb
· Plaquettes
· Coombs direct
· CRP
· ECBU
· Hémoculture
· Sérologie
· Echographie ..
· Autres bilans
· BT (mg/L)
IV. Non
Non
PRISE EN CHARGE
Photothérapie Oui Exanguino transfusion
Oui
Antibiothérapie Oui Non
Autres
V. EVOLUTION
|
Favorable
|
décès complication
|
Durée d'hospitalisation
46
TABLE DES M AT RES
£PIORAPH_.. I
DEDI ACE . 2
AVANT PROPOS .III
LITE. DES ABRE9IATI NS IV
LISTE DES TABLEAUX ET FIGURES . y
RESUME .VI
INTRODUCTION 1
OBJECTIF O£mARAL 2
;
;
l
;
THODES ET TECHNIQUES
CHOIX ET INTERE.T DU SUJET
DEL IMITATIONSPATIO TEMPORELLE
SUBDIVISION DU TRAVAIL
PREMIERE. PARTIE . LES CONSIDERATIONS THEORIQUES 4
CHAPITRE I:DEFINITION DES CONCEPTS 4
1.1. of 4
1.2. Epidérni o2é 4
1.3. Clinique 4
1: Priseen charge 4
1.5.Ict&e 4
1.6. Neonatal 4
CHAPITRE S:ICTERE KECNATAL£ 5
1DEFINITION 5
22.£PIDOLOGW 5
2.3. RAPPEL PHX7OLOGIQ ET METAEOLIÇUE DE t`HEMOLYSE
NORMAL, DE
LA SYNTHESE ET DE L'ELLVIINATION DE LA BIURI2INE 5
2a:.MECANISNIE DE t'HEMOLYSE PHY OLOÜlqT_TE 5
Figure L DIAGRAMME RECAPITULATIF DEGRADATION DES GLOBULES
ROUGES
S
2.4. £T OPATHOGENI DE t2CTERE NEONATAL 9
2.4.1. A BILURIBINE LIBRE 9
2.4.1.1. Hyper prod ta£de1 bilirubinepar hémolyse
9
4.1.2. Défa de transport plasmatique de la bilirubine
indirecte II
4.1.3. Anomalie de captation hépatique de la bilirubine
indirecte II
2.4.1.4. Anomalie de conjugaison de la bilirubine 12
2.4.2. A BILT_TRIBINE DIRECTE 14
47
2.4.2.1. Défaut d'élimination intestinale de la
bilirubine et stimulation du cycle entero-
hépatique
2.5. MAINIFESTATIONS CLINIQUES DE L'ICTERE NEONATAL 14
2.6. PARACLINIQUE 15
2.6.1. Le bilirubinométre transcutané 15
2.6.2. La bilirubinérnie 15
2.6.3. Le bilan étiologique 15
2.7. PRISE EN CHARGE DE L'ICTERE NEONATAL. 16
2.7.2. Les immunoglobulines pot ..alentes 16
2.7.3. La photothérapie 16
2.7.4. L: exsannuino-transth joli 19
2. 7. Antibiothérapie 20
Figures 4 et 5_ Courbes d'indication de la
photothérapie et exa gu no-transfusion 21
2.8. LES COMPLICATIONS DE L'ICTERE NEONATAL 22
L'encéphalopathie bilirubinique aigue 22
L'encéphalopathie bilinibinénuque chronique
22
DEUXIEME PARTIE : PAR 11b. PRATIQUE 23
CHAPITRE III : PRESENTATION DU LIEU DE. STAGE 23
SITUATION GEOGRAPHIQUE ET PRESENTATION 23
APERCU HISTORIQUE DE L'.HOPITAL Jason SENDW . 23
3. SUR LE PLAN ADMINISTRATIF 24
A. LA STRUCTURE ADMINISTRATIVE 24
B_ LA STRUCTURE MEDICALE 24
CHAPITRE V: MATÉRIELS ET NIETHODOLOGIE 26
CHAPITRE V : PRESENTATION DE RÉSULTATS 28
5.1 FRÉQUENCE GLOBALE DE L'ICTERE NEONATAL 28
5.2 CARACTERISTIQUES SOCIODEMOGRAPHIQUES DES PATIENTS 29
5.3 ASPECT CLINIQUE 30
5A ASPECT PARACLINIQUE 14
5.5 PRISE EN CHARGE .16
5.6 CARACTERI TIQUES EVOLUTIVES
·l 7
CHAPITRE VI : DISCUSSIONS
CONCLUSION 41
SUGGESTIONS ET RECOMMENDATIONS 41
RÉFÉRENCES 42
ANNEXES 44
FICHE DE RÉCOLTE DES DONNEES
TABLE DES MATURES 46
| 


