|

ÉíÈÚÔáÇ
ÉíØÇÑÞãíÏáÇ
ÉíÑÆÇÒÌáÇ
ÉíÑæåãÌáÇ
République Algérienne Démocratique et
Populaire
íãáÚáÇ
ËÍÈáÇ æ
íáÇÚáÇ
ãíÜáÚÊáÇ
ÉÑÇÒæ
Ministère de l'Enseignement Supérieur et de la
Recherche Scientifique
áÜÔáÇ
äÈ
ÉÈÜíÓÍ
ÉÜÚãÇÌ
íáÚæÈ
Université Hassiba Benbouali de Chlef
ÉÇíÍáÇ
æ ÉÚíÈØáÇ
ãæáÚ Éíáß
Faculté des Sciences de la Nature et de la Vie
Þ
ÇíÌæáæíÈáÇ
Département de Biologie
N° d'ordre : /20
MÉMOIRE
En vue de l'obtention du diplôme de
Master
Domaine : Sciences de la nature et de la vie
Filière
: science biologique.
Spécialité:Biologie Moléculaire
des Micro-organismes
Antibiorésistance des Bacilles à Gram
négatif non fermentants responsables des mammites en élevage
Bovin
Présenté par :
? SAHLI SALIHA .
? MENACER KHEDIDJA.
Soutenu publiquement le : 22/06/2022. Devant le jury:
Mr Sebaihia.M PROF
Université Hassiba Benbouali de Chlef Présidente
Mm Souna.D
Université Hassiba Benbouali de Chlef Encadreur :
MCA
Mm Ziani .M
Université Hassiba Benbouali de Chlef Examinatrice
MCA
Mr El salhi .M
Invité
Chlef
Vétérinaire
Année universitaire : 202119/2022

Remerciement
Louange à DIEU de nous avoir accordé la
santé et les moyens de réaliser ce travail.
En premier lieu,
nous tiens à remercier vivement madame Souna Djahida
Docteure,
à l'Université de Chlef, Directrice de thèse, qui nous
avons honoré d'avoir
Accepté l'encadrement de ce travail, en
étant toujours prêts à répondre à nos
interrogations
Et à soutenir notre travail.
En témoignage
de notre reconnaissance.
Nous remercions vivement ...
Monsieur Sebaihia
Mohammed, Professeur, à l'Université de Chlef, d'accepter
La
présidence de notre jury de thèse, Hommages
respectueux.
Madame Ziani M, Docteure, à l'Université de
Chlef, d'avoir accepté d'examiner notre thèse,
Sincères
remerciements.
Monsieur El Salhi Mohammed, Docteur en médecine
vétérinaire, qui nous
a fait l'honneur d'être membre de
notre jury de thèse et pour ces conseils et son aident du
travaille
au niveau des Fermes, Sincères remerciements.
Nous tiens à exprimer notre reconnaissance au
Laboratoire pédagogique de biologie moléculaire
au Travers
d'ingénieure madame, Mekrafe S pour leurs accueils, qualité
humaine, et les moyens de
mener à bien ce travail.
Nous remercie
tous les éleveurs des bovins laitier dans la wilaya de chlef pour nous
aident de faire
ce travail.
Nous remercie très sincèrement
tous ceux qui de près ou de loin ont contribué à la
réussite
De ce travail..
Dédicace
Au nom de Dieu le Miséricordieux
D'abord
et avant tout je remercie ALLAH de réussi à compléter ce
travail.
JE DEDIE CE MODESTE TRAVAIL
À ma maman, pour toute la
complicité qui nous unie, depuis mon enfance
jusqu'à ce jour.
Ce travail est une maigre récompense à ce que je te
dois.
À mon cher Papa «M'hammed», tu es toujours
présent dans ma vie et je
T'aime beaucoup.
A ma binôme
Khadidja
À mes soeurs : Rokaya ,Rahma
À mes chers amies:
Saida; Fatima ; Douae; Chiama; Imane, Chanaz, Ikram
À toute ma
famille et tous mes collègues sans exception.
Dédicace
ááå
ÏãÍáÇ
Tous mes remerciements et mes appréciations
seront À ma mère l'être le
plus cher de ma vie
À mon père qui
m'a fait de moi une femme
À l'honnête Saliha ma cher
binôme, amie et soeur
À mes cher soeurs Fatima Rafika et
surtout Djihane
À mon cher frère Abd El Basset et les petits
de la famille Menacer
Meriem El Batoul et Youssef
À mes chers
amies :Houria, Djamila, Yasmine, Wafa, Siham et Wafa
À tous ma
famille surtout ma tante Fatma et mon oncle Ahmed
À tous mes
collègues sans exception
Enfin, à tous ceux qui ont
collaboré à la réalisation de ce travail,
en
guise
De reconnaissance
I
ÕÎáã
ÕÎáã
ÊÇíÕÚáá
ÉíÑíÊßÈáÇ
ÉãæÇÞãáÇ
ÏíÏÍÊá
ÉÓÇÑÏáÇ åÐå
ÏåÊ ÇÐá
ãáÇÚáÇ
ìæÊÓã ìáÚ
íÆÇÐÛáÇ
äãáÇ áßÇÔã
äíÈ äã ÚÑÖáÇ
ÈÇåÊáÇ ÍÈÕ
Ç ÉÏã .áÔáÇ
ÉíáÇ æ í
ÉÈæáÍáÇ
ÑÇÞÈáÇÈ
ÕÇÎáÇ ÚÑÖáÇ
ÈÇåÊáÅÈ
ÉÈÇÕáÅÇ äÚ
ÉáæÄÓãáÇ æ
ÒæÊßáÇá
ÉÑãÎã ÑíÛáÇ
ãÇÑÞáÇ
ÉÈáÇÓáÇ
ÉÈæáÍ ÉÑÞÈ 200
ìáÚ ÉÑíÎáÇ
åÐå ÊãíÞ
.ÉíÑÇÌáÇ
ÉäÓáÇ äã áíÑ
ÑåÔ ÉíÇÛ ìáÅ
íÑí ÑåÔ äã
ÉíÇÏÈ ÑåÔ
ÉËáÇË ÊáãÔ
ÉÓÇÑÏáÇ äã%63
ÏíÏÍÊ ãÊ .
áÔáÇ ÉíáÇæ
áãÇß ìáÚ
ÉÚÒæã
ÉÚÑÒã 29 äã
ÊÇäíÚáÇ ÐÎ
ãÊ .ÉÚÇÖÑáÇ
ÉÑÊ ááÇÎ
ÉáÊÎã
ÊáÇáÇÓ ÉÏÚ
äã ÕÇÎáÇ
ØÓæáÇ ìæÊÓ ã
ìáÚ
ÉíÈÇÌíÅ
ÉäíÚ %50.93 äÚ
íÑíÊßÈáÇ
áíáÍÊáÇ
Ôß.ÇíäÑæíáÇß
ÑÇÈÊÎÅ äÚ
ÉÌÊÇäáÇ
ÉíÈÇÌíáÇÇ
ÊáÇÇÍáÇ
ÇåÚÈÊÊ)%50( Burkholderia cepacia
ÉááÇÓáÇ
ÈáÛÊ
ÉáæÒÚãáÇ
ÊÇíÕÚáÇ äã% 21.87
äíÈ äã .
ãÇÑÞáÇ
ÉÈáÇÓáÇ
ÊÇíÕÚáÇÈ äã
äíÊááÇÓ )%21?42(Pseudomonas
aeroginosa äã ÊáÇáÇÓ
ËáÇË Çåäã)%42,8
)PseudomonasÊáÇ áÇÓ äã
ÉÏÍÇæ
ÇíÑíÊßÈ ìáÅ
ÉÇÖáÅÇÈ )%7?14(Pseudomonas
fleurescen äã ÉááÇÓ æ
)% 14?28(Pseudomonas luteola
ÑÇÔÊäáÇÇ
ÞíÑØ äÚ
ÉíæíÍáÇ
ÊÇÏÇÖãáá
ÉíÑíÊßÈáÇ
ÉíÓÇÓÍáÇ
ÑÇÈÊÎÇ ãÊ
.)%7?14(Chryseobacteruim indologène
ÉááÇÓ
ÉÓÑÏãáÇ
ÉíæíÍáÇ
ÊÇÏÇÖãáá
ÈáÛ áÈÇÞã
ÉíÑíÊßÈáÇ
ÉãæÇÞãáÇ
ÉæÞ ÌÆÇÊäáÇ
ÊÏß ËíÍ
äæÊäíå
ÑÇíáã
íÒæáíÌáÇ
ØÓæáÇ ìæÊÓã
ìáÚ ÒæÊßáÇá
ÉÑãÎã ÑíÛáÇ
ãÇÑÞáÇ
ÉÈáÇÓáÇ
ÊÇíÕÚáá
ÉíäíÌáÇ
ÉíÕÇÎáÇ ÊÏß .
ÇíÑíÊßÈáÇ
áßá ÉíÓÇÓÍ
ÑåÙ íÐáÇ
äíÓÇßíãáÇÇ
ÁÇäËÊÓÇÈ
.ÉíÑíÊßÈ
ÊáÇáÇÓ
ÉÚÈÑ ÏäÚ bla VIM
ÊÇíãíäíÈÇÈÑßáÇ
ÉáÆÇÚáá
ãæÇÞãáÇ
ãíÒäáÅá
ÉÑÔãáÇ
ÉíËÇÑæáÇ
ÉãæáÚãáÇ
ÏæÌæ
ÉÑãÎã
ÑíÛáÇ
ãÇÑÞáÇ
ÉÈáÇÓáÇ
ÊÇíÕÚáÇ
ÉíæíÍáÇ
ÊÇÏÇÖãáá
ÉíÑíÊßÈáÇ
ÉãæÇÞãáÇ
áÔáÇ ÑÇÞÈáÇ
ÚÑÖáÇ
邌懂 :
ÉíÍÇÊãáÇ
ÊÇãáßáÇ
ÒæÊßáÇá
Résumé
RESUME
La mammite est devenue un problème de
sécurité alimentaire à travers le monde. Le présent
travail a pour but d'étudier l'Antibiorésistance des bacilles
à Gram négatif non fermentants responsables de mammites en
élevages bovins laitiers dans la wilaya de Chlef. L'étude a
été réalisée pendant 3 mois sur 200 vaches
laitières en période de lactation de différentes races
chez 29 fermes de bovins. La positivité du California mastitis test
(CMT) est constatée dans 63% des cas. L'examen bactériologique a
révélé un pourcentage d'échantillons positifs de
50,39% sur milieu des bacilles à Gram négatif. 21,87% des isolats
sont des bacilles à Gram négatif non fermentants, avec une
dominance de l'espèce Burkholderia cepacia (50%),suivi
par les espèces du genre Pseudomonas avec 42,85% (trois souche
Pseudomonas aeroginosa (21,28%), 2 souches Pseudomonas luteola
(14,28) et une souche Pseudomonas fleurescens (7,14%)) et une
souche de Chryseobacteruim indologène (7,14% ).Le test de
sensibilité aux antibiotiques a été réalisé
par la méthode de diffusion sur gélose Muller-Hinton
vis-à-vis de sept antibiotiques : Les résultats montrent une
forte résistance vis-à-vis de la plupart des antibiotiques
testés sauf pour l'amikacine qui présente une sensibilité
totale .La caractérisation génotypique d'antibiorésistance
des bacilles à Gram négatif non fermentants a confirmé la
présence du gène bla VIM chez quatre souches.
la mise en place de programme de contrôle de la mammite
contagieuse et de biosécurité est essentielle dans les troupeaux
laitiers en Algérie.
II
Mots Clé : Mammite ,Bovins, Chlef,
Antibiorésistance, Bacilles à Gram négatif non
fermentants
Abstract
Abstract
Mastitis has become a food safety problem throughout the
world. The present work aims to study the antibiotic resistance of
non-fermenting Gram-negative bacilli responsible for mastitis in dairy cattle
farms in the wilaya of Chlef. The study was carried out during 3 months on 200
lactating dairy cows of different breeds in 29 cattle farms.The positivity of
the California mastitis test (CMT) was found in 63% of cases. Bacteriological
examination revealed a percentage of positive samples of 50.39% on
Gram-negative bacilli medium. 21.87% of the isolates were non-fermenting
Gram-negative bacilli, with a dominance of Burkholderia cepacia
species (50%), followed by species of the genus Pseudomonas with 42.85%
(three Pseudomonas aeroginosa strains, 2 Pseudomonas luteola
strains and one Pseudomonas fleurescens strain) and one
Chryseobacteruim indologen strain (7.14%). Antibiotic susceptibility
testing was performed by the Muller-Hinton agar diffusion method against seven
antibiotics: The results show a high level of resistance against most of the
antibiotics tested except for amikacin which is fully susceptible. Genotypic
characterization of antibiotic resistance in non-fermenting Gram-negative
bacilli confirmed the presence of the bla VIM gene in four strains. The
implementation of contagious mastitis control and biosecurity programs is
essential in Algerian dairy herds.
III
Key words: Mastitis, Bovine, Chlef, Antibiotic
resistance, Non-fermenting gram-negative bacilli.
Table des Matières
TABLE DES MATIERES
ÕÎáã 4
RESUME...................................................................................................4
ABSTRACT................................................................................................
III
LISTE DES ABREVIATION 4
LISTE DES ANNEXES 4
LISTE DES FIGURES 4
LISTE DES TABLEAUX 4
INTRODUCTION..........................................................................................
01 PARTIE 01 : PARTIE BIBLIOGRAPHIQUE
CHAPITRE 01: BACILLES GRAM NEGATIF NON FERMENTANTS
1. Généralité sur les bacilles Gram
négatif non fermentants.............................................
04
1.1. Définition des bacilles à Gram négatif
non fermentants (BGN nf) 04
1.2. Caractères morphologiques et culturaux 04
1.3. Principaux germes isolés ... 05
1.3.1. Pseudomonas
aeruginosa...........................................................................
05
1.3.2. Acinetobacter 05
1.3.3. Brucella 06
1.3.4. Le Complexe Burkholderia cepacia
06
1.3.5. Stenotrophomonas maltophilia
08
1.3.6. Chryseobacterium indologenes
08
CHAPITRE 02 : MAMMITES EN ELEVAGE BOVIN LAITIER
1. Généralités sur les mammites des bovins
laitiers......................................................11
2. Différentes mammites rencontrées en
élevage bovin laitier.......................................11
2.1. Mammites
Latentes....................................................................................
11
2.2. Mammites
Subcliniques.................................................................................
11
2.3. Mammites
cliniques....................................................................................
12
2.3.1. Mammites
aiguës.......................................................................................
12
2.3.2. Mammites
suraiguës....................................................................................
12
Table des Matières
2.3.3. Mammite chronique .. 13
3. Etiologie des mammites rencontrées en
élevage du bovins Laitiers 13
4. Bactéries Mammo-pathogènes (agents
pathogènes responsables de mammites) .. 13
5. Principaux facteurs de risques 15
6. Diagnostic des Mammites en élevage bovin laitier
16
6.1. Le Taux cellulaire du Tank TCT 16
6.2. Le CCSI ou Comptage Cellulaire Somatique Individuelle
16
6.3. Le Test CMT ou Test de Mammite de Californie 16
6.4. D'autres tests de détection de mammites 16
7. Guérison spontanée 17
8. Traitement . 17
9. Effets de la mammite sur la santé humaine 18
CHAPITRE 03 : ANTIBIORESISTANCE
1. Antibiotiques 19
1.1. Définition des antibiotiques 19
1.2. Classification et action des antibiotiques 19
1.3. Les antibiotiques en médecine
vétérinaire 21
1.4. Antibiothérapie des Mammites en élevage
bovins laitiers dans le monde 22
1.4.1 Traitement antibiotique des vaches en lactation 22
1.4.2 Traitement antibiotique des mammites en première
intention 22
1.4.3 Plans de traitement au Tarissement 22
1.4.4 Antibiotiques utilisables en lactation 22
1.4.5 Antibiotiques utilisables au tarissement 22
2. Antibiorésistance 23
2.1. Types de résistance 23
2.1.1. Résistance naturelle 23
2.1.2. Résistance acquise 23
Table des Matières
2.1.3. Résistance croisée et
co-résistance ... 24
2.2. Vois d'acquisition des gènes de résistance
. 24
2.3. Antibiorésistance chez certain bactéries
à Gram négatifs non fermentants . 24
2.3.1. Pseudomonas aeruginosa 24
2.3.2 . Acinetobacter baumannii 25
2.3.3 . Chryseobacterium indologenes 25
2.4 . Utilisation des antibiotiques chez les animaux et le
développement de la résistance 25
PARTIE 02 : PARTIE EXPERIMENTALE
1. Matériel . 28
1.1. Animaux 28
1.2. Fiche d'enquête . 30
1.3. Matériel de prélèvements 30
1.4. Matériel de Laboratoire 30
1.3.1. Milieux de culture 30
1.3.2. Tests biochimiques et réactifs . 30
1.3.3. Solutions .. 30
1.3.4. Enzymes, Tampons et amorces 31
1.3.5. Antibiotiques 31
2. Méthodes .. 31
2.1. Prélèvements 31
2.2. Test de mammite de Californie (CMT) 32
2.3. Enrichissement 32
2.4. Isolement et purification 32
2.5. Conservation des souches 33
2.6. Coloration de Gram 33
2.6.1. Principe 33
2.6.2. Technique 33
2.6.3. Lecture ... 34
Table des Matières
2.7. Test d'oxydase 34
2.7.1. Principe 34
2.7.2. Technique 34
2.8. Galerie API 20NE 34
2.8.1 Principe 34
2.8.2. Technique 34
2.8.3. Lecture .. 35
2.9. Antibiogramme 35
2.9.1. Principe 35
2.9.2 Technique . 36
2.9.3. Lecture 37
2.10. Recherche de gènes de résistance par PCR
37
2.10.1. Extraction de l'ADN par Choc thermique 37
2.10.2. Dosage d'ADN par la spectrophotométrie 37
2.10.3. Amplification de l'ADN par PCR 38
2.10.4. Electrophorèse sur Gel d'agarose .. 39
PARTIE 03 : RESULTATS
1. Prélèvement 43
2. Identification des Germes responsable de mammites 49
3. Antibiorésistance des bacilles à Gram
négatif non fermentants . 54
4. Dosage d'ADN par spectrophotométrie 55
5. Recherche des gènes de résistance 57
PARTIE 04 : DISCUSSION 59
CONCLUSION 63
REFERENCES BIBLIOGRAPHIQUES 67
ANNEXES
IV
Liste des Abréviations
LISTE DES ABREVIATIONS
AK : Amikacine
AR : action rapide.
ATM : Aztréonam
BET : Bromure d'éthédium
BGN : Bacilles à Gram négatif
BGNF : Bacilles à Gram négatif
fermentants
BGNnF : Bacilles à Gram négatif
non fermentants
CA-SF : Comité de l'Antibiogramme de la
Société Francaise de Microbiologie
CAZ :
Céftazidime
CCSI : Comptage Cellulaire Somatique
Individuelle
CIP : Ciprofloxacine
CMT : California mastitis test
GNI : Gélose Nutritive Incliné
HL : hors lactation.
IMP : Imipénème
LA : longue action
MCF : McFarland
MH : Mueller-Hinton
NiT : Nitrate
PLP : penicillin binding proteins
PM : Poids moléculaire
PRL : Pipéracilline
QAD : Quartier Antérieur Droit
QAG : Quartier Antérieur Gauche
QPD : Quartier Posterieur Droit
QPG : QuartierPosterieur Gauche
R : Résistane
S : Sensible
TAE : Tris Acide Acétique Glacial EDTA
V
Liste des Abréviations
TCC : Ticracilline / Acide clavulanique
TCT : Taux cellulaire du Tank
TDA : Tris Acide Acétique Glacial
EDTA
UV : Ultra-Violet
VI
Liste des Annexes
LISTE DES ANNEXES
Annexe 01 Questionnaire
Annexe 02 Compositions chimiques des milieux
de culture
Annexe 02 Tableau de lecture API 20 NE
Annexe 03 Comité de l'antibiogramme de
la société française de microbiologie
Annexe 04 Tableau de préparation de
tampon TAE
Annexe 05 Catalogue d'identification de
Galerie API 20NE
Annexe 06 Résultats d'antibiogramme
VII
Liste des Figures
LISTE DES FIGURES
Figure 01. Cibles des principaux
antibiotiques . 19
Figure 02. Cycle de? lactame . 20
Figure 03. Classification des?-lactamines ...
21
Figure 04. Voies d'acquisition de
résistance aux antibiotiques 24
Figure 05. Localisation géographique
de différentes fermes dans la wilaya de Chlef . 28
Figure 06. Disposition des antibiotiques sur
les boîtes d'antibiogrammes .. 37
Figure 07. Test CMT positif du lait .. 44
Figure 08. Résultat de CMT de 200
vaches laitières 44
Figure 09. fréquence de mammites en
fonction des mois de prélèvements .. 45
Figure 10. Fréquence de mammites en
fonction des communes de la wilaya de Chlef 45
Figure 11. Fréquence des cas de
mammites en fonction de stade de lactation .. 46
Figure 12. Fréquence de mammites en
fonction de rang de lactation . 46
Figure 13. Fréquence de mammites en
fonction de l'Age de bovins 47
Figure 14. Fréquence de mammites en
fonction de déférentes races des bovins 47
Figure 15. Fréquence de mammites en
fonction de l'état des étables 48
Figure 16. Fréquence de mammites en
fonction du Score d'hygiène de vache . 48
Figure 17. Résultat des
échantillons des prélèvements analysés 49
Figure 18. Répartition des bacilles
à Gram négatif .. 49
Figure 19. Répartition des
espèces identifiées . 50
Figure 20. Aspects des colonies des BGNnFsur
milieu Mac Conkey 52
Figure 21. Résultat de la coloration
de Gram . 52
Figure 22. Test oxydase positif . 53
|
Figure 23. Identification biochimique des BGNnF
par les Galerie API 20 NE et API
20E
|
54
|
Figure 24. Profil d'antibiogramme de P.
aeruginosa.................................................. 55
Figure 25. Pourcentage de Résistance
des bacilles à Gram négatif non fermentants aux
des antibiotiques 56
Figure 26. Résultats de la PCR
blaTEM 57
Figure 27. Résultats de la PCR
blaVIM 58
VIII
Liste des Tableaux
LISTE DES TABLEAUX
Tableau 01. Déférentes
espèces de complexe
B.cepacia............................................. 07
Tableau 02. Principaux caractéristiques
des bactéries contagieuses et environnementales retrouvées dans
les infections intra-mammaires chez la vache
laitière 14
Tableau 03. Type d'activité et
modalités d'action des principales classes
d'antibiotiques 20
Tableau 04. Liste des fermes
sélectionnée pour prélèvements . 29
Tableau 05 Lecture et interprétation du
test CMT 32
Tableau 06. Produits du mix pour la PCR 38
Tableau 07. Les amorces
d'oligonucléotidiques utilisées pour la PCR 38
Tableau 08. Subdivision des
Prélèvement réalisé dans les communes de wilaya de
chlef 43
Tableau 09. Fréquence des isolats
identifiée 50
Tableau 10. Répartition des
espèces identifiées en fonction de site de
prélèvement 51
Tableau 11. Résultats de dosage d'ADN par
spectrophotomètre 57

1
Introduction
Introduction Général
Une mammite est une inflammation d'un ou de plusieurs
quartiers de la mamelle, provoquée majoritairement par une infection
bactérienne. Elle se rencontre généralement chez les
vaches en lactation (Gambo et Agnem, 2001). Elle a bien
évidemment un impact financier pour l'éleveur (lait non produit
ou non commercialisé, réforme des vaches incurables, et
coût des soins) mais aussi un impact sur la santé publique par
l'utilisation quasi systématique d'antibiotiques.
L'Algérie est le premier consommateur laitier du
Maghreb et le troisième importateur mondial de la poudre de lait
après l'Italie et le Mexique. La consommation moyenne de lait est de 147
L/habitant/an (Hamlaoui, 2017). Les effectifs bovins
représentent 1,9 millions de têtes dont 52% de vaches
laitières en Algérie (Ferreira et al.,
2013).
Considérant les vaches produisent environ 84 % de la
production mondiale totale de lait, la mammite bovine menace l'industrie
laitière notamment en raison de son incidence et de son impact
économique sur la production et la qualité du lait
(Halasa et al., 2007). Elle représente aussi le premier
poste de consommation d'antibiotiques avec deux traitements par vache et par an
en moyenne, et la première source de pollution du lait par des
antibactériens (Barrot Debreil, 2008).
La mammite, problème radicale qui apparait dans chaque
élevage de bovin (Descoteaux, 2004), il s'agit d'une
inflammation intra-mammaire dont l'origine la plus fréquente est la
pénétration d'une bactérie dans un quartier par le canal
du trayon (Remy, 2010). Ces maladies multifactorielles se
rencontrent généralement chez les vaches en lactation
(Frihi et Hadjadj, 2019). La principale cause de la mammite
est l'invasion et la colonisation de la glande mammaire par des agents
pathogènes opportunistes (Keane, 2019 ; Burvenich et al.,
2003).Ces derniers recourent à stratégies originaux
pour persister dans la glande mammaire, comme la formation de biofilm
(Melchior, 2011). Parmi ces pathogènes, les bacilles
à Gram négatif non fermentants (pathogènes mineures)qui
possèdent un niveau de résistance naturelle élevé
d'une part, en relation avec différents mécanismes de
résistance : sécrétion d'enzymes,
imperméabilité membranaire et efflux et d'autre part, leurs
capacité d'acquérir de nouveaux mécanismes de
résistance (Lepape, 2007). L'émergence rapide de
la résistance bactérienne aux nouveaux composés
antimicrobiens soulève des inquiétudes concernant la
stratégie de traitement des infections causées par ces
pathogènes.
La plupart des élevages en Algérie ne sont
soumis à aucun contrôle laitier régulier, par
conséquent, la fréquence des mammites cliniques et subcliniques
est élevée (Beroual, 2003). Pour cela notre
objectif de travail est de rechercher la présence des bacilles à
Gram négatif non fermentants responsable de mammites en élevage
bovin au niveau de différentes fermes dans la wilaya de Chlef.
2
Introduction
Ainsi, d'étudier la sensibilité des souches
isolées vis-à-vis de différentes familles d'antibiotiques
selon les étapes suivantes:
> Réalisation des prélèvements aux
niveaux de 33 fermes dans la wilaya de Chlef ;
> Détection rapide des mammites par le Test CMT;
> Isolement et purification des bacilles à Gram
négatif non fermentants responsables de
mammites ;
> Identification des souches par galerie API 20NE et API 20 E
;
> Détermination de profil d'Antibiorésistance
des germes isolés par antibiogramme ;
> Recherche des gènes de résistance (blaTEM
et blaVIM) de quelques souches sélectionnées.
3

4
Chapitre 01 : Bacilles à Gram négatif non
fermentant
2. Généralité sur les bacilles
à Gram négatif non fermentants 2.1. Définition des
bacilles à Gram négatif non fermentants (BGNnf)
Les bacilles Gram-négatifs non-fermentaires (BNGnf)
sont un groupe hétérogène de microorganismes
aérobies strictes, qui n'ont pas la capacité de fermenter les
hydrates de carbone pour obtenir de l'énergie (Deliberali et
al., 2011; Radice et al., 2011). Ces organismes sont
omniprésents dans la nature, notamment dans le sol et l'eau. Dans
l'environnement hospitalier, ils peuvent être isolés à
partir d'instruments tels que les humidificateurs des machines à
ventilation, les matelas et d'autres équipements ainsi qu'à
partir de la peau des corps médicales Ils sont apparus comme
d'importants pathogènes opportunistes dans la population croissante de
patients immunodéprimés (Mellmann et al.,
2009), chez les animaux ces derniers sont pathogènes (exemple :
Pseudomonas aeruginosa) (Avril et al .,
2000).
Il existe plus de 120 espèces classées comme
pathogènes, parmi lesquelles Pseudomonas aeruginosa,
Acinetobacter baumannii, Stenotrophomonas maltophilia et
Burkholderia cepacia (Deliberaliet al., 2011;
Radice et al., 2011).
Parmi les bacilles à Gram négatif, 10 à
15% sont des BNGnf dont les 3/4 appartiennent à l'espèce
Pseudomonas aeruginosa. Les autres espèces appartiennent aux
genres: Stenotrophomonas, Burkholderia, Acinetobacter et Achromobacter
(Martin, 2011).
Ces bactéries acquièrent une résistance
élevée à une grande variété de
médicaments, notamment les pénicillines, les
céphalosporines, les aminoglycosides, les tétracyclines, les
fluoroquinolones, le trimétropim-sulfaméthoxazole, les
carbapénèmes et les polymixines (Grillo et al.,
2013).
L'analyse du degré de sensibilité et de
résistance des bacilles Gram négatif non fermentants est
essentielle pour une meilleure compréhension de
l'épidémiologie des infections causées par ces
microorganismes, en plus de contribuer à la proposition de nouveaux
schémas thérapeutiques pour les combattre plus
efficacement (Menezes et al.,2004 ; McGowan,2006 ;Pontes
et al.,2006).
2.2. Caractères morphologiques et culturaux
Les bacilles à Gram négatif se présentent
sous forme de bacilles longs et fins à extrémité
effilée `Bâtonnets' (Pseudomonas) (Hafiane et
Ravaoarinoro, 2008), mais également sous forme de diplobacilles
à extrémité arrondie avec des formes coccoïdes
`coccobacilles' et longues (Acinetobacter) (Doughariet al.,
2011). Ils sont mobiles grâce à la présence d'un
flagelle (Pseudomonas) (Hafiane et Ravaoarinoro, 2008), ou
immobile (Acinetobacter) (Roca et al., 2012).
5
Chapitre 01 : Bacilles à Gram négatif non
fermentant
En général, les bacilles à Gram
négatif non fermentants croissent sur milieux simples comme la
gélose Trypto-Caséine Soja (TSA) et la gélose
lactosée de Drigalski. Certaines de ces bactéries
élaborent des pigments :
? La pyocyanine, pigment bleu-vert, de Pseudomonas aeruginosa
;
? Des pigments allant du jaune pâle au jaune orangé
peuvent être produits par diverses espèces au
sein des genres Pseudomonas, Flavobacterium et Xanthomonas
(Diop, 2001).
2.3. Principaux germes isolés
2.3.1. Pseudomonas aeruginosa
Ce sont des bacilles à Gram négatif,
aérobies stricts, possèdent une oxydase, non fermentaires,
mobiles par une ciliature polaire, respirant ou non les nitrates, oxydant ou
non le glucose. Les espèces les plus fréquemment isolées
en milieu médical sont : Pseudomonas aeruginosa,
Pseudomonas stutzeri, Pseudomonas fluorescens et
Pseudomonas putida (Schuster, 2001).
Ces bactéries occupent des niches écologiques
variées, mais se retrouvent plus particulièrement dans les
milieux humides tels que les eaux douces, les eaux de mer et les eaux
thermales. Elles sont considérées comme une flore commensale chez
l'homme ou l'animal. Certaines jouent un rôle pathogène dont
P. syringae chez les plantes et P. aeruginosa chez l'homme et
l'animal (Avril et al.,2000).
Les Pseudomonas sont peu virulents pour l'individu normal, par
contre ils sont considérés comme des agents infectieux
redoutables lorsque les défenses immunitaires du sujet sont
altérées (Avril et al.,2000).
P. aeruginosa dispose d'un impressionnant arsenal de
facteurs de virulence, qui lui permet de combattre les défenses de
l'hôte tell que le flagelle, les pili, la production d'alginate, le
lipopolysaccharide, les facteurs de sécrétion de type III, les
protéases sécrétées, les facteurs d'oxydation et
les toxines (Pier et Ramphal, 2005),La détection du
quorum peut réguler l'expression des facteurs de virulence
(Heurlieret al., 2006).
2.3.2. Acinetobacter
Les bactéries du genre Acinetobacter appartiennent
à la famille des Moraxellaceae et Acinetobacter baumannii
est l'espèce la plus fréquemment identifiée dans les
infections humaines .Ce sont des coccobacilles, courts, Gram négatif,
non sporulées, parfois capsulés, immobiles (mais pouvant
présenter une mobilité par saccade résultant de la
présence de fimbriae polaires) (Peleget
al.,2008).
Acinetobacter baumannii est également
largement répandu dans l'environnement. Il est
généralement non pathogène chez les individus sains, sauf
peut-être en tant qu'agent d'infection des
6
Chapitre 01 : Bacilles à Gram négatif non
fermentant
plaies (Jones et al., 2006 ; Davis et
al., 2005),Au cours de la dernière décennie, il est
devenu une cause croissante d'infection opportuniste grave. Un grand nombre de
souches de cette espèce qui provoquent des épidémies ont
impliqué des souches multirésistantes, notamment aux
carbapénèmes et à l'amikacine, à la colistine et
à la tigécycline. L'amikacine, la colistine et la
Tigécycline représentant parfois la seule option
thérapeutique restante (Bogaerts et al., 2006 ;
Coelho et al., 2006).
Acinetobacter ssp est un germe ubiquitaire
retrouvé dans les sols, l'eau potable, les eaux de surface ainsi que
dans diverses denrées alimentaires (Lambert, 2007).Les
facteurs de virulence sont limités, ce qui correspond au potentiel
invasif limité de l'organisme. Il ne produit pas de cytotoxines et son
lipopolysaccharide à un potentiel endotoxigène incertain. Sa
survie accrue est due à la combinaison de la production de
bactériocines, de la présence d'une capsule et d'une
viabilité prolongée dans des conditions sèches
(Wendt et al., 1997).
2.3.3. Brucella
Les Brucella sont de petits bacilles à Gram
négatif, aérobies stricts, oxydase positifs,
catalase positive. Ce sont des coccobacilles de 0,5 à 1,5
ìm de long et 0,5 à 0,7 ìm de diamètre, non
capsulés, qui comprennent trois espèces principales Brucella
melitensis, Brucella abortus et Brucella suis, qui sont
responsables d'une maladie animale transmissible à l'homme, la
brucellose (Fièvre de Malte) (Denis et
al.,2007).
Les Brucella sont responsables d'infections génitales
avec avortement chez les femelles et lésions testiculaires chez le
mâle. Ils pénètrent dans l'organisme par plusieurs voies:
cutanée, digestive, respiratoire, puis gagnent par voie lymphatique le
premier relais ganglionnaire. Elles se multiplient et disséminent dans
tout l'organisme par voie lymphatique et sanguine, ces germes sont
phagocytés plus au moins rapidement par les macrophages puis
détruits avec libération d'antigène et d'endotoxine
(Khetab et al.,2010).
2.3.4. Le complexe Burkholderia cepacia
Bacille à Gram négatif non fermentant,
aérobie strict, mobile grâce à plusieurs flagelles
polaires, présentant une oxydase lente, Burkholderia cepacia a
été décrit pour la première fois en 1950 par Walter
Burkholder comme une bactérie phytopatogène isolée
à partir d'un bulbe d'oignon dont il causait la porriture (cepa =
oignion).En 1977, Vandamme et al., ont montré
que l'espèce Burkholderia cepacia était en fait un
ensemble de cinq génomovars désigné sous le nom de
(complexe B. cepacia), dont seulement trois individualisés en
espèces (B.multivoran, B. stabilis et B.
vietnamiensis) (Vandamme et al.,1997).Le terme
génomovars est utilisé pour différencier des souches
phénotypiquement similaires mais génotypiquement
hétérogènes. Ainsi, les génomovars
7
Chapitre 01 : Bacilles à Gram négatif non
fermentant
présentent des génotypes spécifiques mais
ne peuvent être distingués par les tests biochimiques usuels
employés en laboratoire (Courtney et
al.,2004), Actuellement, le complexe cepacia
présente neuf génomovars (tableau 1).Les
souches sont des bactéries ubiquistes dans l'environnement. Elles sont
retrouvées dans le sol, sur les végétaux et dans l'eau.
Tableau 1.Déférentes
espèces de complexe B.cepacia (Courtney et al.,
2004)
|
Génomovar
|
Nom
|
|
Génomovar I
|
B. cepacia sensa stricto
|
|
Génomovar II
|
B.multivorans
|
|
Génomovar III
|
B. cenocepacia
|
|
Génomovar IV
|
B. stabilis
|
|
Génomovar V
|
B.vitenamiensis
|
|
Génomovar VI
|
B. dolosa
|
|
Génomovar VII
|
B. ambifaria
|
|
Génomovar VIII
|
B. anthina
|
|
Génomovar IX
|
B.pyrrocinia
|
Un certain nombre de facteurs de virulence potentiels ont
été identifiés, bien qu'il n'ait pas été
prouvé que tous ces facteurs avaient un impact sur la santé (la
pathogenèse de la maladie humaine) (Mahenthiralingam et
al., 2005). Ces facteurs comprennent les résistances
antimicrobiennes intrinsèques (par exemple aux polymyxines et aux
aminoglycosides), la capacité à former des biofilms, des pili
(Jones et al., 2001). Le complexe B. cepacia
est impliqué dans trois groupes d'infections :
? Infections nosocomiales
(bactériémies, infections respiratoires, abcès...) ;
? Infections sévères chez les
immunodéprimés (bactériémies chez les
drépanocytaire...) ;
? Colonisation ou infection respiratoire dans le
cadre de mucoviscidose (Segonds et Chabanon,
2001).
2.3.5. Stenotrophomonas maltophilia
Le genre Stenotrophomonas est classé dans la famille
des Xanthomonadaceae (ordre des Xanthomonadales, classe des
Gammaproteobacteria) et comporte à ce jour quatre autres espèces.
S. maltophiliaest une bactérie ubiquiste retrouvée au
sein de divers environnemet et occupant des
8
Chapitre 01 : Bacilles à Gram négatif non
fermentant
niches écologiques à l'interieur et à
l'exterieur de l'hopitale. Cette espèce est présente dans le sol,
les végétaux(blé, canne à sucre, tournesol...) et
divers sources d'eaux (eaux de surface, puits,eaux usées... ). Elle a
été également ésolée à partir de lait
cru de vache et de brebis, de lait pasteurisé et d'aliments
réfrigérés. Chez l'homme sain, cette espèce peut
etre isolée des fèces, de la gorge ou des mains, mais le portage
semble peut fréquent chez l'animal, S. maltophilia a
été mise en évidence chez des poissons, dans les
fèces de lapins de lézard et de grenouilles, dans le cloaque des
serpents et dans l'intestin des rongeurs de laboratoire (Denton et
Kerr, 1998).
La transmission nosocomiale de S.maltophiliaest rare
et la plupart des infections sont dues à des souches uniques. Il est
associé à une importante morbidité et de mortalité
chez les patients immunodéprimés (Nseir et
al.,2006).
Les facteurs de virulence comprennent une gamme d'exoenzymes
tels que la DNase, RNase, la fibrinolysine, les lipases, l'hyaluronidase, la
protéase et l'élastase. Les bactériémies
liées aux cathéters veineux centraux et aux pneumonies
nosocomiales sont les deux manifestations les plus fréquentes de
l'infection vraie due à S. maltophilia. Des taux de
mortalité de 10 à 60 % chez les patients présentant une
bactériémie due à S. maltophilia ont
été rapportés (Pathmanathan et Waterer,2005;
Feldman et al., 2002).
1.3.6 Chryseobacterium indologenes
Les espèces de Chryseobacterium sont des bacilles
Gram-négatifs oxydase-positifs et ne fermentant pas le glucose qui sont
largement distribués dans la nature, et peuvent être isolés
des milieux aquatiques, du sol, des plantes et de certains produits
alimentaires (Zamora et al., 2012).
Chryseobacterium indologenes (anciennement Flavobacterium
indologenes) est l'espèce cliniquement la plus importante du genre,
provoquant des pneumonies, des bactériémies, des
septicémies ainsi que des infections intra-abdominales et des voies
biliaires. Principalement pathogène opportuniste, C. indologenes
infecte les nouveau-nés et les hôtes
immunodéprimés de tous les groupes d'âge (Reynaud
et al., 2007 ; Smith et al., 2012). Cependant, le
potentiel épidémiologique de cet organisme ainsi que les sources
d'infections ne sont pas encore clairs. Bien que peu fréquentes, des
infections nosocomiales acquises par des dispositifs médicaux contenant
des fluides et des sources d'eau contaminées dans les hôpitaux ont
été signalées (Bayraktar et al., 2007 ;
Lin et al., 2010).
La connaissance de leur distribution dans l'environnement
marin est également rare et seules quelques études ont
documenté la présence de C. indologenes, principalement
dans les crevettes
9
Chapitre 01 : Bacilles à Gram négatif non
fermentant
(Matyar et al., 2008 ; Uyaguar et
al., 2009) et les phoques (Bogomolni et al.,
2008 ; Rose et al., 2009).
10

11
Chapitre 02 : Mammites en Elevage Bovin Laitier
1. Généralités sur les mammites des
bovins laitiers
Une mammite est l'inflammation d'un ou de plusieurs quartiers
de la mamelle. L'étiologie principale est infectieuse. Elle se traduit
dans la majorité des cas par une réponse inflammatoire de type
cellulaire impliquant une augmentation de la concentration en cellule dans le
lait (Barone, 2001). C'est une inflammation du tissu de la
mamelle qui affecte la production de lait et entraîne des changements
pathologiques tels que le gonflement, la douleur, l'oedème,
l'inflammation et la fibrose de la mamelle (Shaheen et al.,
2016).
Cette maladie résulte de l'invasion des tissus de la
mamelle par des espèces procaryotiques (bactéries) et
eucaryotiques (mycoses et algues), suivie d'une infection des glandes mammaires
(Bradley, 2002).La mammite est considérée comme
l'une des pathologies les plus importantes, fréquentes et
coûteuses affectant les vaches laitières (Boutet et
al., 2005 ;Bradley, 2002),et la plus pénalisante pour les
élevages laitiers (Remy, 2010) en fonction de l'agent
pathogène responsable (Gröhn et al.,
2004).
De nombreux problèmes de santé peuvent
également résulter de la moindre qualité de la
matière première. En effet, la présence de
bactéries dans le lait suite à la traite d'animaux
infectés peut entraîner la contamination tout au long de la
chaîne de production laitière, provoquant des intoxications
alimentaires (Saidiet al., 2021).
2. Les différentes mammites rencontrées en
élevage bovin laitier 2.1. Mammites Latentes
Lors d'une mammite latente, la vache n'exprime pas de signe
clinique et son lait n'est pas modifié. En effet, malgré la
présence du pathogène la mamelle ne réagit pas. Ces
mammites sont pourtant extrêmement dangereuses puisqu'elles peuvent
entraîner rapidement une contamination de tout le troupeau laitier sans
que l'éleveur ne s'en aperçoive (Remy, 2010).
2.2. Mammites Subcliniques
La mammite subclinique est une évolution de la mammite
latente, mais elle peut aussi correspondre à une mammite clinique
traitée mais dont le traitement n'a pas réussi à
éliminer totalement le pathogène. Ces derniers
caractérisés par une absence de signes cliniques et par une
modification de la composition chimique du lait (baisse des taux de
caséine et de lactose, augmentation des taux d'électrolytes).
L'inflammation due à l'infection s'accompagne essentiellement d'un
afflux de
12
Chapitre 02 : Mammites en Elevage Bovin Laitier
cellules somatiques dans le lait du quartier infecté,
particulièrement les polynucléaires. Neutrophiles. Le comptage
cellulaire dans le lait dépasse alors 300 000 cellules/ml contre moins
de 150 000 cellules/ml chez une primipare saine et moins de 200 000 cellules/ml
chez une multipare saine (Remy, 2010; Institut de l'élevage,
2008). Les variations sont uniquement microscopiques et la mammite
reste asymptomatique (Bardiau etal.,2014 ).
2.3. Mammites cliniques
La mammite clinique se manifeste par une modification de la
sécrétion lactée (lait aqueux, présence de
grumeaux....) avec présence des signes primordiaux de l'inflammation
(douleur, rougeur, chaleur, gonflement). Dans certains cas, la mammite clinique
peut être accompagnée de symptômes généraux
tels que la fièvre, la déshydratation de l'animal et faiblesse
(Desteaux, 2004).Il est important de noter qu'une mammite
subclinique peut devenir clinique si l'immunité de la vache ne parvient
plus à assurer une stase bactérienne. De même une mammite
clinique peut devenir subclinique si le traitement administré ne
parvient pas à éliminer la totalité des pathogènes
impliqués (Remy, 2010).La mammite clinique peut
être suraigüe, aigue ou chronique :
2.3.1. Mammites aiguës
La douleur et la chaleur associées au quartier
caractérisent les douze premières heures de l'infection,
vingt-quatre heures après l'entrée des germes, apparaît
l'altération du lait et du tissu mammaire : un oedème
interstitiel dû aux toxines et à la migration leucocytaire se
forme. On note par ailleurs une hyperthermie modérée autour de
39-39,5°C (Remy, 2010).Elles peuvent survenir à
tous les stades de la lactation; toutes les bactéries peuvent provoquer
ce type d'inflammation de la mamelle (Victor, 2007).
2.3.2. Mammites suraiguës
La mammite suraiguë se caractérise par la
rapidité de leur apparition et de leur évolution, souvent
mortelles en l'absence de traitement, surviennent généralement
quelques jours après le vêlage. Elles peuvent revêtir deux
formes chez les bovins, la forme paraplégique et la forme
gangréneuse. La forme paraplégique est associée le plus
souvent aux coliformes. Elle est caractérisée par une agalaxie
brutale, une toxémie, une hyperthermie, une hypocalcémie, de la
tachycardie, de l'anorexie, l'atonie du rumen et de la diarrhée. Le
quartier atteint est chaud, enflé et douloureux. Le lait peut être
blanc avec une consistance aqueuse ou devenir jaune et séreux avec des
caillots observables à l'épreuve du bol à fond noir
(Remy, 2004; Green et al.,1998).
13
Chapitre 02 : Mammites en Elevage Bovin Laitier
2.3.3. Mammite chronique
Elle est le plus souvent secondaire à une mammite
aiguë. Les symptômes locaux sont discrets, lentement le quartier
évolue vers l'atrophie du fait de l'installation de zones de fibrose
cicatricielle. La mamelle devient noueuse à la palpation. La
sécrétion n'est souvent modifiée qu'en début de
traite. L'évolution est lente vers le tarissement de la
sécrétion au bout de plusieurs mois. Tous les germes donnant des
mammites peuvent être isolés (Noireterre,
2006).
3. Etiologie des mammites rencontrées en
élevage du bovins Laitiers
Les mammites sont presque exclusivement d'origine
bactérienne. Exceptionnellement, elles peuvent être causées
par des champignons, des parasites, des agents chimiques, un traumatisme (comme
un choc violent ou une agression de la peau du quartier ou du trayon), ou une
sténose (engendrée par un dysfonctionnement de la machine
à traire ou un papillome) (Remy, 2010).
4. Bactéries Mammo-pathogènes (agents
pathogènes responsables de mammites)
À ce jour, plus de 140 espèces potentiellement
pathogènes de bactéries (dont Mycoplasma), de champignons,
d'algues et de virus sont à l'origine de la mammite bovine
(Watts, 1988 ; Petrovski et al., 2011).
Les bactéries responsables de mammites peuvent
être distinguées en deux groupes. Le premier groupe est
constitué par des bactéries qui vivent sur la vache et se
transmettent d'animal à animal ou d'un quartier à un autre
à l'occasion du processus de la traite. Ces bactéries sont
à l'origine de l'apparition dans les élevages laitiers de
mammites contagieuses. Le deuxième groupe des bactéries
responsables de mammites est constitué des germes qui vivent dans
l'environnement de la vache. Ces germes contaminent directement la mamelle
entre les traites (lors du couchage) par simple contact avec la litière
qui est une source majeure de contamination favorable à la
multiplication des germes dans le cas où l'environnement des animaux est
mal entretenu.(Georges et al., 2008).
Parmi les bacilles à Gram négatif qui provoquent
la mammite, il s'agit principalement des bactéries appartenant à
la famille des Enterobacteriaceae et à la famille des
Pseudomonadaceae (plus particulièrement Pseudomonas
aeruginosa) (Spiers et al., 2000).
Les bactéries impliquées dans les mammites
bovines ont été classées en fonction de leur impact sur la
santé du pis. On distinguait alors les bactéries
pathogènes mineures, responsables d'une réaction inflammatoire
légère, et des bactéries pathogènes majeures
responsables quant à elles de réactions
14
Chapitre 02 : Mammites en Elevage Bovin Laitier
inflammatoires sévères pouvant entraîner la
mort de la vache (Vanderhaegen et al., 2014 ; Reyher et
al., 2010) (tableau 02).
Tableau02. Principaux caractéristiques
des bactéries contagieuses et environnementales
retrouvées
dans les infections intra-mammaires chez la vache
laitière(Blowey et Edmonson, 2010)
|
Propriétés
|
Bactéries contagieuses
|
Bactéries environnementales
|
|
Espèces
|
Staphylococcus aureus Staphylocoques à
coagulase
négative
Streptococcus agalactiae Streptococcus dysgalactiae
Corynebacteriumbovis Mycobacterium bovis
|
Streptococcus uberis Streptococcus dysgalactiae
coliformes (Escherichia coli et Klebsiellaspp.)
Staphylocoques à coagulase négative
Trueperellapyogenes Bacillus cereus
Pasteurella
|
|
Source(s)d'infection
|
Principalement par les autres quartiers infectés mais
aussi par la peau des trayons et du pis
|
Environnement contaminé : litière, eau, plantes,
fumier, mouches et peau de la vache
|
|
Mode de transmission
|
Transmission d'une vache à
l'autre durant la traite par l'intermédiaire d'un
vecteur
|
Contamination des trayons entre les
traites par contact direct avec environnement contaminé
|
|
Type de mammite
|
Mammite souscliniqueMajoritaire
Comptage Cellulaire Somatique
augmenté
|
Mammite clinique majoritaire
Comptage Cellulaire Somatique
pouvant être très élevé au moment de
la mammite mais redevenant rapidement normal
|
Chapitre 02 : Mammites en Elevage Bovin Laitier
5. Principaux facteurs de risques (Serieys,
2015)
? La température de la litière :
elle ne doit pas excéder 40 °C à 10 cm de
profondeur, soit 30°C en surface. Plus élevée, elle
deviendra très favorable au développement des germes
d'environnement
? Les manchons trayeurs : une collerette de
manchon usée, un manchon rayé constituent une niche pour les
germes, permettent leur transmission. Des manchons mal adaptés
favorisent l'agression du trayon.
? L'anneau de compression sur le haut du trayon :
s'il est normal en début de lactation, il devient un indicateur
de risque, puis un facteur de risque si plus de 10% des vaches sont atteintes.
Il indique un phénomène de « grimpage » des faisceaux
responsable d'une traite incomplète. Ce phénomène peut
être associé à des faisceaux trop légers, un vide
trop élevé, ou des manchons inadaptés. L'anneau de
compression peut, au contraire, être la conséquence d'une
surtraite.
6. Diagnostic des Mammites en élevage bovin
laitier
Un bon diagnostic de l'infection et de l'agent
pathogène en cause, et cela de façon rapide, permettra d'adapter
le traitement et d'obtenir un taux de guérison élevé.
Différents outils sont à la disposition du
vétérinaire mais également du producteur (Viguier
et al., 2009 ; Wallace, 2007). On peut citer certain
méthodes de diagnostic :
6.1. Le Taux cellulaire du Tank TCT
Il donne une idée de la situation sanitaire du troupeau
laitier. Il correspond en quelque sorte à une moyenne des Concentrations
Cellulaires Somatiques Individuelles (CCSI) des vaches du troupeau
(Noireterre, 2006).
6.2. Le CCSI ou Comptage Cellulaire Somatique
Individuelle
Le Comptage Cellulaire Somatique Individuelle correspond
à la moyenne des taux cellulaires des quatre quartiers d'une vache
(Pezon et Gremy, 2015 ;Noireterre, 2006).
Une relation linéaire inverse a été
définie entre un CCS faible (par exemple <100 000 cellules ml-1) et
une qualité de lait élevée, ainsi qu'un CCS
élevé (par exemple >200 000 cellules ml-1) et une
qualité de lait en déclin (Sharma et al., 2011 ;
Bradley, 2002).
15
6.3. Le Test CMT ou Test de Mammite de
Californie
16
Chapitre 02 : Mammites en Elevage Bovin Laitier
Le test CMT est également appelé test au
Leucocytes. C'est un test très simple, directement réalisable en
salle de traite par l'éleveur et peu onéreux. Le résultat
est visible à l'oeil nu et n'est donc pas quantitatif contrairement au
TCT et aux CCSI (Salat, 2014 ; Dudouet, 2004).
Le CMT, lorsqu'il est réalisé
régulièrement, présente les mêmes indications que le
comptage cellulaire individuel. Il a l'avantage, par rapport à ce
dernier, d'être moins coûteux, de pouvoir être
réalisé par tous les éleveurs et de fournir une image plus
précise des infections en donnant des résultats quartier par
quartier. Il peut également être utilisé pour
vérifier, voire sélectionner les animaux à traiter au
moment du tarissement. Dans la pratique, le CMT constitue donc la
méthode de choix pour la détection des mammites par
l'éleveur (Gambo et AgnemEtchike, 2001).
6.4. D'autres tests de détection de
mammites
Les autres tests courants de détection de la mammite
bovine sont la conductivité électrique, le pH, le NaOH (test du
côté blanc), la mesure de la
N-acétyl-â-D-glucosaminidase, la déshydrogénase du
lactate, la culture bactérienne du lait et le test immuno-enzymatique du
lait ainsi que le test de réaction en chaîne par polymérase
(PCR) (Mahmoud, 2013).
D'autres techniques de biologie moléculaire
développées pour le diagnostic de la mammite bovine incluent la
détection basée sur la protéomique, les biopuces et les
biocapteurs (Deb et al., 2013).
7. Guérison spontanée
Il est possible, suivant l'état immunitaire de la
vache, d'obtenir une guérison spontanée de l'infection. Les
polynucléaires neutrophiles contrôlent les bactéries dans
20% des cas (Remy, 2010).
8. Traitement
Actuellement, il n'existe pas de procédure universelle
pour traiter les mammites. Pour la plupart des campagnes de traitement, le
traitement recommandé dépend de l'étendue de la
détérioration de la santé de la mamelle (Preez,
2000).
Il n'est pas inutile de rappeler que la réussite d'une
antibiothérapie est liée à une intervention précoce
de traitement dès l'apparition des premiers symptômes pour
éviter l'extension ou la persistance de l'infection et augmenter les
chances de réussite thérapeutique (Faroult et Seryes,
2005).
17
Chapitre 02 : Mammites en Elevage Bovin Laitier
Un traitement se doit d'être aussi précoce que
possible et son choix dépendra des symptômes
présentés par l'animal. On privilégiera le traitement en
lactation pour les mammites cliniques. Les vaches infectées pendant la
lactation devront impérativement faire l'objet d'un traitement au
tarissement. On peut y voir deux raisons. La première est une plus
grande efficacité curative et la seconde se base sur le fait que les
vaches infectées pendant la lactation présentent également
un risque plus élevé de nouvelles infections pendant le
tarissement (Mcdougal, 2009).
9. Effets de la mammite sur la santé
humaine
La mammite clinique et la mammite subclinique
sévère n'endommagent pas seulement les tissus de la mamelle et la
production de lait et causent des dommages financiers en affectant la
santé des animaux, mais elles constituent également une menace
sérieuse pour la santé humaine en affectant
négativement la qualité nutritionnelle du lait
(Gurjar et al., 2012 ; Schukken et al.,
2009
;Gröhnet al., 2004).
Des souches de bactéries résistantes sont
continuellement développées en raison de l'utilisation
d'antibiotiques et leur transfert à l'homme ne peut être
ignoré (Virdis et al., 2010).Le lait
mastiqué obtenu à partir de l'animal laitier traité aux
antibiotiques peut être la source de la résistance aux
antimicrobiens chez l'homme. Pour garantir la sécurité et la
qualité du lait, l'utilisation excessive d'antibiotiques doit être
contrôlée (Syuhada et al., 2016).
19

Chapitre 03 : Antibiorésistance
1. Antibiotiques
1.1. Définition des antibiotiques
Le terme d'antibiotique vient du grec « bios » qui
signifie la vie et « anti » qui signifie contre. Le rôle d'un
antibiotique vient de son nom : c'est donc littéralement « agir
contre la vie ». Donc les antibiotiques sont toute substance
antibactérienne d'origine biologique, synthétique ou
semi-synthétique(Guillemot et al., 2006 ; Muylaert
et al., 2012), capable d'inhiber sélectivement
certaines voies métaboliques des bactéries, sans exercer
habituellement d'effets toxiques pour les organismes supérieurs
(Lavigne et al., 2008).
C'est en 1941 que fut utilisé pour la première
fois un antibiotique « la pénicilline », découverte en
1928 par le bactériologiste anglais Alexander Fleming pour traiter un
patient atteint de septicémie à staphylocoques (Besassier
et al., 2005).
1.2. Classification et action des antibiotiques
Les antibiotiques constituent un important groupe de
médicaments pour la médecine. À coté de leurs
propriétés de lutter contre les infections humaines dues aux
bactéries pathogènes, ils sont également utilisés
en médecine vétérinaire (Emmanuel,2003).
Les antibiotiques agissent à un niveau précis dans les structures
bactériennes et chaque famille possède son site d'action
propre(Figure 1).
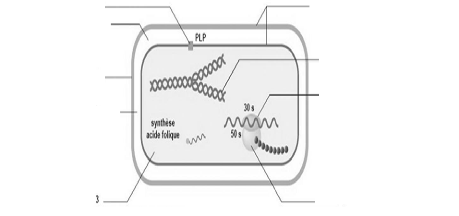
b) Espèce périplasmique
3)Dihydroptéoratesynthétase
(Sulfamides)
4) Fixation à la sous-unité 50
S
duribosome (macrolides,
synergistines,lincosamides,
7) Membranes cytoplasmiques (polymyxines)
6) Acides nucléiques (quinolones, rifamycines,
nitro-imidazolés)
5) Fixation à la sous-unité 30 S du
ribosome (aminosides,
???-lactamine (PLP) 2)Glycopeptides(Dala)
a)Paroi bactérienne
19
Figure 1. Cibles des principaux antibiotiques
(Benlmouden et Hakkou, 2007)
20
Chapitre 03 : Antibiorésistance
Tableau 3. Type d'activité et
modalités d'action des principales classes d'antibiotiques
(Demoré et
al., 2012)
|
Familles et classes
|
Action
d'antibiotiques
|
Concentration ou temps
dépondant
|
Effets inoculum
|
Effet post antibiotique
|
|
Pénicillines
|
Bactéricide
|
Temps dépondant
|
Oui
|
Faible ou nul
|
|
Céphalosporines
|
Bactéricide
|
Temps dépondant
|
Oui
|
Faible ou nul
|
|
Carbapénèmes
|
Bactéricide
|
Concentration dépondant
|
Non
|
Oui
|
|
Monobactames
|
Bactéricide
|
Temps dépondant
|
Oui
|
Faible ou nul
|
|
Glycopeptides
|
Lentement
Bactéricide
|
Temps dépondant
|
Oui
|
Non
|
|
Polymyxines
|
Bactéricide
|
Concentration dépondant
|
Oui
|
Non
|
|
Fluoroquinolones
|
Bactéricide
|
Temps et Concentration
dépondant
|
Non
|
Oui
|
|
MLK
|
Bactériostatique
|
Temps dépondant
|
Oui
|
Non
|
|
Synergistines
|
Bactéricide
|
Temps dépondant
|
Oui
|
Bactériopause
|
|
Aminosides
|
Bactéricide
|
Concentration dépondant
|
Non
|
Oui
|
|
Tétracycline
|
Bactériostatique
|
Concentration dépondant
|
Non
|
Non
|
On distingue plusieurs familles d'antibiotiques, pour
certaines divisées en sous-classes (Tableau 4), permis
lesquelles les â-lactamines sont les antibiotiques les plus
utilisés dans la pratique clinique courante
(Rodriguez-Villalobos et Struelens, 2006).Cette famille
comprend un grand nombre de molécules, toutes
caractérisées par la présence d'un cycle J3-lactame
(Figure 2) indispensable à l'activité
antibiotique, une faible toxicité, associées à un mode
d'action fort complexe sur des protéines de la membrane cytoplasmique,
dénommées protéines liant la pénicilline (PLP) ou
penicillinbindingproteins (Cavallo et al., 2004).
La figure 3 présente les principaux classes de
cette famille.
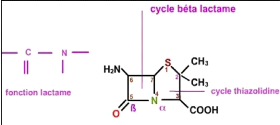
Figure 2. Cycle J3-lactame (Bessard,
2004)
21
Chapitre 03 : Antibiorésistance
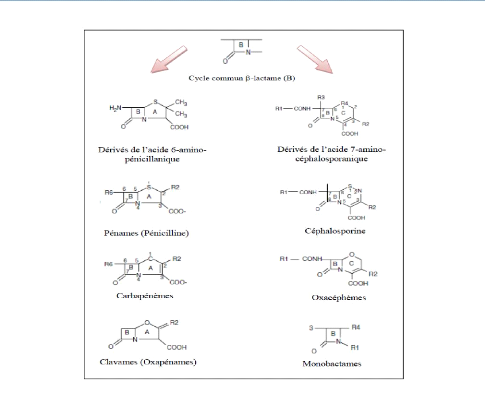
Figure 3. Classification des ?-lactamines
(Cavallo et al., 2004)
1.3. Les antibiotiques en médecine
vétérinaire
Les antibiotiques sont la seconde classe de médicaments
utilisés en médecine vétérinaire. Ils sont
utilisés depuis les années 50 chez les animaux producteurs de
denrées alimentaires (Sanders, 2005). C'est des
substances antimicrobiennes utilisés en médecine humaine et
vétérinaire appartiennent aux mêmes familles, à
l'exception de quelques sous familles spécifiques de la médecine
humaine, ont pour objectifs la maîtrise des maladies, la restauration ou
le maintien du bien-être animal et la prévention de la
transmission des agents pathogènes aux autres animaux voire à
l'homme (Schwarz et al., 2001 ; Phillips et al.,
2004). La caractéristique principale des antibiotiques est leur
grande spécificité d'action car ils agissent sur des cibles
cellulaires structurales ou métaboliques spécifiques des
procaryotes. Cette caractéristique leur permet d'être efficace
à de faibles concentrations et d'être, la plupart du temps, non
toxiques pour les espèces animales (Guillemot et al.,
2006 ; Collectif, 2008).
22
Chapitre 03 : Antibiorésistance
1.5. Antibiothérapie des Mammites en
élevage bovins laitiers dans le monde
Le plan de traitement proposé par le
vétérinaire praticien se base sur le modèle
épidémiologique du troupeau établi à partir des
documents de l'élevage et d'un sondage bactériologique
(Angoujard, 2015).
1.4.1. Traitement antibiotique des vaches en lactation
IL existe 3 types de préparations antibiotiques
intra-mammaires dans le commerce (Hamlaoui, 2017):
? AR: action rapide. Ces traitements sont
administrés en cas de mammite aiguë en lactation.
? LA: longue action. Ces traitements sont
indiqués en cas de mammite chronique en lactation.
? HL: hors lactation. Ces traitements sont
destinés aux mammites subcliniques ou chroniques en cours ou au moment
du tarissement.
1.4.2. Traitement antibiotique des mammites en
première intention
Ce traitement utiliser généralement
vis-à-vis les mammites en premier choix. Il est administré par
voie locale (intra-mammaire) avec un antibiotique à spectre large Gram-
et Gram+. Le Choi de l'antibiotique repose tout d'abord sur le spectre
d'activité, par exemple : â-lactamines et
aminosides(Hamlaoui, 2017).
1.4.3. Plans de traitement au Tarissement
Les deux plans de traitement principal pendant le tarissement
sont l'antibiothérapie systématique (consiste à traiter
toutes les vaches au tarissement avec un antibiotique à spectre large).
Elle est utilisée quand la prévalence des mammites apparues au
cours de la lactation est moyenne à élever) et l'association
d'une obturation du trayon systématique avec une antibiothérapie
sélective (l'utilisation des antibiotiques pendant le tarissement et la
lactation suivante). Toutes les vaches auront une obturation du trayon mais
seules les vaches infectées auront une antibiothérapie avec un
spectre large) (Angoujard, 2015).
1.4.4. Antibiotiques utilisables en lactation
Il existe actuellement trois spécialités
d'antibiotiques destinées au traitement des mammites subcliniques en
lactation parmi eux :Stop M(une pénicilline G), Pirsue (Pirlimycine) et
Gentamam (la Gentamicine et la Cloxacilline) (Rattez,
2017).
1.4.5. Antibiotiques utilisables au tarissement
De nombreuses classes d'antibiotiques sont utilisées :
les pénicillines M à spectre étroit, les
céphalosporines de deuxièmes générations à
large spectre, les céphalosporines de dernières
23
Chapitre 03 : Antibiorésistance
générations au spectre extrêmement large,
les ansamycines et également les aminosides avec un spectre
extrêmement large (Rattez, 2017).
2. Antibiorésistance
La résistance aux antibiotiques est une réponse
physiologique des bactéries à tout usage d'antibiotique et c'est
la capacité d'une bactérie spécifique à survivre en
présence d'un antibiotique qui a été initialement efficace
pour traiter les infections causées par la bactérie
(D'Costa et al., 2011 ; Chancey et al., 2012 ;
Magiorakos et al., 2012).
2.1. Types de résistance
2.1.1. Résistance naturelle
La résistance naturelle d'une bactérie est une
caractéristique propre a une espèce bactérienne, qu'est
partagée par toutes les souches normales de cette espèce, elle
délimite le spectre naturel de l'antibiotique et constitue une aide
à l'identification (Rebiahi,2012).
2.1.2. Résistance acquise
Contrairement à la résistance naturelle, la
résistance acquise intéresse certaines souches au sein d'une
espèce bactérienne normalement sensible à cet antibiotique
(El bouderkaoui, 2015).
La résistance acquise résulte de
mécanismes qui sont liés à l'ADN de la bactérie et
sont donc caractérisés par des mutations ou des transferts de
gènes résistant d'une bactérie résistante vers une
bactérie sensible, via un plasmide, un transposon ou un
intégrons.
Les plasmides présentent un «génome cargo
», quant à lui, rassemble des gènes apportant un
phénotype qui peut se révéler avantageux pour la cellule
hôte, comme des gènes de résistance ou de
virulence(Anders et al.,2009; Barcia et al., 2011;
Harrison et Brockhurst, 2012).
Les transposons sont, eux aussi, des éléments
transposables (mobiles par transposition puisque codent une transposase). Ce
dernier compose par un site d'insertion ne possèdent pas de gènes
de résistance aux antibiotiques, mais peuvent intervenir dans leur
expression (Toleman et al.,2006).
Les intégrons sont des systèmes
génétiques de capture et d'expression de cassettes codant des
résistances aux antibiotiques. Ces éléments ne sont, par
eux-mêmes, ni mobiles, ni transférables, mais sont souvent
associés à des éléments génétiques
mobiles et/ou transférables tels que les transposons
(Tolemanet al.,2006; Mazel, 2006; Schlüter et
al., 2007).
24
Chapitre 03 : Antibiorésistance
2.1.3. Résistance croisée et
Co-résistance
La résistance croisée résulte d'un seul
mécanisme biochimique et concerne des antibiotiques appartenant à
la même famille. La Co-résistance est liée à
plusieurs mécanismes (plusieurs gènes de résistance
impliqués) et concerne des antibiotiques appartenant à
différentes familles (SekhriArafa, 2011).
2.2. Vois d'acquisition des gènes de
résistance
Une bactérie peut devenir résistante à un
antibiotique par mutation survenant au niveau du gène codant pour la
cible de l'antibiotique au sein du chromosome.
Une bactérie peut également acquérir du
matériel génétique étranger par incorporation de
segments d'ADN libre dans leur chromosome (transformation). Des gènes de
résistance peuvent aussi être transférés lors d'une
infection par un bactériophage (transduction) et lors de
phénomène de conjugaison de transposons conjugatifs et de
plasmides. Ces mouvements intercellulaires représentent la transmission
horizontale (Boerlin et Reid-Smith, 2008) (Figure 4).
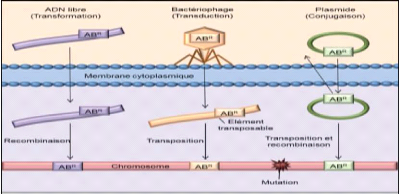
Figure 4. Voies d'acquisition de
résistance aux antibiotiques, d'après(Levy, 2007) 2.3.
Antibiorésistance chez certain bactéries à Gram
négatifs non fermentant
2.3.1. Pseudomonas aeruginosa
Les infections à P.aeruginosa chez l'animal
sont rapportées, telles que certains cas de mammites bovines
(Mekic et al., 2011). En effet, P.aeruginosa
présente la particularité d'être naturellement
multi-résistante à de nombreux antibiotiques grâce à
l'usage mal raisonné d'antibiotiques qui peut
25
Chapitre 03 : Antibiorésistance
donc conduire à la sélection de cette espèce
bactérienne, qu'il devient ensuite très difficile à
éliminer.
P.aeruginosa possède une membrane externe
faiblement perméable, ce qui lui confère une résistance
naturelle à de nombreux antibiotiques, dont la plupart des
â-lactamines hydrophiles (Carpentier et al.,
2003).
La résistance acquise de cette bactérie consiste
à la résistance enzymatique par : les ß-lactamases
(Philippon, 2005), l'hyperproduction de
céphalosporinase chromosomique de classe C (Poirel, 2006)
et les carbapénèmases de classe B (Queenan et
Bush, 2007).
2.3.2 . Acinetobacter baumannii
A.baumannii produit naturellement une
céphalosporinase de type AmpC qui est normalement exprimé
à bas niveau, et ne diminue pas l'efficacité des
céphalosporines à large spectre (céphalotine) ou des
carbapenems. L'insertion d'une séquence spécifique ISAba1
en amont du gène bla ampC favorise l'expression de cette
â-lactamase de type AmpC en fournissant des séquences promoteur ce
qui entraîne la résistance à la ceftazidime
(Nordmann et al., 2009).
Dans un autre cas cette bactérie possède une
pompe à efflux AdeABC dont les substrats sont : aminoglycosides,
tétracyclines, érythromycine, chloramphénicol,
triméthoprime, fluoroquinolones, â-lactamines, et encore
récemment, la tigécycline (Wieczorek et al.,
2008).
2.3.3. Chryseobacterium indologenes
Le choix d'agents antimicrobiens efficaces contre les
infections à C.indologenes est difficile en raison de
l'étendue de sa résistance aux antibiotiques. Des souches
cliniques résistantes à presque toutes les pénicillines,
aux céphalosporines à faible spectre et, surtout, aux
carbapénèmes ont été signalées
(Hsueh et al., 1997 ; Bellais et al., 1999 ;
Kirby et al., 2004 ; Sader et Jones, 2005 ;
Chou et al,. 2011 ; Chen et al.,
2012).Ce phénotype semble être intrinsèque
à cette bactérie et
associé à la production de
ce phénotype semble être intrinsèque à cette
bactérie et associé à la production de
Métallo-â-Lactamases (LBM)codés par le chromosome qui
présentent une grande hétérogénéité
moléculaire et biochimique (Bellais et al., 2000 ;
Perilli et al., 2007 ; Lin et al., 2008).
2.4. Utilisation des antibiotiques chez les animaux et le
développement de la résistance
L'utilisation d'antibiotiques dans la production animale est
blâmée pour contribuer à la résistance
bactérienne croissante aux antibiotiques chez les humains. Cependant,
presque tous les
26
Chapitre 03 : Antibiorésistance
microorganismes ciblés par les agents antimicrobiens
possèdent la capacité d'y devenir résistants
(Kuipers et al., 2016).
27

28
Matériel et Méthodes
1. Matériel 1.1. Animaux
Notre étude s'est déroulée durant la
période allant du mois de Février jusqu'au mois d'Avril 2022.
Elle a porté sur un effectif de 200 vaches laitières en
lactation, de différentes races et à différents stades de
lactation. Ces vaches ont été choisies après l'observation
de l'état général de l'animal. Elles appartiennent
à plusieurs élevages bovins laitiers situés dans
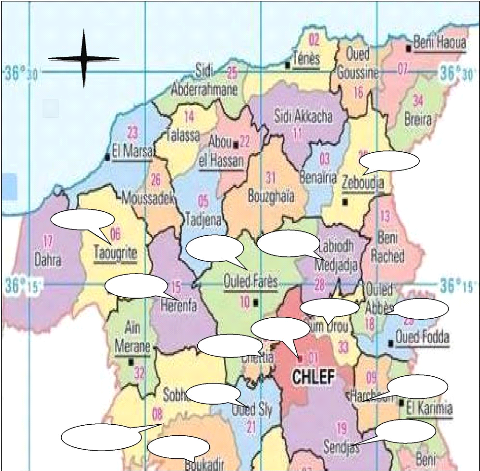
différent communes de la wilaya de Chlef (figure 05, Tableau
05). Les animaux sont en stabulation entravée dans la
majorité des élevages et tous les aspects de bien-être des
animaux ne sont pas respectés (mauvaise conception de l'habitat, sol
glissant, litière insuffisante, aération déficiente,
humidité...).
W
1 ferme
N
S
1ferme
1 ferme
E
2 fermes
1 ferme
1ferme
3 fermes
4fermes
5ferme
3 fermes 1 ferme
1ferme
4fermes
1 ferme
Figure 05.Localisation géographique de
différentes fermes dans la wilaya de Chlef
29
Matériel et Méthodes
Tableau 04. Liste des fermes
sélectionnée pour prélèvements
|
Ferme sélectionnée
|
Nombre des prélèvements
|
|
Ferme Amour
|
10
|
|
Ferme El nakhla
|
6
|
|
Ardh baidha
|
23
|
|
El brancia
|
15
|
|
Mihoubi
|
3
|
|
Chegga
|
5
|
|
Medjadja
|
1
|
|
Sendjass
|
7
|
|
Haouche el ghaba
|
22
|
|
Oulad Mghazi
|
8
|
|
Harchoun
|
3
|
|
Sidi Saleh
|
11
|
|
El ghorf
|
4
|
|
El glaftia
|
3
|
|
Hdjer el Baidhe
|
2
|
|
Oulad bekhaira
|
3
|
|
Oulad Abess
|
1
|
|
Yarmoul
|
4
|
|
Zemoura
|
2
|
|
Ouad sli
|
1
|
|
Hranfa
|
5
|
|
Siahi
|
1
|
|
Chettia
|
3
|
|
Mouamnia
|
5
|
|
Bsakra
|
10
|
|
Boukaaben
|
14
|
|
Taougrit
|
7
|
|
Zebouja
|
1
|
|
Oum Droue
|
20
|
|
Totale :29
|
200
|
30
Matériel et Méthodes
1.2. Questionnaire
Cette partie permet l'évaluation des mammites sur le
terrain et de récolter toutes les informations en
relation avec le sujet. Pour cela, nous avons fait recours
à un questionnaire (fiche d'enquête)
(Annexe 01) qui a porté sur les
principaux points suivants :
> Estimation de la fréquence des mammites dans les
élevages visités ;
> L'effet des différents paramètres sur
l'apparition des mammites (type d'élevage, état de
propreté,
nature du sol, équipements et alimentation...) ;
> Détermination des différentes
molécules d'antibiotiques utilisées et de la présence
d'une
éventuelle Antibiorésistance.
1.3. Matériel de prélèvements
Le matériel nécessaire pour le
prélèvement est :
> Glacière isotherme avec pains de glace ;
> Pots de prélèvement stériles ou des
tubes à vis stériles ;
1.4. Matériel de laboratoire
1.4.1. Milieux de culture (Annexe 02)
> Mueller Hinton Agar ;
> Bouillon nutritif ;
> Mac Conkey agar ;
> Gélose nutritive ;
1.4.2. Tests biochimiques et réactifs
> Galerie API 20NE et API 20E. ;
> Test d'oxydase (disques d'oxydases) ;
> Réactif CMT ;
> Réactif Nit 1, Nit 2, James; VP 1, VP 2 et TDA
.
1.4.3. Solutions
> Eau physiologique ;
> Solution d'EDTA 0,5 M, pH 8 ;
> Solution de BET (10 mg/ml) ;
> Solution de violet de gentiane ;
> Solution de lugol (solution d'iodo-iodurée) ;
> Solution de fuchsine .
31
Matériel et Méthodes
1.4.4. Enzymes, Tampons et amorces
> Taq polymérase (5ug/ul) ;
> Tampon TAE 0.5X ;
> DNTP (10 umol) ;
> Amorces : TEM-F ,TEM-R, VIM-F,VIM-R..
1.4.5. Antibiotiques
> Ticarcilline/ acide clavulanique (75/10) ;
> Pipéracilline (75ug) ;
> Imipénème (10ug) ;
> Céfoxitine (30ug) ;
> Aztréonam (30ug) ;
> Amikacine (30ug) ;
> Ciprofloxacine (5ug).
2. Méthodes
Pour une vache donnée, nous considérons 2, 3 ou
4 quartiers atteints comme un seul prélèvement
(un seul cas de mammite).
2.1. Prélèvements
Les prélèvements du lait ont été
réalisés au niveau des élevages, selon les étapes
suivants :
> Désinfecter les mains de l'opérateur et
porter des gants à usage unique ;
> Laver les trayons avec l'eau ;
> Désinfecter les trayons dans l'ordre suivant :
quartier postérieur gauche (QPG), quartier antérieur
gauche (QAG), quartier postérieur droit (QPD) et
quartier antérieur droit (QAD) ;
> Essuyer avec compresse stérile ;
> Eliminer les premiers jets du lait, ouvrir le pot
stérile d'une main en gardant le capuchon
disponible entre le pouce et l'index, puis prélever
environ 10à 15 ml du lait. Ce pot est
immédiatement refermé pour éviter la
contamination ;
> Marquer et identifier chaque pot avec des
étiquettes portant les abréviations du matricule de
vache, du lieu de prélèvement et du quartier
mammaire gauche ou/et droit (QPG, QAG, QPD ou
QAD) ;
> Placer les pots dans la glacière et acheminer vers
le laboratoire. Les échantillons analysés ont
été
conservés à +4°C.
32
Matériel et Méthodes
2.2. Test de mammite de Californie (CMT) (Dudouet, 2004 ;
Salat, 2014)
Le test CMT est également appelé test au
teepol® ou Leucocytest. C'est un test très simple, directement
réalisable en salle de traite par l'éleveur et peu
onéreux, Le résultat est lisible à l'oeil nu et n'est donc
pas quantitatif.
Le test CMT est un test rapide, pas cher et simple pour le
dépistage de la mammite subclinique dans des conditions de terrain. Le
principe du test repose sur l'utilisation d'un corps tensio-actif, le teepol
à 10% et
d'unindicateurdepH,lepourpredebromocrésolàproportionégale,mélangéedansunverrede
montre avec 2 ml de lait. Le teepol est un détergent qui fait
éclater les cellules somatiques et réagit avec leur ADN en
formant un gel dont la viscosité d'autant plus élevée que
la teneur encellule est importante. Ce détergent permet
l'appréciation visuelle de la viscosité du
précipitéobtenuquipermettrad'apparierleniveaud'inflammationdemamelle.Lebromocrésol,indicateur
depH,changedecouleur en fonction de l'acidité du mélange
(Tableau 5).
Tableau 5. Lecture et interprétation du test
CMT
|
Score
|
Interprétation
|
Réaction visible
|
|
0
|
Négatif
|
Mélange fluide
|
|
1
|
Trace
|
Floculat très fin qui disparait après agitation
|
|
2
|
Fiable positif
|
Floculat très net sans tendance à la
gélification
|
|
3
|
Distinct positif
|
Floculat épais avec d'un gel
|
|
4
|
Forte positif
|
Viscosité fortement augmentée. Un gel
cohésif et solide, avec une surface convexe
|
2.3. Enrichissement
Cette étape consiste à ensemencer 1 ml du lait
à l'aide d'une micropipette dans un tube de 5 ml de bouillon nutritive
et incuber à 37°C pendant 24.
2.4. Isolement et purification
L'isolement a été réalisé par
ensemencement de la culture d'enrichissement (dans le bouillon nutritif) par
épuisement dans un milieu sélectif des bacilles à Gram
négatif non fermentants : le milieu Mac Conkey puis incubation les
boites pendant 24 heures à 37°C.
La purification s'est effectuée par le
réensemencement de chaque colonie suspecte sur les mêmes milieux
sélectifs. La pureté des souches est révélée
par des colonies homogènes ayant le même aspect
phénotypique (couleur, taille et forme).
33
Matériel et Méthodes
2.5. Conservation des souches
Les souches ainsi ré-isolées et purifiées
sont repiquées dans des tubes de gélose nutritive inclinée
(GNI), incubées à 37°C pendant 24 heures puis
conservées au réfrigérateur à une
température de 4°C.
2.6. Coloration de Gram
Apres vérification de leur pureté, les isolats
bactériens ont été soumis aux examens microscopiques
après la coloration de Gram.
2.6.1. Principe
Le but de cette coloration est de déterminer la
morphologie et l'aspect pariétal des bactéries à Gram
négatif non fermentants.
2.6.2. Technique
A. Réalisation de frottis
> Sur une lame, déposer une goutte d'eau physiologique
stérile ;
> Ajouter à l'aide d'anse de platine
stérilisée une fraction de colonie bien isolée ;
> Étaler et fixer à la chaleur (au-dessus de
flamme de bec bunsen) ;
> Poser la lame séchée sur le portoir reposant
sur un bac de coloration.
B. Réalisation de la coloration
Voici succinctement les différentes étapes de cette
coloration :
> Coloration par le violet de gentiane : Laisser agir de 30
secondes à 1 minute. Rincer à l'eau de robinet ;
> Mordançage au lugol (solution d'iode
iodo-iodurée): étaler le lugol et laisser agir 30 secondes,
Rincer à l'eau de robinet ;
> Décoloration (rapide) à l'alcool
(+acétone): verser goutte à goutte un mélange alcool
acétone sur la lame inclinée obliquement, et surveiller la
décoloration (5 à 10secondes). Rincer sous un filet d'eau de
robinet ;
> Recoloration à la fuchsine : laisser agir de 30
secondes à 1 minute. Laver doucement à l'eau de robinet ;
> Sécher la lame et observer au microscope optique
à objectif 100 à l'immersion.
2.6.3. Lecture
Les bactéries Gram positif apparaissent en violet
foncé tandis que les bactéries Gram négatif sont
colorées en rose
34
Matériel et Méthodes
2.7. Test d'oxydase 2.7.1. Principe
Ce test permet la mise en évidence d'une enzyme la
phénylène diamine oxydase de la bactérie à partir
de leur culture en milieu gélosé. Cette enzyme est capable
d'oxyder le réactif : N dimethyl para phénylène diamine
qui est incolore, et en présence de l'enzyme, il libère un
composé bleu violacé.
2.7.2. Technique
A l'aide d'une pipette Pasteur boutonnée, une colonie
est déposée sur un disque oxydase placé sur
une lame.
2.7.3. Lecture
La présence d'une cytochrome-oxydase se traduit, pendant
20 à 60 secondes, par l'apparition d'une
coloration rouge virant rapidement au violet foncé
2.8. Galerie API 20NE (
www.biomerieux.com)
2.8.1 Principe
Le principe consiste à inoculer dans les microtubes,
à l'aide d'une pipette pasteur, une suspension bactérienne
homogène. Les réactions produites pendant la période
d'incubation se traduisent par des virages colorés spontanés ou
révélés par l'addition de réactifs.
Cette technique est utilisé pour déterminer
certains caractères biochimiques des bactéries Gram
négatif non fermentants tel que : la production des sucres (mannose,
glucose...), assimilation d'azote...
2.8.2 Technique
A. Préparation de la galerie
? Réunir fond et couvercle d'une boite d'incubation et
répartir environ 5ml d'eau physiologie
dans les alvéoles pour créer une atmosphère
humide ;
? Inscrire la référence de la souche sur la
languette latéral de la boite (ne pas inscrire la
référence sur le couvercle celui-ci pouvant
être déplacé lors de la manipulation) ;
? Sortir la galerie de son emballage individuel ;
? Placer la galerie dans la boite d'incubation.
B. Préparation de l'inoculum
? Ouvrir une ampoule d'API NaCl 2ml de la notice du produit ou
utiliser un tube contenant 2ml de la solution saline à 0,85 sans additif
;
35
Matériel et Méthodes
> A l'aide d'une pipette pasteur,
prélever 1 à 4 colonies de morphologie identique, par aspiration
ou par touche successives, utiliser préférentiellement des
cultures jeunes (18-24) heures ;
> Réaliser une suspension d'opacité
«égale à 0,5 de Mc Farland, cette suspension doit être
utilisée extemporanément.
C. Inoculation de la Galerie
> Remplir les tubes (et non les cupules) des tests NO3
à PNPG avec la suspension précédent en utilisant la
pipette ayant servi au prélèvement, pour éviter la
formation des bulles au fond des tubes, poser la pointe de la pipette sur le
côté de la cupule, en inclinant légèrement la boite
d'incubation vers l'avant ;
> Remplir tubes et cupules des tests GLU à PAC en
veillant à créer un niveau horizontal ou légèrement
convexe, mais jamais concave, des cupules incomplètement remplier ou
trop remplier peuvent entrainer des résultats incorrect ;
> Remplir d'huile de paraffine les cupules des trois tests
(GLU- ADH- URE) pour former un ménisque convexe ;
> Refermer la boite d'incubation et incuber à 29C°
pondant 24 heures.
4.8.3. Lecture
Après incubation, la lecture de la galerie doit se
faire en se référant au tableau de lecture (Annexe
03).
> Noter sur la fiche les résultats de toutes les
réactions spontanées (GLU, ADH, URE, ESC, GEL, PNPG).
> La révélation des 2 testes NO3 et TRP doit
se faire en mettant les tests d'assimilation à l'abri d'une
contamination par l'aire, pour cela placer le couvercle de la boite
d'incubation au-dessus de ces tests pendant la période de
révélation ;
> Ajouter une goutte de réactifs NIT1 et NIT 2 dans la
cupule NO3 ;
> Ajouter une goutte de réactif JAMES dans la cupule
TRP.
2.9. Antibiogramme (Comité de l'antibiogramme
de la société française de microbiologie,
2021)
2.9.1. Principe
L'antibiogramme a été réalisé
selon la méthode de diffusion sur milieu gélosé (Muller
Hinton), méthode recommandée par le CA-SFM. Cette méthode
est utilisée pour déterminer la sensibilité ou la
résistance des bactéries aux antibiotiques.
36
Matériel et Méthodes
2.9.2. Technique
A. Préparation de l'inoculum
> A partir d'une culture pure de 24H sur milieu
d'isolement, racler à l'aide d'une anse de platine quelques colonies
bien isolées et parfaitement identiques ;
> Décharger l'anse dans 5 à 10 ml d'eau
physiologique stérile à 0,9% ;
> Bien homogénéiser la suspension
bactérienne, son opacité doit être équivalente
à 0,5 Mc Farland ;
> L'inoculum peut être ajusté en ajoutant,
soit de la culture s'il est trop faible ou bien de l'eau physiologique
stérile s'il est trop fort.
B. Ensemencement
> Tremper un écouvillon stérile dans la
suspension bactérienne ;
> L'essorer en le pressant fermement (en le tournant) sur la
paroi interne du tube, afin de le
décharger au maximum ;
> Frotter l'écouvillon sur la totalité de la
surface gélosée (Muller-Hinton), sèche, de haut en bas,
en stries serrées ;
> Répéter l'opération deux fois, en
tournant la boîte de 60° à chaque fois sans oublier de
faire
pivoter l'écouvillon sur lui-même ;
> Finir l'ensemencement en passant l'écouvillon sur la
périphérie de la gélose.
C. Application des disques
> Déposer les disques d'antibiotiques à l'aide
d'une pince stérile suivant la Figure6 ;
> Presser chaque disque d'antibiotique à l'aide de
pince, pour s'assurer de son application. Une fois appliqué le disque ne
doit pas être déplacé ;
> Laisser les boites 20 mn à la température
ambiante pour permettre une pré-diffusion de l'antibiotique, puis les
incuber pendant 18-24 H à 37°C #177;1°C.
37
Matériel et Méthodes
ATM
IPM
CAZ
AK
TCC
CIP
PRL
Figure 6. Disposition des antibiotiques sur
les boîtes d'antibiogrammes.
AK: Amikacine, CIP:
Ciprofloxacine, PRL : Pipéracilline, CAZ :
Ceftazidime, ATM : Aztréonam
IPM
:Imipénème ,TCC : Ticarcilline/ acide
clavulanique
2.9.4. Lecture
> Les résultats ont été
interprétés selon les critères du comité de
l'antibiogramme de la société
française de microbiologie (CA-SFM, 2021)
;
> Mesurer avec précision les diamètres des zones
d'inhibition à l'aide d'un pied à coulisse ;
> Comparer les résultats obtenus aux valeurs critiques
figurant dans les tables de lecture
correspondante, ensuite la bactérie est classée
dans l'une des catégories: sensiblerésistante ou
intermédiaire(Annexe 4 ).
2.10. Recherche de gènes de résistance par
PCR
La PCR est une technique bien établie qui amplifie, de
façon sélective, certaines régions d'ADN
génomique en fonction de la liaison d'amorces qui sont
propres aux régions en question (Aboura,
2010).
2.10.1. Extraction de l'ADN par Choc thermique
(Perez-Hernandez et al.,2002)
> Mélanger 100ul de l'eau distillée avec une
colonie ;
> Incuber au bain marie à 100°C pendant 10 min
;
> Mettre au congélateur à -4°C pendant 10
min ;
> Ré-incuber au bain marie à 100°C pendant
5 min ;
> Centrifuger le mélange 5min à 12000 rpm ;
> Récupérer le surnageant dans un nouveau
Eppendorf.
38
Matériel et Méthodes
2.10.2. Dosage d'ADN par la
spectrophotométrie
C'est l'une des méthodes les plus répandues pour
le dosage des acides nucléiques. La spectrophotométrie mesure
l'absorbance ou la densité optique (DO) des acides nucléiques
à 260 nm (absorbent dans l'ultraviolet). Parallèlement, nous
mesurons l'absorbance à 280 nm pour le dosage des protéines. Un
rapport R est déterminé pour estimer la pureté de l'ADN
:
R= DO260/DO280
? Pour une solution d'ADN pure : le ratio doit être compris
entre 1,8= R = 2 ;
? Pour une solution d'ADN contaminée par les
protéines : le ratio est inférieur à 1,8 ;
? Pour une solution d'ADN contaminée par les ARN : le
ratio est supérieur à 2. Enfin, la concentration de la solution
d'ADN est calculée par la formule suivante :
C (ng/ul) = DO260 ×50 × D
? D: dilution
2.10.3. Amplification de l'ADN par PCR
La PCR standard est effectuée pour détecter les
â-lactamases de type TEM et VIM.
A. Préparation du mix
Le mélange réactionnel (24 ìl) ou le Mix se
fait dans une pièce spéciale avec le port de gants pour
éviter toute contamination et qui sera par la suite
distribué dans des tubes Eppendorf (Tableau 05).
Les amorces d'oligonucléotides sont
énumérées respectivement sur le tableau
06.
Tableau 06.Produits du mix pour la PCR
|
Produit
|
Réaction pour un échantillon
|
|
dNTP(10 mM)
|
0.5ìl
|
|
Tampon 1-10X (MgCl2 20mM)
|
2.5 ìl
|
|
Taq (5pig/pil)
|
0.25 ìl
|
|
Chaque amorce (10 piM)
|
1.5 ìl
|
|
Eau
|
17.75 ìl
|
|
Volume total du mix
|
24 ìl
|
39
Matériel et Méthodes
Tableau 07.Les amorces
d'oligonucléotidiques utilisées pour la PCR
|
Gènes cibles
|
Amorces
|
Séquences
|
Taille de l'amplicon (pb)
|
|
blaTEM
|
TEM-F
|
ATGAGTATTCAACATTTCCGTG
|
840
|
|
TEM-R
|
TTACCAATGCTTAATCAGTGAG
|
|
BlaVIM
|
VIM-U
|
ATTGGTCTATTTGACCGCGTC
|
382
|
|
VIM-L
|
TGCTACTCAACGACTGCGCG
|
Chaque constituant de ce mix est multiplié par le nombre
d'échantillons étudiés, puis 24ul de ce mélange
sont distribués dans chaque tube Eppendorf PCR stériles :
> Témoin négatif : 1ul d'eau
distillé stérile plus 24ul de mix ;
> Témoin positif : 1ul de DNA positif
pour 24ul du mix ;
> Echantillons : 1ul de DNA de notre
échantillon est ajouté à 24ul de mix;
> Volume total : 25ul par échantillon
(les témoins ou les échantillons à analyser).
Le mix et les DNA sont transférés dans des tubes
Eppendorf de type « Master cycler
personnal » et sont introduits dans le thermocycleur.
B. Programmation du thermocycleur
Les réactions d'amplification sont réalisées
à l'aide d'un thermocycleur : Applied Biosystems Gene
Amp, PCR système TC-3000. Cette réaction est
cyclique, et elle se fait en trois étapes :
> Dénaturation : consiste à
chauffer avec une température élevée pour séparer
l'ADN à double
brin en brisant les liaisons hydrogènes ;
> Hybridation : une fois l'ADN
séparé, on refroidit rapidement pour que les amorces se fixent
à
chaque extrémité complémentaire de l'ADN
à simple brin ;
> La polymérisation ou élongation
: Après la fixation des amorces, l'ajout de la Taq
polymérase
et de nucléotide permet la synthèse des nouveaux
brins d'ADN.
Les différentes étapes sont reprises ci-dessous:
> 95°C pendant 10 min ;
> 35 cycles de :
? 95°C pendant 45 s ;
? 53°C pendant 45 s ;
? 72°C pendant 1 min ;
> 72°C pendant 10 min.
40
Matériel et Méthodes
2.10.4. Electrophorèse sur Gel d'agarose (Sambrook
et Russel, 2001)
A. Principe
L'électrophorèse sur gel d'agarose est la
méthode de choix pour la séparation, la purification et
l'identification des fragments d'ADN et d'ARN. Sous l'influence d'un courant
électrique, les acides nucléiques chargés
négativement se déplacent à travers le gel d'agarose vers
la borne positive (l'anode). Les molécules seront séparées
dans le gel dû au fait qu'elles ne migrent pas toutes à la
même vitesse.
B. Technique
1) Préparation du gel d'agarose
> Pour un gel de 1%, dissoudre par chauffage jusqu'à
ébullition, 1g d'agarose (Sigma) dans 100 ml
de tampon TAE 0.5 X (Annexe 054) ;
> Refroidir la solution à 55°C dans un bain marie,
puis ajouter du BET (Bromure d'éthidium)
(chaque 5 ul du BET dans 100 ml de TAE) qui va se fixer sur l'ADN
(cette molécule s'intercale
entre les bases de la molécule d'ADN) et va permettre la
visualisation des bandes d'ADN dans le
gel sur la table UV du transilluminateur;
> déposer le gel dans un moule dont les 2
extrémités ont été préalablement
fermées par du ruban
adhésif;
> Déposer un peigne dans le gel afin de réaliser
des puits;
> Laisser solidifier;
> Retirer le peigne du gel et le ruban adhésif du
moule;
> Placer le moule avec le gel dans la cuve
d'électrophorèse;
> Ajouter un volume de tampon TAE 0.5 X dans la cuve
préalablement remplie jusqu'à ce que le
gel soit immergé (environ 1 mm au-dessus).
2) Ensemencement
> Répartir sur un morceau de Parafilm des gouttes de
tampon de charge (Bleu de Bromo-phénol)
qui assure le maintien du dépôt en immersion dans le
puit et permet la visualisation de la
migration;
> Mélanger à l'aide d'une micropipette, 10 ul de
chaque échantillon avec le tampon de charge;
> Transférer les 5 ul des mélanges dans les
puits du gel;
> Deux puits sont réservés au témoin
positif et au témoin négatif et un puit au marqueur de poids
moléculaire;
> Déposer les échantillons dans les autres
puits.
41
Matériel et Méthodes
3) Migration
> Fermer la cuve et brancher l'alimentation de la cuve de
manière à ce que les dépôts soient de
côté cathode (-);
> Appliquer un voltage de 100 volts pendant 30 min;
> Couper l'alimentation quand le colorant a parcouru la
distance requise ou laisser la migration
arriver jusqu'à 1 cm du bord de la cuve (cette ligne est
appelée le front de migration);
> Débrancher le générateur de la cuve.
4) Lecture (Visualisation par
Transilluminateur)
> La visualisation des bandes d'ADN du gel se fait sur la
table UV du transilluminateur dans une
chambre noire;
> En fonction de la taille des fragments d'ADN
étudiés, on repèrera la bande et sa taille
respectivement par rapport au témoin positif et au
marqueur de PM.
42

43
Partie 03 : Résultats
1. Prélèvement
Entre la période de 17 février au 27 avril 2022,
200 prélèvements de lait mammiteux ont été
effectués, à partir de 29 fermes distribuées sur 14
communes de wilaya de Chlef, dont 5 prélèvements ont
été réalisés dans la commune de Medjadja , 4
prélèvements ont été réalisés
à chacune des communes de Chlef et Sendjass, 3
prélèvements à Chettia et Oum Droue, 2
prélèvements à boukadir et nous avons enregistré un
prélèvement dans chacune des communes de Sobha, Oulad Fares ,
Harcoune , Oulad Abess , Oued Sli , Hranfa , Taougrit et Zebouja
(Tableau 08).
Tableau 08. Répartition des
prélèvements réalisés dans les communes de wilaya
de Chlef
|
Communes
|
Nombre des fermes
|
Nombre des prélèvement
|
|
Sobha
|
1
|
10
|
|
Medjadja
|
5
|
16
|
|
Chettia
|
3
|
29
|
|
Chlef
|
4
|
28
|
|
Senjass
|
4
|
23
|
|
Oulad fares
|
1
|
22
|
|
Oum droue
|
3
|
38
|
|
Hrchoune
|
1
|
3
|
|
Oulad Abess
|
1
|
1
|
|
Boukadir
|
2
|
16
|
|
Oued sli
|
1
|
1
|
|
Hranfa
|
1
|
5
|
|
Taougrit
|
1
|
7
|
|
Zebouja
|
1
|
1
|
|
Total
|
29
|
200
|
La révélation des infections mamelles se traduit
par la présence d'une viscosité fortement augmentée, un
gel cohésif et solide avec une surface convexe après le test de
CMT. Nos résultats montrent que de 127 vaches ont présenté
un test positif (Figure 07). Sur la totalité des
prélèvements du lait considérés (200 vaches), nous
avons trouvé 37% des échantillons qui présentent un lait
normal, alors que 63% des échantillons du lait sont
considérés mammiteux (Figure 08).
44
Partie 03 : Résultats
Figure 07. TestCMT positif du lait
Négative
36,5%
positive
63,5%
Figure 08. Résultat de CMT de 200
vaches laitières
Cependant, durant la période d'étude de 3 mois,
les infections mammaires sont réparties différemment avec un pic
au mois de Février dans lequel, on dénombre 70,07% des cas de
mammites, suivi d'une décroissance régulière de taux aux
mois de Mars et d'avril (Figure 09).
45
Partie 03 : Résultats
Février
74.07%
Mars
64%
Avril
57%
Figure 09. Fréquence de mammites en
fonction des mois de prélèvements
Les résultats du test CMT du lait prélevé
vis-à-vis les communes de la wilaya de Chlef sont
représentés sur le diagramme de la Figure 10. La
commune de Chettia atteint une fréquence maximale d'infection d'environ
10% suivie par les communes d'Oum Derou et de Chlef (8,5% pour chacune),
Sendjess et Ouled Fares (8% pour chacune) et Medjaja (5,5%).
Alors que d'autre communes couvrent des basses
fréquences d'infection dont Boukadir (4%), Sobha (3,5%), Taougrit (3%),
Hrenfa (2%), Harchoune (1%) et les dernières communes Oued Sli ,
Zeboudja et Ouled Abbes (0,5% pour chacune).
46
Partie 03 : Résultats
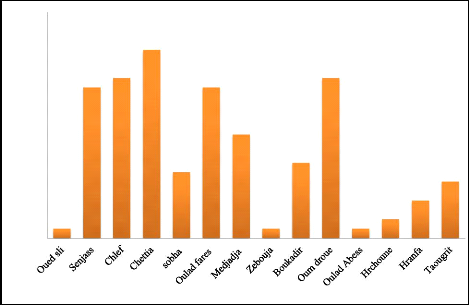
12.00%
10.00%
4.00%
2.00%
6.00%
0.00%
8.00%
0.50%
8%
8.50%
10%
3.50%
8%
5.50%
0.50%
4%
8.50%
0.50%
1%
2%
3%
Figure 10. Fréquence de mammites en
fonction des communes de la wilaya de Chlef
La figure 11 représente la
répartition des cas de mammites en fonction du stade de lactation. Les
résultats montrent une fréquence maximale de contamination dans
plus de cinq mois suivant le vêlage au cours duquel on dénombre
55% du total des cas de mammites.
2-4 MOIS
39%
1 MOIS
6%
>=5 MOIS
55%
Figure 11. Fréquence des cas de
mammites en fonction de stade de lactation.
Partie 03 : Résultats
La répartition des mammites en fonction du rang de
lactation est représentée par la figure 12.
L'incidence des mammites diminue avec le rang de lactation des animaux. Il faut
signaler que cette fréquence est plus élevée chez les
vaches au deuxième rang.
25.00%
20.00%
15.00%
10.00%
0.00%
5.00%
11.50%
1 2 3 4 5 6 7 8
22.50%
13.50%
7.50%
5.50%
1.50%
0.50% 0.50%
Figure 12. Fréquence de mammites en
fonction du rang de lactation
Par rapport à l'âge des bovins, la fréquence
de mammites est beaucoup plus enregistré chez les troupeaux
appartiennent à la classe d'âge de 3 à 4 ans
(Figure 13).
|
16% 16%
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8% 8%
|
|
|
|
|
7%
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2%
|
|
|
|
|
3%
|
2%
|
|
|
|
|
|
|
|
|
|
1%
|
|
1%
|
1%
|
|
|
|
1 2 3 4 5 6 7 8 9 10 11
Age
|
Fréquence de mammite
|
18% 16% 14% 12% 10% 8% 6% 4% 2% 0%
|
47
Figure 13. Fréquence de mammites en
fonction de l'âge des bovins
| 


