III.2.1.3- Conductivité électrique
La conductivité électrique nous permet de
déterminer le degré de minéralisation des eaux
souterraines. Elle exprime la charge minérale des eaux souterraines et
permet d'estimer la
Etude hydrogéologique et
caractérisation des aquifères du Batha Est Université de
N'Djaména
Mémoire de master, présenté et
soutenu par : BETOLOUM VINCENT 38
quantité d'ions en solution (J. Nicod,
1973). Les valeurs de conductivité électrique
mesurées des échantillons des forages de la zone d'étude
varient de 88 à 1 290 uS/cm avec une moyenne de 538,81 uS/cm.
Ainsi nous pouvons affirmer sans risque que ces eaux
échantillonnées de différents ouvrages de notre zone
d'étude ne présentent pas une minéralisation
accentuée.
III.2.1.4- Total des Solides Dissouts (TDS)
Le TDS est aussi un bon indicateur de minéralisation
des eaux souterraines et il varie de 0 à 122mg/l dans tous les forages
échantillonnés.
Pour les eaux potables, l'OMS fixe la valeur maximale de TDS
à 1500mg/l et qu'aucune valeur mesurée dans les eaux
échantillonnées de notre zone d'étude n'a atteint la
valeur limite. La plus petite est 0 et la grande valeur est de 122mg/l donc la
nappe exploitée n'est pas minéralisée.
La plus petite valeur de TDS est mesurée au Nord-Est et
elle peut être une zone d'inondation et la plus grande valeur au
Sud-Ouest de la zone d'étude peut être exondée
(Seeber et al., 2014).
III.2.2-Paramètres chimiques
Les éléments chimiques des eaux permettent de
connaître la nature et la quantité de certains
éléments chimiques et d'évaluer l'agressivité de
ces eaux ainsi que les éléments chimiques en solution.
Etude hydrogéologique et
caractérisation des aquifères du Batha Est Université de
N'Djaména
Mémoire de master, présenté et
soutenu par : BETOLOUM VINCENT 39
Tableau 1 : Données chimiques brutes
|
|
|
|
|
|
|
|
|
|
mg++
|
|
|
|
NO3-
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cations
|
|
|
|
|
Anions
|
|
Somme
|
Somme
|
Balance
|
|
|
|
|
|
|
|
|
|
des cations
|
des anions
|
ioninique
|
|
IRH
|
K+ (méq/L)
|
Na+
|
Ca++
|
|
Cl-
|
SO4--
|
HCO3-
|
|
|
|
|
|
|
(méq/L)
|
(méq/L)
|
(méq/L)
|
(méq/L)
|
(méq/L)
|
(méq/L)
|
(méq/L)
|
|
|
|
|
ABEA087
|
0,08
|
1,09
|
1,37
|
0,82
|
0,28
|
0,02
|
2,80
|
0,02
|
3,36
|
3,12
|
4%
|
|
ABEA090
|
0,05
|
0,57
|
0,76
|
0,04
|
0,39
|
0,00
|
0,92
|
0,00
|
1,42
|
1,31
|
4%
|
|
ABEA091
|
0,03
|
0,43
|
0,80
|
0,27
|
0,28
|
0,31
|
0,84
|
0,00
|
1,53
|
1,43
|
3%
|
|
ABEA093
|
0,08
|
1,09
|
1,25
|
0,99
|
0,71
|
0,21
|
2,20
|
0,02
|
3,41
|
3,14
|
4%
|
|
ABEA097
|
0,07
|
1,13
|
1,29
|
0,75
|
0,56
|
0,21
|
2,26
|
0,02
|
3,24
|
3,05
|
3%
|
|
ABEA100
|
0,05
|
1,00
|
2,13
|
0,27
|
1,04
|
0,12
|
2,00
|
0,04
|
3,45
|
3,20
|
4%
|
|
ABEA105
|
0,08
|
1,09
|
1,37
|
0,82
|
0,28
|
0,02
|
2,80
|
0,02
|
3,36
|
3,12
|
4%
|
|
ABEA106
|
0,06
|
0,96
|
1,25
|
0,44
|
0,87
|
0,23
|
1,30
|
0,04
|
2,71
|
2,44
|
5%
|
|
ABEA107
|
0,05
|
1,09
|
1,64
|
0,82
|
0,85
|
0,12
|
2,36
|
0,03
|
3,60
|
3,36
|
3%
|
|
ABEA108
|
0,05
|
1,78
|
3,52
|
0,87
|
2,26
|
0,92
|
2,40
|
0,10
|
6,22
|
5,68
|
5%
|
|
ABEA110
|
0,03
|
0,43
|
1,47
|
0,40
|
0,23
|
0,62
|
1,28
|
0,00
|
2,33
|
2,13
|
4%
|
|
ABEA111
|
0,07
|
1,26
|
1,24
|
0,88
|
0,42
|
0,25
|
2,50
|
0,04
|
3,45
|
3,21
|
4%
|
|
ABEC076
|
0,15
|
4,00
|
2,34
|
1,86
|
0,56
|
0,31
|
0,74
|
0,07
|
8,35
|
1,68
|
67%
|
|
ABEC077
|
0,07
|
1,22
|
1,24
|
0,44
|
0,71
|
0,11
|
2,04
|
0,04
|
2,97
|
2,90
|
1%
|
|
ABEC083
|
0,15
|
2,48
|
2,34
|
1,23
|
0,56
|
0,31
|
4,92
|
0,07
|
6,20
|
5,86
|
3%
|
|
MGRC030
|
0,00
|
0,09
|
3,29
|
1,23
|
2,79
|
0,19
|
1,51
|
0,07
|
4,61
|
4,56
|
1%
|
|
MGRC031
|
0,00
|
0,00
|
2,74
|
1,15
|
1,27
|
0,08
|
2,46
|
0,01
|
3,89
|
3,82
|
1%
|
|
OMJA089
|
0,01
|
0,17
|
1,75
|
0,91
|
1,97
|
0,00
|
0,90
|
0,02
|
2,84
|
2,89
|
-1%
|
|
OMJA101
|
0,08
|
1,00
|
1,20
|
0,80
|
0,28
|
0,19
|
2,40
|
0,02
|
3,08
|
2,89
|
|
|
OMJB074
|
0,05
|
0,43
|
1,15
|
0,04
|
0,17
|
0,21
|
0,88
|
0,00
|
1,67
|
1,26
|
|
|
OMJB076
|
0,17
|
3,91
|
5,26
|
1,53
|
3,24
|
1,46
|
6,00
|
0,05
|
10,87
|
10,75
|
|
|
OMJB079
|
0,05
|
0,48
|
1,25
|
0,46
|
0,71
|
0,15
|
1,20
|
0,02
|
2,24
|
2,08
|
|
|
OMJC075
OMJC084
|
0,06
0,08
|
0,00
0,78
|
1,64
1,36
|
0,46
0,24
|
0,31
0,28
|
0,35
0,25
|
2,40
1,70
|
0,00
0,00
|
2,16
2,46
|
3,06
2,23
|
|
3%
14%
1%
4%
-17%
5%
OMJC086
0,26
5,31
3,59
0,40
0,59
0,21
8,42
0,05
9,56
9,27
2%
OMJC120
0,16
1,30
2,30
0,53
0,34
0,31
3,18
0,13
4,29
3,96
4%
OMJC131
0,15
2,57
2,00
1,40
0,42
0,71
4,80
0,00
6,12
5,93
2%
OMJD034
0,14
2,39
4,41
0,62
1,69
0,54
4,79
3,23
7,56
10,25
-15%
5%
Les principaux éléments chimiques analysés
des échantillons des eaux souterraines issues de
notre zone d'étude sont les suivants :
OMJC079
0,05
0,83
1,28
0,72
0,56
0,04
2,00
0,02
2,88
2,62
Le Calcium (Ca2+): les teneurs en
calcium sont comprises entre 15,2 et 105,4 mg/L, avec une
moyenne de 39,53 mg/L. Nous pouvons expliquer cette faible teneur
par le fait que les eaux
Etude hydrogéologique et
caractérisation des aquifères du Batha Est Université de
N'Djaména
Mémoire de master, présenté et
soutenu par : BETOLOUM VINCENT 40
pluviales n'ont pas assez de temps de ruissellement pour se
charger avant de s'infiltrer pour être saturées en calcium
à cause de la forte pente.
Le Magnésium (Mg2+): les
teneurs du magnésium sont nettement inférieures à celles
du calcium et varient entre 0,5 et 22,9 mg/L avec une moyenne de 9,14 mg/L.
Le Potassium (K+): les teneurs de
cet élément sont faibles et varient entre 0 et 10 mg/L avec une
moyenne de 3,25 mg/L.
Le Sodium (Na+): les teneurs du
sodium sont importantes et varient entre 0 et 122 mg/L avec une moyenne de
32,55 mg/L.
Le Bicarbonate (HCO3-):
le bicarbonate est l'élément le plus abondant de tous
les ions dans les eaux souterraines de notre zone d'étude. Les teneurs
sont comprises entre 45 et 514 mg/L avec une moyenne de 163,7 mg/L. Ces teneurs
peuvent être expliquées par la dissolution de certaines roches
carbonatées du réservoir (détritiques ou mixtes).
Le Chlorure (Cl-): il est
le deuxième élément le plus dominant des anions par
rapport aux autres éléments. Il a des teneurs comprises entre 6
et 115 mg/L avec une moyenne de 32,55 mg/L.
Les Nitrates (NO3-): ils
ont des teneurs disparates qui varient entre 0 et 200 mg/L avec une moyenne de
15,7 mg/L.
Les Sulfates (SO4-): les
sulfates sont très faibles dans les eaux souterraines de notre zone
d'étude. Leurs teneurs varient entre 0 et 70 mg/L avec une moyenne de
15,37 mg/L.
Parmi ces éléments chimiques analysés
sont repartis en cations et les anions représentés dans les
histogrammes suivants :
Le calcium est le cation dominant et le sodium puis le
magnésium et enfin le potassium en faible teneur (Figure
22).
Le bicarbonate est l'anion dominant et la chlorure puis le
sulfate et enfin le nitrate est en trace (Figure 23).
Etude hydrogéologique et
caractérisation des aquifères du Batha Est Université de
N'Djaména
Mémoire de master, présenté et
soutenu par : BETOLOUM VINCENT 41
|
60%
|
|
|
|
|
|
50%
|
|
|
48%
|
|
|
40%
|
|
|
|
|
|
|
32%
|
|
|
|
30%
|
|
|
|
|
|
20%
|
|
|
|
18%
|
|
10%
|
|
|
|
|
|
2%
|
|
|
|
|
0%
|
|
|
|
|
|
|
|
|
|
K+
|
Na+
|
Ca++
|
mg++
|
Figure 22: Histogramme de répartition des cations
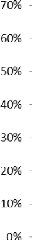
Figure 23: Histogramme de répartition des anions
|
|



