Republique Algerienne Democratique et Populaire
Ministere de 1'Enseignement Superieur et de la Recherche
Scientifique
UNIVERSITE AMAR TELIDJI LAGHOUAT
FACULTE DES SCIENCES ET DE L'INGENIERIE
DEPARTEMENT DE
BIOLOGIE

4,Ay=k=4;
MEMOIRE DE FIN D'ETUDES
En vue de l'obtention du diphime
d'Ingenieur d'Etat en Biologie
Option : Genie Biologique
Thême
Effets des extraits de quelques plantes
medicinales locales sur les enzymes: a-amylase,
trypsine et lipase
Presents par : Encadre par :
· BENAROUS Khedidja YOUSFI Mohamed
n DJERIDANE Amar
Je dedie ce modeste travail a
mes parents, qui m'ont encourage,
mes freres et sours qui m'ont supporte.
Remerciements
Que toutes les personnes m'ayant permis de mener a bien ce
travail de these soient assurees de ma gratitude.
Je tiens a remercier M D. Benbertal Directeur du
Laboratoire des sciences fondamentales de l'Universite AMAR TELIDJI de Laghouat
de m'avoir accueilli et d'avoir mis a ma disposition tout le materiel
necessaire.
Je tiens a exprimer mes sinceres remerciements au Dr M
YOUSFI, Maitre de conferences a l'Universite de Laghouat, responsable de cette
etude, pour avoir accepte de m'encadrer, pour le choix du theme et pour avoir
partici* activement a la correction de ce manuscrit afin de realiser cette
etude. Ses competences techniques et son efficacite ont fortement contribue a
la realisation de cette these.
Mes sinceres remerciements iront egalement a Monsieur A.
Djeridane, Co-promoteur de ce memoire. Son aide et sa disponibilite ont ete des
atouts precieux.
Tout au long de ce travail de longue haleine qui m' a
oblige a consulter une bibliographie consequente, Un grand merci au Dr M
OUI1VTEN et a M A. SARIDI pour les efforts consentis de leur part.
Mes profondes reconnaissances a l'ensemble des enseignants
du departement de biologie, Universite de Laghouat pour m'avoir appris
l'autonomie, la debrouille et l' auto-critique.
Une tendre pens& pour mes parents, pour leur patience,
leur presence a mes cotes et leur contribution a l'elaboration de ce
manuscrit.
Je tiens a remercier mon oncle M BENAROUS Belabbes pour
son aide relatif aux plantes medicinales sahariennes et egalement remercier mon
oncle M BENAROUS Kamal pour ses conseils appreciables.
Je remercie egalement mon oncle M LAHDEB Mohamed pour ces
precieux conseils durant tout mon cycle universitaire et egalement remercier
mon oncle M LAHDEB Hadj pour son soutien.
Une pens& amicale aux collegues etudiants et
etudiantes du Departement Biologie pour leur soutien et leur aide.
Un grand merci a toutes les personnes qui m'ont soutenu de
pres ou de loin au cours de la realisation de ce modeste travail.
Je voudrai remercier Messieurs les membres du jury d'avoir
accepte d'evaluer cette
these.
Liste des figures
Figure II. 1. Squelette de base des flavonoIdes.
28
Figure III. 1. Mecanisme reactionnel de la
formation du produit. 35
Figure III. 2. Graphe de Michaelis-Menten:
Vo en fonction de [S]. 36
Figure III. 3. Graphe de Lineweaver-Burk: 1/Vo
en fonction de 1/[S]. 37
Figure III. 4. Mecanisme reactionnel de la
formation du produit en presence 38
d'inhibiteur.
Figure III. 5. Variation de la vitesse initiale
en fonction de la concentration en substrat 38
pour une reaction de
Michaelis-Menten simple en presence de differentes concentrations d'un
inhibiteur competitif.
Figure III. 6. Representation de Lineweaver-Burk
de l'enzyme michaelienne inhibee 39
competitivement decrite dans la Figure
111.5.
Figure III. 7. Mecanisme reactionnel en presence
d'inhibiteur. 39
Figure III. 8. Variation de la vitesse initiale
en fonction de la concentration en substrat 40
pour une reaction de
Michaelis-Menten simple en presence de differentes concentrations d'un
inhibiteur incompetitif.
Figure III. 9. Representation de Lineweaver-Burk
de l'enzyme michaelienne inhibee 40
incompetitivement decrite dans
la Figure 111.8.
Figure III. 10. Mecanisme reactionnel en
presence d'inhibiteur. 40
Figure III. 11. Variation de la vitesse initiale
en fonction de la concentration en substrat 41
pour une reaction de
Michaelis-Menten simple en presence de differentes concentrations d'un
inhibiteur non competitif.
Figure III. 12. Representation de
Lineweaver-Burk de l'enzyme michaelienne inhibee 41
non
competitivement decrite dans la Figure MA 1.
Figure III. 13. Structure de l'alpha amylase.
43
Figure III. 14. Les inhibiteurs : l'acarbose et
l'octapeptide de la reaction catalysee par 44
l'amylase.
Figure III. 15. Structure schematique de la
trypsine. 46
Figure III. 16. Voies d'activation des
proenzymes et du PAR-2 par la trypsine. 48
Figure III. 17. Structure tridimensionnelle de
la lipase pancreatique humaine. 49
Figure IV. 1. La poudre de chaque plante apres
le broyage. 54
Figure IV. 2. Le lavage par l'hexane de deux
extraits des plantes Zewadet Elkhrouf et 55
Gondale.
Figure IV. 3. Les extraits alcooliques bruts.
56
Figure IV. 4. L'acide gallique. 57
Figure IV. 5. Figure IV. 6. Figure IV. 7.
Figure IV. 8. Figure IV. 9. Figure V. 1. 1. Figure V. 1. 2. Figure V.
1. 3. Figure V. 1. 4. Figure V. 1. 5.
Figure V. 1. 6.
Figure V. 2. 1. Figure V. 2. 2.
Figure V. 2.3. Figure V. 2.
4.
Figure V. 2. 5.
Figure V. 3. 1. Figure V.
3.2. Figure V. 3.3. Figure V. 3.4.
Figure VI. 1.
Figure VI. 2. Figure VI. 3 Figure VI.
4. Figure VI. 5.
La courbe d'etalonnage de l'acide gallique. 57
Le spectrophotometre UV- visible de Shimadzu 1601. 57
La catechine. 59
La courbe d'etalonnage de la catechine. 59
La teneur en composes phenoliques et en flavonokles des plantes.
61
L'action de l'a- amylase sur l'amidon. 65
La courbe d'etalonnage de maltose. 66
La cinetique enzymatique de l'a amylase. 67
Representation de Lineweaver-Burk de l'enzyme a- amylase.
67
Representations graphiques 1/V = f ([polyphenols]) de chaque
extrait 68
phenolique tel que 1/V (s/ADO).
([S3]> [S2]> [S1]).
Le taux d'inhibition de l'a amylase avec deux concentrations
70
d'inhibiteur croissantes (Rd < [I2]) et une seule
concentration de substrat.
L'action de la trypsine sur le BAPNA. 72
La cinetique enzymatique de la trypsine. 73
Representation de Lineweaver-Burk de l'enzyme trypsine.
73
Representation graphique 1N = f ([polyphenols]) de Foulia tel que
74
([Si] < [S2] < [S3] <
[S4] < [S5]).
77
78
78
79
84
85
86
87 88
Le taux d'inhibition de la trypsine avec une concentration fixe
de 75
substrat et d'inhibiteur.
L'action de la lipase sur l'huile de maIs.
La cinetique enzymatique de la lipase.
Representation de Lineweaver-Burk de l'enzyme michaelienne
lipase. Le taux d'inhibition de la lipase avec trois concentrations
d'inhibiteur croissantes ([Ii] < [12] <
[I3]) et une seule concentration de substrat.
.
Piegeage des ERO (R) par les flavonokles.
Elements essentiels pour l'activite antioxydante des flavonokles.
La reaction entre le DPPH et l'hydroquinone.
Les graphes PI =f (C) de chaque plante.
Classement croissant des plantes selon leur EC50.
Liste des tableaux
Tableau II. 1. Tableau III. 1. Tableau IV. 1. Tableau IV.
2. Tableau IV. 3. Tableau V. 1. 1. Tableau V.
3. 1. Tableau V. 2. 1. Tableau V. 1. 2.
Tableau VI. 1.
Les principales classes des composees phenoliques. Classification
des enzymes selon la reaction catalysee. La couleur et l'aspect de chaque
extrait phenolique. La teneur en phenols totaux des plantes investiguees.
24 42
56 58 60 69 69 75 81 90
La teneur en flavonoIdes et leur pourcentage des plantes
investiguees. Le type d'inhibition et la constante d'inhibition de chaque
plante.
Le pourcentage d'inhibition de chaque plante. Le pourcentage
d'inhibition de chaque plante.
Le pourcentage d'inhibition de chaque plante. Les EC50
de chaque plante.
Table des matieres
Introduction generale 10
Bibliographie 12
Partie bibliographique 13
I. les plantes medicinales
14
1. La phytotherapie 15
1.1. La phytotherapie, une medecine vieille comme le monde
15
1.2. La definition de la phytotherapie 15
1.3. Avantages de la phytotherapie 15
2. Les plantes medicinales 16
2.2. Importance de l'utilisation des plantes medicinales
16
2.3. Fiches monographiques des plantes investiguees
17
Bibliographie 21
II. Les composes phinoliques
22
1. Les composees phenoliques ou les polyphenols 23
2. Classification des composes phenoliques 23
2.1. Les flavonoides 28
2.2. Les proprietes des flavonoides 29
3. Dans une cellule vegetale oil se trouve chaque compose
phenolique ? 29
4. Role et interet des polyphenols 30
5. Quelques exemples d'implication industrielle des composes
phenoliques 30
5.1. Utilisation des tanins 31
5.2. Importance des composes phenoliques dans la qualite du
bois 31
Bibliographie 32
III. Les enzymes 33
1. Historique 34
2. Definition d'un enzyme 34
3. La specificite enzymatique 34
4. La cinetique enzymatique 35
4.1. L'activite enzymatique 35
4.1.1. Reaction catalysee par une enzyme 35
4.1.2. Linearisation de l'equation de Michaelis-Menten
36
4.2. L 'inhibition enzymatique 37
4.2.1. Les inhibiteurs 37
4.2.2. Les types d'inhibition
4.2.2.1. Les inhibiteurs competitifs
4.2.2.2. Inhibition incompetitive 4.2.2.3. Les inhibiteurs
non-competitifs
5. Classification des enzymes
6. Les enzymes etudies
6.1. La a amylase
6.1.1. La reaction specifique
6.1. 2. Interet de l'inhibition de l'alpha amylase
6.2. La trypsine
6.2.1. La reaction specifique
6.2.2. Interet de l'inhibition de la trypsine
6.3. La lipase
6.3.1. La reaction specifique
6.3.2. Interet de l'inhibition de la lipase
Bibliographie
La partie experimentale
IV. Extraction et quantification des composies
phinoliques
1. Extraction des composes phenoliques
2. Quantification des composees phenoliques
2.1. Dosage des phenols totaux 2.1.1. La courbe d'etalonnage
2.1.2. Traitement des echantillons 2.1.3. Resultats et discussion
2.2. Dosage des flavonoides 2.2.1. La courbe d'etalonnage
2.2.2. Resultats et discussion
3. Conclusion
Bibliographie
V. Effets des extraits phinoliques sur les
enzymes
a- Amylase
1. Principe de la methode
2. Procedure experimentale 3. Resultats et
discussion
Conclusion
Ttypsine 71
1. Principe de la methode 72
2. Procedure experimentale 72
3. Resultats et discussion 73
4. Conclusion 75
Lipase 76
1. Principe de la methode 77
2. Procedure experimentale 77
3. Resultats et discussion 77
4. Conclusion 80
Bibliographie 81
VI. Evaluation de l'activite antioxydante
82
1. Les radicaux libres 83
1.1. Les differents types des radicaux libres 84
2. L'activite antioxydante et les antioxydants 85
2.1. L'activite antioxydante 85
2.2. Les antioxydants 85
2.2.1. Les antioxydants synthetiques 85
2.2.2. Les antioxydants naturels 86
3. Test de DPPH 86
3.1. Principe de la methode 86
3.2. Procedure experimentale 86
3.3. Resultats et discussion 87
4. Conclusion 90
Bibliographie 91
Conclusion generale 92
Index des noms latins 94
introduction
La medecine alternative ou la phytotherapie
est Part de guerir par les plantes, elle est aussi la connaissance et
l'utilisation de leurs proprietes therapeutiques (Philippe Sionneau,
2006). La phytotherapie suscite actuellement un renouveau
d'interest, son efficacite est prouvee et elle est toujours vue
comme un remede surtout utilise par la population rurale a travers le monde.
Les plantes medicinales sont douees de cette efficacite a
cause de ses metabolites secondaires ou ses principes actifs : les composes
phenoliques, les alcalokles, les huiles essentielles... Notre pays est riche de
ce type des plantes qui sont utilisees en medecine traditionnelle.
Les composes phenoliques ont un effet inhibiteur sur les
enzymes (M. Yousfi et al, 2006) et ils sont connus
par son pouvoir antioxydant ((M. Yousfi et al, 2007),
ce qui prouve leur utilisation therapeutique.
Les enzymes qui seront etudiees dans ce travail sont : l'a-
amylase qui degrade les polymeres glycosidiques ce qui cause
l'augmentation du taux de glucose chez les diabetiques (Myo-Jeong Kim
et al, 1999), la trypsine qui coupe les liaisons
peptidiques specifiques ce qui active d'autres enzymes dans le pancreas peuvent
étre responsables de la pancreatite (D. Page et al,
2000) et la lipase qui degrade les triglycerides en acides gras
ce qui permet leur stockage dans le tissu adipeux causant l'obesite
(May Faraj et al, 2004).
Les plantes sahariennes utilisees dans cette recherche sont
recoltees de la region de Laghouat, elles sont de diverses familles botaniques
douees de differentes caracteristiques, apres la connaissance et
l'identification de ces sept plantes, nous avons cherche si les extraits
phenoliques des plantes possedent le pouvoir inhibiteur de ces enzymes ou
non.
Dans ce travail, on commence par quelques connaissances
bibliographiques concernant la phytotherapie et les plantes etudiees, dans un
deuxieme chapitre on s'interesse aux metabolites secondaires « les
composes phenoliques », dans le dernier chapitre nous avons evoque les
enzymes etudies et Pinter& de leur inhibition.
L'objectif principal de ce travail est d'evaluer l'effet
inhibiteur des extraits des plantes en faible concentration sur l'activite des
trois enzymes cites ci-dessus et d'utiliser ces plantes comme une cure de
certaines maladies.
Bibliographie
· D. Page, L. Quillien, and G. Duc, 2000,
Trypsin inhibitory activity measurement:
simplifications used for pea seed,
published in Crop Sci. Volume 40, pp 1482-1485.
· M. Yousfi, A. Djeridane, B. Nadjemi, S.
Maamri, F. Djireb, P. Stocker, December 2006, Phenolic extracts from
various Algerian plants as strong inhibitors of porcine liver carboxylesterase,
J Enzyme Inhib Med Chem, Volume 21, No 6, pp 719-726.
· M. Yousfi, A. Djeridane, B. Nadjemi, N. Vidal,
JF. Lesgards and P. Stocker, April 2007, Screening of some Algerian
medicinal plants for the phenolic compounds and their antioxidant activity,
J European Food Research and Technology, Volume 224, No 6, pp
801-809.
· May Faraj, Allan D. Sniderman, and Katherine
Cianflone, April 2004, ASP enhances in situ lipoprotein lipase
activity by increasing fatty acid trapping in adipocytes, Journal of Lipid
Research, Volume 45, 657-666.
· Myo-Jeong Kim, Soo-Bok Lee, Hee-Seob Lee,
Su-Yong Lee, Jin-Sook Baek, Doman Kim, Tae-Wha Moon, John F. Robyt, and
Kwan-Hwa Park, 1999, Comparative Study of the Inhibition of
a-Glucosidase, a-Amylase and Cyclomaltodextrin Glucanosyltransferase by
Acarbose, Isoacarbose, and Acarviosine#177;Glucose, Archives of Biochemistry
and Biophysics, Volume. 371, No. 2, pp. 277-283.
· Philippe Sionneau, 2006, La
phytotherapie chinoise moderne, p500.
Var6e
06(ioirapkque
.&so plantes
Macinaies
1. La phytotherapie
La phytotherapie, c'est l'emploi de medicaments vegetaux pour
soigner les differents maux dont vous pouvez étre victime.
A travers les siecles, les hommes ont su developper la
connaissance des plantes et de leurs proprietes therapeutiques.
Aujourd'hui, l'efficacite prouvee et les bienfaits incontestables
de la phytotherapie pour notre sante lui ont permis d'entrer dans nos vies de
tous les jours (Gildo Pastor, 2006). 1.1. La
phytotherapie, une medecine vieille comme le monde
Les fruits, les racines, les plantes et autres substances
naturelles ont toujours ete connues pour leurs proprietes nutritives, mais
aussi pour leurs vertus curatives.
Le premier texte ecrit sur la medecine par les plantes est grave
sur des tablettes en argile en caractere cuneifonne et date de la civilisation
sumerierme, 3000 ans avant Jesus-Christ. Durant des milliers d'armees, la
phytotherapie a constitue la principale source de remedes contre de nombreuses
maladies (Larousse Encyclopedie MEMO, 1999).
1.2. Avantages de la phytotherapie
L'ethnobotanique est une discipline scientifique dont le but
est de mieux cormaitre les pharniacopees traditionnelles utilisees dans
certaines regions. L'inventaire partiel etabli dans divers pays par
l'organisation mondiale de la sante repertorie environ 20 000 plantes
medicinales. Parmi les 250 000 especes de plantes que compte actuellement notre
planete, moms de 10% ont fait l'objet d'analyses chimiques fines pour detecter
d'eventuels principes actifs. Une etude plus systematique des plantes
medicinales pourrait se traduire par la decouverte de nouveaux medicaments
utilisables.
Tous les organes d'une plante medicinale ne sont pas
forcement actifs ; suivant les especes, on utilise les fleurs, les feuilles,
les fruits, les tiges, les ecorces ou les racines. L'epoque et le moment de la
cueillette ont une grande influence sur l'activite therapeutique, car les
phenomenes biochimiques qui ont lieu dans les cellules vegetales dependent de
la photosynthese et de phenomenes hormonaux qui dependent du rythme solaire.
Les substances contenues dans les plantes sont de nature
chimique variee ; certaines sont solubles dans l'eau, d'autres dans l'alcool
ethylique, d'autres encore dans l'huile. A partir des plantes medicinales, on
peut obtenir differentes preparations : infusions, decoction, maceration dans
l'alcool (teinture) ou dans l'huile (extraction huileuse, plus rare), etc. Les
plantes peuvent aussi étre consommees entieres, fraiches ou seches,
reduites en debris plus ou moms fins, eventuellement conditiormees en gelules.
Les seves et secretions sont egalement utilisees dans certains cas. Il est enfm
possible d'en extraire chimiquement des principes actifs en vue de leur
utilisation therapeutique.
Certaines plantes sont inoffensives, mais d'autres, tits
nombreuses (digitale, belladone, colchique, etc.), sont toxiques et ne sont
utilisees que sous des formes bien contrOlees, exclusivement commercialisees en
pharmacie. L'emploi inconsidere de plantes cueilles dans la nature peut aboutir
a des intoxications graves, voir mortelles (Larousse Encyclopedie MEMO,
1999).
2. Les plantes medicinales
En botanique et en pharmacie, les plantes medicinales sont
reconnues pour offrir, par leur administration, un effet bienfaisant et
therapeutique sur l'organisme. Employees depuis la plus haute antiquite,
souvent en relation avec des pratiques magiques, leurs proprietes reelles ont,
a toute époque, ete exagerees, ou niees, ou deformees selon les
croyances en vigueur. A l'epoque moderne, les progits de la biochimie et de
l'analyse organique, ainsi que ceux de la physiologie vegetale, ont permis de
commencer un tri scientifique dans la masse des actions attribuees aux simples,
detruisant certaines legendes, mais etablissant solidement certains usages
empiriques anciens. Il est assure que, pour obtenir des resultats utiles, it
convient de se documenter au moyen d'ouvrages serieux en vue de
l'identification botanique des plantes choisies et de la verification de leurs
proprietes : certaines espêces ont des actions parfois differentes, et
méme contraires de celles qui leur avaient ete attribuees
traditionnellement. Méme pour les plantes medicinales qui repondent bien
a leur renommee, le choix des varietes, celui du terrain sur lequel elles
poussent, de la saison ou de l'heure du jour oil on les cueille, sont des
facteurs tits importants, pouvant modifier jusqu'a 100 p. 100 la teneur en
principes actifs physiologiquement (Universalis, 2006).
2.1. Importance de l'utilisation des plantes
medicinales
Il est acquit que les plantes medicinales sont en mesure de
soigner des maladies simples comme le rhume, ou d'en prevenir de plus
importantes comme l'ulcêre, la migraine, l'infarctus en plus de certaines
allergies ou affections. Si l'on y ajoute leurs vertus reparatrices,
tonifiantes, sedatives, revitalisantes ou immunologiques, on mesure mieux
l'aide precieuse qu'elles sont susceptibles de nous apporter au quotidien
(Anonyme, 2005).
Chapitre I: les plantes
medicinales


2.2. Fiches monographiques des plantes investiguees
Atractylis serratuloides
Nom vernaculaire : Serr,
jmall
Famille : Compositae (Asteraceae)
Descriptions Botaniques :
Plante vivace a tiges epaisses dressees de 20 a 30 cm de
haut, tres ramifiees a toutes les hauteurs, a rameaux tres feuilles.
Feuilles tres epineuses a epines jaune
fonce, les fleurs Carminees.
Habitat : Pfitures semi arides, hauts plateaux,
Regs caillouteux et les hamadas.
Recolte : octobre 2006.
Parties Utilisees : partie aerienne
(feuilles, fleurs, tiges). Mode d'emploi : Extraction des
racines un latex "Loubene".
Interest pastoral: C'est une plante broutee
par les dromadaires (Dr A. Chehma, 2006).
Astragalus armatus
Nom commun : Astragale,
Nom vernaculaire : Gondale,
JI
·l
Famille : Legumineuse
Descriptions Botaniques :
Arbrisseau tres dense a rameaux dresses de taille 50 cm a 1
metre, les feuilles fraiches bien vertes avec de nombreuses
petites folioles, les fleurs blanches sont
nombreuses.
Habitat : la zone predesertique du Sahara
septentrional. Recolte : octobre 2006.
Parties Utilisees : racines.
Mode d'emploi : broutee par les dromadaires
(Dr A. Chehma, 2006).
Astragalus vogelii fatimensis


Nom vernaculaire : Foulia,
;13...9i
Famille : Fabaceae.
Descriptions Botaniques :
est une plante herbacee, feuilles
pennees a folioles ovales. Nombreuses petites fleurs jaunes
portees sur une hampe florale. Gousses courtes, globuleuses,
en forme de grain de ble et recouvertes de longs poils, la feuille
est composee renfermant entre 3 et 8 folioles et terminee par une
vrille ramifiee (Sahara-nature).
Habitat : Sahara central et occidental.
Recolte : octobre 2006.
Parties Utilisees : partie aerienne.
Mode d'emploi : alimentation des animaux.
Haloxylon scoparium
Nom vernaculaire : Remth, eLAJ1
Famille : Chenopodiacees
Descriptions Botaniques :
Ce petit buisson dense et sombre, est tres frequent sur les
regs a sols gypseux, ses fleurs sont discretes mais a
la fin de l'automne, l'extremite de ses rameaux se couvre de fruits.
Habitat : Pfitures semi arides, hauts
plateaux.
Recolte : octobre 2006.
Parties Utilisees : parties aeriennes
(fleurs).
Mode d'emploi :
Phannacopee: Ses rameaux, ses feuilles et ses fleurs
(en decoction, en maceration, en cataplasme), sont utilises pour les
traitements des indigestions, des piqines de scorpion et des dermatoses
(Dr A. Chehma, 2006).
Helianthemum lippii, Helianthemum ellipticum


Nom vernaculaire : Reguig,
cliki31
Famille : Cistaceae
Descriptions Botaniques :
Arbrisseau vivace de taille 30 a 40 cm, tres rameux a
feuilles sessiles couvertes de tres courts poils ce qui
donne une couleur blanchfitre a la plante. L'ecorce des rameaux est egalement
blanchfitre. Petites fleurs jaunes sessiles a cinq petales en
grappes peu fowl-lies.
Habitat : Dans tout le Sahara.
Recolte : octobre 2006.
Parties Utilisees : parties aeriermes.
Mode d'emploi :
Phannacopee: en poudre ou en compresse, pour les
traitements des lesions cutanees.
Interest pastoral: Elle tres appreciee par les
dromadaires et les chevres (Dr A. Chehma, 2006).
Plantago ciliata
Nom vernaculaire : Lelma, U.1
Famille : Plantaginaceae
Descriptions Botaniques :
Plante herbacee annuelle de petite taille 10 a 15 cm de haut
a tige tres courte, les feuilles naissent a la base de la
plante, sont lanceolees etroites velues.
Fleurs petites et verddtres en epis
globuleux.
Habitat : sur les sols sableux et
gravillonnaires, dans les depressions et lits d'oued (Dr A. Chehma,
2006) Recolte : octobre 2006.
Parties Utilisees : parties aeriermes
(fleurs).
Mode d'emploi : Elle est utilisee comme
cicatrisante des blessures et pour les traitements des inflammations de la
gorge et des ulceres (Dr A. Chehma, 2006).
If loga spicata

Nom vernaculaire : Zwadet Elkhrouf, 1-4)&31
U..1) Famille : Compositae (asteraceae)
Descriptions Botaniques :
Petite plante de taille 3 a 10 cm, a tige centrale dressee,
emettant de nombreux rameaux couches puis releves. On rencontre plus
frequemment la plante sous son aspect sec que vert.
Les rameaux sont couverts de feuilles etroites obtuses
couvertes de poils appliqués. Les tres nombreux capitules floraux sont
disposes en Mice tres sen-ee ce qui donne a la plante un aspect de boudin
(Sahara-nature).
Les fleurs discrêtes blanc-jaunatre sont
entourees de bractees devenant jaune pale brillant en sechant.
Habitat : Espêce saharo-arabique, commune dans
tout le Sahara, dans les sols pierreux (Dr A. Chehma, 2006).
Recolte : octobre 2006.
Parties Utilisees : parties aeriennes.
Phannacopee: Ecrasee, elle est utilisee pour le
traitement des lesions cutanees.
Inter& pastoral: Elle est broutee par les
dromadaires.
Chapitre I: les plantes
medicinales
Bibliographie
· Anonyme, 2005, Ministêre de
l'Agriculture Et du Developpement Rural, Unite De Conservation et de
Developpement - Batna.
· Dr Abdelmajid Chehma, juin 2006,
catalogue des plantes spontanees du Sahara septentrional algerien, edition Dar
Elhouda, AM mlila, p 22, 32, 66, 73, 81, 104.
· Gildo Pastor, septembre 2006,
Précis de phytotherapie, edition Alpen, p 3,4.
· Larousse Encyclopedie MEMO, 1999,
le" edition Montreal (Quebec), p182.
· Les photos des plantes sont clichees par M. M.
Benarous en mai 2007 de la localite
de AM Madhi, Laghouat.
· Les plantes sahariennes sont identifiees par M A.
DJERIDANE et confirme par Dr M OUINTEN et M A.
SARIDI.
· Universalis Encyclopedia (CD), 2006.
·
www.sahara-nature.com.
Chapitre II: les composes phenoliques
Une des originalites majeures des vegetaux reside dans leur
capacite a reproduire des substances naturelles tres diversifiees. En effet, a
cote des metabolites primaires classiques (glucides, protides, lipides, acides
nucleiques), ils accumulent frequemment des metabolites dits « secondaires
» dont la fonction physiologique n'est pas toujours evidente mais qui
represente une source importante de molecules utilisables par l'homme dans des
domaines aussi differents que la pharmacologie ou l'agroalimentaire. Les
metabolites secondaires appartiennent a des groupes chimiques varies
(alcalokles, temenes, composes phenoliques...) qui sont tres inegalement
repartis chez les vegetaux mais dont le niveau d'accumulation peut quelquefois
atteindre des valeurs elevees. La notion de « metabolite secondaire »
resultait initialement de trois groupes d'observations : d'abord une difficulte
a attribuer a ces metabolites une fonction precise dans la physiologie
méme de la plante, ensuite une repartition tres inegale selon les
vegetaux, quelquefois entre des especes ou varietes a l'interieur d'une
méme espece, enfm une certain « inertie biochimique » car ces
substances sont rarement remobilisees dans la plante apres qu'elles y ont ete
accumulees (Jean-Jacques Macheix et al, 2005).
1. Les composees phenoliques ou les
polyphenols
Le terme volyphenols» est
frequemment utilise dans le langage courant et méme dans des articles
scientifiques ou de vulgarisation pour designer l'ensemble des composes
phenoliques des vegetaux. En fait, it devrait étre reserve aux seules
molecules presentant plusieurs fonctions phenols. Ce qui exclurait alors les
monophenols, pourtant abondants et importants chez les vegetaux. Donc la
designation generale «composes phenoliques» concerne a la fois les
mono-. di- et polyphenols dont les molecules contiennent respectivement une,
deux ou plusieurs fonctions phenoliques (Jean-Jacques Macheix et
al, 2005).
2. Classification des composes
phenoliques
Plusieurs milliers de composes phenoliques ont ete
caracterises jusqu'a aujourd'hui chez les vegetaux. Bien qu'etant tres
diversifies, ils ont tous en commun la presence d'un ou de plusieurs cycles
benzeniques portant une ou plusieurs fonctions hydroxyles.
Les composes phenoliques peuvent étre regroupes en de
nombreuses classes (Tableau II. 1) qui se differencient d'abord par la
complexite du squelette de base (allant d'un simple C6 a des formes tres
polymerisees) ensuite par le degre de modifications de ce squelette (degre
d'oxydation, d' hydroxylation, de methylation...), enfin par les liaisons
possibl es de ces molecules de bases avec d'autres molecules (glucides,
lipides, proteins, autres metabolites secondaires pouvant étre ou non
des composes phenoliques (Jean-Jacques Macheix et al,
2005).
Tableau IL1 : Les principales classes de
composees phenoliques (Jean-Jacques Macheix et al,
2005)
|
Les composes phenoliques
|
Classe
|
Sous classe
|
Structure chimique
|
Caracteristique
|
Exemple
|
|
Les formes simples
|
Acides
hydroxybenzoIques
|
(p-hydroxybenzoIque. Protocatechique Vanillique, gallique.
Syringique, salicylique, gentisique
|
' OH
·
|
sont representes chez les gymnospermes et les angiospermes.
existent sous forme d'esters.
|
* epices * fraise
|
|
Acides hydroxycinnamiques
|
Acide cinnamique Acide p-coumarique Acide cafeique
Acide ferulique
|
COOH
OH lei
R3
|
* souvent lies a d'autres molecules organiques. * existent sous
forme d'esters.
|
* * grains de (pomme, fruits
pomme de terre)
|
|
Flavonokles
|
Chalcones
|
0
(SI
IP
|
* antibacterien * antifongique
|
divers
|
|
Flavanones
|
'
H1
|
* antioxydant
* anti-inflammatoire * anti radicalaire
|
Agrumes : orange, citron, pamplemousse
|
|
Flavonols
|
CI I-1
MS
11111
CI H
CI I-I
|
* anti-inflammatoire * anti- allergique
|
* fruits
* legumes * fleurs
|
|
Les composes phenoliques
|
Classe
|
Sous classe
|
Structure chimique
|
|
Caracteristique
|
Exemple
|
|
Les formes
simples
|
Flavonokles
|
Flavones
|
H C
|
POD
allii
_
· H 1
|
|
* anti-inflammatoire * anti- cancer
|
* celeri, persil * la peau des fruits
|
|
Anthocyanidines
|
|
---1H
1H
|
0 H
|
* responsable de la couleur des plantes.
* responsable de l'astringence des fruits.
|
* Aubergine * Cerise
* Fraise
* Rhubarbe
* Choux rouge
|
|
Isoflavones
|
R3c
|
-r-8 Ra
1 2' - '';.,
_._.4_
|
|
* anti cancer
* Phytoestrogênes
|
* haricots de soja
* produits de soja
|
|
Autres
particuliers
|
Oleuropeine
|
o cii--Lo
II
H3C0- C
|
OH
o_cii--oil . OF
-- CI+ Cli
0- Glucose
|
* antioxydantes
* antibacteriermes * antivirales.
|
* olive
|
|
vanilline
|
|
|
CHO
1.1
OH
|
OCH 3
|
|
* aromatisant
|
* graines de vanille
|
|
Les composes phenoliques
|
Classe
|
Sous classe
|
Structure chimique
|
Caracteristique
|
Exemple
|
|
Les formes
|
Tanins
|
condense
|
. _
· 1111_,.
110 OH
4111
= 41111111 .,
0 ;-i 02-E MS"
-=411-_
IIIII -
-
|
* anti parasitaire (gastro- intestinale chez les animaux). *
capable de se Her avec les proteins animales.
|
* Raisin rouge prune
* fraise
* the
* paume
|
|
'H OH
OH
·
·H
OH--.
OH 'H OH
· H C.,' 0 1
OH .
i
OH
OH OH
O
OH OH
|
* anti parasitaire (gastro- intestinale chez les animaux). *
capable de se her avec les prproteinsanimales.
|
* chén
* Chdtaignier
*
dicotyledon
|
|
Polymerisation de 3 sous unites d'alcool :
* p-coumarylique * coniferylique * sinapylique
|
uu HO
oqd--E) 110H
OM.
101
04
HO OH no HO
·
0MO
MeO CH4
CM.
99
|
* hydrophobes
* lignification des tissus vegetaux.
* role de soutien de la plante.
|
* boil
* noyaux des fruits
angiospermes gymnospermes
|
|
Les composes phenoliques
|
Classe
|
Structure chimique
|
Caracteristique
|
Exemple
|
Les formes bees
a des
macromolecules
non
phenoliques
|
Liees a des glucides
|
OH
OH
R
CH 2 OH
It
OH
lb OCH 3
OCH
OH W
0 o
i
OH CH 2
OH
|
* la reticulation de la paroi cellulaire
|
* la pulpe de la betterave
|
|
|
* lipophile
* defense de la plante contre les attaques biologiques.
|
* tubercule de pomme de terre
* pin
* chéne
|
|
|
Parmi les composes phenoliques les flavonokles occupent une
large classe.
2.1. Les flavondides
L'ensemble des flavonokles, de structure generale en C15
(C6-C3-C6), comprend a lui seul plusieurs milliers de molecules regroupees en
plus de dix classes dont certaines ont une tres grande importance biologique et
technologique: les anthocyanes, pigments rouges ou bleus, les flavones et les
flavonols, de couleur creme ou jaune clair, les flavanes dont les produits de
condensation sont a l'origine d'un groupe important de tannins et les
isoflavones qui jouent un role dans la sante humaine.
Figure ILL Squelette de base des flavonokles
(Abdelghafour MARFAK, 2003).
C'est d'abord la structure de l'heterocycle central et son
degre d'oxydation (Figure II.1) qui pennettent de distinguer les differentes
classes de flavonokles. Le cas extreme d'oxydation (le l'heterocycle central
correspond aux anthocyanidines, toujours presentes en milieu acide sous forme
d'un cation de couleur rouge, dit cation flavylium. Au contraire, dans le cas
des flavanes (flavane-3-ols comme la catechine; flavane-3,4-diols (quelques
fois denommes leucoanthocyanes car ils peuvent dormer des anthocyanes rouges
sous l'action d'un acide), le cycle central est tres fortement reduit. On
trouve des situations intennediaires chez les flavanones, les flavones, les
flavonols et d'autres groupes. Exceptionnellement, le noyau central de la
molecule peut ne pas étre totalement cyclise (chez les chalcones et
molecules voisines) ou se presenter sous forme d'un cycle ne presentant que 5
sommets (cas des aurones, de couleur generalement jaune vif).
A l'interieur de chacune des classes, les variations autour
du squelette chimique de base en C15 portent principalement sur trois
points:
- Le degre d'hydroxylation : des differents
cycles: ainsi, le cycle B est mono-hydroxyls chez le kaempferol ou la
pelargonidine, di-hydroxyls chez la quercetine ou la cyanidine, trihydroxyle
chez la myricetine ou la delphinidine. Il en resulte des differences de spectre
d'absorption donc de couleur chez les anthocyanidines et les autres
pigments.
- Le niveau de methoxylation : (groupements
O-CH3 a la place des seules fonctions phenoliques) : La
methoxylation diminue l'hydrosolubilite des molecules qui, dans des cas
extremes, sont alors presentes dans les exsudats de certains bourgeons
(peuplier) ou liees a des structures lipidiques comme les cires de feuilles
d'eucalyptus.
- Le niveau de glycosylation :
en dehors de quelques exceptions (d'une part le groupe des flavanes et
d'autre part quelques flavonokles excretes dans les exsudats) les flavonokles
des vegetaux sont presque tous lies a des sucres. A ce titre, ils appartiennent
au grand groupe des heterosides, la partie phenolique representant ici
l'aglycone. Il en resulte une complication dans la nomenclature que nous
expliciterons seulement dans le cas des anthocyanes. Ainsi, alors que le terme
« anthocyanes » a une valeur generale (designant soit les formes
naturelles glycosylees soit la molecule non glycosylee), la partie phenolique
seule est designee sous le nom d' anthocyanidines (par exemple la
pelargonidine ou la malvidine), alors que l'heteroside (molecule phenolique +
sucre associe) prend celui d' « anthocyanine » (la pelargonine ou la
malvine). Des regles semblables ou voisines sont adoptees pour les autres
flavonokles (par exemple la quercetine designant l'aglycone alors que la
quercitrine correspond a ce méme aglycone lie au rhamnose
(Jean-Jacques Macheix et al, 2005).
2.2. Les proprietes des flavondides
Une des proprietes majeures des flavonokles est de contribuer
a la couleur des plantes et notamment a celle des fleurs. Or, c'est par la
couleur de ses fleurs que la plante exerce un effet attracteur sur les insectes
et les oiseaux pollinisateurs, assurant par ce biais une &ape fondamentale
de sa reproduction. On peut egalement noter que les flavonokles, en repoussant
certains insectes par leur gout desagreable, peuvent jouer un role dans la
protection des plantes.
Par ailleurs, les flavonokles presentent un
interest therapeutique qui date de la decouverte de la vitamine C
par Szent Gyorgyi (Prix Nobel, 1937), chercheur de l'Universite de Szeged
(Hongrie), qui a constate que les symptOmes hemorragiques du scorbut, lies a la
fragilite ou l'hyperpermeabilite des vaisseaux, etaient gueris par des extraits
de paprika ou de jus de citron, riches en vitamine C et flavonokles. Cette
action a ete appelee proprietes vitaminique P (P etant la premiere lettre du
mot permeabilite).
3. Dans une cellule vegetale oft se trouve chaque
compose phenolique ?
Une des caracteristiques des composes phenoliques, qu'ils
partagent generalement avec l'ensemble des metabolites secondaires, est de
montrer une repartition tress inegale chez les differentes especes vegetales
et, pour une méme espece, selon la variete et le stade de developpement
physiologique ; les variations sont egalement considerables selon la nature des
tissus et des cellules composant le vegetal.
Les variations chimiques rapportees precedemment ont comme
consequence de modifier profondement la solubilite des molecules dans l'eau et
d'entrainer des modifications significatives de leur repartition dans la
cellule vegetale. On observe ainsi une
compartimentation nette des composes phenoliques avec deux
localisations principales bien distinctes:
- D'une part, la vacuole oil sont presents tous les composes
ayant un caractere hydrophile plus ou moins marque. Ils correspondent a la
plupart des formes simples decrites precedemment et a certaines formes
polymerisees comme les tannins. Il faut rappeler que la glycosylation tres
frequente des molecules phenoliques augmente considerablement
hydrosolubilite.
- D'autre part, la paroi oil sont retrouvees la lignine et les
differentes formes liees aux structures lipidiques, Dans les tissus oil la
plupart des cellules sont mortes (le bois par exemple), les composes
phenoliques, et en particulier les flavonokles, se retrouvent alors adsorbes
sur les structures parietales. Par ailleurs, certains flavonokles simples a
caractere apolaire (par exemple des formes tres methylees de flavonokles)
peuvent egalement étre presents dans des exsudats a la surface de
bourgeons ou de feuilles (Jean-Jacques Macheix et al,
2005).
4. Role et interet des polyphenols
Le role des composes phenoliques est maintenant reconnu dans
differents aspects de la vie de la plante et dans l'utilisation que fait
l'homme des vegetaux. Ils peuvent en effet intervenir:
· dans certains aspects de la physiologie de la plante
(lignification. regulation de la croissance, interactions moleculaires avec
certains microorganismes symbiotiques ou parasites...).
· dans les interactions des plantes avec leur
environnement biologique et physique (relations avec les bacteries, les
champignons, les insectes, resistance aux UV), soit directement dans la nature
soit lors de la conservation apres recolte de certains vegetaux.
· dans les criteres de qualite (couleur, astringence,
amertume, qualites nutritionnelles...) qui orientent les choix de l'homme dans
sa consommation des organes vegetaux (fruits, legumes, tubercules...) et des
produits qui en derivent par transformation.
· dans les variations de certaines caracteristiques des
vegetaux lors des traitements technologiques (preparation des jus de fruits,
des boissons fermentees...) pendant lesquels apparaissent frequemment des
brunissements enzymatiques qui modifient la qualite du produit fini.
· dans la protection de l'homme vis-à-vis de
certaines maladies en raison de leur interaction possible avec de nombreuses
enzymes et de leurs proprietes antioxydantes (Jean-Jacques Macheix et
al, 2005).
5. Quelques exemples d'implication industrielle des
composes phenoliques
Comme cela vient d'être largement developpe dans les
paragraphes precedents, les multiples proprietes chimiques ou biologiques des
composes phenoliques donnent a ces molecules et aux plantes qui les contiennent
un interest economique certain qui est pris en compte par les
industries agro-alimentaires et pharmaceutiques. En outre,
dans certains cas egalement três importants d'un point de vue economique,
les phenols naturels participent directement au developpement d'activites
industrielles dont certaines bien que três anciennes, beneficient des
progrês scientifiques et technologiques et de notre meilleure
connaissance des proprietes chimiques de ces composes. Nous retiendrons ici
deux exemples particuliêrement importants. 5.1. Utilisation des
tanins
La fabrication du cuir par tannage des peaux des animaux est une
activite humaine traditionnelle, déjà mise en oeuvre it y a
plusieurs millenaires dans le bassin mediterraneen. Elle a utilise pendant
longtemps des extraits vegetaux riches en tannins: ecorces et bois de
differents arbres ou arbustes (chéne, chataignier, eucalyptus, acacia.
Quebracho, etc.), fruits de myrobolan ou de differentes Cesalpiniees, feuilles
de sumac, galles causees par les attaques d'insectes sur les chénes ou
le pistachier... Les tannins d'origine vegetale ont cependant ete
progressivement supplantes, au cours du XXe si&le, par des
«tannins» mineraux (en particulier les sels de chrome) et ne sont
plus utilises que pour la fabrication de cuirs particuliers d'articles de luxe
ou d'orthopedie.
Les proprietes tannantes des tannins (qu'il s'agisse de
tannins hydrolysables ou de tannins condenses) sont dues a leur capacite a
former des liaisons entre les fibrilles de collagêne du tissu animal,
conduisant alors a un ensemble peu accessible a l'eau et en partie
protégé de l'action des bacteries. Les mecanismes chimiques du
tannage correspondent a une complexation irreversible des tannins avec les
proteins animales.
5.2. Importance des composes phenoliques dans la
qualite du bois
Une des applications directes des proprietes de la lignine
reside dans l'utilisation du bois pour les constructions humaines. En effet, ce
materiau presente a la fois une grande resistance mecanique et un
caractêre isolant marque vis-à-vis des variations de temperature
et d'humidite. Il est ainsi couramment utilise pour la realisation des
charpentes, des parquets, des fermetures (portes, volets, fenétres) et
des meubles. Par ailleurs, la haute valeur calorifique du bois, exploit&
traditionnellement depuis que l'homme a appris a maitriser le feu, est due pour
une part importante a la presence de la lignine. Ce compose a en effet une
haute teneur en carbone et se revêle plus energetique que les autres
constituants du bois, cellulose et hemicelluloses, et une teneur en lignine
plus elevee est associee a une chaleur de combustion plus importante.
En plus de la rigidite qu'apporte la presence de lignine,
deux proprietes complementaires du bois sont associees a la presence de
composes phenoliques: d'une part sa durabilite et d'autre part sa couleur
(Jean-Jacques Macheix et al, 2005).
Bibliographie
· Abdelghafour MARFAK, Le 12 Decembre
2003, Radiolyse gamma des flavonokles, etude de leur reactivite avec les
radicaux issus des alcools : formation de depsides, p 220. (These de Doctorat),
l'Universite de Limoges, Ecole Doctorale Sciences Biologie Sante, Faculte de
Pharmacie.
· Borivoj Klejdus, Radka Mikelova , Jitka
Petrlova ,David Potesil, Vojtech Adam, Marie Stiborovaa , Petr Hodek, Jan
Vacek, Rene Kizek, and Vlastimil Kuban, 06/24/2005, Evaluation of
Isoflavone Aglycon and Glycoside Distribution in Soy Plants and Soybeans by
Fast Column High-Performance Liquid Chromatography Coupled with a Diode-Array
Detector, journal of agricultural and food chemistry, Volume 53, pp
5848-5852
· Jean-Jacques Macheix Annie Fleuriet Christian
Jay-Allemand, 2005, les composes phenoliques des vegetaux, un exemple
de metabolites secondaires d'importance economique, presses polytechniques et
universitaires romandes, p 1, p 67, p viii, p 162.
Les enzymes
Historique
Les premieres demonstrations d'une activite enzymatique dans
des extraits naturels remontent au XVII' siecle, quand Reaumur d'abord et
Spallanzani ensuite montrent que le suc gastrique des oiseaux est implique dans
la digestion de la viande. La mise en evidence de l'activite d'autres «
enzymes » se poursuit au XIX' siecle. En 1833, Payen et Persoz isolent a
partir du malt une substance qui est responsable de la fermentation et qu'ils
nomment diastase. Ce terme sera par la suite utilise pour designer de
maniere generale toutes substances responsables de fermentation. Plus tard, le
suffixe -ase a ete conserve pour designer la macromolecule responsable d'une
activite enzymatique. Par exemple. L'amylase est un enzyme responsable de la
degradation de l'amidon. En 1836, alors qu'il etudie les processus digestifs,
Schwann isole la pepsine, une substance responsable de la digestion dans
l'estomac et le premier enzyme obtenu a partir d'un tissu animal (Athel
cornish-bowden et al, 2005).
Definition d'un enzyme
Les enzymes sont des catalyseurs biologiques qui jouent un
role central dans le monde vivant. Les reactions essentielles pour le
fonctionnement d'un étre vivant sont trop lentes et sans lu presence de
ces catalyseurs, la vie telle que nous la connaissons aujourd'hui ne serait pas
possible. Qu'il s'agisse de reactions simples comme la formation de bicarbonate
a partir d'eau et de dioxyde de carbone ou de reactions complexes comme la
replication de l'ADN, chaque reaction chimique se deroulant au sein d'un
étre vivant est catalysee par un ou plusieurs enzymes specifiques. Les
enzymes sont des macromolecules, des proteins ou des ARN (les ARN catalytiques
sont plus correctement denommes ribozymes), qui reconnaissent specifiquement
certaines molecules et accelerent les reactions de transformation de ces
molecules suffisamment pour que leur vitesse devienne compatible avec le
fonctionnement de l'organisme. Un second role essentiel joue par les enzymes
est d'assurer le couplage physique entre reactions endergoniques et reactions
exergoniques et de permettre ainsi de maintenir les systemes biologiques dans
des etats hors d'equilibre, egalement indispensables pour le maintien de la vie
(Athel cornish-bowden et al, 2005).
3. La specificite enzymatique
Le probleme de la specificite de l'enzyme pour son substrat
est au centre de l'enzymologie. C'est en effet la particularite la plus
fondamentale et la plus remarquable de cette catalyse. Les enzymes sont
etroitement specifiques d'une reaction chimique donne, realisee sur un type de
substrat demi. La configuration spatiale du substrat est donc en quelque sorte
reconnue par l'enzyme ; Ce fait est particulierement bien mis en evidence par
la specificite d'action vis-à-vis des isomeres optiques. Tres
generalement, les enzymes sont capables de metaboliser l'un et non pas l'autre.
Une hypothese simple regroupe ces dormees : le site
reactionnel d'une enzyme possede, au moires formellement, une
conformation spatiale complementaire de celle du substrat.
Le site catalytique
La fonction des enzymes est liee a la presence dans leur
structure d'un site particulier appele le site actif qui a la
forme d'une cavite ou d'un sillon. Les molecules sur lesquelles agit une enzyme
sont definies comme les substrata de la reaction enzymatique. Chaque
enzyme « recormait » specifiquement une ou plusieurs molecules de
substrat selon un principe de complementarite de type cle-sen-ure, d'apres le
modele statique de Fischer, grace a des sites de
reconnaissance et de fixation situes a sa surface.
Le site actif est constitue d'un petit nombre d'acides amines
qui le plus souvent ne sont pas contigus dans l'enchainement de la chain
polypeptidique. Ces acides amines sont caracterises par une chain laterale dont
a la fois la nature chimique (groupement ionisable ou polarisable) et la
structure (encombrement sterique) sont particulieres (Anonyme,
2003).
4. La cinetique enzymatique
4.1. L' activite enzymatique
4.1.1. Reaction catalysee par une enzyme (Bernard
Offmann, 2003)
Il y a au moires trois reactions simples:
1. Fixation du substrat (S) sur l'enzyme (E), formation du
complexe (ES)
2. Transformation du substrat lie (ES) en produit lie (EP)
3. Dissociation du complexe (EP), largage du produit (P)
ki k2 k3
+s .4,1 ES ...0"- 7P
...0"- ' + P
k_d k_2 k_3
Figure III.1 : Mecanisme reactionnel de la
formation du produit.
Leonor Michaelis et Maud Menten ont deduit de ce modele en 1913
une equation qui predit la vitesse initiale (de formation de P) en fonction de
la concentration du substrat:
Equation de Michaelis-Menten
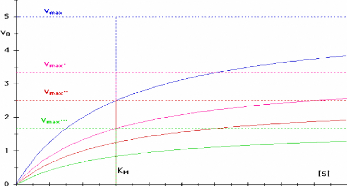
Vo =
Vmax
·
[ S ]
[ S ] + Km
Tel que KM est la constante de Michaelis- Menten, et
Vmax est la vitesse maximale de la reaction enzymatique.
Dont sa representation graphique est port& dans la figure.
111.2.
0 1 2 3 4 5 6 7 8 9 10
Figure 111.2. Graphe
de Michaelis-Menten: vo en fonction de [S]
4.1.2. Linearisation de l'equation de
Michaelis-Menten
Il est difficile de placer correctement a la main une
hyperbole dans un graphe. On se trompe tres facilement sur la hauteur de
Vmax. Pour simplifier
revaluation des resultats, on utilise une transformation de l'hyperbole en
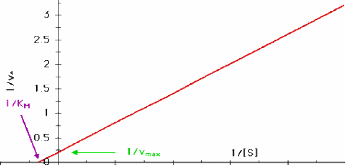
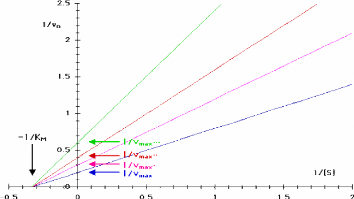
droite. La plus connue est la transformation en doublereciproque de Lineweaver
et Burk :
1 / Vo = 1 / Vmax + (KM /
Vmax)
· 1 /
[S]
Cette equation represente une droite de pente KM /
Vmax
L'intersection sur l'axe vertical est 1 / Vmax
et sur l'axe horizontal 1 / KM.
11 v 0 = 1 1 vmax +
(KM 1 vmax ). 1 1 [ s ]
0 I 2 3 4 5
Figure III. 3. Graphe de Lineweaver-Burk: 1/Vo
en fonction de 1/[S].
Cette representation permet d'estimer les constantes a l'aide
de papier millimetre et d'une regle. Elle a cependant le defaut de dormer trop
de poids aux valeurs experimentales les plus imprecises, celles des plus
petites concentrations de substrat.
4.2. L'inhibition enzymatique
4.2.1. Les inhibiteurs
De nombreuses substances modifient l'activite enzymatique en
se combinant a elle, ce qui altere la liaison de substrat et/ou son turnover.
Les substances qui diminuent l'activite enzymatique de la sorte sont appelees
des inhibiteurs.
Beaucoup d'inhibiteurs sont des molecules de structure voisine
du substrat de leur enzyme, mais qui soft ne reagissent pas, soient elles
reagissent tres lentement. De telle substance sont frequemment utilisees pour
elucider la nature chimique ou conformationnelle d'un site de liaison du
substrat, afin de determiner le mecanisme catalytique de l'enzyme. De plus,
beaucoup d'inhibiteurs d'enzymes sont des agents chimiotherapeutiques efficaces
car un analogue de substrat "non naturel" peut bloquer l'action d'un enzyme.
Par exemple, le methotrexate (appele aussi l'aminopterine) ressemble
chimiquement au dihydrofolate. Le methotrexate se lie fortement a la
dihydrofolate reductase, ce qui l'empéche d'assurer sa fonction
physiologique, la reduction du dihydrofolate en tetrahydrofolate.
Les inhibiteurs d'enzyme peuvent agir selon des mecanismes
varies. Dans cette section, nous allons etudier plusieurs de ces mecanismes
parmi les plus simples, et leurs influences sur le comportement cinetique des
enzymes qui suivent le modele de Michaelis-Menten (Donald Voet et
Judith G. Voet, 1998).
4.2.2. Les types d'inhibition :
4.2.2.1. Les inhibiteurs competitifs
Ils se lient de maniere reversible au site actif de l'enzyme
et en bloquent l'acces au substrat. Ils diminuent donc la concentration
d'enzyme libre ([E]). En general ils ressemblent chimiquement au substrat.
D'ailleurs, si une enzyme a plusieurs substrats possibles, ceux-ci peuvent
aussi agir comme inhibiteurs competitifs reciproques. Les meilleurs inhibiteurs
sont souvent en fait des analogues de l'etat de transition de la reaction.
|
k1
E -1- S
k-1
I
-1-
|
K2
ES -Ow E -1- P
|
kilt k_i
El
Figure 111.4 : Mecanisme reactionnel en presence
d'inhibiteur. Dans l'equation de Michaelis-Menten, KM est remplace
par:
Km = K m
· {-1 +
[IFKI )

|
Yo
|
|
|
|
3 --
|
|
|
|
v,,,,,/ 2
|
|
|
,----- ..--
|
|
2 --
|
Oil K1= ki/k_i est la
constante de dissociation de l'inhibiteur. Le KM apparent augmente
donc, it y a perte apparente d'affinite pour le substrat. Cependant un
supplement de substrat peut compenser cette inhibition et la vitesse maximale
Vmax reste la méme.
5 --
4 --
,-----------17:: - --
_---------
,
Kri-
Km.
Kri
1
4 5 6 7 13 9
I
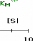
1
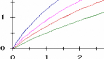
Figure 111.5. Variation de la vitesse
initiale en fonction de la concentration en substrat pour une reaction de
Michaelis-Menten simple en presence de differentes concentrations d'un
inhibiteur competitif.
En double-reciproque, on obtient des droites de pentes
differentes qui se croisent a 1/[S] = 0 : 1N max est donc
le méme, mais -1/Km est de plus en plus petit (fleches colorees), alors
que la pente augmente.
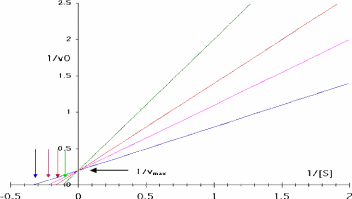
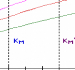
Figure 111.6. Representation de Lineweaver-Burk
de l'enzyme michaelienne inhibee competitivement decrite dans la Figure 111.5
Notez que toutes les droites se coupent sur l'axe
1/V0 a 1
/Vmax.
Exemples de medicaments: Le methotrexate, un analogue
structurel du tetrahydrofolate, est un inhibiteur competitif de la
dihydrofolate reductase, sur laquelle it se fixe 1000x mieux que le substrat
naturel. C'est un medicament anticancereux (Bernard Offmann,
2003).
4.2.2.2. Inhibition incompetitive
Dans l'inhibition incompetitive, l'inhibiteur se
lie directement au complexe enzyme-substrat, sans pouvoir se fixer a l'enzyme
libre (Donald Voet et Judith G. Voet, 1998).
ki 2
E +S NIN''' ES
-11.- E + P 1(4
+1
kilrt k-js
PSI
Figure 111.7: Mecanisme reactiormel en
presence d'inhibiteur.
Dans ce cas, V. et KM diminuent du méme
facteur (1 + [WIC's), alors que KM / V. reste inchange.
L'affinite apparente de l'enzyme pour le substrat augmente donc :
(Bernard Offmann, 2003).
Villa; -- Vmax i (1
+ [I]1KIs )
Km = Km i ti + [1]1Kis )
0 4 b 8 10
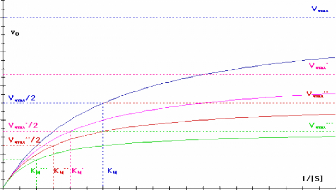
Figure 111.8. Variation de la vitesse
initiale en fonction de la concentration en substrat pour une reaction de
Michaelis-Menten simple en presence de differentes concentrations d'un
inhibiteur incompetitif (Bernard Offmann, 2003).
En double-reciproque, on obtient des droites paralleles de pente
constante KM / V.
Chapitre III: les enzymes
0
2
- 0_5
0_5
Figure 111.9. Representation de Lineweaver-Burk
de l'enzyme michaelienne inhibee incompetitivement decrite dans la Figure 111.8
(Bernard Offmann, 2003).
4.2.2.3. Les inhibiteurs non-competitifs
Its se lient de maniere reversible ailleurs qu'au site actif de
l'enzyme et n'en empéchent pas l'acces. Il s'agit donc d'inhibiteurs
allosteriques, c'est-à-dire agissant a un autre (allo-) site.
K1 2
E + S ..410
· ES
-lo. E + P
k-1
+ I +I
kilt k_i kisif k-is
kli
El
4111P'
ESI
k.11
Figure III.10: Mecanisme reactiormel en
presence d'inhibiteur.
Dans le cas particulier oil la fixation de l'inhibiteur ne
modifie pas la fixation du substrat, ou reciproquement = Kis et
Ki = l'inhibiteur (dit "non-competitif pur") diminue [E]T
sans modifier la repartition entre enzyme libre et lie. Dans ce cas, c'est V.
qui est remplacee par:
vmax = vmax I
(1 + [I]/KI )
Le KM reste constant, mais it y a perte apparente de
concentration d'enzyme, donc reduction de V..
vo
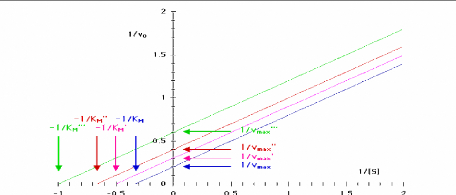
a 2 3 ! 7 B 9 10
Figure III.1 1. Variation de la vitesse
initiale en fonction de la concentration en substrat pour une reaction de
Michaelis-Menten simple en presence de differentes concentrations d'un
inhibiteur non competitif (Bernard Offmann, 2003).
En double-reciproque, on obtient des droites de pentes
differentes qui se croisent a -1/KM
1.5
2
Figure 111.12. Representation de Lineweaver-Burk
de l'enzyme michaelienne inhibee non competitivement decrite dans la Figure
III.11 (Bernard Offmann, 2003).
5. Classification des enzymes
Les enzymes sont classees et nominees en fonction de la nature
des reactions chimiques qu'elles catalysent. Il y a six classes principales de
reactions catalysees par les enzymes (Tableau III.1), ainsi qu'un certain
nombre de sous-classes et de sous-sous-classes a l'interieur de chaque classe.
Chaque enzyme se voit assignee deux noms et une classification a quatre
chiffres (Donald Voet et Judith G. Voet, 1998).
Tableau III. 1 : Classification des enzymes
selon la reaction catalysee.
Classification Type de reaction catalysee
Oxydoreductases Transferases Hydrolases Lyases
Isomerases Ligases
Oxydoreduction
Transfert de groupes fonctionnels
Hydrolyse
Elimination de groupes et formation de doubles liaisons
Isomerisation
Formation de liaison couplee a l'hydrolyse de l'ATP
6. Les enzymes etudiees
6.1. L'a- amylase
L'amylase a ete purifiee en 1835 du malt par Anselme Payen et
Jean Persoz. Leur travail les a merles de suspecter que des substances
semblables, maintenant connues sous le nom d'enzymes, pouvaient participer dans
les processus biochimiques.
Elle est repandue dans tous les organismes vivants. Dans les
systemes digestifs des humains et beaucoup d'autres mammiferes, elle est aussi
appelee « diastase » (Encyclopaedia Britannica,
2007).
L'amylase hydrolyse l'amidon, le glycogene, et la dextrine
pour former le glucose, le maltose et les dextrines.
Une alpha-amylase appelee la ptyaline est produite par les
glandes salivaires, tandis que l'amylase pancreatique est secret& par le
pancreas dans le petit intestin (Encyclopaedia Britannica,
2007). La Ptyaline commence la digestion du polysaccharide dans la
bouche ; le processus est complete dans le petit intestin par l'amylase
pancreatique, parfois appelee l'amylopsine (The Columbia Encyclopedia,
2006)
Les Béta-amylases sont presentes dans les levures, les
moules, les bacteries, et les plantes, en particulier dans les grains. La
13-amylase attaque l'amylose de chain droite mais ne peut pas attaquer la
majeure partie de l'amylopectine de chain en branche (Encyclopaedia
Britannica, 2007).
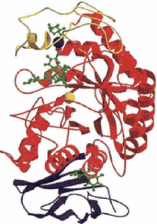
Figure 111.13. Structure de l'alpha amylase
pancreatique humaine.
Les trois domaines sont montres : le domaine A est rouge; le
domaine B est jaune ; le domaine C est noir. L'ion de calcium (sphere bleue) et
l'ion de chlorure (sphere jaune) sont egalement montres a proximite immediate
du centre catalytique. Le ligand d'acarbose (bouleet-bdton vert) est lie au
site actif. Des ligands de monosaccharide et de disaccharide (dans la
representation de boule-et-bfiton) sont attaches aux accepteurs exterieurs
(Minxie Qian et al, 1997).
6.1.1. La reaction specifique
Les a-amylases (a-1,4-glucan-4-glucanohydrolase, EC 3.2.1.1)
sont les enzymes omnipresentes synthetisees dans tous les genres de la vie, de
poids moleculaire 50 kDa. Tous les a-amylases lient au moms un ion fortement
conserve de Ca2+ qui est exige pour l'integrite structurale et pour
l'activite enzymatique (Nushin Aghajari et al,
2002).
L'a-amylase pancreatique humaine (APH) catalyse l'hydrolyse de
la liaison glycosidique a(1-4) en polymeres de glucose tels que l'amidon. L'APH
est composee de 496 acides amines en une seule chain de polypeptide liee aux
ions essentiels de chlorure et de calcium. L'hydrolyse de l'amidon ou les
substrats se produisent avec la conservation nette de la configuration au
centre anomerique de sucre, et sont censes proceder par l'intermediaire d'un
double mecanisme de &placement comportant la formation et l'hydrolyse d'un
intennediaire de b covalent glycosyle-enzyme (Dr. Anjuman Begum,
2007).
6.1. 2. Interet de l'inhibition de
l'alpha amylase
Les amylases sont une partie de la plus large classe des
enzymes hydrolytiques appelees les glycosidases, clivent les liaisons
glycosidiques de l'amidon dormant les fragments de disaccharide qui sont plus
tard decomposes en glucose (Figure III. 14).
OH
0
|
HO
|
HO0
HO
Amidon
|
OH
0
OH
H00 0
HO
HO
|
amylase
|
|
disaccharicles - glucose
|
|
Les inhibiteurs qui bloquent la reaction hydr olyt ique
|
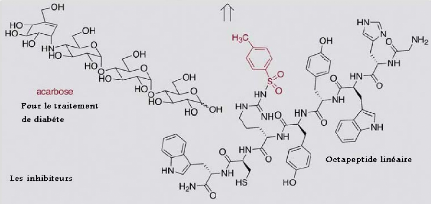
OH
HO
HO
H5
HO
(1`
-0
Ffp,,
OH HN-4
NHO. HN
HN7i
OH No NH2
NH
HN
Octapeptide lineaire
1-1C
OH
I-10
FIN
HO
HOo
HO
acarbose
Four le traitement de diabete
Les inhibiteurs
OH
O
N
HN
H2N
Figure III. 14. Les inhibiteurs : l'acarbose
et l'octapeptide de la reaction catalysee par l'amylase (Nicola Pohl,
2005).
Les inhibiteurs des amylases ont déjà montre
leur utilite en aidant les diabetiques (Franco, O.L. et al,
2002). Les niveaux de glucose des diabetiques peuvent étre
contrOles apres des repas par l'administration d'un inhibiteur d'amylase tel
que l'acarbose. Acarbose est un produit naturel obtenu par la fermentation et
est structurellement lie au substrat d'oligosaccharide d'amylase, car jusqu'a
cinq residus de glucose sont connus pour étre adaptes dans le site actif
d'amylase (Machius et al, 1996). Il est interessant
que certains plantes et micro-organismes produisent les inhibiteurs d'amylase
qui sont bases sur des proteins plutOt que les carbohydrates. Ces proteins
inhibitrices, qui s'etendent dans la taille de 32 acides amines avec 3 liaisons
disulfures a plus de 19 kDa, regule l'activite d'amylase endogene, par exemple
dans les grains des plantes, aussi bien que pour defendre contre les amylases
digestives d'autres organismes telles que les insectes (Breuer,
2003).
On a rapporte que l'inhibition des a-amylases induit la
tolerance des carbohydrates, la satiete et la perte de poids, et pour prolonger
le vide gastrique. Les inhibiteurs d' a-amylase ont ainsi un potentiel
therapeutique pour le traitement de l'obesite et du diabete non-insulin
(Juliet A. Gerrard et al, 2000).
6.2. La trypsine
Sous le terme de trypsine immun reactive (TIR), on regroupe un
ensemble de molecules qui ont en commun d'être reconnues par divers
anticorps developpes contre la trypsine humaine cationique ou trypsine-1. Cette
protease est issue de l'activation du plus abondant des trypsinogenes produits
par le pancreas chez l'homme.
La trypsine est une protein de 201 acides amines d'un poids
moleculaire de 23 kDa et qui possede quatre ponts disulfures.
La trypsine est synthetisee par les cellules acines du
pancreas sous forme d'une pro-enzyme qui inactive le trypsinogene. Il existe en
fait deux trypsines originaires de deux isoformes differentes du trypsinogene
mais a capacites catalytiques quasi identiques. Cette activite proteolytique
est tres intense ; elle se manifeste au niveau des liaisons carboxyliques de la
lysine et de l'arginine.
La plus grande partie de la secretion pancreatique passe dans
le duodenum mais une faible partie est retrouvee dans le serum oil elle est
amen& par les voies veineuses, lymphatiques et peritoneales. Il existerait
egalement une secretion endocrine. La trypsine serique peut donc representer un
passage fortuit de l'enzyme dans la circulation mais aussi un recyclage
enzymatique ou encore un mecanisme d'autoregulation de la synthese. Une infime
proportion du trypsinogene secrete se retrouve dans la circulation sanguine,
oil it est detectable par des techniques sensibles.
Le pouvoir proteolytique de la trypsine est trop intense pour
qu'elle circule isolement dans la circulation sanguine. Elle se presente donc
dans le serum, liee a des inhibiteurs des proteases tels que
l'ai-antitrypsine et l'a2-macroglobuline. La trypsine
developpe son activite dans les voies intestinales (0. Gaillard,
1996).
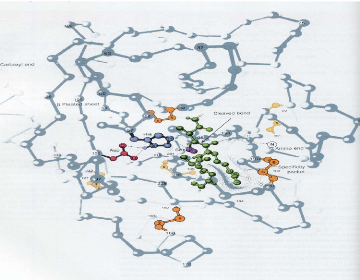
Figure 111.15. Structure par rayons X de la
trypsine bovine.
Dessin de l'enzyme complexes avec son substrat polypeptidique
(en vert) dont la chaine laterale d'arginine occupe la poche de specificite de
l'enzyme (en pointilles bleu), la chaine des Ca, les pouts
disulfures et les chains laterales de la triade catalytique, Serine 195,
Histidine 57, et Aspartate 102 sont representees (D. Voet et J. G.
Voet, 1995).
6.2.1. La reaction specifique
La trypsine est une enzyme de la digestion synthetisee et
secret& par les cellules acinaires pancreatiques, en passant par le canal
pancreatique, dans le duodenum (la partie superieure du petit intestin), elle
catalyse l'hydrolyse d'une liaison peptidique d'un residu chargé
positivement : l'arginine et la lysine (D. Voet et J. G. Voet,
1995).
6.2.2. Interet de l'inhibition de la
trypsine
Trypsine-like proteases a serine composent une famille
d'enzymes avec une importante activite. Its sont connus pour étre
impliques dans beaucoup d'etats physiologiques et desordres pathologiques. Leur
activite non contrOlee est nes dangereuse et mene souvent aux maladies
serieuses comme emphyseme, fibrose cystique ou developpement et progression de
cancer. Par exemple, l'enzyme principale dans la croissance et la metastase de
tumeur est activateur plasminogen d'urokinase (uPA) appartenant a la famille de
protease a serine (trypsine-type).
Dans des conditions physiologiques normales, cette enzyme joue
un role essentiel dans des processus d'angiogenese mais ces resultats non
contrOles d'activite dans d'enormes niveaux de la plasmine active, qui facilite
le mouvement des cellules de cancer (Marcin Sienczyk et Jozef
Oleksyszyn, 2004).
Formes moleculaires multiples d'inhibiteurs de trypsine (TI)
et chymotrypsine (CI), qui sont des enzymes digestives typiques des insectes,
des mammiferes et des micro-organismes, et subtilisine (SI), une proteinase de
beaucoup de bacteries et mycetes phytopathogenique (Alexander V.
Konareva et al, 2001).
La grande variete d'inhibiteurs de protease a serine sont
fournies par plusieurs sources telles que les tissus, micro-organismes,
plantes, etc., jouent un role important en reglant les enzymes proteolytiques.
L'analyse des complexes de protease-inhibiteur aide a la comprehension du
mecanisme d'action, aussi bien que pour concevoir des inhibiteurs. Les
inhibiteurs de protease sont repandus en nature, variant de petites molecules,
peptides aux proteins. Jusqu'ici, 18 differents inhibiteurs de protease ont ete
classifies et la liste est en croissance continue. Dans la plupart des
inhibiteurs de protease la boucle de reactif-site, avec la geometrie
specifique, bloque le site actif et la region substrat-liante (B. Syed
Ibrahim et Vasantha Pattabhi, 2005).
L'activation inadequate du trypsinogene dans le pancreas mene
au developpement de la pancreatite. Une fois que la trypsine est activee, elle
est capable d'activer beaucoup d'autres proenzymes digestives. Ces enzymes
pancreatiques activees augmentent plus loin l'autodigestion du pancreas. La
trypsine active egalement des cellules par l'intermediaire du recepteur de
trypsine. Le recepteur de la trypsine est egalement connu en tant qu'un des
recepteurs actives par protease, a savoir PAR-2, recemment. Les cellules
acinaires et les cellules de conduction expriment PAR-2 abondant. L'activite de
la trypsine dans le pancreas est contrOlee principalement par l'inhibiteur
pancreatique secrete de la trypsine (PSTI), qui est egalement connu en tant que
type 1 de Kazal d'inhibiteur de protease de serine (SPINK1).
PSTI est synthetise dans les cellules acinaires du pancreas et
agit en tant qu'un inhibiteur normal efficace de trypsine pour empécher
l'occurrence de la pancreatite. Quand le trypsinogene est active a la trypsine
dans le pancreas, PSTI lie immediatement a la trypsine pour empécher
davantage l'activation des enzymes pancreatiques. PSTI bloque egalement
l'activation supplementaire des cellules pancreatiques par l'intermediaire du
recepteur de trypsine, PAR-2 (figure III. 16).
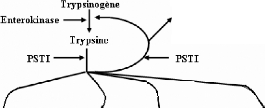
Activation des cellules : acinaires
de conduction inflammatoires
a travers le rècepteur de la trypsine
(PAR-2)
Kallikreinog6ne f Chymotrypsino gene Proelastase roc arb
oxyp eptidase rop hasp holipas e A2
Kallikreine Chyrnotrypsine Elastase
Carboxy-peptidase Phospholipase A2
Figure 111.16. Voies d'activation des
proenzymes et du PAR-2 par la trypsine.
Une fois que la trypsine est activee, elle est capable
d'activer beaucoup d'autres proenzymes digestifs. La trypsine active egalement
les cellules pancreatiques et inflammatoires par l'intermediaire de PAR-2.
L'activite de trypsine dans le pancreas est contrOlee principalement par PSTI.
Quand le trypsinogene est active a la trypsine dans le pancreas, PSTI lie
immediatement a la trypsine pour empécher davantage l'activation des
enzymes pancreatiques (Masahiko Hirota et al,
2003).
6.3. La lipase
Nous obtenons des lipides de l'ingestion, du stockage, ou de la
synthese. Les graisses dietetiques emulsionnees par des sels de bile, digeres
par des lipases, absorbees dans le systeme de lymphe, apres elles entrent dans
la circulation sanguine (Marcotte, 2005). Les lipases ont ete
citees en tant qu'une des plus souples des enzymes par la plupart des
scientifiques de recherches du monde. Elles sont employees dans un certain
nombre de bioconversions et leurs applications peuvent étre trouvees
dans les industries comme pharmaceutique, la laiterie, le detergent, le produit
de beaute, le produit oleochimique et d'autres. Selon l'opinion courante de
l'industrie et du milieu universitaire, it peut y avoir d'exploitation
commerciale a grande echelle de ces enzymes en prochaines annees. Cette base de
donnees est une compilation des donnees liees aux lipases.
Les lipases (EC 3.1.1.3, triacylglycerol lipases) sont des
enzymes qui ont ete classiquement utilisees pour continuer l'hydrolyse des
triglycerides avec la production concomitante des acides gras libres. Cependant
ces enzymes montrent egalement l'activite catalytique vers une grande variete
d'alcools et d'acides dans des reactions de synthese d'ester a condition que
l'activite de l'eau soit tres basse (Dr. P. Gautam, 2006).
L'entite fonctionnelle pour l'hydrolyse des triglycerides
alimentaires dans l'intestin, serait un complexe ternaire associant la lipase,
la colipase et une micelle de lipides biliaires. La taille, plus que la nature
chimique de la micelle serait importante. La destabilisation de l'interface
lipidique pourrait se faire par des peptides obliques de la
lipase et de la colipase (Denis Lairon, 2007).
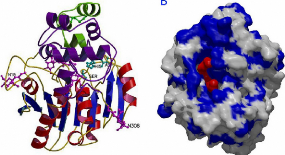
A
Figure III. 17. Structure trois dimensionnel de
la lipase pancreatique humaine (Marion Ansorge-Schumacher,
2007).
6.3.1. La reaction specifique
La plupart des lipases agissent a une position specifique sur
la molecule de glycerol d'un substrat de lipide (A1, A2 ou A3). Dans
l'exemple de la lipase pancreatique humaine (LPH), qui est l'enzyme principale
responsable de decomposer des graisses dans le systeme digestif humain, une
lipase acte pour convertir des substrats de triglycerides trouves en huiles de
nourriture en monoglycerides et acides gras libres (Princeton
University, 2005).
6.3.2. Interet de l'inhibition de la
lipase
La lipase pancreatique est l'enzyme la plus importante pour la
digestion des triglycerides. L'application d'un inhibiteur de lipase a ete
examinee plus tot comme traitement pour l'obesite. Orlistat (RO 18-0647), un
derive hydrogens de lipstatine derive du Streptomyces toxitricini, est
un inhibiteur efficace de la lipase gastrique et pancreatique, et s'est avers
étre efficace pour le traitement d'obesite. L'existence des inhibiteurs
de lipase dans divers produits alimentaires a ete recherchee, et la presence de
ces inhibiteurs dans les cereales, dans le son de ble, germe de ble et dans le
soja a ete rapportee. Des inhibiteurs de lipase ont ete egalement cherches dans
les produits naturels tels que les medecines chinoises et les diverses herbes
(M Yamamoto et al, 2000). L'obesite est Fun des
problemes principaux de la sante publique dans les pays developpes. On le
considere comme un facteur de risque lie a la genese ou le developpement des
maladies chroniques principales, y compris la maladie cardiovasculaire, le
diabete, et le cancer. Aux Etats-Unis, l'obesite augmente a un taux alarmant.
Le poids excessif et l'obesite sont les troubles nutritifs les plus communs aux
Etats-Unis, affectant la majorite d'adultes dans le pays (Diego A.
Moreno et al, 2003).
Bibliographie
· Anonyme, 28/10/2003, Cours notions de
base Enzymologie Licence Angers, source: F. Chapeville, H. Clauser, 1974,
Biochimie Par Chapeville Et Clauser.
· Athel cornish-bowden, Marc Jamin et Valdur
Saks, 2005, cinetique enzymatique, p 7, p 55, first published in 2004
by Portland Press, Ltd, London, second published EDP sciences, 2005.
· B. Syed Ibrahim and Vasantha Pattabhi,
20 May 2005, Trypsin Inhibition by a Peptide Hormone: Crystal
Structure of Trypsin-Vasopressin Complex. Journal of Molecular Biology
Volume 348, Issue 5, pp 1191-1198.
· Bernard Offmann, Cours, 13 avril 2003,
Universite de La Reunion, Departement de Biochimie et Biologie Moleculaire.
· Diego A. Moreno, PhD, Nebojsa Ilic, PhD,
Alexander Poulev, PhD, Dawn L. Brasaemle, PhD, Susan K. Fried, PhD, and Ilya
Raskin, PhD, October 2003, Inhibitory Effects of Grape Seed Extract on
Lipases, Journal Nutrition, Volume 19, Issue 10, pp 876-879.
· Docteur Denis LAIRON, 2007, Le systeme
lipase et colipase pancreatique, U 476
INSERM / 1260 INRA, Faculte de
Medecine de la Timone, Marseille, France.
· Donald Voet et Judith G. Voet ; 1998 ;
Biochimie ; pages 355-356, 358; edition De Boeck Universite.
· Dr. Anjuman Begum, Shin Numao, Iben Damager,
Chunmin Li, Tanja M.
Wrodnigg, Christopher M. Overall, Gary D. Brayer, and
Stephen G. Withers,
November 12, 2004, In Situ Extension as an Approach for
Identifying Novel Amylase
Inhibitors, Journal Biol. Chem., Vol. 279, Issue 46, pp
48282-48291.
· Dr. P. Gautam, 2006, AU-KBC RESEARCH
CENTRE, Anna University, Chennai.
· E. Marcotte, fall 2005, cours de
"Oxidation of Fatty Acids", source: Lehninger -
Principles of Biochemistry
by Nelson/Cox, 4th ed. W. H. Freeman Publishing, 2005.
· Encyclopedia Britannica, 2007.
· Franco, 0.L., Rigden, D.J., Melo, F.R., and
Grossi-De-Sa', M.F, January 2002, Plant a-amylase inhibitors and their
interaction with insect a-amylases, European journal of biochemistry.
Volume 269 Issue 2 pp 397-412.
· Gerrard, J.A., Prince, M.J. and Abell, A.D.,
2000, Kinetic Characterisation of EneDiol-Based Inhibitors of
a-Amylase, Bioorganic & Medicinal Chemistry Letters, Volume 10,
No14, pp 1575-6.
· H.W. Breuer, 2003, Review of acarbose
therapeutic strategies in the long-term treatment and in the prevention of type
2 diabetes. Int J ClM Pharmacol Ther, Volume 41, pp 421- 440.
· Konarev, Alexander V: Anisimova, Irina N:
Gavrilova, V A: Vachrusheva, T E: Konechnaya, G Yu: Lewis,
Mervyn: Shewry, Peter R, 2002 Feb, Serine proteinase inhibitors in the
Compositae: distribution, polymorphism and properties, Volume 59, No 3, pp
279-91
· M Yamamotol, S Shimural, Y Itohl, T Ohsaka, M
Egawa and S Inoue, 2000, Anti-obesity effects of lipase inhibitor
CT-II, an extract from edible herbs, Nomame Herba, on rats fed a high-fat diet,
International Journal of Obesity , Volume 24, pp 758-764.
· M. Machius, L. Ve' rtesy, R. Huber, and G,
Wieland, 1996, Carbohydrate and protein-based inhibitors of porcine
pancreatic alpha -amylase: structure analysis and comparison of their binding
characteristics, J. Mol. Biol. Volume 260, pp 409-421.
· Marcin Sienczyk and Jozef Oleksyszyn,
2004, A convenient synthesis of new aaminoalkylphosphonates, aromatic
analogues of arginine as inhibitors of trypsin-like enzymes, Tetrahedron
letters, Volume 45, No 39, pp 7177,7251-7254.
· Masahiko Hirota, Kinuko Kuwata, Masaki
Ohmuraya, Michio Ogawa, 2003, Significance of trypsin inhibitor gene
mutation in the predisposition to pancreatitis, Hirota et al. / International
Congress Series 1255, pp 41-48.
· Minxie Qian, Silvia Spinelli, Hugues Driguez,
and Francoise Payan, 1997, Structure of a pancreatic a-amylase bound
to a substrate analogue at 2.03 A° resolution; Protein Sci.
Volume 6, pp 2285-2296.
· Nicola Pohl, December 2005, Acyclic
Peptide Inhibitors of Amylases, J Chemistry & Biology, Vol. 12, pp
1257-1258.
· Nushin Aghajari, Georges Feller, Charles
Gerday and Richard Haserl, 2002, Structural basis of a-amylase
activation by chloride, Protein Science, Volume 11, pp 1435-1441.
· Olivier Gaillard, 2003, Immunoreactive
trypsin (TIR), Immunoanal. biol. Spec, , Volume. 18, No 5, pp.
254-255
· Prof. Dr. Marion Ansorge-Schumacher,
08/09/2006, Hydrolases, Department of Biotechnology, Aachen
University.
The Columbia Encyclopedia, 2006, Columbia
University Press
.Ca par6e
Expirimenble
Chapitre IV: extraction et quantification des
composes phenoliques
1. Extraction des composes phenoliques
La recolte des plantes a ete effectuee en octobre 2006, de la
region de Laghouat "Sidi Makhlouf', ce sont sept plantes, elles sont sechees a
l'ombre pendant sept mois.
Les parties aeriennes de ces plantes (sauf pour le Gondale, ce
sont des racines) sont finement broyees puis stockees dans des sachets en
papier jusqu'a l'utilisation.
La procedure suivie est celle appliquee dans le laboratoire des
sciences fondamentales, elle comporte trois sous &apes:
1.1. La maceration
La masse choisie est de 5 g de chaque poudre de plante, elle
est maceree dans un mélange hydro-alcoolique (methanol
(CH3OH)/eau 80/20: v/v) pendant 24 h a temperature ambiante et a
l'obscurite.

Zwadet Elkhrouf
Serr
Figure IV. 1. La poudre de chaque plante
aprês le broyage.
1.2. La &pigmentation
Aprês filtration des extraits hydro-alcooliques, ils
subissent une evaporation sous vide dans un rotavapeur a une temperature de
60°.
La phase aqueuse de chaque extrait est lay& un
ou plusieurs fois jusqu'a l'epuisement total avec un demi-volume de l'hexane
dans une ampoule a decanter afin d'eliminer toutes traces de composes apolaires
(pigments, lipides, etc.).

Figure IV. 2. Le lavage par l'hexane de deux
extraits des plantes "Zewadet elkhrouf' et
"Gondale".
1.3. La purification
La phase aqueuse ainsi obtenue est ensuite
lay& un ou plusieurs fois avec un volume d'acetate d'ethyle.
L'addition d'un mélange de deux solutions aqueuses (4m1): sulfate
d'ammonium (NH4)2SO4 20 % (m/v) et l'acide
orthophosphorique H3PO4 2% (m/v) facilite le passage des
composes phenoliques de la phase aqueuse vers le solvant « l'acetate
d'ethyle».
La phase organique obtenue est sechee sur sulfate de sodium
anhydride Na2SO4pour eliminer toutes traces d'eau.
Aprês filtration le solvant est evapore sous pression reduite a
60°C. Les extraits phenoliques obtenus sont sous forme d'une poudre ou
pfite, de couleur jaune, marron et vert militaire suivant la nature de la
plante, ils sont aussi peses pour calculer le rendement de chaque plante.
Le residu est repris dans 10 ml de methanol pur et conserve a
--10°C dormant l'extrait phenolique purifie.
Le tableau IV. 1 presente l'aspect, la couleur et la masse de
chaque extrait phenolique de chaque plante :
Tableau IV. 1. La couleur, l'aspect et la
masse de chaque extrait phenolique
Plante
|
Couleur
|
Aspect
|
Masse (g)
|
Rendement (%)
|
Foulia
|
Vert militaire
|
Poudre+pfite
|
0.3
|
5.8
|
Gondale
|
Jaune
|
Poudre
|
0.3
|
5.8
|
Lelma
|
Vert militaire
|
Pfite
|
0.1
|
2
|
Remth
|
Marron clair
|
Pfite
|
0.04
|
0.8
|
Reguig
|
Vert militaire
|
Pfite
|
0.06
|
1.2
|
Serr
|
Marron
|
Poudre +pfite
|
0.37
|
7.4
|
Zewadet Elkhrouf
|
Vert militaire fonce
|
Poudre +pfite
|
0.36
|
7.2
|
|

Figure IV. 3. Les extraits alcooliques
bruts
2. Quantification des composees phenoliques
2.1. Dosage des phenols totaux
Le principe de ce dosage est adapte par Singleton et Ross (en
1965) avec le reactif de Folin -- Ciocalteu (B.I.GINER-Chavez
,1996).
Le reactif de Folin-Ciocalteu est un acide de couleur jaune,
constitue de polyheterocycles acides contenant l'acide phosphotungestique
H3PM12040 et l'acide phosphomolybdique
H3PW12040 dont la reaction est :
Oxydation des phenolates --> reduction des polyheterocycles
--> formation d'un complexe
molybdene(Mo8023)-tungstene
(W8023) stable bleu qui absorbe fortement a
une longueur d'onde de l'ordre 760 nm. Le phenol standard utilise dans cette
methode est l'acide gallique dont la formule chimique est presentee dans la
figure IV. 4.
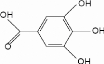
Figure IV. 4. L'acide gallique (Acide
3,4,5-trihydroxybenzoIque).
2.1.1. La courbe d'etalonnage
A partir d'une solution mere aqueuse preparee de l'acide
gallique de concentration massique 0.5 g/1, des solutions filles sont ainsi
preparees de concentration allant de 0.06 g/1 jusqu'a 0.28 g/1.
A l'aide d'une micropipette, 100 gl de chaque solution est
introduite dans des tubes a essais, suivi de l'addition de 500 gl du reactif de
Folin-Ciocalteu (10 fois dilue dans l'eau), apres 2 minutes 2 ml de carbonate
de sodium Na2CO3 a 20% (m/v) ont ete ajoutes (favoriser
un milieu alcalin pour declencher la reaction d'oxydoreduction), par la suite
ces solutions sont maintenus a l'obscurite pendant 30 minutes a temperature
ambiante. La lecture de l'absorbance de chaque solution est effectuee a l'aide
d'un spectrophotometre de Shimadzu 1601 (figure IV .5) a une longueur d'onde de
760 nm contre un blanc (méme solution sans la solution d'acide gallique)
ce qui nous permet de tracer la courbe d'etalonnage (figure IV .6).

f -4111111F"'
Figure IV. 5. Le spectrophotometre UV-visible
de Shimadzu (1601).
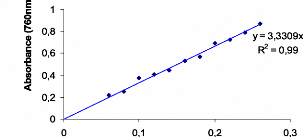
0
0,1
0,2
0,3
co
|
|
C
|
0,8
|
8
|
|
|
0,6
|
-E 0
|
|
.c%
|
0,4
|
|
0,2
|
|
0
|
|
Concentration (g/I)
Figure IV. 6. La courbe d'etalonnage de
l'acide gallique.
2.1.2. Traitement des echantillons
Une quantite de 100g1 de chaque solution d'extraits dillies
est introduite dans des tubes a essais, l'addition de 500g1 du reactif de
Folin- Ciocalteu (10 fois dilue dans l'eau), apres 2 minutes, on ajoute 2 ml de
carbonate de sodium Na2CO3 a 20% (m/v) afin de favoriser
un milieu alcalin pour demarrer la reaction d'oxydoreduction, par la suite ces
solutions d'extraits sont maintenus a l'obscurite pendant 30 minutes a
temperature ambiante. La lecture de l'absorbance de chaque solution d'extraits
est effectuee de la fawn decrite precedemment.
2.1.3. Resultats et discussion
L'analyse quantitative des phenols totaux des extraits
phenoliques a ete realisee par la méme procedure decrite precedemment.
La teneur en composes phenoliques de chaque extrait de plante a ete alors
calculee a partir de la courbe d'etalonnage et exprimee en milligrammes par 100
grammes de la matiere seche equivalent en acide gallique.
Les resultats obtenus sont presentes dans le tableau IV. 2.
Tableau IV.2 : La teneur en phenols totaux des
plantes investiguees.
Teneur en
plante C: g/1 polyphenols: mg/100g
Foulia 1,85 370
Gondale 0,18 37
Lelma 1,21 241
Remth 1,10 215
Reguig 1,21 241
Serr 1,10 214
Zwadet Elkhrouf 0,81 162
La teneur en polyphenols dans les plantes etudiees varie de
37mg/100g a 370mg/100g. Remarquons que les quatre plantes renferment presque la
méme quantite de phenols totaux. Si on compare nos resultats a ceux
déjà realises au laboratoire (M. Yousfi et al,
2006, 2007) on peut dire que les plantes investiguees sont
pauvres en composes phenoliques.
Les teneurs en phenols totaux determines par colorimetrie
(tableau W. 2) sont toujours tres faibles par rapport aux rendements des
extraits bruts (tableau IV. 1), ce resultat indique que l'extrait brut obtenu
par extraction liquide- liquide avec de l'acetate d'ethyle contient des
composes autres que les polyphenols.
2.2. Dosage des flavondides
La quantification des flavonokles a ete effectuee par une
methode adapt& par Zhishen et al (Zhishen et al,
1999) avec le trichlorure d'aluminium et la soude. Le trichlorure
d'aluminium forme un complexe jaune avec les flavonokles et la soude forme un
complexe de couleur rose absorbe dans le visible a 510 nm. Le flavonokle
standard utilise dans cette methode est la catechine dont la formule chimique
est represent& dans la figure IV. 7.
Figure IV. 7. La catechine
(-)-trans-3,3',4',5,7-Pentahydroxyflavane (Augustin Scalbert,
2004)
2.2.1. La courbe d'etalonnage
A partir de la solution mere de la catechine (utilisee comme
&talon pour tracer la courbe d'etalonnage) preparee dans le methanol de
concentration massique 1 g/1, on prepare des solutions filles de concentrations
allant de 0.1 a 0.8 g/l.
Dans une fiole, on met 1 ml de chaque dilution de solution
fille de la catechine (Figure IV.7) ou de l'extrait lors de la quantification
des flavonokles, on ajoute 5 ml d'eau distill& puis 0.3 ml de nitrite de
sodium NaNO2 a 5% (m/v) dans l'eau et apres 5 minutes on rajoute 0.6
ml de trichlorure d'aluminium A1C13 a 10 % (m/v) dans l'eau, on
remarque que les flavonokles reagissent avec lui pour former un complexe jaune.
5 min apres, on additionne 2 ml de la soude NaOH (1M) et on constate le
changement de coloration du jaune vers le rose qui absorbe dans le visible a
510 nm. Ceci est complete a 10 ml avec de l'eau distillee, suivi d'une legere
agitation afin d'homogeneiser la solution pour la lecture contre un blanc d'eau
distill& en employant le méme spectrophotometre ultraviolet. A
partir des valeurs des absorbances obtenues, nous avons trace la courbe
d'etalonnage de la catechine (Figure IV.8).
I
|
1,6 1,4 1,2
1
0,8 0,6 0,4 0,2
|
|
y = 2,2272x R2 =
0,9974
O
0 0,1 0,2 0,3 0,4 0,5 0,6 0,7
concentration (g/1)
Figure IV. 8. La courbe d'etalonnage de la
catechine.
2.2.2. Resultats et discussion
La quantification des flavondides dans nos extraits a ete
determine en utilisant la courbe d'etalonnage et les resultats sont exprimes en
equivalent de la catechine, les resultats obtenus sont consigns dans le tableau
W. 3.
Tableau IV.3. La teneur en flavonoIdes et leur
pourcentage des plantes investiguees.
plante
|
C: g/1
|
Teneur en flavomfides mg/100g
|
Taux de flavomfides (%)
|
Foulia
|
0.72
|
144
|
38,91
|
Gondale
|
0,127
|
25
|
67,56
|
Lelma
|
1.32
|
264
|
109,12
|
Remth
|
0.4
|
80
|
36,74
|
Reguig
|
0,55
|
110
|
45,22
|
Sen-
|
0,77
|
155
|
72,43
|
Zwadet Elkhrouf
|
0,13
|
26
|
15,43
|
|
Dans toutes les plantes, on remarque que la taux des
flavonoIdes est compris entre 15,43 et 72,43% et inferieur aux taux des phenols
totaux, sauf pour la plante "Lelma", ce resultat peut étre explique que
la plante "Lelma" contient des composes possedant des structures chimiques
similaires aux flavondides, ou des flavonoIdes de couleur rose ce qui augmente
l'absorbance de l'extrait a 510 nm.
3. Conclusion
Les sept plantes ont subi le méme traitement de
sechage et d'extraction comme it est decrit precedemment. La teneur en composes
phenoliques et en flavonokles depend de differents facteurs (nature de
l'espêce, conditions physiologiques, la genetique, type d'extraction: le
solvant, le mode "a froid, a chaud", agitation ou non, ...). Les resultats
obtenus aprês les analyses sont résumés dans l'histogramme
figure IV. 9.
Teneur Ingig 3_
2,5 -
2 -
1 ,5-
1-
|
|
|
|
1 d t
|
|
|
|
|
|
IiI Phenols (mg/g)
Flavonoides (mg/g)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0
|
|
|
|
0,5-
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Plantes
|
|
|
|
|
|
|
|
Figure IV. 9. La teneur en composes phenoliques
et les flavonokles dans chaque plante. Dans la plante "Lelma" le taux des
flavonokles est nettement superieur au taux des poly phenols, celui est
interprets que peut étre ces composes ont une structure semblable de
celle des flavonokles donc ils absorbent dans la méme longueur
d'onde.
Bibliographie
· Augustin Scalbert, 1 avril 2004,
Fruits et legumes, polyphenols et sante, laboratoire des maladies metaboliques
et micronutriments, INRA, Centre de Recherche de Clermont-Fen-and/Theix, relu
par Edith Florentin (professeur agregee).
· B.I. Giner-Chavez, 1996, condensed
tannins in tropical forages -these Ph. D, Cornell University, Ithaca, USA.
· J. Zhishen, T. Mengcheng, W. Jianming,
1999, the determination of flavonoid contents in mulberry and their
scavenging effects on superoxide radicals, J Food Chem, Volume 64, pp
555-559.
· M. Yousfi, A. Djeridane, B. Nadjemi, S.
Maamri, F. Djireb, P. Stocker, December 2006, Phenolic extracts from
various Algerian plants as strong inhibitors of porcine liver carboxylesterase,
J Enzyme Inhib Med Chem, Volume 21, No 6, pp 719-26.
· M. Yousfi, A. Djeridane, B. Nadjemi, N. Vidal,
JF. Lesgards and P. Stocker, July 2007, Screening of some Algerian
medicinal plants for the phenolic compounds and their antioxidant activity,
J European Food Research and Technology, Volume 224, No 6, pp
801-809.
Z1 Ids des extraits
p6andires sur (es
enzynes
ai--d Amyrase
Alpha dextrines
Chapitre V: effets des extraits phenoliques sur les
enzymes 1. a- Amylase
1. Principe de la methode
L'activite enzymatique peut étre mesuree par
differentes techniques physico-chimiques (colorimetrie, spectrophotometrie,
fluorimetrie) ; cherchant generalement la disparition du substrat ou
l'apparition de produit en suivant l'evolution de la densite optique.
Dans ce travail on s'interesse a l'evaluation de l'effet des
composes phenoliques des extraits (des plantes investiguees) sur l'activite
(inhibition) enzymatique de l'alpha amylase d'Aspergillus oryzae. Elle
hydrolyse l'amidon (il existe sous forme de granules, qui se composent de
plusieurs molecules de million d'amylopectine ainsi qu'un nombre encore plus
grand de molecules d'amylose (R. Bowen, 2006) en produit
principal le maltose incolore suivant cette reaction :
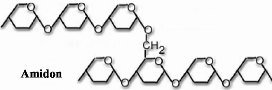
a- amylase

Maltase +
Maltatriase
Figure V. 1. 1. L'action de l'a- amylase sur
l'amidon
2. Procedure experimentale
L'analyse des inhibiteurs de l'alpha amylase est effectuee par la
quantification du sucre reducteur libere dans le milieu (maltose).
L'activite inhibitrice de l'enzyme est exprimee par la diminution
des unites du maltose libere dans le milieu reactiormel.
La methode suivie est celle de Bernfeld (1955), elle est basee
sur le dinitrosalicylique DNS qui stoppe la reaction enzymatique (changement de
pH) et forme un complexe avec le maltose dormant une coloration rouge dont
l'absorbance est mesuree a 530 nm.
Chapitre V: effets des extraits phenoliques sur les
enzymes 1. a- Amylase
2.1. La courbe d'etalonnage du maltose
A partir d'une solution mere aqueuse preparee du maltose de
concentration massique 0.03 mo1/1, des solutions filles sont ainsi preparees de
concentration allant de 0.0005 mo1/1 jusqu'a 0.002 mo1/1. Dans un tube, on
introduit 2 ml de la solution du maltose puis on ajoute 1 ml du reactif DNS (1
g de DNS, 200 mg de phenol cristallin, 20 g de double tartarate de sodium, et
50 mg sulfite de sodium dissous dans la soude de 1% [eau/volume] [prepare
frais]) qui est chauffe a 100 °C pendant 5 min, aprês
refroidissement, le mélange est complete a 10 ml d'eau distillee. La
lecture de l'absorbance de chaque solution est effectuee a l'aide d'un
spectrophotomêtre de Shimadzu 1601 a une longueur d'onde de 530 nm contre
un blanc (méme solution sans la solution du maltose) ce qui nous permet
de tracer la courbe d'etalormage (figure V. 1. 2) (Sigma
Aldrich, 1999) :
|
g 0,9
§
0,8
4
0,7
0,6
0,5
0,4
0,3
0,2
0,1
0
|
|
0 0,0005 0,001 0,0015 0,002 0,0025
Concentration du maltose mol/I
Figure V. 1. 2. La courbe d'etalormage de
maltose.
2. 2. Activite de 1' a- amylase
Le milieu reactiormel contient 100 ill des extraits
phenoliques, 50 IA de l'a- amylase sont pre incubes pendant 30 minutes,
aprês lml de solution d'amidon 1% (m/v) est ajoute puis incube a
37°C pendant 10 minutes, par la suite le milieu est traite de la
méme fawn que la courbe d'etalormage du maltose et la lecture est
effectuee a 530 nm. Un blanc a ete place sans extrait phenolique, et encore
sans l'a-amylase (E. Kokiladevi et al, 2005).
La representation graphique 1/V = f ([polyphenols]), nous
renseigne sur le type d'inhibition et permet de determiner les constantes
cinetiques en presence et en absence des extraits phenoliques.
3. Resultats et discussion
A l'aide des mesures spectrophotometriques realisees sur
l'activite enzymatique de l'a amylase et comparativement a la representation de
Michaelis-Menten, on apercoit que cet enzyme presente une cinetique
michaelienne (figure V. 1. 3).
1
0,5
0 2 4 6 8 10 12 14 16
Am idon (NM)
Figure V. 1. 3. La cinetique enzymatique de l'a
-amylase.
Les differentes parametres cinetiques de l'enzyme (V.,
KM) sont determines selon l'equation en double inverse de Lineweaver
Burk [1/ V = f (1/ S)] (figure. V.1.4).
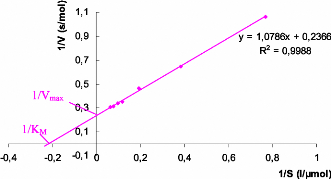
Figure V. 1. 4. Representation de
Lineweaver-Burk de l'enzyme michaelienne a- amylase.
A partir de la representation de Lineweaver-Burk de l'a-
amylase, la vitesse maximale V. est de 3, 846 mol/s et la constante de
Michaelis KM est de 4, 347 mM.
L'etude de l'effet des extraits phenoliques sur l'activite de
l'a- amylase est effectuee a l'aide d'un spectre UV-visible Shimadzu 1601,
mesurant la concentration de maltose libere qui est transforms par la suite en
une vitesse en mol/s.
D'apres les traces (figure V. 1. 5) representant la variation
de l'inverse des vitesses reactionnelles en fonction des concentrations des
extraits phenoliques exprimees en 1.1M (en considerant une masse molaire
moyenne des polyphenols de l'ordre de 500g) pour differentes concentrations de
substrats, nous avons determine le type et la constante d'inhibition
(Ki) de chaque echantillon.
-
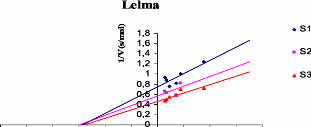
· S1
· S2 A S3
120 -100 -80 -60 -40 -20 0 20 40 60 80
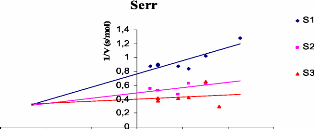
· S1
· S2
· S3
- 60 -40 -20 0 20 40 60
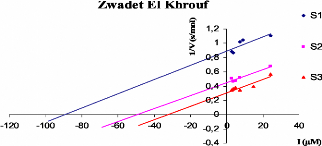
· S1 S2 A S3
Figure V. 1. 5. Representations graphiques
1/V = f ([polyphenols]) de chaque extrait phenolique tel que 1/V (s/ADO),
([S3]> [S2]> [Si]).
Les constantes d'inhibition (Ki) sont calculees a
partir de ces graphes par la projection du point d'intersection des droites sur
l'axe des abscisses, tandis que le type d'inhibition est deduit a partir du
point de rencontre de ces traces. Le tableau V. 1. 1 regroupe les differents
resultats obtenus.
Chapitre V: effets des extraits phenoliques sur
les enzymes 1. a-
Amylase
Tableau V. 1. 1. Le type
d'inhibition et la constante d'inhibition de chaque plante
Plante Type d'inhibition Ki (pM)
Foulia I I
Gondale / I
Lelma Non competitif 58
Remth / I
Reguig / I
Serr Non competitif 46
Zwadet Elkhrouf incompetitif ND
ND: Non determine
Les resultats obtenus montrent que parmi les sept plantes it
y'a seulement trois plantes qui ont un pouvoir inhibiteur de l'a-amylase de
type non competitif pour "Lelma" et "Serr" et de type incompetitif pour "Zwadet
Elkhrouf'.
Nous avons teste les extraits phenoliques des sept plantes
etudiees vis-à-vis a l'inhibition enzymatique car on peut trouver les
extraits qui inhibent mais qui ne peuvent pas apparaitre dans les traces 1/V= f
(I), pour cela nous avons appliqué la methode de Qiang II et al
(Qiang .H et al, 2006) qui determine le
pourcentage d'inhibition suivant cette relation:
Inhibition (%) = [1 - (test d'activite
/ contrOle)]* 100
tel que: test d'activite est le test en presence l'inhibiteur, le
contnile est le test sans inhibiteur. Les resultats obtenus sont consigns dans
le tableau V.1. 2 et presentes dans l'histogramme (figure V. 1. 6).
Tableau V. 1. 2: Le pourcentage d'inhibition de
chaque plante.
|
|
|
|
Plante
|
Pourcentage d'inhibition
Inhibiteur 1
Inhibiteur 2
|
|
Foulia
|
22,84
|
7,71
|
|
Gondale
|
22,63
|
52,57
|
|
Lelma
|
12,65
|
23,25
|
|
Remth
|
17,48
|
20,37
|
|
Reguig
|
5,14
|
21
|
|
Serr
|
8,12
|
9,46
|
|
Zwadet Elkhrouf
|
24,48
|
15,94
|
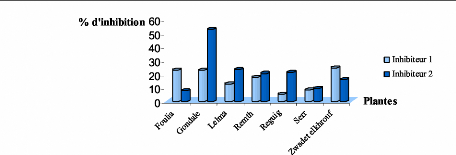
q Inhibiteur 1
q Inhibiteur 2
% d'inhibition 60
50 40 30 20 10
Plante s
0
b tp* 4.° 00
Figure V.1.6. Le taux d'inhibition de
l'a-amylase avec deux concentrations d'inhibiteur croissantes (Rd <
[I2]) et une seule concentration de substrat.
Nous remarquons que l'extrait "Gondale" possede un pourcentage
d'inhibition le plus eleve de l'ordre de 52,57 %, alors que cet extrait ne
repond pas au graphique 1/V = f (I) car ce type de graphique a ete obtenu a des
concentrations nes faibles en phenols.
Le taux d'inhibition augmente lorsque la concentration
d'inhibiteur augmente a l'exception de deux plantes : "Foulia" et "Zwadet
Elkhrouf' et ceci peut étre explique par l'effet activateur qui est du a
la concentration elevee en composes phenoliques.
4. Conclusion
Les inhibiteurs de l'a amylase sont diversifies et
generalement synthetiques utilises comme medicament contre le diabete exemple
l'acarbose, mais toujours on s'interesse a la nature pour la recherche des
inhibiteurs de cette enzyme, beaucoup des plantes medicinales sont connus dans
ce domain ; nos plantes sont des plantes sahariennes qui contiennent les
phenols connus par leur pouvoir d'inhiber les enzymes et surtout les
flavonokles du a leurs structures chimiques.
Parmi les sept plantes seulement trois plantes qui ont le
pouvoir inhibiteur de l'enzyme sachant que ces plantes ont subit la méme
procedure d'extraction des composes phenoliques ce qui explique que
l'inhibiteur est specifique capable de bloquer le site actif de l'enzyme.
Chapitre V: effets des extraits phenoliques sur les
enzymes 2. Ttypsine
1. Principe de la methode
Dans cette partie du travail, on s'interesse
a l'evaluation de l'effet des composes phenoliques des extraits (des plantes
investiguees) sur l'activite enzymatique de la trypsine pancreatique bovine.
Cette enzyme hydrolyse le Na- Benzoyle- DL- Arginine -p-
Nitroaniline (BAPNA) en produit principal le Na- Benzoyle- DL- Arginine
incolore et le -p- Nitroaniline qui est de couleur jaune detectable en visible
suivant cette reaction (figure V. 2. 1):
H-,INT NH2
|
0
NO
|
BAPNA
Tiypsine
|
|
|
|
|
|
|
|
|
|
1-12N
|
|
N.,NH
|
|
-p- Nitroaniline
H2N NTT) (405 nm)
Na- Benzoyle- DL- Arginine
Figure V. 2. 1. L'action de la trypsine sur le
BAPNA (Anonyme, 2004). 2. Procedure
experimentale
L'analyse des inhibiteurs de la trypsine est effectuee par la
mesure de la vitesse de la reaction enzymatique dans le mode cinetique
(kinetic) dans le spectrophotometre Shimadzu 1601. Le milieu reactionnel (3 ml)
contient 200 1.t1 de la trypsine (0,16 mg/ml) dans 1,6 ml de tampon tris
(trishydroxymethylaminomethane) C41-1111103 de
concentration molaire 50 mM avec le chlorure de calcium CaC12 de
concentration molaire 10 mM et de pH= 8,2. La cinetique enzymatique (t = 300
secondes) debute apres l'addition de 1 ml de substrat (a differentes
concentrations) ; le blanc est depourvu de l'enzyme et les inhibiteurs.
Chapitre V: effets des extraits phenoliques sur
les enzymes 2. Ttypsine L'activite
inhibitrice des polyphenols est mesuree de la méme fawn en introduisant
200 IA de differentes concentrations des extraits phenoliques.
3. Resultats et discussion
A l'aide des mesures spectrophotometriques realisees sur
l'activite enzymatique de la trypsine et comparativement a la representation de
Michaelis-Menten, on apercoit que cet enzyme presente une cinetique
michaelienne (figure V. 2. 2).
V (AA/s)
0,03
0,025 -
0,02 -
0,015 -
0,01
0,005 -
0 0,5 1 1,5 2
S(mM)
Figure V. 2. 2. La cinetique enzymatique de la
trypsine.
Les differentes parametres cinetiques de l'enzyme (V.,
KM) sont determines selon l'equation en double inverse de Lineweaver
Burk [1/ V = f (1/ S)] (figure V. 2. 3).
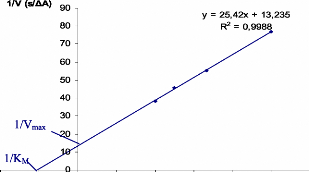
1/V (s/AA)
90
1/K
-1 -0,5 0 0,5 1 1,5 2 2,5 3
1/S (1/mM)
Figure V. 2.3. Representation de Lineweaver-Burk
de l'enzyme michaelienne trypsine.
A partir de la representation de Lineweaver-Burk de la trypsine,
la vitesse maximale V. est de 0.0769 AA/s et la constante de Michaelis
KM est de 2 mM.
Chapitre V: effets des extraits phenoliques sur
les enzymes 2. Ttypsine
Parmi les sept plantes etudiees, on trouve uniquement que
l'extrait "Foulia" qui possêde un pouvoir inhibiteur vis-a-vis de la
trypsine (Figure. V. 2. 4). Le type d'inhibition dans ce cas est non competitif
avec une constante d'inhibition Ki de l'ordre de 16 gM.
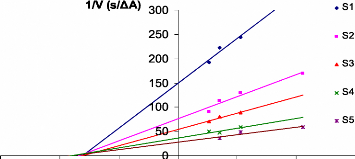
-30 -20 -10 0 10 20 30
I (PM)
Figure V. 2. 4. Representation graphique 1/V = f
([polyphenols]) de Foulia tel que ([S1] < [S2] <
[S3] < [S4] < [S5]).
Nous avons essaye de determiner le pourcentage d'inhibition de
tous les autres extraits y compris l'extrait "Foulia", pour ce faire nous avons
fixe la concentration des inhibiteurs et nous avons calcule le taux
d'inhibition suivant la methode de Qiang II et al (Qiang .H et
al, 2006). Les resultats obtenus sont regroupes dans le
tableau V.2.1 et representes dans l'histogramme (figure V. 2.5).
Tableau V. 2.1. Le pourcentage d'inhibition de
chaque plante.
|
Plante
|
Pourcentage d'inhibition
Substrat
|
|
Foulia
|
20,04
|
|
Gondale
|
5,44
|
|
Lelma
|
16,83
|
|
Remth
|
22,03
|
|
Reguig
|
21,78
|
|
Serr
|
21,78
|
|
Zwadet Elkhrouf
|
15,10
|
o
% 30 d'inhibition
20- °
d
--7
plantes
10-
·SIS)
Figure V. 2. 5. Le taux d'inhibition de la
trypsine avec une concentration fixe de substrat et d'inhibiteur.
On remarque que les valeurs du pourcentage d'inhibition
varient de 5,44 % pour l'extrait "Gondale" a 22.03 % pour l'extrait "Remth",
les valeurs trouvees prouvent que le taux d'inhibition est independant de la
concentrations des phenols, on peut conclure que l'inhibition enzymatique
depend du type des composes phenoliques (relation structure -- activite).
4. Conclusion
Les inhibiteurs de la trypsine sont diversifies et
generalement synthetiques utilises comme medicament contre plusieurs maladies
par exemple la pancreatite, mais toujours on cherche des extraits naturels des
plantes qui peuvent etre des inhibiteurs de cette enzyme, beaucoup des plantes
medicinales sont connus dans ce domain ; nos plantes sont des plantes
sahariennes qui contient des principes actifs connus par leur pouvoir d'inhiber
les enzymes et notamment les composes a structure phenolique.
Parmi les sept plantes seulement une seule plante qui a le
pouvoir inhibiteur de l'enzyme sachant que les sept plantes ont subit les
mémes procedures experimentales ce qui explique que l'inhibiteur est
specifique capable de bloquer le site actif de l'enzyme.
L'inhibition enzymatique de la trypsine depend de differentes
parametres tel que : La concentration de substrat.
Le type d'inhibiteur et la nature de sa structure chimique (sa
relation avec le site catalytique).
La concentration de l'inhibiteur.
Lipase
1. Principe de la methode
Nous avons aussi evalue l'effet de nos extraits phenoliques sur
l'activite de la lipase pancreatique porcine.
Cette enzyme hydrolyse l'huile de maIs (poly insature) riche
en triglycerides en produit le glycerol et principalement l'acide linoleique
detectable dans l'UV a 232.5 nm suivant cette reaction (figure V. 3. 1):
H2C-- 0 -- CO -- C (CH2)7 CH
= CH-- CH2 -- CH = CH (CH2)4CH3 H
C-- 0 -- CO -- C (CH2)7 CH = CH-- CH2 -- CH =
CH (CH2)4CH3 H2C-- 0 -- CO -- C
(CH2)7 CH = CH-- CH2 -- CH = CH
(CH2)4CH3
L'huile de ma'is (riche en tri linoleine)
Lipase
CH2-- OH
CH -- OH
3 (CH3
(CH2)4 CH = CH -- CH2 -- CH = CH
(CH2)7 -- COON) +
CH2-- OH
Acides linoleiques Glycerol
Figure V. 3. 1. L'action de la lipase sur
l'huile de maIs.
2. Procedure experimentale
L'analyse des inhibiteurs de la lipase est effectu& par la
mesure de l'absorbance du produit libere puis transforms en une vitesse.
Le milieu reactiormel (3 ml) contient lml de la lipase
pancreatique porcine de concentration 1,1 mg/ml dissout dans le tampon tris 0,2
M de pH = 7,7, 1 ml d'eau distill& et 1 ml d'huile de maIs 5 mg/ ml prepare
dans l'eau et 200 mg de tween 20 (Polyethylene glycol sorbitan monolaurate)
pour la solubilisation de l'huile dans l'eau, le mélange est incube
a 37°C pendant 30 minutes puis la reaction est stopp& par l'ajout de
lml d'ethanol, la lecture est effectu& 232.5 nm contre un blanc depourvu de
l'enzyme.
L'activite inhibitrice des extraits est mesur& de la
méme fawn en introduisant 1 ml de differentes concentrations des
extraits phenoliques.
3. Resultats et discussion
A l'aide des mesures spectrophotometriques realisees sur
l'activite enzymatique de la lipase et comparativement a la representation de
Michaelis-Menten, on apercoit que cet enzyme presente une cinetique
michaelienne.
|
E0,025 -
> 0,02 -
0,015 -
0,01 -
0,005 -
0 '
|
|
|
|
|
|
|
|
0 0,001 0,002 0,003
|
0,004 0,005
concentration (g/m1)
|
Figure V. 3. 2. La cinetique enzymatique de la
lipase.
Les differentes parametres cinetiques de l'enzyme
(Vmax, KM) sont determines selon l'equation en
double inverse de Lineweaver Burk [1/ V = f (1/ S)].
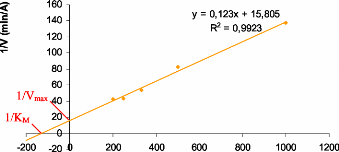
Ze c
E
160 140
120 100 80
60
y = 0,123x + 15,805 R2 = 0,9923/
1/S (ml/g)
Figure V. 3.3. Representation de Lineweaver-Burk
de l'enzyme michaelienne lipase.
A partir de la representation de Lineweaver-Burk de la lipase, la
vitesse maximale Vmax est de 0.0625 AA/min et la constante de
Michaelis KM est de 0.008 g/ml.
Nous avons essaye de tracer les graphes 1/V = f (I) pour tous
les extraits, mais malheureusement nous n'avons pas abouti car un test realise
nous a demontre que les extraits phenoliques etudies absorbent dans la
méme longueur d'onde que l'acide linoleique qu'elle est de 232,5 nm,
pour cela nous avons prefere d'evaluer le pouvoir inhibiteur de nos extraits
vis-a-vis de la lipase par la determination du pourcentage d'inhibition
seulement en appliquant la methode de Qiang .I-1 et al (Qiang
.H et al, 2006), les resultats sont consigns dans le tableau
V. 3. 1 et representes dans l'histogramme (figure V. 3. 4)
|
Chapitre V: effets des
extraits phenoliques sur les enzymes
|
3. Lipase
|
|
Tableau V. 3. 1. Le pourcentage d'inhibition de
chaque
|
plante.
d'inhibition Inhibiteur 2
Pourcentage
|
|
|
Plante
|
Inhibiteur 1
|
Inhibiteur 3
|
|
Foulia
|
15,60
|
21,70
|
71,03
|
|
Gondale
|
3,40
|
32,73
|
21,23
|
|
Lelma
|
29,03
|
10,31
|
69,44
|
|
Remth
|
11,20
|
11,51
|
70,43
|
|
Reguig
|
15,60
|
29,74
|
25
|
|
Sen-
|
29,46
|
10,31
|
44,44
|
|
Zwadet Elkhrouf
|
28,32
|
38,71
|
42,06
|
|
% d'inhibition 80 -
60 -
40 -
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
q Inhibiteur 1
q Inhibiteur 2
q Inhibiteur 3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20-
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0
|
|
|
|
|
|
|
|
plante s
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Figure V. 3. 4. Le taux d'inhibition de la
lipase avec trois concentrations d'inhibiteur croissantes ([Ii] <
[12] < [I3]) et une seule concentration de
substrat.
Nous remarquons que parmi les sept plantes seulement "Foulia"
et "Zwadet Elkhrouf' sont des bons inhibiteurs de la lipase, car le taux
d'inhibition augmente en fonction de la concentration des extraits phenoliques
par contre pour les autres extraits aucune relation est remarquee entre la
concentration des extraits et le taux d'inhibition.
Chapitre V: effets des extraits phenoliques sur
les enzymes 3. Lipase
4.
Conclusion
La lipase est une enzyme importante dans le corps humain et
son activation peut étre benefique ou nefaste presente generalement dans
le problême de l'obesite, it y a plusieurs types d'inhibiteurs
synthetiques exemple : -polylysine, parmi les plantes etudiees deux plantes
peuvent étre classees parmi les bons inhibiteurs de la lipase a savoir :
"Foulia" et"Zwadet Elkhrouf'.
Chapitre V: effets des extraits phenoliques sur les
enzymes
Bibliographie
· Anonyme, 2004, Experiment 3: protease
kinetics.
· E. Kokiladevi, A. Manickam and B.
Thayumanavan, 2005, characterization of Alpha-amylase inhibitor in
Vigna sublobata, J Botanical Bulletin of Academia Sinica, Volume 46,
pp 189-196.
· Qiang He, Yuanping Lv, Kai Yao,
2006, Effects of tea polyphenols on the activities of a-amylase,
pepsin, trypsin and lipase, J Food Chemistry, Volume xxx, pp
xxx-xxx.
· R. Bowen, 2006, Polysaccharides
dietetiques : Structure et digestion.
· Sigma Aldrich, 1999, Enzymatic assay of
a- amylase Inhibitor, Sigma quality control test procedure.
Evaluation de factiviti
antioydante
Chapitre VI: evaluation de Pactivite antioxydante
Les termes antioxydants et radicaux libres sont des termes
populaires utilises par les nutritionnistes et autres professionnels de la
sante. Ces dernieres armees ont vu apparaitre un debordement d'informations sur
le role du stress oxydatif dans le declenchement d'un certain nombre de
maladies graves, telles que certains cancers, les maladies cardiovasculaires et
les maladies degeneratives liees au vieillissement, ainsi que sur le role
therapeutique possible des antioxydants dans ces maladies (Kristiina
Pelli et Marika Lyly, 2003).
1. Les radicaux libres
Les radicaux libres sont des atomes, ou un groupe d'atomes,
avec un nombre impair d'electrons sur la loge exterieure, et ils peuvent se
former quand l'oxygene interagit avec certaines molecules (Kristiina
Pelli et Marika Lyly, 2003).
Les radicaux libres sont des composes caracterises par une
structure electronique desequilibree qui leur confere une grande reactivite sur
les constituants organiques et sur les structures cellulaires. Ils se foment de
fawn inevitable en parallele au metabolisme energetique et par une multitude
d'autres voies. Ils favorisent habituellement le bon fonctionnement de
l'organisme et la sante des mammiferes, mais leur exces peut étre
nefaste. En dehors de toute situation pathologique, leur production est
stimulee par toute situation de stress, en particulier par la manipulation
maladroite ou brutale des animaux, par l'exercice physique, par le froid, par
des niveaux d'alimentation excessifs ou par des desequilibres alimentaires.
Elle peut alors atteindre des niveaux nuisibles pour les aspects quantitatifs
et qualitatifs des productions animales (B. Aurousseau,
2002).
Le metabolisme cellulaire normal de l'oxygene produit de
maniere continue de faibles quantites de derives reactifs de l'oxygene. Le role
physiologique de cette production basale de
Chapitre VI: evaluation de Pactivite
antioxydante
derives reactifs de l'oxygene n'est pas totalement connu, mais
certaines de ces molecules pourraient avoir une fonction dans les processus de
signalisation cellulaire.
Dans certaines situations, cette production augmente
fortement, entrainant un stress oxydatif que l'on definit comme un desequilibre
entre la production et la destruction de ces molecules. En raison de leur
capacite a endommager presque tous les types de molecules dans l'organisme, les
derives reactifs de l'oxygene ont ete impliques dans un tres grand nombre de
pathologies, tant aigues que chroniques (Gutteridge, 1993).
L'appellation " derives reactifs de l'oxygene " n'est pas
restrictive. Elle inclut les radicaux libres de l'oxygene proprement dit
[radical superoxyde (.02:), radical hydroxyl
(
·011), monoxyde d'azote (NO
·), ...],
mais aussi certains derives oxygenes reactifs non radicalaires dont la toxicite
est importante [peroxyde d'hydrogene (11202),
peroxynitrite (ON00-)] (GP. Novelli, 1997)
1.1. Les differents types des radicaux
libres
D' apres Halliwell (Halliwell, 1994), les
mecanismes de l'action d'un antioxydant peuvent comprendre :
- Le piegeage direct des especes reactives d'oxygene (ERO).
- L'inhibition des enzymes et la chelation des traces
metalliques responsables de la production des ERO.
- La protection des systemes de defense antioxydants.
- Le piegeage direct des ERO
L'interaction des flavonokles avec de nombreux radicaux a ete
employee dans plusieurs etudes afin de determiner les elements majeurs de
l'activite antioxydante. A cause de leurs faibles potentiels redox
(Jovanovic, 1994), les flavonokles (Fl-OH) sont thermodynamiquement
capables de reduire les radicaux libres oxydants comme le superoxyde, le
peroxyle, l'alkoxyle et l'hydroxyle par transfert d'hydrogene :
El - ( )H + R 6 H - 0' + RH
Oil R represente l'anion superoxyde, le peroxyle, l'alkoxyle et
l'hydroxyle.
Le radical flavonoxy (FL-0
·) peut reagir
avec un autre radical pour former une structure quinone stable.
quilione
R. RH
OH K... )
Chapitre VI: evaluation de Pactivite
antioxydante
Figure VI. 1. Piegeage des ERO (
·)
par les flavondides.
- L'inhibition des enzymes et la chelation des traces
metalliques responsables de la production des ERO
Les ions du fer (Fe24) et du cuivre
(Cu2#177;) sont essentiels pour certaines fonctions physiologiques.
Its peuvent étre, soit des constituants des hemoproteines, soit des
cofacteurs des differentes enzymes du systeme de defense antioxydant (par
exemple, Fe pour la catalase, et Cu et Zn pour la superoxyde dismutase). Mais
ils sont aussi responsables de la production du radical hydroxyle par la
reduction du peroxyde d'hydrogene selon la reaction suivante:
H2O. +Fe2+ (Cu+) '0H + -OH +
Fe3+ (Cti2+)
Les flavonokles sont consideres comme de bons chelateurs de ces
ions metalliques.
L'activite antioxydante des flavonokles est assuree grace a sa
structure active qu'elle est represent& dans la figure VI. 2. :
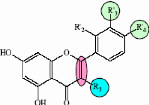
HO
Figure VI. 2. Elements essentiels pour
l'activite antioxydante des flavonokles
(Abdelghafour
MARFAK, 2003).
2. L'activite antioxydante et les
antioxydants
2.1. L'activite antioxydante
Les mecanismes de defense anti-oxydante du corps humain
peuvent étre divises en deux categories differentes. Premierement, un
certain nombre d'enzymes sont synthetisees a partir des proteins et d'autres
nutriments et constituants de l'organisme. Le second groupe d'antioxydants doit
étre obtenu a partir de l'alimentation, puisque ces derniers ne peuvent
étre synthetises par l'étre humain. Its comprennent les
nutriments et les metabolites vegetaux mentionnes plus haut : les vitamins E et
C, les carotenokles, le selenium, les folates, les flavonokles, les
phytoestrogenes et les glucosinolates (Kristiina Pelli et Marika
Lyly, 2003). 2.2. Les antioxydants
Les antioxydants sont des molecules capables d'interagir sans
danger avec les radicaux libres et de mettre fin a la reaction en chain avant
que les molecules vitales ne soient endommagees. Chaque molecule antioxydante
ne peut reagir qu'avec un seul radical libre, et par consequent, it faut
constamment refaire le plein de ressources anti-oxydantes.
Chapitre VI: evaluation de Pactivite
antioxydante
2.2.1. Les antioxydants synthetiques
Its sont utilises pour empécher les aliments gras de
rancir et pour proteger les vitamines liposolubles (A, D, E et K) contre
l'oxydation. Les esters d'acides galliques, le butylhydroxytoluene et le
butylhydroxyanisol, appartiennent a cette categorie. Les vitamines C et E ont
egalement des proprietes antioxydantes et ont l'avantage d'augmenter la valeur
nutritive des aliments. Des recherches ont montre que les antioxydants
synthetiques employes par l'industrie alimentaire sont egalement benefiques
pour l'organisme (Microsoft Encarta, 2007)
Les antioxydants synthetiques sont generalement prepares en
laboratoire, et principalement a partir de composants chimiques. Dans
l'industrie alimentaire, l'ajout d'antioxydants naturels dans les aliments est
une technique completement nouvelle. Depuis a peu pres 1980, les antioxydants
naturels sont apparus comme alternative aux antioxydants synthetiques, et ils
sont aujourd'hui generalement preferes par les consommateurs. Toutefois, le
fait de trouver communement une substance dans un aliment ne constitue pas une
garantie de son absence totale de toxicite. Les antioxydants synthetiques ont
ete testes quant a leurs effets carcinogens ou mutagenes, mais de nombreux
constituants naturels des aliments n'ont pas encore ete testes
(Kristiina Pelli et Marika Lyly, 2003).
2.2.2. Les antioxydants naturels
Parmi les antioxydants naturels on trouve l'acide ascorbique
(Vitamine C), les tocopherols (Vitamine E) et les composes phenoliques exemple
les flavonoIdes.
3. Test de DPPH
3.1. Principe de la methode
Le DPPH ou 1,1-dipheny1-2-picrylhydrazyle agit en tant qu'un
radical libre stable efficace reduit par un antioxydant, montrant un spectre
d'absorption a 517 nm avec une couleur violette, la reduction de ce radical
nous donne la coloration jaune (Dong-Sun Lee et al,
2001).
La reaction de la reduction de DPPH. Avec les
composes phenoliques est montre ci-dessous :
0
0
Figure VI. 3 : La reaction entre le DPPH et
l'hydroquinone (Masahiro Nishizawa et al, 2005).
3.2. Procedure experimentale
On prend 1 ml de la solution de DPPH dissout dans le methanol de
concentration 250 1.1A4 avec 1 ml de l'extrait phenolique de concentrations
croissantes, apres une incubation pendant
30 minutes on effectue la lecture dans le spectrophotometre a
517 pourcentage d'inhibition suivant cette relation :
I% = (1 --
(Aextrait
ADPPH temoin)) *100
|
nm, on calcule le
|
|
3.3. Resuftats et discussion
Les resultats obtenus nous permet de tracer les graphes
figurant la variation du pourcentage d'inhibition en fonction de la
concentration de l'extrait phenolique I% = f (C), les graphes sont representes
dans la figure VI. 4.

E 70
E 60
50 40 30 20 10
PI (%) 100 -80 -60 -40 -20 -
Foulia
y= 3,8593x
R2 = 0,9818
y = 5,0395x
R2 = 0,973
Gondale
0
|
|
|
|
0
|
|
|
|
|
|
5
|
10
|
15
|
20 C (pM)
|
|
10
|
15
|
20
|
|
C (pM)

Lelma
Remth
y = 6,1801x
y = 5,5069x
-8. 100
E 80
60 40 20
R2 = 0,9695
R2 = 0,9669
C
80 60 40 20
0
0
5 10 15 20
C (1M)
2 4 6 8 10 12 14
C (pM)
Chapitre VI: evaluation de Pactivite
antioxydante
E 100
r.
80 60 40 20 0
Reguig y = 8,5847x
il 120
-
a 100
-
80 -60 -40 -20 -
R2 = 0,9487
0
2 4 6 8 10 12 14
C (OA)
Serr y = 7,4359x
R2 = 0,9912
,
2 4 6 8 10 12 14
C (pM)
Zwadet El khrouf
E 50 r. 40
30 20 10 0
y = 3,2364x R2 = 0,9945
·
2 4 6 8 10 12 14
C (pM)
Figure VI. 4. Les graphes PI =f (C) de chaque
plante.
Puisque la valeur d'EC50 presente la concentration
d'inhibiteur necessaire pour balayer 50 %
des radicaux libres et qui est
inversement proportionnelle a l'activite antioxydante, nous avons
determine
les valeurs des EC50 de chaque extrait phenolique a partir des
representations
graphiques I % = f (I). Les resultats sont groupes dans le
tableau VI. 1 et presentes dans
l'histogramme (figure VI. 5).
Tableau VI. 1. Les EC50 de chaque
plante.
|
|
Plante
|
EC 50 (mg/ml)
|
Foulia
|
12,95
|
Gondale
|
9,92
|
Lelma
|
9,1
|
Remth
|
8,1
|
Reguig
|
5,8
|
Serr
|
6,7
|
Zwadet
|
15,4
|
|
EC50
(mg/m1)16
14- 12- 10- 8 - 6- 4 - 2 -
0 MI , Plantes
640 ,z--
ks>,
oP ,z--
,z, *
· ,z, ,
,i, 4,1, , c.0
00 i. ,,i,
be
1
Figure VI. 5. Classement croissant des
plantes selon leur EC50.
Si on compare les valeurs de EC50 des sept
extraits, on peut dire que l'extrait "Reguig" est le plus puissant antioxydant,
alors que l'extrait phenolique "Zwadet Elkhrouf' est l'antioxydant le plus
faible. Nous n'avons pas trouve une correlation entre le pouvoir antioxydant
EC50 et la teneur en phenols totaux et flavonoIdes. Ce resultat peut
étre explique que les extraits etudies renferment des composes
phenoliques de structures chimiques differentes et que ractivite antioxydante
etudiee par ce test ne depend pas obligatoirement de la concentration des
composes phenoliques. L'idee de revaluation de ractivite antioxydante est dans
le but de trouver une correlation de ractivite antioxydante et le pouvoir
inhibiteur des enzymes. Les tentatives essayees n'ont pas conduit a un resultat
significatif et ceci montre q'un extrait inhibiteur d'enzyme ne soit forcement
pas un antioxydant puissant.
Chapitre VI: evaluation de Pactivite
antioxydante
4. Conclusion
Les radicaux libres sont des molecules instables produites en
permanence par le corps humain suivant des reactions biochimiques, par exemple
la production de l'energie a partir des aliments et de l'oxygene, ils peuvent
s'associer a d'autres molecules et entrer en reaction comme ils peuvent
endommager ou detruire les parois des cellules. De cette oxydation provient
l'alteration de l'ADN et le vieillissement cellulaire qui est a la base de
certaines maladies comme l'atherosclerose et le cancer.
L'organisme pour se defendre possede des agents neutralisant
les radicaux libres qui sont les enzymes tel que la super-oxyde dismutase et
les vitamines "anti-oxydantes" C, E, A, les bioflavonoIdes, les vitamines du
groupe P comme les pigments vegetaux qui ont un effet protecteur "le
béta-carotene".
A travers cette etude, on peut dire que les plantes etudiees
possedent des pouvoirs antiradicalaires importants.
Chapitre VI: evaluation de Pactivite
antioxydante
Bibliographie
· Abdelghafour Marfak, le 12 Decembre
2003, Radiolyse gamma des flavonokles. etude de leur reactivite avec les
radicaux issus des alcools : formation de depsides, p 30-34 (these de
doctorat), l'Universite de Limoges, Ecole Doctorale Sciences Biologie Sante,
Faculte de Pharmacie.
· B. Aurousseau, 2002, les radicaux
libres dans l'organisme des animaux d'elevage : consequences sur la
reproduction, la physiologie et la qualite de leurs produits, INRA Prod.
anim.
· Dong-Sun LEE, Nam-Soon KIM and Sang-Han LEE,
2001, 2, 2-Dipheny1-1- picrylhydrazyl Hydrate, a Stable Free Radical,
Is an a-Glucosidase Inhibitor, J Biological & pharmaceutical bulletin,
Volume 24, No 6, pp 727-728.
· JM Gutteridge, 1993, Free radicals in
disease processes: a compilation of cause and consequence. J Free Radical
Res Commun, Volumel9, pp 141-158.
· ICristiina Pelli et Marika Lyly, janvier
2003, les antioxydants dans l'alimentation, Biotechnology Finlande.
· Masahiro Nishizawa, Masahiro Kohno, Minemitsu
Nishimura, Akio Kitagawa, and Yoshimi Niwano, 2005, Non-reductive
Scavenging of 1, 1-Dipheny1-2- picrylhydrazyl (DPPH) by Peroxyradical: A Useful
Method for Quantitative Analysis of Peroxyradical, J Chemical and
pharmaceutical bulletin, Volume 53, No 6, pp 714716.
· Novelli GP, 1997, Role of free radicals
in septic shock. J Physiol Pharmacol, Volume 48, pp 517-527.
Conclusion générale
Les plantes medicinales restent toujours la
source fiable des principes actifs connus par leurs proprietes therapeutiques,
ce qui nous amen a la conservation de la biodiversite vegetale locale.
Et comme la phytotherapie suscite un renouveau d'interet, nous
nous sommes interesses dans ce travail a Petude des extraits phenoliques de
quelques plantes medicinales locales de divers familles botaniques connues par
leurs utilisations dans la medecine traditionnelle.
Dans ce travail, par Petendue des domaines de recherches
impliques se voulait une contribution a la connaissance de certaines plantes
appartenant a diverses familles. Il visait a evaluer les potentialites
bioactives du plus grand nombre d'especes afin de les selectionner pour une
etude chimique approfondie.
Dans un premiers temps, nous avons evalue la quantite des
phenols totaux en adoptant la methode de Folin -Ciocalteu, les resultats
montrent que les plantes etudiees sont relativement pauvres en ces composes
comparativement a d'autres plantes medicinales locales déjà
etudiees auparavant dans notre laboratoire. De méme nous avons dose les
flavonokles par la methode de Zhishen et al (complexation des
flavonokles avec le trichlorure d'aluminium en presence du nitrite de sodium
dans un milieu alcalin), le pourcentage des flavondides dans les extraits
phenoliques est relativement moyen.
Dans le but de trouver des plantes possedant des effets
inhibiteurs sur trois enzymes a savoir: Pa- amylase, la trypsine et la lipase,
nous avons etudie l'effet des extraits des plantes investiguees sur ces enzymes
par des methodes colorimetriques simples.
Les extraits des plantes: Atractylis serratuloides,
Plantago ciliata et Ifloga spicata sont doues d'un pouvoir
inhibiteur de Pa- amylase d'Aspergillus oryzae de types non competitif
et incompetitif avec des valeurs de Ki = 46 et 58 11,A4
respectivement.
Un seul extrait des plantes etudiees: Astragalus vogelii
fatimensis est un bon inhibiteur de la trypsine pancreatique bovine de
type non competitif et de Ki = 16 gM.
La lipase est inhibee par deux extraits de plantes:
Astragalus vogelii fatimensis et Ifloga spicata.
Dans un dernier temps, nous nous sommes interesses a etudier
Pactivite antioxydante des extraits des plantes dans le but de connaitre leurs
capacites antioxydantes et leurs pouvoirs inhibiteurs des enzymes.
Le pouvoir antiradicalaire des extraits vis-à-vis du
radical DPPI-1* est important, les valeurs des EC50 varient de 5.8 a
15.4 mg/ml ce qui nous permet de dire que les plantes etudiees sont une source
prometteuse des antioxydants naturels. Par contre aucune correlation positive a
ete prouvee entre Pactivite antioxydante et l'effet inhibiteur d'enzyme. Ceci
indique
que l'effet inhibiteur d'enzyme est independant de la quantite
des composes phenoliques ainsi que de leur pouvoir antioxydant.
Ce resultat prouve l'idee que l'activite enzymatique depend de
la structure chimique de l'inhibiteur (relation activite - structure).
L'ensemble de ce travail nous a permet de mieux cormaitre
Pinter& de l'etude des plantes medicinales de notre region. Les resultats
obtenus repondent a beaucoup de questions sur l'utilisation de ces plantes en
medicine traditionnelle.
Sans doute de nombreuses perspectives peuvent étre
envisagees qui se resument dans l'isolement et l'identification des molecules
bioactives responsables a l'inhibition enzymatique.

Index des noms latins
Le nom scientifique Atractylis
serratuloides
Astragalus armatus Astragalus vogelii fatimensis
Haloxylon scoparium
Helianthemum lippii Plantago ciliata
Ifloga spicata
La famille Compositae Legumineuse Fabaceae
Chenopodiacees Cistaceae Plantaginaceae Asteraceae
.DPPH'
Résumé: La phytotherapie est
une medecine traditionnelle utilisee par la population, elle est aussi la
connaissance et l'utilisation des proprietes therapeutiques des plantes dues
generalement aux metabolites secondaires "principes actifs". Dans le cadre de
ce travail nous nous sommes interesses aux extraits phenoliques de quelques
plantes medicinales locales et leur effets sur les enzymes: l'a- amylase, la
trypsine et la lipase. La premiere partie de cette etude concerne les modes
d'extraction et la quantification des composes phenoliques, d'apres les
resultats nos plantes montrent des teneurs faibles en phenols totaux (de 0.37
jusqu'i 37 mg/g en equivalent d'acide gallique) et en flavonoIdes (de 0.25
jusqu'i 1.55mg/g en equivalent de la catechine). Dans la deuxieme partie, nous
avons etudie l'effet de ces extraits sur l'a- amylase dont on trouve trois
plantes ont le pouvoir inhibiteur, la trypsine avec une seule plante inhibante
et la lipase avec deux plantes inhibantes. Dans la derniere partie, nous avons
cherche une correlation entre le pouvoir antiradicalaire des composes
phenoliques d'une part avec la teneur des plantes en polyphenols et d'autre
part avec le pouvoir inhibiteur des enzymes, on constate que l'activite
antioxydante depend de la structure chimique des phenols totaux et la meme
constatations pour l'activite inhibitrice des enzymes. En conclusion, d'autres
etudes sont necessaires pour connaitre les structures des composes phenoliques
responsables de l'inhibition enzymatique.
Mots des: Plantes medicinales, polyphenols,
flavonoIdes inhibition enzymatique, a-amylase, trypsine, lipase, pouvoir
antioxydant, DPPH.
Abstract: The traditional medicine or
phytotherapy is the art of curing using plants it is also the knowledge of
their therapeutic properties due to the secondary metabolites "active
ingredients". In this study, we are searching for phenolic compounds in seven
medicinal plants of Laghouat suburbs. Firstly we estimated the content of
polyphenols in the plants, such as the proportioning of total phenols which was
carried out following Singleton and Ross method while the flavonoids were
quantified by tri aluminium chloride and sodium hydroxide. Then we studied the
effect of these phenolic extracts on a- amylase, trypsin, lipase and also their
antioxidant characters using the test of DPPH (free stable radical reduced by
polyphenols). The quantitative analysis shows that the total phenols contents
lie between 0.37 and 3.7 mg/g equivalent of gallic acid while the flavonoids
contents lie between 0.25 and 1.55 mg/g equivalent of catechin. The study of
the extracts effects shows that three plants have an inhibiting capacity of a-
amylase, one plant for trypsin and two plants for lipase while their
antioxidant capacities are weak. According to these results, we resume that
enzymatic inhibition can be done with polyphenols which present also an
antioxidant capacity. This work shows that medicinal plants in our area should
be investigated to better comprehend their therapeutic properties. Further
studies are needed to know the relation ship between the chemical structure and
the enzymatic inhibition.
Keywords: Medicinal plants, polyphenols,
flavonoIds, enzymatic inhibition, a- amylase, trypsin, lipase antioxidant
capacity, DPPH.



