4. La cinetique enzymatique
4.1. L' activite enzymatique
4.1.1. Reaction catalysee par une enzyme (Bernard
Offmann, 2003)
Il y a au moires trois reactions simples:
1. Fixation du substrat (S) sur l'enzyme (E), formation du
complexe (ES)
2. Transformation du substrat lie (ES) en produit lie (EP)
3. Dissociation du complexe (EP), largage du produit (P)
ki k2 k3
+s .4,1 ES ...0"- 7P
...0"- ' + P
k_d k_2 k_3
Figure III.1 : Mecanisme reactionnel de la
formation du produit.
Leonor Michaelis et Maud Menten ont deduit de ce modele en 1913
une equation qui predit la vitesse initiale (de formation de P) en fonction de
la concentration du substrat:
Equation de Michaelis-Menten
Vo =
Vmax
·
[ S ]
[ S ] + Km
Tel que KM est la constante de Michaelis- Menten, et
Vmax est la vitesse maximale de la reaction enzymatique.
Dont sa representation graphique est port& dans la figure.
111.2.
0 1 2 3 4 5 6 7 8 9 10
Figure 111.2. Graphe
de Michaelis-Menten: vo en fonction de [S]
4.1.2. Linearisation de l'equation de
Michaelis-Menten
Il est difficile de placer correctement a la main une
hyperbole dans un graphe. On se trompe tres facilement sur la hauteur de
Vmax. Pour simplifier
revaluation des resultats, on utilise une transformation de l'hyperbole en
droite. La plus connue est la transformation en doublereciproque de Lineweaver
et Burk :
1 / Vo = 1 / Vmax + (KM /
Vmax)
· 1 /
[S]
Cette equation represente une droite de pente KM /
Vmax
L'intersection sur l'axe vertical est 1 / Vmax
et sur l'axe horizontal 1 / KM.
11 v 0 = 1 1 vmax +
(KM 1 vmax ). 1 1 [ s ]
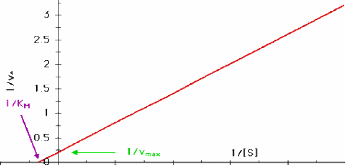
0 I 2 3 4 5
Figure III. 3. Graphe de Lineweaver-Burk: 1/Vo
en fonction de 1/[S].
Cette representation permet d'estimer les constantes a l'aide
de papier millimetre et d'une regle. Elle a cependant le defaut de dormer trop
de poids aux valeurs experimentales les plus imprecises, celles des plus
petites concentrations de substrat.
4.2. L'inhibition enzymatique
4.2.1. Les inhibiteurs
De nombreuses substances modifient l'activite enzymatique en
se combinant a elle, ce qui altere la liaison de substrat et/ou son turnover.
Les substances qui diminuent l'activite enzymatique de la sorte sont appelees
des inhibiteurs.
Beaucoup d'inhibiteurs sont des molecules de structure voisine
du substrat de leur enzyme, mais qui soft ne reagissent pas, soient elles
reagissent tres lentement. De telle substance sont frequemment utilisees pour
elucider la nature chimique ou conformationnelle d'un site de liaison du
substrat, afin de determiner le mecanisme catalytique de l'enzyme. De plus,
beaucoup d'inhibiteurs d'enzymes sont des agents chimiotherapeutiques efficaces
car un analogue de substrat "non naturel" peut bloquer l'action d'un enzyme.
Par exemple, le methotrexate (appele aussi l'aminopterine) ressemble
chimiquement au dihydrofolate. Le methotrexate se lie fortement a la
dihydrofolate reductase, ce qui l'empéche d'assurer sa fonction
physiologique, la reduction du dihydrofolate en tetrahydrofolate.
Les inhibiteurs d'enzyme peuvent agir selon des mecanismes
varies. Dans cette section, nous allons etudier plusieurs de ces mecanismes
parmi les plus simples, et leurs influences sur le comportement cinetique des
enzymes qui suivent le modele de Michaelis-Menten (Donald Voet et
Judith G. Voet, 1998).
4.2.2. Les types d'inhibition :
4.2.2.1. Les inhibiteurs competitifs
Ils se lient de maniere reversible au site actif de l'enzyme
et en bloquent l'acces au substrat. Ils diminuent donc la concentration
d'enzyme libre ([E]). En general ils ressemblent chimiquement au substrat.
D'ailleurs, si une enzyme a plusieurs substrats possibles, ceux-ci peuvent
aussi agir comme inhibiteurs competitifs reciproques. Les meilleurs inhibiteurs
sont souvent en fait des analogues de l'etat de transition de la reaction.
|
k1
E -1- S
k-1
I
-1-
|
K2
ES -Ow E -1- P
|
kilt k_i
El
Figure 111.4 : Mecanisme reactionnel en presence
d'inhibiteur. Dans l'equation de Michaelis-Menten, KM est remplace
par:
Km = K m
· {-1 +
[IFKI )

|
Yo
|
|
|
|
3 --
|
|
|
|
v,,,,,/ 2
|
|
|
,----- ..--
|
|
2 --
|
Oil K1= ki/k_i est la
constante de dissociation de l'inhibiteur. Le KM apparent augmente
donc, it y a perte apparente d'affinite pour le substrat. Cependant un
supplement de substrat peut compenser cette inhibition et la vitesse maximale
Vmax reste la méme.
5 --
4 --
,-----------17:: - --
_---------
,
Kri-
Km.
Kri
1
4 5 6 7 13 9
I
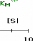
1
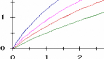
Figure 111.5. Variation de la vitesse
initiale en fonction de la concentration en substrat pour une reaction de
Michaelis-Menten simple en presence de differentes concentrations d'un
inhibiteur competitif.
En double-reciproque, on obtient des droites de pentes
differentes qui se croisent a 1/[S] = 0 : 1N max est donc
le méme, mais -1/Km est de plus en plus petit (fleches colorees), alors
que la pente augmente.
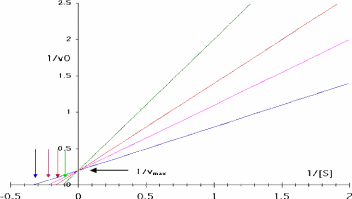
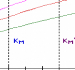
Figure 111.6. Representation de Lineweaver-Burk
de l'enzyme michaelienne inhibee competitivement decrite dans la Figure 111.5
Notez que toutes les droites se coupent sur l'axe
1/V0 a 1
/Vmax.
Exemples de medicaments: Le methotrexate, un analogue
structurel du tetrahydrofolate, est un inhibiteur competitif de la
dihydrofolate reductase, sur laquelle it se fixe 1000x mieux que le substrat
naturel. C'est un medicament anticancereux (Bernard Offmann,
2003).
4.2.2.2. Inhibition incompetitive
Dans l'inhibition incompetitive, l'inhibiteur se
lie directement au complexe enzyme-substrat, sans pouvoir se fixer a l'enzyme
libre (Donald Voet et Judith G. Voet, 1998).
ki 2
E +S NIN''' ES
-11.- E + P 1(4
+1
kilrt k-js
PSI
Figure 111.7: Mecanisme reactiormel en
presence d'inhibiteur.
Dans ce cas, V. et KM diminuent du méme
facteur (1 + [WIC's), alors que KM / V. reste inchange.
L'affinite apparente de l'enzyme pour le substrat augmente donc :
(Bernard Offmann, 2003).
Villa; -- Vmax i (1
+ [I]1KIs )
Km = Km i ti + [1]1Kis )
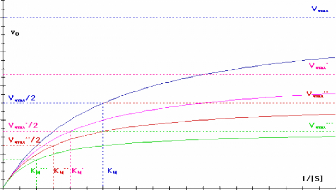
0 4 b 8 10
Figure 111.8. Variation de la vitesse
initiale en fonction de la concentration en substrat pour une reaction de
Michaelis-Menten simple en presence de differentes concentrations d'un
inhibiteur incompetitif (Bernard Offmann, 2003).
En double-reciproque, on obtient des droites paralleles de pente
constante KM / V.
Chapitre III: les enzymes
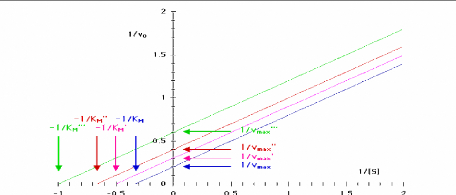
0
2
- 0_5
0_5
Figure 111.9. Representation de Lineweaver-Burk
de l'enzyme michaelienne inhibee incompetitivement decrite dans la Figure 111.8
(Bernard Offmann, 2003).
4.2.2.3. Les inhibiteurs non-competitifs
Its se lient de maniere reversible ailleurs qu'au site actif de
l'enzyme et n'en empéchent pas l'acces. Il s'agit donc d'inhibiteurs
allosteriques, c'est-à-dire agissant a un autre (allo-) site.
K1 2
E + S ..410
· ES
-lo. E + P
k-1
+ I +I
kilt k_i kisif k-is
kli
El
4111P'
ESI
k.11
Figure III.10: Mecanisme reactiormel en
presence d'inhibiteur.
Dans le cas particulier oil la fixation de l'inhibiteur ne
modifie pas la fixation du substrat, ou reciproquement = Kis et
Ki = l'inhibiteur (dit "non-competitif pur") diminue [E]T
sans modifier la repartition entre enzyme libre et lie. Dans ce cas, c'est V.
qui est remplacee par:
vmax = vmax I
(1 + [I]/KI )
Le KM reste constant, mais it y a perte apparente de
concentration d'enzyme, donc reduction de V..
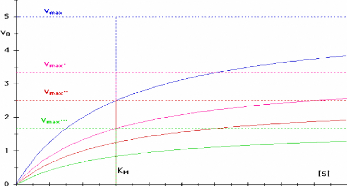
vo
a 2 3 ! 7 B 9 10
Figure III.1 1. Variation de la vitesse
initiale en fonction de la concentration en substrat pour une reaction de
Michaelis-Menten simple en presence de differentes concentrations d'un
inhibiteur non competitif (Bernard Offmann, 2003).
En double-reciproque, on obtient des droites de pentes
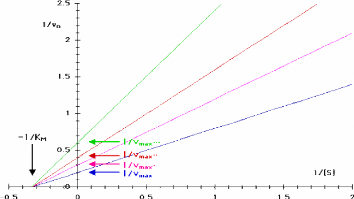
differentes qui se croisent a -1/KM
1.5
2
Figure 111.12. Representation de Lineweaver-Burk
de l'enzyme michaelienne inhibee non competitivement decrite dans la Figure
III.11 (Bernard Offmann, 2003).
| 


