Septicémie
Et
Choc septique
Dédicace
A nos parents
Qui n'ont jamais cessé de nous soutenir et
encourager dans les études.
Que le Seigneur vous bénisse et vous accorde
une longue vie !
Remerciement
Tout d'abord, nous tenons présenter nos remerciements avec
une profonde reconnaissance et gratitude à la directrice de notre
recherche, Dr. Soraya Talhouk pour tous ses précieux conseils
donnés au cours de l'année, nous permettant de réaliser au
mieux ce mémoire et qui nous a fait bénéficier de son
expérience.
Nous tenons aussi à remercier profondément les
membres du jury, les Professeurs Mohamed Skandarani et Zeina berjawi, pour
leurs conseils et leurs regards critiques. Nous allons les prendre en compte
dans la réalisation des travaux futurs.
Nous tenons à remercier ici les personnes qui, par leurs
conseils, leurs aides et leurs encouragements ont contribué à
l'aboutissement de ce travail.
· Dr. Elias Chamoun, doyen de la faculté de
santé publique à l'université libanaise.
· Dr. Fatina Alayly, directrice de FSP section 1.
· Dr. Mohamed Skandarani, Chef de département des
sciences de laboratoire.
· M. Samira Ghotmeh, Coordinatrice dans le
département des sciences de laboratoire.
· Dr. Mohamed Haydar, chef de laboratoire à
l'hôpital Bahman.
· Dr. Hosni Yazbek, chef de laboratoire à
l'hôpital Rassoul-AL-Aazam.
· Dr. Sanaa Ismail, chef de laboratoire à
l'hôpital Zahraa.
· DR. Joud Haydar, chef de laboratoire à
l'hôpital RHUH.
Résumé
La septicémie est la présence des microorganismes
viables dans le sang détecté en réalisant des
hémocultures positives avec association des signes
généraux (fièvre, parfois hypothermie, tachycardie,
altération de l'état général) ; la
septicémie s'aggrave en choc septique, causé par la
présence de quantités massives de bactéries dans le
courant sanguin. Le choc septique est un syndrome qui consiste en une chute de
la tension artérielle, en une altération de la coagulation, et en
une atteinte des systèmes organiques, dont les reins, le foie et les
poumons.
Ainsi dans notre étude nous avons étudié une
évaluation de la fréquence des différentes
bactéries causant la septicémie bactériennes dans le grand
Beyrouth et leurs types de résistances.
L'analyse a été faite sur 4574 hémocultures
positives dans le département de bactériologie de 4
hôpitaux de Beyrouth durant 2 années consécutives 2005 et
2006.
Les bactéries les plus rencontrées durant notre
étude sont E.coli, Staphylocoque aureus, Staphylocoque
coagulase négative, Klebsiella pneumoniae.
L'étude des résistances des souches
bactériennes isolées à l'antibiotique a montré des
résultats compatibles entre les différents hôpitaux suivant
la même période étudiée.
· Augmentation d'E. coli (BLSE).
· Augmentation de Klebsiella pneumoniae (BLSE).
· Diminution de Staphylococcus aureus
résistant à la méticilline.
Les conclusions :
1. Toute hémoculture positive ne correspond pas à
une septicemie à cause de la présence des contaminations.
2. Le pourcentage de Klebsiella pneumoniae (BLSE)
augmente rapidement beaucoup plus qu'E.coli (BLSE) d'une année à
l'autre.
Introduction
La septicémie est la présence des
microorganismes viables dans le sang. Une infection bénigne se produit
fréquemment (par exemple un abcès dentaire, une
gastro-entérite, le virus de la grippe) et le système immunitaire
peut facilement la combattre et l'éliminer. Néanmoins, lors d'une
infection plus sévère, le système immunitaire peut se
trouver dans l'incapacité de gérer cette invasion de
micro-organismes. Le système de réponse immunitaire réagit
de façon excessive et incontrôlée à l'infection pour
devenir totalement inopérant.
Il apparaît aussi qu'au cours d'une septicémie
des interactions inflammatoires, coagulatrices et fibrinolyses
débouchent sur la mort du patient.
Le sepsis peut être
défini comme la réponse inflammatoire systémique à
l'infection.
Le choc septique représente la forme la plus grave de
cette réponse inflammatoire, sa traduction clinique est
représentée par un état infectieux grave associant des
dysfonctions d'organes à une défaillance circulatoire ne
répondant pas au remplissage vasculaire et nécessitant
l'utilisation de drogues vasoactives. Le pronostic vital du patient est souvent
engagé et il s'agit d'une urgence thérapeutique.
La distinction faite entre syndrome infectieux
sévère et choc septique a pour but de définir des groupes
homogènes de maladies. Il existe pourtant une continuité
évidente entre ces deux états. Il est donc nécessaire de
traiter précocement ces maladies afin d'éviter le passage au
stade le plus grave.
TITRE DU MÉMOIRE:
Evaluation de la fréquence des différentes
bactéries causant les septicémies bactériennes dans le
grand Beyrouth.
1. Problématique:
· La septicémie bactérienne a t- elle
évolué au cours des années ?
· Est ce que le traitement avec des antibiotiques fait
augmenter ou bien diminuer le taux des souches multi
résistantes ?
· Quels sont les bactéries causant une
septicémie évoluant vers une souche multi résistantes
rapidement ?
· Est ce que toute bactérie présente dans
le sang correspond à une septicémie ?
2. Hypothèses :
· Le taux de l'infection des bactéries
résistantes à l'antibiotique est en perpétuelle
évolution.
· E. coli devient de plus en plus résistante d'une
année à l'autre.
3. Outil de recherche :
L'outil utilisé dans cette étude est basé
sur une analyse du contenu des dossiers médicaux des patients.
4. Difficultés rencontrés :
· Refus de certains hôpitaux de nous accueillir ou
d'avoir accès aux dossiers médicaux des patients ou des
informations pour établir des statistiques concernant le foyer septique
et les organes les plus touchés par l'infection ainsi que le type de
traitement.
· Manque dans certains hôpitaux d'information
concernant le type de résistances et le nombre total des patients et le
foyer septique.
· Absence de disponibilités des résultats
d'hémocultures de l'année (2005-2006) dans certains
hôpitaux.
· L'absence d'utilisation des traitements en
émergence dans tous les hôpitaux au Liban.
5. Différents chapitres du
mémoire :
Ce mémoire est constitué de deux
chapitres :
· Chapitre 1 : Partie
théorique, regroupe toute les informations collectés concernant
la septicémie, les portes d'entrées, l'évolution vers le
choc septique, les manifestations cliniques, le diagnostic ainsi que leurs
traitements.
· Chapitre 2 : Etude statistique
faite sur un ensemble de 4 hôpitaux de la grande ville de Beyrouth ayant
le but de confirmer les hypothèses proposées avec une analyse des
résultats et une discussion générale pour tirer une
conclusion.
1. Définitions et baromètre de
gravité
Il est important de distinguer entre BACTERIEMIE, SEPTICEMIE
GRAVE, et CHOC SEPTIQUE
Une septicémie se caractérise par des
décharges importantes et répétées dans le sang, de
germes pathogènes et de leurs poisons qui créent une infection
générale grave accompagnée de poussées
fébrile1(*),
provenant d'un foyer (zone où se trouve une concentration importante de
bactéries pathogènes), et qui conduit à un
dysfonctionnement d'organe, à des signes d'hypoperfusion ou à une
hypotension.
L'hypoperfusion se caractérise par une acidose
lactique, une oligurie, des altérations de la conscience.
La bactériémie consiste à un passage bref
et transitoire d'une faible quantité d'agents infectieux dans le sang,
avec l'absence des signes généraux c'est à dire sans
aucune manifestation clinique ou fièvre passagère et la
possibilité d'une métastase infectieuse isolée, restant
toujours localisée. Il en est de même pour la virémie ou la
parasitémie.
Le choc septique est le résultat d'interactions
complexes entre cellules, cytokines et cascades humorales. Cette cascade
d'événements est initiée aussi bien par des
bactéries à gram positif ou des éléments fungiques
que par l'endotoxine contenue dans les bactéries à gram
négatif. La mortalité reste élevée dans les chocs
septiques.
2. Les principales portes d'entrée
Les bactéries passent dans le sang à partir d'un
ou de plusieurs sites infectieux .Les principaux foyers infectieux (aussi
appelées portes d'entrée) sont le plus souvent :
* Pulmonaires.
* Urinaires.
* Digestives et biliaires.
* Cutanées. .
* Cardiaque.
* Utérin (génitales).
* Dentaires.
* Méningée.
* Chirurgicales, d'origine traumatique.
Les principales portes d'entrée d'un choc septique par
ordre décroissant sont les origines pulmonaire, hépato-digestive,
urinaire, cathéter, cutanée et méningée.
Les infections à l'origine des états septiques
graves peuvent être très diverses, qu'elles soient communautaires
ou liées aux soins, mais sont néanmoins largement
dominées par les infections respiratoires, puis
intra-abdominales, suivies loin derrière par les infections urinaires,
de la peau et des tissus mous et, chez les malades déjà
hospitalisés, les infections intra-vasculaires.
Ce sont donc ces sources d'infection qui doivent être
recherchées en priorité. D'autres infections à l'origine
d'états septiques graves sont moins fréquentes, et de diagnostic
plus ou moins aisé : méningites, endocardites, infections
ostéo-articulaires ...
3. Physiopathologie
La Physiopathologie de la septicémie diffère
dans le cas d'un choc septique.
A. Dans le cas d'une septicémie:
A.1. Pulmonaire :
a. Facteurs Favorisants: Splénectomie.
Alcoolisme.
Sujet âgé.
Intubation trachéale.
b. Germes probables: Peumocoques.
Haemophilus influenzae.
Entérobactéries.
Klebsiella pneumoniae.
Proteus, E.coli.
A.2. Urinaire :
a. Facteurs Favorisants: Obstacles sur les voies.
Sonde vésicale à demeure.
Instrumentation.
b. Germes Probables:
Entérobactéries.
E. coli.
Pseudomonas species.
Entérocoques.
A.3. Abdomino-pelvienne :
3.1. Tube Digestif et Voies biliaires :
a. Facteurs Favorisants: Tumeur digestive.
Sigmoúdite, Appendicite2(*).
Infection biliaire.
Toxico-infection-alimentaire.
b. Germes Probables: Entérobactéries.
Entérocoques.
Les Anaérobies.
Clostridium.
Staphylocoque aureus.
3.2. Origine pelvienne:
a. Facteurs Favorisants: Multiplicité des
partenaires
Stérilet
IVG (Interruption volontaire de la grossesse).
Exploration endo-pleurale
b. Germes probables: Gonocoque
Anaérobies
Entérobactéries
Streptocoque B + Pluri-microbien
A.4. Cutané :
a. Facteurs Favorisants: Blessure.
Panaris.
Infection sur matériel étranger
(Aiguille=Toxicomanie).
Cathéter veineux.
Brûlure.
b. Germes Probables: Staph epidermidis, S.aureus
Streptocoques
A.5. Cardiaque :
a. Facteurs favorisants: Valves artificielles.
Perfusion intraveineuse.
Stimulateur.
b. Germes Probables: Bacille pyocyanique.
Klebsiella pneumonia et Klebsiella
oxytoca.
A.6. Utérin :
a. Facteurs Favorisants : Avortement.
Curetage3(*).
b. Germes Probables : Klebsiella.
E.coli.
A.7. Dentaire :
a. Facteurs favorisants: Infection dentaire non
traitée.
b. Germes Probables: Cocci Gram (+) (Streptocoque A et
D).
B. Dans le cas d'un choc septique:
La gravité de l'infection
est le fait d'un déséquilibre entre un agent causal et la
réponse immuno-inflammatoire de l'hôte infecté. La survenue
du choc septique résulte de l'invasion de l'organisme par des agents
infectieux (bactérie à gram négatif et à gram
positif, champignons, virus) suivie d'une activation des nombreux
systèmes cellulaires (macrophages, leucocytes, plaquettes, cellules
endothéliales...) et humoraux (complément, coagulation,
protéases). Il est bien évident que les capacités de
l'agresseur à dépasser les systèmes de lutte
anti-infectieuse sont fonction du nombre et de la virulence de cet agresseur
mais aussi des défenses immunitaires de l'hôte.
L'activation cellulaire et la libération des
médiateurs pro-inflammatoires, sont responsables d'altérations
cellulaires et microcirculatoires qui vont s'étendre au système
vasculaire et entraîner:
1- Une augmentation de la
perméabilité capillaire ce qui aboutit à une augmentation
du flux liquidien et protidique du secteur vasculaire au secteur interstitiel,
ce qui est responsable du syndrome oedémateux ; par ailleurs il y a
des anomalies de l'utilisation de l'oxygène au niveau
périphérique.
2- Une défaillance cardio-circulatoire
qui associe une hypovolémie absolue à une hypovolémie
relative par vaso-dilatation périphérique donc
une atteinte myocardique aiguë précoce est souvent présente
avant l'apparition du choc et est réversible à la guérison
de l'infection. Cette altération myocardique est globale. Elle se
traduit par une diminution voire un effondrement de la fonction
d'éjection ventriculaire.IL existe alors des facteurs sériques
dépresseurs myocardiques qui sont libérés. Ce sont les
cytokines: TNF (tumor necrosis facteur), IL1, 2, 6(interleukine 1, 2, 6), qui
sont des molécules de la cascade de l'inflammation. Ces cytokines
diminuent directement la contractilité des myocytes cardiaques.
L'élément prédominant reste cependant la
vasoplégie artérielle et veineuse qui conditionnera le traitement
symptomatique initial.
3- Une modification de la régulation de
la perfusion de chaque organe à l'origine d'une mal-distribution des
débits sanguins régionaux entraînant une diminution de la
perfusion tissulaire, une altération de la micro-circulation et
l'apparition de dysfonctions d'organes et cela entraine des conséquences
sur les systèmes suivants:
3.1. Le système pulmonaire:
Quelques heures après l'agression initiale, il y a une
nécrose des cellules épithéliales alvéolaires
laissant l'interstitium en communication directe avec l'espace
alvéolaire. Il y a donc formation d'un exsudat dans l'espace
alvéolaire qui constitue l'oedème pulmonaire aigu (OAP).
Si l'agression disparaît, il se produit une phase de
réparation avec formation d'un infiltrat mononucléé. Un
rétablissement structurel et fonctionnel est observé chez la
plupart des patients. Dans les autres cas, il se constitue une fibrose
pulmonaire rapidement extensive.
3.2. Le système hépatique:
Le foie a un rôle cytoprotecteur central dans le
système de défense de l'organisme contre les agents infectieux.
IL faut différencier deux stades dans la dysfonction
hépatique:
Primaire: L
'hypoperfusion microvasculaire hépatique est responsable d'une
ischémie hépatique aiguë. Elle est réversible en
l'absence de pathologie hépatique préexistante si le choc
disparaît.
Secondaire: Même si
l'infection est apparemment guérie une défaillance
hépatique peut survenir dans le cadre du syndrome de défaillance
multiviscérale. L'endotoxine et les médiateurs inflammatoires
participent aux lésions endothéliales et parenchymateuses.
3.3. Le système digestif :
L'atteinte digestive est dominée par des lésions
hémorragiques et nécrotiques des muqueuses digestives. Cela
provoque une aggravation de l'hypovolémie par transsudation4(*) plasmatique ou
hémorragique. L'intestin est précocement le siège
d'anomalies de l'extraction de l'oxygène et présente donc des
stigmates d'hypoxie localisée de la muqueuse même si la perfusion
intestinale globale est satisfaisante. Il en résulte une érosion
de la muqueuse qui entraîne une perméabilisation de
l'endothélium et des phénomènes de translocation
bactérienne. Ce processus aggrave, entretient le syndrome de
défaillance multiviscérale. D'où l'intérêt de
monitorer le pH intra-muqueux gastrique ou rectal.
3.4. Le système nerveux central :
L'atteinte cérébrale est souvent précoce
avec encéphalopathie, troubles de la conscience et confusion.
3.5. Le rein :
L'hypotension et les troubles de la microcirculation sont
source d'insuffisance rénale.
4- Une activation de la coagulation
conduisant à une coagulation intravasculaire disséminée
(CIVD). Cette CIVD est fréquente, d'intensité variable
corrélée à la survenue d'un syndrome de défaillance
multi-viscérale et à la mortalité.
De ce fait deux phases se succèdent
généralement dans un choc septique :
· L'une hyperkinétique pendant laquelle
l'augmentation du débit cardiaque arrive à compenser la baisse
des résistances vasculaires.
· L'autre hypokinétique correspondant à la
chute du débit cardiaque, consécutive à l'action
négative des médiateurs libérés par
l'inflammation.
4. Les Manifestations cliniques
A. Signes généraux, non
spécifique
Les Signes généraux graves engendrés sont
le résultat de multiples embolies microbiennes, de l'action des toxines
microbiennes et des effets nocifs des produits de désintégration
cellulaire.
· Fièvre élevée qui correspond
à la présence des bactéries en grand nombre dans le
sang.
· Chute de la tension artérielle (de 40 mm Hg).
· Teint grisâtre.
· Extrémités froides.
· Tachycardie.
· Signes traduisant un trouble de la coagulation sanguine
(purpura : petites hémorragies apparaissant au niveau de la peau sous
forme de taches violacées).
· Frissons5(*), Asthénie6(*).
· Malaise Splénomégalie.
· Difficultés à respirer.
B. Signes cliniques en rapport avec le foyer
initial
Sont généralement le motif de
consultation :
- Urinaire = pyélonéphrite
- Biliaire = angiocholite, cholécystite
- Pulmonaire = pneumopathie
- Abdominale = péritonite, abcès
- Endocarde = souffle (+ signes
périphériques).
C. Les Manifestations cliniques du choc septique
C.1. À la phase précoce :
1. Une défaillance circulatoire aiguë
associée à un foyer infectieux.
2. Une tachycardie.
3. Une hypotension artérielle.
4. Des marbrures cutanées par vasoconstriction
cutanée.
5. Une polypnée signant une acidose
métabolique.
6. Une encéphalopathie septique (agitation, confusion,
troubles de conscience pouvant parfois conduire à un coma profond).
7. Une oligoanurie7(*) (confirmé par sondage vésical).
8. Hyperbilirubinémie, Hyperglycémie, Hypo
albuminémie, Thrombopénie,
9. Augmentation des D-dimères, Hyperleucocytose.
10. Augmentation de la concentration du cortisol, du glucagon
et de l'hormone de croissance et ce proportionnellement à la
gravité du sepsis.
11. Un hypercatabolisme azoté
L'adrénaline augmente la glycémie, la
glycogénolyse et inhibe la sécrétion d'insuline. Elle
augmente aussi la synthèse du glucagon.
En pratique, les dysfonctions circulatoire, respiratoire,
rénale et l'encéphalopathie sont initialement au premier plan,
les autres altérations biologiques (coagulation, et surtout
hépatique) étant d'apparition plus tardive, en l'absence de
choc d'emblée patent8(*).
C.2. Évolution
Malgré l'augmentation du débit cardiaque il y
a augmentation des troubles de la microcirculation et atteinte tissulaire: La
diurèse s'effondre, l'acide lactique augmente, il y a stase capillaire,
la déplétion intravasculaire s'intensifie et la dysfonction
cardiaque s'installe.
La fréquence cardiaque augmente, la tension
artérielle est basse, les extrémités sont froides et
cyanoses (coloration bleue ou noirâtre de la peau). Le patient est
polypnéique.
En fait les tableaux sont multiples intriqués en
fonction de la gravité mais aussi du terrain sous jacent sur lequel
survient le sepsis.
5. Diagnostic biologique
Les signes biologiques spécifiques d'atteinte d'organe
ne sont guère utiles à l'orientation diagnostique (sauf
peut-être ceux témoignant d'une infection hépato-biliaire),
de même que les examens non spécifiques : Procalcitonine
(PCT),... qui ne font que conforter l'impression générale d'un
état infectieux plus ou moins grave, ou témoigner de son
retentissement général.
Il est bien rare qu'en cas de syndrome septique grave ou
imminent9(*), un (ou
plusieurs) foyer infectieux ne soit pas suspecté cliniquement.
L'imagerie (échographie, tomodensitométrie)
dirigée par l'examen clinique et les symptômes donne le plus
souvent une orientation diagnostique.
Le laboratoire intervient dans le diagnostic
étiologique des septicémies la recherche du foyer, le choix d'un
traitement et la surveillance de son efficacité.
La lenteur dans le rendu d'un résultat est un handicap
majeur quant à l'efficacité du laboratoire.
Compte tenu de l'urgence il est nécessaire de:
· confronter la clinique à la biologie,
· communiquer rapidement les résultats même
partiels,
· choisir des méthodes de travail donnant des
résultats le plus rapidement possible.
A. Recherche de causes favorisantes :
- Toutes causes d'immunodépression:
maligne, et/ou iatrogène, splénectomie.
- Toxicomanie intraveineuse, alcoolisme.
- Hépatopathie.
- Matériel étranger et/ou
prothétique.
- Agranulocytose.
- Chimiothérapie,
corticothérapie.
B. Rechercher une Porte d'entrée:
La recherche du foyer infectieux et de la porte
d'entrée est obligatoire pour arrêter l'infection. IL faudra faire
une étude bactériologique ou cytobactériologique de tout
matériel étranger enlevé, de tous les
prélèvements effectués pour la recherche du foyer et des
portes d'entrée possibles.
- En faveur de S.aureus:
cathéter veineux, Panaris, infection sur matériel
Étranger...
- En faveur d'un bacille Gram négatif:
bandelette urinaire +, cholécystite. ...
- En faveur d'un
Bartonella.fragilis: infection sous mésocolique.
C. Les Hémocultures:
Pour faire une étude bactériologique convenable
au cours d'une septicémie, il faut prendre en considération
plusieurs points :
· Le sang est normalement stérile. Toute
bactérie est pathogène.
· Le nombre de bactéries dans le sang est souvent
faible .C'est pourquoi l'examen direct est inutile (pas assez sensible), et la
quantité de sang prélevée doit être assez
importante, un volume de 20 ml de sang prélevé augmente le
pourcentage de positivité de 30%, comparativement à un volume de
10 ml qui est le minimum souhaitable chez l'adulte. De la même
façon l'augmentation du volume de sang inoculé dans les flacons
augmente la sensibilité de la détection de la positivité
par un «automate ».
· Le sang contient des substances qui vont inhiber la
culture de la bactérie (cellules phagocytaires, Anticorps...). Pour
diminuer leur pouvoir, il est nécessaire de diluer le sang dans une
grande quantité de milieu de culture. La dilution du sang dans le
bouillon atténue l'effet de ces substances. La dilution au 1/10 est
celle qui donne le meilleur résultat. Cependant une dilution
inférieure, jusqu'à 1/5, est encore possible .Quant à une
dilution supérieure à 1/10, elle est sans inconvénients
sinon de réduire la quantité de sang inoculé. Au total,
plus grand est le volume de bouillon dans le flacon, meilleur est l'effet de
dilution.
· Au cours de la septicémie, la présence de
la bactérie dans le sang n'est pas constante. Il faut donc
réaliser plusieurs hémocultures et prélever lors des
épisodes bactériémiques (Fièvre et
Frissons).
C.1. Prélèvements:
Effectués devant « Toute
Fièvre » d'aspect infectieux,
avant toute antibiothérapie et au moment d'un
« Pic Fébrile » entre 2 et 6
hémocultures en 4-12 heures.
20 ml de sang sont prélevés après une
antisepsie soigneuse de la peau.
Eviter agitation et courant d'air; se laver les mains au savon
puis de les désinfecter à l'alcool à 70°;
désinfecter la peau du malade avec un antiseptique iodé; ne plus
toucher la peau à l'endroit de la ponction ; et désinfecter
les bouchons de caoutchouc des flacons avec de l'alcool iodé.
. Les milieux de cultures:
Les milieux de culture peuvent être liquides (Bouillon
trypticase soja= aérobie ; Bouillon thioglycolate=
anaérobie) ou biphasique(Flacon de Castaneda), permettant la culture de
la plupart des bactéries rencontrées en pathologie humaine et
contiennent un anticoagulant comme Le polyanéthol
sulfonâtes de sodium (SPS) qui est très
généralement utilisé dans les bouillons
pour hémoculture à une concentration de 0,025
à 0,05 %. Le SPS favorise la croissance de la plupart
des bactéries car il inhibe l'activité
bactéricide du sérum, il inhibe la phagocytose,
il inactive le complément, neutralise le lysozyme et
les antibiotiques de la famille des aminosides.
Néanmoins, le SPS peut avoir un effet inhibiteur
sur certaines souches de Neisseria, de
Peptostreptococcus anaerobius ou de
Streptobacillus moniliformis. Il est donc
préférable d'utiliser une concentration de 0,025
% de SPS.
L'addition de gélatine à la concentration de 1,2
% peut neutraliser l'effet inhibiteur du SPS. Ils sont préparés
sous pression atmosphérique réduite et contiennent 10 de
CO2 .L'oxygène de l'air est ajouté
stérilement au moment du prélèvement dans le milieu
destiné à l'aérobiose.
Des résines adsorbeuses de cations ou le charbon actif
ont un certain effet neutralisant des antibiotiques.
* Intérêt du flacon anaérobie
remis en question devant la baisse de fréquence des
bactéries anaérobies mais:
· Nécessaire dans les services de chirurgie
digestive ou gynécologique.
· Développement plus rapide de Streptococcus
spp (saprophyticus) et Enterococcus saprophyticus
· Permet de doubler le volume de sang mis en culture.
*Intérêt du milieu Castaneda:
IL associe un milieu solide et un milieu liquide.
· Une association de peptone, de caséine et de
gélatine permet un apport varié d'acide amine.
· L'extrait de levure apporte des facteurs vitaminiques
ainsi que les précurseurs des acides nucléiques (purines et
pyrimidines).
· Le NAD (Nicotinamide adénine
dinucléotide) et l'hémine permettent le développement des
Haemophilus et ont été décrits comme favorisant
la croissance d'un certain nombre d'autres germes tells que les
Actinobacillus et les Cardiobacterium.
· La vitamine B6 intervient comme
élément indispensable dans le développement des
streptocoques dits déficients rencontrés dans les
endocardites et certains staphylocoques.
· La phase gazeuse contient du CO2 qui est un
élément important pour la croissance des Neisseria,
Brucella, Haemophilus, Pneumocoque.
· La phase gélosée renferme des
polysaccharides d'hemisynthèse ce qui évite une surcharge en agar
et donne une gélose plus transparente.
C.2. Détection de la croissance
bactérienne :
a. Par incubation dans un automate :
?
5 jours suffisent pour les systèmes
automatisés:
· majorité des agents pathogènes, mis en
évidence en 2 jours.
· au-delà de 5 jours, croissance essentiellement
de contaminants.
Les principales caractéristiques des
automates:
- Pas de maintenance quotidienne.
- Détection automatique des positifs.
- Détection des flacons pré-incubés.
- Gestion des données.
- Connexion bidirectionnelle possible10(*).
- Statistiques et sauvegarde.
- Télémaintenance possible.
BacT/Alert
Le Principe est d'incorporer dans chaque flacon un
détecteur colorimétrique «CO2 sensor" de
coloration verte. Le sensor est séparé du bouillon par une
membrane semi-perméable qui ne laisse passer que le CO2. La
production du CO2 entraîne une diminution du pH et le sensor
devient jaune. Le virage de couleur est interprété par
réflectométrie, chaque lecture compare la variation de couleur
à la précédente, chaque flacon dispose de sa propre
cellule de lecture.
. Par incubation dans un étuve :
Les hémocultures sont placées à
37°C. Elles sont incubées 15 à 20 jours, examinés
chaque jour ou mieux deux fois par jour et systématiquement
subcultivées. (Chaque 2j).
Cet examen est macroscopique, il est possible en fonction de
l'aspect d'un flacon de pressentir l'identité de la bactérie en
cause:
|
Signe observé
|
Turbidité
|
Hémolyse
|
Production de gaz
|
Coagulum
|
|
Bactéries en cause
|
Bacille à gram négatif aérobie,
Staphylocoque, Bactéroides
|
Streptocoque Staphylocoque
Listeria
Clostridium
Bacillus
|
Bacilles à gram négatif aérobies
anaérobies
|
Staph aureus
|
Chaque flacon suspect fera l'objet d'un examen microscopique,
et d'une subculture en aérobiose et anaérobiose.
Les résultats doivent être transportés
immédiatement au clinicien en précisant le nombre
d'hémocultures positives, aérobiose ou anaérobiose, la
morphologie et le Gram de la bactérie. Ce qui permettra d'instaurer un
traitement antibiotique.
L'identification de la bactérie isolée et
l'antibiogramme seront rendus au bout de 24-48 heures, car il y a des
bactéries qui poussent lentement comme Clostridium perfringens.
REMARQUE : Pour la
réalisation de la coloration Gram et la détermination de
l'antibiotique convenable (grâce à l'antibiogramme), les
bactéries doivent être cultivés sur divers
milieux pour satisfaire les besoins nutritifs et
énergétiques des bactéries à cultiver
(Physiologie-Croissance). En pratique, on utilisés plusieurs milieux
solides (gélosés) avec une technique particulière
d'ensemencement (isolement orthogonal ou en cadran) permettant l'isolement de
clones bactériens sous la forme de colonies (de l'ordre de
106 bactéries).
C.3. Amélioration de la précocité et
de la sensibilité de la détection de la croissance
bactérienne :
· La centrifugation-lyse : le système
Isolator :
Ce système permet de recueillir 8 à 10 ml de
sang et de concentrer les micro-organismes avant d'ensemencer les milieux
gélosés adaptés à la croissance de ces
micro-organismes. La solution présente dans le tube contient de la
saponine pour lyser les leucocytes et les érythrocytes, du
polypropylène glycol pour éviter la formation de mousse due
à la saponine et du SPS comme anticoagulant.
Après centrifugation du tube dans un rotor à
angle fixe de 35° pendant 30 minutes à 3 000 tours/min, le
surnageant est éliminé et le concentré est
homogénéisé au vortex puis ensemencé sur
différents milieux gélosés appropriés. Isolator
(1,5) est le même système sans étape de centrifugation.
Pratiqué avec des tubes de 1,5 ml, il est utilisable en
pédiatrie.
Le système Isolator est très performant pour
l'isolement des micro-organismes suivants: mycobactéries, levures
à croissance difficile et champignons filamenteux, bactéries
exigeantes (Bartonella, Legionella).
Le système Isolator permet en outre de quantifier la
bactériémie, ce qui serait utile pour mettre en évidence
une infection sur cathéter. Ce système a cependant quelques
inconvénients. Le risque de contamination lors des manipulations oblige
à travailler sous hotte, mais surtout c'est une méthode manuelle
très consommatrice du temps du manipulateur, ce qui est un facteur
limitant.
· L'aération des flacons aérobies avec un
dispositif adapté favorise la croissance des Pseudomonas.
· L'agitation des flacons aérobies pendant les
premières 24 heures d'incubation accélère la croissance
bactérienne, mais elle est difficile à mettre en pratique si l'on
ne dispose pas d'un automate.
· Les systèmes diphasiques permettent la
croissance précoce de colonies sur le milieu gélosé. Ceci
est intéressant pour les espèces bactériennes à
croissance délicate.
C.4. Réaliser les
hémocultures :
Devant un tableau clinique évoquant une
septicémie, les hémocultures sont prélevées en
quelques heures. Mais les délais de réponses se situent entre 1
et 20 jours (environ 48 heures, si le prélèvement est fait au bon
moment).Ces délais sont beaucoup trop lents et en général
un traitement de premier intention est institué.
* Respect des précautions standard,
avec friction hydro alcoolique des mains.
* Trois hémoculture au moins, lors
des frissons ou à l'accès fébrile.
* Désinfection large et
prolongée de la peau, ponction d'une veine non perfusée.
* Prévenir le laboratoire en cas de
suspicion d'endocardite ou de brucellose.
C.5. Interprétation des
hémocultures :
a. Plusieurs hémocultures positives:
- Diagnostic étiologique certain.
- Si bactéries différentes:
terrain particulier (cirrhose, dysimmunité, foyer polymicrobien) foyer
digestif ou cutané. Les problèmes d'interprétation et de
traitement sont réglés quand le foyer est localisé.
b. Une seule hémoculture positive :
L'interprétation est de démontrer que la
bactérie est ou non une contamination.
- S'il s'agit d'une bactérie au
pouvoir pathogène incontestable, elle peut être
considéré comme responsable.
- Souillure probable si la bactérie
de la flore cutanée normale (Staphylocoque à coagulase
négative, Propionibacterium acnes,
Corynébactérie...), mais prendre en compte si
matériel étranger, toxicomanie, neutropénie et le
même germe devra être découvert au niveau du foyer
infectieux ou de la porte d'entrée pour être considérer
comme responsable.
- Bactériémie
post-chirurgicale peut être évoquée.
c. Hémocultures négatives:
Plusieurs hypothèses à évoquer:
- Absence d'une cause infectieuse à
une fièvre, à condition que les hémocultures aient
été correctement prélevées.
- Hémocultures négatives
(antibiothérapie récente).
- Bactéries à croissance
lente ou nécessitant des milieux spéciaux.
- Bactéries intra cellulaires ne se
cultivant pas (diagnostic sérologique ou PCR).
- Foyer infectieux ne relargant pas de
bactérie viable dans le sang.
- Volume de sang prélevé non
suffisant.
d. Si les hémocultures sont négatives
après 3 jours d'incubation.IL est recommandés de faire les
examens sérologiques suivants:
-Chlamidia psittaci, C.pneumoniae,
C.trachomatis.
-Brucella.
-Legionella.
-Mycoplasma pneumaniae.
-Bartonella (ex-Rochalemea).
-Candida (voire selon le contexte
Aspergillus,Histoplasma,penicillium...)
Pour la détection des anticorps vis à vis de
Candida ou Aspergillus, il est recommandé d'utiliser deux techniques
utilisant des principes différents: une technique de
précipitation (éléctrosynérèse,
immuno-éléctrophorèse) et une technique de type IF ou
ELISA.
Par ailleurs, la détection d'antigène circulant
par méthode immunologique est réalisée par certains
laboratoires.
-Coxiella burnetii : concernant
cette sérologie, il est nécessaire de déterminer par
immunofluorescence les titres des anticorps contre les antigènes de
phase I et de phase II. En cas d'endocardite de la fièvre Q, le taux
d'anticorps contre l'antigène de phase I est supérieur à
800 en IgG.
D. La CRP pour confirmer si les hémocultures
sont faussement positives ou faussement négatives :
La CRP est une
protéine qui permet de diagnostiquer et de suivre l'évolution des
phénomènes inflammatoires aigus. Elle est
synthétisée par les hépatocytes, puis
libérée dans la circulation 6 à 48 heures après une
stimulation par des cytokines. Lorsque l'inflammation résulte d'une
infection bactérienne, l'élévation de la CRP est un
indicateur reconnu, bien que peu sensible précocement et très peu
spécifique pour les valeurs basses. La spécificité
augmente lorsque la CRP atteint des valeurs très élevées.
Nous avons voulu voir dans quelle mesure ce test pouvait contribuer à
établir la signification clinique d'une hémoculture positive.
Pour une valeur de CRP
>200 mg/l, la sensibilité du test est faible (23%) mais la
spécificité bonne (94%) avec une valeur prédictive
positive de 95%. Par conséquent, la présence d'une
hémoculture positive et d'une CRP >200 mg/l rend la
probabilité d'une contamination faible. Pour des valeurs <200 mg/l,
la spécificité diminue et la sensibilité augmente.
Il existe de nombreuses
données contradictoires concernant l'utilité de la CRP pour
identifier les patients bactériémiques avec ou sans
hémocultures positives et plus particulièrement chez le
nouveau-né, le patient de soins intensifs et chez le
neutropénique.
Selon une étude
récente effectuée chez des patients de soins intensifs, la CRP
possède une sensibilité de 98,5% (spécificité 75%)
pour une valeur seuil de 50 mg/l chez les malades ayant une clinique suggestive
de sepsis, avec ou sans hémoculture positive. Dans une autre
étude menée dans une population de patients hospitalisés
avec un diagnostic de leucémie aiguë et ayant eu une ou plusieurs
hémocultures positives pour un staphylocoque coagulase-négative,
l'augmentation de la CRP dans les 24 heures suivant la première
hémoculture positive était significativement plus
élevée pour les épisodes de bactériémies que
pour les contaminations.
La CRP est un outil
complémentaire à la clinique, relativement spécifique de
la présence d'une bactériémie/fongémie lorsque ses
valeurs sont très hautes et en présence d'une hémoculture
positive. Néanmoins, dans la majorité des cas son
élévation est modérée et se trouve aussi bien dans
les bactériémies/fongémies que dans les contaminations.
E. Discussion des résultats:
Toute hémoculture positive n'est pas
nécessairement la conséquence d'une septicémie.
1ère
éventualité: Contamination par de germe commensaux ou de
l'air.
Ex: Staphylococcus aureus, germes
commensaux (Staph.epidermidis),
Bacillus (contamination de
l'air).
2ème
éventualité: La culture est celle d'un germe
pathogène, reconnu comme agent de septicémies.
Ex: Listeria monocytogenes, Streptococcus
pyogenes, salmonella typhii, Brucella.
3ème
éventualité: La culture obtenue est celle de
germes qui peuvent être soit agents de septicémie soit de
bactériémies (entérobactérie par ex) alors il est
indiqué de refaire une hémoculture.
4ème
éventualité: La culture obtenue est mixte, c'est le cas
soit d'une septicémie polymicrobienne (ex: Klebsiella
pneumonia et Streptococcus D) ou tout simplement d'une
contamination extérieur s'ajoutant à un germe de la
septicémie.
5ème
éventualité: La culture est négative
1. Absence réelle de bactérie dans le sang.
2. Traitement par des antibiotiques qui inhibent la culture
des germes.
3. Prise de sang faite après la période
septicémique.
4. Quantité de sang ensemencée trop forte.
5. Temps d'observation insuffisante.
Le problème de la subjectivité dans
l'interprétation d'une hémoculture positive joue certainement un
rôle dans les différences de résultats observés et
il faut ainsi relever la difficulté d'établir la signification
clinique des isolats de faible virulence. La surévaluation de
résultats positifs peut entraîner des problèmes de
santé publique et économiques, puisqu'elle conduit à la
l'utilisation excessive des antibiotiques, favorisant secondairement le
développement de résistances (par exemple, utilisation excessive
de la vancomycine lors d'hémocultures faussement positives pour un
staphylocoque coagulase-négative, avec pression de sélection sur
les entérocoques). Des critères microbiologiques
d'évaluation ont été développés pour aider
le clinicien à déterminer la signification d'une
hémoculture positive, notamment pour les staphylocoques
coagulase-négative. Par exemple : le nombre d'hémocultures
positives sur le nombre total effectué, l'analyse quantitative de la
croissance des germes (CFU/ml) et la rapidité de croissance en
culture.
Dans le cas de choc septique: l'état de
choc septique sera évoqué préférentiellement en cas
d'infection connue, de frissons, de fièvre ou d'hypothermie. Son
diagnostic impose l'élimination des autres causes d'état de choc
(cardiogénique, anaphylactique, hypovolémique).
Tout
état de choc, ne faisant pas la preuve immédiate de son
étiologie, doit être considéré dans un premier temps
comme un possible choc septique.
Une recherche minutieuse de la source de l'infection est
fondamentale. Il faut pratiquer des hémocultures et
prélever toutes les voies d'abord veineuses.
En cas de choc inexpliqué, on recherchera toujours un
foyer pulmonaire par la réalisation d'un cliché thoracique
(pneumopathie, syndrome de détresse respiratoire aiguë SDRA), une
infection urinaire en pratiquant une bandelette urinaire et une ECBU. Il faut
compléter le bilan par un scanner cérébral (sinusite,
abcès cérébral) et par un scanner abdominal.
Les investigations ne doivent pas retarder le traitement
symptomatique du choc et la mise en route d'un traitement antibiotique
empirique probabiliste.
On sera attentif à la recherche d'un foyer infectieux
profond vésiculaire, abdominal ou urinaire en réalisant une
échographie abdominale. Au moindre doute, une ponction lombaire sera
réalisée et il faudra rechercher de manière
systématique des lésions cutanées de purpura.
6. Recommandation de pratique: Conduite à tenir
devant un choc septique:
1. Mettre en place, sans délai, une voie d'abord
vasculaire de bon calibre et démarrer un remplissage
vasculaire par des bolus de cristalloides (500 ml/15 min), en
évaluant la réponse hémodynamique à celui-ci (index
cliniques de remplissage vasculaire, mesure de la PVC, lactatémie,
diurèse).
2. Prélever sans délai des
hémocultures rapprochées (2 dans l'heure), et
obtenir les autres prélèvements à visée
microbiologique guidés par l'examen clinique.
3. Administrer des antibiotiques sans délai
(au maximum dans les 3 heures1), adaptés à
l'origine présumée du foyer infectieux, à
l'épidémiologie générale et locale, et aux risques
spécifiques au malade, en tenant compte du résultat
d'éventuels examens directs de prélèvements.
4. Compléter si nécessaire, les examens
biologiques (fonction rénale, glycémie, hématologie et
coagulation) et obtenir un dosage de lactatémie s'il
n'est déjà disponible, pour préciser les
caractéristiques et le retentissement fonctionnel du syndrome
septique.
5. Instaurer une surveillance rapprochée des
fonctions vitales (pression artérielle, diurèse,
lactatémies).
6. Demander sans délai un avis
spécialisé au réanimateur pour
évaluer le malade sur place et organiser la suite de la prise en
charge et son transfert en réanimation, en tenant
compte des aspects éthiques.
7. L'absence de réponse satisfaisante au remplissage
vasculaire au-delà de 60 minutes (= choc septique) impose le
transfert rapide dans une structure de réanimation,
après avoir mis en route l'ensemble des mesures thérapeutiques
précédentes, et éventuellement débuté un
traitement vasopresseur.
N.B : Un sepsis grave peut être
l'évènement terminal de l'évolution d'une maladie
sous-jacente grave, fatale à court terme. Il est important que les
médecins des urgences et les réanimateurs - avec les documents
fournis par l'entourage ou par les archives hospitalières (qui doivent
être disponibles 24h/24), et éventuellement appel du
médecin référent s'il est connu- se donnent les moyens de
décider rapidement de la prise en charge et de l'intensité des
soins adaptées au contexte.
7. Principaux résultats réalisés
en urgences:
On note:
· Une hypoxémie parfois sévère en
cas de Syndrome de Détresse Respiratoire Aiguë
· Une acidose métabolique avec un pH
inférieur à 7,38 (Normale =7.38-7.42).
· Une hyperlactatémie > 2000umol/l
(Normale : 180-550umol/l).
· Une insuffisance rénale aiguë avec une
augmentation de l'urée sanguine et de l'Uréatininémie.
· Un syndrome cytolytique et rétentionnel.
· Une CIVD due à la consommation des facteurs de
la coagulation avec un taux de prothrombine abaissé, associé
à une élévation du TCA, une diminution du taux des
plaquettes et une fibrinolyse visualisée par une augmentation des PDF ou
des D-dimères.
· Fréquemment une hyperleucocytose, parfois une
neutropénie transitoire.
Il existe souvent un syndrome inflammatoire avec augmentation
de la protéine C réactive et/ou de la Procalcitonine (PCT).
N.B: L'absence d'un syndrome inflammatoire
n'élimine pas l'origine infectieuse d'un état de choc.
8. Les examens paracliniques:
Les examens paracliniques permettront surtout
d'apprécier le retentissement du choc et l'efficacité du
traitement, de dépister les complications (défaillance d'organes)
et de confirmer les hypothèses diagnostiques.
L'examen comprend:
1. Gaz du sang : acidose métabolique avec
hyperlactatémie (>2mmol/L).
2. Ionogrammes sanguin et urinaire: insuffisance rénale
fonctionnelle ou organique (nécrose tubulaire).
3. Numeration-formule sanguine+plaquettes: anémie
(hémorragie, hémolyse), hyperleucocytose, neutropénie ou
thrombopénie.
4. TP-INR, TCA (temps de céphaline active),
fibrinogène: recherché d'une CIVD.
5. Enzymes cardiaques (CPK, Myoglobine, Troponine)
6. Dosage de la CRP et prélèvement
bactériologiques.
7. ECG systématiques.
9. Les conséquences surrénaliennes et
vasculaires du choc septique:
Le choc septique peut avoir schématiquement trois
conséquences surrénaliennes :
1-Une insuffisance surrénale (IS) absolue, rare chez
l'adulte mais probablement plus fréquente dans le purpura fulminant de
l'enfant.
2-Une réponse surrénalienne adaptée avec
cortisolémie basale élevée et augmentant après
injection d'ACTH (test au synacthène), témoin de l'existence
d'une réserve sécrétoire.
3- Une insuffisance surrénale «relative
«associant une cortisolémie de base normale ou élevée
mais avec une absence d'augmentation après stimulation par l'ACTH. Son
incidence est très variable (6 à 75 %) en fonction des seuils
utilisés. L'incapacité à produire du cortisol en
réponse à l'ACTH serait un critère de gravité,
particulièrement chez les patients ayant une cortisolémie de base
déjà très élevée.
En pratique, on recommande un dosage systématique de
la cortisolémie avant le début du traitement glucocorticoïde
(GC), pour détecter les rares IS absolues. En l'absence de valeur seuil
validée dans la littérature, chez des patients en choc septique,
on propose de retenir le seuil de cortisolémie de base à 10
ug/dl, soit environ 275 nmol/L, pour le diagnostic d'IS absolue.
Le test à l'ACTH permet de détecter l'origine
haute ou basse d'un hypocortisolisme. Il permet l'identification des patients
non répondeurs à haut risque de décès lorsque la
cortisolémie de base est haute. Néanmoins, on ne recommande pas
la réalisation systématique de ce test car la réponse
normale n'est pas clairement définie au cours du choc septique et son
résultat n'influence pas la conduite thérapeutique.
En cas d'urgence absolue (ex : purpura fulminant), le
traitement par les GC peut être débuté sans dosage
préalable de la cortisolémie.
Au cours du choc septique, la réponse vasculaire aux
catécholamines endogènes est diminuée alors que leur
concentration sérique est très élevée. Plusieurs
mécanismes peuvent participer à l'hypotension artérielle :
désensibilisation du récepteur bêta et probablement alpha,
production de monoxyde d'azote et hyperperméabilité
capillaire.
Les GC peuvent expérimentalement augmenter le nombre
d'adréno-récepteurs alpha ou bêta et restaurer leur
sensibilité aux catécholamines.
Au cours du choc septique,
l'amélioration hémodynamique induite par les GC implique
plutôt un effet vasculaire qu'une modulation de la réponse
inflammatoire. Néanmoins, les données de la littérature ne
permettent pas d'analyser la part respective de la composante vasculaire et/ou
anti-inflammatoire dans l'efficacité des GC.
10. Traitement
A. Traitement de la septicémie
A.1. Principes du traitement :
Le traitement est choisi en fonction de la gravité des
signes cliniques, du germe suspecté, de la diffusion de l'antibiotique
bactéricides. IL est entrepris 4 à 8 heures après la
constatation des signes cliniques.
Il est institué par une antibiothérapie à
large spectre en attente des résultats de l'antibiogramme,
L'antibiothérapie sera ensuite adaptée au germe en cause, suivant
son type et son degré de résistance évalué à
l'antibiogramme.
L'antibiotique sera administré initialement par voie
parentérale et relais oral vers le 5ème jour si
possible sans diminuer l'efficacité.
La monothérapie est la règle, sauf signes de
gravité, ou pour certaines bactéries (P.aeruginosa,
Enterococcus species, Staph Méti R) souvent une bithérapie,
associé à un traitement symptomatique (antipyrétiques si
hyperthermie ++, rééquilibrage hydroélectrolytique...).
On recherche aussi un traitement local de la porte
d'entrée.
A.2. Suivi du traitement :
- Surveillance clinique:
température, fréquence cardiaque et respiratoire, PA,
diurèse examen physique.
- Efficacité du traitement:
· Clinique: courbe thermique, état
général, porte d'entrée, localisations secondaires.
· biologique : hémogramme, CRP et VS
- En cas de persistance de la
fièvre:
· répéter les hémocultures.
· vérification de la porte d'entrée,
recherche de nouvelles localisations secondaires.
· rechercher une complication iatrogène.
· Vérification de l'adéquation de
l'antibiothérapie (CMI et CMB).
CMI : (concentration minimale inhibitrice)
C'est la plus petite concentration d'antibiotique qui inhibe toute culture
visible d'une souche bactérienne après 18 heures de culture
à 37°c. Cette valeur caractérise l'effet
bactériostatique d'un antibiotique.
Plusieurs méthodes permettent de réaliser cette
détermination en milieu liquide ou en milieu gélosé.
La technique de l'E Test est une
méthode simple d'utilisation. en milieu gélosé qui se
prête à des déterminations unitaires: elle utilise des
bandelettes (commercialisées sous le nom E Test) avec un gradient
exponentiel continu d'antibiotique sur une face et une échelle de
lecture de concentration sur l'autre face.
CMB: C'est la plus petite concentration
d'antibiotique laissant 0, 01% ou moins de survivants de l'inoculum initial
après 18 heures de culture à 37°C. Cette valeur
caractérise l'effet bactéricide d'un
antibiotique. Différentes techniques dérivent de ces deux
mesures; le laboratoire de bactériologie effectuera ces techniques en
fonction des différentes étapes de l'analyse
bactériologique.
Antibiotique bactériostatique: CMB/CMI= tend
vers l'infini.
Antibiotique bactéricide:
CMB/CMI=1-2.
A.3. En cas d'échec de traitement :
· Faire des hémocultures pour isoler le germe.
· Pratiquer un pouvoir bactéricide du
sérum.
a- Hémoculture en cours de traitement, positive
et pouvoir bactéricide du sérum
>1/8
· Foyer non atteint par le traitement.
· Bactérie défective.
· Inoculum sanguin élevé.
· Hôte immunodéprimé.
b- Hémoculture en cours de traitement
positive et pouvoir bactéricide du sérum
<1/8
· Posologie incorrecte.
· Incompatibilité médicamenteuse (2
médicaments qui ont des effets antagonistes).
c-Hémoculture en cours de traitement
négative et pouvoir bactéricide du sérum
>1/8
· Fièvre non infectieuse.
· Bactérie défective difficilement
cultivable.
· Hôte immunodéprimé.
d- Hémoculture en cours de traitement
négative et pouvoir bactéricide du sérum
<1/8
· Pouvoir bactéricide du sérum ou
hémocultures pratiqués aux mauvais moments.
B. Principes thérapeutiques du choc septique
Le traitement du choc septique repose sur 3 points
essentielles:
- Un traitement anti-infectieux précoce et
adapté.
- La recherche d'un foyer infectieux nécessitant un
geste chirurgical ou l'ablation d'un matériel invasive.
- Un traitement symptomatique de la défaillance
cardio-circulatoire (remplissage vasculaire, utilisation de
catécholamines) et des autres dysfonctions.
B.1. Traitement anti-infection:
L'antibiothérapie sera débutée
après réalisation des prélèvements
bactériologiques (2 ou 3 hémocultures sont
réalisées à une heure d'intervalle, ECBU,
prélèvement d'une Porte d'entrée).
Le traitement de l'infection reste fondamental et
nécessitera parfois un drainage ou une intervention chirurgicale afin de
diminuer l'inoculum bactérien, il s'agira le plus souvent d'une double
antibiothérapie par voie intraveineuse à large spectre, ayant une
activité bactéricide.
Afin d'optimiser ce traitement, il
conviendra tout particulièrement d'analyser les éléments
suivants:
1- Identifier la porte d'entrée, rechercher un
matériel invasif et préciser l'existence d'une
antibiothérapie préalable ou d'un hospitalisme antérieur.
2- Caractériser l'origine nosocomiale ou non de l'infection,
3-
Préciser le terrain sous-jacent sur lequel survient l'infection
:
* Patient neutropénique
(polynucléaires < 500/mm3).
*
Immunodépression (chimiothérapie, patient greffé,
corticothérapie au long cours).
*
SIDA, toxicomanie intraveineuse.
* Patient
asplénique.
* Situations
particulières: diabète, éthylisme chronique et cirrhose.
a. Le traitement antibiotique
En l'absence de foyer infectieux évident, le traitement
comportera le plus souvent une association d'antibiotiques avec une
céphalosporine de 3ème génération et un aminoside
afin d'élargir le spectre et d'être rapidement bactéricide.
Dans un deuxième temps l'identification de l'agent pathogène et
ensuite de son antibiogramme doivent faire reconsidérer et modifier
l'antibiothérapie instituée de première intention. Il est
très important de resserrer le spectre thérapeutique. Il faut
tenir compte aussi d'une éventuelle antibiothérapie
préalable. Il faut tenir compte des pathologies associées et
notamment d'une insuffisance rénale ou hépatique.
Les données cliniques permettent
généralement de guider les prélèvements
locaux des sites accessibles, en complément des
hémocultures systématiques
prélevées d'emblée, en demandant chaque fois que possible
un examen direct par Gram, qui orientera le traitement
antibiotique.
Une fois cette démarche rapidement effectuée,
le choix des antibiotiques et la décision
d'administration peut être prise (dans les 3 heures de
l'admission ou du diagnostic), tandis que le traitement
symptomatique (remplissage vasculaire) est poursuivi.
Le choix du traitement antibiotique est fonction du
mode d'acquisition de l'infection (communautaire ou lié
aux soins), du foyer infectieux présumé et de
l'épidémiologie générale et
éventuellement locale (notamment pour les infections
hospitalières) associée à ce type d'infection, et de la
pharmacodynamie des molécules utilisées et des
risques d'intolérance prévisibles. Les doses
prescrites doivent être maximales d'emblée,
parentérales, souvent avec une dose de charge initiale,
en particulier pour les béta-lactamines (voir le tableau).
En l'absence d'orientation étiologique initiale devant
un état septique grave, on débutera un traitement
empirique par une association définie localement (le plus
souvent une béta-lactamine à large spectre active sur les
staphylocoques, les streptocoques et les entérobactéries dans les
infections communautaires, ou une céphalosporine active sur le
pyocyanique dans les infections nosocomiales, en association avec un
aminoside).
Dans tous les cas, le traitement doit être
réévalué dès réception des
premiers résultats microbiologiques (qu'ils soient positifs ou
négatifs) et, de manière systématique, 48 heures
après le début du traitement.
Tableau d'administration initiale des antibiotiques au cours des
états septiques graves et les posologies proposées chez
l'adulte :
|
Familles
|
Antibiotiques
|
Posologie de la première injection
|
Mode d'administration
|
|
Bêtalactamines
|
amoxicilline
|
2 g
|
ivl
|
|
Amoxicilline +
Ac. Clavulanique
|
2 g
|
ivl
|
|
oxacilline
|
1 g
|
ivl
|
|
ticarcilline
|
5 g
|
ivl
|
|
pipéracilline
|
4 g
|
ivl
|
|
Pipéracilline +
tazobactam
|
4 g
|
ivl
|
|
C3G
|
céfotaxime
|
2 g
|
ivl
|
|
céftriaxone
|
2 g
|
ivl
|
|
Ceftazidime*
|
2 g
|
ivl
|
|
céfépime
|
2 g
|
ivl
|
|
Carbapenem
|
imipénème
|
1 g
|
ivl
|
|
Aminosides
|
gentamicine
|
5 mg/kg
|
perfusion 30 min
|
|
amikacine
|
20 mg/kg
|
perfusion 30 min
|
|
tobramycine*
|
5 mg/kg
|
perfusion 30 min
|
|
Glycopeptides
|
vancomycine
|
15 mg/kg
|
perfusion 1 h.
|
|
Fluoroquinolones
|
ofloxacine
|
400mg
|
ivl
|
|
ciprofloxacine
|
400 mg (800 mg *)
|
ivl
|
|
Macrolides
|
érythromycine
|
1 g
|
ivl
|
|
spiramycine
|
3 MU
|
ivl
|
|
Nitroimidazolés
|
métronidazole
|
500 mg
|
perfusion 30 min
|
Ivl = Intraveineux lent; * Si suspicion de Pseudomonas
aeruginosa.
B.2. Le traitement de la porte d'entrée.
Il sera essentiel de rechercher d'emblée la porte
d'entrée qui conditionnera la qualité du traitement antibiotique
et l'ablation éventuelle d'un matériel invasif.
L'éradication du foyer infectieux afin de diminuer
l'inoculum bactérien est primordiale. Bien souvent les antibiotiques ne
peuvent pas pénétrer dans le foyer. Il doit être
précoce et il est souvent chirurgical.IL faut aussi rechercher
d'éventuelles métastases septiques.
B.3. Traitement symptomatique:
Le traitement initial symptomatique comporte le remplissage
vasculaire. Celui-ci doit être réalisé sur une voie
veineuse périphérique de bon calibre sur une période
d'environ 30mn. Le choix du produit de remplissage repose sur l'utilisation de
colloïdes surtout de type hydroxyéthylamidon (HEA) bien que le
débat reste ouvert entre les cristalloïdes et les
macromolécules.
En cas d'absence de réponse au remplissage vasculaire
(2 fois 500cc de macromolécules), il sera nécessaire d'utiliser
une drogue vasoactive, vasoconstrictive comme la dopamine
noradrénaline....
a. Le traitement de l'insuffisance circulatoire.
1) Restauration d'un volume circulant
adéquat
Elle permet:
· D'augmenter le débit cardiaque.
· D'optimiser le transfert en oxygène.
· D'améliorer les débits
régionaux.
Les critères de correction sont:
· Une réduction de la tachycardie.
· Une normalisation de la tension artérielle.
· Une disparition des signes de vasoconstriction
cutanée.
· Une reprise d'une diurèse satisfaisante.
Il est nécessaire de mettre en place un monitorage
adéquat par PVC (premature ventricular contraction),
échocardiographie, sonde de Swan Ganz et cathéter artériel
afin d'assurer le meilleur débit cardiaque en minimisant le risque
d'oedème pulmonaire car compte tenu de l'altération de la
perméabilité capillaire ce dernier risque est majeur.
2) Emploi des catécholamines:
IL est bien entendu qu'il n'existe pas de règles
précises d'utilisation des catécholamines. Les patients devant
bénéficier des catécholamines sont ceux qui à un
niveau de remplissage jugé satisfaisant ont des signes cliniques
d'incompétence circulatoire ou ceux qui ont une mauvaise
tolérance au remplissage.
Dans un contexte de contractilité myocardique
effondrée sans baisse importante des RAS (résistance
artérielle systémique) on introduit une catécholamine
à effet inotrope positif comme la dobutamine ou mieux la dopamine.
Dans un contexte de vasoplégie sans atteinte importante
de la contractilité myocardique on préfère la
noradrénaline.
Dans un contexte mixte on se sert de dopamine à forte
dose soit d'adrénaline ou mieux encore de l'association dobutamine
à noradrénaline. La détermination d'une balance
adéquate entre l'augmentation des RAS et le maintien du débit
cardiaque doit permettre de déterminer individuellement les doses
optimales.
N.B: L'utilisation de plus de deux
catécholamines n'est pas justifiée sur le plan pharmacologique.
3) Optimisation de la ventilation:
Maintien d'une oxygénation tissulaire adaptée
aux besoins.
Par oxygénothérapie nasale dans un premier temps
mais le plus souvent il faut intuber le patient pour mettre en route une
ventilation mécanique qui est un des éléments majeurs du
maintien d'une oxygénothérapie satisfaisante. Elle
améliore les échanges gazeux, diminue la post-charge du
ventricule gauche et diminue le travail des muscles respiratoires.
4) Optimisation de la répartition du
débit cardiaque :
Les critères d'efficacité manquent pour
évaluer le résultat des thérapeutiques. Certes la reprise
d'une diurèse, la restauration d'un état circulatoire
satisfaisant, la disparition des troubles neurologiques sont de bons indices.
Mais rien ne permet d'apprécier la perfusion intestinale et le risque
d'ischémie de la muqueuse qui conduit à la translocation
bactérienne.
La surveillance du taux de lactates artériels permet
d'estimer l'insuffisance circulatoire et le métabolisme anaérobie
qui en découle. Les résultats de la mesure séquentielle du
taux des lactates présentent un intérêt pour évaluer
l'efficacité des thérapeutiques en cours en termes d'hypoxie
cellulaire. Mais il s'agit d'index global qui ne fournit pas de renseignement
sur les différentes circulations régionales.
5) Les thérapeutiques
adjuvantes :
5.1. La correction des troubles métaboliques
La correction d'une éventuelle acidose est discutable.
La fonction cardiaque n'apparaît déprimée que pour des pH
inférieurs à 7,2.
5.2. L'hémofiltration
Elle réduit l'inflation hydrosodée. Elle
élimine de la circulation un certain nombre de toxines
bactériennes et de médiateurs responsables du choc.
5.3. Les corticostéroïdes
Ils sont très controversés. Plusieurs
études sont en cours. De petites doses pourraient être
efficaces.
11. Les indications et les modalités
d'administration de la corticothérapie lors du choc septique
La corticothérapie doit être envisagée
chez les patients présentant un choc septique de gravité
particulière car nécessitant des doses élevées
et/ou croissantes d'agents vaso-actifs du fait de la persistance d'une
hypotension malgré un remplissage vasculaire jugé
satisfaisant.
Avant la corticothérapie, il faut s'assurer du
caractère approprié de l'antibiothérapie et de l'absence
d'indication chirurgicale visant à éradiquer un foyer infectieux.
Le traitement peut être alors instauré. Il peut l'être aussi
plusieurs jours après l'installation du choc.
L'hémisuccinate d'hydrocortisone à la posologie
de 200 à 300 mg/j, en perfusion continue ou répartis en 3 ou 4
injections intraveineuses, est administré après avoir
effectué un prélèvement pour un dosage de cortisol. Des
interactions médicamenteuses (inducteurs enzymatiques ou substrats du
cytochrome P3A4) peuvent modifier le taux sanguin de l'hydrocortisone.
Chez l'enfant, une posologie de 100 mg/m2/j répartis en
4 injections toutes les 6 heures s'impose dès que possible dans le
purpura fulminant.
La durée du traitement est de 5 jours au minimum
lorsque une réponse clinique est observée. La disparition des
signes de choc autorise une réduction progressive de la
corticothérapie et son arrêt, à l'exclusion des
exceptionnels cas d'insuffisances surrénales (IS) absolue.
La réponse clinique à la corticothérapie
est appréciée sur l'évolution hémodynamique :
augmentation de la pression artérielle, stabilisation des besoins en
agents vaso-actifs ou début de leur sevrage. Cette réponse peut
s'observer dans les heures qui suivent le début de la
corticothérapie ou plus tardivement. Toutefois, au-delà de 72
heures, l'absence de réponse hémodynamique justifie l'arrêt
du traitement.
La glycémie, la natrémie et la kaliémie
doivent être surveillées. Au cours du traitement, la modification
des signes systémiques d'inflammation induite par les GC peut masquer
une surinfection.
12. Les bénéfices attendus et les risques
de la corticothérapie lors du choc septique
Dans le choc septique, seul l'utilisation de faibles doses
d'hydrocortisone est bénéfique. Le principal effet attendu est
une diminution de la mortalité. Il existe une amélioration de la
défaillance hémodynamique qui se traduit par une diminution de la
fréquence cardiaque, une augmentation des résistances
artérielles systémiques et de la pression artérielle
moyenne permettant le sevrage plus rapide des amines vasoactives.
A doses cumulatives élevées, la
corticothérapie augmente le risque infectieux. Au cours du SDRA, la
recherche d'une infection systémique ou d'un foyer infectieux, en
particulier pulmonaire doit donc précéder systématiquement
la corticothérapie.
En cas d'infection bactérienne, il est
nécessaire de prescrire un traitement antibiotique adapté, au
moins trois jours avant de débuter les GC. La corticothérapie
peut atténuer une hyperthermie éventuelle ; en cours de
traitement, l'absence de fièvre ne permet pas d'éliminer une
infection, en particulier pulmonaire.
Les faibles doses cumulatives d'hydrocortisone
recommandées dans le choc septique ne semblent pas entraîner de
risque infectieux supplémentaire.
Les GC entraînant une intolérance glucidique,
particulièrement chez l'enfant, la surveillance de la glycémie
est nécessaire. Le risque d'hémorragie digestive ne semble pas
accru bien que les données prospectives soient insuffisantes.
Le
risque de neuromyopathie apparaît pour des doses cumulatives de GC
supérieures à 1000-1500 mg de méthylprednisolone (MP), le
plus souvent associées aux curares.
13. Mode d'action des catécholamines et de leurs
associations
Les catécholamines sont des agonistes des
récepteurs membranaires du système adrénergique. Dans le
système cardio-vasculaire, trois types de récepteurs sont
impliqués: les récepteurs alpha, béta et dopaminergiques
(DA). Les catécholamines stimulent de façon plus ou moins
préférentielle un ou plusieurs de ces types de
récepteurs.
A. La régulation des récepteurs
adrénergiques
Il existe une régulation du nombre des
récepteurs adrénergiques fonctionnels. La diminution de la
réponse, appelée désensibilisation, survient lors d'une
stimulation importante et/ou prolongée par les catécholamines et
concerne plus particulièrement les récepteurs béta. Elle
implique une phosphorylation, une internalisation et enfin une diminution du
nombre des récepteurs.
Dans le choc septique, on observe une stimulation sympathique
qui aboutit à une désensibilisation des récepteurs
béta-1 et à une stimulation de la synthèse du monoxyde
d'azote qui contrecarre les effets de la stimulation alpha-1.
B. Effets cardio-vasculaires des catécholamines
utilisées dans le choc infectieux
1) La dopamine augmente la pression
artérielle par ses effets conjoints d'augmentation du débit
cardiaque et des résistances vasculaires.
2) La noradrénaline augmente la
pression artérielle principalement par augmentation des
résistances vasculaires
3) L'adrénaline à des doses de
0.05 à 0.5 mg/kg/min, augmente la pression artérielle
principalement par augmentation du débit cardiaque. A ces doses, les
résistances vasculaires ne sont pas affectées et la
fréquence cardiaque tend à augmenter. A des doses de 0.5 à
1 mg/kg/min, la pression artérielle augmente par effet conjoint
d'augmentation du débit cardiaque et des résistances
systémiques, et la fréquence cardiaque reste stable.
4) La dobutamine augmente le débit
cardiaque sans affecter la pression artérielle. La fréquence
reste stable et les résistances vasculaires tendent à baisser.
5) La phényléphrine augmente la
pression artérielle principalement augmentation des résistances
vasculaires. Le débit cardiaque et la fréquence peuvent
augmenter.
C. Effets indésirables des
catécholamines
1) Toutes les catécholamines sont arythmogènes ;
Cet effet secondaire est dépendant de la dose administrée et du
terrain sous-jacent. L'imprévisibilité des doses susceptibles
d'entraîner de tels effets nécessite une surveillance très
attentive. L'augmentation de la consommation d'oxygène myocardique
expose le patient coronarien à un risque d'ischémie
surajouté.
2) Syndrome de sevrage: le début du sevrage en
catécholamines devrait se faire quand le patient est guéri de son
insuffisance circulatoire, c'est à dire après au moins 12
à 24 heures de stabilité hémodynamique. La décision
d'arrêt s'appuie avant tout sur les signes cliniques et une exploration
hémodynamique invasive n'est le plus souvent pas nécessaire.
Modalités du sevrage : L'expérience clinique et
les caractéristiques pharmacologiques des catécholamines imposent
un sevrage progressif. La rapidité du sevrage dépend de la
durée du traitement catécholaminergique, source d'une
désensibilisation des récepteurs
béta-adrénergiques. Il semble raisonnable de respecter un
intervalle minimal de 30 minutes entre chaque palier pour juger de la
stabilité hémodynamique. La vitesse de décroissance repose
sur la tolérance clinique.
3) Un échec de sevrage: en cas d'association de
plusieurs catécholamines, il est difficile de conseiller l'arrêt
prioritaire d'une des drogues. L'arrêt d'une drogue à effet alpha
á avant une drogue à effet béta â pourrait se
justifier par l'absence de désensibilisation démontrée des
récepteurs alpha á. C'est l'état hémodynamique
apprécié par l'examen clinique qui guide ce choix. Une
insuffisance cardiaque sévère peut nécessiter une
exploration hémodynamique complémentaire (échographie,
cathétérisme droit), afin d'éviter un échec du
sevrage.
L'échec du sevrage en catécholamines doit faire
rechercher la persistance d'un foyer infectieux, d'une insuffisance cardiaque
ou d'une hypovolémie. L'absence d'une de ces causes suggère un
sevrage trop rapide.
14. Les traitements en émergence
A. Traitement en émergence en cas de
septicémie Grave Protéine C activée:
Les protéines S et C sont des protéines normales
de l'organisme qui ont un rôle anticoagulant et s'opposent ainsi à
des phénomènes de coagulation.
La protéine C est une protéine vitamine K
dépendante synthétisée dans le foie qui circule sous
forme inactive de même que la protéine S. Elle est activée
par la thrombine lorsque cette dernière est liée à une
protéine de la cellule endothéliale = La thrombomoduline.
La protéine C activée exerce son activité
anticoagulant par catalisation de la protéolyse des facteurs Va et VIII
a.
Les protéines S et C sont des protéines
normales de l'organisme qui ont un rôle anticoagulant et s'opposent ainsi
à des phénomènes de coagulation.
Un déficit en protéine S ou en protéine C
peut entraîner des phénomènes de thrombose
artérielle ou veineuse (phlébite11(*)). Un déficit en protéine S ou en
protéine C entraîne habituellement des thromboses
récidivantes et touche plusieurs membres d'une même famille.
A.1. Définition et Produit de traitement:
Une réaction inflammatoire systémique et la
coagulation résultant de la septicémie, peuvent avoir
d'énormes répercussions sur les systèmes organiques et
entraîner un dysfonctionnement myocardique, une insuffisance
rénale aiguë ou le poumon de choc.
L'alpha drotrécogine (activée) est une
protéine C activée recombinante humaine (PCArh) dont
l'utilisation dans le traitement de la septicémie grave chez l'adulte
à risque élevé de mortalité est autorisée
aux États-Unis. L'alphadrotrécogine (activée)
complémente le traitement courant et
entraîne des coûts supplémentaires.
A.2. Les sujets sélectionnés pour le
traitement par PCArh:
IL est important de sélectionner minutieusement les
patients à qui l'on destine le traitement par l'alpha
drotrécogine activée (XigrisMC).
Le médicament peut être nocif chez certaines
personnes, notamment celles à risque élevé de saignement,
en état d'hypercoagulabilité ou prenant des médicaments
qui augmentent le risque de saignement (Aspirine, Ximelagtran,
Danaparoúde, Bivaluridine).
A.3. Mode d'action de PCArh:
La plupart des personnes atteintes de septicémie grave
sont caractérisées par une déficience acquise en
protéine C. La présence de ce déficit accroît la
morbidité et la mortalité liée à l'affection.
La protéine C participe à la régulation
des processus de l'inflammation et de la coagulation qui interviennent dans la
septicémie grave. La protéine C activée (PCA) inhibe les
cofacteurs Va et VIII a, éléments essentiels de la cascade de la
coagulation, et, par là, empêche la formation de caillots. La PCA
peut également réduire l'inflammation en inhibant les cytokines
et stimuler la fibrinolyse en contrant l'inhibiteur des activateurs du
plasminogène, puissant inhibiteur du processus de fibrinolyse. L'alpha
drotrécogine (activée) est une forme recombinante de la PCA
humaine.
A.4. Administration et taux d'utilisation :
La posologie recommandée de l'alpha Drotrécogine
(activée) est de 24 ìg/kg/h pendant 96 heures en administration
intraveineuse. Le produit se présente en flacons de 5 mg et de 20 mg.
L'adoption de cette technologie variera sans doute d'un établissement
à un autre, par suite de la prise en considération des aspects
budgétaires et des préférences des médecins.
A.5. Activité dans le domaine:
De nouvelles modalités thérapeutiques
visent à contrer les effets des endotoxines (ex : les
Immunoglobulines), des cytokines (ex : le facteur de nécrose des
tumeurs, l'interleukine-1), de systèmes biologiques (ex : la
coagulation), de médiateurs (ex : le facteur d'activation des
plaquettes) ou d'autres éléments. Jusqu'à tout
récemment, on n'a cru que l'antithrombine III et la tifacogine
produisaient des effets bénéfiques dans le traitement de la
septicémie. Mais, des essais cliniques portant sur les deux
médicaments n'ont pu démontrer d'influence sur la
mortalité à 28 jours toutes causes confondues.
B. Traitement en émergence du choc septique:
[Traitement du choc septique par l'anticorps monoclonal]:
B.1. Des résultats précliniques très
encourageants dans le domaine du choc septique
Gand (Belgique), le 6 mai 2003 - Innogenetics
annonce des résultats très prometteurs de son anticorps
monoclonal anti-inflammatoire (INNO 202), développé pour le
traitement des chocs septiques, au terme d'essais précliniques. Au vu de
ces données, Innogenetics envisage de procéder prochainement au
lancement d'essais humains.
La septicémie est une condition
clinique fréquente et souvent fatale qui s'est répandue au cours
des 20 dernières années, notamment au sein des centres de soins
intensifs pour représenter à ce jour l'une des 10
premières causes de décès dans les pays
développés. Selon des études récentes, ce
phénomène représenterait un coût annuel
supérieur à 17 milliards de dollars aux Etats-Unis. Malgré
les progrès dans le domaine des thérapies et des soins, cette
condition reste une cause majeure de maladie et de mortalité,
nécessitant de nouvelles réponses plus efficaces.
B.2. Une approche innovante dans le traitement de la
septicémie
Après plusieurs conclusions
encourageantes découlant des tests préliminaires, suivis du
développement d'un anticorps monoclonal anti-inflammatoire
humanisé, nommé INNO 202, Innogenetics s'est engagé dans
un test préclinique décisif sur un modèle animal qui a
été mis au point par des experts américains et
européens et qui est très pertinent d'un point de vue
clinique.
B.3. Des résultats précliniques
positifs
Les résultats de cette étude
préclinique étaient très positifs. Les six animaux qui
n'ont pas reçu l'anticorps monoclonal, ont développé les
symptômes de septicémie sévère et sont
décédés prématurément. Par contre, sur les 8
animaux ayant reçu le traitement INNO 202, 6 ont survécu 7 jours
ou plus. Ces derniers ont été considérés par les
experts comme étant des « survivants à long terme». Le
taux de survie entre les deux groupes était significativement
différent.
Chapitre 2
Étude
Statistique
1. Méthode
C'est une étude rétrospective, sur une
période de 2 ans, des dossiers des patients ayant eu un ou plusieurs
résultats positifs d'hémoculture.
2. Matériel
A. Lieu et périodes de l'étude:
Notre étude à lieu dans les départements de
bactériologies des laboratoires des 4 hôpitaux suivants :
-AUH
-Bahman
-Rassoul
-RHUH
Nous avons revu les dossiers
des patients hospitalisés qui avaient un ou plusieurs résultats
positifs d'hémoculture aux hôpitaux déjà
cités durant une période allant :
Ø de 1 juillet 2004 à 30 juin 2006 pour l'AUH.
Ø de 1 janvier 2006 à 31 décembre 2006 pour
l'hôpital universitaire de Rafic Hariri.
Ø de 1 janvier 2005 jusqu'à 31 décembre 2006
pour les 2 hôpitaux Rassoul-al-Aazam et Bahman.
Les dossiers du Laboratoire ont étés
analysés avec l'aide d'un médecin assistant ayant de
l'expérience en médecine interne et ayant été
sensibilisée à l'analyse des hémocultures par un
spécialiste en maladies infectieuses ; ce dernier a
été consulté pour les cas difficiles.
Les hémocultures positives ont
été évaluées afin de déterminer si les
microorganismes isolés étaient pathogènes (vrais positifs)
ou contaminants (faux positifs). La classification s'est faite sur la base de
l'histoire du patient, de son statu, des résultats de laboratoires (avec
une attention particulière pour la protéine C-réactive
(CRP, en mg/l) et aux leucocytes), du nombre d'hémocultures positives
par rapport au nombre total effectué, de la rapidité de
croissance du germe en culture.
3. Etude statistique
AUH (La 1ère) période :
* Dans le premier période (1/7/04 à
30/6/2005), nous avons passé en revue les dossiers de 1495
d'hémocultures positives. 1351 microorganismes (90.4%), isolés
ont été considérés comme pathogènes, 144
microorganismes (9,6%) comme des contaminants.
Répartitions des germes à l'AUH de 1/7/04
à 30/6/2005
|
Bacille Gram positive
|
Nombre de cas
|
Pourcentage %
|
|
Staph.aureus
|
202
|
13.5
|
|
Staph coagulase negative
|
94
|
6.2
|
|
Sterptococcus pneumoniae
|
90
|
6.2
|
|
Streptocoque á-hémolitique
|
162
|
10.8
|
|
Enterococcus spp
|
40
|
2.6
|
Bacille Gram négatif
|
|
|
|
E.coli
|
270
|
18
|
|
Klebsiella pneumoniae
|
210
|
14.4
|
|
Acinetobacter baumanii
|
40
|
2.6
|
|
Pseudomonas aeruginosa
|
95
|
6.3
|
|
Salmonella spp
|
67
|
4.48
|
|
Salmonella typhii
|
81
|
5.4
|
|
Contaminations
|
144
|
9.6
|
Hémocultures positive 1495
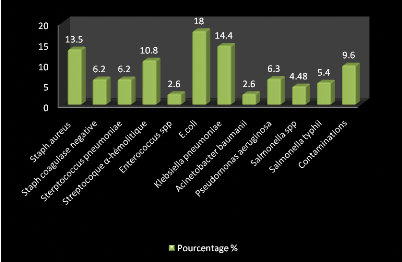
*Dans la deuxième période
(1/7/05 à 30/6/2006), nous avons passé en revue les dossiers
de 1625 d'hémocultures positives. 1314 microorganismes (90.4%),
isolés ont été considérés comme
pathogènes, 311 microorganismes (19.6%) comme des contaminants.
|
Bacille Gram positive
|
Nombre de cas
|
Pourcentage %
|
|
Staph.aureus
|
227
|
14
|
|
Staph coagulase negative
|
125
|
7.7
|
|
Sterptococcus pneumoniae
|
117
|
7.2
|
|
Streptocoque á-hémolitique
|
91
|
5.6
|
|
Enterococcus spp
|
65
|
4
|
|
Bacille Gram négatif
|
|
|
|
E.coli
|
273
|
16.8
|
|
Klebsiella pneumoniae
|
143
|
8.8
|
|
Acinetobacter baumanii
|
65
|
4
|
|
Pseudomonas aeruginosa
|
104
|
6.4
|
|
Salmonella spp
|
52
|
3.2
|
|
Salmonella typhii
|
52
|
3.2
|
|
Contaminations
|
311
|
19.1
|
Répartitions des germes à l'AUH de
1/7/05 à 30/6/2006
Hémocultures positive 1625
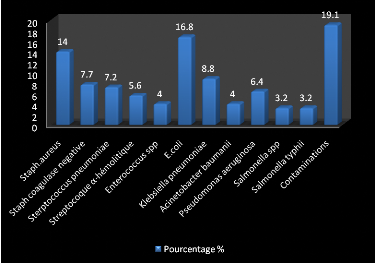
Résistance des souches bactériennes
isolées dans la première période à
l'AUH
|
Bactéries
|
Types de Resistances
|
Nombre
|
Pourcentage%
|
|
Staph.aureus (n=202)
|
SARM
|
48
|
24
|
|
Norfloxacine
|
59
|
29
|
|
Staph.CN (n=94)
|
S.Méti R
|
66
|
70
|
|
Strept.pneumonia (n=90)
|
Resist à Pénicilline
|
59
|
66
|
|
Enterococcus spp (n=40)
|
Resist à Vanco
|
0
|
0
|
|
Norfloxacine
|
12
|
29
|
|
Tétracycline
|
30
|
74
|
|
E. coli (n=270)
|
BLSE
|
25
|
9.2
|
|
Pénicilline
|
197
|
73
|
|
Céphalosporine
|
70
|
26
|
|
Kleb.pneumoniae(n=216)
|
BLSE
|
30
|
13.8
|
|
P.aeruginosa (n=95)
|
Multi résistante
|
18
|
18.9
|
|
Acineto baumanii (n=40)
|
Multi résistante
|
28
|
70
|
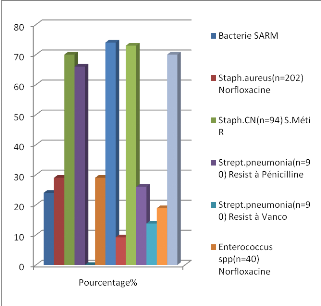
Résistance des souches bactériennes
isolées dans la deuxième période à l'AUH
Bactéries
|
Types de resistances
|
Nombre
|
Pourcentage%
|
|
Staph.aureus (n=227)
|
SARM
|
45
|
20
|
|
Norfloxacine
|
23
|
10
|
|
Staph.CN (n=125)
|
S.Méti R
|
87
|
70
|
|
Strept.pneumonia (n=117)
|
Resist à Pénicilline
|
16
|
14
|
|
Intermédiaire
|
59
|
50
|
|
Sensible
|
42
|
36
|
|
Enterococcus spp (n=65)
|
Resist à Vanco
|
0
|
0
|
|
Norfloxacine
|
20
|
30
|
|
Tétracycline
|
52
|
80
|
|
E. coli (n=273)
|
BLSE
|
41
|
15
|
|
Pénicilline
|
197
|
72
|
|
Céphalosporine
|
35
|
20
|
|
Kleb.pneumoniae(n=143)
|
BLSE
|
32
|
22
|
|
P.aeruginosa (n=104)
|
Multi résistante
|
21
|
20
|
|
Acineto baumanii (n=65)
|
multi résistante
|
49
|
75
|
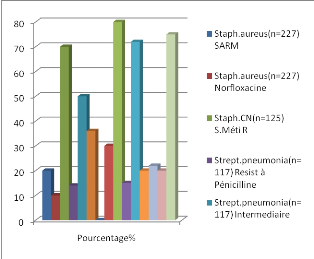
· Augmentation d'E. coli (BLSE) de 9.2% à 15%.
· Augmentation de Klebsiella pneumonia (BLSE) de 13.8%
à 22%.
· Diminution de Staphylococcus aureus (résistante
à la Méticilline) de 24 % à 20 %.
Bahman (La 1ère) période:
* Dans la première période (1/1/05 à
31/12/2005), nous avons passé en revue les dossiers de 177
d'hémocultures positives. 136 microorganismes (76.9%), isolés ont
été considérés comme pathogènes, 41
microorganismes (23.16%) comme des contaminants.
Répartitions des germes à l'Hôpital
Bahman en 2005
Bacille Gram positive
|
Nombre de cas
|
Pourcentage %
|
|
Staph.aureus
|
14
|
7.9
|
|
Staph coagulase negative
|
12
|
6.7
|
|
Sterptococcus pneumoniae
|
8
|
4.5
|
|
Streptocoque á-hémolitique
|
9
|
5.08
|
|
Enterococcus spp
|
1
|
0.56
|
Bacille Gram négatif
|
|
|
|
E.coli
|
25
|
14.1
|
|
Klebsiella pneumoniae
|
15
|
8.47
|
|
Acinetobacter spp
|
5
|
2.82
|
|
Pseudomonas aeruginosa
|
12
|
6.7
|
|
Salmonella spp
|
5
|
2.82
|
|
Salmonella typhii
|
14
|
7.9
|
|
Autres
|
16
|
9.03
|
|
Contaminations par SCN
|
41
|
23.16
|
Hémocultures positive 177
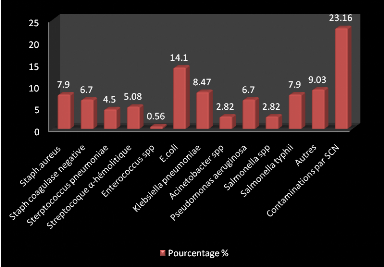
Bahman (La 2ème) période:
* Dans la deuxième période (1/1/06 à
31/12/2006), nous avons passé en revue les dossiers de 174
d'hémocultures positives. 125 microorganismes (71.84%), isolés
ont été considérés comme pathogènes, 49
microorganismes (28.16%) comme des contaminants.
Répartitions des germes à l'Hôpital
Bahman en 2006
Bacille Gram positive
|
Nombre de cas
|
Pourcentage %
|
|
Staph.aureus
|
10
|
5.74
|
|
Staph coagulase négative
|
10
|
5.74
|
|
Sterptococcus pneumoniae
|
9
|
5.17
|
|
Streptocoque á-hémolitique
|
7
|
4.02
|
|
Enterococcus spp
|
5
|
2.87
|
Bacille Gram négatif
|
|
|
|
E.coli
|
21
|
12.06
|
|
Klebsiella pneumoniae
|
11
|
6.32
|
|
Acinetobacter spp
|
4
|
2.29
|
|
Pseudomonas aeruginosa
|
8
|
4.59
|
|
Salmonella spp
|
4
|
2.29
|
|
Salmonella typhii
|
14
|
8.04
|
|
Autres
|
22
|
12.6
|
|
Contaminations par SCN
|
49
|
28.16
|
Hémocultures positive=174
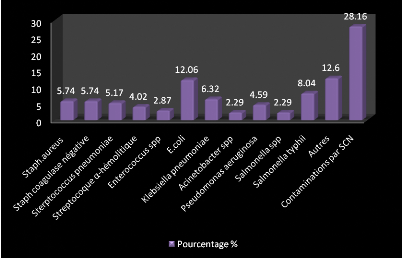
Résistance des souches bactériennes
isolées dans la première période à Bahman
Bactéries
|
Types de resistances
|
Nombre
|
Pourcentage%
|
|
Staph.aureus (n=14)
|
SARM
|
5
|
35.7
|
|
Staph.CN (n=12)
|
S.Méti R
|
7
|
58.3
|
|
Strept.pneumonia (n=8)
|
Resist à Pénicilline
|
5
|
62.5
|
|
Enterococcus spp (n=1)
|
Resist à Vanco
|
0
|
0
|
|
E.coli (n=25)
|
BLSE
|
4
|
16
|
|
Kleb.pneumoniae (n=15)
|
BLSE
|
3
|
20
|
|
P.aeruginosa (n=12)
|
Multi résistante
|
3
|
25
|
|
Acineto spp (n=5)
|
Multi résistante
|
4
|
80
|
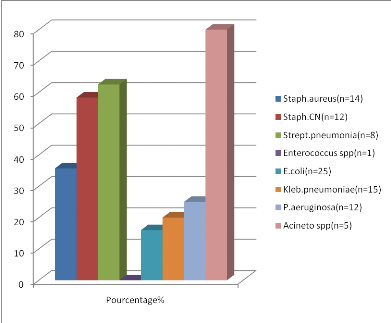
Résistance des souches bactériennes
isolées dans la deuxième période à
Bahman
Bactéries
|
Types de resistances
|
Nombre
|
Pourcentage%
|
|
Staph.aureus (n=10)
|
SARM
|
3
|
30
|
|
Staph.CN (n=10)
|
S.Méti R
|
6
|
60
|
|
Strept.pneumonia (n=9)
|
Resist à Pénicilline
|
6
|
66.6
|
|
Enterococcus spp (n=5)
|
Resist à Vanco
|
1
|
20
|
|
E.coli (n=21)
|
BLSE
|
4
|
19
|
|
Kleb.pneumoniae(n=11)
|
BLSE
|
3
|
27.8
|
|
P.aeruginosa (n=8)
|
Multi résistante
|
2
|
25
|
|
Acineto spp (n=4)
|
Multi résistante
|
4
|
100
|
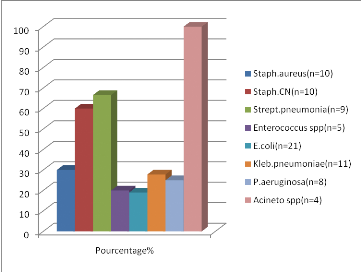
· Augmentation d'E.coli (BLSE) de 16 % à 19 %.
· Augmentation de Klebsiella pneumoniae de 20 % à
27.8 %.
· Diminution de Staphylococcus aureus (résistant
à la méticilline) de 35.7 % à 30 %.
Al Rassoul (La 1ère) période:
* Dans la première période (1/1/05 à
31/12/2005), nous avons passé en revue les dossiers de 116
d'hémocultures positives.
Répartitions des germes à l'Hôpital
Rassoul el -Aazam en 2005
Bacille Gram positive
|
Nombre de cas
|
Pourcentage %
|
|
Staph.aureus
|
15
|
13
|
|
Staph coagulase negative
|
7
|
6
|
|
Sterptococcus pneumoniae
|
7
|
6
|
|
Streptocoque á-hémolitique
|
12
|
10.3
|
|
Enterococcus spp
|
3
|
2.5
|
Bacille Gram négatif
|
|
|
|
E.coli
|
20
|
17.2
|
|
Klebsiella pneumoniae
|
16
|
13.8
|
|
Acinetobacter spp
|
3
|
2.5
|
|
Pseudomonas aeruginosa
|
7
|
6
|
|
Salmonella spp
|
5
|
4.3
|
|
Salmonella typhii
|
3
|
2.5
|
|
Autres
|
18
|
15.5
|
Hémocultures positive=116
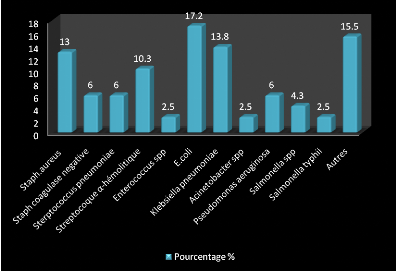
Al Rassoul (La 2ème) période:
* Dans la deuxième période (1/1/06 à
31/12/2006), nous avons passé en revue les dossiers de 98
d'hémocultures positives.
Répartitions des germes à l'Hôpital
Rassoul el -Aazam en 2006
Bacille Gram positive
|
Nombre de cas
|
Pourcentage %
|
|
Staph.aureus
|
11
|
11.22
|
|
Staph coagulase négative
|
8
|
8.1
|
|
Sterptococcus pneumoniae
|
8
|
8.1
|
|
Streptocoque á-hémolytique
|
8
|
8.1
|
|
Enterococcus spp
|
2
|
2.04
|
Bacille Gram négatif
|
|
|
|
E.coli
|
17
|
17.3
|
|
Klebsiella pneumoniae
|
12
|
12.24
|
|
Acinetobacter spp
|
4
|
4.08
|
|
Pseudomonas aeruginosa
|
5
|
5.1
|
|
Salmonella spp
|
5
|
5.1
|
|
Salmonella typhii
|
5
|
5.1
|
|
Autres
|
13
|
13.2
|
Hémocultures positive=98
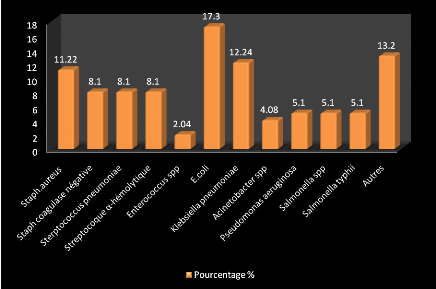
Résistance des souches bactériennes
isolées dans le premier période à
Rassoul-Al-Aazam
Bactéries
|
Types de resistances
|
Nombre
|
Pourcentage%
|
|
Staph.aureus (n=15)
|
SARM
|
4
|
26.6
|
|
Staph.CN (n=7)
|
S.Méti R
|
4
|
57
|
|
Strept.pneumonia (n=7)
|
Resist à Pénicilline
|
1
|
14.2
|
|
Enterococcus spp (n=3)
|
Resist à Vanco
|
1
|
33.33
|
|
E.coli (n=20)
|
BLSE
|
4
|
20
|
|
Kleb.pneumoniae(n=16)
|
BLSE
|
3
|
18.75
|
|
P.aeruginosa (n=7)
|
BLSE
|
2
|
22
|
|
Acineto spp (n=3)
|
BLSE
|
2
|
66.6
|
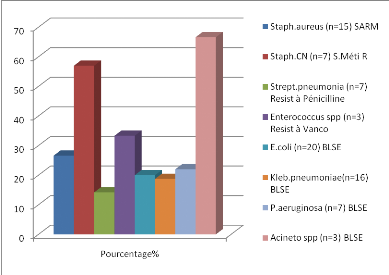
Résistance des souches bactériennes
isolées dans la deuxième période à
Rassul-Al-Aazam
Bactéries
|
Types de resistances
|
Nombre
|
Pourcentage%
|
|
Staph.aureus(n=11)
|
SARM
|
4
|
23.5
|
|
Staph.CN (n=8)
|
S.Méti R
|
3
|
27.2
|
|
Strept.pneumonia(n=8)
|
Resist à Pénicilline
|
1
|
12.5
|
|
Enterococcus spp(n=2)
|
Resist à Vanco
|
0
|
0
|
|
E.coli(n=17)
|
BLSE
|
4
|
23.5
|
|
Kleb.pneumoniae(n=12)
|
BLSE
|
3
|
25
|
|
P.aeruginosa(n=5)
|
BLSE
|
1
|
20
|
|
Acineto spp(n=4)
|
BLSE
|
3
|
75
|
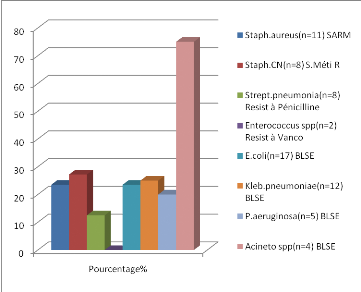
· Augmentation d'E.coli (BLSE) de 20 % à 23.5 %.
· Augmentation de Klebsiella pneumoniae de 18.75 % à
25 %.
· Diminution de Staphylococcus aureus (résistant
à la méticilline) de 26.6 % à 23.5%.
RHUH (2006):
Répartitions des germes à RHUH en
2006
|
Bacille Gram positive
|
Nombre de cas
|
Pourcentage %
|
|
Staph coagulase négative
|
228
|
36
|
|
Staph.aureus
|
57
|
9
|
|
Sterptococcus pneumoniae
|
32
|
5
|
|
Enterococcus faecalis
|
20
|
3
|
|
Stenotrophomonas maltophilia
|
13
|
2
|
Bacille Gram négatif
|
|
|
|
E.coli
|
172
|
13
|
|
Pseudomonas aeruginosa
|
93
|
7
|
|
Klebsiella pneumoniae
|
79
|
6
|
|
Salmonella typhii
|
53
|
4
|
|
Enterobacter cloacae
|
40
|
3
|
|
Salmonella spp
|
26
|
2
|
|
Acinetobacter baumanii
|
26
|
2
|
|
Autres
|
50
|
8
|
Hémocultures positives = 889 cas
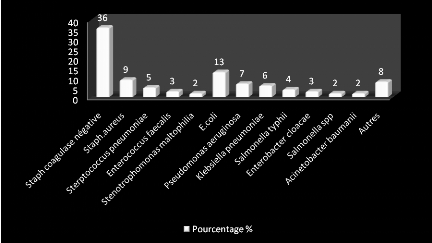
Résistance des souches bactériennes
isolé
|
Bactéries
|
Types de resistances
|
Nombre
|
Pourcentage%
|
|
Staph.aureus (n=57)
|
SARM
|
18
|
32
|
|
Norfloxacine
|
15
|
26
|
|
Phenotype naturel
|
24
|
42
|
|
Staph.CN (n=228)
|
S.Méti R
|
205
|
90
|
|
Strept.pneumonia(n=32)
|
Resist à Pénicilline
|
17
|
54
|
|
Enterococcus spp(n=20)
|
Resist à Vanco
|
0
|
0
|
|
E.coli(n=172)
|
BLSE
|
53
|
31
|
|
Penicilline
|
89
|
52
|
|
C3G
|
6
|
3
|
|
Phenotype naturel
|
24
|
14
|
|
Kleb.pneumoniae(n=79)
|
BLSE
|
28
|
35
|
|
P.aeruginosa(n=93)
|
Multi résistante
|
17
|
18
|
|
Acineto baumanii(n=26)
|
Multi résistante
|
19
|
73
|
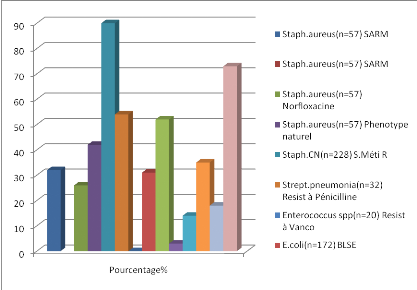
4. Discussion des résultats
Nos résultats
montrent un faible taux de contamination des hémocultures à
l'Hôpital Américain de Beyrouth. En effet 9.6% des isolats
représentent des contaminants. Plusieurs explications sont
possibles : le facteur principal réside très probablement
dans le fait que le taux de contamination est plus faible lorsque ce sont des
infirmières (c'est le cas à l'Hôpital Américain de
Beyrouth), ou une équipe spécialisée («iv team»)
qui effectuent les prélèvements, que lorsque celui-ci est fait
par des étudiants en médecine ou des médecins, comme dans
la plupart des autres hôpitaux. D'autres aspects propres à la
méthode de prélèvement ont été
étudiés et leur influence sur le taux de contamination reste
controversé : il s'agit de la modalité de ponction du sang
veineux (la ponction veineuse directe serait associée à un taux
de contamination plus faible que lorsque le prélèvement se fait
par un accès vasculaire déjà en place, de la
désinfection du capuchon de la bouteille avant l'ensemencement et du
changement de l'aiguille entre la ponction et l'ensemencement. Le
désinfectant utilisé semble jouer un rôle, avec dans la
littérature une tendance controversée de la chlorhexidine
à être associée à un taux de contamination plus
faible que le povidone-iode; cette dernière est utilisée à
l'Hôpital (AUH).
Escherichia coli
est le germe qui a été le plus fréquemment
retrouvé, suivi du staphylocoque doré et Klebsiella
pneumonia. Alors que les staphylocoques coagulase-négative
représentaient plus du deux tiers des germes considérés
comme des contaminants. En raison de leur haute prévalence, les
staphylocoques coagulase-négative restaient toutefois en
troisième position des germes responsables de
bactériémies.
Le pneumocoque, les streptocoques
ß-hémolytiques, les entérobactériacées,
Pseudomonas aeruginosa ainsi que les autres bacilles Gram
négatif non fermentatifs étaient presque toujours
pathogènes.
Les streptocoques viridans
et les entérocoques étaient pathogènes dans la plupart des
cas.
Les bactéries Gram positif ont été plus
souvent isolées et plus souvent à l'origine d'une contamination
que les bactéries Gram négatif. Le nombre
élevé de bactéries Gram positif peut notamment être
expliqué par une augmentation de la fréquence d'isolement des
staphylocoques coagulase-négative au cours de la dernière
décennie, souvent comme contaminants, mais aussi comme
pathogènes.
A l'Hôpital (AUH), les staphylocoques
coagulase-négative ont été considérés comme
des pathogènes dans 6.2% en 2005 et 7.7% en 2006 des épisodes
d'hémocultures positives, tandis qu'à l'hôpital (RHUH), le
taux des Staphylocoques coagulase-négative pathogènes est
très élevés par rapport aux autres hôpitaux (36%).
Plusieurs explications ont été avancées pour expliquer ce
changement d'épidémiologie : l'utilisation de plus en plus
fréquente de biomatériaux tels que les prothèses
orthopédiques, les valves cardiaques de remplacement et les
cathéters intra vasculaires, l'amélioration des régimes
antibiotiques dirigés vers les Gram négatif, notamment chez les
patients oncologiques et de soins intensifs et l'augmentation du nombre global
d'hémocultures effectuées (augmente le nombre de
contaminants).
Si on compare le pourcentage des E. coli multi
résistantes (BLSE) avec Klebsiella pneumoniae (BLSE) dans les 2
périodes étudiées et dans les différentes
hôpitaux, on remarque que le pourcentage d'E.coli (BLSE)
augmente rapidement d'une façon étonnante, ceci doit obliger tous
les médecins et chercheurs à contrer ce phénomène
dangereux puisque E.coli est un germe ubiquitaire (qui se trouve
partout dans la nature) et si à un moment donné le taux
d'E.coli multi résistant devient très
élevé alors les médecins feront face à un
défi pour traiter ces patients infectés par des bactéries
pathogènes résistantes à un large spectre
d'antibiotiques.
La cause principale qui explique ce phénomène
est que la bactérie elle-même fabrique des nouvelles enzymes et
acquièrent ainsi de nouveaux types de résistances.
Ce phénomène est dû principalement
à la prise aléatoire des antibiotiques et au non respect des
prescriptions médicales et la durée du traitement
énoncée par le médecin.
5. Conclusion
Toute présence des microorganismes dans le sang
même qu'avec hémocultures positives ne signifie pas une
septicémie à cause des contaminations représentées
par des germes tels Staphylococcus epidermidis (un germe ubiquitaire)
et la bactériémie passagère. Ceci rend la
répétition des tests d'identification un outil important dans la
confirmation.
Les bactéries les plus isolées sont E.coli,
Staphylococcus aureus, Staphylocoque coagulase négative, Klebsiella
pneumoniae.
Une augmentation de différents types de
résistance aux antibiotiques a été signalée pendant
notre étude, surtout au niveau des bacilles Gram négatifs
(E.coli, Klebsiella pneumoniae), alors qu'il y a une diminution de
résistance au niveau des cocci Gram positifs (Staphylococcus
aureus, Staphylococcus coagulase négative).
Le pourcentage de klebsiella pneumaniae (BLSE)
augmente rapidement beaucoup plus qu'E.coli de 2005 à 2006.
L'origine des contaminations n'est pas seulement due aux
prélèvements et aux germes ubiquitaire mais peut être aussi
lié à la procédure d'hygiène suivie par
l'hôpital, ce qui entraine une augmentation des infections nosocomiales
responsable à leur tour de l'aggravation des atteintes septiques.
La réorganisation des hôpitaux, du point de vue
gestion des risques, la mise en place d'un système de contrôle de
la bonne exécution des actes médicaux et paramédicaux
ainsi que la création d'un comité nationale de surveillance des
infections nosocomiales devraient faire diminuer les infections
hospitalières notamment les septicémies. En est-il ainsi ?
Est-ce que ces mesures prises sont facilement applicables et
ne se heurtent pas avec les difficultés liées aux habitudes du
personnel hospitalier ? Ne faudrait-il pas faire une compagne nationale
pour sensibiliser la population à ne pas abuser des antibiotiques, et de
ne pas les prendre sans prescription médicale de façon à
limiter l'émergence de bactéries de plus en plus
résistantes dans leur écosystème, qui entraînent des
conséquences graves pour la vie humaine et un coût excessif pour
le budget national de la santé ?
Abréviations
ACTH: L'hormone corticotrope ou Adreno
CorticoTropic Hormone.
AUH: American university hospital.
BLSE : Béta Lactamase à
spectre étendu.
CRP: C réactive protéine.
CFU: Colony forming unit.
CIVD: Coagulation intra vasculaire
disséminée.
CPK : Créatinine phospho-kinase.
CMI: Concentration minimale inhibitrice.
CMB: Concentration maximal bactericide.
C3G : Céphalosporine
3ème génération.
DA : Dopaminergique.
ELISA: Enzyme Linked ImmunoSorbent Assay.
ECBU: Examen cytobactériologique des
urines.
ECG: Electrocardiogramme.
GC: Glucocorticoïde.
IF: Immunofixation.
IgG: Immunoglobuline G.
IL: Interleukine.
IVG: Interruption volontaire de grossesse.
IS : Insuffisance surrénale.
Ivl : Intraveineux lent.
MP: Méthylprednisolone.
NAD: Nicotinamide adénine
dinucléotide.
OAP: OEdème aiguë pulmonaire.
PCT: Procalcitonine.
PVC : Premature ventricular choc.
PDF : Produit de dégradation de
fibrine.
PCArh : Protéine C activée
recombinante humaine.
RHUH: Rafic Hariri university hospital.
Resist : Résistant.
RSA : Resistance artérielle
systémique.
SPS: Poly anéthol sulfonâte de
sodium.
SDRA: Syndrome de détresse respiratoire
aiguë.
SIDA: Syndrome d'immunodéficience humaine
acquise.
S ou Staph : Staphylococcus.
TCA : Temps de céphaline
activé.
TNF: Tumor necrosis factor.
TP: Temps de Prothrombine.
VS: Vitesse de sédimentation.
Vanco : Vancomycine.
* 1 État
fièvreux.
* 2 Inflammation de l'appendice
vermiculaire.
* 3 Opération qui
consiste à nettoyer une cavité naturelle.
* 4 Transpiration.
* 5 Contraction involontaire de
la peau.
* 6 Etat de faiblesse.
* 7 Peu d'urine.
* 8 Evident.
* 9 Qui est tout près
d'arrivé.
* 10 Connexion bidirectionnelle
entre machine et ordinateur.
* 11 Inflammation d'une veine
pouvant provoquer la formation d'un caillou.



