|
UNIVERSITE DE KINSHASA
FACULTE DE MEDECINE
PREDICTION DES ACCIDENTS VASCULAIRES CEREBRAUX :
SCORE DE SIRIRAJ, SCORE D'ALLEN ET TOMODENSITOMETRIE CEREBRALE
Par
MBETE TSASA Jean-claude
Mémoire présenté en vue de
l'obtention du grade de Spécialiste en Radiologie
Promoteur : Prof. Dr. LONGO-MBENZA
Benjamin
Mai 2005
INTRODUCTION
Selon l'Organisation Mondiale de la Santé (OMS),
l'accident vasculaire cérébral (AVC) est défini comme
"l'installation rapide de signes cliniques localisés ou globaux de
dysfonction cérébrale au-delà de 24 heures de
durée, pouvant conduire à la mort, sans autre cause apparente
qu'une origine vasculaire "(1); par contre, l'accident ischémique
transitoire (AIT) est défini comme "la perte brutale d'une
fonction cérébrale ou oculaire durant moins de 24 heures,
supposée due à une embolie ou à une thrombose
vasculaire " (2).
Les accidents vasculaires cérébraux (AVC)
constituent la pathologie la plus invalidante et la plus mortelle du
système nerveux central (3). Ils constituent donc un problème
majeur de santé publique pour l'OMS (4). En effet, dans les pays
développés, les AVC occupent la 3e place de la
mortalité globale derrière l'infarctus du myocarde et les cancers
(5).
L'AVC rend compte aujourd'hui d'une morbidité et d'une
mortalité élevées chez les patients noirs africains (6-8).
La prise en charge prompte et adéquate de l'AVC devrait
découler d'un diagnostic clinique élaboré et
affiné. En effet, il est important pour les cliniciens d'être
capables de distinguer (discriminer) l'AVC de type hémorragique de l'AVC
de type ischémique (infarctus cérébral) en cas d'apoplexie
(attaque cérébrale) aiguë ; en ce que la prise en
charge thérapeutique de ces deux types diffèrent totalement
(9).
Dans les pays industrialisés, le diagnostic de l'AVC
est facilité par la tomodensitométrie cérébrale ou
tomographie computérisée du crâne (CT scan
cérébral) ou scanographie cérébrale (10-15). Le
scanner cérébral est recommandé à tous les patients
de ces pays riches avec tableau clinique permettant d'adapter un traitement
spécifique à chaque type d'AVC (16,17). Ainsi, les
anti-coagulants seront de mise dans l'AVC ischémique et la
neuro-chirurgie dans l'AVC de type hémorragique en aggravation (18).
Par contre, dans les pays en voie de développement en
général et en Afrique sub-Saharienne dont la République
Démocratique du Congo (RDC) en particulier, le diagnostic de l'AVC reste
encore clinique excepté pour les rares centres hospitaliers dotés
d'imagerie médicale.
Pour une population de 60 millions d'habitants, la RDC ne
dispose que de quatre centres hospitaliers dotés de scanographie, tous
à Kinshasa, capitale de la RDC et dont trois sont fonctionnels et
performants.
La performance du diagnostic clinique pour distinguer un AVC
présent de l'absence d'AVC est très bonne avec une
sensibilité au-delà de 95% (9,19) et une
spécificité de 66 à 97% (10,20). Malheureusement, cette
performance se dilue de façon significative en cas de distinction des
différents types d'AVC avec une sensibilité de 68% et une
spécificité de 67% (13,15,17).
Le diagnostic clinique de l'AVC est donc moins performant que
le scanner cérébral pour recommander l'initiation d'un traitement
anti-coagulant ou thrombolytique (21).
Lorsque la scanographie est disponible dans les pays en voie
de développement, la majorité des patients avec AVC sont exclus
par son coût prohibitif et par la distance très
éloignée des centres hospitaliers (22). Ces patients ne peuvent
pas bénéficier d'un traitement approprié selon les
données scanographiques obtenues de manière non invasive.
Devant l'inaccessibilité pour certains patients au
scanner cérébral aussi bien dans les pays
développés que dans les pays en voie de développement,
plusieurs systèmes de score ou indice, basés sur les
données cliniques (3,12,23,24) ont été construits à
partir de certaines analyses statistiques multivariées (analyse
discriminante, régression logistique) (6). Il s'agit du score d'Allen ou
score de GUY'S hospital (12,25) et du score de Siriraj (23). Ces scores sont
simples, moins coûteux et pratiques pour discriminer l'AVC de type
hémorragique de celui de type ischémique mais pas assez sensibles
pour remplacer le scanner cérébral.
Le score de Siriraj, développé dans la ville de
Bangkok en Thaïlande, pays en voie de développement, consiste en
une formule mathématique basée sur des valeurs chiffrées
de cinq variables cliniques dont l'état de conscience, les vomissements,
les céphalées, la pression artérielle diastolique et les
marqueurs d'athérosclérose (26).
Le score de Siriraj a été validé avec
une précision de 88,5% à Taiwan (26) et de 85% au Mexique
(3).
Le score d'Allen a été validé dans
différents pays européens avec une très bonne
précision de 90% (25,27).
Et le score de Siriraj est plus simple à utiliser
immédiatement après l'avènement de l'attaque
cérébrale, contrairement au score d'Allen disponible seulement
après 24 heures (25,27,28).
Toutefois, les scores d'Allen et de Siriraj testés
respectivement à Taiwan (29) et à Hong Kong (30), le score de
Siriraj et le score d'Allen évalués à la fois en milieu
rural de l'Inde (31), et le score de Siriraj testé chez les noirs
africains du Nigeria (6), ont montré une faible performance diagnostique
dans la distinction des différents types d'AVC.
Devant l'allure épidémique de l'incidence des
AVC en milieu hospitalier de Kinshasa (7,8) et en présence des patients
économiquement défavorisés, il est nécessaire de
doter les cliniciens de Kinshasa des outils cliniques simples pour
différencier l'AVC hémorragique de celui ischémique.
Objectif général
La présente étude vise à renforcer les
capacités des cliniciens d'agir avec efficacité dans la prise en
charge thérapeutique des accidents vasculaires
cérébraux.
Objectifs spécifiques
Pour atteindre cet objectif général, les
objectifs spécifiques suivants ont été
fixés :
- inventorier le nombre d'examens scanographiques
cérébraux ;
- déterminer le profil épidémiologique,
clinique, et biochimique des patients ;
- valider les scores d'Allen et de Siriraj dans le cadre
hospitalier de Kinshasa.
Hypothèses
La population de Kinshasa est en pleine transition
démographique (32,33), épidémiologique (34) et
nutritionnelle (35). Pis encore, les patients hypertendus
irrégulièrement traités ou jamais traités par
manque de moyens financiers se présentent toujours avec des chiffres
tensionnels très élevés susceptibles d'entraîner un
AVC hémorragique.
La première hypothèse émise est que les
cas d'AVC hémorragique plus prédominants dans le passé
(36) seraient entrain de s'égaliser avec ceux d'AVC
ischémique(37,38) dans le cadre du vieillissement (32,33), de
l'urbanicité (32,33), des changements de style de vie (34) et de
diète (35).
La deuxième hypothèse émise est que le
score de Siriraj, élaboré dans la population thaïlandaise
plus encline à l'AVC hémorragique (39) serait plus performant
que le score d'Allen dans leurs validations auprès des hypertendus de
Kinshasa.
CHAPITRE I. GENERALITES
1.1. Rappel anatomique et fonctionnel de la
circulation cérébrale
1.1.1. Système artériel
L'encéphale est irrigué par deux réseaux
artériels : en avant, le système de la carotide interne qui
assure la vascularisation de tout l'encéphale et en arrière les
artères du tronc basilaire qui assurent la vascularisation de la partie
postérieure. Ces deux systèmes sont anastomosés à
la base du cerveau pour former le cercle ou polygone de Willis.
L'artère carotide interne se divise en deux branches
terminales importantes :
- l'artère cérébrale antérieure
qui vascularise la capsule interne, le noyau caudé et le
putamen ;
- l'artère cérébrale moyenne ou
sylvienne donne deux branches (la superficielle et la profonde). Elle irrigue
la surface latérale des hémisphères.
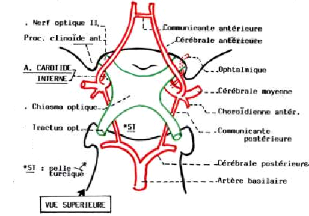
La figure 1 décrit l'anatomie du système
artériel cérébral.
Figure 1. Cercle artériel du cerveau (
polygone de willis).
1.1.2. Le système veineux
Les veines importantes sont situées à la
surface du cerveau dans l'espace sous-arachnoïdien.
Les veines du cerveau ne possèdent ni valvules, ni
tuniques et ne sont pas satellites des artères. Elles se jettent dans
différents sinus veineux, canaux à parois rigides creusés
dans l'épaisseur de la dure-mère. Les veines
cérébrales sont classées en deux groupes :
- les veines superficielles qui aboutissent au sinus de la
dure-mère, comprenant les veines cérébrales
supérieures et les veines cérébrales
inférieures.
- les veines profondes qui déversent leur sang dans la
grande veine cérébrale.
1.1.3. Débit sanguin
Le débit sanguin cérébral normal est
compris entre 40 et 50 ml/minute. Une diminution du débit sanguin
cérébral en dessous de certains seuils (<à 10 ml/min)
est à la base d'un état d'ischémie.
1.2. Types et étiopathogénie des AVC
Schématiquement on distingue 3 grands types.
1. L'hémorragie sous-arachnoïdienne :
lorsque le saignement se fait dans les
méninges .
L'étiologie est dominée par la rupture
anévrysmale dans 50 à 70% des cas.
Dans 10 à 20% l'origine est indéterminée
(40).
2. L'hémorragie cérébrale : lorsque
le saignement se produit dans le
parenchyme cérébral. Elle représente
10 à 15 % des cas (40).
Trois principales causes sont retenues :
a. l'hypertension artérielle responsable de 72
à 81% des hémorragies cérébrales (41). Le plus
souvent il s'agit d'une rupture artérielle principalement au niveau des
artères de petit calibre et les perforantes ;
b. les malformations vasculaires
cérébrales : 5% des hémorragies dans les
anévrismes artériels et les angiomes
artério-veineux ;
c. les troubles de la coagulation en relation avec un
traitement anti-coagulant, une hémopathie et/ou une cirrhose.
3. L'accident ischémique cérébral (ou
accident ischémique constitué),
caractérisé par la nécrose d'une zone du
parenchyme cérébral responsable
d'un déficit neurologique qui dure plus de 24
heures. L'étiologie est
dominée par 3 grandes causes :
a. l'athérosclérose des artères
cervico-cérébrales : 30 à 50% des cas, lié
à la formation d'athérome au niveau de l'intima du vaisseau
(41) ;
b. les lacunes cérébrales : 30% des cas
(41), liées à l'occlusion des artérioles
perforantes ;
c. les cardiopathies emboligènes : 15 à 20
% (42,43)dont la plus fréquente est la fibrillation
auriculaire dans 50% des cas (44) ;
d. les autres causes sont l'infarctus du myocarde,
l'endocardite infectieuse et les prothèses valvulaires.
1.3. Les méthodes d'exploration
Les différentes méthodes d'exploration en
imagerie de ces AVC sont essentiellement la tomodensitométrie
cérébrale, l'imagerie par résonance magnétique,
l'ultrasonographie des vaisseaux cervicaux et intracrâniens, ainsi que
l'angiographie cérébrale.
1.3.1. La tomodensitométrie (TDM)
cérébrale
C'est une méthode basée sur le principe de la
tomographie et sur la mesure de la densité des tissus traitée par
ordinateur.
Les rayons X émis de façon collimatée par
le tube radiogène traversent le corps examiné dans lequel ils
subissent une atténuation. Les rayons résiduels recueillis par un
système des détecteurs fournissent des informations quantitatives
qui seront secondairement analysées et traitées par ordinateur
pour la reconstruction de l'image du corps.
L'image obtenue est une coupe axiale dont chaque
élément de la matrice (pixel) répond à une valeur
de l'atténuation des rayonnements proportionnelle à la
densité du volume élément (voxel) correspondant. La valeur
de la densité est exprimée en unité Hounsfield.
La tomodensitométrie a révolutionné le
diagnostic d'urgence des accidents vasculaires cérébraux,
permettant de distinguer un AVC ischémique (scanner normal ou
hypodensité), d'un AVC hémorragique (hyperdensité
spontanée).
A la phase aiguë de l'AVC, le scanner
cérébral doit être effectué sans injection
intraveineuse de produit de contraste parce que :
- il n'existe pas de rupture de la barrière
hémato-encéphalique ;
- elle risque de masquer une hypodensité
débutante ou une hyperdensité
intravasculaire décelable uniquement à
l'examen sans contraste.
Cependant le scanner ne peut pas mettre en évidence les
accidents ischémiques de petit volume.
De plus, il est mal adapté à la visualisation
des infarctus de la fosse postérieure (45-47), car l'image est
dégradée par les formations osseuses (les rochers en
particulier).
1.3.2. Imagerie par résonance
magnétique
Elle fait appel aux propriétés
électromagnétiques des noyaux d'hydrogène (protons) du
corps humain. Soumis aux forces d'un champ magnétique puissant (appareil
d'IRM) et excités par des ondes de radio fréquence, les protons
accumulent de l'énergie qu'ils perdent après chaque impulsion
sous forme de signal électromagnétique en revenant à
l'équilibre.
Tous les auteurs insistent sur le fait que l'IRM (en
particulier les séquences de diffusion-perfusion) est la meilleure
technique d'imagerie médicale pour le diagnostic positif et pour choisir
les modalités de la prise en charge d'un accident ischémique
aigu, puisque la technique de diffusion -perfusion peut montrer à la
fois l'infarcissement du parenchyme et la zone de pénombre (48-50). De
plus l'angio IRM peut mettre en évidence l'occlusion artérielle
intracrânienne.
1.3.3. Ultrasonographie
L'ultrasonographie des vaisseaux cervicaux et
intracrâniens utilise des ultrasons respectivement de haute
fréquence (5 - 7,5MHz) et de basse fréquence (2,5MHz).
La production de l'image se fait après traitement par
l'ordinateur des informations reçues par le canal d'une sonde
émettrice et réceptrice contenant du quartz et qui grâce
à sa piézoélectricité, transforme l'énergie
mécanique en énergie électrique et vice versa.
L'exploration ultrasonore permet une évaluation
atraumatique des vaisseaux cervicaux et intracrâniens au lit du
malade.
C'est la seule exploration apportant des informations
hémodynamiques précises en temps réel sur la circulation
intra et extra crânienne.
1.3.4. L'angiographie cérébrale
Elle consiste en l'opacification à l'aide d'un produit
de contraste iodé du réseau artériel du cerveau par
ponction directe de la carotide interne ou par cathétérisme
sélectif d'une artère (humérale ou fémorale).
Cette technique, invasive est en voie de disparition sur le
plan de diagnostic des AVC au profit de la tomodensitométrie
cérébrale à cause de son rapport bénéfice /
risque médiocre.
Toutefois, elle garde encore une place importante dans la
prise en charge thérapeutique (embolisation, thrombolyse) des AVC ainsi
que dans le dépistage des malformations vasculaires.
CHAPITRE II. MATERIEL ET METHODES
2.1. Nature et période de l'étude
La présente étude de séries s'est voulue
évaluative et multicentrique. Elle a été
réalisée entre le 1er janvier 1998 et le 30 juin
2004, soit une période de 6 ans.
2.2. Cadre de l'étude
Les institutions hospitalières publiques et
privées de la ville de Kinshasa, RDC, hospitalisant les patients avec
AVC étaient invitées à participer à la
présente étude (n=30).
Mais seules les cliniques universitaires de Kinshasa dans la
commune de Lemba, la clinique Ngaliema dans la commune de la Gombe, le centre
neuro-psycho-pathologique (CNPP) du Mont-Amba dans la commune de Lemba, la
clinique Dr LELO dans la commune de Barumbu et la clinique Lomo Médical
dans la commune de Limete ont accepté de participer en disponibilisant
les dossiers des patients hospitalisés.
2.3. Population d'étude
2.3.1 Critères d'inclusion
Seuls les dossiers médicaux des patients
hospitalisés répondant aux critères suivants ont
été inclus dans la présente étude :
- être noir de nationalité congolaise ;
- avoir un diagnostic clinique avec ou sans précision
du type d'accident vasculaire cérébral ;
- disposer des données scanographiques
cérébrales.
2.3.2. Critères d'exclusion
Ont été exclus de la présente
étude, les patients avec examen tomodensitométrique
cérébral (scanner cérébral) réalisé
au-delà des 10 jours suivant l'attaque cérébrale
aiguë (Ictus ou apoplexie) ou un cliché scanographique
illisible.
Les patients avec hémorragie sous-arachnoïdienne
ou avec lésion infra-tentoriale au scanner cérébral ont
aussi été exclus de la présente étude.
2.4. Approche méthodologique
2.4.1. Choix des indicateurs
Grâce à la fiche de récolte des
données (ANNEXE), les paramètres d'intérêt suivants
ont été colligés :
- l'âge au moment de l'accident ;
- le sexe ;
- la pression artérielle diastolique à
l'admission ;
- la pression artérielle diastolique après
24heures ;
- l'état de conscience : lucide, obnubilé
(stupeur) et coma ;
- les vomissements ;
- les céphalées dans les 24 heures
précédant l'AVC ;
- les marqueurs d'athérome : le diabète
sucré, l'angine de poitrine, la claudication intermittente, le signe de
la sonnette humérale;
- la raideur de nuque ;
- les réflexes plantaires ;
- les antécédents d'HTA ;
- l'antécédent d'AIT ;
- les pathologies cardiaques : le souffle mitral ou
aortique, l'insuffisance cardiaque, la cardiomyopathie, la fibrillation
auriculaire, la cardiomégalie, l'infarctus du myocarde ;
- certains paramètres hématologiques :
hémoglobine, hématocrite, globules blancs ;
- les données de la biochimie sanguine :
glycémie, urémie, créatininémie,
cholestérolémie totale et uricémie ;
- le comportement à risque : tabagisme et
alcoolisme ;
- le diagnostic présomptif du type d'AVC par les
cliniciens ;
- les données scanographiques relatives au type d'AVC
intra-cérébral et supra-tentorial : hémorragique et
ischémique.
2.4.2. Technique de la scanographie
cérébrale
Les appareils de tomodensitométrie, leurs principes
ainsi que la technique pratiquée dans les formations médicales
retenues ont fait l'objet d'une brève description.
Trois types d'appareils ont été
utilisés : SHIMADZU CT-2000T-11 (Kyoto, Japon), GENERAL ELECTRIC CT
ace (USA) et PHILIPS Tomography (Amsterdam, Pays -bas), tous des appareils de
3e génération.
La tomodensitométrie reposait sur deux
propriétés : la mesure de la densité des tissus
à partir de l'absorption des rayons X et la reconstruction d'une image
en coupe du corps humain à partir des différentes projections
transversales obtenues par l'appareil (51).
Du point de vue technique, le sujet était en
décubitus dorsal, les bras le long du corps, la tête collée
dans la têtière pour avoir une immobilité parfaite. La
tête était placée de face, à l'aide des
repères lumineux, l'obliquité du plan de coupe était
choisie après la réalisation d'une radiographie
numérisée du crâne de profil (scout- view).
Le plan orbito-méatal (OM) était le plan de
référence et visualisé facilement sur un scout-view de
profil, ligne allant du bord supérieur du conduit auditif externe au
nasion.
Les coupes tomodensitométriques ont été
obtenues dans un plan transversal parallèle au plan orbito
-méatal ; elles ont été réalisées de la
base du crâne au vertex sans et ou avec injection de produit de
contraste. L'épaisseur des coupes était de 10mm, espacées
de 5mm et une dizaine des coupes étaient réalisées en
moyenne.
La relecture des clichés scanographiques
déjà protocolés était réalisée par
nous-mêmes en suivant la sémiologie habituelle : la
densité parenchymenteuse, la position de la ligne médiane, la
taille, la symétrie et la position des ventricules et des sillons. Les
parties osseuses et les tissus mous ont aussi été successivement
examinés.
2.4.3. Calcul du score de Siriraj
Le score de Siriraj pour l'AVC a été
calculé à posteriori et selon la méthodologie initiale
(Tableau I) de HUNG LY et al (26) comme suit :
(2,5 x niveau de la conscience) + (2 x vomissements) + (2x
céphalées) +
(0,1 x PAD) - (3x marqueurs d'athérome) -12.
Tableau I. Calcul du score
de Siriraj
|
Variables
|
Trait clinique
(Aspect clinique)
|
Score
|
|
Conscience (x 2,5)
Vomissement (x2)
Céphalées en-déans 24h
(x2)
Pression artérielle diastolique (x0,1)
Marqueurs d'athérome (x3)
(Diabète sucré, angine de poitrine,
claudication intermittente)
Constante
|
Vigilant (lucide)
Obnubilé, stupeur,
Coma
Non
Oui
Non
Oui
-
absent
un ou plus
|
0
1
2
0
1
0
1
-
0
1
-12
|
Un score >+1 indiquait un AVC intra-cérébral
de type hémorragique, alors qu'un score < -1 indiquait un AVC
intra-cérébral de type ischémique (infarcissement).
Un score entre -1 et +1 représentait un résultat
équivoque, incertain, nécessitant un scanner
cérébral pour vérifier le diagnostic.
Le score de Siriraj pour l'AVC a été
calculé pour chaque patient. Et à partir du score individuel, le
patient était classé en hémorragie cérébrale
ou en ischémie cérébrale, grâce à l'indice
>+1 pour l'hémorragie cérébrale et <-1 pour
l'ischémie cérébrale (23).
Les patients avec un score de Siriraj entre +1 et -1
n'étaient pas classés.
2.4.4. Calcul du score d'Allen
Grâce au tableau II proposé par le travail
originel d'Allen (12), le score d'Allen a été calculé.
Tableau II. Calcul du score d'Allen
|
Variables
|
Trait clinique
|
Score
|
|
Installation de l'apoplexie
n Perte de conscience
n Céphalées
n Vomissements
n Raideur de nuque
Niveau de la conscience
24h après l'admission
Réflexes plantaires
Pression artérielle diastolique
(24h après l'admission) (x 0,17)
Marqueurs d'athérome
(Angine de poitrine,
Claudication intermittente
Signe de la sonnette humérale)
Antécédent d'HTA
Evénement précédant l'attaque
(AIT)
Pathologies cardiaques
Constante
|
absent
présent
lucide
somnolent
coma
absent
présent
absent
un ou plus
absent
présent
absent
présent
absent
souffle mitral ou aortique
insuffisance cardiaque
cardiomyopathie
cardiomégalie
fibrillation auriculaire
infarctus du myocarde
|
0
21,9
0
7,3
14,6
0
7,1
0
-3,7
0
-4,1
0
6,7
0
-4,3
-4,3
-4,3
-4,3
-4,3
-4,3
-12
|
Un score d'Allen > 24 indiquait un AVC de type
hémorragique tandis qu'un score d'Allen < 4 définissait un AVC
de type ischémique.
Un score d'Allen entre 4 et 24 représentait un
résultat incertain et nécessitait un scanner
cérébral. Les patients dont le score d'Allen se situait entre 4
et 24 n'étaient pas classés.
2.5. Validité interne de la présente
étude
L'évaluation de la validité interne de chaque
test diagnostique (score de Siriraj et score d'Allen) permettait de juger sa
valeur. Cette validité interne (dans la présente étude)
définissait la capacité d'évaluer correctement
l'état de santé d'un individu.
La valeur diagnostique (performance) de chaque score
était mesurée en comparaison avec le scanner
cérébral considéré comme test de
référence (le diagnostic réel ou vrai, la règle
d'or ou Gold standard).
Pour ce faire, la base de la formule a été
établie à partir du Quarré Latin (Tableau III) :
cette capacité de poser correctement le diagnostic du type d'AVC
était mesurée par les valeurs prédictives (positives et
négatives), la sensibilité, la spécificité et la
statistique Kappa (degré d'agrément, concordance, valeur globale
de précision, de reproductibilité, efficience globale,
fiabilité ou overall accurary), rapport de vraisemblance positive et
négative.
Tableau III. Quarré Latin
|
Valeur diagnostique
Score Siriraj
Score d'Allen
|
Test de référence CT scan
+
-
|
Total
|
|
Test +
Test -
|
a = Vrai Positif, VP b= Faux Positif, FP
c = Faux Négatif, FN d= Vrai Négatif
|
a+b
c+d
|
|
Total
|
a+c b+d
|
a+b+c+d
|
Sensibilité 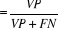 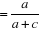 ; ;
Spécificité 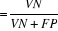 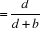 ; ;
Valeur prédictive positive, VP + 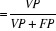 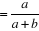
Valeur prédictive négative, VP - 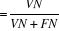 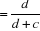 ; ;
Statistique Kappa ou K 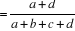 ; ;
LR + 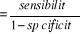 ; ;
Rapport de vraisemblance
LR - 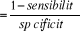
La classification du degré de concordance pour des
valeurs de la statistique Kappa comprise entre 0 et +1 était
utilisée, telle que présentée dans le tableau IV.
Tableau IV. Classification du degré de
concordance
|
Valeur de Kappa Degré
de concordance
|
|
< 0,20
Mauvais /Nul
0,21 - 0,40
Faible /Médiocre
0,41 - 0,60
Moyen
0,61 - 0,80 Bon
0,81 - 1
Très bon à excellent
1
Parfait
|
|
K <0 = discordances
K = -1 ; discordances totales
|
2.6. Analyses statistiques
Après évaluation et validation des
données, ces dernières ont été saisies sur
micro-ordinateur en utilisant les logiciels EPI-INFO version 6.04 et SPSS sur
Windows 10.01.
Les données des variables qualitatives et celles des
variables continues (quantitatives) ont été respectivement
présentées sous forme de proportions (pourcentage) et de moyennes
Ecart types (ET).
Le test Chi-carré apparié de Mc Nemar et le
test-t de Student étaient respectivement utilisés pour comparer
les pourcentages et les moyennes des variables normalement
distribuées.
Le test H de Kruskall-Wallis était utilisé pour
comparer les moyennes des variables asymétriques.
La valeur de p<0,05 était considérée
comme seuil de significativité statistique (p<0,01= différence
statistique hautement significative et p<0,001 = différence
statistique très significative).
CHAPITRE III. RESULTATS
Ce chapitre présente les résultats
observés chez 182 patients retenus parmi les 189 patients
éligibles (taux de réponse = 96,3%).
3.1. Données
épidémiologiques
3.1.1. Formations médicales
La répartition de la population d'étude selon
les formations médicales d'accueil est résumée dans le
tableau V.
Tableau V. Répartition des patients
selon les formations médicales d'accueil
|
Variables n
%
|
|
C U K 73
40,1
Clinique Ngaliema 71
39
CNPP 24
13,2
LOMO MEDICAL 9
4,9
Clinique Dr LELO 5
2,7
|
3.1.2. Données démographiques
La population d'étude était composée de
124 hommes (68,1%) et 58 femmes (31,9%) avec un sexe ratio de 2 hommes : 1
femme.
L'âge moyen de cette population était de 58,7
11,2ans (extrêmes 28 ans et 88 ans).
16,7%
3,3%
16,2%
4,4%
30%
%
Population
29%
La figure 2 répartit la population
étudiée par tranches d'âges.
<40 40-49 50-59
60-69 70-79 80-89 âge
n =8 n=29 n=54
n=52 n=30 n=6
Figure 2. Répartition de la
population d'étude selon l'âge.
Cette population est caractérisée par plus des
2/3 des personnes dont l'âge est >55 ans.
3.2. Données scanographiques
Sur l'ensemble de 182 clichés de scanner
cérébral disponibles, 22 clichés étaient
jugés dans les limites normales et 160 clichés restants
considérés avec diagnostic d'AVC. Parmi les 160 clichés
scanographiques avec AVC, 48,2% (n=77) portaient le diagnostic d'AVC de type
hémorragique et 51,8% (n=83) portaient plutôt le diagnostic d'AVC
de type ischémique.
3.3. Calcul du score de Siriraj
Les caractéristiques informationnelles colligées
24 heures avant ou le jour de la survenue de l'AVC sont résumées
dans le tableau VI.
Tableau VI. Informations recueillies 24
heures avant ou le jour de la
survenue de l'AVC
|
Variables n ou moyennes
ET %
|
|
Etat de la conscience
· Coma 18
9,9
· Obnubilé/stupeur 44
24,2
· Lucide 120
65,9
Vomissements 15
8,2
Céphalées 24h avant
la survenue de l'accident 77
42,3
PAD (mmHg) 98,7 18
Marqueurs d'athérome 34*
18,7
*(1 cas avec signe de la sonnette
humérale et 33 cas avec diabète sucré)
|
Les histogrammes des fréquences de répartition
du score de Siriraj selon le type d'AVC défini cliniquement sont
présentés dans la figure 3.
AVC de type ischémique (n=87)
AVC de type hémorragique (n=75)
-7
-5
-6
+2
-2
+1
0
-1
+3
+4
-9
+6
-8
+5
+11
-10
+10
+8
+7
+9
-4
-3
Score de Siriraj
20 18 16 14 12 10 8 6 4 2
2 4 6 8 10 12 14 16 18
20
Nombre des patients Nombre des patients
Figure 3. Histogrammes des fréquences
de répartition du score de Siriraj
selon le type d'AVC défini par le
diagnostic clinique.
La valeur moyenne du score de Siriraj en cas d'AVC de type
hémorragique confirmé par le scanner cérébral
(1,423 2,992 ; médiane +1,5 ; extrêmes -5 et +11)
était supérieure à celle observée en cas d'AVC de
type ischémique confirmé par le scanner cérébral
(-1,682 2,574 ; médiane -2 ; extrêmes -7 et +8), la
différence étant statistiquement très significative
(p<0,00001).
Ainsi le score de Siriraj classait 51 patients (28%) comme
hémorragie cérébrale, 72 patients (39,6%) comme
ischémie cérébrale et 59 patients comme incertains
(diagnostic équivoque).
L'ensemble des cas avec hémorragie
cérébrale et ceux avec ischémie cérébrale
constituent les cas diagnostiqués certains par le score de Siriraj
(n=123 ; 67,6%).
Le tableau VII compare le score de Siriraj avec diagnostic
d'hémorragie cérébrale, d'ischémie
cérébrale et diagnostic incertain. Parmi les AVC incertains,
selon le score de Siriraj, il y avait plus d'AVC de type ischémique
selon le scanner cérébral (57,7%) que d'AVC de type
hémorragique selon le scanner cérébral (42,3%), la
différence étant statistiquement très significative
(p<0,0001).
Tableau VII. Classification des types d'AVC
selon le score de Siriraj chez
des patients congolais avec diagnostic scanographique d'AVC
confirmé
|
CT scan
AVC hémorragique AVC ischémique
(n) (n)
|
Total
n
|
|
Score de Siriraj
>+1 (Hémorragie)
< -1 (Ischémie)
> -1 et < +1
|
38 8
13 49
22 30
|
46
62
52
|
|
Total n
|
73 87
|
160
|
En ne considérant que le diagnostic des cas certains
selon le score de Siriraj, le tableau VIII compare ces derniers au diagnostic
de types d'AVC confirmés par le scanner.
Tableau VIII. Classification des AVC de types
certains hémorragique et ischémique selon le score de Siriraj
chez les patients avec diagnostic scanographique d'AVC confirmé
|
CT scan
AVC hémorragique AVC ischémique
n n
|
Total
n
|
|
Score de Siriraj
> + 1(hémorragie)
< - 1 (ischémie)
|
38 8
13 49
|
46
62
|
|
Total n
|
51 57
|
108
|
Sensibilité = 74,5% Statistique Kappa = 0,81
Spécificité = 86% Rapport de vraisemblance +
= 5,2
Valeur prédictive positive = 82,6% Rapport de
vraisemblance - = 0,29
Valeur prédictive négative = 79%
Mais l'habilité du score de Siriraj de discriminer un
AVC incertain d'un AVC certain n'a pas atteint le seuil de décision
statistique pour l'AVC hémorragique (42,3% versus 47,2% ;
p>0,05) et pour l'AVC ischémique (57,7% versus 52,8% ;
p>0,05) selon le Scanner cérébral (Tableau IX)
Tableau IX. Classification des AVC de types
certains et incertains selon le
score de Siriraj chez les patients congolais avec diagnostic
scanographique d'AVC confirmé
|
CT scan
AVC hémorragique AVC ischémique
|
Total
n
|
|
Score de Siriraj
> + 1 et < - 1
(certain)
> + 1 et < - 1
(incertain)
|
51 57
22 30
|
108
52
|
|
Total n
|
73 87
|
160
|
3.4. Calcul du score d'Allen.
Les données bio-cliniques ayant servi à calculer
le score d'Allen selon les critères originels sont
résumées dans le tableau X.
Tableau X. Données bio-cliniques
à la base du calcul du score d'Allen
|
Variables n ou moyenne ET %
|
|
Perte de connaissance 91 50
Céphalées 78 42,9
Vomissements 15 8,2
Raideur de nuque 22 12,1
Etat de conscience
24h après l'admission
· Coma 28 15,6
· Somnolent/stupeur 20 11,6
· Lucide 132 73,3
Réflexes plantaires 102 57
PAD (mmHg) 94,1 20,2
Marqueurs d'athérome 34 18,7
ATCD d'HTA 142 78
AIT 35 19,2
Maladies cardiaques 21 11,5
|
La valeur moyenne du score d'Allen était de 3,5 4,4
(extrêmes -12 et +25,7).
Ainsi, le score d'Allen >24 correspondait à
l'hémorragie cérébrale, le score d'Allen < 4 à
l'ischémie cérébrale et le score d'Allen de 4-24 à
un diagnostic incertain.
Le score d'Allen moyen de l'AVC hémorragique par
scanner cérébral égal à 4 4,2 (extrêmes -12
et 11,8) était supérieur (p>0,01) à celui de l'AVC
ischémique par scanner cérébral égal à 3,6
4 (extrêmes 1,8 et 25,7).
En ne considérant que les cas certains selon le score
d'Allen, le tableau XI compare ces derniers au diagnostic des types d'AVC
confirmés par le scanner: sensibilité nulle. La capacité
du score d'Allen de discriminer un AVC hémorragique d'un AVC
ischémique est totalement inéfficiente avec une statistique Kappa
suggérant que le score d'Allen était discordant du scanner.
Tableau XI. Score d'Allen versus scanner
cérébral
|
CT scan
AVC hémorragique AVC ischémique
n n
|
Total
n
|
|
Score d'Allen
>24
(hémorragique)
< 4
(ischémique)
|
0 1
32 59
|
1
91
|
|
Total n
|
32 60
|
92
|
Sensibilité = 0% LR + = 0
Spécificité = 98,3% LR- = 1,01
VPP = 0% Kappa =0
VPN = 64,8%
3.5. Comparaison du score de SIRIRAJ à celui
d'Allen
Aucune association significative n'était
démontrée entre le score d'Allen et celui de Siriraj
(Chi-carré = 0,19 ; p>0,05). Pis encore, 1 seul cas certain a
été diagnostiqué comme hémorragie
cérébrale par le score d'Allen. (Tableau XII)
Tableau XII. Score de Siriraj versus score
d'Allen
|
Score d'Allen Total
Score Siriraj Hémorragique Ischémique
n
n n
|
|
Hémorragique 1 69 70
Ischémique 0 34
34
|
|
Total 1 103 104
|
CHAPITRE IV. DISCUSSION
En faisant le bilan de l'évaluation de l'AVC en milieu
hospitalier de Kinshasa, la présente étude démontre
l'applicabilité de l'indice de Siriraj et non du score d'Allen. Les
présentes données viennent renforcer les capacités de
gestion de l'AVC aigu pour la connaissance des types hémorragique et
ischémique.
4.1. Plateau technique et accessibilité
En dépit de la présence de quatre centres
disposant d'un scanographe dont trois sont performants, le nombre d'examens de
scanographie cérébrale réalisés restent
insignifiants par rapport à l'incidence élevée et sans
cesse croissante des AVC en milieu hospitalier de Kinshasa (7,52,53).
Le degré d'appauvrissement de la population congolaise,
confrontée à des crises socio-politiques multiformes (54), ne
permet pas à la majorité des patients souffrant d'AVC de
bénéficier des données scanographiques. Ce qui retarde la
décision des médecins pour initier un traitement anti-coagulant
précoce.
4.2. Données épidémiologiques
Dans les pays développés d'Europe et
d'Amérique du Nord, tout comme dans les pays en émergence
économique comme le Mexique, l'AVC de type ischémique rend compte
de plus de 80% de l'ensemble des AVC (12,23,55).
Hier, l'AVC de type hémorragique était
présent dans 90% des cas au scanner (56) et dans 95% des cas à
l'autopsie (57) en Afrique en général et dans l'ordre de 55% au
scanner cérébral (36) en RDC en particulier. Dans la
présente étude, l'AVC de type ischémique tend à
égaliser voire surpasser l'AVC de type hémorragique dans les
mêmes proportions (51,8%) que celles de l'hôpital Siriraj en
Thaïlande (39). Par contre, au Nigeria l'AVC de type ischémique
estimé à 89% (58) est identique au spectre européen
(24).
L'âge avancé, la moyenne dans cette étude
tournant autour de 60ans, conséquence de l'amélioration de
l'espérance vie en dépit de la pandémie VIH/SIDA (59),
expliquerait la tendance à la suprématie de l'AVC de type
ischémique.
Le contrôle de l'hypertension artérielle
jugé récemment bon en milieu hospitalier de Kinshasa (60)
pourrait aussi expliquer la diminution de la prévalence de l'AVC de type
hémorragique. En effet, le contrôle inadéquat de
l'hypertension artérielle expliquerait la fréquence
élevée de l'AVC de type hémorragique.
La prédominance masculine dans la présente
étude confirme la vulnérabilité des hommes dans
l'hypertension artérielle (61,62).
4.3. Validité des scores de Siriraj
et d'Allen
Les données de la présente étude montrent
que la pratique clinique s'est considérablement modifiée, en
particulier en matière d'investigation des AVC. En dépit des
demandes de scanner cérébral, nombres d'investigations ne sont
pas disponibles dans notre pays, et c'est pourquoi un des objectifs
spécifiques de la présente étude a recherché
à explorer la validité du diagnostic clinique des types d'AVC par
le score de Siriraj et d'Allen.
Il s'agissait de dégager la valeur diagnostique de
chaque score en comparaison avec le diagnostic réel ou Gold standard qui
apporte le diagnostic final. Ce diagnostic final est déterminé
par le scanner cérébral considéré comme
investigation de référence.
Les résultats sur la valeur diagnostique de chaque
score ont été rapportés sous forme d'indices telles
que la sensibilité, la spécificité, la valeur
prédictive positive, la valeur prédictive négative, la
statistique Kappa (reproductibilité, valeur globale de précision,
fiabilité) et le rapport de vraisemblance.
L'avantage est que la sensibilité et la
spécificité sont des mesures indépendantes de la
prévalence de la maladie et peuvent donc être utilisées
aussi bien pour le dépistage en cas de faible prévalence que pour
le diagnostic en cas de prévalence plus élevée.
Le clinicien veut connaître en quoi le résultat
de chaque score modifie la probabilité d'un tel type d'AVC. C'est
pourquoi les valeurs prédictives l'aideront à la prise de
décision thérapeutique : faut-il instaurer
précocement l'anti-coagulation en cas d'AVC de type ischémique ou
post-poser le traitement ?
4.3.1. Score de Siriraj
Le score de Siriraj montre dans la présente
étude une sensibilité de 75%, une spécificité de
86%, une VP+ de 83%, une fiabilité, exactitude (précision,
pourcentage des sujets correctement classés comprenant les vrais
positifs et les vrais négatifs sur l'ensemble de la population ou
statistique Kappa de 81%) et un rapport de vraisemblance positif tendant vers
l'infini pour l'AVC hémorragique.
Cette valeur de la sensibilité définit la
capacité du score de Siriraj d'identifier les vrais positifs (avec AVC
de type hémorragique) (13,63). La valeur de la sensibilité de 75%
pour l'AVC hémorragique de la présente étude, est
égale à celle de 76% rapportée au Mexique (3). En
comparant aux valeurs respectives de 89% de la sensibilité et de 90% de
fiabilité ou exactitude pour l'AVC de type hémorragique dans le
travail originel de Bangkok (23), valeurs d'un test excellent, la
sensibilité de 75% et la fiabilité de 81% pour l'AVC de type
hémorragique de ce travail, permettent d'affirmer que le score de
Siriraj est un très bon test. Ce score de Siriraj a aussi
été d'application excellente dans d'autres pays de l'Asie :
sensibilité de 87% et fiabilité de 91% pour l'AVC de type
hémorragique en Inde (28) ; une sensibilité de 83,8% et une
fiabilité de 88% dans une étude de Taiwan (26).
Mais au Nigeria, en Afrique de l'Ouest (6), en Italie (27) et
dans d'autres centres d'Asie (30), la faible fiabilité, la basse
sensibilité et la basse valeur prédictive positive ont conclu
à l'inutilité du score de Siriraj pour discriminer l'AVC de type
hémorragique de celui de type ischémique. Ceci prouve à
suffisance la validité de l'anamnèse et de l'examen clinique des
médecins de la ville de Kinshasa. En effet, le caractère
rétrospectif des études justifie les différentes faibles
valeurs de la sensibilité pour l'AVC de type hémorragique
(6,30,65). La valeur prédictive de n'importe quel test diagnostique
dépend de la prévalence (64). Ce qui interdit l'application
transculturelle des systèmes de score (23).
En Thaïlande, il est noté une
prépondérance de l'AVC hémorragique (39) tandis que l'AVC
de type ischémique est plus prévalent au Nigeria (58), en Europe
(24), en Amérique (65) et à Hong Kong (30).
Les présentes données corroborent avec celles de
Celani qui considère une meilleure application du score de Siriraj
auprès des africains (66). Mais tel n'est pas le point de vue de OGUN
et al au Nigeria (6).
Le score de Siriraj est facile d'application puisqu'il inclut
seulement cinq variables disponibles au chevet des patients à la phase
aiguë de l'AVC. Le score de Siriraj ne suggère que les
lésions supra-tentoriales et intra parenchymateuses (67).
Une longue expérience est donc nécessaire pour
appliquer le score de Siriraj. Et en cas des valeurs du score de Siriraj
comprises entre -1 et +1, cas incertains, le scanner cérébral est
de mise. Une économie de ressources financières serait
réalisée pour les pays pauvres si seuls les cas incertains selon
le score de Siriraj étaient référés à la
scanographie cérébrale.
4.3.2. Score d'Allen
Le score d'Allen a été validé dans la
présente étude avec des valeurs de sensibilité de 0%, de
spécificité de 98,3%, de VPP de 0%, de statistique Kappa
(fiabilité ou exactitude) de 0% et de rapport de vraisemblance + de 0%
qui militent pour la non application de ce score chez les africains de la
RDC.
Mais le score d'Allen a été jugé comme un
très bon test diagnostique surtout pour l'AVC de type ischémique
à Oxford (25), à Londres (25), à Hong-Kong (29) et en
Italie (27).
Le score d'Allen est d'applicabilité difficile en
clinique à cause du nombre élevé de variables cliniques
à inclure. Le score d'Allen requiert plusieurs détails
anamnéstiques et cliniques ne pouvant pas être utilisés
moins de 24 heures après la survenue de l'attaque aiguë. Ce qui
justifie la discordance totale entre le score d'Allen et le scanner
cérébral.
CONCLUSION
Cette étude permet de conclure à la très
bonne performance diagnostique du score de Siriraj dans la distinction de l'AVC
de type hémorragique et de celui de type ischémique.
Le score de Siriraj est de réalisation facile
contrairement au score d'Allen sans valeur diagnostique valide. En cas de
ressources financières limitées, seuls les cas incertains selon
le score de Siriraj bénéficieront d'une scanographie
cérébrale
Le score de Siriraj va aider les cliniciens de la RDC dans la
prise de décision thérapeutique en cas d'attaque aiguë.
Le score d'Allen nécessitant plusieurs variables,
dépourvu d'exactitude, de sensibilité et de valeur
prédictive positive, n'est pas recommandé pour la
République Démocratique du Congo.
RECOMMANDATIONS
Au terme de la présente étude, les
recommandations suivantes sont formulées.
1. A l'autorité sanitaire étatique
De doter chaque province du pays d'un appareil de
tomodensitométrie pour améliorer la prise en charge des
accidents vasculaires cérébraux.
D'encourager des cycles de formation continue dans le domaine
de la neuroradiologie en disponibilisant des bourses d'études.
Aux cliniciens
De tenir correctement les dossiers des malades afin de
faciliter les recherches. Ces dossiers médicaux doivent contenir les
informations sur l'état de conscience, les vomissements, les
céphalées en-déans 24 heures, la pression
artérielle diastolique et les marqueurs
d'athérosclérose.
Aux radiologues
De ne protocoler que les clichés réalisés
dans des conditions techniques acceptables.
De convaincre les cliniciens de remplir correctement le bon de
demande du scanner cérébral avec l'âge, le sexe, le type
d'AVC soupçonné, les circonstances et l'heure de survenue de
l'AVC.
REFERENCES
1. WHO.
World Health Report 2001. Who (ed.) Genève,
2001.
2. FEINBERG WM.
Guidelines for the management of transitent ischemic
attacks. Stroke
1994; 25: 1320-35.
3. RAMIREZ MA. CM.
Indice de Siriraj : Diagnóstico
diferencial entre hemorragia einfarto
cerebral supratentorial. Revista Médica del Instituto
Mexicano del Seguro
social 1998; 36 (3) : 185-9.
4. WHO.
World Health Report 2003. Who (ed.)
Genève, 2003.
5. MURRAY CJL.
Evidence-based health policy: Lessons from
the global Burden of disease
study. Science 1996; 274: 740-43.
6. OGUN SHAMSIDEEN ABAYOMI, OLUWOLE STEVEN, AOGUNSEYINDE
OLUREMI, FATADE ABIODUN O, OJINI FRANCK,ODUSOTE KAYODE A.
Accuracy of the Siriraj stroke in
differentiating cerebral haemorrhage
and infarction in african nigerians. African journal of
neurological sciences
2001; 20 (1): 1-9
7. LONGO-MBENZA B, TONDUANGU K, MUYENO K, ET
AL.
Predictors of stroke - associated mortality in Africans.
Revue Epidemiol
Santé Publique 2000; 48 (1): 31-9.
8. LIMBOLE BAKILO E.
Pronostic vital et fonctionnel des patients traités
pour accident vasculaire
cérébral aux cliniques universitaires de
Kinshasa.
Mémoire de fin de spécialisation,
Université de Kinshasa, 2001.
9. BAMFORD J.
Clinical examination in diagnosis and
subclassification of stroke. Lancet
1992; 339: 400-2.
10. EDLOW AJ, CAPLAN RL.
Avoiding pitfalls in the diagnosis of
subarachnoid haemorrhage. N Eng J
Med 2000; 342:29-36.
11. OGUN SA, ADELOWO OO, FAMILONI OB, JAIYESIMI AE,
FAKOYA EA.
Pattern and outcome of medical admission at the Ogun
State University
Teaching Hospital - A three year review. W Afr J Med
2000; 19: 304-8.
12. ALLEN CMC.
Clinical diagnosis of acute stroke syndrome. QJ Med 1983;
42: 515-23.
13. VON ARBIN M, BRITTON M, DE FAIRE U, HELMERS C, MIAH
K,
MURRAY V.
Accuracy of beside diagnosis stroke. Stroke
1981; 12:288-93.
14. BONITA R.
Epidemiology of stroke. Lancet 1992; 339:342-44.
15. HARRISON MJB.
Clinical distinction of cerebral haemorrhage and
cerebral infarction.
Postgraduate Med J 1980; 56: 629-32.
16. ADAMS HP, BROTT TA, CROSSWELL RM, FURLAN AJ,
GOMEZ CR,
GROTTA J.
Guidelines for the management of patients with acute
ischaemic stroke.
Circulation 1994; 90 (3): 1588-601.
17. WARDLAW JM.
Is routine CT in stroke unnecessary? BMJ 1994;309:1498.
18. CHALELA JA, MERINO JG, WARACH S.
Section on stroke Diagnosis and therapeutics, National
Institute of Neuro-
logical Disorders and stroke, National Institutes of
Health, Bethesda,
Maryland, USA. Curr Opin Neurol 2004; 17 (4): 447-51.
19. SANDERCOCK P, MOLYNEUX A, WARLOW
C.
Value of CT in patients with stroke: Oxfordshire
community stroke
project. BMJ 1985; 290: 193-97.
20. HAMFORD J, SANDERCOCK PAG, DENNIS MA.
Prospective study of acute cerebrovascular
disease in the community.
The Oxfordshire community stroke project 1981-1986:1
Methodology,
Demography and incident of first ever stroke. J Neurol
Neurosurg
Psychiatry 1988; 1373-80.
21. SHAMS -UR- RHEMAN, KHAN MA.
Clinical versus CT scan diagnosis in
stroke-comparative study of 50 cases.
J Ayub Med Coll Abbottabad 2002; 14(1): 2-5.
22. DIAGANA M, TRAORE H, BASSIMA A, DRUET-CABANAC M,
PREUX PM, DUMAS M.
Contribution de la tomodensitométrie
cérébrale dans le diagnostic des
accidents vasculaires cérébraux à
Nouakchott, Mauritanie. Med Trop
2002; 62 (2): 145-9.
23. POUNGVARIN N, VIRIYAVEJAKUL A, KPMONTRIC C.
Siriraj stroke score and validation study
to distinguish supratentorial
intracerebral haemorrhage from infarction. BMJ 1991; 302:
1565-67.
24. BESSON G, ROBERT C, HOMMEL M, PERRET J.
Is it clinically possible to distinguish Nonhemorrhagic
Infarct from
Haemorrhagic Stroke? Stroke 1995; 26: 1205-9.
25. SANDERCOCK PAG, ALLEN CMC, CORSTON RN, HARRISON MJG,
WARLOW CP.
Clinical diagnosis of intracranial haemorrhage using
Guy's Hospital score.
Br Med J 1985; 291: 1675-77.
26. HUNG LY, WANG PY, WANG Y, CHIA LG.
Distinction between acute hemorrhagic and acute
ischemic stroke by
Siriraj stroke score. Zhonghua Yi Xue Za Zhi. 1995; 55
(3): 248-52.
27. CELANI MG, CERAVOLO MG, DUCA E ET AL.
Was it infarction or haemorrhage ? A clinical
diagnosis by means of
the Allen score. J Neurol 1992; 239 (7): 411-13.
28. WADHWANI J, HUSSAIN R, RAMAN PG.
Nature of lesion in cerebrovascular stroke patients:
clinical stroke
score and computed tomography scan brain correlation. J
Assoc
Physician India 2002; 50: 777-81.
29. HUANG JA, WANG PY, CHANG MC, CHIA LG, YANG DY, WU
TC.
Allen Score in clinical diagnosis of intracranial
haemorrhage. Zhonghua
Yi Xue Za Zhi 1994; 54 (6): 407-11.
30. HUI AC, WU B, TANG AS, KAY R.
Lack of clinical utility of the Siriraj Stroke Score.
Intern Med J 2002;
32 (7): 311-14.
31. BADAM P, SOLAO V, PAI M, KALANTRI SP.
Poor accuracy of the Siriraj and Guy's hospital stroke
scores distinguishing
haemorrhagic from ischaemic stroke in a rural tertiary care
hospital.
Nat Med J india 2003; 16 (1): 8-12.
32 HENRY L.
Démographie, analyse et modèle. INED,
1984.
33. PRESSART R.
L'analyse démographique,
concepts-méthodes. PUF, 1983, 294pp.
34 . OMRAN AR.
The epidemiologic transition, a key of the epidemiology
of population
change. Milibank Memorial Fund Q 1971; 49: 509-38.
35. SRINATH KR, YUSUF S.
Emerging Epidemic of cardiovascular disease in developing
countries.
Circulation 1998; 97: 596-601.
36. LELO TSHIKWELA , MALENGA MP, NDOMA K, LONGO
MBENZA B.
Les accidents vasculaires cérébraux
à Kinshasa : étude tomodensito-
métrique. Panorama Méd
1993 ;4 :166-8.
37. TAMBWE M.
Facteur de pronostic des patients admis pour accidents
vasculaires
cérébraux aux cliniques universitaires de
Kinshasa.
Mémoire de fin de spécialisation,
Université de Kinshasa, 1990.
38. MUVOVA DEBO L.
Un anti-hypertenseur à la phase
aiguë de l'accident vasculaire
cérébral influence-t-il l'issue vitale?
Leçons à tirer de la pratique aux
CUK. Mémoire de fin de spécialisation,
Université de Kinshasa, 1997.
39. VIRIYAVEJAKUL A, POUNGVARIN N.
Internal medecine patient : An analysis of incidence,
mortality rates
of 27325 admissions. Siriraj Hospital Gasette 1982;
34 : 501-600.
40. BRODERICK JP.
Guidlines for the management spontaneous intracerebral
haemorrhage.
Stroke 1999; 30: 905-15.
41. SACCO RL.
Risk factor, Outcomes, and stroke subtypes for ischemic
stroke.
Neurology 1997; 49 (supp 4):
S39-S44.
42. CAPLAN LR.
Cerebral embolism in the Michael Reese stroke Registry.
Stroke 1983;
14: 530-36.
43. JOUBERT J.
The Medunsa stroke DATA Bank. An analysis of 304 patients
seen
between 1986 and 1987. S Afr Med J 1991; 80: 567-70.
44. PETTY GW.
Ischemic stroke subtypes: a population-based study of
functional
outcome, survival and recurrence . Stroke 2000;
31:1062-68.
45. TORMURA N.
Early CT findings in cerebral infarction :
obscuration of the lentiform
nucleus. Radiology 1988; 168: 463-67.
46. TRUWIT C L.
Loss of sular Ribbon: another early CT sign of acute
middle cerebral
artery infarction. Radiology 1990; 176:801-6.
47. VON KUMMER R.
Acute stroke: Usefulness of early CT findings before
thrombolytic therapy.
Radiology 1997; 205: 327-33.
48. BRYAN R N.
Diffusion- weighted imaging: to treat or not to treat?
That is the
question. A m J Neuroradiol 1998; 19: 396-97.
49. GONZALEZ RG.
Diffusion- weighted MR Imaging within 6 hours of stroke
symptom
onset. Radiology 1999; 210: 155-62.
50. NOGUSHI K.
MRI of acurate cerebral infarction: a
comparison of flair and T2
weighted fast spin-echo imaging. Neuroradiology 1997;
39: 406-10.
51. DOUEK PH, PINAUDEAU D, AMIEL M.
Tomodensitométrie x, principes,
technologie, caractéristiques de
l'imagerie. Feuillets de radiologie 1987 ; 27
(4) : 221-30.
52. MBALA MUKENDI M, TAMBWE MJ, DIKASA LN, MBUYAMBA -
KABANGU JR.
Epidémiologie clinique de
l'accident vasculaire cérébral chez l'adulte
zaïrois. Journal africain des sciences
biomédicales 1994 ; 1 (1) :3-6.
53. KABEYA JMK, LELO T, KAMBANGU M, MALENGA M, LONGO -
MBENZA B,
MBUYAMBA - KABANGU JR.
Profil du sujet à risque d'accident vasculaire
cérébral en milieu urbain
zaïrois. Journal africain des sciences
biomédicales 1995 ; 2(1) : 21-3.
54. KABUYA KALALA F., TSHUINZA MBIYE O.
Les enjeux du financement de la reconstruction de
l'Etat et de
l'économie formelle au Congo. Congo-Afrique
2004 ; 384 : 197-210.
55. PULSINELLI WA.
Enfermedades cerebrovasculares. En : Bennet CJ,
Plum Fred, editores.
Tratado de medicina interna. Vigésima edicion.
Philadelphia : Mc Graw-
Hill ; 1997 : 2376-84.
56. KOUASSI B, RENAMBOT J, PIQUEMAL M.
Accidents vasculaires
cérébraux en côte d'ivoire. CR 6e Sem. Institut
de cardiologie. Abidjan 1992 Trop Cardiol 1992 (N° sp
I): 154
57. SEEDAT TK.
Race, environment and blood pressure: The
south experience. J Hypertens
1983; 1:7-12.
58. OSUNTO KUN BO, ODEKU, E., ADELOYE RBA.
Nonemboloic ischaemic cerebravascular disease in
Nigerians.
J Neurol sci 1969; 9: 361-88.
59. CYNTHIA MC, STEIN JH.
Cardiovascular diseases and the Aging woman: Overcoming
barriers to
lifestyle changes, current women's Health. Reports 2002;
2: 366-72.
60. HENNESKENS CH.
Lessons learned from hypertension
Trials. Amer J Med-1988; 104:
505-35.
61. M'BUYAMBA - KABANGU JR, FAGARD R, LIJNEN P, STAESSEN
J,
DITU MS, TSHIANI KA ET AL.
Epidemiological study of blood pressure and hypertension in
a sample of
urban Bantu of Zaïre. J Hypertens 1986; 4: 485-92.
62. SCHENCK -GUSTFSSON K.
Risk factors of cardiovascular disease in
women. Heart beat Bulletin of
the world heart Federation, S-17176 Stockholm, Sweden,
March 2000.
63. GEHLBACH SH.
Interpreting the medical literature.
Third edition. United states of
America: Mc Graw-Hill; 1993:182
64. The VPP of diagnostic test typically decreases with the
prevalence of
disease (CHOI BCK. Causal modeling to estimate
sensitivity and specificity
of a test when prevalence changes. Epidemiology 1997;
8: 80-86.
65. BROWN RD JR, CSHIMANT, JP, SICKS JD.
Stroke incidence, prevalence and survival: secular
trends in Rochester,
Minnesota, through 1989. Stroke 1996; 27:373-80.
66. CELANI MG, RIGHETTI E, MIGLIACCI R,
ZAMPOLINI,
ANTONIRETTI L, GRANDI C F, RICCI S.
Comparability and validity of two clinical
scores in the early
differential diagnosis of acute stroke. BMJ 1994; 308:
1674-76.
67. PLUM F, PASNER JB.
Estupory coma. Segunda edicion. Mexico:
El Manual Moderno;
1982.pp14.
TABLE DE MATIERES
DEDICACE
..........................................................................................................i
REMERCIEMENTS
...........................................................................................ii
ABREVIATIONS
..............................................................................................iv
INTRODUCTION
..............................................................................................1
Objectif général
.................................................................................................4
Objectifs spécifiques
..........................................................................................
4
Hypothèses
.......................................................................................................
4
CHAPITRE 1. GENERALITES
....................................................................... 6
1.1. Rappel anatomique de la circulation
cérébrale ....................................... 6
1.1.1. Le Système artériel
.............................................................................6
1.1.2. Le système veineux
............................................................................7
1.1.3. Débit
sanguin.......................................................................................7
1.2 Types et étiopathogènies des AVC
.............................................................. 7
1.3. Les Méthodes
d'exploration..........................................................................8
1.3.1. La tomodensitométrie (TDM)
cérébrale .................................................. 9
1.3.2. Imagerie par résonnance magnétique
.................................................. 10
1.3.3. Ultrasonographie
...................................................................................
10
1.3.4. L'angiographie cérébrale
.................................................. .....................11
CHAPITRE 2. MATERIEL ET METHODES
...................................................12
2.1. Nature et période de l'étude
....................................................................12
2.2. Cadre de l'étude
..................................................
....................................12
2.3. Population de l'étude
..............................................................................
.12
2.3.1. Critères d'inclusion
...........................................................................
.12
2.3.2. Critères d'exclusion
...........................................................................
13
2.4. Approche méthodologique
....................................................................... 13
2.4.1. Choix des indicateurs
.........................................................................13
2.4.2. Technique de la scanographie cérébrale
...........................................14
2.4.3. Calcul du score de Siriraj
...................................................................15
2.4.4. Calcul du score d'Allen
................................................... ...................17
2.5. Validité interne de la présente
étude ....................................................18
2.6. Analyses statistiques
.............................................................................20
CHAPITRE III. RESULTATS
.........................................................................21
3.1. Données épidémiologiques
...................................................................... 21
3.1.1. Formation médicales
......................................................................... 21
3.1.2. Données démographiques
................................................................ 21
3.2. Données scanographiques
........................................................................22
3.3. Calcul du score de Siriraj
........................................................................ 23
3.4. Calcul du score d'Allen
.............................................................................
27
3.5. Comparaison du score de Siriraj et du score d'Allen
............................... 29
CHAPITRE IV. DISCUSSION
...................................................................... 30
4.1. Plateau technique et accessibilité
.............................................................30
4.2. Données épidémiologiques
...................................................................... 30
4.3. Validité des scores de Siriraj et d'Allen
.....................................................31
4.3.1. Score de
Siriraj....................................................................................32
4.3.2. Score d'Allen
......................................................................................
34
CONCLUSION
................................................................................................
35
RECOMMANDATIONS
.................................................................................
36
REFERENCES
..................................................................................................37
TABLE DE MATIERES
....................................................................................46
ANNEXE............................................................................................................48

| 


