UNIVERSITE DE
KINSHASA
FACULTE DE MEDECINE
DEPARTEMENT DE MEDECINE INTERNE
PLACE DE L'ECHOGRAPHIE ABDOMINALE DANS LE DIAGNOSTIC DE
LA CIRRHOSE HEPATIQUE ET DE L'HEPATOCARCINOMIE
A KINSHASA
Par
MALENGA MPAKA SERGE
Mémoire présenté en vue de l'obtention du
grade de Spécialiste en Radiodiagnostic
Directeur : Prof. Dr. LONGO-MBENZA
Benjamin
Juin 2006
INTRODUCTION
La très grande importance du foie pour le
métabolisme et pour le rétablissement des hémostases est
très bien connue.
En Afrique Sub-Saharienne en général et en
République Démocratique du Congo (RDC), les agressions
fréquentes et les étiologies variées (infectieuses,
parasitaires et toxiques) ont été décrites dans les
affections du foie (1). La cirrhose hépatique constitue une phase
évolutive ultime dans l'histoire naturelle des affections chroniques du
foie. L'hépatocarcinome ou carcinome hépato-cellulaire, le plus
fréquent des cancers primitifs du foie, survient toujours sur une
cirrhose hépatique dans plus de 90% des cas (2). Quelle que soit la
cause de la cirrhose hépatique, l'incidence de
dégénérescence est de l'ordre de 1 à 3% des cas par
ans (2).
De 1885 à 1990, la prise en charge (étiologique,
diagnostique, bilan de l'évaluation, décision médicale,
surveillance) de la cirrhose hépatique et de l'hépatocarcinome a
été fondée exclusivement sur la séméiologie
médicale, la clinique et la biologie. L'introduction de
l'échographie abdominale et l'arrivée des premiers pionniers
congolais formés à l'étranger (MATUSILA A, MANONO K, BONGO
B, LONGO MBENZA B, LELO T, NDOMA E) a propulsé dès 1990
l'échographie abdominale au rang de scanner des pauvres de la RDC, pays
sans plateau technique sophistiqués par manque de politique
adéquate d'équipements (3). L'introduction de
l'échographie abdominale à Kinshasa, a profondément
bouleversé les stratégies de diagnostic de la cirrhose
hépatique et de l'hépatocarcinome. Comme dans les pays
développés et riches, l'échographie est souvent l'examen
pratiqué en première intention, juste après l'examen
clinique, le cliché radiologique d'examen sans préparation
(Radiologie conventionnelle) et le bilan biologique de débrouillage en
cas de suspicion de masse palpable, de douleur abdominale et de bilan
biologique hépatique perturbé (4).
Dans l'investigation clinique du parenchyme hépatique,
l'échographie ou l'ultrasonographie permet d'une part de
démontrer la forme et les dimensions du foie et, d'autre part, d'en
représenter l'architecture interne (5). L'apport de l'échographie
abdominale appliquée à des pathologies générales
est déjà évident dans les pays d'Afrique Sub-Saharienne
(6-8).
Les performances de l'échographie abdominale
centrées sur les parenchymes pleins de l'abdomen (le foie, la rate, les
reins, les ganglions) sont bien connus à ce jour (9). Le carcinome
hépatocellulaire est détecté par l'échographie
abdominale qui est supérieure à la scanographie et aux tests
biologiques (10).
Pour TAKAYASU et al (11), la sensibilité pour
détecter un hépatocarcinome sur une série
rétrospective de 100 patients est proche de 80%, , la preuve
chirurgicale et biologique ou l'artériographie étant le test de
référence. En ce qui concerne la cirrhose hépatique, les
renseignements de l'échographie abdominale complètent utilement
le bilan clinique et biologique en première intention (12). Aussi la
biopsie hépatique avec étude histopathologique est très
rarement nécessaire au diagnostique de cirrhose (13).
Toutefois, l'analyse de la littérature ne montre aucun
travail publié sur les performances de la symptomatologie, de la
biologie et du diagnostic relatif à la cirrhose hépatique et
à l'hépatocarcinome, en considérant l'échographie
abdominale comme test de référence (Gold Standard).
Ce qui justifie la présente étude initiée
avec des objectifs précis.
OBJECTIF GENERAL
L'objectif général de la présente
étude vise à dégager les principales qualités des
données biocliniques et ultrasonographiques susceptibles d'être
mesurées en terme de performances diagnostiques de la cirrhose
hépatique et de l'hépatocarcinome et de discriminer ces derniers
diagnostics.
OBJECTIFS SPECIFIQUES
Pour atteindre cet objectif général, les
objectifs spécifiques suivants analysent les 5 critères de
validité diagnostique et du pouvoir discriminant de la cirrhose
hépatique et de l'hépatocarcinome remplis par les données
biocliniques :
- avoir une bonne qualité technique ;
- être reproductible dans leur
interprétation ;
- apporter une information valide ;
- être utile à la prise de décision
médicale ;
- être efficace devant le coût de
l'échographie abdominale.
CHAPITRE 1. GENERALITES
1.1. ECHOGRAPHIE DU FOIE
NORMAL
Le parenchyme hépatique présente aux ultrasons
une surface lisse si l'on excepte la région hilaire.
Les dimensions du foie normal sont difficiles à cerner
de façon pratique. Il existe en effet de nombreuses variations
anatomiques et topographiques en fonction de la morphologie du sujet. Les
brévilignes présentent constamment un foie haut situé sous
le gril droit, le lobe gauche étant peu développé
latéralement. Les longilignes par contre, présentent
parfois un foie très plat largement étendu vers la gauche dans
l'épigastre. Plusieurs auteurs ont proposé des
procédés sophistiqués de mesure du volume
hépatique, difficilement applicable en routine (14). L'étiquette
«hépatomégalie »est considérée comme
telle si le foie était palpable à l'examen clinique.
L'échostructure du parenchyme hépatique est
uniforme, fine et de relativement basse amplitude. Chez l'individu normal, elle
est soit semblable à celle du rein ou seulement légèment
plus échogène. Sur ce fond homogène se détachent
quelques échos plus amples correspondant aux ramifications
périphériques des structures portales. Les branches principales
de la veine porte sont, de façon constante, cernées par un
manchon échogène, ce qui n'est le cas pour les veines
sus-hépatiques que lorsque l'onde sonore aborde perpendiculairement la
paroi vasculaire. Le diagnostic ultrasonographique du parenchyme
hépatique normal repose donc sur cinq critères :
- absence de modification évidente de la
taille ;
- bord antérieur angulaire ;
- échostructure homogène semblable ou
légèrement plus marquée que
celle du parenchyme rénal ;
- limites vasculaires nettes ;
- particulièrement des veines
sus-hépatiques.
1.1.1. Rappel anatomique
Le foie présente une face diaphragmatique
supérieure convexe, une face viscérale inférieure
légèrement concave et inclinée et quatre Lobes : le
lobe gauche, le lobe droit, le lobe carré et le lobe de spiegel (figure
1)
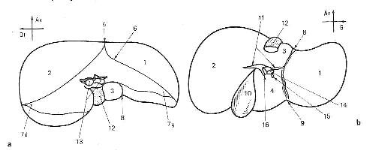
Figure 1. Anatomie du foie :
a) Face supérieur du foie (diaphragmatique)
b) Face inférieure du foie (viscérale)
1 : Lobe gauche, 2 : Lobe droit, 3 : Lobe
caudé (segment I), 4 : Lobe carré (segment IV)
5 : Ligament falciforme, 6 : Ligament coronaire,
7 : Ligaments triangulaires droit et gauche, 8 : Sillon d'Arantius,
9 : Sillon du ligament rond, 10 : Lit vésiculaire
11 : Hile hépatique, 12 : Veine cave
inférieure, 13 : Veines sus-hépatiques,
14 : Veine porte et branches, 15 : Artère
hépatique, 16 : Voie biliaire principale.
La face diaphragmatique est amarrée au diaphragme et
à la paroi Abdominale antérieure par des structures
ligamentaires. En avant, le ligament falciforme est en continuité en bas
avec le ligament rond, vestige de la veine ombilicale qui rejoint l'ombilic. En
haut, le ligament falciforme rejoint le ligament coronaire et les ligaments
triangulaires droit et gauche qui fixent le foie au diaphragme. A droite, le
ligament triangulaire est prolongé par le ligament
hépatorénal. Le ligament coronaire est en continuité avec
le petit épiploon.
La face viscérale présente plusieurs sillons et
empreintes : Le sillon du ligament rond, le sillon d'Arantius, l'empreinte
du lit vésiculaire l'empreinte de la veine cave inférieure et le
sillon du hile hépatique.
Le petit épiploon est un méso tendu du hile et
du sillon d'Arantius jusqu'au premier duodénum et le long de la petite
courbure gastrique. Le bord droit de ce méso contient le pédicule
hépatique. La capsule de Glisson recouvre le foie et s'invagine dans le
hile formant des gaines qui entourent les vaisseaux et les voies biliaires
jusqu'aux espaces portes.
Le foie reçoit une double vascularisation, à la
fois veineuse portale et artérielle hépatique dans un rapport de
2/3 et 1/3.
La veine porte se divise dans le hile hépatique au
niveau de la bifurcation portale en deux branches portales
intrahépatiques, la gauche, circulant dans la scissure ombilicale se
distribue au foie gauche, correspondant au lobe gauche et au lobe
carré ; la branche droite se distribue au foie droit correspondant
anatomiquement au lobe droit.
L'artère hépatique est le plus souvent unique,
chemine dans le pédicule hépatique en avant de la veine porte.
Le foie se draine en périphérie par les veines
hépatiques qui se jettent dans les veines sus-hépatiques droite,
médiane et gauche.
Le foie est divisé en huit segments par la
vascularisation segmentaire portale : ( Figure 2).
- le lobe caudé ou de Spiegel correspond au
segment I, limité en avant par
le hile, à gauche par le sillon d'Arantius
et, à droite et en arrière, par la
veine cave inférieure. La segmentation se
distribue ensuite selon le sens
inverse des aiguilles d'une montre ;
- le lobe gauche est divisé en deux segments : le
segment II postéro-
supérieur et le segment III
antéroinférieur ;
- le lobe carré, correspondant au segment IV,
situé entre les veines sus-
hépatiques gauche et médiane et
limité en bas par le lit vésiculaire et le
sillon du ligament rond en avant de la bifurcation
portale ;
- le lobe droit est divisé en quatre segments qui sont
séparés les uns des
autres, verticalement par le plan des veines
sus-hépatiques médiane et
droite et, horizontalement, par le plan de la bifurcation
portale. De
gauche à droite et d'avant en arrière, les
segments inférieurs sont les
segments V et VI et les segments supérieurs sont
les segments VII et
VIII. Les branches segmentaires portales traversent les
segments alors
que les veines sus-hépatiques sont en position
inter-segmentaire.






Figure 2 : Segmentation hépatique.
1.1.2. Echoanatomie
Elle est bien appréciée en échographie B
bidimensionnelle (Figure 3 et 4).
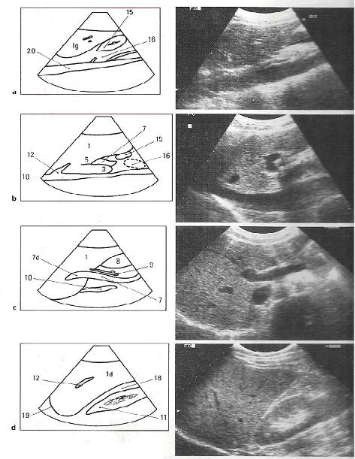
Figure 3. Coupes de référence : coupes
sagittales.
a) Coupe passant par le foie gauche et l'aorte, b) Coupe passant
par la veine cave inférieure et le tronc porte, c) Coupe passant par le
pédicule hépatique
d) Coupe passant par le foie et le rein droit
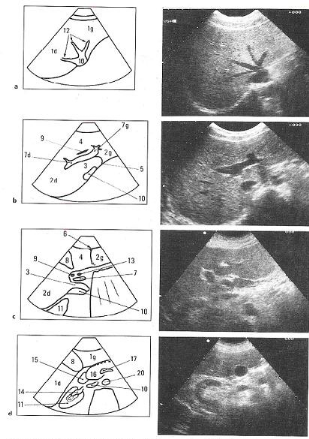
Figure 4. Coupes de référence : coupes
axiales.
a) Coupe passant par la convergence sus-hépatique b) Coupe
passant par la bifurcation portale
c) Coupe passant par le pédicule hépatique d)
Coupe passant par le foie et le rein droit
Légendes communes aux figures 2 et 3
1. Foie (1d : Foie droit, 1g : Foie gauche), 2. Lobes
hépatiques (1d : Lobe hépatique droit,
1g : Lobe hépatique gauche), 3. Segment I, 4.
Segment IV, 5. Sillon d'Arantius, 6. Sillon ligament rond
7. Tronc porte (7d : Branche droite, 7g : Branche
gauche), 8. Voies biliaires, 9. Cholédoque, 10. Veine cave
inférieure, 11. Rein droit, 12. Veines sus-hépatique, 13.
Artère hépatique, 14. Veine rénale droite, 15. Antre
gastrique et duodénum, 16. Pancréas, 17. Tronc veineux
spléno-mésaraique 18. Espace de Morisson, 19. Diaphragme, 20.
Aorte
Le volume hépatique est estimé sur des coupes
sagittales passant par l'aorte pour le foie gauche et par la ligne
médio-claviculaire droite pour le foie droit. On mesure la distance
entre le point le plus haut du dôme et le bord inférieur du foie,
comme à l'examen clinique. On considère comme anormale une mesure
du foie gauche supérieure à 100 mm et une mesure du foie droit
supérieur à 150 mm.
Les contours hépatiques sont normalement parfaitement
lisses, soulignés par un fin liséré échogène
correspondant à la capsule. Les courbures sont harmonieuses, en principe
sans encoche ni modulation, avec des empreintes épousant parfaitement
les organes de voisinage.
Le foie est mobile à la respiration et les changements
de posture. Il existe un interface de glissement entre le rein droit et le foie
dans l'espace de MORISSON. Le parenchyme hépatique est parfaitement
homogène et finement granuleux. Sa tonalité iso, hypo ou
hyperéchogène est appréciée par rapport à
celle du cortex du rein droit ; elles sont à peu près
équivalentes.
Les veines sus-hépatiques sont bien visualisées
par un balayage axial oblique. Leurs parois sont fines et
régulières et pratiquement invisibles quand la veine est
coupée tangentiellement. Le flux sanguin et l'analyse spectrale sont
étudiés en mode Doppler. La veine porte présente un
diamètre antéropostérieur normalement inférieure
à 12 mm en respiration spontanée. Son diamètre varie moins
au cours de la respiration que celui des veines sus-hépatiques. Ses
parois sont bien visibles.
L'artère hépatique n'est toujours visible en
échographie, elle est souvent repérée à son
origine, mais plus rarement dans le pédicule hépatique. Son
diamètre est inférieur à 5mm avant la naissance de
l'artère gastroduodenale.
Les voies biliaires intrahépatiques ne sont
habituellement pas visibles sauf sur certains appareils performants ou chez des
sujets âgés. Leur calibre normal est inférieur à
3mm. La voie biliaire principale est inférieure à
6 mm.
1.2. QUALITES MESUREES PAR
UNE METHODE DIAGNOSTIQUE
On doit évaluer les tests diagnostiques selon des
critères objectifs.
Cela concerne aussi bien les méthodes nouvelles avant
leur diffusion que les examens anciens comme la séméiologie
médicale et la biologie sanguine.
Une technique d'utilisation
courante peut se révéler inutile dans un contexte nouveau.
1.2.1. Avoir une bonne
qualité technique
La première qualité d'un test à
évaluer ressort du domaine technique. Le minimum que l'on doit exiger
est que le test fournisse une information valable.
Le problème relève du contrôle de
qualité. Le test mesure-t-il ce pour lequel il est utilisé ?
Est-il exact (absence d'erreur systématique) et précis (faible
variabilité) ? Montre-t-il ce qu'il est sensé montrer ?
Le test est-il facile à exécuter correctement ?
1.2.2. Avoir une
interprétation
La clinique et la biologie sanguine posent le problème
de reproductibilité, de jugement et de variabilité
d'interprétation.
La notion de concordance de réponse est importante dans
un hôpital où un même malade est examiné par
plusieurs médecins, ou lors de sa surveillance au long cours par le
même médecin.
La concordance ou la reproductibilité des tests
diagnostiques peut se quantifier par le coefficient d'agrément Kappa
(15).
1.2.3. Apporter une information
valide
On doit mesurer objectivement la qualité de
l'information fournie par le test diagnostique. Le clinicien estime les chances
qu'a le sujet d'être atteint de la maladie M. Le rôle du test
diagnostique est de modifier ces probabilités à priori afin de
pouvoir estimer, en fonction des résultats, le risque d'être
malade (valeur prédictive positive) ou de ne pas être malade
(valeur prédictive négative).
Les valeurs prédictives dépendent de deux types
de données :
qualités intrinsèques du test
(sensibilité et spécificité) et probabilité
primaire à priori, pré-test, ou prévalence de la maladie
à détecter. On doit, en évaluation , être
très précis dans la définition du signe mis en
évidence à qui on va appliquer la procédure et, surtout,
dans la façon de déterminer si le sujet est réellement
malade ou pas (16).
1.2.3.1. Définition du signe
Le signe peut être soit une variable quantitative
continue soit une variable qualitative le plus souvent à deux
classés (présence ou absence d'une affection). Les signes
doivent être parfaitement définis pour augmenter la concordance de
mesure.
1.2.3.2. Définition des patients de
l'étude
L'étude doit être testée dans un groupe de
patients, malades et non malades, reproductifs de la population cible. Cette
dernière est la population de patients qui sera susceptible de
bénéficier par la suite de ces tests diagnostiques.
Il importe d'éviter tout biais susceptible de fausser
les estimations.
1.2.3.3. Définition des malades et des non
malades
La valeur diagnostique de la clinique et de la biologie
sanguine est mesurée en comparaison avec l'échographie abdominale
ou gold standard. De même, le test à évaluer ne doit pas
contribuer à la détermination du signe réel. Les
résultats d'une étude sur la valeur diagnostique d'un test
doivent être rapportés sous forme d'indices tels que la
sensibilité et la spécificité. Soit un groupe de sujets
dont on sait, grâce au test de référence, que certains
sont malades et d'autres pas. On effectue sur ces sujets le test dont on veut
évaluer l'apport en informations et dont on suppose que la
réponse est binaire : ou normale ou pathologique.
On présente alors les résultats sous forme de
tableau à quatre cases (contingences). La sensibilité (ou taux de
vrais positifs) est la proportion de résultats pathologiques chez les
sujets malades. C'est la probabilité que le signe soit présent
chez les sujets malades. La spécificité (ou taux des vrais
négatifs) est la proportion de résultats normaux chez les sujets
non malades.
1.2.4. Etre utile à la
prise de décision
La quatrième
qualité d'un test est son utilité au diagnostic, à la
thérapeutique et au pronostic (16). Les questions suivantes doivent
être posées. Cet examen modifie-t-il le comportement
médical en termes de stratégie décisionnelle ?
Remplace-t-il d'autres examens moins performants, ou plus onéreux, ou
vient-il s'ajouter à la stratégie d'exploration actuelle ?
A-t-il modifié le choix thérapeutique ? Va-t-il permettre de
prévoir l'évolution et de formuler un pronostic ? La
stratégie optimale dépend de la fréquence de la maladie
dans la population étudiée, de la gravité et des erreurs
possibles de diagnostic et de la rationalité du décideur
(17).
Là, l'étude doit prendre en compte le
coût. Son évaluation est du domaine de l'équipe
médicale.
1.2.4.1. Etre efficace pour le malade et la
population
Il s'agit de la
capacité à produire le maximum de résultats sur
l'état de santé du malade ou de la population avec le minimum de
coût (18,19). On regroupe dans le coût aussi bien les aspects
financiers que les aspects de santé (probabilité infligée
au malade en cas d'exploration longue ou coûteuse, gravité d'un
incident iatrogène, «coût » de l'erreur ou
l'absence de diagnostic, arrêt de travail. Si on raisonne en terme
uniquement monétaire, l'analyse coût-avantage ou
coût-bénéfice permet de répondre à des
questions telles que : cette procédure vaut-elle la peine
d'être entreprise ? Son objectif est-il acceptable ?. Si par
contre on raisonne en terme de rendement, l'analyse
coût-éfficacité répond à des questions
comme :quel est le meilleur moyen pour atteindre l'objectif
fixé ? Et quelle est l'utilisation la plus efficace des ressources
limitées ?
CHAPITRE 2. MATERIEL ET
METHODES
2.1. NATURE ET PERIODE DE
L'ETUDE
La présente étude
documentaire a analysé de manière rétrospective
les dossiers médicaux des patients pris en charge pour
cirrhose hépatique et hé-
patocarcinome entre le 1er janvier 1990 et le 31
décembre 2004.
2.2. CADRE DE L'ETUDE
Le service de
gastro-entérologie du département de médecine interne,
Cliniques universitaires de Kinshasa (CUK), commune de Lemba, ville province de
Kinshasa, RDC, a servi de cadre à ce travail.
2.3. PATIENTS
Etaient éligibles
(population cible), les patients constituant les séries
consécutives admises pour différentes affections
du foie dans le cadre et durant la période d'étude.
2.3.1. Critères
d'inclusion
Ont été inclus dans la présente
étude, les patients ayant satisfait les
critères suivants :
- être de race noire sans distinction de
nationalité ni de religion ;
- avoir un dossier médical avec un diagnostic
bioclinique de cirrhose
hépatique ou
d'hépatocarcinome ;
- avoir un résultat de l'échographie
hépatique.
2.3.2. Critères
d'exclusion
Ont été finalement exclus, les patients
présentant les caractéristiques
suivantes :
- données incomplètes relatives aux
paramètres d'intérêts ;
- mauvaise qualité des images échographiques de
l'abdomen ;
- métastases hépatiques et autres affections
hépatiques.
2.4. AUTRE MATERIEL
Les autres outils de travail étaient constitués
d'un cahier registre, d'une règle plate, de cinq stylos à bille,
d'un protocole de récolte de données
(ANNEXE) et des dossiers médicaux
sélectionnés.
2.4. APPROCHE
METHODOLOGIQUE
2.4.1.Choix et collectes des
paramètres d'intérêt
Les paramètres étudiés et
colligés à partir de chaque dossier médical retenu
étaient retranscris dans la fiche précodée de collecte des
données (protocole d'étude en annexe). Il s'agissait des
paramètres cliniques d'intérêt suivants :
- identité du patient ;
- l'âge ;
- le sexe ;
- l'éthnicité ;
- les douleurs abdominales ;
- le ballonnement abdominal ;
- l'asthénie physique ;
- l'ictère ;
- la fièvre ;
- le maelena ;
- la circulation collatérale ;
- l'hépatomégalie clinique ;
- Le foie sensible ;
- la consistance ferme du foie ;
- la surface irrégulière du foie ;
- le bord tranchant ;
- la matité pré-hépatique ;
- la matité déclive ;
- le signe de flot ;
- le signe de glaçon ;
- l'ascite ;
- le diagnostic bioclinique de cirrhose et
d'hépatocarcinome.
Les paramètres biologiques sanguins
étudiés étaient les suivants :
- l'hémoglobine ;
- l'hématocrite ;
- la numération des globules blancs ;
- la vitesse de sédimentation ;
- le taux de prothrombine ;
- les transaminases hépatiques (SGOT, SGPT) ;
- la bilirubine totale ;
- la bilirubine directe ;
- la bilirubine indirecte ;
- les fibrinogène ;
Les données échographiques de l'abdomen
étaient relatives à l'hépatomégalie
échographique (augmentation du volume du foie), aux contours
irréguliers du foie, à l'échostructure
hétérogène du parenchyme hépatique, à
l'aspect macronodulaire du foie, aux diagnostics de cirrhose hépatique
et d'hépatocarcinome.
2.4.2. Examen physique
L'examen physique réalisé de manière
classique par les médecins du cadre d'étude, permettait
d'obtenir des variables cliniques.
2.4.3. Données de
l'échographie abdominale
Les patients étaient référés pour
échographie abdominale première
intention auprès des centres médicaux
suivants :
- le Centre Kinois de Radiodiagnostic (CKR), commune de
Kasa-vubu, ville de Kinshasa ;
- le Centre d'Imagerie de la Gombe (CIGO), commune de la
Gombe, ville de Kinshasa.
- le Service de radiologie, département de
médecine interne, Cliniques
Universitaires de Kinshasa, commune de Lemba, ville de
Kinshasa.
Les examens ultrasonographiques du foie étaient
réalisés par différents radiologistes en application des
principes physiques des ultrasons, en utilisant des appareils, des
matériels, des techniques d'examen et des protocoles des diagnostics
échographiques résumés ci-après.
2.4.3.1. Principes physiques des ultrasons
Les images échographiques de l'abdomen reposaient sur
les ultrasons, ondes de pression qui se propagent en provoquant localement des
variations de pression et vibrations infimes de la matière.
La réflexion entraînant une réfraction, a
aboutit aux principes de l'échographie : émission et
réception des échos. C'est le mode bidimensionnel (B) qui a
été utilisé tel que déjà
démontré dans le chapitre 1.
2.4.3.2. Prise en main de l'appareil
Les radiologistes commençaient par
sélectionner une sonde de fréquence adaptée à
l'examen pratiqué. Un gel de contact entre la sonde et la peau assurait
une bonne transmission des ultrasons.
Les données échographiques
détectées étaient stockées sous forme
numérique dans une mémoire d'images avant d'être
affichées en échelle de gris.
Sur tous les appareils existait la possibilité de
réglage de la courbe de gain d'am-
plification en fonction de la profondeur (TGM : Time Gain
Compensation). Le
rôle de l'amplification était d'assurer une
lecture satisfaisante des échos à toutes
les profondeurs en compensant l'effet de l'atténuation.
La courbe de gain dépendait des tissus traversés, de la
fréquence de la sonde connectée à l'appareil et de la
corpulence du patient. Sur tous les appareils haut de gamme, ce réglage
de la courbe de gain se faisait de façon automatique.
Tous les appareils disposaient de la
possibilité de post-traitements sur l'image : zoom sur certaines
régions de l'image, renforcement des contours, mesures de distance et de
surface , réglage de contraste en agissant directement sur la
correspondance entre niveaux du signal mémorisé et niveaux de
l'échelle de gris affichés sur l'image.
2.4.3.3. Les appareils utilisés
Les appareils utilisés étaient les
suivants :
- échographe de marque Siemens Sonoline SL1
(Allemagne) (Figure 5) avec un transducteur de 3,5MHz et un échographe
de marque ACUSON 128 XP/10 (U.S.A) (Figure 6) avec plusieurs traducteurs de
3,5MHZ, 5MHZ, 7,5MHZ, de radiologie, département de médecine
interne des cliniques universitaires de Kinshasa, ville de Kinshasa ;


Figure 5. Siemens Sonoline SL1. Figure 6.
Acuson 128 XP/10.
- échographe de marque RT x 200 (U.S.A) (Figure 7)
avec un transducteur de 3,5MHz du centre Kinois de radiodiagnostic (CKR)
commune de Kasa-vubu, ville de Kinshasa ;
Figure 7. RT x 200.
- échographe de marque TOSHIBA, modèle TOSBEE
(Japon) (Figure 8) avec un transducteur de 3,5 et de 7,5MHz et un
échographe de marque ACUSON (U.S.A) (Figure 9) avec transducteur de 3,5
et de 7,5MHz du Centre d'Imagerie de la Gombe (CIGO), commune de la Gombe.

Figure 8. TOSHIBA.
Figure 9. ACUSON.
2.4.3.4. Techniques d'examen
Les patients devaient être à
jeun depuis 8 heures, sauf en cas d'urgence, en décubitus dorsal et plus
ou moins en latéral gauche.
La sonde utilisé était de 3,5 Mhz, celles de 5
Mhz et 7,5 Mhz étaient utilisé pour étudier les contours
du foie droit et chez les individus minces.
Les médecins réalisaient des coups sagittales de
l'épigastre en sous costal droit, des coupes transversales
épigastrique, des coups obliques récurrentes sous costales droits
et Intercostales.
En présence d'une image anormale, l'étude se
faisait dans deux plans de coupes au minimum.
L'échogénicité du foie était
comparée au parenchyme rénal et splénique. La taille du
foie s'étudiait en coupe sagittale, flèche hépatique
droite sur la ligne médio-claviculaire en coupe axiale pour
l'épaisseur du foie gauche.
Il fallait également étudier les angles
marginaux inférieurs (20).
2.4.3.5. Définition opérationnelle
Le diagnostic bioclinique de cirrhose hépatique
était défini de la manière suivante :
Recherche dans l'anamnèse un terrain d'éthylisme
chronique, d'hépatite virale B
et / ou C ;
Des signes bioclinique d'hypertension portale :
Circulation veineuse collatérale, Splénomégalie,
hépatomégalie, debord hépatique dur et tranchant,
thrombopénie ;
Des signes bioclinique d'insuffisance
hépatocellulaire : Ictère conjonctival, albumine et taux de
Prothrombine abaissée, bilirubine élevé ; signes
biologiques de cytolyse (SGOT et SGPT élevé) et de Cholestase
(Gamma GT et Phosphatase alcaline élevé) (21).
Le diagnostic bioclinique
d'hépatocarcinome était défini par une altération
rapide de l'état général, une hépatomégalie
de dureté pierreuse, de surface irrégulière, parfois
nodulaire, sensible ou franchement douloureuse à la palpation, une
présence de circulation collatérale, une cirrhose
compliquée, une ascite de constitution rapide, une palpation d'une masse
à l'hypochondre droit et une élévation de l'alpha
foetoprotéine.
Au plan échographique, la cirrhose
(Figure10) était définie par des modifications dysharmonieuses de
la taille du foie, des contours hépatiques finement bosselés, des
macronodules plus faciles à visualiser que les micronodules
(1à3mm), un parenchyme hépatique étant homogène ou
hétérogène.
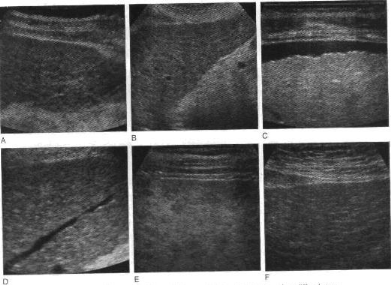
Figure 10. Cirrhose hepatique .
A et B : Echostructure Micronodulaires du Parenchyme
Hépatique
- C : Contours Irréguliers du foie et surface
Micronodulaire
- D : Veine sus Hépatique avec bord irrégulier
- E : Nodule Hypoéchogène multifocal au sein
du parenchyme Hépatique micronodulaire
- F : Fibrose hépatique
Le diagnostic échographique de
l'hépatocarcinome (Figure11) était caractérisé,
sous sa forme nodulaire par sa forme ronde ou polylobée, hypo ou
hyperéchogène avec halo hypoéchogène
périphériphérique qui est très évocateur,
sous sa forme infiltrative par une plage d'échostructure
hétérogène mal limitée, l'extension vasculaire
surtout l'envahissemnt portal se manifestant par la présence du
matériel échogène intraluminal dans la branche portale
élargie, la paroi restant visible sous la forme de liséré
hyperéchogène, extension biliaire par dilatation des voies
biliaires ntrahépatiques, extension ganglionnaire au niveau du
pédicule hépatique et coeliomésentérique.
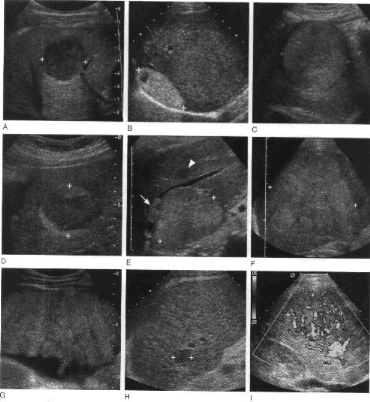
Figure 11. Hepatocarcinome.
A : Lésion hypoéchogène relativement
homogène
B : Lésion hyperéchogène avec focus
central hypoechogène
C : Lésion hyperéchogène avec halo
hypoéchogène
D : Lésion a échogenicité mixte avec
large lésion centrale hypoechogène avec
hyperechogénicité périphérique
E : Lésion hyperéchogène avec invasion
de la veine sus hépatique, petite lésion
hypoéchogène satellite en antérieur
F : Masse hyperéchogène occupant tout le lobe
droit hépatique
G : Infiltration tumorale diffuse au sein d'un foie
cirrhotique
H : Echstructure micronodulaire hépatique montrant
une masse hypoéchogène de 2cm de diamètre
I : Echographie doppler montrant l'hypervascularisation de
l'hépatocarcinome
2.5. ANALYSES STATISTIQUES
2.5.1. Exploitation des
données
Le nettoyage (épuration) systématique du
fichier a été réalisé au moyen du test
d'exhaustivité et du test de cohérence en vue de l'harmonisation
et de la validation des données.
Le test d'exhaustivité a permis de
s'assurer que tous les paramètres
étudiés ont été saisis dans le
module où ils étaient éligibles et non placés dans
un
module où ils ne devraient pas êtres.
Le test de cohérence a
été conçu en vue de détecter les
incohéren-
ces dans les informations sur un individu dans un même
module ou d'un module
à un autre.
Enfin, l'harmonisation, la validation et
l'analyse des données ont été réalisées sous
la supervision du directeur de ce mémoire (Professeur LONGO -
MBENZA).
2.5.2. Validité,
performances diagnostiques et choix décisionnels
L'évaluation des méthodes biocliniques et
des diagnostics clinique de la cirrhose hépatique et de
l'hépatocarcinome a été réalisée par leur
validité interne, la mesure de l'accord (efficience ou concordance) et
le choix décisionnel à l'aide des courbes ROC (Receiver Operating
Curves) (22). Cette valeur diagnostique des tests biocliniques a
été mesurée en comparaison avec le diagnostic réel
apporté par le test de référence ou Gold Standard
représenté par l'échographie abdominale en utilisant des
tableaux à quatre cases (contingences ou quarré latin).
La validité interne était
considérée comme la capacité de poser cor-
rectement le diagnostic de cirrhose hépatique et
d'hépatocarcinome sous forme d'indices suivants :
- la sensibilité ;
- la spécificité.
Les indices de décision médicale étaient
représentés par les valeurs prédictives (risque
d'être malade ou de ne pas être malade).
La validité externe était
définie par la reproductibilité de plusieurs tests de diagnostic,
le taux de référence, la proportion d'agrément, indiquant
la probabilité d'obtenir les mêmes résultats.
Pour ce faire, la base des formules a
été établie à partir du quarré
latin (Tableau 1).
Tableau 1. Quarré latin
Test diagnostique Test de
référence
*examen clinique échographie
abdominale Totaux
*biologie sanguine
+
-
Test + a=vrai positif
b=faux positif a+b
VP
FP
Test - c=faux négatif
d=vrai positif c+d
FN
VN
Totaux a+c
b+d a+b+c+d
VP
a
* Sensibilité = =
;
VP + FN a +
c
VN
d
*Spécificité = =
;
VN +FP d +
b
*Rapport de vraisemblance (Likelihood Ratio) :
Sensibilité
LR+ =
;
1 -
Spécificité
1 - Sensibilité
LR- =
;
Spécificité
VP
a
*Valeur Prédictive Positive, VPP = =
;
VP +
FP a + b
VN
d
*Valeur Prédictive Négative, VPN =
= ;
VN +
FN d + c
*Proportion de Classification Correcte (PCC) ou
reproductibilité (précision,
a+d
concordance brute observée, statistique Kappa) =
= Po ;
a+b+c+d
*Concordance attendue sur l'hypothèse
d'indépendance :
(a+c)(a+b)+(b+d)(c+d)
= Pa ;
(a+b+c+d)²
Po-Pa
*Le coefficient Kappa = ;
1- Pa
*Proportion d'agrément entre deux observateurs :
a
si résultat anormal, P+ =
;
a+b+c
d
si résultat normal, P- =
;
b+c+d
* Indice de Youden : l'addition de la sensibilité
et de la spécificité d'un seuil à
risques (lignes de partage) a conduit à l'Indice de
YOUDEN :
Y= (Sensibilité +
Spécificité)-1.
L'estimation du cout-éfficacité des tests
cliniques explorés se référait à la proportion des
patients référés par le clinicien à
l'échographie abdominale participait au coût à supporter
par elles-mêmes, la famille ou l'l'employé.
Par rapport à cette notion, l'importance des groupes de
patients Vrais Positif, Faux Positifs et Faux Négatifs, était un
élément qui rentrait dans l'estimation de l'efficacité
prédictive d'un test clinique (ou diagnostic clinique). Pour cette
raison, les indices suivants ont été définis :
- l'Indice de Vraie Positivité (IVP) était
égal au nombre des patients référés divi-
sé par celui des patients Vrais Positifs (expression du
Rapport Cout-efficacité
d'un test prédicteur de la maladie). Plus le nombre des
patients Vrais Positifs
était élevé, plus l'IVP diminuait et plus
le test clinique prédicteur exploré était
efficace pour le diagnostic de la maladie ;
- l'Indice de Fausse Positivité (IFP) était
égal au nombre des patients référés
divisé par celui des patients Faux Positifs. A
l'inverse de IVP, l'IFP exprimait
une charge injuste pour les patients qui étaient
inutilement référés et pour le
système de soutien (Famille, Amis, Entreprises). Plus
le nombre des patients
Faux Positifs était élevé, plus l'IFP
diminuait et plus la spécificité du test
clinique était faible pour le diagnostic de la
maladie.
Ne connaissant pas le nombre de patients non
référés à l'échographie, l'indice de Fausse
Négativité et l'indice de Vraie Négativité n'ont
pas été calculés.
La concordance était qualifiée d'excellente pour
un coefficient K entre 0,81 et 1, de bonne pour les valeurs 0,61 à 0,80,
de moyenne pour les valeurs 0,41 à 0,60, de faible entre 0,21 et 0,40,
et de mauvaise entre 0 et 0,29
(23-25).
Les tests statistiques ont été conclus avec un
risque de première espèce de 0,05. Les intervalles de confiance
ont été calculés avec le même risque de 5% (IC
95%)
2.5.3. Calculs statistiques
Les données saisies sur micro ordinateur
personnel avec le logiciel EPI INFO version 6.04, ont été
représentées par leurs moyennes +écarts-types pour les
variables quantitatives et par leurs fréquences absolues (n) et leurs
fréquences relatives ou proportions (en pourcentage) pour les variables
qualitatives.
La comparaison des proportions a été
réalisée au moyen de Yates Corrigé si c'était
nécessaire.
La comparaison des moyennes a été
effectuée par l'utilisation du Test-t de Student pour les variables
continues normalement distribuées et par l'utilisation du test-H de
Kruskall-Wallis pour les variables continues asymétriques.
L'association entre deux variables qualitatives en analyse
univariée était déterminée par le calcul du rapport
des côtes ou Odd Ratio (OR) avec son
intervalle de confiance à 95% (IC 95%) et le test de
Chi-Carré de Mantel-
Haenszel. OR était une mesure de la force ou
d'intensité de l'association statisti-
que entre deux variables.
La valeur de p<0,05 a été
considérée comme seuil de signification statistique.
CHAPITRE 3. RESULTATS
Au total, les dossiers de 200 patients ont été
examinés.
3.1. CARACTERISTIQUE
GENERALE DES PATIENTS
3.1.1. Données
démographiques
La population d'étude se répartissait en 142 hommes
et 58 femmes avec un sexe ratio proche de 3 Hommes : 1 Femme (Figure
12).
71%
29%
Hommes
Femmes
Figure 12. Répartition des patients
étudiés selon les sexes.
L'âge moyen était de 47,4 15,1
ans (extrêmes 16 ans et 82 ans).
La figure 13 répartit 196 patients
selon l'ethnicité précisée chez ces
derniers : comme il fallait s'y attendre, l'ethnie Kongo
autochtone de l'ancienne
province de Léopoldville (actuelle Kinshasa)
était surreprésentée.
58,7
%
27,1
Effectif
7,1
7,1
Kongo
Ngala Luba Swahili
N = 115
= 14 = 53 = 14
Figure 13. Répartition de l'effectif
étudié selon l'ethnicité.
3.1.2. Diagnostic
Le diagnostic de cirrhose hépatique bioclinique
était portée selon les internistes chez 134 patients (67%),
contrairement à celui des cirrhoses hépatiques
échographiques (Figure 14), reconnues chez 87 patients (43,5%).
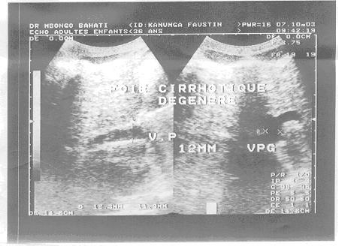
Figure 14. Cirrhose
hepatique.
Le diagnostic échographique d'hépatocarcinome
primitif était reconnu chez 61 patients (30,5%) (Figure 15).
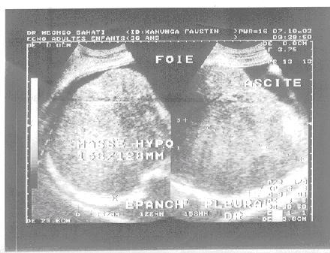
Figure 15.
Hepatocarcinome.
3.2. COMPARAISONS
3.2.1. Cirrhose
hépatique bioclinique
Les patients avec cirrhose bioclinique étaient plus
âgés (49,714,7ans) que leurs collègues sans cirrhose
bioclinique (42,715,1 ans), la différence étant statistiquement
très significative (p<0,001).
A valeurs moyennes identiques (p>0,05)
d'hémoglobine, de SGOT, et de SGPT, les valeurs moyennes
d'hématocrite, de prothrombine et d'albuminémie des cirrhotiques
étaient plus effondrées (p<0,001) que celles des patients sans
cirrhose bioclinique (Tableau 2).
Tableau 2 Cirrhose hépatique bio-clinique et
paramètres continus
Variables Présence
Absence
Cirrhose
Cirrhose
Bio-clinique
bio-clinique p
Matité pré-hépatique(cm) 8,74
10,53,8 <0,05
Hémoglobine(gr %) 9,42,7
10,23,1 0,08
Hématocrite(%) 28,77,3
33,211,7 <0,05
Prothrombine(%) 60,820,1
74,716,5 <0,001
Albuminémie(%) 26,313,3
32,710,9 <0,05
SGOT 76,372,4
89,9148,7 0,09
SGPT 49,875,6
65,8102 NS
Les hommes étaient plus (p<0,001)
fréquents (74,6 % n=106) que
les femmes (48,3 % n=28) dans ce sous-groupe de cirrhoses
hépatique bioclinique.
Le signe de glaçon et la surface
irrégulière du foie à l'examen clini-
que étaient indifférents pour discriminer la
présence de cirrhose hépatique bioclinique et l'absence de
cirrhose (p>0,05), alors que l'ascite, le maelena, les
oedèmes des membres inférieurs, la circulation
collatérale, la matité déclive, le signe de flot,
l'hépatomégalie et les bords tranchants du foie étaient
les discriminants respectifs et significatifs de la présence de la
cirrhose hépatique (Tableau 3).
Tableau 3 Cirrhose hépatique bio-clinique et variables
qualitatives cliniques
Variables Présence
Absence
Cirrhose
cirrhose
Bio-clinique n(%)
bio-clinique n(%) p
Ascite 77 (57,5)
17 (25,8) <0,0001
Méléna 17 (12,7)
2 (3) <0,05
OEdème
des membres inférieurs 50 (37,3)
6 (9,1) <0,0001
Circulation collatérale 44 (32,8)
7 (10,6) <0,001
Matité déclive 50 (37,3)
13 (19,7) <0,01
Signe de flot 36 (26,9)
7 (10,6) <0,01
Signe de glaçon 18 (13,4)
5 (7,6) NS
Hépatomégalie 78 (83)
36 (66,7) <0,05
Surface irrégulière
du foie 47 (50)
19 (35,2) NS
Bord tranchant 54 (57,4)
15 (27,8) <0,001
Sur les 134 cas de cirrhose hépatique, 46,3 % (n=62)
ont évolué par dégénérescence maligne en
carcinome hépatocellulaire. Les autres modes de décompensation de
la cirrhose hépatique était ascitique chez 58,2 % (n=78),
ictérique chez 18,7 % (n=25) et oedèmatique chez 26,9 %
(n=36).
3.2.2. Diagnostic
d'hépatocarcinome à l'échographie
Il était noté une répartition
inégale sans pour autant atteindre le seuil
de signification statistique(p=0,20) des taux
d'hépatocarcinome entre différentes
catégories d'ethnicité : le taux
étant le plus élevé au sein de l'ethnicité Luba et
le taux le plus bas au sein de l'ethnicité Ngala (Figure 16).
%
Hépatocarcinome
39,6
28,7
21,4
14,3
KONGO NGALA
LUBA SWAHILI
n = 3 n = 2
n = 21 n =3
Ethnicité
Figure 16. Répartition des taux
d'Hépatocarcinome entre les différentes catégories
d'ethnicité (p=0,20).
Seules les valeurs moyennes du fibrinogène sanguin et
de la vitesse de sédimentation du sang étaient capables de
discriminer la présence de l'hépatocarcinome à
l'échographie devant l'absence de l'hépatocarcinome, les autres
paramètres biologiques étant indifférents (Tableau 4).
Tableau 4. Données biologiques selon la
présence de l'hépatocarcinome à l'échographie du
foie
Variables Présence
Absence p
Hépatocarcinome Hépatocarcinome
Age(ans) 47,715,5
47,215 NS
Hémoglobine(g%) 9,8 2,7
9,6 2,9 NS
Hématocrite(%) 30,4 6,9
30,4 10,2 NS
Globule blanc(/mm) 9441,34263,8
8903,97275,6 NS
VS(mm/H) 75,2 34,9
54,9 40,1 <0,01
Prothrombine(%) 67,121,3
63,719,3 NS
SGOT(UI/L) 108,4151,6
69,372,3 NS
SGPT(UI/L) 67,695,5
50,180,6 NS
Bilirubine totale(mg/dl) 4,96,2
7,617,7 NS
Bilirubine directe(mg/dl) 3,33,7
6,69,2 NS
Bilirubine indirecte(mg/dl) 1,92,8
2,43,6 NS
Fibrinogène(mg/dl) 255,4222,7
48,986,3 <0,0001
Par contre, le tableau 5 montre que
l'hépatomégalie (augmentation du volume du foie), les contours
irréguliers, l'échostructure hétérogène du
foie, l'aspect macronodulaire du foie à l'échographie
étaient les discriminants très significatifs (p<0,000001) de
la présence de l'hépatocarcinome à
l'échographie.
Tableau 5. Données échographiques selon la
présence de l'Hépatocarcinome à
l'échographie
Variables Présence
Absence p
Hépatocarcinome
Hépatocarcinome
n (%)
n (%)
Hépatomégalie
échographique 57 (96,6)
56 (46,7) <0,000001
Contours irréguliers
à l'échographie 51 (83,6)
61 (43,9) <0,000001
Echostructure
hétérogène du foie 55 (90,2)
72 (51,8) <0,000001
Aspect macronodulaire
du foie à l'échographie 45 (73,8)
26 (18,7) <0,000001
Au plan clinique, les douleurs abdominales,
la circulation collatérale,
le foie palpé, le foie sensible,
l'hépatomégalie clinique, la consistance ferme, la surface
irrégulière du foie et le bord tranchant discriminaient de
manière respective et très significative la présence de
l'hépatocarcinome de l'absence de
ce diagnostic à l'échographie (Tableau 6).
Tableau 6. Données cliniques selon la présence de
l'hépatocarcinome.
Variables Présence
Absence
Hépatocarcinome
Hépatocarcinome p
n (%)
n (%)
Douleurs abdominales 46 (75,4)
80 (57,6) <0,01
Ballonnement abd. 25 (41)
47 (33,8) NS
Asthénie physique 21 (34,4)
64 (46) NS
Ictère 9 (14,8)
36 (25,9) NS
Fièvre 13 (21,3)
29 (20,9) NS
Melena 3 (4,9)
16 (11,5) NS
Circulation collatérale 24 (39,3)
27 (19,4) <0,01
Foie palpé 58 (95,1)
90 (64,7) <0,00001
Foie sensible 54 (93,1)
62 (68,9) <0,001
Hépatomégalie clinique 54 (93,1)
60 (66,7) <0,0001
Consistance ferme
du foie 34 (58,6)
20 (22,2) <0,00001
Surface irrégulière
du foie 41 (70,7)
25 (27,8) <0,000001
Bord tranchant 39 (67,2)
30 (33,3) <0,0001
3.3. VALIDITE
DIAGNOSTIQUE
3.3.1. Validité du
diagnostic clinique de la cirrhose hépatique
Le tableau 7 présente la validité diagnostique
de la cirrhose bio-clinique, l'échographie abdominale étant le
test de référence.
Tableau 7. Validité diagnostique de la cirrhose
hépatique bio-clinique, l'écho-graphie du foie étant le
test de référence
Validité
Diagnostic bio-clinique
de la cirrhose hépatique
Sensibilité (%)
88,5
Spécificité (%)
49,5
Valeur Prédictive Positive (%)
57,4
Valeur Prédictive Négative (%)
84,8
Proportion d'agrément
P +
53,4
P -
45,5
Rapport de vraisemblance
LR +
1,78
LR -
0,22
Taux de référence (coût) ( %)
67
Reproductibilité (concordance brute) (%)
67
Coefficient KAPPA
0,37
Indice de Youden (%)
40
En ce qui concerne l'estimation du cout-efficacité du
diagnostic bio-clinique de la cirrhose hépatique, l'Indice de Vraie
Positivité (IVP) était estimé à 2,5 et l'Indice de
Fausse Positivité (IFP) à 3,5.
En guise d'interprétation, le diagnostic bioclinique de
cirrhose hépatique avait une très bonne sensibilité, une
médiocre spécificité et une faible reproductivité
(précision). Le coût était aussi très
élevé, mais balancé par des bons indices de
cout-éfficacité (diminution de l'Indice de Vraie
Positivité et de l'Indice de Fausse Positivité). La Valeur
Prédictive Négative était sinon très
élevée.
3.3.2. Validité de la
séméiologie hépatique
En prenant l'augmentation du volume du foie à
l'échographie abdo-
minale comme référence,
l'hépatomégalie clinique (augmentation du volume ré-
vélée à l'examen clinique du foie)
apportait une information valide à raison de sa sensibilité
excellente, de sa bonne spécificité, des valeurs
prédictives très élevées, des rapports de
vraisemblances (LR+ tendant vers l'infini et LR- égal à
0) une très bonne concordance brute /
reproductibilité en précision : le coefficient KAPPA
était de moyenne valeur (Tableau 8).
L'Indice de Vraie Positivité (IVP) était bas et
estimé à 2,2 ; contrairement à l'Indice de Fausse
Positivité qui était élevé et estimé
à 12,5.
Tableau 8. Validité de l'hépatomégalie
clinique, l'augmentation du volume du
foie à l'échographie étant la
référence
Validité diagnostique
Augmentation du volume
de la sémiologie hépatique
du foie à l'échographie
Sensibilité (%)
93,9
Spécificité (%)
61,9
Valeur Prédictive Positive (%)
85,3
Valeur Prédictive Négative (%)
81,2
Proportion d'agrément
P+
80,8
P- 54,1
Rapport de Vraisemblance
LR+
2,47
LR-
0,09
Taux de référence (coût %)
77
Reproductibilité (concordance brute) (%)
84
Coefficient KAPPA
0,59
Indice de Youden (%)
60
OR d'hépatomégalie clinique et
hépatomégalie échographique.
Le signe sémiologique de surface
irrégulière du foie à l'examen clinique a porté
une faible information valide en comparaison avec
l'échostructure hétérogène
du foie à l'échographie et prise comme test de
référence (Tableau 9).
Tableau 9. Validité du signe clinique de surface
irrégulière du foie, l'échostructure
hétérogène du foie à l'échographie
étant le test de référence
Validité diagnostique de surface
Echostructure hétérogène
Irrégulière du foie à la clinique
du foie à l'échographie
Sensibilité (%)
57,5
Spécificité (%)
81,6
Valeur Prédictive Positive (%)
86,3
Valeur Prédictive Négative (%)
48,7
Proportion d'agrément
P+
52,7
P- 43,9
Rapport de Vraisemblance
LR+
3,2
LR-
0,51
Taux de référence (coût %)
44,5
Reproductibilité (concordance brute) (%)
66
Coefficient KAPPA
0,35
Indice de Youden (%)
40
En ce qui concerne l'estimation du cout-efficacité,
l'Indice de Vraie
Positivité (IVP) bas et estimé à
3,5 contrastait grandement avec l'Indice de fausse Fausse Positivité
élevée et estimée à 22,2. Et pourtant la force /
intensité d'association statistique entre la présence du signe
clinique « surface irrégulière du foie » et
la présence de l'échostructure hétérogène du
foie à l'échographie était très forte : OR= 6
IC 95% 2,7 - 14,3 ; p<0,00001.
3.3.3. Validité
diagnostique de la sémiologie clinique et échographique devant le
diagnostique d'hépatocarcinome
3.3.3.1. Sémiologie clinique
Le tableau 10 présente la validité diagnostique
de certains signes Cliniques relatifs au foie, l'hépatocarcinome
échographique étant le test de référence.
Tableau 10. Sémiologie clinique du foie,
l'hépatocarcinome à l'échographie étant le test de
référence
Validité Circulation Bord
Surface Consistance hépatomég foie douleur
diagnostique collatérale tranchant
irrégulière ferme clinique sensi abdom.
Se (%) 39,3 67,2 70,6
58,6 93,1 93,1 75,4
Sp (%) 80,5 66,7 72,2
77,7 33,3 31,1 42,4
VPP (%) 47 56,5 62,1
62,9 47,3 46,5 36,5
VPN (%) 75,1 75,9 79,2
74,4 88,2 87,5 79,7
P + 27,2 44 49
44 46 45 32,6
P - 63,6 55 61
61 32 29,7 38,3
LR + 2 2
2,53 2,68 0,26 1,35 1,29
LR - 0,75 0,49 0,40
0,53 0,21 0,23 0,59
T.de Réf.(%) 26 47 44,5
36 77 78 63
Reprod.(%) 68 67 71
70 57 55 53
K 0,2 0,33
0,43 0,36 0,23 0,20 0,15
Youden(%) 20 34 43
37 26 24 17
En guise d'interprétation, seuls les signes cliniques
hépatomégalie clinique et foie sensible comportent une excellente
sensibilité et un coût élevé
(taux de référence). La reproductibilité
est bonne pour la surface irrégulière du foie, mais le
coefficient Kappa est médiocre pour l'ensemble des signes cliniques
explorés, mais la Valeur Prédictive Négative est
très élevé pour l'ensemble de ces signes.
Le tableau 11 résume l'estimation
efficacité-cout et la force / intensité statistique entre les
signes explorés et l'hépatocarcinome.
La force statistique est très significative et plus
élevé pour l'hépatomégalie clinique, le foie
sensible et la surface irrégulière du foie. Mais les valeurs
d'IVP et IFP sont plus diminuées pour l'hépatomégalie
clinique, le foie sensible et les douleurs abdominales.
Tableau 11 Efficacité-cout et force statistique entre la
sémiologie clinique et
L'hépatocarcinome à l'échographie.
Sémiologie
Efficacité-cout OR
clinique
(IC 95%)
Circulation collatérale IVP = 8,3
2,7**
IFP = 7,4
(1,4 - 5,2)
Bord tranchant IVP = 5,1
4,1****
IFP = 6,7
(2 - 8,3)
Surface irrégulière IVP = 4,9
6,2****
IFP = 8
(3 - 13,1)
Consistance ferme IVP = 5,9
4,9****
IFP = 10
(2,3 - 10,9)
Hépatomégalie clinique IVP = 3,7
6,7****
IFP = 3,3
(2,4 - 23,5)
Foie sensible IVP = 3,7
6***
IFP = 3,2
(2,1 - 21,3)
Douleurs abdominales IVP = 4,3
2,3**
IFP = 2,5
(1,2 - 4,5)
** :p<0,01
*** :p<0,001 **** :p<0,0001
3.3.3.2. Sémiologie échographique
Le tableau 12 montre que dans le diagnostique de
l'hépatocarcinome à l'échographie, la sensibilité
est excellente pour l'augmentation de volume du foie à
l'échographie et pour l'échostructure
hétérogène du foie à l'échographie alors que
la spécificité est très bonne uniquement pour l'aspect
macronodulaire du foie à l'échographie.
Tableau 12. Sémiologie échographique,
l'hépatocarcinome échographique Etant le test de
référence.
Validité Augmentation du
aspect échostructure
Diagnostique du foie à l'écho.
macronodulaire hétérogène
Se (%) 96,6
73,7 90
Sp (%) 53,3
81,2 48
VPP (%) 50,4
63,3 43
VPN (%) 96,9
87,5 92
P + 50
52 41
P - 52
73 46
LR + 2
3,9 1,7
LR - 0,06
0,32 0,21
Taux de reference(%) 63,1 36
64
Reproductibilité(%) 68
79 61
K 0,41
0,52 0,29
Youden (%) 50
55 40
La valeur prédictive négative est excellente
pour l'augmentation du volume du foie à l'échographie et
l'échostructure hétérogène du foie à
l'échographie. Toutefois le coefficient Kappa suggère une
concordance médiocre.
L'efficacité coût avec des valeurs
diminuées d'IVP et d'IFP et une
force statistique très significative et très
élevée pour la sémiologie échographique,
suggère la performance diagnostique de l'augmentation du volume du foie
à l'échographie, de l'aspect macronodulaire à
l'échographie et de l'échostructure
hétérogène du foie à l'échographie dans la
prédiction de l'hépatocarcinome à l'échographie
(Tableau 13).
Tableau 13. Efficacité-cout et forces statistiques
entre la sémiologie échographique et
l'hépatocarcinome.
Sémiologie
Efficacité-cout OR
échographique
(IC 95%)
Agmentation du volume IVP = 3,5
32,1******
du foie à l'échographie IFP =
3,57 (8,8 - 203,5)
Aspect macronodulaire IVP = 4,4
12*****
du foie à l'échographie IFP = 7,7
(6 - 25)
Echostructure hétérogène IVP =
3,6 8,5******
du foie à l'échographie IFP = 0,4
(3,6 - 22,9)
***** :p<0,00001
****** :p<0,000001.
3.3.4. Choix décisionnel dans la
prédiction de la cirrhose hépatique à l'échographie
après dosage des transaminases.
La figure 17 montre que
les transaminases SGOT ne possèdent pas
une bonne capacité ROC pour la cirrhose
hépatique à l'échographie dans la population
étudié.
%
Sensibilité
1 - Spécificité (%)
SUD-EST
SUD-OUEST
NORD-OUEST
NORD-EST
100
81
66
64
49
42
40
30
26
O
=30,2
=45
=48
=55
=60
=65
=75
=85
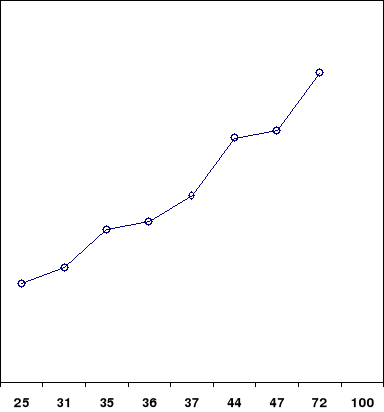
Figure 17. Courbe ROC illustrant la
prédiction à l'échographie par les taux de SGOT à
différents seuils : = 30,2UI/ml, = 24 UI/ml, = 45 UI/ml, = 48
UI/ml, = 55 UI/ml, = 60 UI/ml, = 65 UI/ml, = 75 UI/ml et = 85 UI/ml
%
Sensibilité
NORD-EST
NORD-OUEST
1 - Spécificité (%)
SUD-OUEST
SUD-EST
100
78
65
56
43
40
35
26
15
0
= 16
= 24
= 30
= 35
= 40
= 45
= 50
= 65
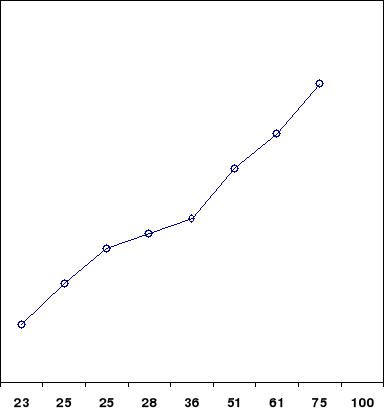
Figure 17. Courbe ROC illustrant la
prédiction de la cirhose hépatique à l'échographie
par les taux de SGPT à différents seuils : = 16UI/ml, = 24
UI/ml, = 30 UI/ml, = 35 UI/ml , = 40 UI/ml, = 45 UI/ml, = 50 UI/ml et = 65
UI/ml.
CHAPITRE 4.
DISCUSSION
La présente étude a analysé les
performances diagnostiques des données biocliniques devant la cirrhose
hépatique et l'hépatocarcinome.
L'échographie abdominale a été le test de
référence à cause de sa sensibilité très
élevée (11) et de l'indication de plus en plus rare de la biopsie
hépatique avec étude histopathologique (13). L'opportunité
de l'échographie en pathologie hépatique est d'ailleurs reconnue
comme le scanner des pauvres (3).
La validité diagnostique de l'échographie
hépatique est aussi reconnue dans le diagnostic des abcès
amibiens du foie dans d'autres pays africains (5-8). Mais telle n'est pas le
cas de la validité diagnostique des données biocliniques devant
la cirrhose hépatique et le cancer primitif du foie, anomalies les plus
fréquemment rencontrées à Kinshasa (26).
4.1. DONNEES
DEMOGRAPHIQUES
Dans cette population d'étude, la
vulnérabilité de l'homme est très marquée dans cet
ensemble des cas de cirrhose hépatique et
d'hépatocarcinome :
Le sexe ratio était de 3 hommes :1 femme. Cette
vulnérabilité du sexe masculin est aussi rapportée chez
des patients italiens avec cirrhose hépatique (27).
La consommation excessive de l'alcool est plus
rapportée chez l'homme que chez la femme (28-29). La prédominance
du cancer primitif du foie dans le sexe masculin est établie
(30-35).
Les hommes paraissent plus exposés au risque
cirrhogène que les femmes, mais dans une population de cirrhotique, le
risque de transformation néoplasique semble identique dans les deux
sexes (36).
L'hypothèse d'une intervention hormonale, loin
d'être concluante, a néanmoins été
suggérée (37). Mais l'hyperoestrogénie physiologique en
Ouganda (37) ne met pas à l'abri du cancer primitif du foie et les
essais d'oestrogénothérapie à Dakar n'ont eu aucun effet
concluant (37).
Comme démontrés ailleurs en Afrique, les
patients souffrants de cirrhose hépatique et de cancer primitif du foie
soit des adultes jeunes (29,30,38). En Europe au contraire, les patients sont
plus âgés autours de 60 ans (33).
4.2. PARAMETRES
BIOCLINIQUES DISCRIMINANTS DE LA CIRRHOSE
HEPATIQUE
La matité pré-hépatique, la baisse de
l'hématocrite, l'hypoalbuminémie, l'hypothrombinémie,
l'ascite, le maelena, les oedèmes des membres inférieurs, la
circulation collatérale, la matité déclive, le signe de
flot, les bords tranchants du foie et l'hépatomégalie clinique
gardent leurs valeurs discriminantes classiques de la cirrhose des patients
examinés. Par contre les transaminases SGOT et SGPT, le signe de
glaçon et la surface irrégulière du foie ne
présente aucun pouvoir discriminant de la cirrhose hépatique.
La non perturbation des tests hépatiques (SGOT et
SGPT) a été déjà rapportée chez les
africains cirrhotiques de Bangui en Centrafrique (28).
4.3. PARAMETRES
BIOCLINIQUES DISCRIMINANTS DU CANCER
PRIMITIF DU FOIE
Ce travail démontre une susceptibilité de
l'ethnicité Luba vis à vis de l'hépatocarcinome,
contrairement aux études antérieures incriminants
l'ethnicité Kongo (ressortissant de l'ancienne province de
Léopoldville éclatée en province de Bandundu et du Kongo
central (39).
On ne note aucune anomalie significative des tests
hépatiques chez les patients avec hépatocarcinome. Seule
l'élévation de fibrinogène, de la vitesse de
sédimentation, le foie sensible, la circulation collatérale,
l'hépatomégalie, la surface irrégulière du foie, la
consistance ferme du foie et le bord tranchant du foie se
révèlent des signes discriminants du cancer primitif du foie.
Ceci suggère la transformation maligne de la cirrhose hépatique
dans la majorité des cas.
La pratique gastroentérologique est fort limitée
par l'absence des marqueurs tumoraux (& foetoprotéine, D gamma
Carboxy prothrombine, ACE) non abordable par leur coût
élevé.
Ce travail souligne donc le caractère discriminant de
l'ensemble des caractéristiques échographiques du foie devant la
cirrhose hépatique (27,40-42) telles que l'hépatomégalie
échographique, le contour irrégulier du foie à
l'échographie et l'aspect macronodulaire à l'échographie
(43).
Le couplage du Doppler à l'échographie aurait
permis la définition de l'hypertension portale et la thrombose de la
veine porte (44) en cas de cirrhose hépatique et /ou cancer
primitif du foie.
4.4. VALIDITE DIAGNOSTIQUE
DES DONNEES BIOCLINIQUES
A notre connaissance, il
n'existe pas une étude ayant analysée la validité de la
sémiologie hépatique et de la biologie sanguine hépatique
de routine dans le diagnostic de la cirrhose et du cancer primitif du foie,
l'échographie hépatique étant le test de
référence.
4.4.1. Chez les patients
avec cirrhose hépatique
Le diagnostic bioclinique
de cirrhose hépatique comporte une médiocre
spécificité, une faible reproductivité (précision)
et un coût très élevé en dépit de sa
très bonne sensibilité. Seule, l'hépatomégalie
clinique présente une très bonne sensibilité, une bonne
spécificité, des valeurs prédictives positive et
négative très élevées en débit d'un
coefficient KAPPA modéré et d'un coût très
élevé.
La surface irrégulière du foie à l'examen
clinique paraît inutile dans le diagnostic de la cirrhose à cause
d'une faible sensibilité et d'un coefficient KAPPA très bas.
4.4.2. Chez les patients
avec cancer primitif du foie
Seuls les signes cliniques,hépatomégalie
clinique et foie sensible, comporte une excellente sensibilité et un
coût élevé (taux de référence) dans le
diagnostic du cancer primitif du foie.
CONCLUSION
Le diagnostic clinique et
biologique sanguine hépatique de routine semble limité dans le
diagnostic certain de la cirrhose hépatique et de
l'hépatocarcinome. L'échographie abdominale devrait être
obligatoire dans l'évaluation diagnostique des affections chroniques du
foie telles que la cirrhose hépatique et l'hépatocarcinome.
RECOMMANDATIONS
Le terme de ce travail, nous tenons à formuler quelques
recommandations.
1. A l'autorité sanitaire publique
· De doter notre système sanitaire au niveau des
hôpitaux de référence, de zone de santé ainsi que
des hôpitaux Universitaires de bons échographes de haute
résolution muni de système Döppler couleur comportant au
moins une sonde de 3,5MHZ et de 7,5MHZ.
· De disposer des bourses de formation et recyclage pour
échographistes dans le domaine hépatique car les aberrations
diagnostiques malheureusement courante dans le chef de non initiés sont
de nature à jeter le discrédit sur un outil éminemment
précieux entre de main formé.
2. Aux cliniciens
· D'informer les échographistes des circonstances
de la demande, d'une anamnèse particulière, des données
cliniques et biologique contributives et de préciser le but de
l'examen.
· De bien tenir les dossiers des malades afin de
permettre aux futurs chercheurs d'avoir des éléments pour leurs
recherches.
3. Aux échograhistes
· D'exiger la confection parfaite des bons de demande
d'examen échographique avec clinique complète et/ou
biologique.
· D'analyser le foie dans sa totalité, suivant
toutes les coupes possibles afin de faire ressortir tous les
éléments nécessaire pour le diagnostic des pathologies
chronique concernant le foie.
REFERENCES
1. JANSSENS PG, KIVITS M ET VUYLSTEKE
J.
Médecines et hygiènes en Afrique centrale
De 1885 à nos jours
Volume II
Fondation Roi Baudouin, Bruxelles 1992 :713-29.
2. MORICE V.
Foie et voies biliaires : Cancer du foie.
CHU-Pitié-Salpetrière,
hépato-gastro-enterologie.
3. BAHATI M
Réflexions d'un échographiste africain.
J.E.M.U. 1988 ;8, n°5 :213-4.
4. BONNIN A.
Imagerie médicale. Formation. Echographie
Masson, Paris, 1993.
5. DARDENNE AN.
Ultrasonographie du foie, des voies biliaires, du
pancréas et de la rate
Louvain Méd 1984 ;103 :S13-S23.
6. BOCO V, HOUTONJI A.
Echographie et abcès amibien du foie au CNHU de
Cotonou : A propos de
33 cas.
Cahier Santé 1996 ;6 :157-60.
7. DUQUESNE J, NGIRABANYGINYA A.
Evolution échographique des abcès
amibiens hépatiques :Place actuelle de
La ponction évacuatrice
J. Radiol. 1990 ;71 (4) :279-85.
8. FLAGENT J, PERROT N, BERL L et
al.
Aspect échographique des abcès amibiens du
foie : A propos de 22 cas
J. Radiol. 1982 ;63 (5) :305-9 .
9. AMOURETTI M., DESSEIGNE F., KUNSTLINGER et
al.
Echographie abdominale (pelvis exclu) en première
intention :Indications
Sommaires.
10. HELENON O ET BICLET P.
Imagerie des tumeurs du foie
Ebsenier SAS, Paris, 2003.
11. TAKAYASU K., MORIYAMA N., MURAMATSU
Y.,MAKUUCHI
HASEGAWA H., OKAZAKI N et al.
The diagnosis of small hepatocellular carcinoma :
efficacy of various
Imaging procedures in 100 patients
AJR Am. J. Roentgenol. 1990 ;155 :49-54.
12. ZWIEBEL WJ.
Sonographic diagnosis of diffuse liver
disease
Semin. Ultrasound CT MR 1995 ;16 : 8-15.
13. MORICE V.
Foie et voies biliaires : Cirrhoses
CHU-Pitié-Salpetrière,
Hépato-gastro-enterologie.
14. WEIL F.
L'ultrasonographie en pathologie digestive
Vigot, Paris, 1987.
15. COHEN J.
A coefficient of agreement for normal scales
Educat. Psychol. Measurement,
1960 ;20 :37-40.
16. GREMY F.
Information
médicale : Introduction à la méthodologie en
médecine et
Santé publique.
Flammarion médecine-science, Paris
1987 :269-77.
17. ALPEROVITCH A., LEMINOR M.
Quelques remarques sur la notion de stratégie
diagnostique optimale.
Radiol J. CEPUR 1982 ;2 :33-7.
18. BERTRANT P.
Comment évaluer un examen d'imagerie
Rev. Im. Med 1991 ;2 :399-401.
19. GRENIER B.
Décision médicale : analyse et
stratégie de la décision dans la pratique
Médicale
Masson, Paris 1990 ;246.
20. DARNAULT P., OLIVIE D., MEKDJIAN
S.
Echoanatomie du foie, de la vésicule et des voies
biliaires
CHU RENNES, CHRU - LILLE.
21. MENNECIER D.
Pronostic de l'hypertension portale : hémorragie
digestive par rupture des
varices oesophagiennes.
Hépato-gastro. Vol. 5, n°5, Sep-Oct. 1998 : 371 -
7.
22. SWETS J.A.
ROC analysis applied to the evaluation of
medical imaging techniques
Invest Radiol 1979 ;14 :109-121.
23. MEGNIGBETO AC., NIAKARA A., NEBIE LVA.,
OUEDRAOGO
NA., ZAGRE NM.
Validation de la méthode de mesure de la tension
artérielle pour une
Enquête en population sur HTA chez le noir africain.
Cahier d'études et de recherches francophone SANTE,
2002 ;12 :314.
24. GRENIER B.
La mesure de la qualité de vie en pédiatrie.
In : Décision thérapeutique
Et qualité de vie. Paris : John Libby Eurotext,
1992 :74-82.
25. FERMANIAN J.
Mesure de l'accord entre deux juges : cas qualitatif.
Rev. Epidémiol. Santé publique
1984 ;32 :140-7.
26. MBONGO B.
Profil de la pathologie hépatique observée en
échographie à l'hôpital
Saint Joseph de Kinshasa
Panorama Médical 1997 vol II n°2-3.
27. D'ONOFRIO M., MARTONE E., BRUNELLI S.,
FACCIOLI N.,
ZAMBONI G., ZAGNI I., FATTOVICH G., POZZI MUCELLI
R.
Accuracy of Ultrasound in the detection of liver fibrosis in
chronic
Viral hepatitis.
Radiol. Méd (Torino) 2005 Oct. ; 110 (4) :
341-8.
28. YASSIBANDA S., KOFFI B., YANGUE N. et
al.
Les hépatomégalies à l'hôpital de
l'amitié de BANGUI
Mali Médical 2004 T XIX.. 1-7.
29. LESI OA., KEHINDE MO., ANOMNEZE
EE.
Chronic liver disease in Lagos : a clinicopathological
study.
Niger
30. EBARA JR.
Etude épidémiologique du cancer primitif du
foie au Congo.
A propos d'une statistique hospitalière de 181 cas.
Thèse de Médecine Brazzaville 1982.
31. BOUTIN JP., POTTERMAN F., ALANDRY G., CARTEL
JL.,
SPIEGEL A., ROUX J.
Epidémiologie du cancer primitif du foie en
Polynésie française.
Bull. Soc. Pathol. Exot. 1990, 83 : 596-602.
32. BRUNETON J., DAREVILLE X., FENART D.,
CARAMELLA ,
ROUX P., OCELLI J., BOURRY J.
Les masses hépatiques à l'échographie. A
propos de 400 cas.
J. Radiol. 1982, 63 : 184-7.
33. ATTALI P., PROD'HOMME S., PELLETIER G., PAPOZ
L.,
BUFFET C., ETIENNE P.
Carcinome hépatocellulaires en France.
Aspects cliniques, biologiques et
Virologiques chez 197 malades.
Gastroenterol. Clin. Biol. 1978 :2 :679-88.
34. ALLAH LOUADIO E., LOHOUES KOUAKOU MJ., ASSI
C.,
BA N., TROH E., BATHAIX F. et al.
Quelles indications pour la ponction biopsie
hépatique en 1990-2000
Dans un service de médecine et
d'hépato-gastroenterologie en milieu
Africain : à propos de 57 cas.
Rev. Int. Méd. 2000 ;2 :126-32.
35. VOHITO MD., VOHITO JA., IVANOVA L.
Hépatites virales. Etude de 90 cas hospitalisés
à Bangui.
Méd. Afr. Noire 1980 ;27 :5
36. LE BRAS M., TRICOLAT R., CLERC M., LOUBIERE
R.,
BEDA., BERTRAND E.
Les facteurs étiologiques du cancer
primitif du foie en Cote d' Ivoire
Gastroenterol. Clin. Biol. 1978 ;2 :679-88.
37. PAYET M., SANKALE B.
Les cancers du foie et du pancréas chez le noir
africain.
Méd. Afr. Noire 1971 ;18 :215-26.
38. IBARA JR., OSSENDZA A., OKOUO M., DEBY
GASSAYE,
NGOMA PH., MANIBOUANA.
Les cancers primitifs du foie au Congo, étude
hospitalière de 558 cas.
Médecine d'Afrique Noire 1999 ;46 :394-7.
39. MUZEKE A.
Contribution à l'étude de l'association du
cancer primitif du foie et de la
cirrhose
Mémoire de fin spécialisation en médecine
interne ; Déc.1976.
40. SHEN L., LI JQ., ZENG MD., LU LG., FAN
ST.,BAO H.
Correlation between ultrasonographic and
pathologic diagnosis of liver
Fibrosis due to chronic virus hepatitis.
World J Gastroenterol. 2006 Feb 28 ;12
(8) :1292-5.
41. COLLI A., COLUCCI A., PAGGI S., FRAQUELLI M.,
MASSIRONI S., ANDREOLETTI M., MICHELA V., CONTE
D.
Accuracy of a predictive model for severe
hepatic fibrosis or cirrhosis in
Chronic hepatitis C.
World J Gastroenterol ,2005 Dec 14 ;11
(46) :7318-22.
42. YAN G., DUAN Y., RUAN L., CHAO T., YANG
Y.
A study on the relationship between
ultrasonographic score and clinical
Score (MELD, CPT) in cirrhosis.
Hepatogastroenterology, 2005 Sept-Oct ;52
(65) :1329-33.
43. DI LELIO A., CESTARI C., LOMAZZI A., BERETTA
L.
Cirrhosis : Diagnosis with sonographic study of the
liver surface.
Radiology 1989 ; 172 : 389-92.
44. PUTTERMANS T.
Echographie Doppler couleur des shunts hépatiques
porto-systémiques.
JEMU 1995, 16 n°4 :153-63.
TABLE DES MATIERES
DEDICACE
................................................................................................i
REMERCIEMENTS....................................................................................ii
INTRODUCTION
1
OBJECTIF GENERAL
3
OBJECTIFS SPECIFIQUES
3
CHAPITRE 1. GENERALITES
4
1.1. ECHOGRAPHIE DU FOIE
NORMAL
4
1.1.1. Rappel anatomique
5
1.1.2. Echoanatomie
8
1.2. QUALITES MESUREES PAR UNE METHODE
DIAGNOSTIQUE
11
1.2.1. Avoir une bonne qualité
technique
11
1.2.2. Avoir une
interprétation
12
1.2.3. Apporter une information
valide
12
1.2.4. Etre utile à la prise de
décision
14
CHAPITRE 2. MATERIEL ET
METHODES
16
2.1. NATURE ET PERIODE DE
L'ETUDE
16
2.2. CADRE DE L'ETUDE
16
2.3. PATIENTS
16
2.3.1. Critères
d'inclusion
16
2.3.2. Critères
d'exclusion
17
2.4. AUTRE MATERIEL
17
2.4. APPROCHE METHODOLOGIQUE
17
2.4.1.Choix et collectes des
paramètres d'intérêt
17
2.4.2. Examen physique
19
2.4.3. Données de
l'échographie abdominale
19
2.5. ANALYSES STATISTIQUES
27
2.5.1. Exploitation des
données
27
2.5.2. Validité, performances
diagnostiques et choix décisionnels
27
2.5.3. Calculs statistiques
31
CHAPITRE 3. RESULTATS
33
3.1. CARACTERISTIQUE GENERALE DES
PATIENTS
33
3.1.1. Données
démographiques
33
3.2. COMPARAISONS
35
3.2.1. Cirrhose hépatique
bioclinique
35
3.2.2. Diagnostic d'hépatocarcinome
à l'échographie
37
3.3. VALIDITE DIAGNOSTIQUE
41
3.3.1. Validité du diagnostic
clinique de la cirrhose hépatique
41
3.3.2. Validité de la
séméiologie hépatique
42
3.3.3. Validité diagnostique de la
sémiologie clinique et échographique devant le diagnostique
d'hépatocarcinome
45
CHAPITRE 4. DISCUSSION
52
4.1. DONNEES DEMOGRAPHIQUES
52
4.2. PARAMETRES BIOCLINIQUES DISCRIMINANTS
DE LA CIRRHOSE
53
4.3. PARAMETRES BIOCLINIQUES DISCRIMINANTS
DU CANCER
54
PRIMITIF DU FOIE
54
4.4. VALIDITE DIAGNOSTIQUE DES DONNEES
BIOCLINIQUES
55
4.4.1. Chez les patients avec cirrhose
hépatique
55
4.4.2. Chez les patients avec cancer
primitif du foie
55
CONCLUSION
56
RECOMMANDATIONS
56
REFERENCES
58
TABLE DES MATIERES
............................................................................65



