|
Sommaire :
Chapitre I :
Introduction..........................................................................................2
Chapitre II :
Généralités.....................................................................3
II.1. La maladie de
Behçet...................................................................3
II.1.2
Prévalence...............................................................................4
II.1.3
Etiopathogénie........................................................................
4
II.1.4 Mécanismes physiopathologiques de la maladie de
Behçet.....................5
II.1.5
Thérapie....................................................................................7
II.2. Les
cytokines...............................................................................9
II.2.1. Les
interférons...........................................................................9
II.2.2. L'interféron gamma
(IFNã)............................................................9
II.3. Les
immunoglobulines ..................................................................13
Chapitre III : Matériels et
méthodes........................................................15
III.1.
Matériel.....................................................................................15
III.2.
Méthodes.................................................................................15
III.2.1. Etude de la production de l'IFNã in
vivo...........................................15
III.2.1.1. Dosage de l'IFNã par la technique Elisa
sandwich..............................15
III.2.2. Etude de la production des immunoglobulines
sériques (IgM, IgG et IgA)...16
III.2.2.1.Dosage des immunoglobulines sériques (IgM,
IgG et IgA) par Immunonéphélémétrie
Laser..................................................................16
III.3. Etude
statistique...........................................................................18
Chapitre IV : Résultats et
discussions.......................................................19
Chapitre V : Discussion
générale............................................................21
Chapitre VI :
Conclusion.....................................................................22
Chapitre VII :
Bibliographie..................................................................23
Chapitre I
Introduction
I. Introduction:
Le syndrome de Behçet est une pathologie
endémique. C'est une vascularité multisystémique
caractérisée par des désordres immunitaire et
inflammatoire. Parmi les manifestations cliniques les plus fréquents de
cette maladie : l'uvéite et l'aphtose bipolaire.
Son étiologie reste inconnue car il n'y a pas de signes
spécifiques qui permettent de la reconnaître. Plusieurs
éléments interviennent dans l'apparition de la maladie de
Behçet (MB), dont une susceptibilité
génétique :
association génétique entre la maladie de
Behçet et HLA-B51, gène MICA (major histocompatibility complex
class I chain related gene) et gène du TNFá ,des facteurs
environnementaux (infections virales et/ou bactérienne), des anomalies
de la réponse inflammatoire (protéines du choc thermique,
dysrégulation de la production de NO) et des anomalies de
l'immunité : les lymphocytes CD4+ et CD8+ produisent des cytokines
pro-inflammatoires ( l'IL2, l'IFNã , l'IL6, l'IL8, l'IL12 et le
TNFá).
Les cytokines sont des médiateurs autocrines,
endocrines, et paracrines apparaissant désormais comme un langage
universel dans le dialogue muni entre les différentes cellules de
l'organisme. Elles peuvent modifier, induire ou supprimer les fonctions de
nombreux types cellulaires.
Deux voies distinctes de réponses des lymphocytes Th
ont été mises en évidence au cours de la MB : les
lymphocytes Th-1 produisent essentiellement l'IFNã qui joue un
rôle important dans divers processus immunitaires, il module la
prolifération, la différentiation et l'activité des
cellules immunitaires. Les concentrations sériques de ces cytokines
sont augmentées au cours de la maladie de Behçet et
l'augmentation du nombre des lymphocytes Th-1 dans le sang
périphérique est corrélée à
l'activité de la maladie. Les cytokines marqueurs de la voie Th-2 sont
IL4, IL10, IL5. Plusieurs arguments suggèrent que l'immunité
humorale participe à la physiopathologie de la maladie de Behçet
malgré que le nombre de lymphocytes B de patients soit normal.
Parmi les anomalies de l'immunité humorale
décrites au cours de la maladie de Behçet,
l'élévation de taux des immunoglobulines sériques.
L'objectif de ce travail est de suivre d'une part,
l'activité de l'IFNã in vivo chez des patients atteints
de la MB en activité (poussée inflammatoire) vue son implication
dans les mécanismes immunopathologiques antérieurement
rapportée dans la MB par de nombreux auteurs (Guenane, 2001; Guenane et
al, 2006 ; Djaballah-Ider, 2008), et d'autre part, de situer la production
des immunoglobulines circulantes (IgM, IgG, IgA) vue le rôle non
négligeable du lymphocyte B dans la MB.
Cette étude s'articule autour des axes suivants :
Ø Etude de la production de l'IFNã in
vivo par la méthode Elisa sandwich.
Ø Etude de la production des immunoglobulines
sériques (IgM, IgG, IgA) par Immunonéphélemétrie
Laser.
Chapitre II
Généralités
II.1. La maladie de Behçet.
En 1937, un professeur en dermatologie turc,
Hulusi Behçet «1889-1948», définit une
entité associant une aphtose buccale, une aphtose génitale et une
inflammation oculaire sous le nom de la maladie de
Behçet, depuis de nombreuses autres manifestations
systémiques ont été reliées à cette triade.
La physiopathologie de la maladie de Behçet reste incomprise, de
nouvelles données expérimentales permettent toutes fois de mieux
comprendre les mécanismes impliqués dans cette maladie.
La maladie de Behçet (MB) est une
vascularité multi systémique
d'étiologie inconnue, elle se
manifeste essentiellement par des signes muqueux tels des aphtes buccaux, des
aphtes génitaux et cutanés. Des manifestations systémiques
notamment oculaires (uvéite, vascularité rétinienne),
neurologiques et vasculaires. Son diagnostic est clinique et repose sur des
critères internationaux (ISGBD 1990).
|
Tableau I. - Critères
diagnostiques du groupe international d'étude sur la maladie de
Behçet (ISGBD, 1990)
|
|
critères obligatoires:
Ulcérations buccales récurrentes : aphtose
mineure, aphtose majeure ou ulcération herpétiforme
observée par un clinicien ou le malade survenant au moins 3 fois en 12
mois.
|
|
Autres critères :
1. Lésions cutanées : érythème
noueux observé par un clinicien ou le malade, pseudo-folliculites ou
lésions papulopustuleuses ou nodules acnéiformes observés
par un clinicien en dehors de la période d'adolescence et de traitement
corticoïde.
2. Ulcération génitale récurrente :
aphtose ou cicatrice observée par un clinicien ou le malade.
3. Lésions oculaires : uvéite antérieure,
uvéite postérieure ou hyalite à l'examen à la lampe
à fente ou vascularite rétinienne observée par un
ophtalmologiste.
4. Test pathergique : lu par un clinicien entre la 24 e et la
48 e heure. présence d'une pustule ou d'une papule après 24
à 48 h, au point de ponction d'une aiguille sous-cutanée à
la face antérieure de l'avant-bras.
|
Chapitre II
Généralités
II.1.2 Prévalence :
La maladie de Behçet est particulièrement
fréquente dans les pays du bassin Méditerranéen et au
Japon. Sa prévalence est de 80-370/100000 habitants en Turquie,
d'environ 10/100000 habitants au Japon, de 110/100000 habitants en Tunisie
(Zouboulis, 1999), de 2/10000 en Arabie Saoudite, de 1.67/10000 en Iran. En
Europe la prévalence la plus élevée se situe en
Italie : 2.5/100000 (Kone-Paut 2001) mais, elle est rare au États
Unis, sa prévalence est de 0,1-7,5/100000 habitants (Zouboulis,
1999).
La maladie de Behçet survient
généralement entre 18 et 40 ans, avec une prédominance
masculine.
II.1.3 Etiopathogénie :
La pathogénie de cette maladie reste inconnue, pour
cela les facteurs environnementaux et immunologiques impliqués sont de
plus en plus étudiés afin de mieux la caractériser.
Les mécanismes physiopathologiques ne sont pas encor
clarifier (Otmani, 2003), cette étiologie a été
focalisée initialement sur :
- Les infections virales, en particulier par le virus Herpes
simplex.
-Les agents bactériens, en particulier
streptococciques.
-L'auto-immunité ou réactivité
croisée entre antigènes microbiens et antigènes mucosales.
Behçet suggéra que le virus de l'herpes simplex
soit un agent causatif de la maladie dans son premier rapport, il y a une forte
incidence d'anticorps antivirus herpes simplex (Lee et al ,1996) virus de
l'hépatite C et le parvovirus B19.
Dans la maladie de Behçet, les antigènes
streptococciques ont été aussi impliqués, en particulier
une rare variété de Streptococcus sanguis dont
l'hypersensibilité joue un rôle important dans
l'étiopathologénie de cette maladie (Tanaka et al, 1999).
La multiplicité des facteurs étiologiques
devrait avoir comme dénominateur commun la protéine microbienne
HSP 65 KDa (heat shock protein). C'est une protéine largement
conservée entre plusieurs espèces, synthétisée par
les cellules en réponse à un stress thermique, aux agents
toxiques et à l'infection. L'HSP 65 KDa montre une homologie
significative avec l'HSP 60 KDa mitochondriale humaine; il a été
aussi démontré que des régions de 200 résidus
d'acides aminés dans la séquence de la molécule HSP de
Streptococcus pyogenes et l'HSP de boeuf présentant une
homologie de 47% (Stanford et al, 1994).
Les recherches sur les HSP ont révélé
chez des patients la présence de trois populations de cellules B
spécifiques de trois épitopes de la protéine HSP 65 de
Mycobactérium tuberculosis. Il s'agit des fragments 111-125,
154-172 et 311-326. Les peptides 136-150 et 336-351 de l'HSP 60 KDa
mitochondriale humaine montre des résultats comparables avec leurs
homologues mycobactériens respectifs 111-125 et 311-326 (Direskeneli et
al, 1996). Ces observations confirment le rôle de l'infection
bactérienne dans l'apparition de la maladie de Behçet et en
particulier avec Streptococcus pyogénes.
L'investigation de l'étiologie de la maladie de
Behçet a porté par la suite sur la composante
génétique retrouvée dans la pathologie de la maladie
(Samngooei et al, 2000 ; Cohen et al 2002).
Chapitre II
Généralités
Le gène le plus étudié est de l'HLA B51
(Misuki et al ,2001), mais il existe d'autres gènes qui ont
été aussi associés à la maladie comme le
gène MICA et les gènes de certaines cytokines (TNFá, IL6,
IL1) dont le polymorphisme des régions promotrices induit une
hyperréactivité des lymphocytes T (Mi-La et al, 2004 ; Chang
et al, 2005).
II.1.4 Mécanismes physiopathologiques de la
maladie de Behçet :
1-Prédisposition
génétique :
La composante génétique de la MB reste à
élucider et plus particulièrement l'identification des
gènes impliqués dans sa survenue. S'il est admis qu'il existe des
cas familiaux, aucun modèle d'hérédité ne peut
encore être définitivement établi.
Des associations avec le système HLA ont
été décrites, le rôle de l'HLA B51 dans
l'étiopathologie de la MB a été en premier
évoqué par Ohno et al en 1973 puis confirmé par plusieurs
auteurs.Un certains nombre d'études a fourni l'évidence que
l'antigène HLA-B51est fortement associé à la maladie de
Behçet, vue la prévalence de cet antigène au niveau du
bassin méditerranéen et en extrême orient (Ohno et al,
1982). Selon les populations, l'expression variante de cet antigène est
apparue non conforme aux critères de diagnostic proposés par le
groupe d'étude international sur la maladie de Behçet (ISGBD,
1990). Sa fréquence au cours de la maladie varie entre 50 et 88% des
cas.
Une étude a montré que l'allèle B5101 est
trouvé chez 72% des patients avec une prédisposition chez l'homme
aux uvéites Behçet (Mizuki et al, 2001).
Il a été démontré
récemment, une association avec un polymorphisme du gène MICA
(major histocompatibility complex class I chain related gene). Ce gène
localisé à 46kb en position centromérique du gène
HLA-B et le séparant de celui du TNFá, code pour une
protéine HLA de classe I non classique induite par le stress, jouant
probablement un rôle directe dans la destruction des cellules cibles par
les lymphocytes Tãä (Hue-Lemoire et al, 1999 ; Nishiyama et
al, 2004).
Récemment un polymorphisme des gènes de
certaines cytokines a été démontré, induisant une
augmentation de la production du TNFá, de l'IL6 de l'IL1 et une
diminution de l'IL10 (Mi-la et al, 2004 ; Chang et al, 2005).
2-Prédisposition immunologique :
Le système immunitaire est fortement impliqué
dans la maladie de Behçet car des auto anticorps anti auto
antigènes de localisations diverses ont été
détectés dans le sérum de patients atteint de la MB :
des autoanticorps-anti muqueuses buccales, des auto anticorps-anti cellules
endothéliales (Le Hoang, 1988), des auto-anticorps anti antigènes
rétiniens, des anticorps anticardiolipines, des anticorps anti
alpha-tromyosine ; toutes ces molécules induisent une
réactivité lymphocytaire importante (Smet et Dayan, 2000 ;
Triolo et al, 2002).
2.1 Rôle pathogénique des lymphocytes
T (LT) :
Les LT participent et jouent un rôle
majeur dans l'évolution de la MB, et l'anomalie en question touchant le
LT a pu être située.
Chapitre II
Généralités
Il s'agit d'une transduction excessive du signal due à
une perturbation des chaines â du TCR (Hirohata et Hashimoto, 1998) et
une anomalie fonctionnelle de LCK (Tyrosine Kinase) qui cause une
hyperphosphorilation de la ZAP70 impliquée dans la transduction du
signal.
Les LT des patients présentant d'autres anomalies parmi
lesquelles l'augmentation du nombre de cellules CD4+CD29+ avec diminution du
nombre de cellules CD4+CD45RA+ (cellules naïves) (Kahan et al, 1991). Des
changements dans le répertoire Vâ au niveau du TCR (Direskeneli et
al, 1999) et une élévation des cellules CD4+ (Thelper) exprimant
le CD16 et le CD56. Ce dernier marqueur dont l'expression est
corrélée avec l'activité de la maladie est une
molécule associée aux NK ce qui conforte l'hypothèse d'une
sous population de cellules CD8+ cytotoxiques (Eksioglu-Demiralp et al, 1999)
et l'orientation vers la cytotoxicité fréquemment
rencontrée dans cette pathologie.
Le rôle pathogénique des LT exprimant à
leur surface le TCRãä a été démontré,
l'augmentation de la proportion des LT de type ãä, notamment en
réponse aux HSP 65kda mycobactériénnes (Hasan et al,
1996), cette augmentation est corrélée à la phase active
de la maladie (Bank et al, 2003) avec une diminution des LT de type
áâ.
2.2 Rôle pathogénique des lymphocytes B
(LB) :
Bien que le nombre de LB de patients atteints MB soit normal
(Eksioglu-Demiralp et al, 1999) plusieurs arguments suggèrent que
l'immunité humorale participe à la physio- pathologie de la MB du
fait que des taux élevée d'IgA sériques sont
signalés au cours des formes rhumatismales, neurologiques et oculaires
de la pathologie (Le Hoang, 1988), alors que le taux d'IgG et d'IgM sont
normaux.
Le taux de cellules B (CD19+) exprimant les marqueurs
myéloïdes CD13 et CD33 est augmenté, ainsi que celui des
cellules CD19+CD45RA+ et des cellules CD19-CD80+ (cellules B activées).
Ces anomalies de fonction des cellules B semblent être liées
à une stimulation de moindre degré mais continue par un
antigène externe inconnu (Eksioglu-Demiralp, 1999).
2.3 Rôle des cytokines :
De nombreux chercheurs se sont intéressés
à étudier le profil des cytokines pro inflammatoires (IL12, IL6,
IL10, IL18, IFNã) de fait que la vascularité
multisystémique est un processus inflammatoire, au cours de
l'évolution clinique de la pathologie (Guenane, 2002 ; Guenane et
al, 2006 ; Hartani et al, 2006 ; Djaballah-Ider, 2008)
c'est-à-dire durant la phase active (poussées inflammatoires) et
inactive (rémission).
D'autres auteurs rapportent l'augmentation de la production du
TNFá, de l'IL1 (IL1â) de l'IL6, du récepteur soluble
(75kda) du TNFá, de l'IL8 et du récepteur soluble de l'IL1 chez
des sujets en phase active par rapport au sujet normaux et aux malades en
rémission (Akoglu et al, 1990 ; Hamzaoui et al, 1990 ; Mege et
al, 1993; Adam et Calikoglu, 2004).
L'IL8 semble jouer un rôle clé dans le
développement de la réaction inflammatoire. Son taux est
très élevée au cours des poussées (Al-Dalaan et
al, 1995 ; Mantas et al, 2000). Elle a été associée
à l'activité de la maladie (Katsantonis et al, 2000).
Chapitre II
Généralités
L'IL8 est secrétée principalement par le
systéme monocyte/macrophage et les LT en réponse à
l'IL1â et le TNFá. Cette cytokine est chimiotactique pour les
granulocytes et les LT. Elle favorise leurs passage a travers
l'endothélium en augmentant l'expression des molécules
d'adhésion (Mantas et al, 2000).
La production de l'IFNã, de l'IL2 et de l'IL12 est
importante in vivo et in vitro, cette production
corrélée à l'activité de la maladie (Hamzaoui et
al, 2002 ; Djaballah-Ider, 2008).
Guenane et al en 2006 ont démontré une
production augmentée d'IL10 chez de nombreux patients. Cette même
observation a été rapportée par Raziuddin et al en 1997
indiquant que le profil de sécrétion de cytokines est à la
fois Th1/Th2.
II.1.5 Thérapie :
L'évolution de la MB pouvant se faire par
poussés et rémission. Son traitement est essentiellement
symptomatique du fait des nombreux inconnus concernant son étiologie et
sa physiopathologie.
L'hyperstimulation des polynucléaires, avec en
particulier une augmentation du chimiotactisme rencontrer au cours de la MB,
explique l'utilisation et l'efficacité de la colchicine
qui induit une dépolymérisation des microtubules cytoplasmiques,
atténuant ainsi la première étape du processus
inflammatoire à l'origine de la microvascularite et justifiant son
utilisation avec la Thalidomide dans les formes cutanéomuqueses et
rhumatismales de la MB (Le Hoang, 1988).
Les glucocorticoïdes de synthèse,
prednisone et méthylprednisone, possèdent touts
une série d'effets qui les rendent extrêmement efficaces pour
inhiber la réponse immunitaire, partiellement par leurs actions sur les
cytokines de l'immunité mais aussi, en raison de leurs effets
inhibiteurs de l'inflammation. Ces effets anti-inflammatoires sont
particulièrement remarquables : une inhibition de la
sécrétion des prostaglandines a été
reportée, des leucotriénes et une inhibition de l'activité
de la phospholipase A2 (PLA2) via la synthèse de lipocortine, inhibition
de la sécrétion des cytokines pro- inflammatoires (IL-1, IL-6 et
plus modestement le TNFá) et stimulation des inhibiteurs de ces
cytokines, inhibition de nombreuses protéases, inhibition de la
production de monoxyde d'azote (NO). Les glucocorticoïdes sont aussi
immunosuppresseurs par leurs effets inhibiteurs directs sur la production de
cytokines impliquées dans la réponse immune, spécialement
d'IL-2 et de l'IFNã.
La corticothérapie est souvent associée à
l'utilisation des immunosuppresseurs dont certains sont
cytotoxiques tels que le méthotréxate, l'azathioprine, le
chlorambucil et le cyclophosphamide (Caspers-Velu et al, 1989 ; Hamuryudan
et al, 1997 ; Okada, 2000).
L'azathioprine appartient à la famille des thioprines.
Son activité inhibitrice s'exerce principalement sur les lymphocytes T
auxiliaires (CD4+), les cytotoxiques (CD8+), et sur les NK.
Chapitre II
Généralités
Le cyclophosphamide (Endoxan) et le chlorambucyl
(Chloraminophéne) ont des effets inhibiteurs sur la réponse
immune, essentiellement sur la production d'anticorps qui est inhibée de
manière spectaculaire ; accessoirement sur la prolifération
des lymphocytes T auxiliaires (CD4+) ou cytotoxiques (CD8+).
Cyclosporine A et le Tacromilus (FK506)
sont des substances extrêmement hydrophobes qui se lient dans le
cytoplasme aux récepteurs de la famille des immunophilines (Okada,
2000). Ce complexe inhibe la calcineurine, qui contrôle les processus
d'activation de la transcription de plusieurs gènes de cytokines
responsables de la réponse immune cellulaire : IL-2, IL-4,
IFNã.
L'IFN-á (IFN-á2a) est utilisé comme un
immunomodulateur permettant la diminution du taux du TNFáR et
d'E-sélectine chez les patients en phase active de la maladie de
Behçet (Kotter et al, 1998).
L'utilisation des anticorps monoclonaux anti- TNFá a
fait ses preuves dans le traitement de maladie de Behçet (Hassard et
al, 2001).
Chapitre II
Généralités
II.2. Les cytokines :
Les cytokines forment un groupe de médiateurs
intercellulaires qui agissent de façon autocrine, paracrine ou
endocrine. Elles interviennent dans le développement des réponses
immunitaires, cellulaires ou humorales, l'induction de la réponse
inflammatoire, le contrôle de la prolifération, la
différenciation cellulaire et la cicatrisation des plaies. Elles sont
classées en quatre groupes en fonction de leur structure biochimique
(Scott et al, 2002):
· Cytokines de classe I ou
hématopoïétiques.
· Cytokines de la classe II ou interféron
(IFN).
· Cytokines de la classe III ou facteurs nécrosant
des tumeurs (TNF).
· Chemokines ou chimiokines.
II.2.1. Les interférons (cytokine de la
classe II) :
Dans les années trente, plusieurs chercheurs notamment
Jener observèrent le phénomène de l'interférence
virale ou l'infection d'un animal par un virus semble le protéger contre
l'infection par d'autre virus. En 1957 Isaacs et Lindenman découvrirent
l'agent de l'interférence virale, une protéine
libérée par les cellules quand elles sont exposées
à un virus et qui permet aux autres cellules de résister à
l'infection virale. Ils appelèrent cette protéine :
l'interféron (Falcoff ,1972).
Les interférons (IFN) naturels constituent une famille
de protéines synthétisées par les cellules eucaryotes en
réponse à une infection virale ou à des inducteurs divers.
Ces protéines sont capables de conférer à toutes les
cellules d'espèce homologue une protection contre la multiplication des
virus aux quelles elles sont d'origine permissives. A l'intérieur d'une
même espèce, il existe une variété d'IFNs (Kelly,
1986). Cette diversité a conduit à établir une
classification selon la source cellulaire, le mode d'induction, la structure de
leurs gènes, leurs caractéristiques physico-chimique et les
propriétés antigéniques des INFs (Commission de
nomenclature ISICR, 2000). Ils ont été classés en deux
types distincts: Les IFNs de type I (IFNá, â, ù, æ)
et l'IFNã de type II dit immunologique et possédant des effets
pléiotropies (tableau II).
II.2.2. L'interféron gamma
(IFNã)
1. Structure biochimique de
l'IFNã :
L'IFNã est une glycoprotéine basique
composée de deux sous unités protéiques de 166 acides
amines avec deux sites potentiels de glycosylation en 25 et 97 et ne contenant
pas de ponts disulfure (Rinderknescht et al, 1984 ; Touil, 1986).
Elle existe sous trois formes monomériques de 25 ;
20 et 15,5 KDa. Son poids moléculaire dépend du degré de
glycosylation (Kelker et al ,1984):
Chapitre II
Généralités
· La forme 25KDa (63 à 71) est glycosylée
sur les deux sites.
· La forme 20KDa (24 à 32) sur un seul site
seulement.
· La forme 15,5KDa (inférieur a 5) n'est pas
glycosylée.
L'extrémité N terminale de l'IFNã est
caractérisée par la présence d'un résidu
Pyroglutamate alors que son extrémité C terminale est
hétérogène.
Les formes monomériques s'associent pour former des
dimères de 45 à 50 KDa : formes biologiquement actives.
La forme dimérique est nécessaire à son
activité biologique (Ferrar et Scheiber, 1993) mais les deux sous
unités ne sont pas liées par des liaisons covalentes.
L'IFNã est codé par un gène unique situé sur le
bras court du chromosome 12 avec 3 introns et 4 exons. Il ne présente
aucune autre homologie avec les gènes codants pour les autre IFNs de
type I.
2. Sources cellulaires :
L'IFNã est principalement produit par les lymphocytes T
CD4 de type Th1, les cellules T CD8, les lymphocytes Tãä et les
cellules NK (Gao et al ,2003), mais il peut être aussi produit à
faible quantité par les monocytes /macrophages et les cellules
dendritiques en présence de certains effecteurs tel que l'IL12 et IL18,
de même que les NK le produisent en réponse à l'IL2 (Munder
et al ,1998).
3. Induction et production de
l'IFNã :
Les agents viraux sont la cause majeure induisant la
synthèse de l'IFNã. D'autres agents non viraux peuvent
également l'induire :
· Les RNAs bicaténaires naturels ou de
synthèse (Falcoff et al, 1972).
· Les endotoxines bactériennes.
· Les antigènes spécifiques.
· Les sérums anti-lymphocytaires.
· Les lipopolysaccharides (Touil, 1986).
· Les agents mitogènes : PHA, Con A (Touil,
1986).
· Des virus à DNA, des virus à RNA (Touil,
1986).
· Les parasites parmi, l'Echinococcus
granulosus.
La synthèse de cette cytokine est le résultat
d'une dérepression du gène codant pour la protéine
«IFNã» permettant la transcription du message et ainsi une
synthèse et une excrétion de la molécule de l'IFNã
dans le milieu extracellulaire.
Chapitre II
Généralités
4. Actions physiologiques et physiopathologiques de
l'IFNã :
Les récepteurs de l'IFNã sont présent
à la surface de toute les cellules de l'organisme à
différent degré d'affinité ce qui suggère son
implication dans divers processus physiologiques ou physiopathologiques dans
différents types cellulaires.
5. Action de l'IFNã sur la prolifération
cellulaire :
L'IFNã exerce des actions prolifératives,
antiprolifératives et apoptotiques sur différents types
cellulaires. L'IFNã active la synthèse de l'IRF-1 (Interferon
Regulatory Factor-1) par la forte expression de ses récepteurs
à la surface cellulaire. Ce facteur stimule la transcription des
gènes impliqués dans la régulation négative de la
croissance cellulaire et conduirait ainsi à l'apoptose, cette
derniére est liée à l'expression de la Bcl-2 toujours sous
l'action de l'IFNã (Kim et al, 2002).
De même, l'IFNã induit l'expression de la p21 et
la p202 : molécules qui bloquent le passage de la phase G1 à
la phase S du cycle cellulaire, ce qui impliquera une action
antiproliférative de l'IFNã.
Par ailleurs, l'effet prolifératif est le
résultat d'une action synergique de l'IFNã avec certaines
cytokines stimulant la prolifération et la différenciation
cellulaire, telles qu'en présence de l'IL3 et l'IL6, l'IFNã
induit la prolifération des cellules CD34+ (Snoecket al,
1993).
6. Action de l'IFNã dans la réponse
immunitaire :
L'IFNã tient une place très importante au cours
de la réponse immunitaire Il régule la prolifération, la
différenciation et l'activité des cellules immunitaires.
6.1 Action de l'IFNã sur les cellules de
système monocytes/macrophages :
L'IFNã est un puissant activateur des cellules de
système monocytes /macrophages .En effet, il induit une
augmentation importante de leurs activités cytotoxiques, anti tumorales,
antimicrobiennes et antivirales. Ces activités sont le résultat
de l'induction de différentes enzymes par l'IFNã notamment de la
NOS II, de la NADPH oxydase et des protéases neutres. Cette induction
est plus importante en présence de certaines cytokines qui exercent une
action synergique avec l'IFNã telle que l'IL1, IL6 et le TNFá, la
production de ces cytokines pro-inflammatoires elle même est induites par
l'IFNã. L'IFNã intervient également dans les processus de
maturation et d'activation des autres cellules présentatrices de
l'antigène (CPA) telle que les cellules dendritiques, les cellules de
Langerhans, les cellules endothéliales et les cellules microgliales en
induisant l'expression les molécules du CMH de classe II et par
conséquent augmentera leur capacité de présenter les
antigènes aux lymphocytes T CD4+ (John et al ,2003).
6.2 Action de l'IFNã sur les lymphocytes
B :
L'IFNã régule la prolifération et la
différenciation des lymphocytes B, action qui résulte de
l'importante présence de son récepteur IFNGR2 à la surface
cellulaire des cellules B notamment préactives (Bernabei et al ,2001).
Il exerce un effet inhibiteur sur le recrutement des lymphocytes B immatures
(Flaishon et al, 2000).
Chapitre II
Généralités
L'IFNã stimule la production des isotypes
d'immunoglobulines IgG2a et IgG3 et inhibe la synthèse des IgE (Snapper
et al, 1992).
6.3 Action de l'IFNã sur les lymphocytes
T :
L'IFNã induit la différenciation de lymphocytes
T CD4+ vers la voie Th1 en induisant la production de l'IL12 et de la sous
unité â de son récepteur, par ailleurs il inhibe la
réponse vers le profile Th2 en stimulant la production de l'IL4 et par
l'inhibition de son récepteur (Farrar et al, 2002).
7. Action antivirale de
l'IFNã :
En plus de la participation de l'IFNã dans les
mécanismes de défenses antiviraux par la modulation positive
de l'activation des cellules T cytotoxiques et par l'augmentation de
l'expression de l'antigène CMH I et II augmentant ainsi la
capacité des cellules infectées à présenter les
peptides viraux aux lymphocytes T CD8+ (Touil-Boukoffa, 1998). L'IFNã
possède des propriétés antivirales très importantes
qui résultent de son action directe sur les enzymes impliquées
dans la production des protéines virales dont les principales induites
par l'IFNã sont les PKR (Protéine Kinase dépendant des RNA
double brin) et la 2',5' oligoadénylate synthétase.
8. Applications cliniques de
l'IFNã :
L'implication de l'IFNã dans de nombreux
mécanismes de régulation des réponses immunitaire
anticancéreuses et antivirales et antiparasitaires (Touil, 1986 ;
Touil-Boukoffa, 1998), a suscité son utilisation dans diverses
thérapies anticancéreuses, antivirales et antiparasitaires
(Antoniou et al 2003 ; Amri et al, 2007).
Le traitement par l'IFNã de la leishmaniose
viscérale réfractaire au traitement classique par des Sels
d'antimoine à un pronostic très positif (Falcoff et al, 1993). De
même le traitement des lisions cutanées de lèpre par
l'IFNã conduit à la diminution de l'index bactérien avec
affluence de macrophages et lymphocytes T activés vers les
lésions (Miossec, 1998).
Chapitre II
Généralités
II.3. Les immunoglobulines :
Les immunoglobulines (Ig) sont des glycoprotéines
sécrétées par les plasmocytes qui se différencient
à partir des lymphocytes B. Elles sont impliquées dans la
réponse humorale. Cinq classes d'immunoglobulines ont
été identifiées: IgG, IgA, IgM, IgE et IgD d'après
la structure de leurs chaînes lourdes.
II.3.1.Structure générale des
immunoglobulines :
La structure de base d'une immunoglobuline est identique
quelle que soit la classe à la quelle elle appartient, elle est
constituée de quatre chaînes polypeptidiques dont deux
chaînes légères (? ou ë) et deux chaînes lourdes
identiques (ã, á, u, ä ou å) réunies entre
elles par un nombre variable de ponts disulfures.
v Les IgM :
L'IgM est la première immunoglobuline produite par les
cellules B et exprimée sur leur surface.
Elle agit en récepteur d'antigène pour ces
cellules, elle est ainsi présente en molécule soluble dans le
sang. Cette molécule est exprimée sur la surface de la cellule B
en unité à quatre chaînes (deux chaînes H u et deux
chaînes -L).
Elle est composée de cinq unités à quatre
chaînes retenues entre elles par des ponts disulfures à
l'extrémité C terminale des chaînes u. La chaîne J
également associée à l'IgM dans le sang, initie la
polymérisation de ses sous-unités au moment ou elle est
secrétée par les plasmocytes.
En raison de sa taille (900 KDa), l'IgM est trouvée
principalement dans l'espace intra vasculaire, elle est le premier anticorps
produit dans une réponse immunitaire.
Les IgM possèdent 10 sites de liaison par
molécule qui peuvent être synergiques les uns aux autres sur la
même molécule lorsque celle-ci se lie à un antigène.
Donc, l'intensité globale de la liaison d'une molécule d'IgM
(avidité) à un antigène est élevée, ce qui
permet aux anticorps de cette classe de supprimer l'antigène en
question.
v Les IgG :
Les immunoglobulines de la classe IgG possèdent un
poids moléculaire de 150 KDa et sont trouvées dans les espaces
vasculaire et extravasculaire ainsi que dans les sécrétions.
L'IgG est l'immunoglobuline la plus abondante dans le sang,
elle fournit la majorité de l'immunité aux agents infectieux
transmit par voie sanguine. Elle est la seule classe d'anticorps qui traverse
le placenta pour fournir l'immunité humorale passive au foetus.
L'IgG possède deux chaines-H (chaine de type ã)
avec deux chaines légères (ê et ã).
Il existe quatre sous-classes d'IgG (désignées
par IgG1, IgG2, IgG3, IgG4) qui possèdent des séquences de
chaines-H et des activités fonctionnelles légèrement
différentes.
Chapitre II
Généralités
v Les IgA :
Cette immunoglobuline est présente dans le sérum
(PM : 170 KDa), sous forme de quatre chaînes polypeptidiques (deux
L et deux H). Elle est principalement présente dans les
sécrétions externes telles que le colostrum, le lait et la salive
ou elle existe en dimère de 420KDa. Outre les chaînes -L (? ou
ë) et la chaîne lourde (désignée par á), qui la
distingue de l'IgG ou des autres classes d'anticorps, l'IgA
sécrétoire contient également deux autres chaînes
polypeptidiques (pièce sécrétoire) et la chaîne J
(chaîne de liaison).La pièce sécrétoire appartient
à la molécule (récepteur du poly-Ig) qui contribue au
transport transépithélial de l'IgA exocrine et la stabilise
contre une dégradation protéolytique.
Les deux unités à quatre chaînes
composant l'IgA sécrétoire sont retenues ensemble par la
chaîne-J à travers des ponts disulfures. La majorité de
l'IgA est synthétisée localement par les plasmocytes dans les
glandes mammaires et salivaires, et le long du tractus gastro-intestinal,
respiratoire et génito-urinaire. Elle est ensuite transportée par
les cellules épithéliales à la lumière. Cet
anticorps constitue la première ligne de défense contre
l'agression microbienne sur les surfaces muqueuses.
Chapitre III
Matériels et
méthodes
III. Matériels et méthodes.
III.1. Matériels :
III.1.1. Patients :
Pour la réalisation de notre étude, nous avons
effectué des prélèvements sanguins sur quatre patients
atteints de la MB et sur quatre sujets sains. La collecte du sang est faite sur
tube hépariné.
III.1.2. Sérums :
Les sérums des patients Behçet et des sujets
sains ont été récupérés sur tubes secs.
III.1.3. Réactifs :
Plaque d'Elisa sandwich (Immunotech, France) ; anticorps
monoclonaux de souris anti- immunoglobuline (anti-IgM, anti-IgG, anti-IgA)
adapté à l'immunonéphélémétrie
Laser.
III.2. Méthodes :
III.2.1. Etude de la production de l'IFNã
in vivo :
III.2.1.1. Dosage de l'IFNã par la technique
Elisa sandwich :
a/Principe :
Il s'agit d'un dosage de type sandwich. Dans les puits d'une
plaque de micro titration recouverts d'un premier anticorps monoclonal anti
IFNã sont incubés les échantillons à doser ou le
standard ainsi que le deuxième anticorps couple à la
peroxydase.
Après incubation l'activité enzymatique est
révélée par le substrat chromogène.
L'intensité de la coloration est proportionnelle à la
concentration en IFNã présents dans les échantillons ou
le standard.
Dosage d'un antigène par méthode Elisa
sandwich
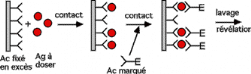
Mesure de l'activité enzymatique par
Spectrophotomètre d'absorption
Chapitre III
Matériels et
méthodes
b/Mode opératoire :
Dans les puits d'une plaque de microtitration recouverte d'un
1 premier anticorps monoclonal anti IFNã sont incubés
les sérums avec le standard à raison de 50ìl
IFNã.

Après 2h d'incubation sous agitation à
température ambiant et lavage, 50ìl d'anticorps biotinylé
ainsi que 100ìl de streptavidine couplé à la peroxydase
sont ajouté aux différents puits.
Après une deuxième incubation pendant 30 min
sous agitation à température ambiante et lavage,
l'activité enzymatique est révélée par addition du
substrat chromogène TMB à raison de 100ìl par puits.
La réaction chromogène se développe
à l'obscurité pondant 30min, elle est ensuite
arrêtée avec une solution d'acide sulfurique 2N.
L'absorbance est lue à 450 nm contre le blanc substrat,
l'intensité de la coloration est proportionnelle à la
concentration en IFNã présente dans l'échantillon et le
standard.
III.2.2. Etude de la production des immunoglobulines
sériques (IgM, IgG et IgA) :
III.2.2.1. Dosage des immunoglobulines sériques
(IgM, IgG et IgA) par Immunonéphélémétrie
Laser :
a/Principe :
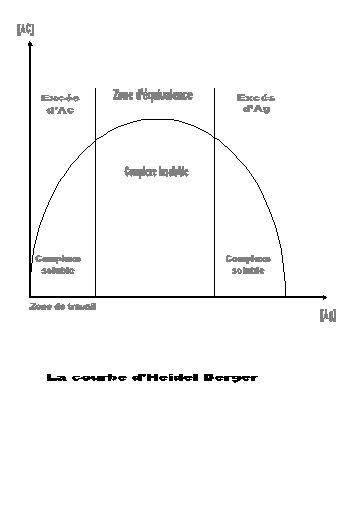
L'immunonéphélémétrie Laser est
une absorption de la lumière par les complexes Ag-Ac en excès
d'anticorps, selon la courbe d'Heidel Berger.
b- Mode opératoire :
La réaction immunologique de dosage des
immunoglobulines sériques (IgM, IgG et IgA) par
immunonéphélémétrie Laser est comme suit :
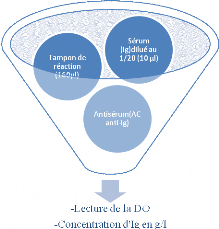
Après dilution au 1/20 du sérum qui contient des
immunoglobulines sériques à doser, 10ìl sont mis en
contact avec l'antisérum renferment les anticorps monoclonaux
anti-immunoglobulines (anti-IgM, anti-IgG, anti-IgA) en présence de
150ìl du tampon de réaction.
Après incubation pendant 6 min et passage du faisceau
lumineux (Laser), l'absorption de la lumière par le complexe Ag-Ac, en
excès d'anticorps selon la courbe d'Heidel Berger, permet d'obtenir la
concentration des immunoglobulines sériques en g/l.
Chapitre III
Matériels et méthodes
Chapitre III
Matériels et
méthodes
III.3. Etude statistique :
La comparaison des moyennes a été
réalisé en utilisant le test de student (t) pour les petits
échantillons (<30) à un taux de risque maximum de 5%.
Chapitre IV
Résultats et discussions
III. Résultats et
discussions :
1. Etude de la production de l'IFNã in
vivo :
Nous avons entrepris une étude de la production de
l'IFNã chez des patients atteints de la maladie de Behçet en
activités (poussée), et chez des sujets sains, les taux de
l'IFNã dans le sérum varient entre [2.6 et 6.5 UI/ml] avec une
moyenne égale à [4.42#177;1.79 UI/ml].
Les taux sériques de l'IFNã ont montré
une augmentation significative chez les patients atteints de Behçet en
comparaison avec les sujets sains. En effet, cette production chez les
patients varie entre [23 et 28 UI/ml] avec activité moyenne égale
à [25#177;2.16 UI/ml] (figure 04).
2. Etude de la production des immunoglobulines
sériques (IgM, IgG et IgA) in vivo :
L'étude de la production des IgM, IgG et IgA in
vivo a montré une augmentation de leurs taux chez les patients
Behçet par rapport aux sujets sains (figure 05).
2/1 Production des IgM :
Chez les sujets sains, les taux d'IgM dans les sérums
ont une moyenne de [2.35#177;1.07 g/l], leur production est plus importante
chez les patients atteints Behçet, chez les quelle nous avons
observé une teneur moyenne de [4,32#177;1,53 g/l] (figure 05-a).
2/2 Production des IgG :
Les taux sériques des IgG ont montré une
augmentation chez les patients Behçet par rapport aux sujets sains. Chez
les patients Behçet, les taux sériques ont une moyenne de
[18,51#177;2.37 g/l], celle des sujets sains est de [9,1#177;0,57 g/l] (figure
05-b).
2/3 Production des IgA :
Chez les sujets sains les taux sériques des IgA ont
une moyenne de [1,16#177;0,73 g/l]. Leur production est plus importante chez
les patients Behçet, elle est de [6,02#177;1,09 g/l] (figure 05-c).
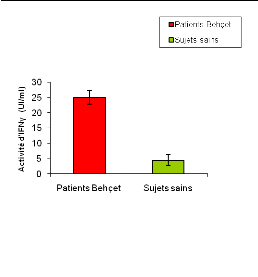
Figure 04 : Activité moyenne de
l'IFNã dans le sérum des patients Behçet (n=4) et des
sujets sains (n=4).
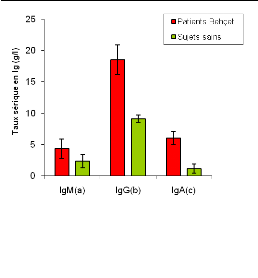
Figure 05 : Teneur moyenne en
immunoglobulines (Ig) sériques (IgM, IgG et IgA) chez des patients
Behçet (n=4) et des sujets sains (n=4).
Chapitre V
Discussion
générale
IV. Discussion
générale :
Notre étude portant sur l'implication de l'IFNã
dans le processus auto immun accompagnant la MB a montré une
augmentation significative de la production de cette cytokine in vivo
chez les patients atteints de Behçet par rapport aux sujets sains
(figure 04), notre résultat confirme les résultats
apportés par plusieurs auteurs où la production de l'IFNã
est corrélée à la phase active de la maladie (Turan B et
al, 1997; Singh VK et Rai 2001).
Les processus auto-immuns accompagnés de
réactions inflammatoires mettent souvent en jeu une réponse
cellulaire associée à la voie Th1. L'IFNã dont la
production est favorisée par l'IL12 exerce plusieurs actions au cours de
ces processus, notamment des actions activatrices sur les fonctions du
système monocyte/macrophage et les cellules TCD8+ (Abbas et
al ,1996).
Ainsi, il apparait que les cytokines Th1, notamment
l'IFNã jouent un rôle crucial dans
l'immunopathogénèse associée à l'évolution
de la pathologie (Guenane et al, 2006 ; Djaballah-Ider, 2008).
Les résultats relatifs à l'étude de la
production des immunoglobulines sériques chez les patients atteints de
la MB indiquent une élévation du taux des IgM, IgG et IgA au
cours de la pathologie considérée par rapport aux sujets sains
(figure 05-a, b et c). Ce qui suggère l'implication non
négligeable du lymphocyte B et de la réponse humorale au cours de
la maladie de Behçet, en particulier dans la relation existante entre
l'expression CD19 et la production des 3 isotypes d'immunoglobulines
mesurées chez les patients (Djaballah-Ider, 2008). Cette relation
implique l'existence du profil mixte Th1/Th2 chez les malades atteints de
Behçet.
En effet, plusieurs anomalies de la réponse humorale
ont été rapportées (Otmani, 2003).
Par ailleurs, les commutations de classe d'immunoglobuline
induite par les cytokines Th1/Th2 sont à considérer
(Djaballah-Ider, 2008), ce qui engendre la diversité isotypique
observée, nos résultats appuient cette donnée.
Chapitre VI
Conclusion
V. Conclusion :
Notre étude a contribué à la mise en
évidence d'un profil mixte Th1/Th2 dans l'orientation des
réponses immunitaires rencontrées au cours de la maladie de
Behçet.
Les résultats relatifs à la production de
l'IFNã confirment l'implication des cytokines Th1 dans l'hyper
activation des cellules T associée à la maladie de Behçet.
Notre étude à montré également, le
rôle non négligeable du lymphocyte B dans les mécanismes
immunopathologiques associés à la maladie de Behçet en
relation avec la diversité isotypique (IgM-IgG-IgA) observée chez
les patients Behçet en activité, ce qui confirme l'implication
d'un profil mixte Th1/Th2 au cours de cette maladie.
L'approfondissement de l'étude des réponses
immunitaires cellulaire et humorale rencontrés au cours de la maladie de
Behçet, par l'étude des marqueurs de surface
caractéristiques des cellules lymphocytaires conforterait nos
résultats.
Chapitre VII
Bibliographie
VII. Bibliographie:
Abbas, A.K., Murphy .K.M. and Sher.A.
(1996).Functional diversity of helper T lymphocytes. Nature; 383:787-793.
Adam, B. and Calikoglu, E. (2004).
Sérum interleukin-6, procalcitonin and C-reactive protein levels in
subjects with active Bebçets disease, JEADVJ. eut. Acad. Dermatol
Venereol; 18 (3) :318 - 320.
Akoglo,T (1999). Phenotypic characteristics
of B cells in Behçet's disease: increased activity in B cell subsets. J
Rhumatol.1999; 26 (4): 826-32.
Akoglu, T.F., Direskeneli, H., Yazici, H. and
Lawrence, R. (1990). TNF, soluble IL- 2 receptor and soluble CD8 in
Behçet's disease (letter). J Rheumatol; 17: 1107- 1108.
Al-Dalaan, A., Al-Sedairi, S., and Al-Balaa,
S. (1995).Enhanced IL8 secretion in circulation of patients with
Behçet's disease .J Rheumatol; 22: 904-907.
Antoniou, K.M, Ferdoutsis, E. & Bouros,
D. (2003). Interférons and Their Application in the Diseases of
the Lung. Chest..; 123:209-216.
Amri,M., Ait Aissa, S., Belguendouz,H., Mezioug,D and
Touil-Boukoffa, C.(2007) In vitro antihydatic action of IFNã is
dependent on the nitric oxide pathway. Journal of interferon & cytokine
research; 27:781-787 (2007).
Bank, L, Duvdevani, M. and Lrvneh, A. (2003).
Expansion gamma delta T-cells in Behçet's disease: role of disease
activity and microbial flora in oral ulcers. J. Lab. Clin, Med41(1):33-40.
Bernabei, P., Coccia, E.-M. and Rigamonti, L.
(2001) Interferon-gamma receptor 2 expression as the deciding factor in human
T, B, and myeloid cell proliferation or death. J Leukoc BioL, 70 : 950-960.
Binisti, P. (1999).Oeil et maladie de Behcet.
Rev Prat; 49: 1999-2003.
Caspers-Vleu, L .E.,Decaux ,G. and Libert
,J.(1989).Cyclosporine in Behçet's disease resistant to
conventional therapy. Ann Ophthalmol; 21:111-118.
Chang, H.K, Jang, W.C., Parle, S.B., Han, S.M., Nam,
Y.IL, Lee, S.S., Kïm, J.U. and Lee, H.S., (2005). Association
between interleukin 6 gene polymorphisms and Behçet's disease in Korean
people, Ann. Rhewn. Dis; 64:339-340.
Cohen, R. Metzger, S., Nahir, M and Chajek-Shaul,
T. (2002). Association of the MICA gene and HLA B51 with Behçet
disease in Arabs and non-Ashkenazi Jews in Israel. An Rheum. Dis; 61:
157-160.
Direskeneli,H.,Hassan,H.,Shinnck,T.,Mizushima,Y.,Van
Der Zee ,F.,Stanford,M.R. and Lehner,T.(1996) .Recognition of B-cell
epitopes of the 65Kda HSP in Behçet's disease. Scand Immunol;
43: 646-467.
Direskeneli,H.,Eksioglu-Demiralp,E.,Kibaroglu,A.,Yavuz,S.,Ergun,T.
and Akoglu ,T.(1999).Oligo clonal T cell expansions in patients with
Behçet's disease. Clin Exp Immuunol; 117: 166-170.
Djaballah-Ider,F.Z.(2008).Etude de
l'expression des antigénes de surface CD3, CD4,CD8 et du CD19 en
relation avec la production de l'IFNã , de l'lnterleukine 18 ,du
monoxyde de l'azote et les immunoglobulines circulantes au cours de la maladies
de Behçet .Thèse de Magistère en Biochimie-immunologie
.FSB-USTHB.
Eksioglu-Demiralp, E., Kibaroglu,A., Direskeneli,H.,
Yavus,S., Karsli,F., Yurdakul,S., Yazici,H., Hassan, A.,Fortune,F., Wilson,A.,
Warr,K., Sehinnick,T., Mizushima,Y., Van Der Zee,R., Standford,M-R.,
Sanderson,J. and Lehner,T.( 1996).Role of ãäT cells in
pathologenesis and diagnosis of Behçet's disease Lancet; 347:
789-794.
Falcoff, R. (1972) .Some properties of virus
and immune induced human lymphocyte interferon. J Gen Virol; 16: 250-253.
Falcoff, E., Bernabo, J., et Botasso, O.
(1993). L'interféron -ã transforme le pronostic des patients
atteints de leishmaniose chimiorésitante. Med/Sci; 9: 1214-1217.
Farrar, J.D., Asnagli, H. and Murphy, K.M.
(2002). T helper subset development: roles of instruction, selection, and
transcription. J. Clin. Invest ;109:431-435.
Flaishon, L., Hershkovitz, R., Lantner, F., Lider, O.,
Alon, R., Levo, Y., Flavell, R.A. and Shachar, L (2000). Autocrine
sécrétion of interferon gamma negatively regulates homing by
immature B cells. J. Exp. Med, 192:1381-1390.
Gao, Y., Yang, W., Pan, M., Scnlly, E., Girardi, M.,
Augenlicht, L.BL, Craft, J. and Yin, Z. (2003). T cells provide an
early source of Interferon y in tumor immunity.../ Exp. Med. 198 (3):
433-442.
Ferrar,M.A. and Shrieber,R.D. (1993). The
molecular cell biology of interferon -ã and its receptor. Ann Rev
Immunol; 11: 571-611.
Guenane, H. (2002),
Immunoréactivité des patients (isotype IgG) et recherché
de cytokines marqueures (Th1, Th2) et de NO au cours des manifestations
ophtalmiques du syndrome du Behçet. FSB-USTHB.
Guenane, H., Hartani, D., Chachoua, L.,
Lahlou-Boukoffa, O.S., Mazari, F., Touil-Boukoffa, C. (2006).
Production des cytokines Th1/Th2 et du monoxyde d'azote au cours de
l'uvéite Behçet et de l'uvéite idiopathique.J Fr .
Ophtalmol., 2006 ; 29,2, 146-152.
Hamuryudan, V., Ozyazgan, Y., Hizli, N., Mat, S.
Yardakul, S., TOEzûn, Y., $enocak, M. and Ya.zici, H., (1997).
Azathioprine in Behçet's syndrome. Effects on long-term prognosis.
Arthritis Rheum; 40: 769-774.
Hamzaoui,K.,Haniza,M. and Ayed,K. (1990).
Production of TNF-alpha and IL-1 in active Behçet's disease (letter), J
Rheumatol; 17: 1428-1429.
Hamzaoui,
K.,Hamzaoui,A.,Guemira,F.,Bessioud,M.Hamza,M. and Ayad, K.(2002),
Cytokine profile in Behçet's disease patients.Relationship with disease
activity, Scand. J. Rhumatol;31 (4): 205-101.
Hassard,P.V.,Binder,S.W.,Nelson,V. and
Vasiliasuskas,E. A.(2001).Anti tumor necrosis factor antibody therapy
for gastrointestinal Behçet's disease :A cause report.
Gastroenterology; 120: 115-119.
Hartani , D., Guenane, H., Chachoua, L.,
Lahlou-Boukoffa, O.Q., Touil-Boukoffa, C.(2006). Effet des nitrites et
des nitrates sur les rétines de boeuf in vitro. J Fr. Ophtalmol., 2006;
29, 1, 32-36.
Hirohata,S. and Hashimoto,T. (1998).Abnormal
T cell responses to bacterial superantigens in Behçet's disease.Clin Exp
Immunol; 112: 317-324.
Hüe-Lemoine,S.,Amoura , Z.,
Wechsler,B ., Piette, J. C. et Caillat-Zucman,S. (1999).Aspects
récents de la génétique de la maladie de Behçet.
Ann Med interne; 150: 499-503.
Kahan ,A.,Hamzaoui,K. and Ayed,K.
(1991).Abnormalities of T lymphocyte subsets in Behçet's
disease demonstrated with anti CD45RA and anti CD29 monoclonal antibodies.J
Rheumatol ;19 : 742-746.
Katsantonis,J.,Adler, Y., Orfanos,C.E. and
Zouboulis,C.C. (2000). Adamantiades-Behçet's disease: Serum
IL-8 is a more reliable marker for disease activity than C-reactive protein and
erythrocyte sedimentation rate. Dermatology; 20: 37-39.
Kelker,H.,Le,J.,Rubin,B.,Yip,Y.,Nagler,C. and
Vilcek,J. (1984). Three molecular weight forms of natural human
interferon-ã revealed by immuno precipitation with monoclonal antibody.J
Boil Chem; 259: 4301.
Kim, EJT.,Lee, J.M.,Namkoong,S.E.,Uni,SJ. and
Parle,J.S.(2002). Interferon regulatory factor-1 médiates
interferon-gamma induced apoptosis in ovarian carcinoma cells.Cell. Biochem;
85:369-376.
Kone-Paut 2001, I. La maladie de
Behçet, Encyclopédia Orphanet, décembre 2001.
Kotter,I.,Ecksetein,A.K.,Stubiger,N. and
Zlerhut,M. (1998).Treatment of ocular symptoms of Behçet's
disease with interferon alpha2a : a pilot study.Br J Ophthalmol; 82
:488-494.
Lee,S.,Bang,D., Cho, Y. H.Lee, E. S.and
Sohn,S. (1996).Polymerase chain reaction reveals herpes simplex virus
DNA in saliva of patient with Behçet's disease. Arch Dermatol Res; 288:
179-183.
Le Hoang, P. (1988).Maladie de
Behçet.In immunopathlogie de l'oeil.Edi Masson.Paris.France.310-317.
Mantas, C., Direskeneli H., Oz, D., Yavus, S. and
Akoglu T. (2000). IL-8 producing cells in patients with
Behçet's disease. Clin Exp Rheum; 18: 249-251.
Mege, J.L., Dilsen, N. and Sangueddolce, V.
(1993). Overproduction of monocyte derived tumor necrosis factor
alpha, interleukin (IL) 6, IL-8 and increased neutrophil superoxide generation
in Behçet's disease. A comparative study with familial mediterranean
fever and healthy subjects. J Rheumatol; 20: 1544-1549.
Mi-La, C., Ju-young, K., Hyeok-Jae, K.O., Young-Hoon,
K., Wan-Uk, K.,Chul-Soo, C.,Ho-Youn,K. and Sue-Yan,H.(2004).The MCP1
promoter 2518 polymorphism in Behçet's disease: correlation between
allele types, MPC1 production and clinical symptoms among Korean patients.
Autoimmunity: (Print) 37 (1): 77 -80.
Mizuki, N., Ota, M., Katsuyama, Y., Yabuki, K., Ando,
H., Shiina, T., Nomura, E., Onari, K., Ohno, S. and Inoko, H. (2001).
HLA-B51 allele analysis by PCR-SBT method and a strong association of HLA-B5101
with Japanese patients with Behcet's disease, T. Antigen; 5S (3):l8l-4.
Miossec, P. (1998). Réseau des
cytokines .L'inflammation. Med /Sci; 14:453- 459.
Munder.M, Mallo,M, EicHmann. K. and Modolel,M
(1998) ;Murine Macrophages Secrete interferon gamma combined
stimulation with IL12 and IL18 : A novel pathway of autocrine macrophage
activation. J.Exp.Med. 187;(12): 2103-2108.
Nishiyama, M., Takahashi, M., Manaka, K.C.,
Roosihermiatie, B., Kuriyama, T. and Nakae, K. (2004).Frequencies of
mica gene polymorphism: A comparison between Indonesians on Bacan Island and
suburban Japanese, South east. Asian. J. Trop. Mal. Public. Health;
35(1):195-201.
Ohno,S.,Kato,F.,Matusda,H.,Fujii,N. And Minagawa
T.( 1982). Detection of gamma interferon in the sera of patients with
Behçet's disease. Infet Immun; 36: 202-208.
Okada,A.A.(2000). Drug therapy in
Behçet's disease.Ocul Immunol Inflamm; 8: 85-91.
Otmani, F. (2003). Maladie de Behçet:
Revue générale. N° 26 (2003).
Samangooei, Sh., Hakim, S.M. and Khosravi, F.
(2000). Frequency of HLA- alleles B5, B51 and B27 in patients with
Behçet `s disease from southwest of Iran. Irn. J. Med. Sci. 25
(3§4): 144-146.
Smet, M.D. and Dayan, M., (2000),
Prospective determination of T-cell responses to S-antigen in Behçet's
disease patients and controls, Invest. Ophtalmol. Vis. Sci. Oct;
41(ll):3480-4.
Snapper, C.M., Mclntyre, T.M., Mander, R., Pecanha,
L,T.M,, Finkelman, F.D., Lees, A. and Mond, JJ. (1992). Induction of
IgGa secretion by interferon y: A model for T cell in dependent class switching
in response to T cell-independent type 2 antigens. ./. Exp. Med., 175:
1367-137].
Singh VK, Rai G.Cytokines in posterior
uveitis. Immunol R 2001; 23: 59-74.
Snoeck, H.-W., Lardon, F., Nys, G., Lenjou, M., Van
Bockstaele, D.R. and Peetermans, M.E. (1993). Interferon gamma and IL4
reciprocally regulate the production of monocytes/macrophage and neutrophils
through a direct effect on commited monopotentiel bone marrow progenitor cells.
Fur. J. Immunol; 23:1072-1078.
Rinderknescht,E., O'conor,B. And
Rodriguez,H.( 1984).Natural human IFNã.J Biol chem; 259:
67-90.
Tanaka,T., Yamakawa ,N., Koike,N., Suzuki,J.,
Mizuno,F. and Usui ,M.(1999) .Behçet's disease and antibody
titers to various heat shock protein 60s.Ocul Immunol Inflamm; 7: 69-74.
Touil,C. (1986). Production et purification
de l'IFNã humain naturel. Application : Dosage et
caractérisation de l'IFNã sur des sérums de patients
atteints d'hydatidose. Thèse de Magister en biochimie ISN, USTHB.
Touil-Boukoffa, C.(1998). Etude du
système interféron et cytokines au cours de l'hydatidose
humaine : implication de l'IFNã, du TNFá, de l'IL6 et du NO
dans la réponse immunitaire antifraction 5.Thèse de Doctorat
d'Etat en Biochimie-Immunologie-ISN-USTHB
Turan B, Gallati H, Erdi H, Gurller A, Michel BA,
Villiger PM. Symic levels of the Tcell regulatory cytokines IL-10 and
IL-12 Behçet disease ; Soluble TNFR-75 as biological marker of dise
activity. J Rheumatol, 1997;24 :128-32.
Triolo, G., Accardo-Palumbo, A., Dieli, F., Ciccia,
F., Ferrante, A., Giardina,E., Licata, G. (2002).Humoral and cell
mediated immune response to cow's milk proteins in Behçet's disease,
Ann. Rheum;61(5):459-62.
Wong, A.B., Tarn, N.W., Yang, Y.I, Cuddihy, A.R., Li,
S., Kirchhoff, S., Hauser, H., Decker, T.& Koromilas, A.E. (1997).
Physical association between STAT1 and thé interferon-induciblc protein
kinase PKR and implications for interferon and double-stranded RM A signaling
pathways. EMBO Journal, 16: 1291-1304.
Zouboulis,CHC.(1999). Epidemiology of
Adamantiades-Behçet disease.Ann Med Interne; 150:488-98.
Pour les Ig:
L'essentiel en IMMUNOLOGIE, cours et QCM de P.M Lydyard, A.
Whelan et M.W. Fanger. In BIOS Scientific Publishers, 2001, Oxford,UK. BERTI
Editions
| 


