PARTIE B (RESULTATS ET DISCUTION)
CHAPITRE 1
SYNTHESE
OBJET DU TRAVAIL
Le but de ce travail de recherche est le développement
de stratégies synthétiques permettant d'accéder
efficacement à des analogues de nucléosides acyclique de
façon stéréocontrôlée. Inspiré par la
structure des triazoles, ce projet pourrait mener à la découverte
de nouveaux prototypes moléculaires. Les amino triazole et
leurs dérivés acycliques, ont une importance biologique
significative, et ce pour plusieurs raisons. En effet, ces composés
démontrent une variété de propriétés telles
des activités antibactériennes et antifungiques
Dans le cadre de l'élaboration d'un nucléoside
modifiés abordé au Laboratoire de
Chimie biomoléculaire, nous nous proposons de
synthétiser, de caractériser et
d'évaluer les potentialités
antibactérienne et antifungique d'analogues de nucléosides
acycliques produit (b-6)
à base d'acide L(+) tartrique.
Afin de synthétiser le produit
(b-6) : ce acyclonucléoside à base d'acide
L(+) tartrique, nous avons adopté la stratégie
représentée sur le schéma synthétique (B.1)
suivante :
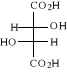
b-1
(H2SO4+
T=110°C + 7h+CH2OH)
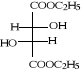
b-2
(NH2NH2.H2O+C2H5OH)
b-3
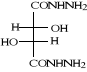
(CH3OH+KOH+NH2NH2+Tamb+17h+4h)
(CS2+C2H5OH+KOH+T°=110°C +4h)
b-4
b-5
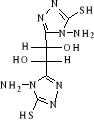 
(L-Arabinose+C2H5OH+Hcl+Tamb+4h)
b-6
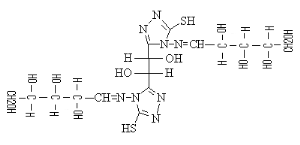
Schéma B-1: Schéma
Synthétique
B-1-
Synthèse :
B-1- 1- L (+)tartrate de
diéthyles (b-2)

Schéma B-2 :
estérification d'acide L(+) tartrique
la réaction d'acide L(+) tartrique
(b-1) avec l'éthanol en présence 101Acide
chlorhydrique comme catalyseur a donné l'ester L (+) tartrate de
diéthyles (b-2) , Nous avons tout d'abord
utilisé les conditions opératoires qui ont conduit aux meilleurs
rendements . L'analyse CCM indique l'apparition de la
tâche de l'ester. Rf = 0.41
(éluant A) . R= 96%
CARACTERISATION SPECTRALE
Le spectre IR (Annexe2) de diéthyles L (+) tartrates
(b-2), montre l'apparition d'une bande large située à 3439.6
cm-1 caractéristique du groupement OH et une
bande aiguë et intense centrée à 1730.1 cm-1
caractéristique aux vibrations du groupement carbonyle
C=O.
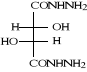
B-1- 2- di hydrazides L
(+) tartrique (b-3) :
Schéma B-3: Synthèse de
di hydrazide tartrique
di hydrazides L (+) tartrique (b-3) est
obtenue par réaction101de l'ester tartrique
diéthylique (b-2) avec l'éthanol et L'hydrazine hydratée
64 % respectivement, par agitation magnétique à
température ambiante. La réaction est spontanée et est
totale après 25 minutes d'agitation. Le produit est obtenu avec un
Rendement de 84 %.
Le point de fusion du produit obtenu est de
176 °C
L'analyse CCM indique l'apparition de la
tâche de produit (b-3) : Rf = 0.27
(éluant B)
CARACTERISATION SPECTRALE
L'analyse infrarouge (Annexe 3) indique Trois bandes
à 3364.6 cm-1, 3311.0 cm-1 et 3294.4 cm-1
attribuées aux vibrations du groupement amine NH
et une bande moyenne à 3175.2 cm-1 attribuée au
groupement CH alkyl chaine. Deux bandes intenses
caractéristiques au groupement carbonyle C=O
centrées à 1657.1 cm-1 et 1612.3 cm-1 et
déplacées vers les faibles fréquences traduisant
l'établissement d'une forte liaison hydrogène
intramoléculaire.il ya une bande à 3422.6 cm-1
attribuée au groupement OH.
B-1- 3- bis-1, 3,4-oxadiazole-5-thione
(b-4) :
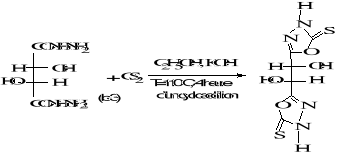
(b-4)
Schéma B-4: Synthèse de
bis-1, 3,4-oxadiazole-5-thione
La réaction de dihydrazides tartrique
(b-3) avec le CS2 dans l'eau en
présence101de KOH conduit au produit : bis-1,3,4-
oxadiazole-5- thione tartrique (b-4), après une 4heure de reflux, avec
un meilleur rendement de 72%. Le produit est obtenu sous forme
de fibres jaunes blanches.
Le point de fusion du produit obtenu est de
186 °C
L'analyse CCM indique l'apparition de la
tâche de produit (b-4) : Rf = 0.62
(éluant C).
CARACTERISATION SPECTRALE
Le spectre infrarouge (Annexe4) présente deux bandes
larges à 3350.2 cm-1, 3230 cm-1 attribuées
au groupement NH. Deux bande large situé à
3051.2 cm-1 ; 2890cm-1 attribuée aux
vibrations du groupement CH alkyl chaine, et une bande
à 3463.2 correspondant au groupement OH.
La bande aigue et intense centrée à 1634
cm-1 est caractéristique au groupement C=N
et deux bandes aigus et intenses à 1459.6 cm-1 et 1406.1
cm-1 représentent le groupement C=S. La
bande aiguë et intense située à 1093.8 est attribuée
au groupement C-O-C. d'après la
structure (b-4) en peux montrer que il ya un équilibre
tautomérique qui permet de donner la possibilité d'enolization en
obtient un enol .
B-1- 4- bis-(4-amino-5-mercapto-4H-[1,2,4]
triazol-3-yl) acide tartrique (B-5)
 (b-3) (b-3) 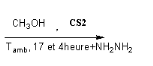 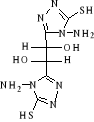 (b -5) (b -5)
Schéma B-5:
Synthèse de bis-(4-amino-5-mercapto-4H-[1,2,4] triazol-3-yl) acide
tartrique
La réaction de dihydrazides tartrique
(b-3) avec CH3OH absolu en
présence140 CS2 et
Hydrazine 67% après 17 heures à Tamb en obtient le
composé Bis-(4-amino-5-mercapto-4H-[1,2,4] triazol-3-yl) acide tartrique
(b-5) dans les conditions opératoires
spécifiques,
Avec un rendement de 70%
Le point de fusion du produit obtenu est de 122
°C
L'analyse CCM indique l'apparition de la
tâche de produit (b-5) : Rf = 0.80
(éluant D)
CARACTERISATION SPECTRALE
Le spectre infrarouge (Annexe 5) présente trois bandes
à 1605.9 cm-1 correspond au vibration du groupement
C=N ; et à environ de
1946.9 cm-1 une faible bande correspond au
groupement SH qui traduisant
l'établissement d'une forte liaison hydrogène
intramoléculaire, nous avons aussi voir un large bande
entre 3041cm-1 correspond au groupement CH alkyl
chaine ; la bande à 3330 cm-1
attribuées groupement NH ; il ya une bande
à 3422.7 cm-1 attribuée au groupement
OH.
Pour RMN 1H (CDCL3) :
(Annexe 6) la disparition des protons au niveau 2.063ppm correspond au
SH(S,1H, SH) ; au niveau 6.501ppm
correspond au groupement alkyl (m.4H, 2CH2O alkyl
chaine ) ; et au niveau 2.3 correspond fonction amine 2.3-2.5
ppm (S,1H ,NH)102.
Pour RMN
13C(CDCL3) : (Annexe
7) au niveau de 23.78 ppm correspond au C-C (m, 2C,
C-C) , entre 50.72-64.23 ppm correspond
(S,1C,CH2O) , au niveau de 180.36 ppm (S,1C, C=N) ,
au niveau de 206.38 ppm (S, 1C,
C-N)
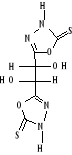
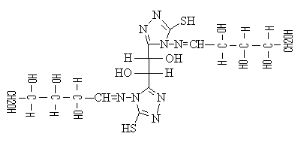
B-1- 5-
bis-(4-arabinosidene-amino5-mercapto-4H-[1,2,4] triazol-3-yl)acide
tartrique(b-6)
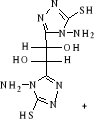   
(b-5)
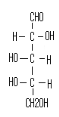
L-Arabinose (b-6)
Schéma B-6:
bis-(4-arabinosidene-amino -5-mercapto-4H-[1,2,4] triazol-3-yl) acide tartrique
La réaction de bis-(4-amino-5-mercapto-4H-[1,2,4]
triazol-3-yl) acide tartrique (b-5) avec le sucre L(+)
Arabinose en présence de éthanol avec HCl concentré avec
chauffage douce,102 permet me donner le composé :
Bis-(4-arabinosidene-amino -5-mercapto-4H-[1,2,4] Triazol-3-yl)
tartaric acid (b-6) sous
forme un Sirop marron, Avec un bon rendement de 75.33%
L'analyse CCM indique l'apparition de la
tâche de produit (b-6) : Rf = 0.72
(éluant E)
CARACTERISATION SPECTRALE
Le spectre infrarouge (Annexe 8) présente trois bandes
larges à 1550.49 cm-1 correspond au vibration du groupement
C=N ; et à environ de
2359.48 cm-1 une faible bande correspond
au groupement SH, nous avons aussi voir un large bande entre
2973.7 à 2884.02 cm-1
correspond102 au groupement CH alkyl chaine ;
et entre 3334-3631 attribuées au groupement OH.
1H NMR (CDCL3)
(Annexe 9) : il ya une disparition des proton au
niveau :1.091-1.147ppm qui correspond au
(m,9H,CH2O Arabinose) ,
2.1ppm correspond
(S.1H,SH); 2.3-2.5
ppm correspond (S,1H,N=CH) qui montre
que il ya griffage au niveau fonction amine de composé (b-5);
3.7ppm correspond (m,4H,2CH2O alkyl
chaine).
PARTIE B (RESULTATS ET DISCUTION)
CHAPITRE 2
| 


