|
REPUBLIQUE ALGERIENNE DEMOCRATIQUE ET
POPULAIRE
Ministère d'enseignement Supérieur et
de la Recherche Scientifique
Université Hassiba Ben
bouali
Faculté des Sciences Agronomiques et des
Sciences biologique de Chlef
Département d'Agronomie
Thèse de Magister
Thème
Régénération via
l'organogénèse ou l'embryogénèse somatique chez le
Scorpiurus.
Présenté par Hamdani fatima
zohra
Soutenu le 28/11/2001
Devant le Jury
BOUGUEDOURA N Président du jury
professeur à l'université des sciences technologiques
Houari Boumediene
SAADI A.E.K Promoteur
chargé de cours à l'Institut d'Agronomie de Chlef
KHILIFI L examinateur
maître de conférences à L'INA d'EL HARACH
ELSHAMAKHANI H examinateur
Professeur à l'université Hassiba Ben Bouali de
Chlef
Remerciements
Je tiens à remercier Monsieur. SAADI
A.E.K , chargé de cours à l'Institut d'Agronomie de
Chlef, d'avoir accepté d'être le rapporteur de ce travail et
soutenu par son attitude à la fois compréhensive et bienveillante
durant toute ma formation . Je le remercie également pour la minutie et
la rigueur de ces critiques toujours constructives formulées lors de la
rédaction de ce manuscrit.
Mes vifs remerciements s'adressent à Madame
BOUGUEDOURA N, professeur à l'université des
sciences technologiques Houari Boumediene, qui m'a fait l'honneur d'avoir
accepté de présider le jury en dépit de ces nombreuses
occupations, en m'apportant ces observations et ces critiques.
Je tiens à exprimer mes sincères
remerciements à Monsieur KHILIFI L, maître de
conférence à L'INA d'EL HARACH pour avoir accepter d'honorer
par sa présence le jury malgré ces nombreuses tâches.
Je remercie vivement Monsieur ELSHAMAKHANI
H , professeur à l'université Hassiba Ben Bouali de
Chlef qui a bienvoulu accepter de faire partie du jury.
J'aimerais exprimer ma reconnaissance aux responsables
de l'université Hassiba Ben Bouali et plus particulièrement
à Messieurs : Le recteur de l'université Mr
OUAGUED A , le directeur adjoint chargé des
études Mr DILMI BOURRAS A.E.K, le directeur de
l'institut d'Agronomie Mr KOUDJIL M et le chef de
département de Biologie Mr BOUTIBA A.E.K pour leurs
aides et leurs encouragements.
Mes remerciements s'adressent aussi à tous le
staff enseignant de l'Institut de biologie de l'université Houari
Boumediene, en particulier Mr BOUKHROUFA F
et son équipe du laboratoire de Biologie marine et
Mr AMRANI S et son équipe du
laboratoire de Biologie des sols, pour leur bon accueil et leur aide à
la réalisation des coupes histologiques.
Je ne serais oublier Mr HOUARI A.E.K
pour son aide , sa disponibilité au laboratoire de
phytopathologie de l'institut des Sciences agronomiques et biologiques de
chlef, ces orientations et ces précieux conseils ,
qui `il trouve en ces lignes le témoignage de mon grand respect et
mes sincères remerciements .
Je remercie toutes les personnes qui m'ont aidée
au cours de ce travail, réalisé au laboratoire de physiologie
végétale de l'Institut d'Agronomie de Chlef. Leur collaboration,
leur assistance technique, leurs conseils et leur encouragement m'ont
été très profitables et ont puissamment contribué
à mener à bien cette étude.
Dédicaces
A la mémoire de ma mère
A mon père
A celui qui m'a enseigné le respect de la science
A mes frères
A mes soeurs
Résumé du travail
Compte tenu de l'absence d'étude ayant
porté sur la régénération in-vitro du
Scorpiurus
au cours de la recherche bibliographique que nous avons
entrepris et ce qui nous a permis d'orienter notre étude vers la
recherche d'une méthode de régénération
in-vitro et de tester les aptitudes à la
régénération de huit génotypes de
Scorpiurus . Le présent travail représente un
prélude pour l'amélioration génétique du
Scorpiurus . Les voies à explorer sont l'organogenèse
(formation de nouveaux bourgeons) ou d'embryogenèse somatique (formation
d'embryons somatiques).
Concernant l'organogenèse, les résultats
révèlent que les milieux riche en cytokinines par rapport aux
auxines(souvent les combinaisons hormonales 2,4-D x BA) permettent l'obtention
de bourgeons néoformés à partir d'explants de racines,
d'hypocotyle et de cotylédons avec l'ensemble des génotypes
testés . Les bourgeons apparaissent au bout de 12 à 15 jours de
cultures sur milieu d'induction.
L'enracinement des bourgeons néoformés, sur les
milieux généralement pauvres ou complètement
dépourvus de cytokinines a permis leur développement et aussi
leur enracinement
Le transfert des plantules obtenues lors de la phase
d'enracinement, sur pots n'ont pas permis à celle ci de poursuivre
normalement leur développement. .
En ce qui concerne l'embryogenèse somatique, les
embryons se forment soit directement sur l'explant ( embryogenèse
somatique directe) soit indirectement sur un cal(embryogenèse somatique
indirecte ) . Les embryons sont obtenus après un mois de culture sur
milieu de culture unique et contenant une combinaison hormonale auxine x
cytokinine(2,4-D x BA , 2,4-D x Kin, AIA x BA et AIA x Kin ) . Les meilleures
productions embryogènes sont obtenues avec les explants hypocotyles et
cotylédons des génotypes de l'espèce Scorpiurus
vermiculatus et de l'espèce Scorpiurus subvillosus
Les embryons somatiques sont transférer ensuite sur un
milieu de germination appauvris ou dépourvue de régulateurs de
croissance.
Mots clés : Scorpiurus ,
Organogenèse , embryogenèse somatique , milieux de culture ,
explant , génotype .
Liste des
tableaux
Tableau 1 : Résultats des
analyses de la composition chimique des espèces de
Scorpiurus, Médicago et Onobrychis.
Tableau 2 : Plantes
régénérées par embryogenèse somatique chez
les légumineuses
Tableau 3 : Variation de l'aptitude
à la callogénèse en fonction de la composition hormonale
du milieu et du génotype chez le Scorpiurus
Tableau 4: Variation de l'aptitude à
la callogénèse en fonction de la composition hormonale du milieu
et du génotype chez Scorpiurus
Tableau 5 : Effet de la composition
hormonale du milieu sur la rhizogenèse
Tableau 6: Aptitude rhizogène des
explants
Tableau 7: Aptitudes des huit
génotypes de Scorpiurus à la rhizogenèse
Tableau 8 : Effet de la composition
hormonale du milieu sur la caulogenèse
Tableau 9 : Aptitude caulogène des
explants
Tableau 10: Aptitudes des huit
génotypes de Scorpiurus à la caulogenèse
Tableau 11 :Effet de l'interaction
génotype * explants sur la caulogenèse .
Tableau 12 : Effet de l'interaction
explant * composition hormonale du milieu sur la caulogenèse.
Tableau 13 : Effet de l'interaction
génotype * composition hormonale du milieu sur la
caulogenèse.
Tableau 14: Effet de l'interaction
composition hormonale du milieu * génotype * explant sur la
caulogénèse.
Tableau 15 : Tableau d'analyse de la
variance à 3 facteurs croisés(caulogenèse) .
Tableau 16: Effet de la source
carbonée sur la caulogenèse
Tableau 17 : Influence de la source
carbonée, sur l'aptitude caulogène des explants du
génotype V12
Tableau 18 : Effet de la composition
hormonale du milieu sur l'embryogenèse somatique
Tableau 19: Aptitude des explants à
l'embryogenèse somatique .
Tableau 20: Aptitude des huit
génotypes de Scorpiurus à l'embryogenèse
somatique
Tableau 21 : Effet de l'interaction
génotype * explant sur l'embryogenèse somatique.
Tableau 22: Effet de l'interaction explant *
composition hormonale du milieu sur l'embryogenèse somatique.
Tableau 23 : Effet de l'interaction
génotype * composition hormonale du milieu sur l'embryogenèse
somatique.
Tableau 24: Effet de l'interaction
composition hormonale du milieu * génotype * explant sur
l'embryogenèse somatique.
Tableau 25 : Tableau d'analyse de la
variance à 3 facteurs croisés(embryogenèse somatique) .
Tableau 26 : Influence de la source
carbonée, sur l'embryogenèse somatique des explants du
génotypeV12.
Tableau 27 : Influence de la source
carbonée, sur l'aptitude embryogène des explants du
génotype V12.
Tableau 28 : Aptitude
morphogénétique des embryons somatiques en fonction du milieu de
germination
Liste des
Figures
Figure 1 : Les techniques de
micropropagation
Figure 2 : Les Facteurs influant sur
l'aptitude à régénérer in-vitro
Figure 3 : L'aire de répartition
géographique des espèces de Scorpiurus en
Algérie
Figure 4: Variation du pourcentage d'explant
régénérant en fonction du génotype à la
lumière et à l'obscurité.
Figure 5 : Cinétique de croissance des
cals issus d'explants de cotylédons des différents
génotypes sur le milieu d'induction B3D0,1(3mg/l de BA et 0,1 de
2,4-D).
Liste des
Abréviations
|
MS
|
: MURASHIGE et SKOOG, (1962)
|
|
ABA
|
: Acide abscissique
|
|
AIA ou A
|
: Acide - indolylacétique
|
|
ANA ou N
|
: Acide naphtalène acétique
|
|
2,4-D ou D
|
: Acide 2,4- dichlorophénoxyacétique
|
|
BA ou B
|
: 6 - benzyladénine
|
|
Kin ou K
|
: Kinétine ou 6 - furfuryladénine
|
|
GA3 ou G
|
: Gibberélline
|
|
M.A.D
|
: Matière azotée digestible
|
|
M.A.T
|
:Matières Azotées Totales
|
|
M.M
|
: Matières Minérales ;
|
|
C.U.D
|
:Coefficient de Digestibilité de la matière
organique
|
|
C.B
|
: Cellulose Brute
|
|
U.F
|
: Unité Fourragère.
|
|
V6,V12,V13
|
: Scorpiurus vermiculatus ( génotypes)
|
|
B1, B6, B8
|
: Scorpiurus muricatus.ssp subvillosus (
génotypes)
|
|
L26 , L3
|
: Scorpiurus muricatus.ssp sulcatus (
génotypes)
|
|
Emb
|
: Embryogenèse somatique
|
|
Org
|
: Organogenèse
|
|
mg/l
|
: milligramme par litre
|
|
H
|
: Hypocotyle
|
|
C
|
: Cotylédon
|
|
R
|
: Racine
|
Liste des
planches
Planche 1:( A) - Jeune plantule de
Scorpiurus de 20 jours .(B) -Plante adulte de Scorpiurus
au stade floraison .(C) - Fruit en gousse de Scorpiurus
muricatus. (D) - Graine de Scorpiurus muricatus.. (E )- Fruit
en gousse de Scorpiurus vermiculatus .(F) - Graine de Scorpiurus
vermiculatus
Planche 2: -Coupes histologiques
longitudinales réalisées au niveau de bourgeons
néoformés, obtenus par voie directe et indirecte.
Planche 3:-Coupes histologiques
longitudinales réalisées au niveau d'embryons somatiques.
Planche 4: Différents types de cals
obtenus après 20 jours de culture .
Planche 5: Différents types de
racines développées .
Planche 6: Développement de racines
par voie directe et indirecte
Planche 7: Néoformation de bourgeons
par voie directe et indirecte
Planche 8: Bourgeons néoformés
obtenus, sur milieux B3D0,1 (contenant 30 g/l du maltose ( A) et du
glucose ( B)), avec des explants d'hypocotyles.
Planche 9: Formation et développement
des embryons somatiques
Planche 10:. Principales malformations
morphologiques que présentent les embryons somatiques .
Planche 11: Opération d'enracinement
des bourgeons et transfert des plantules en pots .
Planche 12: Germination d'embryons somatique,
après 2 semaines de culture sur milieu B0,1G0,1( 0,1 mg/l de BA et
0,1mg/l de GA3)
CHAPITRE I GENERALITE SUR LES CULTURES
IN-VITRO
1 - APERCU HISTORIQUE SUR LES TECHNIQUES DE CULTURES
IN-VITRO.
2- La MICROPROPAGATION
2.1- Cultures de méristèmes
2.2- Organogenèse
2.2.1-Caulogenèse
2.2.1.1 Définition
2.2.1.2 Origine des bourgeons
2.2.2 Rhizogenèse
2.2.2.1 Définition
2.2.2.2 Origine des racines néoformées
2. 3 Embryogénèse somatique
2.3.1Définition
2.3.2 Origine et développement des embryons
somatiques
2.3.3 Intérêt de l'embryogenèse
somatique
2.4 Facteurs de la
régénérabilité
2.4.1 Effet de l'explant
2.4.2 Influence du génotype
2.4.3 Influence du milieu de culture
2.4.3.1 Les régulateurs de croissance
2.4.3.2 Influence de la source carbonée
3 LES LEGUMINEUSES ET LA MICROPROPAGATION
3.1 Intérêt de la famille des
Légumineuses
3.2 Micropropagation des Légumineuses
in-vitro
4 -OBJECTIF DU TRAVAIL
CHAPITRE II MATERIELS
et METHODES
1 MATERIEL VEGETAL
1.1 Présentation de l'espèce
1.1.1 Classification de l'espèce
1.1.2 Les caractéristiques biologiques de la
plant
1.1.3 Répartition géographique
2-CONDITION DE CULTURE DES PLANTES MERE ET OBTENTION
DES EXPLANTS.
2.1 Origine des graines
2.2 Scarification des graines
2.3 Explants provenant de jeunes plantes
cultivées in- vitro
2.4 Explants provenant de plantes cultivées en
pots
3-TECHNIQUE DE CULTURE IN-VITRO
3.1 Milieux de cultures
3.2 Préparation des explants et ensemencement
3.3 Conduite des cultures
4-EVALUATION DES RESULTATS
4.1 Cas de la callogénèse
4.2 Cas de structures embryogènes ou
organogènes
4.3 Analyse statistique
5- ETUDE HISTOLOGIQUE
CHAPITRE III
RESULTATS
1-ESSAI PRELIMINAIRES
1.1 Introduction
1.2 Résultats obtenus
1.3 Coupe histologiques
1.3.1 Coupe de bourgeons
1.2.3Coupe des embryons somatiques
1.4 Conclusion
2-APTITUDE A LA CALLOGENESE
2.1 Influence des régulateurs de croissance
2.1.1 Action des auxines seules ou
combinées
2.1.2 Action des cytokinines seules ou
combinées.
2.2 Influence de l'explant
2.3Influence du génotype
2.4 Conclusion
3 APTITUDE A L'ORGANOGENESE
3.1Aptitude à la rhizogenèse
3.1.1 Influence de la composition hormonale du milieu
3.1.2 Influence de l'explant
3.1.3 Influence du génotype
3.1.4 Conclusion
3.2 Aptitude à la caulogenèse
3.2.1 Description morphologique
3.2.2 Amélioration de l'induction de la
caulogenèse
3.2.2.1 Influence de la composition hormonale du
milieu
3.2.2.2 Recherche d'explants plus performants
3.2.2.3 Recherche d'un génotype
3.2.2.4 Etude des interactions de l'explant , du
génotype et la composition hormonale du milieu
3.2.2.4.1- Influence de l'origine
génétique des explants sur la caulogenèse
3.2.2.4.2 Conduite des explants en fonction de la
composition hormonale
3.2.2.4.3 Aptitude caulogène des différents
génotypes en fonction de la composition hormonal
3.2.2.4.4 Etude de l'Interaction ( Explant,
Génotype et de la composition hormonale du milieu).
3.2.2.5 Influence de la source carbonée
3.2.3 Conclusion
3.2.4 Enracinement et transplantation
3.2.5 Apparition de structures particulières
4 APTITUDE A L'EMBRYOGENESE SOMATIQUE
4.1 Description morphologique des embryons somatiques
4.2 Amélioration de l'induction de
l'embryogenèse somatique
4.2. 1 Influence de la composition hormonale du
milieu
4.2.2 Recherche de l'explant le plus performant
4.2.3 Effet du génotype
4.2.4 Etude des interaction de l'explant , du
génotype et de la composition hormonale du milieu
4.2.4.1 Influence de l'origine
génétique des explants
4.2.4.2 Conduite des explants en fonction de la
composition hormonale
4.2.4.3 Aptitude embryogène des
différents génotypes en fonction de la composition hormonale
4.2.4.4 Interaction de la composition hormonale du milieu ,du
génotype et de l'explant
4.2.5 Influence de la source carbonée.
4.3 Germination des embryons somatiques
4.4 Conclusion
5 DISCUSSION ET CONCLUSION GENERALE
CHAPITRE I GENERALITE SUR LES CULTURES
IN-VITRO
1 - APERCU HISTORIQUE SUR LES TECHNIQUES DE CULTURES
IN-VITRO.
La multiplication in-vitro trouve son fondement dans
le concept de " totipotence cellulaire " énoncé au début
du siècle : la cellule, unité morphologique et physiologique de
l'être vivant ,est capable d'autonomie . Elle possède toute
l'information génétique nécessaire à
régénérer la plante entière, à condition
bien sûr de créer les conditions favorables à ce
développement . Ce concept énoncé des 1902 par HABERLANDT
, ne sera finalement démontré par STEWARD et son équipe
qu'en 1958 , lorsque ces chercheurs obtiendront les premiers " embryons
artificiels" appelés " embryons somatiques" à partir de cellules
de carotte qui évolueront par la suite en jeunes plantules(ZRYD, 1988;
MARGARA, 1989; AUGE et al.,1989; BOXUS,1995 TOUTE,1998).
En effet le botaniste HABERLANDT fut le premier, en 1902,
à définir exactement le problème de la culture des tissus
et l'a tenter avec des fragments de plantes très diverses Il obtenait
une survie des cellules de quelque mois mais jamais de multiplication (SCHMID
et KELLER,1981) .
En 1934 GAUTHERET eut l'idée d'utiliser le tissu
cambial des arbres. Il avait aussi trouvé le matériel
idéal mais pas encore le milieu nutritif optimal. Ce n'est qu'en 1932
que WHITE aux Etats - Unis obtint des cultures indéfinies de cellules
de tabac. Au même moment GAUTHERET et NOBECOURT publiaient leur
résultats sur la culture indéfinie de tissus de carotte
(TOUTE,1998) .
Le succès fut assuré lorsque, on commença
à ajouter au milieu de culture de l'auxine. En 1946, partant d'apex, BAL
aux USA obtient quelques plantes de lupin. Tandis que WETMORE et MOREL
régénèrent des fougères en 1949. A la même
époque l'équipe de LIMASSET et CORNUET en France
démontrent l'absence de particules virales dans les apex de tabac
(ZRYD,1988).
Ces dernières observations ont été mises
à profil, vers les années 1952, par MOREL et MARTIN qui ont
réussi à obtenir, par culture in-vitro de
méristèmes, des plantes saines (indemnes de viroses ) à
partir de dahlia (CHEVRE,1985).
L'année 1955 été marqué par la
découverte de la Kinétine par SKOOG (substance dotée d'un
grand pouvoir caulogène) a permis de provoquer, presque à
volonté, la néoformation de bourgeons adventifs qui,
traités par de l'acide gibbérellique et des auxines,
s'enracinaient pour donner des plantes entières(TOUTE,1998).
En 1958, STEWARD et son équipe
régénèrent les premiers embryons dits somatiques à
partir de cellules de carotte et confirment que certaines plantes
développées à partir de culture de cellules sont issues
d'embryogenèse asexuée. Dès lors, les expériences
s'accumulèrent avec des plantes aussi diverses que le tabac, la
carotte, le trèfle, le pois, le soja,....etc (SCHMID et KELLER ,1981;
MARGARA,1989; TOUTE,1998).
2- La MICROPROPAGATION
La multiplication végétative par culture
in-vitro ou micropropagation présente plusieurs avantages
sur les méthodes classiques dites " conventionnelles "de propagation .
Cette technique a rendu possible la multiplication d'espèces chez
lesquelles les semences sont rares, ou présentant des difficultés
de germination et/ou dont les techniques de bouturage ou de greffage sont
inapplicables , ce qui a conduit à une plus grande diversité
des plantes commercialisées.
De même plusieurs autres techniques, toutes
dérivées de la culture in-vitro ,ont un rôle
important à jouer dans l'amélioration des performances
agronomiques ou horticoles des plantes cultivées. La micropropagation
est utilisé dans un but de multiplication en masse , puisqu'elle
permet , en partant d'un seul individu (plant), l'obtention d'un nombre
considérable de plantes génétiquement identiques à
la plante mère ( FERRY et al.,1998; SEMAL,1998). Les plants
reproduits ne sont pas seulement conformes mais présentent aussi une
grande uniformité.
Par ailleurs, l'usage de cette technique nécessite
peu d'espace et peu être programmé indépendamment des
saisons. La technique représente donc sans contexte un outil puissant
aux perspectives industrielles et économiques importantes (MARGARA,1982;
BOXUS,1995; SEMAL,1998; SKIRVIN et al., 2000) .
Les techniques de micropropagation empruntent essentiellement
deux voies ,
· L'une qui utilise des tissus
méristématiques (méristème ou apex de tige,
bourgeons axillaires ) potentiellement capable de donner suite, au
développement normal, d'un individu est appelée microbouturage
(SAADI,1991) cette technique est souvent appelée "multiplication
conforme" car elle part de méristème préexistant dans les
quels , les cellules sont génétiquement très stables
(AMATO,1977 in BOXUS,1995),l'individu est généralement obtenu en
deux étapes successives, d'abord la production de tige ,puis son
enracinement .
· L'autre voie, utilise toute sorte tissus
différenciés (fragments de tige, de racines, de pétiole ,
de feuilles, d'embryons matures et immatures ,d'hypocotyles,
cotylédons...etc) pour aboutir à la néoformation soit de
bourgeons ou de racines , c'est l'organogenèse ,soit de structures
ressemblant aux embryons zygotiques, c'est l'embryogenèse somatique
(ZRYD,1988 ; MARGARA,1989).
2.1- Cultures de
méristèmes
les premiers résultats de cultures de
méristèmes appelées communément "cultures d'apex"
furent obtenus par KOTTE et ROBBINS, dés 1922 à partir de
méristème radiculaires de fève et de maïs(
TOUTE,1998).
Dix ans plus tard, WHITE(1934) obtiendra une culture
indéfinie de racines de tomate . En même temps, il s'apercevait
que si le virus de la mosaïque du tabac pouvait se multiplier dans des
racines de tomate isolées , le virus n'atteignait pas les cellules
méristématiques . Plus tard , LIMASSET et CORNUET(1949) montrent
que les organes jeunes de tabac ne renferment que très peu de virus
(TMV) et que les méristèmes apicaux n'en contiennent pas .
En 1952, partant de ces observations, MOREL et MARTIN
tentent de prélever des pointes méristèmatiques de dahlias
viroses pour reproduire des dahlia génétiquement semblables aux
parents, mais exempts de virus . Ils réussiront de la sorte à
éliminer la mosaïque du dahlia et le " spotted wilt virus". En
1955 , ils régénéreront de façons analogue des
pommes de terre atteintes de virus A et Y (BOXUS, 1995).
Depuis lors , la culture de méristèmes à
conduit à des applications nouvelles , originales concernant le domaine
du phytosanitaire, notamment pour l'éradication de nombreuses maladies
(viroses, mycose, mycoplasmoses, bactérioses) et a permis la
régénération d'un grand nombre d'espèce saines
(TOUTE, 1998).
Les méristèmes qui sont des tissus de formation,
en expansion continue ,confèrent à la plante une
organogenèse permanente chez les végétaux
supérieurs. Ils représentent des petits massifs de cellules
indifférenciées (0.1mm) et conservent la capacité de se
diviser activement. Ces zones méristèmatiques gardent
jusqu'à leur mort le caractère juvénile. Elles jouent un
rôle capital dans le développement végétal
puisqu'elle édifient tous les organes (CAMEFORT, 1977; MARGARA, 1989).
En multipliant le méristème
prélevé au sommet d'une plante ou dans le bourgeon axillaire, le
plus souvent indemne de maladies. On pourra très rapidement obtenir de
nombreuses plantes, toutes semblables du point de vue génétique
et débarrassées de maladies dont elles étaient
affectées (SCHMID et KELLER, 1984; SAMA et al., 1998;). Il est
même possible de reconstituer des clones indemnes de maladies à
partir de pieds -mères malades. D'après TOUTE, 1998; FLETCHER et
al. ,1998 , il existe plus de 50 espèces
végétales qui ont été ainsi assainies c'est le
cas de la pomme de terre , la canne à sucre , de dahlia ..etc .
La culture de méristème est la méthode
la plus généralisable et la plus sûre pour éviter
l'apparition de plantes non conformes à la plante mère ou
variants (SAADI, 1991) . Elle paraît plus intéressante chez les
plantes allogames ou il est généralement impossible de conserver
des génotypes intacts par reproduction sexuée classique.
2.2- Organogenèse
l'organogenèse est la base fondamentale de la
multiplication végétative , laquelle s'appuie toujours sur la
formation de méristèmes nouveaux (MARGARA,1989). En partant d'un
explant , elle aboutit à la formation d'un nouvel individu par
l'élaboration de bourgeons (caulogenèse ) et de racine
(rhizogenèse).
2.2.1-Caulogenèse
2.2.1.1 Définition
La caulogenèse désigne à la fois
l'initiation et le développement des bourgeons terminaux, axillaires,
adventifs ou néoformés sur un cal.
· Les bourgeons terminaux dérivent de la
gemmule de l'embryon.
· Les bourgeons axillaires sont produits
généralement par les deux ou trois assises cellulaires
superficielles de la tige.
· Les bourgeons adventifs sont formés en
des endroits inhabituels. Ils sont formés à partir d'organes
différenciés de la plante (entre noueds, tubercules, racines).
Ils peuvent avoir pour origine des massifs cellulaires restés
méristèmatiques ou bien provenir d'une différenciation de
certaines cellules(CAMEFORT, 1977).
· Les bourgeons néoformés in-vitro
peuvent apparaître sur l'explant initial ou sur un cal, ils peuvent
être considérés comme un cas particulier de bourgeons
adventifs BOXUS, 1995). Ils sont induits sur n'importe quel type d'organe ou de
tissu y compris sur ceux qui ne les produisent pas dans les conditions
naturelles (CAMEFORT, 1977; ZRYD, 1988; MARGARA, 1989).
2.2.1.2 Origine des bourgeons
Les études cytologiques, conduites dans le but de
déterminer l'origine des bourgeons néoformés à
partir d'un fragment d'organe contenant divers tissus montrent souvent que
l'aptitude à la caulogenèse se manifeste à partir de
certaines catégories de tissus telle que: le cambium ,le parenchyme
vasculaire ou libérien (BELANGER, 1998; FORTES et PAIS, 2000).
L'intensité de cette néoformation est nettement
dépendante de la nature des tissus contenus dans l'explant. Elle est
maximale pour les tissus cambiaux, élevée pour les tissus du
phloème et du xylème, très faible ou nulle pour le
parenchyme cortical ou médulaire (MARGARA, 1989) .
Chez les conifères, comme le pin , les premières
divisions périclines apparaissent dans les couches
subépidermiques du mésophylle, l'origine des pousses caulinaires
parait être unicellulaire. Par contre chez les Angiospermes, l'origine
peut être pluricellulaire, des méristèmes peuvent se former
à partir de cellules épidermique ou encore à partir de
tissus palissadiques, du mésophylle spongieux ou de la gaine
perivasculaire des explants cultivés (BOXUS, 1995).
2.2.2
Rhizogenèse
2.2.2.1 Définition
La rhizogenèse désigne la néoformation
et la croissance de racine. Les méristèmes de racines se
répartissent en plusieurs catégories selon leurs origines.
· Les racines latérales se forment de
manière spontanée sur la racine principale dans les conditions
naturelles.
· Les racines adventives sont produites par des
organes divers, soit spontanément, soit accidentellement à la
suite d'une blessure ou d'une manière provoquée, dans les
conditions du bouturage et du marcottage.
· Les racines néoformées, au sein
d'un cal, en culture in-vitro, peuvent être
considérées comme un cas particulier de méristèmes
adventifs (rhizogenèse indirecte) ou l'émission de racines sur un
explant dans des endroits inhabituelles (rhizogenèse directe).
2.2.2.2- Origine des racines
néoformées
La rhizogenèse est un phénomène
complexe, il comporte différentes phases : la
dédifférenciation, formation d'amas de cellules
méristèmatiques , différenciation et organisation des amas
méristèmatiques en primordium racinaire qui se
développeront en jeunes racines ( MARGARA , 1989; BOXUS, 1995).
L'origine des cellules impliquées dans la cicatrisation
dépend de l'espèce. FAVRE (1985) inBOXUS,(1995)sur son
modèle vigne relève que ce sont les cellules du phloème
primaire qui réagissent les premières. Les cellules non
lignifiées d'origine secondaire et le parenchyme cortical, ou même
la moelle peuvent également réagir en formant un tissu
cicatriciel plus ou moins important. Mais dans tous les cas, c'est l'assise
génératrice libéro- ligneuse ( combium) qui donne, des
tissus de bonne aptitude callogène. Le cal est formé
essentiellement de cellules de type méristèmatique secondaire,
qui incorporent certaines cellules voisines parenchymateuses . Les cellules
méristèmatiques se différencient par la suite et
s'organisent pour donner naissance à une nouvelle racine.
2.3-Embryogénèse somatique
2.3.1-Définition
Classiquement, l'embryon est défini comme
étant une plante se trouvant au stade initial de son
développement. Il s'agit en fait d'une structure bipolaire ( munie de
deux méristèmes : l'un caulinaire et l'autre racinaire) qui,
suite au processus de germination, donne naissance à une nouvelle
plante.
Habituellement, l'embryon s'édifie à partir
d'une cellule initiale, le zygote, formé lors de la reproduction
sexuée (embryon zygotique) .
Cependant, d'autres types d' embryons peuvent
également se développer à partir de cellules du sporophyte
ou du gamétophyte, embryons qui ne sont pas le produit d'une fusion
gamétique et qui sont appelés "embryons somatiques" . Parfois,
chez certains espèces, ils résultent d'une embryogenèse
somatique naturelle qualifiée d'apomixie . Dans certains cas en effet,
les anthérozoîdes , l'oosphère , voire d'autres cellules
gamétophytiques peuvent engendrer des embryons
parthénogénétiques. Dans d'autres cas, certaines cellules
sporophytiques localisées au niveau des tissus intra-ovulaire, en
particulier le nucelle, fournissent naturellement des embryons
apoméiotiques appelés aussi "embryons nucellaires. Ce type
d'embryogenèse est très développé dans la famille
des Rutacées, spécialement chez les Citrus (TISSERAT et
al., 1979;VARDI et al., 1990) Toutefois, cette appellation
est essentiellement appliquée , selon certains auteurs comme PIATTI,
(1988) et MARGARA, (1989), aux embryons obtenus à partir de culture de
tissus in-vitro du sporophyte .
2.3.2 - Origine et développement des
embryons somatiques
Les donnés cytologiques montrent que les embryons
somatiques ont pour origine des cellules particulières; dites
embryogènes. Elles présentent des caractères de cellules
méristèmatiques primaires: petites tailles, cytoplasme dense,
gros noyaux aux nucléoles proéminents et petites vacuoles.
Elles fixent de manière intense les colorants ce qui
les rend aisément repérables en cytologie(JULLIEN, 1991 ;LOISEAU
et al .,1998; VASLENKO et al, 2000).
Selon SHARP et al (1980)in PIATTI
(1988)décrivent deux voies pour l'embryogenèse somatique:
La première dite est l'embryogenèse directe
où les embryons sont initiés à partir de tissus en absence
de prolifération de cal. Ceci se produit à partir des cellules
pré-embryogéniques déterminées (P.E.D.C) ou les
cellules sont déjà engagées dans un développement
embryogène et ils ont besoins seulement d'être
libérées (PIATTI,1988; ROUGET,1989). Elle semblent
préexister dans les tissus de certains explants comme les embryons
immatures ou les fragments de très jeunes plantes (SAADI, 1991) .
La seconde dite est l'embryogenèse somatique indirecte,
pour la quelle une prolifération cellulaire est requise. Les travaux de
SHARP (1980) et d'EVANS (1981) in PIATTI(1988) ont également pu
servire à mettre en évidence, l'existence de cellules
initiatrices qui sont déjà différenciées mais
dépourvues de capacité embryogènes. Ils les nomment des
cellules pré-embryogènes indéterminées(PEIC).Les
cellules embryogènes apparaissent tardivement au sein du cal produit par
la réactivation mitotique des cellules différenciées et/
ou la prolifération des cambiums obtenus à partir d'explants de
type racines, tige ou de feuille(JULLIEN,1991 ; RUGKHLA et JONES , 1998)).
Leurs multiplications aboutit à la formation de groupes de cellules
embryogènes "nodules méristèmatiques" dispersés,
parmi les autres cellules du cal et qui sont généralement de type
parenchymateux. A la suite de leur repiquage sur des milieux dépourvus
d'auxines, ces nodules évoluent en des embryons somatiques comme c'est
le cas chez la carotte (SAADI,1991).
Les embryons somatiques connaissent les même stades de
développement morphlogiques que traversent habituellement les embryons
zygotiques à savoir : stade globulaire, cordiforme, torpille et
cotylédonaire(EGERTSDOTTER et ARNOLD , 1998). Ils ont une structure
chromosomique souvent semblable à celle de la plante- mère dont
ils sont issus (NUTI RANCHI, 1995) . Le critère qui permet de
reconnaître un embryon somatique est certainement sa structure
bipolaire, qui développe précocement et simultanément un
méristème caulinaire et un méristème racinaire
(NORREL, 1973 ; NUTI RANCHI , 1990).
2.3.3 Intérêt de l'embryogenèse
somatique
Historiquement , les premiers embryons somatiques ont
été signalés, en 1958, par l'équipe de REINERT
& STUART sur des cultures du parenchyme libérien de racine de
carotte (BELANGER, 1998).Depuis et grâce au progrès
spectaculaire que connaît les techniques de cultures in-vitro,
la production d'embryons somatiques est devenue possible chez un grand nombre
d'espèces végétales.
Comparativement aux autres voies de multiplication
végétative in-vitro , l'embryogenèse somatique se
montre plus séduisante en terme de performance et d'efficacité
(HARKMAN et ARNOLD , 1985 ; PIATTI, 1988). En effet, la maîtrise de
la production d'embryons, chez certaines espèces, via les suspensions
cellulaires permet d'obtenir des milliers d'embryons par litre de milieu de
culture et par conséquent la régénération de
milliers de plants. L'embryogenèse somatique permet aussi en un temps
très court de produire des plantes entières sans passer par les
contraintes que connaît habituellement l'organogenèse ( phase de
caulogenèse et de rhizogenèse) (DAIKH et DEMARLY, 1987 ;
ROGUET, 1989).
La voie de l'embryogenèse somatique est actuellement
intégrée dans de nombreux schémas de sélection
puisqu'elle permet de diminuer sensiblement la longueur des cycles
d'amélioration comme par exemple , le temps nécessaire à
la valorisation du matériel sélectionné âgé
ou juvénile ou la production de parents hybrides nécessaires
à la diffusion de nouvelles variétés (DEMARLY et SIBI,
1989 ; DEMARLY, 1994; STANANTINO et al., 1998; LOISEAU et
al., 1998; TREMBLAY et al., 1999). De telles applications
ont été réalisées chez plusieurs espèces
comme le café (CARNEIRO, 1999) ; la carotte (TOUTE,1998); la luzerne
(REDENBOUGH et al., 1986 FUJII et al., 1987 ; STUART et
al., 1987 ; RAY et BINGHAM, 1989) ;Asparagus officinalis
(MAMIYA et SAKAMOTO , 2001); le palmier dattier (FERRY et al, 1998)
et le palmier à huile (RIVAL et al., 1998).
2.4 Facteurs de la
régénérabilité
Les facteurs influant sur la
régénérabilité in-vitro peuvent être
schématiquement répartis en 2 groupes ( figure 2) . Le premier
représente Les facteurs internes , ( ceux liés à la
plante) et concerne d'une part le génotype , la nature et l'âge
ontogénique de l'explant et d'autre part l'état physiologique de
la plante mère sur laquelle, l'explant a été
prélevé . Le second réunit les différents facteurs
externes qui englobent et les milieux (notamment leur composition en
régulateurs de croissance et les sucres ) et les conditions de
cultures.
2.4.1- Effet de l'explant
Un des atouts majeurs de la culture in-vitro
est de montrer que des cellules somatiques (à 2n chromosomes) ,
pouvaient produire , soit des structures comparables à des embryons
somatiques, soit à des bourgeons et dont le développement permet
de régénérer des plantes conformes à la plante
mère . Pratiquement, n'importent quel organe(bourgeon, racine,
feuille, anthère, etc.) ou fragment d'organe (explant),
prélevé sur celle-ci , peut être cultivé
isolément sur milieu nutritif synthétique, mais le choix de
celui-ci est d'une importance primordiale . On retiendra cependant que la
réponse in-vitro est sous la dépendance de nombreux
facteurs .
· L'age physiologique et ontogénique de
l'organe
Généralement dans les cultures
in-vitro ,on privilégiera les explants les plus jeunes
(embryons immatures , jeunes feuilles , méristèmes etc.) car
c'est l'état juvénile qui semble offrir le plus de
possibilités de régénération ( DAVIS, 1986.,SAADI,
1991). Souvent , ce sont les tissus provenant d'embryons qui expriment le plus
souvent, d'une manière nette et reproductible, l'aptitude à la
régénération, .C'est le cas par exemple du pois (SAADI,
1991); du lupin (DESIRE, 1988) , du coton (BRAR et al. , 1998) ; du
soja (SANTAREM et al ., 1997); du tournesol(CHARNIERE et
al., 1999) ; Pinus sylvestris ( HAGGMAN et al .,
1999) et bien d'autres espèces.
Figure 2 : Les facteurs influants sur l'aptitude à
régénérer in-vitro
· L'époque du
prélèvement
Ce problème se pose surtout pour les espèces
vivaces, on peut distinguer un stade de vie active et un stade de vie ralentie
de la plante ce qui conduit les explants à développer des
réactions différentes en culture in-vitro. Cette
différence peut être expliquée par la modification des
équilibres internes des régulateurs de croissance (auxines,
cytokinines, gibbérelline ...) lors des différentes saisons (AUGE
et al., 1989) .
· La taille de l'explant
Plus la taille est importante et plus les équilibres
endogènes sont déterminants et les conditions extérieures
seront influentes . La taille choisie variera selon la nature de l'explant . si
le tissu végétal est de nature organisée , un ensemble
assez complet sera nécessaire ( soit un noeud , un apex , ou un bourgeon
entier ) mais dans le cas d'une structure différenciée (
éléments de feuilles , de tige, de racines ,inflorescence..) des
fragments de 5à 10 mm suffiront ( ZRYD, 1988., AUGE et al .,
1989; HANNWEG et al ., 1996).
D'une manière générale, il existe
des tissus privilégiés appelés «tissus
cibles » qui répondent à un stimulus indicateur qui
orientera son programme morphogénétique vers une voie
particulière de développement contrairement à certains
tissus récalcitrants aux manipulations in-vitro, dues
essentiellement à un manque de compétence cellulaire(COLEMAN et
ERNST, 1990 ; NUTI RONCHI, 1995 ; YADAV et RAJAM , 1998).
2.4.2-Influence du
génotype
La plupart des plantes montrent une
régénération génotypique spécifique
liée à l'espèce. A l'intérieur d'une même
espèce, un génotype donne des bourgeons tandis qu'un autre ne
peut fournir que des embryons(AUGE et al ., 1989) . Cependant,
plusieurs auteurs mentionnent que seulement certains génotypes
paraissent posséder la capacité d'induire une embryogenèse
somatique . Cette capacité, chez beaucoup d'espèce semble
être génotypiquement contrôlé ( GEORGE et
SHERRINGTON , 1984 ., BROWN, 1988 ; DODEMAN et al ., 1997 ) .
Un tel contrôle de la
régénération ( par la voie de l'embryogenèse
somatique ou de la caulogenèse ) a été rapporté
chez les Légumineuses fourragères est spécialement chez
la luzerne par BROWN et ATANASSOV (1985); Trifolium repens par
PARROT (1991) et bien d'autres espèces . BENCHEIKH et GALLAIS (1996 )
indiquent la présence de quelques gènes majors pouvant
contrôler l'embryogenèse somatique chez le pois. De même
BINGHAM et al (1975) ont réussit à augmenter
considérablement la fréquence embryogène chez
Médicago sativa après deux étapes de
sélection récurrente. REISCH et BINGHAM , (1980) trouvent chez un
génotype de luzerne diploïde que la différenciation de
bourgeons à partir de cal est contrôlée par deux
gènes dominants désignés Rn1 et Rn2 dont la
présence simultanée permet un taux élevé de
régénération ( plus de 75 % des explants) .
L'hétérogénéité existante chez les
Légumineuses fourragères, permet d'expliquer la facilité
à identifier les génotypes favorables à la
régénération .
2.4.3-Influence du milieu de culture
Avec le développement des cultures de tissus , divers
milieux de base comprenant des sels inorganiques , des composés
organiques ( sucres , vitamines et régulateurs de croissances ) ont
été progressivement utilisés .Certains milieux
proposés dans un but donné sont en fait utilisables d'une
manière beaucoup plus étendue.
Les milieux de culture sélectionnés doivent
être le plus parfaitement adaptés aux besoins nutritifs de la
plante soumise à l'étude afin de laisser s'exprimer pleinement
son potentiel génétique.
Les principaux constituants d'un
milieu de culture sont généralement représentés
par les macro et les micro-éléments, une source carbonée
et azotée, des vitamines et des régulateurs de croissance.
Selon EVANS et al , (1981) ,dans 70% des cas , des
milieux de culture de base de type MURASHIGE et SKOOG (MS) ont
été utilisés. Il a été employer d'une
manière générale pour tous les types de cultures
in-vitro . Mais c'est essentiellement pour le déclenchement de
l'organogenèse , en particulier pour la néoformation de
bourgeons que s'est révélé nettement supérieur
à d'autres milieux (MARGARA, 1989) c'est le cas du Cunila
galioides ( FRACARO et ECHEVERRIGARAY , 2001).
Le milieu de MURASHIGE et SKOOG est caractérisé
principalement par une très forte teneur en sels minéraux , en
particulier en potassium et par une concentration également
élevée en azote (60méq/l environ sous forme de nitrate et
d'ammonium ) dont 1/3 apporté sous forme réduite (ionsNH4+); le
rapport nitrate / ammonium, dans ce milieu est très favorable à
l'induction de l'embryogenèse somatique , en particulier chez
Feijoa sellowiana (DEL VESCO et GUERRA , 2001).
Il apparaît à travers la recherche
bibliographique que nous avons effectuées , qu'il existe deux
composantes majeurs du milieu qui peuvent intervenir dans l'orientation du
phénomène de morphogenèse et qui sont
représentées par les régulateurs de croissances et la
source carbonée.
2.4.3.1-Les régulateurs de
croissance
Un régulateur de croissance est défini comme
étant, une substance qui, suivant sa concentration absolue ou relative
dans le milieu, peut supprimer, permettre ou modifier sous certaines conditions
les processus de cytodifférenciations (STREET, 1977).
Aucun régulateur de croissance ne provoque une
initiation directe du phénomène d'organogenèse ou
d'embryogenèse somatique , mais il interfère dans de nombreux
métabolismes internes de la cellule végétale.
l'organogenèse est fortement influencée par les
régulateurs de croissance. Les deux hormones, les plus souvent
utilisés, d'une manière conjointe ou séquentielle, sont
les auxines et les cytokinines. NITSH et NOUGAREDE ,(1967) ont montré
que des explants de parenchyme médullaire de tabac cultivés
in-vitro dans un milieu ne contenant ni auxine ,ni cytokinine ne
prolifèrent pas. Il en était de même lorsque seulement une
auxine ou une cytokinine était incorporée au milieu. Par contre ,
la prolifération cellulaire se déclenchait lorsque ces deux
substances sont présentes dans le même milieu de culture.
Le rapport hormonal (auxine/ cytokinine) conditionne, en
grande partie, le type de néoformation obtenu. Ce rapport a conduit,
dans le cas de la culture in-vitro du parenchyme médullaire de
tabac, par exemple , à l'orientation des tissus, soit vers la
caulogenèse , soit vers la rhizogenèse (SKOOG et MILLER, 1957 in
ZRYD ,1988). Ainsi la néoformation de bourgeons est souvent
favorisée par des teneurs élevées en cytokinine (FRETT,
1977; WALKER et al., 1979; MARGARA , 1989; ABRIE et STADN , 2001;
COMPTON et al., 2001; TANG et GUO, 2001 ) alors que les fortes
doses en auxines stimulent la formation de racines et améliorent leurs
qualités (DRUART, 1992, HOBBIE, 1998; ABRIE et STADN , 2001; COMPTON et
al., 2001).
L'influence de ce rapport hormonal n'est, cependant , pas une
règle générale pour toutes les espèces
végétales . En effet, il suffit, dans certains cas, d'ajouter au
milieu de culture l'un ou l'autre des deux régulateurs
précités pour parvenir à une réponse
morphogénétique (SEON et al. , 1998). Dans ce cas
précis, nous pouvons citer deux exemples : le premier, concerne
le Tritical où l'organogenèse a été obtenue en se
servant uniquement d'auxine ( milieu dépourvu de cytokinine) (VIKRANT
et RASHID , 2001) ; le second, touche l'espèce Piper barberi
gamble où l'équipe d'ANAND et RAO,(2000) a obtenu des
bourgeons néoformés en utilisant des cytokinines seules dans le
milieu d'induction
Par ailleurs ,il est important de dire, en se basant sur la
diversité des réponses obtenues dans ce domaine , qu'il n'existe
pas de règle générale, concernant l'efficacité des
différentes auxines et cytokinines sur la caulogenèse ou sur la
rhizogenèse. Les effets paraissent varier essentiellement avec le
matériel végétal employé.
Tout comme l'organogenèse, Les régulateurs de
croissance de type auxine et cytokinine sont aussi indispensables à
l'embryogenèse somatique.
La production d'embryons somatique est
généralement obtenue en deux phases de culture, sur des milieux
qui différent essentiellement par leurs concentrations en
régulateurs de croissance (AUGE et al., 1989). Par
exemple, chez la carotte ou la luzerne, les embryons sont obtenus en deux
phases: Une phase dite d'induction réalisé sur un
milieu souvent riche en régulateurs de croissance en
particulier en auxines permet la formation et / ou la prolifération
des cellules embryogènes. Ces cellules n'évolueront en embryons
qu'au cours d'une deuxième phase dite de développement
qui se réalise au moyen d'un transfert de tissus induits, sur un nouveau
milieu moins riche , voir dépourvu de régulateurs de croissance
essentiellement en auxines (SAADI, 1991 ; GIORGETTI et al.,1995) .
Cette façon de faire ou plutôt ce schéma
de transfert a été appliqué avec succès dans de
nombreux travaux de recherche portant sur l'obtention de l'embryogenèse
somatique . Nous citons, à titre d'exemple, les travaux
réalisés à partir d'embryons immatures de graminées
(JULLIEN, 1991) , de pois (SAADI, 1991), de coconut (NAIR et al .,
1999) , de Pinus sylvestris ( HAGGMAN et al ., 1999) ,
d'Arabidopsis thaliana ( GAJ, 2001 ) ; de boutons floraux du bananier
(ESCALANT et al., 1994) ; d'hypocotyles du tournesol (LAPARRA et
al., 1997) ; des feuilles du Santalum album et Santalum
spicatum (RUGKHLA et JONES , 1998); etc...
Le transfert des tissus d'un milieu riche en auxine vers un
milieu pauvre n'est pas toujours indispensable pour le déroulement des
différentes phases annoncées précédemment.
L'exemple des travaux de MAHESWAREN et WILIAMS, (1984), portant sur
l'embryogenèse du trèfle et la luzerne, est très
significatif puisqu'ils ont réussi à obtenir, des embryons
somatiques, directement sur les explants d'embryons immatures cultivés
sur un milieu riche en cytokinine et totalement dépourvu d'auxine. C'est
l'exemple aussi des travaux de KRISTEN et al., 2000
réalisés sur les explants de pétioles de Echinecea
purpurea L
Par contre d'autres cultures exigent en phase inductive, la
présence conjointe d'une auxine et d'une cytokinine, c'est le cas de la
luzerne (JULLIEN, 1991); du papayer (MONMARSON et al., 1994); du
cocotier (SERGE, 1998) ; du caféier (CARNEIRO, 1999) et bien
d'autres espèces.
Il est utile de rappeler , que les auxines les plus souvent
utilisées en organogenèse ou en embryogenèse somatique
sont le 2,4-D, l'AIA, l'AIB et l'ANA. A cause de son bon pouvoir inducteur,
le 2,4 -D semble détenir, d'après EVANS et al., 1981, le
record d'utilisation dans les études portant sur l'embryogenèse
somatique (puisque 57 % des travaux de recherche l'utilisent comme
régulateur). Quand aux cytokinines , elles sont
représentées par la Kinétine, , la benzyladenine (BA), la
2- isopentenyladénine et la zéatine.
Outre, les auxines et les cytokinines, d'autres
régulateurs de croissance peuvent intervenir dans le processus
d'organogenèse ou d'embryogenèse somatique tels que les
gibbérellines et l'acide abscissique (ABA) ; cependant, leur
utilisation reste limiter . Les gibbérellines, selon JAYASREE et al,
2001, stimulent fortement la production de bougeons néoformés
chez la pomme de terre lorsqu'elles sont combinées aux cytokinines. Par
contre, d'après MARGARA, 1989, les gibberellines ont la
réputation d'inhiber l'organogenèse et particulièrement la
rhizogenèse chez le Chou-fleur.
L'acide abscissique (ABA) quant à lui, est
employé par certains auteurs dans le but de corriger ou
d'améliorer la qualité morphologique des embryons (UNNIKRISHAN et
al., 1990 ; DODEMAN et al., 1997). Son usage peut inhiber,
en même temps, le déclenchement éventuel d'une
embryogenèse secondaire et empêche la germination précoce
des embryons somatiques MILENA et al., 1998; SVOBODOVA et
al ., 1999).
2.4.3.2-Influence de la source
carbonée
Les tissus en cultures in-vitro sont largement
hétérotrophes via à vis du carbone en raison de l'absence
ou de l'insuffisance de l'assimilation chlorophyllienne. Il est donc
indispensable d'ajouter une source carbonée (des glucides) au milieu de
culture. Les glucides remplissent deux fonctions principales dans les milieux
de culture ; ils fournissent de l'énergie nécessaire pour la
croissance des tissus et maintiennent une pression osmotique donnée du
milieu de culture (ZRYD, 1988). Cette pression osmotique, appelée aussi
« effet osmoticum , peut avoir diverses actions sur les tissus.
Elle agit , dans certains cas , sur l'orientation ou l'expression
morphogénétique des tissus (BELAIZI et BOXUS, 1995; CHARNIERE et
al., 1999), dans d'autres , sur la maturation des embryons somatiques
produits (WALKER et PARROTT, 2001) .
Les glucides, les plus généralement
utilisés sont le saccharose et le glucose (MARGARA,1989; DRUART et
SAMYN,1995). Selon certains auteurs, le maltose peut constituer une bonne
source carbonée puisqu'il permet , dans certains travaux portant sue
l'embryogenèse, d'améliorer à la fois, et la
qualité et la quantité des embryons somatiques produits ( SAADI
, 1991).
L'organogenèse ou l'embryogenèse somatique ne
semblent pas être influencées uniquement par la nature des sucres
mais aussi, et pour un même sucre, par sa concentration dans le milieu de
culture. Généralement, selon PIATTI, 1988, les doses
employées oscillent entre 2 et 12 %.
L'effet dose peut avoir, comme nous l'avons signalé
ultérieurement, une grande influence sur le devenir
morphogénétique des cultures. Dans ce cas , l'exemple du
tournesol est très significatif, l'usage d'une concentration de 12% en
saccharose peut orienter le processus vers la voie de l'embryogenèse
somatique, alors qu'une concentration de 3 % conduirait vers la
néoformation de bourgeons (CHARNIERE,1999).
3 LES LEGUMINEUSES ET LA MICROPROPAGATION
3-1 Intérêt de la famille des
Légumineuses
La famille des Légumineuses renferme environs 600
genres et 12000espèces, disperser dans le monde (DESIRE, 1988).
Généralement, elle est divisée en deux classes :
Légumineuses fourragères et les Légumineuses à
graines .
Ces espèces présentent une importance
agronomique particulière. Les cultures de certaines Légumineuses
sont d'un intérêt de premier ordre , du fait de leur mode de
nutrition azotée ( symbiose avec des bactéries du genre
rhizobium, réalisant la fixation de l'azote atmosphérique), car
elles permettent à la fois une économie d'engrais lors de leur
culture et un enrichissement des sols en matières azotées
(assolement , enfouissement) . En outre , dans les zones
semi-arides et arides où l'absence d'humus pose de grave problème
, l'introduction et l'adaptation de certaines Légumineuses sont au
premier plan des préoccupations. D'autant plus que les
sols algériens sont généralement pauvres en
matières organiques et régulièrement soumissent au
phénomène d'érosion (ABDELGUERFI BERRIKIA et ABEDELGUERFI
1986. ,OUZZANE et ABEDELGUERFI, 1989).
De plus, les graines de certaines Légumineuses
sont particulièrement riche en protéines de réserve,
présentant parfois des aminogrammes tout à fait compatibles avec
une nutrition animale et humaine. Elle sont utilisées comme
complément alimentaire pour le bétail et interviennent aussi dans
l'alimentation humaine .
Les Légumineuses fourragères ( luzerne
,trèfle ,sain foin etc... ) sont cultivées essentiellement pour
leur système végétative, producteur de matière
verte. Le développement de ce type de culture, dans un pays comme le
notre, contribuera certainement d'une part à compenser le
déficit fourragère, estimait, d'après MOSKAL, 1983,
à 3 milliard en U.F et d'autre part à anéantir la carence
chronique, des ressources azotées dans l'alimentation du cheptel et
dont les conséquences se répercutent sur les performances des
animaux ( ZEGHIDA et al .,1997).
Le genre Scorpiurus fait partie de cet
ensemble de plantes fourragères sauvages qui peut constituer un model
biologique, fortement intéressant de par sa production et la
qualité nutritive de ses graines .La grosseur des graines et leurs
appréciations par les ovins pourrait amener les éleveurs
à l'utiliser comme aliment concentré (M'HAMMEDI BOUZINA,1992).
Les résultats de certaines analyses chimiques
effectuées dans le but d'évaluer la valeur alimentaire des
espèces du genre Scorpiurus au stade végétative
et comparée à d'autres espèces appartenant aux
Légumineuses comme les Hedysorum, Onobrychis et les
Trifoliées (la luzerne pérenne et les luzernes
annuelles) révèlent l'existence en quantité très
appréciables de matière minérale (M.M) et
azotées totales(M.A.T) .
Le coefficient de digestibilité de la matière
organique (C.U.D) est assez voisin de ceux du bersim (GAILLARD
et al. , 1977) et des luzernes annuelles, (GOUMIRI et
ABEDELGUERFI , 1989). Leurs teneurs en Matières azotées
digestibles(M.A.D) sont par contre inférieures à
celles des Trifoliées (ANDRIEU et al. , 1978) ( tableau 1).
Aujourd'hui, les légumineuses spontanées
d'intérêt fourragères sont appelées à
être valoriser et intégrer dans des programmes de
sélections pour participer à la réduction du
déficit en protéines que connaît l'alimentation animale en
Algérie.
Tableau 1 : Résultats de
l'analyse de la composition chimique des espèces de
Scorpiurus , Médicago et Onobrychis. Source
(GOUMIRI et ABEDELGURFI,1989).
|
Teneur en
Matière
|
|
Espèces
|
M.M (%)
|
M.A.T (%)
|
C.B (%)
|
C.U.D (%)
|
U.F (%)
|
M.A.D (g)
|
|
Scorpiurus.muricatus.
sulcatu
|
19.47
|
21.83
|
15.61
|
73.84
|
0.57
|
173.20
|
|
Scorpiurus.muricatus.
subvillosus
|
22.42
|
20.55
|
14.12
|
75.46
|
0.58
|
161.03
|
|
Scorpiurus.vermiculatus
|
20.14
|
14.44
|
14.60
|
74.87
|
0.58
|
103.17
|
|
Hedysarum aculeolatum
|
16.14
|
11.80
|
14.94
|
75.57
|
0.61
|
78.22
|
|
Médicago arborea
|
09.00
|
22.00
|
23.00
|
66.00
|
0.47
|
173.00
|
|
Onobrychis capot-golli
|
09.84
|
11.63
|
22.59
|
66.31
|
0.54
|
76.61
|
M.A.T: Matières Azotées
Totales; M.A.D: Matières Azotées
Digestibles ; M.M : Matières Minérales ;
C.U.D: Coefficient de Digestibilité de la
matière organique ; C.B: Cellulose Brute ;
U.F: Unité Fourragère.
3.2-Micropropagation des Légumineuses in-vitro
La micropropagation chez les Légumineuses est
récente et c'est seulement au cours des quinze dernières
années que son application est devenue possible sur de nombreuses
espèces . Elle a pu être réalisée aussi bien via
l'organogenèse que l'embryogenèse somatique ( HAMATT et
al , 1986).
La multiplication végétative in-vitro
par néoformation de bourgeons a été obtenue chez plusieurs
Légumineuses et avec divers explants . On note cependant que ce mode de
régénération n'est bien maîtrisé que chez
certaines espèces à petites graines, cultivée pour la
production de fourrage vert comme la luzerne ( SAUNDERS et BINGHAM, 1972; 1975;
BINGHAM et al ., 1975; WALKER et al ., 1978 ) , les
trèfles ( PELLETIER et PELLETIER, 1971 ; BEACH et SMITH, 1979; PHILLIPS
et COLLINS, 1979) ou le lupin (SROGA, 1987). Chez ces derniers, les plantes
sont facilement régénérées à partir de cal
dérivant d'organes divers : racines, hypocotyle, cotylédon, tige,
pétiole, feuille ou organes floraux.
Contrairement aux précédentes, les
Légumineuses à grosses graines telles que le soja, le pois ,
l'haricot et le fève, ont montré très longtemps une faible
capacité de régénération en culture de tissus .
Dans le cas du soja , seule l'utilisation d'embryons zygotiques immature
(BARWALE et al ., 1986; GRAYBOSCH et al., 1987 ) ou de jeunes
feuilles (WRIGHT et al ., 1987; WRIGHT et al. , 1986
; WEY et XU, 1988) a permis l'obtention de cals caulogènes . Chez le
pois, de bons résultats ont cependant pu être obtenus à
partir de tranches d'hypocotyles MALMBERG et ,(1979) , de jeunes feuilles (
MOROGINSKI KARTA, 1981) et d'embryons mûrs ( ATANASSOV et MEHANDJIER,
1979).
Autrefois limitée à quelques espèces de
la famille des ombellifères, l'embryogenèse somatique a
été obtenue in-vitro sur de nombreuses autres famille ( AMMIRATO,
1983) dont celle des Légumineuses . Toutefois dans cette famille,
l'obtention d'embryons somatique reste encore limitée à quelques
espèces qui la plupart du temps appartiennent aux Légumineuses
à petites graines . En effet, les premiers embryons ont
été obtenus par SAUNDERS et BINGHAM (1972) sur la luzerne. De
nombreux travaux ont été réalisés depuis et se sont
portés sur des espèces particulièrement
intéressantes sur les plans agronomiques et économiques .
Quelques résultats obtenus ces dernières années ont
été répertoriés dans le tableau 2.
Tableau 2 : Plantes
régénérées par embryogenèse somatique chez
les légumineuses
|
Espèces
|
Source d'explants
|
Références
|
|
Pisum sativum
Lens culinaris
Glycine max
Winged bean
Médicago
Trifolium
Phasueolus
|
Apex
Apex
Apex et embryon immature
Embryon immature
Embryon immature
cotylédon
Noeud cotylédonnaire
Embryon immature
Embryon immature
Hypocotyle et cotylédon
Inflorescence et tige
Embryon immature
Hypocotyle
Embryon immature
Pétioles
Pétiole
Culture cellulaire
feuille
Protoplaste
Hypocotyle
Culture cellulaire
Hypocotyle et épicotyle
Embryon immature
Embryon immature
|
JACOBSEN et KISELY, 1987
KISELY et al., 1987
SAADI, 1991
SAXENA et KING, 1987
TETU et al. ,1987;
PARROTT et al., 1989
GUIFERREIRA et al., 1990
HARTWECK et al., 1988
BARWALE et al., 1986
VENKETE SWARANS et al., 1990
SANDERS et BINGHAM,1972
BINGHAM et al., 1975
SKOKUT et al.,1985
STUART et al .,1985
BIANCHI et al. ; 1988
BROWN,1988
REISH et BINGHAM , 1981 ; GROSE et BINGHAM, 1984
TEOULE et DATTEE ,1987
PELLETIER et PELLETIER, 1971 ;
BEACH et SMITH,1979
PHILIPS et COLLINS , 1979
SANTALLA et al.,1998 ALAVENA et ROTA , 1990
|
4 -OBJECTIF DU TRAVAIL
La micropropagation une des plus remarquable technique
qu'offrent les cultures in-vitro et la biotechnologie en
général permet d'obtenir des individus semblables et
génétiquement "conformes" aux plantes d'origine, devrait fournir
un moyen efficace pour multiplier par exemple des individus hybrides
très performants à des fin de production commerciale .
En effet partant d'un fragment de
végétal, placé en conditions plus au moins aseptique, la
plante mère peut être multipliée en un temps très
court, en plusieurs millions d'exemplaires et cela à l'infini. Il s'agit
là probablement d'un objectif lointain dont l'intérêt
technico-économique doit être soumis à évaluation.
La technique est maîtrisée surtout chez les espèces
à petites graines cultivées pour la production de fourrage vert.
Contrairement au Scorpiurus, qui selon notre recherche
bibliographique, nous a conduit à conclure, qu'il n'existe aucune
étude dans ce contexte sur l'espèce en comparaison avec d'autre
Légumineuses.
Le Scorpiurus est une plante autogame, à
fleurs pauvres en nectar. L'autofécondation qui se déroule
à une étape précoce du développement de la fleur,
réduit fortement le taux de pollinisation croisée. Les essais des
croisements interspécifiques effectués par DOMINGUEZ et
GALLIANO (1974) pour la recherche des hybrides ne semble pas
réussir. Le mode de reproduction qui caractérise cette plante
rendait difficile l'obtention des hybrides, les méthodes de micro
propagation in- vitro permettent de palier à cet obstacle.
L'absence de travaux ayant porté sur la
régénération in-vitro chez le Scorpiurus
, nous a permis d'orienter notre tache vers la recherche d'une
méthode de régénération in-vitro et de
tester les aptitudes à la régénération de plusieurs
génotypes de Scorpiurus . Le présent travail
représente un prélude pour l'amélioration
génétique du Scorpiurus. Cette tentative s'appuyait sur
les résultats déjà obtenus avec les autres
Légumineuses réputées pour longtemps
récalcitrantes. Les voies à explorer sont l'organogenèse
(formation de nouveaux bourgeons) ou d'embryogenèse somatique (formation
d'embryons somatiques) avec ou sans passage par une phase de
callogénèse. La démarche scientifique suivie pour
essayer d'atteindre les objectifs que nous étions fixés consiste
à tester trois principaux paramètres pouvant influencer ce
processus. Il s'agit d'abord de la nature de l'explant, puis l'effet
génotypique et aussi la nature du milieu (régulateurs de
croissance et la source carbonée).
CHAPITRE II MATERIELS
et METHODES
1- MATERIEL VEGETAL
1.1- Présentation de
l'espèce
1.1.1-Classification de l'espèce
Le Scorpiurus est une plante
dicotylédone appartenant à la famille des Légumineuse
(troisième grande famille chez les Angiosperme) et la sous famille des
Papilionacées, à la tribu Hedysarée et au
genre Scorpiurus. La classification du Scorpiurus
étudiée par plusieurs auteurs, indique que jusqu'à nos
jours, pas de nomenclature claire concernant ces espèces et reste
cependant très confuse, en particulier pour l'espèces
Scorpiurus muricatus en raison de l'existence d'un
polymorphisme morphologique. De ce fait de nombreuses classifications sont
proposées (BATTANDIER et TRABUT, 1890 ; JULIEN,1894 ; JAHANDIEZ et
MAIRE 1932 ; FOURY, 1954 ; LE HOUEROU, 1959 ; NEGRE, 1961;
QUEZEL et SANTA, 1962 et DOMINGUEZ et GALIANO,1974) se basant
essentiellement sur l'étude de caractères morphologiques.
Pour notre travail , nous retiendrons la classification de
DOMINGUEZ et GALIANO,(1974 ).
·
Scorpiurus vermiculatus est la forme sauvage la plus stable du genre Scorpiurus
(2n=14);
·
Scorpiurus muricatus :Cette espèce regroupe des plantes annuelles
(2n=28), au sein du quel on distingue:
- Scorpiurus muricatus ssp subvillosus . L
- Scorpiurus muricatus ssp eumuricatus . L
- Scorpiurus muricatus ssp sulcatus .L
1.1.2 -Les caractéristiques biologiques de la
plante
Le Scorpiurus est une plante annuelle ,
autogame. Elle présente au stade plantule de grands cotylédons
qui prennent l'aspect d'un axe dressé, lancéolé et
atténue progressivement en pétiole. Les premières
feuilles qualifiées de primordia foliaires sont entières et
sont disposées sur un court hypocotyle en rosette lâche. La tige
est rampante et dont la taille peut atteindre , les 40 à 50 cm de
longueur avec un large recouvrement végétal. Les feuilles sont
grandes, entières et de forme ovales (BENSALEM et al.,1990;
YOUNSI , 1996 ).
La floraison débute vers le mois de mars et
s'étend jusqu'a mai .Les graines en nombre de (9 à 11) sont
pourvues d'un tégument très dur causant ainsi la dormance
tégumentaire (BATTANDIER et TRABUT, 1890 ; NEGRE, 1990 ).
la différenciation morphologique entre les
espèces est généralement décelable au moment ou
les plantes atteignent le stade adulte (Planche 1).
* Scorpiurus vermiculatus
L'espèce est dotée d'un système
racinaire pivotant, puissant et atteignant parfois 1.0 mètre de taille
(OUZZANE et ABEDELGUERFI, 1989).
Les fleures sont grandes, à pétales
jaunes ou parfois rougeâtres. Elles sont généralement
solitaires. Les fruits sont des gousses, grosses ,repliées sur elles-
mêmes en spires régulières . Elles sont couvertes de
tubercules , élargies au sommet en forme de chapeau et couvertes
d'épines en écusson (BATTANDIER et TRABUT, 1890 ;
NEGRE,,1961; CARENE, 1992).
*- Scorpiurus muricatus
Les fleurs sont de petites tailles , groupées
en inflorescence (2 à 5 fleurs) et portées par de longs
pédoncules. Les fruits sont des gousses enroulées de façon
irrégulière et se décomposant en articles à
maturité. Cependant on note la présence d'aiguillons au niveau
des gousses chez le Scorpiurus muricatus ssp sulcatus alors qu'ils
sont absent chez le Scorpiurus muricatus ssp subvillosus (BATTANDIER
et TRABUT, 1890 ; JULIEN, 1894 ; NEGRE,,1961; CARENE, 1992).
1.1.3- Répartition géographique
Bien que l'origine de Scorpiurus soit obscure et sa
classification peu claire . C'est une espèce très connue par les
agriculteurs communément appelés cheniettes , Tagourit ou El
ghagfa . Elle est citée comme mauvaise herbe .
On signale sa répartition dans le monde entier. On la
rencontre, en plus du Nord africain , en Australie , en Amérique du nord
et aussi sur le basin méditerranéen (les Iles Canaries, Sud du
Portugal, l'Espagne, Centre de l'Italie, Malta, Sud-ouest de la France, la
Grèce) ; mais dont les conditions pédoclimatiques
différent d'une espace à une autre, ZIELINSKI,(1991) .
En Algérie, certains auteurs comme BATTANDIER et
TRABUT, (1890 ) trouvent que le Scorpiurus vermiculatus et
Sscorpiurus muricatus ssp subvillosus sont présent
pratiquement dans toute la partie Tell de l'Algérie. Ils poussent
préférentiellement bien dans les régions bien
arrosées, de faible altitudes, sur sol à texture fine et pauvre
en calcaire total. Alors que d'autres comme JAHANDIEZ et MAIRE (1932),
limitent leurs présence aux zones de pâturages de type
argileux, et sablonneux des plaines et plus rarement sur les régions
des bases montagnes .
Quant au Scorpiurus muricatus ssp sulcatus , il
semble moins exigeant sur le plan nutritionnel et pédologique (BENSALEM
et al.,1988). Il parait effectivement s'accommoder d'habitat
différent , on a signalé sa présence sur les terres
argileuses de Constantine, lieux herbeux et pentes des collines JULLIEN
(1894). Par contre BENSALEM et al (1990) indique l'avoir
rencontré dans plusieurs régions en Algérie (figure 3).
2-CONDITION DE CULTURE DES PLANTES MERE ET
OBTENTION DES EXPLANTS.
2.1- Origine des graines
Au cours de cette étude, huit génotypes
d'origine, très diverses ont été utilises afin
d'éviter tout apparentement entre eux. Ils sont issus de huit
populations de Scorpiurus distantes les unes des autres de 50 à
800 km et qui ont été récolté dans les
régions nord du pays : Miliana - Alger- Médéa -Bejaia -
Tébessa - Skikda - Barika et Annaba .
* Trois génotypes appartiennent à Scorpiurus
vermiculatus (V6- V12-V13 ) ;
* Trois autres génotypes appartiennent à
Scorpiurus subvilusus (B1--B6-B8) ;
* Et les deux génotypes appartiennent à
Scorpiurus sulcatus(L26-L3).
Toutes les semences employées dans notre
étude, nous ont été aimablement fournies par
Mer.M'HAMMEDI BOUZINA enseignant chercheur à
l'institut agronomique de Chlef. La récolte des graines à
été faite lors des différentes sorties de prospections
effectuées dans le cadre d'une collaboration INA EL Harrach, INA Paris
et ICARDA de Syrie.
2..2-Scarification des graines
Les graines de Scorpiurus présentent
un faible pourcentage de germination suite à une dormance
tégumentaire. Selon WHITE in COME (1970), la cuticule et une partie des
cellules palissadiques empêchent la pénétration de l'eau
chez certaines graines de Llégumineuses. Pour surmonter cet obstacle,
les graines ont été scarifiés graine par graine,
à l'aide d'une planche en bois recouverte de papier verre et d'une
lime métallique. Celles ci étant perméable à l'eau
germent plus facilement.
2.3-Explants provenant de jeunes plantes
cultivées in- vitro
Les graines sont désinfectées dans une
solution d'hypochlorite de calcium concentrée à 7% et d'ISIS
liquide (un détergent liquide équivalent au domestos) à
4% pendant 25 ;minutes. Après plusieurs rinçage à
l'eau distillée stérile, les graines sont mises, aseptiquement,
à germer sur milieu gélosé (0,8%), à
l'obscurité pendant huit jours, les plantules présentent les
caractéristiques suivantes.

A

B


C
E
D
F
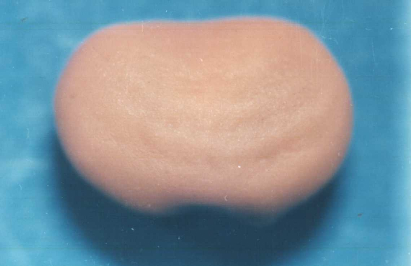
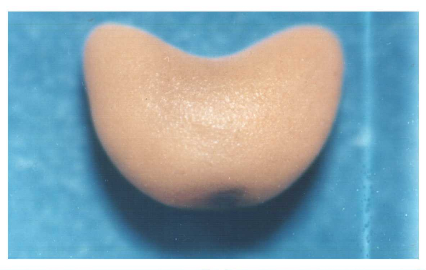
Planche 1:(A) - Jeune plantule de
Scorpiurus au stade de 25 jours .(B) -Plante adulte de
Scorpiurus au stade floraison .(C) - Fruit en gousse de
Scorpiurus muricatus. (D) - Graine de Scorpiurus muricatus..
(E )- Fruit en gousse de Scorpiurus vermiculatus .(F) - Graine
de Scorpiurus vermiculatus
· Une seule racine bien développée fine
de 3-4 cm de longueur chez Scorpiurus muricatus, épaisse et
courte de 0,5-1 cm de longueur chez Scorpiurus vermiculatus.
· Un hypocotyle blanc de 9 à 13 cm de longueur
chez Scorpiurus muricatus et de 4 à 5 cm chez
Scorpiurus vermiculatus.
· Deux cotylédons jaunes de 0,9- 1,5 cm de
longueur.
2.4-Explants provenant de plantes cultivées
en pots
Les graines scarifiées sont d'abord trempées
dans l'eau pour imbibition, pendant 24 heures , afin de permettre une
meilleure alimentation en eau et en oxygène de l'embryon et par
conséquent une germination facile et rapide puis on les sème
dans des pots en raison de 2 graines / pot à une profondeur de 1
à 2 cm. Les explants cotylédons, tiges, apex ,pétioles et
feuilles sont prélevées dans ces conditions à partir de
plantules âgées de 20-25 jours.
3-TECHNIQUE DE CULTURE IN-VITRO
3.1 Milieux de cultures
Les milieux de culture sont préparés au moment
de l'emploi, à partir de solutions mères concentrées
contenant les macro et micro- éléments et les vitamines de
MURASHIGE et SKOOG (1962) (Annexe N°1).
La source carbonée est assurée par l'apport
seul de saccharose , de glucose , de fructose ou de maltose à une
concentration de 30 g/l. Nous avons employé de l'Agar
«Difco » à raison de 8g/l dans le milieu .
L'auxine, trois régulateurs à effet auxinique
et deux cytokinines ont été testés, employés seuls
ou en mélanges à différentes concentrations. Les
régulateurs de croissances à effet auxiniques utilisées
sont : l'acide naphtylène-acetique (ANA) ; l'acide
indol-3acétique (AIA) ; l'acide 2-4 dichlorophenoxyacetique
(2,4-D). Les cytokinines quant à eux sont représentées
par la 6 benzyl-adenine (BA) et la 6 furfurylaminopurine (Kinetine).
L'identification des milieux de cultures comportant une
auxine, une cytokinine ou les deux combinées est la suivante:
· Les lettres désignent les régulateurs de
croissance utilisés : N pour ANA ; A pour AIA ; D
pour 2,4 D ; B pour BA et K pour Kinétine.
· Les chiffres indiquent la concentration du
régulateur de croissance (en mg/l) additionné au milieu.
L'absence des régulateurs de croissances dans le milieu est
mentionnée par le chiffre 0.
Le pH est ajusté de 5.7 à 5.8 avec une
solution d'hydroxyde de sodium, avant que le milieu ne soit
stérilisé par autoclavage (20 minutes à 120°C ,
2bar). Ils sont ensuite repartis en fraction de 15 ml dans des boites de
pétris stériles de 9 cm de diamètre pour être
utilisé.
3.3-Préparation des explants et ensemencement
Les explants de tiges , de feuilles , de
pétioles et de cotylédons sont plongés dans une solution
d'éthanol à 70 % (V/V) pendant 30 secondes, puis immergés
dans un désinfectant commercial à 12 % (V/V) pendant 15 à
20 minutes . Les explants sont ensuite rincés trois fois à l'eau
distillée stérile afin d'éliminer toute trace du produit
désinfectant. Après la désinfection , les tiges ,
pétioles , feuilles et cotylédons sont découpées
stérilement en fragments d'environ 1 cm de longueur.
A partir de plantules cultivées in
-vitro, âgées de 8 jours ,les explants de
cotylédons , d'apex, d'hypocotyles et de racines sont
prélevés et fragmentées en petits morceaux de 2 mm de
longueurs pour les explants cotylédons, racines et 5 mm pour les
explants hypocotyles .
Les explants ainsi préparés, sont
ensemencés sur les différents milieux , à raison de 15
explants par boites de Pétri avec un nombre de répétition
de cinq(05). Les boites sont ensuite scellées par un film extensible
" parafilm" . La dissection et l'ensemencement se font sous une hotte
stérilisée avec de l'eau de javel et de l'alcool à 70% .
Les pinces et scalpels sont passés à l'éthanol 70% puis
flambés .
3.4 - Conduite des cultures
Après l'ensemencement , les cultures sont
exposées , soit à l'obscurité , soit à la
lumière (2500lux), 16 heurs de photopériode et à une
température de 25 + 1°C. ces dernières conditions
seront maintenues pour la plupart des cultures durant la phase de
développement et de germination des embryons somatiques ou pour
l'enracinement et le développement des bourgeons.
4-EVALUATION DES RESULTATS
4.1-cas de la callogénèse
L'évaluation de la callogénèse a
été appréciée quantitativement (la masse de la
teneur en matière fraîche et sèche ) et qualitativement
(importance, couleur et texture des cals).
La callogenèse est exprimée par le pourcentage
d'explants callogènes pendant une durée d'exposition de quatre
(4) semaines sur le milieu d'induction . En outre la texture, la coloration
sont notée. Ainsi que l'évolution de la matière
fraîche et sèche est suivie au cour du temps. Les cals obtenus
sont prélevés et pesés individuellement. La teneur en
matière sèche est évaluée, après passage
des cals à l'étuve 65°C pendant 24 heurs. La taille (
diamètre) des cals est appréciée approximativement.
4.2 Cas de structures embryogènes ou
organogènes
Le relevé des structures embryogènes ou
organogènes est réalisé périodiquement ce qui
permet de mentionner les observations suivantes:
· Le pourcentage d'explants organogènes ou
embryogènes ( rapport du nombre de cals portant au moins un bourgeon ou
un embryon sur le nombre total des cals examinés).
· Le nombre moyen de structure organogène par
explant organogène ou le nombre moyen de structures embryogènes
par explant embryogène.
· Le rendement correspond au produit entre le
pourcentage de cals organogène ou embryogène et le nombre moyen
de bourgeon ou d'embryon par cal organogène ou embryogène. Ce
dernier paramètre relevé permis de mieux cerné les
potentialités régénératrices des explants et afin
de s'assurer de la nature des structures, une étude histologique est
réalisée.
4.3 Analyse statistique
Les paramètres d'appréciation des
résultats en organogenèse ou embryogenèse somatique
utilisé sont :
1
· La moyenne arithmétique :
^u =
n nXi
i=1
· L'ecart type empirique : ^ =
1
(n-1) n (xi -^)2
i=1
· L'erreur standard : t 1- /2 = ^
(n
1/2 )
Ces paramètres peuvent être définis pour
chacune des boites de pétri ou pour la totalité des boites d'un
même test. L'effet des différents facteurs conditionnant , la
production des structures embryogènes ou organogène est
étudiée statistiquement au moyen des méthodes d'analyse de
la variance (DAGNELIE,1970).Les analyses de la variance sont
réalisées avec le logiciel (statitcf). Pour la comparaison des
moyennes, elle est réalisée à l'aide du test de
NEWMAN& KEULS.
5- ETUDE HISTOLOGIQUE
Les échantillons sur lesquels nous avons
effectué des coupes histologiques sont d'abord fixés pendant 24
heures par le FAA(Formol 40%: 2 ml , Alcool 95%: 17ml , Acide acétique
: 2 ml ) , lavés à l'eau courante pendant 30 minute puis
déshydratés progressivement par des passages successifs dans des
bains d'éthanol de 25% jusqu'à l'alcool absolu pendant 30 minutes
chacun . pour les échantillons de petite taille , une étape
supplémentaire est nécessaire . Elle consiste à les
inclure dans l'agar à 10 % pour pouvoir mieux les orienter .Après
leur passage à l'alcool , les échantillons sont
transférés dans un solvant de la paraffine, le toluène ,
d'abord mélangé à l'alcool ( 3/4 - 1/4 ; 1/2 -1/2 ; 1/4 -
3/4 ) ensuite pur .
Une imprégnation de transition toluène -
paraffine , à l'étuve à 60 °C est effectuée
avant l'inclusion des échantillons dans la paraffine en fusion
coulée, entre deux lames métalliques (barres de LEUKART) et sur
une plaque de verre.
A l'aide de pinces fines et chauffées, les
échantillons sont orientés dans les bains selon le plan de coupe,
avant solidification des blocs. Ceux ci sont sectionnés au mictrome
à 7ou 10 um d'épaisseur selon les échantillons.
En fin les coupes sont montées sur des lames
préalablement gélatinées et après un
déparaffinage au toluène et alcool et un rinçage à
l'eau distillée, elles sont colorées dans le réactif de
SCHIFFS et l'hématoxyline de GROAT. Un passage à l'eau courante
a lieu entre chaque bain de colorant . Les lames sont alors passées
rapidement dans des bains d'alcool 100° absolu et remises à
sécher à 35 °C pendant plusieurs jours.
CHAPITRE III RESULTATS
1-ESSAI PRELIMINAIRES
compte tenu de l'absence totale d'un support bibliographique
traitant la question de la régénération in-vitro
du Scorpiurus ; nous étions amené donc à nous
inspirer , dans une première série d'expérience, que nous
avons qualifiée de préliminaire, d'un certains nombre de travaux
réussis portant sur l'organogenèse et l'embryogenèse
somatique de plusieurs espèces appartenant à la famille des
légumineuses en vue d'établir un protocole expérimental
susceptible de nous conduire à résoudre notre
problématique . Cette problématique qui se résume en fait
à essayer d'obtenir soit des bourgeons néoformés soit des
embryons somatiques et par la même , réussir dans la mesure de
possible, à régénérer des plantes entières
via l'une ou l'autre méthode de micropropagation .
Après l'étude bibliographique , nous nous sommes
parvenues à établir un protocole de travail , qui prenait en
compte les paramètres suivants :
· Un milieu de culture, composé des sels
minéraux et des vitamines de MURASHIGE et SKOOG.
· Des régulateurs de croissance,
représentés essentiellement par le 2,4-D (substance à
effet auxinique) et la BA (cytokinine) employées dans le milieu de
culture, seules ou en combinaison et à différentes doses (0, 0.1
,0.5, 1, 2, 3, 4, 5)
· Des explants de nature et d'origines diverses:
-Des explants de racines, d'hypocotyle et de
cotylédons sont prélevés à la fois à partir
de plantules cultivée in-vitro et dont l'âge varie de 7
à 10 jours et aussi sur de jeunes plantes cultivées
séparément en pots âgées de 30 -35 jours
-Des explants de tige, d'apex, de feuille et de
pétiole sont prélevés de plantes cultivées en pots
âgées de 30 -35 jours .
· Trois génotypes différents appartenant
au genre Scorpiurus ont été choisis de manière
aléatoire. Il s'agit des génotypes V12, B8 et L26.
· En ce qui concerne les conditions de culture, nous
avons retenu à ce que la plupart des expérience seront conduites
à l'obscurité et aussi à la lumière.
1.2 Résultats obtenus
La lecture des résultats des expériences
préliminaires a été faite à trois niveaux de
considération . Le premier, concerne la callogenèse, le second
l'organogenèse et le troisième l'embryogenèse
somatique.
S'agissant de la callogenèse, nous avons
constaté qu'elle s'est déclenchée sur l'ensemble des
explants testés à l'exception des apex qui débourrent et
cela, quelle que soit leur nature ou leur origine . Toutefois, son importance,
semble varier selon l'explant et aussi selon le milieu de culture ( en
particulier sa composition hormonale). En effet, concernant les explants, ce
sont les cotylédons suivies des hypocotyles qui paraissent
répondre le mieux à la callogenèse . Quant aux milieux de
cultures, ils induisent dans leurs majorité, des cals, en dehors de
ceux dépourvus de régulateurs de croissance ou pourvus
uniquement de ( BA) ou de 2,4-D seuls. Les meilleurs réponses sont
obtenues sur les milieux : D3B0,1 ; D0,1 B3 et D1B3.
Les résultats des expériences
préliminaires, nous ont permis de mettre en exergue, l'influence de la
photopériode. L'exposition des cultures sous une photopériode de
16/8 (16 heures de lumière et 8 heures d'obscurité) favorise de
loin la callogenèse que l'obscurité.
Par ailleurs, les plantules ayant servi comme "parc à
bois " ou plantes - mères, apportent aussi leur part d'influence. Ainsi,
nous avons pu relevé que les explants provenant de plantules
cultivées in-vitro réagissent mieux que ceux
prélevés des plantules cultivées en pots .
Ce sont là, les principaux remarques que nous avons pu
relever lors de ces expériences préliminaires .
Au sujet de l'organogenèse, nous avons
remarqué qu'elle s'exprime chez les trois génotypes
testés. Toutefois, comme en callogenèse, son importance est
fonction de la nature l'explant et de la composition hormonale du milieu .
Effectivement, ce sont encore une fois les cotylédons et les hypocotyles
qui expriment des aptitudes organogènes et ce sont aussi les explants
issus de plantes cultivées in-vitro qui réagissent
positivement à ce processus, à l'inverse de ceux
prélevés sur plantules cultivées en pots.
En ce qui concerne les milieux de culture, ce sont ceux
pourvus d'un mélange (2,4-D - BA) qui ont permis l'obtention de
structures organogènes. Ces milieux sont représentés par
le D0,1B3, le D1B3 et le D1B5.
Comme en callogenèse, l'organogenèse est
complètement inhibée à l'obscurité ; un
régime photopériodique de 16/8 ( 16 heures de lumière
et 8 heures d'obscurité ) lui est très favorable (Figure 4).
Concernant l'embryogenèse somatique, les
résultats préliminaires indiquent qu'elle est possible chez le
Scorpiurus. Cependant, elle reste tributaire, comme c'était
le cas en callogenèse et en organogenèse, de plusieurs facteurs
tels que : la nature de l'explant, le génotype et la composition
hormonale du milieu.
Parmi, tous les explants testés, les cotylédons
, les hypocotyles et les racines, sont les seuls à avoir exprimé
des potentialités embryogènes et seulement avec deux
génotypes (le V12 et le B6) sur trois.
Quant à l'influence de la composition hormonale du
milieu, nous avons relevé que, parmi toute la panoplie de milieu de
culture que nous avons testé, seuls les milieux à (2,4-D -
BA), notamment le D3B0,1 et le D0,1B0,5 , possèdent des pouvoirs
inducteurs.
Par ailleurs, il est important de signaler que les
différents types d'explants réagissent mieux à
l'embryogenèse somatique en présence de lumière qu'en
obscurité ( Figure 4).
.
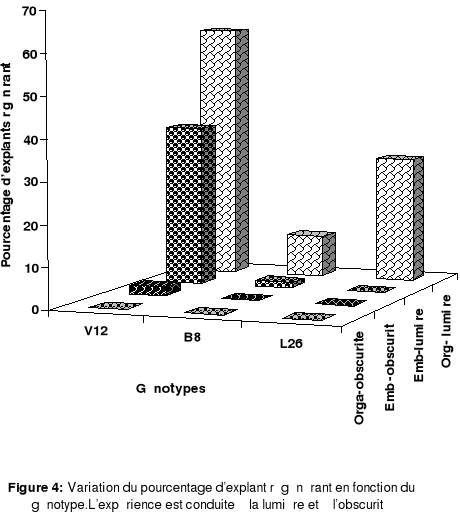
Le temps d'apparition des embryons sur les cals, lorsque
les cultures sont soumises à l'obscurité, prend beaucoup plus
de temps comparativement aux résultats obtenus en présence de la
lumière. Effectivement , les structures embryogènes
n'apparaissent qu'après 60 jours de culture sur le milieu d'induction.
Elles n'atteignent le stade cotylédonnaire qu'au bout du 90
éme jours. Alors qu'à la lumière , elles
apparaissent dés le 15éme jours qui suit
l'ensemencement et atteignent le stade cotylédonnaire au alentour du
25éme jours de culture.
1.3 Coupes histologiques
Nous avons procédé dans
cette partie réalisé des coupes histologiques pour confirmer , si
les structures organogènes ou embryogènes que nous avons
obtenues représentent réellement des bourgeons ou des embryons
somatiques.
1.3.1 Coupes histologiques au niveau des
bourgeons
L'apparition des bourgeons sur les explants hypocotyles,
cotylédons et racines s'est faite de façon progressive.
Néanmoins, il a été possible de distinguer 2 situations.
D'une part, un certain nombre d'explants édifiant des bourgeons
très rapidement (7 à 8 jours) .D'autre part, des
régénérations ne se formant qu'après un temps de
culture plus important (12 à 35 jours ).Il était
intéressant de savoir si le processus d'organogenèse etaient le
même dans les deux cas. Quelques coupes histologiques ont
été effectuées.
· Examen d'explants
régénérant par voie directe (7 à 8
jours)
Les coupes histologiques
permettent d'observer les explants d'hypocotyles ayant conservé une
structure classique. Il semble y avoir une continuité entre le bourgeon
néoformé et les vaisseaux conducteurs, mais il
est impossible d'affirmer qu'elle provient du cambium (Planche 2:A).
· Examen d'explants
régénérant par voie indirecte(12 à 35
jours)
Les explants ont été transformés
par la culture. Les tissus sont plus lâches avec des amas de grandes
cellules très vacuolées. Il y a constitution de cal sur les zone
de blessures et l'intérieur de l'explant. De même,
l'épiderme n'est plus continu mais interrompu, par des cellules de type
cal à cellules de taille variable. On note la présence de
très jeunes méristèmes dont le point
végétatif est identifiable(Planche 2B). Cet ensemble est
très dense fortement colorer. La discontinuité dans les explants
entre les bourgeons néoformés et les tissus conducteurs permet
d'envisager le cal de néoformation à partir de cellules de
cal.
1.3.2 Coupes histologique au niveau des embryons
somatiques
Nous avons regardé la forme et l'organisation
cellulaire des cals embryogènes et des embryons somatiques obtenus,
à travers des coupes histologiques.
Les cellules des cals embryogènes sont souvent
grandes et vacuolisées. On observe quelque fois, la présence
d'amas de cellules différentes du reste du cal. La taille de ces
cellules particulières est inférieure aux autres cellules du cal,
leur contenu est dense et le noyau occupe une grande partie de la cellule.
Elles sont probablement à l'origine des embryons somatique. Les parties
sous-jacentes aux embryons somatiques sont composées de cellules de
grandes tailles(Planche 3:A).
La coupe d'un embryon au stade globulaire ou un pseudo-embryon
sur son cal, nous montre un pédicelle qui le rattache au cal (Planche
3:B). Dans le quel, on trouve pas de liaisons vasculaires qui relieraient le
pseudo-embryon au cal, mais il y à une rupture de l'épiderme
à ce niveau.
1.4 Conclusion
A travers les résultats obtenus lors des essais
préliminaires, nous avons décidé d'orienter notre travail
de recherche sur deux axes essentiels à savoir l'organogenèse
et l'embryogenèse somatique qui paraissent être favorables
à la lumière qu'a l'obscurité. Par ailleurs il
s'avère utile d'utiliser comme source d'explants, ceux issues des
plantules cultivées in-vitro avec les trois génotypes
testées et ayant manifestés des aptitudes embryogénes et
/ou organogénes.
A
B
Planche 2: -Coupes histologiques
longitudinales de bourgeons formé par voie directe après 7
à 8 jours ( A ) et par voie indirecte après 12 à 35 jours
( B) de culture des explants d'hypocotyle du génotype V12 sur milieu de
culture D0,1B3( milieu pourvu de 3mg/l de BA et 0,1mg/l de 2,4-D).
A
B
Planche 3:-Coupes histologiques
longitudinales d'embryons somatiques au stade globulaire (A) et au stade
torpille (B) obtenus à partir d'explant d'hypocotyle du génotype
V 6 sur milieu de culture D3B0,1( milieu pourvu de 3mg/l 2,4-D et 0,1 mg/l de
BA).
ESSAIS D'OPTIMISATION
A la lumière des résultats obtenus au cours des
essais préliminaires , et qui nous ont permis de conclure que la
régénération par organogenèse ou
embryogenèse somatique est possible chez l'espèce
Scorpiurus. Nous avons lancés une série
d'expérience, de grande envergure, dans le but d'apporter des
réponses à un certains nombre de questions que nous nous sommes
posées. Parmi ces questions , on voulait savoir s'il n'existe pas un
problème de répétabilité ou de
reproductibilité des expériences qui peut poser dans notre cas.
On voulait aussi déterminer les possibilités d'optimisation de la
production de bourgeons ou d'embryons somatiques et en dernier, voir
l'éventualité de régénérer des plantes
entières via l'organogenèse ou l'embryogenèse, autrement
dit, tester la convertibilité des bourgeons ou embryons somatique en
plantes.
Pour cela, nous avons intégré, dans ces
expériences, d'une part des régulateurs de croissance autres que
ceux utilisés lors des essais préliminaires. Il s'agit de l'AIA
et de l'ANA pour les auxines et de la Kinétine pour les cytokinine et
d'autre part de nouveaux génotypes (V13, V6 ,B6,B1 et L3) dans
l'intention d'élargir, le plus possible, la variabilité
génétique de l'espèce étudiée et augmenter,
ainsi, les chances de tomber sur un génotype à fort potentiel
organogène et ou embryogène.
2.1 Aptitude à la callogenèse
Lors de cet essai , nous avons testé l'effet que peut
avoir l'apport seul puis combiné des auxines ou des cytokinines, sur
l'aptitude à la callogenèse chez les huit génotypes de
Scorpiurus choisis, en se servant des explants ayant montré des
capacités organogènes et embryogènes lors des essais
préliminaires. Les cultures sont conduites sur milieu de base MS
contenant différentes combinaisons hormonales.
Le suivi de la callogenèse porte à la fois sur
la détermination du pourcentage d'explants callogènes,
l'estimation quantitative des cals formés, et sur la description des
caractéristiques morphologiques des cals (texture et couleur) .
2.1.1 Influence des régulateurs de
croissance
Les régulateurs de croissance testés
sont les auxines, représentées par le 2,4-D, l'AIA et l'ANA
et les cytokinines , représentées par la BA ou BAP et la
Kinétine. Ils sont apportés seuls ou combinés entre eux ,
à différentes doses (0,1; 0,5 ; 1; .. . . . . .15; 20; 25 ;30 ;
35 ; 40).
Action des auxines ou des cytokinines
seules
De manière générale, l'usage des
auxines seules, à faibles concentrations dans le milieu d'induction
s'est révélé inefficace à la callogenèse
quelque soit le génotype ou le type d'explant utilisé .
Cependant, leur apport à forte concentrations semble déclencher
une légère callogenèse , souvent localisée au
niveau des zones de blessures des explants. C'est le cas du 2,4-D ou de l'ANA
et l'AIA lorsqu'ils sont fournis, au milieu, respectivement aux doses de (5
mg/l à 10 mg/l) et (10 mg/l à 40 mg/l). L'emploi de
concentrations plus fortes devient létale.
Quant à l'apport des cytokinines seules, dans le milieu
d'induction, quelle que soit la dose, la nature de l'explant , ou le
génotype utilisé, il se montre sans effet aucun sur la
callogenèse.
Action de la combinaison auxine-
cytokinine
Les combinaisons hormonales testées, lors de ce
travail, sont du type (2,4-D x BA; 2,4-D x Kin ; AIA x BA ; AIA x Kin ;
ANA x BA et ANA x Kin).
Les résultats du tableau 3, représentant
l'influence de la nature et de la concentration des régulateurs de
croissance sur l'aptitude à la callogenèse des cotylédons
de plusieurs génotypes, montrent clairement que l'apport combiné
des auxines et des cytokinines ne peut être que bénéfique
et par conséquent très stimulant à la callogenèse.
En effet, la callogenèse a été induite, mais à des
degrés différents, sur l'ensemble des milieux testés et ce
sont les combinaisons à base de 2,4-D qui semblent développer les
meilleurs pouvoir inducteur. La callogenèse est, davantage,
améliorée lorsque l'association ou la combinaison regroupe le
2,4-D et la BA.
On note par ailleurs que le pourcentage callogène des
explants devient plus important, lorsque le rapport auxine/cytokinine , dans
le milieu, est supérieur à 1.
On remarque aussi que la présence de fortes doses de
kinétine, dans le milieu, permet souvent l'obtention de cal à
texture friable et à aspect chlorophylliens (coloration vert
pâle)( Planche 4:A). La présence de BA,
quant à elle , semble favoriser la production de cals
à texture compacte et à coloration verdâtre (Planche 4:B),
bien qu'il y ait parfois présence de tâches rougeâtres .
Tableau 3 : Variation de l'aptitude
à la callogénèse en fonction de la composition hormonale
du ( quelque soit le génotype testé). Les résultats sont
obtenus après 30 jours de culture des explants cotylédons .
Taille des cals : (+) : (0 - 0.5)cm ; (++) :
(0.5 - 1)cm ; (+++) : (1 - 1,5) cm.
|
Composition hormonale du milieu
|
Pourcentage d'explants callogènes
|
Couleur des cals
|
Texture des cals
|
Taille des cals
|
|
N4B0,1
N4K1
D3B0,1
A20K11
A20B1
D2K1
|
43.57
30.62
85.75
42.50
40.87
60.62
|
Vert
Vert
Vert
Vert
Vert
Vert
|
Compacte
Compacte
Compacte
Compacte
Compacte
Compacte
|
+
+
+++
++
++
+++
|
|
N1B3
N0.1K11
D0.1B3
A1B3
A4K11
D0.1K1
|
30.00
20.87
91.75
19.00
12.37
36.37
|
Vert
Vert pâle
Vert
Vert
Vert pâle
Vert
|
Compacte
Friable
Compacte
Compacte
Friable
Compacte
|
++
++
+++
++
++
++
|
2.2.2 -Influence de l'explant
Les résultats de nos expériences, nous ont
révélé que la callogenèse dépendait aussi de
la nature des explants. Dans notre cas, ce sont les explants de
cotylédons suivis des hypocotyles qui réagissent le mieux
à la callogenèse. Leur pourcentage d'explant callogène
est presque similaire et il est de l'ordre de 45% à 100%.. Les racines,
quant à elles, paraissent développer de faibles capacités
callogène avec un pourcentage oscillant généralement
entre 13 % et 40%.
La callogenèse se déclenche après les
cinq premiers jours de culture qui suivent l'ensemencement. Les explants
commencent d'abord par connaître un léger gonflement,
accompagné de brunissement, au niveau des zones d'excisions. Les cals
font, souvent, leur apparition au niveau de ces zones et sur les facettes, des
explants, se trouvant en contact avec le milieu et se généralise,
par la suite, pour couvrir la totalité de l'explant. Le
développement de la callogenèse devient plus important au
delà du 10ème ou du 12 ème jours de culture
On note par ailleurs, que la croissance des cals varie aussi
d'un type d'explant à un autre. Ainsi, nous avons pu constaté que
les cals provenant des explants de cotylédons, malgré leur
apparition tardive, connaissent une croissance plus rapide et donc plus
importante que ceux produits par le reste des explants : hypocotyles et
racines.
2.2.3-Influence du génotype.
Les résultats préliminaires ne nous ont pas
permis d'avoir une idée précise sur l'effet génotypique et
ses conséquences sur la callogenèse, compte tenu du nombre
très restreint de génotypes soumis à l'expérience.
L'élargissement des expériences à d'autres
génotypes est devenu donc nécessaire. Ainsi, huit
génotypes de Scorpiurus ont été choisis, afin de
tester leurs aptitudes à la callogenèse, en se servant d'un
milieu (D0,1B3) ayant montré de bon pouvoir inducteur, lors des
résultats préliminaires (l'annexe 3).
Les résultats du tableau 4, présentant les
aptitudes à la callogenèse, montrent que, pour un explant
donné, l'ensemble des génotypes testés développent
une callogenèse. Toutefois son, importance change d'un génotype
à l'autre. Les génotypes de l'espèce Scorpiurus
vermiculatus ( V12, V13 et V6) et Scorpiurus muricatus ssp
sulcatus donnent les meilleurs pourcentages callogènes.
Tableau 4: Variation de l'aptitude à
la callogénèse de huit génotypes de Scorpiurus
sur milieu D0,1B3. Les résultats sont obtenus après 30 jours de
culture des explants cotylédons .
Taille des cals : (++) : (0.5 - 1)cm ; (+++) :
(1 - 1,5) cm.
|
Génotypes
|
Pourcentage d'explants callogènes
|
Couleur des cals
|
Texture des cals
|
Taille des cals
|
|
V12
V6
V13
B1
B8
B6
L26
L3
|
100.00
98.00
96.00
76.00
83.00
85.00
96.00
100.00
|
Vert
Vert
Vert
Vert
Vert
Vert
Vert
Vert
|
Compacte
Compacte
Compacte
Compacte
Compacte
Compacte
Compacte
Compacte
|
+++
+++
+++
++
++
++
+++
+++
|
Le suivi de la callogenèse, en établissant une
cinétique de croissance des cals obtenus, avec les explants de
cotylédons des huit génotypes, sur milieu d'induction D0,1B3 (
fig 5), reflète bien l'existence d'une variabilité
génotypique. En effet, avec les génotypes de l'espèce
Scorpiurus vermiculatus, en particulier le V12, la croissance des cals
est plus importante, comparativement aux génotypes de l'espèce
Scorpiurus muricatus..
2.2.4-Conclusion
L'ensemble des génotypes et explants testés ont
manifesté des aptitudes callogènes. Le pourcentage, la texture,
la couleur et la taille des cals dépend de la composition hormonale du
milieu, de l'explant et du génotype. En effet , l'usage des auxines ou
des cytokinines seules, dans le milieu d'induction, ne favorise pas la
callogenèse et les meilleurs résultats sont obtenus avec les
explants cotylédons et hypocotyles des génotypes de
l'espèce Scorpiurus vermiculatus et Scorpiurus muricatus
ssp sulcatus sur le milieu de culture D0,1B3.
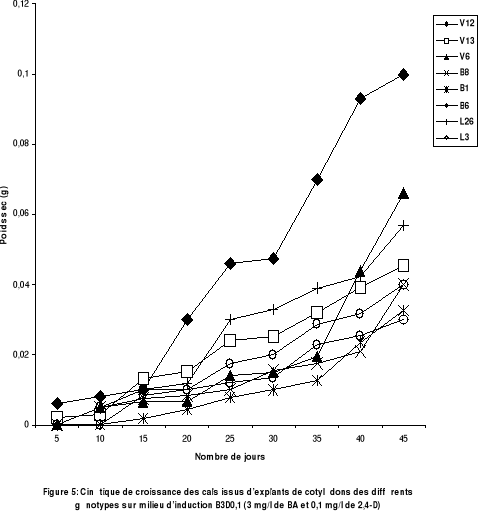
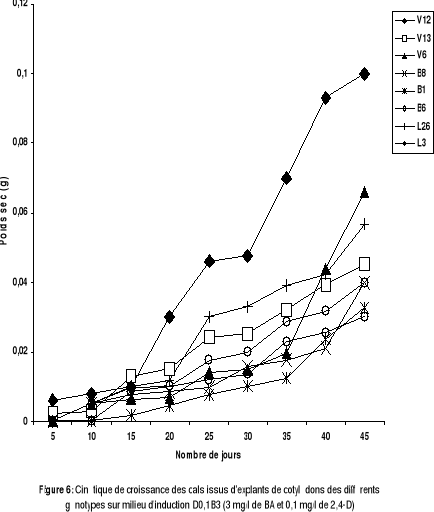
A
B
Planche 4: Différents types de cals
retenus après 20 jours de culture des explants de racine sur milieux
d'induction (MS) contenant 4 mg/l d'AIA et 11mg/l de Kinétine (A);
3mg/l de BA et 0,1mg/l de 2,4-D(B)
2.3 Aptitude à l'organogenèse
2.3.1-Aptitude à la rhizogenèse
On désigne par le terme rhizogenèse , la
différenciation de racines soit directement sur les explants soit
indirectement sur les cals produits au cours de la phase d'induction. Ce
processus morphologique est dépendant à la fois, de la
composition hormonale du milieu, de l'explant et du génotype .
2.3.1.1-Influence de la composition hormonale
du milieu
L'induction des racines semble être, elle aussi, sous
grande influence des régulateurs de croissance. La nature des
régulateurs, la dose avec laquelle sont employés, ainsi que le
type de combinaison hormonale testée sont tous des modulateurs
importants de la rhizogenèse. Parmi, toutes les gammes de concentration
et les différentes combinaisons hormonales testées, seuls les
milieux à AIA * KN et à des degrés moindre le 2,4-D * BA,
permettent des résultats positifs (tableau 5). L'action de l'ANA quant
à elle est quasiment nulle.
Il n'est pas inutile de rappeler , que la rhizogenèse
n'a pu être induite sur les milieux qui contenaient des auxines ou des
cytokinines seules.
Généralement les milieux dotés de 2,4-D
permettent le développement de racines vigoureuses, de coloration
jaunâtre . Sur ses mêmes racines peuvent se développer des
racines secondaires (Planche 5:A). On note par ailleurs, que les racines
produites en présence d'AIA paraissent moins vigoureuses et ne
développent jamais de racines secondaires(Planche5:B).
Tableau 5 : Effet de la composition
hormonale du milieu sur la rhizogenèse. Les résultats sont
prélevés 3 semaines de la mise en culture des explants (quelque
soit le génotype ou explant testé )
|
Composition hormonale du milieux
|
Pourcentage d'explant rhizogène
|
Nombre moyen de racine / explant
|
Longueur des racines (cm)
|
|
D0 ,1B0 ,1
D3B0,1
A20B0,1
A20K0,1
D0,1B3
D1B3
|
10.25
02.66
11.17
16.44
05.99
03.11
|
0.86 +0.81
0.45+0.69
0.39+0.49
1.42+1.66
0.83+0.94
0.34+0.515
|
0.5 -4 .0
1.0 -3.5
1.0 -4.0
4.0 - 8.0
0.5 -4.0
0.5 -2.0
|
2 ** = 23.89 , DDL = 5
(Significative au seuil de confiance = 0.01)
A
B
Planche 5: Différents types de racines
développées dans des milieux d'induction (MS) contenant
respectivement: 0,1mg/l de 2,4-D et 0,1mg/l de BA sur explants hypocotyles
(A) ; 20mg/l d'AIA et 0,1 mg/l de BA sur explants cotylédons (B).
A1
A2
B
Planche 6: Développement de racine,
directement sur explant d'hypocotyle (A1), et de cotylédon (A2) sur
milieu D0,1B0,1 ( milieu pourvu de 0,1 mg/l de 2,4-D et de 0,1 mg/l de BA) et
indirectement sur explant de racine (B), sur milieu A20B0,1 ( milieu pourvu de
20mg/l d'AIA et 0,1 mg/l de BA).
2.3.1.2-Influence de
l'explant
Les résultats, de notre expérience (tableau 6),
montrent, de manière inéluctable que la nature des explants
influence également la rhizogenèse. C'est toujours les
hypocotyles qui prennent le dessus sur le reste des explants en exprimant les
meilleures potentialités.
On signale par ailleurs, que les racines formées
à partir d'hypocotyles paraissent plus vigoureuses et plus nombreuses
comparativement à celles issues de cotylédons. On note
également qu'avec certains types d'explants comme les cotylédons
ou les hypocotyles l'induction de la rhizogenèse peut être
à la fois directe ou indirecte (Planche6: A1 et
A2), par contre avec d'autres explants comme les racines, elle est
exclusivement indirecte(Planche 6 B)
Tableau 6 : Variation des aptitudes
rhizogène des explants. Les résultats sont prélevés
3 semaines après la mise en culture des explants (quelque soit le
milieu ou le génotype testé)
|
Nature de
l'explants
|
Pourcentage d'explant rhizogène
|
Nombre moyen de racines / explant
|
Longueur des racines (cm)
|
|
Hypocotyle
Cotylédon
Racine
|
10.59
04.88
10.08
|
1.88 + 0.43
1.72 + 0.53
1.95 + 0.2
|
0.5 - 8.0
1.0 - 5.0
0.5 - 4.0
|
2 *** = 26.35 , DDL = 2 (Significative au
seuil de confiance = 0.001)
2.3.1.3 Influence du génotype
Les résultats du tableau 7, donne une idée
précise sur la variabilité des aptitudes à la
rhizogenèse en fonction des génotypes. Comme on peut le
constater, les meilleures réponses ont été obtenues avec
les génotypes L3,V12 et V13 sur les huit (08) testés. Des
génotypes comme le B8, le B6 et le B1 ne manifestent aucune attitude
rhizogène .
Tableau 7 : Aptitudes des huit
génotypes de Scorpiurus à la rhizogenèse . Les
résultats sont prélevés 3 semaines après la mise en
culture des explants (quelque soit le milieu ou l'explant testé)
Génotype
|
Pourcentage d'explant rhizogène
|
Nombre moyen de racines / explant
|
Longueur des racines (cm)
|
V12
V13
L3
L26
V6
|
13.10
06.53
14.07
00.37
07.77
|
1.40+ 0.24
1.78 +0.16
2.62 +1.61
2.0 + 0.00
3.08 +1.60
|
1.0 - 8.0
0.5 - 2.0
1.0 - 3.0
0.5 - 2.0
0.5 - 4.0
|
2 *** = 38.47 , DDL = 4 (Significative au
seuil de confiance = 0.001)
2.3.1.4 Conclusion
De l'ensemble des résultats que nous avons
trouvé, nous pouvons retenir les conclusions suivantes :
- l'aptitude à la rhizogenèse est fortement
influencée par le facteur génotype. Dans notre cas se sont
surtout les génotypes de l'espèce Scorpiurus
Vermiculatus et Scorpiurus muricatus ssp
sulcatus qui manifestent les meilleures aptitudes.
- Les explants les plus performants en terme de
rhizogenèse sont les hypocotyles
- le milieu à bon pouvoir rhizogène est
composé d'un mélange hormonale (0.1 mg/l de 2,4-D et 0.1 mg/l de
BA)
2.3.2 Aptitude à la caulogenèse
On désigne par le terme caulogenèse, la
néoformation de bourgeons de manière directe ou indirecte
à partir des différents types d'explants.
2.3.2.1- Description morphologique
Après la mise en culture des explants provenant des
différents génotypes ; on assiste à la
néoformation de bourgeons qui peut se faire selon deux voies
exclusives :
Dans certains cas, des bourgeons prennent naissance
directement sur la surface de l'explant sans passer par le stade cal.
Généralement, après 3 à 5 jours de culture, des
zones verdâtres apparaissent à la surface des explants. On
assiste, par la suite, à un gonflement superficiel de l'épiderme,
qui entraînera son déchirement et finira par crée une
petite entrave à travers laquelle sortira les premières
primordias foliaires des bourgeons néoformés(Planche 7: A). On
note par ailleurs, que la formation directe des bourgeons
néoformés n'est cependant possible qu'avec les explants
d'hypocotyles .
Dans d'autres cas, les explants développent,
après une semaine de culture , des cals compacts et de coloration
verdâtre. Souvent, les cals surmontés d'un amas de petites
cellules blanchâtres présentent de grandes
prédispositions à la caulogenèse. Ces petites cellules
blanchâtres dispersées sur les cals peuvent constituer donc un
marqueur (ou indice) morphologique de bonnes aptitudes à la
caulogenèse. Ce n'est qu'à partir du 15 éme
jour de culture, que des primordia foliaires (des futures bourgeons
néoformés) commencent à se différencier à
partir des structures nodulaires réparties sur les cals (Planche
7:B,C et D). Vers le 25 éme jours, les cals peuvent
être entièrement envahies par des touffes de bourgeons (Planche 7
: E).
Il est important de rappeler par ailleurs, qu' il existe des
endroits privilégiés à l'apparition des nouveaux
bourgeons comme les zones de blessures par exemple.
A
B
C
D
E
Planche 7: (A) Néoformation de
bourgeons directement sur les explants d'hypocotyles. Aspect des nodules
méristématiques différenciées après 7 jours
(B), 10 jours(C) et 15 jours (D)de culture, sur des cals provenant d'explants
d'hypocotyles. (E) Développement de bourgeons néoformés
en touffe sur le milieu d'induction D0,1B3 (milieu pourvu de 3mg/l de BA et
0,1 mg/l de 2,4-D).
2.3.2.2 Amélioration de l'induction de la
caulogenèse
Après avoir confirmé
la possibilité d'obtenir des bourgeons néoformés avec
l'espèce Scorpiurus, lors des essais priliminaires, nous assaillons,
cette fois-ci, d'améliorer la production en testant trois facteurs
essentiels à savoir la composition hormonale des milieux, la nature de
l'explant et le génotype.
2.3.2.2.1 - Influence de la composition
hormonale du milieu
La nature et la concentration des régulateurs de
croissance employé dans le milieu de culture peut influencer
considérablement l'organogenèse. Partant de ce constat, nous
avons testé l'influence d'un certain nombre de régulateurs de
croissance à savoir : trois (3) auxines (2,4-D, AIA et ANA ) et
deux (2) cytokinines (BA et Kinétine). Leur apport, dans le milieu, peut
être effectué seul ou combiné et à
différentes doses.
Les résultats de la caulogenèse, obtenus avec
l'ensemble des milieux ayant exprimé un pouvoir inducteur et ceci quel
que soit le génotype ou le type d'explant testé, sont
représentés dans le tableau 8. Après lecture de ces
résultats, nous pouvons retenir que seules les combinaisons 2,4-D x BA
, 2,4-D x Kin , AIA x BA et l'AIA x Kin se révèlent favorable
à la caulogenèse mais en général se sont les
combinaisons à 2,4-D x BA qui fournissent les meilleures
réponses. Les combinaisons faites avec l'ANA se sont montrés
totalement inefficaces.
Les résultats du tableau 8, nous enseigne une fois de
plus sur l'inefficacité de l'usage seul des auxines ou des cytokinines
dans le milieu de culture vis à vis de la caulogenèse.
Dans ce volet, les résultats de l'analyse statistique
(comparaison de moyennes) pour comparer les rendements moyens en bourgeons par
milieu, en se basant sur le test de NEWMAN et KEULS, révèlent
l'existence de deux groupes homogènes :
le 1er groupes, à rendement
élevé, renferme les milieux D1B3 et D0,1B3
le 2 eme groupe, à rendement moyen à
faible, englobe les milieux D0,5B0,5 ; D0,5B1 ; D0,5B3 ;
A20K11 ; D1B5 ; D0,1 B0,5 ; D0,5 K0,1 et A20 B0,1.
Tableau 8 : Effet de la
composition hormonale du milieu sur la caulogenèse . Les
résultats sont obtenus après 4 semaines de cultures (quelque soit
le génotype ou l'explant testé) . A et B désignent
les groupes homogènes séparés par le test de NEWMAN et
KEULS au seuil 5%.
|
Composition hormonale du milieu
|
Nombre moyen de bourgeons /explant(A)
|
Pourcentage d'explants caulogène(B)
|
Rendement
(AxB)
|
|
D1B3
D0,1B3
D0,1B0,5
D0,5B0,5
D0,5B1
D0,5B3
D1B5
D0,5K0,1
A20B0,1
A20K11
|
4.07+2.05
5.41+1.78
1.71+2.27
0.95+2.52
0.69+1.47
1.06+2.81
3.58+3.57
1.26+1.72
1.12+1.96
3.59+3.58
|
43.98
44.90
01.57
01.68
15.90
04.71
06.14
00.48
00.89
00.27
|
1.790A
2.430 A
0.027 B
0.16 B
0.080 B
0.050 B
0.22 B
0.0061 B
0.010 B
0.010 B
|
2*** = 60.96 DDL = 8 (significatif au seuil
=0.001)
2.3.2.2.2- Recherche d'explants plus performants
Nous avons tenté, dans cette partie du travail, de
tester les performance, en terme de production de bourgeons, des
différents types d'explants et ceci quel que soit le génotype ou
le milieu de culture utilisée (en particulier sa composante
hormonale).
Les résultats de cette étude sont
présentés dans le tableau 9
Tableau 9 Variation des aptitudes
caulogène des explants . Les résultats sont relevés
après 4 semaines de la mise en culture des explants (quelque soit le
milieu ou le génotype testé).
|
Explant
|
Pourcentage d'explants
Caulogéne (B)
|
Nombre moyen de bourgeons / explants (A)
|
Rendement
(AxB)
|
|
Hypocotyle
Cotylédon
Racine
|
24.79
30.75
39.54
|
1.327 + 1.34
0.80 + 1.59
0.687 + 1.338
|
0.329
0.246
0.271
|
2*** = 25.40 DDL=2
(significatif au seuil =0.001).
Comme on peut le constater, l'ensemble des explants
testés (cotylédons, hypocotyles et racines) réagissent, de
façon presque similaire, à la caulogenèse. Ainsi, et en
dépit de la différence apparente qui existe, le test de NEWMAN et
KEULS n'a pas décelé de différence significative entre
les rendements. On note cependant que les explants d'hypocotyles ont une
production de bourgeons par explants supérieures à celle des
cotylédons et des racines. Par contre, le pourcentage d'explants
caulogènes des cotylédons et des racines est supérieur
à celui des hypocotyles. La corrélation entre le pourcentage
d'explant caulogène et le nombre moyen de bourgeons / explant est
négatif (R= - 0.745).
2.3.2.2.3- Recherche d'un
génotype
Les travaux entrepris dans cette étude , consistent
à tester l'aptitude à la caulogenèse des huit
génotypes sur tous les milieux ayant manifesté un pouvoir
inducteur .
A la lecture des résultats du tableau 10, nous
constatons que l'ensemble des génotypes répondrait favorablement
à la caulogenèse. Cependant, les réponses varient d'un
génotype à un autre .On distingue, selon le test de NEWMAN et
KEULS, trois groupes de génotypes . Un premier groupe, constitué
du génotype V6 , présente les meilleures aptitudes. Un
deuxième , à faible aptitude caulogène, regroupe le B1, le
B6 et le B8 . Le reste des génotypes se situent entre ces
extrêmes et correspondent au troisième groupe.
Tableau 10 :Aptitudes des
huit génotypes de Scorpiurus à la caulogenèse .
Les résultats sont obtenus après 4 semaines de la mise en
culture des explants ( quelque soit le milieu ou l'explant utilisé) . A
et B désignent les groupes homogènes séparés par le
test de NEWMAN et KEULS au seuil 5%.
|
Génotypes
|
Nombre moyen de bourgeons /explant (A)
|
Pourcentage d'explants caulogène
(B)
|
Rendement
(AxB)
|
|
V6
V12
V13
L26
L3
B1
B8
B6
|
7.49+1.458
8.77+3.710
5.43+1.618
6.02+2.98
6.23+3.03
3.45+3.98
2.03+0.01
6.47+3.63
|
14.95
08.80
11.18
08.97
13.96
01.44
02.93
01.47
|
1.12 A
0.77 B
0.60 B
0.54 B
0.87 B
0.05 C
0.059 C
0.095 C
|
2** = 24.11 DDL
=7 (significatif au seuil =0.01)
En ce qui concerne le nombre moyen de bourgeons par explant,
on remarque qu'il dépend lui aussi du facteur génotypique. En
effet, des génotypes comme le V12 et le B6 parviennent à produire
un nombre élevé de bourgeons par explant comparativement au reste
des génotypes. Sur ce chapitre, on enregistre que les écart types
sont moins importants pour certains génotypes ; c'est le cas des
cultures issues des V6,V13 et B8 qui affichent une certaine
homogénéité par rapport aux autres.
2.3.2.2.4 Etude des interactions de l'explant
, du génotype et de la composition hormonale du milieu sur la
caulogenèse
2.3.2.2.4.1 - Effet de l'interaction
(génotype * explants)
Dans cette partie du travail, nous avons essayé de
connaître l'incidence que peut avoir l'interaction génotype *
explant sur la caulogenèse .Le tableau 11 où sont
présentés les résultats ayant trait à cela, mettent
en évidence le degré d'influence, de ce paramètre, sur la
néoformation de bourgeons. Ainsi, nous constatons que, certains explants
comme les hypocotyles et les racines des génotypes B1,B6 et B8 se
montrent incapables de produire des bourgeons, contrairement aux
cotylédons qui eux, réagissent très favorablement et ceci
quel que soit le génotype testé. Nous constatons aussi, qu'avec
certains génotype comme leV12,leV6, leV13,le L26 et le L3, l'ensemble de
leurs explants réagissent positivement à ce processus.
En terme de rendement, les meilleurs résultats (0.753)
sont obtenus avec les explants d'hypocotyles du génotype V6.
Tableau 11 : Influence de
l'interaction génotype * explant sur la caulogenèse. Les
résultats sont obtenus après 4 semaines de culture.
|
Génotype
|
Explants
|
Pourcentage d'explant Caulogéne (B)
|
Nombre moyen de bourgeons / explants (A)
|
Rendement
(AxB)
|
|
V12
|
Hypocotyle
Cotylédon
Racine
|
43.84
28.11
5.54
|
1.30+1.99
0.97+1.92
1.06 +2.01
|
0.570
0.272
0.05
|
|
V13
|
Hypocotyle
Cotylédon
Racine
|
25.45
15.96
5.83
|
1.75+2.60
0.93+2.18
0.76+2.14
|
0.446
0.148
0.044
|
|
V6
|
Hypocotyle
Cotylédon
Racine
|
23.53
37.33
06.84
|
3.20+3.71
0.99+2.14
2.13+3.63
|
0.753
0.369
0.145
|
|
B1
|
Cotylédon
|
06.73
|
0.40 + 1.13
|
0.026
|
|
B6
|
Cotylédon
|
04.68
|
1.19+2.31
|
0.055
|
|
B8
|
Cotylédon
|
04.75
|
0.48+0.99
|
0.022
|
|
L26
|
Hypocotyle
Cotylédon
Racine
|
22.38
03.14
04.12
|
1.34+2.84
0.66+1.87
0.82+2.32
|
0.30
0.02
0.033
|
|
L3
|
Hypocotyle
Cotylédon
Racine
|
16.97
03.82
06.60
|
2.54+2.80
0.88+2.51
1.21+2.15
|
0.438
0.030
0.080
|
2*** = 929.96 DDL = 10 (significatif au seuil =0.001,pour tout
milieux confondus )
La comparaison des moyennes par le test de NEWMAN et KEULS
met en évidence l'existence de 10 groupes homogènes. Le
classement par ordre décroissant des rendements est le suivant.
V6H>V12H>V13H=L3H=V6C>L26H=V12C>V13C>V6R>L3R>V12R=V13R=
B6C >L26R= L26C = L3C= B1C=B8C.
La corrélation entre le nombre de bourgeons et le
pourcentage caulogène varie d'un génotype à un autre. Elle
est très importante pour le génotype L26 (R = 0.96) ,
L3(R=0.95) et V13( R= 0.85) et moyenne pour les génotypes V12(R=0.66) et
V6(R=0.61).
2.3.2.2.4.2- Effet de l'interaction
(composition hormonale du milieu* explant)
Dans cette partie, nous avons essayé de vérifier
l'existence ou pas de corrélation entre la nature de l'explant et la
composition hormonale du milieu et ceci quel que soit le génotype.
En se réfèrant au tableau 12, nous remarquons
que l'ensemble des explants réagissent différemment selon les
milieux testés. En effet ,seuls les milieux à concentration
élevée en BA permettent une induction caulogène quel que
soit la nature de l'explant mis en culture. Les milieux en question, sont
représentés par le D1B5 , le D1B3 et le D0,1B3. Le reste des
milieux permettent cette induction mais seulement avec certains type d'explant,
le plus souvent, l'hypocotyle .
Sur ce sujet, la séparation des moyennes par le test
de NEWMAN et KEULS a pu mettre en exergue des différences significatives
entre les rendements moyens obtenus sur totalité des milieux
testés . Les meilleurs rendements sont enregistrés sur les
milieux D1B3 et D0,1B3, . Le classement par ordre décroissant des
rendements moyens obtenus pour chaque milieu est le suivant :
D0,1B3H>D0,1B3R>B3D1C=D1B3H=D0,1B3C>D1B3R>D1B5H>D1B5R=A20B0,1H>=D0,5B0,5H=D0,5B0,5R=D1B5C>D0,5B0,1C=A20K11H=D0,5K1H>D0,1B0,5H=D0,5B1C=D0,1B0,5R.
On remarque par ailleurs, qu'il existe, en se servant de
certain milieu, comme le D1B3, une corrélation négative (R= -
0.89) entre le pourcentage caulogène et le nombre moyen de bourgeon
par explant ; l'usage d'autres milieux comme le D0,1B3 conduit lui,
à une corrélation positive (R=0.64).
Tableau 12 : : Aptitude
caulogène des explants en fonction de la composition hormonale du milieu
( quelque soit le génotype testé). Les résultats sont
obtenus après 4 semaines de la mise en culture des explants .
|
Composition
Hormonale
Du milieu
|
Explants
|
Pourcentage d'explants
Caulogéne (B)
|
Nombre moyen de bourgeon/ explant(A)
|
Rendement
(AxB)
|
|
D1B5
|
Hypocotyle
Cotylédon
Racine
|
05.60
04.07
10.57
|
2.075 + 0.5
0.82 + 0.066
0.69 + 0.176
|
0.1166
0.0334
0.033
|
|
D1B3
|
Hypocotyle
Cotylédon
Racine
|
64.00
41.40
43.40
|
3.28 + 0.89
5.55 + 3.19
3.37 + 1.32
|
02.10
02.30
01.80
|
|
D0,5 B3
|
Hypocotyle
|
4.41
|
1.06 + 0.15
|
0.0471
|
|
D0,1 B3
|
Hypocotyle
Cotylédon
Racine
|
51.50
42.00
53.60
|
6.32 + 1.93
4.78 + 1.57
5.31 + 1.87
|
3.26
2.01
2.25
|
|
D0,5 B1
|
Hypocotyle
Cotylédon
|
02.67
08.85
|
0.56 + 1.073
0.131 + 1.768
|
0.015
0.0116
|
|
D0,5 B0,5
|
Racine
|
03.54
|
0.953 + 0.05
|
0.0338
|
|
D0,1 B0,5
|
Hypocotyle
Cotylédon
Racine
|
02.82
01.83
04.15
|
00.41 + 0.176
1.091 + 0.033
0.20 + 0.01
|
0.0116
00.02
0.0083
|
|
D0,5K1
|
Hypocotyle
|
01.23
|
1.26 + 0.649
|
0.0156
|
|
A20B0,1
|
Hypocotyle
|
05.56
|
1.127 + 0.272
|
0.0627
|
|
A20K11
|
Hypocotyle
|
02.50
|
0.656 + 0.81
|
0.0165
|
2*** = 67. 12 DDL = 2 (significatif au seuil
=0.001 ).
2.3.2.2.4.3 Effet de l'interaction
(génotypes * composition hormonale)
En abordant la question des interactions, nous avons
essayé de connaître, cette fois-ci, si les milieux testés
interagissent avec les différents génotypes et cela quel que soit
la nature de l'explant utilisé .
A la lumière des résultats
présentés dans le tableau 13, nous constatons qu'il existe
réellement un effet interaction (milieu * génotype) sur la
caulogenèse. De manière générale, l'ensemble des
génotypes testés expriment des potentialités
caulogènes. Néanmoins, ces potentialités paraissent varier
en fonction de la composition hormonale du milieu. En effet, certains milieux
tels le D0,1B3 , le D1B3 ou le D1B5 possèdent un large pouvoir
inducteur , ce qui a permis d'ailleurs, à un grand nombre de
génotype de s'exprimer favorablement à la caulogenèse.
D'autres milieux comme le D0 ,5B3 ; le A20B0,1 ou le A20K11,
permettent à un ou au plus à deux génotypes de
s'exprimer.
D'après les résultats de l'analyse statistique,
aucune corrélation n'a été décelé entre le
pourcentage caulogène et le nombre moyen de bourgeons par explant sur
les milieux D0,1B3 (R=0.39) , D1B3(R=0.21). Par contre, elle est très
importante sur le milieu D1B5(R = 0.92).
Tableau 13: Aptitude caulogène des
huit génotypes de Scorpiurus en fonction de la composition
hormonale du milieu (quelque soit l'explant testé). Les
résultats sont obtenus après 4 semaines de la mise en culture
des explants .
|
Composition
Hormonale du milieu
|
Génotype
|
Nombre moyen de bourgeons /explant (A)
|
Pourcentage d'explant caulogène
(B)
|
Rendement
(AxB)
|
|
D0,1B3
|
V12
V13
V6
L26
L3
|
11.42+1.04
6.87+1.67
9.31+2.58
10.16+3.17
6.00+2.51
|
58.66
37.33
54.22
30.66
34.21
|
6.69
2.56
5.04
3.11
2.05
|
|
D1B3
|
V13
V6
B6
B1
B8
L26
L3
|
6.52+2.54
7.76+1.68
1.53+0.82
2.4+2.59
2.03+1.88
4.66+1.12
7.64+3.79
|
48.87
55.00
11.10
15.10
12.00
36.00
58.22
|
3.18
4.26
0.17
0.36
0.24
1.67
4.45
|
|
D0,5 B0,5
|
V6
B6
|
7.625+1.65
9.375+1.27
|
03.50
03.50
|
0.27
0.332
|
|
D1 B5
|
V13
V12
V6
B1
L3
|
2.75+1.023
6.15+0.966
4.28+1.001
4.5+1.63
11.04+1.026
|
01.70
05.70
03.10
01.70
10.60
|
0.04
0.35
0.132
0.076
1.170
|
|
D0,5B3
A20 B0,1
D0,5B1
D0,5B1
D0,1K0,1
A20K11
A20K11
|
V6
V13
L3
B6
B6
L26
L3
|
8.5+1.274
5.61+0.766
4.5+1.073
10.5+1.768
4.5+1.06
3.25+1.138
2.00+0.5
|
04.43
08.00
02.60
14.40
00.80
01.77
01.77
|
0.376
0.448
0.117
1.197
0.036
0.057
0.035
|
2 = 18.11NS DDL =20 ( Non significatif).
2.3.2.2.4.4 Effet de l'interaction
(composition hormonale du milieu * explant * génotype).
Après avoir testé l'influence des interactions
entre de deux paramètres, nous étions amené, dans un
dernier essai, à tester l'effet que peut avoir l'interaction entre trois
paramètres (composition hormonale * explant * génotype) sur la
caulogenèse. Compte tenu du nombre élevé de
répétitions ayant des rendements nuls, dans nos résultats,
et qui peuvent poser d'énormes difficultés dans le calcul
statistique, nous nous sommes limités donc, dans ce travail, à
tester seulement deux milieux de culture D0,1B3 et D1B3 sur l'ensemble des
génotypes et des explants.
Le tableau 14 regroupe les observations faites des
expériences précédentes sur les milieux D1B3 et D0,1B3,
déterminant la production caulogène en fonction à la fois
de la composition hormonale du milieu, du génotype et de l'explant.
A travers ces résultats, il apparaît que les
meilleurs rendements sont obtenus avec les explant d'hypocotyles du
génotype V12(9.78) et sur le milieu D3B0,1. Les plus faibles rendements
sont enregistrés respectivement avec les explants de cotylédons
du génotype V13 et L26 ainsi que les explants de racines du
génotype L3.
Afin de proposer une évaluation quantitative de
l'aptitude à la caulogenèse des différents milieux
testés, nous étions amené à se servir des
méthodes statistiques classiques. Dans ce cadre, nous avons
effectué une analyse de variance, à partir du rendement de chaque
boite de pétri. Les résultats sont prélevés
après 4 semaines de culture. Elle correspond à un model
complètement aléatoire à 5 répétitions et
à 3 facteurs croisés.
· Le facteur composition hormonale du milieu à 2
niveaux : D0,1B3 et D1B3.
· Le facteur génotype à 8 niveaux :
V12,V13,V6,B1,B6,B8,L26 et L3.
· Le facteur explant à 3 niveaux :
hypocotyle ,cotylédon et racine
Tableau 14: Aptitudes caulogènes des
explants des huit génotypes cultivés sur milieux de cultures D0,1
B3 (3 mg/l de BA et 0,1 mg/l de 2,4D) et D1 B3 ( 3 mg/l de BA et 1 mg/l de
2,4-D). Les résultats sont obtenus après 4 semaines de la mise
en culture des explants .
|
Composition Hormonale du milieu
|
Génotype
|
Explants
|
Nombre moyen de bourgeons /explant (A)
|
Pourcentage caulogène (B)
|
Rendement
(AxB)
|
|
D1B3
|
L26
|
Hypocotyle
|
5.81+0.54
|
38.72
|
2.25
|
|
Cotylédon
|
4.10+0.047
|
33.17
|
1.36
|
|
Racine
|
4.06+0.80
|
61.82
|
2.51
|
|
L3
|
Hypocotyle
|
6.73+1.62
|
64.48
|
4.34
|
|
Cotylédon
|
9.27+1.21
|
38.29
|
3.55
|
|
Racine
|
6.93+2.82
|
58.87
|
4.08
|
|
V13
|
Hypocotyle
|
6.32+8.04
|
75.15
|
4.75
|
|
Cotylédon
|
6.47+1.04
|
24.88
|
1.61
|
|
Racine
|
6.77+1.15
|
48.39
|
2.87
|
|
V6
|
Hypocotyle
|
7.41+8.17
|
73.27
|
5.43
|
|
Cotylédon
|
6.70+0.98
|
37.91
|
2.54
|
|
Racine
|
9.18+2.11
|
53.92
|
4.95
|
|
B 1
|
Cotylédon
|
7.20+5.46
|
66.80
|
4.81
|
|
B6
|
Cotylédon
|
4.6+1.29
|
36.30
|
1.67
|
|
B8
|
Cotylédon
|
6.10+2.06
|
46.22
|
2.82
|
|
D0,1 B3
|
V12
|
Hypocotyle
|
12.79+3.62
|
76.46
|
9.78
|
|
Cotylédon
|
11.40+0.56
|
44.73
|
5.10
|
|
Racine
|
10.06+0.73
|
55.46
|
5.58
|
|
V13
|
Hypocotyle
|
8.25+0.94
|
27.15
|
2.24
|
|
Cotylédon
|
5.44+0.20
|
24.08
|
1.31
|
|
Racine
|
6.92+3.57
|
73.69
|
5.10
|
|
V6
|
Hypocotyle
|
10.36+3.20
|
67.27
|
6.97
|
|
Cotylédon
|
6.84+2.35
|
69.15
|
4.73
|
|
Racine
|
10.74+2.92
|
66.85
|
7.18
|
|
L26
|
Hypocotyle
|
11.88+1.68
|
31.22
|
3.71
|
|
Cotylédon
|
7.85+0.75
|
30.57
|
2.40
|
|
Racine
|
10.74+1.65
|
33.33
|
3.58
|
|
L3
|
Hypocotyle
|
7.26+2.26
|
46.14
|
3.35
|
|
Cotylédon
|
6.73+1.98
|
38.18
|
2.57
|
|
Racine
|
4.00+0.85
|
33.75
|
1.35
|
Les résultats de l'analyse de variance sont
présentés dans le tableau 15. Ils montrent sans ambages
l'existence d'une différence qui peut être, dans certains
cas, très hautement significative comme, c'est le cas avec le facteur
génotype, de l'interaction (composition hormonale * génotype) ou
(génotype * explant ), dans d'autres, hautement significative comme
pour le facteur composition hormonale et l'interaction (composition
hormonale * génotype * explant) ou simplement significative comme
c'est le cas avec l'interaction (composition hormonale * explant). Cependant
certains facteurs comme l'explant n'enregistre aucune différence.
Tableau 15 : Tableau d'analyse de la
variance à 3 facteurs croisés .
|
Source de variation
|
Somme des carrés
|
D.D.L
|
Carré moyen
|
F. calculé
|
|
Var . totale
Var. Milieux
Var. Génotype
Var. Explant
Var. Milieux X Génotype
Var. Milieux X Explant
Var. Génotype X Explant
VAR.Milieux X Génotype X Explant
Var . Résiduelle
|
1915.78
24.67
637.49
11.31
411.47
25.75
171.12
98.16
535.81
|
239
1
7
2
7
2
14
17
192
|
8.02
24.67
91.07
5.66
58.78
12.88
12.22
7.01
2.79
|
8.84**
32.63***
2.03 NS
21.06***
4.61*
4.38***
2.51**
|
NS : Non significatif , * : Significatif au seuil
=0.05 , ** : Significatif au seuil =0.01
et *** : Significatif au seuil =0.001.
2.3.2.2.5- Influence de la source
carbonée
Toujours dans l'espoir d'améliorer davantage
les rendements de nos cultures en terme de caulogenèse, nous avons, dans
cette partie, essayé de tester l'influence de la source carbonée.
Pour conduire cette expérience nous avons retenu un seul génotype
le V12 , compte tenu de ses bonnes performances préalablement
manifestées, et pour les même raisons le milieu D0,1 B3 est
sélectionné.
Quatre sucres comprenant deux monosaccharides (glucose et
fructose) et deux disaccharides (saccharose et maltose) ont été
testés. Les résultats observées sont reportées
sur le tableau 16 . Comme on peut le constater sur le tableau 16, l'ensemble
des sucres testés, induisent une caulogenèse mais à des
degrés différents. Le maltose et le saccharose se
révèlent très favorable à la néoformation de
bourgeons face au fructose et le glucose. Les rendements obtenus avec le
maltose et le saccharose sont nettement supérieur au rendement moyen
relative à l'essai (3.88)
Tableau 16: Effet de la source
carbonée sur la caulogenèse. Les expériences sont
conduites avec les explants du génotype V12 ensemencées sur
milieu D0,1 B3 (3mg/l de BA et 0,1 mg/l de 2,4-D).Les résultats sont
obtenus après 4 semaines de la mise en culture. A et B :
Désignent les groupes homogènes séparés par le test
de NEWMAN et KEULS au seuil 5%.
|
Source carbonée
|
Pourcentage d'explants
Caulogéne (B)
|
Nombre moyen de bourgeons / explants (A)
|
Rendement
(AxB)
|
|
Maltose
Saccharose
Fructose
Glucose
|
69.02
59.71
26.21
19.60
|
11.43+1.39
11.42+1.04
2.67+1.53
0.51+0.52
|
7.89 A
6.82 A
0.70 B
0.10 B
|
2*** =73.89 DDL =3 (significatif au seuil =0.001)
.
A travers ces premiers résultats nous pouvons
dire, avec prudence, que les disaccharides paraissent plus favorables à
la caulogenèse que les monosaccharides. La comparaison des moyennes par
le test de NEWMAN et KEULS à 5% a permis de classer les sucres par ordre
décroissant comme suite:
Maltose = Saccharose > Fructose = Glucose.
L'entrée en production, des bourgeons
néoformés, par les explants semble gagner de
précocité lorsque le milieu contient du maltose ou du saccharose.
Les bourgeons commencent à apparaître souvent vers le 15
ème qui suit l'ensemencement. En présence de glucose
ou de fructose, la néoformation des bourgeons ne démarre
qu'à partir du 20 ème jours.
A
B
Planche 8: Bourgeons néoformés
, induit à partir d'explants hypocotyles, sur milieux D0,1B3 ( milieu
pourvu de 3mg/l de BA et 0.1 mg/l de 2,4-D) contenant 30 g/l du maltose ( A)
et du glucose (B).
Les rendements les plus élevés sont obtenus avec
les explants d'hypocotyles cultivés en présence de maltose ou du
saccharose. Il est à noter par ailleurs, que les explants de
cotylédons paraissent incapables de produire des bourgeons sur milieu
contenant du glucose (tableau 17).
Tableau 17 : Influence de la source
carbonée, sur l'aptitude caulogène des explants du
génotype V12. L'expérience est conduite sur milieu D0,1 B3 (3mg/l
de BA et 0,1 mg/l de 2,4-D).Les résultats sont prélevés
après 4 semaines de culture. % EC : Pourcentage d'explant
caulogène, NMB/E : Nombre moyen de bourgeons par explant et
R : Rendement.
|
Nature de
l'explant
|
|
Explants
|
Hypocotyle
|
Cotylédons
|
Racine
|
|
% EC
|
NMB/E
|
R
|
%EC
|
NMB/E
|
R
|
%EC
|
NMB/E
|
R
|
|
Maltose
Saccharose
Glucose
Fructose
|
79.25
76.52
32.20
22.42
|
14.46+0.86
12.78+1.32
0.59+ 0.80
3.88+2.70
|
11.46
9.78
0.19
0.87
|
61.01
44.73
_
2.65
|
8.67+1.76
11.40+1.11
_
2.00+0.49
|
5.29
5.10
_
0.53
|
62.09
55.46
11.82
32.24
|
11.16+1.70
10.06+0.92
0.93+0.55
2.14+0.84
|
6.93
5.58
0.11
0.69
|
2***=73.89 DDL =6 (significatif au seuil
=0.001)
2.3.2.3-Conclusion
En guise de conclusion, nous pouvons dire que cette partie de
notre travail nous a permis de retenir ce qui suit :
- l'existence d'une variabilité génotypique.
Les meilleurs rendements ont été enregistrés
respectivement avec les génotypes V6 (1.12) , L3(0.87) et V12 (0.77)
quelque soit l'explant et le milieu utilisés
- l'existence d'un effet explant. Les cotylédons
semblent plus caulogènes que le reste des explants. Il existe cependant,
quelques exceptions ou les explants sont incapables d'induire une
caulogenèse ; c'est le cas des hypocotyles et des racines provenant
des génotypes B1,B6 et B8.
- L'existence d'un effet milieu (composition hormonale). Dans
notre cas, sur
- l'ensemble des 10 milieux testé, seuls les milieux
D0,1B3 et D1B3 ont permis d'atteindre de bons rendements en terme de bourgeons
néoformés.
- La source carbonée semble, elle aussi, avoir une
part d'influence dans le processus. Effectivement, les résultats obtenus
en présence de maltose ou de saccharose sont meilleurs que le reste des
sucres.
2.4 Aptitude à l'embryogenèse
somatique
2. 4.1 Induction et développement de
l'embryogenèse somatique
Généralement sur les milieux ayant
montré des pouvoirs embryogènes, l'embryogenèse somatique
peut être induite soit directement sur l'explant ensemencé soit
indirectement (en passant par une phase de callogenèse).
Dans le cas d'une embryogenèse somatique directe (qui
se reproduit rarement), les embryons apparaissent sur la surface des explants
de racines. Le processus commence tout d'abord par l'apparition de petits
gonflements, au niveau de l'épiderme des explants, qui évoluent
en petites structures de forme sphérique et à aspect lisse
verdâtre. Ces structures traversent, par la suite, les mêmes stades
de développement morphologique que traversent habituellement les
embryons zygotiques (Planche9: E).
.Dans le cas d'une embryogenèse somatique indirecte,
c'est la callogenèse qui se déclenche la première,
après 5 jours de culture. Après le 8 ème jour, le cal se
développe davantage et présente un aspect
hétérogène. A ce moment, on distingue des régions
très -chlorophylliennes dispersées sur la surface du cal et
à partir duquel se développent de petits corps de forme nodulaire
ou globulaire et à aspect lisse verdâtre. Ces corps
représentent en fait, des embryons somatiques au stade globulaire
(Planche 9:A) et qui sont appelés ,par la suite, à évoluer
à d'autres stades : cordiforme (Planche 9:B), torpille
(Planche9:C) et cotylédonaire (Planche9:D).
Les embryons somatiques produits présentent souvent des
malformations morphologiques (embryons monocotylé, tricotylé, en
forme de bouteille.....etc.) (Planche11: A,B,C,D). On enregistre cependant, un
faible taux d'embryons somatiques à morphologie normale.
2.4.2 Amélioration de l'induction de
l'embryogenèse somatique
2.4.2. 1 Influence de la composition
hormonale du milieu
De la même manière qu'en
caulogenèse, nous avons essayé de voir, dans cette partie de
travail, s'il existe ou non un effet milieu en particulier sa composition
hormonale, sur l'induction de l `embryogenèse somatique. A cet
effet, nous nous sommes servis de 8 génotypes de Scorpiurus et
de divers explants pour conduire cette expérience. Les milieux de
culture testés sont pourvus d'un cocktail hormonal composé de
deux types de régulateurs de croissance à savoir : les auxines
et les cytokinines. Les premiers sont représentés par l'AIA,
l'ANA et le 2,4-D et les seconds par la BA et la Kinétine. Ces
régulateurs sont apportés aux milieux soit
séparément, soit en mélange.
La nature des auxines ou des cytokinines influence
considérablement la production d'embryons somatiques quel que soit le
génotype ou l'explant utilisé.
L'induction de l'embryogenèse somatique semble
être nulle lorsqu'on emploi des milieux à auxines ou à
cytokinines seuls et à différentes doses. Ceci est valable avec
l'ensemble des concentrations employées mais aussi sur l'ensemble des
explants et génotypes testés. Seuls les milieux pourvus d'un
mélange hormonal (auxine*cytokinine) semble amorcer cette induction.
Ainsi, l'apport du 2,4-D et de l'AIA en mélange avec des cytokinines,
notamment la BA et la Kinétine, dans le milieu d'induction permet
l'obtention d'embryons somatiques. Comme on peut le constater, les
résultats du tableau 19, montrent clairement l'effet de la composition
hormonale du milieu sur l'embryogenèse somatique et cela sans tenir
compte du facteur génotype ou explant utilisé.
Tableau 19 : Effet de la composition
hormonale du milieu sur l'embryogenèse somatique. Les résultats
sont obtenus après 4 semaines de cultures (quel que soit le
génotype et explant testé) le pourcentage d'embryons normaux est
calculé à partir des embryons qui se différencient sur
milieu d'induction.. A et B désignent les groupes homogènes
séparés par le TEST de NEWMAN et KEULS au seuil 5%
|
Composition Hormonale
Du milieu
|
Nombre moyen de structure embryogène
(A)
|
Pourcentage d'explants
embryogène(B)
|
Rendement
( A x B )
|
Pourcentage d'embryons normaux
|
|
D3B0,1
D0,1B0,5
A20 B1
A20 K0.1
|
7.79 + 4.37
4.47 + 3.23
4.78 + 3.54
5.56 + 3.60
|
31.19
22.14
32.42
.26.07
|
2.67 A
1.15 B
1.69 B
1.59 B
|
53.00
34.00
76.00
84.00
|
2*** = 8.94 DDL = 3 (significatif au
seuil = 0.001)
B
A
D
C
E
Planche9 : Formation et développement
des embryons somatiques: Embryons somatiques obtenu, directement sur explant de
racine (A), cal embryogène avec embryons somatiques au stade
globulaire(B); au stade cordiforme (C); au stade torpille (D) et au stade
cotylédonnaire (E).
Les rendements rapportés dans le tableau 19, montrent
que les milieux à 2,4-D x BA sont plus favorables que ceux à AIA
x BA ou à Kin x AIA. Malgré les différences apparentes
observées entre les rendements obtenus en milieu D0,1B0,5 ;
B1A20 ou A20K0.1, l'analyse statistique n'en révèle aucune.
Néanmoins, il est clair que le milieu D3B0,1 est plus favorable
à la production de structures embryogènes que le reste.
On relève par ailleurs ,en partant des résultats
du tableau 19, que la corrélation entre le pourcentage
embryogène et le nombre moyen d'embryons par explant est très
élevée, sur les quatre milieux testés. Toutefois, la
bonne corrélation est enregistrée sur le milieu B0,5D0,1 (R=0.98)
,suivie de B1A20 et de A20K0.1 (R=0.95) et enfin de B0.1D3 (0.81). On note
aussi que les écart- types augmentent, quand la moyenne des
structures embryogènes par explant augmente. Ceci est dû à
la production très irrégulière d'embryons somatique par
explant.
La structure morphologique des embryons produits semble elle
aussi être affectée par la nature de l'auxine utilisée. En
effet, comparativement aux milieux à 2,4-D, les milieux à ANA
paraissent favoriser mieux le développement d'embryons normaux. Ainsi,
nous constatons que le taux d'embryons somatiques à morphologie normale
est plus élevé sur milieu à AIA qu'à 2,4-D. Les
principales malformations qui caractérisent ces embryons sont : la
monocotylédonie, la tricotylédonie ou l'obtention de structure
complètement désorganisée ou en forme de bouteille.
Par ailleurs, il n'est pas inutile de rappeler aussi, que
certains milieux, notamment ceux pourvus de 2,4-D x BA, peuvent provoquer
à la fois et l'induction de l'embryogenèse et le
développement des embryons. Par contre, des milieux renfermant de l'ANA,
nécessitent des transferts d'embryons sur milieu dépourvu de
régulateurs de croissance pour permettre leur développement.
2.4.2.2- Recherche de l'explant le plus
performant
Pour évaluer les potentialités
embryogènes des explants en fonction de leur nature, nous avons
mené cette expérimentation avec les explants de
cotylédons , d'hypocotyles et de racines des huit génotypes. Les
milieux d'induction retenus sont le D3B0,1 ; le D0,1B0,5 ; le
A20K0.1 et le A20B1 .
Les résultats de cette expérience (tableau
20),nous ont permis de conclure que les hypocotyles suivis des
cotylédons possèdent les meilleures aptitudes à
l'embryogenèse somatique. En effet le classement du rendement des
explants par le test de NEWMAN
B
A
C
D
Planche 10 (suite): Principales anomalies
morphologiques des embryons somatique .(A) embryon somatique monocotylé.
(B) embryon somatique en forme de font de bouteille. (C) embryon somatiques
présentant des fasciations au niveau des hypocotyles .(D) amas
d'embryons somatiques complètement désorganisés.
& KEULS met en évidence l'existence de trois
groupes homogènes: le premier groupe comprend les
hypocotyles, le second les cotylédons et le troisième les
racines.
On note par ailleurs que le pourcentage embryogène est
proportionnel au nombre moyen d'embryon par explant (R=0.86). Quant, aux
écart - types du nombre moyen d'embryons produits par explants et ceci
quel que soit le génotype ou le milieu utilisé sont importants.
Tableau 20: Variation de
l'aptitude embryogènes des explants ( quel que soit le milieu ou le
génotype testé). Les résultats sont récoltés
après 4 semaines de culture . A et B : désignent les
groupes homogènes séparés par le test de NEWMAN et KEULS
au seuil de 5% :
|
Explant
|
Nombre moyen d'embryons somatiques/explants
(A)
|
Pourcentage d'explants embryogène
(B)
|
Rendement
(AxB)
|
|
Hypocotyle
Cotylédon
Racine
|
6,56 + 3.98
6.19 + 4.22
4.21 + 2.70
|
35.51
29.56
26.36
|
2.33 A
1.83 A
1.11 B
|
2 *** =
23.51 , DDL =2 (significative au seuil = 0.001)
2.4.2.3-Effet du génotype
Lors de cette essai, nous avons testé l'aptitude
embryogène des huit génotypes dont nous disposions, sur les
milieux d'induction D3B0,1 ; D0,1B0,5; A20K0.1 et A20B1 (milieux
supposés être à bon pouvoir embryogène) . Les
résultats de cette essai devraient nous conduire à choisir le
génotype le plus performant en terme de potentialités
embryogènes.
En se referant au tableau 21 où sont
présentés les résultats, nous constatons qu'il existe,
d'après l'analyse statistique (test de NEWMAN et KEULS), quatre (4)
groupes homogènes. Les génotypes sont classés selon
leurs aptitudes à l'embryogenèse somatique. Le groupe A
où se trouve le V12, renferme les génotypes à fort
potentiel embryogène. Le groupe B, où figure le V6 et le V13,
regroupe les génotypes aux potentialités embryogènes
moyennes. Le groupe C ,représenté par le B1, B8 et B6, se
caractérise par un faible potentiel embryogène. Le groupe D,
renfermant le L26 et le L3, se montre quasiment nul à l'égard de
l'embryogenèse.
Dans ces résultats (du tableau 21), nous
remarquons que la différence en terme de rendement entre les
différents génotypes est beaucoup plus marquée par le
nombre moyen d'embryon par explant (qui oscille entre 12.23 et 0.77) que par
le pourcentage d'explant embryogène.
Tableau 21: Aptitude des huit
génotypes de Scorpiurus à l'embryogenèse
somatique (quelque soit le milieu ou l'explant utilisé). Les
résultats sont récoltés après 4 semaines de
culture . A, B, C et D désignent les groupes homogènes
classés par le test de NEWMAN et KEULS au seuil 5%.
|
Génotype
|
Nombre moyen d'embryons par explants
(A)
|
Pourcentage d'explant embryogène
(B)
|
Rendement
(AxB)
|
|
V6
V12
V13
B8
B1
B6
L26
L3
|
9.63 + 5.50
12.23 + 4.92
9.49 + 4.76
1.10 + 0.77
0.68 + 1.95
0.77 + 2.26
0
0
|
27.72
33.68
31.08
30.00
39.70
24.67
0
0
|
2.67 B
4.12 A
2.95 B
0.33 C
0.27 C
0.19 C
0 D
0 D
|
2** = 218.67 DDL = 5
(significative au seuil = 0.01)
2.4.2.4 - Effet de l'interaction des explant, des
génotypes et de la composition hormonale du milieu sur
l'embryogenèse somatique
2.4.2.4.1 - Effet de l'interaction
(génotypes* explants)
De la même manière qu'en caulogenèse, le
but visé par cet essai est de connaître l'incidence de
l'interaction génotype *explant sur l''embryogenèse somatique .
L'expérience a été conduite sur les milieux d'induction
(MS): B0,1D3; A20K0.1; A20B1; D0,1B0,5
Une fois de plus l'effet de l'origine génétique
des explants se prononce sur l'expression morphogène des explants .En
effet les résultats obtenus (tableau 22) montrent que les explants
d'hypocotyle et de racine provenant des génotypes B1, B6 et B8 , sont
incapables de produire des embryons somatiques. On remarque par contre, que la
totalité des explants issus des génotypes V12 ,V6 et V13 sont
embryogènes.
Le classement par ordre décroissant du rendement moyen
par le test de NEWMAN & KEULS est le suivant: HV12 > HV6 > CV12 >
HV13 > CV13>RV12 > RV13>CV6>RV6 >CB8 >CB6 > CB1.
Tableau 22 : effet de l'interaction
(génotype*explant) sur l'embryogenèse somatique. Les
résultats sont récoltés après 4 semaines de culture
et ceci quel que soit le milieu testé. NMES/E : Nombre moyen
d'embryons somatiques par explant PE : Pourcentage embryogène
et R : Rendement.
|
Nature de
l'explant
|
|
Génotype
|
Hypocotyle
|
Cotylédon
|
Racine
|
|
NMES/E
|
PE
|
R
|
NMES/E
|
PE
|
R
|
NMES/E
|
PE
|
R
|
|
V12
V6
V13
B6
B8
B1
|
15.30+6.41
14.47+5.19
9.59 +5.87
_
_
_
|
41.98
28.95
36.07
_
_
_
|
6.31
4.18
3.46
_
_
_
|
11.42+5.14
7.72+4.170
10.32+6.19
2.32+3.99
3.31+ 1.35
2.03+3.43
|
30.73
26.16
29.55
34.91
29.90
28.57
|
3.51
2.02
3.05
0.81
0.99
0.087
|
9.98+3.34
6.71+5.12
8.56+3.10
_
_
_
|
25.25
26.97
27.33
_
_
_
|
2.52
1.81
0.58
_
_
_
|
2** = 51.87; DDL =10 (significative au seuil =
0.01)
2.4.2.4.2 Conduite de l'interaction (explant *
composition hormonale)
Dans cette partie du travail, nous avons essayé de
voir s'il existe ou pas une interaction (explant * composition hormonale) sur
l'embryogenèse somatique. Cet essai a été conduit avec les
génotypes ayant montré de bonnes aptitudes embryogènes.
L'effet de l'interaction (explant * composition
hormonale) sur l'embryogenèse somatique, peut être mis en
évidence, d'après les résultats du tableau 23. On remarque
que les aptitudes embryogènes changent d'un type d'explant à un
autre et pour un même explant, elles varient d'un milieu à un
autre. Comme on peut le constater, ce sont les cotylédons
ensemencés sur le milieu D3B0,1 qui donnent les meilleurs rendements. La
comparaison des moyennes réalisée par le test de NEWMAN &
KEULS confirme cela.
Tableau 23: Effet de l'interaction (explant *
composition hormonale) sur l'embryogenèse somatique et cela quel que
soit le génotype testé. Les résultats sont
récoltés après 4 semaines de culture.
NMES/E : Nombre moyen d'embryons somatiques par
explant ; PE : Pourcentage embryogène et R : Rendement .
|
Composition
hormonale du milieu
|
|
Explants
|
D3B0,1
|
A20K0.1
|
A20B1
|
D0.1B0.5
|
|
NMES/E
|
PE
|
R
|
NMES/E
|
PE
|
R
|
NMES/E
|
PE
|
R
|
NMES/E
|
PE
|
R
|
|
Hypocotyle
Cotylédon
Racine
|
6.75+ 3.44
11.75 +5.9
4.89+ 3.40
|
44.88
30.80
27.60
|
3.03
3.62
1.35
|
7.5 +3.29
4.17+4.30
5.02 + 3.2
|
30.40
30.21
24.10
|
2.28
1.26
1.21
|
6.98 +5.5
3.87 +2.2
3.49 +1.7
|
37.82
28.68
31.51
|
2.64
1.11
1.10
|
5.01+3.47
4.95 +3.8
3.43 +2.3
|
26.94
26.46
23.03
|
1.35
1.31
0.79
|
2 ** = 72.74 DDL = 6
(significative au seuil = 0.0.1)
Le classement par ordre décroissant du rendement moyen
des explants mis en culture sur les milieux d'induction est le suivant :
D3B0,1(C) > D3B0,1(H) = A20B1(H) >A20K0.1(H)=D0,1B0,5(H) = A20K0.1(R)=
D0,1B0,5(C) =D3B0,1(R) = A20K0.1(C) = A20B1(C) = A20B1(R) >D0,1B0,5(R).
On remarque aussi, dans les résultats du
tableau 23, que le nombre moyen d'embryons produits par les explants
d'hypocotyles et de racines est sensiblement identique, quel que soit le
milieu. Par contre, avec les explants de cotylédons, ce nombre moyen est
nettement supérieur avec le milieu D3B0,1 qu'avec le reste.
2.4.2.4.3- Effet de l'interaction
(génotype * composition hormonale)
Comme pour les autres interaction , nous essayons, lors de cet
essai , de voir l'effet (génotype * composition hormonale) sur
l'embryogenèse somatique. Les expériences sont conduites
uniquement avec les meilleurs explants qui sont les hypocotyles.
Les résultats de cet essai (tableau 24) mettent en
évidence, l'existence réelle d'un effet interaction
(génotype * composition hormonale). Ainsi , nous remarquons que les
réactions, à l'égard de l'embryogenèse, varient
d'un génotype à un autre et pour un même génotype,
elles varient d'un milieu à un autre.
Tableau 24 : Effet de l'interaction
(génotype * composition hormonale) sur l'embryogenèse somatique.
Les expériences sont conduites avec les explants d'hypocotyles. Les
résultats sont obtenus après 4 semaines de la mise en culture
des explants . NMES/E : Nombre moyen d'embryons somatiques par explant;
PE : Pourcentage embryogène et R : Rendement
|
Composition hormonale
du milieu
|
|
Génotype
|
D3B0,1
|
D0,1B0,5
|
A20K0.1
|
A20B1
|
|
NMES/E
|
PE
|
R
|
NMES/E
|
PE
|
R
|
NMES/E
|
PE
|
R
|
NMES/E
|
PE
|
R
|
|
V12
V6
V13
B1
B8
B6
|
15.18+5.31
11.43 + 5.58
9.94 + 4.67
2.70 + 4.00
4.41 + 1.58
3.09 + 0.00
|
42.02
33.15
26.65
28.15
29.93
34.95
|
6.38
3.79
2.65
0.77
1.32
1.08
|
10.71+ 4.96
9.06 + 3.03
7.02 + 5.69
_
_
_
|
22.31
20.97
20.97
_
_
_
|
2.39
1.90
2.62
_
_
_
|
11.78+ 5.3
11.41 + 5.7
10.21 + 4.6
_
_
_
|
32.17
27.78
24.87
_
_
_
|
3.79
3.17
2.54
_
_
_
|
11.25 +4.61
6.64 + 4.72
0.78 +6.02
_
_
_
|
34.66
16.88
36.92
_
_
_
|
3.90
1.82
3.98
_
_
_
|
2 ** = 28.31, DDL = 15
(significative au seuil = 0.01 )
De manière générale, nous constatons que
les génotypes appartenant à l'espèce Vermiculatus
paraissent plus souples ou plus disposer à produire des embryons
somatiques et sur une large gamme de milieu, que les autres espèces. On
peut citer à titre d'exemple un ensemble de milieu comme le
D3B0,1 , le D0,1B0,5 ; le A20K0.1 et le A20B1 où les
espèces Vermiculatus., se sont favorablement exprimées.
Ce n'etait pas le cas avec des génotypes comme le B1 , le B6 ou le B8
où le nombre de milieu ayant permis leur expression était
limité au D3B0,1 seulement.
S'agissant des corrélations existante entre le
pourcentage d'explant embryogène et le nombre moyen d'embryons par
explant, elles peuvent être, avec certains génotypes, très
positives comme c'est le cas du V6 (R=0.96) ou négative comme le V13 (R=
- 0.51).
2.4.2.4.4- Effet de l'interaction (composition
hormonale * génotype * de l'explant )
Nous avons décidé, de finir cette
série d'expérience en essayant de voir, par le biais d'une
analyse de variance, l'influence de l'interaction des trois principaux
paramètres, préalablement testés à savoir :
l'explant, le génotype et la composition hormonale du milieu, sur
l'embryogenèse somatique.
Les résultats du tableau 25 indiquent que le nombre
moyen d'embryons par explant et le pourcentage d'explant embryogène,
obtenus, en particulier, avec les hypocotyles et les cotylédons des
génotypes, version Vermiculatus, et sur milieux D3B0,1 et
A20K0.1, sont les meilleurs. Ainsi, les bonnes performances, vis à vis
de l'embryogenèse, manifestées d'une part par les hypocotyles et
à degré moindre par les cotylédons et d'autres part par
les génotypes affiliés à l'espèce Vermiculatus,
se confirment une fois de plus.
Tableau 25: Effet de l'interaction (explant
* génotype * composition hormonale du milieu) sur l'embryogenèse
somatique. Les résultats sont récoltés après 4
semaines de culture.
|
Composition hormonale du milieu
|
Génotype
|
Explants
|
Nombre moyen d'embryons /explant
(A)
|
Pourcentage d'explant embryogène
(B)
|
Rendement
(AxB)
|
|
D3B0.1
|
V12
|
Hypocotyle
|
17.67 + 3.54
|
61.33
|
10.67
|
|
Cotylédon
|
12.77 + 7.93
|
36.02
|
4.60
|
|
Racine
|
15.12 + 4.84
|
25.66
|
3.88
|
|
V13
|
Hypocotyle
|
6.67 + 6.16
|
17.84
|
1.19
|
|
Cotylédon
|
15.82 + 4.49
|
27.11
|
4.29
|
|
Racine
|
7.34 + 4.27
|
23.70
|
1.74
|
|
V6
|
Hypocotyle
|
16.14 + 5.9
|
34.57
|
5.58
|
|
Cotylédon
|
11.26+ 5.5
|
29.57
|
3.35
|
|
Racine
|
6.89 + 6.56
|
35.55
|
2.45
|
|
B 1
|
Cotylédon
|
8.11 + 7.48
|
28.60
|
2.32
|
|
B6
|
Cotylédon
|
9.28 + 8.69
|
34.80
|
3.23
|
|
B8
|
Cotylédon
|
13.23 +2.95
|
29.93
|
3.96
|
|
A20K0.1
|
V12
|
Hypocotyle
|
18.48 +5.51
|
33.06
|
6.11
|
|
Cotylédon
|
9.59 + 6.85
|
35.97
|
3.45
|
|
Racine
|
7.26 +4.5
|
25.06
|
1.82
|
|
V13
|
Hypocotyle
|
11.47 + 5.23
|
28.68
|
3.29
|
|
Cotylédon
|
7.07 + 6.49
|
23.90
|
1.69
|
|
Racine
|
12.08 + 2.29
|
21.93
|
2.65
|
|
V6
|
Hypocotyle
|
15.04 + 4.5
|
28.59
|
4.30
|
|
Cotylédon
|
8.38 + 6.74
|
28.75
|
241
|
|
Racine
|
10.80 + 7.11
|
26.01
|
2.81
|
2 = 60.34* , DDL = 30( significative au
seuil = 0.05)
Tableau 25: Effet de l'interaction (explant *
génotype * composition hormonale du milieu) sur l'embryogenèse
somatique. Les résultats sont récoltés après 4
semaines de culture.
|
Composition hormonale
du milieu
|
Génotype
|
Explants
|
Nombre moyen d'embryon par explant
(A)
|
Pourcentage d'explant embryogène
(B)
|
Rendement
(AxB)
|
|
D0,1B0,5
|
V12
|
Hypocotyle
|
12.45 +8.41
|
23.69
|
2.95
|
|
Cotylédon
|
16.58 + 3.00
|
14.17
|
2.35
|
|
Racine
|
9.50 + 2.51
|
19.68
|
1.87
|
|
V13
|
Hypocotyle
|
3.97 + 2.26
|
31.13
|
2.17
|
|
Cotylédon
|
10.09 + 5.23
|
35.67
|
3.60
|
|
Racine
|
7.01 + 4.2
|
29.95
|
2.10
|
|
V6
|
Hypocotyle
|
13.65 + 3.91
|
33.77
|
4.61
|
|
Cotylédon
|
9.43 + 2.30
|
21.31
|
2.01
|
|
Racine
|
4.10 + 3.89
|
19.02
|
0.78
|
|
A20B 1
|
V12
|
Hypocotyle
|
12.60 +8.08
|
43.80
|
5.52
|
|
Cotylédon
|
13.12 + 2.61
|
27.82
|
3.65
|
|
Racine
|
8.04 + 1.4
|
31.34
|
2.52
|
|
V13
|
Hypocotyle
|
16.23 + 9.66
|
39.86
|
6.47
|
|
Cotylédon
|
8.30 + 5.38
|
31.44
|
2.61
|
|
Racine
|
7.81 + 2.12
|
36.74
|
2.87
|
|
V6
|
Hypocotyle
|
13.04 + 7.76
|
29.52
|
3.85
|
|
Cotylédon
|
1.82 + 1.16
|
21.42
|
0.39
|
|
Racine
|
5.07 + 4.05
|
24.06
|
1.22
|
2 = 60.34* , DDL = 30( significative
au seuil = 0.05)
L'analyse de variance est réalisée à
partir du rendement obtenu par boite de pétri. Elle correspond à
un modèle complètement aléatoire à 5
répétitions et à 3 facteurs croisés :
· Le facteur composition hormonale du milieu à 4
niveaux : D3B0,1 ; D0,1B0,5 A20K0.1 et A20B1.
· Le facteur génotype à 6 niveaux :
V12 , V13, V6 , B1 , B6 et B8
· Le facteur explant à 3 niveaux :
Hypocotyle, cotylédon et racine.
Les résultats de cette analyse (tableau 26) montrent
qu'il existe , dans certains cas, des différences très hautement
significatives comme, c'est le cas avec les facteurs : explant ;
génotype ; composition hormonale du milieu ; de l'interaction
(composition hormonale * explant) ; (génotype * explant) ou
(composition hormonale * génotype), dans d'autres, elles sont hautement
significatives comme avec l'interaction (milieu * génotype *
explant).
De cette analyse de variance , il y a lieu de retenir surtout
que le génotype constitue le facteur essentiel, autrement dit le facteur
qui influence le plus le processus de l'embryogenèse somatique. En
effet, cela se confirment par le fait qu'environ 34.55 % de la variation totale
est liée au facteur génotypique.
2.4.2.5-Influence de la source carbonée.
Compte tenu de l'importance capitale que revêt la source
carbonée dans les recherches entreprises sur l'embryogenèse
somatique, nous avons décidé de tester l'effet de la nature des
sucres sur ce processus morphogénétique. Les expériences
sont conduites avec des explants d'hypocotyles, de cotylédons et de
racines, du génotype V12. Le milieu de culture choisi contient 3 mg/l de
2,4-D et 0,1 mg/l de BA. ( composition hormonale ayant conduit à
l'obtention de meilleures réponses à l'embryogenèse). La
gamme des sucres utilisés est la même que celle
préalablement testée en caulogenèse.
les résultats relatifs à cet essai sont
consignés dans le tableau 27 .
De façon générale, l'embryogenèse
s'est manifestée sur l'ensemble des sucres testés.
Néanmoins, les sucres disaccharides semblent plus stimulant à ce
processus que les monosaccharides. Des résultats, du même ordre,
ont été signalé au cours de la caulogenèse. Cela
confirme, une fois de plus, l'efficacité des sucres disaccharides, en
l'occurrence le maltose et le saccharose, par rapport aux monosaccharides.
Tableau 26 : Tableau d'analyse de la
variance à 3 facteurs croisés .
|
Source de variation
|
D.D.L
|
Somme des carrés
|
Carré moyen
|
F. calculé
|
|
Var . totale
Var. Milieux
Var. Génotype
Var. Explant
Var. Milieux * Génotype
Var. Milieux * Explant
Var. Génotype * Explant
VAR.Milieux * Génotype * Explant
Var . Résiduelle
|
359
3
5
2
15
6
10
30
288
|
2347.22
111.67
871.00
89.20
115.83
69.66
173.16
146.26
770.45
|
6.54
37.22
174.20
44.60
7.72
11.61
17.32
4.88
2.68
|
13.91***
65.12***
16.67***
2.89***
4.34***
6.47***
1.82**
|
*** : Significative au seuil de confiance =
0.001
** : Significative au seuil de confiance = 0.01
Tableau 27 : Influence de la source
carbonée, sur l'embryogenèse somatique des explants du
génotypeV12.L'expérience est conduite sur milieu contenant 3 mg/l
du 2,4-D et 0,1 de BA. Les résultats sont prélevés
après 4 semaines de culture.
% EC : Pourcentage d'explant caulogène,
NMB/E : Nombre moyen de bourgeons par explant et R : Rendement.
A,B,C,et D:Désignent les groupes homogènes séparé
par le test de NEWMAN et KEULS au seuil de 5% .
|
Nature du Sucre
|
Nombre moyen d'embryons explant
(A)
|
Pourcentage embryogène
(B)
|
Rendement
(AxB)
|
|
Maltose
|
19.30 + 1.01
|
34.04
|
6.57 A
|
|
Saccharose
|
15.19 + 2.74
|
40.35
|
6.13 B
|
|
Fructose
|
6.84 + 0.96
|
30.40
|
2.08 C
|
|
Glucose
|
3.92 + 3.44
|
20.40
|
0.8 D
|
2 = 13.86* , DDL = 3( significative au
seuil = 0.05)
L'analyse statistique confirme la
supériorité des disaccharides, en terme d'efficacité,
comparativement aux monosaccharides. Les rendements obtenus en présence
du maltose sont statistiquement supérieur à la moyenne
générale du rendement relative à l'essai qu'est de l'ordre
de 3.89. Les rendements les plus faibles sont obtenus sur les milieux à
glucose. La comparaison des rendements moyens de l'essai par le test de
NEWMAN & KEULS a permis de classer les sucres par ordre décroissant
comme suit :
Maltose > Saccharose > Fructose > Glucose.
Les explants eux aussi réagissent différemment
selon la nature des sucres employés. Ainsi, nous constatons que les
explants d'hypocotyles s'expriment mieux en présence de saccharose qu'en
maltose et c'est le contraire qui se reproduit, avec les explants de
cotylédons et de racines (tableau 28).
Tableau 28 : Influence de la source
carbonée, sur l'aptitude embryogène des explants du
génotype V12. L'expérience est conduite sur milieu D3B0,1. Les
résultats sont prélevés après 4 semaines de
cultures.
NMES/E : Nombre moyen d'embryons somatiques par
explant, % EE : Pourcentage embryogène et R : Rendement
|
SUCRE
|
Hypocotyle
|
Cotylédon
|
Racine
|
|
NMES/E
|
%EE
|
R
|
NMES/E
|
%EE
|
R
|
NMES/E
|
%EE
|
R
|
|
Maltose
|
25.40+2.52
|
35.99
|
9.141
|
19.26+4.65
|
33.33
|
6.161
|
13.23+1.58
|
33.33
|
4.40
|
|
Saccharose
|
17.67+3.54
|
61.33
|
10.83
|
12.77+7.92
|
29.33
|
3.74
|
15.12+4.84
|
25.33
|
3.82
|
|
Glucose
|
5.12+4.66
|
18.66
|
0.955
|
4.90+3.66
|
18.59
|
0.910
|
1.76+0.34
|
30.66
|
0.54
|
|
Fructose
|
8.8+2.54
|
30.66
|
2.698
|
8.24+2.39
|
33.33
|
2.746
|
3.50 +1.45
|
22.66
|
0.793
|
2 *** =32.66 , DDL = 6 (Significative au seuil
de confiance = 0.001)
2.4.3- Germination des embryons somatiques
Les embryons somatiques ayant atteint le stade
cotylédonaire sont automatiquement détachés du cal et
transférés sur trois milieux (MS) « dits de
germination » , dont la composition hormonale est la
suivante :
· Un milieu MS sans régulateurs de croissance
nommé M0.
· Un milieu MS contenant 0,1 mg/l de BA et 0,1 mg/l de
GA3 nommé B0,1G0,1.
· Un milieu MS contenant 20 mg/l d'AIA , 2 mg/l de
Kinétine et 0,1 mg/l de GA3 nommé A20K2G0,1.
L'ensemble des milieux sus-cités, contiennent 60 g/l
de saccharose et 8 g/l d'agar. Les embryons somatiques utilisés
proviennent dans leur majorité, des explants de cotylédons et
d'hypocotyles de six génotypes.
Les résultats, rapportés dans le
tableau 29, montrent que la mise en germination des embryons somatiques sur le
milieu MO (dépourvu de régulateurs de croissance) et le A20K2G0,1
se révèle inefficace. En revanche, le milieu B0,1G0,1
paraît plus favorable à la conversion mais à des
pourcentages qui restent, tout de même, faibles (Planche 10: A) .
Dans certains cas la germination des embryons somatiques n'est pas
complète, il y a soit le développement de la tige seule (Planche
10 : B), soit le développement de la racine seule (Planche 10: C) .
Tableau 29 : Aptitude
morphogénétique des embryons somatiques en fonction du milieu de
germination . Les résultats sont calculés après 2 semaines
de culture de 100 embryons somatique mis en germination pour chaque
traitement
Milieu de
Germination
|
Pourcentage d'embryons somatique
|
|
Ne développant que de racines
|
Ne développant que de tiges
|
Développement de plantes
entières
|
M0
B0,1G0,1
A20K2G0,1
|
100
35
100
|
0
20
0
|
0
40
0
|
0
5
0
|
|
La germination des embryons peut durer jusqu'à 2
semaines. Les boites de pétri ,où sont ensemencés les
embryons, sont exposées à une photopériode de 16/8
(heures) et à une température de l'ordre de 25 °C +
1.
En règle générale , c'est la racine qui
commence sa croissance la première suivie de près par le
démarrage du méristème caulinaire.
De manière générale l'étape de
germination des embryons somatiques pose d'énormes problèmes.
Parmi ces problèmes nous pouvons citer :
* Le phénomène de brunissement des jeunes
racines qui finissent tout le temps par mourir.
* Le grand nombre d'embryons somatiques
transférés présentent des malformations morphologiques
(absence de méristème caulinaire ou racinaire ). ces derniers
sont incapables de se convertir en plantes entières
* Blocage temporaire du méristème racinaire ou
caulinaire par les régulateurs de croissance employés au cours
de la phase d'induction précédentes.
* Durée d'exposition des cultures "in -vitro"
trop longue et qui pourrait perturber la physiologie des embryons
somatiques.
* Le taux de contamination très élevée
lors du transfert des embryons somatiques du milieu d'induction vers le milieu
de germination.
A
B
C
Planche 10: la conversion des embryons
somatiques après 2 semaines de la mise en germination des embryons sur
milieu B0,1G0,1( 0,1 mg/l de BA et 0,1mg/l de GA3) (A) plantule
développée à partir d'un embryon somatique; (B) embryon
somatique ne développant qu'une tige; (C) embryon somatique ne
développant qu'une racine.
2.4.4-Conclusion
L'initiation à l'embryogenèse somatique chez le
Scorpiurus est possible et elle dépend, comme nous l'avons vu,
à la fois de la composition hormonale du milieu, du génotype et
de la nature de l'explant.
Si on tient compte des résultats auxquels nous nous
sommes parvenus, on trouve que le rôle que peut jouer les
régulateurs de croissance est prépondérant. Aucune
réactions relative à l'embryogenèse somatique n'a
été décelée sur les milieux qui y sont
dépourvus. Les régulateurs réagissent en fonction de leur
nature et de leur concentration dans le milieu. Dans notre cas, ce sont les
milieux, pourvus d'une combinaison hormonale (auxine * cytokinine) tels que le
D3B0,1 ; le A20B1 ou le A20K11, qui fournissent les meilleures
réponses à l'embryogenèse.
S'agissant de l'effet génotypique, les rendements
les plus élevés sont obtenus avec les génotypes
appartenant à l'espèce Scorpiurus vermiculatus.
En ce qui concerne les explants, les hypocotyles et les
cotylédons possèdent les meilleures aptitudes à
l'embryogenèse somatique.
La source carbonée, elle aussi joue un rôle
prépondérant dans la régulation du processus de
l'embryogenèse somatique. En effet, sur les quatre sucres testés,
le maltose, suivi de plus prêt du saccharose, se sont
révélés plus efficaces comparativement au reste des sucres
2.3.2.4 Enracinement et transplantation
A) Enracinement et transplantation des bourgeons
néoformés
Cette étape consiste à transférer les
touffes de bourgeons néoformés, souvent attachés à
leur cal d'origine, sur un milieu dit « d'enracinement ».
Ce milieu contient le milieu de base MS et un mélange hormonal fait
d'auxine et de cytokinine A20K0,1 (Planche 11: A)..
Après 10 à 15 jours de culture., la
totalité des bourgeons transférés développent des
racines. La croissance de celles-ci se poursuit jusqu'à atteindre une
taille suffisamment grande ; à ce moment précis, les jeunes
plantules seront retirées des tubes à essais, puis lavées
pour se débarrasser du gélifiant. Ensuite, elles sont
repiquées dans des pots en plastique contenant un substrat
composé de tourbe et de sable au proportion de (2 / 1) (Planche 11:B).
Une certaine humidité doit être maintenue au niveau des plantes et
c'est la raison pour laquelle nous étions amené à
recouvrir les pots par un sac en plastique transparent, placées dans une
mini serre close. Les plantules seront exposées à une
photopériode de 16/8 heures et une température de 23°C +
2. Elles sont régulièrement arropsées par une solution
nutritive composé........
Généralement , la durée de survie des
plantules ne dépasse pas les 10 à 15 jours qui suivent le
transfert. Après le 10 ème jours de culture sur pot, des
symptômes de chlorose (jaunissement des feuilles) commencent à
apparaître sur les feuilles. Elles brunissent par la suite et finissent
par mourir.
A
B
Planche 11 : Enracinement et transfert des
bourgeons. (A)Développement et enracinement des bourgeons obtenus sur
milieu contenant 0,1 mg/l de Kinétine et 20mg/l d'AIA. (B) transfert des
bourgeons enracinés vers les pots (2/3 de tourbe et 1/3 de sable).
DISCUSSION ET CONCLUSION GENERALE
L'objectif essentiel visé par ce travail consiste
à essayer de régénérer in-vitro des
plantes entières de Scorpiurus via l'organogenèse et
l'embryogenèse somatique.
Pour parvenir à cela, nous avons testé trois
principaux facteurs susceptibles d'influencer la
régénération qui sont le milieu de culture, la nature de
l'explant et le génotype .
Dans des essais que nous avons qualifiés de
préliminaires, nous nous sommes parvenu à choisir un certains
nombre de facteurs liés aux conditions d'expérimentation; tel que
la lumière qui semble être nécessaire à
l'organogenèse et l'embryogenèse somatique chez le
Scorpiurus.. L'obscurité semble défavorisée les
deux processus morphogénétique. L'action favorable de la
lumière sur l'embryogenèse et l'organogenèse a
été signalée par plusieurs auteurs notamment
HALPERIN(1966) ; WEBB et al,(1984) in ROGUET,(1989) et LATKOWSKA
et al., 2000
* Concernant la callogenèse, on constate que la
composition hormonale influence considérablement la taille
(importance), la couleur et la texture des cals produits. Ainsi l'usage des
auxines ou de cytokinines, seul dans le milieu de culture, s'est
révélé incapable d'induire une callogenèse sur
l'ensemble des explants testés et cela quelle que soient leurs origines.
Par contre l'adjonction des auxines, en présence de cytokinines, au
milieu de culture la stimule fortement. Des résultats similaire au
notre ont été signalé par (NITSH et NOUGAREDE,1967) sur le
tabac et (SHENG.L et al.,1998) sur le riz.
Par ailleurs, il est utile de rappeler, dans notre cas, que
la présence du 2,4-D associé à une cytokinine (BA ou
Kinétine) favorise considérablement la callogenèse. A ce
sujet , de nombreux travaux rapportent l'efficacité du 2,4-D,
employé seul ou en association avec une cytokinine, vis à vis de
la callogenèse ( SANGHAMITRA et SUMITRA, 1998 ; JAYASREE, 2001).
L'importance de la callogenèse ne dépend pas
seulement de la nature du régulateur de croissance comme nous venons de
le voir mais aussi de sa concentration. Il faut une dose minimale de 0,1 mg/l
de 2,4-D combiné à 0.1 mg/l de BA ou de Kinétine pour
pouvoir obtenir une induction callogène. Pour parvenir à ce
même résultats, en se servant de l'AIA ou de l'ANA comme source
auxinique, il faut un apport d'au moins de 1 mg/l.
La couleur et la texture des cals varient selon la nature des
régulateurs de croissance. Ainsi, on constate par exemple que les
cals induits sur milieux, où la dose de kinétine est
supérieure à celle de l'auxine (quelle que soit sa nature), sont
généralement de couleur vert claire et de texture friable. Sur le
reste des combinaisons, les cals prennent souvent un aspect chlorophyllien et
une texture compacte.
En plus de l'effet hormonal , la nature de l'explant peut
avoir une incidence considérable sur la callogenèse. En effet,
les explants d'hypocotyles et de cotylédons semblent présenter de
bonnes aptitudes .
Le suivi de la cinétique de croissance des cals nous
a permis de mettre en évidence que la callogenèse est
profondément influencée par le facteur génotypique. Ainsi,
nous constatons que l'ensemble des génotypes appartenant à
l'espèce Scorpiurus vermiculatus réagissent mieux
à la callogenèse que le reste. L'implication du facteur
génotypique en callogenèse a été décrit par
BROWN et MEIJER, (1987) sur la luzerne ; SAADI,(1991) sur le
pois ; KALAMANI et RAMASAMY, (1998) sur sorgho
Le présent travail, nous a aussi permis d'obtenir une
organogenèse, avec une production de bourgeons néoformés
(caulogenèse) et de racines (rhizogenèse), et de
régénérer des plantes entières de
Scorpiurus ..
Concernant la rhizogenèse , les résultats de
notre étude nous ont amené à confirmer une fois de plus le
rôle essentiel que jouent les régulateurs de croissances.
Cependant, on constate, que l'usage des auxines ou des cytokinines seules dans
le milieu d'induction, s'est révélé incapable d'induire
une rhizogenèse sur l'ensemble des explants testés et cela quel
que soit le génotype utilisé. Par contre, l'addition d'un
mélange hormonal (auxines * cytokinines) au milieu
d'induction, lui est très favorable. En effet les meilleures
réponses sont enregistrées sur les milieux où sont
combinés les AIA x Kin ou AIA x BA aux doses respectives: 20 mg/l d'AIA
et 0,1 mg/l de Kinétine ou de BA. Cette association hormonale semble
faire bonne recette même sur d'autres espèces telle que le poivre
(CHRISTOPHERE et RAJAM, 1996) ou le prunus (DRUART et al
,(1998).
Il n' y a pas que l'AIA qui se montre bénéfique
pour la rhizogenèse, le 2,4-D aussi, seulement son importance reste
limité. Seul l'ANA affiche une incapacité d'induire ce
processus.
Toujours dans le volet rhizogenèse , nous avons
relevé que la nature des régulateurs naissance à des
racines blanches et poilues moins vigoureuses. Les travaux confirmant cela
sont rapportés par plusieurs auteurs notamment HOBBIE (1998)sur
Arabidopsis ;DRUART et al ,(1998) sur prunus.
Contrairement à nos résultats de nombreux auteurs
mentionnent l'action favorable de l'ANA sur la rhizogenèse en
particulier chez Cucumis hystrix (COMPTON et al.,2001) et
chez Adenophora triphylla ( CHEN et al ., 2001)
Nos expériences nous ont permis aussi de mettre en
évidence une certaine influence génotypique sur la
rhizogenèse. Parmi les génotypes que nous avons testés,
quelques uns se sont montrés récalcitrants c'est le cas de :
B1,B 6 et B8, alors que d'autres comme L3 et V12 ont manifesté de bonnes
capacités rhizogènes. L'influence du génotype sur la
rhizogenèse à été mis en évidence, chez
plusieurs espèces, on cite le cas du pommier (KARHU et ULVINEN,1995) et
celui de la Chamomille recutties (PASSAMONTI et al,1998).
La rhizogenèse varie selon la nature de l'explant
ensemencé. Les plus favorables sont les explants d'hypocotyles, suivis
des racines.
* S'agissant de la caulogenèse, elle se trouve aussi
conditionner par l'action de divers facteurs. Les plus influents sont les
facteurs que nous avons cité précédemment à
savoir : la composition hormonale du milieu, le génotype et la
nature de l'explant.
L'effet de la composition hormonale intervient à la
fois dans l'obtention des bourgeons néoformés et aussi dans
l'enracinement des tiges régénérées (WALKER et
al.,1979; MARGARA,1989) .
Nous avons constaté que, l'usage des auxines ou des
cytokinines seules dans le milieu d'induction est défavorable à
la caulogenèse sur l'ensemble des explants et cela quelle que soit la
concentration utilisée. Les meilleures réponses ont
été enregistrées avec les combinaison 2,4-D x BA, en
particulier sur le milieu B3D0,1( 3mg/lde BA+0,1mg/l de 2,4-D) et à un
degré moindre sur le milieu B3D1( 3mg/l de BA +1mg/l de 2,4-D).
Des résultats similaires aux nôtres, signalent
tous l'intérêt que peut avoir ce type d'association sur
l'induction de la caulogenèse et aussi sur le débourrement de
bourgeons néoformés. C'est le cas de LI et al (1986) sur
Medicago inpulina L. qui précisent que les cytokinines , en
l'occurrence la BA constitue un facteur essentiel pour la néoformation
de bourgeons . Le même constat a été fait par VESTRI et
al (1990) sur le Passiflora coerulea , VENKETESWARAN ,(1990)
sur Psophocarpus tetragonolobus , JADIMATH et al (1998) sur
Guizotia scabra ; CHRISTIANSON et HORNBUCKLE, 1999 sur Funaria
hygrometrica et HANDRO et FLOH (2001) sur Melia
azedarach
En caulogenèse, le facteur génotypique s'impose
comme étant un facteur essentiel et déterminant. Les
résultats, de notre étude, confirment cela, en mettant en
évidence une grande variabilité génotypique vis à
vis de la caulogenèse. Les meilleures aptitudes caulogènes sont
exprimées par le génotype V6 ( avec un rendement de l'ordre de
1.12) pour tous milieux et tous explants confondus. Les réponses de
certains génotypes comme le B1 ; le B8 ou le B6 étaient
faibles. L'effet génotypique sur la caulogenèse n'est pas nouveau
puisque de nombreux auteurs le signalent comme FOUCAULT , (1994), sur le
tabac ; CHRISTOPHERE et RAJAM ,(1996), sur le poivre; SANTALLA et
al .,(1998), sur haricot et TANG et GUO, (2001) sur le pin.
L'importance du facteur génotypique vis à vis
de la caulogenèse s'est confirmé aussi par l'analyse de la
variance. En effet, cette analyse montre qu'environ 33,27 % de la variation
totale des rendements en caulogenèse sont dues à la variation
génotypique.
La nature, des sucres employés dans le milieu,
apporte, elle aussi, sa part d'influence sur la caulogenèse. La
présence du maltose dans le milieu d'induction, entraîne une nette
amélioration des rendements par rapport au rendement moyen de l'essai
obtenu avec la totalité des explants testé. La combinaison du
maltose à la dose de 30 g/l , avec 3mg/l de BA et 0,1mg/l de 2,4-D a
permis une forte stimulation des aptitudes caulogènes.
L'efficacité du maltose comme source carbonée a
été évoquée par plusieurs auteurs notamment DRUART,
(1990) sur le prunus. Le saccharose s'est montré lui aussi
favorable à la caulogenèse. De nombreux auteurs rapportent
l'action positive du saccharose sur la caulogenèse (SAMYN, 1995 ;
SIMPSON et MARKS, 1995 ; GRIBAUDO et RESTAGNO, 1995).
L'action bénéfique du maltose n'agit pas
seulement sur la quantité des bourgeons produits mais aussi sur leurs
qualités. Des résultats presque identiques aux nôtres ont
été rapportés par DRUART,(1995) sur le prunus.
Le transfert des bourgeons néoformés, sur des
milieux dits "de développement" (milieux généralement
pauvres ou complètement dépourvus de cytokinines) a permis leurs
développement et aussi leur enracinement. Il demeure néanmoins
quelques imperfections à corriger, durant cette phase, comme le
brunissement des racines ou l'amélioration du taux de bourgeons
enracinés etc. Ce type de transfert ( transfert des bourgeons, avec
leurs cals d'origines, des milieux d'induction vers les milieux de
développement) est recommandé par de nombreux auteurs (KARHU et
UVINEN, 1995; ANAND et RAO, 2000).
Après enracinement des bourgeons, les nouvelles jeunes
plantules, sont automatiquement transférées sur pots afin de
poursuivre normalement leur développement. Malheureusement ,dans notre
cas, cette étape n'a pas été réussie à cause
peut être de la faible vigueur des racines ou des conditions de culture
inadaptées. Ce constat est appuyé par l'observation faite par
NAIR et al, (1999) sur le cocotier et qui fait état de la
présence d'une corrélation positive entre la vigueur
raçinaire et la survie des plantules en pots.
* Concernant l'embryogenèse somatique, l'impact des
régulateurs de croissance apparaît une fois de plus essentiel dans
les processus morphogènes. L'embryogenèse somatique varie
considérablement en fonction de la nature et de la dose du
régulateur de croissance employé. Effectivement l'usage des
auxines ou des cytokinines seules dans le milieu d'induction est incapable de
conduire à une production d'embryons. Contrairement à nos
résultats, un bon nombre d'auteurs parlent de l'importance de
l'utilisation des auxines seules( en particulier celui du 2,4-D), à
l'obtention des embryons somatiques chez plusieurs espèces comme le
Castanea sativa (PIAGNANI et ECCHER., 1990); le pois (SAADI,
1991); le sorgho (PATIL et KURUVINASHETTI, 1998); le Pinus sylvestris
(HAGGMAN et al ., 1999) et le coton ( ZHANG et al ., 2001).
Les meilleures réponses sont obtenues avec les
combinaisons réalisées entre 2,4-D x BA aux doses
respectives de 3 mg/l et 0,1 mg/l . D'autres combinaisons comme l'AIA x Kin
et l'AIA x BA donnent de faibles rendements. L'action favorable des
combinaisons 2,4-D x BA sur l'embryogenèse somatique a été
signalée par ETIENNE et al (1994) sur
l'Hévéa.
La qualité des embryons a également
été influencée par les régulateurs de croissances.
Les formes dicotylédonnaires sont relativement plus fréquentes
sur les milieux à AIA qu'à 2,4-D. La plupart des auteurs
considèrent que les milieux à 2,4-D, favorisent
fréquemment l'obtention d'embryons anormaux (LIPPMANN et LIPMANN, 1984;
BARWALE et al., 1986; LAZZERI et al., 1987; LAMBERT, 1991;
ZHANG et al ., 2001 ).
L'emploi de l'ANA seul ou combiné aux cytokinines,
dans le milieu d'induction, se montre sans effet aucun sur
l'embryogenèse. Contrairement à nos résultats, d'autres
auteurs utilisent l'ANA avec succès dans de nombreux travaux portant sur
l'embryogenèse somatique : LAPARRA et al .,(1997) chez le
tournesol et BRAR et al ., (1998) chez le coton.
Au cours de la phase d'induction, nos résultats
montrent que l'embryogenèse somatique est sous la dépendance du
génotype. En effet, parmi les génotypes que nous avons
testé, certains se sont montrés récalcitrants, cas des
génotypes L26 et L3 de l'espèce Scorpiurus muricatus ssp
sulcatus alors que d'autres comme V6,V12 et V13 ont manifesté de
bonnes aptitudes embryogènes.
Les rendement obtenus sont nuls pour les génotypes de
l'espèce (tétraploide) Scorpiurus muricatus ssp
sulcatus, faible pour les génotypes de l'espèce
(tétraploide) Scorpiurus muricatus ssp subvillosus et
très élevés pour les génotypes de l'espèce
(diploide) Scorpiurus vermiculatus.. On peut déduire
de nos expériences que l'effet du génotype sur
l'embryogenèse somatique est probablement dû à la
polyploidie,. Des interprétations similaires aux nôtres
ont été faites par BIANCHI et al,(1988) sur la luzerne
et BLONDON et BROWN sur Medicago sativa. Cette relation entre
le génome et l'aptitude à l'embryogenèse somatique a
déjà été reconnue par plusieurs auteurs, SAADI,
(1991) ; BENCHIEKH et GALLAIS (1996) sur le pois ; PATIL et
KURUVINASHETTI, (1998) sur le sorgho et CARNEIRO, (1999) sur le café
.
Nos expériences ont permis de mettre en
évidence une variabilité dans les aptitudes embryogènes,
des différents types d'explants testés. En effet se sont les
explants d'hypocotyles qui ont présenté les meilleures
potentialités embryogènes. Les bonnes performances des
hypocotyles vis à vis de l'embryogenèse sont rapportées
aussi par EVANS et al.,(1981). Cet auteur précise que 40 % des
explants utilisés avec succès en embryogenèse somatique
sont des hypocotyles et des embryon zygotiques .
Le même type d'explant a été testé
avec grand succès par PAMMETIER et al., (1994) et ZHANG et
al .,( 2001) sur coton et NUTI RONCHI et GIORGETTI (1995) sur la
carotte ; BRAR et al., (1998).
Nos résultats, nous ont permis de déduire qu'il
existe aussi le facteur interaction (composition hormonale du milieu *
génotype * nature de l'explant ), qui apporte sa part d'influence sur
l 'embryogenèse somatique. A cet effet, nous constatons que les
aptitudes de certains génotypes tels que le B1, le B6 et le B8
étaient nulles avec l'emploi des hypocotyles et des racines et
positive avec les cotylédons. Néanmoins, ces réactions
positives des cotylédons, ne s'obtiennent qu'avec le milieu
D3B0,1 et elles disparaissent avec les autres milieux .
De nouveau, le facteur génotypique s'identifie comme
étant un facteur incontournable et déterminant dans les
recherches entreprises sur l'embryogenèse somatique. Ce sont les
analyses de la variance qui révèlent cela, en précisant
que 37.10 % de la variation totale est dû à la variation
génotypique.
La source carbonée s'est également
révélée être un facteur pouvant influencer fortement
l'embryogenèse somatique. Les réponses varient en fonction de la
nature des sucres employés.
Parmi tous les sucres testés, dans le milieu
d'induction, le maltose s'est montré comme étant le plus efficace
pour l'embryogenèse somatique suivie du saccharose..
L'efficacité du maltose comme source de carbone a été
évoquée par plusieurs auteurs sur des espèces très
diverses: chez le pois (SAADI,1991); Chez le prunus (DRUART,1990) et
chez l'orange(STANANTINO et al.,1998). L'amélioration des
rendements en présence du maltose peut être due à une
préférence nutritionnelle des tissus à ce type de sucre et
non à un effet osmotique comme l'a constaté SAADI . (1991) sur le
pois.
Au cours de cette étude, nous nous sommes
confrontés à plusieurs problèmes ; le plus important
parmi eux est celui relatif au taux de conversion des embryons somatiques en
plantes entières. Dans cette phase , l'échec était
presque total puisque le taux de conversion n'a pas dépassé les 5
%. Cela est du, en partie, aux expériences limitées ,conduites
lors de cette étude et qui nous semble très insuffisantes pour
résoudre une telle problématique. Les problèmes de
germination des embryons peuvent être attribués soit aux
malformations des embryons (le méristème racinaires ou caulinaire
étant inexistant), soit aux techniques de transferts, des embryons vers
les milieux de germinations. Sur ce dernier point, SVOBODOVA et al.,
(1999) précisent que les dommages causés durant les
procédures de transfert affectent considérablement la conversion
des embryons en plantes entières.
En résumé ce travail nous a permis de
réaliser en grande partie les objectifs que nous nous somme fixés
au départ à savoir l'obtention de bourgeons
néoformés ou d'embryons somatiques , l'optimisation de la
production et la régénération de plantes entières.
Il se termine par la proposition d'un protocole permettant la production de
plante de Scorpiurus par la voie de l'organogenèse et
l'embryogenèse somatique ( Annexe 5).
· Nous voyons chez le Scorpiurus , que seul les
explants issus de plantes cultivées in-vitro sont utilisables (
cotylédon, hypocotyle, racine) . Les possibilités sont donc
réduites à des organes comportant des tissus jeunes.
· La totipotence de ces explants n'est pas toujours
complète et s'exprime à des degrés divers allant d'une
bonne aptitude à l'organogenèse ou à
l'embryogenèse somatique jusqu'à l'inaptitude totale à la
régénération selon leur nature.
· La composition hormonale joue également un
rôle déterminant sur le processus morphogène
(organogenèse ou embryogenèse somatique ). L'induction est
surtout favorisée par la combinaison auxine * cytokinine dans le milieu.
Les meilleures réponses ont été enregistrées avec
les combinaison 2,4-D x BA aux doses respectives de 0,1 mg/l et 3 mg/l
à l'obtention des bourgeons et 3 mg/l et 0,1mg/l pour l'obtention des
embryons somatiques .
· Le facteur génotype influence
énormément la réponse morphogène mais d'une
manière générale se sont les génotypes de l'
espèce Scorpiurus vermiculatus qui expriment les meilleures
réponses aussi bien pour la caulogenèse que
l'embryogenèse somatique .
· La source carbonée à également
influencé considérablement l'organogenèse ou
l'embryogenèse somatique. La présence du maltose dans le milieu
d'induction entraîne une nette amélioration des aptitudes
oraganogènes ou embryogènes des explants .
· La phase de sevrage des plantes ( passage des
plantules des tubes à essais aux pots dans la mini serre ) n'a pas
été réussis probablement à cause d'une part de la
fragilité des plantules et de leur système radiculaire manquant
toujours de vigueur et d'autres part des conditions de sevrage mal
adaptées à notre expérimentation.
En terme de ce travail , on peut dire que la
régénération chez le Scorpiurus via
l'organogenèse et l'embryogenèse somatique est donc possible.
Mais il reste de nombreux problèmes à résoudre, pour que
la technique soit exploitable en sélection végétale.
Concernant l'embryogenèse somatique, le rendement et
la qualité des embryons somatique doivent être
améliorée d'avantage et devaient conduire à
l'amélioration de la germination..
Une autre voie de recherche très prometteuse devra se
porter sur la maîtrise de l'enracinement des bourgeons et la
résolution du problème d'endurcissement ou la phase
d'acclimatation qui reste une des étapes les plus réfractaires
à réalisée.
En conclusion , cette étude nous a permis d'atteindre
l'objectif que nous étions fixé au départ et elle
représente une première contribution de notre part, pour la
régénération de plantes entières chez le
Scorpiurus. Ainsi les résultats auxquels nous nous sommes
parvenus sont plus qu'encourageant puisque jusqu'alors aucune
référence bibliographique n'a rapporté des
résultats relatifs à l'obtention de plantes entières via
l'embryogenèse somatique ou l'organogenèse chez le
Scorpiurus.. Ce travail mérite d'être poursuivie pour
mieux maîtriser la régénération chez le
Scorpiurus
REFERENCES
BIBLIOGRAPHIQUES
ABDELGUERFI A.,1976. Contribution à
l'étude de la répartition des espèces locales de luzernes
annuelles en fonction des facteurs du milieu ( 200 stations ) liaison entre les
caractères de ces 600 populations étudiées à
Benislimane et leur milieu d'origine .Thèse Ing INA Alger174p
ABDELGUERFI BERRIKIA R . et ABDELGUERFI
A.,1986. Valorisation des ressources phytogénétiques
locales d'intérêt fourrager dans l'aménagement des zones de
montagne . Ann.Inst.Nat. Agronomie El Harrach V10(2):1-11
ABDELGUERFI A.,1989. La gestion des milieux
naturelles et artificiel en Algérie . conséquences sur les
ressources phytogénétiques. Ann.Inst.Nat. Agronomie El
HarrachV13(1): 145-156.
ABRIE A.L et STADEN J.V ., 2001.
Micropropagation of the endangered Aloe polyphylla . Plant Growth Regulation
33: 19 - 23.
ALAVENA A.G.A. et ROTA A.R.,1990. Tissus
cultures of bean (P.coccineus L) and then application to breeding ,
Acta - Horticulturae . 280 , in-vitro culture and Horticultural
breeding : 223-229.
AMMIRATO
P.V.,1983.-Embryogenesis in : Handbook of plant cell
culture. Vol 1, Evans D.A ., sharp W.R, AMMIRATO P.V and YAMADA Y. . New
york : Macmllan publishing co: 82 -123
ANAND A. et RAO C.S., 2000.
A rapid in-vitro propagation protocol for Piper barberi
gamble , a critically endangered plant. In-vitro Cellular et
Developmental Biology Plant V36 .
ANDRIEU Y.C ., DEMARQUILL Y. et SAUVANT D.,
1978. Tableau de la valeur nutritive des aliments . Ch Alimentation
Ruminants. 17: 519 -590.
AUGE R., BEAUCHESNE G., BOCCON -GIBOD., DECOURTYE
L., DIGAT B ., JALOUZOT R .,MINIER R.,MORAND .CL.,
REYNOIRDJ.P.,STRULLUD G et VIDALIE H.,1989. La
culture in-vitro et ses application horticoles. Ed Lavoisier
225p
ATANASSOV A.I et MEHANDJIER A.D.,
1979.In-vitro induced morphogenesis in pea .
R.Acad.Bulg.Sci , 32 : 115 - 118.
BARWAL U.B .,KERNS H.R. et WIDHOLM J.M
.,1986. Plant regeneration from callus cultures of sevral soybean
genotypes via embryogenesis and organogenesis . Planta .167: 473-481.
BATTANDIER J.A. et TRABUT L., 1890. Flore
d'Algérie (Dicotylédones). Ed F.BARY :284 - 285.
BEACH K.H. et SMITH R.,1979. Plant
regeneration from callus of red and crimson clover . Plant Sci .Lett. 16: 231 -
237.
BELAIZI M. et BOXUS P.,1995.
In-vitro shoot multiplication of Cork.oak(Quercus suber
L.) influence of different carbohydrates. Bull Rech.Agron.Gembloux
30(1-2).
BELANGER I.A., 1998. Enjeux du
développement des recherches fondamentales : qu'avons nous appris en
analysant le génome d'Arabidopsis thaliana Agronomie 6
BENCHEIKH M et GALAIS A ., 1996. Somatic
embryogenesis in pea ( Pisum sativum L and Pisum arvense L.)
: Diallel analysis and genetic control . Euphitica
BENSALEM K., ABDELGUERFI BERRIKIA R . et ABDELGUERFI
A.,1988: Contribution à l'étude des espèces
spontanées du genre Scorpiurus L en Algérie V .
Comportement en culture expérimentale de 120 population de 3
espèces . Ann.Inst.Nat. AgronomieEl Harrach V13(2) :544-557.
BENSALEM K., ABDELGUERFI BERRIKIA R . et ABDELGUERFI
A.,1990. Relation du genre Scorpiurus L avec certains
facteurs du milieu en Algérie . Fourrages 124:407-419.
BIANCHI S., FLAMENT P. et DATTEE Y.,1988.
Embryogenèse somatique et organogenèse in-vitro chez la
luzerne , évaluation des potentialités de divers génotypes
. Agronomie 8(2):121 - 126.
BINGHAM E.T., HURLEY L.V ., KAOTZ D.M .et SANDERS J.W
., 1975 . Breeding alfalfa wich regenerates from callus tissue culture
. Crop sci 15: 719 - 721.
BLONDON F .et BROWN S., 1999. Ploidy of
embryogenic Medicago sativa ,subsp falcata germplasm.
Agronomie, 19:69 - 72
BOXUS P.,1995:
Multiplication végétative: micropropagation et
embryogenèse somatique in biotechnologies végétales . BV
93, Ed CNED. AUPELF- UREF 191p.
BRAR K.S., SANDHU B.S . et GOSAL S.S .,
1998: Tssue culture reponse of cultivated and wild cotton species.Crop
improvement 25(1): 59-65.
BROWN C.W et ATANASOV A ., 1985. Role of
genetic back ground in somatic embryogenesis in Medicago. Plant cell,
Tissue organe culture 4: 111 -122.
BROWN C.W et MEIJER E.G.M,1987. Role of
exogenous reduced nitrogen and sucrose in rapid high frequency somatic
embryogenesis in Medicago sativa , Plant Cell. Tissue and Organ Culture , 10:
11 - 19
BROWN C.W., 1988: Gemplasm of
in-vitro somatic embryogenesis in alfalfa . Hortscience 23(3): 526 -
531.
CABASSON C., OLLITRAULT P. et TEISSON
C.,1994: Embryogenèse de suspensions de citrus Deliciosa
ten In Teisson : la culture in-vitro de plantes tropicales
CIRAD.Montepellier
CAMEFORT H.,1977: Morphologie des
végétaux vasculaires .Ed DOIN,418p.
CARENE C.,1992. Les adventices des cultures
méditerranéennes en Tunisie leurs plantules, leurs semences : 398
- 399.
CARNEIRO F.M.,1999. Advences in coffee
biotechnology .
Agbiotechnet V(1) ABN 006 CAB
international
CHAUVET M.,1989. Plantes sauvages
menacées de France . Billan et protection . Actes du colloque de Brest
385p.
CHARNIERE F., SOTTA B . MIGINIAC E . et HAHNE G.,
1998:Induction of adventitious shoots or somatic embryos on
in-vitro cultured zygotic embryos of Helianthus annuus:
variation of endogenous hormone levels. Plant Physiology et BiochemestrieV36N9:
81-94.
CHEN C.C ., CHEN S.J ., SAGARE A.P. et TSAY S.H.,
2001. Adventitious shoot regeneration from stem internode explants of
Adenophora triphylla ( Thunb ) A.DC. ( Campanulaceae)- an important medicinal
herb. Bot.Bull.Acad.Sin 42 : 1 - 7
CHEVRE A.M.,1985. Recherche sur la
multiplication végétative in-vitro chez le chataignier.
Thèse de doctorat . Université de bordeaux II 100p.
CHRISTOPHERE T .et RAJAM M.V., 1996. Effect
of genotype explant and medium on in-vitro regeneration of red
papper . Plant Cell Tissue and Organ Culture, 46 (3) : 245 - 250.
CHRISTIASON M.L et HORNBUCKLE J . S., 1999.
Phenyurea cytokinins assayed for induction of shoot buds in the moss
Funaria hygrometrica
COME D.1970. Les obstacles à la
germination : Monographie de physiologie végétale
Ed.Masson .Paris , 216p
COMPTON E.M ., PIERSON B.L et STAUB J.E.,
2001. Micropropagation for recovery of Cucumis hystrix .
Plant Cell Tissue and Organ Culture 64: 63 - 67
COUTET C., BERLAN D.M. et DENANE Y .,1993.
Agriculture et société, pistes pour la recherche. Ed INRA
,.303p
DAGNELIE P.,1970. Théorie et
méthodes statistiques, applications agronomiques, Vol.II., Duclot J. Ed
Gembloux,451p.
DAIKH H. et DEMARLY Y., 1987.
Résultats préliminaires sur l'obtention d'embryons et la
réalisation de semences artificielles de palmier dattier ( Phoenix
dactylifera L). Fruit V42 (10): 593 - 596.
DALVESCO L.L et GUERRA P.M., 2001. The
effectiveness of nitrogen sources in Feijoa somatic embryogenesis. Plant Cell
Tissue and Organ Culture 64:
19 - 25
DEMARLY Y. et SIBI M.,1989.
Amélioration des plantes et biotechnologie IV
vitro variation ou variations
somaclonales Ed John-libbey .Eurotext .London England 152p.
DEMARLY Y.,1994.Les biotechnology et
l'amélioration des plantes .Bull Rech..Agron.Gembloux 29(1)5-21.
DESIRE S.,1988. Aptitude à la
callogenèse et à l'embryogenèse somatique de divers
organes de cinq espèces de lupins ( Lupinus sp ).
Résultats préliminaires . D.E.A en biologie et physiologie
végétale . Paris VI 25 .
DODEMAN V.L ., DUCREUX G. et KREIS
M.,1997. Zygotic embrogenesis versus somatic embryogenesis .
Journal of Experimental Botany 48N 313 : 1493 -1509.
DOMINGUEZ .et GALLIANO ., 1974. Reversion del
geno Scorpiurus l.I parte expirimantal lagascalia 4(1) : 64 - 84
DRUART PH.,1990. Improvement of somatic
embryogenesis of the cherry DWARF root stock Inmil / GM9 by the use of
different carbon sources. Acta Horticulturae , 280 in-vitro culture and
horticulturae breeding.
DRUART PH.,1992: In-vitro culture
and micropropagation of plum (Prunus spp) " Biotechnology in
Agriculture and forestry " V(18) High -Tech and micropropagation II Ed Y.P.S
Bajaj .Springer - Verlag Berlin Heidelberg: 279-301.
DRUART PH., 1995. C - source and grouth
respense of Prunus glandulosa " sineusis" thund and Malus punila
Mill. M26 and M9 clone 29 during in-vitro propagation.
Bull.Rech.Agron.Gembloux 30(1-2): .
DRUART PH. et SAMYN G .,1995.
Carbohydrates and in-vitro organogenesis.
Bull.Rech.Agron.Gembloux 30(1-2):
1-3.
DRUART PH ., DELPOTE F., BRAZDA M., UGARTE - BALLON C
., DA CAMARA - MACHADO A., LAIMER DA CAMARA MACHADO M ., JACQUEMIN J et
WATILLON B., 1998 . Genetic transformation of cherry trres
. Proc Third Int Cherry Sym , Ed
Jones ystaas Acta Hort , 468 - 71 - 76
EGERTSDOTTER U et ARNOLD S.V.,1998.
Development of somatic embryos in Norway spruce.Jou EXP Bot 49 (319): 155
- 162.
ESCALANT J.V.,PODUSCHEK C.C., BABEAU J.GRAPIN A. et
TEISSON C., 1994. Embryogenèse somatique des bananiers
à partir d'explants floraux. In Teisson : la culture in-vitro
de plantes tropicales CIRAD.Montepellier
ETIENNE H., SOTTA B., MONTORO P .,
MIGINIAC E. et CARRON P.M., 1994. Régulateur de croissance en
embryogenèse somatique de l'Hévéa . In Teisson : la
culture in-vitro de plantes tropicales CIRAD.Montepellier .
EVANS D.A., SHARP W.R. et FLIEN C.E.,1981.
Grouth and behaviour of cell cultures : embryogenesis and organogenesis in
Plant tissue culture , méthods and application agricultures . Throupe
T.A Ed Academic press: 45 - 113.
F.A.O statistiques.,1999: Perspective de
l'alimentation , système mondial d'information et d'alerte rapide sur
l'alimentation et l'agriculture N°2 . Organisation des Nations Unies pour
l'alimentation et l'agriculture. Rome.
FELDMAN PH ., SAPOTILLE J. ,GREDOIRE P. et ROTT PH
.,1994. Micropropagation de la canne à sucre . In Teisson :
la culture in-vitro de plantes tropicales CIRAD.Montepellier
FERRY M., BOUGUEDOURA N. et EL
HADRAMI I .,1998. Patrimoine génétique et technique de
propagation in-vitro pour le développement de la culture du
palmier dattier . Numéro spécial oasis .Secheresse.9(2)
:139-146
FLETCHER P.J., FLETCHER J.D. et
CROSS.R.J.,1998.. Potato germplasme in-vitro storage and
virus reduction . Journal of crop and horticultural science 26(3): 249-252.
FOUCAULT C.,1994. Variation somaclonale dans
le genre Nicotiana I , régénération de pousses
feuillés sur cals , influences du génotype. Annales du tabac ,
section 2( 26) : 9 - 17.
FOURY A.,1950. Les légumineuses
fourragères au Maroc . Les cahiers de la recherche agronomique Rabat
N°3 : 101 - 117.
FORTES A.M et PAIS M.S ., 2000. Organogenesis
from internode - derrived nodules of Humulus lupulus Var. Nugget (
Cannabinaceae): histological studies and changes in the starch content .
American Journal of Botany 87 (7) : 971 - 979.
FRACARO F et ECHEVERRIGARAY S ., 2001.
Micropropagation of Cunila galioides, a popular medicinal plant of
south Brazil . Plant Cell, Tissue and Organ Culture 64: 1- 4
FRANKLIN C.I . TRIEU T.N., GONZALES R.A.et DIXON R.A
., 1991.
Plant
regeneration from seedling explants of green bean (Phasealus
vulgaris) via organogenesis . ·Plant cell tissue and organ cult
24 (3) : 199- 206.
FRETT J., 1977 : Influence of nutrient salts
, auxines and cytokinines on the in-vitro grouth of salvia
greggie . Plant cell tissu and organ culture 9: 89 -102.
FUJII A.A.,SHADE D.T., REDENBOUGH K. et WALKER K.A.,
1987: Artificiel seeds for plant propagation . Trendsin Biotechnology
5N°12(47): 335-339.
GAILLARD B.J.C., LEGOUPI L . et RUFFIN J.C.,1977.
Le bersim ou trèfle d'Alexandrie fourrage irrigué
méditerranéen dans le haut Chelif .Agro -trop (32) 4: 364
-376.
GAJ M.D ., 2001 . Direct somatic
embryogenesis as a rapid and efficient system for in-vitro regeneration of
Arabidopsis thaliana . Plant Cell . Tissue and Organ Culture 64: 39 -
46
GALZY R . et HAMOUI M ., 1980. Induction de
l'organogenèse sur des cals de Vicia faba miner provenant
d'apex .Cand jour .Bot (59):203 -206.
GEORGE F et SHERRINGTON P.D ., 1984 .
Plant propagation by tissue culture. Exegetic Itd.England: 125 -129
GIORGETT L ., VERGARA M.R., EVANGELISTA M., LOSCHIAVO
F., TERZI M. et NUTI RANCHI V.,1995. On the occurence of somatic
meiosis in
embryogenic carrot cell cultures
. Mol.Gen.Genet . 246 springer -
VERLAG : 657 - 662.
GOUBAY A. et ABDELGUERFI A.,1991. Les
espèces spontanées du genre trifolium L en
Algérie . Comparaison des graines et des infloréscences chez
treize trèfle . 4 congré Int des Terres des parcours
.Montepellier FranceV(1).
GOUMIRI R. et ABDELGUERFI A
.,1989: Contribution à l'étude des espèces
spontanées de la tribut des Hedysarées en Algerie :
Analyse chimiques du fourrage au stade végétatif. Ann.Inst.Nat.
AgronomieEl Harrach 13(2) : 558 -567.
GOUTHERET R.J., 1977: La culture des tissus
et des cellules des végétaux In travaux dédies à
la mémoire de George Morel. Ed Masson: 253 - 259
GUIFERREIRA A., CHING Y.H. et SANTAREM E.R.,
1990. Somatic embryogenesis of soybean ( glycin max L, merill)
brazilian cultivars Ivora and IAS.5 OYTON ,51(2): 139 - 144 .
GRAYBOSCH R.A., EDYE M.E . et
DELANNEY X ., 1987: Somaclonal variation in soybean plants
régénérated from the cotyledonary . Node tissue culture
système crop sci (27) : 803-806.
GRESPO D.G.,1977: Quelque aspect de
l'amélioration des productions pastorales et fourragères en corse
El vas portugual 32p.
GRIBAUDO I et RESTAGNO M .,1995. Influence
of sucrose concentration on axillary bud proliferation in micropropagted
grapevine. Bull Rech Agron , Gembloux , 30(1-2) : 47 - 55 .
GROSE R.W . et BINGHAM E.T ., 1984: Variation
in plants regeneration from tissue culture of tetraploid alfalfa heterozygous
for sevral traits. Crop Science 24: 655-658.
HAGGMAN H., JOKELA A., KRAJNAKOVA J., KAUPPI ., NIEMI
K.et ARONEN T ., 1999. Somatic embryogenesis of scots pine : cold
treatment and characteristics of explants affecting induction . Jou.exp.Bot,
50 ( 341) : 1769 - 1778.
HALPERIN W., 1966. Alternative morphogenetic
events in cell suspensions . Amer; Jour. Bot,53 : 443 -453.
HAMATT N., GHOSE T.K. et DAVEY M.R.,1986
.Regeneration in legumes. In : vasil, I.KedCell Culture and Somatic ,
Cell Genetic of plants . Vol.3, New York; Acad .press; I.N.C: 67 - 95.
HANDRO W .et FLOH E.I.S.,2001. Neo-formation
of flower buds and other morphogenetic responses in tissue cultures of Melia
azedarach.Plant Cell Tissue and Organ Culture 64: 73 - 76.
HANNWEG K., WATT M.P .et BERJAK ., 1996. A
simple methode for the micropropagation of Bowiea volubilis from inflorescence
explants . Bot.Bull. Acad .Sin 37: 213 - 217.
HARKMAN V. et ARNOLD S., 1985., Plantlet
regeneration through somatic embryogenesis in picea abies ( Norway
spruce) . Journal plant physiology , 121: 149 -158.
HARTWECK L.M., LAZZERI P.A., CUI D .et COLLIN
S.,1988: Auxine orientation effect on somatic embryogenesis from
immature soybean cotyledon in-vitro . Cell Dev Biol 24(8) : 821 -
829.
HOBBIE L.J., 1998 : Auxin
molecular genetic approaches in Arabidopsis . Plant
Physiology et Biochemestrie36
(1-) :91 -102
JACOBSEN H.J. et KISELY W.,1984. Induction
of somatic embryos in pea. Pisum sativum L . Plant Cell Tissue Organ
Culture, 3 : 319 -34.
JACOBSEN H.J. et KISELY W.,1987. Somatic
embryogenesis from pea embryos and shoot apices . Plant Cell Tissue and Organ
Culture,20: 7 - 14 .
JADIMATH V.G., MURTHY H.N., PYATI A.N., KUMAR
H.G.A., RAVISHANKAR B.V., 1998 . Plant regeneration from leaf cultures
of guizotia
Abyssinica (Niger) and guizotia scabra
phytomorphologiy 48(2):131-135.
JAHANDIE Z.E. et MAIRE R.,1932: Catalogue des
plantes du Maroc (Spermaphytes et petéridophytes ). Tome 2.
Dicotylédones et Archilamydes . Alger , Imprimerie Minema p.
Lechevallier. 416p.
JAYASREE T ., PAVAN U ., RAMESH M ., RAO A.V ., REDDY
J .M.K. et SADANANDAM A., 2001. Somatic embrogenesis from leaf
cultures of potato.
Plant Cell Tissue and Organ
Culture,64 : 13 - 17 .
JULLIEN M.,1991: La multiplication
végétative in-vitro , bases méthodologiques et
physiologique . D.E.A . Ressources génétiques et
Amélioration des plantes . INA Paris Grignon 101p.
KALAMANI A. et RAMASAMY N.M, 1998.
In-vitro response of genotype in pearl millet. Indian Journal of
Genetics and plant Breeding ,58 (2): 153 - 158
KARHU S .T. et ULVINEN S.K., 1995. The
effect of different carbohydrates on the rooting of micropropagted apple shoots
and their adaptation after transplantation. Bull Rech Agron , Gembloux 30(1-2)
: 87 -101.
KISELY W., LAZZERI J.R., COLLIN G.B. et JACOBSEN
H.J., 1987. Plant regenetion via somatic embryogenesis in pea . Plant
Cell Reports,6 : 305 - 308.
KRISTEN L.G., JERRIN M.R.V.,MURCH
S.J. et SAXENA K.P.,2000: In-vitro regeneration of
Echinacea purpurea L . Direct somatic embryogenesis and indirect shoot
organogenesis in petiole culture . Rev in-vitro
cellular et developemental biology plant (36).
LAMBERT M.,1991. Embryogenèse
somatique chez le soja ( glycine. Max L. Merrill). Thèse Docteur
.Université. Paris sud, 179p.
LAPARRA H.,STOEVA P., IVANOU P .et
HAHNE G.,1997: Plant regeneration from different explants in
Helianthus smithu heiser (C.sunflower) . Plant Cell
.Reports16(10):692-695.
LATKOWSKA M.J KUAALEN H. et APPELGREN M.,
2000: Génotype dependent blue and red light inhibition of the
proliferation of the embryogenic tissue of Norway spruce.
In-vitro cellular et Developmental Biology Plant 36.
LAZZERI P.A ., HILDEBRAND D.F. et COLLINS G. B.,
1987. Soybean somatic embryogenesis : effects of hormones and
culture manipulations . Plant Mol . Biol . Report . 3: 160 - 167.
LIPPMANN B. et LIPMANN G,1984. Induction of
somatic embryos in cotyledonary tissue of soybean Glycine max L.
plant Cell Reports , 3: 215 - 218.
LI X. Q .,TEOULE E., DATTEE Y .et DEMARLY Y
.,1986: Régénération de plantes après
cultures d'inflorescences in-vitro chez Medicago hipulina L
.C.R. Acad science paris 303 série III N° 13.
LOISEAU J.,FERRIERE N.M. et LEDEUNFF
Y.,1998:Histology of somatic embryogenesis in pea . Plant Physiology
et Biochemestrie36N9.
MAHESWAREN G. et WILIAMS E.G., 1984. Direct
somatic embryoids formation on immatures embryos of Trifolium repens ,
Trifolium pratense and Medicago sativa L. and rapid clonal propagation of
trifolium pratense and Medicago sativa L. and rapid clonal propagation of
Trifolium repens . Ann. Bot, 54 : 201 - 211.
MALMBERG R.L.,1979 . Regeneration of whole
plants from callus cultures of diverse genetic lines of pisum sativum
L. planta, 146: 243 - 244.
MAMIYA K et SAKAMOTO Y., 2001. A method to
produce encapsulatable units for synthetic seeds in Asparagus officinalis.
Plant Cell Tissue and Organ culture 64: 27 -32.
MARGARA F., 1982 : La multiplication
végétative in-vitro .Aspects généraux
B.T.I.374 L1 Agro 15:701-711.
MARGARA F.,1989. Bases de multiplication
végétative : les méristèmes et
l'organogenèse . Ed INRA Paris 262p.
MC CAY T.J.,1987.Characterisation of alfalfa
( Medicago sativa L) plants regenerated from selected NaCL tolerant
cell lines. Plant Cell Rep 6 : 417 - 422.
M'HAMMEDI BOUZINA M.,1992. Contribution
à l'étude des graines de quelques Légumineuses
fourragères spontanées en Algérie . Thèse de
Magister INA . El harrach 105p.
MILENA C., MOLA J., EDER J., HRUBCAVA M . et VAGNER M
., 1998. Abscisic acid , polyamines and phenolic acids in Sessice
oak somatic embryos in relation to their conversion potentiel . Plant
physiology et biochemistry 36N3.
MOKSAL S.,1983. Billan
fourrager en Algérie en Nord . Billan énergétiques INA El
harrach: 1-49.
MONMARSON S.N., FERRIERE M. et TEISSON C.,
1994. Cals embryogènes
Haut fréquence issus de
plantes semis chez Carica papaya (papayer) :
obtention et germination des
embryons somatiques . Fruits 49(4) :
279 - 288.
MOROGINSKI L. A et KARTHA K.K ., 1981.
Regeneration of pea ( Pisum sativum L.cv. century) plants by
in-vitro of immature leaflets . Plant Cell Reports,
1: 64 - 66.
NAIR M.K., KARUM A. et RAJESH M.K.,1999.
Research potentiality of coconut biotechnologiy .AgBioTechNet 1 ABN 019.
NEGRE R.,1961: Petites flores des
régions arides du Maroc occidental . CNRS Paris: 373 - 374.
NOUGAREDE L.A.et NITSH J.P., 1967 . L'action
conjuguée des auxines et des cytokinines sur les cellules de moelles de
tabac , étude physiologique et microscopique électronique .Bull
Soc Franç , physiologie végétale , 13: 81 - 118 .
NORREL B., 1973: Cultures de tissus
végétaux et embryogenèse non zygotique. Soc . Bot memoire
. coll Morphologie : 71 - 98.
NUTI RANCHI V., 1990: Organogenesis and
embryogenesis : genetic and physiological approaches 1st
International symposium in-vitro culture and horticultural breeding
,Acta Horticulturae 280: 1 - 11
NUTI RANCHI V., 1995: Mitosis and meiosis in
cultured plant cells and their relation ship to variant cell types arising in
culture . International revieus of cytology 158: 65 - 139.
OUZZANE .et ABDELGUERFI A.,1989: Etude du
développement du système racinaire en minihizotron chez quatre
légumineuses spontanées en Algérie . Ann.Inst.Nat.
AgronomieEl Harrach 13(2): 568-580.
PAMMETIER C . TOURNEUR J., MAZIER M., DUMANOIS V.et
COUZI P., 1994. Transformation génétique du cotonnier (
Gossypium hirsutum L) In Teisson : la culture in-vitro de
plantes tropicales CIRAD.Montepellier.
PARROTT W.A.,WILLIAMS E.G., HILDEBRAND D.F. et COLLIN
G.B.,1989. E ffect of genotype on somatic embryogenesis from immature
cotyledon of soybean . Plan Cell Tissue Organ Culture, 16: 15 - 21 .
PAROTT W.A., 1991. Auxin - stimulated somatic
embryogenesis from immature cotyledons of white clover . Plant Cell Reports ,
10: 17 -21.
PASSAMONTI F., PICCIONI E., STANDARDI A. et VERONESI
F.,1998. Micropropagation of chamomilla recutita (
L) ranschert. Acta horticulturrae ,457: 303 - 309.
PATIL V.M .et KURUVINNSHETTI M.S.,1998: Plant
regeneration from leaf sheath cultures of some Rabi sorghum cultivars.
South African Journal of Botany 64(3): 217-219
PELLETIER G. et PELLETIER A.,1971: Culture
in-vitro de tissus de trèfle blanc (Trifolium repens)
variabilité des plantes régénérées. Ann -
Amelior Plant. 21: 221-223.
PEDERSON G.A., 1984. In-vitro
culture and somatic embryogenesis of four Trifolium species . Plant
Science .45: 101 -104.
PHILLIPS G.C. et COLLINS R.B., 1979.
In-vitro tissue culture of selected legumes and plant
regeneration from callus cultures of red clover. Crop SCI 19: 59 - 64.
PIAGNANI C . et ECCHER T., 1990.
Somatic embryogenesis in chestnut ( Castanea spp), in-vitro culture
and Horticultural Breeding In Acta Horticulturae, 280 : 159 - 161
PIATTI M.F., 1988. Embryogenèse
somatique et synchronisation du développement embryonnaire .
Thèse de doctorat d'état en pharmacie . paris VI 130p
QUEZEL P. et SANTA ., 1962. Nouvelle Flore
d'Algérie et des régions désertiques méridionales .
Tome1. Ed,CNRS .Paris.
RAY I.M. et BINGHAM E.T.,1989. Breeding
diploid alfalfa for regeneration from tissue culture. Crop Science 29(15): 45 -
48.
REDENBOUGH K., BRIAN D.P ., JAMES W.N., KOSSLER M.E.,
VISS P.R. et WALKER K .A ., 1986. Somatic seeds encapsulation of
asexual plant embryos .
Biotechnology 4: 797 - 801.
REISCH J.W et BINGHAM E.T., 1980. The
genetic control of bud formation from callus cultures of diploid alfalfa .
Plant Science Letters 20:71-77
RIVAL A., BERTOSSI F.A., BEULE T., MORCILLO F.,
RICHAUD F., TREGEAR J., VERDIL J.L ., GASSALIN T.D., KONAN E.K., DUVAL Y. et
KOUAME B.,1998. Multiplication clonal du palmier à huile par
embryogenèse
somatique (Elacis guinoesis
jacq ) . Programme de recherche liés au
transfert d'échelle 10p
ROUGET Y.,1989.
Embryogenèse somatique de la laitue Lactuca sativum L.
Thèse doctorat d'Université d'Orsay 147p.
RUGHLA A et JONES M.G.K., 1998. Somatic
embryogenesis and plantlet formation in Santalum album and S.spicatum . Jou.Exp
Bot 49 (320) : 563 - 571
SAADI A.,1991.
Régénération de plantes de pois Pisum sativum L
par embryogenèse somatique . Thèse de doctorat . Paris Grignon
162p.
SAMA A.E., SIMON Z.,NYOCHEMBENG L., TAMBONG T.A.,
NEZANA X . et WUTAH J.G 1998: Culture in-vitro et
multiplication rapide de plante à tubercules et
racines au Caméroune .
Cahier Agriculture (7) :63-66.
SAMYN G.,1995. Influence of type and
concentration of the C- Sucrose on the propagation by axillary branching of the
tropical aquatic plant :Peplis diandra NUTT.EX.DC. Bull.Rech .Agron
Gembloux.30(1-2): 59 - 65 .
SANDERS J.W . et BINGHAM E.T., 1972.
Production of alfalfa plants callus tissus . Crop sci 12: 804 - 808.
SANGHAMITRA N. et SUMITRA S.E.N., 1998.
Regeneration of Asparagus robustus . Hort.Journal of Herbs spices et
Medicinal plants. 5(4): 43 - 50
SANTALLA M., POWER J.B. et DAVEY M.R.,
1998.Efficient in-vitro shoot regeneration responses of
Phaseolus vulgaris and Phaseolus coccineus . Euphytica,102(2)
: 195 - 202
SANTAREM E.R ., PELISSIER B. et FINER J.J .,1997 :
Effect of explant orientation , pH , solidifrying agent and wounding
on initition of soybean somatic embryos .In-vitro cellular and
developmental biology . Plant journal of the tissue culture association V33(1):
13-19.
SAXENA P.K .et KING J.,1987. Morphogenesis
in lentil plant regeneration from callus culture of leur Cullinaris
medik via somatic embryogenesis . Plant Sci Rep , 52: 223 - 227 .
SCHMID J. et KELLER E .,1981 : Nouvelles
possibilités pour l'amélioration et la multiplication des plantes
: les cultures de tissus et de cellules. Revue Suisse Agriculture 13(6):
265-272.
SEMAL J.,1998: Reproduire à
l'identique : Mythe et réalité .Cahier Agriculture (7):6-8
SEON E.J., JEONGAE K.O. et SEON R.Y., 1998:
Mass propagation of Wasabia japonica by apical meristem culture .
Journal of the Korean society for Horticultural Science 39(3): 278- 282.
SERGE H., 1998: Etude et application de la
régénération par embryogenèse somatique chez le
cocotier . Genetrop rapport d'activité 10p.
SIMPSON S.E. et MARKS T.R.,1995. The role of
sucrose in shoot development leading to rhizogenesis in-vitro in
juvenile and mature pedunculate OAK( Quercus robur
L).Bull.Rech.Agron.Gembloux,30(1-2): 77- 85.
SKIRVIN R.M., COGNER M., NORTON A.M ., MOTOIKA S .et
GORVIN D ., 2000: Somaclonal variation : do we know what causes it .
AgbiotechNet.V12 ABNO48.
SKOKUT A.T., MANCHESTER J. et RAIN D.W .,1985:
Regeneration in alfalfa tissue culture . Plant Physiol 79: 579 -
583.
SROGA G.E, 1987. Plant rregeneration of two
lupinus ssp from callus cultures via organogenesis, Plant Sciences ,
51: 245 - 249.
STANANTINO A.,RECUPERO G.F., TENANOVA
G.,CARUSOA.,RUSSOM.P.,MICALIZIA L. et RUSSO G.,1998: Ability of
flying
dragon Trifoliate orange to
maintain high in-vitro regenerative
potentiale and polymorphisme
analysis by RADR markers .fruits V(53)
:319-323.
STREET H.E.,1977: Culture
in-vitro cytologie organogenèse plant - tissuand cell culture 2 ED
Oxford , London ,614 p
STUART D.A., NELSEN J., MC CALL C.M., STRICKLAND S. et
WALKER K.A., 1985: Physiology of the development of somatic
embryos in cell cultures of alfalfa and celery . Biotechnology in science
Academic press 35-47.
SVOBODOVA H., ALBRECHTOVA J., KUMSTYROVA L., LIPAVSKA
H., VAGNER M . et VONDRAKAVA Z ., 1999. Somatic embryogenesis in
Norway spruce
. Anatomical study of embryo
development and influence of polyethlene
glycol on maturation process.
Plant physiology et biochemistry
V37N3:209-218.
TANG W . et GUO Z ., 2001 . In-vitro
propagation of loblolly pine via direct somatic organogenesis from mature
cotyledons and hypocotyls. Plant Grouth Regulation 33 : 25 - 31 .
TEOULE. et DATTEE Y.,1987. Recherche d'une
méthode fiable de culture de protoplastes , d'hybridation somatique et
de régénération chez Medicago . Agronomie 7(8):
575 - 584.
TETU T., SANGWAN N.B .et SANGWAN R., 1987.
Embryogenèse somatique in-vitro chez trois
variétés précoces de soja. C.R. Acad Sci. Paris t
305.serie III: 613 - 617.
TISSERAT B ., ESANE B. et MURASHIGE T.,
1979. Somatic embryogenesis in Angiosperms . Hort. Rev.,1:1-78.
TOUTE Y.,1998: Genie
génétique et biotechnologie , concepts et méthodes .
Applications à l'agronomie et aux bio-industrie . Ed DUNOD 209p.
TREMBLAY L., LEVASSEUR . et TREMBLAY F.M .,
1999. Frequency of somaclonal variation in plants of black spruce (
Picea mariana , Pinaceae) and white spruce ( P.glauca, Pinaceae ) derived from
somatic embryogenesis and identification of some factors involved in genetic
instability . Amer. Jour. Bot 86 ( 10) : 1373 - 1381.
UNNIKRISHAM S.K.,MEHTA A.R.et BHATT
P.N.,1990: Abscisic acid induced high frequency embryogenesis from
Sapindus trifoliatus leaves :89-94
Acta
Horticulturae 280. In-vitro culture and Horticultural breeding.
VARDI A., FRYDMAN-SHANI A.,GALUN E.,GONEM P. et
BELICHMANS S.,1990: Citrus cybrids transfer of microcitrus organelles
into-citrus cultivars.1st International symposium in-vitro
culture and horticultural breeding ,Acta Horticulturae 280: 234-239.
VASILENKO A.J.K ., DANIEL M.C. et CONGER B.V., 2000 :
Ultrastructural analysis of somatic embryo initition . Development and
polarity establishment from mesophyll cells of (Dactylis glomerata).
In-vitro cellular et Developmental Biology plant V36.
VENKETESWARANS S., DIAS M.A.D. et WEYERS
U.V.,1990: Organogenesis and somatic embryogenesis from callus of
Winged bean ( Psophocarpus tetragonolobus L) 1st
International symposium in-vitro culture and horticultural breeding
,Acta Horticulturae 280: 201 - 205.
VERDILLE J.L., DUSSUT S., GROSDEMANGE F., HUCT C.et
MOREL J.B ., 1994: Multiplication végétative du cocotier
par embryogenèse somatique . in Teisson : La culture in-vitro
de plantes tropicales.
VIKRANT .et RASHID A ., 2001. Comparative
study of somatic embryogenesis from immature and mature embryos and
organogenesis from leaf- base of Triticale . Plant Cell Tissue and
organ Culture 64: 33 - 38.
WALKER K.A., WENDEL M.L .et JAWARSKI E.G .,
1979: Organogenesis in callus tissue of ( Medicago sativa )
the temporal repartition of induction process from differentiation process .
Plant Science letters (16) : 23 -30.
WALKER D.R .et PARROTT A.W.,2001.
Effect of polyethylene gycol and sugar alcohols on soybean somatic
embryo germination and conversion . Plant Cell Tissue and organ Culture 64:
55 - 62.
WEY Z.M. et XUZ H.,1988: Plant regeneration
from protoplasts of soybean (Glycine max L) . Plant cell Reports (7):
348 -351 .
WRIGHT M.S., CARNES M.G., HINCHEE
M.A., DAVIS G.C., KOEHLER S. M., WILLIAMS M. H., COLBURN S. M . et
PIERSON R. E., 1986 : Plant
Regeneration from tissuecultures
of soybean by organogenesis . Cell cultures and somatic cell genetics of plants
Ed Vasil1K V(3):111 - 115.
WRIGHT M.S., CARNES M.G., HINCHEE
M.A., KOEHLER S.M.,1986: Plant Regeneration by organogenesis in
Glycin max plant . Cell Reports (5): 150 - 154.
YADAV J.S. et RAJAM M.V ., 1998. Temporal
regulation of somatic embryogenesis
by adjusting cellular polyamine content in eggplant. Plant
physiol 116:
617 - 625.
YOUNSI A.,1996:
Variabilité des gousses des graines du genre Scorpiurus L en
relation avec le comportement des populations . Thèse Mag. El Harrach
182p
ZAATOUT M.,1995. Contribution à
l'étude de la répartition des espèces spontanées
du genre Trifolium L en Algérie . Thèse Magister. INA
El Harrach.
ZHANG B.H , FENG R., LIU F. et WANG Q., 2001.
High frequency somatic embryogenesis and plant regeneration of an elite chinese
cotton variety . Bot.Bull. Acad. Sin 42 : 9 - 16 .
ZEGHIDA A.,HAMRIT S. et KORICHI M.L.,1997:
Intégration des grandes cultures -élevage ovin .Résultats
d'expérimentations .Céréaliculture N°30:5-10 ITGC.
ZRYD J.P.,1988: Culture de cellules , tissus
et organes végétaux .Ed .Press.Polytechniques Romandes Suisse
308p
| 


