UNIVERSITE DE KISANGANI
FACULTE DES SCIENCES Département d'Ecologie et
Gestion

des Ressources
Végétales.
Typologie des forêts denses des environs
de
Kisangani par une méthode d'analyse
phytosociologique multistrate

janvier LISINGO WA LISINGO
MEMOIRE
Présenté et défendu en vue de l'obtention
de Diplôme d'Etudes Approfondies (DEA) en Gestion de la
Biodiversité et Aménagement Forestier durable.
Promoteur : Pr. Dr. Nshimba Seya W. (UNIKIS)
Co-promoteur : Pr. Dr. Jean Lejoly (ULB)
Année Académique: 2008 - 2009
DEDICACE
En souvenir de ma très chère et
regrettée mère Clémentine Lotomba
A Félix
Magloire Lisingo Bomealimengo, Que mes traces soient pour toi un
modèle
Remerciements
La rédaction du manuscrit d'un mémoire de fin
d'étude représente souvent la partie la plus personnelle d'un
travail pourtant collectif. Je voudrais remercier ici tous ceux qui ont
participé de près ou de loin à l'aboutissement de ce
travail : les collaborateurs du quotidien et occasionnels, les interlocuteurs
intéressés et intéressants, les initiateurs qui m'ont fait
découvrir la profondeur de la recherche en écologie
forestière. Les proches qui ont supporté les caprices et les
plaintes, tous ceux qui ont cru à cette rencontre entre une
thématique et un apprenti-chercheur, sans eux ce document final n'aurait
jamais vu le jour.
J'adresse ma profonde gratitude au Professeur Hyppolite
Nshimba de l'Université de Kisangani, qui à peine venait de
terminer sa thèse n'a pas hésité d'accepter la promotion
de ce travail. Sa disponibilité et sa simplicité ont
favorisé des échanges fructueux qui ont permis la finalisation de
ce travail.
Je reste profondément reconnaissant envers le
Professeur Emérite Jean Lejoly de l'Université Libre de Bruxelles
initiateur de ce travail qui pourtant a accepté d'en être le
co-promoteur. Je mesure la confiance qu'il m'a accordée en me proposant
ce thème de recherche, malgré mes connaissances très
élémentaires en écologie tropicale. Dans toutes les
étapes de ce travail, il m'a fait bénéficier de ses
encouragements et remarques combien louables. Grâce à lui j'ai
obtenu mon tout premier outil informatique qui m'a permis de stocker,
d'analyser et de traiter les données de ce travail.
Je remercie les Professeurs Léopold Ndjele Mianda et
Jean-Pierre Mate Mweru, respectivement Coordonnateur et Vice-coordonnateur du
volet forestier du projet REAFOR pour les grands efforts fournis afin de mener
au bon port cette formation de master.
Mes remerciements s'adressent également à tous
les professeurs et docteurs qui nous ont enseigné. Leurs enseignements
ont révolutionné et élargi notre connaissance
scientifique, nous pensons particulièrement aux professeurs Jan Bogaert,
Quentin Ponnette, Jean Claude Micha, Henry Maraite, Théodore Treffon,
Nicolas Picard, Lokombe, Lubini, Hans Beeckmans, Gaston Kimbuani, Mafuka,
Raymond Lumbuenamo et tous les autres qui ont donné le meilleur
d'eux-mêmes pour nous assurer une formation de qualité et de
renommé international.
J'ai bénéficié des explications et des
logiciels d'analyses de diversité de la part du Docteur Manuel Perez de
l'Université Autonome d'Espagne que je remercie sincèrement.
Mes remerciements à tout le corps académique et
scientifique de la faculté des sciences de l'Université de
Kisangani et à tous les professeurs qui ont contribué à ma
formation. Que les Professeurs Upoki, Dudu, Dhed'a, Ulyel, Mulotwa, Kamabu,
Katuala, les Chef des Travaux Bola, Jean Marie Kahindo, Jean Claude Mukinzi et
Guy Crispin Gembu et les Assistants Faustin Boyemba, Prosper Sabongo et Sylvain
Kumba trouvent ici l'expression de ma gratitude.
Je remercie de manière particulière madame le
Professeur et Ambassadrice Honorine Ntahobavuka et monsieur le Conservateur
Jean Lambert Wetsi pour leurs soutien et encouragements.
Pour continuer avec ceux qui ont joué un rôle
déterminant dans l'accomplissement de cette étude, je tiens
à remercier mes compagnons de terrain, avec qui nous avons bravé
la chaleur et l'humidité, au milieu d'insectes dans la forêt.
D'abord, je pense à Christian Amani, mon Encadrant ; grâce
à son aide sur le terrain, j'ai pu disposer de l'ensemble des
données nécessaires à mon travail et pour m'avoir appris
les logiciels CANOCO et PAST. Je pense aussi à Jason Vleminckx avec qui
nous continuons à échangé, à monsieur Sindani notre
identificateur de terrain et à monsieur Mayani « 7.2 » notre
aide.
Je remercie également le Conservateur John Mabaya de
l'Herbarium de la Faculté des sciences pour avoir identifié mon
Herbier de poche.
A tous mes collègues de master REAFOR, je tiens
à vous remercier pour l'esprit d'équipe durant ces deux
années de formation passées ensemble. Je vous rassure chers
collègues, même le tout dernier d'entre nous est le meilleur du
Congo.
Une formation de troisième cycle de qualité ne
peut s'organiser sans un soutien logistique. Je remercie le CIFOR qui a
assuré notre encadrement scientifique. Que les Docteurs Robert Nasi et
Denis Sonwa ainsi que Madame Verina trouvent à travers ces lignes notre
marque de reconnaissance.
L'organisation de ce master a été rendu possible
grâce à l'appui financier de l'Union Européenne. La bourse
reçue de cette institution internationale nous a permis de recevoir un
enseignement de standard international et de réaliser la récolte
des données de ce travail.
Je remercie également mes amis et connaissances pour
leur amitié et soutien. Je pense à Freddy Likombe et son
épouse Sifa, Willy Dhed'a, Ephraïm Lombo, Badin Mputu,
Pépé Akota, Rosie Emeleme, Casimir Nebesse, Justine Tshidibi,
Julien Kasai, Alphonse Yangambi, Bijou Lituka, Papy Mongindo, Papy
Bokalanganya, Jean-Claude Bilende, Blandine, Crispin Liongo, Eric Musay, Elie
Bughento, J.C. Omba, Jeff Bosuandole, Dido Bossongo et tous les autres dont
nous taisons les noms.
Je remercie les familles Bosuandole, Albert Lotana, Lombo,
Ekongo, Bondonga, Botele, Lotomba, Samy Boendi pour leur soutien.
Ma famille n'a cessé de m'encourager, je suis
très reconnaissant pour leur contribution et l'estime dont ils me
témoignent. Je remercie mes parents Lisingo Félix et
Pélagie Besendja, Rémy Lisingo et Claire-Marie Mbango pour leur
soutien ; Mes soeurs Virginie, Hortense Céline et Jeanova, mes cousins
Mimi, Jeanine, Lavime, Pascal, Félix, Guylain,...
Merci à vous Honorable Faustin Lokinda et épouse
Jolie Ossando pour l'intérêt que vous portez à ma personne,
à travers vous je remercie toute votre famille.
Ya'Bébé Lisingo se souci toujours de notre avenir,
merci pour votre encouragement.
Merci à vous tous dont les noms ne sont pas
mentionnés, je reste très reconnaissant envers tout un chacun de
vous.
Enfin, Pour tout et en tout, je remercie vivement ma future
compagne Françoise Yawike qui me soutient et croit en un avenir meilleur
que nous voulons partager ensemble.
RESUME
La présente étude a porté sur la
typologie des forêts denses des environs de Kisangani. Elle a
consisté à mettre en évidence les communautés
végétales des strates arborescentes de ces forêts et de
partitionner la variance floristique entre les paramètres
environnementaux et spatiaux.
La méthode de relevés phytosociologiques
multistrates (relevé synusial) a été utilisée pour
inventorier les arbres sur terrain. Au total 23 relevés
décomposés en deux sous-relevés emboîtés ont
été mis en place dans les forêts de Yoko et de Biaro,
distantes de plus ou moins 10 Km. La strate arborescente supérieure (A)
a été inventoriée sur une surface de 200 x 50 m (soit 1
hectare) pour un relevé et la strate arborescente inférieure (Ad)
sur une surface de 200 x 10 m (soit 0,2 hectare) pour un relevé.
A l'issue de cette étude, 6987 individus ont
été recensés. Après leur identification, 249
espèces appartenant à 41 familles ont été obtenues
globalement.
A l'issue des analyses d'ordination (logiciel CANOCO) et de
classification (logiciel PAST), deux types de forêts ont
été caractérisés : la forêt établie
sur sol sableux et celle établie sur un substrat argileux.
Les espèces Scorodophloeus zenkeri et
Julbernardia seretii caractérisent la forêt sur sol
sableux au niveau de la strate A et Anonidium mannii et Cola
griseiflora au niveau de la strate Ad ; tandis que les espèces
Petersianthus macrocarpus et Pericopsis elata
caractérisent la forêt sur sol argileux au niveau de la strate A
et Aidia micrantha et Strombosia pustulata au niveau de la
strate Ad.
La diversité spécifique ne montre pas une
différence significative entre ces deux types de forêt, mais
semble plutôt augmenter à hauteur décroissante de
strate.
Le déterminisme de
l'hétérogénéité de différents groupes
est dicté en général par la texture du sol, l'hydromorphie
du sol et la topographie.
Mots clés : Typologie, forêts
denses, relevé synusial, ensembles structuraux, Yoko, Biaro.
ABSTRACT
The current study dealt with the typology of dense forests in
the outskirts of Kisangani. It consisted to enlighten the vegetal communities
of the higher canopy strata of these forests and to partition the flora
variance between the environmental parameters and the spatial ones.
The phytosociological multistrata plotting method (Synusial
plots) has been used to survey the trees in the field. In total, 23 samples
split into two imbedded sub samples has been collected in Yoko and Biaro
forests, distant each other of about 10 km. The higher arborescent canopy
stratum (A) has been surveyed on surface of 200 m x 50 m (that is 1 hectare)
for a plot and the lower arborescent canopy stratum (Ad) on a surface of 200 m
x 10 m (That is 0.2 hectare) for a plot.
At the end of this study, 6987 individuals has been censused.
After their identification, 249 species belonging to 41 families have globally
been recorded.
After ordination analysis by means of CANOCO software and
classification analysis using PAST software, two types of forests has been
characterized: The forest grown on sandy soil and that established on clay
substrate.
Scorodophloeus zenkeri and Julbernardia seretii
species feature the forest on sandy soil at the stratum A level and
Anonidium mannii and Cola griseiflora at stratum Ad level;
whilst Petersianthus macrocarpus and Pericopsis elata feature
the forests on clay soil at stratum A level and Aidia micrantha and
Strombosia pustulata at the level of Ad stratum.
The species diversity does not show a significant difference
between the two types of forest though seems to increase as the canopy height
decreases.
The heterogeneity determinism of different groups is dictated in
general by the texture of the soil, its hydromorphy and topography.
Key words: Typology, dense forests, synusial
plot, structural assemblages, Yoko, Biaro.
Table des matières
Dédicace
Remerciements
Résumé
Abstract
Table des matières Liste des tableaux Listes des
figures
INTRODUCTION .1
0.1. Cadre scientifique de l'étude 1
0.2. Généralités sur les forêts
tropicales ...2
0.3. Considérations générales sur la notion
de typologie en milieu forestier tropical 3
0.4. Les espèces dans la structure verticale : la
problématique des strates et des ensembles structuraux 5
0.5.
Approche contingente et conception déterministe : deux paradigmes
d'explication de la
|
diversité et de la composition floristique
|
6
|
|
0.6. Problématique
|
.7
|
|
0.7. Hypothèses
|
10
|
|
0.8. Objectifs
|
10
|
|
0.8.1. Objectif général
|
..10
|
|
0.8.2. Objectifs spécifiques
|
..10
|
|
0.9. Division du travail
|
.11
|
|
I. MILIEU D'ETUDE
|
..12
|
|
1.1. Description du milieu d'étude
|
12
|
|
1.2. Climat
|
14
|
|
1.3. Géologie et géomorphologie
|
.15
|
|
1.4. Cadre phytogéographique
|
.16
|
|
1.5. Végétation
|
.17
|
|
1.6. Activités anthropiques
|
18
|
II. MATERIEL ET METHODES 19
2.1. Méthodes de collecte des données 19
2.1.1. Dispositif d'échantillonnage et choix de
l'emplacement des relevés 19
2.1.2. Données structurales sur la station .21
a. Nature du sol 21
b. Hydromorphie du sol 22
c. Topographie .22
2.1.3. Inventaires et identification des arbres 23
2.2. Méthodes d'analyses des données .24
2.2.1. Analyses des données floristiques ..24
a. Richesse aréale .24
b. La courbe aire-espèces .24
c. La fréquence relative 24
d. L'abondance des espèces .25
e. La dominance relative ..25
f. Surface terrière ..25
g. Indice d'importance des espèces .25
h. Indices de renouvellement et de
régénération de la strate dominante .26
i. Les coefficients de similarité
2.2.2. Calcul des indices de diversité 27
a. Indice de Simpson 27
b. Indice de Shannon-Weaver ..27
c. Indice de Fisher á 28
2.2.3. Description des communautés 28
2.2.4. Les tests statistiques 29
III. RESULTATS 30
A. La forêt sur sol sableux 30
3.1. Les ensembles structuraux 30
3.1.1. Composition et richesse spécifique 30
3.1.2. Renouvellement et régénération de la
strate arborescente dominante 31
3.2. Analyse floristique interstrate 32
3.2.1. Les familles représentatives 33
3.2.2. Abondance des espèces ..33
3.2.3. La surface terrière ..36
3.2.4. La fréquence des espèces 39
3.2.5. Distribution diamétrique 41
3.2.6. Etude de la diversité 42
3.2.7. Distances floristiques entre les relevés ..43
B. La forêt sur sol argileux 46
3.3. Les ensembles structuraux 46
3.3.1. Composition et richesse spécifique 46
3.3.2. Renouvellement et Régénération de la
strate arborescente dominante .47
3.4. Analyse floristique interstrate 48
3.4.1. Les familles représentatives 48
3.4.2. Abondance des espèces ..49
3.4.3. La surface terrière ..52
3.4.4. La fréquence des espèces 55
3.4.5. Distribution diamétrique 57
3.4.6. Etude de la diversité 59
3.4.7. Distances floristiques entre les relevés ..60
3.5. Déterminisme de
l'hétérogénéité environnementale sur la
composition floristique 62
3.6. Analyse de classification 64
IV. DISCUSSION 67
4.1. Composition floristique et diversité
spécifique 68
4.1.1. Abondance relative comparée 72
4.1.2. Diversité spécifique 74
4.2. Analyses d'ordinations et de classification 79
CONCLUSION 83
REFERENCES BIBLIOGRAPHIQUES 85
Liste des tableaux
Tableau 1 : Moyennes mensuelles de
précipitations et de températures de la région de
KisanganiTableau 2 : Moyennes et écart-types
des variables édaphiques dans le site de Yoko Tableau 3 : Listes des
familles
Tableau 4 : Liste des espèces abondantes sol sableux
Tableau 5 : Valeurs de D130 moyen, de la surface
terrière, de nombre de pieds et de nombre d'espèces pour la
strate A sur sol sableux
Tableau 6 : Valeurs de D130 moyen, de la surface
terrière, de nombre de pieds et de nombre d'espèces pour la
strate Ad sur sol sableux
Tableau 7 : Indices de diversité sol sableux
Tableau 8 : Liste des familles
Tableau 9 : Liste des espèces abondantes sol argileux
Tableau 10 : Valeurs de D130 moyen, de la surface
terrière, de nombre de pieds et de nombre d'espèces pour la
strate A sur sol argileux
Tableau 11 : Valeurs de D130 moyen, de la surface
terrière, de nombre de pieds et de nombre d'espèces pour la
strate Ad sur sol argileux
Tableau 12 : Indices de diversité sol argileux
Tableau 13 : Liste des espèces propres de la forêt
sur sol sableux
Tableau 14 : Liste des espèces propres de la forêt
sur sol argileux
Liste des figures
Figure 1 : Physionomie et structuration des deux strates
arborescentes dans les forêts des environs de Kisangani
Figure 2 : Carte de couverture forestière d'Afrique
centrale localisant la ville de Kisangani Figure 3 : Localisation des
dispositifs de Yoko et de Biaro
Figure 4 : Carte de sols récents et ferralitiques du
Congo
Figure 5 : Carte phytogéographique de la RDC
Figure 6 : Dispositif d'échantillonnage
Figure 7 : Schéma de disposition d'un inventaire
floristique
Figure 8 : Les ensembles structuraux de la forêt sur sol
sableux
Figure 9 : Espèces caractéristiques de la strate A
sur sol sableux
Figure 10 : Espèces caractéristiques de la strate
Ad sur sol sableux
Figure 11 : Courbe aire-espèces strate A sur sol
sableux
Figure 12 : Courbe aire-espèces strate Ad sur sol
sableux
Figure 13 : Espèces les plus fréquentes le long de
la surface d'inventaire strate A sur sol sableux
Figure 14 : Espèces les plus fréquentes le long de
la surface d'inventaire de la strate Ad sur sol sableux
Figure 15 : Classe diamétrique strate A sur sol sableux
Figure 16 : Classe diamétrique strate Ad sur sol
sableux
Figure 17 : Variation de l'indice de Fisher le long de la surface
d'inventaire sur sol sableux Figure 18 : DCA pour la strate A sur sol
sableux
Figure 19 : DCA pour la strate Ad sur sol sableux
Figure 20 : Les ensembles structuraux de la forêt sur sol
argileux
Figure 21 : Espèces caractéristiques de la strate A
sur sol argileux
Figure 22 : Espèces caractéristiques de la strate
Ad sur sol argileux
Figure 23 : Courbe aire-espèces strate A sur sol
argileux
Figure 24 : Courbe aire espèces strate Ad sur sol
argileux
Figure 25 : Espèces les plus fréquentes le long de
la surface d'inventaire de la strate A sur sol argileux
Figure 26 : Espèces les plus fréquentes le long de
la surface d'inventaire de la strate Ad sur sol argileux
Figure 27 : Classes diamétriques strate A sur sol
argileux
Figure 28 : Classes diamétriques strate Ad sur sol
argileux
Figure 29 : Variation de l'indice de Fisher le long de la surface
d'inventaire sur sol argileux Figure 30 : DCA strate A sol argileux
Figure 31 : DCA strate Ad sol argileux
Figure 32 : CCA pour l'ensemble des relevés
Figure 33 : CCA pour les relevés de Yoko avec les
données d'analyses du sol
Figure 34 : Dendrogramme strate A
Figure 35 : Dendrogramme strate Ad
Figure 36 : Courbe d'accumulation des pourcentages cumulés
moyens en fonction de la catégorie de taille des particules
Figure 37 : Richesse spécifique comparée
sable-argile en fonction des ensembles structuraux Figure 38 : Abondance
relative comparée de dix espèces dominantes de la strate A
Figure 39 : Abondance relative comparée de dix
espèces dominantes de la strate Ad Figure 40 : Indices de Simpson et de
Fisher comparés strate A
Figure 41 : Indices de Simpson et de Fisher comparés
strate Ad
Figure 42 : Richesse spécifique comparée strate A
vs strate Ad
Figure 43 : Courbes d'accumulation d'espèces
comparées strate A vs strate Ad
Figure 44 : Indices de Simpson et de Fisher comparés
strate A vs strate Ad
Figure 45 : DCA pour l'ensemble des relevés de la strate
A
Figure 46 : DCA pour l'ensemble des relevés de la strate
Ad.
INTRODUCTION
0.1. Cadre scientifique de l'étude
En milieu forestier tropical, la multiplicité des
espèces et les curieuses morphologies qu'on y rencontre (contrefort,
lianes, regroupement préférentiel des espèces) donnent
généralement l'impression d'une certaine anarchie et d'un
mélange confus d'espèces. Ce qui a pour conséquence, la
difficulté dans la perception des lois qui gouvernent l'organisation de
ces forêts et qui nécessite une connaissance approfondie des
espèces et une maitrise des paramètres environnementaux qui
influencent cette organisation en vue d'amorcer un plan d'aménagement
cohérent relevant d'un grand nombre de mesure (Fournier & Sasson,
1983).
Les débats scientifiques au sujet des processus
déterminant l'organisation spatiale de la diversité
végétale et de l'importance à prendre en compte les
facteurs environnementaux dans la typologie des forêts tropicales denses
se heurtent à des difficultés d'approche méthodologique
qui permettrait, au regard des résultats obtenus une bonne
caractérisation des groupements forestiers.
Ainsi, dans le cadre de l'aménagement durable et de
gestion rationnelle des écosystèmes forestiers tropicaux en
général et des entités mises en réserves en
particulier, il nous a paru opportun par une approche typologique et d'analyses
multivariées des corrélations entre la composition floristique et
les facteurs environnementaux, d'apporter les éléments de base
qui contribueront à soutenir la vision d'une gestion rationnelle
définie par le projet REAFOR et dans laquelle plusieurs organisations
tant nationales (INERA, Université de Kisangani) qu'internationales
(CIFOR, FAO, CIRAD) sont impliquées grâce au financement de
l'Union Européenne.
Il convient de signaler que dans le cadre du projet REAFOR,
l'implantation d'un important dispositif permanent de recherche en
écologie forestière, au regard du caractère intact du
massif forestier dans le territoire d'Ubundu en RDC, justifie notre choix sur
la réserve de Yoko et la forêt de Biaro.
0.2. Généralités sur les
forêts tropicales
Les forêts tropicales se repartissent entre le tropique
du cancer et le tropique du capricorne, dans une bande de plus ou moins
23,5° autours de l'équateur (Chave, 2000). On les retrouve en
Amérique (forêt néotropicale), en Afrique, en Asie et en
Océanie (forêt paléotropicale).
Ces forêts sont définies comme des formations
végétales fermées où les houppiers des arbres se
touchent (Aubreville, 1957 ; Trochain, 1951).
L'existence de ce type de végétation est
étroitement liée aux climats humides et chauds,
caractérisés par une moyenne de température comprise entre
20 et 27° C (Alexandre, 1980).
Ces formations végétales comportent 2 variantes
qui sont dictées par le régime pluviométrique : d'une
part, les forêts denses sempervirentes dont la majorité des arbres
restent feuillies pendant toute l'année et d'autre part, les
forêts denses semi-décidues, où une partie des arbres
perdent plus ou moins totalement leurs feuilles durant les périodes les
plus sèches de l'année (4-6 mois).
Loin d'être une simple juxtaposition d'arbres, ces
forêts sont une combinaison des composantes végétales,
animales, édaphiques et climatiques en perpétuelles interactions
(Guillaumet & Kahn, 1979).
Ce qui fait leur singularité et qui est l'objet de bien
des recherches scientifiques, c'est l'extraordinaire complexité et
diversité des moyens par lesquels les plantes accomplissent leurs
fonctions vitales. Complexité, non seulement dans leur composition
spécifique (Richards 1952), mais aussi par la présence d'une
variété de niches écologiques et d'habitats. Ce qui se
traduit par une hétérogénéité qui
caractérise cet écosystème, expression des multiples
interactions entre les espèces et leur environnement (Longman et Jenik,
1987 ; Puig, 2002 ; Fongnzossié & al. 2008 ; Pascal &
Pélissier 1996).
En Afrique centrale, les situations forestières,
appréciées en termes de surfaces forestières et de
l'état sanitaire des forêts sont différentes selon les
pays. La République démocratique du Congo comprend la
majorité des forêts denses de l'Afrique centrale. Ce qui
correspond à environs 108339 hectares de forêts qui abritent de
nombreuses espèces végétales et animales avec un taux
d'endémisme très élevé, mais avec un taux de
déforestation annuel évalué à - 0,26% (le plus
élevé dans la région) (CIFOR & al. 2007).
Ces formations forestières dynamiques sont
caractérisées à l'état climacique par des essences
arborescentes bien typiques dont certaines présentent de valeur
économique importante. Elle fait partie d'une poignée des pays
dans le monde arborant une biodiversité exceptionnelle, appelée
«méga biodiversité» : Plus de 11000 espèces de
plantes, 409 espèces de mammifères, 1086 espèces
d'oiseaux, 1069 espèces de poissons etc. Les aires
protégées couvrent 10% du territoire national et comprennent 5
sites inscrits au Patrimoine mondial de l'UNESCO (IUCN, 1989). Mais,
Comparativement aux potentialités du pays, l'exploitation
forestière est restée jusqu'ici modeste étant donné
les conditions socio-économiques que traverse le pays. Il est
néanmoins probable que la valorisation des ressources forestières
augmente dans les prochaines années d'autant plus le pays doit faire
face d'une part aux enjeux de développement et d'autre part
résoudre le problème de la population en croissance.
Dans l'optique de la gestion durable de l'environnement, ces
forêts contribuent à l'objectif de préservation de la
biodiversité, des ressources en eau (70% de grand bassin versant du
fleuve Congo), et offrent également d'importantes opportunités
des services environnementaux précieux tels que la séquestration
de carbone.
Ce rôle planétaire se justifie dans le domaine de
l'équilibre écologique du globe car la destruction de
forêts tropicales conduit à l'effet de serre dont
l'humanité se préoccupe (Lomba 2007).
La richesse écologique et économique des
forêts tropicales stimule de nombreuses recherches ayant pour l'objet de
mieux comprendre ses origines, les mécanismes de son maintien et de sa
gestion dans l'optique d'un développement durable.
Ces recherches se sont très vite imposées face
aux menaces économiques et écologiques directement liées
à la disparition rapide de la réserve mondiale de forêts
tropicales (Dupuy, 1989).
0.3. Considérations générales sur
la notion de typologie en milieu forestier tropical
Les principes fondamentaux de la typologie des forêts
tropicales reposent d'une manière générale sur leur
structure, leur physionomie, leur composition spécifique, leur abondance
des taxons et sur les différentes phénophases qui y
règlent la survie des espèces qui s'y développent.
Bien que ces différences aient été mises
en évidences pour caractériser ces forêts, il se
dégage un constat curieux d'un noyau floristique identique, qu'on
retrouve dans presque tous les types forestiers en Afrique centrale et qui
constitue un fond floristique commun.
La difficulté dans la définition typologique de
ce milieu forestier comme le constatent Lebrun et Gilbert (1954), repose dans
les variations incessantes observées dans sa composition floristique
dues à une grande hétérogénéité
spatiale.
A cette hétérogénéité
spatiale dans la composition floristique, s'ajoutent également des
causes de variations d'ordre climatique, physiographique et édaphique
qui caractérisent les peuplements forestiers tropicaux en plusieurs
microhabitats structurés, résultant de l'influence
environnementale caractérisant chaque type forestier. Ce qui se traduit
par des individualités dans la composition floristique et la structure
de ces forêts (Fournier et Sasson, 1983 ; Schnell, 1976 ; Schnell 1987)
le long des gradients écologiques tels que l'altitude (Bouxin, 1977 ;
Senterre, 2005), de facteurs édaphiques (nature et texture) et
topographiques (Parmentier, 2003, Nshimba, 2005), ou de la distance qui
sépare deux entités floristiques (Chapman & al.
1997).
En typologie, l'approche phytosociologique sigmatique explique
la manière dont les plantes s'associent dans le temps et dans l'espace
pour composer les différentes entités de la
végétation. Les populations d'espèces
végétales qui exploitent un même habitat naturel ou
biotope, constituent les unités phytocénotiques dont la
phytosociologie cherche à décrire la composition et les
variations floristiques (Senterre, 2005 ; Nshimba, 2008). Cette approche
constitue un soubassement théorique pour le développement des
outils pratiques de la typologie des forêts denses tropicales. Mais comme
le démontre les auteurs précités, cette approche a
montré ses limites car étant purement descriptif.
D'où la nécessité d'une approche plus
globalisante connue sous le nom de la phytosociologie synusiale
intégrée (Gillet, 2000). Cette approche s'attache non seulement
à la physionomie, mais aussi à l'organisation spatiale des
composantes et à leur capacité à s'organiser en
communauté. C'est-à-dire qu'elle met l'accent sur la tendance de
certaines espèces à vivre ensemble, non pas dans un même
site, mais dans un même type de milieu. Ces espèces forment ce que
Senterre définit comme « élément écologique
».
vue fonctionnel et regroupent des espèces qui vivent
ensemble et qui partagent des stratégies de vie similaires (Gillet,
2000).
0.4. Les espèces dans la structure verticale :
la problématique des strates et des ensembles structuraux
La structure verticale des écosystèmes
forestiers tropicaux a fait l'objet de plusieurs travaux et débats qui
n'ont pas encore jusqu'à ce jour été résolus. Au
stade mature, la forêt tropicale présente une structure verticale
stratifiée dans laquelle il est parfois difficile de définir les
compartiments. Richards (1952), distingue cinq strates indépendantes
dont trois arborescentes, une arbustive et une autre herbacée.
Senterre propose une structure verticale simplifiée en
quatre strates, que nous avons adoptée dans le cadre de ce travail, mais
en focalisant uniquement notre attention sur les deux strates
supérieures (nommées ici strate A qui renferme les arbres
dominants et les émergents et la strate Ad composée des arbres
dominés).
Deux types de configuration spatiale ressortent de l'analyse
de la structure verticale de cette forêt. Si l'on envisage la structure
spatiale en terme de strates, nous distinguons deux strates arborescentes : la
strate arborescente supérieure ou strate des dominants qui inclut les
Emergents (E) et les Dominants (A) ainsi que la strate arborescente
dominée (Ad) qui inclut l'élément propre de cette strate
et la régénération de la strate supérieure.
Mais lorsqu'on tient compte des compartiments structuraux, on
a une perception différente. L'ensemble des individus matures de
diverses espèces forment « l'ensemble du présent ». Cet
ensemble inclut tous les arbres adultes de deux strates. L'ensemble des
individus immatures constitue « l'ensemble du futur » et inclut toute
la régénération de la strate supérieure
présente dans la strate dominée.
Cette configuration introduit la notion des « ensembles
structuraux » définit par Oldeman, (1974) et Senterre (2005).
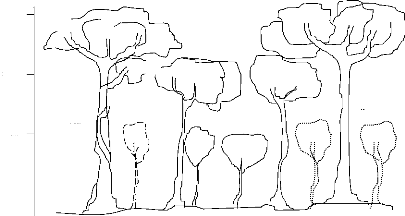
La figure 1 ci-dessous illustre la structure verticale des
espèces de deux strates supérieures étudiées dans
la forêt de notre zone d'étude.
E
A
L
a
b
c
Ad
40 m
25 m
6m
Figure 1 : Physionomie et structuration des deux strates
arborescentes dans les forêts des environs de Kisangani. E+A forme la
strate dominante, Ad : strate dominée ; tandis que a :
régénération de E+A présente dans Ad,
b : régénération de E+A absente dans E+A
c : élément propre de Ad et L : liane
0.5. Approche contingente et conception
déterministe : deux paradigmes d'explication de la diversité et
de la composition floristique
De nombreuses hypothèses ont été
proposées afin d'expliquer la coexistence des espèces et le
maintien des communautés (Palmer, 1994 ; Wright, 2001 et Ricklefs,
2004). En écologie, ces mécanismes dépendent de
l'échelle d'investigation. A une échelle biogéographique
les communautés sont reliées à des causes
géologiques, historiques et climatiques (Ricklefs, 2004 ; Gaston, 2000).
Tandis qu'à une échelle régionale ou locale, ce sont les
facteurs du relief, du substrat et les conditions abiotiques imposées
par le milieu qui définissent les communautés (Tuomisto &
al. 2003 ; Condit & al. 2002).
A l'échelle locale, deux théories majeures sont
généralement mises en avant pour expliquer la diversité
floristique et les variations dans la composition floristique.
La première est basée sur une approche contingente
(facteurs historiques) et la deuxième sur une conception
déterministe (paramètres environnementaux).
Le paradigme de la contingence historique repose sur le fait
que les plantes ont des capacités
de dispersion limitées.
L'hypothèse qui explique cette approche est celle de
l'équivalence
fonctionnelle des espèces connue aussi sous le
terme de la théorie neutre développée par
Hubbell (2005). Elle prône l'équivalence
écologique des espèces et que seuls, la capacité de
dispersion, l'extinction, la spéciation ainsi que des
événements aléatoires déterminent la composition
d'une communauté (Hardy & Sonké, 2004). C'est la
théorie de la dérive écologique (Hubbell, 2001) qui met
l'accent sur les aspects historiques et stochastiques de regroupements.
Le paradigme déterministe se base sur l'idée
selon laquelle la variabilité spécifique dans une
communauté est dictée par les interactions
interspécifiques. Ainsi, il découle de cette explication des
patrons de diversité aux différentes échelles
considérés ce qui suit : la diversité alpha (au niveau
local) dans une communauté est déterminée par des facteurs
biotiques telles que la compétition, et abiotiques (par exemple les
perturbations). La variabilité à l'échelle du paysage de
cette diversité (diversité bêta) est corrélée
à l'hétérogénéité environnementale de
ce paysage (variations topographiques, hydromorphiques, altitudinales, etc.)
(Tuomisto et al. 2003, Chesson & Warner, 1981, Kelly & Bowler,
2002, Dauby, 2007). C'est la théorie de niche écologique selon
laquelle les regroupements d'espèces sont régis par les
interactions entre elles et avec leur milieu. (MacArthur & Levins, 1967 ;
Hutchinson, 1961)
Cependant, certaines caractéristiques des
communautés laissent envisager que des paramètres autres que les
facteurs environnementaux (hétérogénéité
spatiale) participent à l'explication de patrons de diversité
(Flores, 2005).
Il est évident, à en croire Dauby (2007) qu'il
n'y a aucun modèle explicatif unique, chaque modèle apporte sa
part d'explication dans les patrons de diversité et de
variabilité au sein des forêts denses tropicales.
Toutefois, nous estimons que l'approche déterministe
conduit à une définition plus ou moins claire de la typologie des
forêts tropicales.
0.6. Problématique
Les forêts tropicales humides sont des
écosystèmes dont la variété des niches
écologiques qu'on y rencontre et les diverses interactions qui s'y
établissent d'une part entre les espèces et d'autre part entre
ces espèces et leur environnement, rend ce milieu complexe.
Hormis ces différentes interactions, ce qui renforce
encore la complexité de ces forêts, c'est la multiplicité
des stratégies biologiques que développent les espèces
pour assurer leur survie (diverses adaptations physio-morphologiques et
comportementales).
Du point de vue floristique, plusieurs études sur ces
forêts ont eu à établir quantitativement leur composition,
leur structure, leur abondance de taxon et leur diversité
spécifique (Gérard, 1960, Guillaumet, 1967, Lubini, 1982,
Reitsma, 1989, Mosango, 1990, Barbault, 1992, Lubini, 1997, Vandeweghe, 2004 et
Campbell & al. 2006).
En dépit du fait que cette quantification ait
apportée plusieurs éclaircissements sur certaines affirmations
émanant de l'approche descriptive des peuplements forestiers tropicaux
(Fournier et Sasson, 1983) et qu'elle ait en outre permis de mieux
connaître la composition floristique de ces forêts, il a
été rarement prises en compte les données relatives
à la distribution spatiale de cette quantification et à l'impact
des conditions stationnelles sur cette distribution. Ce qui permettrait de
mettre en évidence les différents modèles de regroupement
écologique définit à l'intérieur de chaque cycle
forestier et qui conduirait à une typologie claire de ces forêts,
qui soit la résultante de l'action environnementale sur la
floristique.
Par ailleurs, Lebrun et Gilbert (1954) font savoir que des
changements incessants qui s'observent dans la composition floristique des
forêts tropicales à l'échelle spatiale, ont
constitué un sérieux obstacle à toute tentative de
définition synécologique de ces forêts. Ce qui en outre non
seulement conduirait à mieux cerner les différents groupes
écologiques qui se serait définit à l'intérieur de
chaque cycle forestier, mais rendrait plus aisée la compréhension
des différentes interactions qui s'y seraient établies.
De ce qui précède, il nous semble que la
typologie des forêts est de définition complexe en milieu
forestier tropical en l'absence des corrélations entre la floristique et
les conditions stationnelles.
Pourtant de nombreux travaux notamment ceux de Proctor &
al. (1983), Barhès (1991b), et Clark & al. (1998)
ont eu à relever l'influence des caractères pédologiques
sur la structure, la composition floristique et sur la répartition des
espèces en forêts tropicales.
Diverses données édaphologiques, poursuivent les
auteurs précités, notamment celles liées à
la
texture, peuvent conduire à une définition aisée des
groupes écologiques c'est-à-dire les
types forestiers au sein
d'une même entité forestière et que même le rapport
entre les densités
spécifiques obtenues dans chaque type de substrat peut
également servir d'élément de définition de ces
groupes écologiques.
Si les études menées dans les forêts
tropicales ont eu à déceler de manière qualitative et
quantitative leurs différences d'une région à une autre,
il reste évident que les raisons internes et fondamentales de ces
individualisations non seulement dans l'ensemble du massif forestier tropical
mais également à l'intérieur de chaque cycle forestier
sont rarement abordées dans le milieu forestier. Raison pour laquelle,
nous avons résolu d'aborder le problème en focalisant notre
attention sur la typologie de ces forêts dans les environs de Kisangani
en République démocratique du Congo en identifiant les
différents groupements de végétation le long d'un gradient
du type du sol (support colonisable), pour tenter de caractériser ces
forêts par un modèle corrélatif fondé sur la
floristique et l'édaphologie.
Les questions que l'on se pose sont celles de savoir :
· Comment, en dépit du noyau floristique commun
qu'on retrouve dans presque tous les types forestiers en Afrique centrale, les
conditions stationnelles définissent-elles les individualités
floristiques et structurales à l'intérieur de chaque cycle
forestier ?
· En existe-il- un modèle commun au sein d'un
bloc forestier ?
En outre, en milieu forestier tropical, la grande
complexité floristique ne rend nullement aisée la
définition des strates, qui apparaissent souvent avec moins de
netteté.
Pour tenter de comprendre l'implication
intraspécifique dans la définition de la typologie des
forêts tropicales, plusieurs études telles que celles de
Gérard (1960) sur la forêt dense à Gilbertiodendron
dewevrei de la région de l'Uélé, de Guillaumet (1967)
sur la végétation de la région de Bas-Cavally en
Côte d'ivoire, de Forget (1997a) sur la capacité de dispersion des
diaspores des arbres en Guyane française et de Harms & al.
(2001) mettent de l'intérêt sur l'importance de prendre en
compte les aspects liés au microhabitat des espèces et notamment
les strates forestières. Ainsi, elles définissent les groupes
écologiques en forêt dense humide en les subdivisant en groupe
supérieur (E+A1), groupe moyen (A2+A3) et le groupe du sousbois. Ces
études stipulent aussi que la nature contrastée des comportements
des espèces de différentes strates implique qu'il est
indispensable de les distinguer pour une meilleure compréhension de la
typologie. De même Blanc (2002) montre par des exemples à l'appui
que le microhabitat d'une plante au sein d'une forêt dense
homogène pouvait se définir sur base du type de support
colonisable par cette dernière. Pour lui, le type de support
colonisable
se définit en relation avec le tempérament de
l'espèce vis-à-vis des stades de recolonisation du couvert
végétal.
· Si la dynamique successionnelle des espèces
végétales est fortement influencée par les conditions
stationnelles, peut-on considérer qu'un modèle de composition
floristique stratifié peut être définit
corrélativement aux conditions stationnelles au sein d'un bloc forestier
?
0.7. Hypothèses
· Il existerait un modèle spatiale de regroupement
écologique défini par les conditions stationnelles à
l'intérieur d'un bloc forestier.
· Il existerait un modèle de distribution
spécifique multistrate défini par les conditions
stationnelles.
· Spatialement, la diversité spécifique
à l'intérieur d'un cycle forestier serait fortement
influencée par le type de substrat colonisable : grande sur sol argileux
et faible sur sol sableux.
0.8. Objectifs
0.8.1. Objectif général
L'objectif général de la présente
étude est d'identifier les groupements végétaux des
strates arborescentes des forêts denses étudiées et
partitionner la variance floristique entre les paramètres
environnementaux et spatiaux.
0.8.2. Objectifs spécifiques
· Vérifier s'il existe un modèle spatial et
stratifié de regroupement définit par les conditions
stationnelles.
· Estimer quantitativement et qualitativement le
degré de l'impact de substrat colonisable sur les données
floristique (composition, abondance des taxons, diversité
spécifique) et structurales (distribution spatiale des grosseurs,
surface terrière) à l'intérieur de chaque cycle
forestier.
0.9. Division du travail
Hormis l'introduction et la conclusion, le présent
travail s'articule autours de quatre chapitres :
· Le chapitre premier décrit le milieu où
l'étude a été effectuée ;
· Le second chapitre expose le matériel et les
méthodologies utilisés tant pour la collecte des données
sur le terrain que pour les analyses qui s'en étaient suivies ;
· Le troisième chapitre est consacré à
l'exposé des résultats obtenus ;
· Enfin le quatrième chapitre discute les
résultats obtenus entre eux et avec la littérature.
Chapitre I : MILIEU D'ETUDE
1.1. Description du milieu d'étude
La présente étude a été
menée près de la ville Kisangani (figure 2) qui se situe à
l'Est du bassin du Congo, quasiment sur la ligne de l'équateur
(0°31'N, 25°11'E), à environ 420 m d'altitude dans la province
orientale. Le dispositif d'inventaire se situe, une partie dans la
réserve forestière de Yoko, à environ 30 km et une autre
partie dans la forêt de Biaro à environs 40 km au Sud-Est de la
ville.
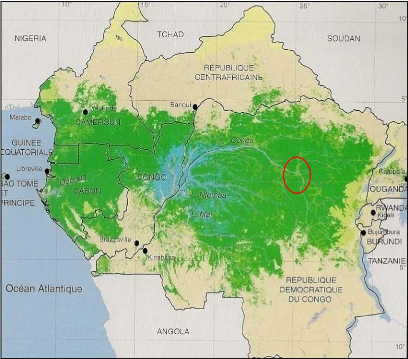
Figure 2 : Carte de l'Afrique centrale illustrant la surface
recouverte par les forêts tropicales (en vert), in Vandeweghe, 2004). Le
cercle rouge situe la ville de Kisangani et ses environs
La réserve forestière de Yoko et la
forêt de Biaro
La réserve forestière de Yoko est située
dans la collectivité de Bakumu-Mangongo, en
territoire d'Ubundu dans
la province orientale. Elle est limitée au Nord par la ville de
Kisangani et les forêts dégradées, au Sud
et à l'Est par la rivière Biaro et à l'Ouest par la voie
ferrée de la Société Nationale de Chemin de fer du Congo
(SNCC) et la route qui mène vers Ubundu le long desquelles elle se
prolonge des points kilométriques 21 à 38 (Lomba & Ndjele
1998).
Propriété privée de l'Institut Congolais
pour la Conservation de la Nature, conformément à l'ordonnance
loi n°75-023 du juillet 1975 portant création de cette institution
dont le but est de gérer le patrimoine biologique et naturel du pays
sous la tutelle du ministère de l'Environnement et Conservation de la
nature (Ordonnance-loi n°52/104 du 28 février 1959).
La réserve est traversée par plusieurs petits
ruisseaux dont celui de Yoko qui la divise en 2 parties, le bloc Nord avec 3
370 ha et le bloc Sud avec 3 605 ha, totalisant ainsi une superficie globale de
6 975 hectares (Lomba & Ndjele op.cit). Seule la partie sud de la
réserve fait l'objet de cette étude.
La station de la réserve est située au point
kilométrique 32, où dans le cadre du projet REAFOR, la FAO a
réhabilité quelques pavillons en bois et construit un laboratoire
et salle de conférence moderne pour les chercheurs qui y travaillent.
Ses coordonnées géographiques sont : 00° 29' longitude nord
et 25° 28' latitude Est.
Il faut signaler qu'actuellement plusieurs travaux de
recherche y sont effectués par les chercheurs de la faculté des
Sciences de l'Université, dont ce mémoire en est une
émanation en collaboration avec d'autres partenaires tant nationaux
qu'internationaux.
Rivière Biaro
10 km
Dispositif de Yoko
Dispositif de Biaro
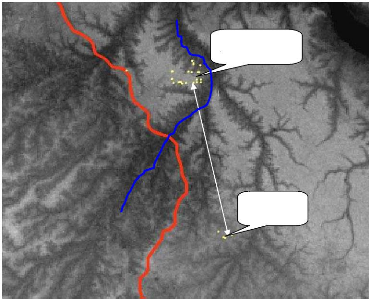
Figure 3 : Distance séparant la forêt de Yoko
à celle de Biaro. La ligne rouge représente la route
Kisangani-Ubundu.
1.2. Climat
Notre zone d'étude jouit d'un climat typiquement
équatorial chaud et humide du type Af selon la classification de
Köppen.
Les précipitations moyennes restent
élevées toutes l'année (1750 mm/an), mais sa
répartition n'est pas uniforme. On y observe des fléchissements
de précipitations entre décembre-février et
juin-août. Pour le mois le plus sec, la moyenne de précipitations
avoisine 60mm (Trochain, 1980).
Les moyennes mensuelles de température à
Kisangani oscillent entre 23,7 et 25,3° C avec une amplitude thermique
annuelle faible de 1,6° C. 24,3° C constitue la moyenne annuelle de
température (Mate, 2001). L'humidité relative moyenne mensuelle
est estimée à 84%.
Tableau 1 : Moyennes mensuelles de précipitations et de
températures de la région de Kisangani. Pp.m. :
Précipitation mensuelle (en mm) et T.m. : Température moyenne (en
°C)
Paramètres
|
J
|
F
|
M
|
A
|
M
|
J
|
J
|
A
|
S
|
O
|
N
|
D
|
|
Pp.m. T.m.
UU
|
69,5
24,4
88
|
99,9
25,1
84
|
144,3
25,3
87
|
171,3
25,1
84
|
178,7
24,7
86
|
128,8 24,3 88
|
95,9 23,7 88
|
130,4
23,5
88
|
204,1 24 86
|
237,4
24,2
87
|
216,2 24,5 90
|
106,2 24,4 86,8
|
1782,7
24,4
|
|
Source : station météorologique de Bangboka
(2007)
1.3. Géologie et géomorphologie
Lomba & Ndjele (1998) mentionnent que la forêt de
la réserve de Yoko a un sol qui présente les
caractéristiques reconnues aux sols de la cuvette centrale congolaise.
En effet, le climat chaud et humide caractérisant la cuvette centrale
possède un grand pouvoir d'altération vis-à-vis de
diverses roches-mères géologiques. Ce qui se traduit par la mise
en place de sols ferralitiques (classification française),
appelés encore ferrasols (classification de la FAO) ou encore oxisols
(classification de l'USDA).
La carte de sols établie par Sys (1960), situe les
sols de notre zone d'étude dans la catégorie des sols
ferralitiques des plateaux du type Yangambi. Ces sols sont
caractérisés par une faible teneur en bases échangeables
inférieur à 3 méq/100 g de terre sèche (TS), un
faible taux de saturation en bases (V <40%), un pH acide (<6) et une
couleur rouge ou jaune (Kombele 2004).
Kisangani
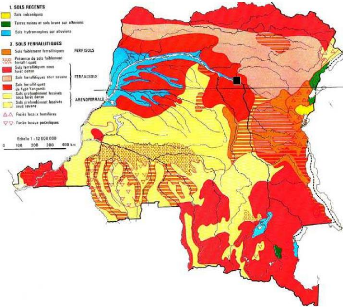
Figure 4 : Sols récents et ferralitiques de la RDC ;
en rouge foncé : sol ferralitique du type Yangambi. Source : Fahen, 1978
in Kombele, 2004.
Généralement sablo-argileux, acide, ces sols
renferment de combinaisons à base de sable, pauvre en humus et en
éléments assimilables par les plantes, à cause du
lessivage dû aux pluies abondantes. Ils ont une fertilité moyenne
et conviennent à la culture des plantes ligneuses et associations
légumineuses-graminées (Nyakabwa, 1982).
1.4. Cadre phytogéographique
La nouvelle classification phytogéographique
proposée par Ndjele (1988) situe notre zone d'étude (Kisangani et
ses environs) dans la région Guinéo-Congolaise qui
comprend le massif forestier équatorial et subéquatorial depuis
l'océan atlantique jusqu'aux hautes montagnes de la dorsale Congo-Nil en
se prolongeant le long des côtes du golf de Guinée jusqu'au
Liberia (Aubreville 1962), dans le domaine Congolais qui
s'étend dans la plaine du bassin du Congo, c'est-à-dire la
cuvette centrale et les plateaux qui l'entourent, dans le secteur Forestier
central qui englobe la cuvette centrale congolaise et dans le district
Centro-
oriental de la Maiko qui occupe toute la partie
située à l'Est de la rivière Lomami jusqu'au versant
occidental de la dorsale du Kivu.
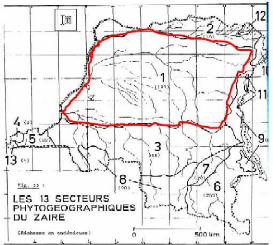
Figure 5 : Carte phytogéographique de la RD.Congo. En
rouge : le secteur forestier central (d'après Ndjele, 1988).
1.5. Végétation
En Province Orientale 3 types de forêts sont
représentés :
· la forêt équatoriale dense et humide :
elle couvre la totalité du district administratif de la Tshopo, la
moitié de Bas-Uélé, du Haut-Uélé (environ
25%) et l'Ituri (territoire de Mambasa),
· la savane parsemée des galeries ou lambeaux des
forêts secondaires : on l'observe au fur et à mesure qu'on avance
vers le nord-est de la province et couvre une partie du district de
Haut-Uélé (territoires de Dungu, Faradje et Watsa), du
Bas-Uélé (territoire de Poko, Ango, et Bondo),
· la végétation
hétérogène d'altitude : elle couvre la majeure partie du
district de l'Ituri. (Nshimba 2008).
Les recherches menées à la Faculté des
sciences de l'Université de Kisangani révèlent l'existence
de 2514 espèces des plantes vasculaires pour le seul district de la
Tshopo (Lejoly & al. 1988).
La végétation de la zone de notre étude
est essentiellement constituée de deux ensembles : un ensemble
regroupant les forêts à Caesalpiniaceae, comprenant des
forêts à Gilbertiodendron dewevrei qui forme un
peuplement plus ou moins pur ; des forêts à Scorodophloeus
zenkeri et un autre ensemble constitué des essences
héliophiles ou semi héliophiles issues probablement de
l'anthropisation dans la zone ; on y rencontre en général les
essences telles que Entandrophragma spp, Guarea spp,
Pericopsis elata, Strombosia grandifolia, etc. (Batsielili,
2008).
La partie Sud de la réserve où notre dispositif
est installé appartient au type des forêts mésophiles
sempervirentes à Scorodophloeus zenkeri, alliance
Oxystigmo-Scorodophloeion, dans l'Ordre des
Piptadenio-Celtidetalia au sein de la Classe
Strombosio-Parinarietea (Lebrun & Gilbert 1954).
1.6. Activités anthropiques
A ce jour, les forêts de la réserve de Yoko et
environs sont menacées par diverses activités humaines.
L'explosion démographique, associée à l'instabilité
politique (guerres de libération, rebellions, etc.) qui a élu
domicile en RD. Congo en général et dans la province orientale en
particulier à partir de 1996, ont donné lieu à une
exploitation désordonnée et à une utilisation
irrationnelle des ressources naturelles de la région.
La population riveraine de la réserve et les habitants
de villages situés sur l'axe routière Kisangani-Ubundu longeant
cette réserve pratiquent des activités qui ont sans doute un
impact sur la biodiversité de la réserve : l'agriculture
itinérante sur brûlis, la pêche, l'élevage, la
carbonisation de charbon de bois, la récolte des chenilles comestibles
et la chasse.
Chapitre II : Matériel et Méthodes
2.1. Méthodes de collecte des
données
2.1.1. Dispositif d'échantiionnage et choix de
l'emplacement des relevés
Afin d'étudier de manière approfondie la
variabilité de types forestiers, nous avons opté pour un
échantillonnage ciblé (cfr. Senterre, 2005) et non
aléatoire ; C'est-à-dire, organisé de manière
à obtenir un nombre de relevés à peu près
équivalent pour chaque situation considérée.
BIARO
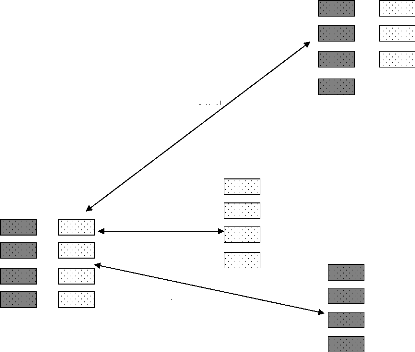
3
2
1
4
3
2
1
10 k m
4
3
4
1 k m
E
_,c
`--i
2
3
1
2
1
2,45 k m
YOKO
4
3
2
1
4
2
1
3
Figure 6 : Dispositif d'échantillonnage. Les cadres
colorés représentent les relevés sur argile et les cadres
non colorés les relevés sur sable.
considérée comme point de départ. Une
série de 4 relevés a été réalisée
pour chaque combinaison, donc quatre placeaux de 1 hectare (200x50 m) et
distants de 100 m chacun ont été établis sur chaque type
de sol (8 relevés au total). Nous avons utilisé un
pentadécamètre pour la délimitation des transects et un
GPS pour la prise des coordonnées géographiques.
Ensuite, à plus ou moins 1 kilomètre de la zone,
quatre autres placeaux ont également été
délimités sur chaque type de sol (encore 8 relevés,
zone).
Un repiquât similaire a été enfin obtenu
à plus ou moins 10 km dans la forêt de Biaro (4 relevés sur
argile et 3 relevés sur sable).
Au total, 23 placeaux (= 23 relevés, constitués de
deux sous-relevés emboîtés chacun) ont été
établis dans l'ensemble de dispositif.
Classiquement, notre dispositif d'échantillonnage
s'est intéressé uniquement aux peuplements arborescents (= 6 m =
20 m). Les strates du sous-bois ne seront pas traitées dans le cadre de
ce mémoire. Les paramètres étudiés sont ceux
relatifs à la densité, à la surface terrière,
à la structure diamétrique et à la structure floristique
(richesse et diversité) ainsi qu'à la définition des
groupes écologiques.
Pour chaque cas considéré, Il a
été question de trouver une station homogène d'environs 1
hectare où la forêt est aussi mature que possible et la plus
représentative en terme de la diversité pour éviter de
biaiser les résultats.
Une fois l'emplacement de relevé
délimité, on a procédé à l'inventaire
proprement dit. Dans le cadre de cette étude, nous avons mis en
exécution une méthode récente, expérimentée
dans la région pour la première fois par Nshimba (op.cit.)
à l'île Mbiye.
Cette méthode consiste à décomposer le
relevé en sous-relevés structuraux emboîtés chacun
adapté à un ensemble d'éléments bien précis,
correspondant aux principales strates de la forêt (relevé synusial
ou phytocénotique) avec un effort d'échantillonnage de 100
individus à l'hectare pour les strates arborescentes (Gillet, 2000 ;
Senterre, op.cit. ; Nshimba, op.cit.).
Pour chaque relevé, le comptage des arbres de hauteur
> à 20 m était fait le long d'un layon de 200 m de longueur et
25 m de large de part et d'autre du layon (200 x 50m donc un hectare).
|
Partie A
|
|
Partie B
|
|
Partie C
|
|
Partie D
|
|
|
25 m
|
|
|
|
5 m
|
|
|
5 m
|
|
25 m
|
|
|
|
|
|
|
50 m

Figure 7: Schéma de la disposition d'un inventaire
floristique vu de dessus. 2.1.2. Données structurales sur
la station
Afin de pouvoir analyser de manière objective les
liens entre paramètres environnementaux, flores (diversité) et
végétations (groupements végétaux), il s'impose de
procéder à un minimum d'observations visant à
caractériser autant que possible les conditions stationnelles des
relevés botaniques réalisés.
Il existe un grand nombre de paramètres
environnementaux mesurables et observables sur le terrain. Etant donné
les moyens dont nous disposions, il n'était de toute façon pas
possible de réaliser le maximum des paramètres et de les analyser
de manière plus sophistiquée. De manière
générale, nous avons opté pour des paramètres
macroécologiques, facilement et rapidement identifiables directement sur
le terrain sans appareillage sophistiqué.
a. Nature du sol
Un effort a été réalisé afin
d'obtenir dans chaque site, des relevés sur un substrat sableux (ou
sablo-argileux) et sur un substrat argileux (ou argilo-sableux).
Pour le dispositif de Yoko (16 ha) les échantillons du
sol ont été prélevés et soumis à l'analyse
granulométrique et dont les résultats présentés
ci-dessous sont tirés du travail de Vleminckx (2009) qui a
récolté ses données dans le même dispositif que le
nôtre.
Tableau 2 : Moyennes et écart-types des variables
édaphiques dans les différentes zone de
récolte de site de Yoko. Indice de significativité
(* = p<0.05 ; ** = p<0.01 ; *** Zones 1s et 1a : zone d'interface
sable/argile, zone 2 : 1 km et zone 3 : 2,5 km.
|
= p<0.001).
|
VARIABLE
|
ZONE 1s
(sableux)
|
ZONE 1a
(argileux)
|
Effet sol
|
ZONE 2 (sableux)
|
ZONE 3 (argileux)
|
% argile
|
7.11 (#177; 3.74)
|
21.93 (#177; 4.16)
|
0.891***
|
5.71 (#177; 0.13)
|
19.18 (#177; 4.15)
|
% sable
|
83.25 (#177; 1.97)
|
50.83 (#177;11.75)
|
0.91***
|
89.11 (#177; 0.84)
|
55.97 (#177; 6.93)
|
pH
|
3.52 (#177; 0.21)
|
4.24 (#177; 0.73)
|
0.499**
|
3.59 (#177; 0.16)
|
4.03 (#177; 0.28)
|
%
mat.
org.
|
2.88 (#177; 0.93)
|
5.76 (#177; 2.14)
|
0.677***
|
1.99 (#177; 0.52)
|
4.98 (#177; 1.52)
|
Conductivité (uS/cm)
|
328 (#177; 75)
|
553 (#177; 257)
|
0.113*
|
277 (#177; 67)
|
215 (#177; 75)
|
[Phosphore] (ug/g)
|
31.74 (#177; 3.64)
|
17.98 (#177; 2.77)
|
0.8999***
|
35.94 (#177; 2.02)
|
18.33 (#177; 1.41)
|
|
b. Hydromorphie du sol
Elle a été évaluée par certaines
caractéristiques au niveau de la physionomie des plantes (racines
échasses,...) (Senterre op.cit.) et par la permanence de l'eau au niveau
de la couche superficielle du sol.
0 = terre ferme
1 = sol hydromorphe drainé
2 = sol hydromorphe mal drainé.
c. Topographie
Variable qualitative ordinale.
1 = plaine disséquée
2 = plateau
2.1.3. Inventaires et identification des arbres
Tous les arbres dont la hauteur totale est supérieure
à 20 m ont été inventoriés et
considérés comme appartenant à la strate E+A. Et ceux dont
la hauteur est comprise entre 6 et 20 m étaient considérés
dans la strate Ad (Senterre, 2005).
Le diamètre pour chaque individu a été
obtenu par la mesure au DBHmètre à 1,30 m. Cette hauteur à
été obtenu en utilisant un bâton de 1,30 de hauteur. En
principe, le diamètre minimum d'inventaire forestier est de 10 cm ;
étant donné l'importance accordée aux strates dans cette
étude, les individus dont le diamètre est inferieur à 10
cm étaient également pris en compte dès lors qu'ils
dépassaient 5 m de hauteur.
Etant donné que des problèmes de mesure de Dbh
se posent assez régulièrement en forêt dense humide lorsque
les arbres présentent des accotements ailés, des racines
contreforts et échasses, les mesures étaient faites au-dessus de
ces adaptations comme prévue par la méthodologie pour les
inventaires forestiers (Rondeux, 1999).
L'identification des arbres a été
réalisée sur le terrain grâce à la combinaison des
caractères végétatifs observés sur le terrain :
· la forme générale du tronc à la base
(cylindrique, avec contreforts ou échasses) ;
· texture de l'écorce ;
· couleur de l'entaille (ocre, rouge, brune, jaune,.....)
;
· le goût de l'écorce ;
· odeur (ail, essence, térébenthine,..) ;
· exsudation (latex jaune, orange, blanc,
résine,...) ;
· type des feuilles et forme ;
· ramification de l'arbre, le fût et le port.
Chaque arbre inventorié et identifié était
marqué en peinture de couleur noire, un signe de trois croix
marqué sur chaque pied permet de le distinguer dans le dispositif.
Malgré la bonne connaissance des essences
forestières de la région des identificateurs, la confection d'un
herbier constitué des fragments des plantes fertiles étaient
importante pour certifier la détermination faite sur le terrain dans un
Herbarium. Cet herbier numéroté constitue la collection AMANI et
dont le double est déposé à l'Herbarium de
l'Université Libre de Bruxelles (BRLU). Quelques ouvrages nous ont aussi
aidé à l'identification ; notamment : Tailfer (1989), Wilks &
al. (2000), Pauwels (1993), Poorter & al. (2004)
Nshimba (2005). Le catalogue informatisé de Lejoly &
al. (1988) nous a aidés pour l'orthographe des noms
scientifiques.
2.2. Méthodes d'analyse des données
2.2.1. Analyses des données floristiques
Afin d'analyser la composition du peuplement, les indices
ci-après ont été utilisés (Lejoly, 1993 et Doucet,
2003).
a. Richesse aréale
C'est l'une des mesures les plus communes de la
biodiversité (Nshimba, 2008). Elle exprime le nombre d'espèces
recensées par unité de surface (Walker 1995). Cette mesure permet
de bien évaluer la variation de la surface terrière et de
diamètre au sein de la surface d'étude.
b. La courbe aire-espèces
Elle exprime l'augmentation de nombre d'espèces (en
ordonnée) en fonction de la surface croissante (en abscisse). Elle
permet de déterminer la surface minimale à inventorier.
c. La fréquence relative
Fréquence d' une espèce
Total des
fréquences de toutes les espèces
FR 100 x
(1)
Nombre d' individus d' une famille ou espèce
Nombre total d' individus dans l' échantillon
DR = 100 x
(2)
La fréquence d'une espèce correspond au nombre
d'unités d'échantillonnage contenant cette espèce.
d. L'abondance relative
e. La dominance relative
Surface terrière d' une espèce
Surface terrière totale de l' échantillon
(3)
DoR =
100 x
ou famille
f. Surface terrière
La surface terrière d'un arbre est la superficie
occupée par le tronc, mesuré sur l'écorce à 1,30m
du sol. Elle s'exprime en m2/ha.
La surface terrière d'une espèce correspond
à la somme des surfaces terrières de tous les individus de cette
espèce et ramener les résultats à l'hectare.
La surface terrière totale correspond à la somme
des surfaces terrières de tous les individus présents sur la
surface inventoriée.
Elle se calcule à partir de la formule suivante :
(4)
Où ST : surface terrière, b : Nbre d'individus, c
: diamètre moyen
g. Indice d'importance des espèces (Importance Value
Index)
Cet indice effectue une pondération des valeurs de la
diversité par des termes relatifs à la densité relative,
à la dominance relative et à la fréquence relative des
relevés dans lesquels l'espèce est présente (Curtis &
Mclntosh, 1950). Elle se calcule par la formule suivante :
IVI = DR + DoR + FR (5)
Avec : IVI : Importance Value Index (Indice d'Importance des
espèces)
h. Indices de renouvellement et de
régénération de la strate dominante
Nous avons utilisé deux indices pour évaluer le
renouvellement de la strate arborescente
supérieure au niveau de la
strate des dominés. Lorsque la valeur tend vers 1, nous estimons
que dans l'avenir la strate arborescente supérieure sera
remplacée par sa propre régénération. Dans le cas
où la valeur tend vers 0, il y a probabilité que la forêt
est en train de changer.
·
·
C'est l'indice de renouvellement
Où a : régénération de la strate A
présente dans la strate Ad, b : régénération de la
strate A présente dans Ad mais absente dans A
a b
+
I S
. = (7)
a
+ +
b c
C'est l'indice de régénération
Où c : élément propre de la strate Ad.
i. Les coefficients de similarité
Le calcul des coefficients de similitude permet de quantifier le
degré d'association entre les espèces, ou encore le niveau de
similitude entre deux sites.
· L'indice MH (Morisita-Horn)
(8)
A l'aide du logiciel BiodivR 1.0 mis au point par O. Hardy (2005)
disponible sur
http://www.ulb.ac.be/sciences/bioancel/ohardy/index.html
2.2.2. Calcul des indices de diversité
Un indice de diversité est fonction de la richesse
spécifique de la communauté et de la structure de la
communauté. Il permet d'évaluer rapidement, en un seul chiffre,
la biodiversité d'un peuplement. Il renseigne sur la qualité et
le fonctionnement des peuplements.
a. Indice de Simpson (S)
Ni
S = (9)
2
(Ni 1) (1
- - pis )
Où pis est la fréquence de l'espèce i dans
l'échantillon s
Cet indice se base sur la fréquence des individus
élevée au carré. C'est la probabilité que deux
individus appartiennent à la même espèce dans une
communauté de taille Ni. Par conséquent la contribution relative
des espèces rares est presque insignifiante.
b. Indice de Shannon-Weaver
L'indice de diversité de Shannon-Weaver mesure la
quantité moyenne d'informations données par l'indication de
l'espèce d'un individu de la collection. Cette moyenne est
calculée à partir des proportions d'espèces qu'on a
recensées (Nshimba, 2008).
s
H = -
i= 1
fi fi
. log2 (10)
ni
fi = (11) avec ni compris entre 0 et N
N
fi est compris entre 0 et 1
N : effectif total, ni : effectif de l'espèce dans
l'échantillon, S : nombre total d'espèces dans
l'échantillon
Les indices de diversité de Simpson, de Fisher et de
Shannon ont été calculés directement sur le logiciel
PAST.
c. Indice de Fisher á
Cet indice est assez facile à calculer car il ne
nécessite que le nombre d'individus dans la communauté dont on
chercher à évaluer la diversité. Il prend en compte les
espèces rares et est stable en fonction de nombre d'individus.
N
s = á ln(1 + (12)
)
á
Où S : richesse spécifique, N : nombre
d'individus
2.2.3. Description des communautés
Afin de d'apprécier les appétences entre les
relevés (ou sites) et en dégager les ressemblances et les
dissemblances on a procédé à des ordinations.
L'ordination est le terme collectif pour les techniques
multivariées qui arrangent les sites le long d'axes sur base de
données de la composition spécifique. Le résultat en deux
dimensions (2 axes) est un diagramme où les sites sont
représentés par des points. Le but de l'ordination est d'arranger
ces points de façon à ce que des points qui sont proches l'un de
l'autre correspondent à des sites qui ont une composition similaire et
que les points éloignés correspondent à des sites à
composition floristique différente (Jongman & al. 1995).
Ce réarrangement permet de synthétiser les
résultats qui sont ensuite interprétés à l'aide de
ce qui est connu de l'environnement des sites. Si on n'a pas de données
environnementales explicites, on le fait de manière informelle et s'il y
en a, de manière formelle.
Ainsi, nous avons d'abord procédé à
l'analyse indirecte particulièrement un DCA (Dentrended Correspondance
Analysis). Ici, l'ordination est construite sur base des
relevés/espèces uniquement. Les facteurs environnementaux sont
projetés à posteriori dans l'espace d'ordination pour examiner
leur corrélation avec la position des relevés/espèces.
Ensuite, les données environnementales sont directement
utilisées (CCA= Canonical Correspondance Analysis) pour organiser
l'information sur la variabilité floristique.
Ces analyses ont été réalisées
avec le logiciel CANOCO (Leps & Smilaur 1999). Ce logiciel nous à
permis grâce à ses nombreuses options notamment Canodraw de
présenter les résultats sous forme de diagrammes d'ordination. On
a pu également calculer l'effet significatif des facteurs
environnementaux sur la variabilité floristique à l'aide de tests
de permutations de Monte Carlo.
L'analyse de classification (dendrogramme) a été
réalisée grâce au logiciel PAST.
2.2.4. Les tests statistiques
Dans une étude comparative, il est important avant de
prendre une position de recourir aux tests statistiques.
Les tests statistiques sont donc des outils d'aide à la
décision. Cependant, ces tests ne proposent aucune interprétation
des résultats. Ils laissent au chercheur les soins d'argumenter sa
décision tout en rappelant les 2 risques d'erreur possibles :
· si un risque d'erreur est > 0,05, on conclut que la
différence entre 2 séries de mesure n'est pas significative.
· si le test indique un risque d'erreur < 0,05, on
conclut à une différence significative entre les 2 séries
de mesure.
Le principal test statistique réalisé dans ce
travail est l'ANOVA.
Chapitre III : RESULTATS
A. LA FORET SUR SOL SABLEUX
3.1. Les ensembles structuraux
3.1.1. Composition et richesse spécifique
Au cours des inventaires réalisés dans la
forêt de sol sableux, nous avons inventorié 3376 individus
d'arbres correspondant à 186 espèces et morpho-espèces
identifiées réparties en 38 familles différentes. Ces
observations proviennent des onze relevés emboités dans une
surface de 11 ha pour les arbres de plus de 20 m de hauteur et 2,2 ha pour ceux
de hauteur compris entre 6-20 m. La liste des espèces pour chaque
ensemble structural est repris dans les annexes de ce travail.
La figure 8 ci-après représente la richesse
spécifique en termes de nombre d'espèces pour chaque ensemble
structurale dans la forêt établie sur sol sableux.


100 90 80
Rihesse specifique

70
60
50
40
30
20 10 0
A a b c
Ensembles structuraux
Légende : (A) élément propre de la
strate A, (a) régénération de la strate A présente
dans la strate Ad, (b) régénération de la strate A
présente dans Ad mais absente dans A et (c) élément propre
de la strate Ad.
L'analyse de cette figure montre que si on considère
les ensembles structuraux, l'ensemble de présent ou
l'élément propre de la strate A est plus riche en espèces
(90 espèces) que l'ensemble du présent ou l'élément
propre de la strate Ad (70 espèces).
De manière particulière, si l'on tient compte
de la contribution des espèces dans la strate Ad incluant
a (avec 89 espèces),
b (avec 16 espèces) et c
(avec 70 espèces) on se rend compte que l'ensemble de la
régénération de A appelé aussi «
élément du futur », contribue à 51% de la richesse
spécifique de cette strate alors que l'élément propre ne
représente que 40%. La part de (c) est de 9%.
3.1.2. Renouvellement et
Régénération de la strate arborescente dominante
Le résultat obtenu dans cette analyse nous a permis de
réfléchir sur le fonctionnement de cette forêt par
l'analyse de deux indices qui nous permettent de prévoir ce qui se
passera dans cette forêt dans l'avenir. Il s'agit des indices
ci-après :
· L'Indice de Renouvellement de la strate arborescente
dominante
I.R = a/a+b
IR = 89/89+16 = 0,79
· L'Indice de Régénération de la
strate arborescente dominante I.S = a+b/a+b+c
I.S = 89+16/89+16+70 = 0, 6
Les valeurs de ces indices approchent 1, ce qui nous conduit
à considérer que la forêt étudiée
évolue normalement, la strate arborescente de cette forêt sera
renouvelée par sa propre régénération se trouvant
actuellement dans la strate Ad. En d'autres termes, les espèces
étrangères de ce groupe sur sable n'influencent pas la
régénération de l'élément propre du groupe
et que la probabilité d'un remplacement de la forêt est
très faible.
la connaissance précise de l'individu en
présence : s'agit-il d'un arbre dominé ou d'un arbre dominant en
régénération ? Et de l'effort d'échantillonnage qui
est faible pour l'élément propre de Ad (40% seulement des
espèces inventoriées dans une surface de 0,2 ha).
Il nous semble que la solution pratique revient à
faire des observations par strate que par ensemble structural car la
présence d'un jeune individu de la strate A dans la strate Ad n'est pas
une observation inutile, mais nous apporte au contraire une information
précieuse sur le taux de remplacement de la strate A tout en nous
renseignant sur la stratégie de vie ou le tempérament de
l'espèce considérée.
C'est cette approche d'analyse que nous avons adopté dans
la suite de ce travail.
3.2. Analyse floristique interstrate
Au total nous avons inventorié 1290 individus des
arbres de la strate arborescente supérieure répartis en 107
espèces et 31 familles sur une surface de onze hectares ; tandis qu'au
niveau de la strate arborescente inférieure, 2086 pieds d'arbres
répartis en 158 espèces et 36 familles sur une superficie de 2,2
hectares.
Au sein de cette forêt les Fabaceae, Malvaceae, Meliaceae
et Sapotaceae (classification APGII) sont les plus représentées
en nombre d'espèces.
3.2.1. Les familles représentatives
Le tableau 3 présente la liste des familles
représentées avec au moins 4 espèces dans les deux strates
arborescentes retenues.
Tableau 3 : Les familles représentatives selon les
strates
Strate A Strate Ad
Familles Nbre d'espèces Familles Nbre d'espèces
Fabaceae 25 Fabaceae 25
Meliaceae 10 Malvaceae 15
Euphorbiaceae 8 Sapotaceae 11
Sapotaceae 7 Meliaceae 10
Olacaceae 5 Annonaceae 9
Annonaceae 4 Rubiaceae 9
Apocynaceae 4 Ebenaceae 8
Malvaceae 4 Euphorbiaceae 8
Puntranjivaceae 4 Moraceae 4
La lecture de ce tableau 3 montre bien la richesse en
espèces de la famille des Fabaceae dans toutes les deux strates ; les
familles Meliaceae et Malvaceae viennent en deuxième position
respectivement au niveau de la strate A et strate Ad. On peut aussi remarquer
la répétition des mêmes familles pour les deux cas.
3.2.2. Abondance des espèces
Dans la forêt établit sur sol sableux, on a
constaté qu'au sein de la strate arborescente supérieure,
Scorodophloeus zenkeri et Julbernardia seretii sont les espèces
les plus abondantes (17,44% et 8.76%), alors qu'au niveau de la strate
arborescente inférieure on note l'abondance des espèces Cola
griseiflora et Aidia micrantha (5,66% et 5,23%). Dans
l'ensemble, 26 espèces présentent des valeurs
d'abondance supérieures à 1 % dans chaque strate.
Tableau 4: Espèces abondantes avec leurs valeurs
d'abondance relative (DR) et de dominance relative (DoR).
Strate A
|
|
|
Strate Ad
|
|
|
Espèces
|
DR
|
DoR
|
Espèces
|
DR
|
DoR
|
Scorodophloeus zenkeri
|
17,44
|
17,02
|
Cola griseiflora
|
5,66
|
4,35
|
Julbernardia seretii
|
8,76
|
9,40
|
Aidia micrantha
|
5,23
|
3,98
|
Polyalthia suaveolens
|
5,50
|
2,63
|
Staudtia gabonensis
|
4,89
|
4,62
|
Cynometra hankei
|
4,34
|
5,47
|
Guarea cedrata
|
4,51
|
3,49
|
Prioria balsamifera
|
3,57
|
3,53
|
Annonidium mannii
|
4,41
|
9,77
|
Petersianthus macrocarpus
|
3,02
|
2,21
|
Drypetes likwa
|
3,84
|
3,52
|
Anonidium mannii
|
2,95
|
2,00
|
Scaphopetalum thonneri
|
3,40
|
1,10
|
Prioria oxyphylla
|
2,64
|
5,53
|
Strombosia pustulata
|
3,21
|
5,00
|
Celtis mildbraedii
|
2,48
|
2,29
|
Grossera multinervis
|
2,97
|
4,14
|
Panda oleosa
|
2,48
|
1,91
|
Guarea thompsonii
|
2,59
|
2,25
|
Guarea cedrata
|
2,40
|
2,81
|
Pycnanthus angolensis
|
2,35
|
2,04
|
Trilepisium madagascariensis
|
2,33
|
1,21
|
Drypetes gossweileri
|
2,21
|
1,09
|
Gilbertiodendron dewevrei
|
2,25
|
2,77
|
Pancovia harmsiana
|
2,21
|
1,50
|
Pycnanthus angolensis
|
1,94
|
1,41
|
Julbernardia seretii
|
2,06
|
3,33
|
Pterocarpus soyauxii
|
1,71
|
1,92
|
Cleistanthus mildbraedii
|
2,01
|
1,52
|
Dialium corbisieri
|
1,63
|
1,93
|
Scorodophloeus zenkeri
|
2,01
|
4,24
|
Schotia romii
|
1,55
|
1,00
|
Petersianthus macrocarpus
|
1,87
|
3,22
|
Staudtia gabonensis
|
1,55
|
0,97
|
Schotia romii
|
1,87
|
1,77
|
Anthonotha fragrans
|
1,40
|
2,00
|
Dialium pachyphyllum
|
1,82
|
1,39
|
Blighia welwitschii
|
1,32
|
1,63
|
Polyalthia suaveolens
|
1,63
|
2,20
|
Xylia ghesquierei
|
1,24
|
0,91
|
Ochthocosmus africanus
|
1,58
|
0,92
|
Celtis tessmannii
|
1,16
|
0,99
|
Rinorea oblongifolia
|
1,39
|
0,65
|
Strombosia grandifolia
|
1,16
|
1,29
|
Trichilia gilgiana
|
1,39
|
1,30
|
|
Drypetes likwa
|
1,09
|
0,71
|
Blighia welwitschii
|
1,34
|
0,90
|
Guarea thompsonii
|
1,09
|
1,07
|
Gilbertiodendron dewevrei
|
1,29
|
1,54
|
Diogoa zenkeri
|
1,01
|
0,63
|
Massularia acuminata
|
1,10
|
0,61
|
|
En termes de dominance relative, c'est Scorodophloeus
zenkeri (17,02%) et Julbernardia seretii (9,40%) qui sont en
tête pour la strate A, elles sont suivies des espèces
Cynometra hankei (5,47%) et Prioria balsamifera (3,53%) pour
la strate A. Tandis que pour la strate Ad, on peut remarquer la dominance des
espèces Anonidium mannii (9,77%), Strombosia pustulata
(5,00%), Staudtia gabonensis (4,62%) et de Cola griseiflora
(4,35%).
L'indice d'importance des espèces (Importance Value
Index = IVI) qui est la somme de l'abondance relative, de la dominance relative
et de la fréquence relative nous indique les espèces qui
caractérisent au mieux la florule étudiée.
Les figures 9 et 10 donnent pour chaque strate les
espèces qui présentent les indices d'importance les plus
élevés dans la forêt sur sol sableux.
40
35
30
25
20
15
10
5
0
!VW
Figure 9 : Espèces caractéristiques de la
strate A sur sol sableux.
Les espèces les plus importantes se démarquent
bien en fonction des strates ; la strate arborescente supérieure (figure
9) est caractérisée par les espèces Scorodophloeus
zenkeri, Julbernardia seretii, Cynometra hankei, Polyalthia suaveolens, Prioria
oxyphylla et Prioria balsamifera.
18
16

14
12



10
8
!VW
6
4
2
0

Figure 10 : Espèces caractéristiques de la
strate Ad sur sol sableux.
Tandis qu'au niveau de la strate arborescente inferieure
(figure10) les espèces caractéristiques sont : Anonidium
mannii, Cola griseiflora, Staudtia gabonensis, Aidia micrantha, Strombosia
pustulata et Guarea cedrata.
3.2.3. La surface terrière
La surface terrière est calculée pour chaque
relevé (placette) les valeurs obtenues auxquelles nous avons adjoint les
valeurs de D130, le nombre de pieds et des espèces sont
données dans les tableaux 5 (strate A) et 6 (strate Ad) ci-dessous.
Tableau 5 : Valeurs de D130 moyen, de la surface
terrière, de nombre de pieds et de nombre d'espèces pour la
strate A dans les 11 relevés réalisés
Relevés
|
Surface cumulée
(en ha)
|
D130 moyen
(cm)
|
ST
(m2/ha)
|
Pieds
(N)
|
Espèces
|
espèces
cumulées
|
1
|
1
|
48,75
|
19,03
|
102
|
31
|
31
|
2
|
2
|
51,9
|
26
|
123
|
42
|
56
|
3
|
3
|
47,83
|
23,7
|
132
|
36
|
65
|
4
|
4
|
52,15
|
25,62
|
120
|
33
|
73
|
5
|
5
|
46,29
|
24,73
|
147
|
35
|
81
|
6
|
6
|
46,95
|
27,86
|
161
|
43
|
87
|
7
|
7
|
50,32
|
24,45
|
123
|
37
|
88
|
8
|
8
|
52,48
|
21,62
|
100
|
34
|
92
|
9
|
9
|
44,93
|
13,79
|
87
|
44
|
101
|
10
|
10
|
53,5
|
18,65
|
83
|
40
|
106
|
11
|
11
|
46,52
|
19,03
|
112
|
43
|
107
|
Moyenne
|
|
49,24
|
22,23
|
117,27
|
38
|
|
Ecart-type
|
|
2,95
|
4,19
|
23,95
|
4,58
|
|
CV
|
|
5,99
|
18,84
|
20,42
|
12,05
|
|
|
En moyenne la surface terrière ramenée à
l'hectare est de 22,23 m2 pour 117, 27 pieds moyens totalisant un
D130 moyen de 49,24 cm. Le nombre d'espèces moyen à
l'hectare s'élève à 38 espèces.
A partir de ces données, nous sommes parvenus à
tracer la courbe aire-espèces qui exprime l'augmentation de nombre
d'espèces en fonction de la surface croissante (figure11).
Especes carrulees
y = 35,928x0,4764
R2 = 0,9608
100
80
60
40
20
0
1 2 3 4 5 6 7 8 9 10 11
120
surface cumulée (en ha)
Figure 11 : La courbe aire-espèces Strate A
Cette courbe aire-espèces est régulière
car le coefficient de variation R2 est élevé (0,9608),
ce qui montre que l'accumulation de nombre d'espèces augmente avec
l'augmentation de la surface d'inventaire.
Tableau 6: Valeurs de D130 moyen, de la surface
terrière, de nombre de pieds et de nombre d'espèces pour la
strate Ad dans les 11 relevés réalisés
Relevés
|
Surface cumulée
(en ha)
|
D130 moyen
(cm)
|
ST
(m2/ha)
|
Pieds (N)
|
Espèces
|
espèces
cumulées
|
1
|
0,2
|
11,41
|
7,67
|
150
|
57
|
57
|
2
|
0,4
|
11,2
|
10,3
|
209
|
67
|
89
|
3
|
0,6
|
9,65
|
8,11
|
222
|
62
|
103
|
4
|
0,8
|
10,01
|
7,28
|
185
|
48
|
108
|
5
|
1
|
9,33
|
7,7
|
225
|
58
|
120
|
6
|
1,2
|
8,86
|
6,072
|
197
|
58
|
126
|
7
|
1,4
|
9,41
|
6,72
|
193
|
44
|
127
|
8
|
1,6
|
9,92
|
8,93
|
231
|
59
|
133
|
9
|
1,8
|
12,104
|
9,6
|
167
|
55
|
142
|
10
|
2
|
12,96
|
10,21
|
155
|
58
|
150
|
11
|
2,2
|
13,87
|
11,49
|
151
|
57
|
157
|
Moyenne
|
|
10,79
|
8,55
|
189,55
|
56,64
|
|
Ecart-type
|
|
1,64
|
1,69
|
30,41
|
6,20
|
|
CV
|
|
15,19
|
19,76
|
16,04
|
19,94
|
|
|
En moyenne la surface terrière à l'hectare est
de 8,55 m2/ha au niveau de la strate Ad. Les valeurs moyennes de
diamètre, de nombre de pieds et des espèces sont respectivement :
10,79 cm, 189,55 et 56,64.
La courbe aire- espèce obtenue (figure 12) à
partir des données ci-haut est également régulière
(R2= 0,9668) et confirme l'augmentation des espèces en
fonction de l'augmentation de la superficie d'inventaire.
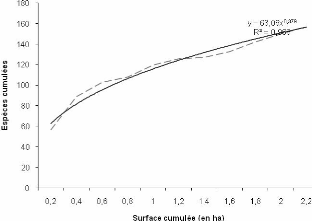
Figure 12 : La courbe aire espèce strate Ad.
3.2.4. Fréquence des espèces
Le nombre d'apparition des espèces le long de la
surface d'inventaire a été calculé pour chaque strate. Il
ressort de cette analyse qu'au niveau de la strate A, les espèces
Scorodophloeus zenkeri, Julbernardia seretii, Cynometra hankei et Panda
oleosa étaient présentes dans tous les 11 relevés
(figure 13) et qu'au niveau de la strate Ad ce sont les espèces
Aidia micrantha, Staudtia gabonensis, Anonidium mannii et Massularia
acuminata qui étaient présentes dans toutes les placettes
(Figure 14).
Scorodophloeus zenkeri Julbernadia seretii Cynometra hankei
Panda oleosa
1 2 3 4 5 6 7 8 9 10 11
Nombre de pieds par placette
45
40
25
20
50
35
30
15
10
5
0
Placettes
Figure 13 : Fréquence des espèces le long de
la surface d'inventaire pour la strate A.
Cette figure montre que Scorodophloeus zenkeri est
non seulement fréquente, mais aussi abondante dans les 8 premiers
relevés (qui correspondent à la forêt de Yoko), alors
qu'elle n'est présente qu'à des très faibles
densités dans les 3 derniers relevés (qui correspondent à
la forêt de Biaro). Le même constat peut être fait pour
Julbernardia seretii et Cynometra hankei.
Aidia micrantha Staudtia gabonensis Annonidium mannii Massularia
acuminata
1 2 3 4 5 6 7 8 9 10 11
Nombre de pieds par placette
25
20
15
10
5
0
Placettes
Figure 14 : Fréquence des espèces le long de
la surface d'inventaire pour la strate Ad.
La figure 14 montre une fréquence élevée
et une abondance de Aidia micrantha et Staudtia gabonensis
dans tous les relevés, alors que Massularia acuminata, bien
qu'elle soit présente dans tous les relevés, mais elle n'est pas
abondante.
3.2.5. Distribution diamétrique
Nombre d'individus par classe
400
250
200
350
300
150
100
50
0
Classes diamétriques
Figure 15 : Répartition des individus par classe
diamétriques strate A
Pour les arbres de la strate arborescente supérieure,
quinze classes de diamètre ont été définies. La
majorité des espèces de cette catégorie se retrouve entre
30 et 40 cm de diamètre (figure 15).
On remarque que la courbe de tendance moyenne des classes
diamétriques pour la strate A est concave, ce qui montre que la
majorité d'espèces dans cette strate sont des espèces de
lumière.
1400
NOrrbre crincividus par dasse






1200
1000
800
600
400
200
0
<10 10-19 20-29 30-39 40-49 =50
Classes diamétriques
Figure 16 : Répartition des individus par classes
diamétrique strate Ad
3.2.6. Etude de la diversité
Le tableau 7 présente les valeurs de trois indices de
diversité calculés dans chaque relevé et pour chaque
strate.
Tableau 7 : Indices de diversité pour chaque
relevé
|
Strate Ad
|
|
|
Strate A
|
|
Relevé
|
Shannon
|
Simpson
|
Fisher
|
Shannon Simpson Fisher
|
1
|
3,64
|
0,96
|
32,61
|
2,696
|
0,8772
|
14,53
|
2
|
3,77
|
0,97
|
33,07
|
3,077
|
0,9161
|
21,83
|
3
|
3,70
|
0,97
|
28,58
|
3,003
|
0,9208
|
16,31
|
4
|
3,45
|
0,96
|
20,73
|
3,011
|
0,9325
|
15,03
|
5
|
3,67
|
0,97
|
25,31
|
2,972
|
0,919
|
14,53
|
6
|
3,55
|
0,96
|
27,71
|
2,981
|
0,8902
|
19,21
|
7
|
3,31
|
0,94
|
17,80
|
3,108
|
0,9255
|
17,96
|
8
|
3,62
|
0,96
|
25,60
|
2,843
|
0,871
|
18,15
|
9
|
3,57
|
0,96
|
27,56
|
3,541
|
0,9638
|
34,22
|
10
|
3,74
|
0,97
|
32,22
|
3,466
|
0,962
|
29,57
|
11
|
3,60
|
0,96
|
30,80
|
3,251
|
0,9336
|
25,03
|
Moyenne
|
3,60
|
0,96
|
27,45
|
3,08
|
0,92
|
20,6
|
|
Nous avons calculé trois différents indices de
diversité pour l'ensemble des onze relevés. Les résultats
montrent que les indices de Shannon et de Simpson ne varient que très
légèrement le long de la surface d'inventaire. Leurs moyennes
donnent respectivement 3,60 et 0,96 bits pour les placettes de la strate Ad et
3,08 et 0,92 bits pour les relevés de la strate A.
La figure 17 montre la variation de l'indice de Fisher le
long de la surface d'inventaire. La valeur la plus faible s'observe au niveau
de la 7ème placette (17,8) et la valeur la plus
élevée est notée au niveau de la 2ème
parcelle (33,07) pour la strate Ad. En ce qui concerne la strate A, la valeur
la plus faible est indiquée dans le 1er et
5ème relevé avec 14,53 bits et la plus haute valeur
est obtenue dans le 9ème relevé (34,22).
1 2 3 4 5 6 7 8 9 10 11
Valens d 'Indica de Fsher
40,00
25,00
20,00
35,00
30,00
15,00
10,00
5,00
0,00
Fisher Ad Fisher A
Surface d'inventaire
Figure 17 : Variation de l'indice de diversité alpha
de Fisher le long de la surface d'inventaire
3.2.7. Distances floristiques entre les
relevés
Sans prêter attention aux espèces qui
caractérisent les onze relevés sur sable, nous les avons
classés selon leur composition floristique en procédant à
des ordinations, principalement la DCA. L'objectif étant de
caractériser les différences de diversité alpha du point
de vue floristique et d'évaluer l'impact de la distance
géographique dans la variation de la composition (en d'autre terme
étudier la diversité bêta).
Nous avons opté de présenter la DCA à
partir de la matrice de similarité de Bray-Curtis par l'indice
d'abondance. En effet, l'indice de similarité de Bray-Curtis ne donne
pas de poids aux espèces rares (Bray J.R & Curtis J.T, 1957).
L'analyse des résultats de la DCA peut conduire à
des observations ci-après :
Au niveau de la strate A : 3 groupes s'individualisent en
fonction de la similitude de leurs composants (relevés). Le groupe I
Correspond à l'ensemble des relevés réalisés dans
la zone d'interface sable-argile à Yoko (considérée comme
le point zéro), le groupe II renferme les transects
réalisés à 2,5 km du point zéro et enfin, le groupe
III regroupe les placeaux réalisés au-delà de la
rivière Biaro à environs 10 km de Yoko. On peut bien remarquer la
variation de la composition floristique en fonction de la distance croissante
allant de 0 à 10 km.
Axe 2
Figure 18 : DCA pour la strate A effectuée sur le
logiciel CANOCO, données d'abondance
-0.5
2.0
-0.5 Axe 1 2.5
Yoko
Ys4a
Ys6b
Ys1a
Ys2a Ys3a
Ys8b
Ys7b
Ys5b
I
II
Biaro
III
Bs1
Bs2
Bs3
Légende : Bs = relevés sur sable à Biaro
Ysa = relevés sur sable à Yoko dans la zone
d'interface Ysb = relevés sur sable à Yoko à plus ou moins
1 Km.
Axe 2
Figure 19 : DCA pour la strate Ad, réalisée
par le logiciel CANOCO, données d'abondance
-0.5
2.0
Yoko
Ys8
|
|
Ys3
Ys4 Ys2
Ys7 Ys5 Ys6
Ys1
|
|
|
Bs3
Bs1 Biaro
Bs2
|
|
|
|
-0.5 Axe 1 2.5
Relevés
Au niveau de la strate Ad par contre, on remarque
l'individualisation en 2 grands groupes : un à Yoko et un autre à
Biaro. Cette figure montre que pour le même type de sol, il n'y a pas de
différence floristique au sein d'un même bloc forestier pour la
strate Ad. Par contre on voit bien une distance floristique entre deux blocs
forestiers en fonction de la distance.
Les résultats de l'analyse de l'indice de
similarité de Bray-Curtis qui nous a permis d'obtenir ces 2 figures
ci-haut sont donnés dans l'annexe.
B. LA FORET SUR SOL ARGILEUX
3.3. Les ensembles structuraux
3.3.1. Composition et richesse spécifique
Au cours des inventaires réalisés dans la
forêt de sol argileux, nous avons inventorié 3521 individus
d'arbres correspondant à 213 espèces et morpho-espèces
identifiées réparties en 38 familles différentes. Ces
observations proviennent des douze relevés emboités dans une
surface de 12 ha pour les arbres de plus de 20 m de hauteur et 2,4 ha pour ceux
de hauteur compris entre 6-20 m. La liste des espèces pour chaque
ensemble structural est repris dans les annexes de ce travail.
La figure 20 ci-après représente la richesse
spécifique en termes de nombre d'espèces pour chaque ensemble
structurale dans la forêt établie sur sol argileux.
Richesse specifique
|
120 100 80 60 40 20 0
|
|
|
|
|
|
A a b c
Ensembles structuraux
Figure 20 : Analyse de la richesse spécifique selon
les ensembles structuraux
Légende : (A) élément propre de la
strate A, (a) régénération de la strate A présente
dans la strate Ad, (b) régénération de la strate A
présente dans Ad mais absente dans A et (c) élément propre
de la strate Ad.
L'analyse de cette figure montre que si on considère
les ensembles structuraux, l'ensemble de présent ou
l'élément propre de la strate A est plus riche en espèces
(102 espèces) que l'ensemble du présent ou
l'élément propre de la strate Ad (94 espèces).
De manière particulière, si l'on tient compte
de la contribution des espèces dans la strate Ad incluant
a (avec 76 espèces),
b (avec 14 espèces) et c
(avec 94 espèces) on se rend compte que l'ensemble de la
régénération de A appelé aussi «
élément du futur », contribue à 41,53% de la richesse
spécifique de cette strate alors que l'élément propre
représente 51,36%. La part de (c) est de 7,6%.
3.1.2. Renouvellement et
Régénération de la strate arborescente dominante
Les résultats obtenus dans cette analyse nous ont
permis de réfléchir sur le fonctionnement de cette forêt
par l'analyse de deux indices qui nous permettent de prévoir ce qui se
passera dans cette forêt dans l'avenir. Il s'agit des indices
ci-après :
· L'Indice de Renouvellement de la strate arborescente
dominante
I.R = a/a+b
IR = 76/76+14 = 0,84
· L'Indice de Régénération de la
strate arborescente dominante I.S = a+b/a+b+c
I.S = 76+14/76+14+94 = 0, 48
La valeur de l'indice de Renouvellement approche 1, ce qui
nous conduit à considérer que la forêt
étudiée évolue normalement, la strate arborescente de
cette forêt sera renouvelée par sa propre
régénération se trouvant actuellement dans la strate
Ad.
Par contre, l'indice de régénération
indique une valeur faible, ce qui traduirait un taux de
régénération assez faible de la strate arborescente
supérieure dans la forêt établie sur sol argileux.
3.4. Analyse floristique interstrate
Dans la florule de la forêt sur sol argileux nous avons
inventorié 1340 individus répartis dans 118 espèces et 30
familles au sein de la strate A. Au niveau de la strate Ad, 2181 individus
regroupés dans 183 espèces et 36 familles on été
comptés.
Dans cette forêt, les familles suivantes sont les plus
représentées en terme de nombre d'espèces, tant pour la
strate A que pour la strate Ad : Fabaceae, Euphorbiaceae, Malvaceae, Rubiaceae,
Moraceae, et Annonaceae.
3.4.1. Les familles représentatives
Le tableau 8 montre les familles les plus
représentées en espèces en fonction des strates
considérées.
Tableau 8 : Les familles représentatives selon les
strates
Strate A Strate Ad
Familles Nbre d'espèces Familles Nbre d'espèces
Fabaceae 30 Fabaceae 28
Euphorbiaceae 8 Malvaceae 18
Malvaceae 8 Euphorbiaceae 13
Meliaceae 8 Rubiaceae 13
Moraceae 6 Annonaceae 10
Annonaceae 5 Moraceae 10
Apocynaceae 5 Meliaceae 9
Clusiaceae 5 Sapotaceae 9
Sapotaceae 5 Ebenaceae 8
3.4.2. Abondance des espèces
Dans cette forêt de sol argileux, les espèces
les plus abondantes se démarquent en fonction de la strate. On note une
abondance élevée de Petersianthus macrocarpus (10,9%),
Julbernardia seretii (5,45%) et Trilepisium madagascariensis
(4,85%) dans la strate A. Tandis que dans la strate Ad ce sont Aidia
micrantha (7,24%), Staudtia gabonensis (3,85%) et
Petersianthus macrocarpus (3,35%) qui présentent une abondance
relative assez considérable.
Le tableau 9 présente pour chaque strate les
espèces ayant une abondance relative supérieure à 1%.
Tableau 9 : Espèces abondantes avec leurs valeurs
d'abondance relative (DR) et de dominance relative (DoR).
Strate A
|
|
|
Strate Ad
|
|
|
Espèces
|
DR
|
DoR
|
Espèces
|
DR
|
DoR
|
Petersianthus macrocarpus
|
10,90
|
10,05
|
Aidia micrantha
|
7,24
|
4,50
|
Julbernardia seretii
|
5,45
|
6,65
|
Staudtia gabonensis
|
3,85
|
3,27
|
Trilepisium madagascariensis
|
4,85
|
3,47
|
Petersianthus macrocarpus
|
3,35
|
4,55
|
Funtumia elastica
|
3,96
|
2,86
|
Drypetes likwa
|
3,30
|
2,96
|
Pericopsis elata
|
3,51
|
13,17
|
Strombosia pustulata
|
3,21
|
6,37
|
Musanga cecropioides
|
3,36
|
2,28
|
Trichilia gilgiana
|
3,12
|
2,54
|
Strombosiopsis tetrandra
|
3,06
|
1,67
|
Diospyros boala
|
2,93
|
1,81
|
Pseudospondias microcarpa
|
2,99
|
2,58
|
Guarea cedrata
|
2,61
|
2,45
|
Celtis tessmannii
|
2,91
|
2,02
|
Pycnanthus angolensis
|
2,52
|
3,04
|
|
|
|
Trilepisium
|
|
|
Uapaca guineensis
|
2,61
|
2,60
|
madagascariensis
|
2,52
|
2,63
|
Guarea cedrata
|
2,46
|
2,49
|
Coelocaryon preusii
|
2,38
|
2,07
|
Panda oleosa
|
2,31
|
1,96
|
Guarea thompsonii
|
1,88
|
2,05
|
Grewia pinnatifida
|
2,09
|
1,35
|
Anonidium mannii
|
1,74
|
3,77
|
|
Gilbertiodendron dewevrei
|
2,01
|
3,35
|
Myrianthus preussii
|
1,74
|
0,90
|
Strombosia grandifolia
|
2,01
|
1,67
|
Grossera multinervis
|
1,60
|
2,06
|
|
|
|
Pseudospondias
|
|
|
Margaritaria discoidea
|
1,94
|
1,80
|
microcarpa
|
1,56
|
2,38
|
Ricinodendron heudelotii
|
1,94
|
3,87
|
Gilbertiodendron dewevrei
|
1,51
|
1,13
|
Pycnanthus angolensis
|
1,79
|
1,48
|
Grewia pinnatifida
|
1,47
|
2,25
|
Tridesmostemon omphalocarpoides
|
1,72
|
1,49
|
Pancovia harmsiana
|
1,38
|
1,22
|
Grewia trinervia
|
1,64
|
1,18
|
Strombosia grandifolia
|
1,38
|
2,37
|
Pterocarpus soyauxii
|
1,57
|
2,24
|
Ochthocosmus africanus
|
1,33
|
0,78
|
Blighia welwitschii
|
1,49
|
1,41
|
Julbernardia seretii
|
1,28
|
1,73
|
Polyalthia suaveolens
|
1,49
|
0,91
|
Massularia acuminata
|
1,28
|
0,68
|
Alstonia boonei
|
1,42
|
1,68
|
Celtis tessmannii
|
1,24
|
2,02
|
Anonidium mannii
|
1,34
|
0,77
|
Hannoa klaineana
|
1,24
|
1,14
|
Zanthoxylum gilletii
|
1,34
|
1,46
|
Rinorea oblongifolia
|
1,24
|
1,25
|
Canarium schweinfurthii
|
1,04
|
2,14
|
Diospyros deltoidea
|
1,15
|
0,73
|
|
En terme de dominance relative, Pericopsis elata
(13,17%), Petersianthus macrocarpus (10,05%) et Julbernardia
seretii (6,65%) dominent dans la strate A ; tandis que Strombosia
pustulata (6,37%), Petersianthus macrocarpus (4,55%) et Aidia
micrantha (4,50%) présentent des valeurs de dominance plus
élevée dans la strate Ad.
L'indice d'importance des espèces (IVI) qui donne les
espèces qui caractérisent au mieux une entité floristique
indique qu'au niveau de la strate A (figure 21) ce sont Petersianthus
macrocarpus, Pericopsis elata, Julbernardia seretii, Trilepisium
madagascariensis, Funtumia elastica et Pseudospondias microcarpa
qui caractérise la forêt de sol argileux.
Mr
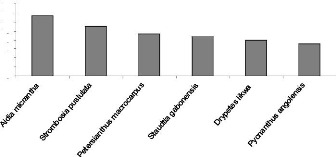
16
14
12
10
4
8
6
2
0
25
20
15
10
5
0

Figure 21 : Espèces caractéristiques de la
strate A sur sol argileux
Au niveau de la strate Ad par contre (figure 22) ce sont
Aidia micrantha, Strombosia pustulata, Petersianthus macrocarpus, Staudtia
gabonensis, Drypetes likwa et Pycnanthus angolensis qui
caractérisent cette forêt.
3.4.3. La surface terrière
La surface terrière est calculée pour chaque
relevé (placette) les valeurs obtenues auxquelles nous avons adjoint les
valeurs de D130, le nombre de pieds et des espèces sont
données dans les tableaux 10 (strate A) et 11 (strate Ad) ci-dessous.
Tableau 10 : Valeurs de D130 moyen, de la surface
terrière, de nombre de pieds et de nombre d'espèces pour la
strate A dans les 12 relevés réalisés
Relevés
|
Surface
cumulée
(ha)
|
D130 moyen
(cm)
|
ST
(m2/ha)
|
Pieds
(N)
|
Espèces
|
Espèces
cumulées
|
1
|
1
|
52,31
|
17,19
|
80
|
40
|
40
|
2
|
2
|
53,17
|
27,86
|
105
|
39
|
64
|
3
|
3
|
48,9
|
24,45
|
118
|
42
|
76
|
4
|
4
|
47,58
|
21,62
|
121
|
53
|
85
|
5
|
5
|
53,82
|
32,06
|
141
|
38
|
89
|
6
|
6
|
45,9
|
22,99
|
139
|
39
|
94
|
7
|
7
|
52,01
|
20,18
|
95
|
35
|
98
|
8
|
8
|
52,09
|
20,03
|
94
|
42
|
104
|
9
|
9
|
46,71
|
23,98
|
140
|
37
|
111
|
10
|
10
|
47,71
|
21,98
|
123
|
37
|
114
|
11
|
11
|
56,47
|
19,53
|
78
|
34
|
116
|
12
|
12
|
49,97
|
20,78
|
106
|
45
|
118
|
Moyenne
|
|
50,55
|
22,72
|
111,67
|
40,08
|
|
Ecart-type
|
|
3,25
|
4,026
|
22,30
|
5,11
|
|
CV
|
|
6,42
|
17,72
|
19,96
|
12,74
|
|
|
En moyenne, la surface terrière (ST) ramenée
à l'hectare donne 22,3 m2/ha pour une moyenne de 111,67 pieds
d'arbres qui totalisent aussi en moyenne 50,55 cm de diamètre. Le nombre
d'espèces moyen donne 40, 08.
A partir de ce tableau, nous avons évalué
l'accumulation de nombre d'espèces en fonction de l'augmentation de la
surface d'inventaire. Le résultat est consigné dans la figure 23
cidessous :
|
140
|
y = 45,189x0,4064
R2 = 0,9683
|
Especes cum ulees
|
120 100 80 60 40 20 0
|
|
|
|
1 2 3 4 5 6 7 8 9 10 11 12
|
|
Surface cumulée en ha
Figure 23 : Courbe aire-espèces pour la strate
A
Cette courbe aire-espèces est régulière
car le coefficient de variation R2 est élevé (0,9683),
ce qui montre que l'accumulation de nombre d'espèces augmente avec
l'augmentation de la surface d'inventaire.
Tableau 11 : Valeurs de D130 moyen, de la surface
terrière, de nombre de pieds et de nombre d'espèces pour la
strate Ad dans les 12 relevés réalisés
Relevés
|
Surface
cumulée
(ha)
|
D130 moyen
(cm)
|
ST
(m2/ha)
|
Pieds
(N)
|
Espèces
|
Espèces
cumulées
|
1
|
0,2
|
12,07
|
12,01
|
210
|
73
|
73
|
2
|
0,4
|
9,56
|
7,52
|
211
|
72
|
101
|
3
|
0,6
|
9,32
|
8,59
|
252
|
68
|
114
|
4
|
0,8
|
9,21
|
7,17
|
215
|
68
|
119
|
5
|
1
|
10,65
|
9,6
|
214
|
65
|
130
|
6
|
1,2
|
10,93
|
9,52
|
203
|
63
|
139
|
7
|
1,4
|
10,93
|
8,35
|
178
|
57
|
146
|
8
|
1,6
|
11,28
|
8,24
|
165
|
66
|
154
|
9
|
1,8
|
14,29
|
9,23
|
115
|
48
|
165
|
10
|
2
|
13,54
|
7,704
|
107
|
44
|
172
|
11
|
2,2
|
13,16
|
10,4
|
153
|
55
|
179
|
12
|
2,4
|
12,18
|
9,2
|
158
|
55
|
183
|
Moyenne
|
|
11,43
|
8,96
|
181,75
|
61,17
|
|
Ecart-type
|
|
1,67
|
1,35
|
43,60
|
9,31
|
|
CV
|
|
14,61
|
15,06
|
23,98
|
15,21
|
|
|
Pour la strate Ad, la surface terrière moyenne est de
l'ordre de 8,96 m2/ha et le diamètre moyen est de 1,67 cm
pour 181,75 pieds et 61,17 espèces en moyenne.
Ainsi la courbe d'accumulation des espèces en fonction de
la surface croissante se présente de la manière suivante :

200
180
160
140
120
100
80
especes cumulees
60
40
20
0
Somme de espèces cumulée
y = 74,819x0,3559
R2 = 0,9906
0,2 0,4 0,6 0,8 1 1,2 1,4 1,6 1,8 2 2,2 2,4
Surface cumulée
surface cumulée
Figure 24 : Courbe aire-espèces pour la strate
Ad
3.4.4. Fréquence des espèces
La fréquence des espèces dans la surface
d'inventaire a été calculée ; et pour la strate A seule
Petersianthus macrocarpus était présente dans les 12
relevés, ce qui représente une fréquence relative de
2,49%. Mais on a noté aussi une fréquence élevée
(11 relevés sur 12) des espèces ci-après : Celtis
tessmannii, Julbernardia seretii, Musanga cecropioides, Pseudospondias
microcarpa, Strombosia grandifolia et Trilepisium madagascariensis avec
2,28% chacune.
Au niveau de la strate Ad, sept espèces sont apparues
dans les 12 placettes, il s'agit de : Aidia micrantha, Staudtia gabonensis,
Drypetes likwa, Pycnanthus angolensis, Trilepisium madagascariensis,
Coelocaryon preussii et Pancovia harmsiana avec chacune 1,63%.
Les figures 25 et 26 présentent les fréquences de
ces espèces le long de la surface d'inventaire.
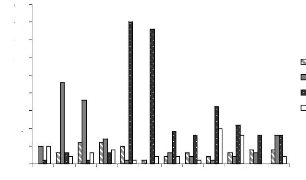
1 2 3 4 5 6 7 8 9 10 11 12
nombre d'individus par placette
45
40
25
20
35
30
15
10
5
0
Celtis tessmannii
Julbernadia seretii
Petersianthus macrocarpus Pseudospondias microcarpa
Placettes
Figure 25 : Fréquence des espèces le long de
la surface d'inventaire pour la strate A
Petersianthus macrocarpus est présente dans tous
les relevés mais avec une abondance élevée à partir
de 5ème jusqu'au 11ème relevé.
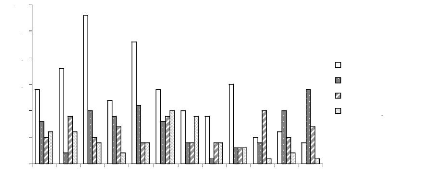
Aidia micrantha Staudtia gabonensis Drypetes likwa Coelocaryon
preusii
1 2 3 4 5 6 7 8 9 10 11 12
Nombre de pieds par placette
25
20
30
15
10
5
0
Placettes
Figure 26 : Fréquence des espèces le long de
la surface d'inventaire pour la strate Ad Aidia micrantha est
présente dans toutes les placettes et avec des densités
suffisantes.
3.4.5. Distribution diamétrique
C'est une caractéristique essentielle du peuplement.
Les figures 27 et 28 présentent les distributions diamétriques
pour chaque strate. Les deux strates ont une distribution
régulièrement décroissante. La strate A (figure 27) est
caractérisée par les individus de diamètre compris entre
30-49 cm. La strate Ad par contre présente un excès d'individus
de diamètre < 10 cm. Contrairement à ce qui se fait
habituellement (inventaire des arbres à D130 = 10 cm) ; notre
échantillonnage a pris en compte même les individus < 10 cm.
Notre analyse étant stratifiée, nous avons constaté que
certains individus bien qu'ayant un D130 < 10 cm atteignaient parfois une
hauteur suffisante pour être classer dans la strate arborescente
inférieure. Nous les avons donc considérées comme tel
malgré leur diamètre minime.
500
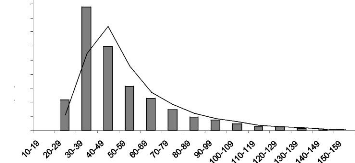
Nombre d'individus par classe
450
400
350
300
250
200
150
100
50
0
Classes diamétriques
Figure 27 : Répartition des individus par classes
diamétriques strate A
La lecture de cette figure montre une concentration des
espèces dans les classes diamétriques comprises entre 30 et 49
cm. La courbe de tendance moyenne mobile est concave, ce qui montre le
caractère héliophile de la plupart des espèces de la
strate A.
1400
Nombre d'individus par classe
1200
1000
800
600
400
200
0
<10 10-19 20-29 30-39 40-49
Classes diamétriques
Figure 28 : Répartition des individus par classe
diamétrique strate Ad
On remarque dans cette figure 28 une concentration de nombre
d'individus dans la classe < 10 cm.
3.4.6. Etude de la diversité
Tableau 12 : Indices de diversité pour chaque
relevé
|
|
Ad
|
|
|
A
|
|
Relevé
|
Shannon Simpson
|
Fisher
alpha
|
Shannon Simpson
|
Fisher
alpha
|
1
|
4,014
|
0,97
|
38,7
|
3,24
|
0,93
|
31,04
|
2
|
3,808
|
0,96
|
36,61
|
3,23
|
0,93
|
22,47
|
3
|
3,786
|
0,96
|
30,58
|
3,38
|
0,95
|
23,3
|
4
|
3,91
|
0,97
|
34,27
|
3,7
|
0,97
|
35,97
|
5
|
3,591
|
0,95
|
31,77
|
2,71
|
0,87
|
17,08
|
6
|
3,719
|
0,96
|
31,29
|
3,01
|
0,90
|
18,01
|
7
|
3,639
|
0,96
|
29
|
3,26
|
0,95
|
20,02
|
8
|
3,934
|
0,97
|
40,77
|
3,39
|
0,95
|
29,14
|
9
|
3,493
|
0,95
|
30,68
|
3,09
|
0,93
|
16,41
|
10
|
3,427
|
0,95
|
27,94
|
3,24
|
0,94
|
17,96
|
11
|
3,727
|
0,96
|
30,78
|
3,17
|
0,93
|
22,96
|
12
|
3,753
|
0,97
|
29,18
|
3,55
|
0,96
|
29,53
|
Moyenne
|
3,73
|
0,97
|
32,63
|
3,2
|
0,94
|
23,66
|
|
Les trois indices de diversité sont calculés
pour chaque relevé et par strate. Les indices de Shannon et de Simpson
ne varient que légèrement entre les relevés et entre
strates. Tandis que l'indice alpha de Fisher montre des écarts entre
relevés et même entre strates. Ces indices montrent qu'il existe
une hétérogénéité spécifique tant au
niveau de la strate A que de la strate Ad.
Leurs moyennes donnent respectivement 3,7 ; 0,97 et 32,63
bits pour la strate Ad et 3,2 ; 0,94 et 23,66 bits pour la strate A. Ce qui
traduit une grande hétérogénéité si l'on
considère l'indice de Fisher, de la strate Ad par rapport à la
strate A (figure 29).
1 2 3 4 5 6 7 8 9 10 11 12
Fisher alpha Ad Fisher alpha A
Valeurs d'indice de Fisher
45
40
25
20
50
35
30
15
10
5
0
Surface dinventaire
Figure 29 : Variation de l'indice de diversité alpha
de Fisher le long de la surface d'inventaire.
L'analyse de cette figure 29 montre la variation de l'indice de
Fisher le long de la surface d'inventaire. Le huitième relevé
présente une hétérogénéité
élevée au niveau de la strate A, tandis qu'au niveau de la strate
Ad c'est le quatrième relevé qui est le plus
hétérogène.
3.4.7. Distances floristiques entre les
relevés
Sans prêter attention aux espèces qui
caractérisent les douze relevés de sol argileux, nous les avons
classés selon leur composition floristique en procédant à
des ordinations, principalement la DCA. L'objectif étant de
caractériser les différences de diversité alpha du point
de vue floristique et d'évaluer l'impact de la distance
géographique dans la variation de la composition (en d'autre terme
étudier la diversité bêta).
Nous avons opté de présenter la DCA à
partir de la matrice de similarité de Bray-Curtis. En effet, l'indice de
similarité de Bray-Curtis ne donne pas de poids aux espèces
rares.
-0.2
Axe 2
1.4
Figure 30 : DCA de la strate A effectué par le
logiciel CANOCO, données d'abondance
-0.5 Axe 1 3.0
Ya1
Ya2
Ya3
Ya4
Ya8
Ba4
Ya7
Ya6
Ya5
Ba3
Ba2
Ba1
· La majorité des relevés tant pour le
site de Yoko que pour le site de Biaro est corrélée à
l'axe 2 qui explique les conditions des plaines disséquées
argileuses pour la strate A (figure 30). En effet les relevés de Biaro
(points noirs) et quelques relevés de Yoko (1, 2, 3, 5 et 7) se situent
dans ces conditions de plaines disséquées.
· Tandis que les autres sont corrélées
plutôt à l'axe 1 qui explique la situation d'un plateau
argileux.
· Au niveau de la strate Ad (figure 31) on remarque que les
relevés de Yoko et de Biaro forment des entités floristiques
spécifiques différentes.
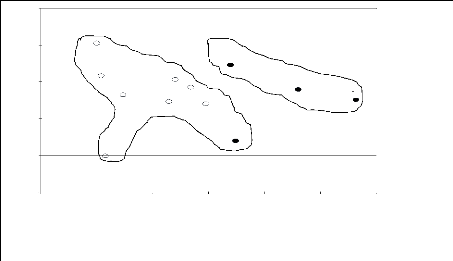
-0.5
Axe 2
2.0
Figure 31 : DCA de la strate Ad réalisé par le
logiciel CANOCO, données d'abondance
-0.5 Axe 1 2.5
Ya2
Ya4 Ya5
Ya6
Ya7 Ya8
Ya1
Ya3
Ba3
Ba4
Ba1 Ba2
3.4. Déterminisme de
l'hétérogénéité environnementale sur la
composition floristique
Dans les paragraphes précédents nous avions
caractérisé les variations de la composition floristique avec les
facteurs du milieu de manière indirecte. Pour une analyse directe, nous
avons réalisé une Analyse Canonique des Correspondances (CCA en
anglais), les axes d'ordination étant contraints par les variables
environnementales mesurées sur le terrain. L'ordination indirecte
confirme la démarcation entre les deux types de forêts.
La figure 32 montre les différentes corrélations
des relevés en fonction des variables environnementales prises en
considération. Tous les relevés effectués sur le sol
sableux ne sont expliqués que par cette variable (sable) ainsi que la
nature de topographie (plateau) tandis qu'au sein des relevés argileux,
retrouvés essentiellement dans des plaines disséquées, on
trouve certains autres qui sont liés à d'autres facteurs comme
l'hydromorphie du sol.
|
Ba Ba
|
|
|
|
|
Ba
|
Bs
|
|
|
Ba
|
|
Bs
|
|
Hydromorphie
|
Bs
|
|
Sable

Ys
Ys Ys
Ys
Ys
Ya
Ya
Ya Ya
Ya
Ya
Argile
Ya
Ya
YsTopographie
Ys
Ys
-1.5 Axe 1 1.5
1.0
Axe 2
-1.0
Figure 32 : Diagramme d'ordination de la CCA pour l'ensemble
des relevés.
Les données des analyses du sol de la zone de Yoko
étant disponibles, nous avons également réalisé une
CCA avec ces variables pour celle-ci seulement.
Nous avons réalisé une « forward selection
» à l'aide de test de Monte Carlo (999 permutations), disponible
sur le logiciel Canoco. De toutes les variables du sol analysées, le
taux d'argile, le taux de sable, le pH, la conductivité et le taux de
matière organique ont montrés des effets significatifs sur la
variance floristique après la réalisation de test de Monte Carlo.
On peut constater que le taux d'argile présente une corrélation
inverse au pourcentage de sable. Le pH et le taux de matière organique
montrent une corrélation positive avec le taux d'argile. Tandis que la
concentration en phosphore est fortement associée au sol sableux.
Cette ordination confirme la variance floristique entre les
deux types du sol dans la zone de Yoko. Les relevés sur sol argileux
sont bien corrélés aux taux d'argile, il semble qu'un effet
topographique démarque les relevés sur sol argileux : les
relevés YR2, YR6, YR7 et YR8 réalisés sur une plaine
argileuse disséquée s'expliquent aussi par la
conductivité, contrairement aux relevés YR13 , YR14, YR15 et YR
16 faits sur un plateau argileux. Les relevés sur sol sableux sont bien
corrélés au pourcentage de sable et forment un groupe
homogène (figure 33).
|
|
YR16
|
YR15
YR14 % a
YR13
%
|
|
YR11
YR12 YR9 ble YR10
osphore
|
YR1 YR5
|
YR4
YR3
|
YR2 YR7
YR6
YR8
|
Con
|
1.0
Axe 2
% s
-0.6
P
rgile pH
mat. O
ductivité
-1.0 Axe 1 1.0
Figure 33 : Diagramme d'ordination de la CCA pour la zone de
Yoko avec les données d'analyse de sol
3.5. Analyse de classification
En tenant compte du nombre d'espèces en commun
(données d'incidence), on remarque que les relevés les plus
proches dans l'espace, présentent de grandes ressemblances que c'est
soit pour la strate A (figure 34) que pour la strate Ad (figure 35). Ces
relevés présentent également des similitudes quant
à leurs compositions (données d'abondance, basées sur le
nombre d'individus par espèce).
Pour la strate A, le dendrogramme permet de déceler
dès la base 2 grands groupes : un constitué uniquement des
relevés sur sable dans la forêt de Yoko et un autre
constitué des relevés sur argile et des relevés sur sable
de la forêt de Biaro (figure 34).

|
|
|
|
|
|
Sable Yoko
Argile
Sable Biaro
|
Figure 34 : Dendrogramme regroupant les relevés selon
leur similarité floristique en termes de leur abondance pour la strate A
(Logiciel PAST, données d'incidence).
Au niveau de la strate Ad, le regroupement en deux grands
groupes semble être dicté par la distance géographique ;
les relevés de Biaro forment un bloc qui se démarque dès
la base du dendrogramme des relevés de Yoko. Même au niveau des
relevés de Yoko la subdivision en deux sous-groupes est aussi fonction
de la distance géographique mais aussi fonction du substrat car tous les
relevés sur sable se regroupent entre eux.
Similarity
-20
|
- '0
|
0
|
|
1 2 3 4 5 6 7 8 9 '0 11 2 13 14 16 16 17 13 19 20 21 22 23 24
|
|
|
|
|
|
Bs2
Bs1
Bs3
|
|
|
|
|
|
|
|
|
|
|
Ba3
Ba4
Ba1
Ba2
|
Biaro
|
|
|
|
|
Ys7
Ys8
Ys5
Ys6
Ys1
Ys3
Ys4
Ys2
|
Yoko
|
|
|
|
Ya3
Ya4
Ya1
Ya2
Ya5
Ya6
Ya7
Ya8
|
|
|
|
|
|
|
|
|
Figure 35 : Dendrogramme regroupant les relevés selon
leur similarité floristique en termes de leur abondance pour la strate
Ad (Logiciel PAST, données d'incidence).
Chapitre IV : DISCUSSION
Nous nous sommes intéressés aux formations
végétales des strates arborescentes dominante et dominée
des forêts de la Réserve forestière de Yoko et de Biaro. Le
dispositif d'échantillonnage a ciblé deux types de forêts
à savoir la forêt sur un sol sableux et une autre sur un sol
argileux. Toutefois il est important de signaler qu'il n'existe pas une
démarcation nette entre ces deux types de sol. En effet, Lomba et Ndjele
(1998) mentionnent que la forêt de Yoko à un sol qui
présente les caractéristiques reconnues aux sols de la cuvette
centrale congolaise, catégorie ferralitique du type Yangambi
généralement sablo-argileux et décrit par Kombele (2004).
Cette caractéristique sablo-argileux serait à la base des
interpénétrations de la composition floristique et de faible
différence de diversité observées dans nos
différents relevés.
Cependant, Vleminckx (2009) dans son étude sur les
facteurs déterminant l'organisation de la diversité
végétale dans les forêts tropicales humides du bassin
congolais a réalisé des comparaisons granulométriques
entre les sols sableux et argileux de la Réserve forestière de
Yoko. Ses résultats font ressortir une séparation nette et sans
recouvrement entre les deux courbes, mettant bien en évidence une
démarcation objective entre ces deux types de sol dans notre zone
d'étude (figure 36).
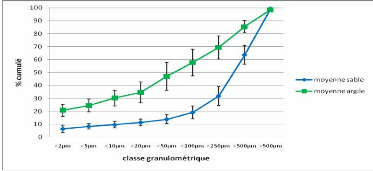
Figure 36 : Courbe d'accumulation des pourcentages
cumulés moyens en fonction de la catégorie de taille des
particules (Vleminckx, 2009).
4.1. Composition floristique et diversité
spécifique
Nous avons tenté d'évaluer la diversité
spécifique en tenant compte des ensembles structuraux ; les
résultats obtenus montrent qu'à l'échelle de nos
relevés, les espèces propres (élément propre) de la
strate arborescente supérieure sont les plus nombreuses et elles
contribuent de manière significative tant en nombre d'individus
qu'à la diversité globale de la florule tant pour la forêt
établie sur sol sableux que sur celle de substrat argileux. De
manière spécifique, si l'on considère l'ensemble
structural « arbre dominé » qui n'inclut que
l'élément propre plutôt que la « strate des
dominés » incluant également la
régénération de la strate A, on constante que ce sont
toujours les éléments de la strate A qui contribuent en grande
partie à la richesse spécifique de la strate des dominés.
La part de son élément propre ne représente que 40% de la
diversité.
|
Richesse specifique
|
120 100 80 60 40
|
|
|
|
|
|
Sable
Argile
|
|
20
0
|
|
|
|
A a b c
Ensembles structuraux
Figure 37 : Richesse spécifique comparée des
ensembles structuraux sur sable et sur argile
Les observations faites par Senterre (2005) dans les
forêts de Cameroun et de la Guinée équatoriale montrent des
résultats similaires. En considérant les ensembles structuraux il
a trouvé que l'ensemble structural « A » contribue à
31,8% de la diversité totale alors que l'ensemble Ad ne
représentait que 19,6% ; le reste étant constitué des
arbustes et herbacées.
Les mêmes observations ont été
rapportées par Nshimba (2008) à l'île Mbiye : 226
espèces pour la strate arbustive et 173 seulement pour la strate A
après celle des dominés.
Bien qu'il y ait une forte décroissance
spécifique à mesure qu'on évolue du sol vers la
canopée, on remarque tout de même que le nombre d'espèces
pour les strates A et Ad est toujours supérieur dans la forêt
établie sur sol argileux que celle établie sur sol sableux. Ce
qui nous permet de considérer le sol sableux a une action beaucoup plus
sélective que le sol argileux.
La diminution de la richesse spécifique observée
à hauteur de strate décroissante peut être aussi est une
conséquence de notre effort d'échantillonnage qui était
fixé en fonction des strates et non des ensembles structuraux, ainsi
donc l'ensemble structural des dominés était
sous-échantillonné que l'ensemble structural des dominants.
Il est important de signifier que dans l'ensemble de 249
espèces recensées dans le dispositif, 152 espèces sont
communes à tous les deux types forestiers. Cependant 97 autres
espèces n'existent chacune dans un seul type forestier selon la
répartition suivante :
- 61 espèces en forêt sur sol argileux dont 8 n'ont
pas été identifiées jusqu'au niveau de l'espèce
et
- 36 espèces en forêt sur sol sableux dont 3 n'ont
pas été identifiées jusqu'à l'espèce.
Il est nécessaire de signaler que vue les
caractéristiques propre de chaque entité, la répartition
des espèces présentées ci-dessous, ne concerne que la
forêt que cette étude a ciblée et ne peut forcement
être enregistrer dans d'autres forêts et sur les mêmes
supports colonisables. Les tableaux 13 et 14 présentent les
espèces propres de chaque type forestier.
Tableau 13 : Espèces propres à la forêt sur
sol sableux
|
Afzelia bipindensis
|
Lovoa trichilioides
|
|
Alchornea yambuyaensis
|
Manilkaria marcoleus
|
|
Anopyxis klaineana
|
Oxyanthus formosus
|
|
Apocynaceae 1
|
Pancovia laurentii
|
|
Apocynaceae 2
|
Rothmania sp.
|
|
Autranela congolensis
|
Strychnos sp.
|
|
Buchnerodendron speciosum
|
Synsepalum dulcificum
|
|
Cathormion altissimum
|
Synsepalum stipulatum
|
|
Chytranthus setosus
|
Tesmania africana
|
|
Cola lateritia
|
Tetraptera tetrapleura
|
|
Cola sciaphylla
|
Tetrorchidium didymostemon
|
|
Combretum lokele
|
Trichilia welwitschii
|
|
Dialium zenkeri
|
Turrea vogelii
|
|
Diospyros bipendensis
|
Turreanthus africanus
|
|
Elaeis guinensis
|
Vitex congolensis
|
|
Ficus sp
|
Xylopia phloiodora
|
|
Gilletiondendron mildibraedii
|
Xylopia sp.
|
|
Irvingia gabonensis
|
|
|
Isolona congolana
|
|
Tableau 14 : Espèces propres de la forêt sur sol
argileux
|
Aidia congolana
|
Hesteria parvifolia
|
|
Albizia adiantifolia
|
Inconnue 2
|
|
Albizia ferruginea
|
Inconnue 3
|
|
Albizia zygia
|
Inconnue 4
|
|
Alstonia congensis
|
Inconnue 5
|
|
Antidesma membraneceum
|
Inconnue 6
|
|
Beilschmieldia variabilis
|
Inconnue 7
|
|
Bombax buonopuozense
|
Khaya anthotheca
|
|
Bridelia ndellensis
|
Maesopsis eminii
|
|
Caloncoba crepiniana
|
Mammea africana
|
|
Caloncoba subtomentosa
|
Mimusops wanerkei
|
|
Campilospermum densiflorum
|
Mitragyna stipulosa
|
|
Cleistopholis glauca
|
Moraceae 1
|
|
Cleistopholis patens
|
Morelia senegalensis
|
|
Cola congolana
|
Morinda lucida
|
|
Cola louisii
|
Olax gambecola
|
|
Croton haumanianus
|
Pachyelasma tessmanii
|
|
Dinophora spenneroides
|
Pachystela excelsa
|
|
Dracaena arborea
|
Parkia bicolor
|
|
Dracaena sp.
|
Pericopsis elata
|
|
Drypetes louisii
|
Pychnathus marchalianus
|
|
Duboscia dewevrei
|
Rabdophyllum anoldianum
|
|
Entandrophragma utile
|
Rothmania lujae
|
|
Eriocoelum microspermum
|
Rothmania macrocarpa
|
|
Erythrophloeum suaveolens
|
Sorindea africana
|
|
Erythrina droogmansiana
|
Sorindea gilletii
|
|
Zantoxylum inaequalis
|
Triplochyton scleroxylon
|
|
Ficus exasperata
|
Uvariopsis congensis
|
|
Ficus mucuso
|
Vitex welwitschii
|
|
Garcinia ovalifolia
|
|
|
Grewia trinervia
|
|
|
Guibourtia demeusei
|
|
La lecture de ces deux tableaux montre qu'en termes des
espèces propres, la forêt établie sur sol argileux est plus
diversifiée que celle établie sur sol sableux.
4.1.1. Abondance relative comparée
L'analyse comparative des abondances relatives montre que
Scorodophloeus zenkeri est l'espèce qui a la plus grande
différence d'abondance relative entre les deux types d'habitats, et
qu'elle est la plus dominante sur sol sableux pour la strate A (figure 38)
tandis que Cola griseiflora marque cette différence au niveau
de la strate Ad (figure 39).
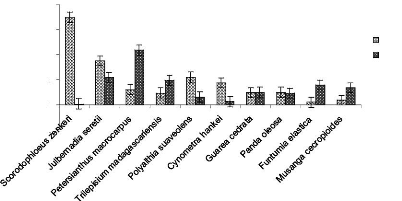
20
15
10
5
0
-5
Sable
Argile
Figure 38 : Abondances relatives moyennes des 10
espèces dominantes de la strate A (comparaison entre les deux types de
sols).
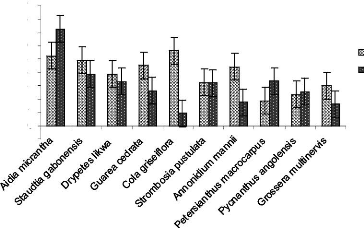
9
8
7
6
5
4
3
2
1
0
-1
sable
argile
Figure 39 : Abondances relatives moyennes des 10
espèces dominantes de la strate Ad (comparaison entre les deux types de
sols)
La dominance de Scorodophloeus zenkeri, de
Julbernadia seretii et même de Polyalthia suaveolens et
Cynometra hankei dans la strate A de la présente étude
semble être dictée par les facteurs sol et topographie. En effet
selon Vande weghe (2004) et Lebrun et Gilbert (1954) Scorodophloeus
zenkeri domine généralement les plateaux sabloneux et forme
avec Julbernadia seretii un noyau d'espèces dominantes dans
l'alliance OxystigmoScorodophloeion (Lebrun et Gilbert 1954)
appelée aussi « forêts semi-caducifoliés à
Scorodophloeus zenkeri ». Parmis les espèces
caractéristiques (élément propre) de la strate Ad Cola
griseiflora a montré une abondance et une fréquence
significative. Cette mésophanérophyte est typique de la strate
arborescente dominée de l'alliance OxystigmoScorodophloeion. Il
en est de même pour Aidia micrantha.
La dominance de Petersianthus macrocarpus et de
Pericopsis elata sur le sol argileux semble un peu surprénante.
Ces espèces ont été observées en très grande
densité et en agrégat dans les relevés
réalisés sur un plateau argileux près de la rivière
Biaro. Pseudospondias macrocarpus présente une fréquence
relative très marquée sur ce sol. Cette espèce est typique
des endroits hydromorphes.
4.1.2. Diversité spécifique
a. Comparaison entre substrats
Au total, 23 relevés emboîtés ont
été réalisés dont 16 dans la réserve
forestière de la Yoko et 7 dans la forêt de Biaro. De ces 23
placeaux, 11 ont été installés sur le sol sableux et 12
sur un substrat argileux. Sur un total de 6897 pieds d'arbres
inventoriés, 3376 arbres ont été inventoriés sur
sol sableux et 3521 sur sol argileux. De ces individus on a enregistré
107 et 158 espèces respectivement pour la strate A et Ad au sein de la
forêt de sol sableux, tandis que pour la forêt de sol argileux, on
a compté 118 espèces pour la strate A et 183 espèces pour
la strate Ad.
Ces résultats semble confirmer une diversité
spécifique élevée de la forêt sur argile tant pour
la strate A que pour la strate Ad. Mais soumis à un test statistique de
comparaison (ANOVA), on constante que les indices de diversité de
Simpson et de Fisher ne présentent pas une différence
significative entre ces deux types de forêts pour la strate A (figure 40)
(p-value : 0,1585 pour Simpson et 0,3284 pour Fisher). Toute fois le sol
argileux semble plus diversifié.
Ficher : p = 0.3284
argile sable
Fisher
15 20 25 30 35
Groupe
Simpson : p = 0,1585
argile sable
0.88 0.90 0.92 0.94 0.96
Simpson
Groupe
Figure 40 : Comparaison de la diversité moyenne
exprimée par les indices de Simpson et de Fisher Strate A (Logiciel
R).
Le même constat est fait sur la strate arborescente
inférieure sauf pour l'indice de diversité alpha de Fisher
où la différence s'est révélée
statistiquement significative (p-value : 0,0305*), le sol argileux ayant un
indice de diversité élevé que le sol sableux (figure
41).
Fisher : p = 0,0305*
Simpson : p = 0,2119
Groupe
Groupe
argile sable
0.945 0.950 0.955 0.960 0.965 0.970 0.975
Simpson
Fisher
20 25 30 35 40
argile sable
Figure 41 : Comparaison de la diversité moyenne
exprimée par les indices de Simpson et de Fisher Strate Ad (Logiciel
R)
b. Comparaison interstrate
Comparé entre strates, on observe une différence
significative de la richesse spécifique exprimée en fonction de
nombre d'espèces entre les strates, la strate arborescente
inférieure étant la plus diversifiée tant sur le substrat
sableux que sur le sol argileux (figure 42).
|
Nbre espèces : p = 1.13e -07***
|
|
Nbre espèces : p = 8.897e-07 ***
|
|
N bre.espece
|
30 35 40 45 50 55 60 65
|
|
N bre.espece
|
40 50 60 70
|
|
Dominant Dominé Dominant Dominé
Strate Groupe
Figure 42 : Comparaison de la richesse spécifique
strate A vs strate Ad sur le sol sableux. A gauche sol sableux et à
droite sol argileux (Logiciel R).
Le même constant s'observe lorsqu'on tient compte des
courbes d'accumulation des espèces le long de la surface d'inventaire.
Un écart significatif se remarque lorsqu'on compare l'accumulation des
espèces au niveau des strates tant sur sable que sur argile (figure
43).
|
Fsnices r.um ii 16AS
|
180 160 140 20 00 80 60 40 20 0
|
|
sable A sable Ad
|
1 2 3 4 5 6 7 8 9 10 11
Relevés
|
Fsn6ens cum nlAns
|
200 180 160 40 20 00 80 60 40 20 0
|
|
argile A argile Ad
|
1 2 3 4 5 6 7 8 9 10 11 12
Relevés
Figure 43 : Comparaison des courbes d'accumulation des
espèces, strate A vs strate Ad pour les deux types de sol.
Les indices de Simpson et de Fisher présentent
également une différence significative interstrate très
marquée tant sur sable que sur argile.
|
Indice de Fisher : p = 0,01348*
|
|
Indice de Simpson : p = 0,00023***
|
Strate Strate
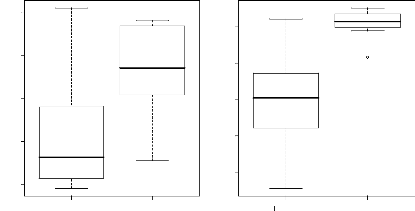
Simpson
0.88 0.90 0.92 0.94 0.96
Dominant Dominé
Dominant Dominé
Fisher
15 20 25 30 35
1 1 1 1 1
Figure 44 : Comparaison de la diversité
exprimée par les indices de Simpson et de Fisher strate A vs strate Ad.
A gauche, sol sableux et à droite sol argileux.
Axe2
2.5
-
05
-0.5 Axe1 3.5
YR10
YR12 YR11
YR13
YR9
YR
1 YR5
SABLE
YR3
YR4
YR6 YR7
BR22
BR21
YR2
YR8
BR20
BR23
YR16
YR15 YR14
ARGILE
BR19
BR18
BR17
Les différences statistiquement significatives
observées lors de ces comparaisons interstrates (grandes pour Ad et
faible pour A) s'expliquent comme nous l'avions dit auparavant par la
contribution des jeunes individus de la strate A présents dans la strate
Ad. Ils contribuent à hauteur de 60% à la diversité de la
strate des dominés. Mais si nous avions tenu plutôt compte des
ensembles structuraux, la tendance serait plutôt inversée.
4.2. Analyses d'ordinations et de classification
Les analyses d'ordinations et les dendrogrammes
effectués ont mis en évidence une différence dans la
composition floristique entre le sol sableux et le sol argileux surtout pour ce
qui concerne la strate arborescente supérieure. La DCA
réalisée pour la strate A montre pour le sol sableux une
démarcation nette entre les relevés de Yoko et de Biaro ; bien
qu'étant tous réalisés sur sol sableux. Donc Les distances
floristiques observées semblent corrélées avec les
distances géographiques ; en effet on remarque que les relevés
les plus proches géographiquement présentent des ressemblances et
forment des entités floristiques communes (figure 45).
Figure 45 : DCA pour l'ensemble des relevés de la
strate A (Logiciel CANOCO), avec les données d'abondance. En bleu,
relevés sur sable et en vert, relevés sur argile.
Figure 46 : DCA pour l'ensemble des relevés de la
strate Ad (Logiciel CANOCO), données d'abondance.
Axe 2
-0.5
2.0
-0.5 Axe 1 3.0
YR 2
YR
0
1
YR1 1
YR9
YR 4
YR
1
YR 5
YR 3
YR 8
YR6
YR 7
YR
2
YR1 5
YR14 9
BR2 0
YR1
3
BR1
YR16
BR2
1
BR22
BR2 3
7
BR1
BR1 8
Par contre, la DCA réalisée pour la strate Ad ne
semble pas montrer ces individualisations. On observe des
interpénétrations des relevés. Ceci montre que au niveau
des dominés, le gradient substrat ne semble pas démarquer les
relevés.
Le fait que la différentiation floristique ne soit pas
nette dans la forêt sur argile s'explique par fait que pour la plupart
des espèces de ces relevés, leur abondance spécifique
contribue faiblement à la discrimination des groupes ou encore, c'est du
à l'hétérogénéité des variables
environnementales corrélées à ce type de sol (le %
d'argile, le taux de la matière organique, la pH ainsi que la
conductivité sont tous corrélés fortement à ce type
de sol).
Au niveau de la strate Ad il semble que les densités
élevées des individus de la régénération
qu'on retrouve dans cette strate ne sont pas encore dans leurs conditions
écologiques optimales. En effet, c'est plus le taux d'éclairement
qui est le gradient discriminatoire qui permet la différentiation des
jeunes individus héliophiles se trouvant encore à ce stade.
d'abondance, basées sur le nombre d'individus par
espèce d'espèces communes, on remarque que les relevés les
plus proches dans l'espace présentent de grandes ressemblances, surtout
sur le sol argileux.
Les ordinations et classifications réalisées
dans le présent travail ont permis dans l'ensemble de distinguer deux
grands groupes de forêts : un groupe sur sol sableux et un autre sur sol
argileux.
Nshimba (2008), par les mêmes ordinations à
identifié trois grands groupes dans la végétation de
l'île Mbiye près de Kisangani : la forêt sur terre ferme au
sein de laquelle il définit 3 groupements, la forêt
périodiquement inondée où deux groupements sont
individualisés et la forêt marécageuse dans laquelle on
retrouve trois groupements. Les gradients discriminatoires principaux à
la base de ce regroupement sont l'hygrométrie, l'anthropisation, la
sécheresse et la variation de niveau d'eau du fleuve,
l'écosystème étudié étant insulaire.
Kouob (2009) dans son étude sur les groupements
végétaux des strates arborescentes des forêts matures de
terre ferme de la Réserve de Biosphère de Dja au Cameroun a
défini 5 groupements dont le déterminisme de
l'hétérogénéité est dicté par les
principales variables ciaprès : l'altitude, les pentes, le sable et
l'indice de continentalité.
Senterre dans son étude typologique dans les
forêts littorales de Guinée équatoriale et continentales
dans le mont Cameroun en a défini 10 communautés
végétales dont le déterminisme de
l'hétérogénéité végétale
était dicté par la pluviosité, l'Hygrométrie
(mesurée par le taux de recouvrement des Bryophytes sur les arbres),
l'altitude et la distance à l'océan.
Dans le présent travail, le déterminisme de
l'hétérogénéité des différents
groupes est dicté en général par la texture du sol
(sableux et argileux), l'hydromorphie du sol et la topographie.
Le nombre réduit des communautés
végétales reconnues dans cette étude se justifie par
quelques raisons à savoir : l'échantillonnage n'a ciblé
que deux strates arborescentes contigües ayant en commun un grand nombre
d'espèces de l'ensemble structural A et la démarcation moins
nette entre le sol sableux et le sol argileux.
CONCLUSION
La présente étude a porté sur la
typologie des forêts denses des environs de Kisangani. Elle a
consisté à mettre en évidence les communautés
végétales des strates arborescentes de ces forêts en
fonction de types de substrats colonisables (sable et argile) et de la distance
géographique séparant deux entités floristiques.
L'objectif principal de ce travail était d'identifier
les groupes des végétaux et partitionner la variance floristique
entre les facteurs environnementaux en présence.
La méthode utilisée pour la collecte des
données était celle des relevés décomposés
en sousrelevés structuraux emboîtés correspondant aux
principales strates de la forêt (relevé synusial).
Les données ont été
récoltées séparément par type de sol et strate par
strate pour estimer la contribution de chaque strate à la
variabilité et la diversité spécifique dans ces
forêts.
Pour chaque cas, les analyses ont porté sur deux
volets, à savoir : les analyses floristiques où nous avions
défini les espèces et les familles caractéristiques de
chaque groupe, leur densité et dominance ainsi que la diversité
spécifique ; les analyses d'ordinations et de classifications pour
montrer la similarité entre les divers relevés permettant de
confirmer les regroupements définis à priori et les
corrélations entre la floristique et les variables de
l'environnement.
A l'issue des inventaires réalisés, sur une
superficie de 23 hectares (dans les placeaux de 200x50m) pour la strate
arborescente supérieure et 4,6 hectares (dans les placeaux de 200x10m)
pour la strate arborescente inférieure, 6897 individus appartenant
à 249 espèces et 41 familles ont été
recensés. Dans la forêt sur sol sableux on a
dénombré 1290 individus, 107 espèces et 31 familles pour
la strate A et 2086 pieds 158 espèces et 36 familles pour la strate Ad.
Au niveau de la forêt sur sol argileux on a compté 1340 individus,
118 espèces et 30 familles pour la strate A, tandis que pour la strate
Ad on a obtenu 2181 pieds, 183 espèces et 36 familles.
La diversité spécifique n'a pas montré
des différences significatives entre les deux communautés (la
forêt sur sol argileux semble plutôt avoir une richesse
spécifique élevée) mais comparée en termes de
strates la diversité augmente à hauteur décroissante de
strate sur différent substrats.
Cette situation est la conséquence de l'apport des
jeunes individus de la strate arborescente présents dans la strate Ad et
qui contribuent à 60% à la diversité de cette strate.
Les analyses multivariées réalisées dans
cette étude ont révélé que les regroupements
observés ont été dictés par la nature du substrat
(très marqué au niveau de la strate A), mais aussi par la
distance géographique séparant les entités. Ces
résultats démontrent que les conditions édaphiques et
topographiques contribuent à déterminer la composition
floristique d'une entité floristique donnée.
En conclusion, au regard des résultats obtenus et y
égard aux questions que nous nous sommes posés, nous
considérons qu'en milieu forestier tropical, plus
précisément à l'intérieur d'un cycle forestier, il
existe un modèle spatial et interstrate.
Toutefois, ce modèle ne se définit pas en termes
de diversité spécifique, mais plutôt en termes de richesse
et de composition spécifique.
Afin d'approfondir l'étude du déterminisme
édaphique dans la variabilité floristique, nous suggérons
que des analyses pédologiques plus poussées
complétées par des inventaires aussi complets (incluant toutes
les strates de la végétation forestière) soient
réalisés pour mettre clairement en évidence la
variabilité des patterns de diversité dans les forêts
denses congolaises. En Outre, ces recherches doivent cibler les habitats les
plus homogènes que possibles et pour lesquels on devra considérer
des distances plus importantes afin de mieux évaluer l'effet de la
distance géographique.
Cette étude n'a évalué que la part des
variables environnementales (facteurs déterministes) dans la variation
de la composition floristique globale, l'analyse des facteurs historiques et
stochastiques devra également être approfondie ainsi que les
études ciblés (pour un certain nombre de taxons par exemple) pour
avoir une idée sur la structure et le fonctionnement des espèces
au sein d'un écosystème aussi complexe qu'est la forêt
dense tropicale.
REFERENCES BIBLIOGRAPHIQUES
Alexandre, D.Y. 1998. Caractère saisonnier de la
fructification dans une forêt hygrophile de la Côte d'Ivoire. Revue
d'Ecologie. 34 : 47-72.
Aubreville, A. 1957. Accord à Yangambi sur la nomenclature
des types africains de végétation. Bois et Forêts des
Tropiques. 57 : 23-27.
Aubreville, A. 1962. Position chorologique du Gabon. Flore du
Gabon, 3:3 - II Muséum Hist. Nat., Paris. 3 : 3-11.
Barbault, R. 1992. Ecologie des peuplements, structure, dynamique
et évolution, Masson, Paris, 273 p.
Barhès, B. 1991a. Influence des caractères
pédologiques sur la répartition spatiale de deux espèces
du genre Eperua (Caesalpiniaceae) en forêt guyanaise. Revue
d'Ecologie (la Terre et la Vie) 46 (4) : 303-320.
Batsielili, A. 2009. Phénologie et
régénération des espèces ligneuses arborées
en forêt tropicale humide : cas d'Afrormosia (Pericopsis elata)
et du Tola (Prioria balsamifera) en RDC. Mémoire de Master,
Engref, 54 p.
Blanc, P. 2002. Etre plantes à l'ombre des forêts
tropicales ; Nathan/VUEF, Paris, France, 432p.
Bouxin, G., 1977, Structure de la strate arborescente dans un
site de la forêt de montagne du Rwanda (Afrique centrale), in Vegetatio,
vol 33, 2/3 : 65-78 .
Bray J.R., & Curtis, J.T. 1957. An ordination of upland
forest communities of southern Wisconsin. Ecological Monographs 27 (4):
325-349.
Campbell P, Rivera P, Thomas D, Bourobou-bourobou H, Nzabi T,
Alonso A &Dallmeier F 2006. Floristic structure, composition and diversity
of an equatorialforest in Gabon. Bulletin of the Biological Society of
Washington 12: 243-252
Chave, J., 2000. Dynamique spatio-temporelle de la forêt
tropicale, thèse, in Ann. Phys. Fr.25, n°6: 1- 184
Chapman, C.A., 1997. Spatial and temporal Variability in the
structure of a tropical forest, Afr. Journal of ecology, vol. 35: 287-302.
Chesson, P., & Warner, P. 1981. Environnemental variability
promotes coexistence in lottery competitive systems. American Naturalist, 117
(6): 923-943.
CIFOR, CIRAD, CTB & MRAC. 2007. Quel avenir pour les
forêts de la République Démocratique du Congo ? Instruments
et mécanismes innovants pour une gestion durable des forêts. 83
p.
Clark, D. B., Clark, D. A. & Read, J.M. 1998 Edaphic
variation and the mesoscale distribution of tree species in a neotropical rain
forest. Journal of Ecology 86: 101- 112
Condit, R., Pitman, N., Leigh, E., Chave, J., Terborgh, J.,
Foster, R., Nunez, V., Aguilar, S., Vaencia, R., Villa, G., H.C., M.-L., Losos,
E., Hubbell, S. 2002. - Beta-diversity in tropical forest trees. Science, 295:
666-669.
Curtis, J.T. & McIntosh, R.P. 1950. The interrelation of
certain analytic and synthetic phytosociological characters. Ecology, Vol. 31,
n°3, pp. 434-455.
Dauby, G. 2007. Etude floristique et Biogéographique du
Parc National de la Pongara, Mém. DEA ULB, 86 p.
Doucet, J-L., 2003. L'alliance délicate de la gestion
forestière et de la biodiversité dans les forêts du centre
de Gabon. Thèse de doctorat, Faculté universitaire des Sciences
Agronomiques de Gembloux, 323 p.
Dupuy B., 1998. Bases pour une sylviculture en forêt
dense tropicale humide africaine. Montpellier, Cirad-Forêt & Projet
Forafri, 328 p., Vol. 4.
Fashing, P.J. & Mwangi, G., 2004, Spatial variability in
the vegetation structure and composition of an east African rain forest, in
African Journal of ecology, vol 9:189- 197 .
Flores, O. 2005. Déterminisme de la
régénération chez quinze espèces d'arbres tropicaux
en forêt guyanaise: les effets de l'environnement et de la limitation par
la dispersion. Thèse. Université de Montpellier II, 231 p
Fongnzossié, F.E., Tsabang, N., Nkongmeneck, B.A.,
Nguenang, G.M., Auzel, P., Christina, E., Kamou, E., Balouma, J.M., Apalo, P.,
Mathieu, H., Valbuena, M. et Valère, M., 2008. Les peuplements d'arbres
du sanctuaire à gorilles de Mengamé au sud Cameroun, Tropical
Conservation Science, Vol 1 (3) : 204-221.
Forget, P.M., 1997a Effet of microhabitat on sead fate and
seedling perfomance in two rodent dispersed tree species in rain forest in
French Guiam. Journal of Tropical Ecology 12: 751-761.
Fournier & Sasson, 1983. Ecosystème : Structure,
Fonctionnement, Evolution. Collection d'écologie 21, Masson Paris,
2éme édition, 447 p.
Gaston, K. 2000. Global patterns in biodiversity. Nature, 405 :
220-227.
Gérard, P. 1960. Etude de la forêt dense à
Gilbertiodendron dewevrei dans la Région de
l'Uélé. Publ. INEAC, Sér. Sc. 87:1-159.
Gillet, F. 2000. La phytosociologie synusiale
intégrée. Guide méthodologique, Université de
Neuchâtel, 68 p.
Guillaumet, J.L. 1967. Recherches sur la végétation
et la flore de la région du Bas-Cavally (Côte d'ivoire), 20 : 247
p. Paris, Mémoires ORSTOM.
Guillaumet, J.L. & Kahn, F. 1979.- Description des
végétations forestières tropicales. Approche morphologique
et structurale. Candollea. 34(1) : 109-131.
Hardy, O. & Sonke, B. 2004. Spatial pattern analysis of
tree species distribution in a tropical rain forest of Cameroon: assessing the
role of limited dispersal and niche differentiation. Forest Ecology and
Management, 197 (1/3): 191-202.
Harms, K. E., Condit, R., Hubbell, S.P., & Foster, R.B.
2001. Habitat associations of trees and shrubs in a 50-ha neotropical forest
plot. Journal of Ecology (Oxford). 89 (6): 947- 959.
Hubell, S. P. 2001. The unified neutral theory of biodiversity
and biogeography. Monograph in population biology. Princeton university Press,
Oxford.
Hubell, S. P. 2005. Neutral theory in communiting ecology and the
hypothesis of functional equivalence. Functional Ecology, 19 (1): 166-172.
Hutchings, M.J., John, E.A. et Stevart, A.T.A. 1999. The
Ecological consequences of environment heterogeneity. School of Biological
Sciences, University of Sussex, 434p.
Hutchinson, G. 1961. The paradox of the plankton. American
Naturalist, 95: 137-147.
IUCN, 1989. La conservation des écosystèmes
forestiers d'Afrique Centrale. Gland, Suisse et Cambridge, Royaume-Uni,
IUCN.
Kelly, C. & Bowler, M. 2002. Coexistence and relative
abundance in forest trees. Nature, 417:437-440.
Kombele, 2004. Diagnostic de la fertilité des sols dans
la cuvette centrale congolaise. Cas des séries Yangambi et
Yakonde, Thèse de doctorat, Faculté universitaire des
sciences agronomiques de Gembloux, 424 p.
Kouob, B, S. 2009. Organisation de la diversité
végétale dans les forêts matures de terre ferme du sud-est
Cameroun. Thèse Université Libre de Bruxelles, 188 p.
Lebrun, J. & Gilbert, G. 1954. Une classification
écologique des forêts du Congo. Publ. INEAC, Série Sc.
N° 63 : 89 p.
Lejoly, J., Lisowski, S. & Ndjele, M. 1988. Les plantes
vasculaires de Sous Région de Kisangani et de la Tshopo. Catalogue
informatisé. Doc. Polycopié Fac. Sc. ULB. 136p.
Lejoly, J. 1993. Méthodologie pour les inventaires
forestiers (partie flore et végétation). AGRECO-CTFT, Bruxelles,
53 p.
Lomba, B. 2007.Biodiversité des ligneux dans la
Réserve forestière de Yoko, Mém. DES, Fac. Sci. UNIKIS 60
p.
Lomba B. L. & Ndjele M.-B., 1998. Utilisation de la
méthode de transect en vue de l'étude de la phytodiversité
dans la Réserve de Yoko (Ubundu, R.D. Congo). Faculté des
Sciences de l'Université de Kisangani. Annales (11), 35-46.
Longman, K.A., & Jenik, J., 1974. Tropical forest and ist
environment in Ewer, D.W. & Gwenne, M.D. (éd), Tropical Ecology
Series, Longman Group Limited, London, 169p.
Lubini, A. 1982. Végétation messicole et post
culturale de Kisangani et de la Tshopo (Haut Zaïre). Thèse de
Doctorat, UNIKIS, Fac. Sciences: 489 p.
Lubini, A. 1997. La végétation de la Réserve
de la biosphère de Luki. Opera Bot. Belg. 10: 155p.
MacArthur, R. & Levins, R. 1967. The limiting similarity,
convergence and divergence of coexisting species. American Naturalist, 101:
377-385.
Mate, M., 2001. Croissance, phytomasse et minéralomasse
des haies des légumineuses améliorantes en cultures en
allées à Kisangani (République Démocratique du
Congo), Thèse inédite, Fac. Sc., ULB, 235p.
Mosango, M. 1990. Contribution à l'étude
botanique et biogéochimique de l'écosystème forêt en
région équatoriale (île Kongolo, Zaïre). Thèse
de doct. ULB. Labo. Bot. Syst. & Phyt. 442 p.
Ndjele, M.B. 1988. Les éléments
phytogéographiques endémiques dans la flore vasculaire du
Zaïre. Thèse de doct. ULB. Labo. Bot. Syst. & Phyt. 528 p.
Nshimba, S-M. 2005. Etude floristique, écologique et
phytosociologique des forêts inondées de l'île Mbiye
à Kisangani, (R.D.Congo), DEA, ULB, 101 p.
Nshimba, S-M. 2008. Etude floristique, écologique et
phytosociologique des forêts de l'île
Mbiyé à Kisangani, R. D. Congo. Thèse,
Université Libre de Bruxelles, 272 p.
Nyakabwa, M. 1982.
Phytocénose de l'écosystème urbain de Kisangani.
Thèse de Doct.
Unikis, Fac.Sc. Vol. 1,2 & 3. 998 p.
Oldeman, A.A. 1974. L'architecture de la forêt
guyanaise. Mémoires de l'ORSTOM, No 73, 204 p.
Oldeman, A.A. 1990. Forests: elements of silvology.
Springer-verlag Berlin, Heidelberg, Germany ; 624 p.
Palmer, M. 1994. Variation in species Richness-Towards a
unification of hypotheses. Folia Geobotanica & Phytotaxonomica, 29 (4):
511-530.
Pascal, J.-P. & Pélissier R. 1996. Structure and
floristic composition of a tropical evergreen forest in south-west India.
Journal of Tropical Ecology 12: 191-214.
Parmentier, I. 2003. Etude de la végétation des
inselbergs de la forêt dense d'Afrique centrale atlantique. Thèse
de doctorat, Université Libre de Bruxelles, Laboratoire de Botanique
systématique et de Phytosociologie, 93 p.
Pauwels, L. 1993. Nzayilu, N'TI. Guide des arbres et arbustes de
la région de Kinshasa-Brazzaville, Jard. Bot. Nat. belg. 493 p.
Poorter, L., Bongers, F., Kouamé, F. N' &
Hawthorne, W. D. 2004. Biodiversity of West African Forests. An Ecological
Atlas of Woody Plant Species. Nat. Herbarium of Nederland, 521p.
Proctor, J., Anderson, J.M., Chai, P. & Vallack, H.W.
1983. Ecological studies in four contrasting lowland rain forests in Gunung
Mulu National Park, Sarawak. I. Forest environment, structure and floristics.
Journal of Ecology, 71, 237-260.
Reitsma, J.M. 1988. Végétation forestière du
Gabon. The Tropenbos Fondation. Ede, the Netherlands, 142 p.
Richards, P.W. 1952. The rain forest, an ecological study,
Cambridge University Press, 450 p. Ricklefs, R. 1997. Environnemental
heterogeneity and plant species: a hypothesis. American Naturalist, 111:
377-381.
Ricklefs, R. 2004. A comprehensive framework for global patterns
in biodiversity. Ecology Letters 7 (1): 1-15.
Rollet, B. 1974. L'architecture des forêts denses humides
sempervirentes de plaines : Paris, CTFT, 298 p.
Rollet, B. 1979. Application des diverses méthodes
d'analyse de données à des inventaires
forestiers détaillés levés en forêt
tropicale. Oecol. Plant. 14 (3) : 319-344.
Rondeux, J. 1999. La mesure des arbres et des peuplements
forestiers. Presse universitaire de
Gembloux, Belgique, 521 p.
Schnell, R. 1976. Introduction à la
phytogéographie des pays tropicaux. Vol III. La flore
et
Végétation de l'Afrique tropicale. 1è partie :
Paris, Gauthier-Villars. 459 p.
Schnell, R. 1987. La flore et la végétation de
l'Amérique tropicale. Tome I. Généralités, les
flores, les formations forestières et les formations mésophiles,
éd. Masson, New York, 480 p.
Senterre, B. 2005. Recherches méthodologiques pour la
typologie de la végétation et la Phytogéographie des
forêts denses d'Afrique Tropicale. Thèse de doct. ULB. Labo. Bot.
Syst. & Phyt. 343 p.
Sonké, B. 1998. Etudes floristiques et structurales des
forêts de la Réserve de Faune du Dja (Cameroun). Thèse de
doct. ULB. Labo. Bot. Syst. & Phyt. 276 p.
Sys, C., 1960. Carte des sols et de la
végétation du Congo Belge et du Rwanda-Burundi. Notice
explicative de la carte des sols du Congo Belge et du Rwanda-Burundi. Publ.
I.N.E.A.C., Bruxelles, 84p.
Tailfer, Y. 1989. La forêt dense d'Afrique Centrale.
Identification pratique des principaux arbres. Agence de Coopération
culturelle et Technique et CTA, Wageningen, Tome 1 (456 p) et 2 (1271 p).
Tuomisto H., Ruokoleinen k. & Yli-halla M. 2003. Dispersal,
environment, and floristic variation of western Amazonian forests. Science 299:
241-244.
Trochain, J.L., 1980. Ecologie végétale de la zone
intertropicale non désertique, Univ. Paul Sabatier, Toulouse.
Trochain, J.L. 1951. Nomenclature et classification des types de
végétation de l'Afrique tropicale. Bull. I.E.C. 2: 9-18.
Vande weghe, J.P. 2004. Forêts d'Afrique Centrale. La
nature et l'homme. Éd. Lannoo SA Tielt-Belgique. 367 p.
Vleminckx, J. 2009. Facteurs déterminant l'organisation
de la diversité végétale des strates supérieures
dans les forêts tropicales humides du bassin congolais. Mémoire
ULB, 88p.
Walker, B.H. 1995. Conservising Biological diversity throught
ecosystem resilience Conservation Biology, 9: 747-752.
Walter, H. 1975. Vegetation of the earth and Ecological System of
the Geo-biosphere. Springer-Verlag., New-York, pp. 25-35.
Wilks, M.C. & Issembé, Y.A. 2000. Guide pratique
d'identification: les arbres de la Guinée
équatoriale, Région continentale. Projet CUREF,
Bata, Guinée Equatoriale, 546 p. Wright, S. 2001. Plant diversity in
tropical forest: a review of mechanisms of species
coexistence. Oecologia, 130: 1-14.
Annexes
A. Liste des espèces
Tableau 1 : Liste de toutes les espèces et familles
inventoriées dans le cadre de ce travail TB : type biologique, DP :
distribution phytogéographique et TD : Type de diaspore.
|
TB
|
DP
|
TD
|
Espèces
|
|
Acanthaceae
|
|
McPh
|
BGC
|
Ballo
|
Thomandersia congolana De Wild. & Th.Dur.
|
|
Agavaceae
|
|
MsPh
|
-
|
-
|
Dracaena arborea (Willd.) Link
|
|
MsPh
|
-
|
-
|
Dracaena sp
|
|
Anacardiaceae
|
|
MsPh
|
BGC
|
Sarco
|
Antrocaryon nananii De Wild.
|
|
MsPh
|
OGC
|
Sarco
|
Lannea welwitschii (Hiern.) Engl.
|
|
MsPh
|
AT
|
Sarco
|
Pseudospondias microcarpa (A. Rich.) Engl.
|
|
McPh
|
BGC
|
Sarco
|
Sorindeia africana (Engl.) Van Der Veken
|
|
McPh
|
BGC
|
Sarco
|
Sorindeia gilletii De Wild.
|
|
Annonaceae
|
|
MsPh
|
BGC
|
Sarco
|
Anonidium mannii (Oliv.) Engl. & Diels
|
|
MsPh
|
BGC
|
Sarco
|
Cleistopholis glauca Pierre ex Engl. & Diels
|
|
MsPh
|
OGC
|
Sarco
|
Cleistopholis patens (Benth.) Engl. & Diels
|
|
McPh
|
-
|
-
|
Inconnue7
|
|
MsPh
|
-
|
-
|
Isolona congolana (De Wild. & Th. Dur.) Engl.
Diels
|
|
MsPh
|
BGC
|
Sarco
|
Isolona hexaloba (Pierre) Engl. & Diels
|
|
MgPh
|
BGC
|
Sarco
|
Monodora angolensis Welw.
|
|
MsPh
|
OGC
|
Sarco
|
Monodora myristica (Gaertn.) Dunal
|
|
MgPh
|
BGC
|
Sarco
|
Polyalthia suaveolens Eng. & Diels
|
|
MsPh
|
BGC
|
Sarco
|
Uvariopsis congensis Robyns & Ghesq.
|
|
MsPh
|
BGC
|
-
|
Uvariopsis congolana (De Wild.) R.E. Fries
|
|
MgPh
|
AT
|
Sarco
|
Xylopia aethiopica (Dunal) A. Rich.
|
|
MsPh
|
BGC
|
Sarco
|
Xylopia phloiodora Mildbr.
|
|
MsPh
|
-
|
-
|
Xylopia sp
|
|
Apocynaceae
|
|
MsPh
|
OGC
|
Pogo
|
Alstonia boonei De Wild.
|
|
MsPh
|
OGC
|
-
|
Alstonia congensis Engl.
|
|
MsPh
|
-
|
-
|
Apocynaceae1
|
|
MsPh
|
-
|
-
|
Apocynaceae2
|
|
MsPh
|
OGC
|
Sarco
|
Funtumia africana (Benth.) Stapf
|
|
MsPh
|
OGC
|
Pogo
|
Funtumia elastica Preuss) Stapf
|
|
McPh
|
BGC
|
-
|
Hunteria mayumbensis Pichon
|
|
McPh
|
OGC
|
Sarco
|
Pleiocarpa pycnantha (K. Schum.) Stapf
|
|
Arecaceae
|
|
MsPh
|
Pa
|
Sarco
|
Elaeis guinensis Jacq.
|
|
Burseraceae
|
|
MgPh
|
OGC
|
Sarco
|
Canarium schweinfurthii Engl.
|
|
MsPh
|
BGC
|
Ballo
|
Dacryodes yangambiensis Louis ex Troupin
|
|
Cecropiaceae
|
|
MsPh
|
OGC
|
Sarco
|
Musanga cecropioides R. Br.
|
|
Chrysobalanaceae
|
|
MsPh
|
AM
|
-
|
Chrysobalanus icaco L. subsp. Atacorensis (A. Chev.) F.
White
|
|
MgPh
|
OGC
|
Sarco
|
Maranthes glabra (Oliv.) Prance
|
|
MgPh
|
OGC
|
Sarco
|
Parinari excelsa Sabine subsp. Holstii (Engl.) Grahan
|
|
Clusiaceae
|
|
McPh
|
OGC
|
Sarco
|
Allanblachia floribunda Oliv.
|
|
MsPh
|
-
|
Sarco
|
Garcinia chromocarpa Engl.
|
|
MgPh
|
-
|
Sarco
|
Garcinia epunctata Stapf
|
|
MsPh
|
OGC
|
Sarco
|
Garcinia kola Heckel
|
|
MsPh
|
AT
|
Sarco
|
Garcinia ovalifolia Oliv.
|
|
MgPh
|
OGC
|
Sarco
|
Garcinia punctata Oliv.
|
|
MgPh
|
OGC
|
Sarco
|
Mammea africana Sabine
|
|
MgPh
|
AA
|
Sarco
|
Symphonia globulifera L. f.
|
|
Combretaceae
|
|
MsPh
|
BGC
|
Ptero
|
Combretum lokele Liben
|
|
MsPh
|
-
|
-
|
Pteleopsis hylodendron Mildbr.
|
|
Ebenaceae
|
|
MsPh
|
BGC
|
Sarco
|
Diospyros bipendensis Gurke
|
|
MsPh
|
BGC
|
Sarco
|
Diospyros boala De Wild.
|
|
MsPh
|
CFC
|
Sarco
|
Diospyros chrysocarpa F. White
|
|
MsPh
|
BGC
|
Sarco
|
Diospyros crassiflora Hiern
|
|
MsPh
|
CFC
|
Sarco
|
Diospyros deltoidea F. White
|
|
MsPh
|
CFC
|
Sarco
|
Diospyros hoyleana F. White subsp. Angustifolia F.
White
|
|
MsPh
|
BGC
|
Sarco
|
Diospyros iturensis (Gurke) R. Let. & F White
|
|
MsPh
|
BGC
|
Sarco
|
Diospyros melocarpa F. White
|
|
MsPh
|
-
|
Sarco
|
Diospyros sp
|
|
Euphorbiaceae
|
|
NPh
|
BGC
|
Ballo
|
Alchornea yambuyaensis De Wild.
|
|
MsPh
|
OGC
|
Sarco
|
Antidesma lanciniatum Mull. Arg.
|
|
MsPh
|
OGC
|
Sarco
|
Antidesma membranaceum (Mull. Arg.) J. Léonard
|
|
McPh
|
OGC
|
Sarco
|
Bridelia ndellensis Beille
|
|
MsPh
|
OGC
|
Sarco
|
Cleistanthus mildbraedii Jabl.
|
|
MsPh
|
BGC
|
Sarco
|
Croton haumanianus J. Léonard
|
|
MsPh
|
AT
|
-
|
Grossera multinervis
|
|
MsPh
|
-
|
-
|
Inconnue3
|
|
MsPh
|
CFC
|
-
|
Lingelshelmia frutescens Pax
|
|
MsPh
|
OGC
|
Sarco
|
Macaranga monandra Mull. Arg.
|
|
MsPh
|
OGC
|
Sarco
|
Macaranga spinosa Mull. Arg.
|
|
MsPh
|
AT
|
Sarco
|
Margaritaria discoidea (Baill.) Webster
|
|
MsPh
|
OGC
|
Sarco
|
Ricinodendron heudelotii (Baill.) Pierre ex Heckel
|
|
MsPh
|
OGC
|
Sarco
|
Tetrorchidium didymostemon (Baill.) Pax & K.
Hoffm.
|
|
MsPh
|
OGC
|
Sarco
|
Uapaca guinensis Mull. Arg.
|
|
Fabaceae
|
|
MsPh
|
BGC
|
Baro
|
Afzelia bipindensis Harms
|
|
MsPh
|
AT
|
Baro
|
Albizia adiantifolia (Schumach.) W.f. Wight
|
|
MsPh
|
OGC
|
scléro
|
Albizia ferruginea (Guill. & Perr.) Benth.
|
|
MgPh
|
OGC
|
baro
|
Albizia gummifera (J. f. Gmel) c.a. Sm.
|
|
MsPh
|
OGC
|
baro
|
Albizia zygia (DC.) Macbride
|
|
MsPh
|
OGC
|
Ballo
|
Anthonotha fragrans (Bak. f.) Exell & Hillcoat
|
|
MsPh
|
OGC
|
Ballo
|
Anthonotha macrophylla P. Beauv.
|
|
MgPh
|
BGC
|
baro
|
Aphanocalyx cynometroides Oliv.
|
|
McPh
|
OGC
|
-
|
Baphia pubescens Hook. f.
|
|
MsPh
|
OGC
|
-
|
Cathormion altissimum (Hook. f.) Hutch. & Dandy
|
|
MgPh
|
BGC
|
baro
|
Copaifera mildbraedii Harms
|
|
MgPh
|
BGC
|
baro
|
Cynometra alexandri C.h. Wright
|
|
MgPh
|
BGC
|
baro
|
Cynometra hankei Harms
|
|
MsPh
|
OGC
|
baro
|
Dialium corbisieri Staner
|
|
MsPh
|
CFC
|
baro
|
Dialium excelsum Louis ex Steyaert
|
|
MsPh
|
BGC
|
baro
|
Dialium pachyphyllum Harms
|
|
MsPh
|
CFC
|
baro
|
Dialium pentandrum Louis ex Steyaert
|
|
MsPh
|
BGC
|
baro
|
Dialium zenkeri Harms
|
|
MgPh
|
AT
|
Ballo
|
Erythrophleum suaveolens (Guill. & Perr.) Bren.
|
|
MsPh
|
OGC
|
-
|
Erytrhrina droogmansiana De Wild. & Th. Dur
|
|
MgPh
|
BGC
|
baro
|
Gilbertiodendron dewevrei (De Wild.) J.
Léonard
|
|
MgPh
|
-
|
-
|
Gilletiodendron mildbraedii (Harms) Vermoesen
|
|
MsPh
|
BGC
|
pléo
|
Guibourtia demeusei (Harms) J. Léonard
|
|
MsPh
|
-
|
-
|
Inconnue2
|
|
MsPh
|
-
|
-
|
Inconnue5
|
|
MgPh
|
BGC
|
Ballo
|
Julbernadia seretii ((De Wild.) Troupin
|
|
MsPh
|
BGC
|
Ballo
|
Millettia drastica Welw. Ex Bak.
|
|
MgPh
|
BGC
|
Ballo
|
Pachyelasma tesmanii (Harms) Harms
|
|
MsPh
|
AT
|
Ballo
|
Paramacrolobium coeruleum (Taub.) J. Léonard
|
|
MsPh
|
OGC
|
Sarco
|
Parkia bicolor A. Chev.
|
|
MsPh
|
AT
|
Sarco
|
Parkia filicoidea Welw. Ex Oliv.
|
|
MsPh
|
OGC
|
Ballo
|
Pentacletra macrophylla Benth.
|
|
MgPh
|
OGC
|
Sarco
|
Pericopsis elata (Harms) Van Meeuwen
|
|
MgPh
|
OGC
|
Ballo
|
Piptadeniastrum africanum (Hook. f.) Brenam
|
|
MgPh
|
BGC
|
Ballo
|
Prioria balsamiferum
|
|
MgPh
|
BGC
|
ptero
|
Prioria oxyphyllum
|
|
MgPh
|
BGC
|
ptero
|
Pterocarpus soyauxii Taub.
|
|
MsPh
|
-
|
-
|
Schotia romii
|
|
MgPh
|
BGC
|
baro
|
Scorodophloeus zenkeri Harms
|
|
MsPh
|
BGC
|
Ballo
|
Tessmannia africana Harms
|
|
MsPh
|
OGC
|
baro
|
Tetraptera tetrapleura (Thonn.) Taub.
|
|
MsPh
|
CFC
|
Ballo
|
Xylia ghesquierei Robyns
|
|
Flacourtiaceae
|
|
McPh
|
AT
|
Sarco
|
Barteria nigritiana Hook. f.
|
|
McPh
|
BGC
|
Sarco
|
Buchnerodendron speciosum Gürke
|
|
McPh
|
AT
|
Sarco
|
Caloncoba crepiniana (De Wild. & Th. Dur.) Gilg
|
|
McPh
|
CFC
|
Sarco
|
Caloncoba subtomentosa Gilg
|
|
Huaceae
|
|
McPh
|
BGC
|
-
|
Afrostyrax lepidophyllus Mildbr.
|
|
MsPh
|
BGC
|
-
|
Hua gaboni Pierre ex De Wild.
|
|
Irvingiaceae
|
|
MgPh
|
OGC
|
Sarco
|
Irvingia gabonensis (Aubry-lecompte ex O'rorke)
Baill.
|
|
MgPh
|
BGC
|
Sarco
|
Irvingia grandifolia (Engl.) Engl.
|
|
MgPh
|
OGC
|
Sarco
|
Klainedoxa gabonensis Pierre
|
|
Lauraceae
|
|
MsPh
|
CFC
|
Sarco
|
Beilschmiedia gilbertii Robyns & Wilczek
|
|
MsPh
|
CFC
|
Sarco
|
Beilschmiedia Variabilis Robyns & Wilczek
|
|
Lecythidaceae
|
|
McPh
|
OGC
|
Sarco
|
Napoleonaea vogelii Hook. & Planch.
|
|
MgPh
|
BGC
|
Sarco
|
Petersianthus macrocarpus (P. Beauv.)
|
|
Lepidobotryaceae
|
|
MsPh
|
BGC
|
Sarco
|
Lepidobotrys staudtii Engl.
|
|
Ixonathaceae
|
|
MsPh
|
OGC
|
Sarco
|
Ochthocosmus africanus Hook. f.
|
|
Loganiaceae
|
|
Ph gr
|
-
|
-
|
Strychnos sp
|
|
Malvaceae
|
|
MgPh
|
-
|
-
|
Bombax buonopuozense P. Beauv. Subsp reflexum (Sprague)
A. Robyns
|
|
MsPh
|
OGC
|
Sarco
|
Chlamydocola chlamydantha (K. Schum.) Bodard
|
|
McPh
|
CFC
|
Sarco
|
Cola bruneelii De Wild.
|
|
McPh
|
BGC
|
Sarco
|
Cola congolana De Wild. & Th. Dur.
|
|
McPh
|
CFC
|
Sarco
|
Cola digitata Mast.
|
|
MsPh
|
BGC
|
Sarco
|
Cola gigantea A. Chev.
|
|
MsPh
|
BGC
|
Sarco
|
Cola griseiflora De Wild.
|
|
MsPh
|
BGC
|
Sarco
|
Cola lateritia K. Schum.
|
|
McPh
|
CFC
|
Sarco
|
Cola louisii R. Germain
|
|
McPh
|
BGC
|
Sarco
|
Cola marsupium K. Schum.
|
|
McPh
|
CFC
|
Sarco
|
Cola sciaphila Louis ex R. Germ.
|
|
MsPh
|
OGC
|
Sarco
|
Desplatsia dewevrei (De Wild. & Th. Dur.)
|
|
MsPh
|
OGC
|
Sarco
|
Duboscia dewevrei
|
|
MsPh
|
OGC
|
Sarco
|
Grewia pinnatifida Mast.
|
|
MsPh
|
OGC
|
Sarco
|
Grewia pubescens P. Beauv.
|
|
MsPh
|
CFC
|
Sarco
|
Grewia trinervia De Wild.
|
|
McPh
|
-
|
-
|
Inconnue6
|
|
MgPh
|
BGC
|
ptero
|
Pterigota bequaertii De Wild.
|
|
McPh
|
BGC
|
Sarco
|
Scaphopetalum thonneri De Wild. & Th. Dur.
|
|
MgPh
|
BGC
|
Sarco
|
Sterculia bequaertii De Wild.
|
|
MsPh
|
AT
|
Sarco
|
Sterculia tragacantha Lindl.
|
|
MsPh
|
-
|
-
|
Triplochyton scleroxylon
|
|
Melastomataceae
|
|
McPh
|
OGC
|
-
|
Dinophora spenneroides Benth.
|
|
Meliaceae
|
|
MsPh
|
AA
|
Sarco
|
Carapa procera DC.
|
|
MgPh
|
OGC
|
ptero
|
Entandrophragma angolense C. DC.
|
|
MgPh
|
OGC
|
ptero
|
Entandrophragma candollei Harms
|
|
MgPh
|
OGC
|
ptero
|
Entandrophragma cylindricum (Sprague) Sprague
|
|
MgPh
|
OGC
|
ptero
|
Entandrophragma utile (Dawe & Sprague) Sprague
|
|
MsPh
|
OGC
|
Sarco
|
Guarea cedrata (A. Chev.) Pellegr.
|
|
MsPh
|
BGC
|
Sarco
|
Guarea laurentii De Wild.
|
|
MsPh
|
OGC
|
Sarco
|
Guarea thompsonii Sprague & Hutch.
|
|
MgPh
|
OGC
|
ptero
|
Khaya anthotheca (Welw.) C DC.
|
|
MgPh
|
OGC
|
ptero
|
Lovoa trichilioides Harms
|
|
MsPh
|
BGC
|
Sarco
|
Trichilia gilgiana Harms
|
|
MsPh
|
BGC
|
Sarco
|
Trichilia prieureana Juss. Subsp vermoesensii J.j. De
Wild.
|
|
MsPh
|
BGC
|
Sarco
|
Trichilia rubescens Oliv.
|
|
MsPh
|
BGC
|
Sarco
|
Trichilia welwitschii C. DC.
|
|
P gr v
|
OGC
|
Sarco
|
Turraea vogelii Hook. f. ex Benth
|
|
MsPh
|
OGC
|
Sarco
|
Turraeanthus africanus (Welw.) Pellegr.
|
|
Moraceae
|
|
MsPh
|
OGC
|
Sarco
|
Antiaris toxicaria Leschenault
|
|
MsPh
|
AA
|
Sarco
|
Ficus exasperata Vahl
|
|
MsPh
|
AT
|
Sarco
|
Ficus mucuso Welw. Ex Ficalho
|
|
MsPh
|
-
|
Sarco
|
Ficus sp
|
|
MsPh
|
-
|
-
|
Inconnue4
|
|
MgPh
|
OGC
|
Sarco
|
Milicia excelsa (Welw.) C.C. Berg.
|
|
McPh
|
-
|
-
|
Moraceae Tanzanie
|
|
MsPh
|
OGC
|
Sarco
|
Myrianthus arboreus P. Beauv.
|
|
McPh
|
BGC
|
Sarco
|
Myrianthus preusii Engl.
|
|
MsPh
|
OGC
|
Sarco
|
Treculia africana Decne var. africana
|
|
MgPh
|
OGC
|
Sarco
|
Trilepisium madagascariensis D.C.
|
|
Myristicaceae
|
|
MsPh
|
CFC
|
Sarco
|
Coelocaryon preusii Warb.
|
|
MsPh
|
CFC
|
Sarco
|
Pycnanthus marchalianus Ghesq.
|
|
MsPh
|
OGC
|
Sarco
|
Pycnanthus angolensis (Welw.) Exell
|
|
MsPh
|
BGC
|
Sarco
|
Staudtia gabonensis Warb.
|
|
Ochnaceae
|
|
McPh
|
CFC
|
Sarco
|
Campylospermum claessensii (De Wild.) Farron
|
|
McPh
|
AT
|
Sarco
|
Campylospermum densiflorum (De Wild. & Th. Dur.)
Farron
|
|
McPh
|
OGC
|
Sarco
|
Rhabdophyllum arnoldianum (De Wild. & Th. Dur.) Van
Tiegh.
|
|
Olacaceae
|
|
McPh
|
BGC
|
Sarco
|
Aptandra zenkeri Engl.
|
|
MsPh
|
BGC
|
Sarco
|
Diogoa zenkeri (Engl.) Exell & Mend.
|
|
MsPh
|
OGC
|
Sarco
|
Heisteria parvifolia Smith
|
|
NPh
|
OGC
|
Sarco
|
Olax gambecola Baill.
|
|
MgPh
|
OGC
|
Sarco
|
Ongokea gore (Hua) Pierre
|
|
MsPh
|
OGC
|
Sarco
|
Strombosia grandifolia Hook. f. ex Benth.
|
|
MsPh
|
CFC
|
Sarco
|
Strombosia nigropunctata J. Louis & J.
Léonard
|
|
MgPh
|
OGC
|
Sarco
|
Strombosia pustulata Oliv. Var pustulata
|
|
MsPh
|
BGC
|
Sarco
|
Strombosiopsis tetrandra Engl.
|
|
Pandaceae
|
|
McPh
|
CFC
|
Sarco
|
Microdesmis yafungana J. Léonard
|
|
MsPh
|
OGC
|
Sarco
|
Panda oleosa Pierre
|
|
Puntranjivaceae
|
|
MsPh
|
BGC
|
Sarco
|
Drypetes gossweileri S. Moore
|
|
MsPh
|
CFC
|
Sarco
|
Drypetes leonensis Pax var. glabrata
|
|
MsPh
|
CFC
|
Sarco
|
Drypetes likwa J. Léonard. Nomen
|
|
MsPh
|
CFC
|
Sarco
|
Drypetes spinosodentata J. Léonard
|
|
Rhamnaceae
|
|
MsPh
|
OGC
|
Sarco
|
Maesopsis eminii Engl.
|
|
Rhizophoraceae
|
|
MsPh
|
OGC
|
Sarco
|
Anopyxis klaineana (Pierre) Engl.
|
|
Rubiaceae
|
|
McPh
|
BGC
|
Sarco
|
Aidia congolana (De W. & Th. D.) E. Pet.
|
|
McPh
|
-
|
-
|
Aidia macroura
|
|
McPh
|
BGC
|
Sarco
|
Aidia micrantha (K. Schum.) F. White
|
|
McPh
|
CFC
|
-
|
Lasianthus batangensis K. Schum.
|
|
McPh
|
OGC
|
-
|
Leptactinia pynaertii De Wild.
|
|
McPh
|
OGC
|
Sarco
|
Massularia acuminata (G. Don) Bullock ex Hoyle
|
|
MsPh
|
OGC
|
Sarco
|
Mitragyna stipulosa (DC.) O. Ktze
|
|
MsPh
|
OGC
|
-
|
Morelia senegalensis A. Rich. ex DC.
|
|
MsPh
|
OGC
|
Sarco
|
Morinda lucida Benth.
|
|
MgPh
|
OGC
|
Sarco
|
Nauclea diderrichii (De Wild.) Merril
|
|
McPh
|
OGC
|
scléro
|
Oxyanthus formosus Hook. f. ex Planch
|
|
McPh
|
CFC
|
Sarco
|
Pausinystalia pynaertii De Wild.
|
|
McPh
|
OGC
|
Sarco
|
Rothmannia longiflora Salisb.
|
|
McPh
|
OGC
|
Sarco
|
Rothmannia lujae (De Wild.) Keay
|
|
McPh
|
OGC
|
Sarco
|
Rothmannia macrocarpa (Hiern) Keay
|
|
McPh
|
-
|
Sarco
|
Rothmannia sp.
|
|
Rutaceae
|
|
MsPh
|
BGC
|
Sarco
|
Fagara inaequalis Engl.
|
|
MsPh
|
BGC
|
Sarco
|
Fagara macrophylla (Oliv.) Engl.
|
|
Sapindaceae
|
|
MgPh
|
OGC
|
Sarco
|
Blighia welwitschii (Hiern) Radlk.
|
|
MsPh
|
-
|
Sarco
|
Chytranthus setosus Radlk.
|
|
McPh
|
BGC
|
Sarco
|
Eriocoelum microspermum Radlk. Ex de Wild.
|
|
MsPh
|
BGC
|
Sarco
|
Pancovia harmsiana Gilg.
|
|
MsPh
|
BGC
|
Sarco
|
Pancovia laurentii (De Wild.) Gilg ex De Wild.
|
|
Sapotaceae
|
|
MsPh
|
-
|
-
|
Aningeria altissima (A. Chev.) Aubr. & Pellergr.
|
|
MsPh
|
BGC
|
Sarco
|
Autranela congolensis (De Wild.) A. Chev.
|
|
MsPh
|
AT
|
Sarco
|
Chrysophyllum africanum A. DC.
|
|
MsPh
|
BGC
|
Sarco
|
Chrysophyllum lacourtianum De Wild.
|
|
MsPh
|
OGC
|
Sarco
|
Donella pruniformis (Pierre ex Engl.) Aubr. &
Pellegr.
|
|
MsPh
|
-
|
-
|
Inconnue1
|
|
MsPh
|
CFC
|
Sarco
|
Manilkara malcoleus Louis
|
|
MsPh
|
-
|
Sarco
|
Mimusops wanerckei Engl.
|
|
MsPh
|
CFC
|
Sarco
|
Omphalocarpum injoelense De Wild.
|
|
MgPh
|
BGC
|
Sarco
|
Pachystela excelsa De Wild.
|
|
MsPh
|
-
|
Sarco
|
Synsepalum dulcificum (Schum) Baill.
|
|
MsPh
|
OGC
|
Sarco
|
Synsepalum stipulatum (Radlk.) Engl.
|
|
MsPh
|
CFC
|
Sarco
|
Synsepalum subcordatum De Wild.
|
|
MsPh
|
BGC
|
Sarco
|
Tridemostemon omphalocarpoides Engl.
|
|
Simaroubaceae
|
|
MgPh
|
OGC
|
Sarco
|
Hannoa klaineana Pierre & Engl.
|
|
Ulmaceae
|
|
MgPh
|
AT
|
Sarco
|
Celtis mildbraedii Engl.
|
|
MgPh
|
AM
|
Sarco
|
Celtis gomphophylla Bak.
|
|
MgPh
|
-
|
Sarco
|
Celtis tessmannii Rendle
|
|
Verbenaceae
|
|
MsPh
|
OGC
|
Sarco
|
Vitex congolensis De Wild. & Th. Dur.
|
|
MsPh
|
BGC
|
Sarco
|
Vitex welwitschii Gürke
|
|
Violaceae
|
|
McPh
|
OGC
|
Ballo
|
Rinorea oblongifolia (C.h. Wright) Marquand ex Chipp
|

Quelques photos illustrant les travaux de terrain au
cours de notre recherche
Aidia micrantha : Caractéristique de la strate Ad
Campylospermum claessensii
Matérialisation d'un relevé floristique

Spécimen de Clamydophytum aphyllum Mildbr.
(Balanophoraceae) dans le sous-bois de Yoko

Séchage des herbiers sur le terrain

Laboratoire et gîtes d'accueil des chercheurs
réhabilités par le projet REAFOR à Yoko.

Campement de fortune lors d'une sortie de terrain.


