Chapitre 3 : Elimination du cuivre par
précipitation sur base d'une aqueuse acidulée.
3.1. Notions :
Dans les traitements hydrométallurgiques des oxydes et des
sulfures, les transformations de précipitation en phase aqueuse
sont :
- La précipitation d'hydroxydes, d'oxydes et de
carbonates
- La précipitation des sulfures à partir des
solutions aqueuses de leurs sels par l'hydrogène sulfuré. Comme
agent précipitant, on utilise souvent le sulfhydrate de sodium ou le
sulfure d'hydrogène. En outre cette méthode est très
complexe et sa faisabilitén'est pas facilitée par la nature de la
toxicité du sulfure d'hydrogène. Elle nécessite donc une
atmosphère de travail à très haut risque.
- La précipitation des métaux par réduction
des sels en solution aqueuse par l'hydrogène sous pression.
- La cémentation.
Les deux premières transformations des
précipitations homogènes par réduction acido - basique.
La précipitation des métaux par réduction
des sels et par cémentation est une précipitation
hétérogène.
3.2. Précipitation du cuivre
Le domaine d'existence des
précipités de cuivre sous forme d'hydroxyde peut être
déterminé à partir du diagramme de Pourbaix pour le
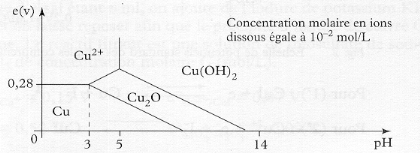
cuivre. Le graphique 1.2 représente le diagramme potentiel - PH du
cuivre (diagramme de Pourbaix) pour une concentration molaire du cuivre en ion
dissous égale à 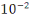 mole par litre. mole par litre.
Les espèces en solution à
prendre en considération dans chaque cas du degré d'oxydation du
cuivre sont : le cuivre du degré d'oxydation 0, l'ion cuivreux 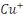 et l'oxyde cuivreux et l'oxyde cuivreux 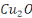 pour le degré d'oxydation 1, l'ion cuivrique pour le degré d'oxydation 1, l'ion cuivrique 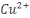 et l'hydroxyde Cu(OH) 2 pour le degré d'oxydation 2. et l'hydroxyde Cu(OH) 2 pour le degré d'oxydation 2.
Dans les équilibres acido-basique, en
fixant la valeur maximale à 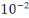 mole pour la concentration totale de mole pour la concentration totale de 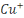 et et 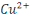 les équilibres acido basiques hétérogènes
sont : les équilibres acido basiques hétérogènes
sont :
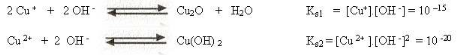
Les couples oxydo réducteurs sont :
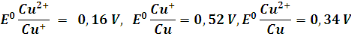
Graphique 1.2 Diagramme de Pourbaix simplifié du
cuivre.
Les facteurs qui influencent la
précipitation sont :
- La nature du réactif précipitant
- La température
- Les espèces possibles du métal en solution
aqueuse
- Le PH du milieu réactionnel
- Le potentiel régnant dans le milieu
réactionnel
Pour obtenir les précipités
hydroxydes du cuivre, il faudra se localiser sur base des paramètres de
travail dans la zone de stabilité de Cu(OH) 2.
Nous signalerons en outre que les réactions
de précipitation du cuivre sous forme d'hydroxyde sont :
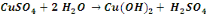
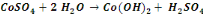
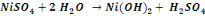
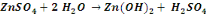
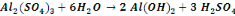
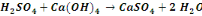
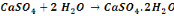
Ces réactions sont d'application pour un concentré
(minerai) ayant en son sein les éléments caractérisant la
minéralisation du Katanga minier.
| 


