Les protéases de la coagulation et de la
fibrinolyse possèdent d'importants domaines non catalytiques liés
au côté N-terminal du domaine protéase ce qui les distingue
des simples protéases. Le rôle de ces domaines est de permettre la
liaison des protéases à leur substrat, l'activation en enzyme,
l'interaction avec les cofacteurs et inhibiteurs, et à travers ces
interactions, de réguler les cascades de la coagulation et de la
fibrinolyse. Ces régions sont essentielles à la
spécificité de ces enzymes. On en distingue 4 principaux types :
les kringles, les domaines vitamino K dépendants liant l'ion Calcium,
les domaines en doigts, et les domaines du type facteurs de croissance. Ces 4
types de domaines correspondent à des unités
génétiquement autonomes qui auraient fusionné avec les
domaines protéases à différentes
époques de l'évolution ( Figure 14)
L'importante similitude de séquence des 5
kringles du plasminogène suggère qu'ils sont apparus par
duplication intra-génique. Le même phénomène est
évoqué pour les 2 kringles du t-PA. D'ailleurs, le
plasminogène et ses 2 activateurs sont plus étroitement
apparentés entre eux qu'avec aucune autre protéine de la
coagulation 141.
Les études de comparaison de séquence
et les prédictions de structure secondaires ont montré que
pendant l'évolution, les kringles ont conservé leur architecture
générale et ont divergé vers la liaison à diverses
protéines à partir d'un module ancestral commun, (probablement
représenté par le matériel génétique codant
pour le K4 du plasminogène) spécialisé dans la liaison aux
protéines. Leurs différences de spécificité
fonctionnelle sont dues à des modifications de conformation à la
suite substitutions d'acides aminés 156
Les gènes de l'apo(a) et du
plasminogène sont étroitement apparentés et proviennent
probablement d'une duplication récente du gène du
plasminogène suivie de la délétion des exons codant pour
les kringles 1 à 3, et de la multiplication des kringles 4 126.
L'apoprotéine(a) apparaît comme un membre récent de
la "super-famille" des protéases de la coagulation et de la fibrinolyse.
Au cours de l'évolution, l'émergence de nouvelles
protéines se fait souvent par duplication de gènes puis
modification de séquence pour donner une nouvelle fonction.
Par des calculs basés sur le taux des
substitutions de nucléotides dans les régions non traduites des
gènes R de la globine des primates, l'émergence
de l'apo(a) serait survenue il y a 40 millions d'années, au moment d'une
divergence phylogénique chez les primates. D'ailleurs la Lp(a) a
été mise en évidence chez certains primates non humains
(où elle se
Thèse Docteur Pharmacie La lipoprotéine Lp(a) :
son intérêt dans l'interprétation du bilan lipidique Dr
GUIMONT MC 92/271 Lipides, Lipoprotéine (a),
Hyperlipoprotéinémie, Athérosclérose, Lipids,
Lipoprotein, Lpa, Hyperlipoproteinemia, Atherosclerosis
Thèse Docteur Pharmacie La lipoprotéine Lp(a)
: son intérêt dans l'interprétation du bilan lipidique Dr
GUIMONT MC 93/271 Lipides, Lipoprotéine (a),
Hyperlipoprotéinémie, Athérosclérose, Lipids,
Lipoprotein, Lpa, Hyperlipoproteinemia, Atherosclerosis
révèle polymorphe comme chez l'homme) et
pas chez d'autres, ni dans plusieurs autres espèces où on l'a
cherché (lapin, rat, bovins).
La comparaison des cDNA de l'apo(a) humaine et du
singe rhésus entre eux et avec ceux du plasminogène
révèle que les 2 apo(a) sont très proches et
possèdent la même homologie avec le plasminogène. Les
différences observées concernent le kringle 5 qui est absent de
l'apo(a) du singe, et le nombre de kringles 4 qui est plus important chez
l'homme 157.
La découverte de la Lp(a) chez le
hérisson (d'Europe puis d'Afrique) 158,
confirmée récemment par le clonage du gène
159 a suscité plusieurs réflexions
:
- l'apo(a) serait peut être apparue avant la
divergence des principaux ordres de mammifères et n'aurait
été conservée que chez certains primates et dans de rares
espèces.
- l'apo(a) serait apparue plus d'une fois au cours de
l'évolution des mammifères. Ceci a été
récemment confirmé par comparaison des séquences d'ADN et
par analyses phylogéniques. L'apo(a) humaine est apparue par duplication
du gène du plasminogène pendant l'évolution récente
des primates, il y a environ 40 millions d'années. Par contre l'apo(a)
de type "multi kringles 3", qu'on retrouve chez le hérisson, a
évolué par duplication indépendante du même
gène il y a 80 millions d'années. Le gène du
plasminogène a donc subi pendant l'évolution, 2 duplications
indépendantes ayant produit 2 formes d'apo(a) dans 2 groupes
d'espèces très éloignées phylogéniquement
160
- certaines espèces pourraient
sécréter de la Lp(a), d'autres non 153 .
Le clonage du gène de l'apo(a) du hérisson
montre que l'apo(a) du hérisson est différente de l'apo(a)
humaine. Les gènes sont apparus indépendamment par multiplication
de domaines différents du gène du plasminogène. L'apo(a)
humaine résulte de la multiplication du kringle 4 du plasminogène
qui contient 6 cystéines, et l'avant dernier dernier kringle 4
possède une 7ème cystéine permettant la liaison à
l'apoB. Par contre l'apo(a) du hérisson provient d'une duplication du
gène du plasminogène avec délétion de tous les
domaines structuraux sauf le kringle 3 suivie d'une multiplication de ce
domaine, lui conférant ainsi une certaine ressemblance avec l'apo(a)
humaine. Chez le hérisson le kringle 3 du plasminogène
possède 7 cystéines, alors que tous les kringles 3 sauf le
dernier, ont perdu la 7ème cystéine. Chez l'homme c'est l'avant
dernier kringle 4 (antépénultième kringle) qui
possède une 7ème cystéine (Figure
19).
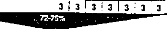
ptasmino9!nt-LP 1 2 3 4 I s PRO
~.
apo(a) humaine
14j4;4j4~~~I4j4I4I4I414 4 4.4 5
PRor
·
-

159
3
apo(a) hérisson 3 3 3 13 I /1 3 13
Figure 19 : Séquences comparées des cDNA du
plasminogène et des apo(a) humaine
et du hérisson
Dans la structure du plasminogène, la 7ème
cystéine du kringle 3 forme une pont disulfure avec une cystéine
du kringle 2.
La conservation d'une 7ème cystéine
(libre) dans l'un des kringles des apo(a) humaine et du hérisson,
suggère qu'elle est utile à la liaison avec une protéine
cible.
Bien qu'ayant perdu l'activité protéolytique,
par substitution (homme) ou par délétion (hérisson), les 2
apo(a) forment une liaison disulfure avec l'apoB100 pour constituer une
lipoprotéine, et sont capables de se lier à la lysine, à
la fibrine et inhiber la liaison et l'activation du plasminogène
Comme l'apo(a) humaine, l'apo(a) du hérisson comporte
de multiples copies de kringles. La signification adaptative des multiples
kringles de l'apo(a) est inconnue.



