|

REPUBLIQUE DEMOCRATIQUE DU CONGO
ENSEIGNEMENT
SUPERIEUR ET UNIVERSITAIRE
UNIVERSITE OFFICIELLE DE
BUKAVU
U.O.B
B.P. 570 BUKAVU
FACULTE DES SCIENCES ET SCIENCES APPLIQUEES DEPARTEMENT
DE BIOLOGIE
Effet du gradient altitudinal sur la diversité
végétale dans la partie de haute altitude du Parc National de
Kahuzi-Biega.
Par NCANGU BAHINDWA Benjamin
Mémoire présenté et défendu en vue
de l'obtention de Diplôme de licence en Sciences
Option : Biologie
Orientation : Ecologie et Gestion des Ressources
Végétales (Botanique)
Directeur : Dr. BALEZI ZIHALIRWA
Encadreur : Ass. CIRIMWAMI BAHIMIRWE
Année académique
2014-2015

In memoriam
A la mémoire de mon regretté Père BAHINDWA
LUKUNGULIKA Gaspard! Que ton âme repose en paix!
II
Dédicace
A Mes parents pour vos conseils et efforts qui ont toujours
contribué à mon épanouissement moral et intellectuel.
A Mes frères et soeurs, amis (es) et connaissances pour
votre amour et encouragements. A tous les membres de ma famille élargie
pour vos conseils et soutiens.
A tous ceux qui concourent à la conservation et de la
nature.
Ce travail étant le fruit de votre abnégation, de
mes efforts et les vôtres associés, je vous le dédie.
Ncangu Bahindwa Benjamin
Au Centre International pour la Recherche Forestière
(CIFOR) à travers son projet FCCC pour nous avoir fourni un appui
financier afin de bien mener nos travaux de recherche.
III
Remerciements
A toi Eternel, Dieu tout puissant, pour m'avoir accordé
la grâce et la force de commencer et d'aboutir à la fin de ce
travail.
Au terme de ces cinq années déjà
passées à l'université, des années des formations
intellectuelle et morale, nous sommes conviés à adresser nos
sentiments de reconnaissance à toute personne qui a contribué
à notre édification.
De prime à bord, nos vifs remerciements s'adressent au
Dr. Balezi Zihalirwa Alphonse, directeur de ce travail, qui a accepté
cette tâche malgré ses multiples occupations. Nous adressons
également notre profonde gratitude à l'Assistant Cirimwami
Bahimirwe Legrand dont les conseils et importantes remarques ont
été très bénéfiques dans
l'élaboration, le traitement des données jusqu'à la mise
au point du présent travail.
Nos sincères remerciements s'adressent à nos
parents Bahindwa Gaspard et Musimwa Françoise pour avoir dignement
accompli leur fonction en gouvernant nos premiers pas et en nous assurant une
éducation de qualité. Il n'existe pas de mot assez fort pour vous
témoigner notre reconnaissance, ce que vous méritez ne pas un
cadeau de qui ce soit mais seul Dieu vous en récompensera.
A mes frères Romuald Sadaka, Léandre Shungu,
Justin Iragi et mes soeurs Bora Uzima et Anne Marie Bahindwa, pour vos conseils
et encouragement.
Notre profonde gratitude s'adresse également au corps
académique de l'Université Officielle de Bukavu (UOB),
spécialement aux Professeurs, Chefs des travaux et assistants du
département de Biologie à la Faculté des Sciences et
Sciences Appliquées. Citons notamment : les Professeurs Amani Christian,
Cubaka Alfred, Masumbuko Céphas, Muhigwa Jean-Berckmans, Kahindo
Charles, Kabonyi Chantal, Dr. Mangambu Jean de Dieu, les Chefs de travaux
Ntamwira Seintsheng, Murhabale Bertin, les Assistants Imani Gérard et
Akonkwa Balagizi. Nous vous remercions pour l'enseignement de qualité
que vous nous avez transmis durant ce cursus académique.
iv
A l'Institut Congolais pour la Conservation de la Nature
(ICCN) pour nous avoir permis d'effectuer cette recherche dans le Parc National
de Kahuzi-Biega (PNKB). Que le chef de ce site Monsieur Radar Nishuli trouve
ici l'expression de notre sincère reconnaissance. Nous remercions aussi
les gardes du Parc dont Fuso et Mirindi pour nous avoir conduits et garanti la
sécurité durant les travaux de terrain.
Aux familles Rusumba, Kabi, Lwahya, Bugandwa pour leur soutien
indéfectible durant toutes ces années.
A mes camarades et grands amis Penedimanja Pancrace et Dany
Kahekwa avec lesquels nous formions une équipe de terrain en
fraternité. Nous sommes aussi reconnaissants envers notre
aîné John Kalumu qui nous a aussi beaucoup aidé durant les
travaux de terrain.
A mes amis (es) Jeanne D'Arc, Prodige, Mugisho, Christian,
Espoir, Fidel, Toussaint, Champion, Gédéon, Anna, Pascal, Chance,
Augustin, Emmanuel, Rachel, Aksanti, Kabwira, Honoré, Alain, Francine,
Isaac, Olivier, Noëlla, Claude, Dieu-merci, Sylvette, Yves,
Séraphin, Théophile et à tous les étudiants de L1
Botanique, année académique 2014-2015 pour vos encouragements et
votre fraternité.
A toute ma famille élargie, oncles et tantes Santa,
Nyagali, Muhigwa, Adèle, Geneviève, Venantie (d'heureuse
mémoire) ; cousins (es) Etienne, Béatrice, Tumsifu, Solide,
Michel, Charles, Mugisho, Maman Fify, Martine, Salomon, Agnès, Olivine,
Ciringwi, Emmanuel, Solange, Bulonza ; belles-soeurs Emilie, Furaha, Nsimire et
Nyenyezi ; neveux et nièces Landry, Armande, Cingazi, Daniel, Esther,
Shukuru, Raphael, Riphine (d'heureuse mémoire), Lili, Amos, Emmanuela,
Eulalie, Amato, Josué pour tous les soutiens et encouragements que vous
ne cessez de témoigner à mon égard.
Il est difficile de citer tous les noms dans ces quelques
lignes réservées aux remerciements. Vous êtes si nombreux
à avoir contribué tant soit peu à l'aboutissement heureux
du présent travail. Je prie à tous ceux-là dont les noms
ne sont pas repris de trouver ici l'expression de ma profonde gratitude.
Je vous remercie.
Ncangu Bahindwa Benjamin
Mots clés : gradient altitudinal, diversité
végétale, placeau, haute altitude du PNKB.
V
Résumé
Cette étude a comme objectif principal d'évaluer
l'effet de l'altitude sur la diversité végétale dans la
partie de haute altitude du Parc National de Kahuzi-Biega. Ceci nous a permis
de mettre en évidence la variation de la diversité
végétale suivant l'altitude allant de 2000 m et 2600 m.
Pour y parvenir, nous avons utilisé la méthode
de placeau. Les placeaux étaient placés à
différents endroits après chaque élévation de 100 m
en altitude, de 2000 jusqu'à 2600 m. Grâce à cette
méthode, nous avons réalisé des inventaires, sur une
surface de 1 hectare, pour tous les arbres et arbustes à DBH = 10 cm.
Nous y avons également inventoriés, par présence-absence,
les individus à DBH < 10 cm (sur une surface de 100 m X 10 m) ainsi
que les plantes herbacées (sur une surface de 4 m2).
Pour l'ensemble de 7 parcelles réalisées, nous
avons inventorié 121 espèces reparties en 108 genres et 65
familles.
Les indices de Shannon et Ficher-alpha nous ont montré
que la diversité végétale diminue au fur et à
mesure que l'altitude augmente mais dont les fluctuations montrent l'impact
d'autres facteurs écologiques.
La densité d'arbres à l'hectare varie en
fonction de l'altitude. Elle est faible au sein de la parcelle située
à 2000 m d'altitude et trop élevée dans la parcelle
située à 2600 m d'altitude.
Le nombre de gros arbres observé à 2000 m
diminue avec l'augmentation de l'altitude. Toutefois, l'analyse de la structure
diamétrique montre que, pour l'ensemble, les classes de diamètre
allant de 10 à 40 contiennent 89,4 % de tous les individus avec DBH.
Ceci peut être un signe indiquant une forêt jeune en
évolution.
Les données d'incidence nous ont permis de
réaliser le regroupement des placeaux dont deux groupes distincts en
sont ressortis, un groupe formé de 5 placeaux (P 2000, P2100, P 2200, P
2300 et P 2400) avec une similarité de 41 %. Un autre composé de
2 placeaux (P 2500 et P 2600) a montré une similarité de 54 %.
Tous les deux groupes ont une similarité de 34 %.
Key words: altitudinal gradient, plant diversity, plot,
highlands of KBNP.
vi
Summary
This study is focused on the impact of the elevation on plant
diversity of part of highlands of the Kahuzi-Biega National Park. It allowed us
to demonstrate the variation of the plant diversity within plots from 2000 to
2600 meters of elevation.
We did inventory in plots having each an area of 1 hectare.
These plots were placed after each elevation of 100 meters in altitude, from
2000 to 2600 m. By this plots method, we inventoried all trees and shrub with a
DBH = 10 cm. Plant with less than 10 cm of DBH were inventoried on a 100 m
× 10 m area (1000 m2) and herbaceous plants on a 4
m2 area.
For these 7 plots achieved, we enumerated 121 species
distributed in 108 genera and 65 families.
Shannon and Fisher-alpha diversity indexes showed that the
plant diversity decreases as the altitude increases but whose fluctuations show
the impact of others ecological factors.
The density of trees per hectare varies according to the
altitude. It is low in the plot situated at 2000 m of altitude and great in the
plot situated at 2600 m of altitude.
The number of fat trees observed in the plot placed at 2000 m
of altitude decreases when the altitude rises. However, the analysis of the
diametric structure shows that, for all plots, diameter classes of 10 to 40
contain 89.4 %. This can be a sign of regeneration of the forest.
Data from presence/absence allowed to realize the pooling of
plots which showed two groups, a group formed by 5 plots (P 2000, P2100, P
2200, P 2300 and P 2400) linked to 41 % and another one formed by 2 plots (P
2500 and P 2600) linked to 54 %. Both two are linked at 34 %.
vii
Table des figures
Fig.1.Parc National de Kahuzi-Biega (Hart et al., 2005) 10
Fig.2. Localisation des parcelles d'inventaire sur la carte du
PNKB 10
Fig.3. Nombre d'individus par parcelle 20
Fig.4. Représentation de la richesse spécifique
par parcelle 21
Fig.5. Classes de diamètre à P 2000 22
Fig.6. Classes de diamètre à P 2100 22
Fig.7. Classes de diamètre à P 2200 23
Fig.8. Classes de diamètre à P 2300 23
Fig.9. Classes de diamètre à P 2400 23
Fig.10. Classes de diamètre à P 2500 23
Fig.11. Classes de diamètre à P 2600 24
Fig.12. Constituants de l'IVI à P 2000 25
Fig.13. Constituants de l'IVI à P 2100 26
Fig.14. Constituants de l'IVI à P 2200 27
Fig.15. Constituants de l'IVI à P 2300 27
Fig.16. Constituants de l'IVI à P 2400 28
Fig.17. Constituants de l'IVI à P 2500 29
Fig.18. Constituants de l'IVI à P 2600 30
Fig.19. Les espèces les plus importantes dans
l'ensemble des parcelles 31
Fig.20. IVI des espèces au sein de P 2000 32
Fig.21. IVI des espèces au sein de P 2100 33
Fig.22. IVI des espèces au sein de P 2200 34
Fig.23. IVI des espèces au sein de P 2300 35
Fig.24. IVI des espèces au sein de P 2400 36
Fig.25. IVI des espèces au sein de P 2500 37
Fig.26. IVI des espèces au sein de P 2600 38
VIII
Fig.27. Les espèces les plus importantes dans
l'ensemble des parcelles 39
Fig.28. Distribution des espèces suivant l'altitude
40
Fig.29. Diversité relative des familles 41
Fig.30. Expression de la similarité entre les parcelles
en fonction de l'abondance spécifique
(algorithme de Morisita) 42
Fig.31. Expression de la similarité entre les parcelles
en fonction des données binaires (algorithme de
Simpson) 43
ix
Contenu du travail
Dédicace ii
Remerciements iii
Résumé v
Summary vi
Table des figures vii
Chapitre 1. Introduction 1
1.1. Présentation du sujet 1
1.2. Problématique 1
1.3. Objectifs et intérêts 3
1.3.1. Objectifs 3
1.3.2. Intérêts de l'étude 3
1.4. Revue de littérature 4
1.4.1. Importance des forêts tropicales 4
1.4.2. Menaces contre la biodiversité 4
1.4.3. La forêt Congolaise et sa biodiversité 4
1.4.4. Facteurs expliquant la diversité
végétale 5
1.4.5. Importance de la diversité végétale
dans la gestion des aires protégées 6
1.4.6. Altitude et végétation 6
Chapitre 2. Milieu d'étude, Matériel et
Méthodes 9
2.1. Milieu d'étude 9
2.1.1. Historique et situation géographique 9
2.1.2. Géomorphologie et Sols 11
2.1.3. Climat 11
2.1.4. Flore et végétation 12
2.1.5. Faune 14
2.2. Matériel et méthode 14
2.2.1. Collecte des données 14
2.3. Analyse des données 15
10. Indices de caractérisation botanique
(Lejoly, 1993) 16
20. Les indices de diversité 17
Chapitre 3. Résultats 20
3.1. Effet de l'altitude sur la densité d'arbres à
l'hectare (N/HA) 20
3.2. Effet de l'altitude sur la richesse spécifique. 21
X
3.3. Structure diamétrique 22
3.4. Densité, dominance et fréquence relatives des
espèces par parcelles / altitude 25
3.5. Indice de valeur d'importance écologique (IVI)
suivant l'altitude 32
3.6. Distribution des espèces suivant l'altitude. 40
3.7. Diversité relative 41
3.8. Diversité Beta 42
3.8.1. Analyse avec les données d'abondance 42
3.8.2. Analyse avec les données d'incidence 43
3.9. Indices de diversité au sein des parcelles 44
Chapitre 4. Discussion 45
4.1. Effet de l'altitude sur la diversité
spécifique 45
4.2. Effet de l'altitude sur la densité d'arbres à
l'hectare. 47
4.3. Effet de l'altitude sur la structure diamétrique
47
Conclusion et Suggestions 49
Références bibliographiques 51
1
Chapitre 1. Introduction 1.1. Présentation du
sujet
La surface forestière mondiale est de 4,06 milliards
d'hectares représentant ainsi 31 % de la surface émergée
de la planète (on line, 08 Janvier 2015). Les forêts tropicales
représentent environ 48 % des étendues forestières de la
terre, soit 1,9 milliards d'hectare (Gembu, 2012).
Les forêts tropicales font partie des
écosystèmes les plus riches de la planète, de par leur
composition elles sont «un monde à part». Elles pourraient
avoir jusqu'à 90 % de l'ensemble des espèces terrestres (Burley,
2002). Leigh et al., (2004), les décrivent par ces mots: «
Tropical forests are clearly museums of diversity».
Avec une superficie d'un peu plus de deux millions de
kilomètres carrés, près de quatre fois la France, les
forêts d'Afrique centrale représentent le second massif de
forêts tropicales au monde. Leur faune et leur flore comptent beaucoup
moins d'espèces que celles d'Amazonie ou du Sud-Est de l'Asie (Nshimba,
2008).
Le bassin du Congo est majoritairement couvert de vastes zones
encore ininterrompues de forêts humides qui vont du golfe de
Guinée au rift Albertin. Elles sont marquées par la
présence d'une plus grande forêt tropicale marécageuse dans
la partie centrale du bassin du Congo et par deux régions montagneuses
situées au Cameroun et dans l'Est de la République
Démocratique du Congo (COMIFAC, 2010).
Sa biodiversité est de signification importante
à cause à la fois du nombre élevé d'espèces
trouvées dans la région. Surtout par sa richesse
spécifique et par le nombre d'espèces animales et
végétales qui n'existent nulle part ailleurs sur la
planète (endemisme). La forêt héberge une grande
diversité de plantes et animaux en Afrique incluant plus de 400
espèces des mammifères, plus de 1000 espèces d'oiseaux et
probablement plus de 10000 espèces végétales dont 3000
sont endémiques (Anonyme, 2005).
1.2. Problématique
De nos jours, la végétation de la partie de
haute altitude du PNKB est constituée d'îlots de forêts
primaires et de plages de forêts secondaires de terre ferme. On y
remarque aussi des taches (clairières ou trouées) dues à
la dominance de Sericostachys scandens (une espèce
végétale de la famille Amaranthaceae), d'autres
espèces qui lui succèdent dont Mimulopsis solmsii,
Mimulopsis arborescens (Acanthaceae) et plusieurs autres
espèces des familles
2
Urticaceae (du genre Pilea), Acanthaceae
(Barelaria et Hypoestes), Lamiaceae
(Solenostemone), Malvaceae (Triumfetta), ainsi
que des fougères (Pteridium) et autres herbacées. A
plusieurs endroits, on observe l'émergence de Sericostachys scandens
allant jusqu'à la hauteur de grands arbres et enfin, cette
dernière étouffe la plante en lui privant d'une bonne absorption
de l'oxygène. Au fil des temps, l'arbre sèche et cède sous
le poids des individus et ramifications enchevêtrées de
Sericostachys scandens. Elle attaque divers habitats dans les biotopes
exceptés les marais (Balezi et al., 2008).
Et pourtant, les forêts de montagnes sont des zones de
refuge de plusieurs espèces végétales et animales qui
commencent à remonter aux altitudes supérieures suites aux
conséquences du réchauffement climatique (Lenoir, 2009).
Ces situations susmentionnées nécessitent des
recherches scientifiques pour que les gestionnaires de ces forêts soient
éclairées sur la façon nécessaire à
effectuer leur tâche.
Il est alors grand temps d'effectuer des recherches qui
permettraient d'améliorer les conditions de gestion des espaces verts
qui nous restent. Pour arriver à une bonne gestion des forêts, il
faut comprendre leur fonctionnement, leur écologie. Les diverses
relations entre les plantes et leurs milieux biotique (végétaux
ou animaux) et abiotique (température, climat, sol, altitude,...)
restent cruciales pour arriver à bien les contrôler, les conserver
et les gérer.
Les assemblages des espèces résultent de la
combinaison complexe de nombreux facteurs de nature écologique,
historique ou évolutive. Ainsi, il demeure particulièrement
informatif d'isoler l'un de ces facteurs lorsqu'il se manifeste sous la forme
d'un gradient (Tassin et al., 2003).
L'altitude est l'une des composantes géographique et
biogéographique qui explique la répartition des espèces
végétales sur terre. Une variable comme l'altitude, souvent
pertinente pour décrire l'habitat d'une espèce, regroupe un
ensemble des conditions et des ressources constituant autant d'axes de la niche
(Morneau, 2007). L'élévation de l'altitude peut induire plusieurs
changements dans la végétation. Soit il y a des changements
brutaux et ponctuels dans la composition floristique ou des adaptations de
moyen et long termes des espèces à l'altitude correspondante.
La variation de la structure des communautés
végétales le long d'un gradient altitudinal constitue un domaine
d'étude de l'écologie qui permet d'explorer une progression
continue au sein de la végétation (Tassin et al., op.
cit).
3
Dans le but d'acquérir des connaissances sur la
diversité végétale suivant le gradient altitudinal dans la
partie de haute altitude du PNKB, nous avons initié cette recherche afin
de répondre à certaines questions dont :
y' Le gradient altitudinal influence-t-il la diversité
spécifique dans la partie de haute altitude du PNKB ?
y' Quel est l'impact qu'a le gradient altitudinal sur la
structure diamétrique de la végétation dans la partie de
haute altitude du PNKB?
y' Le gradient altitudinal influence-t-il la distribution des
espèces végétales dans cette biocénose?
Cette étude veut apporter des éléments de
réponse à ces questions par des méthodes quantitatives.
Pour y parvenir, des travaux de terrain ont été effectués.
Ces travaux ont consisté à la mise en place des placeaux dans
différents milieux dont l'altitude varie entre 2000 m et 2600 m.
1.3. Objectifs et intérêts 1.3.1.
Objectifs
L'objectif général de cette étude est
d'étudier l'influence de l'altitude sur la diversité
végétale de la partie haute altitude du PNKB.
Les objectifs spécifiques sont de :
? Connaitre les tranches d'altitude les plus
diversifiées dans la partie de haute altitude du PNKB.
? déterminer les espèces végétales
à grande valeur écologique à différentes tranches
d'altitude.
? spécifier les espèces végétales
à large distribution dans notre milieu d'étude.
1.3.2. Intérêts de
l'étude
La partie de haute altitude du PNKB étant une zone
montagneuse et considérée comme zone de refuge de diverses
espèces, ce travail nous permettra :
y' d'élucider le comportement de la
végétation vis-à-vis du gradient altitudinal ;
y' de mettre en évidence les différentes
espèces importantes et à large distribution au sein de ces
forêts.
riches en biodiversité au monde. Cette richesse est
liée aussi bien à l'immensité de son
4
1.4. Revue de littérature
1.4.1. Importance des forêts tropicales
Les forêts tropicales sont limitées à une
petite bande de terre comprise entre les latitudes 22,5° Nord et Sud de
l'équateur, entre le tropique de Cancer et le tropique de Capricorne
(FAO, 2006).
L'importance mondiale reconnue aux forêts tropicales est
la multitude des biens et services qu'elles garantissent aux hommes. Sans
parallèle en termes de diversité biologique, les forêts
tropicales sont un réservoir naturel de diversité
génétique qui offre une riche source de plantes
médicinales, de nourritures à haut-rendement, et une myriade
d'autres produits de forêt tout aussi utiles (Koellner et al.,
2008). Les forêts tropicales jouent un rôle primordial dans la
régulation du climat mondial tout en maintenant des
précipitations régulières, et luttant contre les
inondations, les sécheresses, et l'érosion. Elles
séquestrent d'importantes quantités de carbone, tout en
libérant une quantité significative de l'oxygène terrestre
(Chave et al., 2008).
1.4.2. Menaces contre la biodiversité
Dès l'apparition de la vie sur Terre, la
biodiversité subit des menaces naturelles et anthropiques. Les actions
humaines sont entrain de causer une crise de la biodiversité avec un
taux d'extinction spécifique élevé ; ainsi, les processus
conduisant à cette extinction érodent les services de
l'environnement desquels l'humanité dépend (Brooks et
al., 2006). Ces menaces ne laissent pas intactes les
écosystèmes vu les conséquences qui en découlent.
Celles-ci se manifestent par une disparition partielle ou totale des
espèces qu'on appelle crise biologique.
Depuis 13000 ans, une extinction est provoquée par la
colonisation de la planète par l'être humain. Les scientifiques
parlent de la sixième vague d'extinction qui s'inscrit dans l'histoire
de la planète (S.C.B.D, 2007).
Du fait de ces effets anthropiques, les forêts
tropicales ne sont pas épargnées et font partie des
écosystèmes les plus menacés (Morneau, 2007).
1.4.3. La forêt Congolaise et sa
biodiversité
La RDC est dotée d'une grande biodiversité et est
considérée comme l'un des pays les plus
5
territoire qu'à la variété des conditions
physiques et climatiques. Les premières activités de conservation
et de recherche sur cette biodiversité ont été
lancées au début du 20ème siècle. Le
Parc National Albert, créé en 1925 et aujourd'hui nommé
Parc National de Virunga, fut le premier parc national du pays (WCS, 2004).
Les forêts de la RDC couvrent environ 155,5 millions
d'hectares (dont 99 millions de forêts denses humides) soit 67 % du
territoire national dont la superficie est d'environ 2.329.374 km2,
(Eba'a et al., 2009). Elles représentent en superficie 52 % des
forêts denses du Bassin du Congo et 46 % des forêts d'Afrique et,
qui, en zone tropicale, se situe au second rang mondial après celui de
l'Amazonie (MECNT, 2009).
Elles séquestrent seules 8% du carbone mondial qui est
entreposé dans les forêts vivantes. C'est plus que tout autre pays
en Afrique, et ce qui fait d'elles le quatrième plus grand magasin
national de carbone forestier dans le monde (Greenpeace, 2007). Elles aident
également à réguler l'un des plus grands bassins
hydrographiques du monde. Le pays est aussi un réservoir unique de
biodiversité: il occupe la cinquième place au monde du point de
vue diversités végétale et animale. Ses habitats naturels
s'alignent de mangroves aux glaciers et volcans (CIFOR, 2007).
1.4.4. Facteurs expliquant la diversité
végétale
Les regroupements des espèces végétales
résultent de la combinaison complexe de plusieurs facteurs de nature
écologique.
Après la latitude, l'altitude est le second facteur le
plus important structurant la richesse spécifique. En raison de
l'altitude, les montagnes connaissent des gradients climatiques,
édaphiques et biotiques qui créent une stratification des
systèmes écologiques (Delnatte, 2010).
Les montagnes, espaces de contrastes, sont
réputées pour leur grande variété de milieux, la
richesse biologique, les paysages, qui contribuent à leur
diversité (Bornard et al., 2004).
Elles représentent un milieu très particulier,
un complexe d'écosystèmes dans lesquels les plantes se sont
adaptées avec des structures et des mécanismes biologiques
propres. Parmi les facteurs les plus importants qui déterminent les
adaptations des plantes de montagne, on trouve la température, les
précipitations, la radiation solaire et les vents (Quense, 2011).
6
1.4.5. Importance de la diversité
végétale dans la gestion des aires
protégées
Selon la COMIFAC (2010), le taux de déforestation brute
est de 0,32 #177; 0,05 % et celui de déforestation nette de 0,22 % entre
les années 2000 et 2005 en RDC. Etant donné ce taux de
déforestation et de dégradation que connaissent les forêts
congolaises, des travaux de recherche semblent nécessaires afin de
trouver des solutions durables à ces différents problèmes.
Les recherches sur leur diversité végétale se
révèlent nécessaires pour faciliter la gestion rationnelle
des ressources naturelles de la RDC.
Un écosystème, étant une unité
écologique, est caractérisé par sa diversité
biologique qui est soit due à sa position géographique, à
son écologie et/ou à son mode d'exploitation (Balezi, 2013). Les
interactions qu'entretiennent ses éléments sont sûrement
nécessaires dans la gestion et la recherche dans une aire
protégée.
Dans le champ de l'écologie des communautés,
déterminer les facteurs de l'environnement qui influent sur
l'organisation dans l'espace et dans le temps des organismes vivants constitue
donc la problématique centrale des écologues (Blanc, 2000).
La recherche essaie de comprendre le degré de
diversité dans différents sites et quelles en sont les causes.
Ainsi, les résultats de la recherche pourraient constituer une base
solide pour les gestionnaires (Cirimwami, 2013).
Le milieu le plus diversifié floristiquement peut
probablement être la zone où l'on peut rencontrer la plus grande
diversité animale vu qu'il y aurait plus des plantes alimentaires pour
les animaux. D'une façon indirecte, quand on conserve les zones
floristiquement diversifiée on sera entrain de conserver aussi la
diversité faunique. Cette diversité favorise un taux
d'endémisme spécifique élevée.
1.4.6. Altitude et végétation
L'interaction entre les forêts et les facteurs
abiotiques (altitude, sol, climat,...) détermine le type de formation
végétale dans un milieu. Pellegrini (2002) montre que la
variabilité des facteurs topographiques et ceux liés à la
pédologie influence la richesse spécifique. Ainsi, sur une
surface donnée, on peut trouver des peuplements forestiers qui
présentent des différences en structure, composition floristique,
densité et diversité végétale (Cirimwami, 2013).
Cela émane le plus souvent de la variabilité des facteurs
biotiques et abiotiques qui s'exercent sur les peuplements en place.
7
Dans une étude réalisée par Tassin et
al. (2003) à l'île de la Réunion sur une
végétation étagée d'un gradient d'altitude compris
entre 30 m et 2400 m, les résultats montrent que la variation
altitudinale de la richesse spécifique suit une courbe en cloche. Les
espèces à forte amplitude altitudinale sont plus au milieu du
gradient et légèrement comprimé vers 750 m. Au-delà
de 1000 m, la richesse spécifique décroit de manière
linéaire, elle perd en moyenne 5,5 % de sa valeur tous les 100 m. En
dessous de 700 m, la richesse spécifique croit de manière
linéaire. Le nombre maximal est de 34 espèces et est
observé dans une parcelle se trouvant à 1050 m d'altitude ;
à 30 m d'altitude, 13 espèces sont enregistrées tandis
qu'à la plus haute altitude (2400 m) on relève 8 espèces.
Le taux d'endémicité de la flore indigène ligneuse
envisagé au niveau de l'île croît de manière
linéaire avec l'altitude.
Lenoir (2009) dans son étude fait remarquer que de la
même façon que les formations végétales varient sur
un gradient altitudinal, la diversité aussi suit cet
échelonnement. Cet auteur a trouvé qu'en général
les espèces végétales commencent à remonter vers
les altitudes supérieures suite aux effets de réchauffement
climatique. Ceci conduit à une forte diversité aux altitudes
supérieures et une légère baisse de diversité aux
altitudes inférieures.
Dans le milieu où s'effectuera notre recherche, moins
de travaux de ce genre ont été réalisés sur les
plantes ligneuses. Néanmoins, Balezi (2013) dans son étude
effectuée sur les champignons lignivores, a remarqué une
différence de distribution des Hymenochaetales suivant les tranches
altitudinales. Ces espèces sont plus abondantes entre 2000 et 2350 m
d'altitude. La tranche altitudinale la plus diversifiée est celle
comprise entre 2149 et 2249 m d'altitude avec plus de 20 espèces ; et la
tranche altitudinale comprise entre 2549 et 2600 est la moins
diversifiée avec moins de 5 espèces.
De même, Mangambu et al. (2013) ont
réalisé des études relatives sur les Ptéridophytes
et leurs alliées. Ils ont démontré que la diversité
et la richesse spécifique de ces espèces décroissent
linéairement avec l'augmentation de l'altitude dans les forêts de
montagnes du PNKB.
C'est dans le même ordre d'idée qu'Amani (2011)
et Mukubi (2011) ont effectué au PNKB des études sur l'effet du
gradient altitudinal sur l'écologie et la diversité des strates
respectivement herbacée et arborescente dans trois secteurs des
forêts de haute altitude. Les résultats ont
révélé que la diversité décroit quand
l'altitude augmente mais dont certains pics reflètent l'influence
probable d'autres facteurs environnementaux au sein de certaines parcelles.
8
Wyatt-Smith (1960) et Arnot (1934), cités par Fournier
et Sasson en 1983, montrent qu'en Malaisie, il existe un plus grand nombre de
pieds d'arbres à l'unité de surface sur les crêtes que sur
les pentes ou bas de pentes. Cependant, ils expliquent que la tendance à
l'augmentation du nombre de tiges en fonction de l'altitude, si elle existe,
reste assez faible.
Selon Heinsdijk (1957) cité par Fournier et Sasson
(1983), en Amazonie brésilienne, les forêts établies sur
les pentes semblent plus riches en plantes de petits diamètres et moins
riches en celles ayant de gros diamètres que les plateaux. Cirimwami
(2013) a réalisé qu'il n'y a pas de différence
significative sur les structures diamétriques entre les altitudes
supérieures et inférieures à Uma en Province Orientale
(RDC) mais, il a remarqué qu'il y a plus d'arbres dans les classes de
diamètre inférieures allant de 10 à 60 cm.
Mangambu (2013) indique qu'en milieu non perturbé, le
nombre d'arbres et arbustes à DBH ? 50 et ? 30 diminue
considérablement de l'étage sub montagnard à
l'étage afro-subalpin. Aussi il note une faible variation du nombre
d'arbres et arbustes à DBH ? 10.
Dans ce travail, l'altitude est mise en évidence car
considérée comme gradient écologique par excellence qui
permet d'apprécier l'effet d'autres gradients, comme par exemple la
température qui diminue au fur et à mesure qu'on monte en
altitude, l'humidité ambiante qui varie suivant l'altitude et influence
ainsi la nature du substrat et /ou la composition du sol (Amani, 2011).
9
Chapitre 2. Milieu d'étude, Matériel et
Méthodes 2.1. Milieu d'étude
2.1.1. Historique et situation
géographique
Le PNKB est l'une des aires protégées de la RDC.
Il est situé à l'Est du pays, à cheval sur trois provinces
dont celle du Sud-Kivu, Nord-Kivu et Maniema et s'étend du bassin du
fleuve Congo jusqu' au Nord-Est de la ville de Bukavu. Il tire son nom de deux
montagnes qui se situent dans sa partie de haute altitude. Il s'agit des monts
Kahuzi culminant à 3308 m et Biega avec une altitude de 2790 m (Fischer,
1993). En raison de sa situation géographique (1°36'-2°37'
latitude Sud et 27°33'- 28°46' de longitude Est) et du relief, le
PNKB a une flore riche. Il couvre une partie des territoires administratifs de
Kabare, de Kalehe, de Shabunda et de Walungu dans la province du Sud-Kivu, de
Walikale, dans la province du Nord-Kivu et de Punia dans la province du Maniema
(Anonyme, 2010).
Sous l'Ordonnance n° 81/Agri du 27 juillet 1937, une
réserve dénommée « Réserve Zoologique et
Forestière du Mont Kahuzi » fut créée dans la
province du Kivu avec une aire de 750 km2. Cette réserve a
ensuite acquis le statut de Parc National en 1970, par l'Ordonnance n°
70/316. Ce Parc fut agrandi à 6000 km2 en 1975 sous
l'Ordonnance 75-238 du 22 juillet 1975 afin de protéger le Gorille des
plaines orientales (Gorilla beringei graueri Matschie) et son habitat
(Anonyme, 2010).
Par rapport à d'autres aires protégées,
le PNKB est limité au Nord par le Parc National de Maïko, la
Réserve naturelle de Tayna, la Réserve des primates de
Kisimba-Ikobo, le chapelet de Réserves de l'UGADEC (Union des
Associations pour la Conservation des Gorilles et le Développement
Communautaires en RDC orientale) et au sud par la Réserve Naturelle
d'Itombwe (Anonyme, 2010).
En 1997, du fait de la forte pression exercée sur les
ressources naturelles du Parc à la suite des guerres à
répétition à l'Est du Congo avec la présence de
réfugiés rwandais remontant à 1994 et celle de multiples
groupes armés dans le Parc, l'UNESCO le plaça sur la liste des
Sites du Patrimoine Mondial en péril ( Anonyme, 2010).
10
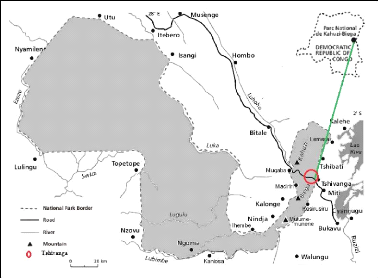
Fig.1.Parc National de Kahuzi-Biega (Hart et al., 2005)
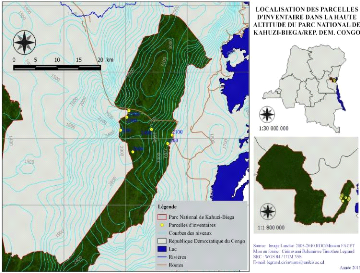
Fig.2. Localisation des parcelles d'inventaire sur la carte du
PNKB
11
2.1.2. Géomorphologie et Sols
A cause de sa situation géographique, de son orographie
très variée, le parc est constitué de deux entités
géomorphologiques dont les montagnes volcaniques du Rift Valley et la
basse altitude du Bassin du Congo. A partir de la cuvette du fleuve Congo, le
relief monte continuellement jusqu'à la crête occidentale du
Graben centrafricain de la Vallée du Rift Occidental. Dans sa partie
basse altitude, le point le plus bas se situe à environ 700 m d'altitude
et le plus haut se situe près de Bunyakiri (Mont Kamani) à
environ 1700 m d'altitude (Fischer, 1993).
Les pierres et le burundien métamorphe
précambriens très pliés provenant de la crête du
Graben prédominent la région orientale. Néanmoins, les
sédiments de sable et de pierres terreuses du mésozoïque se
trouvent de plus en plus dans la cuvette vers l'Ouest. La région autour
du Lac Kivu est réellement influencée par la tectonique
tertiaire, liée à un volcanisme quartenaire. Le corridor
écologique reliant la haute et basse altitude constitue un terrain
ondulé (Fischer, 1993).
2.1.3. Climat
La proximité à l'Equateur de la région du
PNKB détermine la succession saisonnière, à savoir deux
saisons pluvieuses : l'une de Mars à Mai et l'autre de Septembre
à Décembre suivies de deux courtes saisons relativement
sèches, de Janvier à Février et de Juin à
Août (Anonyme, 2010).
Dans les parties basses, le climat est uniformément
chaud la journée et toute l'année. La température moyenne
annuelle calculée à partir de la station d'Irangi est de
20,5°C avec une variation entre 15 et 25°C. Les précipitations
sont très élevées (2.646 mm) mais pas distribuées
uniformément tout au long de l'année (Fischer, 1993).
Par contre, la région montagneuse est dominée
par un climat Afro-alpin avec gel nocturne sur les sommets des monts Kahuzi et
Biega. Pendant la journée, on assiste à une
nébulosité abondante et de fortes pluies, surtout
l'après-midi et le soir. Les précipitations moyennes annuelles
s'élèvent au maximum à 1.900 mm avec une saison
sèche aigue de juin à Août (Fischer, 1993).
C'est une zone submontagnarde, présente sous forme
d'une bande allongée le long de la forêt équatoriale, on la
distingue :
12
2.1.4. Flore et végétation
Avec une diversité biologique exceptionnelle
constituée de beaucoup d'espèces endémiques, rares et
menacées d'extinction, le PNKB est l'un des cinq sites du patrimoine
mondial en RDC. La plus grande partie du Parc est recouverte par des
différents types des forêts et se retrouve dans les forêts
du bassin du Congo (Anonyme, 2010).
Le PNKB appartient à deux grands centres
d'endémisme : guinéo-congolais et afro-montagnard (Fischer,
1993). Le centre d'endémisme guinéo-congolais se situe entre 650
m et 1250 m d'altitude et couvre une végétation de plaine ou
forêts ombrophiles de basse altitude. Celui d'endémisme
afro-montagnard est composé de forêts de montagnes dont le point
culminant est le mont Kahuzi (3.308 m). Au PNKB, ces deux types de
végétation sont reliés par un étroit couloir
écologique formé par la forêt submontagnarde ou de
transition, qui assure les échanges fauniques entre les deux
forêts. Le PNKB est l'un des rares sites de l'Afrique subsaharienne
où existe une transition floristique et faunique de la basse à la
haute altitude (UICN/PACO 2010 et Mühlenberg et al., 1994).
De l'Ouest à l'Est (de la basse altitude à la
crête du mont Kahuzi), divers types de végétation
marqués par la variation altitudinale caractérisent le Parc
(Mangambu, 2013), à savoir :
a. Forêt ombrophile de basse altitude (650-1250 m
d'altitude)
La cuvette congolaise est couverte par un type de forêt
qui se distingue nettement, aussi bien du point de vue physiologique que de la
composition floristique, et porte le nom de forêt équatoriale,
avec des peuplements sempervirents dont :
- Forêt ombrophile sempervirente
semi-caducifoliée à Gilbertiodendron dewevrei.
(De Wild.) J. Léonard et Staudtia stipitata (Welw.) Warb.
- Forêt ombrophile sempervirente
à Cynometra alexandrii C.H.Wright, Mammea africana
Sabine et Aningeria altissima (A.Chev.) Aub. et Pellegr.
- Forêt semi-caducifoliée
à Cynometra alexandrii C.H.Wright et Julbernardia
seretii (De Wild.) Troupin.
b. Forêt ombrophile de transition (1250-1700 m
d'altitude)
13
- Sur le versant Est du Parc, la forêt
débute aux environs de 1325 m d'altitude, avec une forte dominance
d'Ocotea michelsonii Robyns et Wilczek.
- Sur le versant Ouest du Parc, la
forêt commence à 1250 m d'altitude et est dominée par deux
essences : Pentadesma lebrunii Spirlet et Lebrunia bushaie
Staner.
c. Forêt ombrophile de montagne (1700-2600 m
d'altitude)
Elle se trouve au-delà de la forêt
submontagnarde et apparait au-delà de 1700 m sous forme d'une formation
hétérogène à sous-bois très touffu,
contrairement à la forêt équatoriale typique. Le sous-bois
est formé en partie des essences du couvert en voie de croissance,
auxquelles s'ajoute un grand nombre d'espèces buissonnantes ou
arbustives. Les épiphytes (Ptéridophytes et des Orchidées)
sont particulièrement abondants.
Au PNKB, cet étage de végétation est
subdivisé en 3 horizons :
- Horizon inférieur : Cet horizon se
situe entre 1700 à 2000 m d'altitude.
- Horizon moyen : Cet horizon se trouve entre
2000 et 2300 m d'altitude.
- Horizon supérieur : C'est l'horizon
dont l'altitude varie entre 2300 et 2600 m.
d. Etage Afro-subalpin
Localisé entre 2600 et 3308 m, il est
caractérisé par la présence des Ericaceae et des
bruyères sur les sommets des monts Kahuzi (3308 m) et Biega (2790 m).
On note la présence de 1178 espèces de plantes
répertoriées uniquement en haute altitude avec 145 espèces
endémiques du rift Albertin (UICN/PACO, 2010). En RDC, le PNKB est le
troisième site en termes de richesse spécifique après le
Parc national de Virunga et la forêt impénétrable de
Bwindi. La flore de la basse altitude reste peu connue. (Anonyme, 2010).
Au-dessus de 2600 m jusqu'au sommet des monts Kahuzi et Biega,
s'est développée une végétation subalpine à
bruyères, hébergeant l'espèce endémique Senecio
kahuzicus Humbert (Anonyme, 2010).
Chez les Ptéridophytes, dix taxons sont
considérées comme subendémiques et endémiques de la
région du PNKB. Parmi ces espèces, deux espèces
(Asplenium friesiorum subsp kivuensis et Lycopodium
carolinum) sont endémiques du PNKB. Les sept autres espèces
(Cyathea camerooniana var. ugandensis, Elaphoglossum
kivuense, Huperzia bampsiana, Odontosoria
14
africana, Pityrogramma humbertii var. elongata,
Pteris auquieri et Pteris kivuensis) sont endémiques des
montagnes du système Kivu-Ruwenzori (Mangambu, 2013).
L'inventaire des espèces endémiques du Parc
national de Kahuzi-Biega est loin d'être terminé, comme le
démontre de nombreuses nouvelles espèces découvertes
appartenant essentiellement aux familles des Balsaminaceae (6),
Orchidaceae (4), Violaceae(3), Euphorbiaceae (2),
Araliaceae (2), Anacardiaceae (2) (Anonyme, 2010).
2.1.5. Faune
Le PNKB abrite plus d'espèces de mammifères
menacés que tout autre site du rift Albertin. Il est le deuxième
site le plus important du rift pour les espèces endémiques, le
troisième pour les espèces menacées et le second en terme
de richesse spécifique (Anonyme, 2010).
A part les gorilles des plaines orientales (Gorilla
beringei graueri), il regorge une faune importante (Yamagiwa et
al., 2005). Il compte 136 espèces de mammifères, parmi
lesquelles 14 sont menacées, dont un total de 11 espèces de
primates diurnes et 3 espèces nocturnes (Anonyme, 2010). On
dénombre parmi les primates des animaux comme les chimpanzés
(Pan spp.), les babouins (Papio anubis.),
de nombreux singes (Cercopithecus spp, Colobus spp,
Cercocerbus spp) ainsi que plusieurs autres sous-espèces de ces
genres des singes endémiques de la région du Kivu (Anonyme,
2010).
D'autres espèces de mammifères endémiques
et extrêmement rares des forêts de l'Est de la RDC y sont aussi
présentes. On peut citer par exemple la genette géante
(Genetta victoriae) et la genette aquatique (Osbornictis
piscivora), le Bongo (Tragelaphus euryceros) et huit
espèces de petits ongulés dont six céphalophes sont
endémiques au PNKB (Anonyme, 2010). Des mammifères
caractéristiques des forêts d'Afrique centrale comme
l'éléphant (Loxodonta africana var. cyclotis)
et le Buffle de forêt (Syncerus caffer nanus), le lion
(Panthera leo), l'hylochère géant
(Hylochoerus meinertzhageni), divers antilope
(Cephalophus spp.). Il abrite également 335 espèces
d'oiseaux dont 11 sont menacées et 30 sont endémiques au niveau
du Rift Albertin, 69 espèces de reptiles, 44 espèces amphibiens
(Anonyme, 2010).
2.2. Matériel et méthode 2.2.1. Collecte
des données
Une séance de prospection de terrain a
été effectuée en vue d'identifier les différentes
tranches d'altitude où nous avons installé les placeaux.
15
Nous nous sommes servis des machettes pour faire le pistage,
d'un hectomètre pour faire les mesures des placeaux et d'une boussole
(de marque Suunto) pour orienter les azimuts des placeaux. Le sécateur
nous a aidés pour la récolte des échantillons des plantes
non identifiées sur le terrain et le DBH-mètre pour mesurer les
circonférences des troncs d'arbres à DBH = 10 cm à 1,30 m
du sol. Le GPS (de marque Garmin) nous a servis à prélever les
coordonnées géographiques qui nous ont permis de projeter les
parcelles d'inventaire sur la carte du PNKB (voir figure 1) et à
indiquer l'altitude à laquelle elles sont installées. Les
presses, cartons et papiers journaux nous ont aidés à faire
l'herbier.
Dans le but de connaître l'organisation de la formation
végétale, nous avons utilisé la méthode de placeau
tel que réalisé par Amani (2011). La méthode consiste
à inventorier les espèces présentes dans un placeau de
surface représentative et homogène floristiquement, et en
opérant strate par strate.
La réalisation pratique consiste à
délimiter la surface d'échantillonnage. Dans cette étude,
la surface à échantillonner était de 100 m × 100 m,
soit 1 ha où tous les arbres et arbustes à DBH = 10 ont
été énumérés. Chaque placeau a
été subdivisé en 4 placettes de 50 m × 50 m (2500 m2
soit 0,25 ha). Les 4 coins du placeau et des placettes sont marqués par
des piquets, puis les côtés délimités par une
ficelle tendue à une certaine hauteur du sol.
D'autres informations ont été recueillis dans
chaque parcelle telles que l'inventaire par présence/absence pour les
arbustes et arbres de moins de DBH < 10 cm sur une surface de 100 m ×
10 m (1000 m2 ou 0,1 ha) et pour les plantes herbacées sur
une surface de 2 m × 2 m (soit 4 m2). Les nouvelles
espèces des strates arbustive et herbacée rencontrées dans
les parcelles ont été ajoutées à la liste
d'espèces de ces strates.
Les parcelles ont été établies à
différents endroits après chaque élévation de 100 m
d'altitude. 2.3. Analyse des données
Différents logiciels dont Statistica, Past
(Paleontological Statistics) et QGIS (Quantum Geographic Information System)
ont été utilisés respectivement pour l'analyse des
données, le calcul des indices de diversité et
l'élaboration de la carte de localisation des parcelles d'inventaires.
Les analyses ont concerné les indices de caractérisation
botanique dont la surface terrière, la dominance relative, la
fréquence relative, la densité relative, la diversité
relative et l'indice de valeur écologique. A ceux-ci s'est
ajoutée la mesure de diversité dont la
16
diversité alpha (mesure de la diversité locale) et
la diversité beta (mesure de la similarité des
communautés).
1°. Indices de caractérisation botanique
(Lejoly, 1993)
Après la collecte des données, les analyses ont
été effectuées pour les paramètres suivants :
i. La surface terrière (S.T)
C'est un facteur important qui fournit des informations sur la
dominance et le recouvrement forestier. Elle s'exprime en mètre
carré par hectare (m2/ha).
Sa formule est G = (Eq.1), où D =
diamètre (DBH) d'un individu donné et ð=3,14
ii. La dominance relative (Do.R)
Elle tient compte de la taille des individus connaissant leur
surface terrière. Elle met en évidence les espèces
où les familles qui occupent la plus grande espace dans la flore
étudiée.
Sa formule est Do.R = (Eq.2), où ST
est la surface
terrière.
iii. Fréquence relative (FR)
Elle représente le rapport entre la fréquence de
l'espèce i (fi) et la somme de toutes les fréquences
multiplié par 100. La fréquence fi est le rapport des parcelles
où l'espèce i est présente sur le nombre total des
parcelles.
fi = (Eq.3), où Pi indique le nombre
des parcelles (quadrants) où l'espèce i est présente et P
le nombre total des parcelles (quadrants).
Fr = x 100 (Eq.4), où fi est la
fréquence de l'espèce i et F la somme des fréquences de
toutes les espèces.
iv. Diversité relative (DIR)
La diversité relative d'une famille f est le
rapport entre le nombre d'espèces d'une famille et le nombre total des
espèces multiplié par 100. Elle peut varier de 0 à 100 %.
Quand elle est égale à 0 %, cela veut dire que la famille n'est
pas représentée et quand elle vaut 100 %, cela
17
veut dire que toutes les espèces présentes sont
d'une même famille. Elle est donnée par la formule suivante :
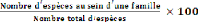
DIR = (Eq.5)
v. La densité relative
Il s'agit du nombre total d'arbres à DBH= 10 cm d'une
parcelle ramené à l'hectare. Elle est basée sur le nombre
d'individus sans tenir compte de leur taille.
Sa formule est D.R = (Eq.6)
vi. La structure diamétrique
Elle indique le nombre d'arbres par classe de
diamètre. Dans ce travail, les classes de diamètres ont chacune
un intervalle de 10 cm de DBH.
vii. Indice de valeur écologique ou Indice de
Valeur d'Importance (IVI)
Cet indice a été calculé pour
déterminer les espèces (DBH = 10 cm) les plus dominantes dans la
parcelle. Il représente la somme de la densité relative, de la
dominance relative et de la fréquence relative de l'espèce
considérée. La densité relative i étant
donnée par :
D reli (Eq.7), l'indice de valeur d'importance
de l'espèce i devient :
IVI = Dreli + Do.Ri+ Fri (Eq.8). Cet indice
varie entre 0 et 300 dans une parcelle. 2°. Les indices de
diversité
Pour cette étude, nous avons utilisé les indices
qui se rapportent à la mesure de la diversité locale
(diversité alpha) et à la similarité des
communautés (diversité beta).
a. La diversité alpha (á)
La diversité alpha ou locale met en
considération le nombre d'espèces coexistant dans un habitat
homogène et le nombre d'individus de chaque espèce. Plusieurs
indices permettent de la calculer mais pour cette étude ce sont les
indices de Shannon, Fisher alpha et l'Equitabilité de Piélou qui
ont été utilisés :
18
i. Indice de diversité de Shannon
Cet indice permet de quantifier
l'hétérogénéité de la biodiversité
d'un milieu d'étude et donc d'observer une évolution au cours du
temps (Ricotta, 2001). Sa formule est :
H' = (Eq.9), où H représente
l'indice de diversité de Shannon, i est une
espèce du milieu d'étude et pi la proportion d'une
espèce i par rapport au nombre total d'espèces S dans le milieu
d'étude (richesse spécifique du milieu), qui se calcule de la
façon suivante :
pi = ni / N (Eq.10) où ni indique le
nombre d'individus pour l'espèce i et N est l'effectif total des tous
les individus et S le nombre total d'espèces.
ii. Indice de Fisher alpha (Marcon, 2013)
Cet indice est calculé par la formule suivante:
S = (Eq.11) avec S le nombre d'espèces,
n le nombre d'individus et a l'indice
de Fisher alpha.
iii. Indice d'Equitabilité de
Piélou
Il exprime la répartition équitable des individus
au sein des espèces. Il se définit par la formule :
R = (Eq.12)
La valeur tend vers 0 lorsqu'un élément, une
espèce ou un trait biologique domine largement sur les autres et est
égale à 1 lorsque tous les éléments, espèces
ou traits biologiques ont la même abondance (Hakizimana, 2012). La
tendance à 0 démontre un fait de mono dominance qui conduit
souvent à une faible diversité.
b. La diversité bêta (B)
Elle consiste à comparer la diversité des
espèces entre écosystèmes ou le long de gradients
environnementaux. Cela suppose de comparer le nombre des taxons qui sont
uniques à chacun des écosystèmes. C'est le taux en
composition d'espèces dans l'ensemble des habitats ou parmi les
communautés (Cirimwami, 2013).
19
Cette diversité est plus exprimée par les
indices ou coefficients de similarité. La similarité entre deux
parcelles ou deux milieux différents peut être calculée
suivant les abondances de leurs espèces (exemple : indice de
similarité de Bray-Curtis, Morisita, Horn) ou selon leur
présence-absence, données d'incidence ou binaires (exemple :
indice de similarité de Simpson, Jaccard, Sorensen, Distance
Euclidienne). Pour ce travail, ce sont les indices de similarité de
Simpson et de Morisita qui ont été calculés.
i. Indice de diversité D de Simpson
L'indice de Simpson mesure la probabilité que deux
individus sélectionnés au hasard dans un échantillon
donné appartiennent à la même espèce. Cet indice
tient compte des richesses spécifiques, des données binaires
(présence-absence). Il se calcul comme suit :
S = avec (Eq.13)
ni : nombre d'individus de l'espèce donnée et N
: nombre total d'individus. Cet indice aura une valeur 1 pour indiquer le
maximum de diversité, et une valeur de 0 pour indiquer le minimum de
diversité (Amani, 2011).
ii. Indice de similarité de Morisita
Cet indice mesure la similarité entre deux ou plusieurs
parcelles sur la base des abondances d'espèces. Il est donné par
la formule suivante :
Mor = (Eq.14) où aN représente
le nombre d'individus du site A, bN le
nombre d'individus du site B ; ani = nombre d'individus de
l'espèce i dans le site A, bni le nombre d'individus de l'espèce
i dans le site B, da est nombre d'espèces particulières au site
A, db le nombre d'espèces particulières au site B.
Ces deux indices (Simpson et Morisita) varient de 0 à
100 % de similarité. Quand la valeur est de 0 %, cela veut dire que les
deux parcelles comparées n'ont aucune ressemblance. La valeur de 100 %
veut dire que les deux parcelles ont une similarité maximale (Cirimwami,
2013).
20
| 


