|
ÉÜÜÜíÈÚÔáÇ
ÉÜÜÜíØÇÑÞãíÏáÇ
ÉÜÜÜíÑÆÇÒÌáÇ
ÉÜÜÜíÑæåãÌáÇ
République
Algérienne Démocratique et Populaire
íãáÚáÇ
ËÍÈáÇæ
íáÇÚáÇ
ãíáÚÊáÇ
ÉÑÇÒæ
Ministère de l'Enseignement Supérieur et de la
Recherche Scientifique
ÉáÞÑæ -
ÍÇÈÑã íÏÕÇÞ
ÉÚãÇÌ


UNIVERSITE KASDI MERBAH - OUARGLA
ÉÇíÍáÇæ
ÉÚíÈØáÇ
ãæáÚ
Éíáß
Faculté des Sciences de la Nature et
de la Vie
ÉíÍáÇáÇ
ãæáÚáÇ
ãÓÞ
Département des Sciences Agronomiques
Année Universitaire : 2019/2020
THESE
Présentée en vue de l'obtention du diplôme
de Doctorat ès sciences
en Sciences Agronomiques
|
Inventaire et bioécologie de quelques
Orthoptères dans
la vallée du M'Zab (Ghardaïa)
|
Présentée et soutenue publiquement le
05/03/2020
Par : ZERGOUN Youcef
Devant le jury composé de:
|
Président :
|
IDDER Mohamed Azzedine
|
Professeur
|
Univ. de Ouargla
|
|
Directeur de thèse :
|
GUEZOUL Omar
|
Professeur
|
Univ. de Ouargla
|
|
Co-directeur de thèse :
|
SEKOUR Makhlouf
|
Professeur
|
Univ. de Ouargla
|
|
Examinateur :
|
TARAI Nacer
|
Professeur
|
Univ. de Biskra
|
|
Examinateur :
|
SADINE Salah Eddine
|
M.C.A
|
Univ. de Ghardaïa
|
|
Examinatrice :
|
LAKHDARI Wassima
|
Maître de recherche
|
INRAA Touggourt
|
Dédicace
Je dédie ce modeste travail :
A MA TRES CHERE MERE Source inépuisable de tendresse,
de patience et de sacrifice. Ta prière et ta Bénédiction
m'ont été d'un grand secours tout au long de ma vie. Quoique je
puisse dire et écrire, je ne pourrais exprimer ma grande affection et ma
profonde reconnaissance. Puisse Dieu tout puissant, te préserver et
t'accorder santé, longue vie et Bonheur
A MON TRES CHER PERE Pourriez vous trouver dans ce travail le
fruit de toutes vos peines et tous de vos efforts. En ce jour, j'espère
réaliser l'un de tes rêves. Aucune dédicace ne saurait
exprimer mes respects, ma reconnaissance et mon profond amour. Puisse Dieu vous
préserver et vous procurer santé et bonheur.
A MA TRES CHERE EPOUSE Tu as partagé avec moi les
meilleurs moments de ma vie. Je remercie le bon dieu qui a croisé nos
chemins. Puisse le bon dieu nous procure santé et longue vie.
A MES CHERS ENFANTS Puisse dieu vous protègent, vous
procurent santé et longue vie.
A MES FRERES ET SOEURS Aucune dédicace ne peut exprimer
la profondeur des sentiments fraternels et d'amour, d'attachement que
j'éprouve à votre égard. Puisse dieu vous protéger,
garder et renforcer notre fraternité
REMERCIEMENTS
Au terme de ce travail, nous tenons à remercier notre
Dieu le tout puissant de nous avoir donné le courage, la patience et la
santé afin d'achever ce modeste travail.
Je remercie tout d'abord le Professeur Omar GUEZOUL de m'avoir
encadré durant ces trois années de thèse. Merci pour votre
aide et votre patience ; pour l'énergie positive transmise au quotidien,
et pour votre encadrement qui a été stimulant et encourageant.
Merci pour votre rigueur, votre précision, et votre expérience
m'ont inspirée, notamment dans la mise en forme du document.
Merci au Professeur Makhlouf SEKOUR, co-directeur de
thèse, pour avoir su se rendre disponible, pour les échanges
intéressants et constructifs durant ces trois années de
thèse.
J'exprime ma profonde gratitude à Mr Mohamed Azzedine
IDDER, Professeur au département des sciences agronomiques,
Faculté des sciences de la nature et de la vie, Université Kasdi
Merbah - Ouargla, d'avoir accepté la présidence du jury de cette
thèse, qu'il trouve ici l'expression de mon profond respect.
J'exprime ma reconnaissance à Mr. Nacer TARAI,
Professeur à l'université de Biskra, qui a accepté de
participer à ce jury et examiner mon travail.
Je voudrais remercier en particulier Madame Wassima LAKHDARI
Maître de recherche à l'INRAA Sidi Mehdi, Touggourt,
Algérie, de m'avoir fait l'honneur d'accepter d'être examinatrice
de cette thèse, me permettant ainsi de bénéficier de son
expertise. Je la remercie pour le temps qu'elle a consacré à
juger ce travail et je tiens à lui exprimer ma respectueuse
considération.
Un grand merci à Mr. SADINE Salah Eddine, Maître
de conférences à l'université de Ghardaïa pour avoir
accepter de juger ce travail et porter ses appréciations.
Mes remerciements vont à Michael D. HOLTZ, Centre de
développement des grandes cultures, Agriculture et Foresterie, Alberta,
Canada, de m'avoir apporté ces connaissances en statistiques, mes
sincères reconnaissances et remerciements et mes respectueuses
gratitudes.
Notre travail ne saurait être mené à de
meilleurs résultats sans les précieuses informations de Mr.
Bernard DEFAUT, acridologue naturaliste ; Mr. Alain LOUVEAUX du Muséum
National d'Histoire Naturelle de Paris.
Merci à mon très cher ami le Professeur
Noureddine Bouras, pour nos échanges fréquents sur la
thèse, qui m'a beaucoup soutenu, et pour m'avoir intégrée
un peu plus au monde de la recherche.
Je suis particulièrement reconnaissant envers : Aissa
BOUCHEN, Mohamed BAKLI et Kacem SEBA de m'avoir accueilli à leur
exploitations et d'avoir mis à ma disposition tout le matériel
nécessaire au bon déroulement de mes observations.
Merci à mon collègue le Dr. Salah-Eddine SADINE
pour son aide précieux dans la réalisation de l'analyse
factorielle des correspondances. Merci aussi à mon collègue Dr.
Youcef ALIOUA pour son aide dans la réalisation et l'explication
d'Estimate S.
Alors puisque la clôture de ce manuscrit m'en offre
l'occasion, j'adresse un grand merci à tous ceux que j'ai pu
croisé jusqu'ici, tous ceux qui m'ont transmis un peu de leur
savoir-vivre, de leur connaissance, de leur engagement et de leur amour. Il
s'agit notamment des personnes qui m'ont suivi, formé et encadré,
des collègues et amis qui m'ont apporté leur aide chaque fois que
j'en avais besoin.
Résumé
Inventaire et bioécologie de quelques
Orthoptères dans la vallée du M'Zab (Ghardaïa)
Neuf stations ont été choisies pendant trois ans
en utilisant l'échantillonnage par quadrats. 47espèces
d'Acridiens sont inventoriés au niveau des neuf stations de la
vallée du M'Zab. Parmi ces derniers, 11 espèces nouvelles sont
recensées pour la première fois dans la région de
Ghardaïa. La sous-famille des Oedipodinae (11 espèces) est la plus
diversifiés, tandis que la sous-famille des Tetriginae est faiblement
représentée avec seulement une seule espèce. La station de
Ben Isguen semble la plus riche en espèces d'Orthoptères.
Respectivement dans le milieu cultivé (24 espèces), le milieu
naturel (21 espèces) et le milieu phoenicicole (18 espèces). Il
est à remarquer, que les Orthoptères recherchent une
végétation herbacée dense, et une intensité
agricole faible. Les densités maximales de population
d'Orthoptères caractérisent les relevés effectués
en milieux cultivés en saison estivale (163 individus à 118
individus pour 100 m2). Les données sur l'abondance relative
des espèces ont montrés qu'Ochrilidia gracilis,
Acrotylus patruelis, Aiolopus strepens, Morphacris
fasciata et Pyrgomorpha cognata dominaient la plupart des sites.
La valeur de l'indice de la diversité de Shannon-Wiener,
l'équitabilité et l'inverse de l'indice de Simpson évolue
progressivement le Printemps et l'Eté où elle est maximale, puis
diminue en Hiver. Cette diversité Alpha est élevée dans
les sites cultivée moins perturbé et les palmeraies mal
entretenues. L'étude du cycle biologique de 26 Caelifères
présents sur les biotopes, nous a permis de déterminer dix
espèces à une seule génération onze à deux
générations annuelles et cinq à trois
générations annuelles. A la lumière de l'étude du
régime alimentaire des sept Acridiens, on distingue deux groupes de
Caelifera, Polyphages pour la majorité (Acrotylus patruelis,
Heteracris annulosa, Aiolopus strepens, Pyrgomorpha
cognata et Morphacris fasciata) et Oligophages pour Acrida
turrita et Ochrilidia gracilis. Il est à constaté
que les plantes les plus ingérées ne sont pas forcément
les plus appétissantes. Par ailleurs, un végétal à
faible recouvrement dans le biotope peut être attiré par les
Orthoptères.
Mots clés : Orthoptera,
biodiversité, cycle biologique, régime alimentaire, vallée
du M'Zab (Sahara septentrionale d'Algérie).
Abstract
Inventory and bioecology of some Orthoptera of the Mzab
valley (Ghardaïa)
Nine sites were chosen for three years using quadrat sampling
method. 47 species of Acridians including eleven new species in the
Ghardaïa .The Oedipodinae subfamily with 11 species was the most
diversified, while the subfamily Tetriginae was the least abundant (represented
by only one species). The locality of Ben Isguen seems the richest in species.
It records respectively in the cultivated environment, natural environment and
palm grove 24, 21 and 18 species of Orthoptera. In addition, Orthoptera are
found to looking for dense herbaceous vegetation and low agricultural
intensity. The maximal densities of Orthoptera population was characterized the
surveys carried out in cultivated areas during the summer season (163
individuals to 118 individuals per 100 m2). Data on the relative
abundance of species have shown that Ochrilidia gracilis,
Acrotylus patruelis, Aiolopus strepens, Morphacris
fasciata and Pyrgomorpha cognata dominated most sites. The value
of the Shannon-Wiener diversity index, the evenness and the inverse of the
Simpson's index progressively change in Spring and Summer which are maximal,
then a decreases was observed in Winter. This Alpha diversity is high in less
disturbed cultivated sites and also in poorly maintained palm groves. The study
of the life cycle of 26 Caelifera present on the biotopes, we have been able to
determine ten species at one generation, eleven species at two generations and
five species to three generations annually. In the light of the study of the
diet of the seven Acridians, two groups of Caelifera can be distinguished:
Polyphagous for the majority of species, Acrotylus patruelis,
Heteracris annulosa, Aiolopus strepens, Pyrgomorpha
cognata et Morphacris fasciata. Oligophageous for Acrida
turrita and Ochrilidia gracilis. It is found that the most
ingested plants are not necessarily the most appetizing. On the other hand, low
cover vegetation in the biotope may be attracted to Orthoptera.
Key words: Orthoptera, biodiversity, life
cycle, diet, Mzab valley, septentrional Sahara of Algeria.
ÕÎáãáÇ
(ÉíÇÏÑÛ)
ÈÇÒã íÏÇæÈ
ÉÍäÌáÇ
ÊÇãíÞÊÓã
ÖÚÈá
ÇíÌæáæßíÇæíÈ
æ ÏÑÌáÇ
|
11
|
ãåäíÈ
|
äã
ÈÏÇäÌáÇ
|
äã
ÇðÚæä 47
.ÊÇäíÚáÇ ÐÎ í
ÊÇÚÈÑãáÇ
ÉÞíÑØ
|
ãÇÏÎÊÓÇÈ
ÊÇæäÓ ËáÇË
ÉÏãá
|
ÚÞÇæã
|
ÉÚÓÊ
|
ÑÇíÊÎÇ
ãÊ
|
. ÚÇæäáÇ
.ÉÍäÌáÇ
ÇãäíÈ
ÇÚæäÊ ÑËßáÇ
íå ÇðÚæä 11 ìáÚ
íæÊÍÊ íÊáÇ
Oedipodinae ÉíÚÑáÇ
ÉáÆÇÚáÇ
ÊäÇß .ÉíÇÏÑÛ
ÉÞØäã í
ÇðÏíÏÌ ÇðÚæä
|
ÚÞæã
|
ä æÏÈí
|
. )ØÞ ÏÍÇæ
|
Úæä
|
ÇåáËãí(
ÉÑæ áÞáÇ íå
Tetriginae ÉíÚÑáÇ
|
ÉáÆÇÚáÇ
ÊäÇß
|
í ìäÛáÇ æå
äÞÒí äÈ
æ 21
ÊÇÊÇÈäáÇ
|
æ 24 áíÎäáÇ
|
äÇÊÓÈæ
ÉíÚíÈØáÇ
ÉÆíÈáÇæ
ÉÚæÑÒãáÇ
|
ÉÆíÈáÇ í
|
íáÇæÊáÇ
|
|
ÊÇÐ
äßÇãáÇ äÚ
|
ËÍÈÊ
|
ÉÍäÌáÇ
|
ÊÇãíÞÊÓã
ä ÇäÏÌæ
|
ßáÐ
|
ìáÚ áÌÓ
ÏÞ
ìáÅ
ÉÇÖáÅÇÈ
ÊÇãíÞÊÓã
äã ÇÚæä 18
æ
ÉíÈÔÚáÇ
ÉíËßáÇ
ÖÇÎäÇ ÊÇÐ
áæÞÍáÇ
íÕáÇ ãÓæã
ááÇÎ
ÉÚæÑÒãáÇ
ÞØÇäãáÇ í
ÉÐäãáÇ
ÊÇäíÚáá
ÉÍäÌáÇ
ÊÇãíÞÊÓã äã
ìæÕÞáÇ
ÉÇËßáÇ
.ÉíÚÇÑÒáÇ
ÉÇËßáÇ
|
Ochrilidia gracilis
|
ä
|
ÚÇæäáá
ÉíÈÓäáÇ
|
ÉÑæáÇ
áæÍ
|
ÊÇäÇíÈáÇ
ÊÑåÙ . )ÚÈÑã
|
ÑÊã 100 áßá
ÇðÏÑ
|
118
|
ìáÅ
|
ÇðÏÑ
|
1 63
|
(
|
ÇæÑØíÓ Pyrgomorpha
cognata æ Morphacris fasciata æ Aiolopus strepens æ Acrotylus
patruelis æ
|
íáÕ
|
í
ðÇíÌíÑÏÊ Simpson
|
ÑÔÄã
|
ÓßÚæ
äÒÇæÊáÇæ Shannon-Wiener
|
ÚæäÊ
|
ÑÔÄã
|
ÉãíÞ
ÑíÛÊÊ
.ÚÞÇæãáÇ
ãÙÚã
|
ìáÚ
|
|
áÞ
ÉÚæÑÒãáÇ
|
ÚÞÇæãáÇ
|
í ÚÊÑã
|
Çá
|
ÚæäÊáÇ
|
ÇÐå
|
.
|
ÁÇÊÔáÇ
|
í
|
ÖÇÎäÇ
ÙÍæá
|
ãË
|
ìÕÞáÇ
ÏÍáÇ
|
Çãåæ
íÕáÇæ
|
ÚíÈÑáÇ
|
|
äã
|
ÇäßãÊ
ÉíæíÍáÇ
|
ÉÆíÈáÇ í
ÉÏæÌæãáÇ Caelifera 26
|
ÉÇíÍ
|
ÉÑæÏá
|
ÉÓÇÑÏ
|
.ÉäÇíÕáÇ
|
ÉÆíÓ
áíÎäáÇ
äíÊÇÓÈ
|
í ÇÖíæ
ÇÈÇÑØÖÇ
|
ÉÓÇÑÏ ÁæÖ
í .ÇíæäÓ
áÇíÌ ÉËáÇË
ÊÇÐ ÚÇæä
ÉÓãÎæ äíáíÌ
ÊÇÐ ÇÚæä ÑÔÚ
ÏÍ ÏÍÇæ áíÌ
ÊÇÐ ÚÇæä
ÉÑÔÚ ÏíÏÍÊ
ÉÓÇÑÏ
ÁæÖ
í .ÇíæäÓ
áÇíÌ
ÉËáÇË ÊÇÐ
ÚÇæä ÉÓãÎæ
äíáíÌ ÊÇÐ
ÇÚæä ÑÔÚ ÏÍ
ÏÍÇæ áíÌ
ÊÇÐ ÚÇæä
ÉÑÔÚ
ÏíÏÍÊ
ÉÈÓäáÇÈ
ÇÐå æ ÉÏÏÚÊã
ÊÇÊÇÈä Éáß - :
äíÊÚæãÌã
ÚÇæäáÇ
ãÙÚãá
ÉÈÓäáÇÈ ÇÐå
æ ÉÏÏÚÊã
ÊÇÊÇÈä Éáß - :
äíÊÚæãÌã
äíÈ ÒííãÊáÇ
äßãí ÈÏÇäÌ
ÉÚÈÓá
íÆÇÐÛáÇ
ãÇÙäáÇ
ÚÇæäáÇ
ãÙÚãá
ãÇÙäáÇ
äíÈ
񒒋懂
äßãí ÈÏÇäÌ
ÉÚÈÓá
íÆÇÐÛáÇ
Pyrgomorpha cognata Aiolopus strepens
Heteracris annulosa Acrotylus patruelis
ÊÇÊÇÈäáÇ
ä ÏÌæ ÏÞá .Ochrilidia gracilis
æ Acrida turrita áËã
ÉáíáÞ
ÊÇÊÇÈä Éáß -
.Morphacris fasciataæ
ÊÇÊÇÈäáÇ
ä
ÏÌæ ÏÞá .Ochrilidia
gracilis æ Acrida turrita áËã
ÉáíáÞ
ÊÇÊÇÈä Éáß
- .Morphacris fasciataæ
|
íÊÇÈäáÇ
|
ÁÇØÛáÇ
ÊÇÐ ÉÆíÈáÇ
|
ìáÅ
|
ÉÍäÌáÇ
|
ÊÇãíÞÊÓã
ÈÐÌäÊ
|
ÏÞ ìÑÎ
ÉíÍÇä
|
äã .ÉíåÔ
ÑËßáÇ
ÉÑæÑÖáÇÈ
|
ÊÓíá
|
ÇðÚáÇÊÈÇ
ÑËßáÇ
|
áÇ
.
ÁÇÑÍÕÁÇÑÍÕáÇ
áÇãÔ ÈÇÒã
íÏÇæ
íÆÇÐÛáÇ
ãÇÙäáÇ
ÉÇíÍáÇ ÉÑæÏ
íÌæáæíÈáÇ
ÚæäÊáÇ ÉÍäÌ
áÇ ÊÇãíÞÊÓã
: ÉáÇÏáÇ
ÊÇãáßáÇ
áÇ
áÇãÔ ÈÇÒã
íÏÇæ
íÆÇÐÛáÇ
ãÇÙäáÇ
ÉÇíÍáÇ ÉÑæÏ
íÌæáæíÈáÇ
ÚæäÊáÇ ÉÍäÌ
áÇ ÊÇãíÞÊÓã
: ÉáÇÏáÇ
ÊÇãáßáÇ .
ÑÆÇÒÌáÇ
a
Liste des abréviations
|
DSA : Direction des Services Agricoles
|
|
BNEDER : Bureau National d'Etudes pour le Développement
Rural
|
|
DPAT : Direction de la Planification et de l'Aménagement
du Territoire
|
|
ONM : Office National de la Météorologie
|
|
FAO : L'Organisation des Nations unies pour l'Alimentation et
l'Agriculture
|
|
WMO : Organisation météorologique mondiale
|
Liste des photos
|
Photos
|
Titre
|
Pages
|
|
1
|
Les trois milieux (cultivé, palmeraie et naturel) du site
Touzouz (Ghardaïa)
|
21
|
|
2
|
Les trois milieux (cultivé, palmeraie et naturel) du site
N'tissa (Ben Isguen)
|
23
|
|
3
|
Les trois milieux (cultivé, palmeraie et naturel) du site
El Djaoua (El Atteuf)
|
26
|
|
4
|
Epidermes des principales espèces
végétales trouvées dans les fèces des Acridiens
|
80
|
b
Liste des figures
|
Figure
|
Titre
|
Page
|
|
Figure 1.
|
Situation géographique de la wilaya de Ghardaïa
|
6
|
|
Figure 2.
|
Diagramme Ombrothermique de Bagnouls et Gaussen (1953) pour
une période de 10 ans (2009-2018) de la région de
Ghardaïa
|
14
|
|
Figure 3.
|
Etage bioclimatique de la région de Ghardaïa selon
le Climagramme pluviothermique d'Emberger (1955) modifié par Stewart
(1969)
|
15
|
|
Figure 4.
|
Démarche à suivre pour la préparation de
l'épidermothèque de référence
|
32
|
|
Figure 5.
|
Démarche à suivre pour l'analyse des fèces
des Acridiens
|
33
|
|
Figure 6.
|
Pourcentages des différentes sous-familles
d'Orthoptères de la région d'étude
|
43
|
|
Figure 7.
|
Courbes d'accumulation de la richesse spécifique des neuf
sites d'étude
|
46
|
|
Figure 8.
|
Variation saisonnière de la densité de
population d'Orthoptères (adultes et larves) enregistrée au cours
de la période d'étude dans les milieux cultivés
|
47
|
|
Figure 9.
|
Variation saisonnière de la densité de
population d'Orthoptères (adultes et larves) enregistrée au cours
de la période d'étude dans les palmeraies
|
48
|
|
Figure 10.
|
Variation saisonnière de la densité de
population d'Orthoptères (adultes et larves) enregistrée au cours
de la période d'étude dans les milieux naturels
|
49
|
|
Figure 11.
|
Constance des Orthoptères dans les trois milieux
cultivés de la vallée du M'Zab
|
54
|
|
Figure 12.
|
Constance des Orthoptères dans les trois palmeraies de la
vallée du M'Zab
|
55
|
|
Figure 13.
|
Constance Orthoptères dans les trois milieux naturels de
la vallée du M'Zab
|
55
|
|
Figure 14.
|
Représentation des espèces et des stations dans le
plan F1-F2 de l'AFC
|
62
|
|
Figure 15.
|
Dendrogramme de similarité entre les neuf peuplements
Orthoptérologique
|
65
|
|
Figure 16.
|
Evolution mensuelle des densités larvaires et d'adultes
pour les espèces Printanières
|
68
|
|
Figure 17.
|
Evolution mensuelle des densités larvaires et d'adultes
pour les espèces Estivales
|
69
|
|
Figure 18.
|
Evolution mensuelle des densités larvaires et d'adultes
pour les espèces de l'Eté- Automne
|
70
|
|
Figure 19.
|
Evolution mensuelle des densités larvaires et d'adultes
pour les espèces à deux générations annuelles avec
reproduction continue
|
71
|
|
Figure 20.
|
Evolution mensuelle des densités larvaires et d'adultes
pour les espèces à deux générations annuelles
à hivernation larvaire
|
74
|
|
Figure 21.
|
Evolution mensuelle des densités larvaires et d'adultes
pour les espèces à deux générations annuelle
à hivernation embryonnaire
|
75
|
|
Figure 22.
|
Evolution mensuelle des densités larvaires et d'adultes
pour les espèces à trois générations annuelles
|
76
|
|
Figure 23.
|
Comparaison entre les indices d'attraction des espèces
végétales ingérées par Acrotylus patruelis
et leurs taux de recouvrement au niveau du milieu cultivé
|
83
|
|
Figure 24.
|
Comparaison entre les indices d'attraction des espèces
végétales ingérées par Heteracris annulosa
et leurs taux de recouvrement au niveau du milieu cultivé
|
84
|
|
Figure 25.
|
Comparaison entre les indices d'attraction des espèces
végétales ingérées par Aiolopus strepens
et leurs taux de recouvrement au niveau du milieu cultivé
|
85
|
|
Figure 26.
|
Comparaison entre les indices d'attraction des espèces
végétales ingérées par Pyrgomorpha cognata
et leurs taux de recouvrement au niveau du milieu cultivé
|
86
|
|
Figure 27.
|
Comparaison entre les indices d'attraction des espèces
végétales ingérées par Morphacris fasciata
et leurs taux de recouvrement au niveau du milieu cultivé
|
87
|
|
Figure 28.
|
Comparaison entre les indices d'attraction des espèces
végétales ingérées par Ochrilidia gracilis
et leurs taux de recouvrement au niveau du milieu cultivé
|
88
|
|
Figure 29.
|
Comparaison entre les indices d'attraction des espèces
végétales ingérées par Acrida turrita et
leurs taux de recouvrement au niveau du milieu cultivé
|
89
|
C
Liste des tableaux
|
Tableau
|
Titre
|
Page
|
|
Tableau 1.
|
Températures pour une période de 10 ans dans la
région de Ghardaïa
|
8
|
|
Tableau 2.
|
Précipitations en (mm) pour une période de 10 ans
dans la région de Ghardaïa
|
10
|
|
Tableau 3.
|
Valeurs moyenne mensuelle de l'humidité (%) dans la
région de Ghardaïa
|
11
|
|
Tableau 4.
|
Vitesse du vent moyenne mensuelle en m/s pour une
période de 10 ans dans la région de Ghardaïa
|
12
|
|
Tableau 5.
|
Moyenne mensuelle de la durée d'insolation dans la
région de Ghardaïa pour une période de 10 ans
|
13
|
|
Tableau 6.
|
Liste des principales espèces végétales de
la région de Ghardaïa
|
16
|
|
Tableau 7.
|
Liste des principales espèces aviennes de la région
de Ghardaïa
|
17
|
|
Tableau 8.
|
Taux de recouvrement des espèces
végétales dans le milieu cultivé Touzouz (Ghardaïa)
pour un transect de 500m2
|
22
|
|
Tableau 9.
|
Taux de recouvrement des espèces
végétales dans la palmeraie de Touzouz (Ghardaïa) pour un
transect de 500m2
|
22
|
|
Tableau 10.
|
Taux de recouvrement des espèces
végétales dans le milieu naturel Touzouz (Ghardaïa) pour un
transect de 500 m2
|
23
|
|
Tableau 11.
|
Taux de recouvrement des espèces
végétales dans le milieu cultivé N'tissa (Ben Isguen) pour
un transect de 500m2
|
24
|
|
Tableau 12.
|
Taux de recouvrement des espèces
végétales dans le milieu cultivé N'tissa (Ben Isguen) pour
un transect de 500m2
|
25
|
|
Tableau 13.
|
Taux de recouvrement des espèces
végétales dans le milieu naturel N'tissa (Ben Isguen) pour un
transect de 500 m2
|
25
|
|
Tableau 14.
|
Taux de recouvrement des espèces
végétales dans le milieu cultivé El Djaoua (El Atteuf)
pour un transect de 500m2
|
27
|
|
Tableau 15.
|
Taux de recouvrement des espèces
végétales dans la palmeraie d'El Djaoua (El Atteuf) pour un
transect de 500 m2
|
27
|
|
Tableau 16.
|
Taux de recouvrement des espèces
végétales dans le milieu naturel (El Atteuf) pour un transect de
500 m2
|
28
|
|
Tableau 17.
|
Inventaire de Orthoptères de neuf sites de la
vallée du M'Zab
|
41
|
|
Tableau 18.
|
Résumé du nombre de sous-familles, genres et
espèces pour chaque famille d'Orthoptères de la vallée du
M'Zab
|
42
|
|
Tableau 19.
|
Abondance relative (%) des Orthoptères dans 9 stations de
la vallée du M'Zab
|
50
|
|
Tableau 20.
|
Constance (%) des espèces d'Orthoptères
inventoriés dans les neuf sites de la vallée du M'Zab
|
53
|
|
Tableau 21.
|
Classes de constance calculées des espèces
d'Orthoptères recensées dans les neuf d'étude choisies
à la vallée du M'Zab
|
54
|
|
Tableau 22.
|
Diversité Alpha des Orthoptères des neuf sites de
la vallée du M'Zab
|
57
|
|
Tableau 23.
|
Variation saisonnière de l'indice de diversité
de Shannon-Wiener dan les neuf sites de la région d'étude
|
58
|
|
Tableau 24.
|
Variation saisonnière de l'indice d'Equitabilité
de Pielou (J) dan les neuf sites de la région d'étude
|
59
|
|
Tableau 25.
|
Variation saisonnière de l'inverse de l'indice de
Simpson dan les neuf sites de la région d'étude
|
60
|
|
Tableau 26.
|
Fréquence (%) des espèces
végétales présentes dans les fèces des sept
espèces Acridiennes dans le milieu cultivé (Touzouz)
|
79
|
|
Tableau 27.
|
Recouvrement global, surface moyenne, taux de consommation et
indice d'attraction des plantes consommées par d'Acrotylus
patruelis
|
82
|
|
Tableau 28.
|
Recouvrement global, surface moyenne, taux de consommation et
indice d'attraction des plantes consommées par d'Heteracris
annulosa
|
83
|
|
Tableau 29.
|
Recouvrement global, surface moyenne, taux de consommation et
indice d'attraction des plantes consommées par Aiolopus
strepens
|
84
|
|
Tableau 30.
|
Recouvrement global, surface moyenne, taux de consommation et
indice
|
85
|
d
|
d'attraction des plantes consommées par Pyrgomorpha
cognata
|
|
|
Tableau 31.
|
Recouvrement global, surface moyenne, taux de consommation et
indice d'attraction des plantes consommées par Morphacris
fasciata
|
86
|
|
Tableau 32.
|
Recouvrement global, surface moyenne, taux de consommation et
indice d'attraction des plantes consommées par d'Ochrilidia
gracilis
|
87
|
|
Tableau 33.
|
Recouvrement global, surface moyenne, taux de consommation et
indice d'attraction des plantes consommées d'Acrida turrita
|
88
|

Sommaire
Titres Page
Introduction 1
6
Chapitre I : Présentation de la région
d'étude
I .1. Situation géographique de la région
d'étude 6
I.2. Relief 7
I.3. Synthèse climatique 7
I.3.1. Températures 7
I.3.2. Précipitations 10
I.3.3. Humidité relative de l'air 11
I.3.4. Vent 12
I.3.5. Insolation 13
I.4. Classification du climat 14
I.4.1. Diagramme Ombrothermique de Bagnouls et Gaussen 14
I.4.2. Climagramme pluviométrique d'Emberger 15
I.5. Sols 16
I.6. Flore 16
I.7. Faune 17
18
Chapitre II : Matériel et méthodes
II .1. Matériel utilisé 18
II .1.1. Sur le terrain 18
II .1.2. Au laboratoire 18
II .1.2.1. Détermination des Orthoptères 18
II .1.2.2. Etude du régime alimentaire 19
II .1.2.3. Constitution d'un herbier 19
II .2. Méthodologie de travail 19
II .2.1. Sur le terrain 19
II .2.1.1. Choix des stations d'étude 20
II .2.1.2. Etude de la végétation 20
II .2.1.3. Caractéristiques des stations d'étude
20
II.2.1.3.1. Touzouz (Ghardaïa) 20
II.2.1.3. 1. 1. Milieu cultivé 21
II.2.1.3. 1. 2. Palmeraie 21
II.2.1.3. 1. 3. Milieu naturel 23
II.2.1.3.2. N'tissa (Ben Isguen) 23
II.2.1.3. 2. 1. Milieu cultivé 24
II.2.1.3. 2. 2. Palmeraie 24
II.2.1.3. 2. 3. Milieu naturel 25
II.2.1.3.3. El Djaoua (El Atteuf) 26
II.2.1.3.3.1. Milieu cultivé 26
II.2.1.3.3.2. Palmeraie 27
II.2.1.3.3.3. Milieu naturel 27
II. 2.1.4. Déroulement des prospections 28
II
II .2.1.5. Fiche de terrain 28
II .2.1.6. Echantillonnage des Orthoptères 29
II .2.1.7. Suivi du cycle biologique des Acridiens 29
II .2.1.8. Méthode d'étude du régime
alimentaire sur le terrain 30
II .2.1.8. 1. Espèces d'Orthoptères
étudiées 30
II .2.1.8. 2. Prélèvement des fèces 30
II .2.2. Méthodes utilisés au laboratoire 31
II .2.2. 1. Détermination des espèces
capturées 31
II .2.2. 2. Conservation des échantillons 31
II .2.2. 3. Constitution d'un herbier de
référence 32
II .2.2. 4. Détermination des plantes 32
II .2.2. 5. Préparation d'une
épidermothèque de référence 32
II .2.2.6. Analyse des fèces 33
II .3. Méthodes d'exploitation des résultats
34
II .3.1. Exploitation des résultats par des indices
écologiques 34
II .3.1.1. Nombre d'individus et richesse spécifique
34
II. 3.1.2. Densité des Criquets 34
II .3.1.3. Abondance relative 35
II .3.1.4. Fréquence d'occurrence ou constance des
espèces 35
II .3.1.5. Diversité Alpha 35
II .3.1.5.1. Indice de diversité de Shannon-Wiener
36
II .3.1.5.2. Equitabilité 36
II .3.1.5.3. L'indice de Simpson 36
II .3.1.6. Indices écologiques utilisés dans le
régime alimentaire 37
II .3.1.6.1. Fréquence des espèces
végétales dans les fèces 37
3.1.6.2. Méthode des surfaces 37
II .3.2. Analyses statistiques 38
II .3.2.1. Estimation de la richesse spécifique 38
II .3.2.2. Test de Kruskal et Wallis 39
II .3.2.3. L'analyse factorielle des correspondances (AFC)
39
II .3.2.4. La classification ascendante hiérarchique ou
CAH 39
40
Chapitre III : Résultats et Discussions
III.1. Inventaire concernant la faune Orthoptérologique
de la vallée du M'Zab 40
III.2. Estimation de la richesse spécifique 44
III.3. Variation saisonnière de la densité des
Orthoptères 47
III.4. Abondance relative 49
III.5. Constance ou Fréquence d'Occurrence 52
III.6. Diversité Alfa 56
III
III.6.1. Variation saisonnière de la diversité
58
III.6.1.1. Indice de diversité de Shannon-Wiener (H')
58
III.6.1.2. Indice d'Equitabilité de Pielou (J) 59
III.6.3. L'inverse de l'indice de Simpson 60
III.7. Analyse factorielle des correspondances 61
III.8. Classification hiérarchique ascendante 64
III.9. Cycle biologique des principales espèces
Acridiennes de la vallée du M'Zab 65
III.9.1. Espèces à une seule
génération annuelle 66
III.9.1.1. Espèces Printanières 67
III.9.1.2. Espèces Estivales 67
III.9.1.3. Espèces de l'Eté-Automne 70
III.9.2. Espèces à deux générations
annuelles 71
III.9.2.1. Espèces à deux générations
annuelles avec reproduction continue 71
III.9.2.2. Espèces à deux générations
annuelles à hivernation larvaire 72
III.9.2.3. Espèces à deux générations
annuelles à hivernation embryonnaire 74
III.9.3. Espèces à trois générations
annuelles 75
77
78
82
III.10. Etude qualitative et quantitative du régime
alimentaire des principales espèces Acridiennes de la vallée du
M'Zab.
III.10.1. Etude qualitative de la consommation chez les imagos
des principales
espèces Acridiennes dans le milieu cultivé
(Touzouz).
III.10.2. Etude quantitative de la consommation chez les imagos
des principales espèces Acridiennes dans le milieu cultivé
(Touzouz).
III.10.2.1. Acrotylus patruelis 82
III.10.2.2. Heteracris annulosa 83
III.10.2.3. Aiolopus strepens 84
III.10.2.4. Pyrgomorpha cognata 85
III.10.2.5. Morphacris fasciata 86
III.10.2.6. Ochrilidia gracilis 87
III.10.2.7. Acrida turrita 88
Conclusion 91
Références bibliographiques 95
Annexes
INTRODUCTION
1
Introduction
Introduction
Les Acridiens sont des insectes regroupés dans l'ordre
des Orthoptera Latreille, 1793. Avec plus de 28419 espèces existantes
(Cigliano et al., 2019). Cet ordre fait partie des
insectes les plus reconnaissables et les plus familiers, notamment les
sauterelles, les criquets et les grillons. Bien que l'on pense souvent que les
criquets sont associés aux prairies, de nombreuses espèces se
trouvent actuellement dans les forêts tropicales, les zones arbustives,
les déserts, les zones humides et les régions alpines
(Song et al., 2018).
Ce sont des insectes sauteurs et stridulants. Ils sautent
grâce à des pattes postérieures bien
développées pourvues d'une musculature puissante. Ils stridulent
en frottant les pattes postérieures contre les élytres (criquets,
sauterelles) ou en utilisant un appareil stridulant différencié
sur les élytres (grillons). On distingue deux sous-ordres : les
Ensifères et les Caelifères. Le terme "sauterelle" a
été employé pour désigner les Ensifères, le
terme de "criquet" étant généralement utilisé pour
désigner les Acridiens (Lecoq, 2012).
Le régime alimentaire des Ensifères se compose
généralement de végétaux et de petits animaux, mais
certaines grandes espèces ne se nourrissent que d'insectes
(Barataud, 2005 ; Dehondt et al., 2013). Ensemble,
les Ensifères comprennent 11 familles, 2111 genres et 14313
espèces (Cigliano et al., 2019). Des
données taxonomiques actualisées sur Ensifera en Algérie
attestent de la présence de 136 espèces / sous-espèces
(Cigliano et al., 2019) réparties en 7
familles. Alors que Mohamed Sahnoun et al., (2010)
ont mentionnés 118 espèces et Chopard (1943)
a cité 96 espèces d'Ensifères sur le territoire.
Avec plus de 11794 espèces décrites (Cigliano et
al., 2019), les Caelifères dans leur ensemble,
montrent une distribution cosmopolite, bien que certains groupes aient des
distributions plus limitées (Song et al.,
2015). Les Caelifères ont des antennes courtes et
multiarticulées à régime alimentaire phytophage
(Lecoq & Chuzel, 2007). La liste taxonomiques
actualisées sur Caelifera en Algérie attestent de la
présence de 154 espèces / sous-espèces (Cigliano
et al., 2019) réparties en 4 familles.
Les Orthoptères jouent également un rôle
majeur dans les réseaux trophiques, car ils représentent des
consommateurs de premier ordre et souvent constituent une fraction
considérable de la biomasse d'arthropodes dans les prairies
(Jamison et al., 2002). De nombreux vertébrés,
notamment les oiseaux des terres agricoles utilisent les Orthoptères en
tant que nourriture pour élever leurs petits (Barker,
2004).
2
Introduction
Le groupe taxonomique des Orthoptères occupe donc une
place prépondérante dans le réseau trophique des marais
littoraux et notamment pour les limicoles en migration postnuptiale
(Barataud, 2005). Ils jouent également un rôle
trophique majeur, étant une proie pour d'autres
invertébrés tels que les araignées (Badenhausser
et al., 2009), les reptiles et les mammifères
(Kok & Louw, 2000).
Plusieurs études ont confirmé que les
récents changements climatiques avaient une forte incidence sur
l'abondance et la répartition géographique des insectes
(Eo et al., 2017) et sur la richesse des parasites,
en particulier des Orthoptères (Weiss et al.,
2012). En outre, de nombreuses recherches considèrent les
Acridiens comme des bio indicateurs du changement climatique
(Báldi & Kisbenedek, 1997) en raison de leur
sensibilité aux conditions microclimatiques (Zografou et
al., 2009). La température élevée peut
affecter directement et indirectement tous les arthropodes en augmentant ou en
diminuant leurs taux métaboliques, en modifiant leurs schémas
d'activité et leurs taux de développement (Zografou et
al., 2017). Les conditions météorologiques
à l'échelle régionale, en particulier les
précipitations, sont également un facteur déterminant de
la densité de population des criquets (Wysiecki et al.,
2011). Le manque de précipitations est
généralement cité comme le principal facteur limitant
l'accroissement de la population (Hunter et al.,
2001). En outre, les espèces à faible mobilité
sont sensibles au changement climatique car elles peuvent ne pas être en
mesure de modifier assez rapidement leur aire de répartition pour
s'adapter aux changements environnementaux (Eo et al.,
2017). Le changement climatique affecte également les insectes
indirectement en affectant leurs plantes hôtes (Cisse et
al., 2013).
Les sauterelles habitent généralement dans une
végétation ouverte et semi-ouverte, où les rayons du
soleil atteignent le sol directement. Ils sont principalement associés
avec une végétation à ciel ouvert telle que les champs et
les savanes (Capinera et al., 2004). La composition
de la végétation et ses caractéristiques structurelles
sont connues pour influencer la distribution des espèces
d'Orthoptères aux échelles régionale et locale
(Guido & Gianelle, 2001). Le rôle le plus évident de
la végétation est de servir de nourriture. Souvent les
mêmes plantes tiennent lieu d'abri de perchoir et de nourriture. Certains
acridiens sont oligophages, d'autres polyphages (Lecoq & Chuzel,
2007). L'augmentation du pourcentage de recouvrement herbacé
favorise la richesse spécifique et le nombre d'individus des
Orthoptères. La présence d'une strate herbacée est donc
indispensable pour la plupart des
3
Introduction
espèces d'Orthoptères. A l'opposé, la
strate arborée est défavorable à la richesse
spécifique (Jaulin, 2009).
Outre les rôles (nourriture, abri, perchoir, ...), le
tapis végétal peut favoriser la grégarisation. Il peut en
effet concentrer les populations de criquets et augmenter leur densité
au dessus du seuil de grégarisation. Ce phénomène peut
être le résultat : - de sa structure : touffe ou homogène -
de sa phénologie : dessèchement et restriction progressive,
localement, des zones favorables - de sa composition floristique : existence de
plantes attractives (Lecoq, 2012). La végétation
dense et haute n'est pas facilement réchauffée par le soleil ou
refroidi par la libre circulation de l'air, contrairement à une
végétation plus clairsemée qui offre de meilleures
conditions pour les sauterelles (Gardiner & Hassall,
2009). Une végétation dense à fort pourcentage de
couverture fournit cependant des sources de nourriture abondantes
(Gardiner, 2018). Du fait de leur herbivorie, les criquets
sont très dépendants de la végétation, ce qui en
fait des indicateurs de plus en plus reconnus pour traduire par la structure de
leurs communautés, le niveau de perturbation anthropique et la
qualité des milieux (Gardiner et al., 2005).
Cependant, la menace que certains scientifiques ont jugée la plus
nuisible à la biodiversité est la destruction de l'habitat. Les
assemblages d'Orthoptères sont sensibles aux perturbations et ils
peuvent être utilisé comme indicateur de la dégradation des
terres ou le changement d'habitat (Gardiner et al., 2005 ;
Terra et al., 2017).
Adu-Acheampong et al., (2016) ont
constaté que l'agriculture a un impact négatif sur la
diversité des sauterelles. Les menaces viennent de plus en plus avec la
demande de nourriture, nécessitant l'expansion des terres agricoles au
détriment de la végétation naturelle (Norris,
2008). Les pâturages non pâturés fournissent des
refuges importants pour les Orthoptères (Gardiner,
2018). En effet, la structure des prairies constitue un excellent
habitat pour les Orthoptères lorsqu'elles ne sont pas coupées
(Gardiner et al., 2015). Par contre le
surpâturage constitue la plus grande menace pour les Orthoptères
(Hochkirch et al., 2016). Le pâturage intensif
des bovins et des ovins sur des sols fertiles peut produire un gazon dense et
court des espèces de prairies, qui ne convient pas aux criquets
(Gardiner et al., 2002). Les effets du pâturage
sur les Orthoptères sont multiples et dépendent de nombreux
facteurs biotiques et abiotiques liés à l'animal
pâturé, à l'Orthoptère et à sa gestion
(Bazelet & Gardiner, 2018). Des études
récentes en Allemagne et dans d'autres pays occidentaux ont
signalées le déclin calamiteux de la biomasse d'insectes volants
(Grubisic et al., 2018 ; Hallmann et al., 2017 ;
Leather, 2017) et la diversité des espèces (Fox,
2012).
4
Introduction
Les facteurs à l'origine de cette baisse ne sont pas
encore complètement explorés mais sont clairement liés
à la modification des modes d'utilisation des terres, à
l'utilisation de pesticides et changements climatiques probables
(Hodjat et al., 2019). La destruction actuelle de
l'habitat, le surpâturage et changement climatique (Jowkar et
al., 2016) menacent la biodiversité en
général et la diversité des Caelifera en particulier
(Dey et al., 2018).
Une étude sur l'historique de la faune acridienne en
Iran (Hodjat et al., 2019), montre que les
enquêtes antérieures sur la diversité des espèces
Acridiennes dans de multiples localités était beaucoup plus
élevée par rapport aux études faunistiques plus
récentes. D'après ces auteurs les raisons potentielles du
déclin observé sont les courants d'air importants
résultant du changement climatique mondial, de la pollution de l'habitat
et de la destruction pour la construction et l'exploitation minière et
en particulier du surpâturage. Dans les milieux agricoles, les insectes
remplissent de nombreuses fonctions et constituent un appui considérable
à la régulation des écosystèmes tels que la
décomposition de la matière organique, la régulation des
nutriments, dispersion des semences et des agents pathogènes,
pollinisation, lutte contre les ravageurs et maintien de la biodiversité
(Schowalter et al., 2018). Par conséquent, le
déclin des insectes peut affecter sensiblement le maintien de ces
fonctions avec des conséquences pour la production alimentaire et la
biodiversité (Grubisic et al., 2018).
Malheureusement les populations d'Orthoptères en milieux agricoles sont
peu étudiées, contrairement aux Acridiens des parcours. La faune
Acridienne de L'Algérie en général et du Sahara en
particulier nécessite d'avantage d'études ; car les seules
espèces qui sont bien étudiées sont des espèces
grégaires et économiquement importantes telles que le criquet
pèlerin Schistocerca gregaria (Forskål, 1775) et le criquet
migrateur Locusta migratoria (Linnaeus, 1758). On peut citer entre autres les
travaux de Kherbouche (2007) et Benfekih et
al., (2011).Parmi les études sur la faune des
sautériaux du Sahara septentrionale on cite ceux de Zergoun
(1991, 1994) ; Zergoun et al., ( 2018a, 2018b, 2019)
; Tarai (1991, 1994) ; Tarai et Doumandji
(2009) ; Ould El Hadj (1991, 2004) ;
Doumandji-Mitiche et al., (2001) ; Moussi et
al., (2011, 2014) et Moussi et al., (
2018).
C'est pour cette raison et dans le but d'améliorer les
connaissances sur la faune Acridienne du Sahara que nous allons aborder la
bioécologie et le régime alimentaire des principales
espèces d'Orthoptères de la vallée du M'Zab.
ü Le premier objectif de ce travail est d'établir
une liste des espèces d'Orthoptères inventoriées durant
les trois années de prospections dans les sites d'étude.
Cependant,
5
Introduction
en aucun cas ce type d'inventaire ne peut être
considéré comme exhaustif. La composition, la densité,
l'abondance relative, la constance et la diversité des peuplements
d'Acridiens des milieux sont également étudiées afin de
distinguer la richesse et le nombre d'individus des différents sites.
Suivre l'évolution des ces indices écologiques avec la variation
saisonnière dans chaque habitat.
y' Comme second objectif c'est d'établir le cycle
biologique de 26 espèces de sautériaux en précisant le
nombre de génération de chaque criquet, et
déterminé la période de diapause.
y' Le troisième objectif consiste à une analyse
microscopique, des fragments d'épidermes présents dans les
fèces de sept Acridiens, afin d'identifier les plantes
ingérées par ces Caelifères et de préciser les
préférences alimentaire de chaque criquet.
y' L'objectif à terme est d'évaluer l'influence
de la végétation, les pratiques agricole et son intensité
sur la diversité de ce groupe taxonomique.
Afin d'atteindre les objectifs fixés, notre travail
comprend trois chapitres. Tout d'abord, le premier chapitre expose la
région d'étude avec ces caractéristiques climatiques et
leurs influences sur les Acridiens. Ensuite, la méthodologie et les
outils employés sont décrits dans le deuxième chapitre.
Les résultat et discussions feront l'objet du troisième chapitre.
Pour terminer, une conclusion générale annonçant les
points les plus pertinents de notre étude et des propositions qui
pourraient être utiles dans le proche avenir seront données.
Durant la réalisation de cette étude, des problématiques
différentes se sont dégagées :
· Combien d'espèces nouvelles peut-on
trouvées dans notre région d'études ?
· A quel nombre d'échantillonnage peut-on
s'arrêter ?
· Est-ce que les variations saisonnières ont un
impact sur la diversité des Orthoptères ?
· L'intensité agricole, le couvert
végétal, l'entretien des palmeraies et l'irrigation ont-ils une
influence sur la diversité des Acridiens ?
· Combien de générations par an
présentent- ils ces Caelifères ?
· Quand font-ils leur diapause ?
· Les sautériaux les plus abondants dans les
milieux cultivés s'attaquent- ils aux cultures ?
CHAPITRE I
Présentation de la région d'étude
Chapitre I : Présentation de la région
d'étude
Dans ce chapitre, les particularités de la
vallée du M'Zab sont présentées, notamment sa situation
géographique et les facteurs édaphiques, climatiques et
biologiques qui la caractérisent.
I .1. Situation géographique de la
région d'étude
La vallée du M'Zab, située à 600 km au
sud de la capitale d'Alger est considérée comme l'une des grandes
oasis du Sahara algérien. Administrativement, elle fait partie de la
wilaya de Ghardaïa, regroupant trois chefs lieu de communes, Ghardaïa
chef-lieu de la wilaya occupant l'amont et le centre de la vallée,
Bounoura et El Atteuf occupant la partie aval de la vallée.
Géographiquement la vallée du M'Zab est comprise entre 32°
26' et 32° 31' de latitude Nord et 3° 37' et 3°46' de longitude
Est (Figure 1). Elle est alignée approximativement NW-SE, en partant de
Bouchen, zone de confluence de l'oued El Haimeur (Laadira) avec l'oued Touzouz,
jusqu'à El Atteuf sur une longueur de 23,50 km. La largeur de la
vallée varie entre 2,35 et 1,50 km en amont et diminue au fur et
à mesure vers l'aval pour atteindre 0,55 km tout au sud de la ville d'El
Atteuf. Les altitudes quant à elles sont relativement faibles, elles
diminuent progressivement de l'amont vers l'aval, 514 à 508
mètres à Bouchen, 505 à 485 mètres au niveau la
ville de Ghardaïa, 455 à 450 mètres au niveau d'El Atteuf,
et 435 mètres à Ahbas point le plus bas de l'oasis d'El Atteuf
(B.N.E.D.E.R., 2014).

6
Figure 1. Situation géographique de la
wilaya de Ghardaïa (Zergoun et al., 2018b).
7
Présentation de la région d'étude
I.2. Relief
Dans la vallée du M'Zab, on peut distinguer trois
types de formations géomorphologiques (D.P.A.T.,
2005).
- Chabka du M'Zab : c'est un plateau
crétacé rocheux et découpé en tous les sens par de
petites vallées irrégulières, qui semblent
s'enchevêtrer les unes des autres. Ces vallées sont plus ou moins
parallèles et leur pente dirigée vers l'Est. Le plateau rocheux
occupe une superficie d'environ 8000 Km2, représentant 21 %
de la région du M'Zab (Coyne, 1989). Neuf communes sont
situées en tout ou en partie sur ce plateau (Ghardaïa, Berriane,
Daïa ben dahoua, Bounoura, El Atteuf, Metlili, Sebseb, Mansoura et Hassi
-Fhel).
- Région des dayas : au sud de
l'Atlas saharien d'une part et d'autre part du méridien de Laghouat
s'étend une partie communément appelée «plateau des
dayas» en raison de l'abondance de ces entités physionomiques et
biologiques qualifiées des dayas. Dans la région de Ghardaïa
seule la commune de Guerrara, située au nord-est, occupe une petite
partie du pays des dayas.
- Région des Regs : Située
à l'Est de la région de Ghardaïa, cette région est
caractérisée par l'abondance des Regs, qui sont des sols solides
et caillouteux, occupée par les communes de Zelfana, Bounoura et El
Atteuf.
I.3. Synthèse climatique
Les données climatiques sont fournies par la station
météorologique de Ghardaïa. Nous avons pris en
considération les moyennes mensuelles concernant une période
s'étalant sur 10 ans de 2009 à 2018, afin de mieux distinguer les
variations climatiques de la région d'étude. Pour Ramade
(1984), les données climatiques sont non seulement des
éléments décisifs du milieu physique mais ont aussi des
répercussions profondes sur les êtres vivants animaux et
végétaux. Selon Lecoq (2012), Les principaux
facteurs régulant la taille, la qualité et la distribution des
populations du Criquet pèlerin sont principalement les facteurs
climatiques.
I.3.1. Températures
La température est un facteur écologique
capital. Elle agit sur la répartition géographique des
espèces animales (Dreux, 1980). Elle dépend
fondamentalement de la quantité de rayonnement reçue du soleil,
soit directement, soit indirectement par
8
Présentation de la région d'étude
l'intermédiaire de la surface de la terre. Le tableau 1
rassemble les valeurs des températures moyennes mensuelles pour une
période de 10 ans (2009 à 2018) dans la région de
Ghardaïa. Tableau 1. Les températures pour une
période de 10 ans (2009 à 2018) dans la région de
Ghardaïa.
|
Mois
|
I
|
II
|
III
|
IV
|
V
|
VI
|
VII
|
VIII
|
IX
|
X
|
XI
|
XII
|
|
Températures moyennes
mensuelles (°C)
|
12,05
|
13,10
|
17,04
|
21,60
|
26,23
|
31,04
|
34,17
|
29
|
30,27
|
23,47
|
16,71
|
12,64
|
|
Moyenne des
Maxima (°C)
|
20,08
|
22,46
|
27,49
|
32,26
|
37,23
|
40,75
|
42,01
|
42,39
|
39,17
|
32,94
|
26,34
|
21,36
|
|
Moyenne des
minima (°C)
|
4,09
|
4,94
|
7,67
|
11,94
|
16,34
|
21,70
|
25,77
|
25,17
|
20,07
|
14,67
|
8,38
|
4,39
|
(ONM, 2019)
Les températures moyennes mensuelles sont très
variables, basses en hiver surtout aux mois de décembre, janvier et
décembre avec respectivement 12,05°C et 12,64°C. Par contre,
entre juin et septembre les températures moyennes mensuelles sont
élevées variant entre 29°C en août et 34,17°C en
juillet (Tableau 1). La température moyenne annuelle est de l'ordre de
22,28 °C. Les valeurs des températures maximas sont les plus
élevées en mois de juillet et aout (42,01-42,39 °C). Les
valeurs les plus faibles des minimas sont enregistrées en mois de
décembre et janvier (4,39-4,09 °C). Chez les acridiens, la
température élevée va permettre un développement
plus ou moins rapide des oeufs et des larves, et permettre l'envol et les
migrations des ailés. En effet d'après Lecoq
(2010), L'ensemble de l'aire d'habitat du Criquet pèlerin est
situé dans des zones où les températures moyennes
annuelles sont élevées (30 - 35°C moyenne / an). Il est
à rappeler que la plupart des insectes sont vulnérables aux
changements environnementaux, ce qui peut réduire leur abondance et leur
aire de répartition. Parmi les variables climatiques, la
température affecte le plus les insectes (Eo et al.,
2017). Par exemple, les Orthoptères, comme tous les insectes,
sont poikilothermiques, ce qui implique qu'ils sont affectés par la
température ambiante (Antonatos et al., 2013).
En effet, le comportement, le métabolisme, la croissance, le
développement, le cycle vital, la dynamique de la population et la
répartition géographique sont tous fortement influencés
par la température (Fielding, 2004). Le minimum de
température à laquelle les insectes commencent à se
développer est appelé le «seuil de développement
inférieur». La température maximale à laquelle les
insectes arrêtent leur développement est appelé «seuil
de développement supérieur» (Hernándes-Zul et
al., 2012). Les seuils inférieur et supérieur
varient entre espèces et ont été déterminées
pour
9
Présentation de la région d'étude
beaucoup d'insectes nuisibles (Logan et al.,
2005). Selon Harris et al., (2015), les
sauterelles ne sont pas distribuées au hasard sur un site, mais
sélectionnez des micros habitats dont les températures se
rapprochent le plus de leur température préférée.
La température influence fortement tous les aspects de la biologie des
acridiens (Brust & Hoback, 2009). Les effets de
différentes températures sur le cycle de vie de Calliptamus
italicus dans les prairies du Xinjiang, en Chine ont été
examiné par Ren et al., (2016); les
résultats indiquent que la température affecte de manière
significative la biologie de Calliptamus italicus et que la plage de
température optimale pour son développement est de 26 à 32
° C. Warren & Chick (2013), ont souligné
l'importance de température minimale chez les insectes. En effet chez
les acridiens, le taux d'alimentation, la marche, le vol, la dispersion, la
mue, l'accouplement et la ponte sont réduits à basse
température et cessent tout à fait à des
températures froides (Lactin & Johnson, 1996).
C'est pourquoi le temps froid et pluvieux a tendance à diminuer les
populations des acridiens même lorsque la nourriture est abondante
(Powell et al., 2007). Avec les basses
températures, les taux de croissance des criquets déclin,
jusqu'à atteindre un seuil au point où aucune croissance n'est
possible (Tu et al., 2012). L'abondance
d'Orthoptères est généralement favorisée selon
Capinera & Horton (1989), par des températures
élevées et sèches ; cependant, cela ne s'applique pas
à toutes les espèces de ce groupe. Barton
(2010), a démontré que cette augmentation de la
température aura pour effet de libérer les criquets de la
pression de prédation exercée par les araignées. Ces
dernières, étant peu adaptées aux températures
élevées, se réfugient plus bas dans le couvert
végétal et n'ont plus la capacité de capturer les criquets
qui, eux, supportent bien l'augmentation de température et demeurent
dans le haut du couvert végétal. Une élévation de
température augmente généralement la taux de
métabolisme, de croissance et d'alimentation des insectes
(Levesque et al., 2002). La température ambiante peut
influencer de manière significative les interactions
hôte-pathogène en renforçant la réponse immunitaire
de l'hôte (Elliot et al., 2005). Une
étude de Sangbaramou et al., (2018) a
démontrée que la thermorégulation peut affecter la
virulence de champignon Beauveria bassiana utilisée pour
contrôler Locusta migratoria manilensis. Ils On constaté
que la thermorégulation comportementale augmentait la survie des
criquets infectés.
10
Présentation de la région d'étude
I.3.2. Précipitations
La région de Ghardaïa est marquée par une
période pluvieuse relativement courte. Le tableau 2 regroupe les
quantités de pluie mensuelles pour une période de 10 ans.
Tableau 2. Les précipitations en (mm)
pour une période de 10 ans (2009 à 2018) dans la région de
Ghardaïa.
|
Mois
|
I
|
II
|
III
|
IV
|
V
|
VI
|
VII
|
VIII
|
IX
|
X
|
XI
|
XII
|
Cumul
|
|
Précipitations (mm)
|
10,5
|
3,04
|
8,39
|
4,45
|
2,75
|
3,58
|
1,49
|
3,79
|
15,73
|
4,09
|
4,02
|
3,54
|
65,37
|
(O.N.M., 2019)
Les précipitations ont pratiquement toujours lieu sous
forme de pluies. Ces dernières sont caractérisées par leur
faible importance quantitative et les pluies torrentielles sont rares
(Dubief, 1953). L'insuffisance de pluies sahariennes est
accompagnée d'une irrégularité très remarqué
du régime pluviométrique et d'une variabilité inter
annuelle considérable, se qui accentue la sècheresse
(Ozenda, 1991). La pluviométrie moyenne annuelle ne
dépasse pas 65,37mm dans cette région (Tableau 2). Ces
précipitations sont caractérisées essentiellement par leur
rareté ainsi que par leur irrégularité au cours de
l'année. Les mois les plus pluvieux sont septembre, janvier et mars. Au
niveau des Oasis, ces quelques millimètres de pluie ne peuvent, à
eux seuls, suffire pour assurer une bonne production agricole. L'agriculture
doit obligatoirement avoir recours à l'irrigation. D'une manière
générale, les précipitations, faibles et d'origine
orageuse sont caractérisées par des écarts annuels et
inter-mensuels très importants et également par leur
intensité. Lorsque la hauteur de la pluie dépasse 10 mm, les
oueds se mettent à couler sur une longue distance. L'eau est le facteur
clé déterminant de la qualité d'un habitat pour le
criquet, permettant la création d'une humidité suffisante pour la
ponte et le développement des oeufs ainsi que la croissance de la
végétation qui assurera la nourriture des jeunes larves issues
des pontes (Lecoq, 2012). Les précipitations selon
Sabu et al., (2008), sont le principal facteur
influant sur le développement des insectes. La pluie est
nécessaire pour que les oeufs des sauterelles et des criquets
éclosent (Walton et al., 2003). Trop peu de
pluie signifie parfois que le sol ne contient pas suffisamment
d'humidité pour que les oeufs se développent correctement, ou
même si les oeufs éclosent, il est possible que la pluie ne soit
pas suffisante pour permettre la croissance de plantes alimentaires
adaptées aux jeunes larves (Steedman, 1990). En effet
d'après Hunter et al., (2001), le manque de
précipitations est le principal facteur limitant
11
Présentation de la région d'étude
l'augmentation de la population acridienne, par son effet sur
la qualité et l'abondance des aliments. Hernándes-zul et
al., (2012), notent que les fortes précipitations
peuvent affecter négativement la population d'insectes. Chandra
(1990), a démontré que les fortes pluies de mousson ont
entraîné une diminution des invasions acridiennes et une
mortalité acridienne élevée, en particulier au stade oeuf,
qui a été causée par l'humidité excessive du sol.
D'autre part, l'augmentation des précipitations améliore
fortement la richesse en espèces et la productivité primaire des
communautés végétales (Yang et al.,
2011), qui pourrait avoir une influence positive sur les sauterelles
au niveau de la communauté (Zhu et al., 2017).
Les précipitations peuvent augmenter l'abondance des sauterelles en
augmentant la végétation disponible. Cependant, les conditions
humides promouvoir les champignons pathogènes qui peuvent nuire affecter
les populations de sauterelles (Hao et al., 2015).
D'après Barton et al., (2009), l'augmentation
des précipitations dans un terrain d'une région
tempérée d'Amérique , provoque une baisse de l'abondance
des sauterelles, ce qui s'est traduit par une réduction de 15% des
dommages causés par les sauterelles sur les plantes. Selon
Ovadia & Schmitz (2004), des niveaux élevés
de précipitations peuvent réduire la survie des sauterelles, en
réduisant ainsi l'effet d'herbivorie sur les plantes.
I.3.3. Humidité relative de l'air
Selon Dreux (1980), les vols des insectes
sont rares lorsque l'humidité relative de l'air est supérieure
à 75% et la température inférieure à13°C.
L'humidité relative moyenne en pourcentage à Ghardaïa durant
la période 2009 - 2018 est présentée dans le tableau 3
Tableau 3. Valeurs moyenne mensuelle de
l'humidité (%) dans la région de Ghardaïa.
|
Mois
|
I
|
II
|
III
|
IV
|
V
|
VI
|
VII
|
VIII
|
IX
|
X
|
XI
|
XII
|
|
Humidité
|
45,8
|
42,3
|
34,6
|
32,9
|
28,4
|
24,9
|
19,8
|
28,9
|
37,4
|
42,4
|
48,9
|
55,4
|
|
(%)
|
|
|
|
|
|
|
|
|
|
|
|
|
(O.N.M., 2019)
L'humidité relative de l'air ou degré
hygrométrique est le rapport entre la teneur réelle de l'air en
vapeur d'eau et la teneur d'un air saturé à la même
température. Au Sahara l'humidité relative de l'air est
très faible. Elle est comprise entre 15% et 50% (Ozenda,
1983). Les données recueillies de la station de Ghardaïa
donnent une moyenne annuelle de l'ordre de 36,81%. Les moyennes mensuelles
varient de 42,3% à 55,4% en hiver et de 19,8 à 28,9% en
été (Tableau 3). Les valeurs de l'humidité mensuelle sont
inversement
12
Présentation de la région d'étude
proportionnelles à la température moyenne
mensuelle. Les précipitations et l'humidité vont
déterminer le développement d'une végétation verte
et d'un milieu propice à la présence du criquet, à sa
ponte et au développement des larves (Lecoq, 2012).
I.3.4. Vent
Le vent à la Chabka du M'Zab a une action indirecte, en
activant l'évaporation, augmentant donc la sécheresse.
Selon Seltzer (1946) le sirocco est le vent le plus
redouté. Il joue le rôle de facteur de mortalité vis
à vis des insectes. D'après Beniston & Beniston
(1984) c'est un vent extrêmement sec. Il entraîne le sable
en tourbillonnant. La vitesse mensuelle du vent pour une période de 10
ans est enregistrée dans le tableau 4.
Tableau 4. La vitesse du vent moyenne mensuelle
en m/s pour une période de 10 ans (2009 à 2018) dans la
région de Ghardaïa.
|
Mois
|
I
|
II
|
III
|
IV
|
V
|
VI
|
VII
|
VIII
|
IX
|
X
|
XI
|
XII
|
|
Vitesse du vent
(m/s)
|
2,14
|
2,2
|
2,58
|
2,44
|
2,42
|
2,44
|
2,26
|
2,3
|
2,48
|
2,14
|
2,04
|
1,78
|
(O.N.M., 2019)
Malgré les apparences, le Sahara n'est pas un pays
venteux, mais un pays ou, par suite de sa dénudation, on ressent le plus
facilement le vent (Dubief, 1953). Les effets du vent sont
partout sensibles et se traduisent par le transport et l'accumulation du sable,
le façonnement des dunes, la corrosion et le polissage des roches et
surtout l'accentuation de l'évaporation (Monod, 1992).
Les vents surviennent habituellement au mois de février et se
poursuivent jusqu'à la fin d'avril avec une intensité variable.
Les vents du Nord-Ouest dominent en automne, en hiver et au printemps. Par
contre en été, ce sont les vents chauds du Sud qui sont les plus
fréquents. Ces derniers ont une action indirecte, en activant
l'évaporation, augmentant donc la sécheresse. La vitesse du vent
moyenne annuelle est de 2,27 m/s avec un maximum au mois de mars 2,58 m/s, et
un minimum enregistrée au mois de décembre 1,78 m/s (Tableau 4).
Parmi les facteurs environnementaux, le vent avait la plus forte influence sur
le comportement d'Orthoptères. La direction des essaims du criquet
dépend de la direction du vent. Comme les avions, les acridiens se
posent et s'envolent face au vent (WMO & FAO, 2016).
L'escalade et la locomotion diminue généralement avec
l'augmentation de la force du vent (Matenaar et al.,
2014). Les essaims du criquet pélerin peuvent voler
jusqu'à neuf ou dix heures par jour, se déplaçant sous le
vent bien que des essaims matures puissent parfois se
13
Présentation de la région d'étude
déplacer sur une courte distance face au vent si
celui-ci est faible. Un essaim se déplace généralement
à une vitesse légèrement inférieure à la
vitesse du vent et peut facilement couvrir 100 km ou plus en une journée
(Lecoq, 2012). Le vent peut transporter des criquets volants
vers la mer, où beaucoup d'entre eux peuvent se noyer, ou dans les pics
glacés de hautes montagnes, où ils peuvent mourir de froid. Des
vents forts entraînent parfois loin le sol contenant les
oothèques, qui se dessèchent ensuite, entraînant la mort
des oeufs. De plus, des vents forts poussent parfois le sable à enterrer
vivants les criquets sédentaires quand ils sont trop froids pour se
déplacer (Steedman, 1990). Selon Gardiner
(2006), la distance de dispersion des sauterelles, dans un
pâturage, était significativement réduite par vent fort
(> 2,5 m / s). En outre, la protection contre le vent semble influencer la
répartition des Orthoptères sur les zones agricoles dans les
zones tempérées (Gardiner & Dover, 2008).
Chez les Orthoptères les espèces et les sexes diffèrent
dans leur réponse comportementale aux facteurs abiotiques (vent,
température, etc.) en raison de la taille différente de leur
corps (Matenaar et al., 2014). Le chant des
Orthoptères est complètement inhibé à une
température inférieure à 17 ° C, pendant un vent fort
et pluie. Ainsi, le succès et la fréquence des accouplements sont
fortement affectés par ces facteurs (Stiedl & Bickmeyer,
1991).
I.3.5. Insolation
Le tableau 5 regroupe les valeurs de la durée d'insolation
de la région de Ghardaïa. Tableau 5. Moyenne
mensuelle de la durée d'insolation dans la région de
Ghardaïa pour une période de 10 ans (2009-2018).
|
Mois
|
I
|
II
|
III
|
IV
|
V
|
VI
|
VII
|
VIII
|
IX
|
X
|
XI
|
XII
|
|
Insolation
|
254,5
|
241
|
278,6
|
299,6
|
336,5
|
342,9
|
349,8
|
328,2
|
265,8
|
280,5
|
256,3
|
240,9
|
(O.N.M., 2019)
Les radiations solaires sont importantes au Sahara car
l'atmosphère présente une grande pureté durant toute
l'année. Cette forte luminosité est un facteur favorable pour
l'assimilation chlorophyllienne, mais elle a en revanche un effet
desséchant, car elle augmente la température (Toutain,
1979). La durée moyenne de l'insolation est de 289,55
heures/mois, avec un maximum de 349,8 heures en juillet et un minimum de 240,9
heures en décembre. La durée d'insolation moyenne annuelle entre
2009 et 2018 est de 3474,6 heures/an, soit environ 10 heures/jour (Tableau
5).
14
Présentation de la région d'étude
I.4.Classification du climat
La classification écologique des climats est
effectuée grâce à deux facteurs, les plus importants, soit
la température et la pluviosité (Dajoz, 1971).
Ces deux paramètres climatiques sont utilisés pour construire le
diagramme Ombrothermique de Bagnouls et Gaussen et le Climagramme
d'Emberger.
I.4.1. Diagramme Ombrothermique de Bagnouls et
Gaussen
Bagnouls et Gaussen (1953) définissent
un mois sec comme étant " celui où le total mensuel des
précipitations exprimé en millimètres est égal ou
inférieur au double de la température moyenne mensuelle
exprimé en degrés centigrades". Le mode de représentation
graphique de ces deux paramètres permet de déterminer et de
localiser la période sèche. Sur le graphe on représente
d'une part la courbe ombrique concernant les chutes mensuelles de pluie en mm
et d'autre part la courbe thermique à l'aide des températures
moyennes mensuelles en degrés Celsius. Quand la courbe ombrique passe en
dessous de la courbe thermique c'est qu'on a P < 2T, et le polygone alors
défini par les deux courbes indique la durée et dans une certaine
mesure l'intensité de la période sèche (Dajoz,
1971). L'étude du diagramme Ombrothermique de Bagnouls et
Gaussen de la région d'étude montre que celle-ci est
située sous un climat errémique chaud à tendance
méditerranéenne (Figure 2). La courbe ombrique est constamment au
dessous de la courbe thermique, ce qui montre que les douze mois de
l'année sont secs.

Figure 2. Diagramme Ombrothermique de Bagnouls
et Gaussen (1953) pour une période de 10 ans (2009-2018) de la
région de Ghardaïa.
15
Présentation de la région d'étude
I.4.2. Climagramme pluviométrique
d'Emberger
Le quotient pluviométrique d'Emberger (Q3)
spécifique au climat méditerranéen permet de connaitre
l'étage bioclimatique de la région d'étude. Pour
déterminer ce quotient nous avons utilisé la formule de
Stewart (1969), adapté pour l'Algérie et le
Maroc (Le Houerou, 1995), qui se présente comme suit :
Q3 = 3,43 P/M-m ; avec (P) la moyenne annuelle des pluies en millimètres
; (M) est la moyenne des maxima du mois le plus chaud alors que (m) est la
moyenne des minima du mois le plus froid. L'amplitude extrême thermique
M-m correspond sensiblement au facteur évaporation. La valeur du
quotient pluviothermique relative à la région d'étude doit
être reportée sur la figure appelée Climagramme
pluviothermique. En abscisses les moyennes des minima du mois les plus froids
sont représentées. En ordonnées on trouve les valeurs du
quotient pluviothermique. Sur ce graphe les limites des divers étages
climatiques reconnues par Emberger sont tracées, Saharien, aride,
semi-aride, subhumide et humide. Dans chacun d'eux des sous-étages
à hiver froid (m < 0°), frais (0° < m < 3°),
doux (3°< m <7°) et chaud (7° > m) sont définis.
Pour le calcul du quotient nous considérons les données de 10 ans
de 2009 à 2018 (Tableaux 1 et 2). Pour notre région
d'étude : P = 65,37 mm ; M = 42,39 °C ; m = 4,09 °C ;
d'où Q3= 5,85. Une fois que cette valeur du quotient est portée
sur le Climagramme pluviothermique, elle situe la région d'étude
dans l'étage bioclimatique saharien à hiver doux (Figure 3).

Figure 3. Etage bioclimatique de la
région de Ghardaïa selon le Climagramme pluviothermique
d'Emberger (1955) modifié par Stewart
(1969).
16
Présentation de la région d'étude
I.5. Sols
Dans la région du M'Zab les sols alluviaux sont
favorable à l'agriculture. Ils appartiennent au sol peu
évolué et peu salé à salé avec texture
sablo-limoneux. Ces sols sont peu à modérément calcaires,
alcalins à fortement alcalins et présentent une faible teneur en
matière organique (Daddi Bouhoun, 1997).
Le sol joue surtout un rôle de part sa texture qui est
définie par la grosseur des particules qui le composent : % graviers,
sable, limon, argile. Le Criquet pèlerin préfère les sols
sableux, sablo-limoneux, ou argilo-limoneux couverts de sable. Seul l'horizon
superficiel est d'intérêt pour le Criquet pèlerin puisque
la ponte n'excède pas 15 cm de profondeur. La qualité du sol est
déterminante pour la ponte et les criquets pèlerins ne pondent
pas dans n'importe quel type de sol (Lecoq, 2012). Les
criquets exigent des conditions de sol spécifiques pour la ponte des
oeufs dans le sol : suffisamment humides pour empêcher la dessiccation
mais pas assez humide pour ne pas favoriser les infections fongiques et
bactériennes (Cease et al., 2015). Les oeufs
sont généralement pondus dans des zones de sol sablonneux
dépourvu de végétation, après une pluie. En
général, la femelle ne pond que si le sol est humide à une
profondeur de 5 à 10 cm. Dans les sols sablonneux meubles, il a
été signalé que des femelles ne pondaient que si
l'humidité se rencontrait à une profondeur de plus de 12 cm.
Avant de pondre, la femelle sonde souvent le sol en y insérant
l'extrémité de son abdomen pour déterminer si
l'humidité est suffisante (WMO & FAO, 2016).
I.6. Flore
La flore saharienne est considérée comme
très pauvre si l'on compare le petit nombre d'espaces qui habitent ce
désert à l'énormité de la surface qu'il couvre
(Ozenda, 1983). L'espèce dominante à Chebket
M'Zab est le palmier dattier. Sous ces palmiers ou dans leur voisinage, des
cultures fruitières et maraîchères sont établies
(Tirichine et al., 2009). Dans son inventaire des
plantes adventices des cultures en milieu oasien, Nouh Mefnoun (1997)
a signalé la présence de 49 espèces appartenant
à 42 genres et 17 familles. Les familles les mieux
représentées sont les Poacées qui regroupent à
elles seules 50% de l'ensemble des espèces recensées.
D'après Quezel et Santa (1962), Ozenda (1983,
1991), Zergoun (1994), Salahou-Elhadj
(2001), la flore du M'Zab regroupe une gamme d'espèces
partagées entre plusieurs familles (Annexe 1, Tableau 6)
17
Présentation de la région d'étude
I.7. Faune
Selon Le Houerou (1990) les Arthropodes
comprennent un grand nombre d'espèces sahariennes. Il y a en particulier
des sabulicoles. Pour les arachnides on cite deux travaux parmi d'autres sur
scorpions de Sadine et al., (2016) et Sadine
et al., (2018), et sur les Aranéides de Alioua
et al., (2016). Parmi les insectes notamment des dictyoptères
mantidés du genre Eremiaphila (Tartoura, 2013). Pour
les Diptères, Boukraa (2009) a inventorié 44
espèces de Nématocères. Des travaux sur les
sautériaux ont été réalisés par
Zergoun (1991, 1994), Babaz (1992), Douadi (1992) et
Yagoub (1995) dans la région de Ghardaïa. Ces
derniers auteurs ont recensé plus de 30 espèces
d'Orthoptères. Pour ce qui concerne les Amphibiens et les reptiles nous
notons ici quelles que espèces signalées par Le Berre
(1989) dans la région du M'Zab : Bufo viridis
Laurenti, Sauradactylus mauritanicus L., Tarentola neglecta
Stauch, Cerastes cerastes L. Aucune étude approfondie n'a
été faite dans la région de Ghardaia sur les oiseaux.
Guezoul (2011), note la présence de 42 espèces
aviennes dans la, réparties en 18 familles. L'ordre le plus important
est celui des passériformes avec 29 espèces et 9 familles (Annexe
2, Tableau 7). Les Sylviidae sont les mieux représentées avec 06
espèces : Hippolaïs pallida Hemprich & Ehrenberg,
Phylloscopus collybita Vieillot, Phylloscopus fuscatus Blyth,
Sylvia deserticola Tristram, Sylvia melanocephala Gmelin et
Sylvia atricapilla L. Les Mammifères de la région du
M'Zab, sont traités par Le Berre (1990). Ils
comprennent des Insectivora Paraechinus aethiopicus Hemprich &
Ehrenberg, des Chiroptera Asellia tridens E.Geoffroy, des Rodentia
comme Gerbillus campestris Le Vaillant, et Massoutiera m'zabi
Lataste. Les herbivores comprennent Capra hircus L., et
Camelus dromedarius L.
CHAPITRE II
18
Matériel et méthodes
Chapitre II : Matériel et méthodes
Dans ce chapitre nous allons décrire le matériel
et les méthodes employées au terrain et au laboratoire. Une
description des sites d'étude sera réaliser afin d'étudier
la biodiversité des Orthoptères. Les techniques d'exploitation
des résultats comme les indices écologiques et certaines
études statistiques sont exposées.
II .1. Matériel utilisé
Pour mener à terme notre expérimentation, nous
avons utilisé un matériel de capture et d'échantillonnage
des criquets. Un matériel est employé au laboratoire pour la
conservation des Acridiens et des plantes. Un matériel utilisé
aussi pour l'étude du régime alimentaire des principales
Caelifères.
II .1.1. Sur le terrain
Pour la réalisation de la partie pratique de notre
travail, nous avons utilisé un matériel à la fois simple
et disponible. Ce matériel comprend les éléments suivants
: Une ficelle de 15 mètres de long reliant quatre bâtons entre
eux, servant à la limitation des carrés dans lesquels se fait
l'échantillonnage. Un filet fauchoir pour la capture des
Orthoptères. Une loupe manuelle nécessaire pour la
détermination des espèces, ainsi que les différents stades
larvaires. Des sachets en plastiques servant à la récolte des
échantillons de criquets et de végétaux. Un
sécateur pour les prélèvements floristiques. Un carnet de
prospection, dont lequel tous les renseignements concernant la sortie à
savoir la date, le lieu, l'altitude, la température la
végétation et toutes informations sur le comportement des
Orthoptères.
II .1.2. Au laboratoire
Le laboratoire regroupe l'équipement nécessaire
à la détermination et la conservation des Orthoptères et
des plantes, ainsi que le matériel utilisé pour l'étude du
régime alimentaire des principales espèces d'Acridiens.
II .1.2.1. Détermination des
Orthoptères
Pour déterminer aisément les Orthoptères,
il est nécessaire d'utiliser un matériel adéquat. Ce
dernier est constitué d'une loupe binoculaire servant à
l'identification et l'observation détaillée de la morphologie des
Orthoptères. L'acétate d'éthyle utilisé pour tuer
les
19
Matériel et méthodes
Orthoptères. Des épingles entomologiques pour
étaler et fixer les individus. Des étaloirs utilisés pour
étaler les échantillons. Une étuve pour le séchage
des échantillons étalés. Des boites à collection
pour ranger les insectes et de la naphtaline pour assurer une meilleure
conservation des Orthoptères. Pour la détermination des
espèces Orthoptéroloqiques, nous avons utilisé les
clés dichotomiques de Chopard (1943); Dirsh
(1965), ainsi que le catalogue des Orthoptères Acridomorpha de
l'Afrique du Nord-ouest (Louveaux et al., 2019).
II .1.2.2. Etude du régime alimentaire
Pour l'analyse des fèces nous avons utilisé cinq
verres de montre. Ces derniers servent à contenir les différents
produits pour l'étude du régime alimentaire. Des pinces à
pointes fines et lisses sont nécessaires à la trituration des
fèces et détaché délicatement les épidermes
des plantes. Nous avons employé de l'eau distillée pour rincer
les fèces et les plantes, l'eau de Javel pour enlever la chlorophylle et
éclaircir les cellules, l'éthanol à concentration
progressives (75°,80°,96°) et la résine pour fixer les
préparations. Les montages des épidermes sont
réalisés entre lame et lamelle. Une plaque chauffante est
nécessaire pour éliminer les bulles d'air existant entre lame et
lamelle. Enfin, pour pouvoir observer les différentes cellules
végétales on doit utiliser un microscope photonique.
II .1.2.3. Constitution d'un herbier
Le matériel comprend : des chemises de papier journal
de format A3, une presse constituée de 2 planches de bois, ainsi que
deux supports bibliographiques sur la flore de Quezel & Santa
(1962-1963) et Ozenda (1983) pour la
détermination des espèces et des sous-chemises en carton pour
présenter l'herbier.
II .2. Méthodologie de travail
La méthodologie de travail regroupe toutes les
méthodes utilisées sur terrain ainsi que les méthodes
employées au laboratoire.
II .2.1. Sur le terrain
Dans cette partie nous allons présenter toutes les
méthodes que nous avons utilisées pour la réalisation de
notre étude.
20
Matériel et méthodes
II .2.1.1. Choix des stations
d'étude
Après plusieurs prospections préliminaires de
terrain au niveau de la vallée du M'Zab, nous avons choisi 09 stations
d'étude (03 milieux cultivés, 03 palmeraies et 03 lits d'Oued)
réparties sur trois localités (Ghardaïa, Ben Isguen et El
Atteuf). Ces stations sont considérées comme
représentatives des différents biotopes des Orthoptères de
la vallée du M'Zab. Il est entendu par station, l'endroit précis
sur le terrain où est effectué un inventaire
Orthoptérique. Le choix des stations est réalisé selon
leur homogénéité apparente. Nous avons opéré
sur des surfaces de l'ordre de 10000 m2 pour chaque station.
II .2.1.2. Etude de la
végétation
Nous avons délimité une surface
d'échantillonnage dans chaque station de 10m de largeur sur 50 m de
longueur, soit une surface de 500 m2. Le taux de recouvrement des
espèces végétales sur le terrain est estimé selon
la méthode donnée par Duranton et al.
(1982), qui consiste à estimer la surface de chaque
espèce végétale en calculant la surface occupée par
la projection orthogonale du végétal. La surface est
déterminée grâce à la formule suivant :
T = [m (d/2)2 * N /S] * 100
T est taux de recouvrement d'une espèce
végétale donnée ;
d est le diamètre moyen de la plante en
projection orthogonale exprimé en mètres ;
S est la surface du transect
végétal, égale à 500 m2 ;
N est le nombre moyen de pieds de
l'espèce végétale prise en considération.
II .2.1.3. Caractéristiques des stations
d'étude
Une caractérisation des stations d'étude nous a
paru indispensable à la compréhension de la bioécologie du
peuplement d'Orthoptères de la vallée du M'Zab. Les listes des
végétaux présentes dans les différentes stations
ainsi que leurs taux de recouvrements ont été
présentées.
II.2.1.3.1. Touzouz (Ghardaïa)
Les trois milieux (cultivé, palmeraie et naturel) du
site Touzouz sont caractérisés par le couvert
végétale, humidité, sol et la perturbation du milieu
(Photos 1).
21
Matériel et méthodes

Milieu cultivé Palmeraie Milieu naturel
Photos 1 : Les trois milieux (cultivé,
palmeraie et naturel) du site Touzouz (Ghardaïa)
II.2.1.3. 1. 1. Milieu cultivé
La station est dans le périmètre agricole de
Touzouz est distante de 8 km de Ghardaïa (latitude 32° 51'Nord et
3° 59' Est) à une altitude moyenne de 558 m Parmi les plantes, on
trouve le palmier dattier (Phoenix dactylifera L.), des agrumes
(Citrus sinensis (L.), des oliviers (Olea europaea L.) et des
cultures légumières telles que Cucurbita siceraria
(Molina), Cucurbita maxima Duchesne, Citrullus lanatus
(Thunb.) et Cucumis melo L...etc. Ces cultures présentent un taux
de couverture de 50%. Les plantes spontanées sont
représentées principalement par les Poaceae telle que Cynodon
dactylon (L.) Pers., Setaria verticillata (L.), et Polypogon
monspeliensis (L) Desf. Leur taux de couverture est estimé à
15%. L'intensité de l'activité agricole est moyenne. L'irrigation
est normale et se fait par goutte à goutte. Taux de recouvrement global
de 65% (Tableau 8)
II.2.1.3. 1. 2. Palmeraie
La palmeraie de Ghardaïa se situe au bord de l'Oued
Touzouz (32°30' N., 3°36' E) à une altitude moyenne de 558 m.
Elle couvre une superficie de 4 ha. La palmeraie est relativement entretenue et
organisée. Le palmier dattier domine dans cette station avec 45 pieds.
La palmeraie est irriguée par le système goutte à goutte.
La strate arbustive est représentée principalement par l'oranger
(Citrus sinensis (L.) Osbeck) et l'abricotier (Prunus armeniaca
L.). La surface intercalaire est colonisée par des plantes
adventices peu denses telles que Cynodon dactylon, Setaria
verticillata et Cyperus rotundus. Le taux de recouvrement global
de la végétation est de 73.7 % (Tableau 9).
22
Matériel et méthodes
Tableau 8. Taux de recouvrement des
espèces végétales dans le milieu cultivé Touzouz
(Ghardaïa) pour un transect de 500m2.
|
Familles
|
Espèces
|
Recouvrement (%)
|
|
Arecaceae
|
Phoenix dactylifera
|
14,13
|
|
Rutaceae
|
Citrus sinensis
|
8,79
|
|
Oleaceae
|
Olea europaea
|
6,37
|
|
Poaceae
|
Cynodon dactylon
|
4,91
|
|
Vitaceae
|
Vitis vinifera
|
4,24
|
|
Poaceae
|
Setaria verticillata
|
3,43
|
|
Solanaceae
|
Capsicum annuum
|
2,54
|
|
Lamiaceae
|
Mentha pulegium
|
2,51
|
|
Cucurbitaceae
|
Lagenaria siceraria
|
2,39
|
|
Cucurbitaceae
|
Cucurbita maxima
|
2,26
|
|
Solanaceae
|
Solanum melongena
|
2,26
|
|
Solanaceae
|
Solanum lycopersicum
|
2,26
|
|
Cucurbitaceae
|
Cucumis melo
|
2,21
|
|
Poaceae
|
Polypogon monspeliensis
|
1,08
|
|
Poaceae
|
Phragmites australis
|
0,78
|
|
Polygonaceae
|
Rumex vesicarius
|
0,49
|
|
Poaceae
|
Hordeum murinum
|
0,39
|
|
Cyperaceae
|
Cyperus rotundus
|
0,39
|
|
Asteraceae
|
Crepis capillaris
|
0,39
|
|
Poaceae
|
Lolium multiflorum
|
0,35
|
|
Asteraceae
|
Sonchus oleraceus
|
0,35
|
|
Amaranthaceae
|
Amaranthus hybridus
|
0,34
|
|
Zygophyllaceae
|
Tribulus terrestris
|
0,31
|
|
Poaceae
|
Anisantha sterilis
|
0,29
|
|
Poaceae
|
Dactyloctenium aegyptium
|
0,29
|
|
Poaceae
|
Stipagrostis plumosa
|
0,29
|
|
Convolvulaceae
|
Convolvulus arvensis
|
0,28
|
|
Poaceae
|
Agrostis stolonifera
|
0,24
|
|
Malvaceae
|
Malva parviflora L.
|
0,21
|
|
Poaceae
|
Digitaria commutata
|
0,20
|
|
15
|
30
|
64,98
|
Tableau 9. Taux de recouvrement des
espèces végétales dans la palmeraie de Touzouz
(Ghardaïa) pour un transect de 500m2
|
Familles
|
Espèces
|
Recouvrement (%)
|
|
Arecaceae
|
Phoenix dactylifera
|
32,55
|
|
Rutaceae
|
Citrus sinensis
|
13,74
|
|
Poaceae
|
Cynodon dactylon
|
11,77
|
|
Rosaceae
|
Prunus armeniaca
|
9,42
|
|
Poaceae
|
Setaria verticillata
|
5,89
|
|
Cyperaceae
|
Cyperus rotundus
|
0,34
|
|
5
|
6
|
73,71
|
23
Matériel et méthodes
II.2.1.3. 1. 3. Milieu naturel
Le milieu naturel Touzouz se situe dans la localité de
Ghardaïa (32°30'N., 3°35'E.) à une altitude moyenne de
558 m. Le sol est sablonneux avec quels que endroits rocailleux. Le couvert
végétal est dominé principalement par Stipagrostis
pungens (Desf.). Le taux de recouvrement global de la
végétation est de 8,8 % (Tableau 10).
Tableau 10. Taux de recouvrement des
espèces végétales dans le milieu naturel Touzouz
(Ghardaïa) pour un transect de 500 m2
|
Familles
|
Espèces
|
Recouvrement (%)
|
|
Poaceae
|
Stipagrostis pungens
|
1,98
|
|
Brassicaceae
|
Henophyton deserti
|
0,90
|
|
Poaceae
|
Stipagrostis obtusa
|
0,85
|
|
Thymelaeaceae
|
Thymelaea microphylla
|
0,85
|
|
Cucurbitaceae
|
Citrullus colocynthis
|
0,78
|
|
Amaranthaceae
|
Hammada scoparia
|
0,77
|
|
Brassicaceae
|
Zilla spinosa
|
0,77
|
|
Cleomaceae
|
Cleome arabica
|
0,68
|
|
Apiaceae
|
Ferula communis
|
0,46
|
|
Boraginaceae Colchicacaea
|
Echium pycnanthum
|
0,38
|
|
Androcymbium wyssianum
|
0,35
|
|
9
|
11
|
8,77
|
II.2.1.3.2. N'tissa (Ben Isguen)
Les trois milieux (cultivé, palmeraie et naturel) du site
N'tissa sont caractérisés par le couvert végétale,
humidité, sol et la perturbation du milieu (Photos 2).

Milieu cultivé Palmeraie Milieu naturel
Photos 2 : Les trois milieux (cultivé,
palmeraie et naturel) du site N'tissa (Ben Isguen)
24
Matériel et méthodes
II.2.1.3. 2. 1. Milieu cultivé
La station est dans le périmètre agricole de
N'tissa est distante de 7 km de Ben Isguen (32°26' N., 3°39' E.)
à une altitude moyenne de 562 m. Les cultures présentent un taux
de couverture d'environ 25%. Elles sont composées principalement du
dattier (Phoenix dactylifera), d'arbres fruitiers tels que Citrus
sinensis (L.) Osbeck et Vitis vinifera L.). Parmi les cultures
légumières on retrouvent Cucurbita siceraria (Molina),
standl., Cucurbita maxima Duchesne, et Cucumis melo L. Une
abondance très remarquée de Poaceae caractérise cette
station. Ces plantes spontanées sont représentées
principalement par Cynodon dactylon (L.) Pers., Setaria
verticillata (L.) P. Beauv, Polypogon monspeliensis (L) Desf.,
Hyparrhenia hirta (L) Stapf et Stipagrostis plumosa (L.)
Munro ex Anderson. Le taux de couverture de ces adventices est d'environ 30%.
L'intensité de l'activité agricole est faible et l'irrigation est
irrégulière. Le taux de recouvrement global de la
végétation est de 55 % (Tableau 11).
Tableau 11. Taux de recouvrement des
espèces végétales dans le milieu cultivé N'tissa
(Ben Isguen) pour un transect de 500m2.
|
Familles
|
Espèces
|
Recouvrement (%)
|
|
Arecaceae
|
Phoenix dactylifera
|
8,48
|
|
Poaceae
|
Cynodon dactylon
|
7,85
|
|
Poaceae
|
Setaria verticillata
|
5,89
|
|
Rutaceae
|
Citrus sinensis
|
5,02
|
|
Vitaceae
|
Vitis vinifera
|
3,53
|
|
Poaceae
|
Polypogon monspeliensis
|
2,94
|
|
Cyperaceae
|
Cyperus rotundus
|
2,45
|
|
Lamiaceae
|
Mentha pulegium
|
2,20
|
|
Asteraceae
|
Sonchus oleraceus
|
2,12
|
|
Cucurbitaceae
|
Cucurbita siceraria
|
2,01
|
|
Poaceae
|
Hyparrhenia hirta
|
1,96
|
|
Cucurbitaceae
|
Cucurbita maxima
|
1,88
|
|
Cucurbitaceae
|
Cucumis melo
|
1,88
|
|
Convolvulaceae
|
Convolvulus arvensis
|
1,41
|
|
Asteraceae
|
Echinops spinosus
|
1,25
|
|
Zygophyllaceae
|
Tribulus terrestris
|
1,15
|
|
Amaranthaceae
|
Amaranthus hybridus
|
1,13
|
|
Malvaceae
|
Malva parviflora
|
1,06
|
|
Poaceae
|
Stipagrostis plumosa
|
0,78
|
|
12
|
19
|
54,99
|
II.2.1.3. 2. 2. Palmeraie
La palmeraie de Béni Isguen se situe dans le
périmètre agricole de N'tissa (32°27' N., 3°39'E.)
à une altitude moyenne de 562 m. La station s'étend sur une
superficie de 2 hectares. La palmeraie est non entretenue, à plantation
non organisée. L'irrigation se fait par goute à
25
Matériel et méthodes
goute. Cette station renferme 25 pieds de palmier dattier
(Phoenix dactylifera L.). La strate arbustive est
représentée par l'oranger et la vigne. La surface intercalaire
est colonisée par des plantes adventices denses telles que les
Poacées. Le taux de recouvrement global de la végétation
est de 57.1 % (Tableau 12).
Tableau 12. Taux de recouvrement des
espèces végétales dans le milieu cultivé N'tissa
(Ben Isguen) pour un transect de 500m2
|
Familles
|
Espèces
|
Recouvrement (%)
|
|
Arecaceae
|
Phoenix dactylifera
|
15,54
|
|
Poaceae
|
Cynodon dactylon
|
15,7
|
|
Poaceae
|
Setaria verticillata
|
7,85
|
|
Rutaceae
|
Citrus sinensis
|
7,54
|
|
Vitaceae
|
Vitis vinifera
|
2,47
|
|
Poaceae
|
Polypogon monspeliensis
|
1,96
|
|
Poaceae
|
Hordeum murinum
|
0,50
|
|
Malvaceae
|
Malva parviflora
|
0,50
|
|
Cyperaceae
|
Cyperus rotundus
|
0,44
|
|
Amaranthaceae
|
Amaranthus hybridus
|
0,40
|
|
7
|
10
|
57,14
|
II.2.1.3. 2. 3. Milieu naturel
Tableau 13. Taux de recouvrement des
espèces végétales dans le milieu naturel N'tissa (Ben
Isguen) pour un transect de 500 m2.
|
Familles
|
Espèces
|
Recouvrement (%)
|
|
Amaranthaceae
|
Hammada scoparia
|
1,92
|
|
Apocynaceae
|
Pergularia tomentosa
|
1,57
|
|
Cucurbitaceae
|
Citrullus colocynthis
|
1,54
|
|
Nitrariaceae
|
Peganum harmala
|
1,37
|
|
Asteraceae
|
Atractylis serratuloides
|
1,10
|
|
Apiaceae
|
Deverra denudata
|
0,78
|
|
Asteraceae
|
Echinops spinosus L.
|
0,63
|
|
Poaceae
|
Stipagrostis obtusa
|
0,56
|
|
Colchicacaea
|
Androcymbium wyssianum
|
0,49
|
|
Lamiaceae
|
Salvia aegyptiaca
|
0,47
|
|
Poaceae
|
Stipagrostis pungens
|
0,45
|
|
Neuradaceae
|
Neurada procumbens
|
0,42
|
|
Brassicaceae
|
Farsetia aegyptiaca
|
0,39
|
|
Zygophyllaceae
|
Tetraena alba
|
0,39
|
|
12
|
14
|
12,08
|
Le milieu naturel N'tissa se situe dans la localité de
Ben Isguen (32°27' N., 3°39' E.) à une altitude moyenne de
562m. C'est un reg, le sol est rocailleux avec quelques endroits sablonneux. Le
couvert végétal est composé principalement de Hammada
scoparia (Pomel)
26
Matériel et méthodes
Iljin, Pergularia tomentosa L., Peganum harmala L.,
et Citrullus colocynthis (L.) Schrad. Le taux de recouvrement
global de la végétation est de 12.1 % (Tableau 13).
II.2.1.3.3. El Djaoua (El Atteuf)
Les trois milieux (cultivé, palmeraie et naturel) du site
El Djaoua sont caractérisés par le couvert
végétale, humidité, sol et la perturbation du milieu
(Photos 3).

Milieu cultivé Palmeraie Milieu naturel
Photos 3 : Les trois milieux (cultivé,
palmeraie et naturel) du site El Djaoua (El Atteuf)
II.2.1.3.3.1. Milieu cultivé
La station est dans le périmètre agricole El
Djaoua à 5 km d'El Atteuf (32°26' N., 3°43' E.) à une
altitude moyenne de 513 m. Les cultures dominantes sont le palmier dattier, les
arbres fruitiers tels que Citrus sinensis (L.) Osbeck et Vitis
vinifera L. Cette station se caractérise par les cultures
fourragères telles que Medicago sativa L. et Hordeum
vulgare L. Les cultures légumières sont
représentées par Cucurbita siceraria (Molina) Standl.,
Cucurbita maxima Duchesne, Cucumis melo L. et Abelmoschus
esculentus (L.) Moench.
Les cultures couvrent environ 65%. La présence de
mauvaises herbes est faible. Parmi les plantes spontanées on note la
présence Cynodon dactylon (L.) Pers., Setaria verticillata
(L.) P. Beauv) et Malva parviflora L. Ces adventices ont un taux
de recouvrement d'environ 5%. L'intensité de l'activité agricole
est forte. L'irrigation est par aspersion pour les cultures fourragères
(luzerne et orge) et goutte à goutte pour autres cultures (fruits et
légumes). Le tableau 8 indique un taux de recouvrement
végétal global de 70%.(Tableau 14).
27
Matériel et méthodes
Tableau 14. Taux de recouvrement des
espèces végétales dans le milieu cultivé El Djaoua
(El Atteuf) pour un transect de 500m2.
|
Familles
|
Espèces
|
Recouvrement (%)
|
|
Arecaceae
|
Phoenix dactylifera
|
16,28
|
|
Rutaceae
|
Citrus sinensis
|
13,74
|
|
Fabaceae
|
Medicago sativa
|
9,92
|
|
Vitaceae
|
Vitis vinifera
|
8,79
|
|
Poaceae
|
Hordeum vulgare
|
7,36
|
|
Cucurbitaceae
|
Cucumis melo
|
2,39
|
|
Cucurbitaceae
|
Cucurbita siceraria
|
2,26
|
|
Malvaceae
|
Abelmoschus esculentus
|
2,16
|
|
Cucurbitaceae
|
Cucurbita maxima
|
2,13
|
|
Malvaceae
|
Malva parviflora
|
1,98
|
|
Poaceae
|
Setaria verticillata
|
1,57
|
|
Cynodon dactylon
|
1,47
|
|
7
|
12
|
70,05
|
II.2.1.3.3.2. Palmeraie
La palmeraie d'El Atteuf se situe dans le
périmètre agricole d'El Djaoua (32°26' N., 3°43' E.)
à une altitude moyenne de 513 m. Elle couvre une superficie de 2
hectares. La palmeraie est bien entretenue et organisée. Cette station
renferme 30 pieds de palmier dattier (Phoenix dactylifera L.). La
strate arbustive est représentée par l'oranger, la vigne, le
figuier et le grenadier. La surface intercalaire est colonisée par
très peu de plantes adventices telles que Cynodon dactylon et
Setaria verticillata. L'irrigation se fait par goutte à goutte.
Le taux de recouvrement global de la végétation est de 76.8 %
(Tableau 15).
Tableau 15. Taux de recouvrement des
espèces végétales dans la palmeraie d'El Djaoua (El
Atteuf) pour un transect de 500 m2.
|
Familles
|
Espèces
|
Recouvrement (%)
|
|
Arecaceae
|
Phoenix dactylifera
|
40,69
|
|
Rutaceae
|
Citrus sinensis
|
13,74
|
|
Moraceae
|
Ficus carica
|
8,48
|
|
Lythraceae
|
Punica granatum
|
7,85
|
|
Vitaceae
|
Vitis vinifera
|
3,53
|
|
Poaceae
|
Cynodon dactylon
|
1,96
|
|
Setaria verticillata
|
0,59
|
|
6
|
7
|
76,84
|
II.2.1.3.3.3. Milieu naturel
Le milieu naturel se situe dans la localité d'El Atteuf
(32°27' N., 3°44' E.) à une altitude moyenne de 507 m.
28
Matériel et méthodes
Tableau 16. Taux de recouvrement des
espèces végétales dans le milieu naturel (El Atteuf) pour
un transect de 500 m2.
|
Familles
|
Espèces
|
Recouvrement (%)
|
|
Thymelaeaceae
|
Thymelaea microphylla
|
2,83
|
|
Brassicaceae
|
Henophyton deserti
|
1,41
|
|
Poaceae
|
Stipagrostis pungens
|
1,41
|
|
Cucurbitaceae
|
Citrullus colocynthis
|
0,61
|
|
Cleomaceae
|
Cleome arabica
|
0,56
|
|
Boraginaceae
|
Echium pycnanthum
|
0,50
|
|
Poaceae
|
Stipagrostis obtusa
|
0,49
|
|
6
|
7
|
7,28
|
C'est un reg, le sol est sablonneux. Thymelaea
microphylla Coss. & Durieu est l'espèce végétale
la plus représentée, suivie de Henophyton deserti Coss.
& Durieu et Stipagrostis pungens (Desf.) De Winter. Le taux de
recouvrement global de la végétation est de 8,7 % (Tableau
16).
II. 2.1.4. Déroulement des
prospections
Nos prospections sur terrain ont débuté en
septembre 2016 jusqu'à aout 2019, à raison d'une sortie par mois.
Les échantillonnages ont été effectués très
tôt le matin, entre 7 h et 9 h en été et entre 9 h et 11 h
en hiver. Au cours de la journée, ce sont les heures les plus chaudes
qui sont les plus propices aux inventaires d'Orthoptères car c'est au
cours de cette période que ces insectes sont les plus actifs. Les
conditions météorologiques les plus favorables pour
l'échantillonnage des criquets, consistent en un ciel
dégagé, un vent faible et une température suffisamment
élevée (Boitier, 2004). Les captures des
Acridiens sont réalisées à l'aide d'un filet fauchoir.
Pour la collecte des spécimens, nous avons utilisé des sachets en
plastique où nous mentionnons pour chaque individu, le nom de
localité et la date de capture. L'identification des spécimens
sur terrain s'effectuera à vue et /ou à l'ouïe. En effet, la
stridulation des mâles est un complément important dans la
détermination et même indispensable pour différencier
certains groupes d'espèces (Jaulin, 2009).
II .2.1.5. Fiche de terrain
L'utilisation de fiche type à remplir directement sur
le terrain est d'une grande importance pour le suivi des peuplements
d'Orthoptères. Lors de chaque prospection, toutes les informations
seront notées sur la fiche de terrain. En plus de leur utilisation
à des fins
29
Matériel et méthodes
purement descriptives (inventaire des Orthoptères,
végétation, site...etc.), les données
récoltées dans les fiches de terrain ont comme objectif de
permettre une exploitation statistique de nos résultats. La forme et le
contenu de la fiche de terrain sont inspirés des modèles
proposés par Duranton et al. (1982), mais sont
adaptés aux conditions d'investigation en milieu saharien (Annexe 3). La
fiche de terrain renferme les descripteurs suivants :
1. Nom de l'observateur ;
2. Date de prospection ;
3. Heure de début et de fin de relevé ;
4. Commune ou lieu de prospection ;
5. Lieu-dit ;
6. Localisation (Coordonnées GPS et altitude) ;
7. Plantes hôtes ;
8. Paramètres climatiques (Température, Vent,
Pluie, ...) ;
9. Remarques sur le déroulement de la sortie ainsi que
toute information qui semble importante pour l'étude.
II .2.1.6. Echantillonnage des
Orthoptères
Les méthodes d'échantillonnage des
orthoptères sont nombreuses et très diverses (Dreux, 1972
; Duranton et al., 1982 ; Voisin, 1986). Dans la
présente étude, la méthode choisie est celle des quadrats,
c'est la méthode la plus souvent utilisée dans les études
sur la biodiversité des écosystèmes terrestres. Pour
enquêter sur les Acridiens dans cette étude, nous avons
utilisé la méthode des quadrats rapportée par
Gardiner et al., (2002). La surface des quadrats
utilisée dans l'enquête est de 25 m2 (5 X 5 m). Dix
quadrats ont été positionnés au hasard dans une parcelle
d'un hectare sur chaque site d'étude. Les coins de chaque carré
ont été marqués à l'aide de poteaux en bois
reliés par une ficelle sans que l'observateur ne perturbe les Acridiens
en créant des ombres. Chaque parcelle sur les sites d'étude a
été étudiée pour déterminer l'abondance et
la richesse en espèces de criquets.
II .2.1.7. Suivi du cycle biologique des
Acridiens
Le suivi des cycles de développement des principales
espèces a été effectué durant l'année 2018.
Les larves et les imagos de chaque espèce ont été suivis
par un échantillonnage
30
Matériel et méthodes
périodique et quantitatif dans les différents
milieux choisis. Les variations des densités imaginales et larvaires
durant l'année nos permet de déterminer le nombre de
générations pour chaque espèce. Nous avons
considérés les espèces les plus fréquentes dans les
stations d'études.
II .2.1.8. Méthode d'étude du
régime alimentaire sur le terrain
La méthode d'étude du régime alimentaire
adoptée pour notre travail est celle proposée par Butet
(1985), et qui se base sur la comparaison de structures histologiques
des fragments végétaux trouvés dans les fèces des
animaux considérés avec ceux d'une épidermothèque
de référence préparée à partir des plantes
prélevées dans la station d'étude. Cette technique ne
perturbe pas l'équilibre démographique des populations. C'est une
méthode objective, rapide et précise, ne nécessitant pas
de matériels délicats ou coûteux (Launois- Luong, 1975).
II .2.1.8. 1. Espèces d'Orthoptères
étudiées
Nous avons étudié sept espèces
acridiennes, appartenant à deux familles et quatre sous familles et qui
sont: Aiolopus strepens (Latreille, 1804), Acrotylus patruelis
(Herrich-Schäffer, 1838) et Morphacris fasciata (Thunberg,
1815) appartenant à la sous-famille des Oedipodinae ; Acrida
turrita (Linnaeus, 1758) de la sous famille des Acridinae ;
Heteracris annulosa Walker, 1870 de la sous famille des
Eyprepocnemidinae ; Ochrilidia gracilis (Krauss, 1902) de la sous
famille des Gomphocerinae et Pyrgomorpha cognata Krauss, 1877 de la
sous famille des Pyrgomorphinae. L'ensemble des espèces sont
récoltées dans le milieu cultivé Touzouz (Ghardaïa).
25 mâles et 25 femelles sont étudiés pour chacune de ces
espèces Acridiennes, soit un total de 350 individus de
Caelifères.
II .2.1.8. 2. Prélèvement des
fèces
Les prélèvements des fèces ont lieu dans
le milieu cultivé Touzouz entre 2017 et 2018, durant les mois allant de
mai à octobre, période où les sept espèces de
criquets étudiés sont présentes dans la station. Nous
avons placé chaque insecte dans une boîte de Pétri. La
durée suffisante pour que les acridiens vident leur tube digestif est
variable selon les auteurs. Launois (1976), signale que
l'insecte doit jeûner 1 à 2 heures. Par contre Ben Halima
et al. (1984), notent qu'il faut 7 heures pour
récupérer les fèces après le repas d'un insecte.
31
Matériel et méthodes
Au contraire Zergoun (1994) a remarqué
qu'il faut 24 heures pour vider le tube digestif des Acridiens. Les
fèces de chaque individu sont conservées dans des cornets en
papier, sur lesquels on inscrit le nom de l'espèce d'Orthoptère,
le sexe de l'individu, la date et le lieu de capture.
II .2.2. Méthodes utilisés au
laboratoire
Les méthodes utilisées au laboratoire, à
savoir la détermination et la conservation des Orthoptères,
constitution d'un herbier de référence, détermination des
plantes, préparation d'une épidermothèque de
référence et analyse des fèces seront décrites.
II .2.2. 1. Détermination des espèces
capturées
L'identification des spécimens est effectuée
à vue et/ou à l'ouïe. L'écoute et la reconnaissance
de la stridulation des mâles est un complément très utile
qui permet de repérer des espèces qui seraient passées
inaperçues. Les spécimens ne pouvant être identifiés
sur le terrain sont capturés en vue d'un examen ultérieur.
L'identification est réalisée à partir des clés
notamment celles des Orthoptères de l'Afrique du Nord de Chopard
(1943) et la base de donnée en ligne sur les Orthoptères
Acridomorpha de l'Afrique du Nord-Ouest de Louveaux et al.
(2019). Les Acridiens ont été classées selon le
fichier en ligne des espèces d'Orthoptères de Cigliano et
al. (2019).
II .2.2. 2. Conservation des
échantillons
Les échantillons d'Orthoptères qui sont
destinés à la collection sont sacrifiés dans un flacon
contenant du coton imbibé d'acétate d'éthyle. Puis on les
place sur des étaloirs en les fixant avec des épingles
entomologiques au niveau du thorax. Les ailes sont étalées sur un
étaloir à l'aide d'épingles entomologiques et du papier
calque, pour maintenir les ailes et les élytres dans une position
horizontale. Les étaloirs sont placés dans l'étuve
à 45°C pendant quelques jours pour dessécher les
Orthoptères, avant d'être placés dans des boîtes de
collection contenant de la naphtaline. Une collection de
référence est constituée au cours du déroulement
des prospections son but est de conserver un ou plusieurs individus de chaque
espèce capturée dans les stations étudiées,
généralement un mâle et une femelle par espèce.
Cette collection sert de référence pour toute la durée des
études et permet de vérifier les déterminations
ultérieures.
32
Matériel et méthodes
II .2.2. 3. Constitution d'un herbier de
référence
Les plantes sont récoltées pendant toute la
période d'échantillonnage des Orthoptères. Les plantes
doivent être bien sèches et fortement pressées pour
être bien conservées. Les trois premiers jours de séchage
le papier journal est changé tous les jours. Les plantes sont
fixées, avec soin, sur des chemises de carton. Les étiquettes,
portant les noms de la plante, les dates et lieu de prélèvement,
sont collées en bas à droite.
II .2.2. 4. Détermination des plantes
L'identification des espèces a été
facilitée suite à la consultation de plusieurs
références, notamment celles de Quezel & Santa
(1962-1963) et Ozenda (1983). La nomenclature des
plantes a été révisée en utilisant celle du site
www.tela-botanica.org.
II .2.2. 5. Préparation d'une
épidermothèque de référence
Les plantes ayant été prélevées
dans la station d'étude, vont être utilisées pour
préparer l'épidermothèque de référence. Le
végétal à l'état sec est laissé 24 heures
dans l'eau, les épidermes sont détachés
délicatement des tissus sous-jacents avec de fines pinces ou quand cela
n'est pas possible en plaçant l'épiderme à étudier
en contact avec une lame de verre et en éliminant l'autre
épiderme et les tissus internes par grattage.

Figure 4. Démarche à suivre pour
la préparation de l'épidermothèque de
référence.
33
Matériel et méthodes
L'épiderme va subir une série de bain successifs
: bain dans l'eau de javel pendant 20
secondes afin d'éliminer la chlorophylle,
rinçage à l'eau distillée pendant 2 minutes
pour
éliminer l'eau de javel, déshydratation dans deux bains
d'alcool (70° et 90°) pendant 30
secondes à une minute. Les fragments
épidermiques sont alors mis entre lame et lamelle
dans une goutte du
baume de canada. Pour éviter la formation de bulles d'air, les
épidermes passent quelques secondes sur une plaque chauffante. Enfin les
épidermes sont observés au microscope photonique et
photographiés. Sur chaque lame ainsi préparée, le nom
scientifique de l'espèce végétale est mentionné. La
collection de référence doit être la plus complète
possible, tant au point de vue espèces, qu'organes de la plante, tige,
feuille et inflorescence.
II .2.2.6. Analyse des fèces
Les Acridiens récoltés sur le terrain sont
placés individuellement dans des tubes en plastique et sont mis à
jeun pendant 24 heures (temps suffisant pour vider leur tube digestif).
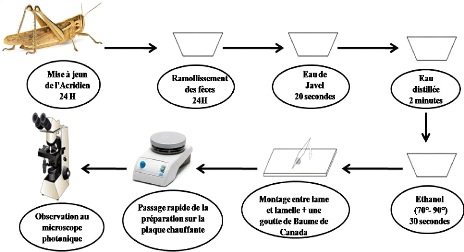
Figure 5. Démarche à suivre pour
l'analyse des fèces des Acridiens.
Les techniques de traitement des fèces sont
inspirées de la méthode de Launois-Luong (1975)
qui consiste au ramollissement des fèces dans l'eau pendant 24
heures, et leur passage dans une série de bains : les fèces sont
homogénéisés durant quelques secondes à une minute,
dans l'eau de javel, subissant ainsi une décoloration sans destruction
apparente des épidermes,
34
Matériel et méthodes
rinçage dans l'eau distillée, suivi des bains de
quelques secondes dans l'éthanol à concentrations progressives
(70%, 90%), les fèces ainsi traités sont conservés entre
lames et lamelles dans du baume du Canada et sont examinés au microscope
photonique après avoir effectuer un passage de quelques secondes sur une
plaque chauffante.
II .3. Méthodes d'exploitation des
résultats
L'exploitation des résultats obtenus au cours de la
présente étude est faite grâce à des indices
écologiques de composition et des indices de structure, suivie par une
analyse statistique.
II .3.1. Exploitation des résultats par des
indices écologiques
Le nombre et la richesse, l'abondance relative, la
densité, la diversité et l'équitabilité des
espèces d'Orthoptères ont été calculés. Le
régime alimentaire des principales espèces d'Acridiens a
été aussi exploité par des indices écologiques.
II .3.1.1. Nombre d'individus (N) et richesse
spécifique (S)
Une énumération des individus de chaque
espèce est réalisée pour chaque station. La richesse
spécifique, qui correspond au nombre total d'espèces
d'Orthoptères (Caelifères et Ensifères) rencontrées
sur une station donnée peut être calculée. Elle est
égale au nombre d'espèces différentes pour tous les
prélèvements confondus. Ces paramètres vont permettre de
comparer les différentes stations selon leur diversité et le
nombre d'individus et mettre en avant le type d'habitat le plus
intéressant (Jaulin, 2009)
II. 3.1.2. Densité des Criquets
Pour chaque site, la mesure quantitative de la densité
acridienne a été réalisée par la méthode des
quadrats. Le nombre total d'individus appartenant à chaque espèce
a été compté dans des quadrats de 25 m2. Les
comptages dans les quadrats ont été répétés
dix fois pour chaque site et jour d'échantillonnage. La densité
de chaque site a été rapportée en criquet par 100
m2 (Zergoun et al., 2019).
35
Matériel et méthodes
II .3.1.3. Abondance relative
L'abondance relative (A.R. %) des espèces
d'Orthoptères a été calculée comme le nombre
d'individus de l'espèce (i) par rapport au nombre total
d'individus de toutes les espèces recueillies sur chaque site
(Zaime & Gautier, 1989).
????
??.??.(%) = ?? * ??????
Où ni est le nombre d'individus de
l'espèce i et N le nombre total d'individus
II .3.1.4. Fréquence d'occurrence ou constance des
espèces
La constance (C) est le rapport du nombre de
relevés contenant l'espèce étudiée
(Pi) au nombre total de relevés (P) ;
exprimée en pourcentage (Dajoz, 2006).
????
?? (%) = ?? * ??????
Où Pi représente le nombre total
des prélèvements contenant l'espèce i et P le nombre
total
des prélèvements effectués. En fonction de
la valeur de C on les catégories suivantes :
Omniprésente : si C% = 100% ;
Constante : si 75% S C% < 100% ;
Régulière : si 50% S C% < 75%
;
Accessoire : si 25% S C% <50% ;
Accidentelle : si 5 % S C%< 25 % ;
Espèces Rare si C%< 5 %.
Les fréquences d'occurrence du peuplement ou
espèces sont regroupées en classes (Scott,
2009) qui sont déterminées selon
la règle de Sturge (Scherrer, 1984).
Le nombre de classes est égal à : N (clas.)
= 1 + (3,3 log n)
NC : Nombre de classes ;
n : nombre d'espèces présentes.
II .3.1.5. Diversité Alpha
La diversité alpha est la diversité locale,
mesurée à l'intérieur d'un système
délimité. Plus précisément, il s'agit de la
diversité dans un habitat uniforme de taille fixe (Marcon,
2010). Les calculs de la diversité alpha ont été
effectués avec PAST, version 2.17b (Hammer et al.
2001).
36
Matériel et méthodes
II .3.1.5.1. Indice de diversité de
Shannon-Weaver
La détermination de l'indice de Shannon-Weaver au
niveau des différentes stations durant les différentes saisons
nos permet de suivre la dynamique de la biodiversité Acridienne au
niveau de chaque station. Cet indice est calculé de la manière
suivante : (Marcon, 2010).
s
H' = -1pi* log2 pi
1=1
S = nombre total d'espèces ;
pi = (ni /N), fréquence relative des
espèces ;
ni = fréquence relative de
l'espèce i dans l'unité d'échantillonnage ; N
= somme des fréquences relatives spécifiques
II .3.1.5.2. Equitabilité
L'équitabilité (E) est une mesure
d'uniformité. Elle décrit la manière dont les individus
sont répartis entre les différentes espèces :
(Blondel, 1979 ; Magurran, 2004).
H'
|
E=
|
|
|
E = équitabilité des
espèces ; H' = diversité des espèces ;
S = nombre des espèces.
|
log2 S
|
II .3.1.5.3. L'indice de Simpson
L'indice de Simpson ou indice de dominance prend en compte la
fréquence mesurée des espèces. Ils accordent plus
d'importance aux espèces les plus fréquentes qu'à la
richesse spécifique totale (Magurran, 1988). Il est
calculé selon la formule suivante :
s
D= 1 pi2
1=1
La diversité spécifique est la plus
élevée quand l'indice de Simpson est le plus faible. L'inverse de
Simpson permet de faire varier l'indice dans le même sens que la
diversité : plus la diversité spécifique est
élevée plus l'indice est fort :
s
D = 1/1 pi2
1=1
Matériel et méthodes
II .3.1.6. Indices écologiques utilisés
dans le régime alimentaire
Dans cette partie nous allons compléter l'étude de
la méthode qualitative classique (fréquences) de l'analyse des
fèces par celle des surfaces, dite « de la fenêtre »
(Doumandji et al., 1993) , qui permet d' estimer la
quantité de matière végétale ingérée
par les Acridiens.
II .3.1.6.1. Fréquence des espèces
végétales dans les fèces
Pour exprimer les résultats d'analyses des espèces
végétales présentes dans les fèces nous avons
utilisé la formule de fréquence relative proposée par
Le Gall & Gillon (1989) :
Oi
Pij = Ot
Où : Oi est le nombre de fois
où des fragments du végétal i sont
observés dans les fèces de l'espèce j et
Ot est la somme des Oi
3.1.6.2. Méthode des surfaces
La méthode des surfaces ou « méthode de la
fenêtre », que nous avons utilisée pour quantifier la prise
de nourriture par les Acridiens, consiste à découper un petit
carré de 1 mm2 dans une languette de papier
millimétré. Celle-ci est installée sur la platine du
microscope optique de manière à ce que la fenêtre soit
centrée dans le champ optique, et la lame préparée est
posée dessus. En se repérant sur le millimétrage, on fait
glisser la préparation sur le papier de façon à ce que la
petite fenêtre en parcoure la superficie. La surface de chaque fragment
rencontré est estimée de la façon suivante : 1
mm2 pour la totalité de la surface de la fenêtre, 0,5
mm2 pour la moitié, 0,25 mm2 pour le quart et 0,06
mm2 pour les plus petites fractions. Le nombre de mesures à
effectuer doit être suffisamment grand afin de minimiser les risques
d'erreur, et être au moins égal au tiers des 576 mm2
qui constituent l'aire de chaque lamelle de 24 x 24 mm, soit 192 unités,
prises au hasard, valeur que nous avons retenue . Pour chaque espèce
végétale, on note à chaque fois la surface
(Benzara et al., 2003). La surface totale dans chaque
lamelle étant estimée par 1'équation :
Ss =
S1 + S2 + S3 +
·
·
·+ Sn
* 576
192
37
Ss : est la surface d'une espèce
végétale donnée rejetée dans les fèces et
calculée pour un individu.
38
Matériel et méthodes
? ????
??
??=??
?? = ??
S : est la surface moyenne d'une espèce
végétale consommée par N individus.
??
??= * ??????
? ??
??
??=??
T : est le taux de consommation d'une
espèce végétale donnée est le pourcentage de
surface foliaire de cette espèce ingérée par un Acridien,
rapporté à l'ensemble des surfaces foliaires
ingérées.
????=
??
????
IA : est l'indice d'attraction d'une
espèce végétale donnée. C'est le rapport du taux de
consommation de la plante considérée à son taux de
recouvrement sur le terrain.
II .3.2. Analyses statistiques
L'analyse des données collectées lors des
prospections de terrain s'effectue essentiellement grâce à des
méthodes d'analyse mathématique informatisées, telles que
les analyses factorielles des correspondances (AFC) et les classifications
ascendantes hiérarchiques (CAB).
II .3.2.1. Estimation de la richesse
spécifique
Des courbes d'accumulation d'espèces ont
été utilisées pour déterminer si les assemblages
des Orthoptères de chaque habitat avaient été
échantillonnés de manière exhaustive. Le nombre de
relevé a été utilisé comme la mesure de l'effort
d'échantillonnage. Des estimations de la richesse en espèces avec
des intervalles de confiance de 95% pour les estimateurs S est (analytique) et
Chao1 Classique basées sur 100 échantillons randomisés
pour les données d'Orthoptères échantillonnés ont
été appliquées (Zergoun et al.,
2019). Le logiciel ESTIMATES version 9.1.0 (Colwell, 2013)
a été utilisé pour générer les
estimateurs ICE et Chao1.
39
Matériel et méthodes
II .3.2.2. Test de Kruskal et Wallis
Pour vérifier les différences entre les sites
dans la richesse et la diversité des Acridiens, le test non
paramétrique de Kruskal-Wallis a été utilisé pour
tester l'hypothèse nulle (Ho) selon laquelle les groupes
d'Orthoptères dans les différents sites sont superposables
(même valeur de leurs médianes). Le seuil de signification a
été fixé à 5%. Les Tests ont été
menés en R, version 3.1.2 (R Core Team 2014).
II .3.2.3. L'analyse factorielle des correspondances
(AFC)
Les données Acridiennes sont traitées sur la
base des présences/absences. Une espèce est
considérée présente dans un site si au moins une larve ou
un imago y a été observé. Le tableau de données,
est analysé par l'AFC. Ces analyses permettent de réaliser une
typologie «sociologique» par comparaison des profils de distribution
de chacune des espèces parmi les relevés (Monard,
1986). L'AFC est mené sur Excel 2007 et sur la version 2014.1
de XLSTAT.
II .3.2.4. La classification ascendante
hiérarchique ou CAH
Pour faciliter le dépouillement des résultats de
l'AFC, on effectue une classification ascendante hiérarchique des
relevés sur la base de leurs coordonnées factorielles. La
classification ascendante hiérarchique (CAH) facilite les regroupements
entre relevés analogues (Monard, 1986). La CAH est
effectuée sur la version 2014.1 de XLSTAT.
CHAPITRE III
40
Résultats et Discussions
Chapitre III : Résultats et Discussions
Ce chapitre comporte tous les résultats et discussions
des travaux effectués sur le terrain et au laboratoire. L'inventaire des
Orthoptères de la région d'étude, l'exploitation des
résultats par les indices écologiques et analyse statistiques
seront traités. Le cycle biologique des Acridiens les plus
fréquents fera l'objet d'une étude. Enfin, le régime
alimentaire des espèces les plus abondantes sera examiné.
III.1. Inventaire concernant la faune
Orthoptérologique de la vallée du M'Zab
Pour les insectes Orthoptéroïdes, la
dernière synthèse systématique a été
réalisée par Chopard (1943), qui a
proposé des clés d'identification pour les genres et les
espèces. La classification des Acridoidea (groupe Acridomorpha) a
été profondément remaniée depuis Dirsh
(1965). Plusieurs genres et espèces ont été
révisés ainsi que des nouvelles espèces
identifiées. A titre d'exemple ce qui a été
identifié jusque là par les Orthoptéristes comme
Aiolopus thalassinus (Fabricius, 1781) dans le domaine
méditerranéen occidental relève la plupart du temps d'une
autre espèce, en réalité : Aiolopus puissanti.
Ainsi, Aiolopus thalassinus est apparemment une espèce euro
sibérienne, pénétrant assez peu dans le domaine
méditerranéen, alors qu'Aiolopus puissanti paraît
être une espèce confinée à la région
méditerranéenne, dont elle occupe les deux rives (Defaut,
2005). Si une liste actualisée des espèces a
été récemment proposé pour Ensifera
(Mohamed Sahnoun et al., 2010), rien n'existe pour faciliter
les études de Caelifera, même si ils comprennent plusieurs
espèces potentiellement ravageuses (Duranton et al.,
1982). Pour notre étude l'identification des spécimens
jusqu'à l'espèce a été réalisée
à l'aide des clés taxonomiques de Chopard
(1943); Dirsh (1965), ainsi que le catalogue des
Orthoptères Acridomorpha de l'Afrique du Nord-ouest (Louveaux et
al., 2019). La classification des Orthoptères a
été actualisée à l'aide du fichier en ligne des
espèces d'Orthoptères (Cigliano et al.,
2019). L'identification d'une espèce se fait en plusieurs
étapes par élimination : ex. antennes (ensiformes, filiformes...)
fémur postérieur (long, étroit...), pronotum (en selle,
trapézoïdal, comprimé, bord postérieur arrondi, Bord
postérieur subanguleux...), carènes médiane (coupée
par le sillon...), nervure intercalée (serrulée, non
serrulée), Ailes (hyalines, colorées...), Plaque
sous-génitale (en pointe, courbée vers le haut, incisée
à l'apex,). Le Tableau 17 ci-dessous présente l'inventaire des
Orthoptères recensés dans neuf stations de la vallée du
M'Zab (Ghardaïa), durant la période allant de Septembre 2016
jusqu'à Août 2019.
41
Résultats et Discussions
Tableau 17 : Inventaire d'Orthoptères de
neuf sites de la vallée du M'Zab
|
Sous Ordres
|
Familles
|
Sous Familles
|
Espèces
|
|
Caelifera
|
Acrididae
|
Acridinae
|
Acrida turrita (Linné, 1758)
|
|
Truxalis nasuta (Linné, 1758)
|
|
Cyrtacanthacridinae
|
Anacridium aegyptium (Linné, 1764)
|
|
Schistocerca gregaria (Forskål, 1775)
|
|
Eremogryllinae
|
Notopleura saharica (Krauss, 1902)
|
|
Calliptaminae
|
Calliptamus barbarus (Costa, 1836)
|
|
Eyprepocnemidinae
|
Heteracris adspersa (Redtenbacher, 1889)
|
|
Heteracris annulosa (Walker, 1870)
|
|
Heteracris harterti (Bolivar, 1913)
|
|
Heteracris littoralis (Rambur, 1838)
|
|
Heteracris minuta (Uvarov, 1921)
|
|
Gomphocerinae
|
Ochrilidia filicornis (Krauss, 1902)
|
|
Ochrilidia geniculata (Bolivar, 1913)
|
|
Ochrilidia gracilis (Krauss, 1902)
|
|
Ochrilidia harterti (Bolivar, 1913)
|
|
Omocestus africanus (Harz, 1970)
|
|
Omocestus lucasii (Brisout de Barneville, 1850)
|
|
Oedipodinae
|
Aiolopus puissanti (Defaut, 2005)
|
|
Aiolopus simulatrix (Walker, 1870)
|
|
Aiolopus strepens (Latreille, 1804)
|
|
Acrotylus longipes (Charpentier, 1845)
|
|
Acrotylus patruelis (Herrich-Schäffer, 1838)
|
|
Hyalorrhipis calcarata (Vosseler, 1902)
|
|
Hilethera aeolopoides (Uvarov, 1922)
|
|
Locusta migratoria (Fabricius, 1781)
|
|
Morphacris fasciata (Thunberg, 1815)
|
|
Oedaleus senegalensis (Krauss, 1877)
|
|
Sphingoderus carinatus (Saussure, 1888)
|
|
Sphingonotus azurescens (Rambur, 1838)
|
|
Sphingonotus obscuratus lameerei (Finot, 1902)
|
|
Sphingonotus octofasciatus (Serville, 1839)
|
|
Sphingonotus pachecoi (Bolivar, 1908)
|
|
Sphingonotus paradoxus (Bei-Bienko, 1948)
|
|
Sphingonotus rubescens (Walker, 1870)
|
|
Sphingonotus savignyi (Saussure, 1884)
|
|
Vosseleriana fonti (Bolivar, 1902)
|
|
Tropidopolinae
|
Tropidopola cylindrica (Marschall, 1836)
|
|
Dericorythidae
|
Dericorythinae
|
Dericorys millierei (Bonnet & Finot, 1884)
|
|
Pamphagidae
|
Pamphaginae
|
Eunapiodes sp. (Bolivar, 1907)
|
|
Thrinchinae
|
Tmethis cisti (Fabricius, 1787)
|
|
Tuarega insignis (Lucas, 1851)
|
|
Pyrgomorphidae
|
Pyrgomorphinae
|
Pyrgomorpha cognata (Krauss, 1877)
|
|
Pyrgomorpha conica (Olivier, 1791)
|
|
Tenuitarsus angustus (Blanchard, 1836)
|
|
Tetrigidae
|
Tetriginae
|
Paratettix meridionalis (Rambur,
1839)
|
|
Ensifera
|
Tettigoniidae
|
Phaneropterinae
|
Phaneroptera nana (Fieber, 1853)
|
|
Conocephalinae
|
Conocephalus fuscus (Fabricius, 1793)
|
|
2
|
6
|
15
|
47
|
42
Résultats et Discussions
Au total, 31944 individus d'Orthoptères appartenant
à 47 espèces, 28 genres, 15 sous familles, six familles et deux
sous ordres ont été capturés dans neuf sites de la
vallée du M'Zab, durant la période s'étalant de Septembre
2016 à Août 2019 (Tableau 17).
Les 47 espèces d'Orthoptères, ont
été recensées au cours de 324 prospections et dans 3240
quadrats de 25m2. Le sous Ordre des Caelifères est
représenté par le groupe des Tetrigoidea avec une famille :
Tetrigidae, une sous famille : Tetriginae et une espèce Paratettix
meridionalis (Rambur, 1839). Le groupe des Acridomorpha comporte deux
super-familles : Acridoidea et Pyrgomorphoidea. Cette dernière comporte
une famille : Pyrgomorphidae et une sous famille : Pyrgomorphinae. Par contre
les Acridoidea comportent trois familles : Acrididae, Dericorythidae et
Pamphagidae (Tableau 18).
Tableau 18. Résumé du nombre de
sous-familles, genres et espèces pour chaque famille
d'Orthoptères de la vallée du M'Zab
|
Sous Ordre
|
Groupes
|
Familles
|
Nombre
|
|
Sous
Familles
|
Genres
|
Espèces
|
|
Caelifera
|
Tetrigoidea
|
Tetrigidae
|
1
|
1
|
1
|
|
Acridomorpha
|
Pyrgomorphidae
|
1
|
2
|
3
|
|
Acrididae
|
8
|
20
|
37
|
|
Dericorythidae
|
1
|
1
|
1
|
|
Pamphagidae
|
2
|
2
|
3
|
|
Ensifera
|
Tettigonioidea
|
Tettigoniidae
|
2
|
2
|
2
|
|
2
|
3
|
6
|
15
|
28
|
47
|
La famille des Acrididae est la plus représentée
avec huit sous-familles : Acridinae, Cyrtacanthacridinae, Eremogryllinae,
Calliptaminae, Eyprepocnemidinae, Gomphocerinae, Oedipodinae et
Tropidopolinae.
Alors que la famille des Pamphagidae est
représentée par deux sous familles : Pamphaginae et Thrinchinae.
Par contre la famille des Dericorythidae a une seule sous famille :
Dericorythinae,
Le sous ordre des Ensifères comporte une seule famille
: Tettigoniidae, Cette dernière est représentée par deux
sous familles : Phaneropterinae et Conocephalinae. Les sous familles des
Orthoptères les plus représentées en espèces sont
les Oedipodinae, Gomphocerinae, Eyprepocnemidinae et Pyrgomorphinae avec
respectivement 19, 6, 5, et 3 espèces. Les Acridinae,
Cyrtacanthacridinae et Thrinchinae comportent deux espèces chacune. Les
autres sous familles telles que les Eremogryllinae, Calliptaminae,
Tropidopolinae, Pamphaginae, Dericorythinae, Tetriginae, Phaneropterinae et
Conocephalinae sont représentées par une seule espèce.
Résultats et Discussions
Les espèces en surbrillance (Tableau 17) ont
été capturées pour la première fois dans la
région d'étude. Ils s'agissent de Notopleura saharica
(Krauss, 1902), Heteracris littoralis (Rambur, 1838), Heteracris
minuta (Uvarov, 1921), Aiolopus puissanti (Defaut, 2005),
Aiolopus simulatrix (Walker, 1870), Hilethera aeolopoides
(Uvarov, 1922), Morphacris fasciata (Thunberg, 1815),
Oedaleus senegalensis (Krauss, 1877), Sphingoderus carinatus
(Saussure, 1888), Sphingonotus paradoxus (Bei-Bienko, 1948), et
Tropidopola cylindrica (Marschall, 1836).
La figure 6 montre une dominance de trois sous-familles
d'Acrididae : les Oedipodinae, les Gomphocerinae et Eyprepocnemidinae, Elles
représentent respectivement (40,4%), (12,8%) et (10,6%). Au sein de la
sous famille des Oedipodinae, le genre Sphingonotus est le plus
nombreux en espèces dans cette liste d'inventaire avec 7 espèces
soit 14,9 % de l'effectif total des espèces recensées. Les
espèces les plus rencontrées au cours de nos prospections sont au
nombre de sept. Par ordre de fréquence d'observations on peut citer :
Acrotylus patruelis (Herrich-Schäffer, 1838), Ochrilidia
gracilis (Krauss, 1902), Acrida turrita (Linné, 1758),
Pyrgomorpha cognata (Krauss, 1877), Aiolopus strepens
(Latreille, 1804), Morphacris fasciata (Thunberg, 1815) et
Heteracris annulosa (Walker, 1870),

43
Figure 6. Pourcentages des différentes
sous-familles d'Orthoptères de la région d'étude
44
Résultats et Discussions
L'enquête sur les Orthoptères de la vallée
du M'Zab, dans le Sahara septentrional de l'Algérie, a été
menée sur une période de trois ans, de septembre 2016 à
août 2019, afin de compléter et de confirmer les informations sur
la faune de cette région. Au cours de l'enquête, un total de 47
espèces d'Orthoptères a été recensé sur neuf
sites. Ce nombre est à comparer aux 57 espèces acridiennes
inventoriées dans la région de Biskra (Moussi,
2012), aux 46 espèces Caelifères au niveau du grand
Sahara algérien (Ould El Hadj, 2004) et
également aux 31, 28 et 21 espèces d'Orthoptères
recensées dans la région de Ghardaïa des travaux respectifs
de Zergoun (1991,1994), Babaz (1992) et
Yagoub (1995), semblent satisfaisants. Actuellement, le nombre
d'espèces d'Orthoptères décrites en Algérie est
d'environ 289 espèces (Cigliano et al., 2019).
Dans ce cas avec 47 espèces, la vallée du M'Zab présente
16,3 % de la faune Orthoptérique Algérienne. La liste taxonomique
actualisée sur Caelifera en Algérie atteste de la présence
de 154 espèces / sous-espèces (Cigliano et al,,
2019). Le chiffre de 45 Caelifera recensé dans la vallée
du M'Zab présente 29,2 % du total des Caelifères de
l'Algérie. Ces derniers sont répartis en 5 familles : Acrididae
(37 espèces), Pamphagidae (3 espèces), Pyrgomorphidae (3
espèces), Dericorythidae (1 espèces), et Tetrigidae (1
espèces),
Des données taxonomiques actualisées sur
Ensifera en Algérie notent de la présence de 136 espèces /
sous-espèces (Cigliano et al,, 2019)
réparties en 7 familles : Gryllidae (53 espèces),
Trigonidiidae (06 espèces), Mogoplistidae (06 espèces),
Gryllotalpidae (03 espèces), Myrmecophilidae (05 espèces),
Anostostomatidae (une espèce), Tettigoniidae (62 espèces ). La
vallée du M'Zab ne présente qu'une seule famille : Tettigoniidae
représentée par deux espèces à savoir
Phaneroptera nana (Fieber, 1853) et Conocephalus fuscus
(Fabricius, 1793). Ce chiffre de deux espèces est évidemment
très faible si on le compare aux espèces d'Ensifères
notées en Algérie. Cela est probablement dû au faite que
les représentants des Ensifères sont étroitement
inféodés aux biotopes hygrotrophes et certains ont une
activité nocturne.
III.2. Estimation de la richesse
spécifique
La richesse en espèces est l'une des composantes de la
diversité les plus importantes en écologie communautaire, car
c'est un concept clé dans plusieurs théories biologiques et
stratégies de conservation (Magurran, 2004). Cependant,
le nombre d'espèces détectées dépend
remarquablement de l'échantillonnage (Gotelli & Colwell,
2011) et nécessite une attention particulière pour les
données estimées à partir d'échantillons de
terrain (MacKenzie, 2006). Lors d'un échantillonnage
des peuplements d'Orthoptères d'une région, une question revient
toujours à l'esprit qui est : comment savoir quand arrêter
l'échantillonnage ?
45
Résultats et Discussions
Au fur et à mesure que plus d'individus sont
contactés, le taux de découverte de nouvelles espèces
diminue généralement. Une fois que nous avons trouvé 20
espèces par exemple, nous devrons peut-être augmenter le nombre
d'échantillonnage pour trouver la 21ème espèce
et un nombre encore plus grand pour trouver la 22ème
espèce, car la plupart des espèces communes ont probablement
été rencontrées. Un problème pratique qui se pose
lors de la mesure de la richesse et de la diversité des espèces
consiste à déterminer quand vous avez suffisamment
collecté pour arrêter l'échantillonnage. Heureusement, les
statisticiens ont mis au point un certain nombre de techniques permettant
d'utiliser cette baisse du taux de découverte pour estimer la richesse
totale en espèces du site. La caractérisation de la
diversité spécifique des différents habitats a
été faite grâce aux courbes d'accumulation de la richesse
spécifique. Ces courbes sont largement utilisées dans la
comparaison de la diversité spécifique observée dans
différents sites d'un paysage (Ugland et al., 2003 ;
Kalinganire et al., 2005). Par ailleurs, ces courbes
d'accumulation de la richesse spécifique fournissent une importante
information sur la représentativité de l'échantillonnage
par rapport à la biodiversité de la zone d'étude,
c'est-à-dire le nombre d'espèces rencontrées en fonction
de l'effort d'échantillonnage. Concrètement, elles permettent
d'estimer la richesse spécifique si les milieux ont été
suffisamment échantillonnés (Niyukuri et al.,
2014). Afin de comparer la richesse en espèces des assemblages
des Orthoptères des différents milieux de la vallée du
M'Zab, des courbes d'accumulation d'échantillons randomisées ont
été calculées et extrapolées à 36
échantillons à l'aide du logiciel Estimâtes S
(Colwell, 2013). Les courbes de raréfaction basées sur
des échantillons ont été tracées ensemble pour
chaque site afin de vérifier l'exhaustivité de
l'échantillonnage. En analysant la richesse spécifique des neuf
biotopes échantillonnés dans la vallée du M'Zab, nous
constatons que le milieu cultivé Ben Isguen présente une richesse
spécifique plus élevée par rapport aux autres (Figure 7).
Pour le milieu cultivé Ben Isguen, le nombre de 24 espèces est
atteint après 36 échantillons, ce qui suggère qu'aucun
autre échantillon n'était nécessaire après le
36ème échantillon. Le nombre cumulatif
d'espèces pour chaque milieu cultivé variait entre 24
espèces à Ben Isguen, 22 espèces à Ghardaïa et
16 espèces à El Atteuf pour les milieux cultivés. Ces
nombres cumulatifs d'espèces sont atteints respectivement après
le 36ème, 29ème et 15ème
échantillon. Au niveau des palmeraies de Ben Isguen, Ghardaïa et El
Atteuf, le nombre cumulatif d'espèces est respectivement 18,16 et 15
espèces, Ces chiffres sont enregistrés respectivement
après le 16ème, 14ème et
10ème échantillon.
Résultats et Discussions

46
Figure 7. Courbes d'accumulation de la
richesse spécifique des neuf sites d'étude
47
Résultats et Discussions
Les milieux naturels de Ben Isguen, Ghardaïa et El Atteuf
notent respectivement 21,17 et 14 espèces, Ces nombres cumulatifs sont
atteints respectivement après le 19ème,
15ème et 13ème échantillon. Les
courbes de raréfaction ont montré que l'échantillonnage
était suffisant sur chaque site. Les courbes basées sur les
échantillons ont atteint toutes les asymptotes. Les méthodes non
paramétriques d'estimation de la richesse en espèces
réelle ont indiqué que l'inventaire de chaque habitat
était complet. Malgré l'effort d'échantillonnage suffisant
et même si les principales biotopes de la vallée du M'Zab ont
été visitées et apportent l'essentiel des informations,
d'autres localités de la région d'étude pourraient
être échantillonnées. Malgré des différences
dans les efforts d'échantillonnage, Les assemblages les plus riches
étaient ceux des milieux cultivés de Ben Isguen et Ghardaïa,
et les plus pauvres, ceux de palmeraie et milieu naturel d'El Atteuf.
III.3. Variation saisonnière de la
densité des Orthoptères
Les densités maximales caractérisent les
relevés effectués en milieux cultivés (163 individus
à 118 individus pour 100 m2). Inversement, les
densités les plus faibles (3 à 4 individus pour 100
m2) correspondent aux milieux naturels et les palmeraies, Les
figures 8,9 et 10 montrent la variation saisonnière de la densité
de population d'Orthoptères (adultes et larves) pendant la
période de l'étude.
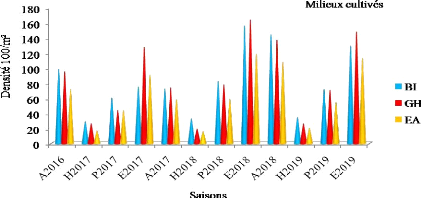
A : Automne ; H : Hiver ; P : Printemps ; E : Eté
Figure 8. Variation saisonnière de la
densité de population d'Orthoptères (adultes et larves)
enregistrée au cours de la période d'étude dans les
milieux cultivés.
48
Résultats et Discussions
La densité totale des sauterelles a varié au
cours de la période d'étude. Des densités plus
élevées ont été atteintes en Eté 2018 dans
les milieux cultivés (163 individus / 100 m2) à Ghardaïa,
(156 individus / 100 m2) à Ben Isguen et (118 individus / 100 m2) pour
El Atteuf. Des densités plus faibles ont été
enregistrées en Hiver 2017 dans les milieux naturels. On note (3
individus / 100 m2) à Ghardaïa et Ben Isguen. Les plus faibles
densités ont été marquées aussi dans la palmeraie
d'El Atteuf durant la saison hivernale des trois ans d'étude (4 à
5 individus pour 100 m2).
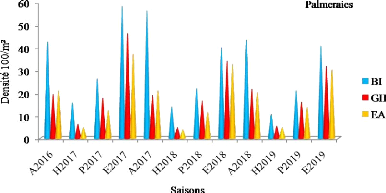
A : Automne ; H : Hiver ; P : Printemps ; E : Eté
Figure 9. Variation saisonnière de la
densité de population d'Orthoptères (adultes et larves)
enregistrée au cours de la période d'étude dans les
palmeraies
Les densités étaient plus élevées
dans les sites moins perturbés de Ben Isguen et Ghardaïa. Des
résultats similaires ont été observés par
Cigliano et al., (2002) dans le comté de
Benito Juarez, sud de la Pampa, en Argentine, où les habitats non
perturbés ont entraîné une augmentation globale
densités de sauterelles.
Les assemblages des Orthoptères peuvent différer
en densité, en dominance et en composition spécifique en raison
des différences de végétation, d'humidité, de sol
et de température de l'habitat (Joern, 1982).
49
Résultats et Discussions
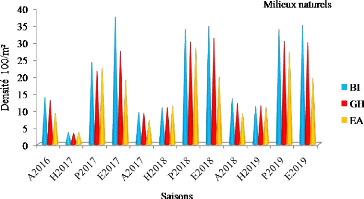
A : Automne ; H : Hiver ; P : Printemps ; E : Eté
Figure 10. Variation saisonnière de la
densité de population d'Orthoptères (adultes et larves)
enregistrée au cours de la période d'étude dans les
milieux naturels
Le pic observé en Eté pourrait s'expliquer par
les fortes températures. La plus faible densité notée en
Hiver pourrait s'expliquer par des températures basses. En effet les
densités ont eu tendance à augmenter par temps chaud et sec dans
notre étude. Ce résultat ne concorde pas avec ceux
enregistrés dans le sud Argentine, où la densité des
sauterelles n'a pas été affectée par les
précipitations et la température saisonnières
(Wysiecki et al., 2011). Durant la Saison hivernal la
majorité des Acridiens sont en diapause (embryonnaire, larvaire ou
imaginale). Au printemps les insectes en général et les
Orthoptères en particulier augmentent leur effectif à cause des
éclosions des oeufs et la reprise de leur activité. Le
recouvrement végétal devient important durant le Printemps, ce
qui favorise une élévation progressive en espèces et en
individus des Acridiens. En général la densité des
criquets commence à augmenter en Printemps pour atteindre le maximum en
Eté. Cette densité élevée est maintenue durant
l'Automne pour diminuer progressivement jusqu'à la mauvaise saison.
Ainsi, le moment des précipitations et le temps ensoleillé
peuvent jouer un rôle très important dans la détermination
de la densité des sauterelles (Stauffer & Whitman,
1997).
III.4. Abondance relative
Le (Tableau 19) regroupe l'abondance relative des 47
espèces d'Orthoptères des 9 stations d'études. Les
prospections menées entre 2016 et 2019 ont permis de recenser un
total
50
Résultats et Discussions
de 47 espèces sur neuf stations de la vallée du
M'Zab. Les trois milieux cultivés : Ben Isguen, Ghardaïa et El
Atteuf enregistrent respectivement 24, 22 et 18 espèces.
Tableau 19. Abondance relative (%) des
Orthoptères dans 9 stations de la vallée du M'Zab
|
Code
|
Stations
|
|
MCBI
|
MCGH
|
MCEA
|
PABI
|
PAGH
|
PAEA
|
MNBI
|
MNGH
|
MNEA
|
|
Actu
|
3,49
|
3,09
|
3,47
|
6,64
|
6,03
|
4,38
|
-
|
-
|
-
|
|
Trna
|
0,92
|
0,74
|
-
|
1,48
|
-
|
-
|
3,92
|
3,33
|
4,18
|
|
Scgr
|
-
|
-
|
-
|
-
|
-
|
-
|
0,93
|
0,70
|
1,01
|
|
Demi
|
-
|
-
|
-
|
-
|
-
|
-
|
0,52
|
-
|
-
|
|
Anae
|
-
|
-
|
-
|
2,10
|
3,61
|
2,22
|
-
|
-
|
-
|
|
Caba
|
0,01
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Nosa
|
1,48
|
1,30
|
-
|
-
|
-
|
-
|
6,39
|
7,49
|
9,36
|
|
Head
|
0,43
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Hean
|
4,89
|
5,17
|
5,12
|
4,40
|
5,35
|
3,87
|
-
|
-
|
-
|
|
Heha
|
2,69
|
-
|
-
|
3,65
|
-
|
3,81
|
-
|
-
|
-
|
|
Heli
|
4,33
|
4,27
|
4,08
|
3,79
|
-
|
-
|
-
|
-
|
-
|
|
Hemi
|
0,29
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Ocfi
|
0,92
|
1,07
|
1,06
|
-
|
9,75
|
9,08
|
-
|
-
|
-
|
|
Ocge
|
3,03
|
3,35
|
4,91
|
3,37
|
8,34
|
7,75
|
-
|
-
|
-
|
|
Ocgr
|
14,37
|
14,52
|
16,31
|
17,89
|
20,00
|
18,48
|
-
|
-
|
-
|
|
Ocha
|
3,23
|
4,68
|
-
|
-
|
-
|
11,49
|
-
|
-
|
-
|
|
Omaf
|
-
|
-
|
-
|
-
|
1,63
|
-
|
-
|
-
|
-
|
|
Omlu
|
-
|
-
|
-
|
-
|
1,24
|
-
|
-
|
-
|
-
|
|
Aipu
|
1,98
|
2,05
|
2,65
|
2,58
|
2,82
|
4,19
|
-
|
-
|
-
|
|
Aisi
|
1,98
|
1,70
|
2,02
|
2,51
|
-
|
-
|
-
|
-
|
-
|
|
Aist
|
10,80
|
9,88
|
10,35
|
12,46
|
7,49
|
6,79
|
-
|
-
|
-
|
|
Aclo
|
4,02
|
3,20
|
3,35
|
-
|
-
|
-
|
14,12
|
15,91
|
20,23
|
|
Acpa
|
12,0%
|
12,75
|
14,46
|
11,46
|
8,06
|
-
|
2,94
|
-
|
-
|
|
Hyca
|
-
|
-
|
-
|
-
|
-
|
-
|
1,08
|
-
|
-
|
|
Hiae
|
2,01
|
2,56
|
0,23
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Lomi
|
-
|
0,11
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Mofa
|
9,33
|
9,53
|
11,38
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Oese
|
-
|
0,04
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Spca
|
-
|
1,23
|
-
|
-
|
-
|
-
|
5,15
|
5,38
|
6,70
|
|
Spaz
|
-
|
1,67
|
-
|
-
|
-
|
-
|
6,75
|
7,02
|
-
|
|
Sppa
|
-
|
-
|
-
|
-
|
-
|
-
|
0,46
|
0,64
|
1,01
|
|
Sppr
|
-
|
-
|
-
|
-
|
-
|
-
|
5,31
|
7,02
|
-
|
|
Spob
|
-
|
-
|
-
|
-
|
-
|
-
|
1,55
|
1,35
|
1,30
|
|
Spoc
|
-
|
-
|
-
|
-
|
-
|
-
|
2,16
|
1,64
|
1,15
|
|
Spru
|
-
|
-
|
-
|
-
|
-
|
-
|
11,64
|
11,05
|
13,10
|
|
Spsa
|
-
|
-
|
-
|
-
|
-
|
-
|
14,37
|
15,91
|
17,28
|
|
Vofo
|
-
|
-
|
-
|
-
|
-
|
-
|
1,29
|
0,88
|
-
|
|
Eusp
|
-
|
-
|
-
|
-
|
-
|
-
|
0,10
|
-
|
-
|
|
Pycg
|
8,12
|
9,36
|
10,67
|
9,05
|
8,00
|
7,37
|
3,19
|
1,64
|
2,52
|
|
Pyco
|
7,00
|
7,73
|
8,78
|
7,67
|
7,04
|
6,03
|
3,14
|
2,63
|
3,38
|
|
Tean
|
1,85
|
-
|
-
|
-
|
-
|
-
|
11,18
|
11,81
|
12,38
|
|
Tuin
|
-
|
-
|
-
|
-
|
-
|
-
|
3,81
|
-
|
-
|
|
Tmci
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
5,61
|
6,41
|
|
Trcy
|
-
|
-
|
-
|
3,06
|
-
|
-
|
-
|
-
|
-
|
|
Pame
|
0,83
|
-
|
1,15
|
4,61
|
4,34
|
5,97
|
-
|
-
|
-
|
|
Cofu
|
-
|
-
|
-
|
1,72
|
3,55
|
4,89
|
-
|
-
|
-
|
|
Phna
|
-
|
-
|
-
|
1,55
|
2,76
|
3,68
|
-
|
-
|
-
|
|
47
|
100%
|
100%
|
100%
|
100%
|
100%
|
100%
|
100%
|
100%
|
100%
|
MCBI : milieu cultivé Ben Isguen ; MCGH : milieu
cultivé Ghardaïa ; MCEA : milieu cultivé El Atteuf ; PABI :
palmeraie Ben Isguen ; PAGH : palmeraie Ghardaïa ; PAEA : palmeraie El
Atteuf ; MNBI : milieu naturel Ben Isguen ; MNGH : milieu naturel Ghardaïa
; MNEA : milieu naturel El Atteuf
51
Résultats et Discussions
On remarque que les cinq Acridiens les plus abondants
(Ochrilidia gracilis, Acrotylus patruelis, Aiolopus
strepens, Morphacris fasciata et Pyrgomorpha cognata)
renferment plus de 57,5 % des spécimens des trois milieux
cultivés. Les proportions des cinq espèces abondantes se
présentent différemment d'une station à une autre durant
la période d'étude. On rencontre deux espèces à
très faible abondance dans les milieux cultivés. Ces
espèces sont : Calliptamus barbarus (un seul spécimen)
dans le milieu cultivé Ben Isguen et Oedaleus senegalensis
(trois spécimens) dans le milieu cultivé Ghardaïa.
Globalement, Ochrilidia gracilis est apparue comme l'espèce la
plus abondante lors des relevés, puisqu'elle est présente en
grande abondance dans les milieux cultivés. Son abondance varie de
(14,4% à 16,3%) dans les habitats cultivés. Acrotylus
patruelis vient en deuxième position avec une abondance qui varie
de (14,5% à 12%). Aiolopus strepens, Morphacris fasciata
et Pyrgomorpha cognata présentent une abondance relative
de (8,1% à 11,4%).
Dans les trois palmeraies : Ben Isguen (PABI), Ghardaïa
(PAGH) et El Atteuf (PAEA), on a recensé respectivement 18, 16, et 15
Orthoptères, Ochrilidia gracilis enregistre le plus fort
pourcentage au niveau des palmeraies. Les valeurs de l'abondance de ce
Gomphocerinae sont de 20 % à Ghardaïa, 18,5 % à El Atteuf et
17,9 % à Ben Isguen. En deuxième position vient Aiolopus
strepens (12,5 %) à Ben Isguen, Ochrilidia harterti
(11,5%) à El Atteuf et Ochrilidia filicornis (9,8 %)
à Ghardaïa.
Les milieux naturels : Ben Isguen (MNBI), Ghardaïa (MNGH)
et El Atteuf (MNEA) révèlent la présence respective de 21,
17 et 14 Caelifères. Dans les milieux naturels, 55,7 % du peuplement des
Caelifères est représenté par seulement quatre
espèces. Ces Acridiens sont : Acrotylus longipes (16,4%°,
Sphingonotus savignyi, (15,7%), Sphingonotus rubescens
(11,85%) et Tenuitarsus angustus. Le milieu naturel Ben Isguen
renferme une seule espèce observé une seule fois, il s'agit
d'Eunapiodes sp.
Selon Bonnet et al., (1997), le type
de milieu influence non seulement la présence des espèces
d'Orthoptères, mais aussi leur abondance relative. Dans le cas de notre
travail, nous avons constaté une influence de la structure de la
végétation sur la composition, la richesse et le nombre
d'individus. En effet, comme nous avons pu le constater, le nombre d'individus
des Orthoptères diminue à mesure que la végétation
est perturbée. La perturbation des milieux cultivés a un effet
sur l'abondance des Orthoptères. L'impact de perturbation est
étroitement lié à son intensité. Dans le milieu
cultive Ben Isguen, l'intensité des travaux agricoles est relativement
faible. Le milieu cultivé Ghardaïa la perturbation est
modérée. Par contre le milieu cultivé El Atteuf,
l'intensité des travaux agricoles est plus prononcée. D'où
l'abondance des criquets est élevée dans les milieux non
perturbés. Un milieu non
52
Résultats et Discussions
perturbé conduit à une augmentation de la
végétation adventice principalement graminéenne. Cette
dernière est très appréciée par un grand nombre
d'espèces d'Orthoptères telles que les Gomphocerinae, c'est le
cas d'Ochrilidia gracilis. Defaut (2000), note que
l'ouverture d'un milieu à la végétation dense conduit
presque inévitablement à une augmentation d'Orthoptères.
La diminution de l'intensité agricole contribuait à l'apparition
de beaucoup de surfaces nues qui favorisent le développement des
Oedipodinae telle qu'Acrotylus patruelis. Au niveau des palmeraies et
autour du palmier dattier s'installe une végétation
graminéenne très dense. Cette dernière est
représentée principalement par Cynodon dactylon et
Setaria verticillata. Ces deux Poaceae créent un microclimat
humide et favorisent l'installation en nombre très important de
Gomphocerinae. Le relief rocailleux des milieux naturels et l'accumulation du
sable au niveau des Oueds est un habitat favorable pour plusieurs
espèces telle que : Sphingonotus savignyi, Sphingonotus
rubescens, Acrotylus longipes et Tenuitarsus angustus.
Ces quatre dernières espèces sont abondantes dans les milieux
naturels.
III.5. Constance ou Fréquence
d'Occurrence
Les données des fréquences d'occurrences
relatives aux classes des espèces d'Orthoptères
inventoriés dans les neuf sites de la vallée du M'Zab sont
reportées dans le tableau 20.
Dans les sites MCBI, MCGH, PABI, MNBI et MNGH le nombre de
classe de constance des espèces Acridiennes calculée selon la
règle de Sturge est de six classes. Les intervalles de classes dans ces
biotopes sont respectivement 17,52%, 16,88%, 14,59%, 17,62% et 14,82%. Par
contre les habitats MCEA, PAGH, PAEA et MNEA enregistrent cinq classes de
constances des Orthoptères. Leurs intervalles de classes est
respectivement 15,09%, 13,97%, 12,78% et 14,52%. Le Tableau 21 regroupe les
classes de constance calculées des espèces d'Orthoptères
recensées dans les neuf d'étude choisies à la
vallée du M'Zab.
Dans les milieux cultivés presque la moitié des
espèces sont omniprésentes, soit 43,6% des espèces
présentes dans ces biotopes (Figure 11). C'est le cas de
d'Ochrilidia gracilis, Aiolopus strepens, Acrotylus
patruelis, Morphacris fasciata, Pyrgomorpha cognata, et
Pyrgomorpha conica. En deuxième positon viennent les
espèces constantes avec 29%. Les espèces régulières
et accessoires dans les trois sites notent une valeur de 12,9%. Il n'y a pas
d'espèces accessoires dans l'habitat El Atteuf. Les espèces
accidentelles et rares sont très faiblement représentées
ou absentes dans les milieux cultivés. Calliptamus barbarus et
Oedaleus senegalensis sont rares dans respectivement le milieu cultive
Ben Isguen et Ghardaïa.
53
Résultats et Discussions
Tableau 20. Constance (%) des espèces
d'Orthoptères inventoriés dans les neuf sites de la vallée
du M'Zab
|
Code
|
MCBI
|
MCGH
|
MCEA
|
PABI
|
PAGH
|
PAEA
|
MNBI
|
MNGH
|
MNEA
|
|
Actu
|
97,22
|
86,11
|
97,22
|
97,22
|
86,11
|
91,67
|
-
|
-
|
-
|
|
Trna
|
75
|
66,67
|
-
|
63,89
|
-
|
-
|
72,22
|
66,67
|
75
|
|
Scgr
|
-
|
-
|
-
|
-
|
-
|
-
|
47,22
|
30,56
|
33,33
|
|
Demi
|
-
|
-
|
-
|
-
|
-
|
-
|
22,22
|
-
|
-
|
|
Anae
|
-
|
-
|
-
|
69,44
|
72,22
|
-
|
-
|
-
|
-
|
|
Caba
|
2,78
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Nosa
|
41,67
|
41,67
|
-
|
-
|
-
|
-
|
44,44
|
44,44
|
47,22
|
|
Head
|
50
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Hean
|
80,56
|
91,67
|
80,56
|
80,56
|
75
|
69,44
|
-
|
-
|
-
|
|
Heha
|
80,56
|
-
|
-
|
83,33
|
-
|
72,22
|
-
|
-
|
-
|
|
Heli
|
81
|
83,33
|
75
|
86,11
|
-
|
-
|
-
|
-
|
-
|
|
Hemi
|
33,33
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Ocfi
|
81
|
80,56
|
69,44
|
-
|
86,11
|
77,78
|
-
|
-
|
-
|
|
Ocge
|
86,11
|
86,11
|
88,89
|
80,56
|
88,89
|
88,89
|
-
|
-
|
-
|
|
Ocgr
|
100
|
100
|
100
|
100
|
100
|
100
|
-
|
-
|
-
|
|
Ocha
|
66,67
|
63,89
|
-
|
-
|
-
|
100
|
-
|
-
|
-
|
|
Omaf
|
-
|
-
|
-
|
-
|
33,33
|
-
|
-
|
-
|
-
|
|
Omlu
|
-
|
-
|
-
|
-
|
30,56
|
-
|
-
|
-
|
-
|
|
Aipu
|
77,78
|
69,44
|
77,78
|
72,22
|
66,67
|
75
|
-
|
-
|
-
|
|
Aisi
|
80,56
|
66,67
|
75
|
77,78
|
-
|
-
|
-
|
-
|
-
|
|
Aist
|
100
|
100
|
100
|
100
|
91,67
|
91,67
|
-
|
-
|
-
|
|
Aclo
|
86,11
|
75
|
75
|
-
|
-
|
-
|
77,78
|
77,78
|
77,78
|
|
Acpa
|
100
|
100
|
97,22
|
100
|
91,67%
|
-
|
50%
|
-
|
-
|
|
Hyca
|
-
|
-
|
-
|
-
|
-
|
-
|
41,67
|
-
|
-
|
|
Hiae
|
52,78
|
55,56
|
25
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Lomi
|
-
|
16,67
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Mofa
|
100
|
94,44
|
97,22
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Oese
|
-
|
8,33
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Spca
|
-
|
33,33
|
-
|
-
|
-
|
-
|
44,44
|
47,22
|
50
|
|
Spaz
|
-
|
44
|
-
|
-
|
-
|
-
|
50
|
44,44
|
-
|
|
Sppa
|
-
|
-
|
-
|
-
|
-
|
-
|
19,44
|
25
|
30,56
|
|
Sppr
|
-
|
-
|
-
|
-
|
-
|
-
|
33,33
|
52,78
|
-
|
|
Spob
|
-
|
-
|
-
|
-
|
-
|
-
|
38,89
|
36,11
|
33,33
|
|
Spoc
|
-
|
-
|
-
|
-
|
-
|
-
|
50
|
47,22
|
38,89
|
|
Spru
|
-
|
-
|
-
|
-
|
-
|
-
|
80,56
|
80,56%
|
83,33
|
|
Spsa
|
-
|
-
|
-
|
-
|
-
|
-
|
66,67
|
69,44
|
66,67
|
|
Vofo
|
-
|
-
|
-
|
-
|
-
|
-
|
30,56
|
33,33
|
-
|
|
Eusp
|
-
|
-
|
-
|
-
|
-
|
-
|
5,56
|
-
|
-
|
|
Pycg
|
100
|
100
|
97,14
|
100
|
100
|
94,44
|
86,11
|
72,22
|
63,89
|
|
Pyco
|
100
|
100
|
61,11
|
100
|
100
|
94,44
|
97,22
|
86,11
|
88,89
|
|
Tean
|
50
|
-
|
-
|
-
|
-
|
-
|
66,67
|
75
|
61,11
|
|
Tuin
|
-
|
-
|
-
|
-
|
-
|
-
|
38,89
|
-
|
-
|
|
Tmci
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
66,67
|
61,11
|
|
Trcy
|
-
|
-
|
-
|
50
|
-
|
-
|
-
|
-
|
-
|
|
Pame
|
63,89
|
-
|
|
66,67
|
66,67
|
72,22
|
-
|
-
|
-
|
|
Cofu
|
-
|
-
|
-
|
25
|
38,89
|
38,89
|
-
|
-
|
-
|
|
Phna
|
-
|
-
|
-
|
25
|
30,56
|
41,67
|
-
|
-
|
-
|
(-) : Espèce absente ; MCBI
: milieu cultivé Ben Isguen ; MCGH : milieu
cultivé Ghardaïa ; MCEA : milieu cultivé El
Atteuf ; PABI : palmeraie Ben Isguen ; PAGH :
palmeraie Ghardaïa ; PAEA : palmeraie El Atteuf ;
MNBI : milieu naturel Ben Isguen ; MNGH :
milieu naturel Ghardaïa ; MNEA : milieu naturel El
Atteuf
54
Résultats et Discussions
Tableau 21. Classes de constance
calculées des espèces d'Orthoptères recensées dans
les neuf d'étude choisies à la vallée du M'Zab entre
Septembre 2016 et Aout 2019.
|
Sites
|
omniprésentes
|
constantes
|
régulières
|
accessoires
|
Accidentelles
|
rares
|
|
MCBI
|
[100-82,48[
|
[82,48-64,96[
|
[64,96-47,44[
|
[47,44-29,92[
|
[29,92-12,4[
|
[12,4- 2,78]
|
|
MCGH
|
[100-83,12[
|
[83,12-66,24[
|
[66,24-49,36[
|
[49,36-32,48[
|
[32,48-15,6[
|
[15,6- 8,33]
|
|
MCEA
|
[100-84,91[
|
[84,91-69,82[
|
[69,82-54,73[
|
[54,73-39,64[
|
[39,64-24,55[
|
-
|
|
PABI
|
[100-85,41[
|
[85,41-70,82[
|
[70,82-56,23[
|
[56,23-41,64[
|
[41,64-27,05[
|
[27,05-25]
|
|
PAGH
|
[100-86,03[
|
[86,03-72,06[
|
[72,06-58,09[
|
[58,09-44,12[
|
[44,12-30,15[
|
-
|
|
PAEA
|
[100-87,22[
|
[87,22-74,44[
|
[74,44-61,66[
|
[61,66-49[
|
[49-36,22[
|
-
|
|
MNBI
|
[100-82,38[
|
[82,38-64,76[
|
[64,76-47,14[
|
[47,14-29,52[
|
[29,52-11,9[
|
[11,9-5,56]
|
|
MNGH
|
[100-85,18[
|
[85,18-70,36[
|
[70,36-55,54[
|
[55,54-40,72[
|
[40,72-25,9[
|
[25,9-11,08[
|
|
MNEA
|
[100-85,48[
|
[85,48-70,96[
|
[70,96-56,44[
|
[56,44-41,92[
|
[41,92-27,4 [
|
-
|
(-) : Espèce absente ; MCBI : milieu cultivé Ben
Isguen ; MCGH : milieu cultivé Ghardaïa ; MCEA : milieu
cultivé El Atteuf ; PABI : palmeraie Ben Isguen ; PAGH : palmeraie
Ghardaïa ; PAEA : palmeraie El Atteuf ; MNBI : milieu naturel Ben Isguen ;
MNGH : milieu naturel Ghardaïa ; MNEA : milieu naturel El Atteuf.
Calliptamus barbarus et Oedaleus senegalensis
sont rares dans respectivement le milieu cultive Ben Isguen et
Ghardaïa. Au niveau des palmeraies les espèces omniprésentes
dominent toutes les catégories de constances. Elles enregistrent une
valeur de 45,8% (Figure 12). Nous citerons à titre d'exemple
Pyrgomorpha cognata, Pyrgomorpha conica, Ochrilidia
gracilis et Acrida turrita. Les espèces constantes et
régulières représentent presque le même taux, ils
marquent respectivement 18 ,7% et 16,7%. Une seule espèce accessoire est
observée dans la palmeraie Ben Isguen, il s'agit de Tropidopola
cylindrica. Ce dernier biotope ne présente pas d'espèces
accidentelles, par contre il marque deux espèces rares c'est le cas de
Phaneroptera nana et Conocephalus fuscus.

Figure 11. Constance des Orthoptères dans
les trois milieux cultivés de la vallée du M'Zab
Résultats et Discussions
Les milieux naturels se caractérisent par les
catégories d'espèces accessoires, constantes et
régulières, avec des taux respectives de 26,9%, 23,1% et 21,1%
(Figure 13). Les espèces omniprésentes quant à eux sont
très faiblement représentées au niveau de ces biotopes.
Parmi les espèces omniprésentes de ces habitats, on cite
Pyrgomorpha cognata, Pyrgomorpha conica et Sphingonotus
rubescens. Les espèces accidentelles notent un taux de 17,3%. Les sites
milieux naturels Ben Isguen et Ghardaïa enregistrent une espèce
rare chacun, ils s'agissent d'Eunapiodes sp et Sphingonotus
pachecoi (Tableau 21).

55
Figure 12. Constance des Orthoptères dans
les trois palmeraies de la vallée du M'Zab
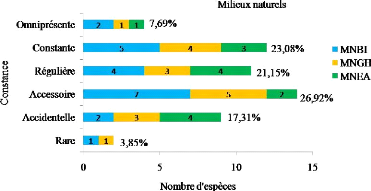
Figure 13. Constance Orthoptères dans les
trois milieux naturels de la vallée du M'Zab
Dans la région de Ghardaia, Zergoun (1994)
note que les valeurs les plus élevées de la constance en
milieu cultivé sont notées chez Acrotylus patruelis,
Ochrilidia gracilis et Pyrgomorpha cognata, ce qui confirme
nos résultats. Dans les Monts de Tlemcen, Mekkioui
56
Résultats et Discussions
& Mesli (2010), notent qu'Acrotylus
patruelis est accessoire dans la station à exposition nord et
constante dans la station à exposition sud. Alors que dans la
vallée du M'Zab, cet Oedipodinae est omniprésent. Calliptamus
barbarus est constante dans les stations du Moyen Atlas marocain
(Essakhi et al., 2014), par contre elle a
été observé qu'une seule fois dans le milieu
cultivé Ben Isguen. Pour Magurran & Henderson
(2003), les communautés écologiques peuvent être
divisées en deux groupes ; les espèces de base qui sont
fréquentes et les espèces occasionnelles qui sont rares.
III.6. Diversité Alfa
Les indices de diversité permettent d'apprécier
la diversité des milieux différents. Un indice de
diversité est fonction de la richesse et de la structure de la
communauté (Ramade, 2009). Pour quantifier la
diversité, le recours aux indices est devenu très répandu.
Cependant le choix de l'indice doit être approprié pour être
objectif. Souvent l'utilisation de plusieurs indices est nécessaire pour
avoir une perception plus juste de la situation (Magurran
2004). L'intérêt de ces indices est de permettre des
comparaisons globales de peuplements différents ou de l'état d'un
même peuplement saisi à des moments différents, en faisant
référence ou non à un cadre spatio-temporel concret. Ces
indices correspondent à une mesure de la composition en espèces
d'un écosystème, en termes de nombre et de leur abondance
relative (Barbault, 1992; Legendre & Legendre, 1998). Les
mesures les plus courantes de la biodiversité sont la richesse
spécifique (S), l'indice de diversité de Shannon-Weaver (H'), et
l'indice de Pielou (J) et l'indice de diversité de Simpson (1-D) et
l'inverse de l'indice de Simpson (1/D). Selon Morris (2014),
le terme "indice de diversité de Simpson" est souvent utilisé de
manière imprécise. Cela signifie que les trois indices (indice de
Simpson, indice de diversité de Simpson et l'inverse de l'indice de
Simpson), qui sont étroitement liés, ont été
cités sous le même terme selon différents auteurs. Par
conséquent, il est important de déterminer quel indice a
été utilisé dans une étude particulière si
des comparaisons de diversité sont souhaitées. Les valeurs de la
diversité Alpha (richesse taxonomique, diversité de
Shannon-Weaver, équitabilité de Pielou et diversité de
Simpson) des différents habitats sont consignées dans le Tableau
22. La richesse spécifique (S) varie d'un biotope à un autre
(Tableau 22), elle est relativement plus faible en milieu naturel El Atteuf (14
espèces) qu'en milieu cultivé Ben Isguen (24 espèces).
Le plus haut indice de diversité de Shannon-Weaver
(2,76) également l'indice de diversité Simpson (0,92) et
l'inverse de l'indice de diversité Simpson (12,70) a été
trouvé dans le milieu cultivé Ben Isguen, ce qui indique sa plus
haute diversité d'espèces (24 espèces) dans
57
Résultats et Discussions
ce type de milieu, car la plus grande valeur de ces deux indices
de diversité révéler la plus grande diversité
d'espèces.
Tableau 22 Diversité Alpha des
Orthoptères des neuf sites de la vallée du M'Zab
|
Stations
|
S
|
N
|
H'
|
J
|
D
|
1-D
|
1/D
|
|
Milieu cultivé Ben Isguen
|
24
|
7357
|
2,76
|
0,87
|
0,08
|
0,92
|
12,70
|
|
Milieu cultivé Ghardaïa
|
22
|
7528
|
2,69
|
0,87
|
0,08
|
0,92
|
12,06
|
|
Milieu cultivé El Atteuf
|
16
|
5738
|
2,46
|
0,89
|
0,10
|
0,90
|
9,95
|
|
Palmeraie Ben Isguen
|
18
|
2906
|
2,62
|
0,91
|
0,09
|
0,91
|
11,08
|
|
Palmeraie Ghardaïa
|
16
|
1775
|
2,56
|
0,92
|
0,09
|
0,91
|
10,83
|
|
Palmeraie El Atteuf
|
15
|
1575
|
2,56
|
0,95
|
0,09
|
0,91
|
11,15
|
|
Milieu naturel Ben Isguen
|
21
|
1955
|
2,73
|
0,90
|
0,08
|
0,92
|
12,98
|
|
Milieu naturel Ghardaïa
|
17
|
1712
|
2,48
|
0,88
|
0,10
|
0,90
|
9,98
|
|
Milieu naturel El Atteuf
|
14
|
1389
|
2,27
|
0,86
|
0,12
|
0,88
|
8,06
|
S : Richesse spécifique, N
: nombre d'individus, H' : Shannon-Weaver, J
: L'indice de Pielou, D : L'indice de Simpson,
1-D : L'indice de diversité de Simpson, 1/D
: L'inverse de l'indice de Simpson.
L'indice de diversité minimal de Shannon-Weaver (2,27),
de Simpson (0,88) et de l'inverse de Simpson (8,06) a été
noté dans le milieu naturel El Atteuf, ce qui montre sa plus faible
diversité d'espèces (14 espèces). Ces valeurs
témoignent que la diversité en espèces de ce biotope est
la plus faible parmi les neuf milieux étudiés.
Les valeurs de l'équitabilité de Pielou (J) dans
les différents milieux d'étude, varient entre 0,86 et 0,95,
Cependant les milieux qui présentent un indice de diversité
élevé ne sont pas forcement les plus homogène et
équilibrée dans la structure de leur peuplement
d'Orthoptères. En effet les milieux cultivés de Ben Isguen et
Ghardaïa ont un indice de diversité de Shannon-Weaver important,
par contre leurs valeurs d'équitabilité indiquent que ces
biotopes sont moins équilibrés. Selon Marcon
(2015), les indices d'équitabilité informent seulement
sur la régularité du nombre d'individus par espèce. Ces
résultats concernant l'équitabilité indiquent la
présence d'espèces dominantes dans les milieux cultivés de
Ben Isguen et Ghardaïa. L'inverse de l'indice de Simpson traduit bien
cette dominance, En effet dans ces deux derniers milieux la valeur de cette
indice est élevé, elle est respectivement égale à
12,70 et 12,06. D'après Blondel (1995), une valeur de
(H') même élevée ne peut être
interprétée en matière de perturbation d'un milieu que si
elle est accompagnée de l'indice d'équitabilité de Pielou
(J). La prise en compte de ces deux valeurs de manière synchrone est
donc nécessaire pour apprécier l'état du milieu. Sachant
que le milieu cultivé d'El Atteuf est perturbé par les
activités agricoles, cela se traduit par une faible diversité
spécifique (14) et par conséquent un indice de diversité
(2,27) et équitabilité (0,86) moins considérée que
les autres milieux.
58
Résultats et Discussions
La diversité des espèces est aussi fortement
influencée par la température, les précipitations,
l'humidité, types de sol, et types de végétation.
III.6.1. Variation saisonnière de la
diversité
Pour mieux comprendre les variations de diversité entre
les sites d'étude, on doit comparer les indices de diversité en
fonction des saisons.
III.6.1.1. Indice de diversité de Shannon-Weaver
(H')
Les variations saisonnières de l'indice de
diversité de Shannon-Weaver dan les neuf sites sont
présentées dans la Tableau 23.
Tableau 23. Variation saisonnière de
l'indice de diversité de Shannon-Weaver dans les neuf sites de la
région d'étude
|
Saison
|
MCBI
|
MCGH
|
MCEA
|
PABI
|
PAGH
|
PAEA
|
MNBI
|
MNGH
|
MNEA
|
|
A2016
|
2,67
|
2,58
|
2,38
|
2,68
|
2,55
|
2,57
|
2,33
|
2,22
|
1,74
|
|
H2017
|
2,44
|
2,17
|
2,13
|
2,28
|
1,84
|
2,23
|
1,30
|
1,38
|
1,52
|
|
P2017
|
2,65
|
2,29
|
2,21
|
2,28
|
2,13
|
2,18
|
2,30
|
2,18
|
2,19
|
|
E2017
|
2,62
|
2,56
|
2,52
|
2,55
|
2,61
|
2,50
|
2,42
|
2,27
|
1,75
|
|
A2017
|
2,61
|
2,55
|
2,28
|
2,60
|
2,54
|
2,46
|
2,16
|
1,92
|
2,04
|
|
H2018
|
2,53
|
2,34
|
2,26
|
2,25
|
2,08
|
2,19
|
1,55
|
1,48
|
1,69
|
|
P2018
|
2,70
|
2,67
|
2,34
|
2,46
|
2,26
|
2,38
|
2,36
|
2,21
|
2,09
|
|
E2018
|
2,74
|
2,73
|
2,46
|
2,63
|
2,58
|
2,58
|
2,44
|
2,29
|
1,96
|
|
A2018
|
2,66
|
2,61
|
2,43
|
2,66
|
2,56
|
2,53
|
2,18
|
2,00
|
1,65
|
|
H2019
|
2,44
|
2,23
|
2,16
|
2,18
|
2,04
|
2,27
|
1,44
|
1,52
|
1,50
|
|
P2019
|
2,73
|
2,70
|
2,36
|
2,41
|
2,29
|
2,39
|
2,31
|
2,20
|
2,09
|
|
E2019
|
2,74
|
2,70
|
2,43
|
2,59
|
2,57
|
2,55
|
2,40
|
2,24
|
1,93
|
MCBI : milieu cultivé Ben Isguen ;
MCGH : milieu cultivé Ghardaïa ; MCEA
: milieu cultivé El Atteuf ; PABI : palmeraie
Ben Isguen ; PAGH : palmeraie Ghardaïa ; PAEA
: palmeraie El Atteuf ; MNBI : milieu naturel Ben
Isguen ; MNGH : milieu naturel Ghardaïa ; MNEA
: milieu naturel El Atteuf ; A : Automne ; H
: Hiver ; P : Printemps ; E :
Eté
Dans la présente étude, la valeur de l'indice de
la diversité de Shannon-Weaver (H') variait de 1,30 à 2,74. Ces
indices enregistrent le minimum en Hiver et le maximum en Eté. En effet
les valeurs de l'indice de la diversité de Shannon-Weaver les plus
élevés sont enregistrées principalement durant les
Eté 2018 et 2019 dans le milieu cultivé Ben Isguen, ils
enregistrent une valeur de 2,74. La deuxième valeur élevée
de l'indice de la diversité de Shannon-Weaver a été
noté durant l'Eté 2018 dans le milieu cultivé
Ghardaïa et au printemps 2019 dans le milieu cultivé Ben Isguen.
Cette valeur importante durant les saisons Printemps et Eté s'explique
par le faite que durant ces deux saisons, les sites concernés ont
atteint leur diversité maximal en nombre et en espèces
d'Orthoptères. Les conditions climatiques et la végétation
ont un rôle primordial dans cette situation. De plus la plus part des
espèces Acridiennes ont
59
Résultats et Discussions
achevés leur cycle biologique. Les valeurs les plus
faibles de l'indice de la diversité de Shannon-Weaver ont
été marquées durant l'Hiver des trois ans d'étude.
Ces valeurs ont été notées dans les milieux naturels Ben
Isguen (1,3) et Ghardaïa (1,38). Cette diminution de diversité est
due probablement à la réduction du couvert végétal
et que durant l'Hiver la majorité des Orthoptères sont en
diapause embryonnaire, larvaire ou imaginale. Aucune différence
significative de la variation saisonnière sur l'indice de
diversité de Shannon-Weaver des Orthoptères dans les trois
palmeraies n'a été trouvée (Test de Kruskal-Wallis,
p-value = 0,32). La même chose était vraie pour la variation
saisonnière de l'indice de diversité de Shannon-Weaver des
milieux naturels (Test de Kruskal-Wallis, p-value = 0,14). Au contraire, la
variation saisonnière de l'indice de diversité de Shannon-Weaver
dans les trois milieux cultivés était significativement
différente (test de Kruskal-Wallis, p-value = 0,00046).
III.6.1.2. Indice d'Equitabilité de Pielou
(J)
Les valeurs de la variation saisonnière de l'indice
d'Equitabilité de Pielou (J) dans les neuf biotopes sont groupées
dans le Tableau 24.
Tableau 24. Variation saisonnière de
l'indice d'Equitabilité de Pielou (J) dan les neuf sites de la
région d'étude.
|
Saison
|
MCBI
|
MCGH
|
MCEA
|
PABI
|
PAGH
|
PAEA
|
MNBI
|
MNGH
|
MNEA
|
|
A2016
|
0,65
|
0,66
|
0,67
|
0,81
|
0,80
|
0,87
|
0,64
|
0,61
|
0,52
|
|
H2017
|
0,60
|
0,67
|
0,70
|
0,69
|
0,57
|
0,78
|
0,74
|
0,79
|
0,76
|
|
P2017
|
0,67
|
0,66
|
0,65
|
0,65
|
0,76
|
0,81
|
0,59
|
0,68
|
0,69
|
|
E2017
|
0,65
|
0,65
|
0,78
|
0,71
|
0,85
|
0,81
|
0,56
|
0,57
|
0,48
|
|
A2017
|
0,64
|
0,64
|
0,70
|
0,74
|
0,79
|
0,78
|
0,62
|
0,45
|
0,77
|
|
H2018
|
0,63
|
0,80
|
0,73
|
0,79
|
0,80
|
0,81
|
0,67
|
0,62
|
0,60
|
|
P2018
|
0,68
|
0,72
|
0,69
|
0,73
|
0,80
|
0,83
|
0,66
|
0,65
|
0,67
|
|
E2018
|
0,67
|
0,70
|
0,73
|
0,77
|
0,82
|
0,88
|
0,57
|
0,58
|
0,51
|
|
A2018
|
0,65
|
0,64
|
0,71
|
0,79
|
0,81
|
0,84
|
0,63
|
0,62
|
0,58
|
|
H2019
|
0,68
|
0,66
|
0,66
|
0,68
|
0,70
|
0,80
|
0,53
|
0,57
|
0,56
|
|
P2019
|
0,70
|
0,75
|
0,71
|
0,70
|
0,83
|
0,84
|
0,63
|
0,60
|
0,62
|
|
E2019
|
0,68
|
0,68
|
0,71
|
0,74
|
0,81
|
0,85
|
0,55
|
0,55
|
0,49
|
MCBI : milieu cultivé Ben Isguen ;
MCGH : milieu cultivé Ghardaïa ; MCEA
: milieu cultivé El Atteuf ; PABI : palmeraie
Ben Isguen ; PAGH : palmeraie Ghardaïa ; PAEA
: palmeraie El Atteuf ; MNBI : milieu naturel Ben
Isguen ; MNGH : milieu naturel Ghardaïa ; MNEA
: milieu naturel El Atteuf ; A : Automne ; H
: Hiver ; P : Printemps ; E :
Eté
En général l'équitabilité
enregistre le minimum en Hiver et le maximum en Printemps-Eté. Cet
indice variait de 0,45 à 0,85. Durant la période
Eté-Automne, le site palmeraie El Atteuf marque les valeurs les plus
élevées de l'équitabilité. Dans cet habitat
l'équirépartition atteint 0,88 en Eté 2018, et 0,87 en
Automne 2016. Il semble que durant les saisons d'Eté et Automne les
espèces Acridiennes sont équitablement réparties dans les
sites. Cet équilibre est
60
Résultats et Discussions
probablement dû aux bonnes conditions d'humidité,
température et végétation de l'habitat durant cette
période de l'année. Par contre les plus faibles valeurs de
l'équitabilité sont observé durant les saisons Eté
et Automne dans les milieux naturels. Les indices les plus faibles ont
été notés dans le milieu naturel Ghardaïa (0,45) en
Automne 2017 et dans le milieu naturel El Atteuf (0,48) durant l'Eté
2017. Ce déséquilibre dans la répartition des
espèces dans le milieu naturel peut s'explique par le faite que durant
l'Eté et une partie de l'Automne les températures dans ces
milieux atteignent des valeurs très élevé, par
conséquent les Acridiens cherchent l'humidité pour ce
protégé des valeurs extrême de températures. La
variation saisonnière de l'équitabilité dans les trois
milieux cultivés (Test de Kruskal-Wallis, p-value = 0,017) et les trois
palmeraies (Test de Kruskal-Wallis, p-value = 0,00052) était
significativement différente. Par contre, aucune différence
significative de la variation saisonnière de
l'équitabilité des Acridiens dans les trois milieux naturels
(Test de Kruskal-Wallis, p-value = 0,84). Selon Marcon (2015),
le maximum de diversité sera atteint quand les espèces auront une
répartition équitable.
III.6.3. L'inverse de l'indice de Simpson
L'indice de Simpson donne plus de poids aux espèces
abondantes qu'aux espèces rares (Schlaepfer & Bütler,
2002). Pour mieux présenter les variations saisonnières
de la diversité de Simpson nous avons préférés
d'utiliser l'inverse de l'indice de Simpson, Le Tableau 25 montre les
différences de l'inverse de l'indice de Simpson dans les neuf habitats
selon les saisons,
Tableau 25. Variation saisonnière de
l'inverse de l'indice de Simpson dans les neuf sites de la région
d'étude
|
Saison
|
MCBI
|
MCGH
|
MCEA
|
PABI
|
PAGH
|
PAEA
|
MNBI
|
MNGH
|
MNEA
|
|
A2016
|
11,79
|
10,91
|
9,23
|
12,35
|
10,49
|
11,31
|
7,76
|
6,54
|
3,85
|
|
H2017
|
9,36
|
7,66
|
7,42
|
7,70
|
4,15
|
7,70
|
3,21
|
3,43
|
3,93
|
|
P2017
|
11,24
|
8,21
|
7,86
|
7,67
|
6,97
|
7,97
|
7,31
|
7,26
|
6,80
|
|
E2017
|
10,36
|
10,53
|
10,66
|
9,20
|
11,88
|
10,42
|
6,75
|
6,02
|
3,86
|
|
A2017
|
10,59
|
9,75
|
7,91
|
11,01
|
10,35
|
9,48
|
6,04
|
4,34
|
6,23
|
|
H2018
|
10,22
|
9,12
|
8,32
|
8,08
|
6,62
|
7,36
|
3,35
|
3,44
|
4,11
|
|
P2018
|
11,30
|
11,01
|
7,92
|
9,45
|
7,94
|
8,89
|
8,70
|
7,54
|
6,92
|
|
E2018
|
12,89
|
13,12
|
10,05
|
11,06
|
11,21
|
11,88
|
8,53
|
7,70
|
5,18
|
|
A2018
|
12,08
|
11,55
|
10,02
|
12,35
|
11,20
|
10,62
|
6,59
|
5,57
|
3,86
|
|
H2019
|
9,54
|
7,56
|
7,05
|
7,26
|
5,78
|
8,03
|
2,90
|
3,56
|
3,48
|
|
P2019
|
11,99
|
11,63
|
8,24
|
9,09
|
8,35
|
9,29
|
8,08
|
7,45
|
6,76
|
|
E2019
|
13,14
|
12,89
|
9,88
|
10,45
|
11,04
|
10,86
|
8,24
|
7,27
|
4,97
|
MCBI : milieu cultivé Ben Isguen ;
MCGH : milieu cultivé Ghardaïa ; MCEA
: milieu cultivé El Atteuf ; PABI : palmeraie
Ben Isguen ; PAGH : palmeraie Ghardaïa ; PAEA
: palmeraie El Atteuf ; MNBI : milieu naturel Ben
Isguen ; MNGH : milieu naturel Ghardaïa ; MNEA
: milieu naturel El Atteuf ; A : Automne ; H
: Hiver ; P : Printemps ; E :
Eté
61
Résultats et Discussions
La valeur de l'inverse de l'indice de Simpson variait de 3,21
à 13,14, Cet indice enregistre le minimum en Hiver et le maximum en
Eté.
La valeur de l'inverse de l'indice de Simpson commence par 1
comme le plus petit nombre possible. Ce cas représenterait une
communauté qui ne contient qu'une seule espèce. Plus la valeur
est élevée, plus la diversité est grande. La valeur
maximale est le nombre d'espèces dans l'échantillon. On constate
que cet indice augmente à partir de Printemps pour atteindre son maximum
Eté et Automne. Le milieu cultivé Ben Isguen enregistre une
valeur maximale de 13,14 durant l'Eté 2019. Cette valeur
représente le nombre d'espèces dominantes dans ce biotope pendant
cette période. Bien que cet habitat renferme 24 espèces,
l'inverse de l'indice de Simpson n'a pas pris en considération 11
espèces d'Acridiens. Les plus faibles valeurs de l'inverse de l'indice
de Simpson sont marquées en Hiver. Cela est du au faite durant la saison
hivernal la richesse spécifique est faible dans les différents
habitats. De plus l'inverse de l'indice de Simpson donne plus de poids aux
espèces abondantes. L'inverse de l'indice de Simpson permet de faire
varier l'indice dans le même sens que la diversité : plus la
diversité spécifique est élevée plus l'indice est
fort. Par exemple : s'il y a 24 espèces dans un site, la valeur maximale
de l'inverse de l'indice de Simpson est de (24). Un habitat dominé par
plusieurs espèces est considérée comme moins
diversifiée que celui dans le quel plusieurs espèces
différentes ont une abondance similaire. Le milieu naturel Ben Isguen
enregistre la plus faible valeur de l'inverse de l'indice de Simpson durant
l'Hiver 2017. Aucune différence significative de la variation
saisonnière sur l'inverse de l'indice de Simpson des Orthoptères
dans les trois palmeraies n'a été trouvée (Test de
Kruskal-Wallis, p-value = 0,057). La même chose était vraie pour
la variation saisonnière de l'indice de Simpson des milieux naturels
(Test de Kruskal-Wallis, p-value = 0,14). Quant à la variation
saisonnière l'inverse de l'indice de Simpson des Orthoptères dans
les trois milieux cultivés était significativement
différente (test de Kruskal-Wallis, p-value = 0,0024). Le nombre
d'espèces des Orthoptères augmentent à partir du Printemps
jusqu'à l'Automne, pour diminuer ensuite pendant l'Hiver. Ceci est
cohérent avec les observations faites par Zergoun (1991,1994)
et Babaz (1992) dans la région de
Ghardaïa.
III.7. Analyse factorielle des
correspondances
Nous avons cherché à savoir comment se
distribuaient les différentes espèces d'Orthoptères au
sein des neuf stations de la Vallée du M'Zab. La matrice des
données (9 stations x 47 espèces) a été soumise
à une Analyse Factorielle des Correspondances (AFC),
62
Résultats et Discussions
suivie d'une classification ascendante hiérarchique (CAH).
Chaque étiquette est composée des 2 premières lettres du
nom générique accolées aux 2 premières du nom
spécifique.
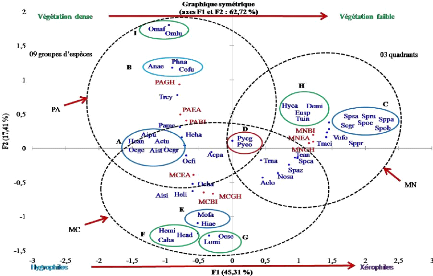
Figure 14. Représentation des
espèces et des stations dans le plan F1-F2 de l'AFC
Les deux premiers axes F1 et F2 de l'AFC englobent 62,72% de
la variance totale du nuage de points avec des contributions partielles
respectives de 45.31% et 17.41%. Ce taux étant supérieur à
50%, de ce fait l'exploitation des résultats par l'analyse factorielle
des correspondances (A.F.C) peut se faire uniquement avec l'axe1 et 2. La
représentation graphique de l'analyse factorielle des correspondances
(Figure 14) montre une répartition des stations dans trois quadrants
différents, les trois stations palmeraies (palmeraie Ben Isguen,
palmeraie Ghardaïa et palmeraie El Atteuf) dans le premier quadrant, le
deuxième quadrant occupé par les trois stations milieux
cultivés (milieu cultivé Ben Isguen, milieu cultivé
Ghardaïa et milieu cultivé El Atteuf) alors que le troisième
quadrant rassemble les trois stations milieux naturels (milieu naturel Ben
Isguen, milieu naturel Ghardaïa et milieux naturel El Atteuf).
Si nous considérons l'ensemble des espèces
d'Orthoptères sur le plan défini par l'axe 1 et 2, nous
constatons l'existence de neuf groupes d'espèces : Le groupe (A)
comprend les espèces présentes en commun dans les milieux
cultivés et palmeraies : Ochrilidia geniculata (Ocge),
Ochrilidia gracilis (Ocgr), Aiolopus strepens (Aist),
Acrida turrita (Actu), et Heteracris
63
Résultats et Discussions
annulosa (Hean). Le groupe (B) contient des
espèces présentes uniquement sur les trois sites de collecte
palmeraies : Anacridium aegyptium (Anae), Conocephalus fuscus
(Cofu) et Phaneroptera nana (Phna). Le groupe (C) regroupe les
espèces communes aux trois sites de collecte milieu naturel, c'est le
cas de Schistocerca gregaria (Scgr), Sphingonotus obscuratus
lameerei (Spob), Sphingonotus rubescens (Spru), Sphingonotus
pachecoi (Sppa), Sphingonotus savignyi (Spsa) et Sphingonotus
octofasciatus (Spoc). Le groupe (D) représente les espèces
communes aux neuf stations d'études. Ces espèces peuvent
fréquenter différents biotopes. C'est le cas de Pyrgomorpha
cognata (Pycg) et Pyrgomorpha conica (Pyco). Le groupe (E) est
composé de deux espèces : Morphacris fasciata (Mofa) et
Hilethera aeolopoides (Hiae). Le groupe (F) regroupe les
espèces présentes uniquement dans le milieu cultivé Ben
Isguen : Calliptamus barbarus (Caba), Heteracris adspersa
(Head) et Heteracris minuta (Hemi). Le groupe (G) est
composé de Locusta migratoria (Lomi) et Oedaleus
senegalensis (Oese). Ces espèces sont présentes uniquement
dans le milieu cultivé Ghardaïa. Le groupe (H) est composé
d'espèces qui caractérisent uniquement le milieu naturel Ben
Isguen. Ces Acridiens sont : Tuarega insignis (Tuin), Dericorys
millierei (Demi), Hyalorrhipis calcarata (Hyca) et Eunapiodes
sp (Eusp). Le groupe (I) représente les espèces
rencontrées uniquement dans la palmeraie Ghardaïa. Ces
Caelifères sont : Omocestus africanus (Omaf) et Omocestus
lucasii (Omlu).
L'axe F1 ordonne apparemment les espèces selon leurs
affinités écologiques. La position de chaque espèce sur
cet axe exprime son degré vis-à-vis d'un ensemble de facteurs
écologiques tels que l'humidité, la luminosité et le
couvert végétal. En effet, les espèces qui
préfèrent l'humidité vivent dans des zones moins
ensoleillées et dans des parcelles recouvertes d'herbes denses et sont
situées du côté négatif de l'axe 1, telles que
Phaneroptera nana, Conocephalus fuscus, Paratettix
meridionalis, Heteracris adspersa et les espèces du genre
Ochrilidia. Du côté positif de l'axe 1, on trouve des
espèces xérophiles qui préfèrent vivre dans des
endroits secs. Ces lieux sont caractérisés par une
végétation très dispersée et un rayonnement solaire
très important. Parmi les espèces qui préfèrent ces
conditions on cite entre autres : Sphingonotus rubescens,
Sphingonotus pachecoi et Sphingonotus obscuratus lameerei.
Les différents gradients, qui sont le gradient d'humidité, le
gradient de luminosité et le gradient de végétation
varient de gauche à droite : de l'environnement le plus humide, à
végétation plus dense et le moins ensoleillée, vers le
milieu le plus sec, la végétation moins dense et plus
ensoleillée. Ould El Hadj (1991) indique la
présence d'Heteracris adspersa dans des environnements secs. En
revanche, Zergoun (1994) a signalé que cette
espèce est présente dans des zones plus humides. Près de
l'origine se trouve un groupe d'espèces
64
Résultats et Discussions
relativement indifférentes aux facteurs
d'humidité, d'ensoleillement et de couverture végétale.
C'est le cas de Pyrgomorpha cognata, Pyrgomorpha conica et
Acrotylus patruelis. Sur les axes F1 et F2, les espèces sont
réparties en fonction de leur présence dans les environnements
d'étude. Sur la partie positive de l'axe F2, on trouve les
espèces du genre Sphingonotus qui fréquentent les sites
de collecte des milieux naturels. Sur la partie négative de l'axe F2, on
trouve les espèces des milieux cultivés et palmeraies. Ainsi,
l'importance de la composition floristique des milieux, l'intensité des
travaux agricoles et le mode d'irrigation sont des facteurs très
importants dans la répartition des criquets dans différents
biotopes. Le milieu cultivé d'El-Atteuf, qui a connu une forte
activité agricole lors de notre échantillonnage, est moins riche
que les deux autres milieux cultivés. Le désherbage a
détruit une grande partie des plantes spontanées telles que les
Poaceae. En fait, la couche herbacée contribue fortement à la
richesse en espèces de criquets. Ainsi, l'activité agricole a un
impact négatif sur les criquets. En revanche, certaines espèces
telles que les Oedipodinae, généralement abondantes sur un sol
nu, peuvent être favorisées dans cette zone. L'irrigation par
aspersion a un effet négatif sur la richesse en criquets. Sachant que la
plupart des criquets préfèrent les endroits chauds et
ensoleillés, ce type d'irrigation créera un environnement humide
et, par conséquent, exclura de nombreuses espèces qui
rechercheront des environnements plus secs.
III.8. Classification hiérarchique
ascendante
En guise de synthèse, nous avons réalisé
une classification hiérarchique ascendante basée sur la
similitude de Sorensen des 9 peuplements étudiés en se basant
seulement sur la présence/absence des espèces dans les
différents biotopes (Figure 15). Le dendrogramme de similarité
est divisé en 2 groupes : Un 1er groupe est formé par
MNBI, MNGH et MNEA. Ce sont les milieux naturels (lits d'oueds)
caractérisés par un faible taux de recouvrement
végétal. Cette dernière est installée sur un sol
rocailleux avec quelques endroits sablonneux. Ces biotopes abritent une
Acridofaune thermophile telle que Tuarega insignis, Sphingonotus
rubescens, Sphingonotus obscuratus lameerei, Sphingonotus
savignyi, Sphingonotus paradoxus, etc. Les milieux naturels
forment une association homogène qui ne peut pas être
divisé en sous-groupes.
Le 2ème groupe est formé par
l'Acridofaune des milieux cultivés et palmeraies notamment, MCBI, MCGH,
MCEA, PABI, PAGH, et PAEA. Ces habitats présentent un recouvrement
végétal assez important par apport aux milieux naturels, une
irrigation plus au moins fréquente et le sol est sablonneux-limoneux
végétation assez caractérisés par la
présence des espèces arboricoles.
65
Résultats et Discussions

Similarité
Figure 15. Dendrogramme de similarité
entre les neuf peuplements Orthoptérologique
Ces biotopes abritent des Orthoptères phytophiles telle
que Ochrilidia gracilis et géophiles telles que Acrotylus
patruelis. Ce groupement est ensuite scindé en 2 sous groupes, l'un
est composé par les milieux cultivé (MCBI, MCGH, et MCEA) et
l'autre par les palmeraies (PABI, PAGH et PAEA). Les milieux cultivés
sont caractérisé par une végétation moins dense,
mais plus riche en espèces herbacées. Ces biotopes abritent les
Acridiens mésohygrophiles, c'est le cas de la plupart des
Caelifères tels qu'Aiolopus strepens, Acrida turrita,
Heteracris annulosa, Morphacris fasciata, Acrotylus
patruelis, Pyrgomorpha cognata, etc. Les palmeraies
présentent une végétation un peu dense par apport aux
milieux cultivés, moins de plantes herbacées, et strate
arboricole plus importantes. Toutes ces caractéristiques vont
crée un microclimat humide qui favorise les Orthoptères
hygrophiles telles que Phaneroptera nana, Conocephalus
fuscus, Paratettix meridionalis, Omocestus africanus,
Omocestus lucasii et l'espèce arboricole Anacridium
aegyptium.
III.9. Cycle biologique des principales espèces
Acridiennes de la vallée du M'Zab
Les stades de développement des criquets comprennent
l'oeuf, la larve et l'adulte. Chaque individu progresse à travers ces
étapes dans l'ordre présenté, mais la durée de
chaque étape et la période de l'année où se produit
une étape donnée varie selon les espèces (Capinera
& Sechrist, 1982). Plus une espèce est abondante par ses
effectifs et sa durée de présence, plus les conclusions
concernant son cycle biologique seront précises.
66
Résultats et Discussions
Nous rapportons ici les résultats d'une étude
d'un an sur la phénologie de 26 espèces d'Orthoptères
(Caelifères) communes de la vallée du M'Zab. Les
échantillonnages ont été réalisés une fois
par mois, pour la période s'étalant de janvier à
décembre 2018. Les données mensuelles sont établies
d'après la moyenne des relevés quantitatifs obtenus sans
distinction de milieu ce qui tend peut-être à étaler les
cycles ; mais les valeurs de densités obtenues, vont données un
approche mieux discutable. Pour chaque espèce étudiée, un
graphe est construit, il porte sur les densités larvaires et imaginales
reportées à 100 m2 et indique leur évolution
selon chaque mois de l'année. Les espèces rares présentes
dans les différents biotopes ne sont pas prises en considération,
car toutes les espèces évoquées dans l'étude du
cycle biologique avaient fait l'objet de présence à l'état
larvaire et imaginal durant leurs cycles de vie. Trois espèces n'ont
été vues qu'une ou deux fois dans les biotopes : Eunapiodes
sp., Calliptamus barbarus et Oedaleus senegalensis.
Selon Monard (1986), la présence de ces espèces
peut s'expliquer par la nature des biotopes adjacents, ou par leur
mobilité. Il ya aussi le cas des espèces observées
uniquement à l'état imaginal, aucune larve n'a été
observée ; C'est le cas d'Anacridium aegyptium, Locusta
migratoria, Schistocerca gregaria, Hyalorrhipis
calcarata, Sphingonotus obscuratus lameerei, Sphingonotus
octofasciatus, Sphingonotus pachecoi, Vosseleriana
fonti, Dericorys millierei, Omocestus africanus,
Omocestus lucasii, Ochrilidia filicornis, Heteracris
adspersa, Heteracris minuta, Tropidopola cylindrica et
Paratettix meridionalis. L'observation des criquets uniquement
à l'état imaginal est dû d'après Monard
(1986), à deux éventualités possibles : les oeufs
sont déposés en dehors de la zone prospectée et seuls les
imagos évoluent dans le biotope, le reste du cycle biologique
s'effectuant dans des milieux adjacents ; le comportement des larves
diffère énormément de celui des imagos et elles
passeraient totalement inaperçues. Les résultats obtenus peuvent
être présentés en fonction du nombre de
générations et le type d'arrêt de développement
(Gillon, 1974 ; Lecoq, 1978 ; Squitier & Capinera, 2002 ;
Bounechada et al., 2006 ; Moussi, 2012). Les photos des
spécimens d'Acridiens utilisées dans cette partie proviennent de
la collection du muséum de Paris (Louveaux et al.,
2019).
III.9.1. Espèces à une seule
génération annuelle
Une génération acridienne correspond à la
succession des états qui relie un oeuf de la génération
parentale à un oeuf de la génération fille (Lecoq,
2010). Plus de tiers (38.46%) des d'espèces de
Caelifères dont le type de cycle a pu être établi ont une
génération annuelle. D'après nos observations sur le
terrain et les courbes des fluctuations de densité des imagos et
67
Résultats et Discussions
des larves des Orthoptères étudiés, on
peut diviser ces espèces univoltines en trois catégories : les
espèces Printanières, les espèces Estivales et les
espèces de l'Eté-Automne.
III.9.1.1. Espèces
Printanières
Les espèces qui caractérise cette
catégorie sont Notopleura saharica, Tenuitarsus
angustus, Tmethis cisti et Tuarega insignis (Figure 16).
Le pic de la densité des larves a été enregistré en
février pour Notopleura saharica, Tenuitarsus
angustus, et Tmethis cisti ; et en mars pour Tuarega
insignis. Les premiers adultes ont été capturés entre
février et juin pour ces insectes. On a observé un accouplement
de Notopleura saharica en fin juin. Les premières
éclosions auront lieu probablement avec les premières pluies de
l'automne ; cela s'explique par l'enregistrement de larves à partir
d'octobre pour Notopleura saharica. Ces Acrididae passent
l'hiver en diapause larvaire. Ces résultats sont en accord avec ceux de
Moussi (2012) dans la région de Biskra. La même
observation a été réalisée pour Tmethis cisti
dans la région de Djelfa par Khadraoui & Ouanouki
(2001).
III.9.1.2. Espèces Estivales
De juin à septembre les fluctuations de la
densité imaginale de Sphingoderus carinatus, Sphingonotus
azurescens, Sphingonotus savignyi et Sphingonotus paradoxus
sont importantes. On note des pics de densité des adultes durant
l'Eté chez les quatre Oedipodinae. Pour chaque Acridien la
densité des larves augmente brutalement en mai et redescend.
Probablement l'éclosion s'effectue au mois d'avril et
les premiers imagos s'observent à partir du mois de juin à
juillet. La densité des adultes ces espèces décroît
à partir de septembre et s'annule en Hiver (Figure 17).
Cet ensemble de faits nos amènent à noter que
Sphingoderus carinatus, Sphingonotus azurescens,
Sphingonotus savignyi et Sphingonotus paradoxus sont des
espèces d'Eté à une seule génération
annuelle et à diapause embryonnaire. Cette conclusion relative à
la phénologie de Sphingoderus carinatus et Sphingonotus
savignyi correspond aux observations réalisées par
Moussi (2012).
68
Résultats et Discussions
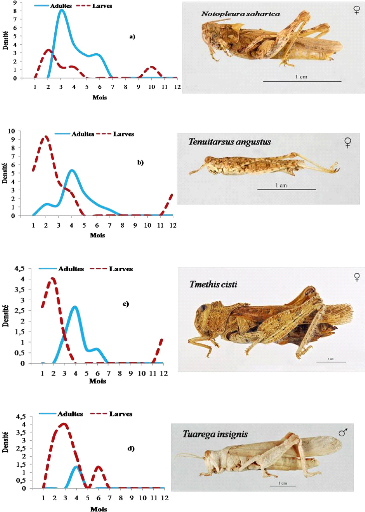
Figure 16. Evolution mensuelle des
densités larvaires et d'adultes pour les espèces
Printanières :
a) Notopleura saharica,
b) Tenuitarsus angustus, c)
Tmethis cisti
et d) Tuarega insignis de
la vallée du M'Zab
69
Résultats et Discussions
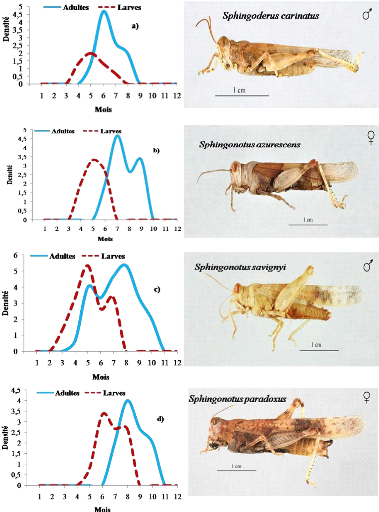
Figure 17. Evolution mensuelle des
densités larvaires et d'adultes pour les espèces Estivales
:
a) Sphingoderus carinatus, b)
Sphingonotus azurescens, c) Sphingonotus
savignyi
et d) Sphingonotus paradoxus de la
vallée du M'Zab.
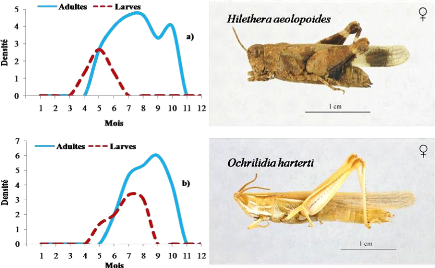
70
Résultats et Discussions
III.9.1.3. Espèces de
l'Eté-Automne
La densité imaginale d'Hilethera aeolopoides
augmente rapidement pour atteindre son maximum vers juillet et août
; elle décroit ensuite pour s'annuler vers novembre (Figure 18). La
durée de présence larvaire de cet Oedipodinae est courte, puisque
les larves sont observées uniquement d'avril à juin. La
densité des larves atteint son pic vers mai. Cette conclusion relative
aux périodes d'Hilethera aeolopoides ne correspond pas aux
observations réalisées par Moussi (2012). Cet
auteur indique en effet qu'Hilethera aeolopoides présente trois
générations par an dans la région de Biskra. Il note que
les adultes et les larves de cet Orthoptère sont présents
pratiquement toute l'année.
Figure 18. Evolution mensuelle des
densités larvaires et d'adultes pour les espèces de
l'Eté-
Automne : a) Hilethera aeolopoides,
b) Ochrilidia harterti de la vallée du
M'Zab.
Les premiers imagos, identifiés comme appartenant
à l'espèce Ochrilidia harterti, apparaissent le mois de
juin ; pour atteindre un pic de densité des imagos vers septembre. Le
développement larvaire de cette espèce dure de mai à
août. Les éclosions des oeufs de ces deux Caelifères ont
lieu donc beaucoup plus tard que dans la majorité des cas. On peut
penser qu'Hilethera aeolopoides et Ochrilidia harterti
présentent une seule génération d'Eté-Automne
à diapause larvaire longue.
71
Résultats et Discussions
III.9.2. Espèces à deux
générations annuelles
Les espèces à deux générations
annuelles représentent (42.3%), soit 11 espèces de l'ensemble des
Orthoptères dont le cycle phénologique a été
étudié.
III.9.2.1. Espèces à deux
générations annuelles avec reproduction continue
Aiolopus puissanti, Aiolopus strepens et
Morphacris fasciata se caractérisent par la présence de
deux pics de densité larvaire et imaginale ; les adultes et les larves
de ces Acridiens ont été capturés toute au long de
l'année. (Figure 19).

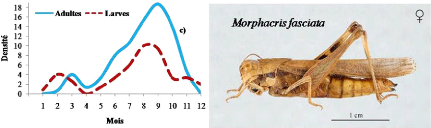
Figure 19. Evolution mensuelle des
densités larvaires et d'adultes pour les espèces à
deux
générations annuelles avec reproduction continue :
a) Aiolopus puissanti, b)
Aiolopus
strepens et c) Morphacris
fasciata de la vallée du M'Zab.
72
Résultats et Discussions
L'étude de l'évolution de la densité des
larves et des adultes des populations d'Aiolopus puissanti,
Aiolopus strepens et Morphacris fasciata montre que ces trois
Oedipodinae sont bivoltines. La reproduction de ces Caelifères semble
continue.
D'après les travaux de Hamdi (1989)
dans la région médio-septentrionale de l'Algérie,
de Benrima (1990) dans la région de Koléa de
Guecioueur (1990) dans la région de Lakhdaria, de
Fellaouine (1989) dans la région de Sétif de
Zergoun (1991,1994) et de Douadi (1992) dans
la région de Ghardaïa ; Aiolopus strepens est
présente à l'état adulte pendant presque toute
l'année. Les larves quant à elles commencent a apparaître
au mois d'avril. Ces auteurs notent que Aiolopus strepens
présente une seule génération annuelle et passe
l`hiver à l'état imaginal. Dans la zone soudanienne de la
région de Saria, Burkina Faso ; Morphacris fasciata
présente une reproduction continue, avec trois
générations par an (Lecoq, 1978).
III.9.2.2. Espèces à deux
générations annuelles à hivernation larvaire
Les courbes d'évolution des densités imaginales
et larvaires d'Acrotylus longipes, Aiolopus simulatrix,
Heteracris annulosus, Heteracris littoralis, Heteracris
harterti et Truxalis nasuta présentent deux maximums au
cours de l'année (Figure 20).
Les six Orthoptères continuent cependant à
être épisodiquement capturés à l'état
larvaire au cours de la période hivernale. On peut penser que ces
Acrididae présentent deux générations par an,
avec une diapause larvaire pendant l'hiver.
C'est effectivement ce qu'observe Moussi (2012)
à Biskra pour Acrotylus longipes, Heteracris
annulosus et Truxalis nasuta.
A Sétif comme à Lakhdaria, Truxalis nasuta
présente une seule génération annuelle
(Fellaouine, 1989 ; Guecioueur. 1990). Dans la région
de Ghardaïa, selon Zergoun (1991) et Babaz
(1992), Truxalis nasuta est univoltine avec une diapause
larvaire automno-hivernale.
73
Résultats et Discussions

74
Résultats et Discussions

Figure 20. Evolution mensuelle des
densités larvaires et d'adultes pour les espèces à
deux
générations annuelles à hivernation larvaire :
a) Acrotylus longipes, b)
Aiolopus simulatrix, c)
Heteracris
annulosus, d) Heteracris littoralis,
e) Heteracris harterti
et f)
Truxalis nasuta de la vallée du M'Zab.
III.9.2.3. Espèces à deux
générations annuelles à hivernation
embryonnaire
Les densités larvaires sont maximales pendant avril et
août pour Sphingonotus rubescens. Cet Oedipodinae apparaît
sous forme d'imagos à partir de mai jusqu'à décembre. Il
semble que la deuxième génération de cet Acridien
dépose leurs oeufs dans le sol vers la fin d'Automne. Les
densités larvaires et imaginales d'Ochrilidia geniculata
présentent deux pics. Les densités larvaires et imaginales
de Sphingonotus rubescens et Ochrilidia geniculata s'annulent
en hiver (Figure 21). Les observations du cycle de Sphingonotus rubescens
et Ochrilidia geniculata dans la vallée du M'Zab montre
que ces criquets présentent deux générations par an et
passent l'hiver en diapause embryonnaire. Nos résultats sont en accord
avec ceux de Moussi (2012). A Sétif
(Fellaouine, 1989) et à Ghardaïa (Babaz,
1992) notent que Sphingonotus rubescens présente une
seule génération par an avec une diapause embryonnaire
automno-hivernale. Zergoun (1991,1994), montre que cet
Oedipodinae présente une seule génération annuelle et
hiverne à l'état embryonnaire.
75
Résultats et Discussions
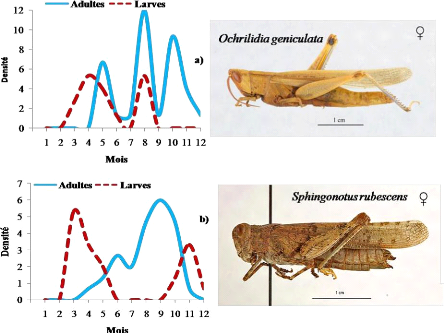
Figure 21. Evolution mensuelle des
densités larvaires et d'adultes pour les espèces à deux
générations annuelle à hivernation embryonnaire :
a) Ochrilidia geniculata et b)
Sphingonotus rubescens, de la vallée du M'Zab.
III.9.3. Espèces à trois
générations annuelles
A part Acrida turrita, les effectifs d'Acrotylus
patruelis, Pyrgomorpha cognata, Pyrgomorpha conica et
Ochrilidia gracilis sont élevés ; elles constituent
alors une part importante du peuplement de la vallée du M'Zab. On
observe chez ces cinq Orthoptères trois pics de densités durant
l'année, aussi bien pour les larves que pour les imagos (Figure 22). Le
résultat obtenu semble bien confirmer l'existence de trois
générations par an chez ces cinq Acrididae. En zone sahélo
soudanienne, Acrotylus patruelis présente trois
génération par an complétée par une diapause
imaginale en saison sèche (Launois et al.,
1996). Ould-El-Hadj (2004) à Ouargla et
Moussi (2012) à Biskra confirment nos résultats
de Pyrgomorpha cognata et Pyrgomorpha conica. Les
résultats de Guendouz-Benrima et al., (2011)
dans la plaine de Mitidja et ceux de Moussi à Biskra sont en
accord avec nos observations pour trois générations par an chez
Acrida turrita. De même pour Acrotylus patruelis
(Ould El Hadj, 2004 ; Guendouz-Benrima et al., 2011 ;
Moussi, 2012) soutiennent notre hypothèse.
76
Résultats et Discussions

Figure 22. Evolution mensuelle des
densités larvaires et d'adultes pour les espèces à trois
générations annuelles : a) Acrotylus
patruelis, b) Acrida turrita,
c) Pyrgomorpha cognata, d)
Pyrgomorpha conica et e) Ochrilidia gracilis
de la vallée du M'Zab.
77
Résultats et Discussions
Par contre chez Ochrilidia gracilis, Zergoun
(1991) et Babaz (1992), notent que dans la
région de Ghardaïa, les adultes de ce Gomphocerinae sont
présents Jusqu'en novembre puis ils disparaissent durant l'hiver, pour
réapparaître à nouveau au printemps. Selon ces auteurs
l'espèce hiverne à l'état larvaire et possède une
génération annuelle.
III.10. Etude qualitative et quantitative du
régime alimentaire des principales espèces Acridiennes de la
vallée du M'Zab.
La quantité et la qualité de l'alimentation
influencent considérablement les caractéristiques de croissance
des populations acridiennes. La natalité, la mortalité et
à la limite la dispersion, en sont effectuées (Duranton
et al., 1982). Les insectes qui se nourrissent sur une ou
quelques plantes étroitement apparentées sont appelées
monophages. Les insectes oligophages se nourrissent d'un certain nombre
d'espèces végétales, toutes appartenant à
même famille de plantes. Les insectes polyphage semblent exercer peu de
choix et accepter beaucoup de plantes appartenant à différentes
familles (Schoonhoven et al., 2005). Environ 60% de
toutes les espèces d'Acridiens connues sont polyphages et 25% sont
graminivores, mais peu d'espèces sont classés comme monophages
(Picaud et al., 2003). D'après Le Gall
(1989), l'herbivore monophage ne consomme qu'une seule espèce
végétale, voire quelques espèces très proches d'un
même genre. Les espèces oligophages sont celles dont le spectre
trophique est limité à un genre ou à une famille
végétale donnée. Le polyphage est un acridien dont le
régime concerne différentes espèces issues de plusieurs
familles végétales.
Les objectifs assignés à cette étude sont
d'une part de combler le manque d'études relatives aux régimes
alimentaires de ces Acridiens dans notre région d'étude, et
d'autre part, de vérifier est ce que l'abondance de ces
Caelifères dans les milieux cultivés causera des
dégâts aux cultures, ou s'attaquants uniquement aux plantes
adventices.
Nous allons étudier le régime alimentaire de
sept espèces acridiennes abondantes dans le milieu cultivé
à savoir : Aiolopus strepens (Latreille, 1804), Acrotylus
patruelis (Herrich-Schäffer, 1838), Morphacris fasciata
(Thunberg, 1815), Acrida turrita (Linnaeus, 1758), Heteracris
annulosa Walker, 1870, Ochrilidia gracilis (Krauss, 1902) et
Pyrgomorpha cognata Krauss (1877). L'ensemble des ces espèces
sont récoltées dans le milieu cultivé (Touzouz) entre 2017
et 2018, durant les mois allant de mai à octobre. Pour chacune de ces
espèces acridiennes nous avons choisi 25 mâles et 25 femelles,
soit un total de 350 individus. L'étude du régime alimentaire des
principales Acridiens a été faite en se basant sur l'analyse
comparative d'une épidermothèque de référence des
espèces végétales présentent dans le
78
Résultats et Discussions
milieu cultivé avec celles trouvées dans les
fèces des différents Caelifères. La détermination
du régime alimentaire, par la méthode de l'analyse microscopique
du contenu des fèces est la plus objective par rapport à l'examen
des contenus du tube digestif du faite qu'elle ne perturbe pas
l'équilibre démographique des populations.
Une étude qualitative du régime alimentaire des
principales espèces Acridiennes a été
réalisée selon la méthode classique des fréquences,
et complétée par une estimation quantitative des plantes
ingérées par la méthode dite de la « fenêtre
». Sur la base de celle-ci, un indice d'attraction pour chaque
espèce végétale a été calculé
à partir des surfaces foliaires ingérées par chaque
individu.
III.10.1. Etude qualitative de la consommation chez
les imagos des principales espèces Acridiennes dans le milieu
cultivé (Touzouz).
Pour exprimer les résultats d'analyses des
espèces végétales présentes dans les fèces
nous avons calculé la fréquence relative proposée par
Le Gall & Gillon (1989). C'est le rapport entre le nombre
de fois où des fragments d'une espèce végétal sont
observés dans les fèces de l'espèce Acridienne sur le
nombre total des fragments végétaux toutes espèces
confondus observés dans les fèces de l'espèce
d'Orthoptère considérée. Le calcul des fréquences
relatives des épidermes des espèces végétales
observés dans les fèces des sept Orthoptères sont
consignés dans le Tableau 26 ci-dessous.
L'analyse des fèces de 350 individus de sept
espèces de Caelifères : Acrotylus patruelis,
Ochrilidia gracilis, Aiolopus strepens, Pyrgomorpha
cognata, Heteracris annulosa, Acrida turrita et
Morphacris fasciata, montre que ces espèces consomment 22
espèces végétales parmi les 30 présentes dans la
station d'étude, ce qui représente un taux d'exploitation de la
niche trophique de 73,3 % (Photos 4).
Cependant, l'analyse de leur spectre alimentaire, montre que
sur les 30 espèces présentes dans leur habitat, sept n'ont pas
été ingérées par ces Acrididae. Les
Orthoptères analysés ont consommés 12 familles de plantes
sur les 15 présentes dans le biotope, soit 80 %. Les Poaceae sont les
mieux représentées avec huit plantes, soit 34,8. Sur les 22
plantes consommées, il n'existe pas de différence notable entre
mâles est femelles pour la fréquence des espèces
végétales dans les fèces des sept Acridiens
étudiés. Les seules différences sont notées chez
Acrotylus patruelis où les mâles n'ont pas
ingérés Tribulus terrestris et Rumex vesicarius
; de même les mâles de Morphacris fasciata n'ont pas
consommés Sonchus oleraceus et les femelles n'ont pas
utilisés Convolvulus arvensis.
79
Résultats et Discussions
Tableau 26. Fréquence (%) des
espèces végétales présentes dans les fèces
des sept espèces Acridiennes dans le milieu cultivé (Touzouz)
|
Espèces
|
ACP
|
OCG
|
AIS
|
PYC
|
HEA
|
ACT
|
MOF
|
|
Vitis vinifera
|
-
|
-
|
4,21
|
-
|
-
|
-
|
-
|
|
Lagenaria siceraria
|
-
|
-
|
-
|
16,74
|
22,61
|
-
|
-
|
|
Cucurbita maxima
|
-
|
-
|
-
|
17,6
|
11,56
|
-
|
-
|
|
Cucumis melo
|
-
|
-
|
-
|
-
|
9,04
|
-
|
-
|
|
Capsicum annuum
|
-
|
-
|
-
|
6,44
|
6,03
|
-
|
-
|
|
Solanum melongena
|
-
|
-
|
-
|
15,45
|
18,59
|
-
|
-
|
|
Solanum lycopersicum
|
-
|
-
|
-
|
16,31
|
13,06
|
-
|
-
|
|
Mentha pulegium
|
-
|
-
|
5,26
|
18,45
|
5,02
|
-
|
-
|
|
Cynodon dactylon
|
27,98
|
30,07
|
33,68
|
9,01
|
6,03
|
29,79
|
29,6
|
|
Setaria verticillata
|
20,83
|
22,88
|
14,74
|
-
|
8,04
|
26,24
|
22,37
|
|
Polypogon monspeliensis
|
13,09
|
16,34
|
11,58
|
-
|
-
|
16,31
|
21,05
|
|
Digitaria commutata
|
-
|
9,80
|
-
|
-
|
-
|
-
|
-
|
|
Anisantha sterilis
|
11,9
|
14,38
|
-
|
-
|
-
|
12,76
|
16,45
|
|
Hordeum murinum
|
-
|
6,54
|
-
|
-
|
-
|
-
|
-
|
|
Phragmites australis
|
-
|
-
|
10,53
|
-
|
-
|
14,89
|
-
|
|
Cyperus rotundus
|
8,93
|
-
|
13,68
|
-
|
-
|
-
|
-
|
|
Sonchus oleraceus
|
3,57
|
-
|
6,31
|
-
|
-
|
-
|
5,92
|
|
Convolvulus arvensis
|
-
|
-
|
-
|
-
|
-
|
-
|
4,61
|
|
Amaranthus hybridus
|
4,76
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Tribulus terrestris
|
1,78
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Rumex vesicarius
|
4,17
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Malva parviflora
|
2,98
|
-
|
-
|
-
|
-
|
-
|
-
|
|
22
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
ACP : Acrotylus patruelis ;
OCG : Ochrilidia gracilis ; AIS :
Aiolopus strepens ; PYC : Pyrgomorpha cognata
; HEA : Heteracris annulosa ;
ACT : Acrida turrita ; MOF : Morphacris
fasciata ; (-) : Espèce absente.
Dix plantes ont été consommées par
Acrotylus patruelis, soit 33,3 % des végétaux
présents dans le site d'étude. Les espèces les plus
consommées par cet Oedipodinae sont Cynodon dactylon, Setaria
verticillata et Polypogon monspeliensis. En deuxième
position on retrouve Heteracris annulosa avec neuf espèces
végétales consommées. Cet Orthoptère a
ingéré trois Cucurbitaceae, trois Solanaceae, deux
Poaceae et une Lamiaceae. La plante la plus préférée par
cet insecte est Lagenaria siceraria, avec une présence dans les
fèces de 22,6 %. Les Poaceae représentées par Setaria
verticillata (8 %) et Cynodon dactylon (6 %) sont faiblement
fréquentes dans les fèces de cet Acridien. Aiolopus strepens a
consommé huit plantes. Cynodon dactylon est la plus
ingérées par ce Caelifère, avec un taux de 33,7 %. Cet
insecte a fait l'exception de s'alimenter de Vitis vinifera, mais avec
une présence faible dans les fèces de 4,2 %. Pyrgomorpha
cognata a prélevée sept espèces
végétales. Mentha pulegium est la plus fréquente
dans les fèces de ce criquet. A part Cucumis melo et
Setaria verticillata qui n'ont pas été consommées
par cet Acridien, ce Pyrgomorphinae présente presque le même
spectre alimentaire qu'Heteracris annulosa. Six végétaux
ont été
80
Résultats et Discussions
consommés par Morphacris fasciata. Cet
Oedipodinae a ingéré quatre Poaceae, une Asteraceae et une
Convolvulaceae. L'espèce la plus fréquente dans les fèces
de cet insecte est Cynodon dactylon, avec un taux de 29,6 %. Parmi les
15 familles végétales présentent dans le biotope,
Ochrilidia gracilis a utilisé que les Poaceae. Les plantes
rencontrées dans les fèces de ce Gomphocerinae sont : Cynodon
dactylon (30,1 %), Setaria verticillata (22,9 %), Polypogon
monspeliensis (16,3 %), Anisantha sterilis (14,4 %),
Digitaria commutata (9,8 %) et Hordeum murinum (6,5 %).
Même cas pour Acrida turrita, où on note sa
préférence unique pour la famille des Poaceae. En effet cet
Acridinae a ingéré Cinq Poaceae qui sont : Cynodon
dactylon (29,8 %), Setaria verticillata (26,2 %), Polypogon
monspeliensis (16,3%), Phragmites australis (14,9 %) et
Anisantha sterilis (12,8 %).

Photos 4. Epidermes des principales
espèces végétales trouvées dans les fèces
des Acridiens
Cependant, l'analyse du spectre alimentaire de cinq
Acrididae de la cuvette d'Ouargla a montrée que sur les 28
espèces présentes dans leur habitat, 20 espèces
végétales ont été consommées par ces
sautériaux (Ould Elhadj, 2001). Les vingt deux plantes
ingérées par les sept Orthoptères se distribuent entre
huit Poaceae, trois Cucurbitaceae, trois Solanaceae, une
Vitaceae, une Cyperaceae, une Lamiaceae, une Asteraceae, une Convolvulaceae,
une Amaranthaceae, une Zygophyllaceae, une Polygonaceae et une Malvaceae. Les
Acridiens analysés ont utilisés au moins une Poaceae. Il
s'avère que sur les sept espèces Acridiennes
étudiées, trois espèces montrent une
préférence marquée pour les Poaceae c'est le cas de
Aiolopus strepens, Morphacris fasciata et Acrotylus
patruelis. Au vu de la fréquence des épidermes des
espèces végétales dans les fèces des sept
Caelifères, chaque espèce présente
81
Résultats et Discussions
une utilisation alimentaire caractérisée par le
choix des plantes ingérées. Acrotylus patruelis est
l'Acridien qui a ingéré plus d'espèces
végétales. En effet sur les 22 végétaux
consommés, cet Oedipodinae a utilisé 10 espèces
végétales. On peut qualifier cette espèce de Polyphage ou
d'insecte à régime alimentaire mixte. Ce criquet a
ingéré sept familles végétales différentes.
Malgré la polyphagie d'Acrotylus patruelis, ce dernier montre
une préférence marqué pour les graminées.
Zergoun (1994), dans la région de Béni Isguen
note qu'Acrotylus patruelis consomme 7 espèces
végétales parmi les 20 présentes dans la station
d'étude. Hamdi (1992), dans les dunes fixées du
littoral algérois signale qu'Acrotylus patruelis
présente le spectre alimentaire le plus restreint en espèces
végétales parmi les acridiens étudiés. Neufs
espèces végétales ont été consommées
par cet Oedipodinae, soit 15% de l'ensemble des espèces
inventoriées dans la station d'étude. Dans la cuvette d'Ouargla
Acrotylus patruelis a utilisé 14 végétaux sur 28
plantes de la station d'étude (Ould Elhadj, 2001). En
Afrique soudano-sahélienne, Acrotylus patruelis a
été signalée comme une espèce à
régime alimentaire mixte (Launois-Luong & Lecoq,
1989). Heteracris annulosa a consommé neuf plantes
appartenant à quatre familles végétales, avec une
préférence nette envers les Cucurbitaceae et Solanaceae. Cet
Eyprepocnemidinae présente un régime alimentaire mixte qu'on peut
qualifier de polyphage à tendance non graminivore. Aiolopus strepens
a préféré huit plantes dont cinq Poaceae, une
Vitaceae, une Cyperaceae et une Asteraceae. Malgré la polyphagie de cet
Oedipodinae, il présente une tendance vers la consommation des
graminées. Dans la région de Tlemcen, cet Acrididae a
consommé uniquement 6 espèces végétales sur 37
végétaux présents dans l'aire échantillonnée
(Medane, 2013). Pyrgomorpha cognata a
ingéré les mêmes espèces végétales
qu'Heteracris annulosa à l'exception de Setaria
verticillata et Cucumis melo. Ce Pyrgomorphinae est polyphage
avec une certaine préférence pour Mentha pulegium. Cet
Acridien a ingéré une seul Poaceae avec une faible
fréquence ce qui indique que cet insecte est non graminivore. Dans la
région d'Ouargla, Pyrgomorpha cognata a utilisé 42,9%,
des plantes de la station d'étude (Ould Elhadj, 2001).
Morphacris fasciata a consommée six plantes, dont quatre
Poaceae, une Asteraceae et une Convolvulaceae. Cet Oedipodinae présente
une très grande préférence pour les graminées. Ce
Caelifère présente un régime alimentaire polyphage avec
une tendance très marqués envers les graminées.
Ochrilidia gracilis a ingérée six Poaceae. Ce
Gomphocerinae a une préférence seulement pour les
graminées. A la lumière de ce résultat, on peut qualifier
cet Acridien d'oligophage. La même constatation est faite pour Acrida
turrita, cet Acridinae a consommée seulement quatre Poaceae.
Fahim (2011) note qu'au Maroc, Acrida turrita se
nourrit exclusivement des graminées. Ce résultat est en accord
avec celui obtenu par Benrima (1993)
82
Résultats et Discussions
dans la région de Mitidja. On distingue des Acridiens
phytophiles telles que Ochrilidia gracilis, Heteracris annulosa
et Pyrgomorpha cognata. D'autres espèces sont
géophiles c'est le cas d'Acrotylus patruelis, Morphacris
fasciata et un peu moins pour Aiolopus strepens et Acrida
turrita.
III.10.2. Etude quantitative de la consommation chez
les imagos des principales espèces Acridiennes dans le milieu
cultivé (Touzouz)
Nous parton de l'hypothèse que le recouvrement global
des espèces végétales présentes dans le transect
est le même à la même époque pour les deux
années d'étude, les quantités d'épidermes
végétaux rejetés dans les excréments sont
proportionnelles à celle ingérées, on admet aussi comme
hypothèse de travail que les coefficients de digestibilité des
différentes espèces végétales consommées
sont égaux et une espèce végétale est plus ou moins
consommée aussi bien par les mâles que par les femelles. De plus
chez les Orthoptères, la taille des femelles est supérieure
à celle des mâles, la biomasse végétale
consommée sera automatiquement proportionnelle à la taille des
individus.
III.10.2.1. Acrotylus patruelis
Les résultats l'étude quantitative de la
consommation chez les imagos d'Acrotylus patruelis sont
consignés dans le Tableau 27.
Il est à constater que Cynodon dactylon est
l'espèce végétale la plus consommée par apport aux
autres plantes. Elle présente un taux de consommation de 36,2 %. Cela
est dû probablement au taux de recouvrement élevé (4,9 %)
de cette graminée.
Tableau 27. Recouvrement global, surface
moyenne, taux de consommation et indice d'attraction des plantes
consommées par 50 individus d'Acrotylus patruelis en milieu
cultivé de Touzouz
|
Espèces
|
RG (%)
|
S (mm)
|
T (%)
|
IA
|
|
Cynodon dactylon
|
4,91
|
138,4
|
36,24
|
7,38
|
|
Setaria verticillata
|
3,43
|
98,2
|
25,71
|
7,49
|
|
Polypogon monspeliensis
|
1,08
|
48,6
|
12,73
|
11,78
|
|
Anisantha sterilis
|
0,29
|
35,5
|
9,30
|
32,07
|
|
Cyperus rotundus
|
0,39
|
22,4
|
5,86
|
15,02
|
|
Sonchus oleraceus
|
0,35
|
9,7
|
2,54
|
7,26
|
|
Amaranthus hybridus
|
0,34
|
11,3
|
2,96
|
8,7
|
|
Tribulus terrestris
|
0,31
|
3,5
|
0,92
|
2,97
|
|
Rumex vesicarius
|
0,49
|
6,8
|
1,78
|
3,63
|
|
Malva parviflora
|
0,21
|
7,5
|
1,96
|
9,33
|
|
Total = 10
|
11,8
|
381,9
|
100
|
105,63
|
RG : Recouvrement global ; S
: surface moyenne ; T : taux de consommation ;
IA : indice d'attraction
83
Résultats et Discussions
A part les Poaceae, toutes les autres familles notent un taux
de consommation faible. L'espèce végétale la moins
consommée est Tribulus terrestris (0,9 %). Sur les quatre
Poaceae consommées par cet Acridien, Cynodon dactylon
présente l'indice d'attraction le plus faible (7,4). En revanche
Anisantha sterilis présente l'indice d'attraction le plus
élevé (32,1), malgré son taux de consommation
réduit (9,3 %) et le faible taux de recouvrement (0,3) (Figure 23).
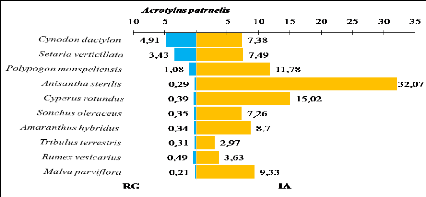
Figure 23. Comparaison entre les indices
d'attraction des espèces végétales ingérées
par
Acrotylus patruelis et leurs taux de recouvrement au niveau du
milieu cultivé Touzouz
III.10.2.2. Heteracris annulosa
Les résultats l'étude quantitative de la
consommation chez les imagos d'Heteracris annulosa sont
consignés dans le Tableau 28
Tableau 28. Recouvrement global, surface
moyenne, taux de consommation et indice d'attraction des plantes
consommées par 50 individus d'Heteracris annulosa en milieu
cultivé de Touzouz.
|
Espèces
|
RG (%)
|
S (mm)
|
T (%)
|
IA
|
|
Lagenaria siceraria
|
2,39
|
116,6
|
17,9
|
7,49
|
|
Cucurbita maxima
|
2,26
|
105,3
|
16,16
|
7,15
|
|
Cucumis melo
|
2,21
|
89,9
|
13,8
|
6,24
|
|
Capsicum annuum
|
2,54
|
53,4
|
8,2
|
3,23
|
|
Solanum melongena
|
2,26
|
107,2
|
16,45
|
7,28
|
|
Solanum lycopersicum
|
2,26
|
96,5
|
14,81
|
6,55
|
|
Mentha pulegium
|
2,51
|
29,3
|
4,5
|
1,79
|
|
Cynodon dactylon
|
4,91
|
25,7
|
3,94
|
0,8
|
|
Setaria verticillata
|
3,43
|
27,6
|
4,24
|
1,24
|
|
9
|
24,77
|
651,5
|
100
|
41,77
|
RG : Recouvrement global ; S :
surface moyenne ; T : taux de consommation ; IA
: indice d'attraction
Le taux de consommation chez Heteracris annulosa marque
une tendance pour Lagenaria siceraria (17,9 %), Solanum melongena
(16,45 %) et Cucurbita maxima (16,2 %).
84
Résultats et Discussions

Figure 24. Comparaison entre les indices
d'attraction des espèces végétales ingérées
par Heteracris annulosa et leurs taux de recouvrement au niveau du
milieu cultivé Touzouz. Ces plantes ont respectivement presque le
même taux de recouvrement 2,4, 2,3 et 2,3 et indice d'attraction 7,5,
7,1, et 7,3. Le taux de consommation le plus faible est noté chez
Cynodon dactylon (3,9), de même pour l'indice d'attraction (0,8)
(Figure 24).
III.10.2.3. Aiolopus strepens
Les résultats l'étude quantitative de la
consommation chez les imagos d'Aiolopus strepens sont consignés
dans le Tableau 29.
Tableau 29. Recouvrement global, surface
moyenne, taux de consommation et indice d'attraction des plantes
consommées par 50 individus de Aiolopus strepens en milieu
cultivé de Touzouz.
|
Espèces
|
RG(%)
|
S (mm)
|
T
|
IA
|
|
Vitis vinifera
|
4,24
|
9,12
|
2,3
|
0,54
|
|
Mentha pulegium
|
2,51
|
12,75
|
3,22
|
1,28
|
|
Cynodon dactylon
|
4,91
|
120,42
|
30,42
|
6,19
|
|
Setaria verticillata
|
3,43
|
87,04
|
21,99
|
6,41
|
|
Polypogon monspeliensis
|
1,08
|
77,15
|
19,49
|
18,05
|
|
Phragmites australis
|
0,78
|
44,63
|
11,27
|
14,49
|
|
Cyperus rotundus
|
0,39
|
34,25
|
8,65
|
22,18
|
|
Sonchus oleraceus
|
0,35
|
10,53
|
2,66
|
7,6
|
|
Total 8
|
17,69
|
395,89
|
100
|
76,74
|
RG : Recouvrement global ; S
: surface moyenne ; T : taux de consommation ;
IA : indice d'attraction
Aiolopus strepens présent le meilleur taux de
consommation pour trois Poaceae : Cynodon dactylon (30,4 %),
Setaria verticillata (22 %) et Polypogon monspeliensis (19,5
%). Le taux de consommation le plus faible est enregistré par Vitis
vinifera (2,3 %). Malgré leur taux de consommation important,
Cynodon dactylon et Setaria verticillata présentent
respectivement
85
Résultats et Discussions
un indice d'attraction faible (6,2) et (6,4) chez cet
Acridien. Le recouvrement végétal le plus important est
enregistré chez Cynodon dactylon (4,9 %) et Vitis vinifera
(4,2 %). Sonchus oleraceus note le recouvrement
végétal le plus faible (0,35 %). L'indice d'attraction le plus
fort est marqué chez Cyperus rotundus (22,2), malgré son
taux de consommation faible (8,65) (Figure 25).
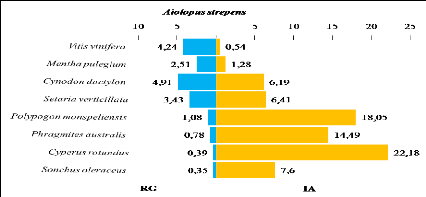
Figure 25. Comparaison entre les indices
d'attraction des espèces végétales ingérées
par Aiolopus strepens et leurs taux de recouvrement au niveau du
milieu cultivé Touzouz.
III.10.2.4. Pyrgomorpha cognata
Les résultats l'étude quantitative de la
consommation chez les imagos de Pyrgomorpha cognata sont
consignés dans le Tableau 30.
Tableau 30. Recouvrement global (RG), surface
moyenne (S), taux de consommation (T) et indice d'attraction (IA) des plantes
consommées par 50 individus de Pyrgomorpha cognata en milieu
cultivé de Touzouz
|
Espèces
|
RG (%)
|
S (mm)
|
T (%)
|
IA
|
|
Lagenaria siceraria
|
2,39
|
36,5
|
10,83
|
4,53
|
|
Cucurbita maxima
|
2,26
|
40,8
|
12,11
|
5,36
|
|
Capsicum annuum
|
2,54
|
11,5
|
3,41
|
1,34
|
|
Solanum melongena
|
2,26
|
43,6
|
12,94
|
5,73
|
|
Solanum lycopersicum
|
2,26
|
65,3
|
19,38
|
8,58
|
|
Mentha pulegium
|
2,51
|
90,5
|
26,86
|
10,70
|
|
Cynodon dactylon
|
4,91
|
48,7
|
14,46
|
2,95
|
|
7
|
19,13
|
336,9
|
100
|
39,18
|
RG : Recouvrement global ; S :
surface moyenne ; T : taux de consommation ; IA
: indice d'attraction Chez Pyrgomorpha cognata, le taux de
consommation et l'indice d'attraction sont respectivement important pour
Mentha pulegium (26,9 %) et (10,7) et Solanum lycopersicum
(19,4 %) et (8,6). La plus faible valeur du taux de consommation est
notée chez
86
Résultats et Discussions
Capsicum annuum (3,4 %), de même pour l'indice
d'attraction où on enregistre un chiffre de (1,3). Cynodon dactylon
marque un indice d'attraction consommée faible (2,95),
malgré son taux de recouvrement (4,9 %) important par apport aux autres
plantes (Figure26).

Figure 26. Comparaison entre les indices
d'attraction des espèces végétales ingérées
par Pyrgomorpha cognata et leurs taux de recouvrement au niveau du
milieu cultivé Touzouz.
III.10.2.5. Morphacris fasciata
Les résultats l'étude quantitative de la
consommation chez les imagos de Morphacris fasciata sont
consignés dans le Tableau 31.
Tableau 31. Recouvrement global, surface
moyenne, taux de consommation et indice d'attraction des plantes
consommées par 50 individus de Morphacris fasciata en milieu
cultivé de Touzouz.
|
Espèces
|
RG (%)
|
S (mm)
|
T (%)
|
IA
|
|
Cynodon dactylon
|
4,91
|
112,4
|
32,7
|
6,66
|
|
Setaria verticillata
|
3,43
|
87,5
|
25,46
|
7,42
|
|
Polypogon monspeliensis
|
1,08
|
65,7
|
19,11
|
17,69
|
|
Anisantha sterilis
|
0,29
|
47,2
|
13,73
|
47,34
|
|
Sonchus oleraceus
|
0,35
|
17,5
|
5,09
|
14,54
|
|
Convolvulus arvensis
|
0,28
|
13,4
|
3,9
|
13,93
|
|
6
|
10,34
|
343,7
|
100
|
107,58
|
RG : Recouvrement global ; S
: surface moyenne ; T : taux de consommation ;
IA : indice d'attraction Morphacris fasciata n'est
pas attirée par Cynodon dactylon (6,7) et Setaria
verticillata (7,4), mais leur taux de consommation respective (32,7 %) et
(25,5 %) est important. Anisantha sterilis marque l'indice
d'attraction le plus élevé (47,3), malgré son taux de
recouvrement faible (0,30 %). Les plantes les moins consommées sont
Sonchus oleraceus (5,1 %) et Convolvulus arvensis (3,9 %),
alors que leurs indice d'attraction est respectivement (14,5) et (13,9) le
double des espèces végétales les plus consommées
(Figure 27).
87
Résultats et Discussions

Figure 27. Comparaison entre les indices
d'attraction des espèces végétales ingérées
par Morphacris fasciata et leurs taux de recouvrement au niveau du
milieu cultivé Touzouz
III.10.2.6. Ochrilidia gracilis
Les résultats l'étude quantitative de la
consommation chez les imagos d'Ochrilidia gracilis sont
consignés dans le Tableau 32.
Tableau 32. Recouvrement global, surface
moyenne, taux de consommation et indice d'attraction des plantes
consommées par 50 individus d'Ochrilidia gracilis en milieu
cultivé de Touzouz.
|
Espèces
|
RG (%)
|
S (mm)
|
T (%)
|
IA
|
|
Cynodon dactylon
|
4,91
|
140,5
|
24,84
|
5,06
|
|
Setaria verticillata
|
3,43
|
117,3
|
20,74
|
6,05
|
|
Polypogon monspeliensis
|
1,08
|
98,5
|
17,42
|
16,13
|
|
Anisantha sterilis
|
0,29
|
78,3
|
13,84
|
47,72
|
|
Digitaria commutata
|
0,20
|
80,5
|
14,23
|
71,15
|
|
Hordeum murinum
|
0,39
|
50,5
|
8,93
|
22,90
|
|
6
|
10,3
|
565,6
|
100
|
169,01
|
RG : Recouvrement global ; S
: surface moyenne ; T : taux de consommation ;
IA : indice d'attraction Parmi les six Poaceae
consommées par Ochrilidia gracilis, on note un taux de
consommation élevé pour Cynodon dactylon (24,8 %) et
Setaria verticillata (20,7 %). Par contre l'indice d'attraction de ces
deux graminées est faible (5,1) et (6,05) et leurs taux de recouvrement
respective est plus élevé (4,9 %) et (3,4 %). Digitaria
commutata a un taux de recouvrement le plus faible parmi les
espèces végétales consommées par ce Gomphocerinae.
Cependant, cette graminée marque une valeur importante de (71,15) pour
l'indice d'attraction. Le faible taux de consommation est enregistré
chez Hordeum murinum (8,9 %) (Figure 28).
88
Résultats et Discussions

Figure 28. Comparaison entre les indices
d'attraction des espèces végétales ingérées
par Ochrilidia gracilis et leurs taux de recouvrement au niveau du
milieu cultivé Touzouz.
III.10.2.7. Acrida turrita
Les résultats l'étude quantitative de la
consommation chez les imagos de d'Acrida turrita sont consignés
dans le Tableau 33.
Tableau 33. Recouvrement global, surface
moyenne, taux de consommation et indice d'attraction des plantes
consommées par 50 individus d'Acrida turrita en milieu
cultivé de Touzouz.
|
Espèces
|
RG (%)
|
S (mm)
|
T (%)
|
IA
|
|
Cynodon dactylon
|
4,91
|
192,5
|
28,51
|
5,81
|
|
Setaria verticillata
|
3,43
|
168,6
|
24,97
|
7,28
|
|
Polypogon monspeliensis
|
1,08
|
112,5
|
16,66
|
15,43
|
|
Anisantha sterilis
|
0,29
|
106,3
|
15,75
|
54,31
|
|
Phragmites australis
|
0,78
|
95,2
|
14,1
|
18,08
|
|
5
|
10,49
|
675,1
|
100
|
100,91
|
RG : Recouvrement global ; S
: surface moyenne ; T : taux de consommation ;
IA : indice d'attraction
Le taux de consommation relativement important pour les cinq
Poaceae, mais avec une certaine tendance pour Cynodon dactylon (28,5
%) et Setaria verticillata (25 %). Par contre leurs indices
d'attraction sont respectivement les plus faibles (5,8) et (7,3). L'indice
d'attraction le plus important est enregistré chez Anisantha
sterilis (54,3). Le taux de recouvrement de cette graminée par
contre est le plus faible (0,3 %) (Figure 29).
89
Résultats et Discussions
Figure 29. Comparaison entre les indices
d'attraction des espèces végétales ingérées
par Acrida turrita et leurs taux de recouvrement au niveau du milieu
cultivé Touzouz.
Les résultats obtenus par l'étude quantitative
montrent qu'Acrotylus patruelis, Aiolopus strepens,
Morphacris fasciata, Ochrilidia gracilis et Acrida
turrita présentent un taux de consommation élevé pour
Cynodon dactylon. Par contre, l'indice d'attraction de cette Poaceae
est très faible pour les cinq Acridiens. Cependant les plantes les plus
ingérées ne sont pas forcément les plus
appétissantes. Nous avons montré aussi, que la plus part des
Acridiens ont consommées au moins une Poaceae, ce qui peut être
expliqué selon Singer & Stireman (2001) par
l'abondance de ces végétaux dans la nature. Ces résultats
semblent en accord avec ceux de Essakhi et al.,
(2015). De plus les graminées possèdent moins de
composés secondaires (pyrrolizidines, quinolizidines et tannins) que les
dicotylédones, qui sont généralement répulsifs pour
les acridiens (Capinera et al., 1997). D'autre part,
le bon équilibre en eau des plantes est un facteur essentiel de leurs
utilisations. Certes, un apport localisé d'eau d'irrigation, inscrit
dans un contexte aride joue également un rôle important dans le
maintient de ces Poaceae en turgescence (Ould Elhadj, 2001).
Nos résultats montrent aussi, qu'une espèce
végétale moins abondante dans le biotope peut être
très attirée par les criquets. C'est le cas d'Anisantha
sterilis chez Acrida turrita, Morphacris fasciata et
Acrotylus patruelis ; de même pour Digitaria commutata
chez Ochrilidia gracilis. D'après Launois-Luong
(1975), le choix de nourriture chez les criquets n'est pas lié
à l'abondance des plantes ingérées. Le choix de la
nourriture d'acridiens peut être influencé par d'autres facteurs,
tels que molécules de dissuasion ou de stimulation (Le Gall,
1989), architecture des plantes et couleur (Picaud et al.
2002). Certaines de ces fonctionnalités peuvent être
détectées par des organes sensoriels, tels que les organes
olfactifs ou gustatifs des sensilles des antennes
90
Résultats et Discussions
(Chen et al., 2003),
chimiorécepteurs sur les palpes (Jin et al.,
2006), et des sensilles du labre (El Ghadraoui et
al., 2002 ; Zaim et al., 2013). La taille du corps
des criquets devrait être liée à la quantité de
biomasse consommée afin de soutenir les demandes métaboliques de
ces insectes (Schmitz & Price, 2011). En effet les grands
Acridiens tels que Acrida turrita et Heteracris ont
ingérés une quantité de nourriture plus importante que les
moins grands tels que Pyrgomorpha cognata et Acrotylus
patruelis. La biomasse consommée est quantifiée en somme
moyenne des surfaces ingérées. Les résultats relatives
à la quantification de l'alimentation et 1' analyse de l'indice
d'appétence confirment la forte sélectivité des sept
espèces Acridiennes à l'égard des plantes disponibles dans
leur biotope. De plus cette étude quantitative a donnée à
chaque plante consommée son importance réelle. C'est dire qu'une
plante peut être fréquente dans les fèces d'un criquet,
mais à des quantités faibles. Parmi les sept Orthoptères
analysés, cinq sautériaux s'attaquent uniquement aux plantes
adventices. Par contre Heteracris annulosa et Pyrgomorpha cognata
consomment des plantes cultivées telles que Lagenaria
siceraria, Cucurbita maxima, Cucumis melo, Solanum
melongena, Solanum lycopersicum, Capsicum annuum et
Mentha pulegium. Les dégâts sur ces plantes sont
importants au fur et à mesure que la densité d'Heteracris
annulosa et Pyrgomorpha cognata augmente dans les parcelles de
ces cultures. De plus cet Eyprepocnemidinae et ce Pyrgomorphinae sont
phytophiles. Cependant, Acrotylus patruelis, et Morphacris
fasciata sont rarement observés sur végétation, ils
sont géophiles. En outre, les spécialistes d'un habitat risquent
l'extinction locale lorsque leurs plantes hôtes et / ou leurs habitats
sont modifiés ou détruits car ils ne s'adaptent pas facilement
aux changements de plantes hôtes ou d'habitats (Keller et
al., 2013). En effet Heteracris annulosa et
Pyrgomorpha cognata sont très liées à leurs
plantes hôtes. La densité de ces criquets diminue très
considérablement avec le changement des cultures.
CONCLUSION
91
Conclusion
Conclusion
A l'issue de ces trois années (automne 2016 jusqu'au
fin été 2019) de suivis, pas moins de 31944 d'individus
d'Orthoptères ont été comptabilisés sur les 9
stations des 3 sites de la vallée du M'Zab appartenant à
l'étage bioclimatique saharien à hiver doux. Ces spécimens
sont représentés par 47 espèces, 28 genres, 15 sous
familles, six familles et deux sous ordres. Il a fallu pour leur collecte 324
sorties de prospections et 3240 quadrats de 25 m2. Ce travail nous a
permis d'ajouter onze espèces nouvelles pour la faune
Orthoptérologique de la vallée du M'Zab. Ils s'agissent de
Notopleura saharica, Heteracris littoralis, Heteracris
minuta, Aiolopus puissanti, Aiolopus simulatrix,
Hilethera aeolopoides, Morphacris fasciata, Oedaleus
senegalensis, Sphingoderus carinatus, Sphingonotus paradoxus
et Tropidopola cylindrica. La sous famille des Oedipodinae est la
plus représentée avec 40,4 % des espèces
inventoriées. Le genre Sphingonotus est le plus riche avec sept
espèces, soit 14,9 % des Orthoptères recensés. Les
méthodes non paramétriques d'estimation de la richesse en
espèces réelle ont indiqué que l'inventaire de chaque
habitat était complet. Au sein de neuf biotopes inventoriés, les
milieux cultivés composent les habitats les plus riches et les plus
peuplés en Orthoptères. En effet, la présence d'une strate
herbacée telle que Cynodon dactylon et Setaria verticillata
favorise le développement des criquets. Au contraire, la
présence d'une trop forte proportion d'Arbres le cas des palmeraies,
contribue à la diminution de la faune Acridienne.
Nos résultats montrent que la richesse des
espèces atteint un maximum en Eté. Elle est plus
élevée dans les sites moins perturbés. En effet ces
résultats confirment la réaction des Acridiens aux modifications
de la structure de la végétation et du sol suite à
l'intensité agricole dans un biotope donné.
Les densités maximales de population
d'Orthoptères caractérisent les relevés effectués
en milieux cultivés en saison estivale (163 individus à 118
individus pour 100 m2). Inversement, les densités les plus
faibles (3 à 4 individus pour 100 m2) correspondent aux
milieux naturels et les palmeraies durant l'hiver. Les densités
étaient plus élevées dans les sites moins perturbés
de Ben Isguen et Ghardaïa.
Les données sur l'abondance relative des espèces
ont montrées que, Morphacris fasciata, Ochrilidia
gracilis, Acrotylus patruelis, Aiolopus strepens et
Pyrgomorpha cognata dominaient la plupart des sites.
Dans les milieux cultivés et les palmeraies, presque la
moitié des espèces sont omniprésentes. Les milieux
naturels se caractérisent par la catégorie d'espèces
accessoires. Les intervalles de classes de constance dans les neuf habitats
décèlent six espèces rares : Calliptamus
barbarus,
92
Conclusion
Oedaleus senegalensis, Eunapiodes sp,
Sphingonotus pachecoi, Phaneroptera nana et Conocephalus
fuscus.
En général, la valeur de l'indice de la
diversité de Shannon-Weaver, l'équitabilité et l'inverse
de l'indice de Simpson évolue progressivement en Printemps et en
Eté où elle est maximale, puis diminue en Hiver. Cette
diversité Alpha est élevée dans les sites cultivés
moins perturbés et les palmeraies mal-entretenues. Par
conséquent, les Orthoptères dans cette étude pourraient
être utilisés avec succès comme bio indicateurs de la
perturbation des habitats.
L'analyse factorielle des correspondances a permis de
dégager trois tendances écologiques des Orthoptères. Les
espèces qui préfèrent l'humidité vivent dans des
zones moins ensoleillées et dans des parcelles recouvertes d'herbes
denses telles que Phaneroptera nana, Conocephalus fuscus et
Paratettix meridionalis. Près de l'origine se trouve un groupe
d'espèces relativement indifférentes aux facteurs
d'humidité, d'ensoleillement et de couverture végétale,
c'est le cas de Pyrgomorpha cognata et Pyrgomorpha conica.
Des espèces xérophiles qui préfèrent vivre dans des
endroits secs, végétation très dispersée et un
rayonnement solaire très important. Parmi ces espèces on cite
entre autres : Sphingonotus rubescens et Sphingonotus
pachecoi.
Le dendrogramme de similarité a divisé les
habitats en 2 groupes : Un 1er groupe est formé par les
milieux naturels (lits d'oueds) caractérisés par un faible taux
de recouvrement végétal et sol rocailleux avec quelques endroits
sablonneux, le 2ème groupe est formé par l'Acridofaune
des milieux cultivés et palmeraies avec un recouvrement
végétal assez important par apport aux milieux naturels, une
irrigation plus au moins fréquente et le sol est sablonneux-limoneux.
L'évolution mensuelle des densités larvaires et
d'adultes des populations acridiennes de la région d'étude a
permis de décrire les cycles biologiques de 26 Caelifères. Nous
avons pu déterminer des espèces à une seule
génération, dont quatre espèces printanières et
estivales et deux de la période Eté-Automne. Les Acridiens
à deux générations annuelles sont en nombre de onze, dont
trois espèces reproduction continue, six à hivernation larvaire
et deux espèces à hivernation embryonnaire. Les Caelifères
à trois générations annuelles sont
représentés par cinq espèces. D'une manière
générale on n'est pas parvenu à situer avec
précision les différents phénomènes
(éclosion, accouplement, ponte). Cela est dû, peut être
à la méthode d'échantillonnage utilisée et surtout
à la fréquence des relevés.
A la lumière de l'étude qualitative et
quantitative du régime alimentaire des sept Acridiens, on distingue deux
groupes de criquets : (i) Polyphages pour la majorité des
espèces, dont Acrotylus patruelis, Heteracris
annulosa, Aiolopus strepens, Pyrgomorpha cognata et
93
Conclusion
Morphacris fasciata. Ces espèces montrent un
large spectre au niveau des plantes consommées, elles s'attaquent
à plusieurs familles végétales toutes en marquants une
tendance flagrante pour les Poaceae et en particulier Cynodon
dactylon ; à l'exception de Heteracris annulosa et
Pyrgomorpha cognata. (ii) Oligophages pour Acrida turrita et
Ochrilidia gracilis. Ces espèces ont consommées une
seule famille végétale, les Poaceae. A travers le calcul
du taux de consommation et l'indice d'attraction, on a constaté que les
plantes les plus ingérées ne sont pas forcément les plus
appétissantes. De plus, un végétal à faible
recouvrement dans le biotope peut être attiré par le criquet.
Perspectives de recherche
Sur le plan taxonomique, il reste encore
énormément d'aspects et de biotopes qui n'ont pas
été exploitées et explorées, c'est pourquoi nous
suggérons d'élargir ces recherches à d'autres milieux. Il
serait nécessaire d'approfondir les travaux systématiques en
utilisant de nouvelles techniques comme la biologie moléculaire pour
déterminer les espèces et sous-espèces.
La présente étude apporte son soutien à
la suggestion que les sauterelles sont des indicateurs potentiellement utiles
de perturbation des terres agricoles. De ce fait, il serait intéressant
d'étudier les facteurs influençant la réponse des
espèces Acridiennes à l'intensité des pratiques agricoles
et l'abandon des parcelles.
Des mesures appropriées devraient être prises
pour minimiser les risques de perturbation et de perte d'habitats naturels, car
cela aurait des effets négatifs sur la composition et l'abondance de la
communauté d'acridiens. En effet, ce travail indique que les mauvaises
herbes telles que Cynodon dactylon et Setaria verticillata
abritaient à l'intérieur et autour des champs un grand
nombre d'espèces de criquets. Nous suggérons à ce que les
plantes hôtes préférables par les Acridiens, soient
cultivées autour du champ. Cela permettra de réduire les dommages
aux cultures et de préserver la biodiversité des
Orthoptères.
Pour une étude de phénologie des Acridiens plus
détaillé on doit faire des relevés hebdomadaires pour ne
pas échapper aux accouplements, aux pontes et aux éclosions des
oeufs. Ces phénomènes vont déterminer avec
précision le cycle biologique de chaque espèce
d'Orthoptère. Pour réaliser un tel travail on recommande de
s'intéresser uniquement à la biologie des Acridiens pour une
future recherche. En fin on peut conclure que toute amélioration de la
prévision, donc de la lutte contre ces sautériaux, passe par une
amélioration des connaissances des cycles biologique de ces
populations.
94
Conclusion
Il est recommandé de mener des enquêtes
similaires à grande échelle dans d'autres régions afin
d'évaluer pleinement la faune d'acridiens de la région du Sahara
septentrionale.
Il est grand temps de faire fait progresser le savoir sur les
Acridiens à fin d'établir une liste nationale des
Orthoptères sur laquelle l'on pourrait s'appuyer pour la gestion
patrimoniale de la nature.
REFERENCES
BIBLIOGRAPHIQUES
95
Références bibliographiques
Références bibliographiques
Adu-Acheampong S., Bazelet C.S & Samways M.J.,
2016 - Extent to which an agricultural mosaic supports endemic
species-rich grasshopper assemblages in the Cape Floristic Region biodiversity
hotspot. Agriculture, Ecosystems and Environment 227: 52-60.
Alioua Y., Bissati S., Kherbouche O. & Bosmans R.,
2016 - Spiders of Sebkhet El Melah (Northern Sahara, Algeria): Review
and new records. Serket, vol. 15(1) : 33-40.
B.N.E.D.E.R., 2014 - Indicateurs de
Développement Monographies régionales La dorsale Mozabite,
106-143.
Babaz Y., 1992 - Etude
bioécologique des orthoptères dans la région de
Ghardaïa. Mémoire d'ingénieur agronome, Institut
Agronomique, Blida, 91 p.
Badenhausser I., Amouroux P., Lerin J. &
Bretagnolle V., 2009 - Acridid (Orthoptera : Acrididae) abundance in
Western European Grasslands: sampling methodology and temporal fluctuations.
J. Appl. Entomol. 133: 720-732.
Bagnouls F. et Gaussen H., 1953. Saison
sèche et indice xérothermique. Bull. Soc. Hist. Nat.
Toulouse (88), 3-4: 193-239
Báldi A. & Kisbenedek T., 1997 -
Orthopterans assemblages as indicators of grassland naturalness in Hungary.
Agriculture, Ecosystems and Environment 66 :121-129.
Barataud J., 2005 - Orthoptères et
milieux littoraux. Influence de la gestion des habitats herbacés sur les
ressources trophiques et enjeux pour la biodiversité. - Rapport de BTS
Gestion des Espaces Naturels, session 2003-2005, encadré par la
Réserve Naturelle de Moëze-Oléron, 50 p.
Barbault R., 1992 - Écologie des
peuplements, structure, dynamique et évolution. Ed. Masson, Paris,
273 p.
Barker AM., 2004 - Insect as food for
farmland birds-Is there a problem? In: Van Emden H,
Rothschild M (eds) Insects and bird interactions. Intercept
Ltd, Hampshire, 37- 50. Barton B.T., Beckerman A.P. & Schmitz O.
J., 2009 - Climate warming strengthens
indirect interactions in an old-field food web.
Ecology, 90: 2346-2351.
Barton B.T., 2010 - Climate warming and
predation risk during herbivore ontogeny. Ecology 91: 2811-2818.
Bazelet C. S., & Samways M. J., 2014 -
Habitat quality of grassland fragments affects dispersal ability of a mobile
grasshopper, Ornithacris cyanea (Orthoptera: Acrididae). African
Entomology, 22: 714-725.
96
Références bibliographiques
Ben Halima T., Gillon Y. & Louveaux A., 1984
- Utilisation des ressources trophiques par Dociostaurus
maroccanus (Thunberg, 1815) (Orthoptera. Acrididae). Choix des
espèces en fonction de la valeur nutritive. Acta Oecologica. Oecol.
Gener., 5(4): 383406.
Benfekih L., Foucart A. & Petit D., 2011 -
Central Saharan populations of Locusta migratoria cinerascens
(Orthoptera: Acrididae) in irrigated perimeters: is it a recent
colonisation event? Annales de la Société Entomologique de
France 47(1-2): 147-153.
Beniston NT. & Beniston S., 1984 -
Fleurs d'Algérie. Ed. Entreprise Nationale du livre, Alger, 359
p.
Benrima A., 1990 - La biologie de la
faune Orthoptérologique de la région de Kolea.
Mémoire Ingénieur Agronome, Univ. Sci. Techn. Blida, 77p.
Benrima A., 1993 - Bioécologie et
étude du régime alimentaire des espèces
d'orthoptères dans deux stations d'étude situées en
Mitidja. Etude histologique et anatomique du tube digestif de Dociostaurus
jagoi jagoi (Soltani, 1978). Thèse Magister, INA, El Harrach,
Alger, 190 p.
Benzara A., Doumandji S., Rouibah M. &Voisin JF.,
2003 - Etude qualitative et quantitative de l'alimentation de
Calliptamus barbarus (Costa, 1836) (Orthoptera : Acrididae). Revue
Ecologie, 58 : 187-196.
Blondel J., 1979 - Biogéographie
et écologie. Ed. Masson, Paris, 173 p.
Blondel J., 1995 - Biogéographie.
Approche écologique et évolutive. Edition Masson, Paris, 297
p.
Boitier E., 2004 - Caractérisation
écologique et faunistique des peuplements d'orthoptères en
montagne Auvergnate. Matériaux Orthoptériques et
entomologiques, 9 : 43-78.
Bonnet E., Vilks A., Lenain J-F. & Petit D., 1997
- Analyse temporelle et structurale de la relation Orthoptère -
Végétation. Ecologie, 28 (3) : 209-216.
Boukraa S., 2009 - Biodiversité
des Nématocères (Diptera) d'intérêt agricole et
médico-vétérinaire dans la région de
Ghardaïa. Mémoire d'ingénieur agronome, Ecole national
des sciences agronomique, El-Harrach, Algérie, 128 p.
Bounechada M., Doumandji S. & Ciplak B., 2006
- Bioecology of the Orthoptera species of the setifian plateau,
North-East Algeria. Turkish journal of zoology 30: 245-253.
Brust M.L., Hoback, W.W. & Wright, R. J., 2009
- Degree-day requirements for eight economically important
grasshoppers (Orthoptera: Acrididae) in Nebraska using field data.
Environmental Entomology. 38(5): 1521-1526.
97
Références bibliographiques
Butet A., 1985 - Méthode
d'étude du régime alimentaire d'un rongeur polyphage Apodemus
sylvaticus (L., 1758) par l'analyse microscopique des fèces.
Mammalia 49(4): 445479.
Capinera J.L. & Sechrist T., 1982 -
Grasshoppers (Acrididae) of Colorado: identification, biology and
management. CSU Experiment Station Bulletin, 584S:161p.
Capinera J.L. & Horton DR., 1989 -
Geographic variation in effects of weather on grasshopper infestation.
Environmental Entomology, 18: 8-14.
Capinera JL., Scherer CW., & Simkins JB., 1997
- Habitat Associations of Grasshoppers at the Macarthur Agro-Ecology
Research Center, Lake Placid, Florida. The Florida Entomologist,
80(2): 253-261.
Capinera J.L., Scott R. & Walker T.J., 2004
- Field guide to grasshoppers, katydids and crickets of the United
States and Canada. Ithaca: Cornell University Press, 249p.
Cease A.J., Elser J.J., Fenichel E.P., Hadrich J.C.,
Harrison J.F. & Robinson B.E., 2015 - Living With Locusts:
Connecting Soil Nitrogen, Locust Outbreaks, Livelihoods, and Livestock Markets.
Bioscience, 65(6): 551-558.
Chandra S., 1990 - Population dynamics of
desert locust (Schistocerca gregaria Forskål, 1775) in relation
to summer monsoon rainfall in western Rajestan desert - long term study,
Plant Protection Bulletin, 42(1-2): 1-6.
Chen H.-H., Zhao Y.-X. & Kang L., 2003 -
Antennal sensilla of grasshoppers (Orthoptera: Acrididae) in relation to food
preferences and habits. Journal of Biosciences, 28(6) : 743-752.
Chopard L., 1943 -
Orthoptéroïdes de l'Afrique du Nord. Ed Rose Bookstore.
Coll: Faune de l'Empire Français. Paris, 405 p.
Cigliano MM, Torrusio SE, & Wysiecki ML., 2002
- Grasshopper (Orthoptera: Acridoidea) community composition and
temporal variation in The Pampas, Argentina. Journal of Orthoptera Research
11 (2): 215-221.
Cigliano, M. M., Braun, H., Eades, D. C. and Otte, D.
2019. Orthoptera Species File. Version 5.0/5.0. [15/4/2019].
http://Orthoptera.SpeciesFile.org.
[Accessed 30 September 2019].
Cisse S., Ghaout S., Mazih A., Ould B. E. M. A. O.,
Benahi A. S. & Piou C., 2013 - Effect of vegetation on density
threshold of adult desert locust gregarization from survey data in Mauritania.
Entomologia Experimentalis et Applicata 149: 159-165.
Colwell R.K., 2013 - Estimate S: statistical
estimation of species richness and shared species from samples. Version 9,
Available at:
http://purl.oclc.org/estimates
98
Références bibliographiques
Coyne A., 1989 - Le M'Zab. Ed.
Adolphe Jourdan, Algérie, 41 p.
D.S.A., 2015 - Direction de service
agricole de la Wilaya de Ghardaia, rapport, 22 p.
Daddi Bouhoun M., 1997 - Contribution
à l'étude de l'évolution de la salinité des sols et
des eaux d'une région saharienne : Cas du M'Zab. Thèse
Magister, I.N.A., Alger, 180 p. Dajoz R., 1971 -
Précis d'écologie. Ed. Dunod, Paris, 434 p.
Dajoz R., 2006 - Précis
d'écologie, 8ème Edition Dunod, Paris, 631 p.
Defaut B., 2000 - Effets comparés du
feu dirigé et du débroussaillement manuel sur les
Orthoptères à Merville (Ariège). Matériaux
Entomocénotiques, 5: 47-62.
Defaut B., 2005 - Aiolopus
Puissanti, espèce nouvelle proche d'Aiolopus thalassinus
(Fabricius) (Acrididae, Oedipodinae). Matériaux
Orthoptériques et Entomocénotiques, 10, 20 : 103-113
Dehondt F., Mora, F. & l'OPIE
Franche-Comté, 2013 - Atlas des sauterelles, grillons et
criquets de Franche-Comté, illustrations commentées du peuple
chantant de l'herbe, Ouvrage, Ed. Naturalia publication: 191 p.
Dirsh V.M., 1965 - The African genera of
Acridoidea, Ed. Presses, University of Cambridge, 579 p.
Douadi B., 1992 - Contribution à
l'étude bioécologique des peuplements Orthoptérologique
dans la région de Guerrara (Ghardaia) - Développement ovarien
chez Acrotylus patruelis (Herrich- Schaeffer, 1838). Mémoire
d'ingénieur agronome, INA, El Harrach, Alger, 75 p.
Doumandji S., Doumandji-Mitiche B., Benzara A. &
Tarai N., 1993 - Méthode de la fenêtre proposée
pour quantifier la prise de nourriture par les criquets. L'entomologiste
49 (5) : 213-215.
Doumandji-Mitiche B., Doumandji S., Kadi A., Kara
F.Z., Ayoub A. & Zergoun Y...., 2001 - La faune
Orthoptérologique de certaines oasis algériennes (Béchar,
Adrar, Tamanrasset, Djanet et Ghardaïa). Conférence internationale
sur les orthoptères. Montpellier, France, Metaleptea,
spécial issue 44: 149-153.
DPAT, 2005 - Annuaire statistique de la
wilaya de Ghardaïa. Direction de la planification et de
l'aménagement du territoire, Ghardaïa, 123 p.
Dreux Ph., 1972 - Recherche de terrain en
autoécologie des Orthoptères. Acrida, 1 : 305-330.
Dreux Ph., 1980 - Précis d'écologie.
Ed. Presses Universitaires de France, Paris, 220 p.
Dubief J., 1953 - Essai sur l'hydrologie
superficielle au Sahara, Ed. Service des études scientifique,
Alger, 457 p.
99
Références bibliographiques
Duranton J.F., Launois S.M., Launois-Luong M.H. &
Lecoq M., 1982 - Manuel de prospection acridienne en zone
tropicale sèche. Ed. G.E.R.D.A.T., Paris, 695 p.
El Ghadraoui L., Petit D., Picaud F. & El Yamani
J., 2002 - Relationship between labrum sensilla number in the Moroccan
locust Dociostaurus maroccanus and the nature of its diet. The
Journal of Orthoptera Research, 11, 1: 11-18.
Elliot S. L., Horton C. M., Blanford S. & Thomas
M. B., 2005 - Impacts of fever on locust life-history traits: costs or
benefits? Biology Letters, 1(2) : 181-184.
Emberger L., 1955 - Une classification
biogéographique des climats. Rev. Trav. Lab. Geol. Bot. et Zool.,
Fac. Sc. Montpellier, 7: 1-43.
Eo J., Kim M-H., Na Y-E., Oh Y-J. & Park S., 2017
- Abiotic effects on the distributions of major insect species in
agricultural fields. Entomological Research, 47(3): 160-166.
Essakhi D., Benjelloun M., Errabhi N., El Harchli H.
& El Ghadraoui L., 2014 - Richesse spécifique en
Orthoptères Acridiens du Moyen Atlas marocain. Bulletin de
l'Institut Scientifique, Rabat, Section Sciences de la Vie, n° 36 :
41-48.
Essakhi D., El Harchli E.H., Benjelloun M., Maazouzi
N., Mansouri I., Azzouzi A. & El Ghadraoui L., 2015 - Contribution
à L'Étude du Régime Alimentaire des Orthoptères
acridiens dans Le Moyen Atlas (Maroc). International Journal of Engineering
And Science. Vol.5, Issue 2 : 60-66.
Fahim S., 2011- Etude de la
biodiversité Orthoptérique des régions traitées
dans le sud-est du Maroc. Mémoire de Master. Université Sidi
Mohamed Ben Abdellah de Fes, Maroc, 67 p.
Fellaouine R., 1989 - Bioécologie
des Orthoptères de la région de Sétif. Thèse
magister, INA, El Harrach, Algérie, 81 p.
Fielding D.J., 2004 - Developmental time of
Melanoplus sanguinipes (Orthoptera: Acrididae) at high latitudes.
Environmental Entomology 33: 1513-1522.
Fox R., 2012 - The decline of moths in Great
Britain: a review of possible causes. Insect Conservation and
Diversity, 6: 5-19.
Gardiner T., Hill J. & Chesmore D., 2005
- Review of the Methods Frequently Used to Estimate the Abundance of
Orthoptera in Grassland Ecosystems. Journal of Insect Conservation, 9:
151-173.
Gardiner T., Pye M., Field R. & Hill J., 2002 -
The influence of sward height and vegetation composition in
determining the habitat preferences of three Chorthippus species
(Orthoptera: Acrididae) in Chelmsford, Essex, UK. Journal of Orthoptera
Research 11: 207-213.
100
Références bibliographiques
Gardiner T. & Dover J., 2008 - Is
microclimate important for Orthoptera in open landscapes? Journal of Insect
Conservation, 12: 705-709.
Gardiner T. & Hassall M., 2009 - Does
microclimate affect grasshopper populations after
cutting of hay in improved grassland? Journal of Insect
Conservation 13: 97-102. Gardiner T., 2006 - The
Impact of Grassland Management on Orthoptera Populations in
the UK. Unpublished PhD thesis, University of Essex,
Colchester, UK. 444 p.
Gardiner T., 2018 - Grazing and Orthoptera: a
review. Journal of Orthoptera Research 27(1): 3-11.
Gillon Y., 1974 - Variations
saisonnières de populations d'Acridiens dans une savane
préforestière de Cote d'Ivoire. Acrida, 3 : 129-174.
Gotelli NJ. & Colwell R.K., 2011 -
Estimating Species Richness. In: Biological Diversity: Frontiers in
Measurement and Assessment, Oxford University Press, United Kingdom,
39-54.
Grubisic M., van Grunsven R. H. A. Kyba C. C. M.
Manfrin A., & Hölker F., 2018 - Insect declines and
agroecosystems: does light pollution matter? Annals of Applied
Biology, 173(2) :180-189.
Guecioueur L., 1990 - Bioécologie
de la faune Orthoptérologique de trois stations à Lakhdaria.
Mémoire Ingénieur Agronome. INA, El-Harrach, Alger, 71 p.
Guendouz-Benrima A., Doumandji Mitiche B. & Petit
D., 2011- Effects of weak climatic variations on assemblages and life
cycles of Orthoptera in North Algeria. Journal of Arid Environments,
75(5) : 416-423.
Guezoul O., Benhadid A., Sekour M., Ababsa L.,
Doumandji S., & Baziz B., 2008 - Biodiversité avienne dans
deux milieux phoenicicoles dans la région de Ghardaïa (Sahara,
Algérie). Premières Journées Nationales sur la
Biologie des Ecosystèmes Aquatiques. Université du 20
août 1955, Skikda du 24 au 25 mai 2008, 11 p.
Guezoul O., Lechheb Y., Sekour M., Ababsa L., Souttou
K & Doumandji S., 2011 - Dommages dus aux Passer domesticus
x hispaniolensis sur la variété Deglet-Nour dans
les palmeraies de Dhayet Bendhahoua à Chebket M'Zab.
Séminaire Internationales sur la protection des
végétaux, E.N.S.A. du 18 au 20 avril 2011.
Guezoul O., 2011 - Importance des
dégâts du Moineau hybride dans différentes régions
agricoles d'Algérie. Thèse de doctorat, Ecole National
Supérieur Agronomique, El Harrach, Alger, 214 p.
Guido M. & Gianelle D., 2001 -
Distribution patterns of four Orthoptera species in relation to microhabitat
heterogeneity in an ecotonal area. Acta Oecologica 22:175-185.
101
Références bibliographiques
Hallmann C. A., Sorg M., Jongehans E., Siepel H.,
Hofland N. & Schwan H..., 2017 - More than 75 percent decline over
27 years in total flying insect biomass in protected areas. PLoS ONE,
12: e0185809: 1-21.
Hamdi H., 1989 - Contribution à
l'étude de la bioécologie des peuplements
Orthoptéroloqiques de la région medio septentrionale de
l'Algérie et de la région de Gabès (Tunisie).
Mémoire Ingénieur Agronome, INA, El Harrach, 127p.
Hamdi H., 1992 - Etude
bioécologique des peuplements Orthoptérologique des dunes
fixées du littoral Algérois. Thèse magistère,
INA, El Harrach, Alger, 165p.
Hammer Ø., Harper D.A.T. & Ryan P.D., 2001
- PAST: Paleontological Statistics software package for education and
data analysis. Palaeontologia Electronica 4(1):1-9.
http://palaeo-electronica.org/2001_1/past/issue1_01.htm.
Hao S., Wang S., Cease A. & Kang L., 2015
- Landscape level patterns of grasshopper communities in Inner
Mongolia: interactive effects of livestock grazing and a precipitation
gradient. Landscape Ecology, 30(9): 1657-1668.
Harris R. M. B., McQuillan P. & Hughes L., 2015
- The effectiveness of common thermo-regulatory behaviours in a cool
temperate grasshopper. Journal of Thermal Biology, 52: 75-83.
Hernándes-Zul M.I., Quijano-Carraza J.A.,
Yañez-López R., Torrespacheco I., Guevara-Gonzalez R. &
Rico-Garcia E..., 2012 - Elements for the sustainable management of
acridoids of importance to agriculture. African Journal of Agricultural
Research 7: 142-152
Hochkirch A., Nieto A., García Criado M.,
Cálix M., Braud Y. & Buzzetti FM..., 2016 - European
Red List of Grasshoppers, Crickets and Bush-crickets. Publications Office
of the European Union, Luxembourg, 94 p.
Hodjat S H., Saboori A. & Husemann M., 2019
- A view on the historic and contemporary acridid fauna (Orthoptera:
Caelifera: Acrididae) of Iran-A call for conservation efforts. Journal of
Crop Protection, 8 (2): 135-142.
Hunter D. M., Walker P. W. & Elder R. J., 2001
- Adaptations of locusts and grasshoppers to the low and variable
rainfall of Australia. Journal of Orthoptera Research, 10(2):
347-351.
Jamison B.E., Robel R.J., Pontius J.S. & Applegate
R.D., 2002 - Invertebrate biomass: associations with lesser
prairie-chicken habitat use and sand sagebrush density in South-western Kansas.
Wildl. Soc. Bull. 30:517-526
102
Références bibliographiques
Jaulin S., 2009 - Etude des
Orthoptères des sites expérimentaux du LIFE Basses
Corbières. Synthèse des 4 années de prospections.
Rapport d'étude de l'OPTE, Perpignan, 51 p.
Jin X., Zhang SG. & Zhang L., 2006 -
Expression of odorant-binding and chemosensory proteins and spatial map of
chemosensilla on labial palps of Locusta migratoria (Orthoptera:
Acrididae). Arthropod Structure & Development. 35 47-56
Joern A., 1982 - Distributions, densities,
and relative abundances of Grasshoppers (Orthoptera: Acrididae) in a Nebraska
Sandhills Prairie. Prairie Naturalist, 14(2): 3745.
Jowkar H., Ostrowski S., Tahbaz M. & Zahler P.,
2016 - The conservation of biodiversity in Iran: threats, challenges
and hopes. Iranian Studies, 49: 1065-1077.
Kalinganire A., Dakouo JM., Bayala J. & Niang A.,
2005 - Relevé des données de la biodiversité
ligneuse : Manuel du projet biodiversité des parcs agroforestiers
au Sahel. World Agroforestry Centre, ICRAF, 69 p.
Keller D., van Strien MJ., Herrmann M., Bolliger J.,
Edwards PJ., Ghazoul J. & 2013 - Is functional connectivity in
common grasshopper species affected by fragmentation in an agricultural
landscape? Agriculture, Ecosystems & Environment, 175 : 39-46.
Khadraoui Z. & Ouanouki Y., 2001 -
Contribution à l'étude bioécologique des peuplements
d'Acridiens (Orthoptera, Caelifera) dans trois stations de la région de
Moudjbara (Djelfa). Mémoire Ingénieur Agronomique, Centre
Universitaire Djelfa, 128 p.
Kherbouche Y., 2007 - Etude de quelques
aspects bioécologiques de la sauterelle pèlerine Schistocerca
gregaria (Forskål, 1775) (Acrididae, Cyrtacanthacridinae) dans la
région d'Adrar (Sahara, Algérie). Thèse
Magistère en sciences agronomiques, Institut National Agronomique, El
Harrach, Algérie, 155 p.
Kok OB. & Louw SV., 2000 - Avian and
mammalian predators of Orthoptera in semi-arid regions of South Africa.
South African Journal of Wildlife Research, 30:122-128
Lactin D.J. & Johnson D.L., 1996 -
Behavioural optimization of body temperature by nymphal grasshoppers
(Melanoplus sanguinipes, Orthoptera: Acrididae) in temperature
gradients established using incandescent bulbs. Journal of Thermal Biology
21: 231-238
Launois-Luong M.H., 1975 - Méthode
d'étude dans la nature du régime alimentaire du criquet migrateur
Locusta migratoria capita (Sauss), Annale de Zoologie et Ecologie
Animale, Paris, 8, 1 : 25-32.
Launois-Luong M. H. & Lecoq M., 1989
- Vade-mecum des criquets du Sahel", Collection d'Acridologie
Opérationnelle, 5, CIRAD/ PRIFAS, Montpellier, 125 p.
103
Références bibliographiques
Launois M., Launois-Luong MH. & Lecoq M., 1996
- Drought and survival of the acridids of the west African Sahel.
Sècheresse, 7 : 119-127.
Le Berre M., 1989 - Faune du Sahara. 1-
Poissons-Amphibiens-Reptiles. Ed. Le chevalier-Chabaud, Paris, 332 p.
Le Berre M., 1990 - Faune du Sahara. 2 -
Mammifères. Ed. Le chevalier-Chabaud, Paris, 359 p.
Le Gall P., 1989 - Le choix des plantes
nourricières et la spécialisation trophique chez les Acrididea
(Orthoptères), Bulletin d'écologie, 20 : 245-261
Le Houerou H.N., 1990 - Définition et
limites bioclimatiques du Sahara. Science et changements planétaires /
Sécheresse. 1(4) : 246-259.
Le Houerou H.N., 1995 - Bioclimatologie
et biogéographie des steppes arides du Nord de l'Afrique.
Diversité biologique, développement durable et
désertification. Options méditerranéennes,
Série B : Etude et recherche N°10. Ed. Ciheam, Montpellier, 396
p.
Leather S. R., 2017- «Ecological
Armageddon» - more evidence for the drastic decline in insect numbers.
Annals of Applied Biology, 172(1):1-3.
Lecoq M., 1978 - Biologie et dynamique d'un
peuplement acridien de zone soudanienne en Afrique de l'ouest
(Orthoptera-Acrididae). Annales de Société Entomologique
Française. (N.S) 14(4) : 603-681.
Lecoq M. & Chuzel G., 2007 - Les criquets
ravageurs : acridiens. Site scientifique du Web
des savoirs. [Online]. Montpellier : CIRAD-AMIS. [Mai
2019]. http://locust.cirad.fr/ Lecoq M., 2010 -
Biologie et dynamique des acridiens d'Afrique de l'Ouest. Montpellier
:
CIRAD-BIOS, 239 p.
Lecoq M., 2012 - Bioécologie du
criquet pèlerin. FAO-CLCPRO (Commission de lutte contre le Criquet
pèlerin en région occidentale), Alger, 217 p.
Legall P., & GillonY., 1989 - Partage des
ressources et spécialisation trophique chez les acridiens (Insectes,
Orthoptera, Acridomorpha). Non graminivores dans la Savane
préforestière (Lamto, cote d'Ivoire). Acta.
Oecologica Oecol.génér., 10: 51-74.
Legendre I. & Legendre P., 1998 -
Numerical Ecology. Developments in Environmental Modelling, 20. Elsevier
Scientific Publication, Amsterdam, 853 p.
Levesque K.R., Fortin M. & Mauffette Y., 2002
- Temperature and food quality effects on growth, consumption and
postingestive utilization efficiencies of the forest tent caterpillar
Malacosoma disstria (Lepidoptera: Lasiocampidae). Bulletin of
entomological research, 92: 127-136
104
Références bibliographiques
Logan JD., Wolensensky W. & Joern A., 2005
- Temperature-Dependent Phenology and Prediction and Arthropods
Systems. Ecological Modelling, 196: 471-482.
Louveaux A., Amedegnato C., Poulain S. &
Desutter-Grandcolas L., 2019 - Orthoptères Acridomorpha de
l'Afrique du Nord-ouest. Version 2.1.
http://acrinwafrica.mnhn.fr
[Date de consultation: 15 septembre 2019].
Mackenzie D.I., 2006 - Modeling the
Probability of Resource Use: The Effect of, and Dealing with, Detecting a
Species Imperfectly. Journal of Wildlife Management, 70(2):
367-374.
Magurran AE., 1988 - Diversity indices and
species abundance models. In: Ecological
Diversity and Its Measurement. Springer, Dordrecht,
7-45.
Magurran AE. & Henderson PA., 2003 -
Explaining the excess of rare species in natural species abundance
distributions. Nature, 422(6933): 714-716.
Magurran AE., 2004 - Measuring Biological
Diversity. Blackwell Publishing Science, Oxford, United Kingdom, 256 p.
Marcon E., 2010 - Mesures de la
biodiversité.
http://www.ecofog.gf/Docs/PFDA/Mesures
Biodiversité.pdf , version: 12 septembre, 283 p.
Marcon E., 2015 - Mesures de la
Biodiversité. Master. HAL Id: cel-01205813,
https://hal-agroparistech.archives-ouvertes.fr/cel-01205813v5
, Kourou, France, 284 p.
Matenaar D., Bröder L., Bazelet C.S. &
Hochkirch A., 2014 - Persisting in a windy habitat: population ecology
and behavioral adaptations of two endemic grasshopper species in the Cape
region (South Africa). Journal of Insect Conservation, 18(3):
447456.
Medane A., 2013 - Etude
bioécologique et régime alimentaire des principales
espèces d'Orthoptères de la région d'Ouled Mimoun (Wilaya
de Tlemcen), Thèse de Magister, Tlemcen, 144 p.
Mekkioui A. & Mesli L., 2010 - Etude
préliminaire des Orthoptères Caelifères de deux stations
dans la région de Hafir (Monts de Tlemcen, Ouest Algérien).
Matériaux Orthoptériques et Entomocénotiques, 14:
53-60
Mohamed Sahnoun A., Doumandji S. E. & Desutter-
Grandcolas L., 2010 - A check-list of Ensifera from Algeria (Insecta:
Orthoptera). Zootaxa 2432: 1-44.
Monard A., 1986 - Étude
bioécologique des peuplements acridiens du Bas Languedoc.
Thèse de doctorat, Université Pierre et Marie Curie, Paris, 543
p.
Monod T., 1992 - « Du désert
», Sciences et changements planétaires/Sécheresse,
vol. 3, n°1 : 7-24
105
Références bibliographiques
Morris E. K., Caruso T., Buscot F., Fischer M.,
Hancock C. & Maier TS..., 2014 - Choosing and using diversity
indices: insights for ecological applications from the German Biodiversity
Exploratory. Ecology and Evolution, 4(18), 3514-3524.
Moussi A., Abba A., Harrat A. & Petit D.
2011. Desert acridian fauna (Orthoptera, Acridomorpha): Comparison
between steppic and oasian habitats in Algeria. Comptes Rendus Biologies
334(2): 158-167.
Moussi A., 2012 - Analyse
systématique et étude bioécologique de la faune des
acridiens (Orthoptera, Acridomorpha) de la région de Biskra,
thèse de doctorat. Université de Constantine. Algérie. 112
p.
Moussi A., Abba A., Harrat A. & Petit D. 2014.
Description of Dociostaurus biskrensis sp. nov. And male
allotypes of four species: Pamphagulus bodenheimeri dumonti, P.
uvarovi, Sphingonotus ebneri and Notopleura pygmaea
(Orthoptera: Acridoidea) in the region of Biskra, Algeria. Zootaxa
(4.4) 3755: 379-390.
Moussi A., Dey L.S., Petit D., Abba A., Klesser
R African Zoology. & Husemann M. 2018.
First genetic data for band-winged grasshoppers (Orthoptera:
Acrididae: Oedipodinae) of the Biskra region of Algeria with new records for
the country. 53(1): 31-40.
Niyukuri J., Ndayishimiye J., Nzigidahera B., Bogaert
J. & Habonimana B., 2014 - Diagnostic de l'effet lisière
dans les paysages anthropisés du secteur Rwegura dans le Parc National
de la Kibira, Burundi. Bulletin Scientifique de l'Institut National pour
l'Environnement. 13: 66-71.
Norris K., 2008 - Agriculture and
biodiversity conservation: opportunity knocks. Conservation Letters 1:
2-11.
Nouh Mefnoun A., 1997 - Contribution
à l'inventaire des plantes adventices des cultures en milieu
oasien. Journées techniques phytosanitaires, I.N.P.V., El
Harrach, Alger : 152155.
O.N.M., 2019 - Office national de la
météorologie, Rapport sur les données climatiques de
Ghardaïa, 4 p.
Ould El Hadj M.D., 1991-
Bioécologie des sauterelles et des sautériaux dans trois
zones d'étude au Sahara. Thèse Magister, Institut National
Agronomique, El Harrach, Algérie, 85 p.
Ould El Hadj M.D., 2001 - Etude du
régime alimentaire de cinq espèces d'acridiens dans les
conditions naturelles de la cuvette de Ouargla (Algérie).
Journées techniques Phytosanitaire, INPV: 303-318.
106
Références bibliographiques
Ould El Hadj M.D., 2004 - Le
Problème Acridien Au Sahara Algérien. Thèse Doctorat,
Institut National Agronomique, El Harrach, Algeria. 279 p.
Ovadia O. & Schmitz O. J., 2004 - Weather
variation and trophic interaction strength: sorting the signal from the noise.
Oecologia, 140: 398-406.
Ozenda P., 1983 : Flore du Sahara.
Ed. Centre national de recherche scientifique, Paris, 622 p.
Ozenda P., 1991 - Flore du Sahara.
3ème édition du centre national de recherche scientifique, Paris,
662 p.
Picaud F., Bonnet E., Gloaguen V. & Petit D., 2003
- Decision making for food choice by grasshoppers (Orthoptera:
Acrididae): comparison between a specialist species on a shrubby legume and
three graminivorous species. Environmental Entomology, 32: 680-688.
Picaud F., Gloaguen V. & Petit D., 2002 -
Mechanistic Aspects to Feeding Preferences in Chorthippus binotatus (Acrididae,
Gomphocerinae). Journal of Insect Behavior, Vol. 15, No. 4:
513-526.
Powell L.R., Berg A.A., Johnson D.L. & Warland
J.S., 2007 - Relationships of pest grasshopper populations in Alberta,
Canada to soil moisture and climate variables. Agricultural and Forest
Meteorology 144: 73-84.
Quezel P. & Santa S.,
1962-1963 - Nouvelle flore de
l'Algérie et des régions désertiques
méridionales. Editions C.N.R.S. Paris, Tome I et II, 1165 p.
R Development Core Team 2014 - R: A Language
and Environment for Statistical Computing. R Foundation for Statistical
Computing, Vienna, Austria.
Ramade F., 1984 - Eléments
d'écologie. Ecologie fondamentale. Ed. Mc. Graw-Hill, Paris, 379
p.
Ramade F., 2009 - Eléments
d'écologie : Ecologie fondamentale. 4ème Edition
Dunod, Paris, 689 p.
Ren J.-L., Tu, X.-B., Ge, J., Zhao, L. & Zhang,
Z.-H., 2016 - Influence of temperature on the development,
reproduction, and life table of Calliptamus italicus (L.)
(Orthoptera:Acridoidea). Journal of Asia-Pacific Entomology, 19(1):
203-207.
Sabu TK., Vinod KV. & Yobi MC., 2008 -
Life History, Aggregation and Dormancy of the Rubber Plantation Litter Beetle,
Luprops tristis, from the Rubber Plantations of Moist South Western Ghats.
Journal of Insect Science, 8(1): 1-17.
107
Références bibliographiques
Sadine SE., Bissati S. & Lourenço WR., 2016
- The first true deserticolous species of Buthus Leach, 1815 from
Algeria (Scorpiones: Buthidae); Ecological and biogeographic
considerations. Comptes rendus biologies 339 (1): 44-49.
Sadine SE., Bissati S. & Idder MA., 2018
- Diversity and structure of scorpion fauna from arid ecosystem in
Algerian Septentrional Sahara (2005-2018). Serket 16 (2): 51-59.
Salahou-Elhadj B., 2001 - Inventaire et
étude bioécologique de quelques déprédateurs de la
palmeraie de Berriane (Ghardaîa). Mémoire Ingénieur,
Inst. Nat., Agro., El Harrach, Alger, 60 p.
Sangbaramou R., Camara I., Huang X., Shen J., Tan S.
& Shi W., 2018 - Behavioral thermoregulation in Locusta
migratoria manilensis (Orthoptera: Acrididae) in response to the
entomopathogenic fungus, Beauveria bassiana. PLOS ONE,
13(11): 119
Scherrer B., 1984 - Résultat des
données. In:Biostatistique. Editeur Gaetan Morin, Louiseville,
Canada, 850 p.
Schlaepfer R. & Bütler R., 2002 -
Analyse de la dynamique du paysage, Fiche d'enseignement 4.2, École
polytechnique de Lausanne, 11 p.
Schmitz OJ. & Price JR., 2011 -
Convergence of trophic interaction strengths in grassland food webs through
metabolic scaling of herbivore biomass. Journal of Animal Ecology, 80:
1330-1336.
Schoonhoven L.M., van Loon J.J.A. & Dicke M., 2005
- Insect Plant Biology. Oxford University Press, Oxford, 421
p.
Schowalter T.D., Noriega J.A., & Tscharntke T.,
2018- Insect effects on ecosystem services - introduction. Basic
and Applied Ecology, 26: 1-8.
Scott D.W., 2009 - Sturges' rule. Wiley
Interdisciplinary Reviews: Computational Statistics, 1(3): 303-306.
Seltzer P., 1946 - Le climat de
l'Algérie, éditions "La Typo-litho" & Carbonel, Travaux
de l'Institut de météorologie et de physique du globe de
l'Algérie, Alger, 219 p.
Singer M. & Stireman J., 2001 - How
foraging tactics determine host-plant use by a polyphagous caterpillar.
Oecologia, 129: 98-105.
Song H., Amédégnato C., Cigliano M.M.,
Desutter-Grandcolas L., Heads S. W., Huang Y., Otte D. & Whiting M.F., 2015
- 300 million years of diversification: elucidating the patterns of
Orthopteran evolution based on comprehensive taxon and gene sampling.
Cladistics 31: 621-651.
108
Références bibliographiques
Song H., Mariño-Pérez R., Woller D. A.
& Cigliano M. M., 2018- Evolution, Diversification, and
Biogeography of Grasshoppers (Orthoptera: Acrididae). Insect Systematics
and Diversity 2: 1-25.
Song H., 2018 - Biodiversity of Orthoptera.
Insect Biodiversity, 245-279.
Squitier J.M. & Capinera J.L., 2002 -
Host Selection by Grasshoppers (Orthoptera: Acrididae) inhabiting semi-aquatic
environments, Florida Entomologist, 85(2):336340.
Stauffer TW. & Whitman DW., 1997 -
Grasshopper Oviposition. In: Gangwere S.K., Muralirangan M.C.,
Muralirangan M. (Eds).The Bionomics of Grasshoppers, Katydids and Their Kin.
CAB International, Wallingford, UK, 231- 280.
Steedman A., 1990 - Locust Handbook.
Natural resources Institute, Chatham, United Kingdom, 204 p.
Stewart P., 1969 - Un nouveau Climagramme
pour l'Algérie et son application au barrage vert. Le Bulletin de la
Société d'histoire naturelle d'Afrique du Nord, 65 : 1-2.
Stiedl O. & Bickmeyer U., 1991 - Acoustic
behaviour of Ephippiger ephippiger fiebig (Orthoptera, Tettigoniidae)
within a habitat of Southern France. Behavioural Processes, 23(2):
125-135.
Tarai N., 1991 - Contribution à
l'étude bioécologique des peuplements Orthoptérologique
dans la région de Biskra, Algérie et régime alimentaire
d'Aiolopus thalassinus (Fabricius, 1781). Mémoire. Ingénieur
Agronome, INA, El Harrach, Algérie, 66 p.
Tarai N., 1994 - Régime
alimentaire d'Aiolopus thalassinus (Fabricius, 1781) et Acrotylus patruelis
(Herrich-Schäffer, 1838) dans la région de Biskra.
Thèse Magister, Agro. Institut National agronomique, El Harrach, 98
p.
Tarai N. & Doumandji S., 2009 - Feeding
preferences of gregarious nymphs and adults of the Desert locust,
Schistocerca gregaria Forskal (Orthoptera,
Cyrtacanthacridinae) in different habitats at Biskra oasis, Algeria.
Advances in Environmental Biology, 3(3): 308-313.
Tartoura M., 2013 - Impact des Mantodea
dans les équilibres en milieux naturels et cultivés dans la
vallée du M'Zab. Thèse de Magister, Université
d'Ouargla, 112p.
Terra B.R., Gatti F.D., Carneiro M.A.A. & Costa
M.K.M., 2017 - The grasshoppers (Orthoptera: Caelifera) of the
grasslands in the southern portion of the Espinhaço Range, Minas Gerais,
Brazil. Check List 13, 2052: 1-17.
109
Références bibliographiques
Tirichine A., Belguedj M., Benkhallfa A. &
Guerradp M., 2009 - Identification, classification et sélection
de la diversité génétique du palmier dattier (phoenix
Dactylifera L.). Cas des palmeraies de la région du Mzab.
Recherche Agronomique,Volume 1, Numéro 25, 75-87
Toutain J., 1979 - Eléments
d'Agronomie Saharienne, de la recherche au développement. Ed.
I.N.R.A., Cellule des zones arides, GRET, Paris, 296 p.
Tu X., Zhang Z., Dan L. Johnson Cao G., Li Z., Gao S.
. . . & Wang G., 2012 - Growth, development and daily change in
body weight of Locusta migratoria manilensis (Orthoptera: Acrididae)
nymphs at different temperatures. Journal of Orthoptera Research,
21(2): 133-140.
Ugland KI., Gray JS. & Ellingsen KE., 2003
- The species-accumulation curve and estimation of species richness.
Journal of Animal Ecology, 72: 888-897
Voisin J.F., 1986 - Une méthode simple
pour caractériser l'abondance des orthoptères en milieux
ouverts. L'Entomologiste, 42: 113-119.
Walton C., Hardwick L. & Hanson J., 2003
- 'Locusts in Queensland'. Pest Status Review Series - Land
Protection, Department of Natural Resources and Mines, Qld: Brisbane, 45 p.
Warren R. J. & Chick L., 2013 - Upward
ant distribution shift corresponds with minimum, not maximum, temperature
tolerance. Global Change Biology, 19(7): 2082-2088.
Weiss N., Zucchi H. & Hochkirch A., 2012
- The effects of grassland management and aspect on Orthoptera
diversity and abundance: site conditions are as important as management.
Biodiversity and Conservation, 22: 2167-2178.
WMO & FAO, 2016 - Weather and Desert
Locusts. No. 1175, Geneva. 48 p.
Wysiecki M. L., Arturi M., Torrusio S. & Cigliano
M. M., 2011- Influence of weather variables and plant communities on
grasshopper density in the Southern Pampas, Argentina. Journal of Insect
Science 11 : 1-14.
Yagoub I., 1995 - Bioécologie des
peuplements Orthoptéroloqiques dans trois milieux : cultive, palmeraie
et terrain nu à Ghardaïa. Mémoire d'ingénieur
agronome, INA, El Harrach, Alger, 63 p.
Yang H.J., Li Y., Wu M.Y., Zhang Z., Li L.H. & Wan
S.Q., 2011 - Plant community responses to nitrogen addition and
increased precipitation: the importance of water availability and species
traits. Global Change Biology, 17: 2936-2944.
110
Références bibliographiques
Zaime A. & Gautier J.Y., 1989 -
Comparaison des régimes alimentaires de trois espèces
sympatriques de Gerbillidae en milieu saharien, au Maroc. Revue d'Ecologie
(Terre & Vie), 44, 153-163.
Zaim A., Petit D. & El Ghadraoui L., 2013
- Dietary diversification and variations in the number of labrum
sensilla in grasshoppers: Which came first?, Journal of biosciences,
38(2): 339-349.
Zergoun Y. 1991. Contribution à
l'étude bioécologique des peuplements Orthoptérologique
dans la région de Ghardaïa. Mémoire d'ingénieur
agronome Institut National d'Agronomique d'El-Harrach, Algeria, 73 p.
Zergoun Y. 1994. Bioécologie des
Orthoptères dans la région de Ghardaïa et régime
alimentaire d'Acrotylus patruelis (Herrich - Schaeffer, 1838) [Orthoptera
Acrididae]. Thèse de Magister, Institut National d'Agronomie
d'El-Harrach, Algeria, 110 p.
Zergoun Y., Guezoul O., Sekour M., Bouras N. &
Holtz M.D., 2018a - Species composition, abundance and diversity of
grasshoppers (Insecta: Orthoptera) in three date palm groves in the Mzab
valley, Northern Sahara, Algeria. Ciencia e Tecnica Vitivinicola
journal, Vol. 33, no 10: 97-111.
Zergoun Y., Guezoul O., Sekour M., Bouras N. &
Holtz M.D., 2018b - Effects of temperatures and rainfall variability
on the abundance and diversity of Caelifera (Insecta, Orthoptera) in three
natural environments in the Mzab Valley, Septentrional Sahara (Algeria).
Tunisian Journal of Plant Protection 13 (2): 217-228.
Zergoun Y., Guezoul O., Sekour M., Bouras N. &
Holtz M.D., 2019 - Acridid (Orthoptera: Caelifera) diversity in
agriculture ecosystems at three locations in the Mzab valley, Septentrional
Sahara, Algeria. Journal of Insect Biodiversity 009 (1): 018-027.
Zhu H., Qu Y., Zhang D., Li J., Wen M., Wang D. &
Ren B., 2017 - Impacts of grazing intensity and increased
precipitation on a grasshopper assemblage (Orthoptera: Acrididae) in a meadow
steppe. Ecological Entomology, 42(4): 458-468.
Zografou K., Sfenthourakis S., Pullin A., & Kati
V., 2009 - On the surrogate value of red-listed butterflies for
butterflies and grasshoppers: a case study in Grammos site of Natura 2000,
Greece. Journal of Insect Conservation 13: 505-514.
Zografou K., Adamidis G.C., Komnenov M., Kati V.,
Sotirakopoulos P., Pitta E. & Chatzaki M., 2017 - Diversity of
spiders and Orthopterans respond to intra-seasonal and spatial environmental
changes. Journal of Insect Conservation 21: 531-543.
ANNEXES
Annexe 1
Tableau 6 - Liste des principales espèces
végétales de la région de Ghardaïa
|
Familles
|
Espèces
|
|
Arecaceae
|
Phoenix dactylifera L.
|
|
Rutaceae
|
Citrus sinensis (L.) Osbeck
|
|
Oleaceae
|
Olea europaea L.
|
|
Vitaceae
|
Vitis vinifera L.
|
|
Rosaceae
|
Prunus armeniaca L.
|
|
Moraceae
|
Ficus carica L.
|
|
Lythraceae
|
Punica granatum L.
|
|
Cucurbitaceae
|
Lagenaria siceraria (Molina) Standl.
|
|
Cucurbita maxima Duchesne
|
|
Cucumis melo L.
|
|
Citrullus colocynthis (L.) Schrad.
|
|
Solanaceae
|
Capsicum annuum L.
|
|
Solanum melongena L.
|
|
Solanum lycopersicum L.
|
|
Lamiaceae
|
Mentha pulegium L.
|
|
Salvia aegyptiaca L.
|
|
Fabaceae
|
Medicago sativa L.
|
|
Poaceae
|
Cynodon dactylon (L.) Pers.
|
|
Setaria verticillata (L.) P.Beauv.
|
|
Polypogon monspeliensis (L.) Desf.
|
|
Digitaria commutata (Schult.) Schult.
|
|
Dactyloctenium aegyptium (L.) Willd.
|
|
Anisantha sterilis (L.) Nevski
|
|
Lolium multiflorum Lam.
|
|
Hyparrhenia hirta (L) Stapf
|
|
Hordeum murinum L.
|
|
Hordeum vulgare L.
|
|
Agrostis stolonifera L.
|
|
Stipagrostis plumosa (L.) Munro
|
|
Stipagrostis pungens (Desf.) De Winter
|
|
Phragmites australis (Cav.) Trin. ex Steud.
|
|
Cyperaceae
|
Cyperus rotundus L.
|
|
Apiaceae
|
Ferula communis L.
|
|
Deverra denudata (Viv.) Pfisterer & Podlech
|
|
Brassicaceae
|
Zilla spinosa Prantl
|
|
Henophyton deserti Coss. & Durieu
|
|
Farsetia aegyptiaca Turra
|
|
Cleomaceae
|
Cleome arabica L.
|
|
Thymelaeaceae
|
Thymelaea microphylla Coss. & Durieu
|
|
Boraginaceae
|
Echium pycnanthum Pomel
|
|
Colchicacaea
|
Androcymbium wyssianum Beau. & Turrett
|
|
Apocynaceae
|
Pergularia tomentosa L.
|
|
Nitrariaceae
|
Peganum harmala L.
|
|
Asteraceae
|
Sonchus oleraceus L.
|
|
Crepis capillaris (L.) Wallr.
|
|
Echinops spinosus L.
|
|
Convolvulaceae
|
Convolvulus arvensis L.
|
|
Amaranthaceae
|
Amaranthus hybridus L.
|
|
Hammada scoparia (Pomel) Iljin
|
|
Zygophyllaceae
|
Tribulus terrestris L.
|
|
Tetraena alba (L.f.) Beier & Thulin
|
|
Neuradaceae
|
Neurada procumbens L.
|
|
Polygonaceae
|
Rumex vesicarius L.
|
|
Malvaceae
|
Malva parviflora L.
|
|
Abelmoschus esculentus (L.) Moench.
|
|
Thymelaeaceae
|
Thymelaea microphylla Coss. & Durieu
|
Quezel et Santa (1962), Ozenda (1983,
1991), Zergoun (1994), Salahou-Elhadj
(2001)
Annexe 2
Tableau 7 - Liste des principales espèces
aviennes de la région de Ghardaïa
|
Familles
|
Espèces
|
Noms communs
|
|
Hirundinidae
|
Hirundo rustica (Linnaeus, 1771).
|
Hirondelle de cheminée
|
|
Delichon urbica (Linnaeus, 1771).
|
Hirondelle de fenêtre
|
|
Turdidae
|
Luscinia luscinia (Linnaeus, 1758)
|
Rossignol progné
|
|
Phoenicurus phoenicurus (Linnaeus, 1758)
|
Rouge queue à front blanc
|
|
Muscicapidae
|
Cercotrichas galactotes (Temminck, 1820)
|
Agrobate roux
|
|
Oenanthe leucura (Gmelin, 1789)
|
Traquet rieur
|
|
Oenanthe leucopyga (Brehm, 1855)
|
Traquet à tête blanche
|
|
Oenanthe deserti (Temminck, 1825)
|
Traquet de désert
|
|
Oenanthe moesta (Lichtenstein, 1823)
|
Traquet à tête grise
|
|
Oenanthe monacha (Temminck, 1825)
|
Traquet à capuchon
|
|
Muscicapa striata (Pallas, 1764)
|
Gobe mouche gris
|
|
Embrizidae
|
Emberiza striolata (Lichtenstein, 1823)
|
Bruant striolet
|
|
Fringilidae
|
Carduelis carduelis (Linnaeus, 1758)
|
Chardonneret
|
|
Corvidae
|
Corvus corax (Linnaeus, 1758)
|
Grand corbeau
|
|
Corvus ruficolis (Lesson, 1830)
|
Corbeau brun
|
|
Laniidae
|
Lanius excubitor (Linnaeus, 1758)
|
Pie grièche grise
|
|
Lanius senator (Temminck, 1758)
|
Pie grièche à tête rousse
|
|
Passeridae
|
Passer domesticus (Linnaeus, 1758)
|
Moineau domestique
|
|
Passer montanus (Linnaeus, 1758)
|
Moineau friquet
|
|
Alaudidae
|
Galerida cristata (Linnaeus, 1758)
|
Cochevis huppé
|
|
Motacillidae
|
Anthus gustavi Swinhoe, 1863
|
Pipit de la petchora
|
|
Anthus pratensis (Linnaeus, 1758)
|
Pipit farlouse
|
|
Anthus campestris (Linnaeus, 1758)
|
Pipit rousseline
|
|
Motacilla alba Linnaeus, 1758
|
Bergeronnette grise
|
|
Motacilla flava Linnaeus, 1758
|
Bergeronnette printanière
|
|
Columbidae
|
Columba livia (Banaterre, 1790)
|
Pigeon biset
|
|
Streptopelia turtur (Linnaeus, 1758)
|
Tourterelle de bois
|
|
Streptopelia senegalensis (Linnaeus, 1766)
|
Tourterelle des palmiers
|
|
Ciconiidae
|
Ciconia ciconia (Linnaeus, 1758)
|
Cigogne blanche
|
|
Upupidae
|
Upupa epops (Linnaeus, 1758)
|
Huppe faciée
|
|
Meropidae
|
Merops supersiliosus (Linnaeus, 1766)
|
Guêpier de pers
|
|
Merops apiaster (Linnaeus, 1758)
|
Guêpier d'Europe
|
|
Phasianidae
|
Alectoris barbara (Linnaeus, 1758)
|
Perdrix gambra
|
|
Accipitridae
|
Buteo rufinus (Cretzschmar, 1827)
|
Buse féroce
|
|
Circaetus gallicus (Gmelin, 1788)
|
Circaète jean-le-Blanc
|
|
Accipiter nisus (Linnaeus, 1758)
|
Epervier d'Europe
|
|
Falconidae
|
Falco naumanni Fleischer, 1818
|
Faucon crécerellette
|
|
Strigidae
|
Asio otus (Linnaeus, 1758)
|
Hibou moyen duc
|
|
Asio flammeus (Pontoppidan, 1763)
|
Hibou des marais
|
|
Bubo ascalaphus (Savigny, 1809)
|
Hibou grand-duc
|
|
Otus scops (Linnaeus, 1758)
|
Hibou petit duc
|
|
Athene noctua (Scopoli, 1769)
|
Chouette chevêche
|
(Guezoul et al., 2008 et Guezoul et
al., 2011)
Annexe 3
Fiche de terrain pour un inventaire d'Orthoptères
Observateur(s) : Date : / / 20 - Heure de début : Heure de
fin :
Commune :
Lieu-dit :
Milieu de prospection :
Coordonnées en degré : E N
Climat : Ensoleillé nuageux Froid Chaud Température
Vent
Remarque :
|
Espèces
|
L
|
A/F
|
A/M
|
Nombres
|
Plante hôte
|

L : Larves ; AF : Adulte Femelle ; AM : Adulte Mâle
Annexe 4
Codes des espèces d'Orthoptères inventoriés
dans la vallée du M'Zab
|
Espèces
|
Codes
|
|
Acrida turrita
|
Actu
|
|
Truxalis nasuta
|
Trna
|
|
Schistocerca gregaria
|
Scgr
|
|
Dericorys millierei
|
Demi
|
|
Anacridium aegyptium
|
Anae
|
|
Calliptamus barbarus
|
Caba
|
|
Notopleura saharica
|
Nosa
|
|
Heteracris adspersa
|
Head
|
|
Heteracris annulosa
|
Hean
|
|
Heteracris harterti
|
Heha
|
|
Heteracris littoralis
|
Heli
|
|
Heteracris minuta
|
Hemi
|
|
Ochrilidia filicornis
|
Ocfi
|
|
Ochrilidia geniculata
|
Ocge
|
|
Ochrilidia gracilis
|
Ocgr
|
|
Ochrilidia harterti
|
Ocha
|
|
Omocestus africanus
|
Omaf
|
|
Omocestus lucasii
|
Omlu
|
|
Aiolopus puissanti
|
Aipu
|
|
Aiolopus simulatrix
|
Aisi
|
|
Aiolopus strepens
|
Aist
|
|
Acrotylus longipes
|
Aclo
|
|
Acrotylus patruelis
|
Acpa
|
|
Hyalorrhipis calcarata
|
Hyca
|
|
Hilethera aeolopoides
|
Hiae
|
|
Locusta migratoria
|
Lomi
|
|
Morphacris fasciata
|
Mofa
|
|
Oedaleus senegalensis
|
Oese
|
|
Sphingoderus carinatus
|
Spca
|
|
Sphingonotus azurescens
|
Spaz
|
|
Sphingonotus pachecoi
|
Sppa
|
|
Sphingonotus Paradoxus
|
Sppr
|
|
Sphingonotus obscuratus lameerei
|
Spob
|
|
Sphingonotus octofasciatus
|
Spoc
|
|
Sphingonotus rubescens
|
Spru
|
|
Sphingonotus savignyi
|
Spsa
|
|
Vosseleriana fonti
|
Vofo
|
|
Eunapiodes sp
|
Eusp
|
|
Pyrgomorpha cognata
|
Pycg
|
|
Pyrgomorpha conica
|
Pyco
|
|
Tenuitarsus angustus
|
Tean
|
|
Tuarega insignis
|
Tuin
|
|
Tmethis cisti
|
Tmci
|
|
Tropidopola cylindrica
|
Trcy
|
|
Paratettix meridionalis
|
Pame
|
|
Conocephalus fuscus
|
Cofu
|
|
Phaneroptera nana
|
Phna
|
Annexe 5
Publications scientifiques internationales
1 - Zergoun Y., Guezoul, O., Sekour M.,
Bouras N., & Holtz M.D., 2019 - Acridid (Orthoptera: Caelifera) diversity
in agriculture ecosystems at three locations in the Mzab valley, Septentrional
Sahara, Algeria. Journal of Insect Biodiversity 009 (1): 018-027
2 - Zergoun Y., Guezoul O., Sekour M., Bouras
N., & Holtz M.D., 2018 - Effects of temperatures and rainfall variability
on the abundance and diversity of Caelifera (Insecta, Orthoptera) in three
natural environments in the Mzab Valley, Septentrional Sahara (Algeria).
Tunisian Journal of Plant Protection 13 (2): 217-228.

J. Insect Biodiversity 009 (1):
018-027
https://www.mapress.com/j/jib
Copyright (c) 2019 Magnolia Press
ISSN 2538-1318 (print edition)

J. Insect Biodiversity
Article ISSN 2147-7612 (online edition)
http://dx.doi.org/10.12976/jib/2019.09.1.2
http://zoobank.org/urn:lsid:zoobank.org:pub:A7AEFA7F-942E-47F9-8B7F-3B776D34842B
Acridid (Orthoptera: Caelifera) diversity in agriculture
ecosystems at three locations in the Mzab valley, Septentrional Sahara,
Algeria
YOUCEF ZERGOUN1,2, OMAR GUEZOUL1, MAKHLOUF
SEKOUR1, NOUREDDINE BOURAS3* & MICHAEL
D. HOLTZ4
1Laboratoire des Bio-ressources
Sahariennes: Préservation et Valorisation, Département des
Sciences Agronomiques, Faculté des Sciences de la Nature et de la Vie et
Sciences de la Terre. Université Kasdi Merbah - Ouargla, BP 511, Ouargla
30000, Algeria. 2Département des Sciences Agronomiques,
Faculté des Sciences de la Nature et de la Vie et Sciences de la Terre,
Université de Ghardaïa, 47000 Ghardaïa, Algeria.
3Département de Biologie,
Faculté des Sciences de la Nature et de la Vie et Sciences de la Terre,
Université de Ghardaïa, 47000 Ghardaïa, Algeria.
4Field Crop Development Centre, Alberta
Agriculture and Forestry, 5030 - 50 Street, Lacombe, Alberta T4L1W8, Canada.
E-mail:
noureddine_bouras@yahoo.fr
Abstract
Caelifera is one of the largest and most diverse group of
insects, and they are the dominant Orthoptera in agriculture ecosystems. We
present here an inventory of Acridid fauna of the agricultural ecosystems in
the Mzab valley (Septentrional Sahara, Algeria). Grasshoppers were sampled with
quadrats in Béni Isguen, Ghardaïa and El-Atteuf, and we have
expressed the species richness, sampling effort and relative abundance. The
method used is that of quadrats sampling. The results revealed the presence of
27 species, divided into three families, Acrididae, Pyrgomorphidae and
Tetrigidae. Among these families, we found that Acrididae are most diverse with
six subfamilies. The subfamily Oedipodinae with 10 species was the most
abundant, while the subfamily Tetriginae was the least abundant (represented by
a one species). The value of the diversity index showed that the cultivated
area of Béni Isguen is the most favorable for the development of many
Caelifera. The abundance of grasses and low intensity of agricultural activity
in this environment favors the presence of Acridid. We found that the Acridid
community depends mainly on the nature and richness of vegetation cover, the
intensity of agricultural activity and the type of irrigation.
Keywords: Grasshopper, agricultural ecosystem,
biodiversity, North Africa, Sahara
Introduction
Currently, the number of Orthoptera species described
worldwide is about 28159 species (Eades et al. 2018). Acridoidea is
the notable superfamily of the suborder Caelifera having 518 species (Yadav
et al. 2017). Furthermore, 241 species of Orthoptera Acridomorpha
Dirsh 1975 have been listed for Morocco, Algeria, Tunisia and the Western
Sahara (Louveaux et al. 2013). Algeria has about 114 Orthoptera,
including 98 Caeliferans. A significant part of Algeria is inhabited by
grasshoppers. These insects are one of important pests since the onset of
agriculture. They can cause great damage to agricultural production when
climatic conditions are conductive to their multiplication. Therefore, it is
necessary to have comprehensive knowledge of all grasshopper species that occur
in an area (Benkenana & Harrat 2009). Given the danger of these Acridids,
several studies have been carried out all over the world, including Algeria. We
cite among others those of Chopard (1943), Dirsh (1965), Zergoun (1991, 1994),
Doumandji-Mitiche et al. (2001), Ould El Hadj (2002), Maurel (2008),
Benfekih et al. (2011), Guendouz-Benrima et al. (2011),
Moussi et al. (2011, 2014, 2018), Louveaux et al. (2013),
Massa (2013) and Defaut (2017). However, the grasshopper fauna of Algeria in
general and of the Sahara in particular needs more studies; because the only
species that are well-studied are the gregarious and economically important
species such as the migratory locust Locusta migratoria (Linnaeus,
1758), the desert locust Schistocerca gregaria (Forskål, 1775),
and the Moroccan locust Dociostaurus maroccanus (Thunberg 1815). The
objectives of these investigations of the grasshoppers in agriculture
ecosystems of Mzab valley
18 Accepted by Petr Kocarek: 7 Feb. 2019;
published: 28 Feb. 2019
ACRIDID DIVERSITY IN AGRICULTURE ECOSYSTEMS J. Insect
Biodiversity 009 (1) (c) 2019 Magnolia Press
·
19
were to (i) investigate grasshopper species composition of
three studied sites, (ii) found the abundance and diversity of grasshopper
species in studied sites, (iii) demonstrate the effect of vegetation cover, the
intensity of agricultural activity and the type of irrigation on the richness
and diversity of Caelifera.
Materials and methods
Study area
The study was conducted in three different localities of the
Mzab valley : N'tissa (Béni Isguen), Touzouz (Ghardaïa) and
El-Djaoua (El-Atteuf). The Mzab valley is located in the Septentrional Sahara
(northern Algerian Sahara). Its elevation is 483.63 m above mean sea level,
between 32° to 33° north latitude and between 3° to 4° east
longitude (Fig. 1).

Figure 1. Geographic location of the surveyed
sites in the Mzab valley, Septentrional Sahara (Mzab valley, Ghardaïa
province, Algeria).
The choice of studied sites is based on the variability in
three criteria: vegetation cover, agricultural intensity and irrigation. At
each study site, the floristic composition was determined by visual survey of a
randomly placed quadrat of 500 m2. For each plant, the cover was
estimated by calculating of the surface area occupied by the orthogonal
projection of the aerial part, according to Duranton et al. (1982).
Agricultural intensity was quantified by the percentage of agricultural crops.
Humidity was quantified by the frequency and amount of irrigation. The study of
the Acridid fauna was conducted in three different localities: N'tissa
(Béni Isguen), Touzouz (Ghardaïa) and El-Djaoua (El-Atteuf).
Béni Isguen (S1): latitude 32° 44' North, and
longitude 3° 65' East. The surface area of the site is about 2 hectares.
The vegetal cover is mainly composed of date palms (Phoenix
dactylifera), fruit trees (Citrus sinensis (L.) Osbeck and
Vitis vinifera L.) and vegetable crops (Cucurbita siceraria
(Molina) Standl., Cucurbita maxima Duchesne, Citrullus
lanatus (Thunb.) Matsum. & Nakai and Cucumis melo L.) cover
25%. Also there was an abundance of weeds, 30% is covered by Cynodon
dactylon (L.) Pers., Setaria verticillata (L.) P. Beauv,
Polypogon monspeliensis (L) Desf., Hyparrhenia hirta (L)
Stapf and Stipagrostis plumosa (L.) Munro ex Anderson. The intensity
of agricultural activity is low; irrigation is irregular.
Ghardaïa (S2): latitude 32° 51' North and longitude
3° 59' East. The surface of the site is 6 hectares. Among the plants, we
find date palm (Phoenix dactylifera L.), citrus fruits (Citrus
sinensis (L.) Osbeck), olive trees (Olea europaea L.), and
vegetable crops (Cucurbita siceraria (Molina) Standl., Cucurbita
maxima Duchesne, Citrullus lanatus (Thunb.) Matsum. & Nakai
and Cucumis melo L.) cover 50%. The Poaceae cover 15% (Cynodon
dactylon (L.) Pers., Setaria verticillata (L.) P. Beauv and
Polypogon monspeliensis (L) Desf.) and are located under the trees.
The intensity of agricultural activity is average. Irrigation is normal and is
done by drip system.
El-Atteuf (S3): latitude 32° 44' North, and longitude
3° 72' East. The surface of the site is 4 hectares. The vegetation is
dominated by forage crops (Medicago sativa L. and Hordeum vulgare
L.) which cover 50%, date palm (Phoenix dactylifera L.) and vines
(Vitis vinifera L.) cover 30% and a few weeds (Cynodon dactylon
(L.) Pers. and Setaria verticillata (L.) P. Beauv) cover 5%. The
intensity of agricultural activity is strong. Irrigation is by sprinkler
irrigation for forage crops (alfalfa and barley) and drip irrigation for other
crops (fruit and vegetables).
20
· J. Insect Biodiversity
009 (1) (c) 2019 Magnolia Press ZERGOUN ET AL.
This Saharan region is characterized by a dry and cold climate
in winter and dry, hot summers. Precipitation in the Mzab region are weak and
irregular. The main rains occur in autumn. Rainfall is very rare during the
whole year (less than 70 mm per annum). During summer, the air relative
humidity falls to as low as 10%, resulting in a strong evaporation. However, in
winter it rises up to 48.6%. In the Mzab region, there are two types of winds:
north-west dominant sand-laden winds and south-north dominant hot and dry winds
(named sirocco). The highest wind speeds occur in the month of April and are in
the range of (14.4 m/s). The climatic data were collected over the period 2007-
2016 from the Office of Algerian meteorology. We used the ombrothermic diagram
of Bagnouls & Gaussen (1953), which defines empirically a dry month as when
the total precipitation (in mm) recorded during a month is lower or equal to
double the average temperature (in °C) of the same month. For the area
considered (2007-2016), the dry season lasts 12 months (Fig. 2).

Figure 2. Graphical representation of
T°-P Ombrothermic diagram (2007-2016) in the Mzab valley, Ghardaïa
province, Algeria (National Office of Meteorology, Ghardaïa).
Sampling and identification
Methods for Orthoptera sampling are numerous and very diverse
(Lamotte & Bourlière 1978; Voisin 1980, 1986; Gillon 1974). In the
present study, the selected method is that of quadrats, the most frequently
reported method used for biodiversity studies of terrestrial ecosystems. The
method used for surveying grasshoppers in this study is reported by Gardiner
et al. (2002). The size of the quadrats used in the survey was 25
m2 (5×5 m). Ten quadrats were positioned at random in one
hectare plot at each study site. The corners of each quadrat were marked using
poles without the observer disturbing the grasshoppers within by casting
shadows. Each plot at the study sites was surveyed to ascertain grasshopper
abundance and species richness. Samplings were carried out very early in the
morning, between 7:00 a.m. and 9:00 a.m. in summer, and between 9:00 a.m. and
11:00 a.m. in winter, when the insects were still immobilized on the ground.
For each site, the quantitative measure of acridian density was carried out
using the quadrats method. The total number of individuals belonging to each
species was counted in quadrats (25 m2). The counting in the
quadrats were repeated ten times for each site and day of sampling. Density
from each site has been reported as grasshopper per 100 m2.
Acridid were collected by sweeping a hand net. A standard net
of 40 cm in diameter having a depth of 60 cm with a 90 cm long wooden handle
was used for sample collecting. Grasshoppers were collected in the different
localities once a month in each ecosystem from January to December 2017. The
collected specimens were killed using ethyl acetate and properly stretched,
pinned and labeled. Specimen identification up to the species level was done
with the aid of the taxonomic keys of Chopard (1943); Dirsh (1965), and also
Catalogue and keys of the Acridomorpha (Insecta, Orthoptera) from North West
Africa (Louveaux et al. 2018).
Data analysis
Relative abundance of grasshopper species was calculated as
the number of individuals of species i relative to the total number of
individuals of all species collected at each site.
Richness, number of individuals of species, species diversity
and evenness (Shannon-Weiner index and evenness index) of the grasshopper
community was evaluated with the help of statistical package Past 3.4 (Hammer
et al. 2014). Species richness estimates with 95% confidence intervals
for the estimators Sest (analytical) and Chao1 Classic based
ACRIDID DIVERSITY IN AGRICULTURE ECOSYSTEMS J. Insect
Biodiversity 009 (1) (c) 2019 Magnolia Press
·
21
on 100 randomized samples for the data of Caelifera sampled
was applied. Estimated species richness was calculated with the program
EstimateS 9.1.0 (Colwell 2013). An Analysis of Similarities ANOSIM (Clarke
1993) was used to test if the differences in structure and composition of
grasshopper communities in each site and throughout the year were significant.
The Bray-Curtis coefficient was used as a distance measure. We used
Kruskal-Wallis non-parametric one-way analysis of variance to test for
differences among the disturbance categories in grasshopper species richness
and grasshopper diversity. Except as otherwise noted, all statistics were
performed using R version 2.15.3 (R Core Team 2013). All data transformations
and graphs were done in Excel. P values of 0.05 or smaller were interpreted as
significant.
Results
During 36 surveys in the 3 studied sites of the Mzab valley, a
total of 5255 Acridid specimens, representing 27 species were recorded in 360
quadrats. Identification of these specimens showed that 23 species belonged to
the Acrididae, 3 to the Pyrgomorphidae and one to the Tetrigidae. Twenty three
Acrididae grasshoppers could be separated into 6 subfamilies and 13 genera,
while the 3 Pyrgomorphidae could be grouped into one subfamily and two genera.
The Tetrigidae is represented by a single sub-family and a single genus. A list
of short-horn grasshopper species found in the 3 studied habitats during our
12-month sampling period is presented in Table 1.
Table 1. Inventory and relative abundance (%)
of short-horn grasshopper species of agriculture ecosystem in three localities
from the Mzab valley (Septentrional Sahara, Algeria).
|
Family
|
Subfamily
|
Species
|
S1
|
S2
|
S3
|
|
Tetrigidae
|
Tetriginae
|
Paratettix meridionalis (Rambur, 1839)
|
0.57
|
-
|
1.18
|
|
Acrididae
|
Acridinae
|
Acrida turrita (Linnaeus, 1758)
|
4.21
|
2.23
|
4.27
|
|
|
Truxalis nasuta (Linnaeus, 1758)
|
1.42
|
0.56
|
-
|
|
Calliptaminae
|
Calliptamus barbarus (Costa, 1836)
|
0.06
|
-
|
-
|
|
Eremogryllinae
|
Notopleura saharica Krauss, 1902
|
0.62
|
0.45
|
-
|
|
Eyprepocnemidinae
|
Heteracris adspersa (Redtenbacher, 1889)
|
0.91
|
-
|
-
|
|
|
Heteracris annulosa Walker, 1870
|
3.69
|
3.44
|
3.22
|
|
|
Heteracris harterti (Bolivar, 1913)
|
1.48
|
-
|
-
|
|
|
Heteracris littoralis (Rambur, 1838)
|
1.82
|
1.01
|
1.44
|
|
|
Heteracris minuta (Uvarov, 1921)
|
0.51
|
-
|
-
|
|
Gomphocerinae
|
Ochrilidia filicornis (Krauss, 1902)
|
1.48
|
2.53
|
2.30
|
|
|
Ochrilidia geniculata (Bolivar, 1913)
|
3.58
|
4.51
|
9.39
|
|
|
Ochrilidia gracilis (Krauss, 1902)
|
17.68
|
16.82
|
15.96
|
|
|
Ochrilidia harterti (Bolivar, 1913)
|
4.77
|
9.88
|
-
|
|
Oedipodinae
|
Aiolopus puissanti Defaut, 2005
|
1.88
|
2.03
|
3.74
|
|
|
Aiolopus simulatrix (Walker, 1870)
|
2.67
|
1.47
|
2.56
|
|
|
Aiolopus strepens (Latreille, 1804)
|
12.28
|
7.87
|
10.84
|
|
|
Acrotylus longipes (Charpentier, 1845)
|
2.10
|
1.21
|
2.23
|
|
|
Acrotylus patruelis (Herrich-Schäffer, 1838)
|
13.13
|
14.89
|
14.32
|
|
|
Hilethera aeolopoides (Uvarov, 1922)
|
0.51
|
1.52
|
0.06
|
|
|
Locusta migratoria (Fabricius, 1781)
|
-
|
0.15
|
-
|
|
|
Morphacris fasciata (Thunberg, 1815)
|
9.61
|
10.43
|
15.11
|
|
|
Sphingoderus carinatus (Saussure, 1888)
|
-
|
0.56
|
-
|
|
|
Sphingonotus azurescens (Rambur, 1838)
|
-
|
1.11
|
-
|
|
Pyrgomorphidae
|
Pyrgomorphinae
|
Pyrgomorpha cognata Krauss, 1877
|
7.50
|
9.27
|
8.01
|
|
|
Pyrgomorpha conica (Olivier, 1791)
|
6.93
|
8.05
|
5.32
|
|
|
Tenuitarsus angustus (Blanchard, 1836)
|
0.57
|
-
|
-
|
|
03
|
08
|
27
|
100
|
100
|
100
|
S1: N'tissa (Béni Isguen), S2: Touzouz (Ghardaïa),
S3: El-Djaoua (El-Atteuf).
Overall, the species found regularly in the surveys are also
the most abundant in terms of frequency. Species richness was higher at sites 1
and 2 compared to site 3. Béni Isguen was the richest site with 24
species, followed by Ghardaïa (21 species). El-Atteuf was the least rich,
with only 16 species.
Non-parametric methods for estimating the true species
richness indicated that the inventory for each habitat was complete. The
accumulation curves for all species stabilized by the 12th survey
for the three sites (Fig. 3).

22
· J. Insect Biodiversity
009 (1) (c) 2019 Magnolia Press ZERGOUN ET AL.
Figure 3. Sample-base rarefaction curve (with
95% confidence intervals) for the estimated species richness in the three study
areas (Béni Isguen, Ghardaïa and El-Atteuf).
Species richness was higher at sites 1 and 2 compared to site
3. At Béni Isguen and Ghardaïa, presence of adventitious vegetation
has favored the increased total richness of Caelifera. Béni Isguen
seemed to be the richest site with 24 species; it is followed by Ghardaïa
with 21 species. El-Atteuf was the least rich, with only 16 species. The
relative abundance of Acridid population among the localities surveyed (Table
1) indicated that populations of Acrotylus patruelis, Aiolopus
strepens, Morphacris fasciata, Ochrilidia gracilis and
Pyrgomorpha cognata, were dominant at the three localities with
16.86%, 14.14%, 11.51%, 10.20% and 8.31% frequencies, respectively. The
Shannon-Wiener index confirms these results, with the highest value (2.65 bits)
reported at Béni Isguen and the lowest value (2.43 bits) recorded at
El-Atteuf (Table 2). In addition, El-Atteuf seems to be more balanced (E =
0.87), followed by Ghardaïa and Béni Isguen with 0.84 and 0.83,
respectively. The diversity index shows a somewhat variable result in different
seasons. The diversity index was highest between March and October and lowest
during winter in the three sites studied. On the other hand, the equitability
index was highest in winter. The lowest equitability index was observed during
late summer and autumn.
Table 2. Different ecological indicators
applied to short-horn grasshopper species of agriculture ecosystem in three
localities from the Mzab valley (Septentrional Sahara, Algeria).
|
Months
|
Béni Isguen
|
|
|
Ghardaïa
|
|
|
|
El-Atteuf
|
|
|
|
S
|
N
|
H
|
E
|
S
|
N
|
H
|
E
|
S
|
N
|
H
|
E
|
|
January
|
11
|
39
|
2.23
|
0.84
|
8
|
30
|
1.94
|
0.87
|
9
|
34
|
1.96
|
0.79
|
|
February
|
16
|
97
|
2.42
|
0.70
|
10
|
97
|
2.14
|
0.85
|
9
|
45
|
2.18
|
0.92
|
|
March
|
17
|
138
|
2.51
|
0.72
|
12
|
162
|
2.10
|
0.68
|
9
|
89
|
1.97
|
0.80
|
|
April
|
21
|
163
|
2.69
|
0.70
|
14
|
102
|
2.24
|
0.67
|
11
|
115
|
2.18
|
0.80
|
|
May
|
19
|
150
|
2.60
|
0.70
|
13
|
63
|
2.26
|
0.74
|
14
|
120
|
2.28
|
0.70
|
|
June
|
19
|
149
|
2.71
|
0.79
|
15
|
221
|
2.28
|
0.65
|
15
|
165
|
2.44
|
0.76
|
|
July
|
20
|
162
|
2.50
|
0.61
|
17
|
412
|
2.46
|
0.69
|
16
|
266
|
2.55
|
0.80
|
|
August
|
21
|
149
|
2.54
|
1.61
|
20
|
323
|
2.50
|
0.61
|
15
|
247
|
2.41
|
0.74
|
|
September
|
20
|
228
|
2.63
|
0.69
|
20
|
268
|
2.51
|
0.61
|
13
|
261
|
2.20
|
0.69
|
|
October
|
20
|
198
|
2.64
|
0.70
|
17
|
170
|
2.54
|
0.75
|
13
|
96
|
2.24
|
0.72
|
|
November
|
11
|
116
|
2.03
|
0.69
|
15
|
113
|
2.25
|
0.63
|
11
|
76
|
2.18
|
0.80
|
|
December
|
11
|
70
|
1.97
|
0.65
|
7
|
13
|
1.82
|
0.88
|
4
|
8
|
1.32
|
0.93
|
|
Total
|
24
|
1759
|
2.65
|
0.83
|
21
|
1974
|
2.55
|
0.84
|
16
|
1522
|
2.43
|
0.87
|
S: Richness, N: number of individuals of species (adults and
nymphs), H: Shannon-Weiner index, E: Evenness index.
The grouping of grasshopper responded differently to each site
(ANOSIM = R: 0.1123, P = 0.006; Fig. 4). Pairwise comparisons showed that the
grouping of grasshoppers on each agricultural ecosystem was significantly
different. The community composition of grasshopper responded differently to
each month (ANOSIM R = 0.152, P = 0.001; Fig. 5). Pairwise comparisons showed
that the community composition of Acridid on each month was significantly
different in each site.
There were not found any significant differences for Caelifera
abundance between the three sites (Kruskal-Wallis test; x2 =
0.82153; df = 2; p-value = 0.6631). Contrarily, the Caelifera richness in the
three agricultural ecosystems were
ACRIDID DIVERSITY IN AGRICULTURE ECOSYSTEMS J. Insect
Biodiversity 009 (1) (c) 2019 Magnolia Press
·
23
significantly different (Kruskal-Wallis test; x2 =
9.2183; df = 2; p-value = 0.00996). The same was true for the diversity between
the three habitats (Kruskal-Wallis test, x2 = 7.4135, df = 2,
p-value = 0.02456).
Total grasshopper density varied during the study period.
Higher densities were reached in July (164.8 individuals/100 m2) at
Ghardaïa and (106.4 individuals /100 m2) at El-Atteuf, for
Béni Isguen the highest value is recorded in August (99.6 individuals
/100 m2). Lower densities in December at El-Atteuf and
Ghardaïa, with a grasshopper density of 3.2 individuals /100 m2
and 5.2 individuals /100 m2, respectively (Fig. 6).

Figure 4. Analysis of similarities (ANOSIM)
plot showing dissimilarity between and within three sites. Bold horizontal bar
in the box indicates median; bottom of the box indicates 25th
percentile; top of the box indicates 75th percentile; whiskers
extend to the most extreme data point, which is no more than the range (i.e.
1.5) times the interquartile range from the box; width of the bar is directly
proportional to sample size.

Figure 5. Analysis of similarities (ANOSIM)
plot showing dissimilarity between and within Months. Bold horizontal bar in
the box indicates median; bottom of the box indicates 25th
percentile; top of the box indicates 75th percentile; whiskers
extend to the most extreme data point, which is no more than the range (i.e.
1.5) times the interquartile range from the box; width of the bar is directly
proportional to sample size.

Figure 6. Monthly variation in grasshopper
population density recorded during the study period in the three studied sites
(Béni Isguen, Ghardaïa and El-Atteuf).
24
· J. Insect Biodiversity
009 (1) (c) 2019 Magnolia Press ZERGOUN ET AL.
Discussion
A total of 27 species of grasshoppers were collected from
different habitats of the Mzab region. Louveaux & Ben Halima (1987) listed
140 Caelifera species for entire Algeria. In this case with 27 species, the
Mzab valley is occupied by 19.28% of Algerian Caelifera-fauna. All the
grasshoppers collected are classified under three families Acrididae,
Pyrgomorphidae and Tetrigidae. Family Acrididae was dominant with 23 species of
Acridids grouped under 13 genera and six subfamilies, amounting to 85.18% of
collected species. The second most abundant family was Pyrgomorphidae with
three genera and one subfamily, which contributed 11.11% (3 species) of the
total species, while the Tetrigidae was represented by only one species
(3.70%). The trend of numerical distribution of different grasshopper families
recorded in the present study is similar to the observations of Belhadj et
al. (2014), who also reported that Acridid grasshoppers were the most
abundant group followed by Pyrgomorphidae and Tetrigidae in three sites at
Ouargla oasis (Algeria). Similar to Zergoun (1994), the species Calliptamus
barbarus has been reported only once in the Mzab valley, and has not been
found since. Three species were recorded for the first time in Mzab valley:
Hilethera aeolopoides and Morphacris fasciata (in the three
studied sites), and Notopleura saharica (in Béni Isguen and
Ghardaïa).
The differences between the three environments are related to
three parameters including, in order of importance: the nature and richness of
vegetation cover, intensity of agricultural activity, and type of irrigation.
The abundance of grasshopper species (27) was highest in Béni Isguen
(24) and Ghardaïa (21). The El-Atteuf studied site was represented by the
smallest number of species (16). The presence of adventitious vegetation has
favored the increased total grasshopper richness at Béni Isguen and
Ghardaïa. According to Paulraj et al. (2009), grasses were the
most common habitat for grasshoppers. This finding is consistent with our
results. Gramnivorous grasshoppers such as Ochrilidia gracilis,
Acrotylus patruelis and Morphacris fasciata were most
abundant, probably because our sites are very rich in grasses. According to
Jaulin (2009), the presence of an herbaceous layer is therefore essential for
most species of Orthoptera encountered.
The majority of Acridid species were found in the herbaceous
layer, such as Ochrilidia gracilis, Aiolopus strepens,
Acrida turrita, Pyrgomorpha cognata and Morphacris fasciata,
or naked soil such as Acrotylus patruelis, Tenuitarsus angustus
and Sphingonotus azurescens, on which they find their food and
can lay eggs. This is in agreement with the results obtained by Benjelloun
et al. (2014). El-Atteuf site has a low rate of grass cover due to
permanent agricultural work with sprinkling irrigation. All of these parameters
mean that this environment is less populated by Acridid.
As more and more samples are examined, it becomes harder and
harder to find species not already counted, so the slope of the curve gets less
and less steep as the sampling effort continues. With the sampling effort
performed at each habitat, all species accumulation curves reached an
asymptotic phase (Fig. 3)
Upon analysis of sites based on species abundance matrix using
Bray-Curtis dissimilarity, the agricultural ecosystem was significantly
different. These could be due to the difference in habitat such as vegetation
cover, agricultural intensity and micro-climate; point out that the vegetation
cover especially Poaceae, seems to be a principal cue for grasshoppers to
select a habitat. This is also mentioned by Zergoun (1994). Higher humidity and
increased agricultural activity were associated with decrease in abundance of
grasshoppers, while greater vegetation cover (especially of Poaceae), was
correlated with higher abundance of Acridids. A similar pattern was observed in
composition of grasshoppers in each month, which reinforces the argument that
humidity, agricultural intensity as well as vegetation cover play an important
role in determining grasshopper assemblages in the study area. These factors
also playing role in the feeding sites selection by Acridids. On the other
hand, Oedipodinae are only rarely observed on the vegetation. According to Otte
(1984) Oedipodinae usually are abundant only in areas with relatively sparse
ground cover.
We found, that habitat management had a significantly
different influence on species diversity and species richness according to its
intensity in studied agricultural ecosystems. A high diversity and richness of
Caelifera indicates a very low level of agricultural activity. Contrary to what
was expected, monthly abundance of grasshoppers did not vary significantly
among the sites, although, total abundance tended to be higher in Ghardaïa
and Béni Isguen than in El-Atteuf.
The value of the diversity index shows that the cultivated
area of Béni Isguen is the most favorable for the development of many
Caelifera. Indeed, it is characterized by an abundance of grasses such as
Cynodon dactylon and Setaria verticillata. In addition, the
low intensity of agricultural activity in this environment favors the presence
of Acridid. The site El-Atteuf is less diversified; this is due to frequent
weeding and therefore a low presence of grasses. In addition, sprinkler
irrigation creates a humid microclimate which limits the development of
grasshoppers. Equitability does not varying much in the three cultivated
environments; it means that the species are equally distributed. It is noted
that the El-Atteuf site has a slightly higher evenness than the other sites,
despite its low diversity. These results are
ACRIDID DIVERSITY IN AGRICuLTuRE ECOSYSTEMS J. Insect
Biodiversity 009 (1) (c) 2019 Magnolia Press
·
25
most consistent with (Frontier 1982) reasoning. According to
this author, a community comprising a small number of relatively abundant
species and the others are rare, appears to be less diversified than a
community comprising in total the same number of species, but with more
equitably distributed frequencies.
Densities were higher in disturbed sites El-Atteuf and
Ghardaïa. Similar results were observed by Cigliano et al. (2002)
in Benito Juarez County, Southern Pampas, Argentina where disturbed habitats
resulted in increased overall grasshopper densities. The monthly variations in
the densities show larger amplitudes at El-Atteuf than at Ghardaïa and
Béni Isguen. Grasshopper total density was affected by seasonal
variation. The greatest density was observed between April and October. The
maximum densities were recorded in summer. Thus, weather variables explained
the spatio-temporal variation of the grasshopper density. This result does not
agree with those registered in the Southern Pampas, Argentina, where
grasshopper density was not affected by seasonal precipitation and temperature
(Wysiecki et al. 2011). On the other hand, densities tended to
increase in hot and dry conditions in our study.
Grasshopper species richness and diversity in three sites vary
significantly among the months. Contrary to what was expected, total abundance
in month did not vary significantly.
The site El-Atteuf, which has undergone a strong agricultural
activity during our sampling, is less rich than the other two sites. Weeding
destroys a large part of the spontaneous plants such as Poaceae. In fact, the
herbaceous layer strongly contributes to the species richness of Acridids.
Thus, the agricultural activity has a negative impact on Acridids. In contrast,
some species such as Oedipodinae, commonly abundant on bare soil can be favored
in this area. Sprinkler irrigation has a negative effect on Acridid richness.
Knowing that most Acridids prefer warm and sunny places, this type of
irrigation will create a moist environment, and consequently, the exclusion of
many species that will seek drier environments. Generally, agricultural
practices such as irrigation and weeding (decline in Poaceae) often lead to the
destruction of species habitats, and cause a general decline in Acridid
biodiversity as reported by Tscharntke et al. (2005). It is
recommended that similar studies be conducted on a large scale in other regions
in order to fully assess the grasshopper fauna of the Algerian Sahara.
Conclusion
This study was aimed to the characterization of the structure
of grasshoppers communities associated with agricultural ecosystems in three
localities situated in Mzab valley, Septentrional Sahara, Algeria. Our results
point to the fact that species richness and diversity was higher in undisturbed
sites, which indicate that the various levels of disturbances play a crucial
role to sustain the Acridid populations. Differences in grasshopper communities
in agricultural ecosystems cannot be attributed solely to the disturbances of
these environments, because various studies suggest that local grasshopper
communities showing predictable structure based on diet preferences of
individual species, their microhabitat selection, interspecific competition and
predation (Joern 1992; Joern & Klucas 1993; Belovsky & Slade 1995).
The present findings indicate that grasses inside and around
the fields supported a large number of grasshopper species. Appropriate
measures should be taken to minimizing of the disturbances and loss of natural
habitats as this would have a negative effect on the composition and abundance
of the Acridid community in Algeria. Further research on the Acridid
biodiversity and taxonomy will continue in this area, in order to get better
and more comprehensive information on those aspects.
Acknowledgement
This work was supported by the Ministère de
l'Enseignement Supérieur et de la Recherche Scientifique (MESRS) of
Algeria. We would like to thank Dr. Youcef Alioua, M. Cherif Ghazi and Miss
Nacira Boudraa for their help in the preparation of the manuscript.
Conflict of interest
The authors declared no potential conflicts of interest with
respect to the research, authorship, and/or publication of this article.
26
· J. Insect Biodiversity
009 (1) (c) 2019 Magnolia Press ZERGOUN ET AL.
Author's contribution
All authors of this work share equal effort contribution
towards: substantial contributions to design and conception, analyses and data
interpretation, drafting and revising the manuscript.
References
Bagnouls F. & Gaussen H. 1953. Saison
sèche et indice xérothermique. Bulletin de la
Société d'Histoire Naturelle de Toulouse 88: 193240.
Belhadj B., Doumandji-Mitiche H. &
Guendouz-Benrima A. 2014. Orthopteric fauna of Ouargla oasis.
International Journal of Zoological Research 4(4): 11-26.
Belovsky G.E. & Slade J.B. 1993. The role
of vertebrate and invertebrate predators in a grasshopper community. Oikos
68:193-201.
https://doi.org/10.2307/3544830
Benfekih L., Foucart A. & Petit D. 2011.
Central Saharan populations of Locusta migratoria cinerascens
(Orthoptera: Acrididae) in irrigated perimeters: is it a recent
colonisation event? Annales de la Société Entomologique de
France 47(1-2): 147-153.
https://doi.org/10.1080/00379271.2011.10697706
Benjelloun M., El Ghadraoui L., Essakhi D., Alfiguigui
J. & Errabhi N. 2014. Contribution à l'étude de la
diversité des Orthoptères acridiens dans le Moyen Atlas (Maroc).
AFPP - 10ème conférence internationale sur les
ravageurs en agriculture, Montpellier, 10 p.
Benkenana N. & Harrat A. 2009.
Contribution to the systematic study of grasshopper fauna (Orthoptera,
Califera) and some bioecological aspects of economic importance of species in
the Constantine region (Eastern Algeria). Emirates Journal of Food and
Agriculture 21(1): 40-47.
https://doi.org/10.9755/ejfa.v21i1.5157
Clarke K.R. 1993. Non-parametric multivariate
analyses of changes in community structure. Australian Journal of Ecology
18: 117143.
https://doi.org/10.1111/j.1442-9993.1993.tb00438.x
Colwell R.K. 2013. EstimateS: statistical
estimation of species richness and shared species from samples. Version 9.
Available at: http://
purl.oclc.org/estimates
Cigliano M.M., Torrusio S. & de Wysiecki M.L.
2002. Grasshopper (Orthoptera: Acrididae) community composition and
temporal variation in the Pampas, Argentina. The Journal of Orthoptera
Research 11: 215-221.
https://doi.org/10.1665/1082-6467(2002)011[0215:GOACCA]2.0.CO;2
Chopard L. 1943. Orthoptèroides de
l'Afrique du Nord. Ed Rose Bookstore. Coll: Faune de l'Empire Français.
Paris, 405 pp.
Defaut B. 2017. Etude entomocénotique
des zones ouvertes du parc national de Tlemcen et de ses environs (nord-ouest
algérien). Matériaux Orthoptériques et
Entomocénotiques 22: 127-169.
Dirsh V.M. 1965. The African Genera of
Acridoidea. Cambridge University Press for anti-locust Research Centre, London,
579 pp. Doumandji-Mitiche B., Doumandji S., Kadi A., Kara F.Z., Ayoub
A., Zergoun Y. & Saharaoui L. 2001. La faune
Orthoptérologique
de certaines oasis algériennes (Béchar, Adrar,
Tamanrasset, Djanet et Ghardaïa). Conférence internationale sur les
orthoptères.
Montpellier, France, Metaleptea, special issue 44:
149-153
Eades D.C., Otte D., Cigliano M.M. & Braun H.
2018. Orthoptera Species File. Version 5.0./5.0.
http://Orthoptera.SpeciesFile.org
[last accessed on 2018 Sep].
Frontier S. 1982. Sampling strategies in
ecology. Ed Masson. Paris, Collo. Ecology. N17. 494 pp.
Gardiner T., Pye M., Field R. & Hill J. 2002.
The influence of sward height and vegetation composition in
determining the habitat preferences of three Chorthippus species
(Orthoptera: Acrididae) in Chelmsford, Essex, UK. Journal of Orthoptera
Research 11: 207-213.
https://doi.org/10.1665/1082-6467(2002)011[0207:TIOSHA]2.0.CO;2
Gillon Y. 1974. Variations
saisonnières des populations d'Acridiens dans une savane
préforestière de Côte d'Ivoire. Acrida 3: 129-174.
Guendouz-Benrima A., Doumandji-Mitiche B. & Petit D. 2011.
Effects of weak climatic variations on assemblages and life cycles of
Orthoptera in North Algeria. Journal of Arid Environments 75:
416-423.
https://doi.org/10.1016/j.jaridenv.2010.12.006
Jaulin S. 2009. Etude des Orthoptères
des sites expérimentaux du LIFE Basses Corbières. Synthèse
des 4 années de prospections. Rapport d'étude de l'OPIE,
Perpignan, 51p.
Joern A. 1992. Variable impact of avian
predation on grasshopper assemblies in sandhills grassland. Oikos
64:458-463.
https://doi.org/10.2307/3545161
ACRIDID DIVERSITY IN AGRICULTURE ECOSYSTEMS J. Insect
Biodiversity 009 (1) (c) 2019 Magnolia Press
·
27
Joern A. & Klucas G. 1993. Intra- and
interspecific competition in adults of two abundant grasshoppers (Orthoptera:
Acrididae) from a Sandhills grassland. Environmental Entomology
22:352-361.
https://doi.org/10.1093/ee/22.2.352
Lamotte M. & Bourliere H. 1978.
Problèmes d'écologie: Ecosystèmes terrestres. Ed. Masson,
Paris, 398 pp.
Louveaux A. & Benhalima T. 1987. Catalogue d'Acridiodea
Orthoptera du nord-ouest de l'Afrique. Bulletin de la Société
Entomologique de France 3-4 (91): 73-87.
Louveaux A., Amedegnato C., Poulain S. &
Desutter-Grandcolas L. 2013. Catalogue and keys of the Acridomorpha
(Insecta, Orthoptera) from north West Africa. Zoosystema 35(2):
175-181.
https://doi.org/10.5252/z2013n2a3
Louveaux A., Amedegnato C., Poulain S. &
Desutter-Grandcolas L. 2018. Orthoptera of the Acridomorpha from north
West Africa. Version 1.3.7.
http://acrinwafrica.mnhn.fr
[date of consultation: 19 Mai 2018].
Hammer O., Harper D.A.T. & Ryan P.D. 2014.
PAST Palaeontological Statistics Version 3.04.
http://folk.uio.no/ohammer/past.
Massa B. 2013. Pamphagidae (Orthoptera:
Caelifera) of North Africa: key to genera and the annotated check-list of
species. Zootaxa 3700: (3): 435-475. Maurel H. 2008.
Premier inventaire des Orthoptères de la collection
systématique du Laboratoire de Zoologie de l'Institut National
Agronomique d'El Harrach (Algérie) (Ensifera, Caelifera).
Matériaux Orthoptériques et Entomocénotiques 13:
33-42.
Moussi A., Abba A., Harrat A. & Petit D. 2011.
Desert acridian fauna (Orthoptera, Acridomorpha): Comparison between
steppic and oasian habitats in Algeria. Comptes Rendus Biologies
334(2): 158-167.
https://doi.org/10.1016/j.crvi.2010.12.001
Moussi A., Abba A., Harrat A. & Petit D. 2014.
Description of Dociostaurus biskrensis sp. nov. And male
allotypes of four species: Pamphagulus bodenheimeri dumonti, P.
uvarovi, Sphingonotus ebneri and Notopleura pygmaea
(Orthoptera: Acridoidea) in the region of Biskra, Algeria. Zootaxa
(4.4)3755: 379-390.
Moussi A., Dey L.S., Petit D., Abba A., Klesser R. &
Husemann M. 2018. First genetic data for band-winged grasshoppers
(Orthoptera : Acrididae : Oedipodinae) of the Biskra region of Algeria with new
records for the country. African Zoology 53(1): 31-40.
https://doi.org/10.1080/15627020.2018.1463172
Otte D. 1984. The North American
grasshoppers. Volume II (Acrididae: Oedipodinae). Cambridge, MA: Harvard
University Press. 366 p.
Ould El Hadj M.D. 2002. Les nouvelles formes
de mise en valeur dans le Sahara algérien et le problème
acridien. Sciences et changements planétaires/Sécheresse
13: 37-42.
Paulraj M.G., Anbalagan V. & Ignacimuthu S. 2009.
Distribution of Grasshoppers (Insecta: Orthoptera) among different
host plants and habitats in two districts of Tamil Nadu, India. Journal of
Threatened Taxa 1(4): 230-233.
https://doi.org/10.11609/JoTT.o1878.230-3
R Development Core Team 2013. R: A Language
and Environment for Statistical Computing. R Foundation for Statistical
Computing, Vienna, Austria.
Tscharntke T., Klein A.M., Kruess A., Steffan,
Dewenter, I. & Thies C. 2005. Landscape perspectives on
agricultural intensification and biodiversity-ecosystem service management.
Ecology Letters 8: 857-874.
https://doi.org/10.1111/j.1461-0248.2005.00782.x
Voisin J.F. 1980. Réflexion à
propos d'une méthode simple d'échantillonnage des peuplements
d'Orthoptères en milieu ouvert. Acrida 9 (4): 159-170.
Voisin J.F. 1986. A simple method to
characterize the abundance of Orthoptera in open environments. The
Entomologist 42 (2):113-119. Wysiecki M.L., Arturi M., Torrusio
S., & Cigliano M.M. 2011. Influence of Weather Variables and Plant
Communities on Grasshopper Density in the Southern Pampas, Argentina.
Journal of Insect Science 11(109): 1-14.
https://doi.org/10.1673/031.011.10901
Yadav R.S., Kumar D. & Kerketta D. 2017.
New report of Choroedocus robustus (Serville, 1838) from
eastern Uttar-Pradesh, India. Journal of Entomology and Zoology Studies
5(6): 1202-1205.
Zergoun Y. 1991. Contribution à
l'étude bio-écologique des peuplements orthoptérologiques
dans la région de Ghardaïa. Mémoire d'ingénieur
agronome Institut National d'Agronomique d'El-Harrach, Algeria, 73 p.
Zergoun Y. 1994. Bioécologie des
Orthoptères dans la région de Ghardaïa et régime
alimentaire d'Acrotylus patruelis (Herrich - Schaeffer, 1838)
[Orthoptera-Acrididae]. Thèse de Magister, Institut National d'Agronomie
d'El-Harrach, Algeria, 110 p.
Tunisian Journal of Plant Protection 217 Vol. 13, No 2,
2018
Effects of Temperatures and Rainfall Variability on
the
Abundance and Diversity of Caelifera (Insecta, Orthoptera) in
Three
Natural Environments in the Mzab Valley,
Septentrional Sahara
(Algeria)
Youcef Zergoun, Laboratoire des Bioressources
Sahariennes: Préservation et Valorisation, Département des
Sciences Agronomiques, Faculté des Sciences de la Nature et de la Vie et
Sciences de la Terre, Université de Kasdi Merbah, BP 511, 30000 Ouargla,
Algeria, and Département des Sciences Agronomiques, Faculté des
Sciences de la Nature et de la Vie et Sciences de la Terre, Université
de Ghardaïa, 47000 Ghardaïa, Algeria, Omar Guezoul, Makhlouf
Sekour, Laboratoire des Bioressources Sahariennes: Préservation
et Valorisation, Département des Sciences Agronomiques, Faculté
des Sciences de la Nature et de la Vie et Sciences de la Terre,
Université de Kasdi Merbah, BP 511, 30000 Ouargla, Algeria,
Noureddine Bouras, Département de Biologie, Faculté des
Sciences de la Nature et de la Vie et Sciences de la Terre, Université
de Ghardaïa, 47000 Ghardaïa, Algeria, and Michael D. Holtz,
Field Crop Development Centre, Alberta Agriculture and Forestry, 5030
- 50 Street, Lacombe, Alberta T4L1W8, Canada
ABSTRACT
Zergoun, Y., Guezoul, O., Sekour, M., Bouras, N., and
Holtz, M.D. 2018. Effects of temperatures and rainfall variability on the
abundance and diversity of Caelifera (Insecta, Orthoptera) in three natural
environments in the Mzab Valley, Septentrional Sahara (Algeria). Tunisian
Journal of Plant Protection 13 (2): 217-228.
The climatic condition is assumed as the main factor
responsible for development and survival of insects; this investigation was
conducted to study the responses of Caelifera to temperatures and precipitation
variations during 2017 in three natural environments of Mzab Valley,
Ghardaïa, Algeria. A total of 22 grasshopper species were collected,
representing four families and eight subfamilies. The subfamily Oedipodinae was
the dominant, followed by Pyrgomorphinae and Thrinchinae. Two species:
Sphingonotus rubescens and Sphingonotus savignyi occurred
frequently in the three sites. However, only one accidental species,
Eunapiodes sp. was found. According to our observations, it is clear
that the grasshopper diversity was higher in July and August coinciding with
the increase in temperature. In such conditions, the precipitation has less
influence on species diversity.
Keywords: Algeria, Caelifera, diversity, precipitation,
Mzab Valley, temperature
|
Corresponding author: Noureddine Bouras
Email:
noureddine_bouras@yahoo.fr
Accepted for publication 16 December 2018
|
More than 28157 species of Orthoptera are distributed
worldwide (Cigliano et al. 2018). This order is among the most recognizable and
familiar insects, that includes the grasshoppers, locusts and
crickets. Although grasshoppers
|
(Acrididae) are often thought to be associated with
grasslands, many species are currently found in tropical forests, shrub-lands,
deserts, wetlands, and alpine regions (Song et al. 2018). Grasshoppers are
considered as the main important insect that cause damage to crops, comprise an
overwhelming proportion of animal biomass and biodiversity, form a major
component of food webs, and play important roles in nutrient cycling and plant
production in grassland ecosystems (Hawlena and Schmitz 2010).
Several studies confirmed that the recent climatic changes
strongly affect the abundance and geographic distribution of insects (Eo et al.
2017) and the richness of pests, particularly Orthoptera (Weiss et al. 2012).
In addition, many researches consider Orthoptera as a bioindicators of the
climate change (Báldi and Kisbenedek 1997) due to their sensitivity to
microclimatic conditions (Zografou et al. 2009). The high temperature can
affect directly and indirectly all arthropods by increasing or decreasing their
metabolic rates, changing their activity patterns as well as their
developmental rates (Zografou et al. 2017).
Tunisian Journal of Plant Protection 218 Vol. 13, No 2,
2018
The abundance of Orthoptera is generally influenced by high
temperatures and dry conditions; however, this is not applicable to all species
in this group (Capinera and Horton 1989). Weather in the regional scale,
particularly the precipitation, is also a critical factor that shapes the
population density of locusts (Wysiecki et al. 2011). Lack of rainfall is
usually cited as the main factor limiting population increase in acridid
inhabiting tropical semiarid and arid areas, while those species occurring in
more temperate or marshy areas are favored by years of subnormal rain (Hunter
et al. 2001). Climate change also indirectly affects insects by affecting their
host plants. The stage of the vegetation can also impact the biological traits
of locust, in case of dry vegetation, a phenomenon of gregarization appear and
swarm formation (Cisse et al. 2013). In addition, species with low mobility are
susceptible to climate change as they may not be able to shift their ranges
fast enough to keep up with environmental changes (Eo et al. 2017). A clear
understanding of the mechanisms and ability of locusts and grasshoppers to
overcome limiting factors in their environment is essential for predicting when
and where outbreaks are likely to occur (Hunter et al. 2001). A strong economic
loss was signaled and a large amounts of vegetation was destroyed resulting to
the invasion of this pests. In general, the grasshopper fauna of the Algerian
Sahara, and Mzab in particular, has attracted less attention of entomologists
and no serious studies were performed on the pest species diversity of the Mzab
Valley. The intention of the present study is to improve knowledge in the
diversity of Orthoptera in the Mzab Valley. The objectives of this work was (1)
to inventory the species of Orthoptera present in the Mzab Valley, and (2) to
compare the attributes of the Caelifera community (abundance, richness and
diversity of species).
MATERIALS AND METHODS
Study site.
the Mzab Valley sites locate in the northern Sahara of Algeria
(Fig 1) at an elevation of 530 m above mean sea level, between 32° to
33° north latitude and 3° to 4° east longitude. These sites are
characterized by little-evolved type of alluvial wind soils. The climate is
Saharan with a mild winter. Sampling and the study of the Caelifera fauna were
conducted in three different localities: Wadi N'tissa (Béni Isguen),
Wadi Touzouz (Ghardaïa) and Wadi Mzab (El Djaoua, El Atteuf).
Wadi N'tissa (S1): Latitude 32° 45' North, and
longitude 3° 66' East. The surface of the site is about 4 ha (rocky
terrain). The vegetal cover is mainly composed of Haloxylon scoparium,
Peganum harmala, Pergularia tomentosa, Colocynthis
vulgaris, Pituranthos chloranthus, Atractylis
serratuloides, Echinops spinosus and Androcymbium
punctatum. The sandy and dry areas are characterized by the presence of
two Gramineae, Aristida obtusa and Stipagrostis pungens.
Wadi Touzouz (S2): Latitude 32° 51' North and
longitude 3° 60' East. The surface of the collection site is 4 ha (the
terrain changes into a rocky bottom with scattered patches of sand). Among the
plants, Haloxylon scoparium, Ferula communis, Zilla
spinosa, Cleome Arabica, Oudneya Africana, Fagonia
glutinosa and Thymelaea microphylla were found.
El Djaoua (S3): Latitude 32° 46' North, and
longitude 3° 73' East. The surface of the collection site is 4 ha (Rocky
and sandy terrain). The vegetation is dominated by Thymelaea
microphylla, Oudneya africana, Echium pycnanthum,
Cleome arabica, and Stipagrostis pungens.
Climatic data.
The climatic data was obtained from the Regional Weather
Service Station of Ghardaïa (32° 40' N, 3° 80' E; elevation 461
m). Average annual maximum temperature was 28.47 °C; with highest
temperature of 40.5 °C in summer and lowest temperature of 6.2 °C in
winter. The amount and seasonal precipitation varied greatly among years. From
the Regional Weather Service Station database, 2017 annual precipitation was 34
mm.
Grasshopper sampling.
Tunisian Journal of Plant Protection 219 Vol. 13, No 2,
2018
Populations of Caelifera were sampled monthly from January to
December 2017. Sampling was performed with quadrats, the most frequently used
method for biodiversity studies. The quadrant method defines in each collection
site an area of 10000 m2. Essentially, it consists of laying a 25 m
long transect using a string and then placing square 5 m quadrats (25
m2) along the transect (Gillon 1974). Ten quadrats were sampled at
each of the three sites on each sampling date. Grasshoppers collected using the
sweep-net were taken to the laboratory for species identification based on
identification keys for Orthopteroid from North Africa of Chopard (1943), Dirsh
(1965) and keys of the Acridomorpha from North West Africa (Louveaux et al.
2018). Grasshoppers were classified according to modern systematic as used in
the Orthoptera species file (Cigliano et al. 2018).
Data analysis.
The data collected from the different sites within the study
area were analyzed using the ecological indices. Relative abundance of
grasshopper species was estimated by the comparison with the total abundance of
all species collected from each site. Species richness was quantified as the
total number of species present in each habitat. Two of the most common indices
have been used to describe and compare the grasshopper diversity in the
prospected sites in 2017: the Shannon-Weaver diversity index (H) and the
species evenness. The formula of the Shannon-Weaver diversity index is:
H = - Ó (ni/N) × log2 (ni/N),
where ni is the abundance of the species i in one site and N
the total number of species living in the same site. Pielou's evenness (J) is a
measure of uniformity. It
describes how evenly the individuals are distributed among the
different species:
J = H / log2S,
where, J = species evenness, H = species diversity and S =
number of species (Magurran 2004). The constancy indices were obtained
following the formula proposed by Bodenheimer:
C = p ×100 / N,
Where p is the number of collections containing the particular
species studied and N is the total number of collections carried out. Based on
the obtained results, the species were classified as: constant (present in more
than 50% of the collections), accessory (present in between 25-50% of the
collections) or accidental (present in under 25% of the collections) (Gallo et
al. 2002).

Tunisian Journal of Plant Protection 220 Vol. 13, No 2,
2018
Fig 1. Geographic location of the study sites
in the Mzab Valley, Septentrional Sahara, Algeria.
RESULTS
Diversity and abundance of the Caelifera
community.
In total, 1385 specimens of grasshoppers were collected during
the 12 months. They belonged to 22 species, four families, and eight
subfamilies (Table 1). Only 14 species were found in Wadi Mzab, whereas 20
species were found in Wadi N'tissa and 17 species in Wadi Touzouz. From a
taxonomic perspective, the Oedipodinae was the most abundant and diverse
subfamily (with 12 species), followed by Pyrgomorphinae (with 3 species) and
Thrinchinae (with 2 species). There was only one species within
Acridinae, Cyrtacanthacridinae,
Eremogryllinae,
Dericorythinae and Pamphaginae. The abundance of grasshopper species fluctuated
between sites (Table 1). Sphingonotus rubescens was broadly
distributed in the three natural environments [29.74% (S1), 28.82% (S2) and
31.60% (S3)], and Sphingonotus rubescens exhibited very high
population abundance, representing 29.96% of the total grasshopper relative
abundance. Sphingonotus paradoxus occurred in Wadi Touzouz but was not
found in Wadi N'tissa and Wadi Mzab. Some species were only distributed on
rocky terrain. For example, Tuarega insignis, Dericorys millierei
and Eunapiodes sp. occurred only in Wadi N'tissa. Nevertheless,
Eunapiodes sp. (0.36%), Sphingonotus pachecoi (0.91%), and
Schistocerca gregaria (0.91%) had the lowest numbers.
The recorded species were divided into constancy classes
(Table 1): in Wadi N'tissa 7 species (35%) are constant species (C), 12 species
(60%) are accessory species (Ac) and one species (5%) is an accidental species
(Acc). In Wadi Touzouz 8 species (47.06%) are constant species (C) and 9
species (52.94%) are accessory species (Ac). The most numerous are the constant
species
(C) in Wadi Mzab: 9 species (64.28 %), and 5 species (35.71%)
are accessory species (Ac).
Tunisian Journal of Plant Protection 221 Vol. 13, No 2,
2018
Wadi N'tissa was most diversified (2.49%) with the highest
abundance of Caelifera (548), Wadi Touzouz was least diversified (2.34%) with
low abundance (451) and Wadi Mzab was least diversified (2.23%) with low
abundance (386) of Caelifera. Grasshopper abundance was positively related with
species diversity (Table 2). High values of evenness (0.82 < J < 0.84)
indicated that the Orthoptera community was evenly distributed at all sites.
Species diversity.
During the study period, the highest Shannon-Weaver diversity
index (2.45 bits) was observed in August (maximum temperature of 40.3 °C,
minimum temperature of 27 °C, average temperature of 33.7 °C) and
lowest (0.67 bits) in January (maximum temperature of 14.9 °C, minimum
temperature of 4.8 °C, average temperature of 9.8 °C) in Wadi
N'tissa. From Wadi Touzouz the highest Shannon-Weaver diversity index (2.27
bits) was observed in August (maximum temperature of 40.3 °C, minimum
temperature of 27 °C, average temperature of 33.7 °C) and lowest
(0.95 bits) in December (maximum temperature of 16.7 °C, minimum
temperature of 6.2 °C, average temperature of 11.5 °C). In Wadi Mzab
the highest Shannon-Weaver diversity index (2.13 bits) was observed in April
(maximum temperature of 27.7 °C, minimum temperature of 14.9 °C,
average temperature of 21.3 °C) and lowest (1.21 bits) in February
(maximum temperature of 20.6 °C, minimum temperature of 8.8 °C,
average temperature of 14.7 °C). Temperature effect on the Shannon-Weaver
diversity index (H) of Caelifera in the three study areas is given in Fig 2.
Tunisian Journal of Plant Protection 222 Vol. 13, No 2,
2018
Table 1. Listing, abundance (%) and constancy of
Caelifera species in natural environments at three localities from the Mzab
Valley, northern Sahara (Algeria) during 2017
|
Family
|
Subfamily
|
Species
|
S1
|
S2
|
S3
|
|
Acridinae
|
Truxalis nasuta (Linnaeus, 1758)
|
3.28 (C)
|
2.21 (Ac)
|
3.37 (C)
|
|
Cyrtacanthacridinae
|
Schistocerca gregaria (Forskål, 1775)
|
0.91 (Ac)
|
1.10 (Ac)
|
2.07 (Ac)
|
|
Eremogryllinae
|
Notopleura saharica (Krauss, 1902)
|
1.46 (Ac)
|
3.10 (Ac)
|
4.14 (Ac)
|
|
|
Acrotylus longipes (Charpentier, 1845)
|
6.20 (Ac)
|
7.32 (Ac)
|
10.88 (Ac)
|
|
|
Acrotylus patruelis (Herrich-Schäffer, 1838)
|
3.83 (Ac)
|
-
|
-
|
|
|
Hyalorrhipis calcarata (Vosseler, 1902)
|
1.46 (Ac)
|
-
|
-
|
|
|
Sphingoderus carinatus (Saussure, 1888)
|
3.28 (Ac)
|
2.44 (Ac)
|
5.18 (C)
|
|
|
Sphingonotus azurescens (Rambur, 1838)
|
4.01 (Ac)
|
2.66 (Ac)
|
|
|
Acrididae
|
Oedipodinae
|
Sphingonotus obscuratus lameerei (Finot, 1902)
|
3.83 (Ac)
|
2.88 (Ac)
|
2.33 (Ac)
|
|
|
Sphingonotus octofasciatus (Serville, 1839)
|
5.29 (C)
|
3.32 (C)
|
1.81 (Ac)
|
|
|
Sphingonotus pachecoi (Bolivar, 1908)
|
0.91 (Ac)
|
1.33 (Ac)
|
2.84 (C)
|
|
|
Sphingonotus paradoxus (Bei-Bienko, 1948)
|
-
|
4.65 (C)
|
-
|
|
|
Sphingonotus rubescens (Walker, 1870)
|
29.74 (C)
|
28.82 (C)
|
31.60 (C)
|
|
|
Sphingonotus savignyi (Saussure, 1884)
|
13.32 (C)
|
19.29 (C)
|
16.32 (C)
|
|
|
Vosseleriana fonti (Bolivar, 1902)
|
2.74 (Ac)
|
13.30 (Ac)
|
-
|
|
Dericorythidae
|
Dericorythinae
|
Dericorys millierei (Bonnet & Finot, 1884)
|
1.09 (Ac)
|
-
|
-
|
|
Pamphaginae
|
Eunapiodes sp. (Bolivar, 1907)
|
0.36 (Acc)
|
-
|
-
|
|
Pamphagidae
|
|
Tmethis cisti (Fabricius, 1787)
|
-
|
5.76 (C)
|
4.14 (C)
|
|
Thrinchinae
|
Tuarega insignis (Lucas, 1851)
|
2.55 (Ac)
|
-
|
-
|
|
Pyrgomorphidae
|
|
Pyrgomorpha cognata (Krauss, 1877)
|
5.66 (C)
|
2.88 (C)
|
5.44 (C)
|
|
Pyrgomorphinae
|
Pyrgomorpha conica (Olivier, 1791)
|
3.83 (C)
|
2.66 (C)
|
4.14 (C)
|
|
|
Tenuitarsus angustus (Blanchard, 1836)
|
6.20 (C)
|
8.20 (C)
|
5.70 (C)
|
(-): absent species. S1: Wadi N'tissa (Béni Isguen), S2:
Wadi Touzouz (Ghardaïa), S3: Wadi Mzab (El Djaoua, El Atteuf). (C):
Constant, (Ac): Accessory, Acc: Accidental.
Table 2. Diversity parameters for three
localities from the Mzab Valley, northern Sahara (Algeria) during 2017
|
Index
|
Wadi N'tissa
|
Wadi Touzouz
|
Wadi Mzab
|
|
Species number
|
20
|
17
|
14
|
|
Species diversity (II)
|
2.49
|
2.34
|
2.23
|
|
Species evenness (J)
|
0.83
|
0.82
|
0.84
|

Fig. 2. Effect of temperature on Caelifera
species diversity (H) in three localities from the Mzab Valley, northern
Sahara, Algeria (during 2017). H1-H3 : Shannon-Weaver diversity index (H) of
Wadi N'tissa (Béni Isguen), Wadi Touzouz (Ghardaïa) and Wadi Mzab
(El Djaoua, El Atteuf), respectively.
Tunisian Journal of Plant Protection 223 Vol. 13, No 2,
2018
Effect of precipitation on species
diversity.
The study of precipitation effect (P) on species diversity (H)
of Caelifera shows that the highest Shannon-Weaver diversity index (2.45 bits)
was observed in August (P = 0 mm) and lowest (0.67 bits) in January (P = 1 mm)
in Wadi N'tissa. From Wadi Touzouz the highest Shannon-Weaver diversity index
(2.27 bits) was
observed in August (P = 0 mm) and lowest (0.95 bits) in
December (P = 0 mm). In Wadi Mzab the highest Shannon-Weaver diversity index
(2.13 bits) was observed in April (P = 0 mm) and lowest (1.21 bits) in February
(P = 0 mm). Effect of precipitation on species diversity (H) of Caelifera in
the three study areas is given in Fig 3.
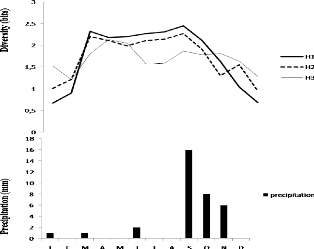
Fig. 3. Effect of precipitation on Caelifera
species diversity (H) in three localities from the Mzab Valley, northern
Sahara, Algeria (during 2017). H1-H3 : Shannon-Weaver diversity index (H) of
Wadi N'tissa (Béni Isguen), Wadi Touzouz (Ghardaïa) and Wadi Mzab
(El Djaoua, El Atteuf), respectively.
DISCUSSION
Tunisian Journal of Plant Protection 224 Vol. 13, No 2,
2018
Species richness of grasshoppers noted in this study was about
22 species; however, Zergoun (1991) and Babaz (1992) noted 17 and 16 species,
respectively, in the same area, Mzab Valley. Previous studies conducted by
Zergoun (1991, 1994), (Babaz 1992) and Yagoub (1995) reported that Oedipodinae
was the most abundant in this area. Zergoun (1991, 1994) found Sphingonotus
rubescens particularly dominant in natural environments of the Mzab
Valley. According to Otte (1984), band-winged grasshoppers (subfamily
Oedipodinae) was abundant only in areas with relatively sparse ground cover. In
this study, they were most common on rocky terrain. Rock cover seems to have an
even greater positive influence on Orthoptera (Zografou et al. 2017). Rocks are
important to Orthopterans aiding in thermoregulation as well as providing
shelter (Chappell 1983). Members of Oedipodinae and Thrinchinae subfamilies,
preferring warm, dry habitats with sparse grass cover, were only found in
desert and mountain rangelands (Sun et al. 2015). In
the prospected areas, the diversity was stable as also noted
by Aprile (2013) indicating that these zones are the most adapted areas that
offer the best conditions for their survival. Only one accidental species, were
found, Eunapiodes sp. Diversity of Caelifera fluctuates with the
seasons. They are abundant for only a few months and absent or rare during the
rest of the year. When we compare different months for Caelifera species
diversity (H) it is clear that diversity was at a maximum in July and August
and lowest in January, February and December. The results were similar to the
finding of Zergoun (1994). According Capinera and Horton (1989), warm dry
weather is positively associated with grasshopper and locust densities in
several areas of the world. In the present study, the lower diversity
registered in winter could be related to the weather patterns and decreased
vegetal diversity at these sites. According to De Wysiecki (2000), composition
and structure of vegetation likely influence habitat selection among
grasshoppers. From Fig 2, it is clear that the diversity of Caelifera is
affected by variation in the pattern of rainfall in different months of 2017.
From these results, it appears that the grasshopper diversity was higher in
July and August concurrent with the decrease in rainfall. In such conditions,
precipitation has no influence. Smith and Holmes (1977) suggested that
densities of Melanoplus sanguinipes and Camnula pellucida in
Alberta were positively related to summer temperatures and negatively related
to amount of precipitation during the previous August and September. In the
United States, the populations case of Dissoteira longipennis showed
rapid increases in numbers following periods of drought, subsiding in numbers
during periods of above-average rainfall (Wakeland 1958). Contrary to our
results, Usmani et al. (2010) reported that
Tunisian Journal of Plant Protection 225 Vol. 13, No 2,
2018
rainfall also affects diversity in India. According to Hunter
et al. (2001), rainfall seems to be a major regulator of Acridid populations in
Australia. Precipitation and drought driven effects on food quality and
quantity are important for grasshopper population dynamics (Joern et al. 2012).
According to Jonas et al. (2015), weather acts on grasshopper populations
indirectly by altering host plant species composition, availability and
quality.
The present study was conducted to estimate abundance,
diversity, constancy and the effect of temperature and precipitation on
grasshopper species in Mzab Valley, Ghardaïa, Algeria, during 2017. The
grasshoppers were collected from study sites with the majority of specimens
belonging to sub-family Oedipodinae (54.54 %) dominated by genus
Sphingonotus. The family Acrididae contained most collected species
(15) followed by Pyrgomorphidae with 3 species. Data on species abundance
showed that Sphingonotus rubescens was dominant in the three sites.
Fluctuation in temperature is vital roles in determining the abundance of
Caelifera fauna from Mzab Valley. It is obvious to see that the diversity of
Caelifera is affected by temperature variations in different months. It appears
that the grasshopper diversity was higher in July and August when temperatures
increase. In these months, precipitation is very low or absent. However, the
results of this study cannot be generalized to all areas or grasshopper
assemblages. Further research is required on the physiological and behavioral
responses of dominant species according to climate parameters.
ACKNOWLEDGEMENT
This work was supported by the Ministère de
l'Enseignement Supérieur et de la Recherche Scientifique (MESRS) of
Algeria. We would like to thank Dr. Salah Eddine Sadine and Mr. Mohamed Kraimat
for their help in the preparation of the manuscript.
RESUME
Zergoun Y., Guezoul O., Sekour M., Bouras N. et Holtz
M.D. 2018. Effets des températures et de la variabilité des
précipitations sur l'abondance et la diversité des Caelifera
(insecte, Orthoptère) dans trois environnements naturels de la
Vallée de Mzab, Sahara Septentrional (Algérie). Tunisian Journal
of Plant Protection 13 (2): 217-228.
La condition climatique est supposée être le
principal facteur responsable du développement et de la survie des
insectes; cette étude a été menée pour
étudier les réponses de Caelifera aux variations de
températures et de précipitations en 2017 dans trois
environnements naturels de la Vallée de Mzab, Ghardaïa,
Algérie. Au total, 22 espèces de sauterelles ont
été recueillies, représentant 4 familles et 8
sous-familles. La sous-famille Oedipodinae est la plus dominante,
suivie des Pyrgomorphinae et des Thrinchinae. Deux
espèces: Sphingonotus rubescens et Sphingonotus savignyi
sont les plus fréquentes sur les trois sites. Cependant, une seule
espèce accidentelle, Eunapiodes sp., a été
trouvée. Selon nos observations, il est clair que la diversité
des sauterelles était plus élevée en juillet et
août, ce qui coïncidait avec l'augmentation de la
température. Dans de telles conditions, les précipitations ont
moins d'influence sur la diversité des espèces.
Mots clés: Algérie, Caelifera,
diversité, précipitations, température, Vallée du
Mzab
ÕÎáã
ÊÇÈáÞÊæ
ÉÑÇÑÍáÇ
ÊÇÌÑÏ
ÊÇÑíËÊ .2018
.ÒÊáæå
áßíÇãæ
ÓÇÑæÈ
äíÏáÇÑæäæ
Ñæ ßÓ æáÎãæ
áæÒÞ ÑãÚ æ
Óæí äæÞÑÒ
|
ÈÇÒã
íÏÇæ í
ÉíÚíÈØ
ÊÇÆíÈ ËáÇË í )
ÉÍäÌáÇ
|
ÊÇãíÞÊÓã
|
ÊÇÑÔÍ(
|
Caelifera ÚæäÊæ
ÉÑæ ìáÚ
|
ÑÇØãáÇ
ØÞÇÓÊ
|
.)ÑÆÇÒÌáÇ(
ÉíáÇãÔáÇ
ÁÇÑÍÕáÇ
Tunisian Journal of Plant Protection 13 (2):
217-228.
ÉÈÊÑ ÊÍÊ
ÉÍäÌáÇ
ÊÇãíÞÊÓã
ìáÚ
ØÞÇÓÊáÇæ
ÉÑÇÑÍáÇ
ÉÌÑÏ ÑíËÊæ
ãÇÙÊäÇæ
ÚæäÊæ ÉÑæ
ÑíÏÞÊá
ÉÓÇÑÏáÇ åÐå
ÊíÑÌ
Caelifera
ÚÈÑ
á ËãÊ
ÏÇÑÌáÇ äã
ÇÚæä
|
22
|
ÚãÌ ãÊ .
|
)ÑÆÇÒÌáÇ(
|
ÉíÇÏÑÛ
|
ÈÇÒã íÏÇæ
í ÉíÚíÈØ
ÊÇÆíÈ ËáÇË í
2017
|
ãÇÚ í
|
ÉáíÕ ÊäÇß
.áÆÇÕ ÊÍÊ
ÉíäÇãËæ
áÆÇÕ
ÚÞÇæãáÇ
ÚíãÌ í
äÇÚÆÇÔ
.Thrinchinae æ Pyrgomorphinae
ÇåÊáÊ
ÉäãíåãáÇ Oedipodinae
äÇÚæä Çãå
Sphingonotus savignyi æ Sphingonotus rubescens ä
ÉÙÍáÇã ÊãÊ
æåæ ÖÑÇÚ
ÏÍÇæ Úæä ÏÌæ
Çãß .ÉÞÍáã
ìÑÎæ ÉÊÈÇË
ÚÇæä æíáæí
|
ÉÙÍáÇã
|
Êã Ê
ÉËáÇËáÇ
ÚÞÇæãáÇ
ìæÊÓã
|
ìáÚ
.ÉËáÇËáÇ
|
ÉÏÇíÒáÇ
Úã äãÇÒÊáÇÈ
ÓØÓÛæ
íÑåÔ í ìáÚ
äÇß ÏÇÑÌáÇ
ÚæäÊ ä ÍæÖæÈ
ÌÆÇÊäáÇ
ÊÑåÙ .Eunapiodes sp.
.ÚÇæäáÇ
ÚæäÊ ìáÚ
ÇÑíËÊ áÞ
ØÞÇÓÊáá äÇß
æÑÙáÇ åÐå
áËã í
.ÉÑÇÑÍáÇ
ÉÌÑÏ í
|
Caelifera
|
ÈÇÒã íÏÇæ
ÉÑÇÑÍ ÉÌÑÏ
|
ÚæäÊ
|
ØÞÇÓÊ
|
ãÇÙÊäÇ
|
ÑÆÇÒÌáÇ
:ÉíÍÇÊã
ÊÇãáß
|
LITERATURE CITED
Aprile, F., Darwich, A. J., Mera, P.A.S., Robertson, B. A.,
Marshall, B.G., and Siqueira, G. W. 2013. On the occurrence of cyanobacteria in
the madeira river in the Brazilian Amazon. Global Journal of Biology,
Agriculture and Health Sciences 2: 125-133.
Babaz, Y. 1992. Etude bioécologique des
Orthoptères dans la région de Ghardaïa. Mémoire
d'ingénieur agronome, Institut d'Agronomie, Université de Blida,
Algeria, 91 pp.
Báldi, A., and Kisbenedek, T. 1997. Orthopteran
assemblages as indicators of grassland
Tunisian Journal of Plant Protection 226 Vol. 13, No 2,
2018
naturalness in Hungary. Agriculture, Ecosystems and
Environment 66:121-129.
Capinera, J. L. and Horton, D. R., 1989. Geographic Variation
in Effects of Weather on Grasshopper Infestation. Environmental Entomology 18:
814.
Chappell, M.A. 1983. Thermal limitations to escape responses
in desert grasshoppers. Animal Behaviour 31: 1088-1093.
Chopard, L. 1943. Orthoptèroides de l'Afrique du Nord.
Ed. Librairie La rose. Coll : (Faune de l'empire française), Paris, 405
pp.
Cigliano, M. M., Braun, H., Eades, D. C. and Otte, D. 2018.
Orthoptera Species File. Version 5.0/5.0. [27/9/2018].
http://Orthoptera.SpeciesFile.org.
Cisse, S., Ghaout, S., Mazih, A., Ould, B. E. M. A. O.,
Benahi, A. S., and Piou, C. 2013. Effect of vegetation on density threshold of
adult desert locust gregarization from survey data in Mauritania. Entomolia
Experimentalis et Applicata 149: 159-165.
De Wysiecki, M.L., Sanchez, N.E. and Ricci, S. E. 2000.
Grassland and Shrubland Grasshopper Community Composition in Northern La Pampa
Province, Argentina. Journal of Orthoptera Research 9: 211-221.
Dirsh, V.M. 1965. The African Genera of Acridoidea. 339
Cambridge University Press for anti locust Research Centre, London. 579 pp.
Eo, J., Kim, M.H., Na, Y.-E., Oh, Y.-J., and Park, S. 2017.
Abiotic effects on the distributions of major insect species in agricultural
fields. Entomological Research 47: 160-166.
Gallo, D., O. Nakano, S.S. Neto, R.P.L. Carvalho, G.C.
Batista, E.B. Filho, J.R.P. Parra, R.A. Zucchi, S.B. Alves, J.D. Vendramim,
L.C. Marchini, J.R.S. Lopes and Omoto C.
2002. Entomologia agrícola.
Piracicaba,
Fundação de Estudos Agrários Luiz de
Queiroz, Piracicaba, São Paulo, Brazil, 920 pp.
Gillon, Y. 1974. Variations saisonnières des
populations d'Acridiens dans une savane préforestière de
Côte d'Ivoire. Acrida. 3: 129174.
Hawlena, D. and Schmitz, O.J. 2010. Herbivore physiological
response to predation risk and implications for ecosystem nutrient dynamics.
Proceedings of the National Academy of Sciences of the United States of
America, 107: 15503-15507.
Hunter, D. M., Walker, P. W., and Elder, R. J. 2001.
Adaptations of locusts and grasshoppers to the low and variable rainfall of
Australia, Journal of Orthoptera Research 10: 347-351.
Joern, A., Provin, T., and Behmer, S.T. 2012. Not just the
usual suspects: insect herbivore populations and communities are associated
with multiple plant nutrients. Ecology 93: 1002-1015.
Jonas, J.L., Wolesensky, W. and Joern, A. 2015. Weather
affects grasshopper population dynamics in continental grassland over annual
and decadal periods. Rangeland ecology and management 68: 29-39.
Louveaux, A, Amedegnato, C, Poulain, S, and
Desutter-Grandcolas, L. 2018. Orthoptères Acridomorpha de l'Afrique du
Nord-ouest. Version 1.3.7.
http://acrinwafrica.mnhn.fr
[Date de consultation : 10 Octobre 2018]
Magurran, A.E. 2004. Measuring Biological Diversity. Blackwell
Publishing Science, Oxford, United Kingdom, 256 pp.
Tunisian Journal of Plant Protection 227 Vol. 13, No 2,
2018
Otte, D. 1984. The North American grasshoppers. Volume II
(Acrididae: Oedipodinae). Cambridge, MA: Harvard University Press. 366 pp.
Smith, D.S. and Holmes, N.D. 1977. The distribution and
abundance of adult grasshoppers (Acrididae) in crops in Alberta, 1918-1975.
Canadian Entomologist 109: 575-592.
Smith, T. R., and Capinera, J. L. 2005. Host preferences and
habitat associations of some Florida grasshoppers (Orthoptera: Acrididae).
Environmental Entomology 1: 210-224.
Song H., Mariño-Pérez R., Woller D. A. and
Cigliano M. M. 2018. Evolution, Diversification, and Biogeography of
Grasshoppers (Orthoptera: Acrididae). Insect Systematics and Diversity 2:
1-25.
Sun, T., Liu, Z., Qin, L., and Long, R. 2015. Grasshopper
(Orthoptera: Acrididae) community composition in the rangeland of the northern
slopes of the Qilian Mountains in Northwestern China. J. Insect Sci. 15:
1-7.
Usmani, M.K., Khan, M.I., and Kumar, H. 2010. Studies on
Acridoidea (Orthoptera) of Western Uttar Pradesh. Biosystematica 4: 39-58.
Wakeland, C. 1958. The high plains grasshopper. United States
Department of Agriculture. Technical Bulletin 1: 167-175.
Weiss, N., Zucchi, H., and Hochkirch, A. 2012. The effects of
grassland management and aspect on Orthoptera diversity and abundance: site
conditions are as important as management. Biodiversity and Conservation, 22:
2167-2178.
Weyer, J., Weinberger, J. and Hochkirch, A. 2012. Mobility and
microhabitat utilization in a flightless wetland grasshopper, Chorthippus
montanus (Charpentier, 1825). Journal of Insect Conservation 16:
379-390.
Wysiecki, M. L., Arturi, M., Torrusio, S., and Cigliano, M. M.
2011. Influence of weather variables and plant communities on grasshopper
density in the Southern Pampas, Argentina. Journal of Insect Science 11:
1-14
Yagoub, I. 1995. bio-écologie des peuplements
Orthoptéroloqiques dans trois milieux: cultive, palmeraie et terrain nu
à Ghardaïa. Mémoire d'ingénieur agronome, INA, El
Harrach, Alger, 63 pp.
Zergoun, Y. 1991. Contribution à l'étude
bioécologique des
peuplements
Orthoptéroloqiques dans la région de
Ghardaïa. Mémoire d'ingénieur agronome, INA, El Harrach,
Alger, 73 pp.
Zergoun, Y. 1994. Bioécologie des Orthoptères
dans la région de Ghardaïa. Régime alimentaire
d'Acrotylus patruelis (Haerrich-Schaeffer, 1838) (Orth. Acrididae).
Thèse de Magister, INA, El Harrach, Alger, Algeria, 110 pp.
Zhu, H., Qu Y., Zhang, D., Li, J., Wen, M., Wan, D. G and
Gren, B. 2017. Impacts of grazing intensity and increased precipitation on a
grasshopper assemblage (Orthoptera: Acrididae) in a meadow steppe: Grazing and
rainfall effects on grasshoppers. Ecological Entomology 42: 458-468.
Zografou, K., Sfenthourakis, S., Pullin, A., and Kati, V.
2009. On the surrogate value of red-listed butterflies for butterflies and
grasshoppers: a
case study in Grammos site of Natura 2000, Greece. Journal of
Insect Conservation 13: 505514.
Zografou, K., Adamidis, G.C., Komnenov, M., Kati, V.,
Sotirakopoulos, P., Pitta, E., Chatzaki, M. 2017. Diversity of spiders and
Orthopterans respond to intra-seasonal and spatial environmental changes.
Journal of Insect Conservation 21: 531-543.
Tunisian Journal of Plant Protection 228 Vol. 13, No 2,
2018
|
|



