Conclusion partielle.
Dans ce chapitre, nous avons présenté
l'essentiel sur le réseau de neurones à convolution, nous avons
aussi décrit l'architecture et les avantages que présente ce
dernier par rapport à notre travail. Nous avons également
étudié les fonctionnalités détaillées d'un
réseau de neurones convolutif. Le plus important réside dans la
différence entre un CNN et un DNN classique par la présence de
filtres, de convolutions et les couches de pooling intercalées. Un CNN
effectue grâce à cela une détection de formes plus
granulaire qu'un DNN classique.
Etant atteints, les objectifs fixés pour ce chapitre,
nous aborderons dans le troisième chapitre « l'État
de l'art sur les méthodes de segmentation & de classification
d'images ».
Figure 26. Types des
mélanomes (a) superficiel extensif, (b)
nodulaire, (c) lentigo
et (d) acral.
P a g e | 45
Chapitre troisième : État de l'art sur les
méthodes de segmentation & de classification d'images.
3.1. Introduction.
Ce chapitre est un aperçu de l'état de l'art des
différents algorithmes de segmentation et de classification des
lésions cutanées. La première partie est une étude
des différentes approches de segmentation et leurs limitations
lorsqu'elles sont appliquées avec les images
dermoscopiques. La deuxième partie est consacrée
aux approches de classification.
3.2. Le mélanome.
Le cancer de la peau est une maladie cutanée
caractérisée par la croissance anormale de cellules. Dans un
premier temps, ces cellules se propagent uniquement dans leur environnement
proche, il s'agit d'une tumeur bénigne.
Ensuite, elles continuent à se propager et finissent par envahir
d'autres parties du corps à travers le sang et la lymphe. Ces cellules
tumorales, communément appelées métastases
détériorent alors une ou plusieurs fonctions de l'organisme et
peuvent conduire à la mort. On parle alors d'une tumeur
maligne. Les cancers de la peau les plus fréquents sont :
le carcinome basocellulaire, le carcinome épidermoïde et le
mélanome.
Actuellement, le mélanome est l'un des
cancers les plus dangereux, c'est un problème majeur de
santé publique dans le monde. Une fois que la propagation des
métastases commence, les traitements tels que la
radiothérapie et la chimiothérapie sont inefficaces.
L'immunothérapie, en revanche, augmente la durée de survie sans
récidive du mélanome. Les mélanomes sont
regroupés en plusieurs sous-types dont les quatre principaux
sont le mélanome superficiel extensif, nodulaire, lentigo et acral
(Hartinger, 2012).

P a g e | 46
3.2.1. Facteurs de risques.
Le mélanome provient de la transformation maligne des
mélanocytes. Les mécanismes par lesquels le mélanome se
développe sont encore mal connus, mais trois principaux facteurs de
risque ont été identifiés :
V' L'exposition aux ultraviolets UV,
V' Les prédispositions
génétiques,
V' Les antécédents personnels de
mélanome.
3.2.2. Développement du
mélanome.
Dans la plupart des cas, l'évolution du mélanome
se divise en quatre stades bien définis.
A Premier stade : les cellules
tumorales sont localisées uniquement dans l'épiderme et
progressent horizontalement (mélanome in
situ). A ce stade, une simple excision de la zone affectée
suffit pour éliminer définitivement le cancer et éviter
ainsi toute évolution.
A Deuxième stade : si aucun
traitement n'est effectué, la tumeur se propage en profondeur, traverse
la membrane basale et colonise le derme et l'hypoderme.
A Troisième stade : les
cellules cancéreuses empruntent la circulation lymphatique pour envahir
les ganglions proches de la lésion initiale.
A Quatrième stade : les
métastases continuent de se développer et atteignent les organes
profonds.
3.2.3. Détection et traitement du
mélanome.
La détection précoce du mélanome
constitue une étape importante du traitement des personnes atteintes. En
effet, si la tumeur peut être retirée avant qu'elle n'ait franchi
la jonction dermo-épidermique, l'individu est
en phase de guérison. Généralement, le moyen de
détection consiste en un examen à l'oeil nu par un
dermatologue. Ce dernier utilise couramment des
dermoscopes (Figure 27) pour une meilleure
visualisation. Plusieurs règles ont été
développées afin de caractériser plus efficacement une
lésion suspecte, la plus connue est la règle ABCD
(Nachbar et al., 1994). L'utilisation de cette dernière
présente plusieurs limites. En effet, elle
n'est pas applicable pour des lésions
précoces.
P a g e | 47

Figure 27. Dermoscope.
Lorsque le mélanome n'a pas encore formé de
métastases, le seul traitement curatif est une exérèse
chirurgicale. À ce jour, il n'existe pas de traitement pour le
mélanome métastasé permettant une rémission
complète. Il est donc nécessaire de développer un outil de
détection automatique du mélanome précoce plus
efficace.
3.2.4. Diagnostic assisté par
ordinateur.
Le diagnostic assisté par ordinateur (DAO) pour la
détection du mélanome a été introduit afin
d'améliorer et d'aider les dermatologues et d'autres cliniciens dans la
prévention du cancer de peau. La construction d'un DAO repose
principalement sur quatre étapes essentielles
: le prétraitement de l'image, la segmentation,
l'extraction des attributs et la classification. La figure 28
présente le schéma bloc d'un DAO9.
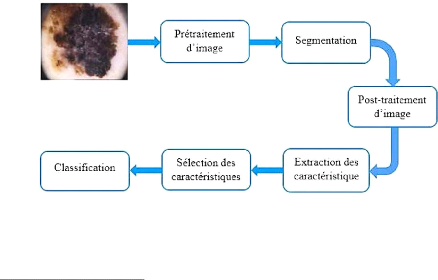
Figure 28. Schéma bloc d'un
DAO.
9 DAO : Diagnostic
Assisté par Ordinateur
P a g e | 48
1. Prétraitement : regroupe
l'ensemble des processus visant à améliorer la qualité de
l'image acquise.
2. Segmentation : est une
répartition de l'image en régions homogènes selon un
critère déterminé : couleur, texture, niveau de gris,
...etc.
3. Extraction d'attributs
(caractéristiques) : vise à extraire les
informations pertinentes qui caractérisent chaque classe.
4. Sélection des caractéristiques
: est utilisée pour sélectionner les
caractéristiques les plus pertinentes et de réduire la dimension
de l'espace des caractéristiques de manière à
éliminer les caractéristiques redondantes.
5. Classification d'images : est
une identification des classes en utilisant les attributs
sélectionnés.
3.3. Segmentation des lésions
cutanées.
La segmentation des lésions cutanées joue un
rôle crucial dans la détection automatique des mélanomes
en délimitant la région d'intérêt
(ROI) comme montré sur la figure 29, vu que dans cette
région que toutes les caractéristiques sont extraites.
L'étude comparative des performances des différentes techniques
de segmentation présentées dans les articles d'Adeyinka et al.
& d'Oliveira et al., démontrent la contribution de la segmentation
dans l'amélioration de la fiabilité d'un système DAO. Pour
cela, différentes techniques de segmentation automatique ont
été proposées pour la délimitation de ROI.

Figure 29. Segmentation d'une
lésion : a) illustration de ROI, b)
masque de la
lésion.
3.3.1. Segmentation basée clustering.
La segmentation par clustering consiste à
affecter à chaque pixel de l'image une classe qui
définit les régions à délimiter sur
l'image. Nous pouvons donc citer des algorithmes de
classification de pixels non-supervisés comme C-moyennes floues (Bezdek,
1980) et les k-means proposés par MAC QUEEN (MacQueen, 1967).
P a g e | 49
3.3.2. Segmentation basée C-moyennes floues
(FCM).
FCM est un algorithme de segmentation basé sur
le regroupement de pixels similaires de manière
itérative, les centres de regroupement étant
ajustés à chaque itération (Bezdek, 1980). En raison de sa
nature itérative, le coût de calcul de l'algorithme
est relativement élevé par rapport aux autres techniques de
segmentation. C'est pourquoi un certain nombre d'approches,
proposées par Cheng et al. & Szilagyi et al., ont été
présentées pour permettre des accélérations
significatives tout en maintenant de bonnes performances de segmentation.
Masood A. et al., ont proposé une nouvelle
méthode de segmentation qui combine FCM, le seuillage et la
méthode level set (LS). Tout d'abord, l'image est
prétraitée pour éliminer les artefacts (poils, bulles
d'air, et les marques de règle) en utilisant un filtre médian
7x7. Ensuite, un seuillage basé sur le FCM est utilisé pour
initialiser l'évolution du LS et réguler les paramètres de
réglage. La méthode proposée a montré une bonne
précision de segmentation des lésions cutanées avec un
taux de détection vrai moyen de 92,6% et une erreur de faux positifs et
de faux négatifs assez réduite, soit 4,66% et 7,34%
respectivement.
Eltayef K. et al., ont présenté une
nouvelle méthode de segmentation des mélanomes à partir
des images dermoscopiques. Pour détecter les poils et
autres bruits dans les images, une étape de prétraitement est
effectuée en appliquant le filtre Gabor. La
région d'intérêt (ROI) de l'image est extraite en combinant
la méthode FCM et Markov Random Field. La
méthode a été évaluée sur un ensemble de
données PH2 de 200 images dermoscopiques. Les résultats de la
méthode proposée ont été comparés aux
masques de la vérité terrain et atteignent une sensibilité
de 93,2%, une spécificité de 98,0% et une précision de
94,0%.
Dans l'article de Jose Luis Garcia et al., l'algorithme
proposé de segmentation des lésions cutanées
dans les images dermoscopiques est basé sur une
classification floue des pixels et un seuillage de l'histogramme.
La méthode a été testée sur deux bases de
données publiques ISIC10 2016 et ISIC 2017 contenant
respectivement 379 et 600 images, et comparée avec les autres travaux de
l'état de l'art, à l'aide des métriques comme
l'exactitude, le coefficient de Dice, l'indice de Jaccard, la
sensibilité et la spécificité : (0.934, 0.869, 0.791,
0.870 et 0.978) et (0.884, 0.760, 0.665, 0.869 et 0.923) respectivement.
3.3.3. Segmentation basée K-means.
L'algorithme des k-means réalise un
partitionnement automatique des pixels de l'image en k classes
homogènes. Divers algorithmes ont été
développés et appliqués pour la segmentation des
lésions cutanées dans le passé. Cette partie
10 ISIC : International
Standard Industrial Classification.
P a g e | 50
présente l'application de certains de ces algorithmes
et leurs performances sur la segmentation des ensembles de
données d'images dermoscopiques.
Alvarez et al., ont développé un algorithme de
segmentation qui se compose des étapes suivantes : une phase du
prétraitement de l'image qui consiste en une opération de
fermeture morphologique réalisée indépendamment sur chacun
des canaux de couleur de l'image RGB, en utilisant comme élément
de sélection un disque de rayon égal à 5 pixels. Ensuite,
un filtre médian 3×3 est appliqué à chaque canal pour
éliminer les poils. Une segmentation de l'image en utilisant
l'algorithme k-means, un calcul d'un ensemble de caractéristiques
décrivant les propriétés de chaque région
segmentée et enfin, un calcul d'un score final pour chaque
région, représentant la probabilité de correspondre
à une segmentation de lésion appropriée. L'algorithme
atteint un indice Jaccard d'environ 0,679.
Dans le travail d'Agarwal et al., une méthode de
segmentation des lésions cutanées basée sur la technique
du clustering est utilisée. D'abord, l'image RGB est convertie en espace
couleur L*a*b*. Une combinaison stratégique est appliquée aux
différents canaux de l'espace L*a*b* pour obtenir une nouvelle image en
niveaux de gris dans laquelle les pixels de la lésion et de la peau sont
plus différenciables. Ensuite, le clustering K-means est mis en oeuvre
pour segmenter la lésion de l'image prétraitée. Enfin, une
étape de post-traitement utilise un filtre moyenneur et un seuillage
basé sur la surface, pour supprimer les pixels bruités (les faux
positifs) de l'image segmentée. La méthode proposée a
été testée sur 50 images de la base de données
public DermIS et DermQuest. Les valeurs du score de chevauchement et du
coefficient de corrélation de la méthode proposée sont
respectivement de 96,75% et 97,66%.
3.3.4. Segmentation basée sur les réseaux
neuronaux convolutifs.
Récemment, les réseaux neuronaux convolutifs ont
été adoptés pour augmenter la précision de la
segmentation des images de lésions cutanées.
Zhang et al., ont développé une structure de
réseau de neurones CNN pour segmenter les lésions
cutanées. L'architecture du réseau comprend plusieurs couches de
convolution, des couches softmax, plusieurs filtres et des
fonctions d'activation. Une fonction d'activation non linéaire
(telle que ReLU et ELU) est utilisée pour
atténuer le problème de disparition du gradient et RMSprop/Adam
sont incorporés pour optimiser l'algorithme de perte. La méthode
a été testée sur l'ensemble de données ISIC 2017,
et elle a atteint une précision de 0.91 qui est plus
élevée que les architectures existantes.
P a g e | 51
Dans le travail de Yu et al., un nouveau réseau
résiduel entièrement convolutif (FCRN) de plus de 50 couches est
proposé, pour la segmentation des images dermoscopiques. Des
expériences sur la base de données ISIC 2016 ont montré
l'efficacité de la méthode proposée. Le FCRN à 50
couches a donné de meilleurs résultats que les architectures
VGG-16, GoogleNet, FCRN-38 et FCRN-100, avec une précision de
segmentation de 94,9%.
Yuan Y. et al., utilisent un réseau convolutif profond
à 19 couches pour la segmentation des lésions cutanées.
L'augmentation des données d'image a été adoptée
pour résoudre le problème des données limitées. De
plus, les performances de segmentation ont été
améliorées par l'utilisation de techniques telles que
la normalisation par lots (Ioffe et al., 2015),
l'optimisation Adam (Kingma et al., 2014) et
la fonction de perte basée sur l'indice Jacquard
(Yang X. et al., 2017). Les résultats expérimentaux
ont montré que la méthode proposée surpasse les autres
algorithmes de l'état de l'art sur la base de données ISIC 2016,
avec un indice de Jaccard de 0,861.
Yang X. et al., ont utilisé l'architecture U-Net pour
segmenter les lésions cutanées. Le modèle d'apprentissage
profond multitâche proposé est entraîné et
évalué sur l'ensemble d'images dermoscopiques ISIC 2017, qui
comprend 2000 échantillons d'entraînement et 150
échantillons d'évaluation. Les résultats
expérimentaux montrent que le modèle d'apprentissage profond
multitâche proposé atteint des performances prometteuses sur la
segmentation des lésions cutanées. La valeur moyenne de l'indice
de Jaccard pour la segmentation des lésions est de 0,724.
Dans l'article de Lin et al., une étude comparative de
deux approches différentes de la segmentation des lésions
cutanées est présentée. La première approche
utilise des U-Nets et introduit une étape de prétraitement
basée sur l'égalisation des histogrammes. La deuxième
approche est une approche basée sur le clustering K-means. Les
expériences ont été testées sur l'ensemble de
données ISIC 2017 pour valider l'étude comparative. En comparant
les deux algorithmes proposés, les U-Nets ont obtenu un indice de
Jaccard significativement plus élevé (0.62) par rapport à
l'approche de clustering (0.44).
P a g e | 52
3.4. Classification des lésions
cutanées.
Différencier les cas malins du
bénins, comme le montre la figure 30 est une tâche
très difficile, même pour des spécialistes
expérimentés. L'utilisation de techniques informatiques et
d'algorithmes peut être d'une grande aide.
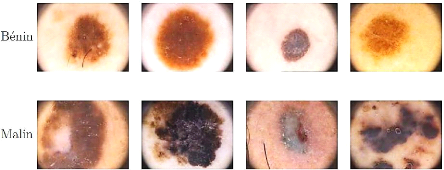
Figure 30. Échantillon des
lésions bénignes et malignes de la base des
images
dermoscopiques PH2.
Kasmi et al., ont proposé d'automatiser la règle
ABCD afin de discriminer les tumeurs malignes des tumeurs bénignes. Une
étape de prétraitement est utilisée pour éliminer
les artefacts (bulles et poils fins) à l'aide d'un filtre médian.
Les poils épais sont détectés en utilisant des filtres de
Gabor avec différentes fréquences et orientations. Ensuite, les
lésions sont segmentées par la méthode des contours actifs
géodésiques (GAC). Enfin, les valeurs de A, B, C et D sont
estimées par différents algorithmes et le Total Dermoscopic Score
(TDS) est calculé. Testé sur 200 images dermoscopiques,
l'algorithme atteint un taux de sensibilité de 91,25%, une
précision de 95,83% et une exactitude de 94,0%.
Jaworek et al., ont utilisé la forme et la texture de
la lésion pour détecter le mélanome à son stade
précoce avec un classificateur SVM. La méthode proposée
contient les étapes suivantes : l'étape du prétraitement
qui comprend l'élimination du cadre noir, le lissage des bulles d'air et
la suppression des poils noirs en utilisant un filtre gaussien et les
opérations morphologiques. Ensuite, une segmentation des lésions
basée sur l'algorithme de croissance de régions est
utilisée. L'extraction des caractéristiques est basée sur
les deux techniques, la règle ABCD pour la forme et 7-points checklist
pour la texture. Ils ont utilisé un ensemble de 200 images et ont obtenu
une sensibilité de 90%, une spécificité de 96% et une aire
sous la courbe de 93,24%.
Dans l'article de Barata et al., un ensemble de
caractéristiques est utilisé. L'étude compare le poids des
descripteurs de couleur (moments et histogrammes) et de texture (Gabor et Laws)
pour le mélanome. Les résultats montrent que les
P a g e | 53
descripteurs de couleur fonctionnent mieux que les
descripteurs de texture et que de bons résultats de classification
peuvent être obtenus en utilisant SVM, avec une sensibilité de 93%
et une spécificité de 88% sur un ensemble de données de
176 images dermoscopiques. La fusion des descripteurs de couleur et de texture
a également obtenu de bons résultats, avec une sensibilité
de 96%, spécificité de 82% pour la combinaison des moments avec
les descripteurs de texture Gabor et Laws.
Alfed et al., combinent la texture (histogramme des gradients,
histogramme des lignes) avec les angles des vecteurs de couleur et les moments
de Zernike comme caractéristiques pour classer les mélanomes des
lésions bénignes de l'ensemble de données PH2. En
utilisant trois classificateurs : SVM, Adaboost et ANN, la méthode
atteint une sensibilité de 99,41%, une spécificité de
98,18% et une précision de 98,79%.
Majumder et al., ont utilisé un réseau neuronal
à rétropropagation (BNN) basé sur les
caractéristiques de la règle ABCD pour classer les
mélanomes et les tumeurs bénignes dans l'ensemble de
données PH2. Ils ont développé cinq
caractéristiques pour classer les mélanomes malins et
bénins. Ces caractéristiques sont le score d'asymétrie
(AS), l'irrégularité des bords (B), la variation des couleurs
(C), le diamètre (D1) et la différence entre les diamètres
de Feret maximum et minimum de l'ellipse la mieux adaptée à la
lésion (D2). La technique proposée atteint une précision
de 98%, une sensibilité de 95% et une spécificité de
98,8%.
Hagerty et al., mélangent les caractéristiques
classiques et d'apprentissage profond après les avoir
évaluées individuellement. D'une part, les trois
caractéristiques classiques sont d'inspiration biologique et
d'information clinique : réseau de pigments atypiques, distribution des
couleurs et vaisseaux sanguins. Les informations cliniques comprennent les
informations soumises au pathologiste - âge du patient, sexe, emplacement
de la lésion, taille et antécédents du patient. Les
caractéristiques d'apprentissage profond utilisent le transfert de
connaissances par l'intermédiaire d'un réseau ResNet-50 qui est
reconverti pour prédire la probabilité de classification du
mélanome. Les scores de classification de chaque caractéristique
individuelle, classique et d'apprentissage profond, sont ensuite
assemblés à l'aide de la régression logistique pour
prédire une probabilité globale des mélanomes. Les
résultats de classification des mélanomes effectuée sur un
ensemble de données HAM10000 comprenant 9174 lésions,
mesurés par l'aire sous la courbe (AUC), montrent l'efficacité
des caractéristiques de fusion en obtenant une précision de
classification de 0,94.
Moura et al., utilisent la règle ABCD et des
caractéristiques de réseaux neuronaux convolutionnels
pré-entraînés CNN : Vgg-m, Vgg-f, Vgg-verydeep-19 et
CaffeNet. A partir du masque binaire, fourni par la base de données
utilisée, la lésion cutanée est segmentée. Les
images originales RGB sont converties dans l'espace couleur HSV. Ensuite, les
caractéristiques sont extraites par les descripteurs de la
P a g e | 54
composante générée par la somme des plans
S et V, puis les descripteurs les plus pertinents sont choisis. Enfin, un
classificateur Perceptron multicouche est utilisé pour distinguer le
mélanome des lésions bénignes. La méthode
proposée a été testée sur les deux bases de
données PH2 et DermIS. La méthode a présenté de
bons résultats avec un taux de précision de 94,9% et un indice de
Kappa de 89,2%.
Hirano et al., ont développé un système
de diagnostic automatisé pour l'identification du mélanome en
utilisant des données hyperspectrales (HSD) et GoogLeNet. Le GoogLeNet
préformé, est utilisé pour alimenter le HSD, ils ont
ajouté un nouveau réseau, appelé "Mini Network", qui
effectue une réduction de taille juste avant la couche d'entrée
de GoogLeNet. Les travaux ont utilisé 619 lésions pour
l'entraînement et les tests. L'évaluation sur 5 validations
croisées indique que sans augmentation des données, la
sensibilité, la spécificité et la précision sont
respectivement de 69.1%, 75.7% et 72.7%. Et avec l'augmentation des
données, la sensibilité, la spécificité et la
précision sont respectivement de 72.3%, 81.2% et 77.2%.
La méthode de classification du mélanome
proposée par Jojoa Acosta et al., se compose de deux étapes :
tout d'abord, la région d'intérêt est
délimitée à l'aide de la technique du masque et du
réseau neuronal convolutif basé sur la région, puis un
classificateur basé sur la structure ResNet152 est utilisé pour
distinguer les lésions malignes. La méthode est
évaluée sur l'ensemble de données ISIC 2017 et atteint une
précision de 90,4%, une sensibilité de 82% et une
spécificité de 92,5%.
Fekrache et al., ont proposé un système
automatisé qui utilise un algorithme de segmentation basé sur les
colonies de fourmis, puis trois types de caractéristiques sont extraits,
basées sur les propriétés géométriques de la
lésion telles que décrites par la règle ABCD, les
caractéristiques de textures calculant des caractéristiques
basées sur l'histogramme du premier ordre, et la couleur relative. 112
caractéristiques sont extraites et 12 attributs pertinents sont
sélectionnés à l'aide de l'algorithme Relief. Deux
classificateurs sont utilisés, le KNN et ANN. Le système
proposé est testé sur 172 images dermoscopiques et atteint une
précision de 85.22% et 93.60% avec KNN et ANN respectivement.
P a g e | 55
| 


