|
Massothérapie équine
Formation Equi'one + - Année 2022
Accompagner le cheval
atteint du syndrome
de narcolepsie-cataplexie
1
par
Lisa Lucarelli
2
3
REMERCIEMENTS
A Sandrine Pabst,
pour ses connaissances, son savoir-faire, mais plus encore sa
confiance en nous et pour la qualité des enseignements fournis tout au
long de cette formation.
A tous les intervenants lors de cette formation,
pour avoir apporter leurs connaissances complémentaires et
notions dans leurs domaines d'expertise respectives.
A mes camarades,
pour la bonne ambiance générale.
Aux chevaux et propriétaires,
pour leur confiance et leur patience.
A mes proches,
pour leur soutien et leur foi en ma réussite, avec une
mention spéciale pour mon père qui m'a accompagnée
à chaque session de formation.
4
TABLE DES MATIÈRES
Table des figures 9
Liste des abréviations 10
Introduction 12
PREMIÈRE PARTIE : ORIGINE DU SYNDROME DE NARCOLEPSIE-
CATAPLEXIE 13
I. Système éveil-sommeil du cheval 14
A) Historique du sommeil 14
B) Les différents états de vigilance 14
1) L'éveil 14
2) La somnolence 14
3) Le sommeil lent 15
4) Le sommeil paradoxal 16
C) Caractéristiques biologiques des états de
vigilance 17
1) L'éveil 17
2) La somnolence 17
3) Le sommeil lentement 17
4) Le sommeil paradoxal 18
II. Le système nerveux central fonctionnel 18
A) Neurochimie des états de vigilance 18
1) Organisation globale du cerveau 19
2) Neurones adrénergiques et noradrénergiques
20
3) Neurones cholinergiques 20
4) Neurones sérotoninergiques 21
5) Neurones histaminergiques 21
6)
5
Neurones GABA-ergiques 22
7) Neurones glutamatergiques 22
8) Neurones glycinergiques 22
9) Neurones hypocrétinergiques et à MCH 22
B) Le maintien de l'éveil 23
C) Apparition et maintien du sommeil lent 24
D) Apparition et maintien du sommeil paradoxal 24
E) La transition entre sommeil paradoxal et éveil 25
F) La régulation du cycle veille-sommeil 25
1) La régulation homéostatique 26
a) État physiologique 26
a.1) Le statut énergétique 26
a.2) La fatigue 26
a.3) Le stress 27
a.4) Les émotions 27
b) La dopamine 27
c) Les facteurs hypnogènes 28
c.1) Adénosine 28
c.2) Autres facteurs hypnogènes 28
2) La régulation circadienne 29
a) Les conditions environnementales 29
b) Les rythmes biologiques 29
c) Les noyaux supra-chiasmatiques 30
3) L'hypothalamus, intégrateur des différents
systèmes de régulation 30
4) Neurones à hypocrétine et régulation des
états de vigilance 30
III. Dysfonctionnement neuronal 31
A) Historique et définitions 31
1) Historique 31
2) Définitions 32
B) Traduction clinique pour le cheval 33
1) Les symptômes 33
2) Les formes familiales 33
3) Les formes acquises 34
C) Pathogénie du syndrome de narcolepsie-cataplexie 35
1) Les premières pistes 35
2) Le rôle de l'hypocrétine 36
a) Généralités 36
b) Le rôle de l'hypocrétine dans la narcolepsie
36
c) Le rôle de l'hypocrétine dans la cataplexie
37
3) Bases génétiques de la narcolepsie-cataplexie
38
a) Chez l'homme 38
b) Chez le chien 38
c) Chez le cheval 38
4) Étiologie du dysfonctionnement du système
hypocrétinergique : une hypothèse
pour les maladies auto-immunes 39
DEUXIÈME PARTIE : LE RÔLE DU MASSOTHÉRAPEUTE
40
I. Problèmes physiques dus au syndrome de
narcolepsie-cataplexie 41
A) Problèmes physiques 41
B) Lésions fréquentes 41
II. Techniques thérapeutique 42
A) Le massage 42
B) Le stretching 43
C) L'algothérapie 44
D) Le K-Taping 45
E) La fasciathérapie 45
III. Autres accompagnements 46
A) Professionnels du milieu équin 46
B) Les outils 47
TROISIÈME PARTIE : DIAGNOSTIC ET TRAITEMENTS 48
6
I. Difficultés de diagnostic 49
A) Un diagnostic d'exclusion 49
B) Diagnostic différentiel 49
1) Narcolepsie sans cataplexie 49
2) Narcolepsie avec cataplexie 50
C) Examens complémentaires 51
D) Diagnostic pharmaceutique 51
II. Traitements médicaux 52
A) Lutte contre les attaques de narcolepsie et cataplexie 52
B) Pronostic 53
C) Les options de traitement 53
III. Cas cliniques 55
1) Hongre Quarter Horse de douze ans 55
2)Hongre Quarter Horse de huit ans 55
Conclusion 57
7
Références 58
8
9
TABLES DES FIGURES
Figure 1 : Cheval en état de somnolence
Figure 2 : Cheval en décubitus sternal
Figure 3 : Cheval en décubitus transversal
Figue 4 : Principales structures impliquées dans
le cycle vielle-sommeil
Figure 5 : Mécanisme de stabilisation de la
veille et du sommeil par les neurones à hypocrétine
10
LISTE DES ABRÉVIATIONS
5HT: sérotonine
A: adrénaline
A/C: région contenant des neurones adrénergiques
et noradrénergiques
Ach : acétylcholine
ACP: acépromazine
ACVIM : American College of Veterinary Internal Medicine
ADA: adénosine
ATP : adénosine tri-phosphate
BMH : barrière hémato-méningée
bpm : battements par minute
cm : centimètre(s)
CRH : hormone de libération de la corticotropine
dDpMe: noyau réticulé profond
mésencéphalique dorsal
DLA : Dog Leukocyt Antigen, antigène leucocytaire
canin
DMPAG : partie dorsomédiane de la substance grise
périaqueducale
Dop : dopamine
DPGi : noyau réticulé dorsal
paragigantocellulaire
DRN : noyau dorsal du raphé
ECG : électrocardiogramme
EEG : électroencéphalogramme
EMG: électromyogramme
EOG : électro-oculogramme
FC : fréquence cardiaque
FR : fréquence respiratoire
GABA : ã-aminobutyric acid
GH : hormone de croissance
GiA : noyau gigantocellulaire alpha
GiV : noyau réticulé ventral
gigantocellulaire
Gly : glycine
Glut : glutamate
HCRT : hypocrétine
His : histamine
HLA : Human Leukocyt Antigen, antigène leucocytaire
humain
HT: hypothalamus
kg : kilogramme(s)
LC : locus coeruleus
LCR : liquide céphalorachidien
LDT : noyau tegmental latéro-dorsal
LH : hypothalamus latéral
LPGi : noyau latéral paragigantocellulaire
m : mètre(s)
11
MCH : hormone de mélanoconcentration
mL : millilitre
MOR: mouvement oculaire rapide
mpm : mouvements par minutes
ms : milliseconde
NO : oxyde d'azote
NorA : noradrénaline
NPY : neuropeptide Y
NSC : noyaux supra-chiasmatiques
PA : pression artérielle
PPT : noyau pédunculopontin
REM : rapide eye movement
SL: sommeil lent
SLD : noyau sublatérodorsal
SNC : système nerveux central
SP: sommeil paradoxal
SWS : slow wave sleep
T: température
TB : télencéphale basal
TMN: noyau tubéro-mamillaire
TNFá : Tumor Necrosis Facteur (facteur nécrosant
tumoral)
VLPAG : partie ventrolatérale de la substance grise
périaqueducale
VLPO : noyau ventrolatéral pré-optique
VU: valeurs usuelles
á : alpha
12
INTRODUCTION
Sur les réseaux sociaux, j'ai fait la découverte
d'une vidéo montrant un cheval qui fait une crise qui pourrait
s'apparenter à de la narcolepsie-cataplexie. Je ne connaissais pas
l'existence de ce syndrome chez les chevaux. Cela m'a donné envie de
savoir comment accompagner au mieux un cheval avec le syndrome de
narcolepsie-cataplexie en tant que massothérapeute équin.
J'ai tout d'abord cherché à comprendre ce qu'il se
passe à l'intérieur du cerveau pour mieux comprendre la maladie,
ses symptômes et les équidés victimes de cela afin de
trouver les meilleurs méthodes et outils qui seront le plus utiles et
bénéfiques pour les propriétaires et les
équidés eux-mêmes.
13
PREMIÈRE PARTIE :
ORIGINE DU SYNDROME
DE NARCOLEPSIE-CATAPLEXIE
14
I. Système éveil-sommeil du cheval
A) Historique du sommeil
Le sommeil est un état qui s'est développé
et complexifié tout au long de l'Evolution, il est présent chez
la majorité des espèces vivantes recensées, bien qu'il ne
s'agisse pas du sommeil tel que nous le connaissons et l'envisageons chez les
humains (CLEMENT 2011). Des études récentes proposent
l'hypothèse que le sommeil possède une fonction de restauration.
Il a un rôle de repos cérébral vis-à-vis des
stimulations sensorielles et un rôle d'entretien des circuits neuronaux
(KAVANAU 1997). C'est chez les vertébrés supérieurs
(VALATX 1998) que ce sommeil est plus profond et adapté au
développement cérébral, divisé en deux états
distincts (BENOIT and FOREST 1995 ; NICOLAU et al. 2000). Durant le sommeil
lent, le tonus musculaire est réduit, et durant le sommeil paradoxal, le
tonus quant-à-lui est totalement inhibé, en dehors des mouvements
oculaires (CLEMENT 2011). Les fonctions propres de ce dernier sont encore
à ce jour non complètement élucidées, mais il
apparaît indispensable à certains aspects développementaux
comme la neurogenèse, la maturation cérébrale ou encore
l'apprentissage (KAVANAU 1997). Il reste certains inconvénients au
sommeil à commencer par la vulnérabilité dans laquelle il
laisse les animaux qui dorment (KAVANAU 1997) mais il est important de rappeler
que la privation sélective de sommeil paradoxal est létale au
bout de deux à trois semaines (CLEMENT 2011).
B) Les différents états de vigilance du cheval
1) L'éveil
Au total, le cheval n'a besoin que de 4 à 6 h de sommeil
englobant la somnolence, le sommeil lent et le sommeil paradoxal (BERTONE
2007), c'est pourquoi l'état de vigilance le plus fréquent chez
le cheval est l'éveil (BERTONE 2016). En tant qu'herbivore non ruminant,
le cheval passe la plupart de son temps à brouter pour obtenir ses
apports énergétiques : il passe 60 % de son budget-temps à
pâturer, en conditions naturelles (VIDAMENT 2016). Le cheval est par
nature assez craintif, toujours prêt à fuir (WILLIAMS et al.
2008). Le cheval se tient debout, reste en alerte et réactif aux stimuli
environnementaux.
2) La somnolence
Il est habituel d'observer, au pré ou à
l'écurie, des chevaux qui somnolent, port de tête
légèrement bas, yeux-mis clos, la lèvre inférieure
relâchée, avec un postérieur fléchi tout en
étant statique (VIDAMENT 2016) (voir figure 1). On dit que le cheval
«dort» debout (TOBLER 1995). Tout cela est possible grâce
à leur anatomie spécifique de l'articulation de leurs membres
inférieurs : les fibro-cartilages parapatellaires très
développés, notamment médialement, permettant de bloquer
la rotule sur un relief du fémur, donc l'angle articulaire physiologique
est maintenu et permet ainsi au cheval d'avoir les muscles
relâchés et de ne pas tomber. Ce qui autorise aussi une
économie de gestion cérébelleuse de l'équilibre.
Cet état de vigilance lui permet de se reposer tout en restant prompt
à prendre la fuite. Le cheval passe en moyenne deux heures
réparties dans sa journée dans cet état de somnolence
(REED, BAYLY, and SELLON 2010).

|
Figure 2 : Cheval dormant en décubitus
sternal.
Crédit photo : Aurélie Huilio.
15
|
Figure 1 : Cheval en état de somnolence. Le cheval
au premier plan "dort debout", il présente les caractéristiques
précédemment décrites. Crédit photo : BLW.
3) Le sommeil lent
Le sommeil lent (SL), ou aussi appelé sommeil à
ondes lentes désigné sous le terme SWS, diminutif de Slow Wave
Sleep en anglais, peut avoir lieu seulement si le cheval se sent en
sécurité dans son environnement. La position adoptée est
le décubitus sternal (VIDAMENT 2016) couché en «vache»
(voir figure 2), le rend en effet vulnérable aux éventuelles
attaques de prédateurs, il est important que les chevaux au box comme au
pré ne soient pas isolés et d'éviter les nuisances sonores
et lumineuses. Le port de la tête est bas voire appuyé sur un
objet, les oreilles relâchées et les yeux sont fermés
(VIDAMENT 2016). Quand il reste debout, il modifie sa charge sur les pattes
arrière. En moyenne le cheval passe un total de trois heures par jour
(BERTONE 2016) en sommeil lent, fractionné tout au long de la
journée. Ce sommeil n'est pas limité qu'aux heures nocturnes et
il est qualifié de polyphasique (ALEMAN 2015). Il est possible que le
cheval se prive plusieurs jours de sommeil si les conditions de confort ou de
sécurité (PEDERSEN, SONDERGAARD, and LADEWIG 2004) ne sont pas
respectées (BERTONE 2016), comme d'autres animaux de troupeau. Les
chevaux restent attentifs à leur environnement et peuvent se
réveiller au moindre bruit.
16
4) Le sommeil paradoxal
Le sommeil paradoxal (SP) tient son nom du paradoxe entre un
relâchement musculaire profond et un cerveau actif (CLEMENT 2011). Il est
qualifié de «sommeil actif» (MONTI, PANDI-PERUMAL, and SINTON
2008) et aussi appelé par les anglophones, sommeil REM (Rapid Eyes
Movements). Le cheval passe moins d'une heure par jour en sommeil paradoxal
(BERTONE 2016) et par périodes de 30 minutes maximum (VIDAMENT 2016). Le
sommeil paradoxal chez le cheval occupe un total d'environ 15 % du temps global
de sommeil (ALEMAN 2015). Le plus souvent le cheval est en décubitus
latéral (VIDAMENT 2016) (voir figure 3). Dans cette position, les
muscles du cou et de la nuque sont complètements détendus, ce qui
fait que cette phase est particulièrement importante pour la
récupération musculaire. Il arrive aussi qu'il soit en
décubitus sternal avec le poids de la tête supporté par le
sol ou un objet (ALEMAN 2015). Dans ces deux cas, les yeux sont fermés
(KAVANAU 1997). D'après certains auteurs, le sommeil paradoxal serait
possible en station debout. Dans ce cas, la durée des épisodes de
sommeil sont très courtes en raison de l'atonie musculaire,
entraînant le début d'une chute qui causerait le réveil du
cheval (CLEMENT 2011). Hormis des épisodes de mouvements rapides des
yeux (Rapid Eyes Movement d'où l'appellation REM-Sleep chez les
anglophones), de tremblements aux extrémités des membres, des
naseaux ou encore des frissons (ALEMAN 2015) observables pendant de
supposés rêves, cet état se caractérise par une
absence de tonus musculaire ou atonie musculaire (SCHULZ and SALZARULO 2012).
Bien sûr, les appareils respiratoires et cardiovasculaires ne sont pas
impactés par cette atonie. En temps normal, le sommeil paradoxal a
toujours lieu après le sommeil lent et par la suite un réveil,
qui peut ne durer que quelques secondes avant un nouvel endormissement
(DEFLANDRE et al. 2002). Il a été observé que les chevaux
ont une capacité rapide à entrer en sommeil paradoxal, cela
minimise le temps en position vulnérable (CLEMENT 2011). Il reste
intéressant de constater que les totaux de sommeil nécessaires
pour le cheval correspondent aux minima convenables chez les humains,
particulièrement en situation difficiles.

Figure 3 : Cheval dormant en décubitus
latéral. Crédit photo : Le temple du sommeil.
17
C) Caractéristiques biologiques des états de
vigilance
On va étudier quelques caractéristiques biologiques
selon les différents états de vigilances : les mouvements
oculaires, le tonus musculaire et d'autres paramètres comme les
fréquences cardiaque et respiratoire seront tous observés et
interprétés par l'électro-encéphalogramme (EEG),
l'électro-oculogramme (EOG), l'électromyogramme (EMG),
l'électrocardiogramme (ECG), pour comprendre les
spécificités de chaque état.
1) L'éveil
Lors de l'éveil, les mouvements oculaires sont bien
présents. Le cheval est attentif et réactif à son
environnement, il a le contrôle conscient de ce qu'il veut observer et de
ses mouvements oculaires (ALEMAN 2015). Le tonus musculaire est bien
présent et le cheval a bien le contrôle conscient de ses
différents muscles (ALEMAN 2015). Il est en pleine possession de ses
moyens dont ses moyens locomoteurs quand il est éveillé. On parle
aussi d'autres paramètres biologiques qui présentent eux aussi un
intérêt de l'étude des cas de vigilance, les
fréquences cardiaque (FC), les fréquences respiratoire (FR), la
pression artérielle (PA) et la température (T) (CLEMENT 2011).
Pendant l'éveil, elles sont comprises dans les valeurs habituelles de
l'espèce (LE POINT VETERINAIRE 2016) :
-FC= 26-50 battements par minute (bpm) au repos et 220 bpm
maximum pendant l'effort puis 60-110 bpm après l'effort, retour à
la valeur au repos (+10%) en moins de 10 minutes dans un environnement
calme.
-FR= <24 mouvements par minute (mpm), l'augmentation est
variable pendant l'exercice en fonction de l'intensité du travail,
retour à la valeur de repos (+10%) en moins de 10 min.
-PA= 100 mmHg
-T= 36,8 à 38,3°C
2) La somnolence
Lors de la somnolence, les mouvements oculaires sont toujours
sous son contrôle conscient, ils sont lents et occasionnels (ALEMAN
2015). Quand le cheval somnole, ses yeux sont mi-clos voire fermés.
Pendant l'état de somnolence, le tonus musculaire est toujours bien
présent, dans cet état de vigilance, il est plus que
nécessaire à la station debout (LE POINT VETERINAIRE 2016). Les
fonctions végétatives ralentissent (VALATX 1998). Les
fréquences cardiaques et respiratoires sont dans les normes basses des
valeurs usuelles au repos (WILLIAMS et al. 2008).
3) Le sommeil lent
On se sert d'un électro-oculogramme pour évaluer
les mouvements oculaires du cheval. Dans la phase de sommeil lent, les
mouvements sont théoriquement possibles mais surviennent en pratique peu
fréquemment (MURPHY 2010). Donc les mouvements oculaires sont quasiment
absents. Sur un EMG il est visible avec la diminution d'amplitude des ondes
correspondantes que le tonus musculaire persiste mais est diminué
(VALATX 1998). Les 4 paramètres étudié diminue, lorsque le
cheval dort (SCHULZ and SALZARULO 2012 ; MURUBE 2008). Il faut souligner la
possible et non rare apparition d'un bloc atrio-ventriculaire de second
degré (altération de la conduction entre les oreillettes et les
ventricules) uniquement pendant ce stade de vigilance (WILLIAMS et al. 2008 ;
ALEMAN 2015).
18
4) Le sommeil paradoxal
L'EOG est le plus intéressant et caractéristique en
sommeil paradoxal. Il faut rappeler qu'en anglais son appellation est «REM
Sleep» qui signifie «sommeil avec mouvements oculaires rapides».
Cette caractéristique a initialement permis de différencier les
différents stades de sommeil au cours des recherches scientifiques
(WILLIAMS et al. 2008), mais son origine et sa fonction restent à ce
jour non interprétés (MURUBE 2008). Une caractéristique
fondamentale du sommeil paradoxal est l'atonie musculaire (MURPHY 2010). L'EMG
est plat donc tonus musculaire absent (VALATX 1998 ; McCARLEY and SINTON 2008).
On parle de tonus musculaire «phasique» (REED, BALLY, and SELLON
2010). Seules des contractions involontaires et isolées de faisceaux
musculaires de la face, ainsi que des tremblements des membres sont
régulièrement observables (ALEMAN 2015) et notamment pendant les
épisodes de rêves (SCHULZ and SALZARULO 2012). Cette atonie ne
touche pas les muscles cardiaques, respiratoires et oculomoteurs (WILLIAMS et
al. 2008). Les fréquences cardiaques et respiratoires ont une valeur de
base semblable à celle du SL en SP (WILLIAMS et al. 2008) avec des
épisodes où elles deviennent plus rapides et
irrégulières (VALATX 1998 ; MURUBE 2008 ; SCHULZ and SALZARULO
2012). En état de vigilance, la thermorégulation du cheval est
mal gérée, il est beaucoup plus dépendant de la
température extérieure (MURUBE 2008). Les quantifications de la
circulation sanguine cérébrale sont compliquées à
établir de façon précise et certaine mais, elles seraient
plus importantes qu'en SL. La pression artérielle peut présenter
des pics d'augmentation de valeur. Le cheval peut avoir des réveils
prématurés en raison d'une meilleure réceptivité
aux stimuli externes (SCHULZ and SALZARULO 2012).
En rassemblant toutes ces données, on sait que chaque
état de vigilance a des caractéristiques physiologiques qui lui
sont propres. Les facteurs les plus importants sont l'activité
cérébrale, le tonus musculaire et les mouvements oculaires, tous
mesurés par EEG, EMG ou EOG. Il faut retenir que :
-L'activité cérébrale est comparable en
éveil et en SP.
-L'atonie musculaire en sommeil paradoxal, hormis des MOR.
-L'EEG du SL présentes des rythmes corticaux
synchronisés, des ondes lentes et des fuseaux (pas
détaillé plus haut).
II. Le système nerveux central fonctionnel A)
Neurochimie des états de vigilance
Le cerveau est un organe complexe, difficile à
appréhender. Il régit de très nombreuses fonctions et a de
nombreuses divisions, aires, noyaux qui peuvent être difficiles à
imager (KIMBERLIN, ZUR LINDEN, and RUOFF 2017 ; RODRIGO-ANGULO et al. 2008).
Cette partie de texte a pour rôle d'expliquer au mieux les
mécanismes neurologiques et neurochimiques dirigeant les
différents états de vigilance, de manière rapide et
simplifié au maximum.
Le terme d'éveil ou de veille inclus l'éveil actif
et la somnolence précédemment expliqués. En effet, la
somnolence est un état d'éveil calme. Dans des conditions
physiologiques habituelles, une
19
personne ne s'endort pas lorsqu'elle est active, elle
éprouve d'abord un état de repos et de somnolence. Seul le terme
d'éveil sera donc utilisé.
Il convient également de noter que la plupart des
études ont été faites sur des rongeurs et des
félins. Le consensus est que ces données sont largement
applicables à d'autres espèces de mammifères (CLEMENT 2011
; TOBLER 1995). Par conséquent, on peut émettre
l'hypothèse que le mécanisme cérébral du sommeil
chez le cheval est cohérent avec les modèles établis par
les études des espèces mentionnées ci-dessus. Cependant,
les données présentées ici peuvent être
modifiées (au moins légèrement) à l'avenir si
d'autres études sont réalisées sur les
équidés. De plus, les données sur l'éveil et le
sommeil pourraient être révisées par de futures
découvertes.
1) Organisation cérébrale globale
La formation réticulée est un ensemble diffus de
neurones, ni moteurs ni sensitifs, très intégrés au
système nerveux central (SNC). Elle s'étend de la substance grise
périaqueducale jusqu'au bulbe rachidien (BARRAUD 2003 ; BONTEMPS 2013 ;
PRADES, LAURENT, and NAVEZ 1999).
La formation réticulée contient la substance grise
périaqueducale ventrolatérale et dorsomédiane
(respectivement VLPAG et DMPAG), le locus coeruleus (LC), le noyau dorsal du
raphé (DRN), les noyaux tegmentaux latérodorsal et
pédiculopontin (LDT et PPT), le noyau réticulé dorsal
paragigantocellulaire (DPGi), le noyau latéral paragigantocellulaire
(LPGi), le noyau réticulé profond mésencéphalique
dorsal (dDpMe), les neurones adrénergiques et noradrénergiques
dans le bulbe rachidien (A/C), les noyaux gigantocellulaires ventral et alpha
(GiV et GiA). Ainsi, la formation réticulée contient de
nombreuses structures impliquées dans le cycle veille-sommeil et a
été décrit de système réticulé
ascendant activateur (BARRAUD 2003 ; BONTEMPS 2013 ; PRADES, LAURENT, and NAVEZ
1999). L'hypothalamus latéral (LH), le noyau tubéro-mamillaire
(TMN) et le noyau ventrolatéral pré-optique (VLPO) appartiennent
à l'hypothalamus (HT) (CLEMENT 2011), centre intégrateur des
informations viscérales et fonctionnelles en lien avec son rôle
hiérarchique de plus haut niveau d'intégration et de modulation
du système nerveux autonome (BONTEMPS 2013).
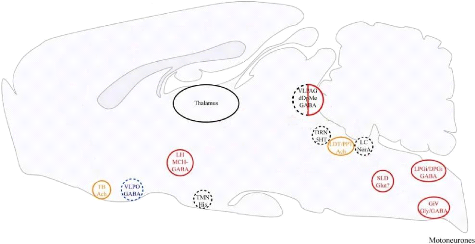
20
Figure 4 : Principales structures impliquées dans
le cycle veille-sommeil. Modifié d'après CLEMENT (2011).
2) Les neurones adrénergiques et
noradrénergiques
Adrénaline et noradrénaline sont deux
neurotransmetteurs appartenant à la famille des catécholamines.
Concernant le cycle veille-sommeil, les neurones noradrénergiques sont
essentiellement présents dans le LC (BARRAUD 2003), et donc dans un
groupe de neurones qui ne forment pas de noyaux à proprement parler dans
le tronc cérébral, appelés région contenant des
neurones adrénergiques et noradrénergiques (A/C), au niveau du
bulbe rachidien. A ce titre, il est placé au centre des circuits de
veille et de sommeil, ce qui en fait un élément important de
régulation des états de vigilance (CLEMENT 2011). Les neurones
noradrénergiques - ainsi que les neurones adrénergiques, bien
qu'en nombre beaucoup plus petit - ont des taux de décharge maximaux
pendant l'éveil (Ev), réduit pendant le sommeil à ondes
lentes (SL) et nul pendant le sommeil paradoxal (SP) (FABRE et 2011 ; NITZ et
Siegel 1997 ; Ohno et Sakurai 2008). Ils sont des promoteurs d'éveil et
se qualifient ainsi d'Ev-on et de SP-off(CLEMENT 2011;MONTI,PANDI-PERUMAL, and
SINTON 2008). L'inhibition du LC est nécessaire pour l'endormissement,
le LC a été décrit comme un système permissif par
rapport au SL et au SP, il joue un rôle clé dans
l'établissement et le maintien de l'éveil et de l'activation
corticale qui l'accompagne (Clement 2011).
3) Neurones cholinergiques
Les neurones cholinergiques sont divisés en deux
systèmes : le noyau basal de Meynert situés dans le
télencéphale basal (TB) (McCARLEY and SINTON 2008) et le
tengmentum ponto-mésencéphalique, lui-même divisé en
noyau tegmental latérodorsal (LDT) et noyau pédunculopontin (PTT)
(MONTI,PANDI-PERUMAL, and SINTON 2008 ; TAFTI et al. 1997). Ils
représentent l'afférence majeure du thalamus, connues pour
être impliquées dans l'activation
21
corticale (FABRE et al. 2011 ; CLEMENT 2011). Ces neurones se
déchargent plus rapidement pendant l'éveil et le SP que pendant
le SL (BARRAUD 2003 ; MONTI, PANDI-PERUMAL, and SINTON 2008). Les neurones
cholinergiques du TB se projettent de manière diffuse vers le cortex, le
thalamus et l'hippocampe. Le TB est en partie responsable de la
désynchronisation observée sur l'EEG au cours de l'éveil
et du SP (VANDENBUNDER 2002). Ils déchargent au maximum pendant
l'éveil et le SP, et à peine pendant le SL (CLEMENT 2011). Ainsi,
les neurones cholinergiques du tegmentum ponto-mésencéphalique et
du TB jouent un rôle dans l'activation corticale, aussi bien pendant
l'éveil que pendant le SP. Ils sont donc SP-on et Ev-on (CLEMENT 2011 ;
MONTI,PANDI-PERUMAL, and SINTON 2008).
4) Neurones sérotoninergiques
Les projections des neurones sérotoninergiques dans le
DRN sont presque identiques à celles du LC : ils se projettent sur la
quasi-totalité du système nerveux central (SNC) (BARRAUD 2003), y
compris l'hypothalamus et l'aire pré-optique, et reçoivent des
projections de HT, de la région pré-optique, de la formation
réticulée mésencéphalique, du LPGi et du DPGi
(CLEMENT 2011). La sérotonine est un neurotransmetteur qui a soit un
effet excitateur soit un effet inhibiteur (POITTE 2015). Le taux de
décharge des neurones sérotoninergiques est maximal pendant
l'éveil, fortement diminué pendant le SL et nul pendant le SP
(McCARLEY and SINTON 2008 ; VALATX 1998 ; FABRE et al. 2011). Ils seraient donc
Ev-on et SP-off. Cependant, lors des transitions entre états de
vigilance, ces neurones sont également activés de manière
synchronisée, avec le retour d'activation corticale. Ainsi, ils sont
impliqués dans la régulation de l'éveil et du SP par leur
rôle dans l'activation corticale (WANG et al. 2005 ; CLEMENT 2011). Bien
qu'ils ne soient pas impliqués dans l'origine de cet état, ils
jouent également un rôle clé dans les mécanismes
responsables de l'éveil (CLEMENT 2011 ; MONTI, PANDI-PERUMAL, and SINTON
2008). Certains auteurs, dont M. Jouvet, ont comparé leur
activité à la mesure de la durée ou à
l'intensité de la veille ( JOUVET 1995). Enfin, ils ont un effet
permissif sur le sommeil, puisque celui-ci ne peut se produire si le DRN n'est
pas inhibé (CLEMENT 2011 ; MONTI, PANDI-PERUMAL, and SINTON 2008).
5) Neurones histaminergiques
Au niveau cérébral, l'histamine (His) est produite
presque exclusivement par des neurones appartenant au TMN du HT
postérieur (McCARLEY and SINTON 2008). Ces neurones histaminergiques
sont peu nombreux mais se projettent principalement vers l'ensemble du SNC,
notamment sur les structures impliquées dans l'état de vigilance
(VALKO et al. 2013 ; CLEMENT 2011). L'activité des neurones
histaminergiques est maximale pendant l'éveil attentif, diminue pendant
l'éveil calme et cesse complètement pendant le sommeil (SL et SP)
(McCARLEY and SINTON 2008 ; OHNO and SAKURAI 2008). Par conséquent, ils
sont qualifiés d'Ev-on et de SP-off. Cependant, ils ne sont pas
impliqués dans la genèse de l'éveil mais sont
nécessaires à son maintien grâce à leur rôle
dans l'activation corticale (CLEMENT 2011 ; MONTI, PANDI-PERUMAL, and SINTON
2008). Ils forment le réseau permissif du SP avec les neurones
adrénergiques, noradrénergiques et sérotoninergiques (soit
les neurones monoaminergiques) (VALATX 1998). En particulier, ils inhibent les
neurones MCH pendant l'éveil (PARKS et al. 2014).
6) 22
Neurones GABA-ergiques
Les neurones GABA-ergiques sont des neurotransmetteurs
inhibiteurs (POITTE 2015). Ils ne sont actifs que pendant le SL, ils sont donc
SL-on (USCHAVOL et al. 2006 ; CLEMENT 2011). La VLPO était essentiel
à l'origine et à l'entretien de ce stade (OHNO and SAKURAI 2008).
Selon un mécanisme mal connu, l'activation de ces neurones pourrait
être due à l'accumulation d'adénosine (ADA) au cours de
l'éveil (CLEMENT 2011). Les neurones GABA-ergiques du tronc
cérébral (VLPAG, LPGi, DPGi, GiV, GiA) se projettent
également sur de nombreuses structures impliquées dans le cycle
veille-sommeil. Ils inhibent les neurones SP-off et participent ainsi à
l'autorisation de la transition en SP (MONTI, PANDI-PERUMAL, and SINTON 2008).
Ceux de GiV et GiA contribuent également à l'atonie musculaire
observée dans le SP (VALATX 1998). Enfin, les neurones GABA-ergiques
contenus dans la LH sont divisés en une population SP-on et une autre
population Ev-on SP-off. Les deux populations se projettent l'une sur l'autre
(CLEMENT 2011 ; MONTI, PANDI-PERUMAL, and SINTON 2008). Ainsi, les neurones
GABA-ergiques impliqués dans le système veille-sommeil ont de
multiples rôles.
7) Neurones glutamatergiques
Les neurones glutamatergiques sont situés dans DLPAG et
SLD (PRADES, LAURENT, and NAVEZ 1999). Le glutamate est un neurotransmetteur
activateur (POITTE 2015), il a un rôle SP-on (CLEMENT 2011). Il est
également impliqué dans l'atonie musculaire
caractéristique du SP par le SLD (VANDENBUNDER 2002). Il serait
également produit en faible quantité par les neurones
MCH-ergiques et hypocrétinergiques du LH (SCHELE et al. 2012).
8) Neurones glycinergiques
La glycine est un neurotransmetteur inhibiteur (POITTE 2015).
Ces deux structures reçoivent les projections glutamatergiques en
provenance du SLD et sont responsables de l'inhibition des motoneurones au
cours du SP, ainsi que de l'atonie musculaire caractéristique de cette
phase (VALATX 1998 ; CLEMENT 2011).
9) Neurones hyprocrétinergiques et à MCH
À la fin du 20e siècle, deux groupes de chercheurs
ont simultanément découvert l'hypocrétine (HCRT) 1 et 2,
aussi appelés orexines A et B (NAHON 1998 ; OHNO and SAKURAI 2008). Ils
jouent de nombreux rôles dans l'homéostasie
énergétique de l'organisme, comme dans la prise alimentaire
(NISHINO and YOSHIDA 2003). C'est un neurotransmetteur excitateur (NISHINO
2007b). La distribution des neurones hypocrétinergiques est très
similaire à celle des neurones qui produisent l'hormone de
mélano-concentration (MCH) et est impliquée dans la
régulation de la prise alimentaire (Nahon 1998). Les neurones MCH ont
des autorécepteurs MCH, qui leur permettent d'établir un
auto-rétrocontrôle négatif (TORTEROLO, LAGOS, and MONTI
2011). Les neurones à HCRT et à MCH sont en outre
interconnectés (CLEMENT 2011). Les neurones HCRT sont également
particulièrement innervés par les noyaux supra-chiasmatiques
(NSC), suggérant un rôle important dans la régulation de la
veille et du sommeil (MIKKELSEN et al. 2001). Ils sont également
associés au système nerveux autonome et au système
endocrine et occupent ainsi une place centrale dans divers systèmes de
régulation (BONTEMPS 2013 ; HORVATH et al. 1999). Le taux de
23
décharge des neurones HCRT est maximal pendant
l'éveil, surtout s'il s'agit d'un éveil actif, et diminue pendant
le SL et le SP (LEE, HASSANI, and JONES 2005 ; FABRE et al. 2011).
Durant le SP, ils peuvent décharger en rafales de
manière phasique, pendant les phases de trémulations musculaires
(MONTI, PANDI-PERUMAL, and SINTON 2008). Les neurones MCH sont SP-on, et ils
favorisent le SP en inhibant la structure SP-off (dites permissives) qui inclut
les neurones à HCRT (KITKA et al. 2011 ; CLEMENT 2011). Cela illustre
l'importance de l'hypothalamus postérieur dans la régulation des
états de vigilance (NISHINO 2007b ; CLEMENT 2011). La MCH est un peptide
inhibiteur (MONTI, PANDI-PERUMAL, and SINTON 2008).
Pour synthétiser :
Les structures cérébrales impliquées dans le
cycle veille-sommeil et leurs neurotransmetteurs associés.
- Centres SP-on : DMPAG (Glut), LH (GABA, MCH),
VLPAG-dDpMe (GABA), SLD (Glut), LPGi (GABA), DPGi (GABA), GiV (Gly et GABA),
GiA (Gly et GABA)
- Centres SL-on : VLPO (GABA)
- Centres Ev-on/SP-off : thalamus, TMN (His),
VLPAG-dDpMe (GABA), LH (HCRT, GABA), DRN (5HT), LC (NorA), A/C (A, NorA)
- Centres Ev-on et SP-on : TB (Ach), LDT (Ach), PPT
(Ach)
Ces systèmes présentent donc une certaine
redondance entre eux, ce qui permet de compenser d'éventuels
défauts sur l'un des composants. Par conséquent, si l'une des
structures Ev-on est endommagée, l'animal peut toujours rester
éveillé, s'échapper ou se défendre et finalement
survivre. Les différents systèmes d'éveil semblent
également complémentaires, permettant différents niveaux
d'éveil et d'activation corticale. Des groupes de nature opposée
s'inhiberaient, ce qui permettrait de maintenir un état de vigilance
stable, plutôt qu'un mélange d'états différents. Ce
modèle est assez consensuel au sein de la communauté
scientifique.
B) Le maintien de l'éveil
L'activité simultanée de divers centres
d'éveil répartis dans tout l'encéphale est responsable de
l'état d'éveil. Ces centres, comme mentionné
précédemment, appartiennent à l'hypothalamus, au
télencéphale basal ou au système réticulé
activateur ascendant. Il existe une redondance entre ces différents
systèmes, et en cas d'endommagement de l'un des centres, il est possible
de réorganiser les systèmes et de maintenir l'éveil,
cruciale pour la survie de l'animal (VALATX 1998). Toutefois, cette redondance
n'empêche pas chaque centre d'être spécifique dans les
processus de l'éveil. En effet, certains noyaux prédisent les
changements de vigilance et participent ainsi à l'apparition de
l'éveil, comme le LC. D'autres sont spécifiquement
impliqués dans l'activation corticale présente pendant
l'éveil, tels que le TB, le DRN, le LDT et le PPT, donc dans le maintien
de l'éveil (McCARLEY and SINTON 2008). Quant au TMN, il intervient dans
les situations d'éveil attentif de manière plus
spécifique. Les neurones hypocrétinergiques du LH semblent
être des synchroniseurs généraux pour maintenir un
état d'éveil stable qui peut être adapté en fonction
des besoins de l'individu (NISHINO and YOSHIDA 2003). Ainsi, l'hypothalamus
24
semble être capital pour la gestion de l'éveil
(CLEMENT 2011). Certaines structures (DMPAG, GiV, GiA, LPGi, DPGi) ne sont pas
impliquées dans le maintien de l'éveil (CLEMENT 2011).
C) Apparition et le maintien du sommeil lent
L'éveil et le sommeil sont deux processus
étroitement liés, l'activation de l'un nécessite
l'inactivation de l'autre, sinon des cas pathologiques telles que l'insomnie
peuvent survenir. Par conséquent, pour déclencher le sommeil, le
sommeil doit être activé et l'éveil inhibé (OHNO and
SAKURAI 2008). Le sommeil qui suit la phase d'éveil est
physiologiquement un sommeil lent et jamais un sommeil paradoxal (BILLIARD 1998
; DEFLANDRE et al. 2002). Elle est produite par les neurones GABAergiques du
VLPO (FABRE et al. 2011), qui inhibent ce dernier de manière
synchronisée par leurs projections vers le système
d'éveil. De plus, ces neurones SL-on ont montré une augmentation
de leur taux de décharge avant l'établissement de la
synchronisation thalamo-corticale caractéristique en SL (CLEMENT 2011).
La genèse du SL peut s'expliquer par un mécanisme assez simple.
Durant l'éveil, tous les neurones SL-on de la VLPO sont inhibés
par l'ensemble des systèmes d'éveil. Lors du changement en SL,
les neurones SL-on annulent cette inhibition et s'activent, ce qui inhibe
à leur tour les systèmes d'éveil, améliorant ainsi
leur propre activité (BOUTREL and KOOB 2004). L'inhibition mutuelle des
systèmes d'éveil et de SL permet le maintien d'un état de
vigilance stable, soit le SL soit l'éveil. C'est la théorie du
flip flop (OHNO and SAKURAI 2008 ; CLEMENT 2011), également connue sous
le nom de modèle des interactions réciproques (MONTI,
PANDI-PERUMAL, and SINTON 2008).
Les neurones hypocrétinergiques sont excitateurs des
neurones monoaminergiques qui ont un rétrocontrôle négatif
sur les neurones à HCRT. Donc l'activité des neurones
monoaminergique est maintenue. Ceux-ci envoient des projections excitatrices
vers le cortex et inhibitrices vers la VLPO, centre du SL. Ce mécanisme
permet le maintien de l'éveil. Les neurones du HCRT reçoivent des
projections issues du système limbique, permettant de stimuler
l'éveil par le biais des émotions. Le sommeil est maintenu par
les neurones SL-on de la VLPO qui activés, inhibent les neurones
noradrénergiques et hypocrétinergiques. Dans la communauté
scientifique, le basculement en SL, donc l'endormissement serait dû
à l'accumulation de substance hypnogènes dont la plus connue est
l'adénosine (ADA) au niveau cérébral durant l'éveil
(BOUTREL and KOOB 2004). Cela permettant à la VLPO d'inhibé les
systèmes de l'éveil pour passer en SL. C'est un peu un indicateur
de la durée de l'éveil. Une fois un certain seuil
d'adénosine atteint, il devient de plus en plus difficile pour
l'individu de rester à un certain niveau de vigilance, car
l'adénosine stimule les neurones SL-on du VLPO, conduisant au sommeil
(McCARLEY and SINTON 2008). L'adénosine inhiberait également les
neurones cholinergiques du TB (CLEMENT 2011). Il s'agit de la composante
homéostatique déterminant le changement en SL (BILLIARD 1998 ;
McCARLEY and SINTON 2008). L'autre composante mise en jeu est circadienne et
due au NSC (BILLIARD 1998 ; McCARLEY and INTON 2008). L'entretien de
l'état de SL s'explique par la théorie du flip flop. En effet,
une fois initié, le SL se poursuit en parallèle avec l'inhibition
des centres de l'éveil par les neurones SL-on de la VLPO (CLEMENT
2011).
D) Apparition et le maintien du sommeil paradoxal
L'arrêt des structures du système permissif du SP
est nécessaire à l'activation de ce dernier (MONTI, PANDI-PERUMAL
and SINTON 2008 ; VALATX 1998). Ce système permissif est
constitué de la VLPAG, du dDpMe, du LC et du DRN. Fait
intéressant, la VLPAG et le dDpMe se divisent en deux populations
neuronales, toutes deux GABAergiques, l'une SP-on et l'autre SP-off (CLEMENT
2011).
25
L'activation des neurones glutamatergiques du SLD est responsable
de la transition de SL à SP (CLEMENT et al. 2011). Le SLD est
responsable de l'activation corticale via des projections ascendantes vers le
thalamus et de l'atonie musculaire via des projections sur le GiV et le GiA
(CLEMENT 2011). Le SLD reste inactif pendant l'éveil et le SL par
l'inhibition tonique GABA-ergique de la VLPAG et du dDpMe, et dans une moindre
mesure pendant l'éveil par le tonus sérotoninergique du DRN et le
tonus noradrénergique du LC (MONTI, PANDI-PERUMAL, and SINTON 2008).
L'arrêt de cette activité permet la désinhibition du SLD et
donc son activation. La transition entre SL et SP se fait progressivement, "en
douceur". Cela pourrait représenter le temps nécessaire aux
neurones SP-on, SP-off et SL-on pour changer de mode de décharge.
Toutefois, de nombreuses inconnues subsistent aujourd'hui, notamment en ce qui
concerne l'arrêt du système permissif du SP (CLEMENT 2011). Une
fois établie, le SP continue parallèlement à l'inhibition
des structures SP-off par les neurones SP-on (LUPPI 2011). Les neurones
cholinergiques du TMN, du LDT et du PPT sont actifs et participent à
l'activation corticale (McCARLEY and SINTON 2008). Le GiV et le GiA restent le
relai du SLD pour la poursuite de l'atonie musculaire (CLEMENT 2011). Ils
viennent inhiber les motoneurones de la moelle épinière (KAVANAU
1997 ; VALATX 1998). Les muscles directement innervés par les nerfs
crâniens (qui eux-mêmes sont issus du tronc cérébral)
sont beaucoup moins affectés par ce tonus inhibiteur, ce qui explique
les éventuels tremblements des muscles faciaux et les MOR (VALATX
1998).
E) La transition entre le sommeil paradoxal et l'éveil
Contrairement à l'entrée dans le SP, la sortie de
cet état de vigilance est brutale. En effet, chaque phase du SP est
suivi d'un stade d'éveil, même si celle-ci ne dure que peu de
temps sans aucunes phases intermédiaires. Cela suppose une activation
synchrone des neurones Ev-on, permettant un réveil rapide, essentielle
à la survie. De plus, cet ensemble de neurones Ev-on doit être
capable de réguler très rapidement toutes les structures
impliquées dans le cycle veille-sommeil. Plusieurs hypothèses
sont à l'ordre du jours pour expliquer l'origine de la stimulation
hypocrétinergiques supposés, cela reste uniquement
expérimental pour le moment (CLEMENT 2011). Les mécanismes
responsables de la sortie du SP restent donc globalement incompris (CLEMENT
2011).
Ainsi, les mécanismes neurochimiques régissant les
différents états de vigilance chez les chevaux sont complexes et
mal compris. Ils font intervenir plusieurs neurotransmetteurs dépendant
de différentes structures cérébrales, dont les activations
et les inhibitions forment un ballet précis qui permet l'état de
vigilance le plus approprié aux données environnementales
à un instant donné. Il ne fait aucun doute que de nombreuses
avancées sont possibles dans le futur.
F) La régulation du cycle veille-sommeil
Ainsi, les états d'éveil et de sommeil sont
soutenus par des mécanismes cérébraux complexes qui
impliquent nécessairement une régulation fine pour obtenir une
alternance des différents états de vigilance, différente
en fonction des conditions environnementales, le stress, des moments de la
journée et de l'état physiologique de l'individu (par exemple la
fatigue). Ces mécanismes de régulation restent mal connus. Dans
cette partie, il s'agira de synthétiser les résultats
publiés et les modèles existants pour rendre ces
phénomènes aussi clairs que possible. Les régulations
homéostatique et circadiennes seront présentées en
détail, suivis d'une explication du rôle intégrateur de
l'hypothalamus. L'hypocrétine sera notamment étudiée en
raison de son
26
rôle régulateur important et de son implication dans
le syndrome de narcolepsie-cataplexie que nous verrons plus loin.
1) La régulation homéostatique
Cet aspect de la régulation du sommeil vise à
assurer l'acquisition d'une certaine quantité de sommeil en fonction des
besoins spécifiques de l'espèce et de l'individu (McCARLEY and
SINTON 2008).
a) État physiologique
a.1) le statut énergétique
L'état énergétique de l'animal est l'un des
facteurs de la régulation des états de veille et de sommeil. En
effet, le glucose et la leptine favorisent le sommeil, tandis que la
ghréline favorise l'éveil (SAKURAI 2007). La leptine, hormone
produite par les adipocytes, est synonyme de satiété, et donc de
satisfaction des réserves énergétiques. La ghréline
peut être considérée comme l'antagoniste de la leptine :
elle stimule l'appétit et la prise alimentaire. Cela signifie donc que
si le cheval ne reçoit pas assez de nourriture, le sommeil sera
inhibé (OHNO and SAKURAI 2008). Ces derniers sont donc plus
éveillés et actifs dans la recherche de nourriture, un
mécanisme de survie rudimentaire (SAKURAI 2007). Ce n'est que dans un
état "d'abondance d'énergie" que l'endormissement peux se
produire (TORTEROLO, LAGOS and MONTI 2011). De plus, pendant la privation de
nourriture, on a observé que les animaux avaient des niveaux
d'éveil accrus et une diminution du temps passé en SP pendant le
repos (NISHINO 2007b). Il est également intéressant de noter que
les neurones à HCRT, Ev-ON ont des récepteurs de leptine. Ainsi,
la leptine peut inhiber directement ces neurones éveillants (OHNO and
SAKURAI 2008).
a.2) La fatigue
Le terme "fatigue" est très général et
désigne ici la sensation de fatigue ou la lassitude que les gens
ressentent en fin de journée (par exemple chez les espèces
diurnes). Il serait plus juste de parler de durée de veille.
Effectivement, l'adénosine tri-phosphate (ATP) est un excellent
carburant cellulaire qui est dégradé par le fonctionnement
cellulaire donc par le métabolisme. Parallèlement à cette
dégradation se produit l'accumulation progressive d'adénosine.
Cette dégradation est plus importante durant l'éveil car le
métabolisme est plus important durant cette phase de vigilance (MONTI,
PANDI-PERUMAL, and SINTON 2008). Cela conduit donc à une accumulation
dans le cerveau d'adénosine, qui est connue pour être un facteur
hypnogène, c'est-à-dire favorisant le sommeil (CLEMENT 2011). Ce
peptide est promoteur du SL (BOUTREL and KOOB 2004). Il a un effet inhibiteur
en inhibant la transmission excitatrice (MONTI, PANDI-PERUMAL, and SINTON
2008). Ainsi, l'accumulation d'adénosine au cours de l'éveil
conduit à l'inhibition des neurones cholinergiques qui favorisent
l'activité corticale et à l'inhibition des neurones GABA-ergiques
qui inhibent la VLPO. Le basculement entre l'éveil et le SL est ainsi
initié (BOUTREL and KOOB 2004), de sorte que la VLPO non inhibé
peut inactiver la structure Ev-on (CLEMENT 2011), comme décrit dans la
section précédente.
a.3) 27
Le stress
Il semble logique que les états de stress, qu'ils soient
métaboliques ou comportementaux, nuisent au sommeil, puisque le stress
peut menacer la survie. Difficile d'imaginer un animal en danger voulant
dormir. En effet, le stress aigu provoque la libération de
sérotonine (Ev-on) dans l'hypothalamus, agissant ainsi comme un stimulus
d'éveil. Les épisodes de stress aigu sont suivis d'un rebond du
sommeil, très similaire à celui observé après la
phase d'apprentissage, du fait de l'activation en cascade de plusieurs circuits
qui renforcent le système anti-éveil une fois le stress
passé (BENOIT and FORET 1995). Le stress chronique (plus de 4 heures)
entraîne une diminution globale du temps de sommeil, qui est
médiée par la production élevée d'hormones
surrénaliennes, y compris les corticostéroïdes (VALATX
1998). Fait intéressant, l'hypoxie (diminution de la quantité
d'oxygène que le sang distribue aux tissus) raccourcit la durée
du sommeil paradoxal, tout comme l'hypercapnie (augmentation pathologique de la
concentration du gaz carbonique dans le sang). L'hypoxie et l'hypercapnie
correspondent à des conditions de stress métabolique. A
l'inverse, l'hyperoxie (taux excessif d'oxygène dans le sang) et
l'hypocapnie (diminution de la concentration de gaz carbonique dans le sang)
augmentent le temps passé en SP (BARRAUD 2003 ; BENOIT and FORET 1995).
Les neurones HCRT sont activés sous stress, un signal pro-éveil
supplémentaire (MONTI, PANDI-PERUMAL,and SINTON 2008).
a.4) Les émotions
Les émotions sont gérées par le
système limbique, qui gère également la mémoire. Ce
système comprend l'hippocampe, l'hypothalamus et l'amygdale (CLEMENT
2011). Il est facile de comprendre la raison pour laquelle le système
limbique interférerait avec la régulation des états de
vigilance. D'une part, il semble presque impossible de s'endormir dans
certaines conditions émotionnelles, en particulier lorsque le cheval a
peur, car cela affecte directement sa survie (MURPHY 2010). Ces situations de
peur représentent également un stress physique, similaire
à ceux décrits précédemment. L'hypothalamus, quant
à lui, appartient au système limbique, et comme nous l'avons vu
dans la section précédente, l'hypothalamus occupe une place assez
importante parmi les différentes structures responsables de
l'éveil et du sommeil. Les neurones à HCRT et à MCH ainsi
que le TMN sont parties intégrantes de l'hypothalamus. Les terminaisons
issues des différentes structures du système limbique sont
nombreuses à projeter vers les neurones HCRT-ergiques (SAKURAI 2007).
Ainsi, ces projections vont réguler l'activité des neurones HCRT
promoteurs d'éveil.
b) La dopamine
La dopamine est la monoamine la plus abondante dans le SNC. Elle
est impliquée dans la régulation du comportement, en particulier
les systèmes de récompense, de motivation et la prise
alimentaire. Ces derniers sont impliqués dans l'éveil (MONTI,
PANDI-PERUMAL, and SINTON 2008). La synthèse et la libération de
la dopamine sont maximales durant la période active et minimale durant
la période inactive, donc le sommeil. En effet, le cheval recherche de
la nourriture et stimule son système de récompense lorsqu'il est
éveillé, ce qui produit de la dopamine (MONTI, PANDI-PERUMAL, and
SINTON 2008). Les mécanismes neuropharmacologiques associés
à la dopamine ne sont pas encore entièrement compris.
28
Néanmoins, une chose est sûre : les stimulants les
plus puissants (comme les amphétamines, la caféine, la nicotine)
ont tous en commun l'induction de la libération de dopamine (BOUTREL and
KOOB 2004). Par conséquent, l'activité de ce peptide est
très excitante, comme le sont d'autres molécules de sa classe
(catécholamines, His, 5HT) (MONTI, PANDI-PERUMAL, and SINTON 2008).
c) Les facteurs hypnogènes
Les facteurs hypnogènes, aussi nommés facteurs de
sommeil ou
hypnotoxines, doivent répondre aux critères
suivants :
-Accumulation progressive dans tout ou partie du cerveau durant
l'éveil,
-Évacuation ou dégradation durant le sommeil,
-Effet inducteur ou facilitateur du sommeil.
c.1) L'adénosine
L'adénosine est un peptide inhibiteur de la transmission
excitatrice qui joue un rôle important dans le passage de l'état
d'éveil au SL. C'est à la fois un facteur hypnogène et un
signe d'épuisement de certaines ressources organiques (MONTI,
PANDI-PERUMAL, and SINTON 2008).
c.2) Autres facteurs hypnogènes
Ces facteurs sont relativement nombreux et sont promoteurs de
différents états de vigilance. Les principaux facteurs
hypnogènes identifiés sont rapportés ici. Cependant, il
convient de rappeler qu'il est parfois impossible de prouver qu'une
molécule donnée n'est pas un agent hypnogène (MONTI,
PANDI-PERUMAL, and SINTON 2008). De plus, la question se pose de savoir si ces
résultats sont transférables entre différentes
espèces. Le TNFá (Tumor Necrosis Facteur : facteur
nécrosant tumoral) est un bon exemple de facteur de sommeil. La
prolactine a un fort effet promoteur de SP. L'hormone de croissance (Growth
Hormon GH) est impliquée dans la régulation du SL. La
somatostatine est quant à elle impliquée dans la
régulation du SP. L'hormone de libération de la corticotropine
(CRH : corticotropin-release hormone) a un effet stimulant sur l'éveil
(MONTI, PANDI-PERUMAL, and SINTON 2008) similaire à celui des
corticostéroïdes décrits précédemment. Le
neuropeptide Y (NPY) est un médiateur de l'activation de la
ghréline des neurones HCRT et favorise ainsi l'éveil par ses
effets sur la prise alimentaire (SAKURAI 2007). Le mécanisme d'action
exact du NPY sur l'hypothalamus n'est pas encore entièrement connus
(MONTI, PANDI-PERUMAL, and SINTON 2008). L'oxyde d'azote (NO) est un
neurotransmetteur gazeux. Il a des effets ambivalents. Effectivement,
différents mécanismes NO-ergiques semblent être à
l'oeuvre pendant l'activité ou le repos, et ces mécanismes
peuvent avoir des rôles opposés dans l'induction du sommeil. Le NO
pourrait également réguler la production de prolactine dans le
tronc cérébral (MONTI, PANDI-PERUMAL, and SINTON 2008). Les
prostaglandines (PG) jouent également un rôle : la PGD2 va
favoriser le sommeil et la PGE2 l'éveil (MOUSSARD et al. 1994 ; HAYAISHI
1991). Mais en conditions physiologiques, cela n'a été
démontré que chez les rongeurs et les singes (MONTI,
PANDI-PERUMAL, and SINTON 2008). Par conséquent, la régulation
homéostatique du sommeil est étroitement liée à
l'état énergétique de l'animal ainsi qu'aux
émotions perçue. Les facteurs de sommeil jouent un rôle
important, notamment dans l'évaluation de la durée d'éveil
et sont donc des indicateurs de fatigue. Par conséquent, la
répartition favorise la survie du cheval.
29
2) La régulation circadienne
Le deuxième aspect de la régulation du sommeil vise
à maintenir le niveau de vigilance du cheval en phase avec son
environnement (McCARLEY and SINTON 2008). Ceci est plus prononcé chez
les animaux plus strictement diurnes ou nocturnes, les chevaux ayant un sommeil
très fragmenté (MURPHY 2010).
a) Les conditions environnementales
La rotation continue de la terre autour de son propre axe et
autour du Soleil engendre des rythmes lumineux d'une période de 24
heures, ainsi que des cycles saisonniers sur 365 jours (modifiant par exemple
la disponibilité de la nourriture, la température). Ainsi, la
pression de sélection naturelle privilégie le
développement de mécanismes d'horloge cellulaire autonomes. Ces
horloges permettent aux organismes de prédire les cycles
d'activité et d'ajuster leur comportement et leur physiologie interne
pour optimiser leur survie (MURPHY 2010).
b) Les rythmes biologiques
Les rythmes biologiques ont différentes
propriétés (REINBERG 1998):
-Ils persistent dans un environnement constant même en
l'absence de repère temporel,
-Ils ont une origine génétique, ils sont donc
innés,
-Ils sont régis par une horloge biologique avec un cycle
d'environ 24 heures,
-Ils sont calibrés dans les 24 heures et mis à jour
quotidiennement en fonction des changements
périodiques des facteurs environnementaux.
Ainsi, les rythmes biologiques peuvent être définis
comme des changements périodiques ou cycliques dans une fonction
particulière d'un être vivant. Ils peuvent être
physiologiques (battements cardiaques par exemple), biochimiques (pic de
cortisol matinal par exemple) ou comportementaux (migration par exemple).
On distingue les rythmes ultradiens, circadiens et infradiens
:
- Le rythme ultradien a une période inférieure
à 20 heures, comme les cycles de sommeil. - Le rythme circadien, avec un
cycle d'environ 24 heures, est basé sur l'alternance du jour et de la
nuit. Il s'adapte à l'environnement et persiste même lorsque les
signaux extérieurs sont abolis.
- Le rythme infradien a une période supérieure
à 28 heures, comme c'est le cas pour des événements tels
que la migration, l'hibernation ou la grossesse (MURPHY 2010 ; REINBERG
1998).
Un synchroniseur est tout facteur environnemental qui change sur
un cycle d'environ 24 heures et peut modifier le cycle du rythme biologique
(MURPHY 2010). Le synchroniseur le plus utilisé et le plus fiable est
l'alternance jour-nuit, qui met en jeu la mélatonine. Les organismes
sont également basés sur des alternances de bruit et de silence
et sur des changements de température extérieure. Ainsi,
l'organisation temporelle d'un être vivant s'adapte aux changements
environnementaux. Par conséquent, les chances de survie sont meilleures
(REINBERG 1998).
30
c) Les noyaux supra-chiasmatiques
Les noyaux supra-chiasmatiques (NSC) sont deux noyaux pairs
situés dans l'hypothalamus, au-dessus du chiasma optique et de part et
d'autre du troisième ventricule. Son fonctionnement est autonome et il a
la capacité d'être entraîné par les différents
synchroniseurs environnementaux (REINBERG 1998). Les NSC sont l'horloge
biologique la plus importante du corps, elles intègrent tous les signaux
périodiques de chaque neurone. Les NSC sont donc l'oscillateur principal
contrôlant les autres oscillateurs du système circadien (REINBERG
1998 ; DARDENTE and CERMAKIAN 2005). Chaque NSC est divisé en deux
parties : un coeur (core en anglais) ventrolatéral qui reçoit les
afférences photiques et non-photiques, et une coquille (shell en
anglais) dorsomédiane qui projette vers le reste de l'hypothalamus.
L'afférence photique est formée par le tractus
rétino-hypothalamique prenant naissance dans la rétine. En effet,
la photopériode est le stimulus circadien le plus fiable pour estimer la
durée du jour et donc prédire l'hiver où il est plus
difficile de trouver de la nourriture (MURPHY 2010). La lumière est
perçue au niveau de la rétine. Elle contient un pigment
photosensible non visuel - la mélanopsine, dont la fonction est de
transmettre les informations lumineuses reçues à l'hypothalamus
(TESTARD-VAILLANT 2017 ; DARDENTE and CERMAKIAN 2005). En l'absence de
lumière, de la mélatonine est produite par l'épiphyse sous
le contrôle des NSC. Cette neurohormone a donc deux fonctions importantes
: indiquer la période nocturne par sa présence et indiquer la
période de l'année par sa durée de sécrétion
nocturne (PEVET 1998). La mélatonine est également
neuroprotectrice (MUELLER, MEAR and MISTLBERGER 2001) et favorise le sommeil
(KWON et al. 2015). Les afférences non optiques sont l'environnement
hormonal, l'environnement interne, les états émotionnels et les
états comportementaux (DARDENT and CERMAKIAN 2005). Les NSC projettent
directement sur le LH, en particulier sur les neurones HCRT. Ces projections
sont principalement GABAergiques et donc inhibitrices. Ainsi, des facteurs
liés à la photopériode, aux états affectifs et
comportementaux, ainsi qu'à l'environnement interne et hormonal
pourraient directement inhiber les neurones HCRT (MIKKELSEN et al. 2001). Le
NSC est une horloge biologique composée d'un ensemble cohérent
d'unités fonctionnelles et interconnectées. Ils intègrent
les signaux comportementaux, métaboliques et environnementaux pour
adapter au mieux le cheval à son environnement.
Le signal le plus important est la photopériode. Le
comportement circadien du cheval est moins prononcé que chez les autres
espèces en raison de son mode de vie nomade et de son statut d'animal
fuyant rapidement, du moins à l'état semi-sauvage ou sauvage.
3) L'hypothalamus, intégrateur des deux
régulations
L'hypothalamus était très présent tant dans
la régulation homéostatique que dans la régulation
circadienne. Les neurones HCRT contenus dans l'hypothalamus latéral sont
également très présents dans divers systèmes de
régulation. De nombreuses équipes de chercheurs se sont
intéressées à ce peptide, du fait de son implication dans
la régulation des stades de vigilance et de son rôle dans la
pathogénie de la narcolepsie.
4) Neurones à hyprocrétine et régulation
des états de vigilance
Les neurones à HCRT ont un rôle critique dans le
maintien de l'éveil (BOUTREL and KOOB 2004) et sont également
régulés par d'autres systèmes d'éveil,
suggérant un rôle dans la synchronisation de tous ces
systèmes, ce qui permettrait la stabilisation des états de
vigilance
31
(FABRE et al. 2011 ; LEE, HASSANI and JONES 2005). Ils
contrôleraient le passage d'un état de vigilance à un
autre, ainsi que la rapidité de cette transition une fois celle-ci
initiée (McCARLEY and SINTON 2008). En raison de leur localisation dans
l'hypothalamus, les neurones hypocrétinergiques apprennent des
informations externes (par exemple, le moment de la journée,
l'année, le comportement des autres chevaux) et des informations
internes (par exemple, l'état énergétique, la fatigue,
l'environnement hormonal) (MONTI, PANDI-PERUMAL and SINTON 2008), qui sont
liées aux informations circadiennes et homéostatique
correspondante. En conséquence, ces neurones peuvent maintenir un niveau
d'éveil approprié qui optimise la survie de l'animal (OHNO and
SAKURAI 2008). Les neurones à HCRT régulent les noyaux
hypothalamiques impliqués dans le comportement alimentaire. Ils
augmentent également l'activation corticale et favorisent l'éveil
en se projectant sur le LC, le DRN, le LDT et le PPT. Les projections issues du
système limbique sont importantes pour moduler l'activité des
neurones à HCRT en fonction des stimuli émotionnels (peur par
exemple) et s'adapter à l'environnement. Ainsi, ce sont les neurones
HCRT qui stabilisent l'équilibre dans le modèle d'interaction ou
la théorie du flip-flop. Ceux-ci envoient des projections excitatrices
vers le cortex et des projections inhibitrices à la VLPO, centre du SL.
Ce mécanisme permet le maintien de l'éveil. Les neurones à
HCRT reçoivent des projections issues du système limbique, ce qui
permet de stimuler l'éveil par le biais des émotions. Les
neurones de la VLPO SL-on sont activés et inhibent les neurones
noradrénergiques et hyposécrétrinergiques pour maintenir
le sommeil.
Pour synthétiser, l'hypocrétine est un neuropeptide
favorisant l'éveil qui joue un rôle crucial dans la
régulation de l'état de vigilance. La localisation
privilégiée des neurones hypocrétinergiques au sein de
l'hypothalamus leur permet de tirer des informations issues des
régulations homéostatique et circadiennes pendant l'éveil
et le sommeil. De cette façon, ces neurones peuvent ajuster
l'état de vigilance en fonction de la situation vécue, optimisant
ainsi la survie du cheval. L'hypocrétine est de plus un stabilisateur
des états de vigilance.
III. Dysfonctionnement neuronal A) Historique et
définitions 1) Historique
Les premiers cas de narcolepsie équine ont
été découverts en 1924 (HINES 2005) chez des poulains du
Suffolk, qui ont d'abord été décrits comme des
"évanouissements" avant d'être requalifiés en trouble rare
du sommeil avec somnolence excessive et cataplexie. La prévalence de la
narcolepsie équine est encore inconnue, mais nous savons que de
nombreuses races sont sujettes au syndrome (MOORE and JOHNSON 2000 ; ALEMAN
2015 ; REED, BAYLI, and SELLON 2010) - par exemple Shetland, Lipizzan, Welsh,
Quarter Horse. La découverte de la narcolepsie chez les chevaux (ainsi
que chez les chiens et les bovins) a suivi la découverte de la maladie
chez l'homme dans les années 1880 et son intérêt dans les
années 1920. La recherche identifie les causes possibles des origines de
la narcolepsie chez les rats, les souris, les chiens et les humains dans les
années 1990 (MIGNOT and DEMENT 1993). La recherche équine a
été guidée par ces constats, mais la recherche
expérimentale sur le cheval est plus difficile à mener, tant
financièrement qu'en termes de nombre de sujets et de leur prise en
charge. L'origine du
32
syndrome de narcolepsie-cataplexie équine n'est toujours
pas clairement élucidée (FINNO and ALEMAN 2013).
2) Définitions
Le syndrome de narcolepsie-cataplexie (communément
appelé narcolepsie), également connu sous le nom de syndrome de
Gélineau, est un trouble neurologique intrinsèque central,
sporadique, chronique, non progressif (ABAD and GUILLEMINAULT 2003 ; NISHINO
2007b) et incurable (REED, BAILY and SELLON 2010) caractérisé par
une dérégulation du rythme veille-sommeil sans augmentation de la
durée totale du sommeil (DEFLANDRE et al. 2002). La narcolepsie est
définie comme des crises de sommeil incontrôlables pendant la
journée, tandis que la cataplexie est une grave perte de tonus
musculaire qui provoque des symptômes allant du fléchissement des
genoux à des chutes complètes (MIGNOT and DEMENT 1993 ; NOUT and
JEFFCOTT 2012). La cataplexie est un trait caractéristique du syndrome
de narcolepsie-cataplexie ( ALEMAN 2015 ; BILLIARD 1998), bien qu'il existe une
forme de narcolepsie sans cataplexie (FINNO and ALEMAN 2013 ; AMERICAIN ACADEMY
OF SLEEP MEDECINE 2015). Cette cataplexie ressemble étroitement à
l'atonie musculaire du sommeil paradoxal (DEFLANDRE et al. 2002) et n'est pas
associée à des événements de sommeil diurne
excessifs (BILLIARD 1998). Selon certains auteurs, la cataplexie est un
état transitoire, voire un état hybride de sommeil paradoxal et
d'éveil (MONTI, PANDI-PERUMAL and SINTON 2008). Les crises de cataplexie
sont déclenchées par une agitation émotionnelle,
généralement positive (DEFLANDRE et al. 2002 ; NISHINO 2007b).
Etymologiquement, les termes viennent du grec ancien : narcolepsie vient de
narké (l'assoupissement) et de lêptikos (qui saisit) soit
littéralement "saisi par l'assoupissement", tandis que cataplexie vient
de kata (de haut en bas) et plêssein (frapper) ce qui revient donc
à une chute (DEFLANDRE et al. 2002 ; BILLIARD 1998). Au niveau
neurophysiologique, la narcolepsie se définit comme un endormissement
caractéristique et anormal en sommeil paradoxal directement à
partir de l'éveil (MONTI, PANDI-PERUMAL and SINTON 2008). La cataplexie
est considérée comme une caractéristique de la
dissociation du sommeil paradoxal (MIGNOT and DEMENT 1993 ; AMERICAIN ACADEMY
OF SLEEP MEDECINE 2015). De plus, le syndrome entraîne une
dérégulation des cycles d'éveil et de sommeil (FABRE et
al. 2001 ; CLEMENT 2011) : les patients narcoleptiques ont une
répartition globale du sommeil plus fragmentée que les individus
sains (ABAD and GUILLEMINAULT 2003 ; DEFLANDRE et al. 2002) - ceci est plus
prononcé chez l'homme (qui se réveille souvent la nuit) que chez
les chevaux dont le sommeil physiologique est déjà
fragmenté (TOBLER 1995 ; BERTONE 2016). En médecine humaine,
quatre éléments sont caractéristiques des symptômes
de la narcolepsie-cataplexie mais chez le cheval, seules la narcolepsie et la
cataplexie sont reconnues.
Pour résumer, après la découverte du
syndrome de narcolepsie-cataplexie chez l'homme au début du XXe
siècle, le syndrome de narcolepsie-cataplexie a été
découvert chez les chevaux. Il associe deux symptômes principaux :
la narcolepsie et la cataplexie. La narcolepsie correspond à un
endormissement inextinguible directement en sommeil paradoxal et survenant
à un moment inapproprié. La cataplexie correspond à une
perte totale du tonus musculaire (excluant les muscles cardiaques et
respiratoires) le plus souvent suite à une émotion intense
généralement positive. Cette cataplexie est pathognomonique du
syndrome de narcolepsie-cataplexie, même si une forme de narcolepsie sans
cataplexie existe. Les patients atteints de narcolepsie-cataplexie
présentent une dérégulation du cycle de vigilance.
33
B) Traduction clinique chez le cheval
1) Les symptômes
Le syndrome de narcolepsie-cataplexie entraîne une
somnolence diurne excessive chez le cheval (FINNO and ALEMAN 2013) et un
sommeil nocturne perturbé, des manifestations anormales de sommeil
paradoxal (ALEMAN 2015) avec ou sans cataplexie (il faut rappeler qu'il s'agit
d'une perte de tonus musculaire profonde) (REED, BAYLY and SELLON 2010). Il
semble assez rare et il existe deux formes différentes de la maladie :
une qui touche les poulains et une qui touche les adultes de plus de 2 ans
(MOORE and JOHNSON 2000). Les crises de narcolepsie-cataplexie sont soudaines
et brutales (MOORE and JOHNSON 2000), le cheval est neurologiquement normal
(à part parfois des réveils avec une légère
somnolence) (HINES, SCHOTT and BYRNE 1992) sauf pour ces épisodes
(KNOTTENBELT 2014 ; MOORE and JOHNSON 2000) qui durent de quelques secondes
à quelques minutes (NOUT and JEFFCOTT 2012). Ces crises sont
récurrentes et leur fréquence varie d'un individu à
l'autre. Elles peuvent durer plusieurs minutes (HINES 2005). Lors de ces
épisodes, les réflexes sont absents (aréflexie totale) et
des mouvements oculaires rapides peuvent être observés. Les
fonctions cardiovasculaires et respiratoires du cheval ne sont pas
affectées (KNOTTENBELT 2014). Fait intéressant, les crises sont
moins probables lorsqu'elles sont examinées dans des environnements
inconnus ou par des personnes inconnues, car cela augmente le niveau
d'activité mentale du cheval (MOORE and JOHNSON 2000). Cela indique
l'influence de facteurs environnementaux sur la maladie. Les signes
avant-coureurs des attaques sont une somnolence et/ou une faiblesse des carpes
et des boulets antérieurs (HINES, SCHOTT and BYRNE 1992). Le cheval peut
alors développer une flaccidité musculaire (NOUT and JEFFCOTT
2012) consécutive à une hypotonie et une faiblesse musculaire
soudaine. Ses antérieurs s'effondreraient alors, provoquant en face
dorsale des carpes et des boulets des lésions de friction qui sont
courants chez les sujets atteints de cette maladie (HINES 2005). Durant cette
phase, le cheval peut soit se réveiller et se relever, évitant
ainsi une chute (MIGOT and DEMENT 1993), soit continuer à dormir, auquel
cas la chute est inévitable (MOORE and JOHNSON 2000 ; HINES 2005). Ce
dernier cas est relativement rare car la cataplexie affecte principalement les
muscles de la tête et de la nuque, même si des lésions
généralisées peuvent survenir (NOUT and JEFFCOTT 2012). Un
paramètre important de ce syndrome est l'absence de perte de conscience
chez les chevaux atteints lors des crises. Il est indéniable qu'il
s'endort anormalement dans des circonstances inappropriées, mais il
reste sensible aux stimuli extérieurs, qu'ils soient sonores, tactiles
ou visuels (HINES 2005). Cela permet de réveiller le cheval en le
stimulant, et lui permet aussi de se réveiller avant une chute
complète quand il se sent tomber (MOORE and JOHNSON 2000).
2) Les formes familiales
La forme familiale du syndrome de narcolepsie-cataplexie est la
plus fréquente, bien que sa prévalence reste inconnue
(KNOTTENBELT 2014). Selon les auteurs, les premières crises surviennent
à la naissance ou quelques jours plus tard (MOORE and JOHNSON 2000 ;
HINES 2005), sinon vers six mois du poulain (REED, BAYLY and SELLON 2010). Ces
formes familiales affectent des races spécifiques (MOORE and JOHNSON
2000), notamment les chevaux miniatures (LUNN et al. 1993 ; NOUT and JEFFCOTT
2012), les poneys Shetland, les chevaux Suffolk Punch, les lipizzans (ALEMAN
2015) et éventuellement les poneys islandais (BATHEN-NOTHEN et al.
2009). Les crises se manifestent par des attaques de sommeil, des phases de
paralysie complète avec perte de conscience apparente (MOORE and JOHNSON
2000) - il est difficile de réveiller le poulain pendant
34
une crise (KNOTTENBELT 2014) - et peuvent durer de quelques
secondes à quelques minutes (KOTERBA, DRUMMOND and KOSCH 1990). Le
poulain s'affaisse sur ses carpes puis tombe en décubitus
latéral, endormi. Il présente alors une paralysie flasque avec
une aréflexie spinale et des mouvements faciaux caractéristiques
du sommeil paradoxal (MOORE and JOHNSON 2000). Les fonctions cardiovasculaire
et respiratoire n'ont pas été affectées. Ces
événements sont spontanés ou déclenchés par
des stimuli spécifiques, le plus souvent étant la contention
(KOTERBA, DRUMMOND and KOSCH 1990). Entre ces crises, l'examen neurologique du
poulain atteint est dans les normes (MOORE and JOHNSON 2000). Étant
donné que les crises sont presque systématiquement
déclenchées chez les poulains atteints de narcolepsie par
contention, certains auteurs pensent qu'il peut s'agir de la persistance des
habitudes de sommeil foetal (HINES 2005) ou d'un cas extrême de
réflexes neurologiques chez les poulains. En général, la
fréquence des crises et la sévérité des
symptômes diminuent avec le temps voire disparaissent complètement
(HINES 2005) : l'auto-résolution est possible (KNOTTENBELT 2014).
3) Les formes acquises
Cette forme du syndrome de narcolepsie-cataplexie touche les
chevaux de plus de deux ans (FINNO and ALEMAN 2013). En fait, la
première crise ne survient pas avant cet âge, et peut même
survenir plus tard, dans certains cas après 20 ans. Il n'y a pas de
prédisposition de sexe, par contre une prédisposition de race est
présente (MOORE and JOHNSON 2000). Les races concernées sont les
races touchées par les formes familiales (cité plus haut) ainsi
que les poneys welsh, les quarter horse, les appaloosa, les morgan, les selle
français, les pur-sang anglais et les trotteurs américains (REED,
BAYLY and SELLON 2010 ; NOUT and JEFFCOTT 2012). La fréquence de ces
attaques est très variable et difficile à quantifier (HINES 2005)
car les chevaux sont rarement observés 24h/24. Cependant, si
l'observation du nombre de crises est bien faite, il est possible de
prédire leur fréquence deux semaines après leur
début (NOUT and JEFFCOTT 2012). Les manifestations cliniques du syndrome
de narcolepsie-cataplexie sont individu-dépendantes (HINES 2005). Il
peut y avoir des cas de narcolepsie sans cataplexie. Mais c'est le plus courant
et peut aller d'un simple abaissement de la tête à la chute totale
(HINES 2005) en passant par l'affaissement sur les boulets antérieurs
voire les carpes (MOORE and JOHNSON 2000). Si un cheval est obligé de
marcher pendant les crises, il apparaît faible et ataxique (MOORE and
JOHNSON 2000), alors qu'en dehors de ces crises, il est neurologiquement normal
(HINES 2005). Rappelons que l'ataxie correspond à un syndrome associant
troubles de l'équilibre et troubles de la coordination motrice. Les
crises de cataplexie sont indépendantes de celles de narcolepsie (HINES
2005). Cette dernière quant à elle se manifeste par des
périodes de sommeil à des moments inappropriés, comme au
pansage ou au sellage (HINES, SCHOTT and BYRNE 1992). Un épisode de
cataplexie peut ou non se produire par la suite. Le cheval est toujours
conscient et peut être réveillé par des stimuli (sonores,
tactiles ou même visuels - comme des lumières vives dans les yeux)
(HINES 2005). Les déclencheurs de ces épisodes de narcolepsie et
de cataplexie sont variables : il peut s'agir de stimuli assez positifs comme
le pansage (MOORE and JOHNSON 2000), certains comportements du cavalier
à cheval (HINES 2005) - ce qui est évidemment dangereux pour le
cheval et le cavalier - voire rien du tout. Effectivement, de nombreux
épisodes de narcolepsie surviennent en dehors d'un
événement donné (MOORE and JOHNSON 2000), dans le calme au
box ou au pré (HINES 2005). Un changement d'environnement peuvent
réduire la fréquence des crises et la gravité des
symptômes, mais cela est rare (HINES 2005). Le syndrome de
narcolepsie-cataplexie peut apparaître en association avec une autre
maladie, c'est par exemple rapporté pour les
35
dysfonctionnements de la pars intermedia de l'hypophyse, les
encéphalites de West Nile, les encéphalomyélites à
protozoaires (ALEMAN 2015).
Pour résumer, Les crises de narcolepsie se
caractérisent par des mouvements oculaires rapides, un affaissement des
membres antérieurs et éventuellement une chute. Un cheval atteint
de narcolepsie présente un examen neurologique normal entre les
épisodes et des écorchures caractéristiques en face
dorsale des boulets et des carpes antérieur. Les crises de cataplexie
correspondent à une hypotonie voire à une atonie musculaire
pouvant entraîner une chute au moins partielle du sujet. L'individu en
crise n'a plus de réflexes mais reste conscient de son environnement :
il réagit aux stimuli extérieurs qui peuvent le réveiller.
Il existe deux formes de syndrome de narcolepsie-cataplexie : la forme
familiale et la forme acquise. Les formes familiales n'affectent que certaines
races. Les premières crises se produisent entre la naissance et les six
mois du poulain. Elles sont le plus souvent déclenchées par la
contention et entraînent une paralysie flasque. Au fil du temps, un
soulagement symptomatique ou même une résolution spontanée
rare peuvent survenir. Les formes acquises apparaissent après
l'âge de deux ans et sont race-dépendantes. Elles prennent des
formes différentes selon les individus, par exemple en termes de
déclenchement, de fréquence et de l'intensité des crises.
La narcolepsie et la cataplexie peuvent être dissociées. Le
syndrome de narcolepsie-cataplexie acquise peut être lié à
une maladie. La prévalence de la narcolepsie-cataplexie chez les chevaux
est inconnue.
C) Pathogénie du syndrome de narcolepsie-cataplexie
La pathogenèse exacte de la narcolepsie n'est pas encore
entièrement comprise. Les cas humains et canins sont les plus connus,
mais des inconnues demeurent (MONTI, PANDI-PERUMAL and SINTON 2008).
1) Les premières pistes
Les symptômes du syndrome de narcolepsie-cataplexie, en
particulier les épisodes de SP au cours de l'éveil, et les
épisodes de cataplexie ont conduit à l'hypothèse de
défauts dans des mécanismes spécifiques de la veille et du
sommeil. Deux approches ont été envisagées. La
première s'interroge sur une altération des rythmes circadiens
des états de veille. En effet, des épisodes
répétés de sommeil se produisent pendant la
journée, tandis que des réveils répétés se
produisent la nuit. La seconde se demande si les limites des états
vigilance sont perturbées, conduisant à un état de
"sommeil de dissociation" (BENOIT and FORET 1995). Aujourd'hui, il est bien
établi que le syndrome de narcolepsie-cataplexie correspond à une
perturbation du cycle veille-sommeil : l'incapacité de l'organisme
à maintenir un cycle normal de veille et de sommeil. Cette
incapacité est le résultat de l'instabilité des
frontières entre les états comportementaux et donc de l'intrusion
constante d'épisodes de SP pendant l'éveil (MONTI, PANDI-PERUMAL
and SINTON 2008). En 1995, la plupart des hypothèses sur l'origine de
ces dysfonctionnements du cycle de vigilance étayaient un
hypofonctionnement des systèmes monoaminergiques responsables de
l'éveil (épinéphrine, noradrénaline,
sérotonine, dopamine) (BENOIT and FORET 1995). Cela a changé en
1999, un an après la découverte de l'orexine/hypocrétine.
Précisément, des manipulations génétiques
pourraient mettre en évidence l'importance de ces peptides dans le cycle
veille-sommeil. Il convient de souligner que les facteurs
génétiques ne sont pas les seuls impliqués et que les
facteurs environnementaux joueront également un rôle important
mais jusqu'ici inexpliqué (DEFLANDRE et al. 2002).
36
2) Le rôle de l'hypocrétine
a) Généralités
La première partie explique l'importance du peptide
hypocrétine pour le maintien de l'éveil et la régulation
du cycle veille-sommeil. La localisation spécifique des neurones
à HCRT dans l'hypothalamus, centre d'intégration de la
régulation du rythme circadien et de l'homéostasie, avec des
afférences et des efférences vers et depuis toutes les structures
impliquées dans l'état de vigilance, explique le rôle
critique de l'hypocrétine. Les travaux sur le syndrome de
narcolepsie-cataplexie depuis le début des années 2000 ont permis
de mettre en évidence que cette affection est systématiquement
associée à un dysfonctionnement cérébral du
système hypocrétinergique (OHNO and SAKURAI 2008 ; MICHINAGA et
al. 2010). Le mécanisme exact a été élucidé
chez le chien et l'homme : il s'agit pour le premier d'un défaut de
fixation sur les récepteurs hypocrétinergiques et pour le second
d'une perte des neurones produisant l'hypocrétine (HINES 2005). Ainsi,
l'hypocrétine est au coeur de la pathogenèse du syndrome de
narcolepsie cataplexie (OHNO and SAKURAI 2008 ; BOUTREL 2006).
b) Le rôle de l'hypocrétine dans la
narcolepsie
Pour rappel, les neurones à HCRT vont contrôler le
passage d'un état vigilance à un autre, et la vitesse de cette
transition une fois qu'elle a commencé (McCARLEY and SINTON 2008 ;
MONTI, PANDI-PERUMAL and SINTON 2008). Ils permettent la stabilité de la
balance dans le modèle des interactions réciproques. En l'absence
de ces neurones, le cerveau est ainsi privé de stabilité entre
les états de vigilance (McCARLEY and SINTON 2008). Les interactions
entre la VLPO et les neurones monoaminergiques est complètement
altérée. Privés de la
régulation exercée par les neurones à HCRT,
la VLPO et les neurones monoaminergiques ne font que s'inhiber mutuellement.
Lorsqu'un système prend le pas sur l'autre, ses projections inhibitrices
renforcent sa propre activité. Lorsque ces deux systèmes sont
actifs, ils sont dans un équilibre précaire, et le corps peut
basculer en sommeil ou en éveil à tout moment. Ces transitions
sont alors involontaires et brutales (SAKURAI 2007). La figure 5 illustre ce
dysfonctionnement.
Pour résumer, des modifications des autres systèmes
des états de vigilance ont été identifiées. Par
conséquent, les sujets narcoleptiques auraient plus de neurones
histaminergiques dans le noyau tubéro-mammaire. Ce serait une
réponse compensatoire à la perte de tonus du stimulus
d'éveil causée par le dysfonctionnement du système
hypocrétine. Cette augmentation du tonus histaminergique peut être
responsable de certains des symptômes de la narcolepsie : la
préservation de la conscience lors de la cataplexie, la fragmentation du
sommeil nocturne chez l'homme (VALKO et al. 2013). Les neurones à MCH ne
semblent pas affectés par le syndrome de narcolepsie-cataplexie
malgré leur proximité avec les neurones hypocrétinergiques
(CLEMENT 2011 ; MONTI, PANDI-PERUMAL and SINTON 2008). D'autres changements
potentiellement présents peuvent être dus à la perte du
tonus hypocrétinergique, mais tous n'ont pas été
identifiés.
|
Figure 5 : Mécanisme de stabilisation de la veille
et du sommeil par les neurones à hypocrétine. D'après
SAKURAI (2007).
|
37
c) Le rôle l'hypocrétine dans la
cataplexie
On a vu auparavant que les crises de cataplexie surviennent le
plus souvent sous l'influence d'émotions positives. Ceci suggère
un lien entre le système limbique responsable des émotions et les
structures responsables de l'atonie musculaire en SP, dont les
caractéristiques sont très proches de celles de la cataplexie. Un
lien entre l'amygdale et les structures responsables de l'inhibition des
motoneurones au cours du SP a été démontré. Le
noyau central de l'hypothalamus projette directement vers le SLD, la dDpMe et
la VLPAG. Ces trois structures sont impliquées dans le SP et, plus
spécifiquement, dans l'atonie musculaire spécifique au SP pour le
SLD. Lors d'émotions intenses, le noyau central de l'amygdale est
activé, induisant ainsi un fort tonus GABA-ergique sur la VLPAG-dDpMe.
En l'absence de tonus hypocrétinergique, celui-ci serait ainsi
inhibé, ce qui permettrait l'activation du SLD et donc l'instauration
d'une atonie musculaire (CLEMENT 2011). Cela correspond à une crise de
cataplexie. D'autres auteurs ont émis l'hypothèse qu'un
déséquilibre entre les monoamines (surtout la dopamine)
(DEFLANDRE et al. 2002) et l'acétylcholine résulte d'un
dysfonctionnement du système hypocrétinergique (NISHINO and
YOSHIDA 2003). Il peut également s'agir d'une combinaison de ces deux
modèles. Par conséquent, d'autres études sont
nécessaires pour améliorer la compréhension des
mécanismes conduisant aux crises de cataplexie.
Pour synthétiser, Ainsi, l'hypocrétine est au coeur
de la pathogénie du syndrome de narcolepsie cataplexie. L'absence de
tonus hypocrétinergique affecte l'ensemble du système responsable
des
38
états de vigilance par perte du tonus régulateur.
L'hypocrétine n'exerce plus son rôle de stabilisateur des
états de vigilance, ce qui provoque des transitions brutales et non
souhaitées entre différents états de vigilance.
L'apparition involontaire d'atonie musclulaire peut être
déclenchée car en l'absence de l'hypocrite les structures
responsables ne sont plus correctement inhibées.
3) Bases génétiques de la narcolepsie-cataplexie
a) Chez l'homme
Chez les patients humains atteints de narcolepsie, la perte de
neurones hypocrétinergique a été démontrée
(TORTEROLO, LAGOS and MONTI 2011). L'un des aspects les plus importants de la
narcolepsie chez l'homme est sans doute son lien avec le système
immunitaire (HINES 2005). En effet, l'association entre le gène HLA
(Human Leukocyt Antigen, antigène leucocytaire humain) est connue depuis
la fin des années 80 (NISHINO 2007b). HLA est le terme anglais pour le
complexe majeur d'histocompatibilité (MHC), qui a un rôle
fondamental d'auto-reconnaissance dans le système immunitaire.
Ainsi, la narcolepsie humaine présente une
prédisposition génétique associée aux gènes
des systèmes HLA-DR et HLA-DQ, impliquant très probablement
d'autres loci (une position fixe d'un gène ou d'un marqueur
génétique sur un chromosome). La
dégénérescence des neurones à hypocrétine ne
semble pas être causée par des mutations dans les gène du
système hypocrétine.
b) Chez le chien
Chez l'espèce canine, une mutation
génétique du système à hypocrétine est
responsable du syndrome de narcolepsie-cataplexie. Le gène en question a
un mode de transmission autosomique récessif chez les chiens (Doberman,
Labrador) atteints de narcolepsie familiale (NISHINO 2007b). Cette mutation du
récepteur interfère avec la voie normale de l'hypocrétine,
entraînant ainsi finalement un manque d'activité de
l'hypocrétine chez les chiens narcoleptiques (HINES 2005 ; REED, BAYLY
and SELLON 2010). Toutefois, une forte association a été
démontrée entre le syndrome de narcolepsie-cataplexie et un
gène hautement homologue à un gène d'une immunoglobuline
humaine (NISHINO et al. 2000 ; MOORE and JOHNSON 2000). Par conséquent,
le système immunitaire joue également un rôle dans la
narcolepsie-cataplexie chez le chien.
Pour récapituler, le support génétique de
la narcolepsie canine est une mutation codant pour le récepteur OX2R
à l'hypocrétine (NISHINO et al. 2000 ; WANG et al. 2005).Ce
dysfonctionnement bloque la progression du tonus hypocrétinergique et
donc est responsable du manque voire de l'absence du dit tonus. Aucun lien avec
le DLA n'a pu être mis en évidence mais le système
immunitaire est tout de même impliqué via un gène hautement
homologue à une immunoglobuline humaine.
c) Chez le cheval
Chez les chevaux, les individus atteints de narcolepsie n'ont pas
de lésions cérébrales microscopiques ou macroscopiques. Le
rôle des hypocrétines dans la narcolepsie-cataplexie équine
est encore à l'étude (HINES 2005). Fait intéressant, les
chevaux atteints de
39
dysfonctionnement de la pars intermedia de l'hypophyse, affection
pouvant être associée à la narcolepsie-cataplexie,
présentent des taux faibles d'HCRT-1 dans le liquide
céphalo-rachidien (REED, BAYLY and SELLON 2010). Ainsi, le
système hypocrétinergique joue un rôle dans le syndrome de
narcolepsie-cataplexie.
Pour conclure,Il existe actuellement peu de données sur
les chevaux. Des recherches sont en cours pour déterminer la base
génétique possible du syndrome de narcolepsie-cataplexie chez
cette espèce, qui peut être étudiée comme
modèle de narcolepsie chez l'homme.
4) Étiologie du dysfonctionnement du système
hypocrétinergique : une hypothèse pour les maladies auto-immunes
Les liens entre système immunitaire et
narcolepsie-cataplexie sont indéniables, au moins chez les deux
espèces pour lesquelles les mécanismes génétiques
sont les mieux connus. Les maladies associées au HLA sont presque toutes
des maladies auto-immunes : comme la spondylarthrite ankylosante, maladies
inflammatoires intestinales chroniques (VILUMA et al. 2017 ; MIGNOT and DEMENT
1993 ; MIGNOT et al. 1995). C'est pourquoi l'origine auto-immune du syndrome de
narcolepsie-cataplexie fait désormais l'objet d'un consensus
scientifique (MOORE and JOHNSON 2000 ; DEFLANDRE et al. 2002 ; HINES 2005). Les
neurones à HCRT seraient détruits par le système
immunitaire de l'individu atteint (DEFLANDRE et al. 2002). Cependant, toutes
les tentatives pour prouver cette origine auto-immune ont échoué
(MIGNOT and DEMENT 1993). Les éventuelles implications chez le cheval ne
sont pas connues puisque les bases génétiques et l'implication du
système immunitaire n'ont pas encore été
déterminées.
L'hypothèse consensuelle concernant l'origine de la
narcolepsie est une origine auto-immune, qui est toujours à
l'étude aujourd'hui.
40
DEUXIÈME PARTIE :
LE RÔLE DU MASSOTHÉRAPEUTE
41
I. Problèmes physiques dus au syndrome de
narcolepsie-cataplexie
A) Problèmes physiques
Les crises de narcolepsie et de cataplexie vont créer
plusieurs problèmes physiques sur le cheval, en plus des
problèmes neuronaux que le massothérapeute ne pourra bien-sur ni
résoudre ni soulager. La narcolepsie ne provoque pas de problèmes
physiques en tant que tels, le cheval peut se sentir désorienté
et perdu suite à ses crises ce qui peut lui provoquer du stress et de
l'anxiété. Il a été prouvé chez les humains
que les massages associé à un traitement médical
réduisent le stress et soulagent les tensions musculaires du quotidien.
Une meilleure nuit de sommeil peut aider à minimiser les
problèmes de jours liées à la narcolepsie. Le maintien
d'un horaire de sommeil régulier et l'absence d'alcool et de
caféine sont la clé de la gestion de la narcolepsie (Institut
National des Troubles Neurologiques et des Maladies). Cette donnée n'est
pas réellement transposable aux chevaux car ils ont un sommeil
déjà fractionné mais on peut supposer que si le stress
lié à la narcolepsie (ou autre chose) et les tensions musculaires
sont traitées, alors peut-être que les épisodes seront
moins fréquents. Si le suivi du cheval est correct et que le
propriétaire a pu mettre en place une vidéosurveillance 24h sur
24, alors il est possible de prédire l'apparition des prochains
épisodes. Selon le délai d'apparition (dans l'heure ou dans la
journée), le praticien pourra éventuellement intervenir pour les
éviter, en stimulant le système nerveux avec différentes
techniques. Au contraire, la cataplexie provoque quant a elle des
problèmes
physiques : le cheval peut rencontrer différentes
complications dues à ses chutes. Le cheval tombe alors constamment sur
l'avant de ses antérieurs ce qui produit des abrasions en face dorsal
des carpes et ou des boulets, les chutes répétées peuvent
conduire à des problèmes articulaires tel que l'arthrose ou
d'autres problèmes squelettique qui ne concernent pas le
massothérapeute. Les chutes du cheval peuvent être plus ou moins
graves (par exemple déplacement vertébral, étirement
musculaire voire déchirure, entorse, lésions cartilagineuses,
arrachements ligamentaires ou capsulaires, traumatismes crâniens ou de la
colonne vertébrale cervicale) mais tout ceci reste très rare et
demande toujours un avis vétérinaire, le plus courant
étant les brûlures, les plaies et les hématomes
intramusculaires. La cataplexie va aussi engendrer de nombreuses tensions
musculaires.
B) Lésions fréquentes
Chez le cheval atteint du syndrome de narcolepsie-cataplexie,
plusieurs lésions peuvent être courantes, notamment les
hématomes intramusculaires. Après avis vétérinaire,
le praticien peut également proposer un «protocole» de soins.
Dans ce cas-là, au moins 7 jours de repos, avec application de froid 1
fois par jour, massage doux autour de la lésion, application
d'antiphlogistiques la nuit et ensuite reprise progressive du travail en
évitant l'élongation du côté de la lésion. Le
cheval peut aussi avoir des mollettes ou et des vessigons dus à une
production anormale de liquide synovial. Le praticien peut recommander un
massage désinfiltrant d'au moins 10 minutes avant le travail, une douche
froide à jet doux après le travail (15 minutes par membre
42
atteint), électrothérapie éventuelle,
enveloppement d'argile la nuit et éventuellement K-Taping. Encore une
fois dû à ses chutes, le cheval peut également avoir des
affections traumatiques, le praticien peut conseiller l'application de froid
pendant 45 minutes, 2 fois par jour pendant les 5 premiers jours, enveloppement
d'antiphlogistique la nuit, suivi d'une douche (avec jet doux) le matin et
massage transversal profond 1 fois par jour avant la sortie au pas (pendant 10
minutes), pendant au moins 10 jours. Avant chaque intervention et conseil, le
diagnostique et l'avis d'un vétérinaire est nécessaire.
II. Techniques thérapeutique A) Le massage
Le massage est la manipulation des tissus mous, dans le but de
drainer, relâcher ou stimuler, et éliminer des points de tensions
et restrictions associées à l'activité musculaire. Il
s'agit d'un ensemble de techniques manuelles de kinésithérapie
humaine adapté aux chevaux, effectués sur les muscles, les
tendons et les ligaments ainsi que les points de tensions du cheval. Il combine
des mouvements de massage, de point de pression ou acupression et une vitesse
et pression adaptées ! A l'aide de la main, des pouces ou des doigts et
de toutes leurs qualités sensorielles, avec un touché doux et
mesuré.
Le massage manuel a beaucoup d'effets physiologiques mais ici on
ne va parler que de bienfaits en
lien avec les problèmes qu'engendrent le syndrome de
narcolepsie-cataplexie. Avec le massage, le
praticien:
-Diminue les courbatures et crampes musculaires
- Améliore la circulation sanguine et lymphatique
- Draine les toxines et optimise l'oxygénation
musculaire
- Améliore la souplesse musculaire et articulaire en
éliminant les tensions qui causent des
problèmes de mobilité
-Réduit le stress et améliore le confort
psychologique
-Prévient les troubles musculo-squelettiques :
optimisation du fonctionnement des
structures et diminution des contraintes tendineuses et
ligamentaires
-Augmente la production de synovie
-Augmente la production d'endorphine
-Prévient et lutte contre les effets secondaires : travail
des cicatrices afin d'éviter les
adhérences
-Accompagne dans la reprise du travail : amélioration de
la proprioception, de ses capacités
et fonctions physiques
43
Pour un cheval atteint de narcolepsie-cataplexie le masseur peut
proposer au propriétaire un accompagnement spécifique selon ses
besoins. Si le cheval est uniquement narcoleptique, le praticien peut effectuer
un massage dit de bien-être dans le but d'une détente musculaire
globale. Le massage est réalisé avec des techniques de base : la
percussion, la compression, la palpation pour localiser les douleurs et zones
de tensions, la pression directe et d'autres techniques. Lorsque le
propriétaire connaît l'arrivée des prochaines crises, il
est possible de mettre en place des massages tonifiants. Cela reste une
hypothèse mais si le cheval est stimulé physiquement au niveau
des muscles, il se pourrait que le système nerveux soit lui aussi
stimulé pouvant ainsi éviter de passer d'un état de
vigilance à un autre, ce qui empêcherait un épisode de
narcolepsie. Ce massage là devra être effectué juste avant
la crise mais faut-il encore savoir à quel moment elle interviendrait
exactement.
Dans l'hypothèse d'un cheval narcoleptique et
cataplectique, le praticien peut effectuer le même travail cité
plus haut et compléter avec un massage défibrosant, pour
décoller les adhérences sur les cicatrises et restaurer la
souplesse des tissus. Ce massage est à effectuer sur des cicatrices donc
plaies fermées, principalement sur la face dorsale des carpes et des
boulets. Il faut être vigilant pendant cette technique de palper-roule
car, cela peut être douloureux pour le cheval. Cependant, il est
important de rappeler que les crises de narcolepsie surviennent
généralement après une émotion positive, le massage
libère de la dopamine (l'hormone de la satisfaction). Elle contribue par
conséquent à limiter le stress et l'anxiété, ce qui
est recherché mais il faut être vigilant et très attentif
à tous les signaux du cheval lors du massage pour éviter une
crise. Au cas où, le cheval tombe dans le sommeil paradoxal, le
praticien doit immédiatement le réveiller en le stimulant, une
stimulation auditive par exemple en claquant des doigts ou en applaudissant. Le
massothérapeute doit constamment regarder et être a
l'écoute du cheval, qui doit demeurer dans un équilibre entre
détente et sommeil paradoxal.
B) Le stretching
Le stretching peut être lui aussi très utile dans
l'accompagnement du syndrome. En un seul geste il étire muscles,
ligaments, tendons et fascia (tissus conjonctifs qui enveloppent et aussi
connectent toutes les structures entre elles). Il prépare le cheval
à exécuter des mouvements souples, amples et efficaces ou
à lutter contre les raideurs sur des chevaux convalescents par
exemple.
Le praticien doit respecter certaines règles pour le bon
déroulement d'une séance. On ne commence jamais à froid.
On peut le faire après la séance de travail du cheval ou avant,
mais dans ce cas là, il faut faire marcher le cheval au moins dix
minutes avant de commencer. L'idéal est d'effectuer les mobilisations
dans un endroit calme et confortable tant pour l'animal que pour le praticien.
Tout comme nous, le cheval a une physionomie et il faut la respecter. Le cheval
connaît ses limites de tolérance aux mouvements imposés. Le
praticien doit proposer au cheval et non le contraindre. Il faut être
progressif dans la demande, d'abord lentement pour ensuite atteindre
l'allongement maximum du cheval en étant de plus en plus ample. Les
demandes doivent être symétriques, avoir la même
durée (30 secondes) et comporter le même nombre de
répétitions.
44
Le stretching peut s'effectuer avant le travail, dans ce cas la,
il favorise le geste souple et l'équilibre, et permet d'éviter
les risques de blessures sur un muscle froid. Après le travail, il
permet de réduire les courbatures et la fatigue ainsi qu'une meilleure
élimination des toxines. Au cours d'une rééducation ou
d'un suivi bien-être, les mobilisations permettent une
ré-information proprioceptive qui favorisent l'intégration de
nouvelles possibilités d'amplitudes de mouvements.
Pour un cheval uniquement narcoleptique il n'y a pas de
réel besoin au niveau du stretching. C'est au praticien de juger la
situation de chaque cheval selon la découverte des tensions après
palpation et après discussion avec le propriétaire. En ce qui
concerne le cheval narcoleptique-cataplectique, hormis principalement des
tensions musculaires à l'avant main, le praticien doit porter son
attention sur la proprioception du cheval. Des mobilisations sur les
antérieurs tel que protraction, rétraction, médiomotion et
latéromotion peuvent s'avérer utiles si le cheval chute. Si les
étirements sont répétés
régulièrement, le cheval pourrait se rattraper rapidement avant
sa chute, les mouvements seraient plus souples et efficaces. Ces mobilisations
traitent également les raideurs de l'avant main.
C) L'algothérapie
L'algothérapie est une technique qui se résume
à envelopper l'animal d'une préparation qui, à l'aide des
ses composants à base d'algues, d'argiles et de sédiments marins,
apporte chaleur et sensation de bien être :
-Elle permet aux muscles de se détendre et favorise ainsi
la relaxation physique et mentale.
-Elle stimule la circulation sanguine ainsi que la circulation
lymphatique.
- Elle a des propriétés antalgiques et
anti-inflammatoires sur les zones musculaires ou tendineuses.
-Elle élimine les toxines musculaires, comme l'acide
lactique et apporte des sels minéraux et oligo-élément
indispensables au bon fonctionnement de l'organisme, notamment pour la
contraction musculaire.
-Elle apporte confort et souplesse aux articulations, notamment
celles atteintes d'arthrose.
-Elle nourrit et tonifie l'organisme en lui procurant les
minéraux nécessaires à son bon fonctionnement.
Sur les chevaux atteint de narcolepsie, une pose
d'algothérapie, qu'elle soit à base d'algues ou d'argiles, permet
de remettre l'organisme à zéro en éliminant les tensions,
en drainant les toxines et en redonnant de la souplesse. Chez les chevaux qui
sont également cataplectique, une pose de
45
boue marine (on parle de fangothérapie) est, quant
à elle, utilisée pour soulager les douleurs articulaires. Encore
une fois, le problème de la détente et donc d'une émotion
positive peut être un danger pour le cheval. Il est obligatoire dans ces
cas-là de rester auprès de l'animal tout au long de la pose pour
pouvoir surveiller les signaux d'une crise et agir en conséquence.
D) Le K-Taping
Le tape est une bande élastique en coton pur, sans latex
et d'une élasticité longitudinale pouvant atteindre 140 % avec
une colle acrylique disposé dessus, conçue pour maintenir le
fonctionnement manuel du praticien entre les consultations. Son
efficacité est constante jusqu'à enlèvement de la bande.
Il stimule les récepteurs de la peau et agit pour influencer les
proprio-récepteurs. Ainsi on obtient un effet ciblé sur
l'interaction entre le tonus musculaire, l'articulation, les ligaments et les
nerfs. La bande entraîne un soulèvement de la peau
élargissant ainsi l'espace inter-tissulaire, favorisant ainsi un
meilleur transport de la lymphe, une meilleure circulation du sang et un
soulagement des récepteurs de douleur. Le tape peut être
utilisé lors du travail du cheval, il ne cause aucune restriction de
mouvements.
Plusieurs types de pose existent : la pose musculaire (tonifiant
ou détonifiant), ligamentaire, lymphatique, pose de corrections de
fascias, space tape. La pose de tape peut toujours être utile même
si le cheval narcoleptique-cataplectique n'a pas de réel besoin à
ce niveau -là. C'est au praticien de prendre cette décision en
fonction de chaque cheval. Le tape a également quelques
contre-indications : il ne doit pas être posé sur une peau
irritée ou sur toute autre affection cutanée telle plaie ouverte
non traitée, et bien d'autres encore.
E) La fasciathérapie
Le fascia est un tissu conjonctif (comme les tendons et les
ligaments) également appelé connectif. C'est une membrane plus ou
moins élastique, capable de se contracter et d'influencer la dynamique
musculaire, articulaire, la biologie et l'ensemble du bon fonctionnement du
corps. En tant que tel, il joue un rôle important dans la transmission de
la force et le contrôle du mouvement, la douleur et l'inflammation, et
même la conscience du corps et de soi. Ils sont interconnectés
dans un réseau complexe qui relie le sommet du crâne aux phalanges
et allant de la superficie de la peau jusqu'à l'intérieur de la
cellule. Cette continuité faciale, aujourd'hui démontrée,
explique pourquoi des problèmes localisés dans une partie du
corps peuvent avoir des effets à longue distance. Par leur relation
étroite avec le système nerveux central, ils participent à
l'interconnexion physique/mental. Cette voie de communication explique comment
la tension faciale est impliquée dans l'anxiété, les
réponses émotionnelles et de stress, et l'équilibre
psychophysique plus largement.
Ils jouent un rôle important dans
l'élasticité et le bon fonctionnement du corps, et l'exercice est
essentiel pour empêcher le fascia de se raidir. Grâce à leur
élasticité et leur tension, les fascias absorbent et
répartissent de manière harmonieuse les chocs physiques et
psychologiques auxquels
46
nous sommes constamment soumis. Le fascia est une structure
fluide avec la capacité de se déformer dans tous les sens et peut
se contracter indépendamment du reste. Leur hypertonie ou leur
crispation explique la présence de douleurs, de dysfonctionnements
parfois médicalement inexpliqués.
La fascia-thérapie est une technique sollicitant ces
membranes par des points d'appui et des étirements plus ou moins
profonds sur des lignes et emplacements précis du corps pour
réduire les adhérences tissulaires.
Lors de traumatismes, tel que la chute d'un cheval cataplectique,
les fascias vont avoir tendance à se rétracter, à perdre
de la viscoélasticité. Cette perte de mobilité (on parle
d' « adhérence ») et la réduction du glissement des
structures entraînent des modifications de la vascularisation et de
l'apport liquidien, qui peuvent être à l'origine de la douleur.
La fascia-thérapie ne possède pas de contre
indication absolue mais il est tout de même fortement recommandé
de laisser le cheval au repos au moins 48 heures entre deux séances. En
effet, les frictions provoquant l'inflammation des fascias laisse des
courbatures au cheval.
III. Autres accompagnements
A) Professionnel du milieu équin
Il est important de rappeler que le massothérapeute ne
peut pas travailler tout seul. Pour aider et accompagner au mieux le cheval
atteint de narcolepsie-cataplexie, il doit s'entourer d'autres professionnel de
la santé équine.
Le cheval doit avant tout être suivi et diagnostiqué
par un vétérinaire. L'accompagnement d'un ostéopathe pour
régler les éventuelles problèmes musculo-squelettiques est
important. Des séances de shiatsu peuvent compléter celles du
massothérapeute. Des communications animal peuvent aider le cheval
à mieux comprendre ce qu'il se passe ou même résoudre le
problème si il n'est pas réellement narcoleptique-cataplectique
(pour un cheval avec un syndrome d'hypersomnie par exemple). Un
kinésiologue équin peut apporter son aide en communiquant avec le
cheval au travers d'un «transfert» (une personne qui touche le
cheval) afin d'identifier les situations de stress (vécues ou
présentes) et les corriger pour lui procurer
sérénité et bien être. La kinésiologie
équine est capable de régler le problème si ce n'est pas
un syndrome de narcolpesie-cataplexie. Étant donné que ce
syndrome n'est pas entièrement connu et compris, et que les traitement
médicaux ne sont pas toujours efficaces, le propriétaire, s'il le
souhaite, doit s'entourer au maximum. L e comportementaliste équin, le
magnétiseur, le thérapeute Reiki et bien d'autres peuvent
soulager les symptômes, voire les faire disparaître s'il
s'avère que le problème est autre chose que le syndrome de
narcolepsie-cataplexie.
47
B) Les outils
Il reste d'autres outils à mettre en place pour assurer la
sécurité et le confort du cheval. Ne surtout pas isoler le cheval
atteint de ce syndrome. Que ce soit au pré ou au box, il est important
de penser notamment aux compagnons de pâture, surtout s'il n'y en a qu'un
seul avec le cheval narcoleptique-cataplectique. En effet, son compagnon
pourrait être affecté psychologiquement, il peut prendre la
position de leader et être deux fois plus vigilant dû fait des
phases répétées et incontrôlables de
vulnérabilité en période de sommeil paradoxal de son
congénère. Cela pourrait le mettre en stress perpétuel, il
faut donc aussi l'accompagner au mieux.
Si le cheval est au box ou au pré avec un abri,
l'idéal est d'installer des tapis en caoutchouc pour amortir ses chutes,
des coussins de protection sur les parois du box et mettre une bonne
épaisseur de litière. Des caméras de
vidéosurveillance pour analyser les crises au moins les 14 premiers
jours est un plus, même si c'est parfois difficile à mettre en
place, surtout pour les chevaux en pâturage.
48
TROISIÈME PARTIE :
DIAGNOSTIC ET TRAITEMENTS
49
I. Difficultés de diagnostic
A) Un diagnostic d'exclusion
Le diagnostic de narcolepsie-cataplexie n'est pas facile, et les
erreurs sont souvent commises en médecine équine, et le
diagnostic différentiel n'est pas le plus simple à faire. Cela se
fait en excluant toutes les autres causes possibles, notamment les causes
neurologiques et cardiovasculaires (REED, BAYLY, and SELLON 2010 ; KNOTTENBELT
2014). Le vétérinaire doit comparer les signes cliniques (NOUT
and JEFFCOTT 2012) sans oublier les abrasions en face dorsales des carpes et
boulets antérieurs (ALEMAN 2015) avec toutes les affections pouvant
être en cause, les examens complémentaires qui pourraient
être effectués et leurs résultats. Celles-ci sont
limitées par rapport à la médecine humaine utilisant la
polysomnographie et les tests de latence d'endormissement. Mais ces examens ne
sont pas possible chez le cheval en France, du moins en dehors du domaine de la
recherche (HINES 2005). L'idéal pour le diagnostic est d'avoir une
anamnèse et des commémoratifs très
détaillés, y compris une description très précise
par le propriétaire (ALEMAN 2015) et des séquences vidéo
du cheval pendant la crise (REED, BAYLY, and SELLON 2010). Mettre en place une
vidéosurveillance continue pendant au moins 7 jours dans l'habitat
normal d'un cheval est possible et très utile, mais difficile à
réaliser en pratique (ALEMAN 2015). Les cliniciens qui examinent un
cheval souffrant de troubles du sommeil doivent garder à l'esprit que le
syndrome de narcolepsie-cataplexie ne doit être qu'un diagnostic
d'exclusion (NOUT and JEFFCOTT 2012 ; REED, BAYLY, and SELLON 2010).
B)Diagnostic différentiel
1) Narcolepsie sans cataplexie
Le diagnostic différentiel de la narcolepsie sans
cataplexie est très limité car une autre cause majeure possible
est l'hypersomnie. Cependant, il peut être difficile de distinguer les
deux troubles car leurs symptômes sont similaires (ALEMAN 2015 ; BERONE
2007). Cette hypersomnie survient chez les chevaux qui ne réalisent pas
des cycles complets de sommeil par défaut de couchage en
décubitus latéral le plus souvent. Elle peut être
idiopathique, notamment chez les chevaux de plus de 15 ans, ou secondaire
à une privation de sommeil (BERTONE 2007). Ce dernier a trois racines
principales (BERTONE 2006) : insécurité environnementale, des
problèmes médicaux qui empêchent le cheval de se coucher et
la monotonie. L'insécurité environnementale peut être due -
entre autres - à la présence de prédateurs (chevaux
sauvages), à des problèmes de dominance, à des conditions
météorologiques difficiles voire extrêmes, à des
compétitions, à une hospitalisation, à un trop grand
nombre de personnes dans les écuries (surtout de nuit), une aire de
couchage absente ou inconfortable (ALEMAN 2015). Diverses études ont
également mis en évidence l'importance de l'environnement du
cheval, notamment sa litière, sur la qualité du sommeil (DALLAIRE
and RUCKEBUSCH 1974 ; PEDERSEN, SONDERGAARD, and LADEWING 2004). Les causes
médicales pouvant conduire à une absence de décubitus sont
des douleurs majoritairement chroniques d'origine osseuse,
musculo-squelettique, gastro-intestinale (entérolithes) ou thoracique
(pleuropneumonie) voire neuropathiques. Elles peuvent rendre le cheval inapte
à se coucher ou à se relever (ALEMAN 2015 ; BERTONE 2006). Cela
peut également se produire chez certaines juments vers la fin de la
gestation (BERTONE 2016). La monotonie quant à elle correspond à
un début d'endormissement réel et normal du cheval en sommeil
lent suite à un épisode de somnolence (BERTONE 2007). Les
cliniciens se tournent le plus souvent vers le
50
diagnostic thérapeutique : en s'attaquant à la
source de l'hypersomnie, le cheval peut à nouveau présenter un
cycle de sommeil normal, ce qui écarterait l'hypothèse de
narcolepsie sans cataplexie (BERTONE 2006).
Le diagnostic différentiel doit également
considérer certaines étiologies minoritaires de l'hypersomnie
suite à la privation de sommeil. En fait, des recherches récentes
ont montré que certains cas de maladie de Lyme ou de terreurs nocturnes
produisent des symptômes très similaires au syndrome de
narcolepsie, mais sans la cataplexie (BERTONE 2016). De plus, il y a eu
quelques cas de narcolepsie post-traumatisme cérébrale en
médecine humaine, mais pas encore chez les chevaux (BAUMANN et al.
2009).
2) Narcolepsie avec cataplexie
Le diagnostic différentiel va se concentrer sur la
cataplexie qui est le meilleur marqueur de la maladie (REED, BAYLY, and SELLON
2010). Il est plus large que le cas de la narcolepsie sans cataplexie car il
comprend toutes les affections pouvant provoquer une faiblesse musculaire
soudaine entraînant des chutes, y compris l'épilepsie et les
causes cardiovasculaires de collapsus (KNOTTENBELT 2014). Distinguer les cas de
narcolepsie avec cataplexie de ceux avec convulsions atoniques
généralisées peut être extrêmement difficile
(MIGNOT and DEMENT 1993). Chez le poulain, la principale hypothèse
à écarter avant d'envisager un syndrome de narcolepsie-cataplexie
est l'hypoglycémie. Il est à noter qu'après avoir pris de
l'acépromazine, les chevaux peuvent connaître une crise de
faiblesse soudaine et une perte de conscience, qui peuvent faire penser au
syndrome de narcolepsie-cataplexie (NISHINO 2007b).
Les différents troubles qui doivent être pris en
compte et écartés avant de tirer des conclusions sur la
narcolepsie avec cataplexie sont (NISHINO 2007a) :
-Les syncopes. Une syncope est un syndrome clinique comportant
une faiblesse généralisée, un collapsus brutal et une
perte transitoire de conscience. Ceci est le résultat d'une diminution
soudaine du débit sanguin cérébral et d'une
ischémie cérébrale subséquente. Elle peut
être d'origine cardiaque ou extracardiaque. Syncope et attaque de
narcolepsie-cataplexie peuvent être difficilement différenciables,
mais l'aréflexie et les mouvements oculaires rapides de la narcolepsie
sont absents lors d'une syncope.
Les causes cardiaques de syncope chez le cheval peuvent
être une rupture de la corde tendineuse, une fibrose myocardique, une
endocardite aortique, une fibrillation atriale, un infarctus du myocarde ou une
péricardite (REED, BAYLY, and SELLON 2010).
-Les troubles métaboliques. Il peut s'agir d'une
hyperthermie, d'un état de choc (dont choc anaphylactique), d'une
hypoglycémie (à rechercher en priorité chez le poulain),
d'une endotoxémie, d'une hypocalcémie, d'une hypo- ou d'une
hyperkaliémie, de l'envenimation suite à une morsure de serpent.
Ces hypothèses peuvent être facilement exclues avec une bonne
anamnèse et des tests supplémentaires appropriés. Chez les
quarter horses, il faut penser à la paralysie périodique
hyperkaliémique ; un test ADN est disponible (REED, BAYLY, and SELLON
2010 ; MOORE and JOHNSON 2000).
-Les troubles neuromusculaires. Il peut s'agir de botulisme, de
myopathie ou de neuropathie post-anesthésique, de rhabdomyolyse à
l'exercice, d'un syndrome myasthénie-like. Ils ne provoquent pas de
perte de conscience, ce qui les distingue généralement de la
narcolepsie-cataplexie (REED, BAYLY, and SLLON 2010).
-Les convulsions généralisées. À
l'exception de très rares cas de convulsions atoniques, la distinction
avec la narcolepsie-cataplexie est relativement facile en raison d'une perte de
conscience complète et profonde, d'une activité tono-clonique,
d'une position d'opisthotonos
51
(contracture de tous les muscles postérieurs du corps) et
de mictions fréquentes et de selles involontaires (MIGNOT and DEMENT
1993).
-Les traumatismes crâniens. Ceux-ci peuvent provoquer une
hémorragie sous-arachnoïdienne, entraînant une brève
perte de conscience. Mais l'examen neurologique révéle des
anomalies entre les épisodes, ce qui a permis d'exclure une
narcolepsie-cataplexie.
Enfin, il existe des cas de narcolepsie-cataplexie "mixtes" :
certaines maladies peuvent s'accompagner de narcolepsie, ou l'imiter. Cela a
été démontré pour l'encéphalite à
protozoaires causée par le Sarcocystis neurona,
l'encéphalomyélite de West Nile et rarement le
dysfonctionnement de la pars intermedia de l'hypophyse (ALEMAN 2015 ;
HINES 2005).
C) Examens complémentaires
Le bilan complémentaire est indispensable au diagnostic
du syndrome de narcolepsie-cataplexie, et il faut rappeler qu'il s'agit d'un
diagnostic d'exclusion (REED, BAYLY, and SELLON 2010). Dans le cas de cette
maladie, la numération-formule sanguine, la biochimie sanguine, le
ionogramme, les analyses d'urine et de LCR, l'ECG et l'échocardiographie
n'ont révélé aucune anomalie (BERTONE 2006). Cela permet
d'exclure de nombreuses hypothèses du diagnostic différentiel
(REED, BAYLY, and SELLON 2010). En plus de la vidéo que le
propriétaire peut fournir au clinicien (HINES 2005), le test de choix
est l'EEG, qui présente pendant les attaques de narcolepsie-cataplexie
les caractéristiques du sommeil paradoxal (MOORE and JOHNSON 2000 ;
REED, BAYLY, and SELLON 2010). Mais l'interprétation de l'EEG d'un
poulain peut être très délicate (KNOTTENBELT 2014), et en
France elle n'est pas accessible aux clients, mais à peu près
uniquement dans le domaine de la recherche (HINES 2005). Les cas où une
maladie sous-jacente est suspectée (encéphalite à
protozoaires, encéphalomyélite de West Nile,
dysfonctionnement de la pars intermedia de l'hypophyse) elles doivent
faire l'objet d'investigations spécifiques (HINES 2005).
D) Diagnostic pharmaceutique
Le diagnostic pharmaceutique repose sur divers tests de
provocation de la narcolepsie-cataplexie, qui peuvent s'avérer
très utile (REED, BAYLY, and SELLON 2010). Différentes
molécules peuvent être utilisées :
-La physostigmine (salicylate de physostigmine). Il s'agit d'un
agent cholinergique (anticholinestérase) qui diffuse à travers la
barrière hémato-méningée (BMH). Il induit une crise
dans les 3 à 10 minutes suivant l'injection. Mais la réponse est
très individu-dépendante donc ce test n'est informatif que s'il
est positif (REED, BAYLY, and SELLON 2010). La trop grande variabilité
des résultats a conduit certains auteurs, dont l'ACVIM, à ne plus
l'utiliser comme outil de diagnostic (NOUT and JEFFCOTT 2012 ; BERTONE 2016).
De plus il n'est pas disponible en France et peut entraîner des coliques
(REED, BAYLY, and SELLON 2010).
-La néostigmine (méthylsulfate de
néostigmine).Il s'agit d'un agent cholinergique
(anticholinestérase) et ne diffuse pas à travers la BMH. En cas
de troubles périphériques tels que la myasthénie grave, il
augmente le tonus musculaire. Si ce test est négatif, cela permet
d'exclure ces atteintes (MIGNOT and DEMENT 1993 ; REED, BAYLY, and SELLON
2010).
-L'atropine (sulfate d'atropine). Il s'agit d'un agent bloquant
muscarinique. Il peut réduire la gravité des crises de cataplexie
et même les éliminer dans les 12 à 30 heures suivant
l'injection.
52
Cependant, les chevaux testés avec cette molécule
doivent être surveillés en raison d'effets digestifs
indésirables (iléus, coliques) (REED, BAYLY, and SELLON 2010).
Pour synthétiser, le diagnostic du syndrome de
narcolepsie-cataplexie ne peut être qu'un diagnostic d'exclusion. Cela
nécessite de nombreux tests supplémentaires pour exclure d'autres
pathologies. Par conséquent, les examens sanguins, cardiaques et
neurologiques n'ont révélé aucune anomalie. Les plus
instructifs pour les cliniciens sont la vidéosurveillance et l'EEG, qui
est malheureusement difficile à obtenir en dehors du domaine de la
recherche. Le diagnostic différentiel de la narcolepsie sans cataplexie
revient presque entièrement à l'hypersomnie. La narcolepsie avec
cataplexie est un spectre plus large qui comprend tous les troubles pouvant
entraîner des syncopes, des causes métaboliques, des troubles
neuromusculaires, des convulsions généralisées et des
encéphalites. Le diagnostic pharmacologique est possible, mais les
difficultés d'obtention des molécules, les effets secondaires et
les réponses très individu-dépendantes limitent sa
réalisation et son utilité.
II. Traitements médicaux
A) Lutte contre les attaques de narcolepsie et de cataplexie
Contrairement à la médecine humaine qui propose
divers traitements symptomatiques du syndrome de narcolepsie-cataplexie, la
médecine équine a des possibilités thérapeutiques
limitées (ALEMAN 2015). Certes, une seule molécule serais
efficace, mais aucun essai thérapeutique contrôlé n'a
été mené pour juger de son efficacité (HINES 2005).
Il s'agit de l'imipramine (chlorhydrate d'imipramine) (Tofranil ND,
spécialité humaine), un antidépresseur tricyclique qui
bloque la recapture synaptique de la sérotonine et de la
noradrénaline (VANDENBUNDER 2002), augmentant ainsi la
disponibilité au niveau cérébral de ces molécules
favorisant l'éveil (POITTE 2015). Ainsi, il supprime principalement les
épisodes de cataplexie (HINES 2005), mais réduit également
le volume de sommeil paradoxal, qui est celui dans lequel sombrent les chevaux
atteints lors des crises de narcolepsie. Le traitement est à prendre au
moins deux fois par jour (ALEMAN 2015 ; MOORE and JOHNSON 2000). Mais la forme
injectable n'est pas disponible en France («VIDAL» 2017), et la
digestion et l'absorption varient d'un cheval à l'autre. Cette dose doit
être ajustée mensuellement, tant en dose qu'en fréquence
d'administration (HINES, SCHOTT, and BYRNE 1992). En termes d'effets
secondaires, ceux-ci se sont produits de manière détectable
à des doses supérieures à 2 mg/kg. Il peut s'agir d'une
tachycardie, d'une hyperréactivité aux stimuli sonores, de
fasciculations musculaires, d'une hémolyse (REED, BAYLY, and SELLON
2010). Cependant, ils sont encore très rares, mais cela peut être
lié au faible nombre de cas diagnostiqués. De plus, parmi ces cas
tous ne sont pas traités, il y a donc un manque de données et de
recul certains. Des interactions médicamenteuses avec les barbituriques
et avec des molécules utilisées en anesthésie
générale ont été décrites (PECK et al.
2001). Il s'agit d'un traitement symptomatique uniquement (NISHINO 2007b) et
doit être pris à vie (PECK et al. 2001). Si le traitement doit
être interrompu, il doit être fait progressivement pour limiter les
épisodes de «rebond» de cataplexie après la disparition
de l'imipramine de la circulation (ABAD and GUILLEMINAULT 2003). Les
traitements médicaux sont loin d'être systémiquement
efficaces et l'imipramine orale donne souvent des résultats
incohérents (ALEMAN 2015), ce qui conduit certains auteurs à
écrire qu'il n'existe aucun traitement pour ce syndrome (KNOTTENBELT
2014). Fait intéressant, certains chevaux traités avec de la
tyrosine par voie orale ont montré une amélioration clinique
(REED, BAYLY, and SELLON 2010). Compte tenu de ce qui précède, il
semble
53
raisonnable de se demander si le traitement des chevaux
narcolepsie-cataplexie est réellement utile. De nombreux
propriétaires de chevaux atteints décident de tolérer
simplement ces crises, notamment parce que connaissant les signes annonciateurs
d'une crise ils peuvent stimuler le cheval et limiter les risques de chutes.
D'autres propriétaires de chevaux choisissent d'essayer le traitement
pendant une période de temps, de quatre à huit semaines, pour
évaluer l'effet sur le cheval. Ceci est relativement courant car le
coût de l'imipramine est très raisonnable (MOORE and JOHNSON 2000
; «VIDAL» 2017). Les changements environnementaux peuvent parfois
améliorer la fréquence et/ou la gravité des crises, mais
cela est loin d'être systémique. Des résolutions
spontanées ont été observées, mais uniquement chez
des poulains (KNOTTENBELT 2014).
B) Pronostic
Le pronostic des cas de syndrome de narcolepsie-cataplexie varie
en fonction de la gravité des épisodes et des circonstances dans
lesquelles surviennent les crises les plus courantes (REED, BAYLY, and SELLON
2010). En effet, un cheval qui ne fait que des crises dans le paddock n'aura
pas la même gravité qu'un cheval plus imprévisible, qui
fait des crises lorsqu'il est monté. Des cas complètement
résolus ont été décrits chez de très jeunes
poulains pur-sang anglais et miniatures atteints de la forme familiale, ainsi
que chez de quelques jeunes chevaux atteints de la forme acquise,
âgés de 2 à 3 ans (REED, BAYLY, and SELLON 2010).
C) Les options de traitement
Divers essais ont été menés pour trouver des
traitements plus efficaces du syndrome de narcolepsie-cataplexie, mais la
plupart des molécules utilisées dans les cas humains et
même canins ne peuvent pas être utilisées chez les chevaux
(BILLIARD 2008). Par exemple le modafinil, un stimulant central dont le
mécanisme excitant semble être dû à son action sur
les récepteurs adrénergiques de hypothalamus (VALATX 1998), ou
l'oxybate de sodium, qui appartient à la classe des stupéfiants,
est coûteux et réduit fortement la digestion et l'absorption si
l'estomac est plein (BILLIARD 2008). L'oxybate de sodium est un
dépresseur du SNC qui réduit la somnolence diurne, la cataplexie
et la fragmentation du sommeil nocturne par un mécanisme inconnu
(«VIDAL» 2017). En 2016, la Haute autorité de la Santé
a autorisé la mise sur le marché du pitolisant (Wakix ND) pour le
traitement de la narcolepsie. C'est un antagoniste/agoniste inverse du
récepteur H3 de l'histamine , un neurotransmetteur qui favorise
l'éveil (SZAKACS et al. 2017). Mais il n'existe aucune données
concernant l'espèce équine pour cette spécialité
humaine. Aussi, le marché représenté par les chevaux
atteints de narcolepsie-cataplexie étant si restreint, il est peu
probable que les laboratoires s'y intéressent en particulier. Une autre
possibilité est de développer des agonistes
hypocrétinergiques capables de traverser le BHM (NISHINO 2007b), mais
les problèmes mentionnés ci-dessus avec le développement
des sociétés pharmaceutiques demeurent. Certains auteurs comme
Nishino et Mignot (MIGNOT and DEMENT 1993 ; NISHINO 2007b) pensent que le
traitement futur du syndrome de narcolepsie-cataplexie fera appel à un
support génétique : transplantation cellulaire, thérapie
génique de substitution de l'hypocrétine. Cette dernière
semble être la voie la plus prometteuse, mais n'en est qu'au stade de
projet pour le moment (NISHINO 2007b). De plus, une telle solution n'est
possible que si l'origine génétique est connue, prouvée et
identifiée, ce qui n'est pas le cas des chevaux. Par conséquent,
les perspectives d'un éventuel nouveau traitement de la narcolepsie
équine sont très minces.
54
Pour résumer, Par conséquent, les options de
traitement pour les chevaux atteints du syndrome de narcolepsie-cataplexie sont
très limitées et uniquement symptomatiques. Seule l'imipramine
semble montrer des résultats dans la suppression de la cataplexie et la
réduction de la quantité de sommeil paradoxal. Cependant, son
efficacité est débattue et dépend en tout cas de
l'individu. Le pronostic est donc réservé. Certaines
auto-solutions ont été décrites, mais cela reste rare. Le
pronostic dépendra de la fréquence et du contexte des attaques.
Les nouvelles molécules approuvées pour traiter la
narcolepsie-cataplexie chez l'homme n'a pas encore été
testée chez les chevaux. De plus, certains d'entre eux sont des
stupéfiants et donc difficiles à obtenir. Des recherches de
traitement avec un support génétique sont en cours, mais on en
sait si peu sur la composante génétique du syndrome équin
qu'il sera difficile de l'appliquer. Des recherches futures pourraient
contribuer à faire avancer ce fait, mais la taille probable du
marché pour une molécule destinée à traiter la
narcolepsie chez les chevaux est très petite, et les lourds protocoles
d'étude et de mise sur le marché rendent de tels progrès
peu probables.
Pour synthétiser :
La prévalence du syndrome de narcolepsie-cataplexie chez
les équidés reste inconnue. Cependant, le diagnostic du syndrome
est important. Selon la fréquence des crises et le contexte dans lequel
les crises se déclenchent, un cheval peut être dangereux, par
exemple s'il tombe sur son cavalier lors du pansage ou de sa monte. Les
cliniciens confrontés à une suspicion de cas de
narcolepsie-cataplexie doivent garder à l'esprit qu'il ne peut s'agir
que d'un diagnostic d'exclusion plutôt que de se précipiter
à la recherche de cette étiologie. Les antécédents
médicaux doivent être exhaustifs et décrire en
détail les événements suspects. Un examen clinique
général et neurologique complet doit être effectué,
en portant une attention particulière à la face dorsale des
carpes. Des tests supplémentaires sont nécessaires pour
écarter certaines hypothèses, par exemple syncope d'origine
cardiaque, hypoglycémie, hypersomnie. Les examens biologiques (sang,
urine, LCR) et cardiaques (ECG, échocardiographie) idéalement
recommandés seront normaux. Le diagnostic pharmacologique est possible,
dans l'éventail des effets secondaires, de la plus ou moins bonne
réponse de l'individu et de la disponibilité de la
molécule. Parfois, un diagnostic thérapeutique peut être
posé. Les traitements sont peu nombreux et décevants.
Actuellement, seule l'imipramine est utilisée. Cette molécule
inhibe les attaques de cataplexie et diminue la quantité de sommeil
paradoxal. La nécessité d'un réajustement mensuel de la
dose et les changements dans les réponses individuelles compliquent son
utilisation, à la fois thérapeutique et diagnostique. Une autre
option pour les propriétaires est de tolérer et d'apprendre
à repérer les signes avant-coureurs de ces attaques pour tenter
de les éviter. Cela n'est possible que si les crises ne surviennent pas
dans une situation qui serait dangereuse pour l'entourage du cheval. L'option
génétique semble la plus prometteuse. Des travaux de recherche
sur une thérapeutique à support génétique sont en
cours, mais leur accessibilité aux équidés ne peut
être garantie, ni techniquement ni économiquement. De plus, si la
base génétique chez le cheval est fortement suspectée,
elle n'est pas établie. Cependant, les tests de dépistage
génétique peuvent être intéressants. Des races
telles que les pur-sang sont en effet prédisposées.
Déterminer la possibilité d'un syndrome de narcolepsie-cataplexie
avant d'acheter ou de saillir est utile à la fois aux acheteurs et aux
éleveurs.
55
III. Cas cliniques
1) Hongre quarter horse de douze ans
D'après BERTONE (2006).
Anamnèse : hongre quarter horse de 12 ans
présenté pour une importante perte de poids. Cheval de loisir en
équitation western depuis 8 ans ayant commencé à maigrir
de façon importante il y a 6 mois. Les propriétaires n'ont
réalisé aucune mesure objective du poids, ils rapportent un petit
appétit et une lenteur de consommation du fourrage et de la nourriture
en général.
Examen clinique général et
spécialisé : cheval calme mais pas abattu. Il toise 1,63 m pour
427 kg, le poids standard d'un cheval de cette taille se situant autour des 570
kg. En face dorsale des deux boulets antérieurs se trouvent deux
dépilation de 2-3 cm de diamètre. Le reste de l'examen ne
révèle aucune anomalie. Placé au calme au box, le cheval
présente des épisodes de somnolence avec fermeture des yeux et
relâchement de la lèvre inférieure suivis quelques secondes
plus tard par un fort abaissement de la tête puis un affaissement de
l'avant-main sur les boulets antérieurs, avant que le cheval ne se
relève juste avant de tomber.
Examens complémentaires : biochimie sanguine et
fibrinogène plasmatique dans les valeurs usuelles,
numération-formule sanguine présentant une formule de stress avec
un comptage des neutrophiles dans les limites hautes et un comptage des
lymphocytes dans les limites basses des valeurs usuelles. Le liquide de
paracentèse et la palpation transrectale ne présente pas
d'anomalie. Radiographies thoraciques et abdominales envisagées, en
route pour la salle de radiographies un bruit provenant de l'abdomen est
entendu, il ressemble à deux rochers entrant en collision sous l'eau. La
radiographie thoracique met en évidence une paire d'entérolithes
crâniaux derrière le diaphragme.
Traitement : une laparotomie thérapeutique est
réalisée, les deux entérolithes sont repoussés de
la courbure diaphragmatique vers la courbure pelvienne et sont extraits suite
à une entérotomie du côlon ventral. Les adhérences
entre la courbure diaphragmatique et le diaphragme sont
éliminées. La chirurgie et l'anesthésie se sont bien
déroulées. Une heure après son retour au box, le cheval
est vu en décubitus latéral pour la première fois depuis
son arrivée à la clinique, il reste couché 12h. Les jours
suivant il est vu deux à trois fois par jour en décubitus sternal
ou latéral. Il sort d'hospitalisation dix jours après la
chirurgie.
Six mois plus tard, le hongre pèse 586,4 kg, il ne
présente plus de dépilation en face dorsale des boulets
antérieurs et les propriétaires le voient
régulièrement couché, ce qu'ils n'observaient pas
auparavant.
Diagnostic : hypersomnie secondaire à une privation de
sommeil causée par une incapacité à se coucher (douleur
causée par les adhérences entre la courbure diaphragmatique et le
diaphragme). Perte de poids consécutive à l'association des
adhérences précitées, du manque de sommeil, des
entérolithes et la péritonite chronique.
2) Hongre quarter horse de huit ans
D'après BERTONE (2006).
Anamnèse : hongre quarter horse de 8 ans récemment
acheté pour une activité de loisir, référé
pour un syndrome de narcolepsie-cataplexie secondaire à une
encéphalite à protozoaires. Les épisodes de collapsus
durent depuis 8 mois, ils ont débuté 30 jours après
l'achat. Le cheval vit seul dans un pré accolé à la maison
des propriétaires qui le voient depuis leurs fenêtres. Le cheval
présente plusieurs fois par jour des moments de faiblesse musculaire
durant lesquels il s'effondre presque jusqu'à la chute. Un
prélèvement et une analyse de LCR ont été
réalisés, l'analyse est positive pour Sarcocystis
56
neurona (recherche par Western blot), l'analyse
cytologique n'a pas été réalisée. Plusieurs
traitements anti-protozoaires ont été essayés, sans
amélioration des symptômes.
Examen clinique général et spécialisé
: le hongre est calme mais pas abattu. Il est en bonne condition physique et
pondérale (472,7 kg pour 1,52 m au garrot). Des dépilations
d'environ 2-3 cm de diamètre sont observées en face dorsale des
boulets antérieurs. Le cheval ne boite pas et le reste de l'examen
clinique est normal. L'examen neurologique ne révèle aucune
anomalie.
Examens complémentaires : numération-formule
sanguine, biochimie sanguine et fibrinogène plasmatique dans les valeurs
usuelles. Le liquide de paracentèse et la palpation transrectale ne
présente pas d'anomalie. Les radiographies abdominales et thoraciques
ainsi que l'échographie ne révèlent aucune anomalie.
Un questionnement plus poussé est entrepris auprès
des propriétaires. Le hongre a été acheté dans une
ferme d'environ cent chevaux qui partageaient la même pâture. Il a
déménagé dans un champ de 4 hectares près d'une
autoroute assez passante, sans compagnon.
Hypothèse diagnostique : hypersomnie secondaire à
une privation de sommeil causée par une insécurité
environnementale.
Traitement : le cheval miniature de 23 ans d'un des
vétérinaires est emprunté et installé comme
compagnon de pré du hongre atteint. Le premier jour suivant
l'arrivée du cheval miniature, le hongre est vu couché environ la
moitié du temps. Les jours suivant, il passe toujours beaucoup de temps
à dormir. Puis, une fois passé le rebond compensateur de sommeil,
le hongre présente une organisation du cycle veille-sommeil classique et
ne présente plus aucun épisode de collapsus. Les
propriétaires font donc l'acquisition de deux chevaux
supplémentaires et le cheval miniature est rendu à son
propriétaire.
57
| 

