Conclusion
La larve de Rhynchophorus palmarum (Curculionidae)
possède dans son suc digestif une variété de glycosidases
acides et mésophiles sécrétées par les glandes
digestives, par l'insecte lui-même ou par des microorganismes. Les
activités enzymatiques les plus élevées sont celles des
glucosidases et de la â-galactosidase. Les glandes
salivaires sécrètent une forte activité amylasique.
Pour la suite de ce travail, les activités osidasiques
les plus élevées dans le suc digestif seront purifiées et
caractérisées afin de déterminer leur rôle
précis dans le tube digestif et envisager leur éventuelle
utilisation dans le domaine industriel.
II- PURIFICATION ET CARACTERISATION PHYSICO-CHIMIQUE
DE L'á-GLUCOSIDASE DU SUC DIGESTIF DE LA LARVE DE
Rhynchophorus palmarum (Curculionidae)
1-Résultats
1-1- Stratégie de purification
La stratégie de purification utilisée pour
isoler à homogénéité
électrophorétique l'áglucosidase du suc
digestif de la larve de Rhynchophorus palmarum (Curculionidae),
a été la suivante :
- chromatographie échangeuse d'anion sur gel de
D.E.A.E-Sepharose CL-6B ;
- fractionnement de la solution enzymatique issue de la
chromatographie échangeuse d'anion au sulfate d'ammonium ;
- chromatographie d'exclusion moléculaire sur gel de
Sephacryl S-100 HR ;
- chromatographie d'interaction hydrophobe sur gel de
Phényl-Sepharose CL-4B.
1-1-1- Chromatographie échangeuse d'anion sur gel
de D.E.A.E-Sepharose CL-6B
L'extrait brut enzymatique résultant du suc digestif de
la larve de Rhynchophorus palmarum (Curculionidae) est un milieu
visqueux contenant de nombreux pigments et est riche en activités
glycosidasiques. La chromatographie échangeuse d'anion sur gel de
D.E.A.E-Sepharose CL-6B a permis non seulement d'éliminer une bonne
partie de ces pigments mais aussi de retenir une seule activité
á-glucosidasique sur le gel de D.E.A.ESepharose CL-6B.
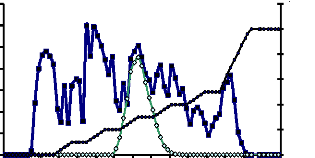
Cette activité a été éluée à la
concentration de 0,3 M de KCl (Fig. 12). L'activité
spécifique de cette enzyme a été de 1,26 UE /mg. Le
rendement et le facteur de purification ont été respectivement de
81,62 % et 2,57 (Tableau 7).
1-1-2- Fractionnement au sulfate d'ammonium
Cette étape a permis d'améliorer le facteur de
purification passant de 2,57 à 3,04. Le rendement obtenu est de 75,64 %
(Tableau 7).
1-1-3-Chromatographie d'exclusion moléculaire sur
gel de Sephacryl S-100 HR
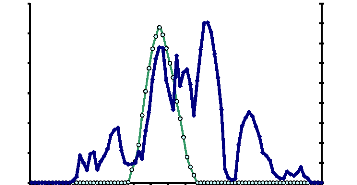
Cette étape chromatographique a permis non seulement
d'obtenir un seul pic d'activité
á-glucosidasique mais aussi d'éliminer le reste
des pigments contenus dans la solution enzymatique (Fig. 13).
L'enzyme responsable de l'hydrolyse du
p-nitrophényl-á-D-glucoside a une
activité spécifique de 32,23 UE/mg de protéine. Le facteur
de purification et le rendement ont été respectivement de 65,77
et 34,43 % (Tableau 7).
1-1-4-Chromatographie d'interaction hydrophobe sur gel de
Phényl Sepharose CL-4B
Cette étape de chromatographie a permis d'isoler une
seule á-glucosidase (Fig. 14). Elle a
été éluée par du thiosulfate de sodium 0,3 M
préparé dans le tampon acétate 100 mM pH 5,6. Son
activité spécifique a été de 94,16 UE/mg. Le
facteur de purification et le rendement ont été respectivement de
20,12 et 19,18 % (Tableau 7).
0,8
0,6
0,4
0,2
0
1,2
1
KC1(M)
3,5
Activite relative (DO 410 nm))
(Protein DO 280
nm)
3
2,5
2
1,5
1
0,5
0
0 10 20 30 40 50 60 70 80 90 100 110 120 130 140 150
Nombre de fraction
|
DO 280 nm DO 410 nm KCl (M)
|
Figure 12 : Profil chromatographique d'échange
d'anion de l'á-glucosidase du suc digestif de la larve de
Rhynchophorus palmarum (Curculionidae) sur gel de D.E.A.ESepharose
CL-6B
La colonne (2,4 × 6,5 cm) a été
équilibrée dans le tampon acétate 100 mM pH 5,6. Le
débit chromatographique a été de 14ml/ h. Les
protéines retenues ont été décrochées par un
gradient en palier croissant de KCl préparé dans le tampon
acétate 100 mM pH 5,6. Des fractions de 4 ml ont été
collectées.
Proteine (DO 280 nm)
Activite relative (DO 410 nm)
3
2,5
2
1,5
1
0,5
0
0,45
0,4
0,35
0,3
0,25
0,2
0,15
0,1
0,05
0
0 10 20 30 40 50 60 70 80 90 100 110 120 130 140 150 160
Nombre de fraction
DO 410 nm DO 280 nm


Figure 13 : Profil chromatographique d'exclusion
moléculaire de l'á-glucosidase du suc digestif de la larve de
Rhynchophorus palmarum (Curculionidae) sur gel de Sephacryl S100
HR
La colonne (1,6 × 64 cm) a été
équilibrée dans le tampon acétate 100 mM pH 5,6. Le
débit chromatographique a été de 15ml /h. Les
protéines ont été éluées par le tampon
acétate 100 mM pH 5,6. Des fractions de 1 ml ont été
collectées.
|
Activite relative (DO 410)
|
0,8 0,7 0,6 0,5 0,4 0,3 0,2 0,1
0
|
|
0,6 0,5 0,4 0,3 0,2 0,1 0
|
Proteine (DO 660 nm)
Thiosulfate de sodium
(M)
|
-1 9 19 29 39 49 59 69 79 89
Nombre de fraction

DO 660 nm DO 410 nm thiosulfate de sodium (M)
Figure 14 : Profil chromatographique d'interaction
hydrophobe de l'á-glucosidase du suc digestif de la larve de
Rhynchophorus palmarum (Curculionidae) sur gel de
PhénylSepharose CL-4B
La colonne (1,4 × 5cm) a été
équilibrée dans le tampon acétate 100 mM pH 5,6 contenant
du thiosulfate de sodium 1,7 mM. Le débit chromatographique a
été de 14 ml/h. Les protéines retenues par le gel ont
été décrochées par un gradient en palier
décroissant de thiosulfate de sodium préparé dans le
tampon acétate 100 mM pH 5,6. Des fractions de 1ml ont été
collectées.
Tableau 7 : Bilan global de la purification de
l'á-glucosidase du suc digestif de la larve de Rhynchophorus
palmarum (Curculionidae)
|
Etape de purification
|
Activité
totale
(U.E.)
|
Protéine
(mg)
|
Activité
Spécifique
(UE
/mg)
|
Facteur de
purification
|
Rendement
(%)
|
|
Extrait brut enzymatique
|
28,08
|
57,36
|
0,49
|
1
|
100
|
|
D.E.A.E. Sepharose CL-6B
|
22,92
|
18,18
|
1,26
|
2,57
|
81,62
|
|
Précipitation au sulfate
d'ammonium (80 % de
saturation)
|
21, 24
|
14,24
|
1,49
|
3,04
|
75,64
|
|
Sephacryl S-100 HR
|
9, 67
|
0,3
|
32,23
|
65,77
|
34,43
|
|
Phényl-Sepharose CL-4B
|
5, 65
|
0,06
|
94,16
|
20,12
|
19,12
|
UE= 1 micromole de p-nitrophénolate
libéré par min
1-2-Critère de
pureté
L'électrophorèse sur gel de polyacrylamide en
présence de SDS et de â-mercaptoéthanol a
permis d'observer une seule bande protéique, traduisant une
pureté satisfaisante de l'á-glucosidase du suc
digestif de la larve de Rhynchophorus palmarum (Curculionidae)
(Fig. 15).
| 


