|

UNIVERSITE CHEIKH ANTA DIOP DE DAKAR
FACULTE DES SCIENCES ET TECHNIQUES Département de
Biologie Animale
Année 2016 Numéro 295
Etude de la dynamique des populations d'Anopheles
et de la transmission du paludisme dans le district sanitaire de Nioro
(Kaolack, Sénégal) après la campagne d'aspersion
intra-domiciliaire d'insecticide de 2015
Mémoire de Diplôme de Master II en
Biologie Animale
Spécialité :
ENTOMOLOGIE
Présenté et soutenu le 04 Juin
2016
Par
Mr Assane Yade Ndiaye
Né le 05
Juillet 1989 à Pikine
Membres du Jury :
Président : Pr Ousmane FAYE
LEVP/FST/UCAD
Membres : Dr Mamadou Demba Sy LEVP/FST/UCAD
Dr Libasse Gadiaga PNLP/MSAS
Dr Abdoulaye Diop Abt Associates
Superviseur : Dr Lassana Konaté
LEVP/FST/UCAD
I
AVANT-PROPOS
Au nom d'ALLAH, le Clément, le Miséricordieux
Paix et salut sur le maître des messagers, le bien
aimé du concepteur de la créature toute entière, ainsi que
sur sa famille, ses compagnons et ceux qui les ont suivis dans la perfection
jusqu'au jour des comptes.
Ce travail a été réalisé au
Laboratoire d'Ecologie Vectorielle et Parasitaire (LEVP) de l'UCAD, en
collaboration avec l'Unité de Recherche sur les Maladies Infectieuses et
Tropicales Emergentes (URMITE) de l'IRD de Dakar.
Qu'il me soit permis de remercier :
Le Professeur Ousmane Faye, pour m'avoir accueilli dans son
laboratoire et proposer ce sujet très intéressant,
répondant à un besoin d'informer et de guider le choix des
mesures de lutte. Vous n'avez ménagé aucun effort quant à
la réussite de nos activités. Vous nous avez mis dans
d'excellentes conditions de travail. Votre humilité, simplicité
et vos qualités
scientifiques font de vous un modèle à suivre.
Recevez ici, l'expression de ma profonde gratitude.
Le Docteur Lassana Konaté, malgré votre emploi
du temps chargé, vous nous avez fait profiter de votre expérience
en nous orientant en vue d'améliorer le document. Soyez assuré de
notre profonde reconnaissance.
Le Docteur El hadji Amadou Niang, malgré vos
occupations, vous avez accepté d'encadrer ce travail. Vous vous
êtes approprié le document et avez participé à sa
conception et à sa finalisation. Vos nombreuses interventions et vos
conseils ont été d'un grand apport. Votre simplicité et
vos qualités scientifiques nous ont séduites. Je ne saurai vous
remercier assez. Puisse ALLAH vous guider et fasse que vous réalisez
tous vos projets.
Les membres du jury, pour avoir accepté de juger de ce
travail.
A toute l'équipe du LEVP : père Alioune Gueye,
père Moussa Diagne, Ndèye Diango Faye, Seynabou M. Diedhiou,
Elhadji Diouf, Mbaye Diouf, Manthia Diallo, Malick Ndao Faye, Pape Thiam,
Babacar Ndiouck, Cheikh Lo. Mention spéciale à Youssou Coulibaly,
père Oumar Niang, Dr Massyla W. Senghor « mon Boss
préféré », pour avoir initié mes premiers
II
pas sur les techniques d'échantillonnage sur le terrain
; Abdoulaye KONATE, un frère sur qui on peut toujours compter, de
m'avoir initié aux techniques des tests de sensibilité ; Omar
Thiaw « mon ami » et Abdoulaye Kane Dia, pour avoir contribuer aux
corrections et à l'amélioration du manuscrit ; El hadji Diouf
qui, malgré ses travaux de thèse et ses occupations, nous a
initié aux techniques de biologie moléculaire et a
contribué grandement aux corrections du document, je ne peux que prier
pour vous.
A mes collègues, Oumou Kalsom Guèye, Amblat Ali
Ahmed et Papa Makhary Fall, pour l'entente, la bonne humeur et l'ambiance
décontractée qui a régné entre nous tout au long de
ce stage.
DéDICACES
Je dédie ce travail : A mes parents :
Mon père Moussa Ndiaye, vous constituez un
modèle pour nous (mes frères, soeurs et moi). Trouver ici le
résultat de longues années de sacrifices et de privations pour
m'aider à avancer dans la vie. Merci pour les valeurs nobles,
l'éducation et le soutien permanent. Puisse Dieu vous prêter
longue vie et une santé de fer pour que vous continuez à nous
accompagner.
Ma mère Oumou Khaïry Diop, ma confidente, mon
amie, mon essentielle. Vous avez beaucoup oeuvré pour notre
réussite de par votre amour, votre soutien, vos sacrifices consentis,
vos précieux conseils et toute l'assistance que vous nous portez.
Recevez à travers ce travail aussi modeste soit-il, l'expression de mes
sentiments et de mon éternelle gratitude.
A mes frères : Youssou « mon jumeau cactus »,
Babacar, Abdou et Khadim et soeurs : Thiané et Fatou, qui n'ont
cessé d'être pour moi des exemples de persévérance,
de courage et de générosité.
A Mawlana Cheikh al islam El hadji Ibrahim Niasse « Baye
» qui a consacré toute son existence à la crainte d'ALLAH et
à la vivification de la Sunna du Prophète (PSL) ainsi que la
Tariqa Tidiane. Que l'agrément d'ALLAH soit sur vous, le
prédicateur vers lui par son ordre.
A mon oncle et ami Moussa Diop ainsi que toute la famille Diop
à St-louis, la famille Ndiaye à Khombole, pour l'affection, les
prières et le soutien constant qu'ils me vouent.
III
A mon homonyme Assane Yade, ses amis père Alpha Ba,
père Ndiaga Dramé ainsi qu'à toute la famille Yade de
Thiaroye, pour leur soutien et leur assistance.
A la famille Marone de Dieupeul, trouver ici l'expression de
mon respect et de ma reconnaissance pour le soutien que vous n'avez jamais
cessé de me porter.
A ma moitié Ndeye Fatou Diallo, merci pour tout ce que
tu fais pour moi et l'importance que tu accordes à ma modeste personne.
Trouve dans ce travail, l'expression de ma profonde gratitude.
A Ndoumbé Mbaye, je ne saurai trouver les mots justes
pour dire à quel point tu es indispensable pour moi. Tes conseils, ton
soutien inlassable et ton assistance sont une source de motivation et me pousse
sans cesse à donner le meilleur de moi-même. Ce travail est
également le vôtre.
A mes amis : Mame Birame Fall, Ibrahima Ndao, Jean
Sédar diaga Marone, Ousmane Kouta, Nicolas Mbaye, Cheikh Tidiane
Dramé, Bidji Ndiaye, Moussa Ndao, Omar Diouf
A la sixième promotion du master en Biologie animale
particulièrement à la famille Entomologie.
A tous ceux qui, de près ou de loin, ont
participé à ce modeste travail, soyez assuré de ma
profonde affection.
III
LISTE DES ABRévIATIONS
ADN: Acide
désoxyribonucléique
An : Anopheles
CTAB: Cétyltriméthylammonium
bromure
DDT :
Dichlorodiphényltrichloroéthane
ELISA: Enzyme linked-immunosorbent Assay
GPS: Global Positioning System
IgG: Immuno-globuline G
IRD: Institut de Recherche pour le
Développement
MILDA : Moustiquaire Imprégnée
d'Insecticide à Longue durée d'Action
OMS : Organisation Mondiale de la
Santé
PCR: Polymerase Chain Reaction
PHN: Piqûre/homme/nuit
PID/AID: Pulvérisation/Aspersion
Intra-Domiciliaire
PNLP : Programme Nationale de Lutte contre le
Paludisme
RBM: Roll Back Malaria
TBE: Tris-Borate-EDTA
UCAD: Université Cheikh Anta Diop de
Dakar
UV: Ultra-violets
WHO: World Health Organization
iv
Liste des tableaux
Tableau 1 : Abondance des espèces anophèliennes
selon la méthode de collecte dans les
différentes zones 21
Tableau 2 : Agressivité des
populations d'An. funestus et d'An. gambiae s.l. à
l'intérieur et à
l'extérieur dans les zones traitées et
témoins 22
Tableau 3 : Variations de la densité au repos selon le
statut de la zone 23
Tableau 4 : Taux de parturité selon les zones 26
Tableau 5 : Sensibilité d'An. gambiae s.l. aux
Carbamates et aux Organophosphorés dans le
district de Nioro 27
Liste des figures
Figure 1: Cycle biologique d'une femelle d'Anopheles
(Source : Hervy et al, 1998) 3
Figure 2: Morphologie d'une femelle d'An. gambiae s.l.
x400 (Source : Amougou zibi, 2010) 5 Figure 3 : Les principales interventions
de lutte anti-vectorielle : MILDA (a) et AID (b)
(Sources: a- who.int; b- Sy, 2015) 9
Figure 4 : Carte du département de Nioro du Rip avec les
différents sites d'études 10
Figure 5 : Etapes de réalisation d'une faune matinale
résiduelle et traitement des échantillons
12
Figure 6 : Prospection des gîtes larvaires et collecte des
larves 13
Figure 7 : Cages d'émergence des adultes 14
Figure 8 : Kit OMS 15
Figure 9 : Recherche de femelles infectantes 16
Figure 10 : Détermination de l'origine des repas de sang
17
Figure 11 : Interprétation des bandes pour
l'identification du complexe Gambiae 18
Figure 12 : Taux d'endophagie (en %) en fonction du statut des
villages 23
Figure 13 : Spectres d'hôtes des populations d'An.
gambiae s.l. et d'An. funestus en fonction
du statut de traitement des zones d'étude 25
v
Table des matières
Introduction générale 1
Chapitre I : Synthèse bibliographique
3
I.1 : Généralités sur les
moustiques vecteurs du paludisme 3
I.2 : Ecologie des vecteurs 5
I.3 : Distribution des vecteurs au
Sénégal 6
I.4 : Mesures de lutte contre les vecteurs
7
Chapitre II : Matériel et méthodes
9
II.1 : Présentation du site d'étude
9
II.2 : Méthodes d'échantillonnage de la
population anophélienne 11
II.3 : Etude de la sensibilité des populations
d'An. gambiae s.l. aux insecticides 13
II.4 : Traitement des moustiques au laboratoire
16
II.5 : Analyses des données 18
Chapitre III : Résultats et discussions
20
III.1 : Résultats globaux 20
III.2 : Variations des densités
anophèliennes 22
III.2.1 : Variations de la densité agressive et
du taux d'endophagie 22
III.2.2 : Variations de la densité au repos
23
III.3 : Préférences trophiques
23
III.4 : Taux de parturité 26
III.5 : Indice Circumsporozoïtique : ICS
26
III.6 : Sensibilité des populations d'An.
gambiae s.l. aux insecticides 26
III.7 : Discussion 28
Conclusions et perspectives 29
Références bibliographiques
30
ANNEXES b
Introduction générale
Le paludisme humain est une maladie infectieuse à
transmission vectorielle faisant intervenir trois protagonistes : (i)
l'hôte humain qui est infecté par (ii) un protozoaire parasite du
genre Plasmodium transmis par (iii) un moustique vecteur du genre
Anopheles (Moiroux, 2012). Malgré plus d'un siècle
d'étude, il demeure l'une des maladies parasitaires les plus
répandues à travers le monde. L'aire de distribution actuelle du
paludisme est superposable à celle des pays pauvres. Toutefois, il faut
souligner que ce n'est pas une maladie des pays pauvres mais plutôt un
facteur de pauvreté des pays qui en souffrent à grande
échelle. Les enfants âgés de 0 à 5 ans et les femmes
enceintes constituent les couches les plus vulnérables. En 2010, environ
219 millions de cas de paludisme ont été
répertoriés dans 99 pays et territoires à travers le
monde. Au cours de la même année, on estimait à 660 000 le
nombre de décès dus au paludisme dont 91% survenus dans la
région africaine de l'OMS, et parmi lesquels 86% étaient des
enfants de moins de 5 ans (WHO, 2013).
Selon les dernières estimations de l'OMS, en 2015, 214
millions de cas de paludisme ont causé 438 000 décès, soit
une diminution de la mortalité de 37% à l'échelle mondiale
par rapport à 2000 et de 66% dans la région africaine de l'OMS.
Cette diminution est en partie liée à une augmentation des
interventions de lutte anti-vectorielle. Cette dernière est basée
essentiellement sur l'utilisation des moustiquaires et autres matériaux
imprégnés d'insecticides et la pulvérisation/aspersion
intra-domiciliaire à effet rémanent (PID/AID) (WHO, 2006). En
effet, sur recommandations de l'OMS, 290 millions de moustiquaires
imprégnées ont été délivrées en
Afrique sub-saharienne entre 2008 et 2010, permettant de protéger 580
millions de personnes du paludisme. Et 80 millions de personnes affirment vivre
sous un toit aspergé d'insecticides (IRD, 2012). Les avancées
significatives notées, au cours des 15 dernières années,
ont été couronnées par l'atteinte de la cible 6c des
Objectifs du Millénaire pour le Développement (OMD) qui
était de réduire de 75% l'incidence du paludisme en 2015.
Dans ce contexte, l'OMS a élaboré un nouveau
Plan Stratégique Mondiale de Lutte contre le Paludisme 2016-2030, dont
l'objectif est de réduire la charge palustre à l'échelle
mondiale d'au moins 90% d'ici à 2030 (WHO, 2015).
1
Au Sénégal, à l'instar d'autres pays
d'Afrique, une baisse notable de l'incidence du paludisme, passant de 27 cas
pour 1000 habitants en 2013 à 18,9 cas pour 1000 habitants en 2014, a
été observée. Ce qui s'est traduit par une diminution de
la mortalité de 7,48 % à 3,59 % entre 2013 et 2014. Cette
avancée majeur dans le pays a été obtenue grâce
notamment
à la mise en oeuvre d'une série d'interventions
à efficacité prouvée et recommandées par l'OMS tels
que la prise en charge des cas, la chimio-prévention du paludisme
saisonnier, le traitement préventif intermittent, la couverture
universelle en MILDA et les aspersions intra-domiciliaires, et une meilleure
compréhension de la maladie par les populations (PNLP, 2014). Elle
réaffirme l'ambition du Sénégal à aller vers la
pré-élimination et la réduction de la mortalité
palustre à un niveau proche de zéro. Mais, pour ce faire, la
lutte antipaludique en générale et celle anti-vectorielle en
particulier, doit être plus ciblée en tenant compte des
particularités éco-épidémiologiques de chaque zone.
Cela suppose une meilleure caractérisation des populations vectorielles
pour la mise en place de programmes de lutte intégrée
adéquats et permettre la prise de décisions
éclairées basées sur les données
bioécologiques des vecteurs, incluant la dynamique de leur population
ainsi que leur sensibilité aux insecticides d'usage en santé
publique.
C'est dans ce cadre que ce travail a été
réalisé afin d'étudier la dynamique des populations
d'Anopheles et la transmission du paludisme dans le district de Nioro
(Kaolack, Sénégal) après la campagne d'AID de 2015.
Il a pour objectifs spécifiques :
? D'estimer l'abondance des populations de vecteurs ainsi que
leur agressivité
? De déterminer le comportement de repos des
espèces vectrices
? D'évaluer l'anthropophilie et l'infection à
Plasmodium falciparum des vecteurs
? De déterminer le statut de sensibilité des
vecteurs vis-à-vis de deux familles
d'insecticides à savoir les Carbamates et les
Organophosphorés
2
Chapitre I : Synthèse bibliographique
I.1 : Généralités sur les moustiques
vecteurs du paludisme
Les vecteurs du paludisme humain sont des anophèles
appartenant à la sous famille des Anophelinae
(Diptera, Culicidae), tous regroupés dans le
genre Anopheles. Ce genre est l'un des plus importants en santé
publique et regroupe environ 484 espèces (Harbach, 2004), dont seulement
une soixantaine assure, avec plus ou moins d'efficacité, la transmission
des plasmodies humaines (Carnevale & Robert, 2009). Les autres ne
participent pas à la transmission soit parce qu'ils piquent de
préférence l'animal, soit parce qu'ils sont réfractaires
à toutes ou une des souches de Plasmodium. Il a
été rapporté des différences dans la
capacité des différentes espèces vectrices ou plasmodiales
à transmettre ou à être transmises suivant leur origine
géographique. Selon leur capacité vectorielle et leur aire
géographique, on distingue des vecteurs majeurs ayant une grande
répartition géographique, des vecteurs secondaires et des
vecteurs d'importance locale dont le rôle reste à préciser
(Mouchet et al., 2004).
En Afrique sub-saharienne, les vecteurs majeurs du paludisme
sont Anopheles gambiae s.l et Anopheles funestus. Le premier
est un complexe de huit espèces jumelles : An. arabiensis, An.
gambiae, An. coluzzii, An. quadriannulatus, An. amharicus, An. bwambae, An.
melas et An. merus. Parmi les espèces, An. coluzzii
(ancienne forme moléculaire M), An. gambiae (ancienne
forme moléculaire S), An. arabiensis et An. funestus
sont les vecteurs les plus répandus (Coetzee et al.,
2013), les plus efficaces et les plus anthropophiles (Faye, 1994).
I.1.1 : Biologie des vecteurs
Le cycle biologique des anophèles comprend deux phases
: l'une aquatique et l'autre aérienne (Figure 1).
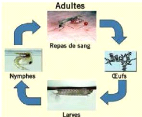
Figure 1: Cycle biologique d'une femelle
d'Anopheles
(Source : Hervy et al, 1998)
3
I.1.1.1 : Les stades
pré-imaginaux
Les femelles d'anophèles pondent
séparément, à la surface de l'eau, 40 à 100 oeufs
non-résistants à la dessiccation, d'environ 0,5 mm de long munis
de flotteurs latéraux qui éclosent 24 à 48 heures selon la
température (Kouadio, 2012). Toutefois, une exception a
été notée chez An. anthropophagus en Chine
centrale chez qui il a été observée une diapause des oeufs
qui, pondus en automne, n'éclosent qu'au printemps.
A l'éclosion, chaque oeuf donne une larve apode de
stade 1, qui après 3 mues successives devient une larve de stade 4. Les
larves d'anophèles au repos se distinguent facilement de celles des
autres genres par leur position parallèle à la surface de l'eau.
Elles ne possèdent pas de siphon respiratoire contrairement au
culicinae et se nourrissent de micro-organismes de surface qu'elles
attirent grâce aux vibrations de leurs brosses buccales. La durée
de vie larvaire dépend de l'espèce, de la disponibilité du
gîte en nourriture et de la température (Kouadio, 2012). Elle dure
en moyenne 7 à 10 jours pour An. gambiae s.l. dans les
conditions optimales de température, s'allonge quand la
température diminue et se raccourcit quand elle augmente (Robert et
Carnevale, 1984).
La mue de la larve de stade 4 ou mue nymphale donne une nymphe
en forme de virgule très mobile. La nymphe ne s'alimente pas, mais
respire l'air atmosphérique grâce aux trompettes respiratoires
situées sur le céphalothorax. Ce stade, d'environ 48 heures de
durée, correspond à la phase pendant laquelle d'importants
remaniements internes s'opèrent permettant sa transformation en adulte
ailé.
I.1.1.2 : Le stade adulte
A l'émergence, l'adulte reste immobile le temps que sa
cuticule sèche, que ses ailes se déploient et que son appareil
reproducteur soit fonctionnel. Les adultes mâles vivent en moyenne 7
à 10 jours, tandis que les femelles peuvent vivre jusqu'à 4
semaines dans les conditions naturelles (Moiroux, 2012). La femelle ne
s'accouple qu'une seule fois dans sa vie, 10 à 24 heures après
l'émergence à proximité des gîtes larvaires et
stocke le sperme dans une spermathèque (Kouadio, 2012 ; Pagès et
al, 2007).
Le mâle se nourrit exclusivement de jus sucrés,
tandis que la femelle s'alimente non seulement de jus sucrés (procurant
l'énergie nécessaire pour le vol), mais aussi de sang
d'hôtes vertébrés nécessaire à la maturation
des oeufs.
4
Après chaque repas sanguin, la femelle se
réfugie dans un abri, appelé gîte de repos afin de
digérer le repas pris et assurer concomitamment la maturation des oeufs.
Une fois les oeufs matures, elle quitte le gîte de repos à la
recherche d'une collection d'eau ou gîte larvaire pour pondre. Ensuite,
elle recherche un nouvel hôte pour d'autres repas de sang : c'est le
cycle gonotrophique qui rythme la vie de la femelle (Pagès et
al, 2007).
Au repos, les anophèles adoptent
généralement une position oblique par rapport au support, les
différenciant facilement des autres Culicinae qui se
positionnent parallèlement par rapport au support. Il existe une
exception chez An. culicifacies qui adopte une position
parallèle au support pouvant le faire confondre avec un Culex
(Carnevale et Robert, 2009).
L'adulte (Figure 2) comporte trois parties bien distinctes : la
tête, le thorax et l'abdomen.
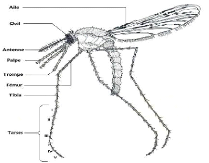
Figure 2: Morphologie d'une femelle d'An. gambiae s.l.
x400 (Source : Amougou zibi, 2010)
I.2 : Ecologie des vecteurs
La colonisation d'un biotope est essentiellement liée
à l'écologie larvaire qui peut être plus ou moins stricte,
inféodée à certains environnements, ubiquiste ou
adapté à une large gamme de milieux (Robert & Carnevale,
2009). Les gîtes d'anophèles sont très diversifiés
et comprennent des collections d'eau calme plus ou moins temporaires, peu
profondes et ensoleillées (certaines espèces du complexe
Gambiae), permanentes ou semi- permanentes avec une
végétation flottante ou dressée (An. funestus,
An. pharoensis), salées ou saumâtres (An. melas,
An. merus), des eaux courantes (An. nili), mares
résiduelles de décrue, collection d'eau des sous-bois etc.
(Guèye, 2015).
5
L'évolution saisonnière de la
végétation permet à certaines espèces de se
succéder dans le temps. C'est ainsi que dans les rizières, par
exemple, les espèces du complexe Gambiae, héliophiles,
pullulent lors de la mise en eau et du repiquage et sont progressivement
remplacées, avec la croissance du riz, par des espèces qui
recherchent l'ombre et l'abri d'une végétation dressée
telles qu'An. pharoensis en Afrique de l'Ouest et An. funestus
à Madagascar par exemple (Mouchet et al, 2004).
I.3 : Distribution des vecteurs au
Sénégal
Environ une vingtaine d'espèces anophèliennes a
été décrite au Sénégal (Diagne et
al, 1994). Parmi elles, les vecteurs du paludisme qui, en fonction de
leur rôle dans la transmission, se répartissent comme suit :
? Vecteurs majeurs : An. gambiae, An. coluzzii, An.
arabiensis et An. funestus ? Vecteurs secondaires : An. nili,
An. melas et An. pharoensis
Généralement, An. coluzzii et An.
gambiae prédominent dans la région du Sud humide alors
qu'An. arabiensis prédomine dans le nord plus sec
(Faye et al., 2011).
Dans la région septentrionale et dans celle des Niayes,
An. funestus, abondant avant 1970, avait disparu du fait des
années de sècheresse entraînant une réduction
drastique du paludisme dans les zones concernées (Mouchet et
al., 1996). Cependant, un retour d'An. funestus a
été récemment rapporté dans le delta du fleuve
Sénégal et serait favorisé par les aménagements
hydro-agricoles pour l'agriculture irriguée le long du fleuve favorisant
la création des conditions propices à sa réimplantation.
Elle a été retrouvée en abondance dans des villages
à proximité des périmètres aménagés
près de Richard-Toll (Konaté et al., 2001) et dans
toutes les zones biogéographiques du Sénégal notamment
dans les localités à proximité de zones
marécageuses ou de cours d'eau (Dia et al., 2003, 2008).
An. pharoensis est présent également
dans toutes les zones biogéographiques mais est prédominant
surtout dans les zones de riziculture de la vallée du fleuve
Sénégal et de Casamance (Faye et al., 1995). La
présence d'An. nili est signalée uniquement
dans la zone du Sénégal oriental et de Casamance (Dia et al.,
2003, 2005). An. melas, du fait de ses affinités avec les
eaux saumâtres, est localisé principalement le long du littoral,
le long des cours d'eau du Sine Saloum (Diop et al., 2002) et de la
basse Casamance.
6
I.4 : Mesures de lutte contre les vecteurs
La lutte anti-vectorielle constitue une composante essentielle
de la stratégie mondiale de lutte contre le paludisme de l'Organisation
Mondiale de la Santé. Elle demeure le moyen le plus efficace pour
prévenir la transmission du paludisme. Elle est basée sur des
mesures visant à réduire le contact homme-vecteur et à
réduire la densité et la longévité des moustiques
au stade infectant. Si ces mesures sont mises en place correctement, la
transmission du parasite est réduite, ainsi que le nombre de cas de
paludisme (Williams et al, 2002).
Actuellement, la lutte contre les vecteurs repose
essentiellement sur deux principales catégories d'interventions
dirigées contre les larves et contre les adultes.
I.4.1 : Lutte contre les larves
La lutte anti-larvaire regroupe l'ensemble des mesures
appliquées au niveau des gîtes et ayant pour but la destruction
des stades pré-imaginaux. Elle fait appel à un certain nombre de
méthodes physiques, chimiques et biologiques.
- Les méthodes physiques entrent dans le cadre de
l'assainissement de l'environnement à grande échelle (travaux de
drainage) ou à l'échelle domestique (hygiène
péri-domestique).
- Les méthodes chimiques, les plus utilisées,
consistent à traiter les gîtes larvaires avec des insecticides
chimiques tels que le Téméphos (Abate®).
- La lutte biologique consiste en l'utilisation de
prédateurs (poissons larvivores) ou de bactéries
entomopathogènes. En santé publique, les seuls succès
enregistrés par l'utilisation de poissons larvivores culiciphages
concernent les zones de paludisme instable, où les gîtes larvaires
sont souvent très limités et faciles d'accès (Alio et
al., 1985 ; Louis et al., 1988). Concernant les
bactéries entomopathogènes, Bacillus thuringiensis (Bti)
avec ses quatre toxines est une alternative intéressante aux larvicides
chimiques (Mittal, 2003).
I.4.2 : Lutte contre les adultes
Les principales méthodes de lutte contre les adultes
qui restent efficaces et utilisées comme prévention primaire
à grande échelle du paludisme sont les moustiquaires
imprégnées d'insecticides à longue durée d'action
(MILDA) et l'aspersion intra-domiciliaire d'insecticide à effet
rémanent (AID). Ensemble, elles représentent près de 60%
de l'investissement mondial dans la lutte contre le paludisme (RBM, 2013).
7
I.4.2.1 : Les moustiquaires
imprégnées d'insecticides
Les moustiquaires (Figure 3) sont utilisées depuis
longtemps pour se protéger des piqûres de moustiques (Snow et
al., 1987). Leur efficacité s'est vue renforcée
lorsqu'elles ont été imprégnées d'insecticides
(Darriet et al., 1984), ajoutant à la barrière physique
un effet répulsif et létal. En effet le contact direct avec la
matière imprégnée entraîne une perturbation du
système nerveux et conduit à une paralysie momentanée du
moustique (Effet Knock-Down ou KD). En fonction de la durée de contact,
de la quantité de matière active présente sur la
moustiquaire et de la sensibilité du moustique, une exposition peut
conduire à la mort de ce dernier (effet létal).
De nombreuses études menées dans des zones
d'endémie palustre ont attribué une réduction
significative du risque de la transmission à la réduction de la
longévité des populations adultes de vecteurs suite à
l'utilisation généralisée de moustiquaires
imprégnées (Brunetaud, 2008). Un effet dissuasif significatif des
MILDA a été démontré sur les anophèles
(Dabire et al., 2006), mettant ainsi en évidence leur
capacité de prévention.
I.4.2.2 : Les Aspersions Intra-Domiciliaires
L'Aspersion Intra Domiciliaire (AID) d'insecticide à
effet rémanent encore appelée Pulvérisation Intra
Domiciliaire (PID) a été la principale méthode de lutte
dans la campagne de l'éradication du paludisme des années 50s et
60s. Elle a contribué à l'élimination du paludisme dans de
nombreuses régions du monde et à sauver des milliers de vies
humaines (
www.spps.sn). Elle reste encore
utilisée en Afrique pour lutter contre les vecteurs endophiles et
anthropophiles comme An. funestus et An. gambiae s.l.
(Pagès et al, 2007).
Le principe de la méthode de lutte repose sur le
comportement des vecteurs qui recherchent après chaque repas de sang,
des endroits tranquilles et sombres pour le repos et la digestion (
www.spps.sn). L'AID consiste en
l'aspersion sur les surfaces intérieures des murs et toits des
habitations et autres structures traitables (magasins, latrines,
étables, etc.,), des insecticides présentant des
propriétés rémanentes et approuvés par l'OMS. Une
fois appliqués, les insecticides, en séchant, laissent une fine
couche de cristaux sur la surface traitée. Le vecteur, au repos sur
celle-ci après un repas sanguin, s'expose alors à une dose
létale de l'insecticide. Il en meurt, s'il est sensible à
l'insecticide utilisé à cet effet. Certains des insecticides
utilisés pour les AID peuvent également avoir un effet
répulsif et réduire ainsi le nombre de vecteurs entrant dans les
pièces traitées (Williams et al, 2002).
8
C'est une intervention très efficace dans la mesure
où elle permet de réduire rapidement la densité et la
longévité des vecteurs adultes et par conséquent
réduire la transmission du paludisme.
Pour la mise en oeuvre de l'AID, certaines conditions doivent
être remplies :
- les populations des vecteurs se reposent en majorité
dans les habitations (endophilie), - les vecteurs sont sensibles à
l'insecticide choisi/utilisé,
- les habitations et autres structures à traiter sont
convenables pour l'application de l'insecticide,
- les communautés concernées acceptent la mesure de
lutte,
- les ressources nécessaires pour la mise en oeuvre sont
disponibles (
www.spps.sn).

a

b
Figure 3 : Les principales interventions de lutte
anti-vectorielle : MILDA (a) et AID (b) (Sources: a- who.int; b- Sy, 2015)
Chapitre II : Matériel et méthodes
II.1 : Présentation du site d'étude
II.1.1 : Données géographiques
La présente étude a été
menée dans le district sanitaire de Nioro du Rip, situé dans la
région de Kaolack. Il couvre une superficie de 2302 km2 et
est limité au nord par le département de Kaolack, au sud par la
république de la Gambie, à l'est par la région de Kaffrine
et à l'ouest par le département de Foundiougne (région de
Fatick).
Le climat est de type soudano-guinéen et l'harmattan
souffle en saison sèche. II.1.2 : Données
socio-économiques
9
C'est une zone à vocation essentiellement agricole. A
côté des cultures de rentes basées sur l'arachide et le
coton, se pratique des cultures vivrières telles que le mil, le
maïs et le sorgho. Au cours des dernières années,
l'installation des cultures de contre-saisons telles que les pastèques
et le maraîchage a été notée.
L'élevage constitue aussi une activité
économique majeure tant par l'importance et la diversité des
espèces animales exploitées, que par le nombre d'individus qu'il
occupe à temps plein ou partiel. La plupart des ménages ruraux du
département ont des troupeaux et élève des petits
ruminants, des bovins, de la volaille, des équins etc.
Par ailleurs, avec les marchés hebdomadaires «
Louma », le commerce informel connaît un véritable essor le
long de l'axe trans-gambien.
II.1.3 : Données démographiques et
administratives
Le département comprend : deux communes (Nioro et Keur
Madiabel), trois arrondissements, treize communautés rurales. Sa
population est évaluée à 356 927 habitants. La
densité est estimée à 155 habitants/km2. Les
ethnies sont principalement constituées par les wolofs (ethnie
dominante), les peulhs, les sérères et les mandingues. La
population est essentiellement rurale, seulement 9 % habitent la commune.
Dans le cadre de notre étude, 3 villages dont 2 ayant
été traités et 1 non traité constituant le
témoin, ont été choisis (figure 4). Il s'agit de Bamba
diakhatou, traité avec l'Actellic 300 CS (Pyrimiphos-méthyl),
Ndramé ndimbe avec le FICAM (Bendiocarb) et Paoskoto (non
traité).
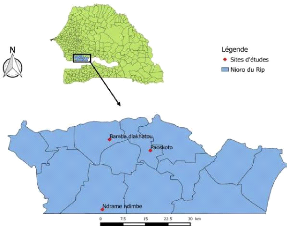
Figure 4 : Carte du département de Nioro du Rip avec les
différents sites d'études
10
Source : Assane yade Ndiaye
II.2 : Méthodes d'échantillonnage de
la population anophélienne II.2.1 : Capture nocturne sur
appât humain
Cette méthode est utilisée pour évaluer
le contact homme-vecteur. Elle permet d'estimer le taux d'agressivité et
aussi de déterminer le rythme de piqûre horaire.
Les captures ont été effectuées dans les
trois villages, durant deux nuits successives sur des volontaires formés
au préalable. Ils servent à la fois d'opérateurs de
capture et d'appât. Les séances de capture se font
simultanément à l'intérieur et à l'extérieur
de 20h à 06h du matin.
Dans chaque village, 12 volontaires et 2 superviseurs ont
été recrutés et formés puis répartis dans 3
points de capture (pièces) distants d'environ 50 à 100m selon la
configuration et la taille du site d'étude. Au niveau de chaque point de
capture, 2 agents ont été installés, l'un à
l'intérieur et l'autre à l'extérieur, afin de capturer la
fraction agressive de moustiques actifs pendant la première tranche de
la nuit (20h à 01h). Ils ont été relayés par 2
autres à partir de 01h pour opérer pendant la deuxième
tranche (01h - 06h). Munis, chacun de lampe torche, de tubes à
hémolyse en verre, de coton cardé et de sacs portant mention du
point, de l'heure et du lieu de capture, ces opérateurs ont
collecté les moustiques ayant atterri sur leur jambe
dénudée avant la piqûre. Pour s'assurer du bon
déroulement des séances de capture, deux superviseurs ont
été chargés de les assister pour le contrôle et le
respect des directives données. Une permutation circulaire du lieu de
capture et des tranches horaires a été établie pour chacun
des opérateurs de capture entre les différents points de collecte
pour réduire les potentiels biais.
Les femelles d'anophèles ainsi collectées, ont
été morphologiquement identifiées et classées par
genre et espèce, et disséquées pour la
détermination de l'âge physiologique selon la méthode de
DETINOVA (1945).
Les femelles disséquées ou non ont
été individuellement placées dans des micro-tubes
contenant un dessiccateur et portant un numéro unique correspondant
à celui du moustique sur la base de données.
II.2.2 : Collecte matinale de la faune
résiduelle dans les habitations
11
La méthode d'échantillonnage consiste à
collecter au matin, après pulvérisation d'insecticide, les
moustiques au repos dans les habitations sélectionnées.
Dans chaque village, les collectes des femelles au repos,
à l'intérieur des habitations, ont été
organisées le matin entre 7h et 9h dans 10 chambres choisies au hasard.
Chaque pièce sélectionnée a été
préparée en bouchant les ouvertures. Ensuite, des draps blancs de
16 m2 ont été étalés sur le plancher et
les surfaces planes du mobilier lourd (Fig. 5A). Une pulvérisation
spatiale de pyréthrinoïdes s'en est suivie.
Après 10 minutes, les draps ont été
soigneusement retirés de la chambre afin de collecter les moustiques
tués ou abattus par l'insecticide à l'aide de pinces souples
(Fig. 5B), puis conservés dans des boites de pétri
numérotées de 1 à 10 dont le fond est garni d'une couche
de coton imbibé d'eau pour éviter la dessiccation (Fig. 5C). Les
informations utiles ainsi qu'un numéro unique correspondant à la
pièce sélectionnée, ont été reportées
sur une fiche de terrain. Les spécimens collectés ont
été morphologiquement identifiés sous loupe,
dénombrés puis regroupés par espèce. Les femelles
des espèces vectrices ont été classées selon leur
état de réplétion en femelles à jeun,
gorgées, semi-gravides et gravides. Ensuite, le sang contenu dans
l'abdomen des femelles gorgées a été recueilli en
écrasant celui-ci sur du papier filtre Whatman (Fig. 5D). Toutes les
femelles de vecteurs traitées ou non ont été
individuellement placées dans micro-tubes numérotés,
contenant du silicagel pour des études de laboratoire.

A B
C D
Figure 5 : Etapes de réalisation d'une faune matinale
résiduelle et traitement des échantillons
A- Etalage des draps avant pulvérisation B- Collecte des
moustiques après pulvérisation
C- Echantillons avant traitement D-Prélèvement des
repas de sang des femelles gorgées
12
Source : Assane yade Ndiaye
II.3 : Etude de la sensibilité des populations
d'An. gambiae s.l. aux insecticides
II.3.1 : Collecte des larves et élevage des
moustiques
L'échantillonnage des larves d'anophèles a
été fait au niveau des gîtes naturels (Fig. 6A et B). Sur
place, ceux positifs ont été
géo-référencés à l'aide d'un GPS. Le
matériel de collecte (Fig. 6C) est constitué de louches, de bacs
en plastique, de filtres à maille et de seaux. La collecte de larves a
été faite par la méthode du « dipping »
(Fig. 6D) qui consiste à prélever l'eau du gîte à
l'aide d'une louche ou d'un bac, puis à y rechercher des larves
d'anophèles. Une fois prélevées, les larves ont
été transférées dans des bacs en plastique, puis
triées par stades (L1, L2, L3 et L4) à l'aide de filtres à
mailles. Les larves de Culicinae et les prédateurs ont
été éliminés des bacs.
Une pipette a été utilisée pour trier les
nymphes, les mettre dans des cristallisoirs puis dans des cages
d'émergence.

A B
C D
Figure 6 : Prospection des gîtes larvaires et collecte des
larves
A et B - Gîtes larvaires ; C et D - Matériel de
prospection et collecte des larves
Source : Assane yade Ndiaye
13
Les larves collectées ont été
acheminées au laboratoire dans des seaux dont les couvercles ont
été régulièrement soulevés pour renouveler
l'air et éviter que les larves ne soient asphyxiées.
Au laboratoire, les larves collectées, nourries avec un
aliment pour alevin, ont été élevées dans des bacs.
L'eau a été régulièrement renouvelée pour
éviter le développement de moisissure. Afin
d'accélérer leur croissance, elles ont été
quotidiennement exposées au soleil et les nymphes formées ont
été régulièrement collectées et
transférées dans les cages d'émergence (figure 7),
convenablement étiquetés portant mention de la date
d'émergence et du lieu de collecte.
Les adultes issus des nymphes ont été
placés dans des cages d'émergence et nourris avec du tampon de
jus sucré à 10%. Les femelles, âgées de 3 à 5
jours ont été sélectionnées pour les tests de
sensibilité aux insecticides selon la méthode de l'OMS.

Figure 7 : Cages d'émergence des adultes
Source : Assane yade Ndiaye
II.3.2 : Test de sensibilité aux
insecticides avec la méthode standard de l'OMS (2013b) Le
principe consiste à exposer des moustiques adultes, dans des cylindres
tapissés de papier traité avec une concentration standard
d'insecticide. Le dispositif est constitué de deux cylindres
tapissés : l'un, de papiers imprégnés d'insecticide
à une dose discriminante et l'autre d'un papier indemne d'insecticide
servant de témoin. Les cylindres sont connectés par une
glissière avec un trou sur lequel se fait le transfert des moustiques
entre deux cylindres.
II.3.2.1 Matériel de test
Outre le matériel biologique constitué de
femelles âgées de 3 à 5 jours, la réalisation du
test a nécessité le Kit OMS (Fig.8), composé de :
- cylindres à pastille verte contenant du papier neutre
(observation),
- cylindres à pastille rouge servant de tubes d'exposition
dont les surfaces
internes sont des papiers imprégnés
d'insecticide,
- glissières ou lames de fermeture,
- des pièces de papier blanc (12 x 5cm),
- des anneaux d'acier pour les tubes d'observation et bronze pour
les tubes
14
d'exposition,
- des aspirateurs à bouche,

- du ruban adhésif,
- des chronomètres
- du coton hydrophile
- d'un crayon et des serpillières.
Figure 8 : Kit OMS
II.3.2.2 Procédure du test
Dans chaque cylindre à pastille verte, 4 à 5 lots
de 20 à 25 moustiques ont été utilisés. Le test a
démarré avec une phase d'observation d'au moins une heure afin
d'éliminer les femelles inaptes.
Source : Assane yade Ndiaye
A la fin de la période d'observation, les
spécimens ont été transférés vers les tubes
d'exposition à pastille rouge pour une période d'exposition d'une
heure pendant laquelle le nombre de moustiques assommés (knock-down) a
été relevé après 10, 15, 20, 25, 30, 40, 50 et 60
minutes.
Après exposition, les femelles ont été
transférées à nouveau des tubes d'exposition vers les
cylindres d'observation. Une lecture de la mortalité immédiate a
été effectuée 20 minutes post-exposition. Ensuite, les
spécimens ont été nourris avec un tampon de jus
sucré à 10% et recouverts de serviettes humides. La
mortalité différée a été
évaluée 24h post-exposition puis consignée dans les fiches
de lecture (Annexe 1).
II.3.2.3 Validation du test et interprétation
des résultats Les critères de validation du test ont
été définis comme suit :
15
- Si la mortalité dans les lots témoins est
inférieure à 5%, le test est directement validé, - Si la
mortalité dans les lots témoins est supérieure à
20%, le test est invalidé et repris,
- Si la mortalité dans les lots témoins est
comprise entre 5% et 20%, une correction est effectuée en appliquant la
formule d'Abbott :
Mortalité corrigée =
100 - mortalité contrôle
(mortalité test - mortalité controle)
Les résultats ont été
interprétés en utilisant les critères définis par
l'OMS (2013) :
|
Mortalité > 98%
|
Population sensible
|
|
Mortalité entre 90 - 97%
|
Résistance suspectée à confirmer par la
recherche de mécanismes de résistance
|
|
Mortalité < 90%
|
Individus de la population présente résistants
|
II.4 : Traitement des moustiques au laboratoire
II.4.1 : Recherche de femelles infectantes
La recherche de femelles infectantes s'est faite par la
méthode de l'Enzyme-Linked Immuno-Sorbent Assay circumsporozoïte
(ELISA CSP) décrite par Burkot et al., (1984),
légèrement modifiée par Wirtz et al., (1987).
Cette méthode d'ELISA indirecte ou en « sandwich » consiste
à coincer l'antigène circumsporozoïte (CS), composante
majoritaire de la surface des sporozoïtes du Plasmodium
falciparum, entre un anticorps monoclonal de capture anti-CS fixé
à la paroi de la plaque et un anticorps monoclonal anti-CS
conjugué à la peroxydase (figure 9A). La présence de
l'antigène est révélée par une coloration des puits
positifs (figure 9B).

A B
Figure 9 : Recherche de femelles infectantes
A) Principe de la méthode ELISA CSP B) Présence de
l'antigène CSP
16
Source : Assane yade Ndiaye
II.4.2 : Détermination de l'origine des
repas de sang
L'origine des repas de sang a été
déterminée avec la méthode de l'ELISA directe
décrite par Beier et al., (1988). Elle consiste à
chercher l'antigène d'hôtes potentiels dans le sang contenu dans
l'abdomen des femelles gorgées, prélevé sur du papier
filtre de Whatman, en le faisant agir avec des anticorps (IgG) d'hôtes
spécifiques (homme, boeuf, mouton, poule et cheval) (Fig. 10A). Ces
anticorps, conjugués à la peroxydase, en réagissant avec
le substrat, permettent de révéler la présence de
l'anticorps par une coloration bleue des puits de la plaque (Fig. 10B).

A B
Figure 10 : Détermination de l'origine des repas de
sang
A) Principe de la méthode ELISA repas de sang ; B)
Identification de l'hôte
Source : Assane yade Ndiaye
II.4.3 : Identification des espèces du complexe
Gambiae
L'ADN génomique des spécimens collectés a
été extrait selon la méthode du CTAB 2% (Annexe 2).
Celle-ci a consisté à broyer les échantillons (moustiques
entiers, pattes/ailes) dans du CTAB. Le broyat obtenu a été
incubé au bain-marie à 56°C, pendant 2 heures. Il s'en est
suivi une série de lyse de la membrane cellulaire, de
précipitation et de purification de l'ADN grâce au chloroforme,
à l'isopropanol et l'éthanol 70°C successivement. L'ADN
ainsi purifié a été élué avec de l'eau ultra
pure puis conserver à -20°C pour la caractérisation
moléculaire des espèces. Cette dernière a
été réalisée selon le protocole de Wilkins et
al., (2006).
Le principe de la PCR (Annexe 3) consiste à
l'amplification qui permet de multiplier la séquence
d'intérêt de l'ADN des milliards de fois. Pour ce faire, un mixte
a été préparé et distribué dans des
micro-tubes dans lesquelles l'ADN extrait a été ajouté. Le
mélange a été porté au thermocycleur pour
amplification suivant un programme prédéfini. Les amplicons
(produits d'amplification) ainsi obtenus ont été
distribués dans du gel d'agarose 2% et colorés
17
avec du biothium. Le marqueur de poids moléculaire a
été placé aux deux extrémités des puits du
gel.
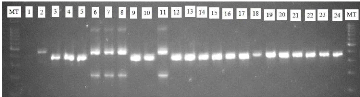
Figure 11 : Interprétation des bandes pour
l'identification du complexe Gambiae
MT= Marqueur de taille (100pb) ; 1= témoin négatif
; 2= témoin positif ; 3, 4, 5, 9,10, 12- 24= An. arabiensis ;
6, 7, 8 et 11= An. gambiae
Source : Assane yade Ndiaye
La migration électrophorétique (Annexe 4) a
été effectuée dans une cuve contenant du TBE 1X. Les
bandes des séquences d'intérêt ont été
soumises à un courant de tension 80V et d'intensité 400mA. Elles
migrent à une vitesse proportionnelle à l'inverse de leur taille.
Après 90 à 180 mn de migration, le gel a été
retiré et les bandes ont été révélées
sous rayons UV au GeldocTM. L'interprétation des bandes pour
la détermination de l'espèce s'est faite en fonction du marqueur
de poids moléculaire (Fig. 11).
II.5 : Analyses des données
Toutes les références des moustiques ainsi que
les résultats des différentes analyses ont été
saisies dans une base de données Excel.
Les densités agressives ont été
calculées en faisant le rapport du nombre de femelles capturées
sur homme par le nombre d'homme-nuit. Le taux d'endophagie a été
estimé en faisant le rapport du nombre de femelles capturées
à l'intérieur des habitations par le nombre total.
Les densités au repos ont été
déterminées en prenant le nombre moyen de femelles
collectées au repos dans les habitations sur le nombre total de chambres
pulvérisées. Le taux d'anthropophilie a été obtenu
par le rapport du nombre moyen de femelles gorgées sur homme sur le
total de repas de sang identifiés. L'indice sporozoïtique a
été enregistré en faisant le rapport du nombre de femelles
infectées au P. falciparum à l'ELISA CSP sur le total
testé.
18
Le taux de parturité a été estimé
en prenant le nombre de femelles pares sur le nombre total de femelles
disséquées.

19
Les tests statistiques ont été
réalisés avec le logiciel R version 3.2.3.
Chapitre III : Résultats et discussions
III.1 : Résultats globaux
Le tableau 1 présente la composition spécifique
et l'abondance des différentes espèces anophèliennes
collectées dans les 3 villages suivis (dont 2 villages AID et 1
témoin non traité) selon la méthode
d'échantillonnage.
Au total, 754 spécimens de moustiques ont
été colletés au cours des 3 passages effectués
entre août et octobre 2015 dans les sites d'étude du district de
Nioro. La proportion de femelles agressives a été de 29%
(217/754) pour un total de 60 hommes-nuits dans les zones traitées et 48
hommes-nuits dans la zone non traitée. A l'intérieur des
habitations, la fraction de femelles au repos a été de 71,2%
(537/754). Au cours de l'étude, 5 espèces anophéliennes
ont été rencontrées dans les 3 sites. Il s'agit d'An.
gambiae s.l., An. funestus, An. pharoensis, An.
ziemanni et An. squamosus.
An. gambiae s.l. a été l'espèce
la plus abondante aussi bien en capture sur appât humain (55,3%) que dans
la faune résiduelle des habitations (78,4%) dans l'ensemble des 3
villages d'étude. Il est suivi d'An. funestus avec 39,2% et
21,6% respectivement des captures sur homme et de faune résiduelle. Les
autres espèces n'ont été présentes qu'en capture
sur homme à des proportions relativement faibles.
En fonction du statut des zones (traité ou non), les
spécimens d'An. gambiae s.l. et An. funestus ont
été plus abondants dans la zone non traitée
comparée aux zones traitées, et ceci quelle que soit la
méthode de collecte.
Dans la suite des analyses, nous ne considérerons que ces
deux espèces.
20
Tableau 1 : Abondance des espèces anophèliennes
selon la méthode de collecte dans les différentes zones
|
|
|
Méthodes de collecte
|
|
|
|
|
|
|
Capture sur homme
|
|
|
Récolte de la Faune résiduelle
matinale
|
|
Statut des zones
|
Nombre
d'hommes-
nuit
|
An.
funestus
|
An. An. An.
gambiae s.l. pharoensis ziemanni
|
An.
squamosus
|
Total
|
Nombre de
cases /
pièces
|
An.
funestus
|
An.
gambiae s.l.
|
Total
|
|
Traitées
Non traitée
|
60
48
|
41
44
|
47 0 8
73 1 0
|
3
0
|
99
118
|
50
40
|
30
86
|
52
369
|
82
455
|
|
Total
|
108
|
85
|
120 1 8
|
3
|
217
|
90
|
116
|
421
|
537
|
21
III.2 : Variations des densités
anophèliennes
III.2.1 : Variations de la densité agressive et
du taux d'endophagie
Le tableau 2 rapporte les résultats des densités
agressives des espèces en fonction du statut des villages.
L'agressivité des femelles d'An. gambiae s.l. et d'An.
funestus a connu des variations entre les zones traitées et celle
non traitée.
Avec respectivement 2,04 Piqûre par Homme et par Nuit
(PHN) et 1 PHN, An. gambiae s.l. a été plus agressive
aussi bien à l'intérieur des habitations qu'à
l'extérieur dans le village non traité comparé à
ceux traités où l'agressivité a été
estimée à 0,87 et 0,70 PHN, respectivement à
l'intérieur et à l'extérieur.
Pour An. funestus, la même tendance a
été observée avec des densités agressives plus
faibles dans les villages, comparé à An. gambiae s.l.
Toutefois, il est important de noter que dans tous les villages suivis, An.
funestus a été plus exophage comparé à An.
gambiae s.l.
Tableau 2 : Agressivité des populations d'An.
funestus et d'An. gambiae s.l. à l'intérieur et
à l'extérieur dans les zones traitées et témoins
Capture sur homme
|
An. funestus
|
An. gambiae s.l.
|
|
Statut des zones
|
Extérieur
|
Intérieur
|
Extérieur
|
Intérieur
|
|
Zones traitées Zone non traitée
|
0,93
1,04
|
0,43
0,79
|
0,70
1,00
|
0,87
2,04
|
Les taux d'endophagie (figure 12) ont été
significativement plus élevés (p = 0,03) pour An. gambiae
s.l. dans le village témoin (41,53%) que dans ceux traités
(26,26%). Par contre, pour An. funestus aucune différence
significative n'a été observée (p = 0,67).
22
100,00
Pourcentage
75,00
50,00
25,00
T NT
0,00
An. funestus An. gambiae s.l
Statut
Figure 12 : Taux d'endophagie (en %) en fonction du statut des
villages
III.2.2 : Variations de la densité au repos
Le tableau 3 présente les densités au repos
à l'intérieur des habitations selon le statut de la zone. Les
résultats montrent que les populations d'An. gambiae s.l. ont
été 9 fois plus importantes dans la zone témoin
comparé à la zone AID. La même tendance a été
observée pour An. funestus dont les densités au repos
ont toutefois été moindre comparé à An. gambiae
s.l.
Tableau 3 : Variations de la densité au repos selon le
statut de la zone
Faune matinale résiduelle
Statut de la zone An. funestus An. gambiae s.l.
Traitées 0,60 1,04
Non traitée 2,15 9,23
III.3 : Préférences
trophiques
23
L'origine des repas sang a été
déterminée sur 62 femelles gorgées (19 An. funestus
et 43 An. gambiae s.l.), collectées au repos dans les
habitations au niveau des 3 villages. La typologie des repas montre que, de
manière globale, 38 étaient des repas mono spécifique, 23
des repas
mixtes pris sur deux hôtes différents et 1 seul
repas triple pris sur homme, boeuf et cheval. Ainsi, 87 repas ont
été identifiés.
Quelle que soit la zone d'étude
considérée, les populations d'An. gambiae s.l., et
d'An. funestus ont montré un profil plus zoophile
qu'anthropophile (figure 13). En effet, dans la zone témoin An.
gambiae s.l. s'est principalement gorgé sur cheval (65,96%), tandis
que dans celles traitées, des proportions égales de repas pris
sur cheval et boeuf (41,67%) ont été notées. Dans ces
dernières, le pourcentage de repas pris sur homme a été
faible (16,67%). Le scénario contraire est noté dans la zone
témoin où le second hôte préférentiel
était l'Homme (25,53%). Les repas sur bovins n'ont compté que
pour environ 8% du total identifié (figure 13).
En ce qui concerne An. funestus, des proportions
comparables sur l'anthropophilie ont été notées aussi bien
dans les zones traitées que dans celle témoin. Cependant, il est
important de noter que le spectre d'hôtes est élargi aux ovins
(figure 13). Dans les villages traités, les femelles de cette
espèce se sont gorgées dans les mêmes proportions (~33%)
sur homme, boeuf et cheval. Le taux d'anthrophilie a été de
26,43% pour l'ensemble des 3 villages.
De manière spécifique, les villages traités
ont présenté un taux d'anthropophilie faible de 22,2%,
comparé à celui du village non traité (27,5%). Cette
différence n'est cependant pas significative (p-value=0,87).
24
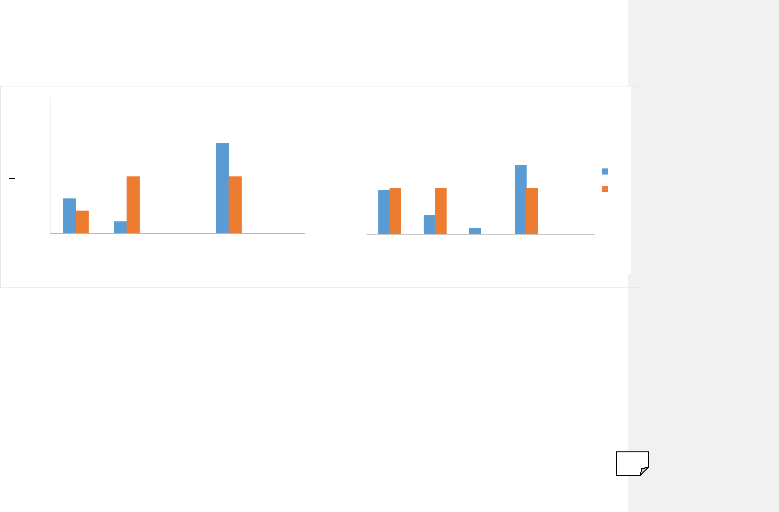
Figure 13 : Spectres d'hôtes des populations d'An.
gambiae s.l. et d'An. funestus en fonction du statut de
traitement des zones d'étude
25
An. funestus
homme boeuf mouton cheval poule
Hôtes
NT T
homme boeuf mouton cheval poule
Hôtes
100
An. gambiae s.l.
Proportion (%)
75
50
25
0
III.4 : Taux de parturité
Au total 113 femelles à jeun capturées sur
appât humain ont été disséquées pour la
détermination de l'âge physiologique. Les résultats sont
présentés dans le tableau 4. L'analyse montre que la proportion
de femelles pares pour An. gambiae s.l. et An. funestus varie
entre zones traitées (55% et 66,67% respectivement) et zone
témoin (52,27% et 35,71% respectivement). Cependant, les
différences observées entre les zones n'ont pas été
significatives. Il en est de même pour la parturité entre les
populations d'An. gambiae s.l. et d'An. funestus.
Tableau 4 : Taux de parturité selon les zones
|
An. gambiae s.l.
|
An. funestus
|
|
|
Statut
|
Total disséqué
|
Parturité (n)
|
Total disséqué
|
Parturité (n)
|
P
|
|
Zones traitées
|
20
|
55,00% (11)
|
21
|
66,67% (14)
|
0,65
|
|
Zone non traitée
|
44
|
52,27% (23)
|
28
|
35,71% (10)
|
0,25
|
p 0,94 0,06
(n) = effectif testé ; p = Valeur de p
III.5 : Indice Circumsporozoïtique :
ICS
Au total, 120 femelles dont 99 dans les deux villages
traités et 21 dans celui non traité (témoin) ont
été testées pour la recherche d'infection à
Plasmodium falciparum par la méthode d'ELISA CSP. Aucune
infection à Plasmodium falciparum n'a été
détectée.
III.6 : Sensibilité des populations d'An.
gambiae s.l. aux insecticides
Parallèlement à l'étude de dynamique des
populations de vecteurs, celle de sensibilité des populations d'An.
gambiae s.l. vis-à-vis des Carbamates (Bendiocarb) et des
Organophosphorés (Pyrimiphos-méthyl, Malathion et
Fénitrothion) a été également évaluée
dans le district de Nioro.
Au total, 443 spécimens ont été
exposés aux 4 molécules d'insecticides appartenant à deux
familles susmentionnées. Les résultats, enregistrés dans
le tableau 5, montrent que les populations d'An. gambiae s.l. ont
été totalement sensibles aux Organophosphorés et aux
Carbamates.
26
L'identification spécifique d'un
sous-échantillon de la population testée, par PCR, a
révélé la présence d'An. arabiensis
(67,6%) et d'An. gambiae (32,84%).
Tableau 5 : Sensibilité d'An. gambiae s.l. aux
Carbamates et aux Organophosphorés dans le district de Nioro
Carbamates Organophosphorés
Bendiocarb Pyrimiphos-méthyl Malathion
Fénitrothion
|
100***
|
100***
|
100***
|
100***
|
|
(114)
|
(109)
|
(116)
|
(104)
|
() = effectifs testés ; *** = Susceptible
27

III.7 : Discussion
Au cours de cette étude, 5 des 20 espèces
déjà décrites au Sénégal (Diagne et
al., 1994) ont été collectées. Il s'agit d'An.
gambiae s.l., An. funestus, An. pharoensis, An.
ziemanni et An. squamosus. Parmi celles-ci, An. gambiae
s.l., et An. funestus, ont été les plus abondantes
quelle que soit la méthode de collecte ou la zone
considérée.
Pour An. gambiae s.l, sa prédominance pourrait
s'expliquer par la présence de ses gîtes
préférentiels, constitués par des collections d'eau
temporaires peu profondes et ensoleillées liées aux pluies
(Gillies et De Meillon, 1968). Quant à An. funestus,
l'abondance notée dans les différents villages suivis,
principalement à Ndramé ndimbe, pourrait être liée
à la présence de cours d'eau permanents à
végétation dressée, favorable au développement de
ses larves. Cette même observation a été rapportée
par Gueye (1969) au cours de ses travaux dans le bassin du Saloum.
Le comportement exophage, moins endophile et zoophile
observé au cours de cette étude chez les populations d'An.
funestus dans les villages traités, pourrait trouver son
explication par l'effet des aspersions intra-domiciliaires, combiné
à l'utilisation des moustiquaires imprégnées
d'insecticides, rendant difficile l'accès à l'homme. En effet,
l'utilisation des insecticides à effet rémanent conduit à
suspecter une hétérogénéité au sein des
populations d'An. funestus. D'autant plus que des études
réalisées au Burkina Faso mettaient en évidence
l'existence de deux unités taxonomiques à capacité
vectorielle et à indice d'anthropophilie différents (Boccolini et
al., 1994); alors qu'à Madagascar des études simi1aires
soulignaient des variations liées à l'anthropophilie (Boccolini
et al., 1992). Au Mali et au Burkina Faso des observations comparables
faisaient état d'un important polymorphisme (Boccolini et al.,
1998). D'autre part, la cohabitation des populations humaines avec les animaux
domestiques pourrait offrir une large gamme d'hôtes alternatifs,
d'où la déviation trophique notée à travers les
repas pris fréquemment sur cheval, boeuf et dans une moindre mesure sur
mouton.
Commentaire [EN1]:
A l'image d'An. funestus, le même comportement
a été également observée chez les populations
d'An. gambiae s.l. Ceci pourrait laisser penser que les espèces
du complexe sont en majorité représentées par An.
arabiensis, dont le comportement exophage, moins endophile et zoophile est
bien connu (Gillies et De Meillon, 1968 ; Niang et al., 2016). Ceci
lui permet de se soustraire aux interventions de LAV et a pour
conséquence un changement de la composition spécifique de la
population d'An. gambiae s.l. comme suggéré dans
d'autres contrées (Derua et al., 2012 ; Kitau et al.,
2012).

Au cours de cette étude, aucune infection à
Plasmodium falciparum n'a été détectée sur
les spécimens testés dans les différents sites. Ceci
pourrait être mis en relation avec les comportements de piqûre et
de repos. En effet, le faible contact homme-vecteur ne permettrait pas aux
espèces de s'infecter.
Commentaire [EN2]:
Nos travaux ont rapporté des taux de parturité
faibles à modérés et similaires entre les deux
espèces vectrices retrouvées dans les deux zones. Pour les deux
taxa, ces taux pourraient être expliqués par l'AID, dont
l'objectif premier est de réduire la longévité des
populations vectrices (Najera et Zaim, 2002).
L'étude a également révélé
une sensibilité totale des populations d'An. gambiae s.l aux
Carbamates et aux Organophosphorés, à l'instar d'autres zones du
pays (Faye et al., 2011). Toutefois, une étude récente
dans le Sénégal Oriental a confirmé la résistance
des populations d'An. gambiae s.l. au Fénitrothion (Niang
et al., 2016).
Conclusions et perspectives
Cette étude menée dans le district de Nioro est
d'une importance capitale dans la mesure où elle a permis de mettre
à jour les données entomologiques dans la zone. Les
différents paramètres entomologiques ont montré, dans
l'ensemble, que les aspersions intra-domiciliaires ont eu un impact positif
dans la réduction du contact homme-vecteur et du risque de transmission
du paludisme. En outre, la bonne sensibilité des populations de vecteurs
aux Carbamates et Organophosphorés offre une alternative durable pour le
contrôle des souches résistantes aux Pyréthrinoïdes et
la pérennisation des programmes d'AID.
En guise de perspectives, il serait intéressant de :
- mieux caractériser les populations d'An. funestus
pour vérifier les espèces représentées dans la
zone de Ndramé ndimbe ;
- faire l'identification spécifique des espèces
du complexe Gambiae pour s'assurer de la présence en
majorité d'An. arabiensis ;
- assurer un suivi régulier de la sensibilité
des populations de vecteurs face aux Carbamates et Organophosphorés dans
le cadre d'une gestion globale de la résistance aux insecticides ; et
enfin
- rechercher les éventuels mécanismes de
résistance aussi bien métaboliques que mutationnels en
particulier l'Acétylcholinestérase (Ace1R).

Références bibliographiques
1. Actualité scientifique de l'IRD n°43
(Septembre, 2012). Paludisme : des moustiques vecteurs en perpétuelle
adaptation. 1-2
2. Alio, I., Delfini, M., 1985. Field trial on the impact of
Oreichromis spiluris on malaria transmission in Somalia. WHO/MAL/85 10
13: 18 p.
3. Amougou zibi, S.E., 2010. Etude qualitative de la faune
culicidienne de l'étang du quartier mairie (Zoetele-Cameroun) [En
ligne]. Mémoire de DEA de Biologie animale option : zoologie approfondie
et appliquée spécialité : Entomologie médicale.
Université de Yaoundé I. 69p disponible sur :
http://www.memoireonline.com/06/11/4584/Etude-qualitative-de-la-faune-culicidienne-de-letang-du-quartier-mairie-Zoetele-Cameroun.html
(page consulté le 26/10/2015 à 9h 19 mn)
4. Beier, J., Perkins, P., Wirtz, R., Koros, J., Diggs, D.,
Gargan, T., Koech, DK., 1988a. Bloodmeal identification by direct Enzyme Linked
ImmunoSorbent Assay (ELISA), tested on Anopheles (Diptera: Culicidae) in Kenya.
J Med Ent. 25:9-16.
5. Boccolini, D., Rakotoson, R., Ralisoa, O., Sabatini, A.,
Randrianarisoa, E., Coluzzi, M., 1992 Polimorfismo cromosomico di
Anopheles funestus in Madagascar. Parassitologia, 34,
(Supplement 1), 14-15.
6. Boccolini, D., Sabatini, A., Sanogo, E., Sagnon,
N., Coluzzi, M., Costantini C., 1994. Chromosomal and vectorial heterogeneities
in Anopheles funestus in Burkina Faso, West Africa.
Parassitologia, 36, (Supplement 1), 20.
7. Boccolini, D., Sagnon, N., Toure, Y.T., 1998. Chromosomal
polymorphism in Anopheles funestus and description of new inversions
in Burkina Faso and Mali. Parassitologia, 40, (Supplement 1), 14.
8. Brunetaud., 2008. Comment lutter contre les moustiques ?
Pathologies et prévention. Bull. Soc.3; 3-12
9. Burkot, T.R., Williams, J.L., Schneider, I., 1984.
Identification of Plasmodium falciparum infected mosquitos by a double antibody
Enzyme-Linked Immunosorbent Assay. Am. J. Trop. Med. Hyg. 33: 783-788.
10. Carnevale, P., Robert, V., 2009. Les anophèles :
biologie, transmission du paludisme et lutte anti-vectorielle. IRD Editions.
Collection Actiques. Marseille. 402p
11. Coetzee, M., Hunt, RH., Wilkerson, R., Della Torre, A.,
Coulibaly, MB., Besansky, NJ., 2013. Anopheles coluzzii and Anopheles
amharicus, new members of the Anopheles gambiaecomplex. Zootaxa. 2013;
3619:246-274.
12. Dabire, R K., Diabaté, A., Baldet, T.,
Paré-Toé, L., Guiguemdé, R T., Ouédraogo, J B.,
Skovmand, O., 2006. Personal protection of long lasting insecticide-treated
nets in areas of Anopheles gambiae s.s. resistance to pyrethroids.
Malaria Journal 2006, 5:12
doi:10.1186/1475-2875-5-12.
13. Darriet, F., Tho vien, N., Robert, V., Carnevale, P.,
1984. Evaluation of the efficacy of permethrin impregnated intact and
perforated mosquito nets against vectors of malaria. WHO. 20p
14.

Derua, Y.A., Alifrangis, M., Hosea, K.M., Meyrowitsch, D.W.,
Magesa, S.M., Pedersen, E.M., & Simonsen, P.E., 2012. Change in composition
of the Anopheles gambiae complex and its possible implications for the
transmission of malaria and lymphatic filariasis in north-eastern Tanzania.
Malar J 11: 188.
15. Detinova, T.S., 1945. Detennination of the physiological
age of female Anopheles from the changes of the tracheal system of the
ovaries. Med. Parasito. i Parazitarn. Bolezni, 14,
45-49.
16. Dia, I., Diallo, D., Duchemin, J.B., Ba, Y ; Konate, L.,
Costantini, C. & Diallo, M., 2005. Comparisons of human-landing catches and
odor-baited entry traps for sampling malaria vectors in Sénégal.
J. Med. Entomol. 42 (2), 104-109.
17. Dia, I., Diop, T., Rakotoarivony, I., Kengne, P., &
Fontenille, D., 2003. Bionomics of Anopheles gambiae Giles, An.
arabiensis Patton, An. funestus Giles and An. nili
(Theobald) and transmission of Plasmodium falciparum in a
Sudano-Guinean zone (Ngari, Sénégal). J. Med. Entomol. 40(3):
279-283.
18. Dia, I., Konate, L., Samb, B., Sarr, J.B., Diop, A.,
Rogerie, F., Faye, M., Riveau, G., Remoue, F., Diallo, M. & Fontenille, D.,
2008. Prevalence of malaria vectors and relationship with malaria transmission
and epidemiology in three physiographic zones in the Senegal River Basin. Acta
Tropica 105: 145-153.
19. Diagne, N.A., Fontenille, D., Konate, L., Faye, O.,
Traoré-Lamizana, M., Molez, J.F. et Trape, J.F., 1994. Les
anophèles du Sénégal. Liste commentée et
illustrée. Bull. Soc. Path. Ex. 87: 1-9.
20. Diop, A., Molez, J.F., Konate, L., Fontenille, D., Gaye,
O., Diouf, M., Diagne, M., & Faye, O., 2002. Rôle d'Anopheles
melas Theobald (1903) dans la transmission du paludisme dans la mangrove
du Saloum (Sénégal). Parasite 9: 239-246.
21. Faye, O., 1994. Le paludisme au Sénégal.
Ecologie de la parasitose et perspectives de lutte. Thèse de doctorat
ès Sciences Naturelles de l'Université Cheikh Anta DIOP. 294p
22. Faye, O., Fontenille, D., Gaye, O., Sy, N., Molez, J.F.,
Konate, L., Hebrard, G., Herve, J.P., Trouillet, J., Diallo, S., Mouchet, J.,
1995. Paludisme et riziculture dans le Delta du fleuve
Sénégal. Ann. Soc. Belge Med. Trop. 75, 179-189.
23. Faye, O., Konaté, L., et Diop, A., 2011. Profil
entomologique du paludisme au Sénégal. PNLP. 47p.
24. Gillies, M. T., & de Meillon, B., 1968. The
Anophelinae of Africa South of the Sahara (Ethopian Zoogeographical
Region). Johannesburg: Publ. S. Afr. Inst. Med. Res.; p. 344.
25. Gueye, I., 1969. Quelques aspects de
l'épidémiologie du paludisme au Sénégal.
Thèse de doctorat de Médecine de l'Université de Dakar,
n°11, 175 pages.
26. Guèye, M., 2015. Biologie des vecteurs et
transmission du paludisme dans des sites sentinelles du Programme National de
Lutte contre le Paludisme (PNLP) après introduction de mesures de
contrôle anti-vectoriel au Sénégal. Mémoire de
Master 2 en biologie animale (spécialité entomologie).
Université Cheikh Anta Diop de Dakar. N°233.37p
27. Harbach, R.E., 2004. The classification of genus
Anopheles (Diptera: Culicidae): a working hypothesis of phylogenetic
relationships. Bull. Ent. Res., 94 : 537-553.
28.

Hervy, J. P., Le Goff, G., Geoffroy, B., Hervé, J. P.,
Manga, L., Brunhes, J., 1998. Les anophèles de la région
afro-tropicale : logiciel d'identification et d'enseignement. ORSTOM, Paris.
29. Kitau, J., Oxborough, R.M., Tungu, P.K., Matowo, J.,
Malima, R.C., Magesa, S.M., Bruce, J., Mosha, F.W., & Rowland, M.W., 2012.
Species shifts in the Anopheles gambiae complex: do LLINs successfully
control Anopheles arabiensis? PLoS One 7(3):
e31481.
30. Konaté, L., Diop, A., Sy, N., Faye, N.M., Deng,
Y., Izri, A., Faye, O., Mouchet, J., 2001.Comeback of Anopheles funestus
in Sahelian Sénégal. Lancet, 358 : 336
31. Kouadio, L., 2012. Aspects parasito-cliniques de
l'épidémiologie du paludisme dans les districts sanitaires
d'Adzopé et de Grand-Bassam en Côte d'Ivoire avant et après
distribution de moustiquaires imprégnées [En
ligne].Mémoire de DEA d'entomologie médicale et
vétérinaire. Université Alassane Ouattara de
Bouaké.72p disponible sur :
http://www.memoireonline.com/12/12/6634/Aspects-parasito-cliniques-de-l-epidemiologie-du-paludisme-dans-les-districts-sanitaires-d-Adzope.html
(page consulté le 13/10/2015 à 11h 34 mn)
32. Louis, J., Albert, J., 1988. Le paludisme en
République de Djibouti; stratégie de contrôle par la lutte
anti-larvaire biologique par des poissons autochtones (Aphaenurus dispar) et
toxines bactériennes. Med Trop; 48:127-31.
33. Mittal, P. K., 2003. Biolarvicides in vector control:
challenges and prospects. J Vector Borne Dis;40:20-32.
34. Moiroux, N., 2012. Modélisation du risque
d'exposition aux moustiques vecteurs de Plasmodium spp dans un
contexte de lutte anti-vectorielle. Thèse de docotorat Université
Montpellier 2. 251p
35. Mouchet, J., Carnevale, P., Coosemans, M., Julvez, J.,
Manguin, S., Richard-Lenoble, D., et al., 2004. Biodiversité du
paludisme dans le monde. Paris: John Libbey
Eurotext, 428 p.
36. Mouchet, J., Faye, O., Julvez, J., Manguin, S., 1996.
Drought and malaria retreat in the Sahel, West Africa. The Lancet,
348: 1735- 1736.
37. Najera et Zaim., 2002. Lutte contre les vecteurs du
paludisme : Critères et procédures de prise de décisions
pour une utilisation raisonnée des insecticides. WHO/CDS/WHOPES/2002.5
Rev.1
38. Niang, E.A., Konaté, L., Diallo, M., Faye, O.,
& Dia, I., 2016. Patterns of insecticide resistance and knock down
resistance (kdr) in malaria vectors An. arabiensis, An. coluzzii
and An. gambiae from sympatric areas in Senegal. Parasite &
vectors; 9:71
39. OMS. 2013b. Malaria entomology and vector control: guide
for participants
40. Pagès, F., Orlandi-Pradines, E., Corbel, V., 2007.
Vecteurs du paludisme : biologie, diversité, contrôle et
protection individuelle. Médecine et maladies infectieuses 37 :
153-161
41. PNLP., 2014. Bulletin épidémiologique
annuel du paludisme au Sénégal. Ministère de la
santé et de l'action sociale, 24p
42. Robert, V., et Carnevale, P., 1984. Les vecteurs du
paludisme en Afrique sub-saharienne. Etudes médicales.2:79-90
43.

Roll Back Malaria (RBM) Partnership. Global Malaria Action
Plan (GMAP). Geneva, 2008. (
http://www.rbm.who.int/gmap/index.html,
accessed 3 January 2013).
44. Snow, R.W., Bradley, A. K., Hayes, R., Byass, P.,
Greenwood, B. M., 1987. Does woodsmoke protect against malaria? Ann Trop Med
Parasitol 81: 449-51
45. Sy, O., Cisse, B., Tairou, F., Diallo, A., Ba, E., Gomis,
J. F., Ndiaye, J.L., Konaté, L., Gaye, O., Milligan, P., Faye, O., 2015.
Etude de l'acceptabilité de l'aspersion intradomiciliaire d'insecticide
à effet rémanent dans le centre-ouest du Sénégal.
Société de pathologie exotique et Lavoisier SAS 2015.
46. WHO. Pesticides and their application for the control of
vectors and pests of public health importance, 6th ed. Geneva, World Health
Organization, 2006.
47. WHO. 2013. World malaria report.
48. WHO. 2015. World malaria report.
49. Wilkins, E.E., Howell, P.I., Benedict, M.Q., 2006. IMP
PCR primers detect single nucleotide polymorphisms for Anopheles gambiae
species identification, Mopti and Savanna rDNA types, and resistance to
dieldrin in Anopheles arabiensis. Malaria Journal. 5:125.
50. Williams, J., Pinto, J., 2002. Manuel de Formation
à l'Entomologie du Paludisme à l' intention des techniciens en
entomologie et lutte anti-vectorielle (Niveau de base). RTI international.
86p
51. Wirtz, R.A., Zavala, F., Charoenvit, Y., Campbell, G.H.,
Burkot, T.R., Schneider, I., Esser, K.M., Beaudoin, R.L., Andre, R.G., 1987.
Comparative testing of monoclonal antibodies against Plasmodium falciparum
sporozoïtes for ELISA development. Bull. WHO 65: 39-45.
Webographie :
1.
http://www.rollbackmalaria.org/fr/a-propos/a-propos-du-paludisme/donnees-cles,
consulté le 20/10/2015 à 12h 28 mn
2.
http://www.who.int/malaria/areas/vector_control/insecticidal_net_malaria.jpg,
consulté le 26/10/2015 à 10h 49 mn

ANNEXES
Annexe 1
UNIVERSITE CHEIKH ANTA DIOP

Faculté des Sciences et Techniques
Département de Biologie Animale
Laboratoire Écologie Vectorielle et Parasitaire
(LEVP)
FICHE DE LECTURE DES TESTS DE SENSIBILITE DES
MOUSTIQUES ADULTES
Enquêteur.
Nom & adresse de l'Institut .
Pays . Région . District . Localité/Village .
Espèces testées. Age (jours) . Etat physiologique
.
Insecticide testé : Concentration .
Date d'imprégnation . Date d'expiration .
Date de sortie du papier de l'emballage . Nombre d'utilisations
antérieures .
Date du test. Temps d'exposition (minutes)
Conditions du test
|
Température
de à
|
Humidité Relative
de à
|
|
Période d'exposition
|
|
|
|
|
|
Période d'observation
|
|
|
|
|
Résultats du Test
|
Lot 1
|
Lot 2
|
Lot 3
|
Lot 4
|
Total des
moustiques
testés
|
Nombre de moustiques du lot témoin
|
|
Nombre de moustiques testés
|
|
|
|
|
|
|
|
Nombre de moustiques abattus (KD) après une exposition
de : *:
|
|
|
|
|
|
|
|
10'
|
|
|
|
|
|
|
|
15'
|
|
|
|
|
|
|
|
20'
|
|
|
|
|
|
|
|
30'
|
|
|
|
|
|
|
|
40'
|
|
|
|
|
|
|
|
50'
|
|
|
|
|
|
|
|
60'
|
|
|
|
|
|
|
|
80'
|
|
|
|
|
|
|
|
Nombre de moustiques morts à la fin de la période
d'observation
|
|
|
|
|
|
|
|
Mortalité observée (%)
|
|
|
|
|
|
|
b
Mortalité corrigée (%)
Espèce des survivants **
Mécanisme(s) de résistance **
C
* pour le DDT et les pyréthrinoïdes seulement **=
là où c'est possible
Annexe 2
UNIVERSITE CHEIKH ANTA DIOP

Faculté des Sciences et Techniques
Département de Biologie Animale
Laboratoire Écologie Vectorielle et Parasitaire
(LEVP)
Protocole d'extraction d'ADN au CTAB 2%, à partir
de moustiques (sans protéinase K)
1. Objectifs
- Standardiser la méthode
- Avoir des ADN de qualité pour une bonne PCR.
2. Champ d'application UMR 198 URMITE,
pôle MIE
3. Mode opératoire
- Broyer chaque échantillon (moustique entier ou pattes ou
ailes, etc.) dans 200ul de CTAB à 2%,
- Mettre au Bain-Marie 56°c pour une durée d'une
à 24 heures
- Ajouter 200ul de chloroforme
- Mélanger par inversion,
- Centrifuger 5 minutes à 12000trs/mn,
- Prélever la phase supérieure et la mettre dans un
autre tube,
- Ajouter 200ul d'isopropanol dans le surnageant
- Bien mélanger par inversion,
- Centrifuger 15 minutes à 12000trs/mn,
- Vider l'isopropanol, bien égoutter et ajouter 200ul
d'éthanol 70%,
- Centrifuger à 5 minutes à 12000trs/mn,
- Vider l'éthanol,
- Sécher le culot 5 minutes maximum au Speed-Vac,
- Reprendre le culot dans 200ul de tampon d'élution,
- Laisser sur le paillage pendant toute la nuit ou pendant une
demi-journée
- stocker l'extrait d'ADN à T -20°C
d
Annexe 3
UNIVERSITE CHEIKH ANTA DIOP

Faculté des Sciences et
Techniques
Département de Biologie Animale
Laboratoire Écologie Vectorielle et Parasitaire
(LEVP)
Protocole d'identification par PCR des espèces du
complexe Gambiae Témoin positif : Souche
insectarium (An. Coluzzii = Forme M)
Témoin négatif : eau ultra pure
|
MASTER MIX
|
Conditions
|
amplification
|
|
nombre de
tubes
|
50
|
|
|
réactif
|
conc. Solution
mère
|
volume (iil)
par tube
|
volume MIX
en iil
|
|
Eau
|
|
9,1
|
455
|
|
5X Go Taq Buffer
|
|
5
|
250
|
|
dNTP
|
2,5 mM
|
2,5
|
125
|
|
MgCl2
|
25 mM
|
0,5
|
25
|
|
IMP-UN
|
F, 25 pmol/iil
|
1
|
50
|
|
AR-3T
|
R, 25 pmol/iil
|
1
|
50
|
|
GA-3T
|
R, 25 pmol/iil
|
1
|
50
|
|
ME-3T
|
R, 25 pmol/iil
|
1
|
50
|
|
QD-3T
|
R, 25 pmol/iil
|
2
|
100
|
|
IMP-S1
|
R, 25 pmol/iil
|
1
|
50
|
|
IMP-M1
|
R, 25 pmol/iil
|
1
|
50
|
|
Go Taq
|
5,0 U/iil
|
0,2
|
10
|
|
Total Master MIX
|
1265
|
|
Total Master MIX par tube: 25 ul
|
|
Volume ADN par tube : 1 ul
|
Référence : Wilkins et al.
2006
e
Bandes attendues : An. quadriannulatus: 637 pb
An. melas/merus: 529 pb
An. arabiensis: 388 pb
Forme M (An. coluzzii): 426 pb
Forme S (An. gambiae): 221 pb
Annexe 4
UNIVERSITE CHEIKH ANTA DIOP

Faculté des Sciences et
Techniques
Département de Biologie Animale
Laboratoire Écologie Vectorielle et Parasitaire
(LEVP)
Protocole de migration
Préparation de gel d'agarose 2%
- Peser 2g d'agarose pour 100 ml de tampon TBE
- Mélanger puis chauffer à la micro-onde
jusqu'à dissolution complète environ 2 min
- Laisser refroidir un instant et ajouter 5 ìl de biotium
dans le mélange et homogénéiser
Préparation de la Cuve à
électrophorèse
- Placer d'abord les peignes dans le moule puis couler le gel
- Attendre que le gel soit complètement solide avant de
retirer les peignes environ 40 min
- Placer le portoir de gel dans la cuve à
électrophorèse, remplir avec du tampon TBE 1X
- Charger les puits avec 5 ìl d'amplicon
mélangé avec du bleu de charge (sur parafilm)
- Mélanger 3 ìl de marqueur de taille et 2
ìl de dye sur le parafilm, bien homogénéiser puis
déposer le mélange dans les deux puits
extrêmes du gel.
- Couvrir la cuve avec les électrodes.
- Régler le générateur de courant à
80V et 400 mA puis le démarrer
- vérifier si le courant passe (petites bulles d'air au
niveau des électrodes)
- Laisser migrer l'ADN pendant 90 à 120 min.
- A la fin de la migration, éteindre le
générateur, enlever le couvercle et sortir le portoir pour
la lecture sur la table à UV (GeldocTM).
Titre : Etude de la dynamique des populations
d'Anopheles et de la transmission du paludisme dans le district
sanitaire de Nioro (Kaolack, Sénégal) après la campagne
d'aspersion intra-domiciliaire d'insecticide de 2015
Nom du candidat : Assane Yade Ndiaye
Nature du mémoire : Master en Biologie
animale spécialité : Entomologie Membres du Jury
:
Président : Pr Ousmane FAYE
LEVP/FST/UCAD
Membres : Dr Mamadou Demba SY
LEVP/FST/UCAD
Dr Libasse Gadiaga PNLP/MSAS
Dr Abdoulaye Diop Abt Associates
Superviseur : Dr Lassana Konaté
LEVP/FST/UCAD
Résumé
Un suivi entomologique a été effectué
d'Août à Octobre 2015 dans le district de Nioro après la
campagne d'aspersion intra-domiciliaire afin d'évaluer son impact sur la
dynamique des populations anophèliennes et la transmission du paludisme.
Le suivi a consisté à l'échantillonnage des adultes
d'anophèles par la capture sur appât humain et la collecte au
repos des populations. Les résultats sur les différents
paramètres entomologiques étudiés ont montré que,
dans l'ensemble, l'AID a eu un impact positif dans la réduction du
contact homme-vecteur et le risque de la transmission palustre en raison de
l'absence d'infection plasmodiale chez les populations de vecteurs.
Parallèlement, la bonne sensibilité des
populations d'An. gambiae s.l. aux deux familles d'insecticide en
cours d'utilisation dans la zone a été confirmée.
Ces travaux ont permis de mettre à jour les
données entomologiques dans le district de Nioro, permettant ainsi de
mieux orienter les interventions de lutte anti-vectorielle du PNLP.
Mots clés: AID, paludisme, impact, transmission,
Anopheles. Abstract:
An entomological follow-up was carried out from August to
October 2015 in the district of Nioro after an IRS campaign aiming at studying
its impact on the dynamics of malaria vectors populations and malaria
transmission. The study consisted in sampling Anopheles adult by both
human landing catches and indoors resting population collections. Ours results
showed an overall positive impact of the IRS campaign by reducing human-vector
contact and risk of transmission as well, due to the lack of finding any P.
falciparum infected female from the studied populations of both An.
gambiae s.l. and An. funestus.
In addition, Anopheles gambiae's populations were
found to be fully susceptible to the Carbamates and Organophosphorates
molecules and confirmed the classical trend for almost Senegalese anopheline
populations.
This study gives an update of entomological data within the
Nioro district for evidence-based decision to implement more efficiently the
Senegal NMCP vectors control interventions.
Key words: IRS, malaria, impact, transmission,
Anopheles.
| 


