|
F.S.D... N° D'ordre :
Université Saâd DAHLAB de
Blida

Faculté des Sciences
Département de Physique
Mémoire Présenté par :
BENNIA Soumia
LAOUES Mustapha
En vue d'obtenir le diplôme de
Master
Domaine : Sciences de la matière.
Filière :
Physique.
Spécialité : Physique Médicale.
Option :
Radiothérapie.
Sujet : Dosimétrie en curiethérapie
gynécologique au 137Cs :
intercomparaison système
de Manchester et ICRU 38
Soutenu le : 30 juin 2011, devant le jury composé
de :
|
Mr. M. Bentaiba
|
Professeur
|
USDB
|
Président
|
|
Mr. B. Hocini
|
Maître - Assistant A
|
USDB
|
Rapporteur
|
|
Mr. R. Khelifi
|
Maître de Conférences A
|
USDB
|
Examinateur
|
|
Mr. B. Benoumhani
|
Maître - Assistant en
radiothérapie
|
HCA
|
Examinateur
|
Remerciements
« A l'issue de ce travail, nous adressons nos
remerciements premièrement à dieu tout puissant pour la
volonté, la santé et la patience qu'il nous a donné durant
ces longues années d'études »
Aucun travail n'est possible dans l'isolement. Les
rencontres, les conseils et les encouragements constituent des aides
précieuses souvent décisives. C'est pourquoi nous tenons à
remercier ici tous ceux qui ont contribué à ce travail parfois
sans le savoir ou du moins sans mesurer la portée de leur
influence.
Nos remerciements s'adressent à notre promoteur
Monsieur Brahim HOCINI pour avoir proposé et dirigé ce modeste
travail et pour son continuel suivi tout le long de la réalisation et de
la correction de ce mémoire. Il nous a présenté un
excellent exemple de la compétence scientifique, discipline et
générosité. Ce mémoire lui doit beaucoup.
Nous exprimons nos sincères remerciements et notre
grande gratitude à tous les membres des services de radiothérapie
des centres (CPMC, CAC, HCA), d'avoir accepté de guider notre travail et
de nous avoir fait le plaisir de profiter de leurs expériences et de
leurs compétences.
Nous adressons également nos vifs remerciements aux
chefs des services de radiothérapie, dans lesquels nous avons
été bienvenus durant ce travail.
Nous remercions également tous les membres de jury
d'avoir accepté de juger notre travail.
Enfin, nous remercions également tous les
enseignants qui nous ont soutenu durant notre formation à
l'université, et tous ceux qui nous ont aidé à
l'élaboration de ce mémoire.
Table des matières
Introduction générale 01
Chapitre 1 : Généralités
04
1.1. La physique médicale 04
1.1.1. Introduction 04
1.1.2. La radiothérapie 04
1.2. Cancer du col de l'utérus 13
1.2.1. Introduction 13
1.2.2. Epidémiologie 13
1.2.3. Anatomie 14
1.2.4. Classification 14
1.2.5. Volumes tumoraux 16
1.2.6. Modalités thérapeutiques
18
1.3. Interactions des rayonnements ionisants avec la
matière 21
1.3.1. Introduction 21
1.3.2. Classification des rayonnements ionisants
21
1.3.3. Interaction photons-matière 22
1.4. Spécification de la dose en
curiethérapie 24
1.4.1. Introduction 24
1.4.2. Activité 24
1.4.3. Activité apparente 24
1.4.4. Transfert d'énergie 25
1.4.5. Dépôt d'énergie 26
1.4.6. Calcul du débit de dose dans l'eau
27
|
Chapitre 2 : Assurance de qualité en
curiethérapie
|
|
|
|
30
|
|
2.1. Introduction
|
|
|
|
30
|
|
2.2. Contrôle du dosimètre
|
|
|
|
30
|
|
2.3. Contrôle des sources et des applicateurs
|
|
|
|
30
|
|
2.4. Contrôle des projecteurs de sources
|
|
|
|
31
|
|
2.5. Contrôle des radiations diffusées
|
|
|
|
32
|
|
2.6. Contrôle du programme de calcul par ordinateur
|
|
|
|
33
|
|
2.7. Programme d'assurance de qualité
|
|
|
|
34
|
|
Chapitre 3 : Systèmes de prescription
de
|
la
|
dose
|
en
|
curiethérapie
|
|
intracavitaires
|
|
|
|
35
|
|
3.1. Introduction
|
|
|
|
35
|
|
3.2. Système de Manchester
|
|
|
|
35
|
|
3.2.1. Points de référence de dose
|
|
|
|
36
|
|
3.2.2. Points de référence des organes
à risque
|
|
|
|
38
|
|
3.2.3. Volumes de référence
|
|
|
|
39
|
|
3.2.4. Limites du système de Manchester
|
|
|
|
42
|
|
3.3. Système recommandé par l'ICRU
|
|
|
|
43
|
|
3.3.1. Description de la technique
|
|
|
|
43
|
|
3.3.2. Le kerma de référence total dans
l'air
|
|
|
|
44
|
|
3.3.3. Points de référence de dose
|
|
|
|
44
|
|
3.3.4. Volume de référence
|
|
|
|
45
|
|
3.3.5. Temps d'application
|
|
|
|
48
|
|
3.3.6. Limites du système recommandé par
l'ICRU
|
|
|
|
48
|
Chapitre 4 : Matériel et méthodes
50
4.1. Introduction 50
4.2. Matériel et méthodes 50
4.2.1. Matériel 50
4.2.1.1. Projecteur de sources 50
4.2.1.2. Applicateurs 51
4.2.1.3. Sources 51
4.2.1.4. Appareil d'imagerie 54
4.2.1.5. Système de planification de traitement
54
4.2.2. Méthodes 55
4.2.2.1. Déroulement de la curiethérapie
LDR du cancer du col utérin 55
4.2.2.2. Planification du traitement et dosimétrie
56
4.2.2.3. Choix de l'isodose de référence
63
4.2.2.4. Calcul du temps de traitement 66
4.2.2.5. Calcul des écarts moyens des doses
reçues par les organes à risque 66
Chapitre 5 : Résultats et discussion
67
5.1. Résultats 67
5.1.1. Choix de l'isodose de référence
67
5.1.2. Temps de traitement 70
5.1.3. Doses aux organes à risque 73
5.1.3.1. Dose au point de référence de la
vessie 73
5.1.3.2. Dose aux points de référence du
rectum 77
5.1.4. Doses aux points spécifiques 80
5.1.4.1. Doses aux points spécifiques de la paroi
pelvienne 80
5.1.4.2. Doses aux points spécifiques du
trapèze lymphatique de Fletcher 86
5.2. Discussion des résultats 110
5.2.1. Choix de l'isodose de référence
110
5.2.2. Dose aux organes à risque 110
5.2.3. Ecart moyen entre les trois méthodes des
doses reçues par les OAR 111
5.2.4. Doses aux points spécifiques de la paroi
pelvienne et du trapèze lymphatique de Fletcher 111
Conclusion générale 112
Liste des abréviations
A.A.P.M : American Association of Physicists in
Medicine.
AP : AntéroPostérieur.
CAC : Centre Anti Cancer.
CPMC : Centre Piere et Marie Curie.
CTV : Clinical Target Volume.
FIGO : Fédération Internationale de
Gynécologie Obstétrique.
GTV : Gross Tumor Volume.
HCA : Hôpital Central de l'Armé.
HDR : High Dose Rate.
HPA : Human Papilloma Virus.
ICRU : International Commission on Radiation Units and
measurements.
IED : Iliaque Externe Droit.
IEG : Iliaque Externe Gauche.
IPara D : Iliaque Para-aortique Droit.
IPara G : Iliaque Para-aortique Gauche.
IPD : Iliaque Primitive Droit.
IPG : Iliaque Primitive Gauche.
Kerma : Kinetic Energy Released in Matter.
L4: Quatrième lombaire.
LDR : Low Dose Rate.
MDR : Medium Dose Rate.
NA : Non Applicable.
OAR : Organs At Risk.
PDR : Pulse Dose Rate.
PTV : Planning Target Volume.
PPD : Paroi Pelvienne Droite.
PPG : Paroi Pelvienne Gauche.
RAKR : Reference Air Kerma Rate.
SI : Système International.
TPS : Treatment Planning System.
TRAK : Total Reference Air Kerma.
Liste des figures
p.08 - Figure 1 : Désintégration
f3- du Cs-137 avec les
énergies.
p.09 - Figure 2 : Différents applicateurs
utilisés dans la curiethérapie intracavitaire.
p.10 - Figure 3 : Projecteur de sources de
Césium-137 (type Curietron).
p.10 - Figure 4 : Console de
programmation de chaque canal de source.
p.11 - Figure 5 : Système de transfert des sources
(gaines de transfert). p.14 - Figure 6 : Appareil génital de la
femme.
p.17 - Figure 7 : Représentation des
différents volumes cliniques.
p.22 - Figure 8 : Effet
photoélectrique.
p.23 - Figure 9 : Effet Compton.
p.23 - Figure 10 : Effet de
matérialisation.
p.36 - Figure 11 : Points A et B de Manchester
(applicateur de Fletcher).
p.37 - Figure 12 : Définition du point A de
Manchester (applicateur de Fletcher).
p.38 - Figure 13 : Définition du point B de
Manchester (applicateur de Fletcher).
p.39 - Figure 14 : Détermination des points de
référence de la vessie et du rectum.
p.41 - Figure 15 : Géométrie pour la mesure
des dimensions du volume dans le traitement du carcinome du col de
l'utérus.
p.42 - Figure 16 : Le point A de Manchester dans deux cas
de différentes tailles du col utérin.
p.44 - Figure 17 : Détermination des points de la
paroi pelvienne.
p.45 - Figure 18 : Détermination du
trapézoïde lymphatique.
p.47 - Figure 19 : Volume de référence pour
la curiethérapie du cancer du col de l'utérus.
p.48 - Figure 20 : Les dimensions de l'isodose de
référence et la région de sous dosage.
p.51 - Figure 21 : Source de Césium-137
formée de Sources élémentaires. p.54 - Figure 22 :
Appareil d'imagerie avec le box de repérage.
p.54 - Figure 23 : Système de planification de
traitement.
p.57 - Figure 24 : Définition des points A et B
modifiés de Manchester.
p.59 - Figure 25 : Représentation des points de
référence d'une curiethérapie du cancer du col
utérin.
p.60 - Figure 26 : Système de coordonnées
de positionnement du patient.
p.61 - Figure 27 : La reconstruction
orthogonale.
p.62 - Figure 28 : La reconstruction avec deux
clichés orthogonaux avec jig.
p.63 - Figure 29 : Isodose de référence
choisie sur la base de la méthode locale.
p.64 - Figure 30 : Isodose de référence
choisie sur la base des recommandations de l'ICRU 38.
p.65 - Figure 31 : Isodose de référence
choisie sur la base de la méthode de Manchester.
p.67 - Figure 32 : Histogramme des isodoses de
référence des patientes du centre A, selon les trois
méthodes.
p.68 - Figure 33 : Histogramme des isodoses de
référence des patientes du centre B, selon les trois
méthodes.
p.69 - Figure 34 : Histogramme des isodoses de
référence des patientes du centre C, selon les trois
méthodes.
p.70 - Figure 35 : Histogramme des temps de traitement
des patientes du centre A, selon les trois méthodes.
p.71 - Figure 36 : Histogramme des temps de traitement
des patientes du centre B, selon les trois méthodes.
p.72 - Figure 37 : Histogramme des temps de traitement
des patientes du centre C, selon les trois méthodes.
p.73 - Figure 38 : Histogramme des doses reçues
par la vessie pour les patientes du centre A, selon les trois
méthodes.
p.74 - Figure 39 : Histogramme des doses reçues
par la vessie pour les patientes du centre B, selon les trois
méthodes.
p.75 - Figure 40 : Histogramme des doses reçues
par la vessie pour les patientes du centre C, selon les trois
méthodes.
p.76 - Figure 41 : Courbe des écarts moyens de la
dose reçue par la vessie entre les trois centres.
p.77 - Figure 42 : Histogramme des doses reçues
par le rectum pour les patientes du centre A, selon les trois
méthodes.
p.78 - Figure 43 : Histogramme des doses reçues
par le rectum pour les patientes du centre B, selon les trois
méthodes.
p.79 - Figure 44 : Courbe des écarts moyens de la
dose reçue par le rectum entre les trois centres.
p.82 - Figure 45 : Histogramme des doses reçues
par les parois pelviennes pour les patientes du centre A, selon les trois
méthodes.
p.84 - Figure 46 : Histogramme des doses reçues
par les parois pelviennes pour les patientes du centre B, selon les trois
méthodes.
p.85 - Figure 47 : Histogramme des doses reçues
par les parois pelviennes pour les patientes du centre C, selon les trois
méthodes.
p.88 - Figure 48 : Histogramme des doses reçues
par les iliaques externes pour les patientes du centre A, selon les trois
méthodes.
p.91 - Figure 49 : Histogramme des doses reçues
par les iliaques primitives pour les patientes du centre A, selon les trois
méthodes.
p.94 - Figure 50 : Histogramme des doses reçues
par les iliaques para-aortiques pour les patientes du centre A, selon les trois
méthodes.
p.95 - Figure 51 : Histogramme des doses reçues
par la symphysis pour les patientes du centre A, selon les trois
méthodes.
p.96 - Figure 52 : Histogramme des doses reçues
par le point S1S2 pour les patientes du centre A, selon les trois
méthodes.
p.98 - Figure 53 : Histogramme des doses reçues
par les iliaques externes pour les patientes du centre B, selon les trois
méthodes.
p.100 - Figure 54 : Histogramme des doses reçues
par les iliaques primitives pour les patientes du centre B, selon les trois
méthodes.
p.102 - Figure 55 : Histogramme des doses reçues
par les iliaques para-aortiques pour les patientes du centre B, selon les trois
méthodes.
p.103 - Figure 56 : Histogramme des doses reçues
par la symphysis pour les patientes du centre B, selon les trois
méthodes.
p.104 - Figure 57 : Histogramme des doses reçues
par le point S1S2 pour les patientes du centre B, selon les trois
méthodes.
p.105 - Figure 58 : Histogramme des doses reçues
par les iliaques externes pour les patientes du centre C, selon les trois
méthodes.
p.106 - Figure 59 : Histogramme des doses reçues
par les iliaques primitives pour les patientes du centre C, selon les trois
méthodes.
p.107 - Figure 60 : Histogramme des doses reçues
par les iliaques para-aortiques pour les patientes du centre C, selon les trois
méthodes.
p.108 - Figure 61 : Histogramme des Doses reçues
par la symphysis pour les patientes du centre C, selon les trois
méthodes.
p.109 - Figure 62 : Histogramme des doses reçues
par le point S1S2 pour les patientes du centre C, selon les trois
méthodes.
Liste des tableaux
p.07 - Tableau 1 : Classification du type de
curiethérapie selon le débit de dose. p.15 - Tableau 2 :
Classifications TNM et FIGO.
p.67 - Tableau 3 : Isodoses de référence
des patientes du centre A, selon les trois méthodes.
p.68 - Tableau 4 : Isodoses de référence
des patientes du centre B, selon les trois méthodes.
p.69 - Tableau 5 : Isodoses de référence
des patientes du centre C, selon les trois méthodes.
p.70 - Tableau 6 : Temps de traitement des patientes du
centre A, selon les trois méthodes.
p.71 - Tableau 7 : Temps de traitement des patientes du
centre B, selon les trois méthodes.
p.72 - Tableau 8 : Temps de traitement des patientes du
centre C, selon les trois méthodes.
p.73 - Tableau 9 : Doses reçues par la vessie pour
les patientes du centre A, selon les trois méthodes.
p.74 - Tableau 10 : Doses reçues par la vessie
pour les patientes du centre B, selon les trois méthodes.
p.75 - Tableau 11 : Doses reçues par la vessie
pour les patientes du centre C, selon les trois méthodes.
p.76 - Tableau 12 : Ecarts moyens de la dose reçue
par la vessie entre les trois centres.
p.77 - Tableau 13 : Doses reçues par le rectum
pour les patientes du centre A, selon les trois méthodes.
p.78 - Tableau 14 : Doses reçues par le rectum
pour les patientes du centre B, selon les trois méthodes.
p.79 - Tableau 15 : Ecarts moyens de la dose reçue
par le rectum entre les trois centres.
p.80 - Tableau 16 : Doses reçues par les parois
pelviennes pour les patientes du centre A, selon les trois
méthodes.
p.83 - Tableau 17 : Doses reçues par les parois
pelviennes pour les patientes du centre B, selon les trois
méthodes.
p.85 - Tableau 18 : Doses reçues par les parois
pelviennes pour les patientes du centre C, selon les trois
méthodes.
p.86 - Tableau 19 : Doses reçues par les iliaques
externes pour les patientes du centre
A, selon les trois méthodes.
p.89 - Tableau 20 : Doses reçues par les iliaques
primitives pour les patientes du centre A, selon les trois
méthodes.
p.92 - Tableau 21 : Doses reçues par les iliaques
para-aortiques pour les patientes du centre A, selon les trois
méthodes.
p.95 - Tableau 22 : Doses reçues par la symphysis
pour les patientes du centre A, selon les trois méthodes.
p.96 - Tableau 23 : Doses reçues par le point S1S2
pour les patientes du centre A, selon les trois méthodes.
p.98 - Tableau 24 : Doses reçues par les iliaques
externes pour les patientes du centre
B, selon les trois méthodes.
p.99 - Tableau 25 : Doses reçues par les iliaques
primitives pour les patientes du centre B, selon les trois
méthodes.
p.101 - Tableau 26 : Doses reçues par les iliaques
para-aortiques pour les patientes du centre B, selon les trois
méthodes.
p.103 - Tableau 27 : Doses reçues par la symphysis
pour les patientes du centre B, selon les trois méthodes.
p.104 - Tableau 28 : Doses reçues par le point
S1S2 pour les patientes du centre B, selon les trois
méthodes.
p.105 - Tableau 29 : Doses reçues par les iliaques
externes pour les patientes du centre C, selon les trois
méthodes
p.106 - Tableau 30 : Doses reçues par les iliaques
primitives pour les patientes du centre C, selon les trois
méthodes.
p.107 - Tableau 31 : Doses reçues par les iliaques
para-aortiques pour les patientes du centre C, selon les trois
méthodes.
p.108 - Tableau 32 : Doses reçues par la symphysis
pour les patientes du centre C, selon les trois méthodes.
p.109 - Tableau 33 : Doses reçues par le point
S1S2 pour les patientes du centre C, selon les trois
méthodes.
ugiit.4
CiA 6-.44.1411 A...J*14 1....)11 Sc. Jim
j...,J E ~~ A.z.),N.11 ul..,..,=. Li.L4.-11 u31.41
ula ;LA. )111 elk _Sji
(A Alail..
1 4,pi t-,;=.9-4:111) Manchester
Z.9.1...iin 6 141-A Z241/111
Z.9.1....)C111 A.LA4113,1
.61.C..)7N.11 7085. J=am
4,i.11 (38 laki -ALA 6.1"4.411
A4c'1-241.71.`"911
A41. 111 A-141) 3 8 ICRU
criLel. c- L.4--»Ai1
.A-ki.....)..11
· ',1.c...}N.11 7085. cri e11.2.411.11
ulc.
vi .A-c'..).41
A-.14-1 41 cci 13S 640..}411
(=Itc...}41 7085. jt ZiNill Li jltil c;LJI. ja elk
cci 111.4%1%.
·JH
· Z2- Ai L:cti2.111 1-:ctc
·Sil
ICRU 38'`317.u..=.35 cDi
..):1.6- E ~~~23~ ~H~I ~~ J4~ ~~~
',10l:i&I aw.." cAhl.a 63.4 vi l+1c
·
LjA...111 cjilil
Ljc ...).6 eij 1.11
f,Letatil 4.4_,
·1 .L4.111 ouii
Lela
|
· cs-J-411 7085211
..):1-13.&I csi S .
·-?. elli
J41-)15
|
|
· J911 4 1, ci CDS.1
'''Im-..)41 csi s2.)13.2-4 ku4LiManchester ICRU
38 -.jtjil clitAISII
.Manchester elA 6 ICRU
38 'TG-43 6AC.41 6 137 Cs
'LDR " .4441 ',6_,Itil EN.c.
Résumé
Dans cette étude, on s'intéresse
à l'aspect clinique et dosimétrique dans le traitement du cancer
du col de l'utérus en curiethérapie, à travers notamment,
la distribution de doses en utilisant, la méthode locale, la
méthode de Manchester (prescription au point A) et la méthode
recommandée par l'ICRU 38 « International Commission on Radiation
Units and measurements, Report N°38 » qui prône la prescription
de la dose en termes de volumes à traiter.
Nous avons utilisé les trois méthodes
de prescription de doses pour le choix de l'isodose de référence
mais également pour estimer la dose reçue aux organes à
risque.
Les résultats obtenus montrent des
différences entre les trois méthodes dosimétriques.
Cependant, la méthode recommandée par l'ICRU 38 parait plus
proche de la réalité concernant le choix de l'isodose de
référence . Par contre, pour la protection des organes
particulièrement surveillés à savoir la vessie et le
rectum, les méthodes ICRU 38 et de Manchester montrent que les doses
reçues sont significatives mais restent en deçà de la dose
de tolérance.
Mots clés
Curiethérapie LDR, Césium-137,
dosimétrie, TG-43, ICRU 38, Système de Manchester.
Abstract
This study is mainly concentrated on clinical and
dosimetrical aspects in brachytherapy treatment of cervix cancer, through
notably, the distribution of doses while using, the local method, the method of
Manchester (prescription to the point A) and the method recommended by the ICRU
38 « International Commission one Radiation Units and measurements, Report
N°38 » that give the prescription of the dose in terms of volumes to
treat.
We used the three methods of prescription of doses, for
the choice of the reference isodose, and also to estimate the dose received to
the organs at risk.
The gotten results show differences between the three
methods. However, the method recommended by the ICRU 38, present good results
concerning the choice of the reference isodose. On the other hand, for the
protection of the organs particularly supervised: the bladder and the rectum,
the methods ICRU 38 and Manchester show that the received doses are meaningful
but remain below the dose of tolerance.
Key words
Brachytherapy LDR, Cesium 137, dosimetry, TG-43, ICRU
38, System of Manchester.
Introduction générale
Les traitements de radiothérapie en
général et de curiethérapie en particulier,
nécessitent la délivrance d'une dose précise au niveau de
la tumeur et une bonne connaissance de la dose dans les zones avoisinantes.
Autrement dit, un bon résultat de traitement nécessite une bonne
dosimétrie, avec un système de dosimétrie
adapté.
Dans les traitements en curiethérapie, il y a
des études réalisées pour différents
systèmes dosimétriques. Deux systèmes sont les plus
communément utilisés à savoir le système de
Manchester (Paterson-Parker 1948) et les recommandations de l'ICRU 38 «
International Commission on Radiation Units and Measurements, Report 38, 1985
».
Notre étude consiste en l'intercomparaison
entre le système de Manchester et le système recommandé
par l'ICRU 38, pour la dosimétrie en curiethérapie
gynécologique à bas débit de dose utilisant le
Césium-137.
Actuellement en Algérie, la dosimétrie
en curiethérapie gynécologique, ne suit pas un système
spécifique. Notre objectif, est de déterminer le système
le plus adéquat pour une meilleure distribution de dose, et de le
recommander dans les centres anti cancer en Algérie, notamment dans des
buts d'études multicentriques.
Cette étude comporte des aspects cliniques et
des aspects physiques à travers notamment, la description des aspects
techniques du traitement, de la spécification des sources
utilisées et l'étude des distributions de doses en utilisant le
système de Manchester et les recommandations de l'ICRU 38.
Cette étude est composée de cinq
chapitres, dans la premier chapitre nous avons définit les aspects
physiques et les aspects cliniques du traitement y compris, la physique
médicale, l'interaction rayonnement matière, le cancer du col de
l'utérus et la spécification des sources utilisées en
curiethérapie. Dans le deuxième chapitre nous avons décrit
les différentes étapes de contrôle de qualité. Nous
avons abordé dans le troisième chapitre aux systèmes de
spécification de la dose : le système de Manchester et les
recommandations de l'ICRU 38.
Dans le quatrième chapitre, nous avons
décrit le matériel et les méthodes dosimétriques
utilisées dans le traitement du cancer du col de l'utérus. Nous
avons donné les résultats et une discussion a été
élaborée dans le cinquième chapitre.
Enfin, nous avons développé nos propres
arguments à travers une conclusion générale.
Partie théorique
Chapitre 1 : Généralités 1.1. La
physique médicale 1.1.1. Introduction
La physique médicale est une branche, qui
fusionne les applications de la physique en médecine,
particulièrement en imagerie médicale et dans le traitement de
quelques maladies notamment cancéreuses. On distingue quatre domaines
d'application de la physique médicale :
- Radio-oncologie (radiothérapie): l'ensemble
des techniques de traitement des cancers par les rayonnements ionisants
d'énergie adaptée (photons, électrons, protons, neutrons
et ions lourds) [1], on distingue la radiothérapie externe et la
curiethérapie.
- Radiologie diagnostique: l'imagerie médicale
par rayons X, par ultrasons et par résonance
magnétique.
- Médecine nucléaire: l'utilisation de
radioéléments, administrés à des patients à
des fins diagnostiques ou thérapeutiques [2].
- Radioprotection: l'étude des risques induits
par les rayonnements, et la protection du personnel, du public et de
l'environnement [3].
1.1.2. La radiothérapie
La radiothérapie (appelée parfois
irradiation ou traitement par les rayons) représente une des
méthodes thérapeutiques curatrices majeures en
cancérologie, elle consiste à utiliser des rayonnements ionisants
d'énergie adaptée pour détruire les cellules
cancéreuses présentes dans le tissu à traiter en bloquant
leur capacité à se multiplier.
L'irradiation a pour but de détruire les cellules
cancéreuses tout en préservant le mieux possible les tissus sains
et les organes avoisinants [3, 4].
Par définition générale, la
radiothérapie est l'ensemble des techniques de traitement
des cancers
par les rayonnements ionisants. Les sources d'irradiation peuvent
êtres
externes au patient, les rayonnements sont émis en
faisceau par une machine et ils
traversent la peau pour atteindre la tumeur: on parle
de radiothérapie externe. Pour la curiethérapie, des sources
radioactives sont implantées directement à l'intérieur du
corps du patient. Il existe une troisième modalité de
radiothérapie, la radiothérapie métabolique. Elle consiste
à administrer, par voie orale (boisson ou capsule) ou par injection
intraveineuse, une substance radioactive, qui se fixe
préférentiellement sur les cellules cancéreuses pour les
détruire [5].
1.1.2.1. La radiothérapie externe [7]
La radiothérapie externe est un traitement
local du cancer, il agit directement sur la région à traiter en
éliminant les cellules cancéreuses au niveau de la zone
touchée (sein, prostate, ovaire, etc.). Les rayons sont produits par une
source externe et sont dirigés vers la zone à
traiter.
La radiothérapie externe est la forme la plus
fréquente des traitements par radiothérapie. L'appareil de
radiothérapie le plus souvent utilisé est un
accélérateur linéaire de particules. Cet appareil produit
des rayons X et des électrons de haute énergie. Il peut s'agir
aussi d'installations de cobalthérapie qui sont remplacées
graduellement par des accélérateurs.
Ces rayons sont dirigés vers la zone à
traiter. Ils atteignent la tumeur mais aussi les cellules saines. La
résistance et la capacité de récupération des
cellules saines leur permettent de se rétablir, contrairement aux
cellules cancéreuses qui meurent et ne peuvent se
régénérer.
1.1.2.2. La curiethérapie ou « brachytherapy
»
La curiethérapie est une des plus anciennes
applications de la radioactivité à usage thérapeutique.
Contrairement à la radiothérapie externe, elle consiste à
mettre en place, de façon temporaire ou permanente, des sources
radioactives naturelles ou artificielles au contact direct de la zone à
traiter. Ces sources émettent des rayonnements qui détruisent les
cellules cancéreuses. La dose de rayonnement décroît
très vite au fur et à mesure que l'on s'éloigne de la
source radioactive, elle est donc très forte au niveau de la zone
à traiter et diminue au niveau des tissus sains [4, 5, 6].
1.1.2.2.a. Différentes modalités de
traitement par curiethérapie
Les éléments radioactifs les plus
souvent utilisés lors d'une curiethérapie sont l'iridium-192, le
césium-137 et l'iode-125 qui ont remplacé le radium-226. Ces
sources peuvent se présenter sous forme de grains, de fils ou de micro
sources en fonction de la nature du radioélément [2,
9].
Les sources radioactives peuvent être
implantées de différentes façons dans le corps
:
· Soient elles sont placées dans des
aiguilles ou tubes plastiques implantés à l'intérieur
même de la tumeur (peau, lèvre, sein, langue, anus, prostate,
etc.) ; on parle de curiethérapie interstitielle ou
endocuriethérapie [8, 10] ;
· Soient elles sont insérées dans
un applicateur spécial qui est introduit dans une cavité
naturelle du corps (comme le vagin ou le col de l'utérus) au contact de
la lésion à traiter ; on parle de
plésiocuriethérapie ;
On distingue deux techniques de
plésiocuriethérapie [6] :
· Endocavitaire ou intracavitaire, pour traiter
certains cancers gynécologiques comme le cancer du vagin ou de
l'utérus.
· Endoluminale, comme la curiethérapie
endobronchique ou endooesophagienne.
· soient elles sont laissées à
demeure dans les tissus comme des grains (l'iode125) ; on parle d'implants
permanents [6].
Dans la majorité des cas, les sources sont
implantées dans l'organisme de façon temporaire. C'est la
technique d'implants temporaires, qui utilise des fils d'iridium192, micro
source d'iridium-192 ou source de césium-137. Ces sources sont
laissées en place de quelques minutes à quelques jours, puis
retirées selon le débit de dose [3].
1.1.2.2.b. Classification du type de curiethérapie
selon le débit de dose
Durant le temps pendant lequel les sources
radioactives restent à l'intérieur du patient, l'irradiation est
continue. Le débit de cette irradiation est défini par le rapport
entre la dose délivrée et la durée de la
curiethérapie [8].
On distingue ainsi (tableau 1) :
- Curiethérapie à bas débit de dose
(LDR) << Low Dose Rate >> de 0,4 à 2 Gy/heure,
- Curiethérapie à moyen débit de
dose (MDR) << Medium Dose Rate >> de 2 à 12 Gy/heure et
;
- Curiethérapie à haut débit de dose
(HDR) << High Dose Rate >> supérieur à 12
Gy/heure.
La curiethérapie à débit de dose
pulsée (PDR) << Pulse Dose Rate >> consiste en la simulation
de curiethérapie LDR avec la curiethérapie MDR, la
délivrance du traitement se fait par pulse de quelques minutes toutes
les heures [8, 10].
Débit de
dose
|
Sources
radioactives
utilisées
|
Type
d'implants
|
Exemples
d'organes
traités
|
Hospitalisation
|
Curiethérapie
LDR
|
Iode-125
|
Permanents
|
Prostate
|
Le plus souvent un à deux
jours, pour la
mise en
place des implants.
|
|
Temporaires
|
Col de l'utérus
|
En chambre protégée
quelques
jours
|
Curiethérapie
PDR
|
Iridium-192
|
Temporaires
|
Col de l'utérus
Prostate
|
En chambre protégée
quelques
jours.
|
Curiethérapie
HDR
|
Iridium-192
Ou
Cobalt-60
|
Temporaires
|
Bronches
OEsophage
Prostate
|
Hospitalisation de courte
durée,
réalisée dans une
salle de
traitement
protégée.
|
|
Tableau 1 : Classification de type
curiethérapie selon débit de dose [11, 12].
1.1.2.2.c. Equipement utilisé en
curiethérapie gynécologique intracavitaire LDR 1.1.2.2.c.1.
Sources
Le Cs-137 a été découvert
à la fin des années 1930 par Glenn Seaborg et Margaret Melhase.
Il a été introduit en premier pour remplacer le Radium-226 en
curiethérapie intracavitaire pour les tumeurs gynécologiques et
ensuite pour les traitements interstitiels. Les principaux avantages de Cs-137
sont l'absence des produits gazeux toxiques par rapport au Ra-226, la longue
demi-vie de 30.07 années ; quand on compare à le demi-vie de 5.27
années pour le Cobalt-60, le Cs-137 permet l'usage clinique sur une
longue période de temps avant que le remplacement ne soit
nécessaire. Les coûts de production des sources de Cs-137 sont
également inférieurs à ceux du Ra-226 et du
Co-60.
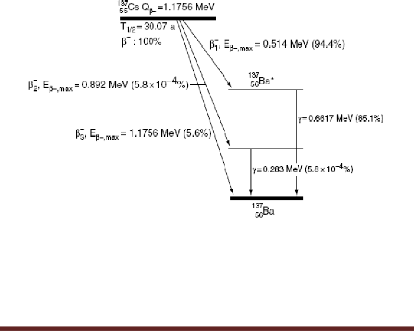
Figure 1 : Désintégration
~- du Cs-137 avec les énergies
[13].
La désintégration du Cs-137 se fait
principalement (94.4%), comme une désintégration
f3- au second état
excité du Barium-137 (figure 1) ; où la désexcitation du
Ba-137 vers son état fondamental se produit à 90% par une
émission d'un rayon gamma d'énergie de 0.662 MeV.
1.1.2.2.c.2. Applicateurs
Les applicateurs intracavitaires abritent les sources
radioactives et sont insérés dans l'utérus et le vagin,
ils incluent une sonde utérine (tandem) et des capsules vaginales
(colpostats ou ovoïdes) développées par des chercheurs
français [14].
Les applicateurs les plus fréquemment
utilisés sont les applicateurs standards métalliques de Fletcher
Suit-Delcos (1953) du système de Manchester (figure 2), pour leurs
aptitudes de réduction de la dose au niveau de la vessie et du rectum,
pour leurs optimisations de la distribution de la dose et aussi pour leurs
longues durées d'utilisation (stérilisables). Cependant, ils
restent très rigides, ce qui provoque un certain inconfort de la
patiente.
Le deuxième type d'applicateurs les plus
utilisés, sont les applicateurs plastiques de Delouche (figure 2), ils
sont disponibles en trois tailles différentes, souples (confortables) et
jetables.
Le troisième type d'applicateurs, sont les
applicateurs personnalisés (moulés) de Chassagne et Pierquin
(figure 2), ils sont très adaptés à la
géométrie du col de l'utérus.
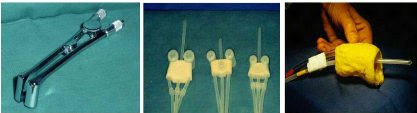
Figure 2 : Différents applicateurs
utilisés dans la curiethérapie intracavitaire
[16] ; de gauche
à droite : applicateur de Fletcher Suit-Delcos du système
de
Manchester, applicateur plastique de Delouche, applicateur
personnalisé (moulé)
de Chassagne et
Pierquin.
1.1.2.2.c.3. Projecteur de sources [15]
La position des sources est un paramètre
physique fondamental dans la précision de la dose délivrée
en curiethérapie. Les projecteurs de source (figure 3) jouent ainsi un
rôle essentiel dans ce domaine, outre celui lié à la
radioprotection qu'ils assurent.

Figure 3 : Projecteur de sources de
Césium-137 (type Curietron) [16].
La technologie des projecteurs de source permet
actuellement d'assurer ces fonctions. En effet, ils comportent, un câble
avec une source fictive, qui permet de mimer les différents pas de la
source radioactive lors de l'application telle qu'elle est réellement
effectuée. Ces systèmes sont liés à un
système de dosimétrie propre au constructeur, mais une
programmation manuelle est également possible à partir de la
console (figure 4).

Figure 4 : Console de programmation de chaque canal
de source [16].
D'une façon générale, tous ces
projecteurs présentent : un système de détection de la
position de des sources, un système de transfert des sources (figure 5),
une minuterie associée à chaque canal. Pour des raisons
évidentes de radioprotection, ils possèdent par ailleurs une
batterie, un système de rentrée d'urgence des sources
radioactives et des dispositifs de voyants lumineux permettant de
vérifier l'état du projecteur et la situation des sources
radioactives. Tous ces projecteurs comportent deux conteneurs de stockage : un
permanent et un temporaire.
Figure 5 : Système de transfert des sources
(gaines de transfert) [16].
1.1.2.2.d. Méthode d'acquisition des
données en curiethérapie gynécologique intracavitaire LDR
[17]
Lorsqu'il s'agit d'applications interstitielles
profondes ou intracavitaires, il est indispensable de faire un repérage
radiographique.
La région de l'application doit être
radiographiée avec deux clichés orthogonaux. Dans la mesure du
possible on s'arrangera pour tourner le tube autour du patient.
Deux techniques sont à l'heure actuelle, les plus
utilisées : 1.1.2.2.d.1. Technique de deux films orthogonaux
L'utilisation d'un box spécial pour le
repérage radiographique, qui permet d'assurer l'orthogonalité du
deux films, de calculer le facteur d'agrandissement et de tenir compte de la
divergence du faisceau et des défauts de centrage
éventuels.
Des repères plombés sont
positionnés sur la surface des faces du box, et leur positionnement doit
être connu par le programme de calcul de manière
précise.
1.1.2.2.d.2. Technique de deux films orthogonaux avec un
centre dit `Jig'
Cette méthode consiste à utiliser le
même box, pour le repérage comme la première
méthode, mais avec la superposition d'un centre (Jig) dans le plan
d'application. Les distances Jig-films et Jig-source des rayonnements
étant connues, il est possible de calculer l'agrandissement des
clichés.
L'axe du faisceau doit être centré sur
l'application pour les deux méthodes.
Les programmes utilisant ces techniques donnent un
tableau où sont notées les caractéristiques du box de
dimensions fixes `largeur (41,6 cm), hauteur (41,6 cm, épaisseur (48
cm)', et de deux repères de positionnement d'une distance (6 cm) qui
nous aide à calculer l'agrandissement des clichés, ce dernier
devra être introduit dans le système de planification du
traitement (TPS) « Treatment Planning System », pour faire une
dosimétrie adaptée.
Le box porte la même cassette porteuse de
cliché de même largeur et hauteur que celles du box, mais
d'épaisseur (1,3 cm), ce qui permet d'utiliser le même TPS pour
faire des calculs pour différents services.
1.2. Cancer du col de l'utérus 1.2.1.
Introduction
Le cancer du col de l'utérus est une maladie
qui atteint des femmes relativement jeunes dont les enfants sont bien souvent
encore à la maison. Il pose donc un important problème social,
outre les souffrances qu'il cause [18].
1.2.2. Epidémiologie
1.2.2.1. Incidence et mortalité
A l'échelle mondiale, le cancer du col
utérin est en termes de fréquence le deuxième cancer
féminin avec environ 466000 nouveau cas et 231000 décès
annuels. Il se situe au premier rang dans les pays en voie de
développement, où il représente la forme la plus courante
de cancer (20 à 30 X de l'ensemble des cancers) et la
cause principale de décès par cancer chez la femme.
L'incidence et la mortalité sont très
variables d'un pays à l'autre en fonction des facteurs de risque et
surtout de l'existence de techniques efficaces de traitement.
1.2.2.2. Facteurs de risque
Plusieurs études fondamentales ont
été réalisées dans le but de saisir les principaux
facteurs de risque incriminés dans la genèse du cancer du col
utérin. Il s'agit en fait d'une maladie multifactorielle [19]
:
· Infection au papillomavirus humain (HPA) «
Humain Papilloma Virus » ;
· Vie sexuelle de la femme ;
· Tabagisme actif et passif ;
· Autres facteurs socioéconomiques et
génétiques.
1.2.3. Anatomie
L'utérus est un organe impair et
médian, situé dans le petit bassin entre la vessie en avant et le
rectum en arrière. Il est composé du corps en haut et du col en
bas (figure 6) [19]. Le col utérin occupe le tiers inférieur de
l'utérus. De forme cyclique, il est dirigé vers le bas et
l'arrière et pénètre le tiers supérieur du vagin :
c'est la partie vaginale du col.
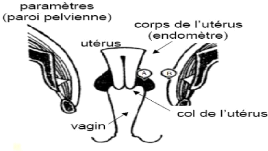
Figure 6 : Appareil génital de la femme [20].
1.2.4. Classification
1.2.4.1. Classification FIGO
Le système d'évaluation des stades des
cancers des organes génitaux le plus largement utilisé est celui
de (FIGO) « la Fédération Internationale de
Gynécologie Obstétrique » qui s'applique à toutes les
formes morphologiques des cancers du col de l'utérus (tableau
2).
1.2.4.2. Classification TNM
Elle est définie en fonction de la taille de la
tumeur (T), du statut ganglionnaire (N) et de la présence de
métastases à distance (M) (tableau 2).
TNM
|
Stades des carcinomes du col utérin
|
FIGO
|
Tis
|
In situ
|
0
|
T1
|
Limité à l'utérus
|
I
|
T1a
|
Diagnostic seulement histologique
|
IA
|
T1a1
|
Profondeur < 3mm, extension horizontale <
7mm
|
JA1
|
T1a2
|
Profondeur entre 3 et 5mm, extension horizontale <
7mm
|
1A2
|
T1b
|
Lésion cliniquement visible ou microscopique et
plus grande que
T1a2
|
ZB
|
T1b1
|
Lésion < 4cm
|
11B1
|
T1b2
|
Lésion > 4cm
|
11B2
|
T2
|
Lésion s'étendant au-delà de
l'utérus, sans extension aux parois
pelviennes, ni au tiers
inférieur du vagin
|
II
|
T2a
|
Paramètres respectés
|
hZA
|
T2b
|
Atteinte des paramètres
|
JIB
|
T3
|
Extension au tiers inférieur du vagin aux
parois pelviennes et
hydronéphrose
|
III
|
T3a
|
Extension au tiers inférieur du
vagin
|
lIlA
|
T3b
|
Extension aux parois pelviennes et/ou
hydronéphrose
|
1111B
|
T4
|
Extension à la vessie et/ou au rectum ou
au-delà du petit bassin
|
ZVA
|
N1
|
Ganglions régionaux
|
-
|
M1
|
Métastases à distance
|
IVB
|
|
Tableau 2 : Classifications TNM et FIGO
[19].
1.2.5. Volumes tumoraux [21]
C'est difficile d'effectuer un traitement sans une
idée claire au sujet de la prescription de la dose. Pour un traitement
exact et complet, il est exigé de faire une prescription raisonnable,
cependant qu'elle est dépendante du choix des paramètres du
traitement (figure 7).
Le statut clinique du patient devrait être
rapporté aussi complètement que possible, y compris l'emplacement
et l'ampleur de la tumeur, la pathologie, etc. Cette information devrait
être rapportée d'après une classification internationale
reconnue (FIGO, TNM).
La détermination des volumes est
extrêmement importante, pour la limitation de la tumeur et des organes
voisins, ce processus comporte plusieurs étapes en termes de
définition des volumes.
1.2.5.1. Volume tumeur macroscopique (GTV) << Gross
Tumour Volume >>
Le volume gros de la tumeur GTV est l'ensemble des
lésions tumorales mesurables, palpables ou visibles avec les moyens
d'imagerie actuellement disponibles (n'existe plus après
exérèse chirurgicale macroscopiquement totale).
1.2.5.2. Volume cible anatomoclinique (CTV) <<
Clinical Target Volume >>
Le volume cible anatomoclinique CTV est l'ensemble du
volume anatomique dans lequel on veut éradiquer la maladie
cancéreuse macroscopique et/ou microscopique.
Le GTV et le CTV sont des concepts oncologiques purs et
donc sont indépendant de la stratégie et de la technique
thérapeutique.
1.2.5.3. Volume cible prévisionnel (PTV) <<
Planning Target Volume >>
Le volume cible prévisionnel PTV est un
concept géométrique utilisé dans le but d'arranger le
traitement et s'assurer que la dose prescrite est réellement
absorbée dans le CTV entier. Cependant, la détermination du PTV
pour la curiethérapie est en général non
considérable, les sources radioactives et le volume cible sont
habituellement proches l'un de l'autre.
1.2.5.4. Volume traité
Le volume traité est le volume de tissu
qu'à reçoit une dose au moins égal à la dose
prescrite par l'oncologue.
1.2.5.5. Volume irradié
Le volume irradié entoure le volume
traité. Il reçoit également du rayonnement
diffusé.
1.2.5.6. Organes à Risque (OAR) « Organs At
Risk »
Les organes à risque OAR sont des tissus normaux
dont la sensibilité aux rayonnements peut influencer significativement
le choix du plan de traitement.
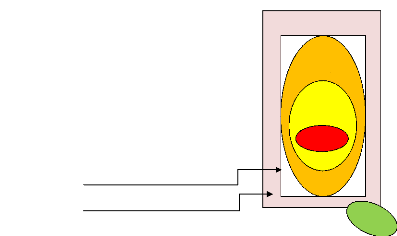
GTV : Gross Tumour Volume, correspond à la tumeur
visible.
CTV : Clinical Target Volume, GTV + extensions
microscopiques.
PTV
PTV : Planning Target Volume, CTV + marge de
sécurité (mouvements).
OAR : Organs At Risk, volume qui ne peut recevoir une
dose supérieure à une valeur limite connue ou volume à
éviter.
Volume à traiter
Volume irradié
CTV
GTV
OAR
Figure 7 : Représentation des
différents volumes cliniques [21].
1.2.6. Modalités thérapeutiques
Le but du traitement est d'enlever la tumeur et
d'éradiquer ses éventuelles extensions locorégionales
(dôme vaginal, paramètres, ganglions pelviens). Et pour cela, Il
existe plusieurs moyens thérapeutiques.
1.2.6.1. Chirurgie
La chirurgie a été la première
méthode thérapeutique appliquée aux cancers du col
utérin. Elle doit être réalisée par une
équipe ayant une bonne expérience de la cancérologie, de
la gynécologie et de la chirurgie viscérale ou urologique. Cette
technique thérapeutique doit être radicale et intéresser
tout le volume tumoral et ses prolongements [22].
1.2.6.2. Chimiothérapie
La chimiothérapie a un double objectif
:
· Améliorer le contrôle
locorégional en facilitant la réalisation de la chirurgie ou en
améliorant l'efficacité de la radiothérapie ;
· Agir sur la maladie micro métastatique
pour améliorer la survie sans métastases et la survie globale des
malades.
La chimiothérapie peut être
utilisée soit en traitement néo adjuvant, soit de façon
concomitante à la radiothérapie externe pour potentialiser
l'effet de l'irradiation, soit en adjuvant dans un deuxième temps
[22].
1.2.6.3. Radiothérapie
La radiothérapie joue un rôle
prépondérant dans la curabilité des cancers du col
utérin. Elle s'intègre dans le cadre d'un traitement
pluridisciplinaire, on distingue deux types de radiothérapie
[22].
1.2.6.3.a. Radiothérapie externe
Pour l'irradiation des cancers du col utérin, les
photons de haute énergie (10 à 25 MV) provenant d'un
accélérateur linéaire sont idéals [22].
Le rythme de l'irradiation classique est de 2Gy par
séance et 5 séances par semaine. Chez les patientes fragiles,
après chirurgie ou sur des champs plus grands, une dose par fraction de
1,8Gy est préférable.
La dose dépend de l'objectif clinique (curatif
ou palliatif), de la stratégie thérapeutique
(radiothérapie exclusive ou association radio-chirurgicale) et du
compromis choisi entre la dose de contrôle tumoral qui dépend du
volume tumoral et de la protection des organes sains. La dose requise pour
stériliser les lésions utérines est de 60 à 75
Gy.
1.2.6.3.b. Curiethérapie
La curiethérapie utéro-vaginale a pour
but de stériliser la maladie microscopique au niveau du col, du tiers
supérieur du vagin et des paramètres proximaux où
cheminent les uretères. Elle consiste à placer des sources
radioactives (le Césium-137 généralement) au contact de la
tumeur : c'est la curiethérapie intracavitaire, ou à
l'intérieur de la tumeur : c'est la curiethérapie interstitielle
[22].
La curiethérapie délivre une dose
inhomogène, des doses très élevées sont
délivrées à quelques mm de la source et des doses
très faibles à 1 ou 2 cm de la source (notion de gradient de dose
ou l'inverse carré de la distance).
1.2.6.4. Stratégie thérapeutique
· Stade IA
La chirurgie est le traitement standard pour ce Stade
[22].
· Stades IB
- Stade IB1 : soit une curiethérapie utéro
vaginale associée à la chirurgie, soit à une
radiothérapie externe sur les aires ganglionnaires pelviennes
[22].
- Stade IB2 : une radiothérapie pelvienne
associée à une chimiothérapie concomitante, puis
curiethérapie utéro vaginale, puis une chirurgie optionnelle
[22].
· Stades II et III
Le traitement comporte une radiothérapie
pelvienne associée à une chimiothérapie concomitante, puis
une curiethérapie utéro vaginale [22].
En cas d'absence d'extension au-delà du tiers
supérieur du vagin et aux paramètres, une chirurgie optionnelle
peut être proposée en cas de stade peu avancé.
· Stades VA
Le traitement peut comporter, après
concertation pluridisciplinaire et selon l'état général de
la patiente ; une chirurgie exclusive et/ou de la radiothérapie et/ou de
la chimiothérapie [22].
· Stades ~VB
Le traitement est palliatif et peut comporter de la
chimiothérapie, de la radiothérapie à visée
symptomatique et différents soins de support non
spécifiques.
1.3. Interactions des rayonnements ionisants avec la
matière 1.3.1. Introduction
Un certain nombre de particules ou de rayonnements
ionisants sont émis lors des phénomènes nucléaires.
Ces rayonnements et particules sont susceptibles d'entraîner des dommages
dans la matière, qu'elle soit vivante ou non, car ils vont y produire
des interactions. Ces interactions seront différentes selon le type de
particules ou de rayonnements, le but du ce chapitre est d'étudier ces
phénomènes qui permettront la compréhension des grandeurs
utilisées en dosimétrie [23].
1.3.2. Classification des rayonnements ionisants
En médecine et en biologie, les rayonnements
ionisants rencontrés sont principalement soit constitués par des
particules matérielles chargées (électrons, protons,
deutons, ions, etc.) ou neutres (neutrons), soit par des photons
(essentiellement les rayons X et y) [23].
Les rayonnements ionisants peuvent être donc
divisés en deux catégories principales :
· Rayonnements corpusculaires : on distingue les
rayonnements corpusculaires en fonction de leur mode de production et par le
type de particules émises: protons, électrons, noyaux
d'hélium, neutrons, etc. La théorie de la relativité
permet de relier la masse et l'énergie par la relation
d'équivalence masse-énergie (Einstein 1905) :
E = m0c2 + T (1)
Ott m0 est la masse au repos de la particule, et T
à son énergie cinétique.
· Rayonnements électromagnétiques
: un rayonnement électromagnétique monochromatique est une onde
électromagnétique caractérisée, par sa
fréquence u. Sa vitesse de propagation dans le vide qui
est la vitesse de la lumière (c).
Des expériences sur les interactions de ces
rayonnements avec la matière montrent qu'un rayonnement
électromagnétique se comporte aussi comme un ensemble de
particules, les photons, se déplaçant à la vitesse de la
lumière. C'est le dualisme onde - corpuscule. L'énergie de chaque
rayonnement de fréquence u est donnée par
:
E = h u (2)
Ott h est la constante de Planck, et v
la fréquence d'onde électromagnétique [23]. 1.3.3.
Interaction photons-matière
Dans la gamme d'énergie des photons
utilisés en radiothérapie, trois effets prédominent
largement.
1.3.3.1. Effet photoélectrique
L'effet photoélectrique (figure 8)
(intégralité de l'énergie du photon incident est
transférée à un électron arraché à
une couche interne d'un atome, le réarrangement électronique qui
s'ensuit entraîne l'émission soit d'un photon dit de fluorescence,
soit d'un électron Auger).
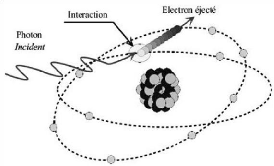
Figure 8 : Effet photoélectrique
[3].
1.3.3.2. Effet Compton
L'effet Compton (figure 9) (énergie d'un photon
incident transmise à un électron arraché à une
couche périphérique d'un atome et à un photon dit
diffusé).
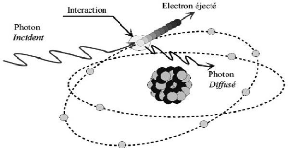
Figure 9 : Effet Compton [23]. 1.3.3.3.
Production de paires
C'est un processus par lequel, un photon incident
disparaît et son énergie se matérialisant au voisinage du
champ Coulombien d'un noyau pour donner naissance à un pair
électron - positron (figure 10).
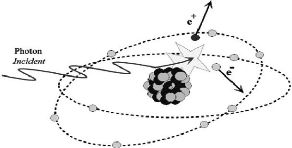
Figure 10 : Effet de matérialisation
[23].
Pour que ce processus ait lieu, le photon doit avoir une
énergie supérieure au seuil de création (e+,
e-), i.e. hv > 2×0,511MeV.
1.4. Spécification de la dose en
curiethérapie 1.4.1. Introduction
La spécification des quantités
dosimétriques est indispensable pour fournir des mesures physiques
reproductibles aux effets des radiations sur la matière.
1.4.2. Activité [17]
L'activité (A) est définie par le
nombre de désintégrations, qui se produisent dans la source par
unité de temps. L'unité appropriée pour exprimer
l'activité d'une source, est le Becquerel (Bq) tel que :
1 Bq = 1 désintégration par
seconde.
Cependant, la mesure de l'activité d'une
source présente des problèmes, en particulier pour une source
scellée, qui est une source enfermée dans une enveloppe
scellée ou munie d'un revêtement auquel elle est intimement
liée qui devait présenter une résistance suffisante pour
empêcher le contact direct avec la matière radioactive et la
dispersion de celle-ci dans les conditions pour laquelle elle a
été conçue (norme ISO 2919).
1.4.3. Activité apparente [17]
L'activité apparente (Aapp) d'une source
radioactive a été définie comme l'activité d'une
source ponctuelle du même radionucléide, qui délivre le
même débit de kerma dans l'air qu'une source réelle,
à une distance identique, sans effets d'autoabsorption et
d'atténuation, elle est exprimée par :
Aapp =
10_6 ( 1 ) ((Re-el (3)
l.36130/ r
Ou :
KR : le débit de kerma de référence
dans l'air ;
r2ref : la distance source
détecteur de rayonnement ; I' : la constante de
débit de kerma ;
10-6 : la constante de conversion
d'unité de (uGy) au (Gy) ;
( 3 1 0)
60 : la constante de conversion d'unité de (h) au
(s).
Ou bien, quand le débit du kerma de
référence dans l'air est exprimé en (mGy/h) et le
rref est la distance est égale à 1 m.
AaPP = 10-6 ( 1 ) (Sk
3600 r ) (4)
Ou : Sk : l'air kerma strength. 1.4.4. Transfert
d'énergie [13]
Le transfert d'énergie des rayonnements ionisants
produit l'ionisation des particules secondaires.
1.4.4.1. Kerma
La quantité dénommée (Kerma)
« Kinetic Energy Released in Matter », traduit le premier acte du
transfert d'énergie, à savoir la mise en mouvement par collision
des particules secondaires. Le Kerma est le quotient :
dE
·
K = cm (5)
dm
Où Ecin
représente la somme des énergies cinétiques initiales de
toutes les particules chargées mise en mouvement par les rayonnements
dans le volume de référence de masse dm.
Le Kerma s'exprime en J kg-1. Son
unité dans le SI « Système Internationale » est le Gray
(Gy) [2].
Le débit de Kerma se exprime par :
K
· d
K = dt (6)
Il s'exprime en Gy s-1.
1.4.4.2. Exposition
Cette quantité est définie dans les
recommandations de (ICRU) « International Commission on Radiation Units
and measurments », comme le quotient de la charge par la masse
:
~'
& ~ (7)
~#
dQ : charge électrique des ions de même
signe produit dans l'air ; dm : masse de l'air.
L'exposition s'exprime en Roentgen (R), qui correspond
à la création de 2,58 10-4 Coulombs (C) dans 1Kg
d'air.
Le débit d'exposition est défini comme
:
dx
x = (8)
~%
Il s'exprime en R s-1 ou en C kg-1
s-1. 1.4.5. Dépôt d'énergie [13]
La déposition d'énergie des
rayonnements ionisants dans matière est un processus stochastique, donc
la valeur de ces quantités ne sont pas uniques mais elles suivent une
distribution de probabilité.
1.4.5.1. Energie déposée
L'énergie résultante d'une particule qui a
subit une seule interaction avec la matière est appelé
énergie déposée, elle est définie :
Ei = Ein - Eout + Q
(9)
Ein : l'énergie de la particule avant
l'interaction ; Eout : lénergie de particules
après l'interaction ;
Q : le changement qui se produit dans les
énergies du noyau et de toutes les particules impliquées dans
l'interaction.
L'énergie déposée est s'exprime en
Joule (J).
1.4.5.2. Dose absorbée
La dose absorbée représente la
quantité d'énergie absorbée, par unité de
matière :
~~-./
Dabs ~ (10)
dm
Le Kerma et la dose absorbée s'expriment avec
la même unité (Gy). Cependant ce n'est que lorsque
l'équilibre électronique est atteint dans le milieu que les
quantités Kerma et dose absorbée sont égales.
Par ailleurs, on appelle le débit de dose
absorbée, la quantité exprimée par la formule suivante
:
dDabs
)~ ~ (11)
~%
Elle s'exprime en Gy s-1.
1.4.6. Calcul du débit de dose dans l'eau
[24]
Les formules suivantes montrent comment calculer le
débit de dose dans l'eau
(1~water) dans un point (P), qui
est déduit du débit de kerma de référence dans
l'air
(~~ ref).
Le point (P) est entouré d'eau à distance
(d) d'une source ponctuelle.

Source ponctuelle
air air
distance d
P
Le débit de kerma au point (P) dans l'air, est
défini comme:
6~air(ctjr) = 'ref= d2
~ (12)

eau
P
air

distance d
Source ponctuelle
Pour le débit de kerma dans le point (P) dans un
petit volume d'eau, entouré d'air :
234
623489:;< ~
6789:;<= ?@AB C D7 (13)
Tel que :
r
gr water P
J
air est le ratio des coefficients du transfert de
l'énergie de masse moyens dans l'eau en
rapport de l'air. Ce ratio est presque
indépendant des énergies Gamma (y) et des rayons
(X) émissent par les radionucléides utilisés en
curiethérapie, sauf pour Iode125 et Paladium-103.
Sous conditions d'équilibre électroniques
:
bwater(air) = kwater(air). (1 -- g)
(14)
g : représente la fraction de l'énergie
des particules chargées (électrons) perdue comme des rayonnement
de "bremsstrahlung". Pour la curiethérapie, g peut être
négligé de manière à ce que :
AT

=
P
Pen (15)
P
D'ou, le débit de dose dans l'air est égal
au débit de kerma de référence :
234
123489:;< ~
645= ?@A~M = ~ d2 (16)
P air
Si le petit volume d'eau qui entoure le point (P) et
la source sont entourées d'eau (ou de tissu), il faut prend en
considération l'atténuation (absorption et dispersion) dans
l'eau.

eau
eau
distance d
P
Source ponctuelle
Un facteur de correction de l'atténuation
(p(d) est introduit, par conséquent.
D~water(water) =
D~water(air)
· T(d)
(17)
En résumé :
D~water(water) = kref
·
kref : débit de kerma de référence
;
|
pen water 1
· (p(d)
(18)
L p 1 air d2
|
|
Erteniwater
: ratio des coefficients d'absorption d'énergie
massique dans l'eau en
1 p -I air
rapport à l'air, pour le Cs-137 ce rapport est
égal à 1,112 ;
d12
: facteur géométrique (loi de l'inverse
carré) ;
(p(d) : transmission effective à travers
l'eau.
Cependant, la source a en réalité une
forme linéaire non pas ponctuelle, pour cette raison, il existe un
formalisme (TG-43) « TASK-GROUP N°43 » pour le calcul du
débit de dose de cette source.
Chapitre 2 : Assurance de qualité en
curiethérapie 2.1. Introduction
La curiethérapie consiste en l'implantation de
sources radioactives scellées. La diversité de la nature des
radioéléments employés, de leur énergie et de leur
activité, impose des règles d'implantation et d'utilisation
très strictes. Ces règles incluent une vérification des
caractéristiques physiques des sources radioactives, une assurance de
qualité des projecteurs de source et des systèmes informatiques
de planification et l'utilisation de systèmes dosimétriques
fiables et reproductibles.
2.2. Contrôle du dosimètre
La constance de la réponse (étalonnage)
du système dosimétrique, doit être vérifiée
par la mesure périodique d'une source de longue demi-vie, tel que
Cs-137. Il est important d'utiliser un détenteur spécial de
source, qui placera la source d'une manière reproductible
[14].
La chambre d'ionisation est un dosimètre
utilisé pour la mesure du débit de Kerma dans l'air, il est
très dépendant de l'emplacement et de l'orientation de la source.
Cette mesure périodique fournit un bon contrôle de qualité
du système de mesure.
2.3. Contrôle des sources et des applicateurs
2.3.1. Propriétés mécaniques
L'intégrité mécanique des
sources doit être régulièrement vérifiée par
une inspection visuelle, un test de fuites et une mesure
d'activité.
A cause de leur usage clinique
répété, les applicateurs subissent une
sévère manutention, nettoyage et stérilisation, pour cela,
ils doivent être habituellement contrôlés par inspection
visuelle et évaluation radiographique. Pour les applicateurs
gynécologiques il est indispensable de vérifier la structure de
la sonde utérine et les capsules vaginales [14].
2.3.2. Activité de la source
Le contrôle d'activité des sources d'une
longue demi-vie, doit être fait d'une manière que,
l'activité mesurée et l'activité calculée devraient
être comparées [14].
Les sources d'une courte demi-vie, utilisées
dans les implants temporaires ou permanents, devraient avoir leur
activité mesurée au moment de l'implant et comparée avec
la valeur donnée par le fabricant.
2.3.3. Contrôle des sources placées dans le
projecteur de sources
La position des sources placées dans
l'appareil de chargement différé dite de (afterloading), peut
être déterminée avec l'autoradiographie. Les sources
doivent êtres placées avec exactitude, ce qui aide à la
prédétermination de la longueur de la sonde utérine
[14].
L'usage des marqueurs radiographiques
appropriés et la combinaison de l'image radiographique avec une
autoradiographie est une méthode appropriée pour vérifier
le positionnement des sources.
2.4. Contrôle des projecteurs de sources
[17]
Tous les projecteurs de sources utilisés en
curiethérapie doivent être :
· Utilisés sous la responsabilité de
personnes qualifiées ;
· Soumis à une maintenance périodique
à intervalles prédéterminés ;
· Vérifiés périodiquement par
l'utilisateur ;
· Utilisés pour des applications
cliniques bien définies, reposant sur une prescription de traitement en
utilisant des sources radioactives dont les caractéristiques
dosimétriques sont connues.
Projecteurs de source à bas débit de dose
:
La période des contrôles de projecteur peut
être établie comme suit :
· Avant chaque nouveau traitement :
> Test d'alimentation électrique ;
> Test des voyants d'indication du traitement
;
> Test du contact de porte ;
> Test du système de surveillance d'ambiance
;
> Test d'intégrité des canaux et gaines
;
> Disponibilité des instructions en cas
d'urgence ;
> A la fin du traitement, vérification du
stockage des sources en position de sécurité.
· Semestriel :
> Contrôle complet du projecteur.
· Annuel :
> Maintenance associée à un
contrôle complet du projecteur. 2.5. Contrôle des radiations
diffusées
Toutes les sources d'usage gynécologique, sont
éprouvées par frottis pour éviter toute fuite des
radiations.
Après l'implantation des sources dans le
patient, un contrôle des radiations diffusées doit être
exécuté autour de la salle du traitement [14]. Le niveau des
radiations devrait être mesuré et enregistré. Ces
radiations devraient être très basses, elles ne doivent pas
dépasser 0.01 mSv/h.
2.6. Contrôle du programme de calcul par
ordinateur [17]
La majorité des calculs de dose pour les
applications de curiethérapie font appel aux systèmes de
planification dosimétrique informatisée (TPS) « Treatment
Planning System ».
Les possibilités de l'informatique ne doivent pas
faire perdre de vue que des erreurs ont pu se glisser dans la chaine des
opérations qui a conduit au résultat.
Le contrôle est à réaliser
régulièrement et chaque fois qu'une modification intervient dans
le programme de calcul (nouvelle version, base de données,
etc.).
Le contrôle doit être effectué
à différents niveaux :
· Contrôle des périphériques
:
> Calcul des coordonnées de points de position
connue à partir d'un relevé au digitaliseur sortie sur papier
d'une grille de dimensions données.
· Contrôle géométrique de la
reconstruction :
> Utilisation d'un fantôme rigide comportant
des fils métalliques et/ou des points de repères à des
positions connue ;
> Calcul des longueurs des fils et des
coordonnées des points à partir des clichés.
· Validation du calcul des doses
> Définition d'une source ponctuelle ou
rectiligne d'activité donnée restant en place pendant un temps
déterminé ;
> Calcul de la dose à différentes
distances de cette source ;
> Comparaison à des données de la
littérature ou à des calculs manuels ; >
Addition des doses pour une association de plusieurs sources
;
> Position des isodoses par rapport aux points de
calcul.
2.7. Programme d'assurance de qualité
[14]
Toutes les installations de curiethérapie,
devraient avoir un programme de gestion de qualité, avec des objectifs
bien définis, pour assurer un bon traitement. Le programme devrait
inclure des procédures écrites, enregistrées et
documentées pour chaque traitement.
Les principales stations de ce programme sont
:
· Une directive écrite d'acquiescement de
traitement ;
· Une claire identification du patient
;
· Une documentation de traitement et un calcul
apparenté ;
· Une identification et évaluation de toute
déviation involontaire de la prescription.
Chapitre 3 : Systèmes de prescription de la dose
en curiethérapie intracavitaire 3.1. Introduction
La curiethérapie intracavitaire du carcinome
du col utérin est l'une des techniques thérapeutiques les plus
efficaces, cette efficacité due principalement à deux facteurs,
les conditions anatomiques qui permettent l'insertion des sources au contact du
volume à traiter, et aussi à cause du gradient de la dose d'une
manière que les hautes doses sont délivrées au volume
cible et que la dose se baisse rapidement avec la distance. Cela a deux
conséquences pratiques : un avantage en rapport avec la protection des
organes à risque, mais une difficulté dans le traitement des
extensions lésionnaires.
Cependant, la spécification de la dose est la
principale difficulté pour cette technique thérapeutique, pour
cela des nombreux systèmes ont été imaginés. Deux
principaux systèmes les plus communément utilisés sont le
système de Manchester (Paterson-Parker 1948) et les recommandations de
l'ICRU 38 « International Commission on Radiation Units and Measurements,
Report 38, 1985 ».
3.2. Système de Manchester
Le système de Manchester spécifie la
dose à deux points : le point A et le point B, il évalue
également la dose aux OAR comme les points vessie et rectum. La
durée de l'implant est basée sur le taux de la dose reçue
par un point, dit point A qui est localisé à 2 centimètres
supérieur à l'os cervical et 2 centimètres latéral
au canal cervical. Un autre point, dit point B est défini
latéralement à 3 centimètre du point A (figure
11).
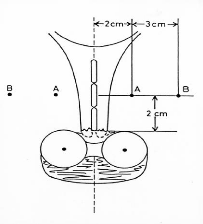
Figure 11 : Points A et B de Manchester (applicateur
de Fletcher) [21].
La technique de Manchester classique a
été basée sur l'utilisation d'une sonde
intrautérine avec deux longueurs standard de 4 centimètres et 6
centimètres ou une de longueur de 3.5 centimètres, et deux
capsules ovoïdales vaginales de différentes diamètres de 2
centimètres, 2.5 centimètres, ou 3 centimètres. Cependant,
l'angle entre la sonde intra-utérine et les capsules vaginales est un
angle droit contrairement à la structure anatomique utérine ce
qui fait que cette technique est abandonnée.
La technique moderne de Manchester est physiquement
semblable à la technique classique. Les sondes intra-utérines ont
les mêmes longueurs fixes sauf qu'elles sont orientées de 40
degrés en rapport des capsules vaginales, qui ont gardé leurs
formes ovoïdales.
3.2.1. Points de référence de dose
3.2.1.1. Dose au point A
Définition du point A
Le point A, dit point A de Manchester, est
relativement défini sur le film orthogonal antérieur à
l'applicateur (figure 12). Il est localisé à 2 centimètres
de la mi-ligne de la source intra-utérin qui coupe les sources vaginales
en deux et à 2 centimètres de la tangente des sources vaginales
[21, 25].
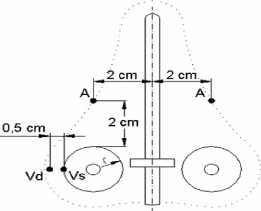
Figure 12 : Définition du point A de
Manchester (applicateur de Fletcher) [21].
Les concepts reliés aux points A de Manchester
ont été introduits dans les années 1934-1938. Depuis lors,
beaucoup modifications ont été présentées à
l'emplacement de ce point, ou au concept de ce point lui-même
[21].
Bien qu'il soit reconnu que le choix des points de
référence de dose est difficile à cause de la
décroissance de la dose autour des sources, le point A est
considéré comme un point de prescription de la dose pour la
curiethérapie intracavitaire du col de l'utérus. Cette
recommandation est justifiée par le fait que le point A est encore
utilisé pour la prescription de la dose dans une majorité de
centres dans le monde.
3.2.1.2. Dose au point B Définition du point
B
Le point B est défini à 5
centimètres de la mi-ligne de la source intra-utérine, c'est
à dire à 3 centimètres du point A (figure 13).
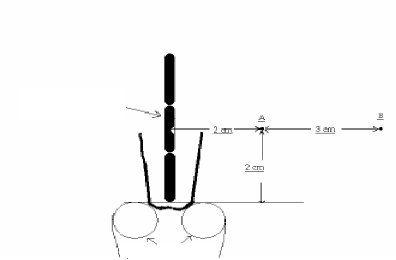
Sources intra-utérines
Applicateur vaginal
Figure 13 : Définition du point B de
Manchester (applicateur de Fletcher) [21]. 3.2.2. Points de
référence des organes à risque
Les complications cliniques d'une
curiethérapie intracavitaire du cancer utérin les plus
fréquentes, résultantes d'une haute dose délivrée
aux portions du rectum et de vessie qui sont aux proximités des sources.
L'emplacement de l'applicateur par rapport au rectum et vessie est très
important pour garder la dose à ces structures critiques aussi basse que
possible. Généralement, le gynécologue écarte les
structures sensibles de l'applicateur à l'aide d'un coton chirurgical,
pour déplacer les structures sensibles loin des applicateurs et
immobilise tout mouvement de ce dernier.
Définition
Dans la curiethérapie du carcinome utérin,
les organes les plus exposés aux risques d'irradiation sont le rectum,
la vessie, l'intestin et la paroi vaginale.
3.2.2.1. Point de référence de la vessie
[21]
La détermination du point de
référence de la vessie, se fait en rapport avec un ballon rempli
de 7 cm3 d'un fluide radio-opaque, introduit au niveau de la vessie
(figure 14).
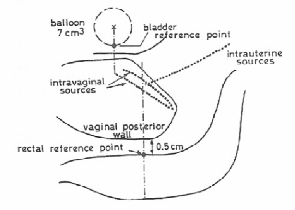
Figure 14 : Détermination des points de
référence de la vessie et du rectum comme
proposé par
Chassagne et Horiot [21].
3.2.2.2. Point de référence du
rectum
Le point de référence d'estimation de
la dose rectale (rectal reference point) est dépendent de l'applicateur,
il est localisé à 5 millimètres derrière la paroi
vaginale postérieur sur une ligne (AP) «
AntéroPostérieur » sortie du milieu des sources vaginales
(figure 14) [21, 25].
3.2.3. Volumes de référence 3.2.3.1.
Volume à traiter
Le volume à traiter est le volume qui a la forme
d'une poire (figure 15), il doit recevoir au moins la dose prescrite par le
radiothérapeute [21].
3.2.3.2. Volume du point A [21] 3.2.3.2.a.
Définition
Le volume du point A est le volume compris par
l'isodose qui passe par le point A, ce volume est recommandé pour
rapporter le rapport entre les dimensions du volume à traiter et celles
du volume réel (figure 15).
3.2.3.2.b. Recommandations du volume du point A
Les dimensions du volume de référence
devraient être rapportées comme indiqué dans (figure
15).
La géométrie de l'isodose passant par le
point A, définit les dimensions du volume du point A (la longueur, la
largeur et l'épaisseur).
3.2.3.3. Volume de la dose de référence
[21] 3.2.3.3.a. Définition
Le volume de référence est le volume
compris par l'isodose de référence, il est différemment
sélectionné et spécifié à cause des
différentes techniques utilisées et exécuté dans
les centres.
3.2.3.3.b. Recommandations du volume de la dose de
référence
La comparaison des volumes de référence
(le volume traité et le volume du point A) déterminés par
l'application des différentes techniques utilisées en
curiethérapie intracavitaire, doit correspondre aussi avec le PTV
respectif.
Cependant, pour une application donnée, les
dimensions du volume traité ou du volume du point A doivent êtres
rapportés à la dose prescrite pour définir ce volume.
Inversement, la dose ne peut pas être rapportée à ce volume
[21, 25].
3.2.3.4. Choix de la dose de référence
[21]
Premièrement, le choix de la dose de
référence implique un consensus entre les centres dans le but
d'introduire un concept de volume de référence.
Deuxièmement, le volume de
référence devrait être plutôt près du volume
à traiter.
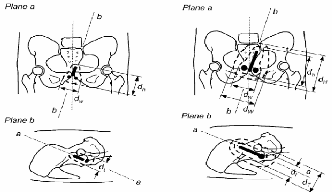
Figure 15 : Géométrie pour la mesure
des dimensions du volume dans le
traitement du carcinome du col de
l'utérus (volume à traité, volume du point A, et
volume
de la référence) dans le traitement carcinome du col de
l'utérus [21].
- Plan a : «plan frontal oblique», obtenu par
la rotation du plan frontal autour d'un axe transversal.
- Plan b : «plan sagittal oblique», obtenu par
la rotation du plan sagittal autour de l'axe AP.
La hauteur (dh) et la largeur (dw) de la poire forme
le volume de référence, comme les dimensions maximales
parallèle et perpendiculaire de l'applicateur utérin.
L'épaisseur du volume (dt) est mesurée dans le plan b comme la
dimension maximale perpendiculaire l'applicateur utérin.
dh, dw et dt font référence seulement
à l'application.
Dans le cas de combinaison de la brachytherapie avec la
radiothérapie externe, ces dimensions sont symbolisées par dH, dW
et dT, respectivement.
Dans le traitement défini au point A et/ou dans
le PTV2 (extension de la tumeur au temps) la gamme de dose totale est compris
entre 75 et 90 Gy (et au-dessus).
Par conséquent, on considère le volume de
référence, comme le volume compris par une plus haute isodose par
exemple le l'isodose 75% ou 85%.
3.2.4. Limites du système de Manchester
L'usage des points A et B du système de
Manchester, n'est pas toujours juste, car leurs significations exactes et leurs
définitions n'ont pas toujours été
interprétées de la même façon dans les
différents centres. Cette différence cause des différences
dans les valeurs de débit de dose calculé au point A.
L'autre limite de ce système, est
reliée à l'anatomie du col utérin (figure 16), puisque le
point A est déterminé par rapport à l'applicateur et non
pas par rapport à la structure anatomique du col utérin
[26].
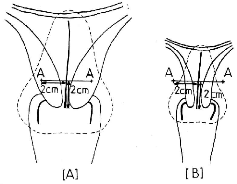
Figure 16 : Le point A de Manchester dans deux cas
de différentes tailles du col
utérin [26].
3.3. Système recommandé par l'ICRU
La commission internationale des grandeurs et des
unités radiométriques (ICRU) « International Commission on
Radiation Units and Measurements », a développé un langage
commun basé sur des concepts existants, afin de décrire «ce
qui a été fait» de manière compréhensible par
tous en relation avec les résultats du traitement.
L'ICRU dans son trente huitième rapport (ICRU 38)
concernant la spécification de la dose en curiethérapie
gynécologique a recommandé :
· La description de la technique utilisée
;
· Que la spécification de la dose au point A
de Manchester ne soit pas utilisée, par ce qu'il est situé dans
une région de haut gradient de dose ;
· Que les doses soient rapportées en termes
de débit de kerma de référence dans l'air, de la dose aux
tissus sains, et du volume de dose de référence.
3.3.1. Description de la technique
Les recommandations actuelles n'impliquent pas une
modification de la méthode employée pour le calcul de temps de
traitement, mais elles impliquent le calcul des quantités
spécifiques à déterminer.
L'ICRU 38 traite principalement le traitement du col
utérin, puisque la région anatomique est semblable pour chaque
patient et la variation possible dans la position des sources radioactives est
limitée.
L'ICRU 38 recommande que la technique soit décrite
sur la base des conseils donnés ci-dessous:
> Radionucléides utilisés ;
> Débit de kerma de référence
dans l'air ;
> Forme des sources, arrangement, filtration,
atténuation, etc. ; > Type d'applicateur
utilisé.
3.3.2. Le kerma de référence total dans
l'air
Le kerma de référence total dans l'air
(TRAK) « Total Reference Air Kerma » est mesuré à 1
mètre des sources radioactives, est égal au débit de kerma
de référence dans l'air multiplié par la durée
d'implant.
3.3.3. Points de référence de dose
3.3.3.1. Dose aux points qui ont un rapport avec les
structures osseuses
L'utilité de la détermination de la dose
aux points en rapport avec les structures osseuses bien définies et les
régions des noeuds lymphatiques se voit particulièrement quand la
curiethérapie est combinée avec la radiothérapie externe,
ou suivie par une chirurgie [21, 25].
3.3.3.2. Points de référence de la vessie et
du rectum
Dans les recommandations de l'ICRU 38, l'estimation de
la dose au niveau des organes critiques est réalisée à
l'aide des radiographies orthogonales standard de l'application (figure
14).
3.3.3.3. Dose aux points de la paroi pelvienne
[21]
Figure 17 : Détermination des points de la
paroi pelvienne (RPW / PPD = Paroi
Pelvienne Droite), (LPW / PPG = Paroi
Pelvienne Gauche) [21].
Le point de référence de dose de la paroi
pelvienne, est représente la dose absorbée aux noeuds lymphatique
de l'obturateur (figure 17).
3.3.3.4. Trapèze lymphatique de Fletcher
[21]
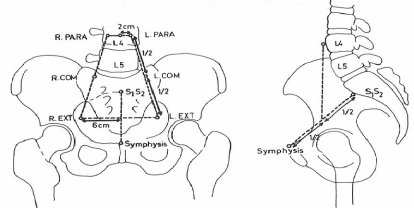
Figure 18 : Détermination du
trapézoïde lymphatique. Sur la gauche une vue
de
l'antéropostérieur et sur la droite une vue latérale
[21].
Les différents points identifiés au
moyen du trapèze lymphatique de Fletcher (figure 18) représentent
la dose absorbée au niveau d'iliaque externe, d'iliaque primitive et des
noeuds lymphatiques para-aortiques.
3.3.4. Volume de référence
3.3.4.1. Volume à traiter
3.3.4.1.a. Définition
Le volume à traiter a la même
définition pour tous les systèmes, c'est le volume
quidoit reçevoir au moins la dose prescrite (figure 15)
[21].
3.3.4.1.b. Recommandations du volume de
référence
Les trois dimensions (figure 15) du volume à
traiter devraient être rapportées séparément. Le
produit de ces dimensions orthogonales n'est pas recommandé comme un
volume à traité.
La dose sélectionnée pour définir le
volume traité peut être rapporté comme : - Une dose
prescrite, dont la valeur absolue est en (Gy) ;
- Un pourcentage de dose délivré à
des points de référence sélectionnés.
Deux volumes complémentaires peuvent être
définis, associés au volume à traiter [21].
3.3.4.1.c. Volume de dose élevée
Le volume de dose élevée correspond au
volume compris entre les isodoses (150% et 200 %) de la dose qui définit
le volume à traiter. Cependant, ce volume correspond aux cellules
radiorésistantes.
3.3.4.1.d. Volume irradié
Le volume irradié est le volume entourant le
volume à traiter, il est compris entre les isodoses (90% à 50%)
de la dose qui définit le volume à traiter. La
détermination du volume irradié est utile pour
l'interprétation des effets secondaires en dehors du volume à
traiter [21, 25].
3.3.4.2. Volume de la dose de référence
[21] 3.3.4.2.a. Définition
On a vu que le volume de référence est
le volume entouré par l'isodose de référence, mais la dose
sélectionnée pour définir ce volume impliquera un
consensus au niveau international ou au moins entre les centres, ce qui a
été réalisé par l'ICRU 38.
3.3.4.2.b. Choix de la dose de référence
[21]
Dans le traitement défini au point A de
Manchester, la gamme de dose de référence est comprise entre 75
et 90 Gy.
Cependant, dans les recommandations de l'ICRU 38,
l'isodose de référence est de 60 Gy. Cette dose est en effet
appropriée pour une curiethérapie exclusive (première), ou
pour une curiethérapie combinée avec chirurgie radicale. Dans
cette situation, la dose 60 Gy définit le volume à
traiter.
Le choix de 60 Gy comme dose de
référence ne définit pas le volume de
référence car il n'implique pas que cette dose est
recommandée comme dose thérapeutique optimale. C'est seulement
dans un but de comparaison du concept de volume de référence,
qu'elle a été introduite par l'ICRU 38 et elle est encore
recommandée (figure 19).
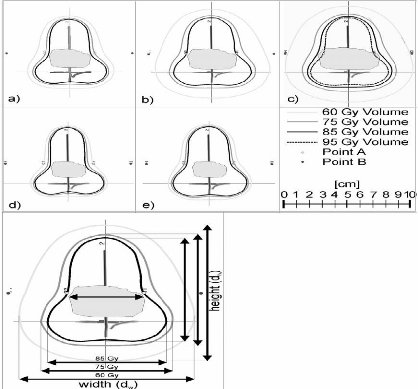
Figure 19 : Volume de référence pour
la curiethérapie du cancer du col de
l'utérus ; Rapporter des
volumes aux doses pour cinq différentes situations
cliniques
[15].
Pour les cas (a), (b) et (c) : curiethérapie
combinée à la radiothérapie externe, le volume à
traiter est défini par l'isodose 85 Gy ;
Pour les cas (d) et (e) : curiethérapie seule,
(d) préopératoire ; (e) curiethérapie exclusive
(Système de Manchester), le volume à traiter est défini
par les isodoses 60 et 75 Gy, respectivement.
La même technique d'application de la
curiethérapie est supposée pour tous les cas. 3.3.5. Temps
d'application
Pour une application gynécologique, l'ICRU 38
recommande pour le calcul du temps de traitement de prendre en
considération les effets biologiques de la dose sur les tissues sains.
On détermine ces effets biologiques et cliniques par rapport à la
dose prescrite [27].
3.3.6. Limites du système recommandé par
l'ICRU [27]
L'ICRU 38 utilise les dimensions largeur, hauteur, et
épaisseur de l'isodose de référence pour
l'évaluation du volume de distribution de la dose, ce qui laisse des
régions de sous dosage (figure 20).
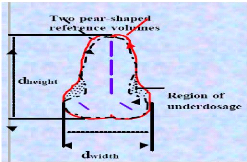
Figure 20 : Les dimensions de l'isodose de
référence et la région de sous
dosage
[27].
L'ICRU réexamine actuellement leurs
recommandations de spécification de la dose.
Dosimétrie en curiethérapie
gynécologique au 137Cs :
intercomparaison système de
Manchester et ICRU 38
Chapitre 4 : Matériel et méthodes 4.1.
Introduction
Notre étude est une analyse
rétrospective de la dosimétrie dans le traitement du cancer du
col de l'utérus en curiethérapie intracavitaire première
(60 Gy), elle porte sur 30 cas pris en charge dans les services de
radiothérapie de trois centres hospitaliers, durant une période
de 2 mois allant du 1er Mars au 1er Mai 2011.
Centre A : Centre Piere et Marie Curie (CPMC),
Alger.
Centre B : Centre Anti Cancer (CAC), Blida.
Centre C : Hôpital Central de l'Armé (HCA),
Ain Naadja - Alger. Sur les 30 cas, 7 dossiers étaient incomplets et
donc exclus de l'étude.
Le but de notre étude est de comparer nos
résultats en termes de dosimétrie réalisée sur la
base du système de Manchester (prescription au point A) et des
recommandations de l'ICRU 38 qui prône la prescription de la dose en
termes de volumes à traiter.
4.2. Matériel et méthodes
Il s'agit d'une étude rétrospective
multicentrique, incluant des patientes atteintes d'un cancer du col
utérin, traitées par curiethérapie première (60
Gy).
4.2.1. Matériel
4.2.1.1. Projecteur de sources
Dans les trois centres, nous avons
réalisé notre étude sur le même type de projecteur
de sources qu'est un projecteur de sources de Césium-137 de type
Curietron (Chapitre 1).
4.2.1.2. Applicateurs
Nous avons réalisés notre étude
sur des applicateurs de type Fletcher (Chapitre 1) de différentes
tailles (dépend de l'anatomie du col de la patiente) dans les centres A
et B. Le centre C, utilise des applicateurs de type Delouche (Chapitre
1).
4.2.1.3. Sources
Nous avons utilisé des sources de
Césium-137 (Chapitre 1). Cependant, les sources de Cs-137 se
présentent en réalité comme un train de sources, qui est
un assemblage de sources élémentaires disposées
régulièrement (figure 21).
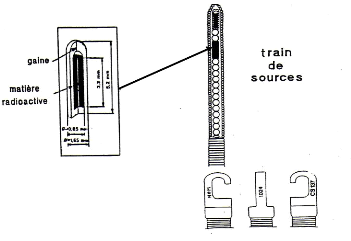
[A] [B]
Figure 21 : Source de Césium-137
formée de Sources élémentaires ;
[A] : Grains de Cs fournis par Cis-Bio
International, constituant l'élément de base
de trains de
sources,
[B] : Identification d'un train de sources
destiné à être utilisé dans un projecteur
de
sources.
4.2.1.3.a. Centre A
Dans le centre A, les sources de Cs-137, ont les
mêmes propriétés pour les patientes (A1, A2, A4, A5, A6,
A7, A8, A9, A10, A11).
|
Modèle de sources
|
Activité apparente (mCi)
(24 mars
2011)
|
Longueur totale (cm)
|
|
Cs UTE (60.9) 760-3/3
|
26,793
|
2,03
|
|
Cs UTE (60.9) 760-3/3
|
26,793
|
2,03
|
|
Cs UTE (60.9) 760-3/3
|
26,793
|
2,03
|
|
Cs VAG 756
|
47,838
|
2,04
|
|
Cs VAG 757
|
47,916
|
2,04
|
Pour la patiente (A3), nous avons utilisé des
sources de Cs, dont les propriétés sont les suivantes
:
|
Modèle de sources
|
Activité apparente (mCi)
(24 mars
2011)
|
Longueur totale (cm)
|
|
Cs UTE (70.9) 150-3/3
|
20,123
|
2,33
|
|
Cs UTE (70.9) 150-3/3
|
20,123
|
2,33
|
|
Cs UTE (70.9) 150-3/3
|
20,123
|
2,33
|
|
Cs VAG 756
|
47,829
|
2,04
|
|
Cs VAG 757
|
47,907
|
2,04
|
4.2.1.3.b. Centre B
Dans le centre B, les sources de Cs-137 ont
différentes propriétés.
Pour la patiente (B1), les sources de Cs utilisées
ont les propriétés suivantes :
|
Modèle de sources
|
Activité apparente (mCi)
(18 avril
2011)
|
Longueur totale (cm)
|
|
PCSM-3-U-172/3
|
26,036
|
2,70
|
|
PCSM-3-U-172/3
|
26,036
|
2,70
|
|
PCSM-3-U-172/3
|
26,036
|
2,70
|
|
PCSM-3-V-5/6
|
44,150
|
2,04
|
|
PCSM-3-V-5/6
|
44,150
|
2,04
|
Les sources de Cs utilisés dans la
dosimétrie des patientes (B2, B4), ont les propriétés
suivantes :
|
Modèle de sources
|
Activité apparente (mCi)
(18 avril
2011)
|
Longueur totale (cm)
|
|
PCSM-3-U-168/3
|
20,194
|
2,04
|
|
PCSM-3-U-168/3
|
20,194
|
2,04
|
|
PCSM-3-U-168/3
|
20,194
|
2,04
|
|
PCSM-3-V-5/6
|
44,148
|
2,04
|
|
PCSM-3-V-5/6
|
44,148
|
2,04
|
Pour les patientes (B3, B5, B6, B7) :
|
Modèle de sources
|
Activité apparente (mCi)
(18 avril
2011)
|
Longueur totale (cm)
|
|
PCSM-3-U-170/3
|
20,087
|
2,33
|
|
PCSM-3-U-170/3
|
20,087
|
2,33
|
|
PCSM-3-U-170/3
|
20,087
|
2,33
|
|
PCSM-3-V-5/6
|
44,150
|
2,04
|
|
PCSM-3-V-5/6
|
44,150
|
2,04
|
4.2.1.3.c. Centre C
Dans le centre C, les sources de Cs-137 ont les
mêmes propriétés :
|
Modèle de sources
|
Activité apparente (mCi)
( le 24 mars
2011)
|
Longueur totale (cm)
|
|
Cs UTE 51820 HCA/3
|
85,84
|
2,30
|
|
Cs UTE 51820 HCA/3
|
85,84
|
2,30
|
|
Cs UTE 51820 HCA/3
|
85,84
|
2,30
|
|
Cs Vag 51816 HCA
|
23,032
|
1,70
|
|
Cs Vag 51817 HCA
|
22,947
|
1,70
|
4.2.1.4. Appareil d'imagerie
Le système d'imagerie utilisé dans notre
travail (figure 22) sert à réaliser des radiographies de face et
de profil en position de traitement, pour vérifier la qualité de
l'application, notamment l'emplacement de l'applicateur et la longueur des
sources radioactives. Ce système est basé sur un box de
dimensions fixes « largeur (41,6 cm), hauteur (41,6 cm) et
épaisseur (48 cm) », et de deux repères plombés de
positionnement d'une distance (6 cm) qui nous aident à calculer le
facteur d'agrandissement des clichés.

Figure 22 : Appareil d'imagerie avec le box de
repérage. 4.2.1.5. Système de planification de
traitement
Le système de planification de traitement, est
le moyen d'obtenir les distributions de dose à l'intérieur des
volumes cibles et des organes critiques. Le hardware est constitué au
minimum, d'un digitaliseur, d'un micro-ordinateur (figure 23) et d'une
imprimante.

Figure 23 : Système de planification de
traitement.
4.2.2. Méthodes
Les patientes incluses dans notre étude ont
été déjà traitées. Nous avons donc
travaillé sur les dossiers qui comprennent les clichés de
repérage ainsi que tous les éléments physiques et
cliniques.
4.2.2.1. Déroulement de la curiethérapie LDR
du cancer du col utérin
Afin de mieux comprendre la chaine de traitement en
curiethérapie gynécologique, nous avons dû assister
à toutes les phases :
Quelle que soit la technique utilisée, la mise
en place du matériel intra-utérin et vaginal est effectuée
sous anesthésie générale ou rachi anesthésie
(localisée à la moitié du corps).
En salle d'application (bloc opératoire), le
médecin radiothérapeute procède à la mise en place
d'une sonde urinaire qui permet l'évacuation des urines durant toute la
durée du traitement.
Une sonde urinaire gonflée avec (7
cm3) de produit radio-opaque constitue le premier temps de
l'application, pour localiser la position de la vessie. Une sonde rectale munie
de repères plombés est mise en place, pour repérer le
rectum.
Après repérage de l'orifice et du trajet
intra-utérin, une dilatation progressive est effectuée permettant
la mise en place dans le vagin d'un dispositif appelé applicateur qui
comprend une sonde intra-utérine passe par le canal du col utérin
et un applicateur vaginal constitué de deux capsules (colpostats ou
ovoïdes) placés de part et d'autre du col de
l'utérus.
Des radiographies de face et de profil sont acquises
en position de traitement, pour vérifier la qualité de
l'application, notamment l'emplacement de l'applicateur et la longueur des
sources radioactives. Ces radiographies seront utilisées pour la
dosimétrie informatisée (dosimétrie à l'aide du
TPS).
4.2.2.2. Planification du traitement et
dosimétrie
À la fin de l'étape de mise en place des
sources fictives réalisée par le radiothérapeute, et avant
la validation du traitement, il est indispensable de faire une planification de
ce dernier, par le physicien médical en deux étapes.
4.2.2.2.a. Etape manuelle
Dans cette étape, nous déterminons les
différents points de référence, tout en prenant en
considération le facteur d'agrandissement des
clichés.
4.2.2.2.a.1. Points de référence A et B de
Manchester
Nous avons vu (Chapitre 3) la méthode suivie
concernant la détermination des points A et B de Manchester. Cependant,
cette méthode n'est valable que dans le cas d'une position parfaite de
l'applicateur en rapport du col utérin.
Dans notre étude, nous avons rencontré
ce problème dans la majorité des cas étudiés
où la sonde utérine ne s'allonge pas dans la mi-ligne de
l'utérus (figure 24), donc nous n'avons pas pu déterminer les
points A et B de Manchester. Pour cette raison, la détermination des
points A et B a été possible sur la base d'une méthode
dite `méthode des points A et B modifiés'.
Méthode des points A et B
modifiés
Le point A, est relativement défini sur le film
orthogonal antérieur à l'applicateur (Figure 25). Il est
localisé à 2 centimètres de la mi-ligne de la source
intra-utérine qui coupe les sources vaginales en deux et à 2
centimètres de la tangente des sources vaginales (figure 24). Cependant,
le point B qui ne dépend pas directement de la sonde utérine,
reste comme un point fixe, localisé à 5 centimètres
latéralement du point qui coupe les capsules vaginales en deux, et
à 2 centimètres en haut de la droite passant par ces
dernières.
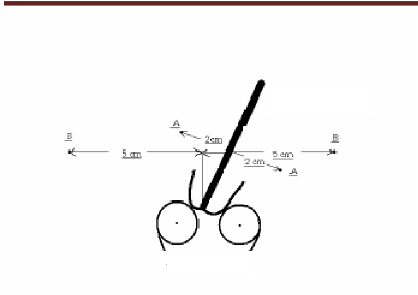
Sources intra-utérines
Applicateur vaginal
Figure 24 : Définition des points A et B
modifiés de Manchester. 4.2.2.2.a.2. Point de
référence de la vessie
La détermination du point de
référence de la vessie, est réalisée avec un ballon
rempli de 7 cm3 d'un fluide radio-opaque, introduit au niveau de la
vessie.
Sur la radiographie antéropostérieure
(Figue 25), le point de référence de la vessie (bladder reference
point) est pris au centre du ballon.
Sur la radiographie latérale (Figure 25), le point
est obtenu sur la même ligne antéropostérieur, mais
à la surface postérieure du ballon.
4.2.2.2.a.3. Point de référence du rectum
Le point de référence d'estimation de la
dose rectale (rectal reference point) est localisé à 5
millimètres derrière la paroi vaginale postérieure sur une
ligne AP sortie du milieu des sources vaginales.
Sur la radiographie latérale (Figure 25), une
ligne AP est dessinée de la limite inférieure de la source
utérine et le milieu des sources vaginales. L'utilisation du gaz
radio-opaque pour le vagin aide à la visualisation du mur vaginal
postérieur.
Sur la radiographie frontale (Figure 25), ce point est
pris à l'intersection de la limite inférieure de la source
utérine et le centre des sources vaginales.
4.2.2.2.a.4. Points de références de la paroi
pelvienne
Le point de référence de dose de la paroi
pelvienne, représente la dose absorbée aux noeuds lymphatiques de
l'obturateur.
Il peut être visualisé sur les radiographies
AP (AntéroPostérieur) et latérales. Il est
apparenté aux structures osseuses fixes.
Sur une radiographie AP (Figue 25), les points de
référence de la paroi pelvienne sont localisés à
l'intersection des lignes suivantes:
- une ligne horizontale tangentielle au plus haut point
de l'os pelvien, - une ligne verticale tangentielle à l'aspect
intérieur de l'os pelvien.
Sur une radiographie latérale (Figue 25), ils sont
localisés aux plus hauts points, à droite et à gauche de
l'os pelvien.
Le point de référence de la paroi pelvienne
est relié aux structures osseuses fixes, mais pas à l'applicateur
comme le point B.
4.2.2.2.a.5. Trapèze lymphatique de Fletcher
Les différents points identifiés au
moyen du trapèze lymphatique de Fletcher représentent la dose
absorbée au niveau de l'iliaque externe, de l'iliaque primitive et des
noeuds lymphatiques para-aortiques.
Le trapézoïde lymphatique (Figure 25) est
obtenu sur le cliché antéropostérieur comme suit
:
- une ligne jointive du point anatomique (S1S2) et de
la symphysis (S),
- une ligne médiale de l'aspect antérieur de
la quatrième lombaire (L4),
- deux points (IED, IEG), chacun se trouvant à
6 centimètres latéralement au milieu de la droite qui relie
(S1S2) et (S), employé pour estimer la dose aux noeuds lymphatiques
d'iliaque externe droit et gauche,
- deux points (IParaD, IParaG), chacun se trouvant
à 2 centimètres latéralement à la mi-ligne de (L4),
employé pour estimer la dose aux iliaques para-aortiques droit et
gauche,
- un trapèze est construit dans un plan qui
rejoint (IED, IParaD) et (IEG, IParaG) respectivement,
- le milieu de la ligne qui relie ces 2 points est
utilisé pour estimer la dose aux noeuds lymphatiques d'iliaque primitive
droit et gauche (IPD, IPG).

[B]
[A]
Figure 25 : Représentation des points de
référence d'une curiethérapie du cancer
du col
utérin ;
[A] : Cliché antérieur,
[B] :
Cliché latéral.
4.2.2.2.b. Etape informatisée
Dans cette étape on décrit les
algorithmes d'acquisition des clichés et de reconstruction des sources
utilisés par le système de planification « Theraplan plus
» pour l'établissement d'un plan de traitement en
curiethérapie.
Dans le planning en curiethérapie, une source
de rayonnement peut être introduite directement dans le système,
si la position de la source est connue. La distribution de la dose due à
cette source peut être calculée et affichée sur
écran ou imprimée.
Cependant, en général, la position
tridimensionnelle de la source n'est pas connue, ses coordonnées doivent
être déterminées. On utilise alors une méthode de
reconstruction basée sur l'imagerie par rayons-X de l'implantation, dans
les clichés de la patiente.
4.2.2.2.b.1. Système de coordonnées de
positionnement du patient Ce système est défini par l'ICRU
(Figure 26).
Figure 26 : système de coordonnées de
positionnement du patient.
Les vues : Antérieur (ANT), Latéral
(LAT) et Transversal (TRAN) sont définies par l'ICRU comme vues qui
regardent le patient le long des directions ZP, XP, et YP, respectivement. Ils
sont affichés comme les projections XP -Yp ,
YP-ZP et XP-ZP plan, respectivement. Les vues ANT, LAT et
TRAN sont seulement significatives dans le système de coordonnées
patient.
La curiethérapie fournit différentes
méthodes de reconstruction de la source. Dans tous les cas, le
digitaliseur est utilisé pour introduire des coordonnées de la
source issues des clichés de rayon-X dans le système. Quand une
source linéaire est impliquée, l'utilisateur digitalise les deux
points extrêmes et le système les reconstruit et calcule la
longueur reconstruite du centre de l'implantions.
4.2.2.2.b.2. Méthodes de reconstruction
On utilise des clichés et un digitaliseur, les
méthodes de reconstruction en curiethérapie nous permettent de
reconstruire la source. Plusieurs méthodes de reconstruction sont
utilisées. Chaque méthode de reconstruction tient compte de
l'agrandissement et utilise un algorithme géométrique. Parmi ces
méthodes ; deux sont utilisées en Algérie :
> Méthode de reconstruction avec deux
clichés orthogonaux
La méthode de reconstruction avec deux
clichés orthogonaux, est basée sur deux clichés
orientés dans les directions antéro-postérieur (AP) et
latérale (LAT). Le cliché AP représente une vue agrandie
du plan X-Y du patient et le cliché LAT représente une vue
agrandie du plan y-Z du patient.
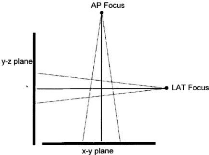
Figure 27 : la reconstruction
orthogonale.
On calcul les facteurs d'agrandissement des
clichés, qui dépendent des positions de source.
> Méthode de reconstruction avec deux
clichés orthogonaux avec jig
Pour cette méthode, les deux clichés
exigés pour la reconstruction de l'implantions sont acquis avec
l'utilisation du point jig en tenant compte des facteurs d'agrandissement, qui
dépendent des paramètres géométriques.
Les paramètres géométriques d'un
appareil de reconstruction avec jig, i.e.; le box de repérage est
décrit comme suit :
Les sources de rayons x sont placées aux positions
S1 et S2. Le box a une longueur BL (figure 28)
. Le jig est utilisé comme l'origine de la
reconstruction à une distance FID (distance jig cliché). Les
repères plombés de positionnement supérieurs et
inférieurs ont des images sur les clichés de l'implantation, le M
a deux images M1 et M2 sur les deux clichés, respectivement.
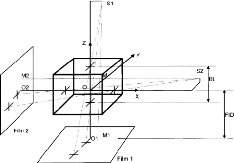
Figure 28 : La reconstruction avec deux
clichés orthogonaux avec jig.
Pour le premier cliché, la source S1 a des
coordonnées (X0, Y0, Z0). Le repère plombé de
positionnementsupérieur sur le jig a des coordonnées (0, 0, BL/2)
et son image a des coordonnées (X1, Y1,-
FID). De la même façon, le repère
plombé de positionnement inférieur sur le jig a des
coordonnées (0, 0,-
BL/2) et son image a des
-FID).
coordonnées (X2, Y2,
Comme mentionné ci-
dessus, l'utilisateur utilise en particulier le box
(jig) dans la détermination des paramètres
géométriques. Le système laisse à l'utilisateur le
choix de la méthode de détermination de ces
paramètres.
4.2.2.3. Choix de l'isodose de référence
Le choix de l'isodose de référence qui
représente cent pour cent de la dose optimale, dépend de la
méthode adoptée par le centre.
4.2.2.3.a. Méthode locale
L'isodose de référence pour les
méthodes locales, est l'isodose passant par deux points de distance (d =
1,5 cm) du centre des sources vaginales sur la distribution des isodoses
antéro-postérieur (figure 29).
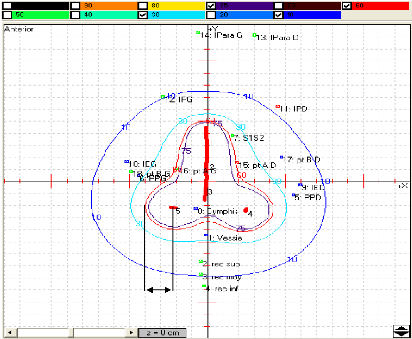
d = 1,5 cm
Figure 29 : Isodose de référence
choisie sur la base de la méthode locale.
4.2.2.3.b. Méthode recommandée par l'ICRU
38
L'isodose de référence
recommandée par l'ICRU 38, est l'isodose définie par les
dimensions (hauteur (dh), largeur (dw) dans la distribution des isodoses
antéropostérieur, et épaisseur (dt) dans la distribution
latérale) (figure 30), telle que les valeurs de ces dimensions soient
approximativement :
dh = 9,4 cm ; dw = 6,7 cm ; dt = 3,2 cm.
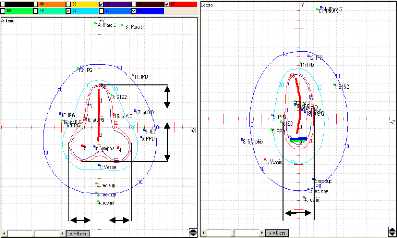
dw
dh
dt
Figure 30 : Isodose de référence
choisie sur la base des recommandations de
l'ICRU 38.
4.2.2.3.c. Méthode de Manchester
Le système de Manchester recommande pour le
choix de l'isodose de référence, que cette isodose passe par le
point A, sur la distribution des isodoses en antéropostérieur
(figure 31).
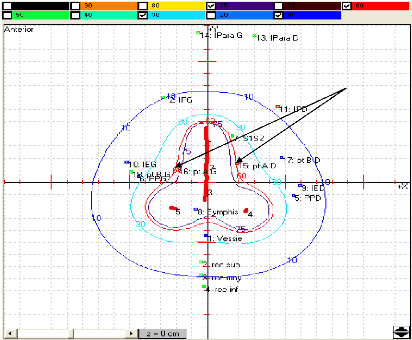
Point A
Figure 31 : Isodose de référence
choisie sur la base de la méthode de Manchester.
4.2.2.4. Calcul du temps de traitement
Après le choix de l'isodose de reference, nous
calculons le temps de l'application par la division de la dose prescrite (60Gy
pour notre cas) sur l'isodose de reference choisie.
> Exemple, pour la patiente A1 (methode locale) :
la dose prescrite (60 Gy), l'isodose de reference (80 cGy/h), ce qui nous a
donne un temps de traitement de 75 heures.
4.2.2.5. Calcul des écarts moyens des doses revues
par les organes à risque
L'ecart moyen des doses reçues par les OAR pour
chaque centre et selon les trois methodes, ont ete calcules
particulièrement au niveau de la vessie et du rectum. Pour calculer
l'ecart moyen des doses reçues par un organe à risque, nous avons
calcule la dose moyenne de cet organe selon les trois methodes, pour les trois
centres :
4.2.2.5.a. Ecart moyen (1) :
Ecart moyen entre la dose reçue par l'organe
à risque, selon les recommandations de l'ICRU 38 en rapport à
celle obtenue par la methode locale.
locale * 100
kart moyen 1 (%) = D (
(. , 7710y) law 38-- D(moy)
(19)
D(may) ICRU 38
4.2.2.5.b. Ecart moyen (2) :
Ecart moyen entre la dose reçue par l'organe
à risque, selon la methode de Manchester en rapport à celle
obtenue par la methode locale.
D(rnoy)Manchester-- D (7noy) locale
* 100
kart moyen 2 (%) = (20)
D(7oy) Manchester
4.2.2.5.c. Ecart moyen (3) :
Ecart moyen entre la dose reçue par l'organe
à risque, selon les recommandations de l'ICRU 38 en rapport à
celle obtenue par la methode de Manchester.
%nay) law 38-- %nay) Manchester
kart moyen 3 (%) =* 100 (21)
D(moy) ICRU 38
Chapitre 5 : Résultats et discussion
5.1. Résultats
5.1 .1. Choix de l'isodose de
référence
Nous avons obtenus à propos du choix
de
l'isodose de référence, dans chaque centre
:
et pour chaque méthode, les résultats
suivants
5.1.1.1. Centre A
|
Identification
de la patiente
|
Méthode locale
(cGy/h)
|
Recommandations de
l'ICRU 38 (cGy/h)
|
Méthode de Manchester
(cGy/h)
|
|
Patiente A1
|
80
|
60
|
65
|
|
Patiente A2
|
75
|
55
|
60
|
|
Patiente A3
|
70
|
60
|
50
|
|
Patiente A4
|
80
|
60
|
60
|
|
Patiente A5
|
60
|
NA
|
50
|
|
Patiente A6
|
80
|
55
|
60
|
|
Patiente A7
|
80
|
60
|
65
|
|
Patiente A8
|
75
|
70
|
75
|
|
Patiente A9
|
80
|
60
|
55
|
|
Patiente A10
|
80
|
60
|
65
|
|
Patiente A11
|
80
|
55
|
55
|
Tableau 3 : Isodoses de référence des
patientes du centre A, selon les trois méthodes.
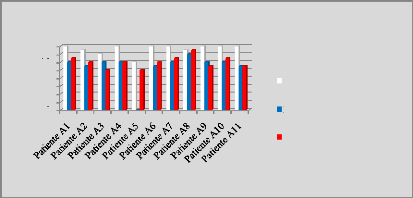
Isodoses de reference (cGy/h)
70
40
60
50
30
20
80
10
0
Identification des patientes
Centre A
Méthode locale
Méthode de Manchester
Recommandations de l'ICRU 38
Figure 32
: Histogramme des isodoses de
référence des patientes du centre A, selon
les trois méthodes.
5.1.1.2. Centre B
|
Identification
de la patiente
|
Méthode locale
(cGy/h)
|
Recommandations de
l'ICRU 38 (cGy/h)
|
Méthode de Manchester
(cGy/h)
|
|
Patiente B1
|
85
|
70
|
60
|
|
Patiente B2
|
70
|
65
|
55
|
|
Patiente B3
|
40
|
75
|
40
|
|
Patiente B4
|
90
|
60
|
40
|
|
Patiente B5
|
50
|
60
|
50
|
|
Patiente B6
|
50
|
60
|
50
|
|
Patiente B7
|
80
|
65
|
40
|
Tableau 4: Isodoses de référence des
patientes du centre B, selon les trois méthodes.
Centre B
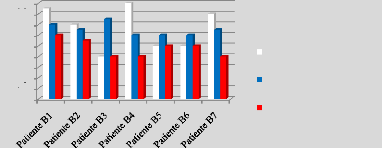
Méthode locale
Recommandations de l'ICRU 38
Méthode de Manchester
Isodoses de reference (cGy/h)
40
90
70
60
50
20
80
30
10
0
Identification des patientes
Figure 33
: Histogramme des isodoses de
référence des patientes du centre B, selon
les trois méthodes.
5.1.1.3. Centre C
|
Identification
de la patiente
|
Méthode locale
(cGy/h)
|
Recommandations de
l'ICRU 38 (cGy/h)
|
Méthode de Manchester
(cGy/h)
|
|
Patiente C1
|
60
|
80
|
110
|
|
Patiente
|
70
|
70
|
115
|
|
Patiente C3
|
60
|
70
|
115
|
|
Patiente C4
|
55
|
60
|
130
|
|
Patiente C5
|
70
|
70
|
110
|
Tableau 5
: Isodoses de référence des patientes
du centre C, selon les trois méthodes.
Centre C
|
Isodoses de reference (cGy/h)
|
140 120 100 80 60 40 20
0
|
|
Méthode locale
Recommandations de l'ICRU 38
Méthode de Manchester
|
Patiente Patiente Patiente Patiente Patiente
C1 C3 C4
C5
Identification des patientes
Figure 34
: Histogramme des isodoses de
référence des patientes du centre C, selon
les trois méthodes.
5.1. 2. Temps de traitement
De l'isodose de référence choisie
découle
le temps de traitement, dans chaque centre sont les
suivants :
et pour chaque méthode, les
résultats
5.1.2.1. Centre A
|
Identification
de la patiente
|
Méthode locale
(h)
|
Recommandations de
l'ICRU 38 (h)
|
Méthode de Manchester
(h)
|
|
Patiente A1
|
75
|
100
|
92,3
|
|
Patiente A2
|
80
|
109
|
100
|
|
Patiente A3
|
85,7
|
100
|
120
|
|
Patiente A4
|
75
|
100
|
100
|
|
Patiente A5
|
100
|
NA
|
120
|
|
Patiente A6
|
75
|
109
|
100
|
|
Patiente A7
|
75
|
100
|
92,3
|
|
Patiente A8
|
80
|
85,7
|
80
|
|
Patiente A9
|
75
|
100
|
109
|
|
Patiente A10
|
75
|
100
|
92,3
|
|
Patiente A11
|
75
|
109
|
109
|
Tableau 6 : Temps de traitement des patientes du
centre A, selon les trois méthodes.
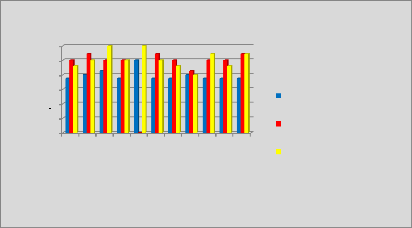
Temps de traitement (h)
120
100
40
60
20
80
0
Patiente Al Patiente A2 Patiente A3 Patiente A4 Patiente A5
Patiente A6 Patiente A7 Patiente A8 Patiente A9 Patiente A 1 0 Patiente All
Identification des patientes
Centre A
Méthode locale
Méthode de Manchester
Recommandations de l'ICRU 38
Figure 35
: Histogramme des temps de traitement des patientes
du centre A, selon
les trois méthodes.
5.1.2.2. Centre B
|
Identification
de la patiente
|
Méthode locale
(h)
|
Recommandations de
l'ICRU 38 (h)
|
Méthode de Manchester
(h)
|
|
Patiente B1
|
70,5
|
85,7
|
100
|
|
Patiente B2
|
85,7
|
92,3
|
109
|
|
Patiente B3
|
150
|
80
|
150
|
|
Patiente B4
|
66,6
|
100
|
150
|
|
Patiente B5
|
120
|
100
|
120
|
|
Patiente B6
|
120
|
100
|
120
|
|
Patiente B7
|
75
|
92,3
|
150
|
Tableau 7 : Temps de traitement des patientes du
centre B, selon les trois méthodes.
Centre B
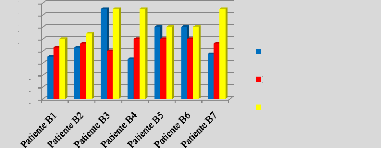
Méthode locale
Recommandations de l'ICRU 38
Méthode de Manchester
Temps de traitement (h)
160
140
120
100
40
60
20
80
0
Identification des patientes
Figure 36
: Histogramme des temps de traitement des patientes
du centre B, selon
les trois méthodes.
5.1.2.3. Centre C
|
Identification
de la patiente
|
Méthode locale
(h)
|
Recommandations de
l'ICRU 38 (h)
|
Méthode de Manchester
(h)
|
|
Patiente C1
|
100
|
75
|
54,5
|
|
Patiente
|
85,7
|
85,7
|
52,1
|
|
Patiente C3
|
100
|
85,7
|
52,1
|
|
Patiente C4
|
109
|
100
|
46,1
|
|
Patiente C5
|
85,7
|
85,7
|
54,5
|
Tableau 8 : Temps de traitement des patientes du
centre C, selon les trois méthodes.
Centre C
|
Temps de traitement (h)
|
120 100 80 60
|
|
|
Méthode locale
|
|
40 20 0
|
|
Recommandations de l'ICRU 38
|
|
Méthode de Manchester
|
Patiente Patiente Patiente Patiente Patiente
C1 C3 C4
C5
Identification des patientes
Figure 37
: Histogramme des temps de traitement des patientes
du centre C, selon
les trois méthodes.
5.1.3. Doses aux organes à risque
La détermination de
la dose reçue au niveau des organes à
risque, dans chaque centre donne les résultats suivants :
et pour chaque méthode,
5.1.3.1 . Dose au point de référence de la
vessie (Tolérance D max = 65 Gy) 5.1.3.1.a. Centre A
|
Identification
de la patiente
|
Méthode loc ale
(Gy)
|
Recommandations de
l'ICRU 38 (Gy)
|
Méthode de Manchester
(Gy)
|
|
Patiente A1
|
17,593
|
23,458
|
21,651
|
|
Patiente A2
|
10,962
|
14,887
|
13,658
|
|
Patiente A3
|
5,587
|
6,52
|
7,824
|
|
Patiente A4
|
12,036
|
16,048
|
16,048
|
|
Patiente A5
|
18,558
|
NA
|
22,269
|
|
Patiente A6
|
21,353
|
31,033
|
28,471
|
|
Patiente A7
|
16,332
|
21,776
|
20,099
|
|
Patiente A8
|
8,7
|
9,32
|
8,7
|
|
Patiente A9
|
32,868
|
43,824
|
47,768
|
|
Patiente A10
|
25,614
|
34,152
|
31,522
|
|
Patiente A11
|
11,128
|
16,173
|
16,173
|
Tableau 9 : Doses reçues par la vessie pour
les patientes du centre A, selon les trois
méthodes.
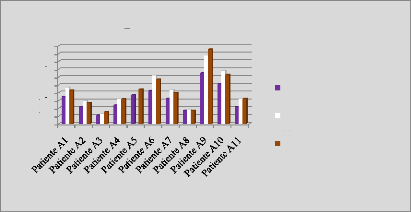
Doses recue (Gy)
45
40
50
25
20
35
30
15
10
5
0
Dose au point de référence de la
vessie
Identification des patientes
Méthode locale
Recommandations de l'ICRU 38
Méthode de Manchester
Figure 38
: Histogramme des doses reçues par la vessie
pour les patientes du centre
A, selon les trois méthodes.
5.1.3.1.b. Centre B
|
Identification de
la patiente
|
Méthode locale
(Gy)
|
Recommandations de
l'ICRU 38 (Gy)
|
Méthode de
Manchester (Gy)
|
|
Patiente B1
|
55,554
|
67,531
|
78,8
|
|
Patiente B2
|
26,639
|
28,691
|
33,882
|
|
Patiente B3
|
25,098
|
13,385
|
25,098
|
|
Patiente B4
|
12,644
|
18,986
|
28,479
|
|
Patiente B5
|
33,914
|
28,262
|
33,914
|
|
Patiente B6
|
22,932
|
19,11
|
22,932
|
|
Patiente B7
|
12,639
|
15,555
|
25,279
|
Tableau 10
: Doses reçues par la vessie pour les
patientes du centre B, selon les
trois méthodes.
Dose au point de référence de la
vessie
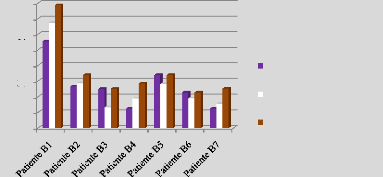
Méthode locale
Recommandations de l'ICRU 38
Méthode de Manchester
Doses recue (Gy)
40
70
60
50
20
80
30
10
0
Identification des patientes
Figure 39
: Histogramme des doses reçues par la vessie
pour les patientes du centre
B, selon les trois méthodes.
5.1.3.1.c. Centre C
|
Identification de
la patiente
|
Méthode locale
(Gy)
|
Recommandations de
l'ICRU 38 (Gy)
|
Méthode de
Manchester (Gy)
|
|
Patiente C1
|
12,134
|
9,1
|
6,613
|
|
Patiente
|
15,617
|
15,617
|
9,494
|
|
Patiente C3
|
34,008
|
29,144
|
17,718
|
|
Patiente C4
|
17,119
|
15,706
|
7,24
|
|
Patiente C5
|
16,141
|
16,141
|
10,265
|
Tableau 11
: Doses reçues par la vessie pour les
patientes du centre C, selon les
trois méthodes.
Dose au point de référence de la
vessie
|
Doses recue (Gy)
|
35 30 25 20 15 10 5 0
|
|
Méthode locale
Recommandations de l'ICRU 38
Méthode de Manchester
|
Patiente Patiente Patiente Patiente Patiente
C1 C3 C4
C5
Identification des patientes
Figure 40
: Histogramme des doses reçues par la vessie
pour les patientes du centre
C, selon les trois méthodes.
5.1.3.1.d. Ecart moyen de la dose reçue par la
vessie entre les trois centres
|
Identification des
centres
|
Ecart moyen 1 (%)
(ICRU 38/locale)
|
Ecart moyen 2 (%)
(Manchester/locale)
|
Ecart moyen 3 (%)
(ICRU 38/Manchester)
|
|
Centre A
|
24,351
|
22,823
|
1,979
|
|
Centre B
|
1,09
|
23,738
|
29,689
|
|
Centre C
|
10,862
|
85,106
|
40,108
|
Tableau 12 : Ecarts moyens de la dose reçue
par la vessie entre les trois centres.
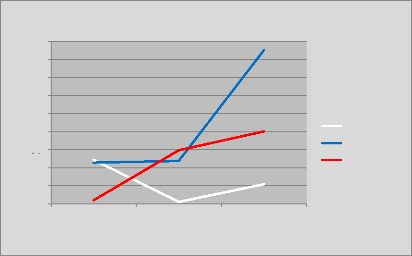
Ecart moyen (%)
40
90
70
60
50
20
80
30
10
0
Ecart moyen de la dose reçue par la
vessie
Centre A Centre B Centre C
Identification des centres
Ecart moyen 1
Ecart moyen 2
Ecart moyen
3
Figure 41 : Courbe des écarts moyens de la
dose reçue par la vessie entre les trois
centres.
5.1.3.2. Dose aux points de référence du
rectum (Tolérance D max = 60 Gy) 5.1.3.2.a. Centre A
|
Identification
de la patiente
|
Méthode locale
(Gy)
|
Recommandations de
l'ICRU 38 (Gy)
|
Méthode de Manchester
(Gy)
|
|
Patiente A1
|
16,429
|
21,714
|
20,219
|
|
Patiente A2
|
10,834
|
14,761
|
13,543
|
|
Patiente A3
|
9,168
|
10,698
|
11,66
|
|
Patiente A4
|
15,104
|
20,139
|
20,139
|
|
Patiente A5
|
17,448
|
NA
|
20,937
|
|
Patiente A6
|
5,709
|
8,298
|
7,613
|
|
Patiente A7
|
18,897
|
25,197
|
23,256
|
|
Patiente A8
|
10,492
|
11,24
|
10,492
|
|
Patiente A9
|
17,972
|
23,963
|
26,119
|
|
Patiente A10
|
26,424
|
35,233
|
32,52
|
|
Patiente A11
|
48,075
|
69,87
|
69,87
|
Tableau 13
: Doses reçues par le rectum pour les
patientes du centre A, selon les
trois méthodes.
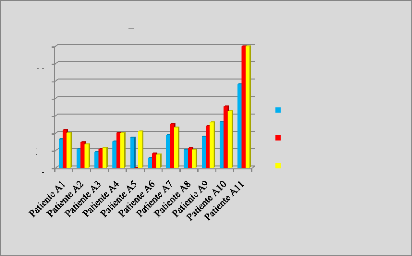
Doses recue (Gy)
40
70
60
50
20
30
10
0
Dose aux points de référence du
rectum
Identification des patientes
Méthode locale
Recommandations de l'ICRU 38
Méthode de Manchester
Figure 42
: Histogramme des doses reçues par le rectum
pour les patientes du
centre A, selon les trois
méthodes.
5.1.3.2.b. Centre B
|
Identification de
la patiente
|
Méthode locale
(Gy)
|
Recommandations de
l'ICRU 38 (Gy)
|
Méthode de Manchester
(Gy)
|
|
Patiente B1
|
29,726
|
36,135
|
42,165
|
|
Patiente B2
|
29,197
|
31,446
|
37,136
|
|
Patiente B3
|
23,44
|
12,501
|
23,44
|
|
Patiente B4
|
12,42
|
18,649
|
27,973
|
|
Patiente B5
|
24,789
|
20,658
|
24,789
|
|
Patiente B6
|
9,324
|
7,77
|
9,324
|
|
Patiente B7
|
30,726
|
37,814
|
61,453
|
Tableau 14
: Doses reçues par le rectum pour les
patientes du centre B, selon les
trois méthodes.
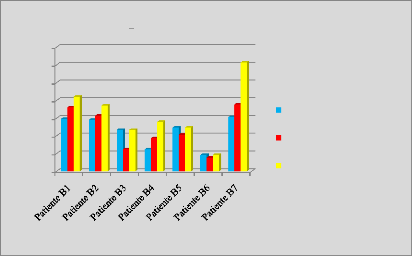
Doses recue (Gy)
70
40
60
50
30
20
10
0
Dose aux points de référence du
rectum
Identification des patientes
Méthode locale
Méthode de Manchester
Recommandations de l'ICRU 38
Figure 43
: Histogramme des doses
reçues par le rectum pour les patientes du
centre B, selon les trois méthodes.
5.1.3.2.c. Centre C
L'application de la curiethérapie dans le centre
C, ne tient pas compte de l'i mplantation de la sonde rectale au moment du
traitement de ces patientes.
5.1.3.2.d. Ecart moyen de la dose reçue par le
rectum entre les trois centres
|
Identification
des centres
|
Ecart moyen 1 (%)
(ICRU 38/locale)
|
Ecart moyen 2 (%)
(Manchester/locale)
|
Ecart moyen 3 (%)
(ICRU 38/Manchester)
|
|
Centre A
|
25,892
|
23,333
|
3,338
|
|
Centre B
|
3,241
|
29,457
|
37,162
|
|
Centre C
|
NA
|
NA
|
NA
|
Tableau 15 : Ecarts moyens de la dose reçue
par le rectum entre les trois centres.
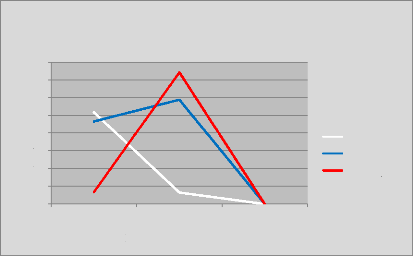
Ecart moyen (%)
40
25
20
35
30
15
10
5
0
Ecart moyen de la dose reçue par le
rectum
Centre A Centre B Centre C
Identification des centres
Ecart moyen 1
Ecart moyen 2
Ecart moyen
3
Figure 44 : Courbe des écarts moyens de la
dose reçue par le rectum entre les trois
centres.
5.1.4. Doses aux points spécifiques
5.1.4.1. Doses aux points spécifiques de la paroi
pelvienne 5.1.4.1.a. Centre A
|
Identification
de la patiente
|
Point de la paroi
pelvienne
|
Méthode
locale (Gy)
|
Recommandations
de l'ICRU 38 (Gy)
|
Méthode de
Manchester (Gy)
|
|
Patiente A1
|
Droite
|
8,943
|
11,925
|
11,006
|
|
Gauche
|
7,59
|
10,121
|
9,341
|
|
Patiente A2
|
Droite
|
9,964
|
13,575
|
12,455
|
|
Gauche
|
11,991
|
16,338
|
14,989
|
|
Patiente A3
|
Droite
|
11,29
|
13,174
|
15,808
|
|
Gauche
|
5,169
|
6,032
|
7,238
|
|
Patiente A4
|
Droite
|
6,517
|
8,69
|
8,69
|
|
Gauche
|
12,18
|
16,241
|
16,241
|
|
Patiente A5
|
Droite
|
12,045
|
NA
|
14,454
|
|
Gauche
|
18,131
|
NA
|
21,757
|
|
Patiente A6
|
Droite
|
9,384
|
13,638
|
12,512
|
|
Gauche
|
16,224
|
23,579
|
21,633
|
|
Patiente A7
|
Droite
|
12,794
|
17,059
|
15,745
|
|
Gauche
|
9,626
|
12,835
|
11,846
|
|
Patiente A8
|
Droite
|
7,682
|
8,229
|
7,682
|
|
Gauche
|
10,274
|
11,006
|
10,274
|
|
Patiente A9
|
Droite
|
9,168
|
12,224
|
13,324
|
|
Gauche
|
6,188
|
8,251
|
8,993
|
|
Patiente A10
|
Droite
|
8,014
|
10,686
|
9,863
|
|
Gauche
|
7,983
|
10,644
|
9,824
|
|
Patiente A11
|
Droite
|
11,181
|
16,249
|
16,249
|
|
Gauche
|
5,183
|
7,532
|
7,532
|
Tableau 16 : Doses reçues par les parois
pelviennes pour les patientes du centre A,
selon les trois
méthodes.
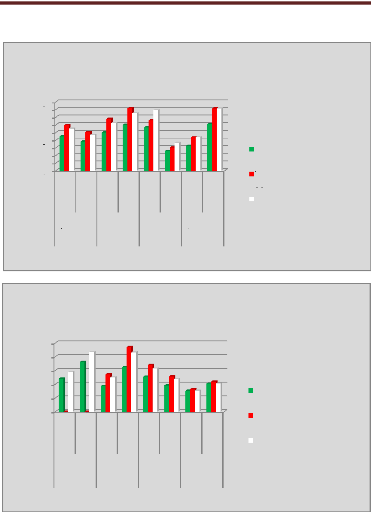
18
16
14
12
10
8
6
Méthode locale
4
2
0
Patiente
A1
Patiente
A2
Patiente
A3
Patiente
A4
Droite
Gauche
Droite
Gauche
Droite
Gauche
Droite
Gauche
Doses recue (Gy)
Doses aux points spécifiques de la
paroi
pelvienne
Identification des patientes
Méthode de Manchester
Recommandations de l'ICRU 38
Doses aux points spécifiques de la
paroi
pelvienne
Méthode locale
Recommandations de l'ICRU 38
Méthode de Manchester
Droite
Gauche
Droite
Gauche
Droite
Gauche
Droite
Gauche
|
Patiente
|
Patiente
|
Patiente
|
Patiente
|
|
A5
|
A6
|
A7
|
A8
|
Identification des patientes
25
20
15
10
5
0
Doses recue (Gy)
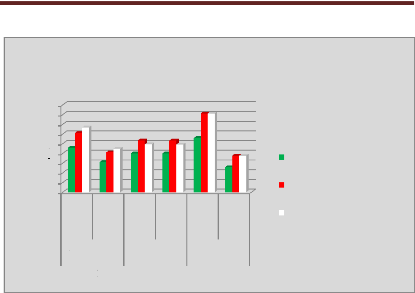
Doses aux points spécifiques de la
paroi
pelvienne
Méthode locale
Recommandations de l'ICRU 38
Méthode de Manchester
Droite
Gauche
Droite
Gauche
Droite
Gauche
Patiente A9
Patiente A10
Patiente A11
Identification des patientes
18
16
14
12
10
8
6
4
2
Doses recue (Gy)
0
Figure 45
: Histogramme des doses reçues par les parois
pelviennes pour les
patientes du centre A, selon les trois
méthodes.
5.1.4.1.b. Centre B
|
Identification
de la patiente
|
Point de la paroi
pelvienne
|
Méthode
locale (Gy)
|
Recommandations
de l'ICRU 38 (Gy)
|
Méthode de
Manchester (Gy)
|
|
Patiente B1
|
Droite
|
7,62
|
9,263
|
10,809
|
|
Gauche
|
6,152
|
7,479
|
8,727
|
|
Patiente B2
|
Droite
|
12,147
|
13,082
|
15,449
|
|
Gauche
|
6,673
|
7,187
|
8,487
|
|
Patiente B3
|
Droite
|
16,558
|
8,831
|
16,558
|
|
Gauche
|
12,931
|
6,896
|
12,931
|
|
Patiente B4
|
Droite
|
3,123
|
4,69
|
7,035
|
|
Gauche
|
5,347
|
8,029
|
12,043
|
|
Patiente B5
|
Droite
|
9,855
|
8,213
|
9,855
|
|
Gauche
|
8,143
|
6,786
|
8,143
|
|
Patiente B6
|
Droite
|
12,339
|
10,283
|
12,339
|
|
Gauche
|
14,923
|
12,436
|
14,923
|
|
Patiente B7
|
Droite
|
8,129
|
10,004
|
16,258
|
|
Gauche
|
5,337
|
6,568
|
10,674
|
Tableau 17 : Doses reçues par les parois
pelviennes pour les patientes du centre B,
selon les trois
méthodes.
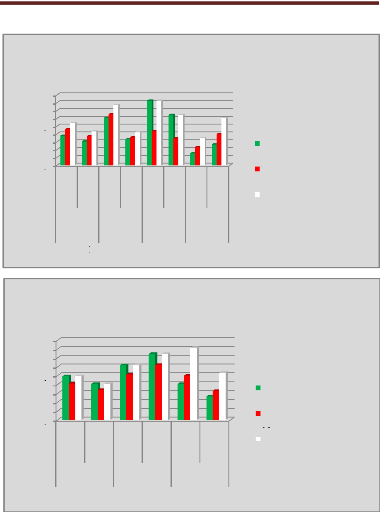
Doses aux points spécifiques de la
paroi
pelvienne
Méthode locale
Recommandations de l'ICRU 38
Méthode de Manchester
18
Doses recue (Gy)
16
14
12
10
8
6
4
2
0
Droite
Gauche
Droite
Gauche
Droite
Gauche
Droite
Gauche
Patiente
B1
Patiente
B2
Patiente
B3
Patiente
B4
Identification des patientes
Doses aux points spécifiques de la
paroi
pelvienne
Méthode locale
Recommandations de l'ICRU 38
18
16
Doses recue (Gy)
14
12
10
8
6
4
2
0
Méthode de Manchester
Patiente B5
Patiente B6
Patiente B7
Droite
Gauche
Droite
Gauche
Droite
Gauche
Identification des patientes
Figure 46
: Histogramme des doses
reçues par les parois pelviennes pour
les
patientes du centre B, selon les trois
méthodes.
5.1.4.1.c. Centre C
|
Identification
de la patiente
|
Point de la paroi
pelvienne
|
Méthode
locale (Gy)
|
Recommandations
de l'ICRU 38 (Gy)
|
|
|
Patiente C1
|
Droite
|
12,251
|
9,188
|
|
|
Gauche
|
9,035
|
6,776
|
|
|
Patiente
|
Droite
|
12,003
|
12,003
|
|
|
Gauche
|
9,068
|
9,068
|
|
|
Patiente C3
|
Droite
|
15,37
|
13,172
|
|
|
Gauche
|
15,751
|
13,498
|
|
|
Patiente C4
|
Droite
|
6,7
|
6,147
|
|
|
Gauche
|
9,658
|
8,861
|
|
|
Patiente C5
|
Droite
|
8,462
|
8,462
|
|
|
Gauche
|
4,632
|
4,632
|
|
Tableau 18
: Doses reçues par les parois pelviennes pour
les patientes du centre C,
selon les trois méthodes.
Doses aux points spécifiques de la
paroi
Doses recue (Gy)
1111
4 02468 2 0 6
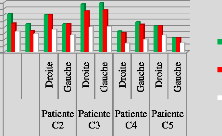
Patiente
C1
Droite
Gauche
Identification des patientes
Figure 47 : Histogramme des doses reçues par
les parois pelviennes pour
patientes du centre C, selon les trois
méthodes.
5.1.4.2. Doses aux points spécifiques du
trapèze lymphatique de Fletcher 5.1.4.2.a. Centre A
5.1.4.2.a.1. Dose aux points de référence des
iliaques externes
|
Identification
de la patiente
|
Point d'iliaque
externe
|
Méthode
locale (Gy)
|
Recommandations
de l'ICRU 38 (Gy)
|
Méthode de
Manchester (Gy)
|
|
Patiente A1
|
Droit
|
10,068
|
13,425
|
12,391
|
|
Gauche
|
9,372
|
12,496
|
11,533
|
|
Patiente A2
|
Droit
|
10,794
|
14,707
|
13,493
|
|
Gauche
|
12,955
|
17,651
|
16,194
|
|
Patiente A3
|
Droit
|
12,123
|
14,147
|
16,976
|
|
Gauche
|
5,205
|
6,074
|
7,288
|
|
Patiente A4
|
Droit
|
7,166
|
9,555
|
9,555
|
|
Gauche
|
22,407
|
29,877
|
29,877
|
|
Patiente A5
|
Droit
|
12,377
|
NA
|
14,852
|
|
Gauche
|
24,005
|
NA
|
28,806
|
|
Patiente A6
|
Droit
|
7,843
|
11,399
|
10,458
|
|
Gauche
|
16,221
|
23,574
|
21,628
|
|
Patiente A7
|
Droit
|
14,207
|
18,943
|
17,484
|
|
Gauche
|
7,899
|
10,533
|
9,721
|
|
Patiente A8
|
Droit
|
11,327
|
12,134
|
11,327
|
|
Gauche
|
12,204
|
13,073
|
12,204
|
|
Patiente A9
|
Droit
|
9,937
|
13,25
|
14,442
|
|
Gauche
|
6,626
|
8,835
|
9,63
|
|
Patiente A10
|
Droit
|
9,936
|
13,248
|
12,227
|
|
Gauche
|
11,589
|
15,452
|
14,262
|
|
Patiente A11
|
Droit
|
16,2
|
23,545
|
23,545
|
|
Gauche
|
6,165
|
8,96
|
8,96
|
Tableau 19 : Doses reçues par les iliaques
externes pour les patientes du centre A,
selon les trois
méthodes.
Dose aux points de référence des
iliaques
externes
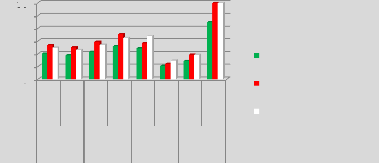
Méthode locale
Recommandations de l'ICRU 38
Méthode de Manchester
Doses recue (Gy)
25
20
30
15
10
5
0
Droit
Droit
Droit
Droit
Gauche
Gauche
Gauche
Gauche
|
Patiente
|
Patiente
|
Patiente
|
Patiente
|
|
A1
|
A2
|
A3
|
A4
|
Identification des patientes
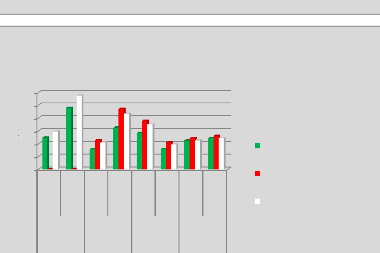
Doses recue (Gy)
25
20
30
15
10
5
0
Dose aux points de référence des
iliaques
externes
|
Patiente
|
|
Patiente
|
|
Patiente
|
|
Patiente
|
|
A5
|
A6
|
A7
|
A8
|
Méthode locale
Recommandations de l'ICRU 38
Méthode de Manchester
Identification des patientes
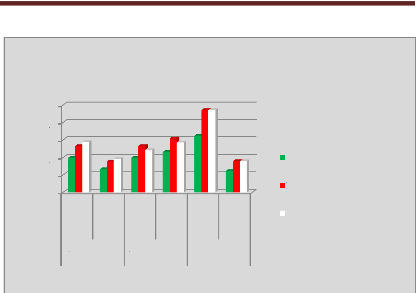
Dose aux points de référence des
iliaques
externes
Méthode locale
Recommandations de l'ICRU 38
Méthode de Manchester
Droit
Gauche
Droit
Gauche
Droit
Gauche
Patiente A9
Patiente A10
Patiente A11
Identification des patientes
25
20
15
10
5
Doses recue (Gy)
0
Figure 48
: Histogramme des doses reçues par les
iliaques
externes pour les patientes du centre A, selon les
trois méthodes.
5.1.4.2.a.2. Dose aux points de référence des
iliaques primitives
|
Identification
de la patiente
|
Point d'iliaque
primitive
|
Méthode locale
(Gy)
|
Recommandations
de l'ICRU 38 (Gy)
|
Méthode de
Manchester (Gy)
|
|
Patiente A1
|
Droit
|
8,994
|
11,992
|
11,068
|
|
Gauche
|
7,47
|
9,961
|
9,194
|
|
Patiente A2
|
Droit
|
6,679
|
9,1
|
8,349
|
|
Gauche
|
7,327
|
9,983
|
9,159
|
|
Patiente A3
|
Droit
|
25,761
|
30,06
|
36,072
|
|
Gauche
|
7,624
|
8,897
|
10,676
|
|
Patiente A4
|
Droit
|
4,286
|
5,715
|
5,715
|
|
Gauche
|
6,532
|
8,71
|
8,71
|
|
Patiente A5
|
Droit
|
6,317
|
NA
|
7,58
|
|
Gauche
|
9,382
|
NA
|
11,258
|
|
Patiente A6
|
Droit
|
3,816
|
5,545
|
5,088
|
|
Gauche
|
6,574
|
9,554
|
8,766
|
|
Patiente A7
|
Droit
|
6,002
|
8,003
|
7,386
|
|
Gauche
|
4,413
|
5,884
|
5,43
|
|
Patiente A8
|
Droit
|
7,404
|
7,932
|
7,404
|
|
Gauche
|
18,678
|
20,009
|
18,678
|
|
Patiente A9
|
Droit
|
3,048
|
4,064
|
4,429
|
|
Gauche
|
2,382
|
3,176
|
3,461
|
|
Patiente A10
|
Droit
|
4,962
|
6,616
|
6,106
|
|
Gauche
|
6,381
|
8,509
|
7,853
|
|
Patiente A11
|
Droit
|
5,69
|
8,269
|
8,269
|
|
Gauche
|
3,285
|
4,774
|
4,774
|
Tableau 20 : Doses reçues par les iliaques
primitives pour les patientes du centre A,
selon les trois
méthodes.
Dose aux points de référence des
iliaques
primitives
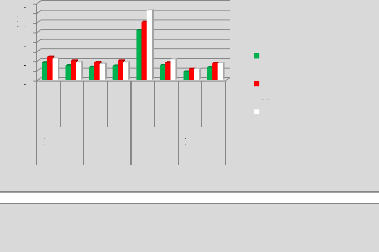
Méthode locale
Recommandations de l'ICRU 38
Méthode de Manchester
Droit
Gauche
Droit
Gauche
Droit
Gauche
Droit
Gauche
Patiente
A1
Patiente
A2
Patiente
A3
Patiente
A4
Identification des patientes
Dose aux points de référence des
iliaques
primitives
40
35
30
25
20
15
10
5
0
Doses recue (Gy)
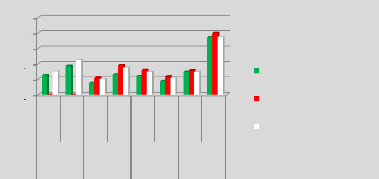
|
Patiente
|
Patiente
|
|
|
Patiente
|
|
Patiente
|
|
A5
|
A6
|
A7
|
A8
|
25
20
15
10
5
0
Doses recue (Gy)
Méthode locale
Recommandations de l'ICRU 38
Méthode de Manchester
Identification des patientes
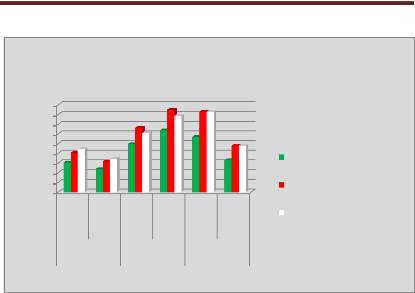
Dose aux points de référence des
iliaques
primitives
Méthode locale
Recommandations de l'ICRU 38
Méthode de Manchester
Droit
Gauche
Droit
Gauche
Droit
Gauche
Patiente A9
Patiente A10
Patiente A11
Identification des patientes
9
8
7
6
5
4
3
2
1
Doses recue (Gy)
0
Figure 49
: Histogramme des doses reçues par les
iliaques primitives pour les
patientes du centre A, selon les trois
méthodes.
5.1.4.2.a.3. Dose aux points de référence des
iliaques para-aortiques
|
Identification
de la patiente
|
Point d'iliaque
para-aortique
|
Méthode
locale (Gy)
|
Recommandations
de l'ICRU 38 (Gy)
|
Méthode de
Manchester (Gy)
|
|
Patiente A1
|
Droit
|
2,146
|
2,862
|
2,641
|
|
Gauche
|
1,939
|
2,586
|
2,386
|
|
Patiente A2
|
Droit
|
1,061
|
1,446
|
1,327
|
|
Gauche
|
1,043
|
1,421
|
1,304
|
|
Patiente A3
|
Droit
|
3,023
|
3,528
|
4,233
|
|
Gauche
|
2,193
|
2,56
|
3,072
|
|
Patiente A4
|
Droit
|
0,018
|
0,024
|
0,024
|
|
Gauche
|
0,122
|
0,163
|
0,163
|
|
Patiente A5
|
Droit
|
1,12
|
NA
|
1,344
|
|
Gauche
|
1,799
|
NA
|
2,158
|
|
Patiente A6
|
Droit
|
0,059
|
0,086
|
0,079
|
|
Gauche
|
0,25
|
0,364
|
0,334
|
|
Patiente A7
|
Droit
|
0,612
|
0,816
|
0,753
|
|
Gauche
|
0,441
|
0,588
|
0,542
|
|
Patiente A8
|
Droit
|
1,594
|
1,708
|
1,594
|
|
Gauche
|
2,024
|
2,168
|
2,024
|
|
Patiente A9
|
Droit
|
0
|
0
|
0
|
|
Gauche
|
0
|
0
|
0
|
|
Patiente A10
|
Droit
|
0,392
|
0,523
|
0,482
|
|
Gauche
|
0,55
|
0,734
|
0,677
|
|
Patiente A11
|
Droit
|
0,169
|
0,246
|
0,246
|
|
Gauche
|
0,11
|
0,16
|
0,16
|
Tableau 21 : Doses reçues par les iliaques
para-aortiques pour les patientes du
centre A, selon les trois
méthodes.
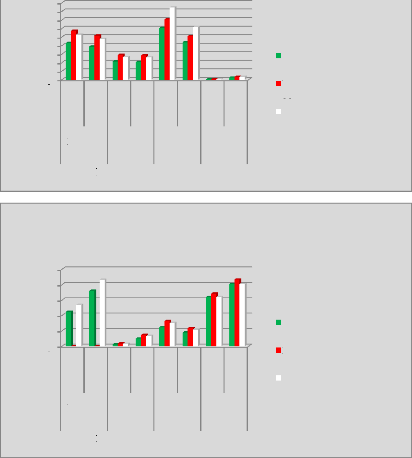
Doses recue (Gy)
Doses recue (Gy)
4,5
0,5
0,5
3,5
2,5
2,5
1,5
1,5
4
0
0
3
2
2
1
1
Dose aux points de référence des
iliaques
para-aortiques
Patiente
A1
Patiente
A5
Droit
Droit
Gauche
Gauche
Identification des patientes
Identification des patientes
Patiente
A2
Patiente
A6
Droit
Droit
Gauche
Gauche
Patiente
A3
Patiente
A7
Droit
Droit
Gauche
Gauche
Patiente
A4
Patiente
A8
Droit
Droit
Gauche
Gauche
Méthode locale
Méthode de Manchester
Méthode locale
Méthode de Manchester
Recommandations de l'ICRU 38
Recommandations de l'ICRU 38
Dose aux points de référence des
iliaques
para-aortiques
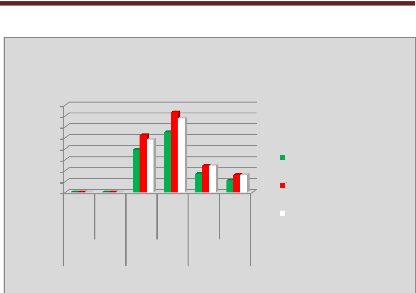
Dose aux points de référence des
iliaques
para-aortiques
Méthode locale
Recommandations de l'ICRU 38
0,8
0,7
Doses recue (Gy)
0,6
0,5
0,4
0,3
0,2
0,1
0
Méthode de Manchester
Gauche
Gauche
Patiente A9
Patiente A10
Patiente A11
Droit
Gauche
Droit
Droit
Identification des patientes
Figure 50 : Histogramme des doses reçues par
les iliaques para -aortiques pour les
patientes du centre A, selon les trois
méthodes.
5.1.4.2.a.4. Dose au point de référence de la
symphysis
|
Identification
de la patiente
|
Méthode locale
(Gy)
|
Recommandations de
l'ICRU 38 (Gy)
|
Méthode de Manchester
(Gy)
|
|
Patiente A1
|
7,258
|
9,678
|
8,932
|
|
Patiente A2
|
5,622
|
7,66
|
7,028
|
|
Patiente A3
|
2,509
|
2,928
|
3,513
|
|
Patiente A4
|
4,986
|
6,648
|
6,648
|
|
Patiente A5
|
11,974
|
NA
|
14,368
|
|
Patiente A6
|
6,966
|
10,125
|
9,289
|
|
Patiente A7
|
7,233
|
9,644
|
8,901
|
|
Patiente A8
|
4,984
|
5,339
|
4,984
|
|
Patiente A9
|
8,334
|
11,113
|
12,113
|
|
Patiente A10
|
8,409
|
11,212
|
10,348
|
|
Patiente A11
|
5,694
|
8,276
|
8,276
|
Tableau 22
: Doses reçues par la symphysis pour les
patientes du centre A, selon les
trois méthodes.
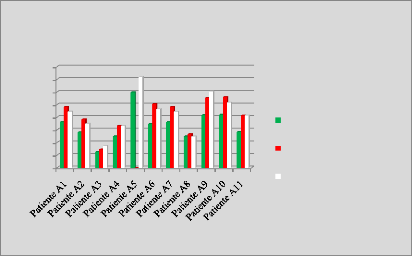
Doses recue (Gy)
16
14
12
10
4
0
6
2
8
Dose au point de référence de
la
symphysis
Identification des patientes
Méthode locale
Recommandations de l'ICRU 38
Méthode de Manchester
Figure 51
: Histogramme des doses reçues
par
la symphysis pour les patientes du centre A, selon
les trois méthodes.
5.1.4.2.a.5. Dose au point de référence
S1S2
|
Identification
de la patiente
|
Méthode locale
(Gy)
|
Recommandations de
l'ICRU 38 (Gy)
|
Méthode de Manchester
(Gy)
|
|
Patiente A1
|
8,366
|
11,155
|
10,296
|
|
Patiente A2
|
9,591
|
13,068
|
11,989
|
|
Patiente A3
|
15,777
|
18,41
|
22,092
|
|
Patiente A4
|
4,702
|
6,27
|
6,27
|
|
Patiente A5
|
7,354
|
NA
|
8,824
|
|
Patiente A6
|
3,069
|
4,461
|
4,093
|
|
Patiente A7
|
3,387
|
4,517
|
4,169
|
|
Patiente A8
|
8,33
|
8,923
|
8,33
|
|
Patiente A9
|
0,849
|
1,132
|
1,233
|
|
Patiente A10
|
5,704
|
7,606
|
7,02
|
|
Patiente A11
|
6,247
|
9,079
|
9,079
|
Tableau 23
: Doses reçues par le point S1S2 pour les
patientes du centre A, selon
les trois méthodes.
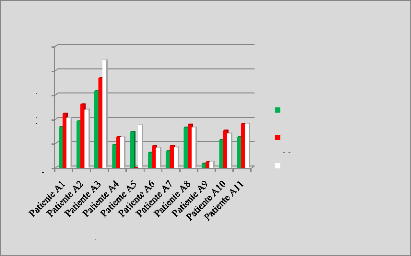
Doses recue (Gy)
25
20
15
10
5
0
Dose au point de référence S1S2
Identification des patientes
Méthode locale
Recommandations de l'ICRU 38
Méthode de Manchester
Figure 52
: Histogramme des doses reçues par le point
S1S2 pour les patientes du
centre A, selon les trois
méthodes.
5.1.4.2.b. Centre B
5.1.4.2.b.1. Dose aux points de référence des
iliaques externes
|
Identification
de la patiente
|
Point d'iliaque
externe
|
Méthode locale
(Gy)
|
Recommandations
de l'ICRU 38 (Gy)
|
Méthode de
Manchester (Gy)
|
|
Patiente B1
|
Droit
|
6,77
|
8,229
|
9,603
|
|
Gauche
|
5,946
|
7,228
|
8,435
|
|
Patiente B2
|
Droit
|
11,203
|
12,066
|
14,249
|
|
Gauche
|
6,004
|
6,466
|
7,636
|
|
Patiente B3
|
Droit
|
17,305
|
9,229
|
17,305
|
|
Gauche
|
12,076
|
6,44
|
12,076
|
|
Patiente B4
|
Droit
|
5,457
|
8,195
|
12,292
|
|
Gauche
|
10,648
|
15,989
|
23,983
|
|
Patiente B5
|
Droit
|
15,748
|
13,124
|
15,748
|
|
Gauche
|
9,886
|
8,239
|
9,886
|
|
Patiente B6
|
Droit
|
13,933
|
11,611
|
13,933
|
|
Gauche
|
15,344
|
12,787
|
15,344
|
|
Patiente B7
|
Droit
|
11,235
|
13,826
|
22,47
|
|
Gauche
|
6,843
|
8,422
|
13,687
|
Tableau 24 : Doses reçues par les iliaques
externes pour les patientes du centre B,
selon les trois
méthodes.
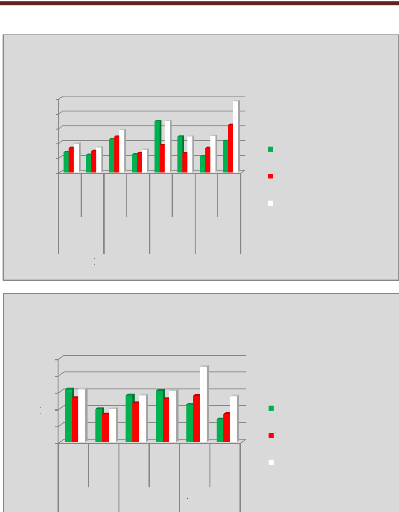
Méthode de Manchester
Patiente B5
Patiente B6
Patiente B7
Droit
Gauche
Droit
Gauche
Droit
Gauche
Dose aux points de référence des
iliaques
externes
Méthode locale
Recommandations de l'ICRU 38
Méthode de Manchester
Droit
Gauche
Droit
Gauche
Droit
Gauche
Droit
Gauche
|
Patiente
|
Patiente
|
Patiente
|
Patiente
|
|
B1
|
B2
|
B3
|
B4
|
Identification des patientes
Dose aux points de référence des
iliaques
externes
25
Méthode locale
Recommandations de l'ICRU 38
25
20
15
10
5
0
Doses recue (Gy)
20
15
10
5
Doses recue (Gy)
0
Identification des patientes
Figure 53
: Histogramme des doses reçues par les
iliaques externes pour les
patientes du centre B, selon les trois
méthodes.
5.1.4.2.b.2. Dose aux points de référence des
iliaques primitives
|
Identification
de la patiente
|
Point d'iliaque
primitive
|
Méthode locale
(Gy)
|
Recommandations
de l'ICRU 38 (Gy)
|
Méthode de
Manchester (Gy)
|
|
Patiente B1
|
Droit
|
1,576
|
1,916
|
2,236
|
|
Gauche
|
1,578
|
1,9188
|
2,239
|
|
Patiente B2
|
Droit
|
3,93
|
4,232
|
4,998
|
|
Gauche
|
2,412
|
2,598
|
3,068
|
|
Patiente B3
|
Droit
|
22,671
|
12,091
|
22,671
|
|
Gauche
|
9,454
|
5,042
|
9,454
|
|
Patiente B4
|
Droit
|
3,537
|
5,311
|
7,966
|
|
Gauche
|
4,709
|
7,071
|
10,606
|
|
Patiente B5
|
Droit
|
6,988
|
5,824
|
6,988
|
|
Gauche
|
5,325
|
4,438
|
5,325
|
|
Patiente B6
|
Droit
|
6,241
|
5,201
|
6,241
|
|
Gauche
|
7,789
|
6,491
|
7,789
|
|
Patiente B7
|
Droit
|
4,089
|
5,033
|
8,179
|
|
Gauche
|
3,455
|
4,252
|
6,91
|
Tableau 25 : Doses reçues par les iliaques
primitives pour les patientes du centre B,
selon les trois
méthodes.
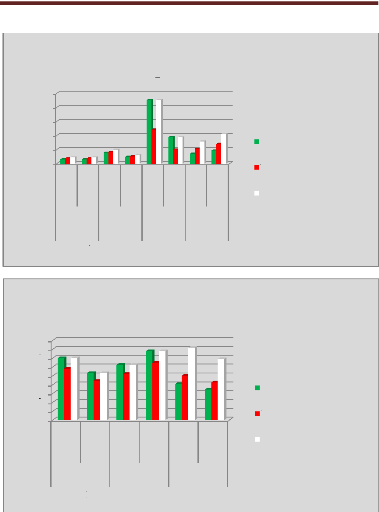
Dose aux points de référence des
iliaques
primitives
Méthode locale
Recommandations de l'ICRU 38
Méthode de Manchester
Droit
Gauche
Droit
Gauche
Droit
Gauche
Droit
Gauche
25
20
15
10
5
0
Doses recue (Gy)
|
Patiente
|
Patiente
|
Patiente
|
Patiente
|
|
B1
|
B2
|
B3
|
B4
|
Identification des patientes
Dose aux points de référence des
iliaques
primitives
Méthode locale
Recommandations de l'ICRU 38
Méthode de Manchester
9
8
Doses recue (Gy)
7
6
5
4
3
2
1
0
|
Patiente
|
B5
|
Patiente
|
B6
|
Patiente
|
B7
|
Identification des patientes
Figure 54
: Histogramme des doses
reçues
par les iliaques primitives pour
les
patientes du centre B, selon les trois
méthodes.
5.1.4.2.b.3. Dose aux points de référence des
iliaques para-aortiques
|
Identification
de la patiente
|
Point d'iliaque
para-aortique
|
Méthode locale
(Gy)
|
Recommandations
de l'ICRU 38 (Gy)
|
Méthode de
Manchester (Gy)
|
|
Patiente B1
|
Droit
|
0
|
0
|
0
|
|
Gauche
|
0
|
0
|
0
|
|
Patiente B2
|
Droit
|
0,144
|
0,155
|
0,184
|
|
Gauche
|
0,051
|
0,055
|
0,065
|
|
Patiente B3
|
Droit
|
2,43
|
1,296
|
2,43
|
|
Gauche
|
2,164
|
1,154
|
2,164
|
|
Patiente B4
|
Droit
|
0,537
|
0,807
|
1,21
|
|
Gauche
|
0,686
|
1,031
|
1,546
|
|
Patiente B5
|
Droit
|
0,475
|
0,396
|
0,475
|
|
Gauche
|
0,367
|
0,306
|
0,367
|
|
Patiente B6
|
Droit
|
0,661
|
0,551
|
0,661
|
|
Gauche
|
0,705
|
0,588
|
0,705
|
|
Patiente B7
|
Droit
|
0,172
|
0,212
|
0,345
|
|
Gauche
|
0,124
|
0,153
|
0,249
|
Tableau 26 : Doses reçues par les iliaques
para-aortiques pour les patientes du
centre B, selon les trois
méthodes.
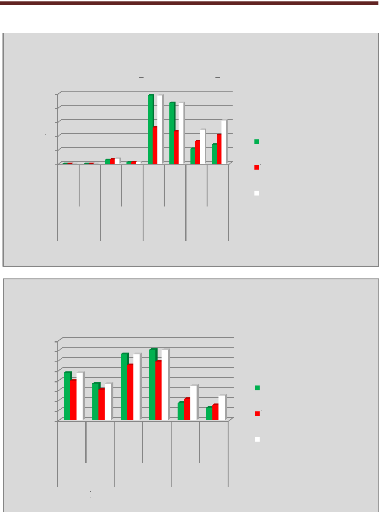
Dose aux points de référence des
iliaques
para-aortiques
Méthode locale
Recommandations de l'ICRU 38
Méthode de Manchester
Droit
Gauche
Droit
Gauche
Droit
Gauche
Droit
Gauche
2,5
2
1,5
1
0,5
0
Doses recue (Gy)
|
Patiente
|
Patiente
|
Patiente
|
Patiente
|
|
B1
|
B2
|
B3
|
B4
|
Identification des patientes
Dose aux points de référence des
iliaques
para-aortiques
Méthode locale
Recommandations de l'ICRU 38
0,8
0,7
Doses recue (Gy)
0,6
0,5
0,4
0,3
0,2
0,1
0
Méthode de Manchester
Gauche
Gauche
Patiente B5
Patiente B6
Patiente B7
Droit
Gauche
Droit
Droit
Identification des patientes
Figure 55 -aortiques pour les
: Histogramme des doses reçues par les
iliaques para
patientes du centre B, selon les trois
méthodes.
5.1.4.2.b.4.
Dose au point de référence de la
symphysis
|
Identification de
la patiente
|
Méthode locale
(Gy)
|
Recommandations de
l'ICRU 38 (Gy)
|
Méthode de
Manchester (Gy)
|
|
Patiente B1
|
12,467
|
15,156
|
17,685
|
|
Patiente B2
|
9,22
|
9,93
|
11,727
|
|
Patiente B3
|
9,016
|
4,808
|
9,016
|
|
Patiente B4
|
4,201
|
6,309
|
9,463
|
|
Patiente B5
|
6,301
|
5,251
|
6,301
|
|
Patiente B6
|
11,196
|
9,33
|
11,196
|
|
Patiente B7
|
4,545
|
5,594
|
9,091
|
Tableau 27
: Doses reçues par la symphysis pour les
patientes du centre B, selon les
trois méthodes.
Dose au point de référence de
la
symphysis
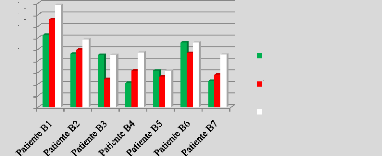
Méthode locale
Recommandations de l'ICRU 38
Méthode de Manchester
Doses recue (Gy)
18
16
14
12
10
4
0
6
2
8
Identification des patientes
Figure 56
: Histogramme des doses reçues par la
symphysis
pour les patientes du
centre B, selon les trois
méthodes.
5.1.4.2.b.5. Dose au point de référence
S1S2
|
Identification de
la patiente
|
Méthode locale
(Gy)
|
Recommandations de
l'ICRU 38 (Gy)
|
Méthode de
Manchester (Gy)
|
|
Patiente B1
|
4,091
|
4,973
|
5,803
|
|
Patiente B2
|
7,913
|
8,522
|
10,065
|
|
Patiente B3
|
24,697
|
13,172
|
24,697
|
|
Patiente B4
|
5,273
|
7,918
|
11,877
|
|
Patiente B5
|
7,498
|
6,249
|
7,498
|
|
Patiente B6
|
5,869
|
4,891
|
5,869
|
|
Patiente B7
|
4,35
|
5,354
|
8,701
|
Tableau 28 : Doses reçues par le point S1S2
pour les patientes du centre B, selon
les trois
méthodes.
Dose au point de référence S1S2
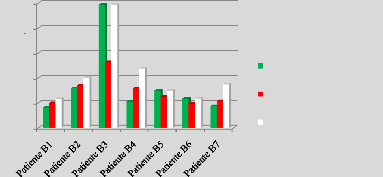
Méthode locale
Recommandations de l'ICRU 38
Méthode de Manchester
Doses recue (Gy)
25
20
15
10
0
5
Identification des patientes
Figure 57
: Histogramme des doses reçues par le point
S1S2 pour les patientes du
centre B, selon les trois
méthodes.
5.1.4.2.c. Centre C
5.1.4.2.c.1. Dose aux points de référence des
iliaques externes
|
Identification
de la patiente
|
Point d'iliaque
externe
|
Méthode
locale (Gy)
|
Recommandations
de l'ICRU 38 (Gy)
|
Méthode de
Manchester (Gy)
|
|
Patiente C1
|
Droit
|
21,105
|
15,828
|
11,502
|
|
Gauche
|
12,534
|
9,4
|
6,831
|
|
Patiente
|
Droit
|
21,246
|
21,246
|
12,916
|
|
Gauche
|
10,221
|
10,221
|
6,213
|
|
Patiente C3
|
Droit
|
18,664
|
15,995
|
9,723
|
|
Gauche
|
17,899
|
15,339
|
9,325
|
|
Patiente C4
|
Droit
|
11,497
|
10,548
|
4,862
|
|
Gauche
|
26,144
|
23,986
|
11,057
|
|
Patiente C5
|
Droit
|
22,787
|
22,787
|
14,491
|
|
Gauche
|
10,867
|
10,867
|
6,911
|
Tableau 29
: Doses reçues par les
iliaques externes pour les patientes du centre C,
selon les trois méthodes.
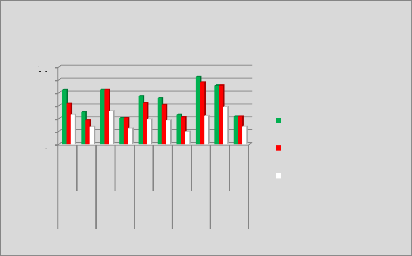
Dose aux points de référence des
iliaques
externes
30
25
20
15
10
5
0
Doses recue (Gy)
Méthode locale
Recommandations de l'ICRU 38
Méthode de Manchester
Droit
Gauche
Droit
Gauche
Droit
Gauche
Droit
Gauche
Droit
Gauche
|
Patiente
|
Patiente
|
Patiente
|
Patiente
|
Patiente
|
|
C1
|
|
C3
|
C4
|
C5
|
Identification des patientes
Figure 58
: Histogramme des doses reçues par les
iliaques externes pour les
patientes du centre C, selon les trois
méthodes.
5.1.4.2.c.2.
Dose aux points de référence des iliaques
primitives
|
Identification
de la patiente
|
Point d'iliaque
primitive
|
Méthode
locale (Gy)
|
Recommandations
de l'ICRU 38 (Gy)
|
|
|
Patiente C1
|
Droit
|
36,746
|
27,559
|
|
|
Gauche
|
22,64
|
16,98
|
|
|
Patiente
|
Droit
|
13,127
|
13,127
|
|
|
Gauche
|
8,491
|
8,491
|
|
|
Patiente C3
|
Droit
|
10,859
|
9,306
|
|
|
Gauche
|
11,511
|
9,864
|
|
|
Patiente C4
|
Droit
|
11,149
|
10,229
|
|
|
Gauche
|
22,162
|
20,333
|
|
|
Patiente C5
|
Droit
|
10,609
|
10,609
|
|
|
Gauche
|
7,982
|
7,982
|
|
Tableau 30 :
Doses reçues par les iliaques primitives pour
les patientes du centre C,
selon les trois méthodes.
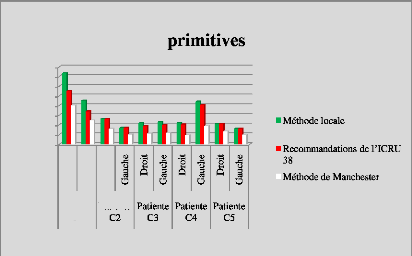
Dose aux points de référence des
iliaques
Patiente
C1
Patiente
Identification des patientes
40
35
30
25
20
15
10
5
0
Doses recue (Gy)
Droit
Gauche
Droit
Figure 59
: Histogramme des doses reçues par les
iliaques primitives pour les
patientes du centre C, selon les trois
méthodes.
5.1.4.2.c.3. Dose aux points de référence des
iliaques para- aortiques
|
Identification
de la patiente
|
Point d'iliaque
para-aortique
|
Méthode
locale (Gy)
|
Recommandations
de l'ICRU 38 (Gy)
|
Méthode de
Manchester (Gy)
|
|
Patiente C1
|
Droit
|
8,102
|
6,076
|
4,415
|
|
Gauche
|
7,326
|
5,494
|
3,992
|
|
Patiente
|
Droit
|
1,329
|
1,329
|
0,808
|
|
Gauche
|
1,034
|
1,034
|
0,288
|
|
Patiente C3
|
Droit
|
1,098
|
0,94
|
0,572
|
|
Gauche
|
1,03
|
0,882
|
0,536
|
|
Patiente C4
|
Droit
|
3,059
|
2,807
|
1,294
|
|
Gauche
|
3,359
|
3,082
|
1,42
|
|
Patiente C5
|
Droit
|
0,425
|
0,425
|
0,27
|
|
Gauche
|
0,061
|
0,061
|
0,039
|
Tableau 31 : Doses reçues par les iliaques
para-
aortiques pour les patientes du centre C, selon les
trois méthodes.
Dose aux points de référence des
iliaques
para-aortiques
Méthode locale
Recommandations de l'ICRU 38
Méthode de Manchester
Droit
Gauche
Droit
Gauche
Droit
Gauche
Droit
Gauche
Droit
Gauche
|
Patiente
|
Patiente
|
Patiente
|
Patiente
|
Patiente
|
|
C1
|
|
C3
|
C4
|
C5
|
Identification des patientes
9
8
7
6
5
4
3
2
1
0
Doses recue (Gy)
Figure 60 -aortiques pour les
: Histogramme des doses reçues par les
iliaques para
patientes du centre C, selon les trois
méthodes.
5.1.4.2.c.4. Dose au point de référence de
la symphysis
|
Identification de
la patiente
|
Méthode locale
(Gy)
|
Recommandations de
l'ICRU 38 (Gy)
|
Méthode de
Manchester (Gy)
|
|
Patiente C1
|
5,598
|
4,198
|
3,05
|
|
Patiente
|
4,578
|
4,578
|
2,783
|
|
Patiente C3
|
8,333
|
7,141
|
4,341
|
|
Patiente C4
|
4,751
|
4,359
|
2,009
|
|
Patiente C5
|
3,601
|
3,601
|
2,29
|
Tableau 32
: Doses reçues par la symphysis pour les
patientes du centre C, selon les
trois méthodes.
Dose au point de référence de
la
symphysis
|
Doses recue (Gy)
|
9 8 7 6 5 4 3 2 1 0
|
|
Méthode locale
Recommandations de l'ICRU 38
Méthode de Manchester
|
Patiente Patiente Patiente Patiente Patiente
C1 C3 C4
C5
Identification des patientes
Figure 61
: Histogramme des Doses reçues par la
symphysis pour les patientes du
centre C, selon les trois
méthodes.
5.1.4.2.c.5. Dose au point de référence
S1S2
|
Identification de
la patiente
|
Méthode locale
(Gy)
|
Recommandations de
l'ICRU 38 (Gy)
|
Méthode de
Manchester (Gy)
|
|
Patiente C1
|
18,349
|
13,761
|
10
|
|
Patiente
|
11,407
|
11,407
|
6,935
|
|
Patiente C3
|
9,811
|
8,408
|
5,111
|
|
Patiente C4
|
18,119
|
16,623
|
7,663
|
|
Patiente C5
|
8,135
|
8,135
|
5,173
|
Tableau 33
: Doses reçues par le point S1S2 pour les
patientes du centre C, selon
les trois méthodes.
Dose au point de référence S1S2
|
Doses recue (Gy)
|
20 18 16 14 12 10 8 6 4 2 0
|
|
Méthode locale
Recommandations de l'ICRU 38
Méthode de Manchester
|
Patiente Patiente Patiente Patiente Patiente
C1 C3 C4
C5
Identification des patientes
Figure 62 : Histogramme des doses reçues par
le point S1S2 pour les patientes du
centre C, selon les trois
méthodes.
5.2. Discussion des résultats
5.2.1. Choix de l'isodose de
référence
Nos résultats montrent que les isodoses de
référence dans la méthode locale du centre A, sont
supérieures à celles préconisées par l'application
des recommandations de l'ICRU 38, ainsi que les valeurs
déterminées par l'application du système de
Manchester.
En d'autres termes et sur le plan dosimétrique,
si nous considérons que la meilleure prescription reste basée sur
l'ICRU 38 du fait de la prise en compte des volumes, nous pouvons affirmer, que
la méthode locale du centre A présente un sous-dosage sur une
partie du volume tumoral et ce, nonobstant le fait que sur le plan clinique,
nous n'avons pas de recul pour déceler un effet biologique.
Pour le centre B, les trois méthodes semblent
assez proches en termes de choix de l'isodose de référence dans
50 % des cas, sinon on constate également un sous-dosage par la
méthode locale relativement à l'ICRU 38 et au système de
Manchester.
Quant au centre C, la méthode locale est
comparable en termes de choix de l'isodose de référence à
l'ICRU 38, alors que le système de Manchester basé sur la
prescription au point A montre un sous-dosage important.
5.2.2. Dose aux organes à risque
Nos résultats montrent pour les organes
particulièrement surveillés à savoir la vessie et le
rectum, que les doses reçues sont significatives mais restent en
deçà de la dose de tolérance, hormis pour les patientes B1
(dose vessie) et, A11 et B7 (dose rectale) par les méthodes ICRU et
Manchester.
Cela est attendu du fait qu'en général,
l'application de la méthode locale montre un choix d'isodose de
référence qui sous-dose certains volumes.
5.2.3. Ecart moyen entre les trois méthodes des
doses reçues par les OAR
Les écarts moyens des doses reçues par la
vessie et le rectum, calculés relativement à l'ICRU 38 sont
acceptables dans la majorité des cas, sauf pour le centre C.
Nous remarquons également un écart
significatif au niveau du centre C quand nous comparons les doses reçues
par la vessie (Manchester/locale). Cela peut être expliqué par la
différence importante dans le choix de l'isodose de
référence. Cela démontre la criticité du choix de
l'isodose de référence. Il faut également souligner que le
système de Manchester est plus adapté à des prescriptions
de dose avoisinant les 75 Gy.
5.2.4. Doses aux points spécifiques de la paroi
pelvienne et du trapèze lymphatique de Fletcher
Nos résultats de doses reçues aux points
particuliers de la paroi pelvienne (PPD, PPG) et du trapèze lymphatique
de Fletcher par les trois méthodes, à savoir :
- IPD, IPG,
- IED, IEG,
- IParaD, IParaG,
- Symphysis S et S1S2,
montrent que les valeurs sont autour de 10
Gy.
Dosimétriquement, cela est en accord avec la
littérature [Pötter et al, Radiotherapy and Oncology
2001;58:11-18], mais il est important d'avoir procédé à
cette évaluation qui permet en fait, d'estimer la dose à ajouter
éventuellement par la radiothérapie externe si le
radiothérapeute constate un reliquat démontré par l'examen
d'anatomo-pathologie après chirurgie.
Conclusion générale
Conclusion générale
L'utilisation des rayonnements ionisants en
radiothérapie de manière générale et en
curiethérapie en particulier, a prouvé son efficacité dans
les traitements des cancers. La maîtrise de plus en plus affinée
des calculs de dose délivrée aux tumeurs et estimée au
niveau des organes voisins et la dosimétrie adaptée des
traitements, ont considérablement augmenté le succès de
ces traitements pour certains cas bien spécifiques en
curiethérapie (variation rapide de dose) à cause des
propriétés physiques et géométriques des sources
radioactives.
Notre modeste travail nous a permis d'aborder les
différents systèmes dosimétriques, qui représentent
aujourd'hui une alternative et un outil performant pour adapter la dose
à la tumeur et la minimiser aux organes à risques, notamment par
l'application d'une méthode qui tient compte d'une réalité
volumique.
Nos résultats ont montré des
différences significatives dans le choix de l'isodose de
référence entre les trois méthodes
étudiées.
Cependant, nous pouvons affirmer que la méthode
qui se rapproche le mieux de la réalité clinique reste celle
préconisée par l'ICRU 38. En effet, le fait de faire un choix
d'isodose basé sur les trois dimensions tient compte des extensions
tumorales microscopiques possibles non visibles.
Cela étant, le rôle du médecin
radiothérapeute dans ce choix reste quand même primordial puisque
les préconisations des dimensions de l'isodose de
référence par l'ICRU restent des indications qu'il faut adapter
à l'anatomie de chaque patiente.
L'avènement de nouveaux systèmes de
planification de traitement (3D) en curiethérapie confortés par
l'utilisation de coupes scanner va, à notre avis, apporter une
précision accrue dans le choix de l'isodose de référence
basée sur la délinéation du volume cible
prévisionnel et le contourage des organes à risque.
Annexes
Annexe (A) : Formalisme de calcul du débit de
dose du (TG-43) « TASK-GROUP N°43 0 de (A.A.P.M) « American
Association of Physicists in Medicine 0.
Pour calculer la distribution de dose d'une source qui
est en réalité linéaire, on la divise en des sources
élémentaires ponctuelles et on calcule son intégrale de
Sievert (intégrale de Sievert est disponible dans les formes
disposées en tableau).
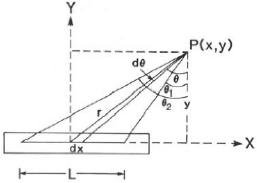
Système de coordonnées de calcul de
l'intégrale de sievert.
En 1995, l'A.A.P.M. propose dans le rapport du TG-43
un nouveau formalisme de calcul de dose dans l'eau. La mise à jour en
Mars 2004 de ce formalisme, afin d'évaluer la distribution de dose 2D
autour d'une source cylindrique donne l'expression du débit de dose dans
l'eau au point P(r,0) suivante:
)~ k*lmk*l 8nm o< ~ p$= q=
r8smt<
r8sbmtb< = u8n<=
v8nm o<
Avec :
r : la distance entre l'origine et le point P en
centimètre;
0 : l'angle entre la direction de vecteur du rayon r et
le long axe de la source; 00 : définit le plan
transversal de la source, est égal aux radians du
R.,/2;
SK : l'air kerma strength de la source
(mGy·m2·h-1); A : la constante
de débit de dose dans l'eau;
G(r,O) : la fonction
géométrique;
g(r) : la fonction radiale de la dose;
F(r,O) : fonction
d'anisotropie.
Le TG-43 utilise un système de
coordonnées polaires (r,O) et l'origine du
repère est prise au centre de la source. Nous allons par la suite
expliciter les différents termes de cette expression et leur
signification physique.
Système de coordonnées polaires pour
les calculs dosimétriques.
1- Air Kerma Strength SK
Le TG-43 définit SK << l'air kerma strength
», en un point P situé sur l'axe transverse de la source
(00 = ir/2) par l'expression suivante
:
SK = K airmair (kr, x 2..' =
r2
~~ air,air (r, x y) est le débit de kerma
dans l'air (RAKR) << Reference Air Kerma Rate ».
z
(6~air)air = 8} ~ e~@x / c0s9 d8 -
f 1 e~@~ / COSO d8<
;| ~ ~
Avec :
A : l'activité totale de la source ;
I' : la constante de débit de kerma ;
L : la longueur de la source linéaire
;
h : est la distance perpendiculaire entre point P et la
source de la ligne et 01 des angles et 02,
comme fait entrer le (figure 12), est les limites de
l'intégration.
f
° e_@~ É cos9 d8: est
l'intégrale de Sievert qui explique l'atténuation du photon dans
~ le capsule de la source;
x : est l'épaisseur de la capsule de la
source;
u : est le coefficient de l'atténuation pour les
photons dans la capsule de la source matière.
Donc SK devient indépendante de la distance r du
point de calcul à la source. L'unité de SK est U tel que 1U =
1cGy.cm2.h-1.
2- Constante de débit de dose A
Le TG-43 définit la constante de débit
de dose A, comme étant égale au débit de
dose
dans l'eau à 1 cm sur l'axe de la source (O0 =
ir/2) pour une unité de « l'air kerma
strength
» en cGy.h-1.U-1 ou cm-2. Son expression
est donnée par la relation suivante :
D (rQ=lcm,OQ=
7t/2)
A =
SK
3- Fonction géométrique G
(r,O)
G(r,O) traduit le
phénomène d'atténuation de la fluence de photons dans le
milieu à partir du nombre initial de photons en un point de
départ, dit de référence. Son expression
générale est donnée par l'équation
ci-dessous.
e8éè <=ê' f
héè-rh2
G(r, 0) =
f
p(sè).dï'
o étant l'angle entre l'axe de la source et le
vecteur joignant le centre de la source au point de calcul
P(r,0) et p(r') étant la
densité de radioactivité au point P' dans l'élément
de volume dV'.
Pour une approximation ponctuelle de la source, cette
diminution se fait en 1/r2.
Pour une approximation linéaire de la source,
l'expression de G(r,0) devient la suivante :
~~
~ (r2 L2
GL = si 0 * 0 GL = ) si 0
= 0
L.r.sinO
4- Fonction radiale de dose g(r)
g(r) est mesurée sur l'axe transverse
(00 = ir/2) et traduit uniquement les
phénomènes d'absorption et de diffusion dans le milieu
situé entre le point P0 de référence et le point P(r,
0). Son expression est donnée par l'équation
suivante :
D(ro,ir/2) G(r,ir/2)
g(r) = D(r,ir/2) . G(ro,ir/2)
g(r) est indépendante de la diminution en
1/r2 de la fluence de photons. Ainsi D(r,n/2) au
numérateur est divisée par G(r,n/2). Cette
fonction est normalisée au point de référence.
5- Fonction d'anisotropie F(r,O)
Elle exprime le caractère non ponctuel de la
source et des matériaux intervenant dans sa fabrication. Elle correspond
à une mesure bidimensionnelle et elle traduit les
phénomènes d'absorption et de diffusion dans le milieu ainsi que
l'encapsulation de la source, et ce sur (4n)
stéradians. Son expression est donnée par l'équation
suivante:
F(r, o) = D(r,O) G(r,ir/2)
D(r,ir/2) . G(r,O)
Dans cette expression, D(r,O) au
numérateur est divisée par G(r,O) dans l'optique
de s'affranchir de la diminution en (1/r2) de la fluence, ce
phénomène étant déjà été pris
en compte dans le facteur géométrique. De plus, la fonction
d'anisotropie est normalisée par rapport à (0 =
n/2), les phénomènes d'atténuation sur
l'axe transverse ayant déjà été pris en compte dans
la fonction de dose radiale g(r).
Annexe (B) : Planification du traitement par TPS
THERAPLAN Plus, méthode de reconstruction avec deux clichés
orthogonaux
1- Du menu de << Source Entry Reconstruction
», on choisi << Reconstruction ».
2- On sélectionne << Orthogonal
».
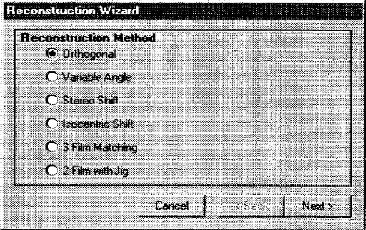
3- Cliquez sur << Next ». Pour les
clichés orthogonaux l
e système vous incite les
facteurs d'agrandissement.
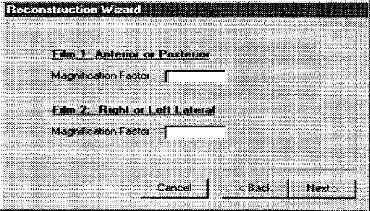
4- Entrez les <<
Magnification Factors >>
pour le cliché AP et LAT, ensuite
cliquez
sur << Next >> . Le système vous
invite à
définir la région d'intérêt
pour le premier
cliché.


5- Digitalisez un point qui représente l e coin
gauche i nférieur et un point pour le coin droit du premier
cliché.
6- Digitalisez un point négatif
(inférieur) le long de l'axe Y et un
deuxième point
emier
positif (supérieur) le long de l'axe Y qui est
positif et plus grand que le pr
ite pour entrer l'origine de l'implant
point. Le système vous inv ation.
7- Pour le premier cliché digitalisez un point
qui représente l'origine de l'implantation. Le système vous
invite à
définir la région d'intérêt
pour le deuxième
cliché.
8- Digitalisez un point qui représente le coin
gauche inférieur et un point pour le Coin droit du deuxième
cliché.
9- Digitalisez un point négatif
(inférieur) le long de la axe Y et un deuxième point positif
(supérieur) le long de l'axe Y. Le système vous invite pour
entrer l'origine de l'implantation.
10- Pour le deuxième cliché digitalisez un
point qui représente l'origine de l'implantation. L'orientation des
clichés est maintenant complète.
11- Cliquez sur « Next ».
12- Entrez les sources et les points de
références, en utilisant le digitaliseur.
Annexe (C) : Planification du traitement par TPS
THERAPLAN Plus, méthode de reconstruction avec deux clichés
orthogonaux avec jig
1- Du menu de << Source Entry »,
sélectionnez l'option << Reconstruction ». La boîte du
dialogue la Reconstruction apparaît.
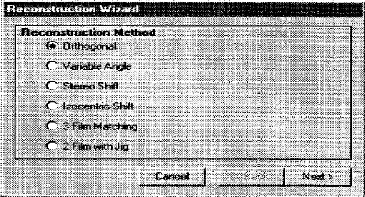
2- Choisir l'option << 2 film with Jig
».
3- Cliquez sur << Next ». Le système
vous invite pour entrer les paramètres des deux
clichés.
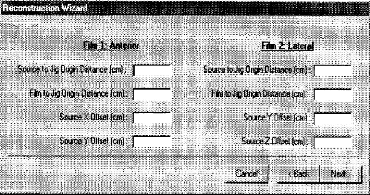
4- Cliquez sur << Next ». Le système
vous invite à définir la région d'intérêt du
premier cliché.
5- Définir la région
d'intérêt et orienter le cliché, digitalisez les points
suivants: " Le coin gauche inférieur "
" Le coin droit supérieur "
" Un point négatif sur l'axe Y du cliché
"
" Un point positif sur l'axe Y du cliché
"
" L'origine de l'implantation "
6- Le système vous invite à définir
la région d'intérêt pour le deuxième
cliché.
7- Répétez la sixième étape
pour le deuxième cliché.
8- L'orientation des clichés est maintenant
complète. Cliquez sur « Next ». Le plan de reconstruction
apparaître.
9- Entrez les sources et les points de
références, en utilisant le digitaliseur.
Références bibliographiques
[1] Cheick Oumar THIAM. Dosimétrie en
radiothérapie et curiethérapie par simulation Monte-Carlo GATE
sur grille informatique. Thèse de Doctorat en Physique Corpusculaire,
Université Blaise Pascal. DU 1771 (2007).
[2] M.Kibler et J-C.Poizat. La Physique pour la
Santé : du diagnostic à la thérapie. Institut de Physique
Nucléaire de Lyon. hal - 00001383, version 1 (2006).
[3] Henri Métivier. Radioprotection et
ingénierie nucléaire. EDP sciences (2006).
[4] Marie-Charlotte RICOL. Contribution a
l'étude des processus nucléaires intervenant en
hadronthérapie de leur impact sur la délocalisation du
dépôt de dose. Thèse de Doctorat, Université Claude
Bernard-Lyon 1. 220 (2008).
[5] http://www.e-cancer.fr/
[6]
http://
www.institutpaolicalmettes.fr
[7] Naima EL AARJI. Les cancers du col utérin.
Thèse de Doctorat en Médecine, Université HASSAN II.
(2006).
[8] Myriam COULIBALY & Boris GEYNET. Evolutions
technologiques en Radiothérapie externe. Université de
Technologie Compiègne. (2000 - 2001).
[9] B.Hocini. Aspects physiques et cliniques de la
curiethérapie. Cours Master 2, Université de Blida. (2009 -
2010).
[10] Radiothérapie et curiethérapie.
Service de radiothérapie, CHU Besançon. (2007).
[11] Gédrik LAFOND. Optimisation des
techniques de radiothérapie dans le cadre de la prise en charge des
patientes traitées par radiochimiothérapie d'un cancer du col de
l'utérus. Thèse de Doctorat en Médecine, Université
Henri Poincare - Nancy. (2007).
[12] Comprendre la radiothérapie. L'Institut
National du Cancer, France CANCER INFO. (2009).
[13] D.Baltas, L.Sakelliou et N.Zamboglou. Series in
Medical Physics and Biomedical Engineering `The Physics of Modern Brachytherapy
for Oncology'. Taylor & Francis Group. (2007).
[14] N.Suntharalingam et al. Chapter 13 Brachytherapy:
Physical and clinical aspects. STI/PUB/1196, IAEA.
[15] C.Haie-Meder et al. Recommandations pour le
contrôle de qualité en curiethérapie. Éditions
scientifiques et médicales Elsevier SAS. (2002).
[16] Yann Métayer. Projecteurs de sources et
Contrôle de Qualité en Curiethérapie. Cours de
Curiethérapie, Centre Alexis Vautrin - Nancy. (2004).
[17] Association des Physiciens d'Hôpital Centre
Rhône Alpes. Bases pratiques de dosimétrie en curiethérapie
Bas et Haut Débit. Besançon C.H.U. (2000).
[18] C.B.G.Taylor. L'atome pour la santé `Les
radioisotopes et le traitement du cancer'. Laboratoire de l'AIEA à
Seibersdorf. AIEA BULLETIN, VOL.25, no 2.
[19] Sophie RENARD-OLDRINI. Implémentation de
la radiothérapie conformationnelle avec modulation d'intensité
dans les cancers du col utérin au centre ALEXIS VAUTRIN. Thèse de
Doctorat en Médecine, Université Henri Poincare - Nancy.
(2010).
[20]
http://fr.wikipedia.org/wiki/Cancer_du_col_utérin
[21] Richard Pötter, Erik Van Limbergen,
André Wambersie. Reporting in Brachytherapy: Dose and Volume
Specification. G 6 25072002.
[22] Isabelle Barillot, Henri Marret.
Référentiels OncoCentre : cancers du vagin - réunion du 19
juin 2009.
[23] E. Garin. Interactions des rayonnements ionisants
(RI) avec la matière. Service de médecine nucléaire,
Centre Eugène Marquis - RENNES20080211064403. (2008).
[24] Edith Briot. Brachytherapy `Radioactive
sources'. Regional training course on clinical and physical aspects of quality
assurance in radiation oncology, Accra, Ghana. (1998).
[25] Alain Gerbaulet, Richard Pötter, Christine
Haie-Meder. Cervix Carcinoma. IA 14 01082002.
[26] JC Rosenwald, G Marinello. Curiethérapie
gynécologique. JC Rosenwald - Tunis (2008).
[27] ICRU Report 38 `Dose and Volume Specifications for
Reporting Intracavitary Therapy in Gynecology'. 01.03.03 - ICRU38.
(2004).
[28] Les actions de l'ASN. Les utilisations
médicales des rayonnements ionisants. (2009).
[29] Habib Zaidi. Principes de base de la physique des
radiations. Cours de physique médical, Universitaires de Genève,
Suisse. (2007).
[30] André Besançon. Radioprotection.
Séminaire destiné aux enseignants, Institut universitaire de
radiophysique appliquée - Lausanne. (2004).
[31] Y.Arnoud. Interaction rayonnement matière.
Cours Master 2, LPSC Grenoble. (2006 - 2007).
[32] René Bimbot, André Bonnin, Robert
Deloche et Claire Lapeyre. Cent ans après la Radioactivité, le
rayonnement d'une découverte. Edition EDP Sciences. (1999).
[33] Ravinder Nath et al. REPORT OF AAPM RADIATION
THERAPY COMMITTEE TASK GROUP 43 `Dosimetry of Interstitial Brachytherapy
Sources'. Med Phy, Vol. 22, Issue 2. (1995).
[34] E.Kathryn, Dusenbery and Bruce J.Gerbi. Radiation
Therapy for Cervical Cancer.
[35] Carole Lambert MD Résidente en
radio-oncologie. Dosimétrie III : Principes physiques «basic»
en brachythérapie. (2004).
| 


