3- Polymorphisme et transmission
génétique des HPAs
A présent, 24 HPAs
allo-antigènes spécifiquement plaquettaires ont été
définis sérologiquement à l'aide d'allo-anticorps
allo-immuns correspondants, dont seulement 12 sont groupés dans six
systèmes bialléliques (HPA-1,-2,-3,-4,-5,-15) avec des anticorps
sériques contre les deux allo-antigènes. D'autres systèmes
antigéniques rares ou privés sont aussi détectés
avec un seul allo-anticorps correspondant. La base moléculaire de 22
antigènes parmi les 24 définis sérologiquement est
résolue. Pour les 21 HPAs, la différence entre les 2
allèles est due à la substitution d'un seul nucléotide
(SNP) au niveau du gène codant (Metcalfe. P et al., 2003 ;
Bugert. P et al., 2005). Sera à l'origine de la substitution d'un
seul aa aux niveaux de l'une des six GPs majeurs, matures de la membrane
plaquettaires (Koutsogianni. P. 2004). L'antigène
HPA-14w constitue la seule exception puisque son polymorphisme
est obtenu par une délétion de trois nucléotides, il en
résulte la perte d'un seul aa. Donc la plupart de ces polymorphismes est
un seul point de mutation de l'allèle de type sauvage (Newman. P. J
et Valentin N., 1995; Santoso. S. A et al., 1999). Tous les
allo-antigènes spécifiques aux PLTs sont hérités
par codominance autosomale (Kulkarni. B et al., 2002).
4- Les différents allo-antigènes
spécifiquement plaquettaires
1- Les systèmes les plus
impliqués en pathologies humaines
Le système HPA-1; (P1A,
Zw)
· Génétique du système
HPA-1
L'antigène Duzo, appelé également (PLA,
Zw), a été identifié en 1959 par Van Loghem (Van
Loghem. J. J et al., 1959), il est désigné par HPA-1
(Newman. P. J et al., 1985). C'est le système plaquettaire le plus
important cliniquement (Williamson. L. M et al., 1998).
L'expression bialléliques de HPA-1 donne les
antigènes allèles HPA-1a (PlAl) (GP3A*01) et HPA-1b
(PlA2) (GP3A*02) qui différent par un SNP 196T>C sur
l'exon 2 du gène codant ITGB3/GP3A. Ce SNP cause une substitution
Leu33/Pro33 de l'extrémité N-terminale de
la GPIIIa mature (Tableau IV). Ce qui donne des différences
considérables dans les structures secondaires des deux formes
alléliques (Newman. P. J et al., 1989).
Cette substitution mène à la formation de
l'épitope HPA-1 (Goldberger. A et al., 1991; Honda. S et al.,
1995), est localisée à l'apex Cys26-Cys38 du boucle AB du
domaine PSI (Xiong. J.P et al., 2004; Santoso. S. A et al.,
2006). Les déterminants antigéniques sont localisés
en outre sur un fragment non carbohydraté de 17-23-kDa (Newman. P. J
et al., 1985; Van Der Shoot. C. E et al., 1986). Les aa de 1 à 66
(Barron-Casella. E.A et al., 1999) et de 288 à 490 contribuent
à la formation de l'épitope HPA-1a. Il est possible que la
séquence 288-490 maintienne la boucle Cys26-Cys38
dans une orientation appropriée par rapport au reste de la
molécule â3 et de cette façon elle maintient la
présentation antigénique adéquate dans cette boucle
(Honda. S et al., 1995).
L'analyse de l'ADN génomique d'un individu a
révélé la présence d'un nouveau SNP
C175G dans le gène ITGB3 qui conduit à une
substitution Leu33Val pour donner un troisième allèle
HPA-1(ITGB3*001.1) (Fig.6). La mutation naturelle Leu33Val peut
interrompre quelques épitopes HPA-1a. Ces conclusions fournissent
l'évidence pour une réponse humorale
hétérogène contre l'antigène HPA-1a qui peut avoir
la possibilité d'être impliqué dans les désordres de
NAITP.
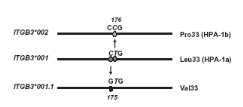
Figure 6. Nouvelle
variante de l'allèle HPA-1a.
La mutation C>G de l'ADNC de l'intégrine
â3 en position 175 (â3-Leu33; HPA-1a) et le résultat d'un
nouveau variant allélique différent ITGB3*001.1 codant pour
Val33. La mutation T>C à la position 176
résultat d'un allèle ITGB3*002 qui
code pour Pro33 (HPA-1b) (Santoso S. A et al.,
2006).
L'Arg 93 du GPIIIa contribue à la formation de
l'épitope HPA-1a au niveau des cellules B (Watkins. N. A et al.,
2002). Un nouveau SNP G376A du gène codant ITGB3 est le
résultat d'une substitution d'un seul aa Arg93Gln au niveau
de l'intégrine â3 remplaçant l'allèle
Leu33 (Watkins. N. A et al., 2002).
La configuration de l'épitope HPA-1 n'a pas
été complètement élucidée.
· Implications cliniques
La réponse humorale de l'antigène HPA-1a est
hétérogène (Valentin. N et al., 1995). Les
anticorps Anti-HPA-1a produits par les réponses immunes peuvent mener
à la destruction des PLTs (Mueller-Eckhard. C et al., 1989; Okamoto.
N et al., 1998) dans les désordres cliniques tels que NAIT
(Blanchette. V. S et al., 2000), le PTP et aux transfusions des les
PLTs. En plus de ces désordres immunologiques, le polymorphisme du
système HPA-1 est associé à plusieurs autres maladies.
D'ailleurs, l'altération de la structure moléculaire de la GPIIIa
au niveau des allèles HPA-1 peut affecter la fonction du GPIIb/IIIa.
De même, le polymorphisme du HPA-1b est associé
au risque de la thrombose coronaire (Weiss. E.J et al., 1996; Kadir et al.,
1999; Kroll. H et al., 2001).
Des différences dans la prédominance de ces
désordres génétiques ont été
observées chez les différents groupes ethniques. Carlsson et al.,
en 1997 ont montré qu'il n y'a pas association entre le polymorphisme
HPA-1 et l'IS (Carlsson. L. E et al., 1997). De même, van Goor
et al., en 2003 ont prouvé que la relation entre l'allèle HPA-1b
et ce désordre est incertaine (Van Goor. M.L.P.J et al., 2003).
Cependant, Jimmy Lim et al en 2003 ont affirmé que ces allèles
peuvent être associés positivement à l'IS (Jimmy Lim et
al., 2003). Le polymorphisme PlA est associé à
l'agrégation accrue des PLTs (Huang. T et Mervyn. A. S. 2003). Ainsi
l'agrégation plaquettaire joue un rôle central dans la
pathogénie de la thrombose aiguë, dans la maladie des coronaires,
l'IS et les maladies artérielles périphériques
(Ulrich. H. F et al., 2003). De ce fait, l'étude faite par
Weber et al en 2002 a démontré une hyperréactivité
considérable des PLTs chez les malades avec l'artère coronaire.
v Implications cliniques de l'allèle
HPA-1a
L'allo-antigène HPA-1a et le plus impliqué dans
les cas de NAIT, que les thrombopénies néonatales
résultantes sont profondes et que ça donne les formes les plus
sévères. En plus des trois principaux désordres
cliniques, le polymorphisme de HPA-1a été identifié comme
un facteur héréditaire du risque thrombotique (Weber. S et
al., 2002) tel que l'IM (Weiss. E. J et al., 1996; Walter et al.,
1997; Zotz. R. B et al., 1998; Nauck. M. S et al., 1999; Mathew. J. G et al.,
2001; Hohlagschwandtner. M. M. D et al., 2003). Le génotype
PlA1/A1 est associé avec la CAD sévère chez des
malades caucasiens de la région nord de la Pologne (Gruchala. M et
al., 2003). Normalement, les homozygotes PlA1/A1 ont un risque
hémorragique plus élevé (Morawski. W. MD. PhD. M et
al., 2005).
v Implications cliniques de l'allèle
HPA-1b
Les individus qui portent l'allèle HPA-1b
paraissent avoir un haut risque pour les événements
cardio-vasculaires (Weiss. E. J et al., 1996; Wagner.
K et al., 1998; Carter. A. M et al., 1996; Vijayan. K. V et al., 2000;
Santoso. S. A et al., 2002). Ainsi en 1996, Weiss et al été
les premiers à démontrer la grande prédominance de
l'allèle PlA2 dans l'IM chez les malades. Ce
même allèle constitue un risque pour les maladies de
l'artère coronaire (Weiss. E. J et al., 1996) (Jimmy Lim et al.,
2003). Il peut être associé positivement avec des
complications thrombotiques d'athérosclérose tels que l'IS.
Quelques études ont aussi montrés des résultats
contradictoires (Korral et al., 1997; Ghosh. K et al., 2002). Un rare
polymorphisme GPIIIa Leu 40/Arg 40 est lié à
l'antigène 1b (Walchshofer. S et al., 1994).
Le polymorphisme PlA1/A2 est fortement
associé avec les maladies ischémiques cardio-vasculaires et l'IM
aigu (Weiss. E. J et al., 1996; Feng. D. M. D et al., 2001; Huang. T et
Mervyn. A. S. 2003; Bojesen. S. E et al., 2003; Lopes. N. H. M
et al., 2004). Le variant allélique PIA2 est un facteur
héréditaire du risque des événements coronaires
aigus (Lim et al., 2003) et au restenosis
(Kastrati. A. M. D et al., 1999).
Il y a une interaction entre le polymorphisme des fumeurs
PlA2 et le CAD (Lopes. N. H. M et al., 2004). Les porteurs
de l'allèle PlA2 sont considérablement
protégés contre SAH. De même, ces allèles
réduisent largement le risque de SAH (Iniesta. J. A et al.,
2004). Les malades qui portent ces allèles présentent de
plus grands anévrismes, mais l'extension de leur hémorragie et le
niveau clinique sont considérablement inférieurs quand on les
compare avec les malades HPA-1a/a (Juan. A et al., 2004). Il est
remarquable que l'allèle HPA-1b paraît réduire la
sévérité de l'hémorragie chez les malades avec
Thrombasthénie de Glanzmann (Ghosh. K et al., 2002; Juan. A et al.,
2004) ou l'athérosclérose comme il peut réduire le
risque et la sévérité de l'hémorragie subarachnoid
(Iniesta. J. A et al., 2004; Corral. J et al., 2004).
Le système HPA-2; (Ko,
Sib)
· Génétique du système
HPA-2
Il a été décrit pour la première
fois par Van der Weerdt en 1961. C'est un système di-allélique
localisé sur un domaine globulaire de 45 kDa du coté N-terminal
du de la GPIbá (Kuijpers. R. W. A. M et al., 1989; Kuijpers. R. W.
A. M et al., 1992). Les deux formes alléliques (HPA-2a ou
Kob et HPA-2b ou Koa ou Siba) sont dus
à une substitution d'un seul nucléotide SNP (C/T Cyt/Thy
(ACG)/ (ATG)) (Kuijpers. R. W. A. M et al., 1992a) dans
l'exon 2 en position 434 du gène codant GP1BA. Ce polymorphisme se
traduisant par une substitution d'un seul aa 145 Thr/Met qui se trouve dans le
cinquième LRR (Murata. M et al., 1992).
· Liaison génétique du
polymorphisme HPA-2 avec d'autres polymorphismes
Le polymorphisme du système HPA-2 pourrait être
lié génétiquement à deux autres
polymorphismes : les polymorphismes VNTR (Simsek. S et al.,
1994; Afshar-Kharghan. V et al., 1999; Chester. Q et al., 2000) et les
polymorphismes de Kozaki (Kozak polymorphism) (Afshar-Kharghan. V et
al., 1999; Chester. Q et al., 2000).
Le polymorphisme HPA-2 est en déséquilibre de
liaison avec le polymorphisme de VNTR (Deckmyn. H et al,. 2004) auquel
il est fortement lié. Le HPA-2a (Thr145) est associé
au VNTR-C et au VNTR-D alors que l'allèle HPA-2b (Met145) est
lié au VNTR-A et au VNTR-B (Simsek. S et al., 1994; Aramaki. K. M.
et Reiner A. P. 1999). En effet, les allèles avec une ou deux
répétitions sont liés à l'isoforme Thr (HPA-a),
alors que les allèles avec trois ou quatre répétitions
sont liés à l'isoforme Met (HPA-b) (Ulrichts. H et al.,
2003). Tandis que d'autres études de génotypage des PLTs
étaient contradictoires en montrant un effet fonctionnel provoqué
par ce dimorphisme (Mazzucato et al., 1996; Boncler et al., 2002;
Jilma-Stohlawetz. P et al., 2003; Deckmyn. H et al.,
2004). Les distributions alléliques de la GPIbá VNTR et
HPA-2 diffèrent considérablement selon les différentes
populations. Par exemple, l'allèle VNTR-A est trouvé presque
exclusivement en Asie de l'est (Aramaki. A K. M. et Reiner. A. P.
1999).
Ces polymorphismes influent sur la structure et le niveau
d'expression de la GPIbá qui possède un effet potentiel sur les
maladies thrombotiques.
· Implications cliniques du polymorphisme du
système HPA-2
L'exposition au non soi des formes allo-antigèniques du
système HPA-2 au cours de la grossesse ou après transfusion peut
mener à la formation des allo-anticorps qui peuvent causer la NAITP
(Kuijpers. R. W. A. M et al., 1992), PTR (Kuijpers. R. W. A. M et al.,
1992a) et le PTP (Chester. Q et al., 2000).
De même, le rapport entre les allèles HPA-2b et
VNTR-B est considéré comme un facteur à risque
thrombotique pour les maladies cardio-vasculaires (Aramaki. K. M. et
Reiner. A. P. 1999), ce qui suggère que ces variantes ont pu
évoluer, au moins en partie, à cause de la pression
sélective pour activer l'hémostase (Aramaki. K. M. et Reiner.
A. P. 1999). Des études récentes ont montré qu'il
existe une association des génotypes HPA-2a/2b ou HPA-2b/2b avec L'IS ou
avec des maladies cardio-vasculaires. D'ailleurs, c'est parce que le
polymorphisme HPA-2 est localisé près des sites de fixation du
FvW et la thrombine qu'il pourrait causer une variation conformationnelle dans
la structure de GPIbá qui peut affecter le site de liaison des ligands.
Le système HPA-2 fait modifier la conformation au
niveau de la région aa-1-59 de GPIbá, ce qui résulte en
une interaction plus forte du FvW avec HPA-2a (Ulrichts. H et al.,
2003). L'association entre le polymorphisme VNTR et les
événements thrombotiques est vague parce que GPIbá est
aussi un récepteur pour P-sélectine, Mac-1, FXI, FXII et le
kininogène de haut poids moléculaire. Le polymorphisme HPA-2
pourrait affecter aussi ces interactions qui pourraient être à la
base de risques thrombotiques (Ulrichts H et al., 2003).
Un nombre limité d'études ont
démontré une association entre les allèles
Met145 (VNTR A ou B) et le risque des maladies cardio-vasculaires
(Murata. M et al., 1992; Murata. M et al., 1997; Gonzalez-Conejero. R et
al., 1998; Murata. M et al., 1998) tandis que d'autres études n'ont
pas trouvé cette association (Carlsson. L. E et al., 1997; Carter.
A. M et al., 1998). Dans une étude récente le HPA-2
Met/VNTR-B a été associé à des
événements importants de l'IM et la mort des vieillards malades
(Mikkelsson. J et al., 2001).
Les études ont des contradictions dans la
répartition du risque de polymorphisme du complexe GPIb/IX/V dans
différents groupes ethniques. Chez les populations européennes,
le génotype VNTR B/C est associé à une augmentation du
risque des maladies de l'artère coronaire dans la population espagnole,
mais aucune association n'a été détectée chez la
population française (Mercier. B et al., 2000). En outre, Chez
les Américains, le génotype VNTR C/C est associe avec un risque
faible des événements coronaires (Murata. M et al., 1998;
Afshar-Kharghan. V et al., 1999a). La présence de l'allèle
VNTRB possède un risque significatif de NAION
(Salomon. O et al., 2004).
| 


