III- Caractérisation
biochimique de la lipase digestive de crabe vert
1- Activité lipasique en fonction
de la température
Il est bien établi que tous les enzymes
lipolytiques du règne animal agissent à 37°C. A cette
température une faible activité est décelée dans
l'hépatopancréas de crabe. Par contre (figure 7) une augmentation
de la température de 37°C à 60°C s'accompagne par une
augmentation significative de l'activité lipolytique. Ce résultat
surprenant mérite, dans l'avenir, d'être expliqué sur le
plan physiologique et biochimique.
TC4/pH 8
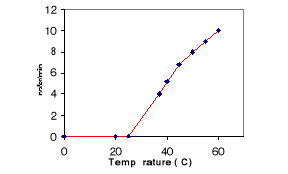
Figure 7 : Profil d'hydrolyse d'une
émulsion de TC4 par la LDC à températures
croissantes.
2- Cinétique
d'hydrolyse de la tributyrine et de l'huile d'olive
Pour avoir une idée sur le comportement aux
interfaces de la LDC, on a suivi l'hydrolyse d'une émulsion de
tributyrine (TC4) et d'une émulsion d'huile d'olive par la LDC en
fonction du temps. Les résultats sont présentés dans la
figure 8.
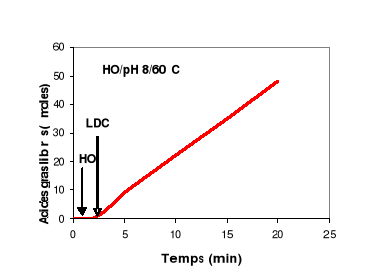
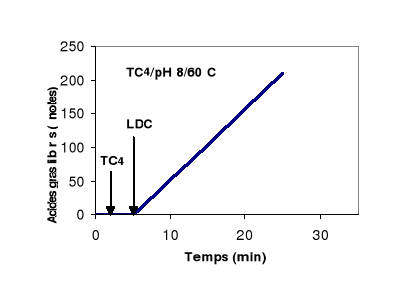

Figure 8 : Cinétique d'hydrolyse d'une
émulsion de HO et de TC4 par la LDC. L'activité lipasique est
mesurée à pH 8 et à 60°C.
Cette figure montre que quelque soit la longueur de la
chaîne acyle du TG, la LDC présente une cinétique
d'hydrolyse qui reste linéaire pendant 20 min. On peut donc conclure que
malgré la tension interfaciale élevée à l'interface
TC4/eau, et malgré l'accumulation des acides gras libres à
chaînes longues à l'interface HO/eau, la LDC continue à
hydrolyser efficacement ses substrats. Ces résultats montrent que la LDC
est plus stable aux interfaces que la plupart des lipases pancréatiques
(Gargouri et al., 1983 ;1984 a ; 1984 b ; 1985).
3- Effet du pH sur
l'activité de la LDC
L'activité spécifique a été
mesurée à différents pH et à 60°C
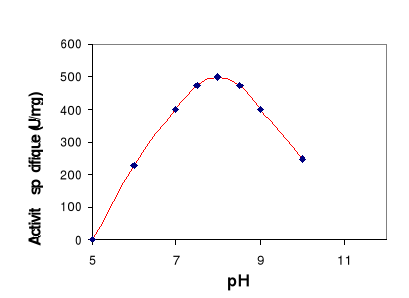
Figure 9 : Effet du pH sur l'activité
de la LDC. L'activité lipasique est mesurée à
différents pH et à 60°C sur une émulsion de
tributyrine.
Ces résultats montrent que la LDC présente un pH
optimum égale 8 et elle est capable d'agir dans un large spectre de pH
compris entre 7 et 10. Une activité spécifique de 500 U/mg est
obtenue à pH 8 en utilisant la tributyrine comme substrat.
4- Stabilité de la
LDC en fonction de pH
La LDC a été incubée à
température ambiante à différents pH et. L'activité
lipasique est mesurée après 30 min d'incubation. La figure 10
montre que la LDC reste stable dans un large spectre de pH compris entre 5 et
9. Aux pH extrêmes l'enzyme est inactivé.
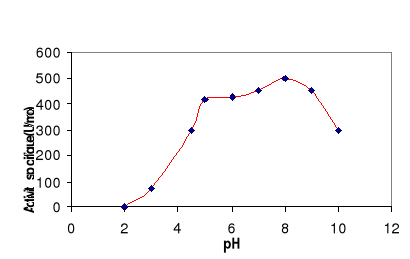
Figure 10 : Effet du pH sur la
stabilité de la LDC. L'enzyme est incubé à
différents pH dans différents tampons, à
température ambiante. L'activité spécifique est
mesurée sur la tributyrine comme substrat à pH 8 et à
60°C.
| 


