|
REPUBLIQUE DEMOCRATIQUE DU CONGO
MINISTERE DE L'ENSEIGNEMENT SUPERIEUR ET
UNIVERSITAIRE
UNIVERSITÉ PROTESTANTE AU CONGO
FACULTÉ DE MÉDECINE
B.P. 4745 KINSHASA II
Site web: www.upc-rdc.cd
ASSOCIATION CANCER DE LA
VESSIE ETSCHISTOSOMIASE A SCHISTOSOMA HAEMATOBIUM A L'HOPITAL GENERAL DE
REFERENCE IME/KIMPESE DE JUIN 2011 A NOVEMBRE 2021
EBAMBE BOMBEKO MICHAEL
Gradué en Sciences
Biomédicales
Mémoire présenté et défendu en vue
de l'obtention du Titre de Docteur en Médecine.
Directeur : Professeur Dr LEBWAZE MASAMBA Bienvenu
Année académique :
2020-2021
EPIGRAPHE
« Comprendre, c'est déjà agir ; mesurer, c'est
déjà soigner. »-- Françoise Dolto
DEDICACE
En gage de ma profonde
affection, je dédie ce travail à ceux qui ont semé en moi
les valeurs et les principes de la persévérance et du courage,
à mes parents : Ebambe Mayebe Louis Faustin Michel et
AkindoaManzela Augustine.
REMERCIEMENTS
A la fin de notre formation en médecine à
l'Université Protestante au Congo (UPC), qu'il nous soit permis de nous
acquitter d'un agréable devoir, celui de remercier tous ceux qui ont
contribué de près comme de loin à notre formation et
à l'élaboration du présent travail ;
A l'Eternel Dieu Tout Puissant, qui est avecmoi depuis mes
faibles commencements jusqu'à ce jour, l'Alpha et l'Omega, le
Maître detemps et decirconstances.
Aux Autorités académiques et lesprofesseurs qui
nous ont formés tout au long de notre parcours à la
faculté de médecinede l'UPC.
Au Professeur Dr Bienvenu Lebwaze
Massamba,Anatomo-Cytopathologiste et Directeur National du Centre National de
lutte contre le Cancer(RDC) qui, en dépit de toutes ses occupations, a
bien accepté de me soutenir dans la direction de ce travail, qu'il
trouve par ces mots malgré courts, mes sincères gratitude et
reconnaissance pour sa disponibilité, sa compréhensionet son
attention soutenue tout au long de cette étude.
Au Docteur Michel KAMBU, Coordonnateur Provincial au Programme
des Maladies Tropicales Négligéesdans la province du Kongo
Central(RDC)qui, en dépit de ses
responsabilités et occupations, a bien voulu disposer de son temps pour
contribuer à l'élaboration de ce travail.
A tous les professionnels de santé et administratifs de
l'HôpitalGénéral de Référence IME/Kimpese,
qui ont été très disponiblesdans lafacilitation de la
prise d'informations et la collecte des données.
A toute ma famille, mes amis et connaissances.
|
ADN
|
:
|
Acide DésoxyriboNucléique
|
|
ANAPATH
|
:
|
Anatomie Pathologique
|
|
BCG
|
:
|
Bacille de Calmette et Guérin
|
|
CIRC
|
:
|
Centre International de Recherche sur le Cancer
|
|
EIQ
|
:
|
Ecart InterQuartile
|
|
GLOBOCAN
|
:
|
Global Cancer Observatory
|
|
HGR
|
:
|
Hôpital Général de Référence
|
|
IME
|
:
|
Institut Médical Évangélique
|
|
MTN
|
:
|
Maladies Tropicales Négligées
|
|
OMS
|
:
|
Organisation Mondiale de la Santé
|
|
OR
|
:
|
Odds Ratio
|
|
PSA
|
:
|
Prostate SpecificAntigen
|
|
RDC
|
:
|
République Démocratique du Congo
|
|
SH
|
:
|
Schistosoma Haematobium
|
|
SSH
|
:
|
Schistosomiase à Schistosoma Haematobium
|
|
TNM
|
:
|
TumorNodesMetastasis
|
|
TVIM
|
:
|
Tumeur Vésicale Infiltrant le Muscle
|
|
TVNIM
|
:
|
Tumeur Vésicale N'Infiltrant pas le Muscle
|
|
UPC
|
:
|
Université Protestante au Congo
|
|
ZS
|
:
|
Zone de Santé
|
LISTE
D'ABRÉVIATIONS
TABLE DES MATIÈRES
EPIGRAPHE
2
DEDICACE
3
REMERCIEMENTS
4
LISTE D'ABRÉVIATIONS
5
TABLE DES MATIÈRES
6
RESUME
9
ABSTRACT
10
INTRODUCTION
11
1. Problématique
11
2. Contexte et justification
12
3. Question de recherche
13
3.1. Question principale (ou
générale)
13
3.2. Questions secondaires (ou
spécifiques)
13
3.2.1. Questions centrées sur l'association
et le vécu des patients
13
3.2.2. Questions sur la gravité et le
pronostic
14
3.2.3. Questions sur le parcours diagnostique et
les déterminants sociaux
14
3.2.4. Questions orientées prévention
et interventions
14
4. Objectifs
14
4.1. Objectif général
14
4.2. Objectifs spécifiques
15
5. Structure du travail
15
CHAPITRE I : GENERALITES
16
1. 1. Généralités sur le
cancer de la vessie
16
1.1.1. Incidence et répartition
géographique
16
1.1.2. Facteurs de risque classiques
16
1.1.3. Types histologiques
16
Figure 1 : Aspect histologique normal des
tissus
17
Figure 2 : Adénocarcinome avec infiltration
de la sous-muqueuse
17
1. 2. Bilharziose urinaire (Schistosoma
Haematobium) et cancer de la vessie
17
1.2.1. Cycle parasitaire et impact tissulaire
17
1.2.2. Mécanisme physiopathologique de
carcinogenèse
17
1.2.3. Données
épidémiologiques de l'association
18
1.3. Présentation clinique du cancer de la
vessie en contexte bilharzien
18
1.3.1. Symptômes
18
1.3.2. Diagnostic
19
1.3.3. Retards diagnostiques et
conséquences
19
1.4. Approches diagnostiques et classification des
tumeurs vésicales
19
1.4.1. Classification TNM
19
1.4.2. Diagnostic avancé
20
1.5. Prise en charge thérapeutique des
tumeurs vésicales dans un contexte bilharzien
20
1.5.1. Traitement des tumeurs non infiltrantes
20
1.5.2. Traitement des tumeurs infiltrantes
20
1.5.3. Traitement de la bilharziose
20
1.6. Pronostic et perspectives
21
1.6.1. Pronostic
21
1.6.2. Survie observée
21
1.7. Prévention et lutte contre la
bilharziose urinaire
21
1.7.1. Prévention primaire
21
1.7.2. Dépistage et surveillance
ciblée
21
1.8. Conclusion
22
CHAPITRE II. METHODOLOGIE
23
2.1. Nature et période d'étude
23
2.2. Cadre de l'étude
23
2.3. Définition des cas
23
2.3.1. Critères d'inclusion
23
2.3.2. Critères d'exclusion
24
2.4. Choix des témoins
24
2.4.1. Stratégie d'appariement
24
2.4.2. Ratio cas/témoins
24
2.4.3. Calcul de la taille d'échantillon
25
A. Hypothèses
25
B. Outil de calcul
25
2.5. Collecte de données
25
2.5.1. Sources d'information
25
2.5.2. Création d'une grille de collecte
standardisée
25
2.5.3. Contrôle qualité
26
2.6. Analyse statistique
26
2.6.1. Analyses descriptives
26
2.6.2. Analyse bivariée
26
2.6.3. Analyse multivariée
26
2.6.4. Interprétation des
résultats
27
2.7. Gestion des biais
27
2.8. Considérations éthiques
27
CHAPITRE III. RESULTATS
28
A. ANALYSES DESCRIPTIVES
28
3.1- DONNÉES SOCIODÉMOGRAPHIQUES
28
Tableau 1 : Profil sociodémographique des
320 participants (cas & témoins)
28
3.2- ANTÉCÉDENTS & EXPOSITIONS
(variables clés de l'étude)
29
Tableau 2 : Description des
antécédents & expositions (cas & témoins)
29
3.3- SYMPTÔMES & EXAMENS CLINIQUES
31
Tableau 3. Symptômes et signes cliniques
retrouvés dans les dossiers
31
3.4- EXAMENS PARACLINIQUES
32
Tableau 4. Examens paracliniques
pratiqués
32
3.5- TRAITEMENT
33
Tableau 5. Prise en charge thérapeutique
33
3.6- ÉVOLUTION / STATUT AU DERNIER
CONTACT
34
Graphique 1. Statut vital et suivi
34
B. ANALYSES BIVARIEES (Odds ratio et Chi²)
35
3.7- FORCE D'ASSOCIATION
35
Tableau 6 - Tableau de contingence
(antécédent de schistosomiase)
35
C. ANALYSE MULTIVARIEE (Régression
logistique)
35
Tableau 7 - Modèle logistique
ajusté
35
CHAPITRE IV : DISCUSSION
37
4.1-DONNEES SOCIODEMOGRAPHIQUES
37
4.2-ANTECEDENTS & EXPOSITIONS
38
4.3-SYMPTOMES & EXAMENS CLINIQUES
39
4.4-EXAMENS PARACLINIQUES
39
4.5-TRAITEMENT
40
4.6-ÉVOLUTION / STATUT AU DERNIER
CONTACT
41
4.7-FORCE D'ASSOCIATION
41
CONCLUSION
43
LIMITES DE L'ETUDE ET PERSPECTIVES
45
LIMITES DE L'ETUDE
45
PERSPECTIVES DE RECHERCHE ET D'ACTION
45
REFERENCES BIBLIOGRAPHIQUES
47
ANNEXES
51
FICHE D'EXTRACTION DES DONNÉES (REGISTRES
HOSPITALIERS)
51
1 RESUME
Introduction :Le cancer se caractérise
par une prolifération anarchique de cellules atypiques envahissant les
tissus sains. Les carcinomes, issues de la muqueuse, représentent
environ 90% des cancers. Cette prolifération résulte
d'interactions complexes entre facteurs génétiques et agents
cancérigènes physiques, chimiques ou biologiques. À
l'échelle mondiale, l'incidence et la mortalité varient selon le
niveau de ressources, les progrès en dépistage étant
limités en Afrique, où la bilharziose, très
répandue, favorise les cancers épidermoïdes de la vessie. En
RDC, le fardeau est mal documenté et exacerbé par des diagnostics
tardifs et des ressources limitées.
Objectifs : L'étude vise à
déterminer si un antécédent d'infection par S.H. augmente
le risque de cancer de la vessie, entraîne des formes histologiques plus
agressives et retarde le diagnostic chez les patients au HGR IME/Kimpese. Les
objectifs spécifiques incluent la quantification de la prévalence
de la bilharziose, la comparaison des caractéristiques cliniques et
socio-économiques, l'évaluation du lien avec les formes
agressives, l'analyse des délais diagnostiques, l'identification des
facteurs d'exposition, l'impact du traitement par praziquantel, et
l'élaboration de recommandations locales pour améliorer
dépistage et prévention.
Méthodologie :Étude
cas-témoinsrétrospectivemenée à l'HGR IME/Kimpese
(2011-2021) pour explorer l'associationschistosomiaseurinaire et cancer
vésical. 160 cas histologiquement confirmés appariés
à 160 témoins hospitaliers selon âge, sexe,
résidence. Données (dossiers, registres laboratoire-anapath)
collectées via grille standardisée. Analyses descriptives
(fréquence, médiane) des variables puis multivariées (Odds
ratio, ÷², régression logistique) sous STATA ; biais
contrôlés, confidentialité respectée,
strictement.
Résultats
:Cancer de la vessie touche surtout hommes âgés
(médiane 65 ans), résidents zones bilharziose, souvent
agriculteurs exposés à eau infestée.
Antécédent schistosomiase associé au risque
élevé (OR ajusté 10,52), exposition chimique aussi (OR
2,37). Tabagisme non significatif ici. Symptômes dominés par
hématurie, carcinome épidermoïde fréquent.
Traitements chirurgicaux courants, suivi difficile.
Conclusion : Le profil des patients,
majoritairement hommes âgés, agriculteurs en zone endémique
bilharzienne, reflète une exposition prolongée et des
vulnérabilités sociales. L'antécédent de
schistosomiase multiplie par 11 le risque de cancer vésical,
accentué par une prévention insuffisante. Le retard au
diagnostic, l'accès limité aux traitements, et l'insuffisance du
suivi exacerbent la gravité et la mortalité.
Mots clés :Schistosoma Haematobium;
Schistosomiase urinaire ; Hématurie ; Cancer de la vessie ; IME/Kimpese
; Zone d'endémicité ; Carcinome
épidermoïde ; Praziquantel ;Dépistage.
2 ABSTRACT
Introduction:Cancer is characterized by the
uncontrolled proliferation of atypical cells that invade healthy tissues.
Carcinomas, originating in the mucous membrane, account for approximately 90%
of cancers. This proliferation results from complex interactions between
genetic factors and physical, chemical, or biological carcinogens. Globally,
incidence and mortality vary according to resource levels, with limited
progress in screening in Africa, where widespread schistosomiasis promotes
squamous cell carcinoma of the bladder. In the DRC, the burden is poorly
documented and exacerbated by late diagnoses and limited resources.
Objectives :The study aims to determine
whether a history of schistosomiasis infection increases the risk of bladder
cancer, leads to more aggressive histological forms, and delays diagnosis in
patients at the HGR IME/Kimpese. Specific objectives include quantifying the
prevalence of schistosomiasis, comparing clinical and socioeconomic
characteristics, assessing the link with aggressive forms, analyzing diagnostic
delays, identifying exposure factors, evaluating the impact of praziquantel
treatment, and developing local recommendations to improve screening and
prevention.
Methodology:A retrospective case-control
study was conducted at the HGR IME/Kimpese (2011-2021) to explore the
association between urinary schistosomiasis and bladder cancer. 160
histologically confirmed cases were matched with 160 hospital controls based on
age, sex, and residence. Data (medical records, laboratory and pathology
registers) were collected using a standardized grid. Descriptive analyses
(frequency, median) of variables were followed by multivariate analyses (odds
ratio, ÷², logistic regression) using STATA; bias was controlled, and
confidentiality was strictly maintained.
Results:Bladder cancer primarily affects
older men (median age 65 years), residents of schistosomiasis-prone areas, and
often farmers exposed to contaminated water. A history of schistosomiasis is
associated with a high risk (adjusted OR 10.52), as is chemical exposure (OR
2.37). Smoking was not a significant risk factor. Symptoms are dominated by
hematuria, and squamous cell carcinoma is common. Surgical treatments are
standard, but follow-up is challenging.
Conclusion: The patient profile,
predominantly elderly men and farmers in schistosomiasis-endemic areas,
reflects prolonged exposure and social vulnerabilities. A history of
schistosomiasis increases the risk of bladder cancer elevenfold, a risk
exacerbated by inadequate prevention. Delayed diagnosis, limited access to
treatment, and insufficient follow-up worsen the severity of the disease and
increase mortality.
Keywords:Schistosoma Haematobium ; Urinary
schistosomiasis ; Hematuria ; Bladder cancer ; IME/Kimpese ; Endemic area ;
Squamous cell carcinoma ; Praziquantel ; Screening.
3 INTRODUCTION
3.1.1 1. Problématique
Le cancer se caractérise par une prolifération
désordonnée de cellules atypiques qui envahissent et
détruisent les tissus sains de notre organisme. Depuis longtemps, le
terme « tumeur maligne » est utilisé comme synonyme
de cancer. Quand cette prolifération anormale prend naissance au niveau
de la muqueuse, on parle alors de carcinome, tandis qu'un léiomyome
désigne une tumeur localisée dans la couche musculaire. Il faut
souligner que les carcinomes représentent environ 90 % des cancers, ce
qui s'explique par la vulnérabilité de la muqueuse à
diverses agressions1,2.
Cette croissance incontrôlée et pathologique est
souvent le fruit d'interactions complexes entre des facteurs
génétiques propres à chaque individu et des agents
cancérigènes présents dans son environnement. Ces agents
peuvent être regroupés en trois grandes catégories : les
physiques (comme les rayons ultraviolets du soleil ou les radiations
ionisantes), les chimiques (tels que l'amiante ou certains composants de la
fumée du tabac) et les biologiques (notamment certains parasites ou
virus favorisant le développement tumoral)3,4.
Au niveau mondial, le nombre de cas de cancer a augmenté
globalement avec le vieillissement des populations, les changements de modes de
vie et l'urbanisation, mais la charge et les types de cancers varient fortement
entre pays à revenu élevé et faible ; les progrès
en dépistage et traitement ont amélioré la survie dans de
nombreux pays riches, tandis que l'accès limité aux soins dans
les pays à ressources contraintes maintient une mortalité
élevée5,6.Le fardeau des cancers a augmenté en
Afrique ; les systèmes de santé affrontent des registres
incomplets, un accès restreint au dépistage et aux traitements
spécialisés, et des diagnostics souvent tardifs, ce qui conduit
à une mortalité proportionnellement élevée; les
politiques de prévention (antitabac, vaccination, lutte contre
infections) et le renforcement des registres sont des priorités
7,8.
À l'échelle mondiale, le carcinome
urothélial lié au tabagisme est le type dominant; en Afrique
subsaharienne, on observe une proportion plus élevée de carcinome
épidermoïde de la vessie associée à la bilharziose
urinaire (Schistosoma Haematobium), et les limitations d'accès à
la cystoscopie, à l'histologie et aux traitements
spécialisés aggravent le pronostic 9,10.
En République démocratique du Congo (RDC), les
données nationales sont fragmentaires, les registres populationnels
complets sont rares, et les estimations modèles (GLOBOCAN/GBD) indiquent
une hausse des cas et une mortalité élevée liée en
partie à la détection tardive et aux ressources limitées
pour la prise en charge; dans les zones où la schistosomiase est
endémique, celle-ci est probablement contributrice au fardeau du cancer
de la vessie, mais des études locales systématiques restent
insuffisantes11-13.
3.1.2 2. Contexte et justification
Actuellement, la majorité des études sur le cancer
de la vessie désignent le tabac comme premier facteur de risque. Ce
constat est confirmé dans diverses recherches américaines et
norvégiennes où la prévalence du tabagisme explique
majoritairement les taux élevés de ce cancer dans les pays
industrialisés14,15.
Dans de nombreuses communautés d'Afrique subsaharienne, la
question du cancer de la vessie n'est pas seulement une donnée
statistique mais plutôt une maladie qui transforme la vie d'un
pêcheur, d'un cultivateur ou d'une mère de famille, d'abord par
des épisodes répétés d'hématurie, de douleur
et de fatigue, puis par l'éloignement du diagnostic et l'accès
limité aux soins. Là où les enfants jouent dans les eaux
infestées et où l'accès à l'eau potable reste
précaire, l'infection par Schistosoma Haematobium demeure
endémique. L'infestation chronique cause une inflammation persistante de
la muqueuse vésicale, des lésions tissulaires et, au fil des
années, un terrain propice à la transformation maligne. Les
tumeurs qui en résultent sont souvent de type épidermoïde,
plus agressives et diagnostiquées à un stade avancé
lorsqu'une prise en charge curative est difficile voire
impossible16-20.Plusieurs raisons rendent urgente et légitime
une étude locale sur l'association schistosomiase et cancer de la vessie
dans ces milieux19,20 :
§ Fardeau persistant de l'infection : malgré des
campagnes de traitement et des efforts de contrôle, des poches de
transmission subsistent et exposent des générations successives.
§ Retard diagnostique et inégalités
d'accès : la cystoscopie, l'anatomopathologie et la chirurgie ne sont
pas toujours disponibles, provoquant des parcours de soins longs et
coûteux pour les familles.
§ Impact socio-économique : le diagnostic tardif
conduit à une mortalité précoce, à la perte de
revenu et à une charge pour les proches, accentuant la
vulnérabilité déjà présente.
§ Lacunes de connaissances locales : peu d'études
robustes quantifient le risque attribuable à S. Haematobium dans des
contextes précis, ni l'effet préventif à long terme des
programmes de traitement de masse.
§ Potentiel d'action immédiate : caractériser
précisément l'association et identifier les facteurs modifiables
(exposition, retard de traitement, pratiques d'eau) oriente des interventions
intégrées ; traitement antibilharzien, assainissement,
dépistage ciblé, susceptibles de prévenir des cancers
évitables.
Cette étude vise donc à documenter le lien
épidémiologique et clinique entre schistosomiase et cancer de la
vessie dans le contexte endémique de la cité de Kimpese
18, à mesurer son impact sur les trajectoires de vie et
à proposer des leviers de prévention opérationnels. En
rendant visibles les parcours des patients et les obstacles du système
de santé, elle ambitionne non seulement d'enrichir la connaissance
scientifique mais aussi d'éclairer des actions concrètes pour
améliorer la santé et l'espérance de vie des populations
touchées.
Cela dit, il semble essentiel de considérer la forte
endémicité de la schistosomiase en Afrique tropicale et
subtropicale, qui pourrait constituer un facteur associé majeur, voire
surpasser dans son impact les autres risques connus16,21.
En outre, cette étude s'inscrit donc dans la
volonté d'identifier et de documenter précisément
l'association possible entre la schistosomiase et le cancer de la vessie chez
les patients suivis à l'Hôpital Général de
Référence IME/Kimpese.
3.1.3 3. Question de recherche
3.1.4 3.1. Question principale (ou générale)
« Dans l'ensemble de cas de cancer de la vessie
diagnostiqués et confirmésau service d'anatomopathologie de
l'hôpital général de Kimpese entre juin 2011 et novembre
2021, un antécédent documenté de la schistosomiase
à Schistosoma Haematobium est?il associé à une
augmentation du risque de cancer de la vessie, à des formes
histologiques plus agressives et à des délais diagnostiques plus
longs comparés aux patients non exposés ? »
3.1.5 3.2. Questionssecondaires (ou spécifiques)
3.1.6 3.2.1. Questions centrées sur l'association et le
vécu des patients
1). Dans cette région endémique à
schistosomiase, les personnes ayant un antécédent d'infection
urinaire à Schistosoma Haematobium sont?elles plus susceptibles de
développer un cancer de la vessie que celles sans
antécédent ?
2). Parmi les patients diagnostiqués du cancer de la
vessie à l'hôpital général de Kimpese, quelle
proportion a un antécédent documenté de bilharziose, et
comment ces patients diffèrent?ils cliniquement des autres ?
3.1.7 3.2.2. Questions sur la gravité et le
pronostic
3). Les patients exposés à la bilharziose(habitant
et ayant longtemps vécu dans la région)arrivent?ils au diagnostic
avec des formes plus agressives (carcinome épidermoïde, stade
avancé) que les patients non exposés ?
4). L'antécédent de schistosomiase est?il
associé à un pronostic plus mauvais (récurrence, survie)
chez les patients cancéreux de notre série ?
3.1.8 3.2.3. Questions sur le parcours diagnostique et les
déterminants sociaux
5). Les patients avec antécédent de schistosomiase
souffrent?ils de délais plus longs entre l'apparition des
symptômes et le diagnostic de cancer vésical, et quels obstacles
(distance, coût, connaissance) expliquent ces retards ?
6). Les facteurs socio?économiques et les pratiques
d'exposition à l'eau (pêche, baignade) sont?ils plus
fréquents chez les cas exposés que chez les témoins ?
3.1.9 3.2.4. Questions orientées prévention et
interventions
7). Le fait d'avoir été traité
antérieurement pour la bilharziose (praziquantel) influence?t?il le
risque ultérieur de cancer de la vessie dans la population ?
8). Les résultats de l'étude mettent?ils en
évidence des priorités locales (dépistage ciblé,
campagnes de traitement, assainissement) pour réduire les cancers
liés à la bilharziose ?
3.1.10 4. Objectifs
3.1.11 4.1. Objectif
général
§ Déterminer si un antécédent
documenté d'infection par Schistosoma Haematobium est associé,
chez les cas de cancer de la vessie diagnostiqués au service
d'anatomopathologie de l'hôpital général de Kimpese (juin
2011 - novembre 2021), à une augmentation du risque de cancer
vésical, à des formes histologiques plus agressives et à
des délais diagnostiques plus longs comparé aux patients non
exposés.
3.1.12 4.2. Objectifs
spécifiques
§ Quantifier la prévalence de
l'antécédent de schistosomiase dans les deux groupes (cas et
témoins).
§ Comparer les caractéristiques cliniques (âge,
sexe, symptômes) et socio-économiques entre les cas exposés
et non exposés à la schistosomiase à Schistosoma
Haematobium.
§ Évaluer si l'exposition à SSH est
associée à des formes histologiques plus agressives de cancer
(carcinome épidermoïde vs carcinome urothélial).
§ Analyser si l'antécédent de schistosomiase
influence le délai entre l'apparition des symptômes et le
diagnostic du cancer.
§ Identifier les facteurs de risque potentiels (pratiques
d'exposition à l'eau, statut socio-économique) associés
à la schistosomiase dans cette population.
§ Explorer si un traitement antérieur par
praziquantel (PZQ) modifie le risque de cancer de la vessie.
§ Enfin, selon les résultats, nous définirons
des recommandations locales, par exemple prioriser le dépistage chez les
personnes à antécédent de bilharziose, renforcer les
campagnes de traitement et améliorer l'accès à
l'assainissement, pour réduire la charge de cancer liée à
la schistosomiase.
3.1.13 5. Structure
du travail
Le travail est structuré en quatre grands chapitres :
· Chapitre I : Généralités sur le
cancer de la vessie et la bilharziose urinaire.
· Chapitre II : Méthodologie.
· Chapitre III : Résultats de l'étude.
· Chapitre IV : Discussion des résultats.
Une conclusion ainsi que des perspectives d'avenir viendront
clôturer cet ensemble.
4 CHAPITRE I : GENERALITES
4.1.1 1. 1.
Généralités sur le cancer de la vessie
4.1.2 1.1.1. Incidence et
répartition géographique
Le cancer de la vessie est le dixième cancer le plus
fréquent dans le monde, avec environ 573 000 nouveaux cas et 213 000
décès estimés en 2020 5. Son incidence augmente
avec l'âge, affectant principalement les sujets de plus de 60 ans. Les
pays développés observent majoritairement des carcinomes
urothéliaux, liés au tabac et aux expositions professionnelles,
alors que dans plusieurs pays africains et du Moyen-Orient, la bilharziose
urinaire constitue un facteur majeur, favorisant des types histologiques
différents5,10.
4.1.3 1.1.2. Facteurs de risque
classiques
Le facteur de risque numéro un reste le tabagisme ;
inhaler quotidiennement les toxines du tabac multiplie par trois à cinq
la probabilité de développer un cancer vésical. Vient
ensuite l'exposition professionnelle, notamment dans les ateliers où
l'on manipule hydrocarbures ou amines aromatiques : ces substances, longtemps
utilisées dans les colorants, la pétrochimie ou la fabrication du
caoutchouc, s'accumulent dans l'urine et agressent durablement
l'urothélium. Tout état d'irritation chronique de la muqueuse,
qu'il s'agisse d'infections urinaires répétées, de calculs
négligés ou d'un cathéter laissé en place des mois,
entretient une inflammation délétère propice à la
transformation cellulaire. Enfin, dans plusieurs régions d'Afrique
subsaharienne, l'infestation par Schistosoma Haematobium provoque des
granulomes persistants qui, avec le temps, favorisent une carcinogenèse
spécifique de type épidermoïde, et hautement
agressive10,22.
4.1.4 1.1.3. Types histologiques
À l'échelle mondiale, la forme la plus
fréquente reste le carcinome urothélial, encore appelé
« transitionalcellcarcinoma » ; il reflète
surtout l'impact des expositions professionnelles à diverses substances
chimiques, notamment les amines aromatiques. En revanche, dans les
régions où la bilharziose est endémique, un autre visage
domine : le carcinome épidermoïde. Nourri par l'irritation
chronique que provoquent les oeufs de Schistosoma Haematobium dans la paroi
vésicale, ce type histologique représente plus de la
moitié des cancers étudiés dans plusieurs séries
africaines. Une enquête menée au Mali illustre bien ce basculement
: 60 % des tumeurs liées à la bilharziose étaient
épidermoïdes, confirmant le rôle clé de l'inflammation
persistante dans la transformation maligne de
l'urothélium5,23.
Figure 1
Figure 2
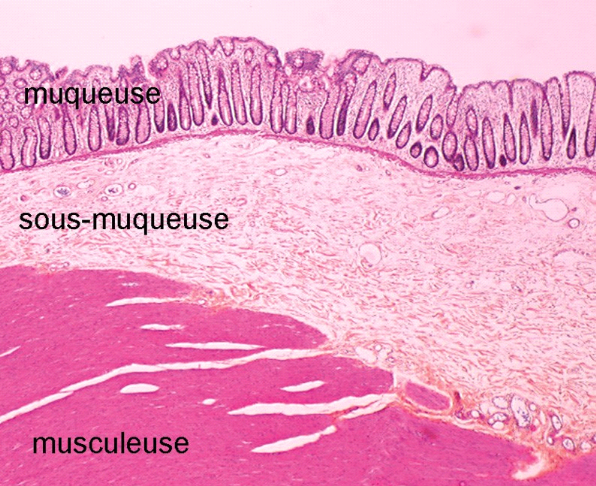 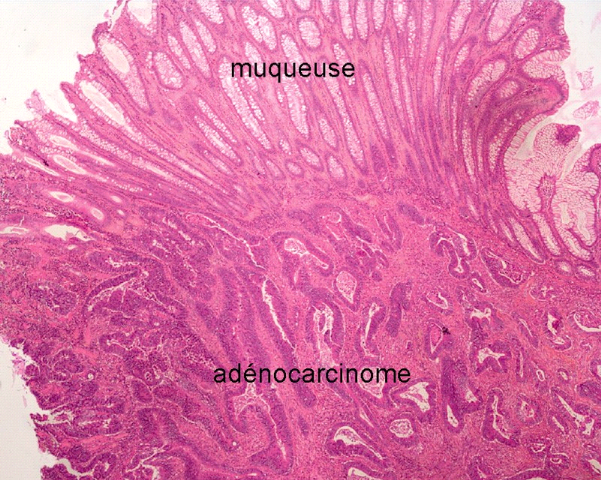
Figure1 : Aspect histologique
normal des tissus
Figure2 :
Adénocarcinome avec infiltration de la sous-muqueuse
4.1.5 1. 2. Bilharziose urinaire
(Schistosoma Haematobium) et cancer de la vessie
4.1.6 1.2.1. Cycle parasitaire et impact
tissulaire
Le Schistosoma Haematobium adulte vit dans le plexus veineux
péri-vésical ; les oeufs migrent à travers la paroi
vésicale, provoquant une inflammation chronique, une formation de
granulomes, une fibrose et parfois une calcification de la paroi
vésicale. Cette irritation prolongée est une cause directe
d'altérations épithéliales pouvant évoluer vers une
transformation maligne24,25.
4.1.7 1.2.2. Mécanisme
physiopathologique de carcinogenèse
Découvert en 1851par Theodor Bilharz, le
S.Haematobium a été premièrement identifié
dans la genèse du cancer de la vessie par Fergusson en 1911 et plus tard
en 1994, cela a été confirmé par le Centre international
de recherche sur le cancer (CIRC) comme étant cancérigène.
La schistosomiase n'a pas été connue pour être
impliquée dans l'étiologie ou la pathogenèse d'une maladie
maligne autre que le cancer de la vessie26.
La persistance des oeufs provoque une inflammation chronique
générant un stress oxydatif et une production
élevée de radicaux libres, altérant l'ADN des cellules
épithéliales 10,22. La métaplasie squameuse
induite par ce microenvironnement inflammatoire favorise l'émergence du
carcinome épidermoïde. L'augmentation des nitrites et des
composés N-nitrosés, issus de bactéries
urinaires, renforce la toxicité locale et la génotoxicité,
participant à l'oncogenèse 10,22.
4.1.8 1.2.3. Données
épidémiologiques de l'association
Une forte corrélation géographique entre
bilharziose et cancer de la vessie a été documentée dans
la vallée du Nil, en Afrique de l'Ouest et en zones endémiques
d'eau douce (lacs, rivières). Plusieurs études
hospitalières rapportent la présence d'oeufs de S.H.dans
les tissus tumoraux : en Afrique, entre 20 et 40 % des cancers vésicaux
exhibent des lésions bilharziennes associées5,10,23.
Par exemple, au Sénégal, une proportion proche de 50 % des
carcinomes étaient épidermoïdes et reliés à la
bilharziose23. La prévalence élevée des formes
avancées infiltrantes au diagnostic est également liée
à cette infection chronique 3.
4.1.9 1.3. Présentation clinique
du cancer de la vessie en contexte bilharzien
4.1.10 1.3.1.
Symptômes
Le cancer de la vessie en contexte bilharzien (schistosomiase
urinaire chronique) se présente typiquement avec des symptômes
liés à l'inflammation et aux lésions causées par le
parasite Schistosoma Haematobium4. L'hématurie macroscopique
(présence visible de sang dans les urines) est le symptôme majeur
et le plus fréquent, souvent chronique et récurrent, et constitue
le principal signal d'alarme chez les patients de zones
endémiques27,28. Les autres manifestations cliniques incluent
des symptômes irritatifs urinaires tels que brûlures mictionnelles,
pollakiurie (besoin fréquent d'uriner) ou dysurie (difficulté
à uriner), qui traduisent l'inflammation vésicale
chronique29. Chez certains patients, des douleurs pelviennes peuvent
apparaître, surtout en cas d'atteinte tumorale avancée ou
d'extension loco-régionale30. La particularité du
cancer bilharzien est la prédominance du carcinome
épidermoïde, conséquence des métaplasies squameuses
induites par l'infection parasitaire chronique, contrairement au carcinome
urothélial plus fréquent en pays non endémiques
22,31. L'hématurie peut être banalisée par les
patients, retardant ainsi le diagnostic et la prise en charge. De plus, la
bilharziose peut entraîner une fibrose vésicale et
urétrale, des lésions génitales (lésions vulvaires,
saignements vaginaux, atteinte prostatique chez l'homme) et des complications
telles que l'insuffisance rénale.
4.1.11 1.3.2.
Diagnostic
Le parcours diagnostique commence souvent par l'observation d'une
hématurie « suspecte », indolore et capricieuse ; chez
l'adulte africain, toute coloration rouge de l'urine doit faire penser à
un possible cancer de la vessie. On réalise alors un examen
cytobactériologique des urines pour écarter une infection banale
et, surtout, un test de filtration à la recherche d'oeufs de Schistosoma
Haematobium, marqueur précieux d'une bilharziose sous-jacente.
L'exploration idéale reste la cystoscopie, qui permet de visualiser
directement la tumeur et de prélever des biopsies ; malheureusement, cet
acte coûteux et technique demeure rare en zone rurale. La certitude
diagnostique est donc apportée par l'anatomopathologie : elle
précise le type histologique, confirme ou non l'origine bilharzienne et
guide ainsi la stratégie thérapeutique3,23.
4.1.12 1.3.3.
Retards diagnostiques et conséquences
En régions endémiques, les délais entre
apparition des symptômes et confirmation sont souvent longs (plusieurs
mois), contribuant à une majorité de diagnostics à stade
infiltrant, difficilement curable3.Les obstacles sont l'accès
limité aux soins, la précarité économique, la
méconnaissance des symptômes, et le recours prioritaire aux
médecines traditionnelles.
4.1.13 1.4.
Approches diagnostiques et classification des tumeurs vésicales
4.1.14 1.4.1.
Classification TNM
Avant d'envisager toute thérapie, il est indispensable de
classer la tumeur selon la profondeur de son implantation dans la paroi
vésicale, car ce seul critère conditionne le pronostic et le
choix des armes. Les lésions Ta et T1, dites non infiltrantes du muscle
(TVNIM), restent cantonnées à la muqueuse ou à la lamina
propria ; elles se prêtent, la plupart du temps, à une
résection endoscopique complétée d'instillations intra
vésicales (BCG ou chimiothérapie) et à une surveillance
rapprochée. À l'inverse, dès que la tumeur franchit la
barrière musculaire : stade T2 ou plus, elle devient une tumeur
infiltrante du muscle (TVIM). L'approche change alors radicalement :
cystectomie radicale, chimiothérapie systémique ou
radio-chimiothérapie combinée deviennent les options prioritaires
pour espérer un contrôle durable de la maladie29.
4.1.15 1.4.2.
Diagnostic avancé
L'évaluation d'un cancer de la vessie repose sur deux
volets complémentaires. D'abord, un scanner thoraco-abdomino-pelvien
couplé à une IRM explore avec précision l'extension
loco-régionale, recherche l'envahissement ganglionnaire et
détecte d'éventuelles métastases pulmonaires,
hépatiques ou osseuses. Ensuite, des biopsies multiples obtenues lors de
la cystoscopie font l'objet d'un examen histologique détaillé et
d'une analyse immunohistochimique. Cette double lecture confirme la nature
urothéliale ou non de la tumeur, attribue un grade de
différenciation, identifie d'éventuelles variantes histologiques
agressives et fournit des marqueurs pronostiques essentiels. Ainsi, l'imagerie
et la pathologie guident conjointement la décision thérapeutique
individualisée, au plus adapté à chaque profil
patient29.
4.1.16 1.5. Prise
en charge thérapeutique des tumeurs vésicales dans un contexte
bilharzien
4.1.17 1.5.1.
Traitement des tumeurs non infiltrantes
Pour les tumeurs non infiltrantes, la prise en charge
débute par une résection transurétrale exhaustive qui
élimine toute masse visible. Ensuite, on administre des instillations
intra-vésicales de BCG ou d'un agent chimiothérapique, choisies
selon le profil de risque, afin de réduire drastiquement les
récidives et la progression à long terme29.
4.1.18 1.5.2.
Traitement des tumeurs infiltrantes
Pour les tumeurs infiltrantes, l'option de
référence reste la cystectomie radicale élargie aux
chaînes ganglionnaires pelviennes. Dans les centres
équipés, on propose auparavant une chimiothérapie
néo-adjuvante à base de cisplatine ; elle diminue la masse
tumorale et améliore la survie, mais son coût et la
nécessité d'un suivi hématologique la rendent souvent
inaccessible sur le continent africain. Le tableau est encore plus complexe
pour les cancers liés à la bilharziose : découverts
tardivement, volumineux, ils réclament de lourdes reconstructions
urinaires qu'aucune structure locale n'est en mesure d'assumer, laissant
parfois le patient sans solution3,29.
4.1.19 1.5.3.
Traitement de la bilharziose
Le praziquantel demeure le traitement de référence
: administré en dose unique ou lors de campagnes de masse, il
élimine la plupart des vers adultes, diminue considérablement la
charge parasitaire et soulage les complications urinaires. Toutefois, son
influence réelle sur la prévention largement définitive du
cancer vésical bilharzien reste encore débattue24.
4.1.20 1.6.
Pronostic et perspectives
4.1.21 1.6.1.
Pronostic
Le sort d'un patient atteint de cancer vésical
dépend avant tout du stade initial, du profil histologique et de la
qualité du traitement reçu. Les tumeurs urothéliales
détectées précocement, correctement
réséquées puis surveillées offrent ainsi des
chances de survie à long terme. À l'inverse, le carcinome
épidermoïde lié à la bilharziose est souvent
découvert plus tard, chez des patients exposés à une
inflammation chronique intense, ce qui alourdit la chirurgie, limite les
options adjuvantes et pèse lourdement sur le pronostic
3,23.
4.1.22 1.6.2.
Survie observée
En Afrique subsaharienne, la survie globale à cinq ans
dépasse rarement 30 %, freinée par le diagnostic tardif, le
défaut d'imagerie et les ressources chirurgicales limitées.
À l'opposé, dans les pays à revenu élevé,
les formes non infiltrantes bénéficient d'une prise en charge
précoce, portant la survie jusqu'à 70 %, voire davantage
aujourd'hui3.
4.1.23 1.7.
Prévention et lutte contre la bilharziose urinaire
4.1.24 1.7.1.
Prévention primaire
L'éradication de la bilharziose passe d'abord par la lutte
contre les escargots, relais du parasite ; épandre des molluscicides
ciblés ou introduire poissons prédateurs, limite leur pullulation
dans les points d'eau douce. En parallèle, la fourniture d'eau potable
traitée, l'aménagement de latrines et la promotion de gestes
d'hygiène rompent la chaîne de transmission. Enfin, des campagnes
de praziquantel distribuées à l'école ou via les centres
communautaires protègent les populations
exposées29,32.
4.1.25 1.7.2.
Dépistage et surveillance ciblée
Dans les zones endémiques, la prévention secondaire
repose sur un dépistage ciblé des riverains exposés ou des
personnes porteuses d'infections chroniques anciennes. Ceux dont l'analyse
d'urine ou l'échographie soulève un doute sont inscrits à
un programme de surveillance cystoscopique périodique, ajusté au
risque individuel, afin d'intercepter toute lésion naissante
suspects29.
4.1.26 1.8.
Conclusion
La relation étroite entre bilharziose urinaire et cancer
de la vessie, notamment par la prédominance du carcinome
épidermoïde, est bien établie dans les régions
endémiques d'Afrique et du Moyen-Orient. Cette parasitose est un facteur
aggravant du retard diagnostique, de la sévérité des
formes cliniques et du pronostic global. La clé d'une meilleure prise en
charge réside dans une combinaison d'actions : prévention
efficace de la bilharziose, amélioration de l'accès au diagnostic
précoce, renforcement des capacités thérapeutiques locales
et recherche approfondie sur les mécanismes moléculaires. Ces
éléments permettront d'espérer une réduction
significative de la morbi-mortalité liée au cancer vésical
dans ces régions.
5 CHAPITRE II. METHODOLOGIE
5.1.1 2.1. Nature et période
d'étude
Il s'agit d'une étude analytique rétrospective type
cas-témoins, axée sur le lien entre la bilharziose à
Schistosoma Haematobium et les cas de tumeurs vésicales chez les
patients diagnostiqués à l'Hôpital Général de
Référence IME/Kimpese durant la période d'étude du
01 Juin 2011 au 30 Novembre 2021.
5.1.2 2.2. Cadre de l'étude
Cette étude a été réalisée
dans le service de chirurgie générale et d'anatomopathologie
à l'HGR IME/Kimpese qui est situé dans la province sanitaire du
Kongo Central, dans la zone santé de Kimpese, dans le territoire de
Songololo en République Démocratique du Congo.
Il est localisé à 222 km au Sud-Ouest de la
Capitale (Kinshasa) et 147 km de la ville portuaire de Matadi.
Il est le seul Hôpital Général de
Référence dans la zone de santé urbano-rurale de Kimpese
sur une superficie de 3900 km². D'une capacité de 400 lits, cet
hôpital comprend plusieurs services médico-chirurgicaux et
médico-techniques notamment la pédiatrie, la médecine
interne, la chirurgie générale, l'orthopédie, la
gynéco-obstétrique, le service de bucco-dentaire,
l'ophtalmologie, l'imagerie médicale, le laboratoire médical et
le service d'anatomopathologie, la kinésithérapie et un
dispensaire qui constitue le service d'accueil et des urgences.
5.1.3
2.3.Définitiondes cas
5.1.4 2.3.1. Critères
d'inclusion
§ Tout patient ayant reçu un diagnostic de cancer de
la vessie (carcinome urothélial, carcinome épidermoïde ou
autre type histologique) confirmé par un examen anatomopathologique
(ANAPATH) au service compétent de l'HGR IME/Kimpese.
§ Diagnostic posé entre le 1?? juin 2011 et le 30
novembre 2021 (période couverte par l'étude).
§ Dossier médical suffisamment complet pour extraire
les informations pertinentes (antécédents, symptômes,
résultats d'examens).
5.1.5 2.3.2. Critères
d'exclusion
§ Cancer de la vessie diagnostiqué en dehors de la
période d'étude.
§ Absence de confirmation histologique (pas d'ANAPATH).
§ Dossier médical incomplet, rendant impossible la
détermination du statut d'exposition à la schistosomiase.
§ Présence d'autres types de cancer concomitant
(biais de confusion)
5.1.6 2.4. Choix des témoins
L'option choisie a été de prendre des
témoins hospitaliers c'est-à-dire les patients consultant le
service de médecine interne et chirurgie générale de l'HGR
IME/Kimpese pour d'autres affections non liées au cancer ou à la
schistosomiase, telle que : traumatismes, infections courantes, etc.).
5.1.7 2.4.1.Stratégie
d'appariement
§ Pour minimiser les biais de confusion dans notre
étude (cas-témoins sur le cancer de la vessie), nous avons
important d'apparier les témoins aux cas selon certains critères
clés, notamment l'âge (#177; 5 ans), le sexe, et la zone de
résidence. Ces variables sont des facteurs de confusion potentiels car
elles sont liées à la fois à l'exposition
étudiée (schistosomiase urinaire) et au risque de la maladie
(cancer de la vessie)33-36.
§ Âge (#177; 5 ans) : Le cancer de la
vessie survient plus fréquemment chez les personnes âgées,
notamment après 65 ans, avec une prévalence plus
élevée autour de 75-84 ans 33-35.
§ Sexe : Les hommes sont plus souvent
atteints que les femmes, avec un risque multiplié par environ 3,8
à 4. Cette différence s'explique par des facteurs biologiques et
des expositions professionnelles ou au tabac plus fréquentes chez les
hommes33-35.
§ Zone de résidence (Kimpese ou
environs) : L'incidence peut varier selon les zones géographiques,
notamment en fonction de l'endémicité à la schistosomiase,
une infection parasitaire reconnue comme un facteur de risque important de
cancer de la vessie. Apparier sur la zone permet de contrôler les
différences d'exposition environnementale 36.
5.1.8 2.4.2.Ratio cas/témoins
Nous avons choisi un ratio cas/témoins de 1:1,
après calcul d'échantillon pour un bon compromis entre
précision et logistique car 1:2 ou 1:3 n'augmente la puissance que
jusqu'à ~1:4 ; au-delà, le gain est négligeable
37.
5.1.9 2.4.3.Calcul de la taille
d'échantillon
5.1.10 A.
Hypothèses
§ Prévalence (P0) de l'antécédent de
schistosomiase chez les témoins : nous estimons prudemment à 10
%ou 0,10.
§ Odds ratio (OR) minimal cliniquement pertinent : 2,5 (une
exposition = 2,5fois de risque).
§ Niveau de signification (á) : 0,05? Zá/2 =
1,96.
§ Puissance statistique (1-â) : 80 %? â = 0,20 ?
Zâ = 0,842.
§ Ratio cas/témoins (R) de 1:1=1
5.1.11 B. Outil de
calcul
A l'aide du logiciel OpenEpi, les valeurs numériques des
hypothèses ci-dessus ont été encodées puis
transformées en taille d'échantillonn et celaa
donnéapproximativement 151. En prévoyant une
marge pour les dossiers incomplets ou illisibles, nous avons
généreusement arrondi à 160 cas et 160
témoins.
5.1.12 2.5.Collecte
de données
5.1.13
2.5.1.Sources d'information
§ Dossiers médicaux des patients
(papier) : antécédents, symptômes, résultats
d'examens, traitements.
§ Registres de laboratoire :
résultats des analyses d'urine (recherche d'oeufs de Schistosoma Haematobium).
§ Registres d'anatomopathologie :
confirmation du diagnostic de cancer, type histologique, grade tumoral.
5.1.14
2.5.2.Création d'une grille de collecte standardisée
Nous allons élaborer un formulaire précis et
détaillé pour uniformiser la collecte d'informations :
§ Identifiants (anonymisés) : code
patient, date de collecte.
§ Données démographiques :
âge, sexe, lieu de résidence, profession, niveau
d'éducation.
§ Antécédents médicaux
: schistosomiase (nombre d'épisodes, traitements reçus),
autres facteurs de risque (tabagisme, exposition professionnelle à des
produits chimiques).
§ Présentation clinique :
symptômes (hématurie, dysurie, pollakiurie), délai entre
les premiers symptômes et le diagnostic.
§ Résultats d'examens :
résultats des analyses d'urine (présence d'oeufs de
Schistosoma Haematobium), échographie vésicale, cystoscopie,
Anapath (type histologique).
§ Traitement : chirurgie,
chimiothérapie, radiothérapie.
§ Suivi : évolution ou statut au
dernier contact.
5.1.15 2.5.3.
Contrôle qualité
Pour minimiser les erreurs, nous avons mis en place une double
saisie d'une partie des données (comparaison et correction des
divergences) et une vérification croisée des informations entre
différentes sources (dossiers et registres), si possible.
5.1.16 2.6.Analyse
statistique
A l'aide du logiciel '' STATA '' version 16.1,
nous allons faire :
5.1.17 2.6.1.Analyses descriptives
§ Calculerles fréquences et les pourcentages pour les
variables catégorielles (ex. : sexe, zone de résidence,
profession, niveau d'étude, antécédent de schistosomiase
urinaire, épisodes de schistosomiase, hématurie, type
histologique, etc.).
§ Pour les variables continues telles que l'âge et
dosage du PSA, déterminerla moyenne etl'écarts-type ; si la
distribution est symétriqueou la médiane et l'écart
interquartile (EIQ) si la distribution est asymétrique.
5.1.18 2.6.2.Analyse bivariée
§ Calculerles odds ratios (OR) pour mesurer l'association
entre l'antécédent de schistosomiase et le cancer de la
vessie.
§ Tests du Chi² ou tests de Fisher pour comparer les
proportions entre les groupes (cas et témoins).
5.1.19 2.6.3. Analyse multivariée
§ Régression logistique pour ajuster les OR sur les
facteurs de confusion potentiels (tabagisme et exposition professionnelle).
5.1.20 2.6.4.
Interprétation des résultats
Nous allons :
§ Tenir compte des intervalles de confiance des OR pour
évaluer la précision des estimations.
§ Interpréter les résultats avec prudence, en
soulignant les limites de l'étude (biais potentiels).
5.1.21 2.7. Gestion
des biais
Les études cas-témoins sont particulièrement
sensibles aux biais. Il est crucial de les anticiper et de les gérer
autant que possible :
§ Biais de sélection : s'assurer que
les témoins sont bien représentatifs de la population source des
cas et des témoins.
§ Biais d'information : utiliser des
définitions claires et standardisées pour les variables et
croiser les sources d'information.
§ Biais de confusion : identifier et
ajuster les facteurs de confusion potentiels dans l'analyse
multivariée
5.1.22 2.8. Considérations éthiques
Notre étude a reçu l'aval de l'autorité
administrative de l'HGR IME/Kimpese. La manipulation des données au
moment de leur collecte, l'enregistrement sur les fiches et analyses
statistiques, a été maintenue anonyme en vue de respecter la
confidentialité des informations. Aucune procédure de la
présente étude n'a été néfaste pour les
participants. Toutes les activités de recherche étaient
exécutées en conformité avec les normes et codes de
conduite acceptables par le principe d'Helsinki.
6 CHAPITRE III. RESULTATS
6.1.1 A. ANALYSES
DESCRIPTIVES
6.1.2 3.1-DONNÉES SOCIODÉMOGRAPHIQUES
Tableau 1 : Profil sociodémographique des 320
participants (cas & témoins)
|
Variable
|
Cas (n = 160)
|
Témoins (n = 160)
|
Total
|
% Cas
|
% Tém.
|
|
1. Sexe
|
|
|
|
|
|
|
§ Homme
|
135
|
131
|
266
|
84
|
82
|
|
§ Femme
|
21
|
24
|
45
|
13
|
15
|
|
§ Non renseigné
|
4
|
5
|
9
|
3
|
3
|
|
2. Âge (années)
|
|
|
|
|
|
|
§ < 60
|
59
|
64
|
123
|
37
|
40
|
|
§ = 60
|
92
|
88
|
180
|
58
|
55
|
|
§ Non renseigné
|
9
|
8
|
17
|
6
|
5
|
|
§ Médiane (EIQ)
|
65 (58-74)
|
60 (50-70)
|
--
|
--
|
--
|
|
3. Zone de résidence
|
|
|
|
|
|
|
§ ZS Kimpese
|
98
|
98
|
196
|
61
|
61
|
|
§ Autres ZS de la région
|
33
|
33
|
66
|
21
|
21
|
|
§ Hors région
|
22
|
22
|
44
|
14
|
14
|
|
§ Non renseigné
|
7
|
7
|
14
|
4
|
4
|
|
4. Profession
|
|
|
|
|
|
|
§ Agriculteur
|
78
|
39
|
117
|
49
|
24
|
|
§ Ménagère
|
17
|
20
|
37
|
11
|
13
|
|
§ Commerçant
|
10
|
43
|
53
|
6
|
27
|
|
§ Enseignant
|
12
|
27
|
39
|
8
|
17
|
|
§ Autres
|
31
|
25
|
56
|
19
|
16
|
|
§ Non renseigné
|
12
|
6
|
18
|
8
|
4
|
|
5. Niveau d'étude
|
|
|
|
|
|
|
§ Aucun
|
8
|
19
|
27
|
5
|
12
|
|
§ Primaire
|
96
|
65
|
161
|
60
|
41
|
|
§ Secondaire
|
36
|
52
|
88
|
23
|
33
|
|
§ Universitaire
|
8
|
16
|
24
|
5
|
10
|
|
§ Non renseigné
|
12
|
8
|
20
|
8
|
5
|
Interprétation
§ Le cancer de la vessie touche surtout les hommes (85 %),
avec un ratio Homme-Femme de 6:1.
§ 58 % des malades sont ont un âge supérieur ou
égal 60 avec une médiane d'âge de 65 ans.
§ La majorité, soit 61 %, des malades habitent la
zone de santé de Kimpese, la zone endémique à bilharziose.
§ Beaucoup travaillent dans le secteur agricole (49 %),
exposés à eau infestée.
§ Le niveau d'instructionest plus faible chez les cas ;
seulement28 % ayant un niveau secondaire et universitaire contre 43 % chez les
témoins.
6.1.3 3.2- ANTÉCÉDENTS & EXPOSITIONS (variables
clés de l'étude)
Tableau 2 : Description
des antécédents & expositions (cas & témoins)
|
Variable
|
Cas (n = 160)
|
Témoins (n = 160)
|
Total
|
% Cas
|
% Tém.
|
|
1. Antécédent de schistosomiase
urinaire
|
|
|
|
|
|
|
· Oui
|
91
|
16
|
107
|
57
|
10
|
|
· Non
|
69
|
133
|
202
|
43
|
83
|
|
· Inconnu / non renseigné
|
0
|
11
|
11
|
0
|
7
|
|
2. Episodes de schistosomiase
|
|
|
|
|
|
|
· Une fois
|
8
|
2
|
10
|
9
|
13
|
|
· Deux fois
|
29
|
5
|
34
|
32
|
31
|
|
· Trois fois ou plus
|
54
|
9
|
63
|
59
|
56
|
|
TOTAL
|
91
|
16
|
107
|
100
|
100
|
|
3. Traitement antibilharzien (praziquantel)
|
|
|
|
|
|
|
· Oui
|
32
|
4
|
36
|
35
|
25
|
|
· Non
|
45
|
9
|
54
|
49
|
56
|
|
· Inconnu
|
14
|
3
|
17
|
15
|
19
|
|
4. Tabagisme
|
|
|
|
|
|
|
· Oui
|
49
|
45
|
94
|
31
|
28
|
|
· Non
|
99
|
103
|
202
|
62
|
64
|
|
· Inconnu
|
12
|
12
|
24
|
8
|
8
|
|
6. Exposition professionnelle aux produits
chimiques
|
|
· Oui
|
40
|
17
|
57
|
25
|
11
|
|
· Non
|
100
|
118
|
218
|
63
|
74
|
|
· Inconnu
|
20
|
25
|
45
|
13
|
16
|
Interprétation
§ 57 % des cas vs 10 % des témoins ont un
antécédent de schistosomiase.
§ Parmi les 91 cas antécédents de
schistosomiase sur 160 cas, 59 % ont eu à faire trois ou plusieurs
épisodes de schistosomiase dans le passé, soit une distribution
similaire, 56% chez les témoins.
§ Seulement 35 % des cas et 25 % des témoins ont
reçu du praziquantel
§ 49 % des cas sans traitement antérieur.
§ Un tiers des cas fument, soit 31% vs les deux tiers (62 %)
des non-fumeurs du tabac. Une distribution similaire chez les
témoins.
§ 24 % des cas rapportent une exposition professionnelle aux
produits chimiques, près du double des témoins.
6.1.4 3.3- SYMPTÔMES & EXAMENS CLINIQUES
Tableau 3. Symptômes et signes cliniques
retrouvés dans les dossiers
|
Symptôme /
Signe
|
Cas (n = 160)
|
Témoins (n = 160)
|
% Cas
|
% Tém.
|
|
1. Hématurie
|
|
|
|
|
|
· Oui
|
118
|
24
|
73,8
|
15,0
|
|
· Non
|
29
|
123
|
18,1
|
76,9
|
|
· Non renseigné
|
13
|
13
|
8,1
|
8,1
|
|
2. Dysurie
|
|
|
|
|
|
· Oui
|
92
|
38
|
57,5
|
23,8
|
|
· Non
|
54
|
109
|
33,7
|
68,1
|
|
· Non renseigné
|
14
|
13
|
8,8
|
8,1
|
|
3. Pollakiurie
|
|
|
|
|
|
· Oui
|
87
|
49
|
54,4
|
30,6
|
|
· Non
|
60
|
98
|
37,5
|
61,3
|
|
· Non renseigné
|
13
|
13
|
8,1
|
8,1
|
|
4. Rétention urinaire
|
|
|
|
|
|
· Oui
|
32
|
14
|
20,0
|
8,8
|
|
· Non
|
114
|
134
|
71,2
|
83,7
|
|
· Non renseigné
|
14
|
12
|
8,8
|
7,5
|
|
5. Douleurs pelviennes /
hypogastriques
|
|
|
|
|
|
· Oui
|
76
|
34
|
47,5
|
21,3
|
|
· Non
|
70
|
113
|
43,7
|
70,6
|
|
· Non renseigné
|
14
|
13
|
8,8
|
8,1
|
|
6. Globe vésical palpable
|
|
|
|
|
|
· Oui
|
23
|
7
|
14,4
|
4,4
|
|
· Non
|
123
|
139
|
76,9
|
86,9
|
|
· Non renseigné
|
14
|
14
|
8,7
|
8,7
|
Interprétation
§ Hématurie dominante : 73,8 % des cas vs 15 % des
témoins
§ Troubles irritatifs : dysurie et pollakiurie, plus
fréquents chez les cas (57,5 % et 54,4 %)vs 23,8 % et 30,6 % chez les
témoins.
§ Douleurs pelviennes plus courantes chez les cas (47,5 % vs
21,3 %).
§ Signes de gravité (rétention, globe
vésical) moins fréquents mais plus de 2× chez les cas (20 %
et 14,4 %) par rapport aux témoins.
§ 8 à 13 % de données manquanteset
équilibrées entre groupes, limitant ainsi le biais d'information.
6.1.5 3.4- EXAMENS PARACLINIQUES
Tableau 4. Examens paracliniques pratiqués
|
Examen / Modalité
|
Cas (n = 160)
|
Témoins (n = 160)
|
Total
|
% Cas
|
% Tém.
|
|
1. ANALYSE D'URINE (sédiment)
|
|
|
|
|
|
|
· Réalisée
|
136
|
96
|
232
|
85,0
|
60,0
|
|
- OEufs de S. Haematobium présents *
|
68
|
5
|
73
|
50,0
|
5,2
|
|
- OEufs absents *
|
68
|
91
|
159
|
50,0
|
94,8
|
|
· Non réalisée
|
18
|
54
|
72
|
11,3
|
83,8
|
|
· Non renseigné
|
6
|
10
|
16
|
3,7
|
6,2
|
|
2. ÉCHOGRAPHIE VÉSICALE
|
|
|
|
|
|
|
· Réalisée
|
144
|
64
|
208
|
90,0
|
40,0
|
|
- Lésion = 3 cm détectée
**
|
82
|
6
|
88
|
56,9
|
9,4
|
|
- Lésion < 3 cm ou aspect suspect
|
38
|
10
|
48
|
26,4
|
15,6
|
|
- Échographie normale
|
24
|
48
|
72
|
16,7
|
75,0
|
|
· Non réalisée
|
10
|
82
|
92
|
6,3
|
51,2
|
|
· Non renseigné
|
6
|
14
|
20
|
3,7
|
8,8
|
|
3. DOSAGE PSA (hommes
uniquement)
|
|
|
|
|
|
|
· Réalisé (n hommes : 135 cas ; 131
témoins)
|
119
|
55
|
174
|
88
|
42
|
|
· Non réalisé / Non renseigné
|
16
|
76
|
92
|
22
|
58
|
|
- Médiane PSA [IQR], ng/mL
|
2,9 [1,4-5,6]
|
1,8 [0,9-3,0]
|
--
|
--
|
--
|
|
4. ANATOMO-PATHOLOGIE
|
|
|
|
|
|
|
· Réalisée
|
152
|
18***
|
170
|
95,0
|
11,3
|
|
- Carcinome épidermoïde
|
91
|
0
|
91
|
59,9
|
--
|
|
- Carcinome urothélial
|
49
|
3
|
52
|
32,2
|
16,7
|
|
- Autres / indéterminés
|
12
|
15
|
27
|
7,9
|
83,3
|
|
· Non réalisée
|
4
|
122
|
126
|
2,5
|
76,3
|
|
· Non renseigné
|
4
|
20
|
24
|
2,5
|
12,4
|
* Proportion calculée parmi les analyses d'urine
réalisées.
** Lésion mesurée à
l'échographie.
*** Biopsies prostatiques ou vésicales faites pour
un autre motif (hypertrophiebénigne de la prostate).
Interprétation
§ Examens urinaires : 85 % des cas ont
bénéficié des analysesd'urine(sédimenturinaire) et
chez la moitié (50 %) d'entre eux, on retrouve des oeufs S.
Haematobium.
§ Échographie : pratiquée dans 90 % des cas ;
57 % montrent une masse =3 cm (vs 9 % chez les témoins).
§ PSA(Antigène Spécifique de la Prostate) :
dosé chez près de 2/3 des hommes ; avec une médiane (cas
comme témoins)inférieure à 3 ng/mL), qui insinue une
faible possibilité d'association avec une anomalie prostatique.
§ Diagnostic histologique : 95 % des cas ont
réalisé un examen anatomopathologieet pour 60 % d'entre eux, il
s'agit du carcinome épidermoïde.
§ Données manquantes : 3-12 %, globalement
équilibrées entre groupes.
6.1.6 3.5- TRAITEMENT
Tableau 5. Prise en charge thérapeutique
|
Traitement
|
Cas (n = 160)
|
Témoins (n = 160)
|
Total
|
% Cas
|
% Tém.
|
|
1. TRAITEMENT
CHIRURGICAL
|
|
|
|
|
|
|
· Oui
|
101
|
18
|
119
|
63
|
11
|
|
- Résection trans-urétrale
(RTUV/TURBT)
|
78
|
6
|
84
|
77
|
33
|
|
- Cystectomie partielle
|
22
|
12
|
34
|
22
|
67
|
|
- Cystectomie totale
|
1
|
0
|
1
|
1
|
--
|
|
· Non
|
49
|
132
|
181
|
31
|
83
|
|
· Non renseigné
|
10
|
10
|
20
|
6
|
6
|
|
2. CHIMIOTHÉRAPIE
|
|
|
|
|
|
|
· Oui
|
56
|
8
|
64
|
35,0
|
5,0
|
|
· Non
|
90
|
136
|
226
|
56,3
|
85,0
|
|
· Non renseigné
|
14
|
16
|
30
|
8,7
|
10,0
|
|
3. TRAITEMENT ANTIBILHARZIEN
(post-diagnostic)
|
|
· Oui (Praziquantel 40 mg/kg en dose unique)
|
64
|
18
|
82
|
40
|
11
|
|
· Non
|
78
|
118
|
196
|
49
|
74
|
|
· Non renseigné
|
18
|
24
|
42
|
11
|
15
|
*Les témoins ont parfois
bénéficié d'interventions urologiques ou de
chimiothérapie pour d'autres pathologies (lithiase, hyperplasie,
prostatite).
Interprétation
§ Traitement chirurgical : 63 % des cas ont
bénéficié dela résection trans-urétrale vs
11% des témoinset la cystectomie a été
réalité dans 22 % des cas.
§ 56 % des cas n'ont pas bénéficiéde la
chimiothérapie après diagnostic contre35 % des
bénéficiaires.
§ Pas de radiothérapie.
§ Seulement 40 % des cas ont reçu un traitement
antiparasitaire au Praziquantelaprès le diagnostic (11 % chez les
témoins).
§ 6 à 12 % de manquede renseignement mais
négligeable.
6.1.7 3.6- ÉVOLUTION / STATUT AU DERNIER CONTACT
Graphique 1. Statut vital
et suivi
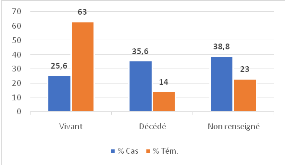
Interprétation
§ Cas (bleu) : 38,8% ont un statut non renseigné, ce
qui est plus élevé que chez les témoins.
§ Témoins (orange) : 23% sont non
renseignés.
6.1.8 B. ANALYSES BIVARIEES (Odds ratio
et Chi²)
6.1.9 3.7- FORCE D'ASSOCIATION
Tableau 6 - Tableau de
contingence (antécédent de schistosomiase)
|
Antécédent
schistosomiase(exposition)
|
Cas (n=160)
|
Témoins (n=149)*
|
Total
|
|
Schisto +
|
91
|
16
|
107
|
|
Schisto -
|
69
|
133
|
202
|
|
Total
|
160
|
149
|
309
|
*11 témoins avec données manquantes
exclus
v Calcul de l'Odds Ratio (OR) brut :
OR = (91/69) ÷ (16/133) = 1.319 ÷
0.120 = 10.99
v Test du Chi² de Pearson :
÷² = Ó[(O-E)²/E] =
72.92 (p < 0.0001)
Interprétation
§ Les patients avec antécédent de
schistosomiase ont 11 fois plus de risque de développer un cancer
vésical que ceux sans antécédent(OR = 10.99; IC95%:
5.92-20.41). Cette association est hautement significative (p < 0.0001).
6.1.10 C. ANALYSE
MULTIVARIEE (Régression logistique)
Tableau 7 - Modèle
logistique ajusté
|
Variable
|
OR ajusté
|
IC 95 %
|
p-value
|
|
Antécédent de schistosomiase
|
10.52
|
5.61-19.74
|
<0.0001
|
|
Tabagisme
|
1.15
|
0.69-1.91
|
0.59
|
|
Exposition professionnelle aux produits chimiques
|
2.37
|
1.26-4.46
|
0.007
|
Interprétation
§ Dans le but d'éliminer l'influence d'autres
variables telles que le tabagisme et l'exposition professionnelle aux produits
chimiques, nous avons ajusté l'odds ratio, afin de normaliser les
résultats et d'isoler l'effet de ces variables sur l'exposition à
la schistosomiase urinaire dans le contexte de notre étude.
§ La schistosomiase reste fortement
associée au cancer vésical (OR ajusté =
10.52).
§ L'exposition professionnelle aux produits chimiques est
également un facteur de risque indépendant (OR ajusté =
2.37).
§ Le tabagisme n'est pas significativement associé
dans cette population d'étude.
7 CHAPITRE IV : DISCUSSION
7.1.1 4.1-DONNEES
SOCIODEMOGRAPHIQUES
Les données présentées dans le
Tableau 1 offrent un aperçu significatif du profil des
patients atteints de cancer vésical dans la région de Kimpese,
une zone connue pour son endémicité bilharzienne. Plusieurs
points clés émergent de cette analyse, corroborés par la
littérature scientifique et ayant des implications en santé
publique.
Avec 85 % des cas de cancer vésical survenant chez des
hommes, notre étude confirme le biais de genre typiquement
observé dans les cancers liés à la
schistosomiase38. Ce ratio Homme : Femme de 6:1 s'explique notamment
par des expositions différenciées : les hommes sont plus souvent
en contact avec des eaux infestées lors des activités agricoles
ou de pêche, augmentant le risque d'infection bilharzienne 16.
Cette disparité appelle des campagnes de sensibilisation ciblant les
hommes, tout en évitant de négliger les femmes, qui peuvent aussi
être exposées lors de tâches domestiques ou agricoles.
L'âge médian des cas est de 65 ans, et 58 % ont = 60
ans. Cela reflète le caractère tardif du diagnostic, mais aussi
la latence entre l'infection bilharzienne (souvent contractée dans
l'enfance) et la cancérogenèse 39. Le vieillissement
dans cette population s'accompagne d'une accumulation d'expositions et d'une
baisse de l'immunité, ce qui aggrave le pronostic.
Il est crucial d'intégrer un dépistage
précoce chez les personnes âgées en zone endémique,
même en l'absence de symptômes aigus.
Le fait que 61 % des cas résident dans la Zone de
Santé (ZS) de Kimpese souligne le lourd fardeau local de la
schistosomiase urogénitale. Kimpese est une zone rurale où
l'accès à l'eau potable est limité et où les
pratiques agricoles exposent régulièrement aux plans d'eau
naturels 40. Cela confirme le rôle des déterminants
géographiques dans la distribution des cancers associés aux
infections parasitaires 41. Une approche de santé publique
territorialisée, ciblant les zones hyperendémiques, est
indispensable.
Près de la moitié (49 %) des cas sont des
agriculteurs, contre seulement 24 % des témoins. Cette
surreprésentation illustre le double fardeau des populations rurales :
exposition professionnelle aux eaux infestées (bilharziose) et possible
utilisation de pesticides 10.
Le travail agricole, souvent informel et sans protection, devient
un facteur de risque socialement structuré. Des programmes de
prévention intégrant des formations sur les risques hydriques et
chimiques sont nécessaires.
Les cas présentent un niveau d'éducation
globalement plus bas : 65 % n'ont dépassé que le primaire ou sont
sans instruction, contre 53 % chez les témoins. Un faible niveau
d'éducation est corrélé à une méconnaissance
des mesures préventives, un recours tardif aux soins et une
difficulté à comprendre les messages de santé
42. Cela renforce la nécessité de messages clairs,
vulgarisés, et diffusés via des canaux adaptés (radio,
leaders communautaires).
7.1.2 4.2-ANTECEDENTS &
EXPOSITIONS
Les données du Tableau 2
révèlent des différences marquées entre les cas et
les témoins, mettant en lumière plusieurs facteurs de risque
importants pour le cancer vésical dans cette population.
La proportion considérable de patients atteints de cancer
vésical ayant des antécédents de schistosomiase (57%
contre 10% chez les témoins) confirme le rôle central du
SchistosomaHaematobium dans la cancérogenèse vésicale en
zones endémiques. Cette association, classée comme
carcinogène certain par le CIRC, s'explique par
l'inflammation chronique et les lésions tissulaires provoquées
par les oeufs du parasite43. Derrière ces chiffres se cache
une réalité telle que ; des patients souvent infectés
dès l'enfance, sans accès à une eau salubre ou à
des mesures préventives adéquates.
Parmi les patients avec antécédent de
schistosomiase, 59% des cas avaient connu trois épisodes ou plus,
suggérant un effet dose-réponse. Chaque réinfection
augmente le risque de lésions précancéreuses, transformant
progressivement la paroi vésicale 39. Cette
répétition d'épisodes infectieux illustre les carences des
systèmes de prévention dans les zones rurales
défavorisées.
Seulement 35% des cas ayant un antécédent
schistosomien avaient reçu du praziquantel. Cetraitement, pourtant
efficace pour réduire la charge parasitaire et l'inflammation chronique,
reste insuffisamment accessible44. Chaque patient non traité
représente une occasion perdue de prévention du cancer,
soulignant l'urgence d'améliorer l'accès aux médicaments
essentiels.
Si le tabagisme (31% des cas) et l'exposition professionnelle aux
produits chimiques (25% des cas) contribuent au risque, leur impact semble
moindre comparé à la schistosomiase. Néanmoins, ces
expositions additives méritent une attention particulière dans
les stratégies de prévention
intégrée45.
7.1.3 4.3-SYMPTOMES
& EXAMENS CLINIQUES
Les données cliniques du Tableau 3
dessinent un tableau cohérent avec la présentation
habituelle du cancer de la vessie.
La prédominance de l'hématurie chez 73,8% des cas
contre seulement 15% des témoins confirme son statut de symptôme
phare du cancer vésical. Cette observation corrobore les données
de la littérature qui indiquent que l'hématurie est le
symptôme initial dans 80-90% des cancers de la vessie 46.
Malheureusement, dans les zones d'endémie schistosomienne,
l'hématurie chronique est souvent banalisée comme une simple
manifestation parasitaire, retardant le diagnostic de complications malignes
10.
La fréquence élevée de dysurie (57,5%) et de
pollakiurie (54,4%) chez les cas reflète l'irritation vésicale
provoquée par la tumeur. Ces symptômes, particulièrement
handicapants au quotidien, altèrent considérablement la
qualité de vie des patients 47. Leur présence chez
près d'un tiers des témoins souligne cependant leur manque de
spécificité, pouvant survenir dans diverses pathologies
urologiques bénignes.
Les douleurs pelviennes/hypogastriques, présentes chez
47,5% des cas, suggèrent souvent une extension tumorale au-delà
de la muqueuse vésicale. Leur relative absence chez les témoins
(21,3%) renforce leur valeur d'orientation vers une pathologie organique
sévère 48. Ces douleurs persistantes contribuent
significativement à la souffrance des patients.
La présence de rétention urinaire (20%) et de globe
vésical palpable (14,4%) chez les cas signale une obstruction
mécanique avancée, nécessitant une prise en charge urgente
49.
Bien que moins fréquents, ces signes sont plus de deux
fois plus présents chez les patients cancéreux, soulignant
l'évolution souvent silencieuse de la maladie.
7.1.4 4.4-EXAMENS PARACLINIQUES
Les données du Tableau 4
révèlent la présence d'oeufs de S. Haematobium chez 50%
des patients atteints de cancer vésical, confirme le lien bien
établi entre schistosomiase urinaire et carcinogenèse
vésicale. Cette association épidémiologique a
été documentée par Mostafa et al. qui ont
démontré le rôle des oeufs de bilharzie dans l'induction
d'une inflammation chronique et de lésions
précancéreuses10. La banalisation de
l'hématurie en zone d'endémie schistosomienne représente
un défi majeur de santé publique, car elle retarde le diagnostic
de complications malignes.
La détection de lésions = 3 cm chez 56,9% des cas,
témoigne d'un diagnostic souvent tardif. Cette observation rejoint les
conclusions de Khaled, qui soulignait que dans les pays endémiques, les
tumeurs vésicales sont généralement diagnostiquées
à un stade avancé en raison de l'accès limité aux
soins spécialisés26. L'échographie, examen non
invasif et relativement accessible, devrait être davantage
utilisée dans le dépistage des populations à risque.
La médiane de PSA à 2,9 ng/mL chez les cas et 1,8
ng/mL chez les témoins, toutes valeurs inférieures au seuil
habituel de 4 ng/mL, suggère une faible implication prostatique dans la
symptomatologie. Ces données confirment les observations de Filella X.
et alliés sur la spécificité relative du PSA dans le
diagnostic différentiel des pathologies urologiques50.
La prédominance du carcinome épidermoïde
(59,9%) par rapport au carcinome urothélial (32,2%) est
caractéristique des séries de cancer vésical en zone
d'endémie schistosomienne. Piero Mustacchiavait déjà
observé laforte représentation du carcinome
épidermoïde de la vessie dans des paysayant une forte
endémicité de la schistosomiase tels que l'Égypte, le
Koweït, le Mozambique, l'Afrique du Sud et le Zimbabwe28.
7.1.5 4.5-TRAITEMENT
Les données du Tableau 5ont
montré que seulement 63% des cas ont bénéficié
d'une intervention chirurgicale, principalement des résections
transurétrales (77% des interventions).
La faible proportion de cystectomies totales (1%) suggère
soit ; les patients arrivent souvent à un stade où la
chirurgie radicale n'est plus possible ou alors un problème lié
au plateau technique. Ces observations corroborent les conclusions de Hussein
Khaled26qui notait que dans les régions endémiques,
les cancers bilharziens sont souvent diagnostiqués à un stade
avancé, limitant les options chirurgicales curatives.
Seulement 35% des cas ont reçu une chimiothérapie,
reflétant les barrières d'accès aux traitements
oncologiques spécialisés. Cette situation rejoint les constats
deDonald Maxwell Parkin30sur les inégalités dans
l'accès aux traitements du cancer dans les pays à ressources
limitées.
Après diagnostic, seulement 40% des cas ont reçu du
praziquantel alors que l'éradication du parasite pourrait limiter
l'inflammation chronique propice à la cancérogenèse. Bruno
Gryseels dans son étude16, a souligné l'importance du
traitement antiparasitaire même après diagnostic de cancer, pour
réduire la charge inflammatoire.
L'absence totale de radiothérapie dans notre série
reflète le manque criant d'équipements de radiothérapie
dans de nombreuses régions d'Afrique subsaharienne, un problème
déjà documenté par Michael Barton et
alliés51 dans leurs études sur les disparités
géographiques dans l'accès à la radiothérapie car
cette dernière combinée à la chimiothérapie
améliorerait le pronostic52.
7.1.6 4.6-ÉVOLUTION/STATUT AU
DERNIER CONTACT
L'ampleur des données manquantes concernant le statut
vital (38,8 %) chez les cas et (23 %) chez les témoins constitue une
limite importante dans l'interprétation des résultats et
soulève des inquiétudes quant à la validité des
conclusions sur l'évolution de la maladie.Cette proportion
élevée de « non renseignés », surtout chez les
cas, pourrait suggérer un biais de sélection : les patients les
plus sévèrement atteints ou ceux ayant eu moins accès au
système de santé sont possiblement surreprésentés
parmi les perdus de vue. Si ces « absents » des données sont
majoritairement décédés ce qui est fréquent dans
les études rétrospectives en contexte de faible
traçabilité, la mortalité réelle serait alors
sous-estimée chez les cas, et les résultats observés (25,6
% de vivants) seraient excessivement optimistes. À l'inverse, une perte
de contact avec des témoins en bonne santé pourrait surestimer la
mortalité dans ce groupe.D'un point de vue méthodologique, ces
manquants compromettent les comparaisons statistiques. Une proportion
supérieure à 20 % de données manquantes, surtout si elles
ne sont pas aléatoires, affaiblit la puissance de l'étude et
introduit un risque d'erreur de classification
différentielle53.
7.1.7 4.7-FORCE D'ASSOCIATION
Le premier regard porté sur nos données frappe par
la force de l'association : un antécédent documenté de
schistosomiase urinaire multiplie par 11 le risque de cancer vésical (OR
brut = 10,99 ; IC95 % 5,9-20,4). Même après ajustement pour le
tabagisme et l'exposition chimique, l'OR demeure à 10,52 ; signe
d'un facteur causal qui domine le paysage étiologique local.
Comparativement, la plupart des cancérogènes « classiques
» (amiante, radon, benzène) oscillent entre 2 et 6 de risque
relatif ; rencontrer un facteur supérieur à 10 est inhabituel et
appelle une mobilisation de santé publique majeure. Ces chiffres
corroborent les observations historiques d'Égypte10,31
où des OR de 2 à 16 avaient déjà été
décrits. Notre étude se situe dans le haut de la fourchette,
probablement parce que Kimpese cumule une endémie ancienne remontant
à l'époque coloniale, des pratiques quotidiennes (bain, lessive,
irrigation) encore largement dépendantes des rivières
infectées et un accès limité au traitement
antiparasitaire, ce qui maintient la charge d'oeufs intra vésicaux sur
plusieurs décennies.
Un tel pouvoir cancérogènetrouve son explication
dans les mécanismes physiopathologiques bien documentés.
L'inflammation chronique provoquée par les oeufs de bilharzie
piégés dans la paroi vésicale crée un
microenvironnement riche en radicaux libres et cytokines
pro-inflammatoires27. Cette tempête inflammatoire permanente
entraîne des dommages à l'ADN, une hyperprolifération
cellulaire et une inhibition de l'apoptose - autant d'étapes vers la
transformation maligne. La séquence métaplasie ? dysplasie ?
carcinome in situ ? cancer invasif se déroule sur des décennies,
expliquant pourquoi la majorité des patients sont diagnostiqués
autour de 65 ans. Cette lente progression offre pourtant une opportunité
cruciale de prévention et de dépistage précoce.
La force de cette association devrait sonner comme une alarme
pour les décideurs en santé publique. Comme le notait
déjà Gryseels16, la lutte contre la schistosomiase
représente probablement la stratégie de prévention
primaire du cancer vésical la plus efficace et rentable dans les
régions endémiques.
Dans les pays industrialisés, le tabagisme amplifie le
risque de cancer vésical13 (Risque Relative 3). À
Kimpese, l'OR ajusté de 1,15 (p = 0,59) montre qu'il n'augmente pas
significativement le risque ; non qu'il soit inoffensif, mais il passe au
second plan face au péril bilharzien. Autrement dit, la «
réputation » épidémiologique du tabac dans le cancer
vésical est sapée par « l'ampleur » de la
schistosomiase. L'exposition professionnelle aux pesticides et solvants
ressort, elle, avec un OR ajusté à 2,37. Plusieurs
composés utilisés dans l'agriculture locale (parathion,
herbicides arsenics) figurent dans les monographies des CIRC38 comme
cancérogènes probables pour la vessie. La synergie inflammation +
chimie pourrait expliquer l'effet additif observé.
8 CONCLUSION
Le profil des patients est sans
ambiguïté : ce sont majoritairement des hommes âgés
(médiane 65 ans), agriculteurs, résidant en zone rurale, avec un
faible niveau d'instruction. Ce portrait est bien justifié car il est
lié à une histoire d'expositions cumulées et de
vulnérabilités sociales. Les hommes, par leurs activités
agricoles et de pêche, sont en première ligne face aux eaux
infestées de bilharzies, expliquant le ratio de 6 hommes pour 1 femme.
Leur âge avancé au diagnostic montre la longue latence de la
cancérogenèse, mais aussi d'un système de santé qui
ne les capture que tardivement, lorsque les symptômes deviennent
invalidants. Le fait que 61% des cas soient concentrés dans la Zone de
Santé de Kimpese souligne le rôle de foyer de forte
endémicitéet de contextesocio-économique précaire,
où le manque d'eau potable et d'assainissement perpétue le cycle
de l'infection. L'agriculture, source de vie pour près de la
moitié des cas, devient ici un facteur de risque mortel, exposant
à un double fardeau : le parasite dans l'eau et les pesticides dans les
champs. Enfin, le faible niveau d'éducation verrouille l'accès
à l'information et aux soins, créant un cercle vicieux de
méconnaissance et de retard diagnostic.
La symptomatologie décrite est celle d'une maladie
déjà avancée. L'hématurie, présente chez
73,8% des cas, est le cri d'alarme de la vessie, mais pisser du sang en zone
d'endémieest trop souvent banalisé comme un « fait normal
», retardant le diagnostic de plusieurs années. La dysurie, la
pollakiurie et les douleurs pelviennes racontent la souffrancequotidienne de
patients dont la qualité de vie est réduite. Le fait que plus de
la moitié des tumeurs fassent déjà plus de 3 cm à
la découverte confirme ce retard,malheureusement tragique.
L'échographie, pourtant simple et accessible, n'est visiblement pas
utilisée assez tôt dans une visée de dépistage.
Seuls 63% des patients ont pu être opérés,
majoritairement par des résections transurétrales. La cystectomie
radicale, traitement curatif pour les tumeurs invasives, n'a concerné
que 1% des cas, insinuant ainsi, soit une insuffisance du plateau technique,
soit le stade trop avancé de la maladie lors de l'admission.
L'accès à la chimiothérapie (35%) et à la
radiothérapie (0%) est trèslimité, reflétant des
fortes inégalités géographiques dans l'accès aux
traitements anticancéreux, un problème bien documenté par
Parkin30 et Barton51. L'omission de traiter le parasite
lui-même après le diagnostic (seulement 40% ont reçu du
praziquantel) serait probablement une erreur stratégique, car
éteindre l'incendie inflammatoire pourrait pourtant ralentir la
progression tumorale, comme le préconisait Gryseels16.
La puissance de l'association est criante car avoir un
antécédent de schistosomiase multiplie le risque de cancer
vésical par près de 11 (OR ajusté = 10,52), un chiffre qui
place le Schistosoma Haematobium parmi les cancérogènes les plus
puissants identifiés par la science, comme le soulignent les
monographies du CIRC38. Cette force s'explique par la biologie
même du parasite : ses oeufs, piégés dans la paroi de la
vessie, déclenchent une tempête inflammatoire chronique qui,
pendant des décennies, endommage l'ADN et pousse les cellules vers la
malignité. Le fait que 59% des cas de cancer de la vessie aient connu
trois épisodes ou plus,montrecombienle système de
prévention est défaillant et seulement 35% d'entre eux avaient
reçu du praziquantel, un traitement efficace et peu coûteux.
Chaque infection non traitée, chaque réinfection, est une
occasion manquée de prévenir un cancer et cette situation
transforme une maladie évitable en fléau pour des populations
entières, comme le dénonce l'OMS en rappelant que la bilharziose
est une maladie de la pauvreté4.
LIMITES DE L'ETUDE ET PERSPECTIVES
LIMITES DE L'ETUDE
Malgré la richesse des informations recueillies, plusieurs
failles méthodologiques tempèrent nos conclusions.
v Conception rétrospective et dossiers
papier
Nous avons travaillé comme des archéologues de
la statistique, fouillant des registres parfois jaunis où une
hématurie pouvait être notée d'une simple croix. Cette
collecte expose à un biais
d'information.
v Statuts vitaux lacunaires
Quatre patients
sur dix, côté cas, se sont volatilisés des radars
sanitaires. Dans une province dépourvue de registre d'état-civil
informatisé, retrouver un patient revient souvent à remonter la
rivière jusqu'au village le plus isolé.
v Mesure approximative des
expositions
· Le tabagisme est codé en « oui /
non », sans quantifier la durée ni l'intensité
;
· L'exposition professionnelle aux pesticides n'a pas
bénéficié d'une liste standardisée.
v Absence de stadification TNM
complète
Sans scanner ni compte rendu histologique
systématique, le stade tumoral précis manquait dans plus d'un
dossier sur deux. Or, corréler le pronostic à la charge tumorale
reste essentiel26.
v Taille d'échantillon et puissance
limitée
Avec 160 cas et 160 témoins, l'étude
est robuste pour la bilharziose, mais sous-dimensionnée pour des
facteurs plus rares ou les interactions tabac - pesticides30.
PERSPECTIVES DE RECHERCHE
ET D'ACTION
v De la rétrospective à la cohorte
prospective
Suivre, dès l'enfance, les habitants
exposés : documenter chaque épisode d'infestation, mesurer la
charge parasitaire par PCR urinaire, consigner le traitement reçu puis
réaliser une échographie vésicale annuelle. Une telle
cohorte préciserait la relation dose-durée et l'impact
réel du praziquantel.
v Numériser les registres et tracer les
patients
v Affiner la mesure des expositions
Adopter
des questionnaires validés pour le tabac et l'alcool ; distribuer des
carnets agricoles listant les pesticides utilisés ; offrir des tests
sérologiques de schistosomiase aux travailleurs des rizières.
Mieux mesurer, c'est déjà mieux prévenir.
v Dépistage communautaire mobile
Une
unité d'échographie itinérante, associée à
un traitement gratuit du parasite pour toute hématurie « banale
», pourrait casser la progression lésionnelle chez des milliers
d'habitants50.
v Intégrer l'axe
eau-pesticides-parasite
Améliorer l'accès à
l'eau potable, distribuer des bottes et des gants aux agriculteurs, promouvoir
les biopesticides : autant de mesures qui réduisent simultanément
l'inflammation parasitaire et l'exposition chimique.
v Plaider pour l'équité
thérapeutique
Créer des partenariats avec les centres
oncologiques urbains, subventionner le transport des patients, mutualiser un
accélérateur de particules pour la radiothérapie
régionale.
REFERENCES BIBLIOGRAPHIQUES
1. National Cancer Institute. What Is
Cancer? - NCI. National Cancer Institute. 2015.
https://www.cancer.gov/about-cancer/understanding/what-is-cancer
2. Ferlay J, Colombet M, Soerjomataram I, et al. Estimating the
global cancer incidence and mortalityin2018: GLOBOCAN sources and methods.
Published online 2018. doi:10.1002/ijc.31937
3. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019. CA
Cancer J Clin. 2019;69(1):7-34. doi:10.3322/CAAC.21551
4. WHO (World Health Organization). Cancer. 2018.
https://www.who.int/news-room/fact-sheets/detail/cancer
5. Sung H, Ferlay J, Siegel RL, et al. Global Cancer
Statistics2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36
Cancers in 185 Countries. CA Cancer J Clin. 2021;71(3):209-249.
doi:10.3322/CAAC.21660
6. Dy GW, Gore JL, Forouzanfar MH, Naghavi M, Fitzmaurice C.
Global Burden of Urologic Cancers, 1990-2013. EurUrol.
2017;71(3):437-446. doi:10.1016/J.EURURO.2016.10.008
7. Global Cancer Observatory. https://gco.iarc.fr/en
8. Group SB, Denny L, Adewole I, et al. On Behalf of the
Executive Council of the African Organisation for Research and Training in
Cancer (AORTIC).; 2013.
9. Burger M, Catto JWF, Dalbagni G, et al. Epidemiology and
riskfactors of urothelialbladder cancer. EurUrol. 2013;63(2):234-241.
doi:10.1016/J.EURURO.2012.07.033
10. Mostafa MH, Sheweita SA, O'Connor PJ. Relationship
betweenSchistosomiasis and Bladder Cancer. Clin MicrobiolRev.
1999;12(1):97. doi:10.1128/CMR.12.1.97
11. Cancer Today. https://gco.iarc.fr/today/en
12. Noncommunicablediseases Democratic Republic of the Congo 2018
country profile.
https://www.who.int/publications/m/item/noncommunicable-diseases-cod-country-profile-2018
13. Freedman ND, Silverman DT, Hollenbeck AR, Schatzkin A, Abnet
CC. Association between smoking and risk of bladder cancer among men and women.
JAMA. 2011;306(7):737-745. doi:10.1001/JAMA.2011.1142
14. Freedman ND, Leitzmann MF, Hollenbeck AR, Schatzkin A, Abnet
CC. Cigarette smoking and subsequentrisk of lung cancer in men and
women:analysis of a prospective cohortstudy. Lancet Oncol.
2008;9(7):649-656. doi:10.1016/S1470-2045(08)70154-2
15. Andreassen BK, Aagnes B, Gislefoss R, Andreassen M, Wahlqvist
R. Incidence and Survival of urothelialcarcinoma of the urinarybladder in
Norway 1981-2014. BMC Cancer. 2016;16(1).
doi:10.1186/S12885-016-2832-X
16. Gryseels B, Polman K, Clerinx J, Kestens L. Human
schistosomiasis. Lancet. 2006;368(9541):1106-1118.
doi:10.1016/S0140-6736(06)69440-3
17. Hotez PJ, Molyneux DH, Fenwick A, et al. Control of Neglected
Tropical Diseases. New England Journal of Medicine.
2007;357(10):1018-1027.
doi:10.1056/NEJMRA064142/ASSET/03E9D853-E92D-4DEA-8053-6124F8C32F91/ASSETS/IMAGES/LARGE/NEJMRA064142_T3.JPG
18. J. GAUD. LES BILHARZIOSES EN AFRIQUE OCCIDENTALE ET EN
AFRIQUE CENTRALE.
https://iris.who.int/bitstream/handle/10665/265545/PM538005.pdf.
19. World Health Organization. Ending the Neglect to Attain
the SustainableDevelopment Goals?: A Road Map for Neglected Tropical Diseases
2021-2030. World Health Organization; 2021.
20. Van Der Werf MJ, De Vlas SJ, Brooker S, et al. Quantification
of clinicalmorbidityassociatedwith schistosome infection in sub-SaharanAfrica.
Acta Trop. 2003;86(2-3):125-139. doi:10.1016/S0001-706X(03)00029-9
21.
https://anafrimed.net/eco-epidemiologie-de-schistosomiase-a-schistosoma-mansoni-zone-de-sante-rurale-de-kimpese-de-2011-2015-eco-epidemiology-of-schistosomiasis-in-schistosoma-mansoni-in-the-rural-health-area/.
22. Mustacchi P. Schistosomiasis and Cancer of the Bladder.
Published online 2003. https://www.ncbi.nlm.nih.gov/books/NBK13949/
23. Mamadou Diallo. PLACE DE LA BILHARZIOSE URINAIRE LES
TUMEURS DE VESSIE AU SERVICE'UROLOGIE DU CENTRE HOSPITALIER UNIVERSITAIRE
TOURÉ.; 2003.
https://bibliosante.ml/bitstream/handle/123456789/7555/03M21.pdf?sequence=1
24. Ishida K, Hsieh MH.
Understandingurogenitalschistosomiasis-relatedbladdercancer: An update.
Front Med (Lausanne). 2018;5(AUG):373022.
doi:10.3389/FMED.2018.00223/BIBTEX
25. Colley DG, Bustinduy AL, Secor WE, King CH. Human
schistosomiasis. The Lancet. 2014;383(9936):2253-2264.
doi:10.1016/S0140-6736(13)61949-2
26. Khaled H. Schistosomiasis and Cancer in Egypt:Review. J
Adv Res. 2013;4(5):461. doi:10.1016/J.JARE.2013.06.007
27. Botelho MC, Machado JC, da Costa JMC. Schistosoma haematobium
and bladdercancer:What lies beneath? Virulence. 2010;1(2):84-87.
doi:10.4161/VIRU.1.2.10487
28. Mustacchi P. Schistosomiasis and Cancer of the Bladder.
Published online 2003. https://www.ncbi.nlm.nih.gov/books/NBK13949/
29. Rouprêt M, Neuzillet Y, Pignot G, et al.
Recommandations françaises du Comité de Cancérologie de
l'AFU - Actualisation 2018-2020 : tumeurs de la vessie. Progres
en Urologie. 2018;28:S46-S78. doi:10.1016/j.purol.2018.07.283
30. Parkin DM. The global healthburden of infection-associated
cancers in the year 2002. Int J Cancer. 2006;118(12):3030-3044.
doi:10.1002/IJC.21731
31. Bedwani R., Renganathan E EKFBCASHAATZAFSBPLVC.
Schistosomiasis and the risk of bladder cancer in Alexandria, Egypt. Br J
Cancer. Published online 1998. doi:10.1038/bjc.1998.197
32. Bilharziose - MedG. https://www.medg.fr/bilharziose/
33. Risques de cancer de la vessie | Société
canadienne du cancer.
https://cancer.ca/fr/cancer-information/cancer-types/bladder/risks
34. Christophe Lelubre MD P. Les études
comparatives non randomisées. Published online 2020.
http://www.pneumocancero.com/Medecine_factuelle/2019-2020/08.%20Lelubre.pdf
35. Saint Pierre P. Epidémiologie. Published online 2021.
moz-extension://274a8b8f-0d0a-4d34-b3ab-b90646719e4c/enhanced-reader.html?openApp&pdf=https%3A%2F%2Fperso.math.univ-toulouse.fr%2Fpsaintpi%2Ffiles%2F2021%2F04%2FFormation_Epidemiologie_Part_3.pdf
36. Critique les résultats d'une étude - LEPCAM.
https://lepcam.fr/index.php/les-etapes/critique/
37. Case-Control Studies: Design, Conduct, Analysis - James J.
Schlesselman - Google Livres.
https://books.google.be/books?hl=fr&lr=&id=5OkyFkYOn0QC&oi=fnd&pg=PA3&dq=1.+Schlesselman+JJ.+Case-Control+Studies:+Design,+Conduct,+Analysis.+Oxford+University.+Press%3B+1982.&ots=phbfd2ZDBt&sig=ZF7wJUfLi22zTuIrOTD0g1w6PzQ#v=onepage&q&f=false
38. Humans IWG on the E of CR to. IARC MONOGRAPHS. IARC
Monogr Eval Carcinog Risks Hum. 1994;61:121-162.
https://www.ncbi.nlm.nih.gov/books/NBK487783/
39. Botelho MC, Machado JC, da Costa JMC. Schistosoma haematobium
and bladdercancer:What lies beneath? Virulence. 2010;1(2):84-87.
doi:10.4161/VIRU.1.2.10487
40. Rapport d'un Comité d'experts de l'OMS. SCHISTOSOMIASE
ET GÉOHELMINTHIASES: PRÉVENTION ET LUTTE. Published online 2002.
https://iris.who.int/handle/10665/42880
41. Vennervald BJ, Polman& K. Helminths and malignancy.
Published online 2009. doi:10.1111/j.1365-3024.2009.01163.x
42. inobaya MT, Olveda RM, Chau TN, Olveda DU, Ross AG, Ross A.
Prevention and control of schistosomiasis:acurrent perspective. Published
online 2014. doi:10.2147/RRTM.S44274
43. WORLD HEALTH ORGANIZATION INTERNATIONAL AGENCY FOR RESEARCH
ON CANCER. WORLD HEALTH ORGANIZATION IARC MONOGRAPHS ON THE EVALUATION OF
CARCINOGENIC RISKS TO HUMANS. IARC MONOGRAPHS. Published online
1996.
44. Preventive in humanhelminthiasischemotherapy. Published
online 2006.
45. Siemiatycki J, Dewar R, Nadon L, Gérin M.
Occupationalriskfactors for bladdercancer:resultsfrom a case-control study in
Montreal, Quebec, Canada. Am J Epidemiol. 1994;140(12):1061-1080.
doi:10.1093/OXFORDJOURNALS.AJE.A117207
46. Messing EM, Vaillancourt A. Hematuria screening for bladder
cancer. J Occup Med. 1990;32(9):838-845.
doi:10.1097/00043764-199009000-00016
47. Heney NM, Ahmed S, Flanagan MJ, et al.
Superficialbladdercancer: progression and recurrence. J Urol.
1983;130(6):1083-1086. doi:10.1016/S0022-5347(17)51695-X
48. Prout GR, Griffin PP, Shipley WU. Bladdercarcinoma as a
systemicdisease. Cancer. 1979;43(6):2532-2539.
doi:10.1002/1097-0142(197906)43:6<2532::aid-cncr2820430654>3.0.co;2-b
49. BLOOM HJG, HENDRY WF, WALLACE DM, SKEET RG. Treatment of T3
bladdercancer:controlled trial of pre-operativeradiotherapy and radical
cystectomy versus radical radiotherapy. Br J Urol. 1982;54(2):136-151.
doi:10.1111/J.1464-410X.1982.TB13537.X
50. Filella X, Molina R, Ballesta AM, et al. Value of PSA
(prostate-specificantigen) in the detection of prostate cancer in patients
withurologicalsymptoms. Results of a multicentrestudy. Eur J Cancer.
1996;32A(7):1125-1128. doi:10.1016/0959-8049(96)00092-5
51. Barton MB, Frommer M, Shafiq J. Role of radiotherapy in
cancer control in low-income and middle-income countries. Lancet
Oncol. 2006;7(7):584-595. doi:10.1016/S1470-2045(06)70759-8
52. James ND, Hussain SA, Hall E, et al. Radiotherapywith or
withoutchemotherapy in muscle-invasive bladder cancer. N Engl J Med.
2012;366(16):1477-1488. doi:10.1056/NEJMOA1106106
53. Little RJA, Rubin DB. Statisticalanalysiswithmissing data.
StatisticalAnalysiswithMissing Data. Published online January 1,
2019:1-449. doi:10.1002/9781119482260
1. 9 ANNEXES
ÉTUDE CAS-TEMOINS RETROSPECTIVE : SCHISTOSOMIASE
& CANCER DE LA VESSIE
HGR IME/KIMPESE
Hôpital/Structure : HGR IME/Kimpese
Service concerné :_________________________________
? Médecine interne ? Chirurgie générale ?
Laboratoire
? Anatomopathologie ? Archives médicales
Extracteur : _________________________________ Date :
____/____/20__
I. IDENTIFICATION DU CAS / TÉMOIN
Code étude (attribué) :
___________________________
Type de sujet : ? Cas (cancer vésical) ? Témoin
(autre pathologie)
Numéro de registre source :
______________________________
Source primaire du dossier :
? Registre d'hospitalisation ? Registre consultations
externes
? Cahier de bloc opératoire ? Registre de laboratoire
? Registre ANAPATH ? Autre (préciser) :
_____________________
II. CARACTÉRISTIQUES
SOCIODÉMOGRAPHIQUES
1. Sexe
? Masculin ? Féminin
2. Âge
Date de naissance : ____/____/____ ? Âge : ____ ans
Groupe d'âge : ?< 60 ans ? = 60 ans
3. Zone de résidence
? Zone de Santé de Kimpese ? Autre ZS de la région
? Hors région ? Non renseigné
FICHE D'EXTRACTION DES DONNÉES (REGISTRES
HOSPITALIERS)
4. Profession principale
? Agriculteur/Agricultrice ? Ménagère ?
Commerçant/Commerçante
? Enseignant/Enseignante ? Autre (préciser) : ________ ?
Non renseigné
5. Niveau d'étude
? Aucun ? Primaire ? Secondaire ?Universitaire ? Non
renseigné
III. ANTÉCÉDENTS & EXPOSITIONS
(variables clés de l'étude)
6. Antécédent de bilharziose urinaire
diagnostiquée
? Oui ? Non ?Non
renseigné
Si Oui :
Nombre d'épisodes
? 1 épisode ? 2 épisodes ? 3
épisodes ou plus ? Non renseigné
7. Traitement par praziquantel reçu
? Oui ? Non ?Non renseigné
8. Tabagisme
? Oui ? Non ?Non renseigné
9. Exposition professionnelle aux produits
chimiques
? Oui ? Non ?Non renseigné
IV. SYMPTÔMES & EXAMENS CLINIQUES
10. Hématurie
? Oui ? Non ?Non renseigné
11. Dysurie
? Oui ? Non ?Non renseigné
12. Pollakiurie
? Oui ? Non ?Non renseigné
13. Rétention urinaire
? Oui ? Non ?Non renseigné
14. Douleurs pelviennes / hypogastriques
? Oui ? Non ?Non renseigné
15. Globe vésical palpable
? Oui ? Non ?Non renseigné
V. EXAMENS PARACLINIQUES
16. Analyse d'urine (sédiment)
? Réalisée ? Non
réalisée ? Non renseigné
Si Réalisée :
Présence d'oeufs
? OEufs présents ? OEufs absents
17. Échographie vésicale
? Réalisée ? Non
réalisée ? Non renseigné
Si Réalisée :
Taille de lamasse
? Lésion = 3 cm détectée ? Lésion
< 3 cm ou aspect suspect ? Échographie normale
18. Dosage PSA (hommes uniquement)
? Réalisé ? Non
réalisé/Non renseigné ? Non renseigné
Si Réalisée :
Résultat duPSA : ____________
19. Anatomo-pathologie
? Réalisé ? Non
réalisé ? Non renseigné
Si Réalisé :
Diagnostic histologique
? Carcinome épidermoïde ? Carcinome
urothélial ? Autres/indéterminés
VI. TRAITEMENT
20. Traitement chirurgical
? Oui ? Non réalisé
? Non renseigné
Si Oui :
? Résection trans-urétrale ? Cystectomie
partielle ? Autres/indéterminés
21. Chimiothérapie
? Oui ? Non réalisé
? Non renseigné
22. Radiothérapie
? Oui ? Non réalisé
? Non renseigné
23. Traitement antibilharzien
(post-diagnostic)
? Oui (Praziquantel 40 mg/kg en dose unique) ? Non
réalisé ? Non renseigné
VII. ÉVOLUTION / STATUT AU DERNIER CONTACT (si
registre suivi)
24. Traitement chirurgical
? Vivant ? Décédé
? Non renseigné
Observations :____________________________________________________________
| 


