La branche large ascendante, mécanismes des
transports ioniques
Introduction
Comme il a été dit précédemment,
la branche ascendante large est le premier segment du néphron distal.
Elle est située dans la médullaire externe et dans le cortex. Le
rôle de la branche large ascendante est de réabsorber le NaCl, le
NaHCO3, le calcium et le magnésium. Elle participe ainsi à la
régulation du bilan de ces différentes substances. La branche
large ascendante joue un rôle important dans le processus de dilution de
l'urine en état de diurèse aqueuse4. Lorsque les
apports hydriques sont importants, il est indispensable que l'excès
d'eau soit éliminé sans modifier l'excrétion des autres
solutés ( NaCl, K+ ... ) . Cependant en situation de
restriction hydrique, l'urine émise doit être concentrée (
état d'antidiurèse ) grâce à une réabsorption
d'eau pure. La branche large ascendante contribue à ces fonctions en
absorbant du NaCl qui, accumulé dans l'interstitium par contre-courant,
va contribuer à la constitution du gradient osmotique. Cette
réabsorption de NaCl, du fait de la faible perméabilité
à l'eau, permet de diminuer l'osmolarité du fluide tubulaire. Un
fluide hypotonique au plasma est délivré au tube distal.
L'ADH5, en modulant la perméabilité à l'eau du
canal collecteur, règle l'équilibre osmotique entre
l'interstitium et la lumière du canal collecteur et ainsi la
réabsorption d'eau dans ce segment. En l'absence d'ADH, la
perméabilité à l'eau est faible, l'urine est hypotonique,
la diurèse élevé. En présence d'ADH
l'osmolarité de l'urine est élevé, la diurèse est
faible.
La branche large ascendante réabsorbe le chlorure de
sodium à un débit très élevé. Le plus
important système de transport actif de la branche large ascendante est
la pompe Na+/K+ ATPase présente dans la membrane
basolatérale. L'activité de cette pompe maintient une
concentration intracellulaire de sodium basse et de potassium
élevée. Du côte apical le cotransport électroneutre
1Na+/1K+(NH4+)/2Cl- assure la
majeure partie du transport du NaCl. Les inhibiteurs spécifiques de
cette protéine sont le furosémide et le bumétanide. Ce
cotransport est secondairement activé par la concentration de sodium
intracellulaire basse qui est établie par l'activité la
Na+/K+-ATPase basolatérale. La réabsorption
du NaCl dans la branche large ascendante permet une accumulation de
solutés dans l'interstitium ce qui contribue à créer un
gradient osmotique croissant du cortex vers la papille.
Une fonction importante des cellules de la branche large
ascendante médullaire est d'absorber en quantités importantes
l'ion bicarbonate. Cette réabsorption contribue également
à la régulation du pH de l'interstitium qui contrôle
l'acidification finale de l'urine par le biais des cellules du
4 Si la sécrétion d'ADH est supprimée (par
exemple par des apports hydriques importants qui tendent à diminuer
l'osmolarité sérique), la réabsorption d'eau sera
supprimée et le rein excrétera beaucoup d'urine ( par exemple 15
L par 24 h) de faible
osmolarité (50 mOsm/L). On a alors une dilution maximale
de l'urine et on parle de diurèse aqueuse.
Si au contraire la sécrétion d'ADH est
stimulée de façon maximale (par exemple par une
déshydratation qui tendrait à augmenter l'osmolarité
sérique), la réabsorption d'eau sera stimulée et le rein
excrétera peu d'urine (p. ex. 0,6 L/24 h) d'osmolarité
élevée (1250 mOsm/L). On a alors une concentration maximale de
l'urine et on parle d'antidiurèse.
5 ADH - Hormone antidiurétique
canal collecteur médullaire. Il est admis que la
réabsorption des HCO3- à travers la membrane apicale
se fait essentiellement via un échangeur Na+/H+
mais la voie d'efflux basolatérale n'est pas connue.
Enfin, les cellules de la branche large ascendante
réabsorbent, grâce au cotransport Na+/K+
(NH4+)/2Cl-, la majorité du NH4+ ( qui est transporté
à la place de K+ ), produit par la cellule du tubule
proximal. En s'accumulant dans l'interstitium, le NH3 par le système de
concentration à contre-courant peut diffuser dans la lumière du
canal collecteur médullaire et permettre une sécrétion
élevée d'H+ dans le canal collecteur médullaire
externe et, donc, une acidification efficace de l'urine définitive.
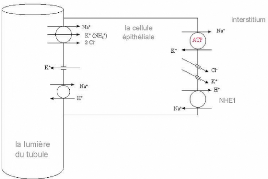
Figure 4. Modèle classique des transferts de
solutés dans la branche ascendante large de Henle.
De ce modèle, on pourrait conclure que les
différentes fonctions, la régulation du bilan d'eau et de
l'état acide-base, sont dépendantes. Cependant, les cellules de
la branche large ascendante sont capables d'absorber une grande quantité
de Na+ et de Cl- sans modification notable de
l'état acide-base, c'est à dire sans modification apparente des
réabsorptions de HCO3 et NH4+. Cette observation a
amené à supposer l'existence d'un échangeur
Cl-/HCO3- sur la membrane apicale. Deux équipes de
l'unité INSERM U 356, celle de R-A. Podevin et celle de P. Houillier
travaillent sur ce sujet en utilisant deux techniques d'approche
différentes mais complémentaires. La technique de microperfusion
in vitro est utilisé par P. Houillier. L'équipe de R-A.
Podevin utilise les vésicules de membranes plasmiques luminales et
basolatérales, hautement purifiées et séparées
simultanément.
La microperfusion in vitro
Résumé
La technique de la microperfusion in vitro est faite
sur des segments de tubule isolés du rein.
Lorsque, par la microdissection, le tubule est extrait du
rein, il est fixé sur un dispositif permettant d'isoler le milieu
intratubulaire du milieu extratubulaire, et de faire s'écouler par le
tubule un liquide de composition connue. Il est possible de recueillir le
liquide sortant du tubule à l'autre extrémité. La
composition exacte de ce liquide peut être déterminée. Il
est donc possible, en comparant la composition du liquide "de perfusion" et du
liquide collecté, d'en déduire le flux de transport
transépithèlial de différents solutés. Cette
analyse peut être couplée avec les mesures du potentiel
transépithèlial et/ou avec la technique de la fluorescence
intracellulaire ( permettant de me-surer le pH intracellulaire ). Ainsi les
renseignements plus complets sur les transporteurs ioniques peuvent être
obtenus.
Les avantages et les limites de la
méthode
Cette méthode est utilisée pour étudier
précisément les activités de transport de certains
segments du néphron. Contrairement aux techniques in vivo (
microperfusion et microponction ), les conditions expérimentales sont
parfaitement contrôlables car le tubule n'est plus soumis aux
différentes influences complexes, en particulier hormonales.
L'importance de cette technique réside dans le fait qu'il est possible
de mesurer sur un même tubule simultanément le flux ionique, la
différence de potentiel transépithèliale et, dans
certaines conditions, le potentiel transmembranaire des cellules et la
conductance de l'épithélium. Il est ainsi possible
d'étudier et de définir la régulation des
mécanismes impliqués dans les transports tubulaires rénaux
et, de ce fait la régulation de la composition du milieu
intérieur.
Cependant le fait que cette méthode utilise un segment
isolé in vitro représente une limite. En effet, dans le
rein, de nombreuses fonctions demandent une action coordonnée de
différents segments et sont soumis aux influences des hormones.
Le matériel et méthodes
Un microscope inversé est
indispensable. Sa construction ( la source lumineuse est au des-sous de la
chambre de perfusion et l'objectif est au-dessus ) permet de travailler sur un
tubule en suspension et facilite l'accès des pipettes.
La chambre de perfusion ( plaque en
matière plastique ) permet de garder le tubule dans un bain, et loge
l'électrode et le thermomètre.
Le système de microperfusion est
composé de deux blocs, l'un assurant la perfusion et l'autre la
collection.
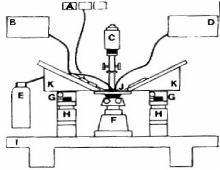
Figure 5. Le montage utilisé pour la
microperfusion in vitro.
Le réservoir contenant le perfusât la pompe
la source de la lumière
le thermomètre
l'arrivé du carbogaz ( O2/CO2
à 5% )
le microscope inverse
et H. micromanipulateur et sa base
la base très stable
la chambre de perfusion
système de maintien des micropipettes permettant leur
coulissement
A. Le système de perfusion :
B. C. Comporte quatre pipettes concentriques montées sur
trois chariots
de façon qu'on puisse les déplacer les unes par
rapport aux autres à l'aide de moteurs.
La pipette de soutien est
connectée à une seringue ce qui permet d'aspirer le tubule et
d'immobiliser ainsi une de ses extrémités.
La pipette de perfusion se trouve
à l'intérieur de la pipette de soutien. Étant très
fine, on la fait rentrer à l'intérieur du tubule lorsqu'il est
maintenu par la pipette de soutien afin de faire s'écouler le liquide de
perfusion par la lumière du tubule.
La pipette d'échange arrive
jusqu'à la partie large de la pipette de perfusion et permet un
changement rapide de liquide de perfusion.
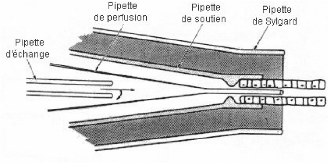
La pipette de Sylgard est la plus
grande, elle contient les autres pipettes. On la remplit de liquide de Sylgard
pour assurer l'étanchéité une fois que le tubule est
perfusé. De plus le liquide de Sylgard est un liquide
diélectrique ce qui permet les mesures du potentiel
transépithèlial.
Figure 6. Le système de
B. Le système de collection : est
composé de trois pipettes montées de la même façon
que celles du système de perfusion.
La pipette soutien-collection ressemble
à la soutien-perfusion, elle est également connectée
à une seringue permettant de placer le tubule à
l'intérieur de la pipette et de l'immobiliser.
La pipette de Sylgard identique
à la Sylgard-perfusion; l'importance de
l'étanchéité y est encore plus grande que du coté
de la pipette de perfusion.
La pipette de collection très
fine, amovible; a une constriction à proximité de l'ouverture ce
qui permet de faire des prélèvements ayant toujours un volume
identique. Ceci permet de calculer le débit, tout simplement en mesurant
le temps nécessaire pour que ce volume se remplisse.
|
Figure 7. Système de collection
|
|
Sur les deux systèmes c'est la pipette de soutien qui est
fixe, les deux autres peuvent coulis-
ser, donc s'éloigner ou s'approcher de celle-ci. Dans le
système de perfusion la pipette de perfusion et la pipette
échange sont solidaires.
| 


