SECONDE PARTIE
Caractérisation de la région 51-160 de la
protéine KIN17 humaine par RMN et Modélisation
Moléculaire
Chapitre 1 : Introduction
CHAPITRE 1
Introduction
1) Généralités sur le maintien de
l'intégrité du génome
L'Acide Désoxyribose Nucléique, connu sous
le nom d'ADN, est un polymère de nucléotides qui contient
sous forme codée une grande partie des informations relatives à
la vie d'un organisme vivant. La protection de l'intégrité du
génome est un défi capital et constant pour les cellules. En
effet, la survie des organismes dépend de la transmission
totale et correcte de l'information génétique lors des processus
de réplication de l'ADN. Les cellules doivent donc être capable
de détecter et réparer les dommages de l'ADN, de toute
nature qu'ils soient, afin de préserver leur patrimoine
génétique.
1.1) Les dommages de l'ADN
1.1.1) Sources
Une cellule doit lutter en permanence pour protéger
l'intégrité de son génome. Toute altération de ce
précieux matériel nucléaire constitue un dommage de l'ADN.
Les origines de
ces altérations moléculaires sont aussi
différentes que nombreuses. Ainsi, elles peuvent provenir
d'agents exogènes, on parle alors d'altération
environnementale, ou d'agents endogènes qui induisent des dommages
dits spontanés.
Parmi les sources exogènes, figurent les rayonnements,
les radiations ionisantes et les substances chimiques mutagènes. Les
ultraviolets (UV), les radiations ionisantes (IR), ou le rayonnement ã,
produisent des lésions sur l'ADN notamment dues à la
radiolyse des molécules d'eau qui forme des espèces
réactives de l'oxygène (Ames et al., 1993). Ces
espèces réactives peuvent modifier aussi bien les bases de l'ADN,
que les sucres, et créent des cassures au niveau du squelette phosphate
(Hutchinson, 1985). Les agents chimiques comme des drogues, les analogues de
base, ou les inhibiteurs de processus biologiques peuvent, une fois
passée la membrane nucléaire, causer d'importants
dégâts à la structure moléculaire de l'information
génétique. C'est notamment le cas du Méthyl
Methane Sulfonate (MMS) qui
bloque la séparation des brins d'ADN.
Les dommages spontanés peuvent provenir d'erreurs
générées durant les processus de réplication,
recombinaison, ou réparation de l'ADN. Des modifications
chimiques peuvent également avoir lieu dans certaines conditions
de pH et de température. D'autre part, le
métabolisme cellulaire induit la formation endogène
d'espèces réactives de l'oxygène. Elles
proviennent notamment de la chaîne respiratoire
mitochondriale (Ames et al., 1993), des peroxysomes (compartiments
cellulaires où sont dégradés les acides gras)
(Yeldandi et al.,
2000), et de la détoxification de certains
composants de la cellule comme la vitamine D (Bondy & Naderi,
1994).
1.1.2) Nature et conséquences
Les différents types de dommage causés par
des agents endogènes ou exogènes peuvent être
classés en quatre catégories distinctes :
- Les cassures d'ADN simple ou double brin
-
- Les mésappariements
- Les dégradations des bases, comme la déamination,
l'oxydation, ou la création de sites abasiques
- Les modifications encombrantes telles que pontages
intra- et inter- brins et la formation de dimères de pyrimidine.
Ainsi, les rayons UV sont connus pour introduire des dimères de
pyrimidines et des pontages ADN-protéine ou ADN-ADN qui causent des
distorsions importantes dans la double hélice pouvant amener
à la rupture de la chaîne polynucléotidique.
Le renouvellement de l'ADN peut provoquer la
dépurination spontanée de certaines bases à raison de 2000
à 10000 sites par cellule humaine quotidiennement (Lindahl, 1993). La
cassure double brin est la plus dangereuse éventualité qu'une
cellule peut rencontrer car elle peut susciter la perte d'un morceau de
chromosome ou une translocation chromosomique (Thompson & Limoli, 2003;
Tong et al., 2001). Si une cellule ne peut réparer les quelques
10000 altérations de l'ADN qu'elle s'impose
quotidiennement (Lindahl, 1993), elle s'expose alors à de graves
problèmes car l'instabilité génomique est l'un des
évènements pouvant mener à la perturbation de la fonction
cellulaire. En effet, l'accumulation de dommages peut avoir de lourdes
conséquences s'ils surviennent à des endroits critiques dans la
structure de l'ADN. Elle peut mener à l'apoptose (mort cellulaire
programmée) ou à la formation de tumeurs, et ainsi
augmenter le risque de développer des maladies graves telles que le
cancer
(Khanna & Jackson, 2001). Lorsque les mécanismes de
réparation échouent ou commettent
des impairs, il y a apparition de mutations. Si celles-ci
induisent une modification structurale
significative, elles peuvent modifier l'activité d'une
protéine ou la guider vers la dégradation.
1.2) Les systèmes mis en jeu
La cellule dispose de systèmes moléculaires
complexes qui lui permettent de réagir rapidement à
l'endommagement de son ADN. L'existence de pathologies humaines liées au
dysfonctionnement de ces systèmes a permis de les
caractériser et de souligner leur importance dans le maintien de
l'intégrité du patrimoine génétique. Ils ont pour
objectif :
- La réparation de l'ADN
- La signalisation des dommages
- La réponse transcriptionnelle (induction de gènes
de la réparation par exemple)
- L'apoptose
Les quatre types de voies citées ci-dessus sont
interconnectées : certaines protéines participent à
plusieurs types de réponses aux dommages de l'ADN. Un défaut dans
l'une de
ces voies provoque l'instabilité du génome (Sancar
et al., 2004).
1.3) Les voies de réparation des lésions de
l'ADN
Suite à la détection d'un dommage de l'ADN,
différentes voies de réparation peuvent être
activées : la réparation directe, la réparation par
excision de base (BER), la réparation par excision de nucléotide
(NER), la réparation des mésappariements (MMR), et la
réparation des cassures double brins qui peuvent être pris
en charge soit par la voie de recombinaison homologue (HR), soit par le
mécanisme de recombinaison non homologue (NHEJ pour Non Homologous
End Joining). Ces différentes voies sont récapitulées
dans la Figure 1.1.
La recombinaison homologue est sans doute le système le
plus efficace de réparation d'une cassure double brin (Szostak et al.,
1983). Ce mécanisme, principalement utilisé chez la levure et les
bactéries, assure la conservation intégrale de l'information
génétique. Il est basé
sur l'échange de brins provenant d'un chromosome
endommagé vers un chromosome homologue intact. La recombinaison non
homologue ou illégitime (NHEJ) se fait par ligature
des extrémités de la cassure de l'ADN. La
réparation des cassures double brins par ce système
s'accompagne fréquemment de délétions
(Jeggo, 1998). Ainsi, le gène n'est, en général, plus
fonctionnel lorsqu'il est réparé par ce
mécanisme.
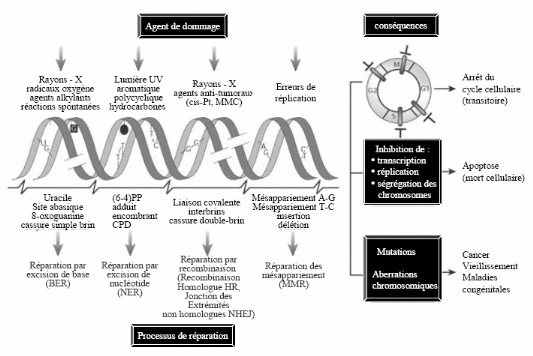
Figure 1.1 : Schéma
récapitulant la nature et les conséquences des dommages de l'ADN,
et
les différentes voies de réparation
(d'après Hoeijmakers, 2001).
Les mésappariements peuvent survenir au cours de la
réplication ou lors de la recombinaison homologue. Leur
réparation par le mécanisme MMR (Marti et al., 2002) peut
se décomposer en trois principales étapes: la
reconnaissance des mésappariements, le recrutement des
protéines du MMR, et l'excision-resynthèse de l'un des deux
brins.
La réparation par excision de bases (BER)
découverte en 1974 (Lindahl, 1974) reconnaît le plus
fréquemment des bases modifiées : déamination des
cytosines en uracile, alkylation de base induite par des
métabolites cellulaires, oxydation des bases de l'ADN et certains
mésappariements induits par les erreurs de réplication de
l'ADN. Plusieurs de ces lésions sont dues à des agents
environnementaux comme les radiations ionisantes mais certaines
résultent d'une hydrolyse spontanée. Dans ce
mécanisme, seule la base qui a été
modifiée est clivée, puis remplacée.
Enfin, la réparation de l'ADN par excision de
nucléotide (NER) (Friedberg, 2001) est
le mécanisme majeur de l'élimination des
lésions simple brin. Cette voie de réparation corrige
préférentiellement les modifications des nucléotides
telles que les dimères de pyrimidine et autres lésions produits
par les rayons UV, mais également les mésappariements de type
C?C. Contrairement au BER, cette voie de réparation clive
plusieurs nucléotides du brin d'ADN endommagé et
libère un fragment simple brin de 24 à 32 bases. Un nouveau brin
est alors synthétisé par des polymérases en utilisant
comme matrice le brin non endommagé. C'est ce mécanisme de
réparation qui intervient dans la régulation de la
protéine KIN17.
| 


