2) Description de la structure tridimensionnelle du
domaine K2
Le bilan de l'analyse des écarts rmsd et des
angles dièdres et montre une convergence des structures finales
vers une structure unique dans la région F15 à L106. Par
conséquent, nous avons choisi le modèle raffiné de plus
basse énergie (ET = 196.1 kcal.mol-1) comme le plus
représentatif de la structure du domaine K2 de la protéine KIN17
humaine.
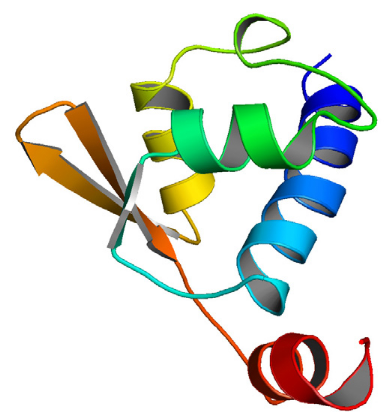
2.1) Structure secondaire
Le calcul de la structure du domaine K2 par
modélisation moléculaire confirme l'existence de l'ensemble des
éléments de structure secondaire mis en évidence
précédemment par l'analyse des paramètres RMN. K2
adopte un repliement de type á/â constitué de 4
hélices á (H1: F15-R34, H2: N42-I50, H3: L66-R75, H4:
E98-E107), de 3 brins â (S1: R39-H41, S2: C79-T84, S3: G87-Y92),
et d'un tour d'hélice 310 (H2.5: M58- A60) situé dans une
large boucle entre H2 et H3 (Figure 4.9). La topologie du domaine est de
la forme H1-S1-H2-H2.5-H3-S2-S3-H4. La partie N-terminale de K2
est donc principalement hélicoïdale alors que la région
C-terminale est dominée par 2 brins â anti-parallèles (S2
et S3)
reliés par un coude â de type I (T84-G87).
H2.5
N
H3
S3
S2 H2
H1
S1
C
H4
Figure 4.9 : Structure
tridimensionnelle du domaine K2 de la protéine humaine
KIN17
résolue par RMN et Modélisation
Moléculaire. Les hélices sont représentées par des
rubans
et les brins â par des flèches.
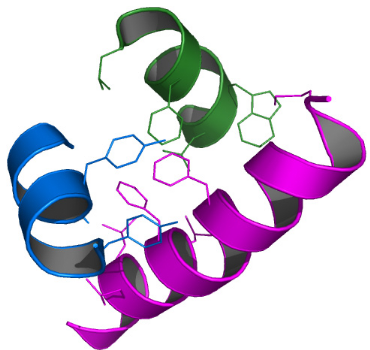
2.2) Les éléments qui composent le coeur
hydrophobe
Les hélices H1, H2, et H3 constituent la zone centrale de
la protéine. Elles forment un
« tonnelet orthogonal » compact où la valeur
d'angle entre chacune d'entre elles est proche de
90°. Avec une longueur de 20 résidus,
l'hélice H1 est l'élément de structure secondaire le plus
imposant du domaine K2. Elle contient 5 tours réguliers d'hélice
á, soit deux fois plus que les hélices H2 et H3
(respectivement 9 et 10 résidus, soit environ 2.5 tours).
Chacune de ces hélices est stabilisée par un réseau
régulier de liaisons hydrogène qui se forment entre
l'oxygène du CO d'un résidu i et le proton amide d'un
résidu i+4. Ces 3 hélices canoniques présentent
un caractère amphipatique : elles projettent la
quasi-totalité de leurs chaînes latérales polaires
vers l'extérieur du domaine et la majorité de leurs
chaînes latérales hydrophobes sont orientées vers
l'intérieur et définissent ainsi une poche hydrophobe qui
stabilise le tonnelet. Cette poche dense et riche en acides aminés
aromatiques est composé des résidus M16, F23, F27, L28, L30, et
L31 de H1, des résidus V45, Y46, et Y49 de H2, et des
résidus L66, F69, W72, et L73 de H3 (Figure 4.10).
L66 H3
F69
W72 M16
Y46
L73
H2
Y49
V45
L30
F27
L31
F23
L28
H1
Figure 4.10 : Description de la
poche hydrophobe du tonnelet orthogonal du domaine K2.
Les chaînes latérales des résidus
qui forment cette poche sont représentées par des sticks
violets pour l'hélice H1, bleus pour l'hélice H2, et verts pour
l'hélice H3.
Les 3 brins S1, S2, et S3 forment un feuillet â
anti-parallèle à la périphérie du tonnelet
orthogonal dans lequel le brin central S3 est stabilisé par 8 liaisons
hydrogène régulières de type COi - HNj. Le brin S1
qui ne compte que 3 résidus est principalement maintenu au
feuillet â via le résidu V40 qui forme 2 liaisons hydrogène
et plusieurs contacts hydrophobes
avec l'isoleucine 90 de S3. Le brin S2 est relié à
l'hélice H3 par un coude â de type I entre les
résidus G74 et G77. L'analyse de cette
région du domaine fait également apparaître une
seconde interface d'interactions hydrophobes entre les brins S2 et S3,
et les hélices du tonnelet. Cette interface est principalement
constituée des résidus F27, L28 et L31 de H1, et des
résidus L66, T70, L73, et G74 de H3 qui établissent des contacts
avec la face hydrophobe
du feuillet â (C79, et V81 de S2, et W88, I90, et Y92 de
S3) (Figure 4.11).
S2
W88
S3
T70
V81
L66
H3
G74
I90
Y92
C79

F27
L73
L28
L31
H1
Figure 4.11 : Description de la
seconde interface hydrophobe du domaine K2. Les chaînes
latérales des résidus qui forment cette
interface sont représentées par des sticks violets pour
l'hélice H1, verts pour l'hélice H3, et oranges pour les brins
S2 et S3.
Les valeurs de nOe hétéronucléaire
1H-15N obtenues au niveau des brins â et
des hélices du tonnelet sont pour la plupart des résidus proches
de 0.8 (Figure 4.2 du paragraphe
1.2.1). Cet ordre de grandeur montre que le feuillet â et
le tonnelet orthogonal constituent un ensemble rigide et stable au sein du
domaine K2.
2.3) La boucle entre les hélices H2 et
H3
A l'opposé du feuillet â anti-parallèle,
le domaine K2 présente une large boucle de 15 acides aminés
(S51-T65) située entre les hélices H2 et H3. Cette région
peu encombrée est très exposée au solvant, ce qui
explique probablement la faible intensité des pics de
corrélation 1H-15N des résidus I56, H57,
M58, N59, et E64 due à un échange rapide de leur proton amide
avec l'eau. Aussi, le proton amide du résidu R53, dont le pic de
corrélation est absent sur l'HSQC 15N-1H, est
orienté vers l'extérieur de la protéine et se situe dans
une zone
très fortement exposée. La boucle S51-T65
n'est pas dénuée de structure secondaire. Elle
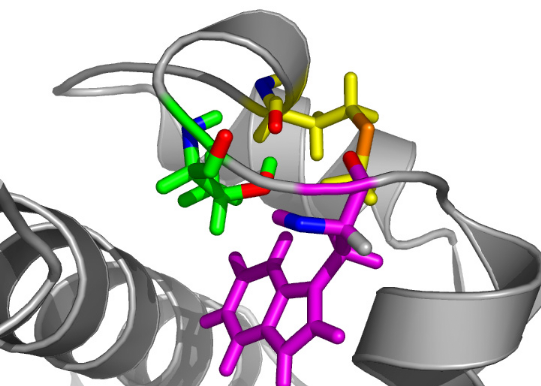
comporte en effet un tour d'hélice 310 canonique de 3
résidus (H2.5) stabilisée par une liaison
hydrogène entre le proton amide de A60 et l'oxygène
du carbonyle de H57. La thréonine T61
joue un rôle majeur dans le maintien de cette
hélice via le groupement OãH de sa chaîne
latérale qui forme 2 liaisons hydrogène avec le proton
HN de W63 et l'oxygène du CO de M58 (Figure 4.12). L'existence
de ce réseau de liaisons hydrogène est en accord avec
les résultats de l'étude par RMN où le proton du
groupement OãH de T61 est observable sur le spectre
15N-NOESY-HSQC à un déplacement chimique
caractéristique de 5.6 ppm. Les chaînes latérales
hydrophobes des résidus I56, M58, et W63 sont orientées vers
l'intérieur de
la protéine et établissent des contacts avec
plusieurs acides aminés du coeur hydrophobe (F23, L66, et F69). Ces
3 résidus contribuent ainsi au positionnement de l'hélice
310 H2.5 à proximité du tonnelet orthogonal.
H2.5
M58
H2
T61
W63
H3
H1
Figure 4.12 : Rôle de la
thréonine T61 dans la stabilisation de l'hélice
310 H2.5. Les atomes
et liaisons des résidus M58, T61, et W63 sont
respectivement représentés par des sticks
jaunes, verts, et roses. Les hétéroatomes O, N,
et S sont différenciés et sont respectivement
représentés en rouge, bleu, et orange. Les liaisons
hydrogène apparaissent en pointillés.
L'analyse de la structure tridimensionnelle de K2 par
l'algorithme Stride (Frishman & Argos, 1995) met
également en évidence la présence de 2 coudes
â de type IV et VIII (respectivement I50-R53 et W63-L66) au niveau
des extrémités de la boucle S51-T65. Ces 2 coudes ne
présentent pas de liaison hydrogène de type CO-HN entre le
résidu i et le résidu i+3, ce qui est
fréquemment observé dans ces types de coude non classiques
(Hutchinson & Thornton, 1994). Il apparaît cependant 2 liaisons
hydrogène dans la région Y49-H55 qui semblent stabiliser
le motif I50-R53. La première implique l'oxygène du CO
de E54 et le proton du groupement OH de chaîne latérale de Y49,
et la seconde relie l'oxygène du CO de
R53 au proton amide de H55.
Le bilan de l'analyse des structures secondaires de la
région S51-T65 fait apparaître un
bon niveau de structuration de cette boucle avec la
présence d'un coude de type IV entre I50
et R53, d'une hélice 310 entre M58 et T60, et d'un
coude de type VIII entre W63 et L66. De plus, le nOe homonucléaire
1H correspondant à une moyenne de l'espace conformationnel en
solution, les nombreux effets observés entre les résidus I56,
M58, T61, et W63 et plusieurs résidus participant au coeur hydrophobe de
la protéine suggèrent une faible flexibilité de la
boucle S51-T65. Ainsi, dans le cas de l'isoleucine I56 située
entre le coude I50-R53 et l'hélice 310, près d'une quinzaine
de nOe de moyenne intensité témoignent de la proximité des
protons de sa chaîne latérale avec les protons du
résidu F23 impliqué dans la poche hydrophobe du domaine
K2. De manière intéressante, les valeurs de nOe
hétéronucléaire
1H-15N relevées dans la
région S51-T65 sont globalement comprises entre 0.7 et 0.85.
Ces valeurs caractéristiques de régions rigides sont tout
à fait comparables à celles obtenues dans
les hélices du tonnelet orthogonal et dans les
brins â. Ces résultats indiquent donc que la région
S51-T65 incorpore le corps rigide de la protéine.
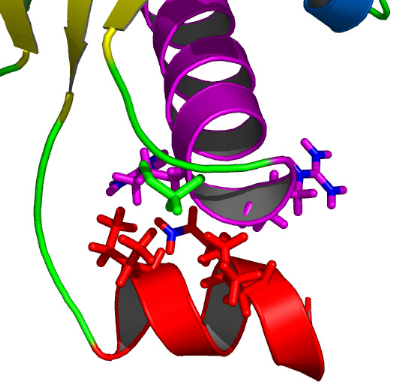
2.4) L'hélice C-terminale H4
L'hélice H4 C-terminale s'étend du
résidu E98 à E107. Elle est constituée de 9
résidus, soit environ 2.5 tours d'hélice á
régulière, et présente un réseau régulier de
liaisons hydrogène qui contribuent à sa stabilité. Dans la
structure de K2, l'hélice H4 se positionne à
la périphérie du domaine au niveau de
l'extrémité C-terminale de l'hélice H1 et de
manière quasi perpendiculaire à H1. L'interface d'interactions
entre H4 et le tonnelet orthogonal est constituée des résidus
I100, Q103, et L104 de H4, des résidus R32 et R33 de H1, et du
résidu G36 de la boucle entre H1 et S1 (Figure 4.13). Cette
interface exclusivement hydrophobe apparaît comme relativement fragile
en raison du faible nombre de contacts observés entre ces acides
aminés. De plus, sur les spectres NOESY-HSQC, seule une dizaine d'effets
à longue distance de faible ou moyenne intensité ont
été collectés dans la région E98-E107. Avec ce
faible nombre de nOe, le programme d'attribution automatique a
rencontré quelques difficultés pour attribuer de
manière reproductible les nOe longue distance de l'hélice H4
au
fil des itérations. Ainsi, ce n'est que lors des derniers
processus itératifs que l'hélice H4 dans
les modèles générés a
adopté une position préférentielle unique autour de
la partie C- terminale de H1.
S2 S3 S1 H2
G36 H1
R33
R32
I100
L104
H4
Q103
Figure 4.13 : Description de
l'interface d'interactions entre l'hélice H4 et l'hélice H1.
Les
résidus impliqués sont
représentés par des sticks rouges pour l'hélice H4, roses
pour l'hélice H1, et verts pour la boucle entre H1 et S1. Les
noyaux azote des chaînes latérales sont
différenciés et apparaissent en bleu.
De manière intéressante, les valeurs de nOe
hétéronucléaire 1H-15N
relevées dans la région E98-E107 sont globalement comprises
entre 0.4 et 0.5 (Figure 4.2 du paragraphe
1.2.1). Ces valeurs mettent en évidence des mouvements
rapides (sur une échelle de temps de
la picoseconde à la nanoseconde) au niveau de
l'hélice H4 et suggèrent un équilibre conformationnel
entre une forme structurée et une forme
déstructurée autour d'une conformation moyenne. Les valeurs
de déplacements chimiques secondaires CSD dans cette région sont
globalement inférieures à celles rencontrées au
niveau des hélices du tonnelet orthogonal. Ceci confirme
l'hypothèse de l'existence d'un échange conformationnel rapide et
explique probablement le peu de nOe 1H longue distance
observés dans cette région. Par conséquent,
l'hélice H4 du domaine K2 présente un caractère flexible
et n'intègre pas le corps rigide de la protéine.
Chapitre 5 : Relations structure-activité : quel
est le rôle du domaine K2 de KIN17 humaine ?
| 


