4) Caractérisation de la position du motif
prédit en « doigt de zinc »
autour du domaine Winged Helix
Dans l'optique d'approfondir notre recherche des fonctions de
KIN17, et notamment
du motif Winged Helix, nous avons abordé
l'étude structurale en solution du domaine K3 (région
1-160). Comme le montre l'alignement de la Figure 5.13, le motif prédit
en « doigt de zinc » par le programme SMART n'est
séparé du motif Winged Helix que par un segment de
taille conservée d'environ 15 résidus dans les
séquences primaires eucaryotes. Avant d'entreprendre à
terme une étude structurale complète du domaine K3 par RMN, nous
avons dans un premier temps voulu caractériser les relations
structurales qui existent entre ces deux modules, et notamment la position
du motif prédit en « doigt de zinc » autour du module
Winged Helix.
|
10
|
20
|
30
|
40
|
50
|
60
|
70
|
80
|
90
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Humain
MGK-SDFLTPKAIANRIKSKGLQKLRWYCQMCQKQCRDENGFKCHCMSESHQRQLLLASENPQQFMDYFSEEFRNDFLELLRRRFGTKRV...
Plante
MGK-NDFLTPKAIANRIKAKGLQKLRWYCQMCQKQCRDENGFKCHCMSESHQRQMQVFGQNPTRVVDGYSEEFEQTFLDLMRRSHRFSRI...
Spore
MGR-AEAGTPKAISNALKSKGLQRLRWYCSACQKQMRDENGFKCHTQSEGHIRQMNVIAMNPGKRIQDFSNQFLRDFISLLRTAHGEKKI...
Ver
MGK-HEKGSSKDLANRTKSKGLQKLKFFCQMCQKQCRDANGFKCHLTSEAHQRQLLLFAENSNSYLRQFSNDFEKNFMQLLRTSYGTKRV...
Neurospore
MPK-AEVGSAKYLANKMKSRGLNRLRWYCQLCEKSCRDENGYKMHCQSPSHTAKALEAGANFKGVQDTFSDQFLKDFIAQLKTSHGEKEI...
Levure
MAD---YDSAKYWSKQGARRGLQKTRYYCQICQRQCKDANGFQSHNKSPSHLRKISQVTAEDAR---RYNIQFEKGFLQLLKQRHGEKWI...
Humain
MGK-SDFLTPKAIANRIKSKGLQKLRWYCQMCQKQCRDENGFKCHCMSESHQRQLLLASENPQQFMDYFSEEFRNDFLELLRRRFGTKRV...
motif prédit C2H2
(ou "doigt de zinc")
région N-terminale du motif Winged
Helix
K2
K3
Figure 5.13 : Alignement de la
région N-terminale de KIN17 réalisé avec les
séquences de
l'Homme, de la plante Arabidopsis Thaliana, du ver
Caenorhabditis elegans, du spore Emericella Nidulans, du neurospore
Neurospora Crassa, et de la levure Saccharomyces Cerevisiae. Les
résidus sont colorés en rouge lorsqu'ils sont conservés,
en vert lorsqu'ils sont fortement similaires, et en bleu lorsqu'ils sont
faiblement conservés. Les 4 résidus cystéine et histidine
ultra conservés et caractéristiques du motif C2H2 prédit
(ou « doigt de zinc ») sont indiquées par des points
noirs.
4.1) Stratégie employée
Par RMN, l'interaction entre deux partenaires peut être
facilement caractérisée à partir
de la connaissance des fréquences de
résonance de l'un des deux partenaires. La méthode
généralement employée consiste à réaliser
une titration du partenaire enrichi en isotope 15N, et dont les
déplacements chimiques 1HN et 15NH sont connus,
par l'autre partenaire non marqué.
Le suivi de l'évolution des pics de
corrélation sur un spectre HSQC 1H-15N
permet alors
d'identifier les résidus dont les noyaux de
groupement amide ont changé d'environnement chimique, et ainsi de
caractériser une surface d'interaction du partenaire marqué
15N avec le partenaire non marqué.
Nous avons adapté le principe de cette méthode,
appelée cartographie des variations
de déplacement chimique, pour déterminer la
position du « doigt de zinc » autour du Winged Helix. Le
domaine K3 (région 1-160) étant constitué de la
totalité des acides aminés de K2 (région 51-160), la
démarche consiste à rechercher les pics de corrélation
1H-15N des résidus
du Winged Helix de K2 sur le spectre HSQC de K3
enregistré dans des conditions identiques
ou très proches. Pour cela, nous avons
enregistré en parallèle une expérience 3D
15N-NOESY- HSQC sur l'échantillon de K3 afin de
distinguer les pics du Winged Helix des pics de la
région 1-50 sur l'HSQC de K3 (par comparaison avec l'expérience
3D 15N-NOESY-HSQC de K2). La comparaison des fréquences de
résonance des noyaux 1HN et 15NH du Winged
Helix permet alors de mettre en évidence l'influence
de la région N-terminale de K3 sur l'environnement
électronique des noyaux amides du Winged Helix. Une
absence totale de modification significative de déplacement chimique
et/ou d'intensité signifierait alors que le
« doigt de zinc » n'adopte aucune position
préférentielle autour du Winged Helix, ou qu'il ne
se positionne pas à sa proximité.
4.2) Préparation de l'échantillon de
protéine K3 simplement marquée 15N
Pour préparer l'échantillon de
protéine K3 simplement marquée 15N, nous avons
eu recours aux mêmes stratégies et méthodologies que celles
utilisées pour produire, purifier, et isoler le domaine K2 (cf. chapitre
2). La région 1-160 de KIN17 humaine a été exprimée
en fusion avec le partenaire ZZ, purifiée sur résine d'amylose,
et le partenaire ZZ a été clivé sur colonne avec la
protéase TEV. Cependant, pour des raisons inhérentes
à la présence du
« doigt de zinc » dans le domaine K3, il
n'a pas été possible d'utiliser les mêmes
compositions de solutions tampons pour purifier la
protéine et préparer l'échantillon RMN.
En effet, la présence de réducteurs de
type DTT ou TCEP, ou d'agent chélateur comme l'EDTA, pourrait
décrocher l'ion Zn2+ lié aux 2 cystéines et 2
histidines du motif C2H2, ou réduire le pont disulfure formé
par les 2 cystéines impliquées dans la chélation
du métal. D'autre part, le phosphate de zinc étant insoluble, il
est préférable d'utiliser un tampon Tris- HCl plutôt
qu'un tampon phosphate qui pourrait favoriser l'agrégation de la
protéine (Vallee & Auld, 1995). La composition finale des
échantillons RMN marqués 15N des protéines
K2 et K3 est indiquée dans le Tableau 5.1. Afin de limiter
les différences de composition entre les 2 échantillons, les
valeurs de pH et de force ionique de l'échantillon K3
ont été choisies identiques à celles de
l'échantillon K2.
|
K2 (C=0.7 mM)
région 51-160 de KIN17 humaine
|
K3 (C=0.2 mM)
région 1-160 de KIN17 humaine
|
|
? 50 mM phosphate (pH 6.0)
? 150 mM NaCl
? 1 mM EDTA
? 1 mM TCEP
|
? 50 mM Tris-HCl (pH 6.0)
? 150 mM NaCl
|
Tableau 5.1 : Composition des
échantillons RMN marqués 15N des protéines K2
et K3.
4.3) Résultats de la cartographie des variations
de déplacement chimique
Nous avons dans un premier temps relevé le nombre de pics
de corrélation 1H-15N sur
le spectre HSQC de K3. Ce nombre de pics est
difficile à comptabiliser en raison de la présence de
recouvrement dans la zone centrale du spectre. On peut toutefois
estimer sa valeur proche de 130 sachant que le nombre de groupements amides
attendu s'élève à 156 (161 résidus dont 4
prolines et une glycine N-terminale). Aussi, près de 90 % des
pics correspondant aux résidus du domaine K2 ont été
retrouvés sur le spectre HSQC de K3. Par déduction, il
apparaît donc que près de la moitié des résonances
1H-15N correspondants aux groupements amides de la
région N-terminale 1-50 de K3 sont absentes sur le spectre. A ce stade
de l'étude structurale, il est difficile d'expliquer la
dégénérescence partielle du signal dans cette
région. Il est toutefois possible que l'extrémité 1-25 en
amont du motif prédit en
« doigt de zinc » soit en échange
conformationnel entre une forme structurée et une forme
déstructurée, ce qui expliquerait l'absence de près de 25
pics de corrélation. D'autre part, la séquence humaine
prédite en « doigt de zinc » comporte 3
cystéines supplémentaires non
conservées et différentes des 2
cystéines ultra conservées qui caractérisent le
motif C2H2.
(Figure 5.13). Ces 3 cystéines pourraient être
responsables de sites d'interaction non
spécifique avec l'ion Zn2+, ce qui induirait un
échange de la position de cet ion entre les 5
cystéines de cette région, accompagné
d'échange conformationnel.
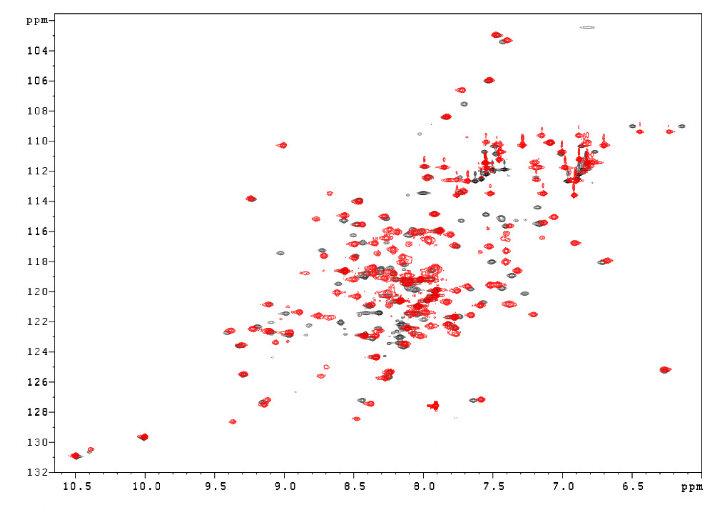
Comme le montre la superposition des spectres HSQC
1H-15N de K2 et K3 (Figure
5.14), la grande majorité des pics relatifs aux
résidus du motif Winged Helix n'ont subi qu'une faible
modification de déplacements chimiques 15N et 1H.
Le domaine K3 comporte donc un motif Winged Helix de repliement
similaire à celui du domaine K2. Toutefois, comme nous nous y
attendions, la présence de la région N-terminale de KIN17,
contenant le
« doigt de zinc », en amont du motif
Winged Helix induit une modification importante de
l'environnement électronique des résidus de
l'extrémité N-terminale 1-18 du domaine K2. En effet, les
changements de déplacements chimiques dans cette région sont tels
que l'expérience
15N-HSQC-NOESY ne permet pas de retrouver les pics de
corrélation 1H-15N correspondants
sur l'HSQC de K3. Cette région 1-18 comporte le segment
1-15 qui sépare le Winged Helix
du « doigt de zinc » potentiel, et les 3 premiers
résidus de l'hélice H1 du Winged Helix.
K2
15N
K3
I50
T61


L28
D26
H52
A60
M58
H41
W72å
1H
Figure 5.14 : Superposition
des spectres HSQC 1H-15N de K2 et K3. Les
résidus qui présentent une variation significative de
déplacements chimiques 1H et 15N sont mis
en évidence (?äm > 0.7 ppm). La numérotation des
résidus est relative au domaine K2.
La variation moyenne ?äm de déplacements
chimiques 1H et 15N par résidu a
été
évaluée en utilisant la relation suivante :
?äm = |?äHN| + |?äNH/10|. Comme le montrent les
Figures 5.14 et 5.15, des valeurs significatives de ?äm
(> 0.07 ppm) sont observées au niveau
de résidus de la boucle H2-H3 (I50, H52, et T61), et de
l'hélice 310 (M58 et A60). Ces valeurs
de ?äm indiquent une modification de l'environnement
chimique des groupements amides de
ces résidus induite par la proximité avec la
région N-terminale de KIN17 contenant le motif prédit en «
doigt de zinc ». Des modifications d'intensité de pic sont
également observées au niveau de la boucle H2-H3. Ainsi, les pics
de corrélation 1H-15N correspondant aux
résidus E54, H55, I56, H57, et N59, et qui appartiennent à des
zones dégagées du spectre HSQC de
K2, n'ont pas été retrouvées sur le
spectre HSQC de K3. Cette dégénérescence du signal
pourrait s'expliquer par une mobilité du motif « doigt de
zinc » qui induirait un équilibre conformationnel (à une
vitesse d'échange intermédiaire) entre une forme liée,
où ces 5 résidus seraient en interaction avec « le doigt de
zinc », et une forme libre où ils ne le seraient pas. Les
résidus dont le pic de corrélation n'a pas été
retrouvé (hors extrémité 1-18) sont imputés
d'une valeur de ?äm de 0.1 ppm.
0,25
0,2
?äm = |?äHN| + |?äNH/10|
pic disparu : pénalité de 0.1 ppm
?äm ppm
0,15
0,1
0,05
0
0 5 10 15 20 25 30 35 40 45 50 55 60 65 70 75 80 85 90 95 100
105 110
H1 S1 H2 310 H3 S2 S3 H4
Figure 5.15 : Graphique des
variations moyennes ?äm des déplacements chimiques 1H
et 15N
des résidus du motif Winged Helix. La
numérotation des résidus est relative au domaine K2.
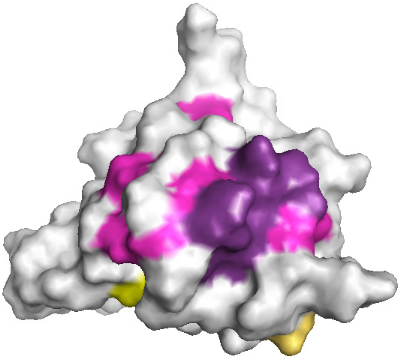
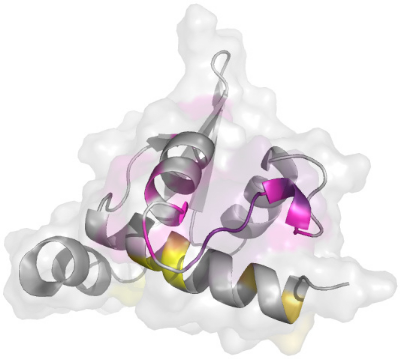
Les résidus de la boucle H2-H3 affectés par la
présence de la région N-terminale de
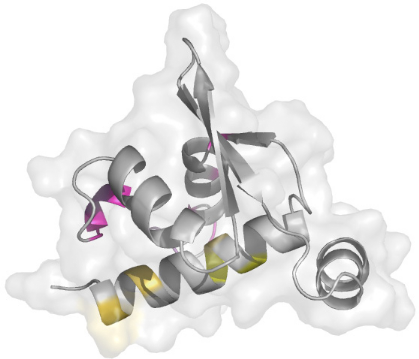
KIN17 contenant le doigt de zinc forment une surface qui est mise
en évidence sur la Figure
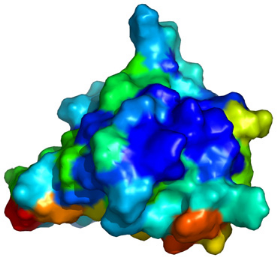
5.16. De manière intéressante, cette surface
se superpose parfaitement avec la surface hydrophobe ultra
conservée que nous avons mise en évidence
précédemment. Le motif prédit
en « doigt de zinc » adopte donc une position
préférentielle au niveau de la surface ultra
conservée H2-H3 du motif Winged Helix.
A)
W1
H2
H3
310
H4 H1
B) W1
H3 H2
H4
310
H1
C)
+ très
conservé
pression
évolutive
_ non conservé
Figure 5.16 : Mise en
évidence d'une surface d'interaction du motif Winged Helix avec
la
région N-terminale de KIN17 contenant le module
prédit en « doigt de zinc ».
A) Représentation de la face avant H2-H3.
Les résidus dont la modification moyenne de déplacements
chimiques ?äm est significative (?äm > 0.07 ppm) sont
colorés en violet (hors hélice H1). Les résidus dont le
pic de corrélation n'a pas été retrouvé sont
colorés en rose (hors hélice H1). Les résidus de
l'hélice H1 dont la valeur de ?äm est significative sont
colorés en jaune. B) Représentation de la face arrière
opposée à la surface H2-H3. Le code couleur est identique
à celui utilisé en A). C) Mise en évidence de la surface
ultra conservée
H2-H3 du motif Winged Helix. Les surfaces sont
colorées en fonction de l'état de conservation des
résidus au cours de l'évolution (d'après CONSURF).
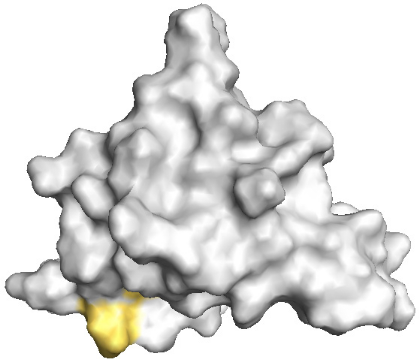
Par ailleurs, des modifications significatives de
?äm apparaissent également au niveau
des résidus D26, L28, et E29 de l'hélice H1. Ces 3
résidus appartiennent à une surface située
à l'opposé de la surface ultra conservée
(Figure 5.16). De plus, dans la structure du domaine K2, les protons amides des
résidus D26 et L28 sont protégés du solvant et
orientés vers le coeur hydrophobe. Par conséquent, nous
proposons que la modification significative de déplacements
chimiques de ces 3 résidus soit plutôt due à une
modification structurale de l'hélice H1 (orientation ou longueur),
ou des résidus qui la précédent qui sont
déstructurés dans la structure du domaine K2. La
structuration des 15 résidus qui séparent le module
« doigt de zinc » du motif Winged Helix
pourrait également provoquer une modification ou une rupture
partielle du réseau de liaisons hydrogènes du Winged
Helix, ce qui expliquerait
les modifications significatives de ?äm
enregistrées.
Chapitre 6 : Conclusions et perspectives
| 


