CHAPITRE 1
METHODES DE CALCUL DES
FONCTIONS D'ONDE ET DES
ENERGIES ELECTRONIQUES
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
1.1 INTRODUCTION
Etudier un système moléculaire revient à
résoudre l'équation de Schrödinger qui régit
l'ensemble de ses électrons et de ses noyaux. Or la résolution de
l'équation de Schrödinger pour un système moléculaire
n'est pas aisée. Pour cela, on fera une première approximation
dite de Born-Oppenheimer, qui va permettre de découpler le mouvement
électronique du mouvement nucléaire.
Dans ce chapitre, on se concentrera sur la résolution
de l'équation de Schrödinger électronique. Pour cela, un
exposé des méthodes de chimie quantique sera fait en passant au
peigne fin les méthodes ab-initio.
Au sorti de cet exposé, il serait nécessaire de
savoir laquelle des méthodes abinitio est la mieux adaptée
à la description d'un système moléculaire.
1.1.1 Hamiltonien et fonction
d'onde.
Considérons un système moléculaire
formé de noyaux et n électrons. A ce
N
système, on associe un repère orthonormé(o
, i , j , k). Dans la
description quantique non relativiste où le spin est
négligé, l'Hamiltonien de ce système peut s'écrire
:
H = Te ( r )
+ TN ( R ) + V
NN ( R ) + VeN
( R,r ) + Vee( r)
(1.1)
Où et r désignent respectivement
l'ensemble des coordonnées des noyaux et des
R
électrons par rapport à l'origine du
repère. Les différents termes constituants cet Hamiltonien sont
définis en unités atomiques comme suit :
· Te ( r) est
l'énergie cinétique totale des électrons :
n
1
T e r = - ?? r
(1.2)
2
( )
i
2 =
i 1
ri étant la position de
l'électron numéro i par rapport à l'origine du
repère.
· TN ( R) est
l'énergie cinétique des noyaux :
N
1 1
TN R = - ? ? R
(1.3)
( )
i
2 = M
i 1 i
Mi étant la masse du noyau numéro i et
sa position par rapport à l'origine du
Ri
repère.
· VNN ( R) est
l'énergie potentiel de répulsion entre noyaux :
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
1N N Z Z
VNN R = ?? (1.4)
i j
( )
2 = = R
i 1 j 1 ij
j i
?

Où R ij = R i - R
j est la distance entre les noyaux de charge Zi
et Zj .
· VeN ( R,r)
est l'énergie potentielle totale d'attraction entre électrons et
noyaux :
n N
Z
VeN R,r ?? R r (1.5)
j
( ) = -
i 1 j 1 j i
-
= =
· Vee ( r) est
l'énergie potentielle totale de répulsion entre électrons
:
1 n n 1
Vee r = ?? (1.6)
( )
2 = = r
i 1 j 1 ij
j i
?
rij étant la distance entre les électrons i et
j.
Chaque état moléculaire peut être
représenté par une fonction d'onde qui est
ØT
solution de l'équation de Schrödinger :
HØT =E
TØT (1.7)
Où est l'énergie totale du système.
L'observation de l'Hamiltonien de ce système
E T
montre que dépend de et . Et quant à lui
dépend seulement de R . L'équation
ØT r R E T
(1.7) peut donc s'écrire :
HØT ( R ,
r ) = E T ( R
)ØT( R , r )
(1.8)
Rappelons que L'équation de Schrödinger est le
postulat de première quantification. La seconde quantification quant
à elle tient lieu des effets relativistes, de la création et de
la destruction des particules. Ce que nous négligerons dans toute notre
étude.
La résolution analytique exacte de l'équation
(1.8) est impossible. On ne peut qu'approcher la solution de par des
considérations physiques simplificatrices. L'approximation fondamentale
qu'on effectue ici est celle de Born Oppenheimer ; qui quant à elle
permet de découpler le mouvement des électrons de celui des
noyaux. Ce qui engendre deux sous problèmes :
v' La résolution de l'équation de Schrödinger
électronique,
v' La résolution de l'équation de Schrödinger
nucléaire.
Bien entendu, chaque sous-problème nécessite des
approximations optimisant la solution du problème global.
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
1.1.2. L'approximation diabatique, l'approximation
adiabatique et l'approximation de Born - Oppenheimer.
L'Hamiltonien du système décrit peut encore
s'écrire sous la forme :
H = TN + H
e +H pm (1.19)
OA He est l'Hamiltonien
électronique et Hpm la polarisation de masse
définis par :
H e = Te
( r ) + Vee ( r )
+ VeN ( R , r )
+ VNN( R ) (1.10)
2
? ?
n
1
H pm = - ? ? ?
? (1.11)
i
2M =
tot i 1
? ?
Mtot étant la masse totale de tout le système.
En supposant connus les vecteurs et valeurs propres de
He , on a :
H e Øi ( R
, r ) = E i ( R
)Øi ( R , r ), i =
1, 2,..., 8 (1.12)
L'hermiticité de H permet de choisir les
solutions orthonormales :
?R r R r r = ä =
* i j ij { 1 si i=j
Ø ( , )Ø ( , )d (1.13)
0 sinon
La base ainsi construite, il est clair que (sans aucune
approximation), la fonction d'onde totale du système peut
s'écrire comme une combinaison linéaire des différents
vecteurs de base. Les coefficients de combinaison étant évidement
des fonctions de R .
8
Ø ( , ) Ø ( )Ø ( , )
R r =? R R r (1.14)
T Ni i
i =1
En introduisant (1.14) dans (1.7), on obtient :
8( VN ØNi ) + 2 ( VN Ø i )( VN Ø Ni ) +
Ø Ni ( VNØ i + Ø Ni E i Ø
i + Ø Ni Hpm Øi = E
T ?Ø Ni Øi (1.15) ? ? ? i 1 = i
1 =
OA nous avons tenu compte du fait que
He et Hpm agissent
seulement sur la fonction d'onde électronique Maintenant, multiplions
l'équation (1.15) à gauche par 'Pj* et
intégrons sur tous les coordonnées électroniques. On
exploitera ici la notation bra-ket :
|
? Ø ØdV Ø Ø
* H =
? ? ? H
Ø *ØdV = Ø Ø
? Ø Ø= ä
i j ij
??
|
(1.16)
|
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
Ainsi, l'équation (1.15) devient :

ur 2
? N Nj
Ø E Ø
+ +
j Nj
8
?
i 1
=
?
??
ur ur ur 2
(1.17)
2 Ø ? N Ø ( )
? N Ø + ?
Ø N Ø Ø + Ø H
j i Ni j i Ni j pm Øi Ø ? = E
Ø
Ni ? T Nj
?
L'équation (1.17) montre que ses deux premiers termes
sont dépourvus de la fonction d'onde électronique ; tandis que
les autres contiennent des termes de couplage de deux états
électroniques différents .Les deux premiers termes de ces
derniers sont des éléments de couplage non
adiabatique, respectivement du premier et du deuxième
ordre. Tandis que le dernier est la polarisation de masse. Le couplage non -
adiabatique est important pour les systèmes à plus d'une surface
électronique, telles que les réactions photochimiques.
Dans l'approximation adiabatique, la
forme de la fonction d'onde totale est restreinte à une surface
électronique ; ce qui signifie que tous les éléments de
couplage contenus dans l'équation (1.17) sont négligés (
seules les termes avec i=j survivent).
ur ? ? ? ?
ur
2 2
N + + ? N
E j Ø j Ø j Ø j pm Ø j Ø Nj E
T Ø N
+ H ? = j (1.18)
? ?
En négligeant la polarisation de masse, (1.18) devient
:
ur
2 + E j + Ø j ? Øj ?
ØNj = E T ØN 2
N N ? ? j
ur ? ? ? ?
(1.19)
Ou plus explicitement :
|
ur ? ? ? ?
|
2
R R R
N + E ( ) + U( ) ? Ø Nj ( ) = E T
Ø ( )
Nj R
j ? ?
|
(1.20)
|
2
U( R ) = Ø ? Ø i
N
est connu comme une « correction diagonale » et il est
plus
Où

j
ur
petit que E j ( R) . En effet,
d'après le théorème d'équipartition
d'énergie,
m 1
U( R ) = áE j ( R
) avec á = . A étant le nombre de charge moyen d'un
M 1836 xA
atome de la molécule (Il est donc clair que les effets
relativistes sont plus marqués
lorsque A est élevé).
Ainsi, la forme de la surface d'énergie est déterminée
presque
exclusivement par Ej ( R) .
L'approximation de Born - Oppenheimer consiste
à
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
négliger la « correction diagonale ». Ce qui
revient à découpler le mouvement des noyaux des atomes de celui
des électrons. Physiquement, ceci se traduit par le fait que la
mobilité des électrons étant beaucoup plus importante que
celle des noyaux, ils s'adaptent adiabatiquement à toute modification de
la position des noyaux en des temps beaucoup plus courts que ceux typiques du
mouvement des noyaux. Du point de vue des noyaux, l'adaptation est quasi
instantanée. L'approximation de Born-Oppenheimer est donc une
approximation adiabatique.
|
|
2
l'équation de Schrödinger
N
|
|
Du point de vu de cette approximation, en posant
|
TN = ?
|
devient :
? T N + V j ( ) ? Ø Nj (
) = E T Ø Nj ( )
R R R (1.21)
? ?
(C'est l'équation de Schrödinger nucléaire
où V j ( R ) = E j ( R
) est l'énergie électronique
et joue le rôle d'énergie potentiel
électronique.) La représentation de est une courbe
Vj
de potentiel (cas d'une molécule diatomique) ou une
surface de potentiel ?-
dimensionnelle (cas d'une molécule à
plus de deux atomes ; étant le nombre de
?
degrés de liberté de vibration de cette
molécule.)
En général, l'approximation de Born- Oppenheimer
(et adiabatique) est une bonne approximation. Mais elle a des limites.
1.1.3. Limites de validité de l'approximation
de Born - Oppenheimer.
L'approximation de Born - Oppenheimer n'est plus valable dans les
situations ci-dessous mentionnées :
> Au niveau de la description des états de Rydberg
où la vitesse des électrons est de l'ordre de celle des
noyaux.
> Lors de croisements évités, quand le couplage
entre deux états électroniques de même symétrie
devient grand devant l'écart en énergie.
En effet, considérons une molécule diatomique
pour simplifier l'étude. Dans ce
cas, les termes de couplage de
premier et de second ordre de l'équation (1.17)
2
? ?
peuvent respectivement s'écrire : i
ø ø et ø ø .
j i 2 j
? R ? R
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
Par ailleurs,
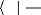
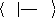
(i)
?ø i ? rid wi vj wj )
wi
? R . = ø
? R ?Røj
? ? ? r`T in \ In ?
? ?
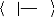
= ø ø V R V R V R
( ) ( ) ( )
+ ? - ? ø ø
i j j ? j i ? i j
? R ?R
Or L? ? R ,Helj= ??R V(R,r i) avec
cf( R, ri)= VeN ( R,
ri )+VNN(R) (ii)
Ainsi, l'équation (i) donne :
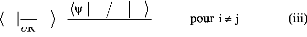
?
ø i ø j =
? R
? c ? R
i j
? - ?
j ( ) ( )
? V R V R
i ?
Quant au terme de couplage de second ordre, en introduisant la
relation de fermeture, on obtient :
(iv)
(5i)
ø i ? R2 ø j = ? ? R ? ø k
øk ? ? Røjj
? 2
? ?
= ? ?
øi ø k øk ?
xi, .)+ ? i ? xi, k Wk ? øj
R ? R ? ? R ?R
? ? ? ? ? ?
= ?? R ?R
+ ? ? R ø k ø k ?R ø
j

Or les fonctions øi étant
orthonormées, on a : ø i ø i = 1 Soit :
ø ?i ? R ø i = 0
Compte-tenu de (iii) et (5i), (iv) devient :
)?? (6i)
? 2 ? ??ø i ? R øj
??øi ? V ? R Wk ? V ? R ø? R 2
øj --( 1 - ä ij )?R ? i[V j ( R ) - V i ( R))
?k ? ij??V k ( R ) - V i ( R ) ??[V j ( R ) -V k(R
pour i ? j (iii)
Ainsi, les expressions (iii) et (6i) des termes de couplages
montrent qu'ils dépendent de manière critique de la
différence d'énergie potentiel ? V j ( R ) - V i ( R ) ? ?
?
entre deux états électroniques donnés. On
peut donc s'attendre à des erreurs importantes dans l'approximation de
Born-Oppenheimer chaque fois que deux courbes se trouverons très
près en énergie l'une de l'autre
(quasi-dégérescence).
> Dans les systèmes Renner -Teller.
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
Une fois l'approximation de Born - Oppenheimer établie,
il reste à résoudre l'équation de Schrödinger
électronique (Comme nous l'avons déjà mentionné)
pour un ensemble de géométries nucléaires
données.
1.2. METHODES DE CALCUL DES FONCTIONS D'ONDE ET DES
ENERGIES ELECTRONIQUES.
Parlant de ces méthodes, on peut citer principalement :
> Les méthodes ab - initio.
> Les méthodes semi - empiriques.
Toutes ces méthodes ont pour but de résoudre
l'équation de Schrödinger électronique (1.12).
Les méthodes ab - initio, qui
signifient du tout début, des premiers principes, ont pour base la
méthode Hartree-Fock. A cause de la complexité des calculs et des
limites (fréquences CPU et capacité RAM) des supercalculateurs,
elles ne s'appliquent que sur des systèmes moléculaires de
petites tailles (quatre atomes au maximum).
Quant aux méthodes semi -
empiriques, elles sont également basées sur les
équations de Hartree - Fock ; mais ne les résolvent pas de la
même façon. Dans ces méthodes, on fait les approximations
suivantes :
v' La matrice de recouvrement S est
équivalente à la matrice unité.
v' Les intégrales mono - électroniques engageant
trois centres (deux des fonctions de base et un de l'opérateur) sont
nuls.
v' Les intégrales bi - électroniques à trois
ou quatre centres sont négligées. Pour compenser ces
approximations, le reste d'intégrales est déterminé sous
la base des paramètres expérimentaux liés à des
systèmes de référence.
Le but principal de ces méthodes étant la
description des liaisons chimiques, elles ne s'occupent que des
électrons de valence. Etant donné le grand nombre
d'approximations effectuées au niveau de ces méthodes, il ne
reste plus que peu d'intégrales à calculer ; ainsi, ces
méthodes sont rapides et nécessitent moins d'espace
mémoire dans un ordinateur.
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
Par rapport aux objectifs, nous nous limiterons aux
méthodes ab-initio que nous présenterons par la suite.
1.2.1. Exposé des méthodes de champ
auto - cohérent de base.
C'est en utilisant l'Hamiltonien ainsi simplifié
qu'historiquement fut mené le tout premier calcul de chimie quantique
dont la paternité revient à Walter Heitler et Fritz
London qui, en 1927, dans le but de vérifier la validité des
équations de la toute jeune mécanique quantique,
calculèrent l'énergie de la molécule la plus simple, H2.
Au-delà de cet exemple extrêmement simple, le grand nombre
d'électrons qui compose les systèmes chimiques
d'intérêt et la taille des bases d'orbitales nécessaires
à une description adéquate font que les calculs exacts sont
généralement hors de portée des calculateurs même
les plus puissants. C'est dans le but de trouver une bonne approximation
à ces impossibles diagonalisations que de nombreuses méthodes de
chimie quantique ont été mises au point. La plus
célèbre d'entre elles est sans conteste la méthode
Hartree-Fock, qui a été proposée sous une forme
primitive par Douglas Hartree en 1928 et qui a pris sa forme définitive
dans les travaux de Vladimir Fock en 1930[5]. Elle consiste à
chercher une fonction d'onde monoélectronique, c'est-à-dire
où chaque électron est traité indépendamment des
autres, même s'il est sensible à leur potentiel moyen ;
d'où son appellation de méthode de champ moyen ou SCF (pour "Self
Consistent Field").
1.2.1.1. Méthode de Hartree.
Hartree considère que les électrons sont
indépendants les uns des autres : C'est le premier niveau de
l'approximation orbitale. En plus, l'interaction entre un électron et
l'ensemble des autres électrons du système est
considérée comme une interaction entre cet électron et un
« champ moyen » crée par l'ensemble de tous les autres corps
du système.
En effet, le premier niveau de l'approximation orbitale (un
modèle à particules indépendantes) laisse comprendre que
chaque électron agit dans un sous espace vectoriel qui lui est propre.
Et ces sous espaces vectoriels ne s'emboîtent pas. Ainsi, l'espace
d'état décrivant le système total est un produit tensoriel
des sous espaces
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
d'états engendrés par des électrons pris
individuellement. Ainsi, la fonction d'onde électronique s'écrit
:
n
H =??á i (i) = ?á 1 (1)
?á2 (2)... ?án (n) . (1.22)
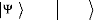

i =1
En projetant cette relation dans la base spatiale
électronique, on obtient :
n
|
H ( r , R )= ??
ái( ri)
|
.
|
(1.23)
|
i =1
Où (pá i (ri ) représente
l'orbitale moléculaire du i -ième électron. ai
est un indice composite représentant l'ensemble des nombres quantiques
associés à cet orbitale. 'PH
représente la fonction d'onde de Hartree. Ainsi,
l'énergie électronique est alors définie par :

E H = ØH H e
ØH . ( 1 .24)
Soit :
n
E H = ? (i)... ?á n (n)
hi ?á 1 (1)... ?á i
(i)..Ván (n)

(1.25)
i =1

i = 1 j = 1
+ 2n
1

(1)... ?á i (i)... ?á n (n)
1 ?á 1 (1)... ?á (i)... ?á
n (n) + VNN
j i
?
= - ?r-
2
i
est la somme de l'énergie cinétique d'un
électron peuplant
h i
1
2
N Zj
j =1 R j - ri
?

l'orbitale ?á et de l'énergie potentiel
de son attraction par les noyaux. Les fonctions ?á
étant orthonormées, il est clair que :


i = 1i = 1 j = 1
-- E (i) hi
EH -- (Pá i (Pá i (i) + 1
alo) ajo 1
E 0) jo +VNN
. (P.J (Pi (Pa.J
. (1.26)
2 ?? rij
En plus, on remarque que les intégrales
biélectroniques sont indépendantes des numéros des
électrons considérés. Ainsi, dans les écritures, on
pourra seulement considérer les électrons 1 et 2. De ces
considérations, l'équation (1.26) devient :
i = 1i = 1 j = 1
n n
E H = (Pá E (1) h 1
?á (1)
(Pa
, (1.27)
1 ?? (1) ?a (2) 1 á (1) ?á
(2) + V
NN
2 r (P

ij
que l'on peut encore écrire :
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
n n n
1
E = ? + ?? + NN , (1.28)
h J V
H i ij
2
i 1
= i 1 j 1
= =
j i
?
où

h i = ? á i (1) h 1 ? á i (1) est
l'énergie orbitalaire du i-ième électron,
|
1
J = ? á (1) ? á (2) ? á (1) ? á
(2)
ij i j i j
r ij
|
|
est l'énergie d'interaction coulombienne entre les
|
électrons i et j. Pour déterminer cette
énergie, Hartree utilise le principe variationnel repris par Vladimir
Fock[6].
Au niveau de sa fonction d'onde, la méthode de Hartree
traite mal la corrélation électronique (Parlant de
corrélation électronique, deux électrons
sont dits corrélés lorsque le mouvement de l'un
influence celui de l'autre. Dans le cas contraire, les électrons sont
dits indépendants. Nous reviendrons sur cet aspect au paragraphe
1.2.3.). Elle ne prend pas en compte le spin électronique. Ce qui
est une violation du postulat de symétrisation, plus
particulièrement le principe d'exclusion de Pauli (Deux électrons
de même spin ne peuvent occuper le même état quantique).
C'est pour lever ce dernier échec que Fock proposa une fonction d'onde
monodéterminentale dite slaterienne construite à l'aide de spin -
orbitales.
1.2.1.2. Méthode de Hartree -
Fock
Afin de corriger la fonction d'onde de Hartree, Fock proposa une
fonction d'onde du type :
n
Ø = A? ? á (i) s (i)
m , (1.29)
H i i

i 1
=
telle que : 1 ( 1)
A = ? - P est
l'opérateur d'antisymétrisaton ; P est
l'opérateur de
ó
ó
n!
permutation et est la fonction d'onde spinorielle de
l'électron i. Par la suite, il
smi (i)
définit l'énergie électronique comme
étant :

E HF = ØHF H e ØHF .
(1.30)
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
En tenant compte des propriétés de
l'antisymétriseur A et en posant :
Ö qi (i) = ? á i ( ri)s
mi (i) avec q i = (ái,mi) ,
on a :

Ö q l (i) Ö qk (j) = ä ij
ä m i mj, (1.31)
et
n n
? ? ? ?
= ? ? ? ? ? ? ?
2
E HF q e q
? Ö (i) H A ? Ö (i) ?
i i
? i 1
= ? ?
(1.32)
i =1 ?
n n nn n n
? ? ? ? 1 ? ? ? ? ? n
A ?
= ? [ ]
h A ? +
q i q ? q q
? ? ? ?
Ö (i) ? Ö (i) ?? ? Ö (i) ? ? ? ? ? Ö (i)
V
? + NN
i i i i
2 r
i 1
= ? i 1
= ? ? i 1
= ? i i 1
= = ? i 1 ? ? ? ? ? ?
= ij i 1
= ?

Par définition, h i Ö
qi(i) = h i Ö qi (i) . Ainsi, en raison de
l'orthogonalité des
fonctionsÖ , le premier terme de l'équation (1.32)
n'est non nul que lorsque P=1 (application
identique) . En effet, toute permutation peut être
décomposée en un nombre fini de transpositions [7], et
dans chaque permutation différente de l'identité, il existe au
moins une transposition qui permettra d'annuler ce premier terme. Quant au
deuxième terme contenant l'opérateur
biélectronique 1 , il est non nul seulement
rij
lorsque l'opérateur P représente
soit la permutation identique (1), soit la transposition entre
les électrons i et j (Pij). Ainsi, l'équation
(1.32) devient :
n n n

1 1 P
- ij
E = ? Ö (i) Ö (i)
h + Ö (i)Ö (j) V
HF q i q q q q q NN
?? Ö (i)Ö (j) +
i i i j i j
2 r
i 1
= i 1 j 1
= = ij
j ?i
n 1 n n 1
= ?
h ?? Ö (i)Ö (j) Ö (i)Ö (j)
i +
q q q q
i j i j
2
(1.33)
=
i
=
1 i
=
1 j
1
rij
j ?i
n n
1 2 ?? Öqi (i)Öqj(j)
i = 1 j =1
1
rij
Ö q (j)Ö (i) +VNN
q j

n n n
= ?
1
h J
i + ij
??
2
i =1 i = 1 j =1
j ?i
n n
1 ?? +
K V
ij NN
2
i = 1 j =1
j ?i
??K
avec
Ji
1
Ö (2) Ö (1) Ö (1) Ö (2)
=
q q q q
j i i j
r12
Ö (2) = Ö (1) 1 Ö (2) Öq j
(1)
r 12
? =
J Ö (2) Ö (2)
J
(1.34)
ij q i q j
et j
?? ?? =
K Ö (2) Ö (1)

K
ij q i qj j
A partir des définitions des Öch , on peut
réécrire Ji et Kij comme suit :
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.

J = ? (2) J ? (2
ij q i q
j j
K = ? (2) K ? ( 1)
ij q i q
j j
?
?? ??
)
(1.35)
Dans le but de déterminer les variations de
l'énergie, il est convenable d'exprimer l'énergie en fonction des
opérateurs de Coulomb :
n n n

1
(1.36)
E = ? Ö (i) Ö (i)
h + ?? i - K
+
( Ö (2) Ö (2) Ö (2) Ö (1) V
J )
HF q i q q q q i q NN
i i j j j j
2
i 1
= i 1 j 1
= =
j i
?
La famille de fonctions d'ondes étant inconnue, le nouveau
problème à
? ?
? ?
Ö =
qi i 1,...n
résoudre est de déterminer une base de
spinorbitale qui minimise l'énergie, ou la rend au moins stationnaire
par un changement de spinorbitale. Les nouvelles spinorbitales restant toujours
orthogonales et normées : Il s'agit donc ici d'une optimisation par
contrainte [8]. Ce principe peut donc être mis en
évidence par la méthode des coefficients de Lagrange. En bref, la
condition est qu'une légère variation des orbitales de base ne
puisse modifier la fonction de Lagrange ; ce qui signifie que la fonction de
Lagrange ainsi définie doit être stationnaire par rapport à
une variation d'orbitales de base. On définit donc la fonction de
Lagrange comme suit :
n n
? =
L E - ë ? ? Ö (i) Ö (j) - ä ? ?
? HF ij q q
?? ij
i j
(1.37)
i 1 j 1
·
= =
??
n n
? et L E
ä = ä - ë ä
? Ö (i) Ö (j) Ö (i) Ö (j) 0
- ä ? =
HF ij q q q q
?? i j i j
?? ? ?
i 1 j 1
= =
Où les ë ij sont les multiplicateurs de
Lagrange. De la relation (1.36), on a :
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
n nn n
ä

1 1
E = ä
? Ö (i) Ö (i)
h + Ö (i) Ö (i)
h ä + ?? ä Ö (i)Ö (j) Ö
(i)Ö (j)
HF q i q q i q q q q q
?
i i i i i j i j
2 r
i =1 i =1
i = 1 j = 1 ij
j i
?
n n n n


1 1 1 1
+ ?? Ö (i) Ö (j) Ö (i)Ö (j)
ä + Ö (i)Ö (j) Ö (i)Ö (j)
ä
q q q q q q q q
??
i j i j i j i j
2 r 2 r
i 1 j 1
= = ij i 1 j 1
= = ij
j i
? j i
?
n n

1 1
+ q q
?? Ö (i)Ö (j)
i j
2 r
i 1
= j 1
= ij
1 1

n n
Ö (i) Ö (j)
q q q q q q
i j i j i j
2 r
= =
i 1 j 1 ij
ä - ?? ä Ö (i)Ö (j) Ö (j)Ö (i)
j ? i j i
?
n n n n


1 1 1 1
Ö (i) Ö (j) Ö (j)Ö (i)
ä - Ö (i)Ö (j) Ö (j) Ö (i)
ä
q q q q q q q
?? q
i j i j i j i j
2 2 ??
r r
i 1 j 1
= = ij i 1 j 1
= = ij
j i
? j i
?
j i
?
n ?n
2 i 1 j 1
1
Ö (i)Ö (j) Ö (j) Ö
(i
ä
q q q q
i j i j
r ij

=
=
Les indices i et j étant muets, cette relation devient
alors :
n n
E = ä
? Ö (i) Ö (i)
h + ? Ö (i) Ö (i)
h ä
HF q i q q i q
i i i i
ä
i 1
= i 1
=
n n
?
?
? ?
?
?
? ?
1 ? 1 1
+
?? ? ä Ö (i)Ö (j) Ö (i)Ö (j) Ö
(i)Ö (j) Ö (j)Ö (i)
- ä
q q q q q q q q
i j i j i j i j
2 ? r r
= =
i 1 j 1 ? ij ij
j i
n n
1 ?
+ 2 ?? ? ?
i 1 1
= =
i ?
j i
?
?

1 1
Ö (i)Ö (j) Ö (i) Ö (j) Ö (i)Ö (j)
Ö (j) Ö (i)
ä - ä
r ij rij
q q j q j q j i j
Remarquons de plus que pour i=j, les deux derniers termes de
l'équation précédente sont nuls. Ainsi, on peut se passer
de la condition i ?j et l'on obtient donc :
n n
E = ä
? Ö (i) Ö (i)
h + ? Ö (i) Ö (i)
h ä
HF q i q q i q
i i i i
ä
i 1
= i 1
=
n n

1 ? 1 1 ?
+ ? Ö (i)Ö (j) Ö (i)Ö (j) Ö (i)Ö
(j) Ö (j)Ö (i) ?
q q q q q q q q
i j i j i j i j
2 ?? - ä
ä
? r r
i 1 j 1
= = ? ij ij ? ?
n n
1 ?
+ ?? ?
2 ?
i 1=j 1
= ?
1 1 ?
Ö (i) ä Ö q j ( j) - (i)Ö q j (j) (j) ä
Ö qj (i)
r ql r
ij ij ? ?
En vertu de leur qualité muets, les indices i et j peuvent
être permutés. Donc
n n

ä = ? ä
E Ö (i) Ö (i)
F + ? F ä
Ö (i) Ö (i) , (1.38)
HF q i q q i q
i i i i
i 1
= i 1
=
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
n
avec F = h i + ?(
J j - Kj). (1.39)
j =1
Fi est appelé
opérateur de Fock ou
Fockien.
Par suite, la variation de la fonction de Lagrange dans
l'équation (1.37) devient :
??
nn n ä L = ? F
? ä Ö (i) Ö (i) Ö (i) Ö (i)
+ F ä ? - ë ? ä + ä
q i q q i q ij q q q
? ?? ? Ö (i) Ö (i) Ö (i) Ö (i)
i i i i i i i i
? q
i =1 i = 1 j =1
En utilisant les relations :
* *
Ö ä Ö = ä Ö Ö , Ö F
ä Ö = ä Ö F Ö et ä L =
0, nous avons :
n? n ?

ä = ? ä
L - ë ä
q i q ij q
? Ö (i) Ö (i)
F Ö (i) Ö (i) ?
q
?
i i i i
i 1
= ? ? j = 1 ? ?
n ? n

* * ?
+ ? ä - ë ä ? =
q i q ij q q
? Ö (i) Ö (i)
F ? Ö (i) Ö (i) 0
i i i i
i 1
= ? ? j = 1 ? ?

Cette relation devant être vérifiée quelque
soit äÖ et *
äÖ , il est clair que :
n



ä Ö(i) Ö (i)
F - ë ä
? ?? ? Ö (i) Ö (i) 0
q =
q i q ij q
i i i i
j 1
=
n
?



* *
Ö(i) Ö (i)
F ä - ë =
q i q ij q
? Ö (i) Ö (i) 0
ä q
i i i i
j =1
En prenant le conjugué complexe des deux derniers termes
du système précédent, et en
les soustrayant des deux
premiers termes, on obtient :

n

? ë - ë ä
( ) i
* Ö (i) Ö (i) 0
= . Soit *
ë ij = ë ji indépendamment de ä
Ö qi (i) . Ainsi,
ij ji q q i
j =1
la matrice des coefficients de Lagrange X est
une observable. Les ont donc un sens ij
physique que nous préciserons dans la suite. On arrive
alors à l'équation :

n
= ?ë
Ö q j (j)
(1.40)
F
ij
i Ö qi (i)
j=1 i =1,...,n
Cette équation constitue l'ensemble des
équations de Hartree - Fock. Pour simplifier son écriture, on
choisit une transformation unitaire qui diagonalise la matrice des
multiplicateurs de Lagrange. Ainsi, les vecteurs de base de cette
transformation unitaire sont ceux qui diagonalisent le Fockien. On les
appellera donc les spinorbitales
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
moléculaires canoniques. Remarquons que réaliser
cette opération revient à choisir les ë ij tels
que ë ij = å i äij. Ainsi, dans la base canonique,
l'équation (1.40) s'écrit :
F Ö (i) Ö (i)
~ ~
q = å
i q i
i i
(1.41)
.
i
1,...,n = Les équations (1.41), dites de Hartree - Fock
seront donc appelées les équations aux
pseudo-valeurs propres. Et les coefficients de Lagrange peuvent
être interprétés dans la base canonique Fockienne comme les
énergies spin-orbitalaires monoélectroniques.
En tenant compte des équations (1.39) et (1.41), on peut
écrire :
n
å = + ? - , (1.42)
h ( )
J K
i i ij ij
j 1
=
Soit enfin,
n n n n n
? ?? ??K V . (1.43)
? 1 1 ?
E J +
HF = å -
i ij - ij NN
2 2
i 1
= ? i 1 j 1
= = i 1 j 1
= = ?
j i
? j i
?
? ?
En définitive, l'énergie électronique
proposée par Fock diffère de celui de Hartree par le terme
d'échange qui n'est effectif que pour deux électrons de
même spin. Ainsi, dans le formalisme de Fock, chaque électron est
entouré par un double trou :
· Un trou de fermi : Deux
électrons de même spin ne s'approchent pas.
· Un trou de Coulomb : Deux
électrons se repoussent en tant que particules de même charge.
1.2.1.3. Méthode de Roothaan et Hall (LCAO)
Rappelons tout d'abord qu'une orbitale atomique (OA) permet de
décrire la distribution des électrons autour d'un atome ; alors
qu'une orbitale moléculaire (OM) permet de décrire la
distribution des électrons autour d'une molécule.
Dans une molécule, l'électron appartient
à l'ensemble des atomes et il ne peut plus être décrit par
une OA, mais par une OM. En effet, au sein d'une molécule,
les atomes ne perdent pas complètement leurs
identités (c'est l'idée forte de la LCAO) qui sont
justement à l'origine de la liaison chimique. Ainsi, les OA de cette
molécule sont une information clé ou mieux les acteurs de la
liaison ; pour tout dire la base de la
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
molécule. Donc une orbitale moléculaire est une
combinaison linéaire d'orbitales atomique.
Ainsi, on peut écrire les ?ái (OM) sous
la forme :
? á (i) = ? ÷
C â â ?
(i) (1.44)
i i n
[ ]
i
[ m]

â?
Où m est la dimension de la base d'OA (nombre de fonctions
÷â ) et Câ i ? 0 ? â? [ m ] , i?[ n] .
Introduisons l'opérateur densité de charge
défini en un point r de l'espace par,
|
ñr = ? ? r ? r
= ?? ? ÷ r ÷ r = ? ?
÷ r ÷
* * *
( ) á ( ) á ( ) C C ( ) ( )
* P ( ) ( )
r
ì í ì
i i í ìí ì í
i i
i n
? [ ]i n
? ì? í?
[ ] [ ] [ ]
m m ì? í?
[ ] [ ]
m m
|
(1.45)
|
|
Où
|
Pìí = ? í (1.46)
C ì * i C i
|
i ?[ n]
Développons les équations de Hartree-Fock dans la
base de Roothaan et Hall.
( j)
Fj ?á j (j) =
å j ?áj (j)
? 1 1 ?
h
? (j) + ? ? (i) ? (i) (j)
? - ? (i) ? (j) (i)
ë
? ä = å
? ÷
j m m j j
? C
á á á á á á á
ë
?
j i i j i i j i j
r
i ? ? r ij ij ? ? ë

?
s i ìíó
? 1 1
( j) * (i) (i) ( j) * ÷ (i) ( j) (i)
C j j
h ÷ + i i j i j i m m
? C C C ÷ ÷ ÷ - ÷ ÷ ä
C C C
s ó ì í ó ì í ó
ì í ó ì í i
? ó
r r
? ij ij
?
j ?
?
j) (1.48)
= å C ÷
j j
? ó
(
ó
ó
En projetant dans la base d'OA, on arrive à :
1
En posant : (2) (1) ÷ í ÷
ó
(1) (2)
÷ ô ÷ ì
, l'équation (1.50) devient:

r12
= ìí ôó
?1 1 ?
* ( j) (i) ÷ ÷ -
(i) ( j) * ( j) (i) ( j) (i)
C (h )
j j i i j i j i m m
? ? C C C ÷ ÷ ÷ ÷
C C C ÷ ÷ ä
ó ôó + ì í ó
ô ì í ó ì í ó ô ì
í ó i j
? r r ?
s
(1.49)
i ìíó ? ij
ij ?
= å
j j
? C S
ó ôó
ó
Soit :
?
? 1 1





(2) (1) (1) (2) ÷ ÷
(2) (1) (2) (1)
+ ?
C (h ) ÷ ÷ ä
j j j j m m
? P C ÷ ÷ ÷ ÷ - P C
ó ôó ìí ó ô
ì í ó ìó í ô ì í
ó 1 2
s ìíó
(1.50)
? r 12 r12
= å
ôó
j j
? C S
ó
ó
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
|
? ?
C (h ) P C j (
ó j j ôó ìí ó m m j
j
1 2 ) = C S
ó ôó
? ? + ? ìí ôó - ìó
ôí ä ? ? å
ó ? ?ìí ?? ó
|
, (1.51)
|
soit :
avec
? - å
C ó i F ôó
( )
(i) i S ôó =0 . (1.52)
ó

F ôó (i)÷ ô (i)F
÷ ó(i) (h i )
ôó + ? PìíCói ( ìí
ôó - ìó ôí ä 1 m2) . (1.53)
m
ìí
La forme matricielle de l'équation (1.52) est donc :
( F - åS ) C
= 0. (1.54)
L'approximation LCAO a donc converti les équations aux
dérivées partielles complexes de Hartree-Fock en un
système d'équations algébriques simple. Dans cette
approximation, on a :
*
h i = Ö (1) h i
Ö q i (1) =?C ìi C í i (h i)ìí
, (1.55)

ìí

ìí ëó , (1.56)
J = Ö (1)Ö (2) 1 Ö (1)Ö (2) = ? C
ì C í C ó C ë
* *
ij q q q q i j i j
i j i jr
12 ìíóë
1
K Ö (1)Ö (2) Ö (2)Ö (1)
= = ? C ì C í C
ó C ë
* * ìó ëí ä . (1.57)
ij q q q q i j i j m m
i j i j i j
r 12 ìíóë
Par la suite, en substituant (1.55), (1.56) et (1.57) dans
l'équation (1.33), on arrive à :
E = ? + ? ìí ëó - ìó
ëí ä (1.58)
P ìí h ìí
( i ) P ìí P ëó
(
HF m m
i j )ìí
ìíëó
Ainsi, déterminer l'énergie électronique
d'un système moléculaire revient à procéder comme
suit :
1) Choisir les fonctions d'essai constituantes la base
d'orbitales atomiques.
2) Calculer la matrice densité
Pìí .
3) Calculer l'énergie électronique ( )
E (1) = ? + ? ìí ëó - ìí
ëó ä m
P ìí h ìí P
ìí P ëó (
i m i j )
ìí ìíëó
4) Calculer le Fockien (
F ôó (h i ) ôó
(i) = + ? ìí ôó - ìó
ôí äm m
P ìí C ó i 1 2 )
ìí
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
5) Diagonaliser le Fockien afin d'en extraire les vecteurs
propres qui constitueront une nouvelle base de combinaisons linéaires
d'orbitales atomiques.
6) Calculer la nouvelle énergie électronique
E(2)
Si le rapport (2)
E - E E est supérieur à la précision
fixée, on recommence les
(1) (1)
étapes 2) à 6).
On résume tout ceci par le graphique ci-dessous :
Obtain initial guess for density
matrix

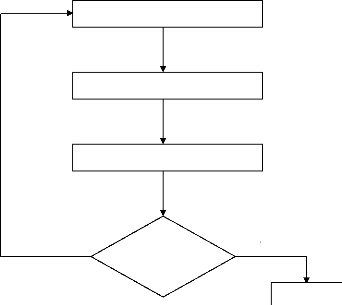
False
Form new density matrix
Diagonalize Fock matrix
Test convergence
Form Fock matrix
True
E=En
Jusqu'à lors, nous avons décrit la
méthode Hartree-Fock sans aucune restriction sur la forme de la fonction
d'onde spatiale. Ainsi, les fonctions d'onde d'essai sont dites de type
«unrestricted Hartree-Fock» (UHF).
Si le système étudié possède un
nombre d'électrons pair, la fonction d'onde du système est un
singulet. On dit alors qu'il s'agit d'un système à couches
fermées. La
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
restriction qu'un tel système impose est que chaque
orbitale spatiale devrait avoir deux électrons, un de spin á (up)
et l'autre de spin â (down). Les fonctions d'onde ainsi construites sont
de type <<restricted Hartree-Fock» (RHF).
1.2.2. Les bases de calculs.
Comme nous l'a déjà appris la méthode
LCAO, les fonctions d'onde moléculaires peuvent s'écrire comme
des combinaisons linéaires d'orbitales atomiques (OA) formant une base
de représentation pour ces OM. En principe, n'importe quel type de
fonction de base peut être utilisé pour la description d'une OM :
exponentiel, gaussien, polynomial, onde plane, ...etc. Mais, tous ces types ne
sont pas bien adaptés. Pour choisir le type de fonction d'onde de base
à utiliser pour la description optimale d'un système
moléculaire, on se base sur deux critères fondamentaux :
Premier critère : Le type de base choisi doit
avoir un comportement en accord avec la physique du problème
étudié. Ceci assure une convergence rapide des calculs lorsque
plusieurs fonctions de base sont ajoutées. En d'autres termes, les
fonctions de base choisies doivent s'annuler pour des électrons
très éloignés des noyaux.
Deuxième critère : Les fonctions d'onde
choisies doivent faciliter le calcul de toutes les intégrales requises.
Le premier critère suggère fortement l'usage des fonctions
exponentielles pour chaque noyau. L'inspiration vient du fait que ces fonctions
décrivent bien l'atome d'hydrogène, surtout le comportement au
voisinage de zéro. Elles ont été par ailleurs mises en
évidence par Slater. D'où leur nom de fonctions de Slater
1.2.2.1. Les fonctions de Slater.
Comme nous l'avons déjà mentionné, les OA
fonctions propres de l'opérateur de Fock atomique, peuvent être
représentées par des fonctions de Slater STO (<<Slater Type
Orbitals»).Les fonctions de Slater étant de même type que les
fonctions hydrogénoïdes, une STO centrée sur l'atome a
s'écrit[4] :
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
|
n 1 ra m
*
÷ = Cr e Y
- -î
a a l
|
( )
è a
, ?
a
|
*
-ó
Z Z
eff
î = =
*
n n
(1.59)
où ( est l'harmonique sphérique liée
à l'atome a.
Y l è a , ? a
m )
C est une constante de normalisation,
ra est la distance de l'électron à
l'atome a.
Z est le nombre d'électrons de l'atome
considéré.
ó est l'effet d'écran des électrons les plus
internes de l'atome considéré.
Dans le cas des hydrogénoïdes, on a î = 1 .
Pour un atome différent d'un hydrogénoïde, les fonctions de
base sont construites à partir des combinaisons linéaires de
fonctions de Slater. Cependant, lorsque dans un système, chaque orbitale
atomique est représentée par une seule fonction de Slater, la
base des fonctions utilisée est dite minimale
ou Single Zéta (SZ). Dans le cas
contraire, on parle de base étendue. Une base
étendue peut être du type :
Double Zêta (DZ) : Chaque
sous-couche d'orbitales atomique est représentée par deux
fonctions de Slater.
Triple Zêta (TZ) : Chaque
sous-couche d'orbitales atomique est représentée par trois
fonctions de Slater.
Quadruple Zêta (QZ) : Chaque
sous-couche d'orbitales atomique est représentée par quatre
fonctions de Slater.
Quintuple Zêta (5Z) : Chaque
sous-couche d'orbitales atomiques est représentée par cinq
fonctions de Slater.
...etc. Ici, l'expression Zêta est liée à
l'argument grec î de l'exponentiel; nommé zêta. Les
fonctions de Slater telles que décrites respectent bien le premier
critère de choix d'une fonction de base ; mais, elles violent le second
critère. Ceci dans le sens que le calcul des intégrales
biélectroniques à deux centres ou plus, rend l'utilisation de ces
fonctions très lourde et très coûteuse en temps de calcul.
C'est pour cette raison que l'usage de ces fonctions reste très
limité aux atomes et aux molécules diatomiques.
Pour surmonter les difficultés rencontrées dans les
calculs des intégrales multicentres, Boys[10]a introduit les
fonctions gaussiennes pour remplacer les slateriennes.
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
1.2.2.2. Les fonctions gaussiennes.
Les fonctions gaussiennes GTO («Gaussian type
orbitals») sont le produit d'une harmonique sphérique et d'une
fonction radiale. Les GTO habituellement utilisées sont de la forme :
|
2
÷ a = Nx l x y l y z lz e-áa
ra
|
.
|
(1.60)
|
L'indice a permet de repérer l'atome a ; á
a est le coefficient de la gaussienne traduisant la
diffusivité de l'orbitale : Plus á a est petit, plus
l'orbitale décrite est diffuse. Par contre, lorsque á
a est grand, on parle d'orbitale polarisée. N est un facteur
de normalisation. On montre qu'il est défini par :
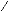

3 ( ) ( 2l 2m 2n 3 4
+ + + )
l m n
+ +
4
? ?
2 2 á
1 2 , (1.61)
N = ? ?
? ð ? ? -
? ( ) ( ) ( )
2l 1 ! 2m 1 ! 2n 1 !
- - ? ?
où n, l et m sont respectivement les nombres quantiques
principal, secondaire et azimutal. La somme donne le type angulaire de
l'orbitale. Ainsi, si
l x + l y + l z
lx + l y + lz=0, 1, 2,.. .,il
s'agit respectivement d'une orbitale de type s, p, d, f,.... Nous avons alors
respectivement les orbitales ÷ as , ÷ ap ,
÷ ad ,... définies comme suit :
÷=
asN se
-á
as r:
2
N xe áap a = p p x
2
?÷ ap = ?N ye áap ra = py
2
? -á ap r a
N ze = p
p z
??
?
?
?
?
?
÷ ad =
?
2
N d x 2e -áad ra = dxx
2
2 -á ad a
N y e r = d
d yy
2
N d z 2e -áadra = dzz
r 2
ad a
N xye -á = d
d ' xy
r 2
ad a
N xze -á = d
d ' xz
r 2
ad a
N yze -á = d
d ' yz
?
? ?
? ?
(1.62)
Pour une orbitale de type d, on peut former les combinaisons
linéaires suivantes : d x 22 -y - 2 , d 2z -2 - 2 - y2 ,
dxy , d, dyz qui représentent bien les cinq
orbitales d disponibles dans
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
une couche électronique de nombre quantique principal
supérieur ou égal à trois. Les fonctions définies
par l'équation (1.62) ont une propriété avantageuse : Le
produit de deux gaussiennes centrées sur deux noyaux A et B
différents est équivalent à une gaussienne centrée
en un point C situé entre A et B et d'exposant á C = á
A+ áB. Ainsi,
toutes les intégrales biélectroniques à
plusieurs centres se ramènent à une somme d'intégrales
monocentriques qui se calculent aisément. Remplacer une orbitale de
Slater par une gaussienne simplifie énormément les calculs, mais
présente quelques inconvénients. En effet, une gaussienne ne
reproduit pas correctement le comportement de la fonction d'onde au voisinage
du noyau, ni à l'infini. Les exponentielles en
e-á r2 constituent donc une
approximation moins bonne que les exponentielles en e-î
r pour la représentation des orbitales atomiques. Ainsi, le
développement des orbitales moléculaires en série de
fonctions de gaussiennes nécessite donc beaucoup plus de termes que leur
développement en fonctions de Slater. Il faut utiliser environ trois
fois plus de GTO que de STO pour atteindre une énergie donnée.
Ainsi, si le calcul des intégrales biélectroniques est
facilité par l'utilisation des fonctions gaussiennes, le nombre de ces
intégrales augmente. Pour décrire au mieux une slaterienne, il
faut combiner linéairement au minimum trois GTO (Voir figure 1.1).
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
Figure 1.1 Représentation d'une orbitale
de Slater STO ( î = 1 ) par une, deux et trois fonctions
gaussiennes, dont les paramètres sont optimisés par
recouvrement maximal avec l'orbitale de Slater.
La qualité d'une base de gaussienne dépend donc de
trois facteurs :
-Le nombre de fonctions primitives (étendue de la
base).
-La méthode utilisée pour l'optimisation des
coefficients de combinaison et des exposants de la
gaussienne[11].
-Le nombre et le type de contractions[12-13].
Dans la pratique, pour le choix des exposants des gaussiennes,
on a recours à la littérature où sont tabulées des
bases dites standard, de tailles différentes pour plusieurs atomes.
Pour se rapprocher le plus possible de la solution
Hartree-Fock, la base d'orbitales doit être suffisamment étendue
dans des limites raisonnables, afin de ne pas dépasser la
capacité des ordinateurs. Pour les calculs SCF, nous utiliserons des
gaussiennes contractées (CGTO), c'est-à-dire des combinaisons
linéaires des gaussiennes primitives (PGTO) de la base standard :
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
÷ = ? ÷ g (1.63)
(k)
t
a ak
k [N ]
? g
|
Où :
· ( )
k
÷g
|
k ? [N ]
g
|
sont les gaussiennes définies par l'équation
(1.60).
|
·

t ? sont des coefficients supposés connus au départ
du calcul variationnel
ak k [N ]
g
moléculaire ; et peuvent être optimisés sur
les atomes séparés.
· Ng est le Nombre de fonctions primitives.
Pour un atome donné, Ng est plus grand pour
les OA des couches internes que pour celles des couches externes à cause
de leur grande contribution à l'énergie électronique de la
molécule et de la variation rapide des orbitales atomiques près
du noyau.
La base d'orbitales atomique doit bien décrire le
système à toutes les distances interatomiques et pour tous les
degrés d'excitation intervenants dans les calculs. C'est la raison pour
laquelle on ajoutera aux bases standard des orbitales plus diffuses, pour bien
décrire les couches de valence ; et des orbitales de corrélation
ou de polarisation non occupées dans l'état fondamental de
l'atome pour décrire les phénomènes relatifs à la
corrélation électronique ou à la déformation des OA
dans la molécule.
Dans une base, pour un atome donné, lorsqu'on
représente les orbitales s, p, d, ... par n1, n2, n3, ... PGTO, cette
base est notée (n1s, n2p, n3d, ...) pour cet atome.
Si par la suite, cette base est contractée en m1, m2,
m3, ... CGTO, elle est alors notée (n1s, n2p, n3d, ...)/[m1s, m2p, m3d,
...]. Cette notation a l'avantage d'indiquer directement les tailles des bases
contractées et non contractées. Mais, elle ne permet pas de
comprendre comment les contractions sont effectuées. Dans la suite, nous
verons comment les bases contractées sont classifiés.
1.2.2.3. Classification des bases
contractées.
Pour comprendre les stratégies d'amélioration des
bases, on peut découper
l'espace en Trois zones comme l'indique la figure 1.2.
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
|
Orbitales internes
Orbitales de valence
Orbitales diffuses
|
|
Fig 1.2 : les zones à considérer
dans la conception d'une base.
Après avoir décidé du type de fonctions
de base à utiliser, le facteur le plus important est le nombre de ces
fonctions à prendre en compte. Ainsi, comme nous l'avons
mentionné plus haut, on pourra construire une base minimale ou
étendue.
La base minimale est formée
d'orbitales entrant dans la configuration électronique du fondamental de
chaque atome. Ainsi, par exemple pour les éléments de la
deuxième ligne du tableau périodique (n = 2 , doncl = 0 ou 1), la
base minimale sera
construite de deux orbitales s (1s et 2s) et d'un ensemble
d'orbitales p ( px , p y , p z ) pour
chaque atome.
La base étendue quant à elle
est construite en multipliant toutes les orbitales de la base minimale par un
coefficient constant. Ainsi, lorsque le coefficient vaudra 2, 3, 4, 5, ..., on
aura ainsi construit respectivement les bases DZ, TZ, QZ, 5Z,... Ainsi, la base
QZ pour un élément de la deuxième ligne du tableau
périodique contient huit orbitales s (4 orbitales 1s et 4 orbitales 2s)
et quatre ensembles d'orbitales p (soit 12 orbitales p). En principe l'effet de
la multiplication des orbitales de la base minimale est négligeable sur
les orbitales de coeur, et plus marqué sur les orbitales de valence. On
pourra donc ainsi construire de nouvelles bases suivant le même principe
que précédemment, mais en gardant le nombre de fonctions
décrivant les orbitales de coeur constant (ce nombre est celui de la
base minimale). Elles seront par la suite dénommées
VDZ (pour valence double zêta), VTZ
(pour valence triple zêta), VQZ (pour valence quadruple
zêta),... Dans la littérature, on laisse souvent de
côté la lettre V et ces bases sont
délibérément appelées DZ, TZ, QZ, 5Z,... Notons
qu'une base étendue a l'intérêt de pouvoir décrire
les systèmes pour lesquels la distribution des électrons est
différente dans plusieurs directions[14]. Mais cette base
devient insuffisante lorsqu'il faut décrire
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
des liaisons polarisées ou diffuses. Il faudra donc
introduire les orbitales de polarisation et diffuses.
Intuitivement, pour polariser une orbitale s, on lui
associera une orbitale p ; on associera une orbitale d à une orbitale p
pour la polariser et ainsi de suite. On retient donc que les orbitales de
polarisation d'une orbitale atomique de moment angulaire l sont les orbitales
de moment angulaire l + 1 qu'on pourrait lui associer. Par définition,
les orbitales de polarisation permettent de bien décrire la
corrélation électronique (corrélation statique, radiale et
angulaire) ; c'est pourquoi elles seront aussi appelées
orbitales de corrélation. Ainsi, par exemple, une base
VQZ enrichie d'un, de deux ensembles de fonctions de polarisation sera
respectivement dénommée VQZP (pour valence
quadruple zêta plus polarization), VQZ2P (pour valence
quadruple zêta plus double polarization). Contrairement aux orbitales de
polarisation, les orbitales diffuses sont
caractérisées par un coefficient de gaussienne á plus
petit, permettant ainsi une bonne description des anions et des états
excités.
Les bases contractées les plus utilisées sont
celles de pople, de DunningHuzinaga, ....
Comment ces bases se présentent-elles ?
1.2.2.3.1. Bases de Pople.
Se sont des bases de type STO-nG et
k-nlmG développées par Pople et
al[15]. Bases de type STO-nG
Se sont des bases d'orbitales de Slater construites à
l'aide de n fonctions gaussiennes primitives. Les
inconvénients de ce type de base est qu'elle détermine les
coefficients de ces PGTO par un fitting sur les STO au lieu de les optimiser
via une procédure variationnelle et considère les mêmes
exposants de PGTO pour les orbitales s que pour les orbitales p. Ce qui
réduit la flexibilité de la base bien que le temps de calcul se
voit réduit. La base minimale la plus utilisée ici est la base
STO-3G et la plus étendue est la base STO-6G.
Pour montrer comment les fonctions sont réparties dans
ce type de base, prenons l'exemple d'un atome de la deuxième ligne du
tableau périodique décrit dans la base STO-6G et consignons ceci
dans le tableau 1.1.
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
Orbitale
|
Contractions
|
Primitives
|
1s
|
1
|
1 x 6 = 6
|
2s
|
1
|
1 x 6 = 6
|
2p
|
1
|
3 x 6 = 18
|
Total
|
3
|
30
|
|
Tableau 1.1 : Présentation de la base
STO-6G pour un atome de la deuxième ligne du tableau
périodique.
Un atome de la deuxième ligne du tableau
périodique dans cette base est donc représenté par 30 PGTO
contractées en 3 CGTO. Ainsi, cette base pour l'atome
considéré est équivalente à la base
(12s6p)/[2s1p].
Base de type k-nlmG
Se sont des bases de démultiplication des couches de
valence notées :
· k-nlG pour les bases VDZ.
· k-nlmG pour les bases VTZ.
Où k est le nombre de primitives utilisées pour
représenter les orbitales de coeur. Les indices n, l, m indiquent
respectivement le nombre de primitives entrant dans chaque contraction pour les
orbitales de valence.
Ces bases ont l'avantage de lever le problème
d'optimisation posé par leurs prédécesseurs en
déterminant les coefficients des PGTO par des procédures
variationnelles. Mais, ne résolvent pas le problème d'exposants
identiques pour les orbitales s et p. Comme exemple, disséquons la base
6-311G pour un atome de la deuxième ligne du tableau périodique.
On a alors le tableau 1.2 suivant :
Orbitale
|
Contractions
|
Primitives
|
|
1s
|
1
|
1 x 6 = 6
|
|
2s
|
3
|
1 x (3+1+1)
|
=5
|
2p
|
3
|
3 x (3+1+1)
|
= 15
|
Total
|
7
|
26
|
|
|
Tableau 1.2 : Présentation de la base
6-311G pour un atome de la deuxième ligne du tableau
périodique.
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
Un atome de la deuxième ligne du tableau
périodique dans cette base est donc représenté par 26 PGTO
contractées en 7 CGTO. Ainsi, cette base pour l'atome
considéré est équivalente à la base
(11s5p)/[4s3p].
Dans chacune de ces bases, on peut ajouter des fonctions
diffuses et/ou de polarisation. Les fonctions diffuses sont
généralement des fonctions s et p. Elles sont marquées par
un plus (+) ou deux plus (++) avant le symbole G. Lorsqu'elles sont
marquées par +, les fonctions diffuses sont ajoutées sur les
atomes lourds. Lorsqu'elles sont marquées par ++, la fonction diffuse s
est aussi ajoutée. Quant aux fonctions de polarisation, elles sont
marquées après le symbole G, par les fonctions concernées
ou par une ou deux étoiles suivant qu'on ait respectivement un ou deux
ensembles de polarisation. La base standard de Pople la plus large est la base
6-311++G (3df, 3pd). C'est une base triple zêta
enrichies des fonctions diffuses sp, de trois ensembles de fonctions d et d'un
ensemble de fonctions f toutes sur les atomes lourds et d'un ensemble de
fonctions diffuses s, de trois ensembles de fonctions p et d'un ensemble de
fonctions d toutes sur les hydrogènes.
Comme exemple, présentons la base 6-311+G* pour un atome
de la deuxième
ligne du tableau périodique. On a alors le tableau 1.3
suivant :
|
|
Orbitale
|
Contractions
|
Primitives
|
|
1s
|
1
|
1 x 6 = 6
|
|
2s
|
3
|
1 x (3+1+1)
|
=5
|
2p
|
3
|
3 x (3+1+1)
|
= 15
|
s diffuse
|
1
|
1 x 1 = 1
|
|
pdiffuse
|
1
|
3 x 1 = 3
|
|
d polarisante
|
1
|
5 x 1 = 5
|
|
Total
|
10
|
35
|
|
|
Tableau 1.3 : Présentation de la base
6-311+G* pour un atome de la deuxième ligne du tableau
périodique.
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
1.2.2.3.2. les bases de Dunning-Huzinaga.
Les bases de Dunning sont affranchies des restrictions
imposées par les bases de Pople. Elles sont par la suite très
flexibles, mais très coûteuses en temps de calcul. Les plus
utilisées sont les bases « correlation consistent
» en abrégé cc. Ces bases ont
l'avantage de réduire le nombre de fonctions de base utilisées
par les bases d'orbitales atomiques naturelles en produisant
des résultats très comparables. Elles sont
dénommées par cc-pVDZ, cc-pVTZ, cc-pVQZ, cc-pV5Z et cc-pV6Z
(correlation consistent polarized Valence
Double/Triple/Quadruple/Quintuple/Sextuple Zeta). Leurs structures sont
présentées dans le tableau 1.4a[16]. Pour obtenir des
énergies optimales, on ajoute à ces bases des fonctions diffuses.
Ceci se fait en ajoutant, à chaque fonction de moment angulaire
l une fonction de même moment angulaire, mais d'exposant
plus petit. Pour dénommer de telles bases, on ajoute simplement le
préfixe aug- (pour Augmented) devant la
dénomination de leurs bases parentes. Leurs structures sont
présentées dans le tableau 1.4b.
Bases Fonctions primitives Fonctions
contractées
cc-pVDZ 9s4p1d 3s2p1d
cc-pVTZ 10s5p2d1f 4s3p2d1f
cc-pVQZ 12s6p3d2f1g 5s4p3d2f1g
cc-pV5Z 14s9p4d3f2g1h 6s5p4d3f2g1h
cc-pV6Z 16s10p5d4f3g2h1i 7s6p5d4f3g2h1i
Tableau 1.4a : Les bases correlation
consistent.
Bases Fonctions primitives Fonctions
contractées
aug-cc-pVDZ 10s5p2d 4s3p2d
aug-cc-pVTZ 11s6p3d2f 5s4p3d2f
aug-cc-pVQZ 13s7p4d3f2g 6s5p4d3f2g
aug-cc-pV5Z 15s10p5d4f3g2h 7s6p5d4f3g2h
aug-cc-pV6Z 17s11p6d5f4g3h2i 8s7p6d5f4g3h2i
Tableau 1.4b : Les bases augmented correlation
consistent.
La plus grande base de Dunning est la base aug-cc-pV7Z.
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
1.2.3 Limites de la méthode
LCAO-SCF.
De ce qui précède, une base idéale
devrait avoir une dimension infinie. Les capacités des ordinateurs
imposent une réduction de l'espace vectoriel où on se place. De
ce fait, la limite Hartree-Fock (EHF) n'est jamais atteinte. La
taille de la base et la qualité des fonctions la constituant en
constitue une limite.
Par ailleurs, la méthode LCAO-SCF donne une fonction
d'onde décrite par un seul déterminant de Slater ; ce qui revient
à obliger chaque électron à rester dans une spin-orbitale
Ö á , et à négliger ainsi « une
partie >> de la corrélation entre électrons. De
plus, de part son caractère variationnel, cette
méthode ne peut que permettre d'atteindre l'état le plus bas
(fondamental) d'un système. Elle est donc inadaptée pour
l'étude des états excités. Ceci bien entendu, n'est pas
sans conséquence négative sur l'évaluation des
différentes grandeurs physiques déduites de la fonction d'onde de
Hartree-Fock telles que les énergies de dissociation, d'excitation, les
sections efficaces, les moments dipolaires, la polarisabilité, etc.
C'est ainsi par exemple que les longueurs de liaison ont tendance à
être plus courtes dans un calcul SCF. Il est donc nécessaire
d'aller au-delà de ce modèle à particules
indépendantes, et d'évaluer l'énergie de
corrélation non prise en compte.
Parlant de corrélation, deux électrons sont
dits corrélés lorsque la probabilité de trouver l'un
à une position quelconque dépend de la position de l'autre. En
général, la corrélation électronique est à
double titre :
- Les électrons se repoussent d'abord comme fermions de
même spin,
- Les électrons se repoussent ensuite comme particules de
même charge.
Cette corrélation à double titre est souvent
interprétée par une représentation imagée où
l'électron est entouré d'un « trou de Coulomb >> et
d'un « trou de Fermi >> qui annihilent plus ou moins, respectivement
l'apparition dans son voisinage d'une particule négative et d'une
particule de même spin.
La corrélation électronique peut être
classée en deux groupes : La corrélation
dynamique et la corrélation statique.
La corrélation dynamique est due à la
répulsion de courte portée, de deux électrons, qui
entraîne leur éloignement l'un de l'autre (i.e. Diminution de
l'énergie).
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
Quant à la corrélation statique, elle est
dûe aux effets de longues portées (états excités,
rupture de liaison,...).
La méthode de Hartree traitait déjà une
partie de l'énergie de corrélation de part sa description de
l'Hamiltonien du système où les électrons se repoussent
entre eux en tant que particules de même charge. Quant à la
méthode de Hartree-Fock, non seulement elle récupère
l'énergie de corrélation de Hartree, mais aussi, de part sa
fonction d'onde qui interdit la cohabitation de deux électrons de
même spin, elle récupère une autre partie de
l'énergie de corrélation. Malgré l'énergie de
corrélation récupérée par la méthode de
Hartree-Fock, l'énergie électronique totale donnée par
cette méthode reste inférieure à la valeur
expérimentale et vaut 99 % de celle-ci. Il reste donc 1% de
l'énergie expérimentale à récupérer. Cette
énergie s'appelle énergie de corrélation ;
bien entendu en prenant le niveau d'énergie HF comme
référence. Ainsi, l'énergie de corrélation peut
s'exprimer comme la différence entre l'énergie
expérimentale et l'énergie de Hartree-Fock :
E corr = E éxacte - EHF (1.64)
Dans les paragraphes suivants, nous exposerons les
méthodes (méthodes PostHartree-Fock) qui permettent de lever les
difficultés posées par la méthode LCAO qui jusqu' à
lors, est la mieux adaptée. Ces méthodes auront donc pour
objectifs de récupérer l'énergie de corrélation et
de traiter les états excités.
1.2.4. Méthodes d'approche de
l'énergie de corrélation ou méthodes
Post-Hartree-Fock
1.2.4.1. Introduction.
Les méthodes de corrélation électronique
peuvent être classées en deux grands groupes : Les
méthodes variationnelles et les méthodes
de perturbation.
Parlant des méthodes variationnelles, on peut
citer :
· L'Interaction de configuration,
(CI pour configuration interaction).
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
· La Méthode du Champ autocohérent
multiconfigurationnelle, (MCSCF pour
Multi-Configuration Self-Consistent Field ).
· L'Interaction de Configuration
Multi-Référence (MRCI pour
Multi-Reference Configuration Interaction ).
· La Théorie de la Fonctionnelle de la
Densité (DFT pour Density Functional
theory).
· Les méthodes Monte Carlo.
Les deux dernières ne sont pas des méthodes
post-HF et ne seront pas exposées explicitement dans ce travail.
Parlant des méthodes de perturbation, on peut
citer :
· La méthode des perturbations multi
corps (MBPT pour Many Body Perturbation Theory) ou
plus précisément MPn (Moller Plesset d'ordre
n).
· La méthode des clusters
couplés (CC pour Couplet Clusters).
Rappelons que le point de départ de toutes ces
méthodes de corrélation est la fonction d'onde de HF. Par
conséquent, pour tout traitement de la corrélation, la fonction
d'onde s'écrira :
8

Ö = ø + ? ø , (1.65)
a a
0 HF i i
i 1
=
avec a 0 1 , et déterminé par la
condition de normation de la fonction d'onde Ö . Les
méthodes de corrélation diffèrent dans la
manière de calculer les coefficients ai. Les øi sont
les déterminants additionnels et s'appellent encore
déterminants de Slater
excités.
Comment les déterminants de Slater
excités sont-ils construits ?
Les øi sont construits par excitation des
électrons des orbitales occupées de la
fonction d'onde HF (déterminant de
référence) vers les orbitales virtuelles
(orbitales
inoccupées). En effet, avec un système à n
électrons construit à l'aide de M fonctions
de base, on a n 2
( resp. (n + 1) 2) occupées dans le cas RHF (resp. ROHF) et
M - n 2 ( resp. M - (n + 1) 2) orbitales virtuelles, qui vont
recevoir les électrons issus
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
des orbitales occupées après être
excités. On pourra donc exciter 1,2,3,... électrons
des
orbitales occupées vers les orbitales virtuelles. Ce qui conduira
aux déterminants de
Slater simplement, bi-, tri-,... excités
respectivement. L'équation (1.65) pourra donc
8 8 8

+...
encore s'écrire : 0 HF
Ö = ø + ? ø + ? ø + ? ø
a a a a
s s D D T T
s D T
Les indices S, D,T,... sont respectivement liés aux
déterminants de Slater simplement, bi-, tri-,... excités.
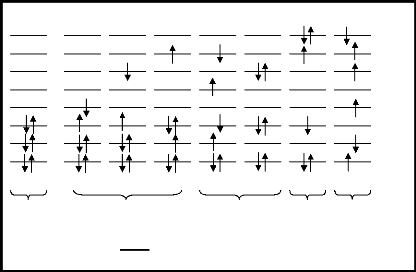
Illustrons ceci par le diagramme de la figure 1.3.
En considérant le cas où n = 6 et M = 8
HF Simples excitations(S) Doubles excitations (D) (T)
(Q)
Fig 1.3 Déterminants de Slater
excités.
On comprend ainsi que le nombre de déterminants
excités générables dépend de la dimension de la
base de fonctions décrivant le système considéré.
Il faut donc prendre en compte dans une base donnée, tous ces
déterminants de Slater excités, afin d'espérer
évaluer complètement l'énergie de corrélation. Par
ailleurs, à l'aide d'une base infinie, l'équation de
Schrödinger est résolue de façon exacte dans l'approximation
de Born Oppenheimer et non relativiste. De ceci, il découle que les
méthodes de corrélation électronique ont deux
degrés de liberté : La dimension de la base utilisée et le
nombre de déterminants de Slater excités. En effet, plus la
dimension de la base utilisée et le nombre de déterminants sont
élevés, meilleurs sont les résultats.
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
Pratiquement, les changements chimiques importants prennent
naissance seulement dans les orbitales de valence. Les orbitales de coeur sont
presque constantes. Ainsi, dans plusieurs situations, on s'intéresse
seulement au calcul de l'énergie de corrélation associée
aux électrons de valence : C'est l'approximation du coeur
gelé.
1.2.4.2. Méthode d'Interaction de Configuration
(CI).
Dans la méthode CI, les ai sont calculés de
manière variationnelle [17]. En effet, on définit
comme pour la méthode SCF, une fonctionnelle
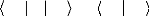
L = Ö Ç Ö - ë ? Ö Ö - 1 ? ? ,
CI e CI ? CI CI
8
où CI
Ö = ? ai ø . (1.66) i
i =0
La condition de minimisation de l'énergie impose :

?
L =0
, (1.67)
? ai
soit :
a i( E i -ë) + ? a j
ø Ç e ø j = 0 . (1.68)
j ?i
Le problème variationnel posé conduit donc
à résoudre le système d'équations séculaires
suivant :
?-
H E H ... H ... a
? ? ? ? ?
0
00 01 0j 0
? ... a
? ? ? ?
H E ... H ?
H -
10 11 1j ? ? ? ? ?
0
? 1
(1.69)
? ... ... ... ... ......
? =
? ? ? ?
...
? ? ? ? ? ?
H ... ... H E ... a
- 0
? j0 jj ? ? ? ? ?
j
?... ... ... ... ......
? ? ? ? ?
? ? ? ? ? ?
...

Où H ij = ø i Ç
e ø j. Ce qui est équivalent
à l'équation matricielle :
Ç a = Ea
Ç = ( ij ) i,j ( i ) i
H a a
=
???
??
(1.70)
Il est donc clair que (de part 1.66), pour déterminer les
coefficients , il suffit juste
( i ) i
a
de diagonaliser la matrice CI, Ç = H .
L'énergie donnée par la méthode CI est la
( ij ) i,j
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
plus petite valeur propre pour le fondamental ; les autres
valeurs propres sont les énergies des états excités.
Remarquons que la matrice CI a beaucoup d'éléments nuls :
· Les éléments matriciels ( ij ) i,j
H issus de deux déterminants de spins total
différents sont nuls. Ceci se justifie par le simple fait
que l'Hamiltonien du système ne contient pas de spin.
· Si de plus, le système étudié
possède une symétrie donnée, on aura encore sans doute
d'autres éléments nuls dans ladite matrice. En effet, les
éléments de H issus des déterminants
n'admettant pas des projections nulles suivant les représentations
irréductibles du système sont tout aussi nuls.
· Les éléments issus des déterminants
de symétries différentes sont
( Hij )
également nuls. En effet, l'Hamiltonien du
système considéré appartient
toujours à la
représentation totalement symétrique. Par suite,
l'intégrale


ø i Ç e
ø j serait non nulle si et seulement si, øi
et ø j appartiennent à la
même représentation
irréductible[18] : C'est la règle
générale de sélection.
· Les éléments ( issus des
déterminants qui diffèrent de plus de deux orbitales
Hij )
=
0
moléculaires (spatiales) sont aussi nuls. En effet,
l'Hamiltonien du système est constitué seulement
d'éléments à un et deux corps. Ainsi, on aura :

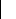
° 1 2
Ö Ö Ö Ö Ö
... ... ... ... h Ö Ö Ö Ö Ö = ?
ä
... ... ... .. h
i j k i 1 2 i ' j' k ' i áá '
á? I
car cardI = 1 . Où I est l'ensemble des indices des
orbitales à gauches de h i qui diffèrent de leurs homologues
à droite.

° 1 2
Ö Ö Ö Ö Ö
... ... ... ... g Ö Ö Ö Ö Ö = Ö
Ö
... ... ... .. g
i j k ij 1 2 i' j' k ' i j ij i' j'
Ö Ö ? ä =
áá 0
'
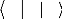
á?I'
avec I ? I ' tel quecardI = cardI'+ 2 = 3. En conclusion,
ø ì Ç e ø
í = 0 lorsque card I = 3 . Ce résultat est d'ailleurs la
règle de Slater-Condon.
· Les éléments de matrice ( Hij )
issus de l'état de référence HF et d'un
déterminant mono excité sont nuls : C'est le
théorème de Brillouin. En effet,
pour un déterminant mono-excité, on excite un électron de
l'orbitale i de la configuration de référence ( ø
0 ) vers une orbitale a. On alors :
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
a
ø H ø = Ö Ö +
h
0 e i i a i j a j i j j a
? ? ? Ö Ö Ö Ö - Ö Ö Ö Ö
? ?
j

(1.71)
= F
Ö Ö
i a
= puisque les
å ä Ö sont fonctions propres de F.
i ia i
= 0 car i a.
?
Remarquons de plus que d'après le résultat de
Slater-Condon, et du résultat précédent, l'état de
référence ne produira des éléments de matrice non
nuls qu'avec des déterminants bi-excités. Et on aura :
ø 0 H e ø ij = Ö
i Ö j Ö a Ö b - Ö
i Ö j Ö b Ö a (1.72)
ab
De part cette multitude d'éléments nuls dans la
matrice CI, elle acquière une structure diagonale par blocs. Cette
matrice est par ailleurs symétrique et définie positive. Ce qui
simplifiera davantage les calculs ! La matrice CI a donc la structure finale
suivante :
|
ø HF
|
ø S
|
ø D
|
ø T
|
ø Q
|
ø Q5
|
...
|
...
|
...
|
ø HF
|
EHF
|
Ï
|
|
Ï
|
Ï
|
Ï
|
LÏ
|
|
Ï
|
ø S
ø D
ø T
ø Q
ø Q5
|
Ï
Ï
Ï
Ï
|
Ï
Ï
|
Ï
|
|
Ï
|
Ï
Ï
|
LÏ
L
Ï
|
Ï
L
Ï
|
Ï Ï Ï Ï Ï
|
M
|
M
|
M
|
M
|
O
|
|
|
|
|
|
M
|
Ï
|
Ï
|
Ï
|
Ï
|
Ï
|
|
|
|
|
M
|
Ï
|
Ï
|
Ï
|
Ï
|
Ï
|
Ï
|
|
|
|
|
Dans cette matrice, les représentent des matrices nulles
de dimension p.q où p et q
Ï
représentent respectivement les nombres de fonctions
de base du sous-espace vectoriel engendré par les excitations
électroniques d'un type donné (S, D, T, Q,...), respectivement
d'un autre type donné (S, D, T, Q,...) afin de former la matrice Hpq.
Par ailleurs, de part la limite des supercalculateurs, aucun
calcul ne peut être effectué dans une base infinie ; et le full CI
n'est possible que sur des systèmes de très petites tailles. On
comprend donc la nécessité de tronquer la méthode CI. Ceci
se fait en se limitant aux excitations doubles, triples, quadruples ou plus. Ce
qui conduira respectivement aux méthodes CIS, CISD, CISDT, CISDTQ,...
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
De part les théorèmes de Slater-Condon et
Brillouin, on comprend que plus on prendra en compte de type d'excitations,
mieux on traitera la corrélation et les états excités.
Cependant, la méthode CI généralement applicable à
une très grande variété des systèmes est la
méthode CISD ; bien que la méthode CISDTQ donne des
résultats généralement très proches du full CI.
Les méthodes CI ne connaissent pas de succès
sans échecs. En plus de leur temps de calcul relativement long, elles
souffrent du problème de contamination de
spin.
1.2.4.3. Méthode du champ autocohérent
multiconfigurationnelle (MCSCF).
La méthode MCSCF peut être
considérée comme une CI où les coefficients ai ne sont pas
les seuls à être optimisés par le principe variationnel,
mais aussi les orbitales moléculaires entrant dans la construction des
déterminants excités[19]. Ces méthodes plus
rapides que les précédentes, ne soufrent pas de la contamination
de spin. Elles sont généralement utilisées pour
générer des fonctions d'ondes assez flexibles et permettant ainsi
de récupérer l'énergie de corrélation statique.
Elles ont l'inconvénient de ne pouvoir pas traiter la corrélation
dynamique d'une part, et de ne pas converger d'autre part. On utilise la
méthode de Newton-Raphson pour forcer sa convergence.
Le problème majeur avec la méthode MCSCF est la
sélection manuelle des configurations nécessaires à
introduire lorsqu'on s'intéresse à des propriétés
bien précises du système à étudier. L'approche la
plus populaire pour résoudre ce problème est la méthode
CASSCF (Complete Active Space Self-Consistent Field) encore
appelée FORS (Full Optimised Reaction Space). Dans
cette méthode, la sélection des configurations se fait en
partitionnant l'espace des orbitales moléculaires en trois sous espaces
:
· L'espace interne ou
espace de coeur, où les OM restent
doublement occupées. Généralement, les électrons de
ces OM sont gelés. On n'y effectue donc aucune excitation. C'est donc un
espace inactif.
· L'espace actif,
où les OM peuvent être occupées ou inoccupées. Cet
espace est constitué de quelques HOMO (Highest occupied Molecular
orbitals) et de quelques LUMO (Lowest unoccupied Molecular orbitals). C'est
dans cet espace qu'ont lieu toutes les excitations possibles.

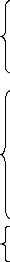
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
· L'espace externe situé
au-dessus de l'espace actif. Cet espace est inactif. Donc l'espace externe et
l'espace de coeur constituent l'espace inactif.
Dans la méthode CASSCF, l'espace actif coïncide avec
l'espace de valence formé à partir des OA de valence des atomes
qui forment la molécule.
Une fois le partitionnement effectué, les
configurations utilisées sont construites en considérant les
différentes possibilités de répartir les électrons
peuplant les orbitales actives dans leur propre sous espace. Ainsi, dans le
sous espace des orbitales actives, la méthode CI est complète.
D'où l'appellation « Complete active Space ».
La figure 1.4 montre le partitionnement de l'espace des OM dans
le cas de la molécule de NO dans une base de dimension 15.
N : 1s2 2s2 2p3
O : 1s2 2s2 2p4
Core
Valence
Espace externe.

Orbitales virtuelles
Espace de valence = Espace actif.
2s2(O) + 2p4(O)
+ 2s2(N) + 2p3(N)
Orbitales occupées.
Espace interne = Espace de coeur 1s2(N) +
1s2 (O)
Fig 1.4 Partitionnement de l'espace des
orbitales moléculaires du système NO.
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
1.2.4.4. Méthode d'interaction de configuration
multiréférence
La méthode d'interaction de configuration
multiréférence appelée par les anglosaxons multireference
configuration Interaction (MRCI) est une approximation dans laquelle la
fonction d'onde est encore une combinaison linéaire de
déterminants de Slater. Elle utilise comme référence la
fonction d'onde MCSCF et n'autorise que les simples et doubles excitations
à partir de cette dernière. On a ainsi :
+ ?? c Ö + ?? c Ö . (1.73)
a a ab ab
ø = ø
MRCI MCSCF s s D D
s a D ab
Les et sont des fonctions de configurations
générées à partir de la fonction
a Ö D ab
Ö S
multiconfigurationnelle MCSCF.
L'un des avantages majeur de la méthode MRCI est que
la fonction d'onde correspondante permet une meilleure prise en compte de la
corrélation. Cependant, le nombre de configurations
généré est souvent trop élevé. Ce qui a pour
effet d'alourdir les calculs, notamment en termes de temps machine. Pour rendre
les calculs faisables, on a souvent recours à de nouvelles
approximations. En général, on ne choisit que les configurations
dont le poids statistique dans la fonction d'onde est important. On peut aussi
associer à cela la contraction des configurations dans le but d'en
diminuer le nombre .
Les différentes approximations effectuées dans
la méthode MRCI diminuent la quantité d'énergie que l'on
peut récupérer par corrélation. Par ailleurs, le fait de
ne pas inclure les excitations quadruples diminue également la
flexibilité de la fonction d'onde. Pour remédier à ces
inconvénients, Davidson propose la correction qui porte son nom et qui
consiste à prendre en compte les excitations quadripolaires à
l'aide de l'approximation
Ä E Q = 1 - a 0 Ä E CISD .
(1.74)
( 2 )
ÄECISD est la correction en énergie due aux simples
et doubles excitations.
1.2.4.5. La méthode des clusters
couplés.
Dans cette méthode, la fonction d'onde
électronique décrivant un système de N électrons
est écrite sous la forme suivante[20] :
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.

Ø cc = e Ø 0 (1.75)
T
Où Ø 0 est la solution de Hartree-Fock
et est un opérateur défini par son
e T
développement de Taylor :
e 1 T T ...
T 1 2
= + + +
2!
, (1.76)
k
8
T
=?
k!
k 0
=
avec T un opérateur cluster (ou d'excitation) qui peut
s'écrire :
N
T T T
= + + L + = ? i , (1.77)
T T
1 2 N
i 1
=
Où N est le nombre d'électrons du
système.
L'opérateur Ti agît sur la fonction d'onde de
référence de Hartree-Fock et génère tous les
déterminants de Slater excités i fois. Ainsi,
occ vir
a a
T Ö
Ö =
1 0 ?? t i i
ab ab
T Ö =
2 0 ?? t ij ij
Ö


i j a b
p p
T1 et T2 donnent respectivement toutes les excitations
simples et doubles. De la même manière, on peut construire des
opérateurs pour les excitations triples, quadruples, etc...
On peut remarquer que :
e = 1 + T + T + T + T + T T + T + T + T T + 2 T +
2 T T + 24 T +L T 1

( ) ( ) (
1 2 4
1
3 2 1 1
2
) ( ) (1.79)
1 2 2 1 3 2 1 6 1 4 3 1 1 2 1 1
Les couples de parenthèses 1, 2, 3, 4,... donnent
respectivement tous les états simplement, doublement, triplement,
quadruplement,... excités.
Avec la fonction d'onde « clusters » couplés,
l'équation de Schrödinger devient :

He Ø 0 = E cc e Ø 0 .
(1.80)
T T
Ce qui conduit à :
Ø 0 He Ø 0 = E cc Ø
0 e Ø 0 = E cc . (1.81)
T T
Par la suite, on a :
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
E = Ø H 1 T T T
1 2
( + + + ) Ø
cc 0 1 2 2 1 0
occ vir occ vir
b a
=E t a a ab a b
H ( t t t t t ) Ø
0 + ?? Ø Ø + ?? + -
i 0 i ij i j i j 0
(1.82)
H
Ø
a i

i a i j a b
-< -<
D'après le théorème de Brillouin, on a
finalement :
occ vir
. (1.83)
ab a b b a
E E
= + ( )
cc 0 ij i j i j i j a b
?? ?
t t t t t ?
+ - Ö Ö Ö Ö - Ö Ö Ö Ö
?
i j b a ?
i j a b
-< -<
Les équations des clusters couplés sont
résolues de façon itérative en utilisant E cc = E
0 comme point de départ.
Si tous les opérateurs Ti sont introduits dans
l'équation de cluster T, tous les déterminants possibles seront
générés et la fonction d'onde Ø cc est
équivalente à une
fonction d'IC complète. Pour limiter le
développement (1.77), on utilise dans la
méthode des clusters
couplés, comme dans les méthodes d'IC, une base des
OM
tronquée. Si l'on fait les restrictions T = T1 et T =
T1 + T2,... on, obtient respectivement
les méthodes CCS, CCSD
et ainsi de suite. L'aspect important dans ces méthodes
CC
est que les excitations d'ordres supérieurs
à ceux correspondant à la coupure de T
entrent dans les
équations des amplitudes. Ce qui rend la théorie CC
extensive en taille.
1.3. RESUME DES METHODES DE CORRELATION
ELECTRONIQUES
Les méthodes de corrélation
généralement utilisées sont : CISD, CCSD, CCSD
(T), MPn, MCSCF et MRCI.
En termes de précision, avec des bases de dimensions
moyennes, on a l'ordre suivant :
HF CISD < MCSCF < MP4(SDQ) CCSD < CCSD(T) < MRCI
En termes de temps de calculs, le tableau 1.5 compare les
méthodes CI, CC et MP. Le temps de calcul avec les méthodes HF
est de l'ordre de M4. M étant la taille de la base.
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
Temps proportionnel à
|
Méthodes CI
|
Méthodes MP
|
Méthodes CC
|
M5
|
|
MP2
|
C
|
M6
|
CISD
|
MP3, MP4 (SDQ)
|
CCSD
|
M7
|
|
MP4
|
CCSD(T),CC3
|
M8
|
CISDT
|
MP5
|
CCSDT
|
M9
|
|
Mp6
|
|
M10
|
CISDTQ
|
MP7
|
CCSDTQ
|
|
Tableau 1.5: Ordre de grandeur des
coûts informatiques des méthodes CI, MP et CC.
On peut comparer ces différentes méthodes de part
leurs avantages et leurs inconvénients par le tableau 1.6.
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
Méthodes Avantages
Inconvénients
HF
· Temps de calcul apaisé
· Ne prend pas en compte la
corrélation statique.
· États excités non décrits.
· Size extensivity*
· Fonctions d'onde peu
·
flexibles.
Non size consistency*. CI
·
Bonne précision
· Temps de calcul élevé.
· polyconfigurationnelle
· Non size
consistency.
· Non size extensitivity.
· Contamination de Spins.
MCSCF
MRCI
CC MP
|
·
·
·
·
·
·
·
·
·
·
|
Pas de contamination de
Spins
Fonctions d'onde flexibles Récupère
l'énergie de
corrélation statique.
Bonne précision.
Très grande précision
Très précise (CCSDTQ).
«Size extensitivity et size
consistency»
Très précise (MP6).
«Size extensitivity».
|
·
·
·
·
·
·
·
·
·
·
|
Convergence difficile
Temps de calcul élevé. Sélection des
configurations difficile.
Fonctions d'onde moins
flexibles.
Nombre de configuration
très élevé.
Temps de calcul très élevé.
Pas variationnelle. Monoréférentielle. Temps de
calcul prohibitif.
Pas variationnelle.
|
|
Tableau 1.6: Avantages et inconvénients
des méthodes HF et post-HF.
* Une méthode est dite << size extensive
>> lorsque l'énergie qu'elle fournie est proportionnelle
au nombre d'atomes du système (idem qu'en thermodynamique) à
toutes les géométries du système étudié.
Une méthode est dite << size consistency
>> lorsqu'il donne l'énergie EA+E B pour deux
sous systèmes A et B bien séparés.
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
La différence entre ces deux qualités de
méthode est donc que la size extensitivity se vérifie à
toutes les géométries alors que la size consistency n'est valable
qu'à la limite de dissociation du système moléculaire.
UNIVERSITE DE DOUALA /ECOLE
DOCTORALE DES SCIENCES FONDAMENTALES ET APPLIQUEES/ UFD PHYSIQUE ET SCIENCES DE
L'INGENIEUR / LABORATOIRE DE PHYSIQUE FONDAMENTALE.
| 

