CHAPITRE IV
DISCUSSION GENERALE
![]()
La résistance des bactéries aux antibiotiques, a
imposée beaucoup de chercheurs dans le monde entier d'utiliser toutes
les méthodes dans l'espoir de minimiser le danger de ces
bactéries, dont l'une de ces méthodes était l'isolement de
nouvelles souches fongiques productrices d'antibiotiques à partir des
milieux naturels.
Notre travail, basé sur la recherche de ce type de souche
fongique à partir du sol et des concrétions sédimentaires
des grottes de Ain Fezza a pu rattacher les isolats ont deux groupes. Le
premier était la cible de notre recherche, dès le début,
représenté alors par les souches du genre
Penicillium. Tandis que le deuxième, sa
présence dans notre étude était liée beaucoup plus
au hasard que d'autre chose, représentée alors par les souches de
l'espèce Beauveria felina.
A partir des résultats d'isolement et d'identification des
souches de Penicillium, on a constaté que la
plupart des 152 isolats proviennent des échantillons du sol de la
station 1 et les échantillons du sol et des concrétions
sédimentaires du point de prélèvement P2
situé à 185 m de l'entrée de la station 3.
D'un autre côté, la station 2 et les points de
prélèvements P1, P3 et
P4 situés respectivement à 60 m, 280 m et 76 m de
l'entrée de la station 3, ont donné une fraction infime d'isolats
de Penicillium.
Par ailleurs, tout être vivant a besoin de se nourrir, de
boire et de respirer. Ces trois exigences ont contribué à la
distribution des êtres vivants dans notre planète, y compris les
champignons.
La matière nutritive, l'eau et l'air sont aussi sous la
dépendance d'autres facteurs qui peuvent agir directement ou
indirectement sur la répartition des champignons souterrains. Prenons la
matière nutritive.
Dans notre travail, la richesse de certaines stations et points
de prélèvement en matière nutritive est peut être
attribué à plusieurs facteurs, telle que la lumière.
Selon Jeannel (1937) :« Aux
entrées des grottes, la lumière du jour pénètre
plus ou moins loin ; dans les parties profondes du domaine souterrain
l'obscurité est totale, éliminant toute possibilité, pour
les plantes à chlorophylles, de croître. ». L'absence de
ces plantes, ou généralement les organismes
photosynthétiques, dans ce domaine surtout dans les endroits plus
profonds influence sur sa richesse en matière organique
végétale et animale ; or on sait, que ces organismes sont
les principaux producteurs de la matière dans la chaîne
alimentaire.
Revenons à nos stations de prélèvement, si
on prend la station 1, on trouve que les algues vertes gagnent une surface
importante de l'entrée (Fig. 4.B). Ces algues sont une bonne source
alimentaire pour l'abondance des champignons du genre
« Penicillium » dans les échantillons des
dix mètres premiers du sol de cette station. Mais on peut pas attribuer
cette abondance seulement à la présence des organismes
photosynthétiques. Pourquoi ?
La station 2, est aussi caractérisée par une
végétation plus importante à l'entrée (les arbres
fruitiers), or la fraction infime de nos isolats de
Penicillium provient des échantillons du sol
de cette station. La question qui peut se poser, est ce que le type de
végétation a une influence sur ces résultats (arbres
fruitiers ou algues vertes) ?
Cependant, le point de prélèvement
« P2 » a donné une fraction importante d'
isolats de « Penicillium », bien qu'il soit
situé à 185 m de l'entrée de la station 3
(obscurité total) où on a presque aucune chance d'existence
d'organismes photosynthétiques.
De ce fait, la présence de la matière organique
végétale sous l'influence de la lumière solaire peut jouer
un rôle dans l'abondance des champignons du genre
« Penicillium » dans ces stations, mais peut
être ce n'est pas le plus important.
Outre, cette source de matière nutritive, d'autres peuvent
intervenir de façon plus importante dans l'abondance du
« Penicillium ». Prenons les animaux, ils
constituent par leurs cadavres et leurs excréments une bonne source de
la matière organique. L'eau joue un rôle aussi important qu'on
peut l'imaginer ; par ses mouvements superficiels et souterrains, elle
entraîne des détritus végétaux et des organismes en
petite taille.
Selon Tercafs (1997) : « La biomasse totale
existant dans les milieux souterrains est généralement faible.
Presque toute l'énergie disponible provient de deux sources
extérieures. Un premier apport, très important, est
constitué de détritus végétaux et d'organismes de
petite taille entraînés par les eaux souterraines (eaux de
percolation et eaux libres). Le second apport provient de l'entrée
régulière d'organismes actifs (trogloxènes) " non
consommateurs " qui viennent peupler l'écosystème. L'exemple le
plus frappant est celui des chauves-souris qui vont se nourrir au-dehors, mais
dont le guano libéré dans les grottes est le point de
départ d'une faune inféodée considérable».
En ce qui concerne nos stations de prélèvement, on
a remarqué d'après le tableau 1 qu'il y avait une
différence entre les sources d'énergie des stations de
prélèvement et même entre ceux des points de
prélèvement de la même station.
Si on prend la station 1, on remarque que les sources
d'énergies sont peut être assurées en grande partie par les
animaux observés aux cours de nos prélèvement
(chauve-souris et insectes) plus les eaux pluviales
pénétrées à travers l'entrée de cette
station.
En rapportant ces observations aux résultats d'isolement
des souches de « Penicillium », on peut dire que
la présence de la matière nutritive représentée par
ces deux types d'apports ont une grande responsabilité sur l'abondance
des isolats de« Penicillium » dans les
échantillons de sol de cette grotte. Mais ils ont pas peut être la
grande responsabilité.
Prenons la station 2, cette station caractérisée
par la présence d'une source de matière organique
végétale importante, elle a aussi révélé la
présence d'autres sources d'énergies considérable du point
de vue quantitatif. En citant le porc-épic, détritus
végétal, fourrages, activité humaine et les bestiaux, on
dit que cette station a un apport énorme en matière organique et
à partir de son sol on peut isoler une fraction importante de souche de
« Penicillium », or c'est le contraire. Pourquoi,
alors ?
Au niveau de cette station, on a remarqué que la surface
mouillée par l'eau était limitée seulement à
proximité de son entrée, alors que l'eau était un apport
d'énergie important. Donc les résultats d'isolement de cette
station peuvent être dus à l'eau.
Par ailleurs, si on prend la station 3 on remarque le même
cas que la station 2, dont on a isolé une fraction très infime de
souche de
« Penicillium » à
partir des échantillons du sol du point de prélèvement
P4, bien qu'il abrite un nombre considérable de pigeons,
alors que le point de prélèvement P2 était
notre source principale d'isolats de
« Penicillium » pourtant on n'a
remarqué aucune trace d'animaux aux cours de nos
prélèvements.
C'est peut être du à l'eau, bien que tous les point
de prélèvement de cette station soient alimentés par les
eaux d'infiltration. Mais, si on prend la remarque concernant la couleur du
tapis mycélien du point de prélèvement P2
qu'était foncé en période sèche
(décembre), et clair avec des hyphes bien visualisés après
la période neigeuse (mars), on peut penser que les eaux d'infiltration
ont un rôle important dans l'abondance des souches de
« Penicillium », puisque les eaux
d'infiltration ont été plus intense en mois de mars.
Par suite de ces résultats, on pose plusieurs questions,
est ce que c'était le type de matière nutritive qui est
responsable des résultats d'isolement
du « Penicillium » et pas la
quantité, ou bien c'était l'eau qui a la grande
responsabilité ?
D'un autre côté, le type d'apport de la
matière nutritive de l'extérieur des trois stations, ainsi l'eau
sont peut être lié indirectement à la forme de
l'entrée de chaque station. Prenons la station 1, l'ouverture
très étroite de cette station, plus la verticalité des
deux mètres premiers de la station (Fig. 4.B) a rendu l'accès de
l'homme et des vertébrés difficile par rapport à la
station 2 dont elle est caractérisé par une entrée
très large et une grotte horizontale, contrairement à l'eau dont
il peut pénétrer facilement dans le cas de la station 1, par
rapport à l'autre station.
La station 3 considérée comme un lieu touristique
intéressant, à son entrée il y a une grande porte
grillée éliminant toute possibilité des
vertébrés d'accès à travers. Les pigeons
observés au niveau du point de prélèvement P4
(le point de prélèvement le plus proche à l'entrée)
ont été entrés par une ouverture en haut de
l'entrée. La forme de l'entrée de cette station, ne peut jouer
aucun rôle dans l'alimentation de nos points de prélèvement
en eau.
A l'égard de la matière nutritive, les champignons
des grottes ont besoin de l'eau et d'air comme tout être vivant.
A propos de ces deux éléments
Jeannel a dit en 1937 « Il ne semble pas que l'air et l'eau
aient une composition spéciale dans le domaine souterrain. L'eau est
saturée de calcaire, comme bien des eaux superficielles ».
Dans le monde souterrain, l'eau et l'air ne semblent pas qu'ils
ont une composition spéciale mais ils peuvent influencer sur l'abondance
des champignons du genre
« Penicillium », aussi ils
peuvent être influencés par d'autres facteurs. Alors, voyons quel
rôle ils peuvent jouer dans nos stations de prélèvement.
Prenons l'eau.
En analysant les résultats des observations sur terrain,
on remarque qu'il existe une différence entre l'alimentation des trois
stations en eau. L'eau alimentant les deux stations 1 et 2 était
d'origine pluviale entrée par l'ouverture principale des grottes, dont
il est plus remarquable dans le cas de la station 1 que l'autre station vue la
forme de son entrée. Cependant, l'eau alimentant la station 3 est comme
origine l'eau d'infiltration plus des sources de cours d'eaux présents
au niveau des points de prélèvement P2 et
P3.
Par suite de ces résultats, on peut dire que l'eau est
suffisante au niveau de tous les sites d'étude à l'égard
de la station 2.
Parallèlement à la matière organique et
l'eau, les champignons ntant qu'organismes hétérotrophes ont
besoin d'oxygène pour vivre. Cependant, l'approvisionnement du milieu
souterraine en oxygène et comme tous les autres milieux (terrestre,
aquatique,...) est sous la dépendance de l'activité des
organismes photosynthétiques dégageant l'oxygène.
Alors, on peut dire que plus l'activité
photosynthétique de ces organismes est plus importante, plus le milieu
s'enrichit en oxygène. Or, le milieu souterrain est
caractérisé par l'absence de la lumière, surtout dans les
galeries les plus profondes, alors que c'est un facteur important pour
l'assimilation chlorophyllienne ; ce qui a rendu ce milieu, un des milieux
les plus pauvres en oxygène. Par contre, ce milieu est
caractérisé par un apport énorme de gaz carbonique
libéré aux cours des précipitations calciques et le
ruissellement des eaux souterraines.
Selon Jeannel (1937) « On
connaît un assez grand nombre de grottes à acide carbonique. Ce
gaz remplit les bas-fonds et y forme des lacs gazeux où toute vie est
impossible. Lorsqu'il coule en ruisseaux aériens dans les galeries
souterraines, il rend l'air irrespirable pour l'homme ».
Si on prend en considération la relation proportionnelle
entre l'oxygène et les organismes photosynthétiques, on peut dire
que parmi nos stations de prélèvement les plus riches en
oxygène étaient la station 1et la station 2 ; tandis que les
plus pauvres sont les points de prélèvements de la station 3.
Donc les deux stations 1 et 2 ont été des milieux favorables
à l'abondance des champignons du genre
Penicillium, alors que les résultats
d'isolement ont été appropriés dans le cas de la station 1
et non dans le cas de la station 2.
Concernant la station 3, les résultats d'isolement des
souches de Penicillium ont été
remarquables. L'absence des producteurs d'oxygène, plus l'infiltration
des eaux aux niveaux de tous les points de prélèvement peut les
transformer en milieu très pauvre en oxygène et riche en gaz
carbonique, alors que le point de prélèvement P2
situé à 180 m de l'entrée, où la chance d'existence
des organismes chlorophylliens est négligeable, a été la
source principale de nos isolats de penicillium.
D'après ces résultats, on peut dire que les
organismes photosynthétiques endogènes n'étaient pas le
seul facteur limitant d'oxygène dans ces stations, et surtout la station
3. L'oxygène est peut être apporté aux cours des
renversements des courants d'air entre la grotte et l'extérieur, dont on
peut remarquer que la largeur de la grotte dans le cas de la station 3 peut la
transformer en un stock d'oxygène, et surtout à proximité
de l'entrée. Cependant, le point de prélèvement
P2 est très éloigné de l'entrée et
même de l'autre ouverture.
Le problème ne se pose pas à la distance entre ce
point de prélèvement et les deux entrées de la station
puisqu' elle n'est pas énorme, l'oxygène est suffisant ; mais
c'est la rétention de l'oxygène par le sol, qu'elle peut poser
les problèmes ; et surtout, lorsqu'on lie ce que vient à
l'influence de l'oxygène et gaz carbonique sur la microflore tellurique
et son activité abordé par Dommergues (1969) :
« Le sol est formé de particules
élémentaires (sable, limon, argile) assemblées en
agrégats et constituant un système poreux (phase solide) dont les
espaces libres sont occupés par l'atmosphère du sol (phase
gazeuse) ou par de l'eau (phase liquide ou solution du sol). Les proportions
relatives des phases gazeuses et liquides variant en fonction de
l'humidité, il est difficile de dissocier l'étude de
l'aération du sol de celle de l'humidité : en effet, lorsque
le sol est gorgé d'eau, la phase gazeuse est inexistante et les
échanges avec l'atmosphère libre sont très
faibles. ».
D'après ce paragraphe, on peut dire que la teneur
très élevé en eau du sol du point de
prélèvement P2 (Fig. 4.D et E) peut réduire sa
teneur en gaz! ! !
Mais, peut être c'est vrai si les gaz du sol n'existent que
dans la phase gazeuse ; or, ils n'existent pas seulement dans la phase
gazeuse mais aussi dans les autres phases, phase liquide ou ils sont dissouts
et à l'état adsorbé sur les particules constituant la
phase solide, dont les gaz dissous joue un rôle
biologique important dans la solution du sol, car la plupart des
microorganismes telluriques ne sont pas en contact direct avec
l'atmosphère du sol mais sont recouverts d'un film d'eau plus ou moins
épais dans lequel diffusent les gaz de l'atmosphère (DOMMERGUES,
1969).
Donc, on peut penser que c'est à l'oxygène dissout
qu'on peut rattacher l'abondance des souches de
Penicillium dans ce point, alors que les solutions du
sol sont caractérisées par une concentration en oxygène
beaucoup plus faible et une concentration en gaz carbonique beaucoup plus
élevée que l'atmosphère du sol avec lesquelles elles sont
en contact (DOMMERGUES, 1969).
Après qu'on a discuté l'approvisionnement en
oxygène de ce point de prélèvement, on y trouvé
toujours devant l'impossibilité de ce point d'être un milieu
convenable et même très convenable à l'abondance des
champignons du genre Penicillium. La preuve le tapis
mycélienne (Fig. 4.D et E).
Sans oublier les résultats d'isolement des souches
de Penicillium à partir des concrétions
en mois de mars, on peut attribuer ces résultats dans la majeur partie
aux eaux d'infiltration, qu'elle peut apporter la matière nutritive,
l'eau et l'oxygène. Et, dont Maheu (1906) a dit à propos des
champignons (supérieur) trouvés sur les concrétions :
« La présence du substratum et surtout sa nature
ne doit pas être sans influence sur le développement de ces
champignons. Dans un grand nombre de grottes, les concrétions calcaires
qui recouvrent entièrement le sol s'opposent aux efforts des
mycéliums pour trouver leur nourriture. En effet, ce n'est
qu'exceptionnellement que des formes naines croissent sur des stalactites qui
semblent ne présenter aucune particule alimentaire ; mais
dés qu'apparaissent les matières organiques : boues
liquides, humus, détritus de feuilles, les champignons plus ou moins
bien développés se multiplient rapidement ».
D'un autre côté, les résultats d'isolement
des souches de Penicillium peut être
attribué à notre travail expérimental dont les conditions
de travail (milieux de culture, température d'incubation, pH...ect) ont
permis peut être à la croissance de certaines en faveur
d'autres.
Enfin, on doit faire la remarque sur l'interprétation et
la discussion des résultats d'isolements des souches de
Penicillium, c'est vrais les résultats
apportées dans notre travail étaient ceux des souches
sélectionnées et pas isolées ; mais si on prend les
résultats, à titre exemple, de la station 1 et du point de
prélèvement P2 de la station 3 le nombre réel
des souches isolées étaient beaucoup plus important que celui des
souches sélectionné ; cependant que le nombre réel
des souches des autres stations et les points de prélèvements
était le même que celui des souches sélectionné.
C'est pour cette raison qu'on a dit que la station 1et le point de
prélèvement P2 de la station 3 ont été
caractérisés par l'abondance de nos champignons cible.
Parallèlement à l'isolement des souches de
Penicillium, on a révélé la
nouveauté dans notre laboratoire d'une souche présent uniquement
dans les échantillons du point de prélèvement
P2 de la station 3. L'étude de ces caractéristiques
morphologiques et culturales, suivie par une identification proprement dite par
le Musium National d'Histoire Naturelle de France, a
montré que la souche appartient à l'espèce
Beauveria felina.
D'après l'article qui a accompagné la lettre du
Musium National d'Histoire Naturelle de France, les
caractéristiques morphologiques et culturaux de la souche 23 B ont
présenté une grande similitude avec celle décrit par De
Hoog (1972) en article ci-dessous.
Isaria felina (DC. per Fr.) Fr.
Clavaria (?) felina DC. - Fl. fr. 6:30. 1815; per Fr. -
Syst. mycol. 1: 496. 1821 = Fibrillaria felina (DC. per Fr.) Pers. -
Mycol. eur. 1:53. 1822 = Isaria felina (DC. per [p. 16] Fr.)
Fr. - Syst. mycol. 3: 271. 1832 = Penicillium felinum (DC. per Fr.)
Biourge - Cellule 33: 102. 1923.
Isaria felina (DC. per Fr.) Fr. var. suina
Sacc. - Michelia 2: 561. 1882.
Isaria felina (DC. per Fr.) Fr. var.
aviaria Sacc. - Michelia 2: 561. 1882.
Isaria edwalliana P. Henn. - Hedwigia 43: 209. 1904.
Isaria felina (DC. per Fr.) Fr. var. domestica
Speg. - An. Mus. nac. Hist. nat. B. Aires 23: 121. 1912.
Isaria felina (DC. per Fr.) Fr. var.
cuniculina Ferr. - Fl. ital. crypt., Fasc. 6, Hyphales p. 152.
1910.
Isaria felina (DC. per Fr.) Fr. var. pirina
El. Marchai & Et. Marchai - Bull. Soc. R. bot. Belg. S4: 134. 1921.
Isaria fimicola Sternon - Bull. Soc. R. bot. Belg. 55:
145. 1923.
Isaria cretacea van Beyma - Zentbl. Bakt. ParasitKde,
Abt. 2, 91: 350. 1935 = Beauveria cretacea (van Beyma)
Matsushima - Microf. Solomon Isl., Papua-New Guinea p. 7. 1971.
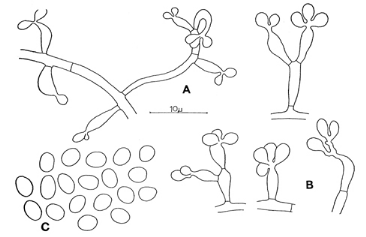
Fig. 11. Isaria felina. a. conidial
structures; b. conidiogenous cells; c. conidia.
Colonies in vitro attaining a diameter of 8-14 mm in 8
days, forming in fresh isolates a dense felt, from which several white,
positively phototropic synnemata arise (Taber & Vining, 1963), up to 70 mm
high and constantly 1 mm wide, terete, tomentose, usually unbranched, or
occasionally branched at the apex, in old strains appearing lanose to floccose;
at first white, later becoming yellowish. Reverse uncoloured or yellowish to
yellow brown. Exudate rarely produced, odour absent. Submerged hyphae
hyaline, smooth-walled, 1-3 um wide. Hyphae of the aerial mycelium hyaline,
smooth-walled, 1-4.5 um wide, creeping, ascendent or fasciculate, bearing
orthotropic conidiogenous cells, solitarily or in small groups; sometimes 1-2
conidiogenous cells are supported by a slightly swollen stalk [p. 17] cell.
Conidiogenous cells not elongating, consisting of a swollen, flask
shaped or curved, occasionally elongate basal part, mostly 3-8.5 x 2-2.5 um,
and a short, irregular conidiiferous portion, mostly comprising 2-4 denticles;
in age a short geniculate rachis may be formed. Conidia hyaline,
smooth, subglobose, ellipsoidal or ovoidal, sometimes with a pointed base,
(2.5-) 3-4 (-4.5) x (2-) 2.5-3 (-3.5) um. No chlamydospores were observed.
Mycelium on natural substrate forming a thin layer of hyaline
hyphae, from which several white, erect synnemata arise, up to 80 mm high and
constantly 0.5-1 mm wide, usually unbranched. Perfect state unknown.
Material examined
Herbarium specimens
Isaria felina in herb. Fries (UPS), probably
collected by F. Chevallier.
Fibrillaria felina in herb. Persoon (L), Nos.
910.262.101 and 910.262.106, leg. F. Chevallier.
Isaria felina in herb. PC under No. 1534; ex herbarium
Durieux de Maisonneuve, leg. L. Motelay, 1879.
Isaria fimicola in herb. BPI (type), cultures on
carrot.
Isaria fimicola in herb. Shear (BPI), leg. P. Marchal,
Gembloux, Belgium, 1924.
Isaria felina var. suina Sacc. in
herb. Bresadola (BPI), type, on dung, Torino, Italy.
Isaria felina in herb. Bommer & Rousseau
(B), on rabbit dung, 1882.
Isaria edwalliana in herb. S, on carnivore
dung, Sao Paulo, Brazil, 1903.
Isaria felina ex herb. Sydow (S), on rat dung,
Leipzig, Germany, leg. B. Auerswald.
Living strains
CBS 110.08 sent in 1908 by A. F. Blakeslee.
CBS 250.34, type culture of Isaria cretacea,
Epsom, Great Britain, sent in 1934 by D. Hutchinson.
CBS 235.36 isolated by H. A. Diddens from pupa of Anaitis
efformata, Soest, sent in 1936 by R. Tolman.
CBS 236.36 isolated from rabbit dung, Erlangen, Germany, sent in
1936 by H. Greis.
CBS 217.37 isolated from mouldy leaves, sent in 1936 by D.
Hellinga.
CBS 312.50 isolated from rabbit dung, sent in 1950 by K. B.
Boedijn under No. BR 17/50.
CBS 313.50 isolated as culture contaminant, sent in 1950 by Lab.
Microbiology, Delft.
CBS 229.58 sent in 1958 by O. Verona.
CBS 648.66 sent in 1966 by F. J. Herrero, Buenos Aires,
Argentina.
CBS 173.71 isolated from porcupine dung, Ontario, Canada, sent in
1969 by D. Malloch under No. TRTC 45685.
En analysant les informations apportées par l'article, on
a trouvé quelques différences. Prenons l'embranchement des
synemmata ; le lectotype décrit en article est fréquemment
non branché (usually unbranched). Ce n'est pas le cas
pour notre souche (Fig. 7).
En plus, si on prend le paragraphe «Mycelium on
natural substrate forming a thin layer of hyaline hyphae, from which several
white, erect synnemata arise, up to 80 mm high and constantly 0.5-1 mm wide,
usually unbranched. Perfect state unknown.» de l'article
ci-dessus, on remarque que la souche décrite dans cette article a
formé sur son milieu naturel des synnemata de grande taille (80 mm en
longeur et 0.5 à 1 mm en largeur).
Dans le cas de la souche 23B, on ne peut pas trouver ses
caractéristiques sur son milieu naturel (le point de
prélèvement P2 de la station 3). On a observé,
seulement, un tapis mycélien dont on ne peut pas distinguer ses
composants (Fig.4.D) ; sa couleur et sa forme ne peuvent nous donner aucun
renseignement des champignons qui tapissent ce point de
prélèvement. Est-ce que c'est
Penicillium ou bien Isaria
felina ou même d'autres champignons hors ces deux types et
que les techniques d'isolement par suspension-dilution n'ont pas permis de les
détecter.
Devant le problème posé, est ce que le tapis
mycélien est celui d' Isaria felina ou pas, on
essayera de discuter la différence entre le lectotype décrit en
article est la souche 23 B du point de vue croissance sur le milieu
naturelle.
En prenant d'abord, l'origine des souches d'Isaria
felina décrit en article si dessus. Qu'est ce qu'on
trouve ? On trouve que les souches ont été isolées
dans la plupart des cas à partir des excréments d'animaux. En
plus, ces souches ont présenté un caractère très
remarquable : leurs synnemata sont phototropique,
Or, notre souche 23 B et toutes les souches qui lui ressemblent
ont été isolées du sol et des concrétions
sédimentaires d'un point situé à 185 m de l'entrée
d'une grotte (Ghar Beni Aâd), alors l'origine est totalement
diffèrent des autres souches, c'est une souche cavernicole.
Si on considère que le tapis mycélien est celui
d'Isaria felina, qu'est ce qu'on peut dire ?
On peut dire, que même si le tapis mycélien est
celui d'Isaria felina, les hyphes n'ont pas les
mêmes caractéristiques que celle décrites par l'article. La
différence observée est peut être attribuée à
plusieurs facteurs, la matière nutritive, l'oxygène,
l'humidité et enfin la lumière.
Si on prend le biotope des souches citées par l'article,
on trouve que c'est des milieux riches en matière nutritive puisque ce
sont des excréments d'animaux, carotte,...ect. Les autres facteurs n'ont
pas été cités.
Contrairement, à nos souches qui sont isolées d'un
milieu extrême où l'apport en matière nutritive, ainsi en
oxygène pose plusieurs questions du fait des caractéristiques du
point de prélèvement P2 évoquées en
haut. La lumière joue un rôle important puisque les synnemata des
souches citées en article sont phototropique, alors que le biotope de la
souche 23 B est caractérisé par une obscurité total.
Par ailleurs, si on considère que le tapis mycélien
est pas à Isaria felina, on peut dire que les
spores de cette espèce ont été conservés dans le
sol et sur les stalactites, et que les caractéristiques du point de
prélèvement P2 n'ont pas permis le
développement de ces spores. En effet, les moisissures sont parfois
condamnées à un mode de conservation originale. Dans les parties
de réseaux soumises aux courants d'air ascendantes ou descendantes,
notamment à proximité des entrées, les apports organiques,
à la surface des sédiments, peuvent être suffisants -
l'humidité par ailleurs ne faisant que rarement défaut - pour
permettre un début de développement des spores qui les
accompagnent. Ce développement est réduit et on isole
fréquemment, notamment dans les galeries de faible volume ouvertes aux
pollutions, à coté de cours filaments mycélien vides,
à parois épaisses, de grosses spores à parois
épaisses également, mais rarement des sporanges. Ces grosses
spores sont capables ultérieurement d'un développement normal. Le
court mycélium issu de la germination, après avoir
rassemblé son cytoplasme, donne des sortes d'oïdies qui sont
plutôt des kystes correspondant à un stade de conservation
(CAUMARTIN, 1959).
Mais le problème ne s'arrête pas, est ce que le
tapis mycélien est celui d'Isaria felina ou
pas, et encore est ce que Isaria felina est
présent au niveau du point de prélèvement P2
à l'état végétatif ou à l'état de
spore, mais de quel facteur, elle est peut être influencé sous les
deux états.
Les interactions entre les composantes de la mycoflore du sol de
ce point peuvent jouer le rôle, comment ?
Selon Dommergues (1969) « Lorsque l'on inocule un sol
stérile avec un microorganisme quelconque, ce dernier s'y installe
sans difficulté, à condition, bien entendu, qu'il dispose d'un
substrat convenable et qu'il ne soit pas gêné par des facteurs
écologiques défavorables, pH excessif ou insuffisant par exemple.
Par contre, si l'inoculation porte sur un sol non stérile, elle est
souvent vouée à l'échec : c'est ainsi que de nombreux
microorganismes pathogènes pour l'homme, les animaux ou les plantes, ne
se conservent pas dans les sols biologiquement actifs. Cet échec de
l'introduction d'un microorganisme étranger dans un sol non
stérile s'explique par l'intervention de processus antagonistes divers,
dont les principaux sont la compétition, l'antibiotisme, la
prédation et le parasitisme. ».
D'après ce paragraphe, on peut dire que nos souches
d'Isaria felina ont été peut être
à l'état de spore, si c'est le cas, pas seulement à cause
des conditions d'environnement mais les interactions peuvent jouer un
rôle, surtout celles de type antagonistes.
L'un de ces interactions le plus intéressentes est la
mycostase ou phénomène d'inhibition de la germination des spores
fongiques en contact avec le sol, même si les conditions d'environnement
sont favorable à leurs germination. Il est expliqué soit par la
déficience du sol en substrat nécessaire à la germination
d'où apparition d'une compétition très vive entre ces
spores d'une part et les autres éléments de la microflore d'autre
part, soit par la diffusion dans le sol de substances inhibitrices
(mycostatiques), en particulier d'antibiotiques (DOMMERGUES, 1969).
On comprend que, si Isaria felina est
présent au niveau de ce point de prélèvement à
l'état de spore, elle est peut être sous l'influence des
interactions antagonistes, mais si elle est à l'état
végétatif, de quel type d'interaction elle est peut être
soumise ?
Premièrement, on doit faire la remarque sur la
différence entre le tapis mycélien et la forme
végétative. Lorsqu'on a dit le tapis mycélien est celui
d'Isaria felina, on a peut être
négligé un peu le cas ou le tapis mycélien est
formé d'une part par Penicillium, qu'on a
révélé auparavant leur abondance au niveau de ce point, et
d'autre part par Isaria felina et même d'autres
champignons.
Si c'est le cas, on peut dire que ces composantes du tapis
mycélien sont peut être sous la dépendance des interactions
synergiques, qui a rendu ce point de prélèvement un milieu
favorable autant pour Penicillium que pour
Isaria felina malgré les points
d'interrogation accompagnant les conditions d'existences au niveau de ce
point.
Si ce n'est pas le cas, on peut dire que cette espèce a
peut être exercé des interactions antagonistes contre les autres
champignons.
Quoiqu'on parle de la différence observée entre les
caractéristiques du lectotype décrit en article et celles de la
souche 23 B, on ne peut pas négliger la différence entre les deux
origines d'isolement. Alors, si on analyse bien les données de cet
article, qu'est ce qu'on peut dire ?
Hors l'origine d'isolement, l'article n'a pas donné des
informations concernant, sous quelle conditions de croissance a donné
cette espèce la forme décrite en paragraphe si dessus ( la
température, la luminosité et l'humidité), ainsi l'origine
exacte pas seulement des excréments mais aussi des animaux, des
champignons, des carottes...ect. Est-ce qu'ils ont une relation avec les
grottes ?
On essayera d'établir cette relation par le schéma
suivant :
Transport de spores
Excréments
Lapin
Souris
Porc-épic
Carottes
Champignons
Grottes
Excréments
Aliments
Pourquoi on a pensé à cette relation ? Peut
être parce qu'on a trouvé que l'origine d'isolements des souches
d'Isaria felina de l'article ont une relation avec
les grottes ; surtout, lorsqu'on parle du porc-épic dont l'habitat
principal de cet animal c'est les cavités souterraines, et même
quand on parle des autres origines, ils ont une relation avec le monde
souterrain.
Par ailleurs, cette relation peut nous diriger vers une
problématique, est ce que Isaria felina est
une espèce cavernicole ou c'était les animaux cités par
l'article qui ont transporté ces spores à l'intérieur de
la grotte de Beni Aâd.
Avant de terminer, nous devons faire la remarque qu'en
laboratoire on a isolé plusieurs souches de cette même
espèce et à partir de plusieurs échantillons du point de
prélèvement P2 et on a fait plusieurs essais
d'isolement pour éviter les probabilités que cette espèce
d'être un simple contaminant de nos cultures.
On peut ajouter que ce point de prélèvement n'est
pas un endroit préférable aux touristes de la grotte, puisqu'elle
n'est pas concrétionné en formes attirantes. Pourquoi on a dit
ça, tout simplement pour éviter la probabilité que les
souches isolées de cette espèce sont à l'origine les pieds
des touristes.
Afin d' atteindre notre objectif de départ que
c'était l'isolement des souches fungiques à activité
antibactérienne ; on a utilisé deux méthodes, dont
l'une était utilisée pour les souches de
Penicillium, pendant que l'autre était
utilisée pour la souche 23 B.
Concernant la première méthode les souches ont
été passées par deux criblages, afin de
sélectionner les souches les plus puissantes de point de vue
d'activité antibactérienne. En passant par le criblage primaire,
on a révélé la présence d'une activité
inhibitrice chez 38 souches de Penicillium parmi 80
souches testées contre une des trois bactéries-cible.
Les souches de Penicillium les plus
puissantes ont été d'origine la station 1 et le point de
prélèvement P2 de la station 3.
Le criblage secondaire a montré que parmi 14 souches de
Penicillium testées seulement 7 souches qui
ont révélé une activité antibactérienne
contre aux moins une bactérie-cible dont la plupart ont exercée
l'activité inhibitrice contre les deux bactéries-cible
Salmonella typhi et
Proteus mirabilis.
Par suite de ces résultats, on peut dire que les zones
d'inhibitions obtenues en deuxième criblage ont été
nettement inférieures à ceux obtenues en premier criblage des
mêmes souches de Penicillium. Cela est peut
être attribué à la méthode utilisée.
En effet, le milieu de culture peut jouer un rôle important
dans les résultats d'activité antibactérienne (TAKAHASHI
CTAKADA et al, 1994 ; BERNAN et al, 1994) ;
dont il peut influencer par différentes voies, par sa composition, sa
richesse en matière nutritive, son pH et même son état que
ce soit liquide ou solide. Alors, le fait que le milieu de culture
utilisé pour la production des antibiotiques par la méthode de
culture en milieu liquide soit le milieu (YGS) et celui de culture en milieu
solide soit (PDA ac) peut influencer sur les résultats
d'antibiose.
Selon Gaden-Junior (2000), la production des métabolites
est sous l'influence de la composition des milieux de cultures, sa richesse en
nutriment, plus d'autres aspects. Différentes sources de carbones et
d'azotes peuvent agir sur la synthèse des enzymes impliqués dans
le métabolisme primaire et secondaire. Les microorganismes sont capables
d'utiliser une large variété de sources de carbones et d'azotes.
Pourtant, beaucoup de voies de métabolismes secondaires sont
affectées négativement par les sources favorables à la
croissance (SANCHEZ et DEMAIN, 2002).
Plus la composition des milieux de culture, le pH peut influencer
sur les résultats d'antibiose puisqu'il est différent. Le pH
du milieu (YGS) neutre, pendant que celui du (PDA
ac) est acide.
Par ailleurs, il faut ajouter que les conditions de laboratoire
peuvent influencer sur les résultats. Alors, comment ?
Les essais effectués aux cours de notre étude en
laboratoire, nous ont imposé à réfléchir ce n'est
pas seulement à la différence observée entre les deux
méthodes mais aussi les différences observées, quelque
fois, entre les résultats d'une même méthode. Et on a fini
par dire que les conditions climatiques ont peut être joué un
rôle important dans l'expression de l'activité
antibactérienne chez les souches de
Penicillium. Pourquoi ?
On a remarqué que les tests d'antibiose effectués
en climat froid ont donné des résultats positifs, tandis que ceux
effectués en climat chaud ont donné dans la plupart du temps des
résultats négatifs. Cela est peut être attribué
à la production des antibiotiques par les souches de
Penicillium, peut être elle est affectée
par la période sèche même en utilisant des étuves
à 25°C, cela n'est pas sans inconvénient.
Ces remarques, nous font penser à l'origine d'isolement
(les grottes) et les conditions de ce milieu (température,
humidité...ect).
Par ailleurs, les résultats d'antibiose des souches de
Penicillium que ce soit en premier criblage, qu'en
deuxième ont été la preuve de la richesse des grottes et
spécifiquement la station 1 et le point de prélèvement
P2 de la station 3 en producteurs d'antibiotiques. Ces sites
d'études que leurs caractéristiques (la matière organique,
l'humidité, l'oxygène...ect), n'ont pas fait défaut
à la présence des champignons du genre
Penicillium, ont favorisé la
compétition entre ces champignons et les autres éléments
de la microflore du sol, donc la présence des producteurs
d'antibiotiques les plus puissants.
En effet, dans la nature les antibiotiques représentent un
atout pour les bactéries et les moisissures qui les synthétisent.
Cet atout leur permet de nuire à leurs compétiteurs pour mieux
s'accaparer les substances nutritives disponibles dans leur environnement
(GAUTHIER, 1993).
Enfin, nous devons faire remarquer que l'activité
antibactérienne des souches testées peut être plus
importante en milieu naturel que celle exhibée en laboratoire, du fait,
premièrement, aux conditions extrême de nos sites d'étude,
plus le choix de milieu de culture et les conditions de production des
antibiotiques.
Avant de terminer, on ne peut pas oublier un autre
témoignage des résultats d'antibiose des souches de
Penicillium, c'était premièrement, les
caractéristiques du point de prélèvements
P2.
Plus, l'histoire du combattant dans la station 1 avec les
blessures et le jeûne pendant 12 jours au lieu qu'elle s'aggravait, elle
s'est stabilisée. Peut être cet état était du
à la présence des organismes producteurs d'antibiotiques.
A propos de la souche 23 B appartenant à l'espèce
Isaria felina, le résultat d'activité
antibactérienne obtenue par la méthode 2 a montré que les
filaments aériens agrégés libèrent dans l'eau
distillée des substances antibactériennes.
Par ailleurs, les résultats des tests de production des
substances antibactériennes exogènes et endogènes ont
montré une activité négligeable du surnageant, et
parallèlement une activité importante de l'extrait
éthanolique du mycélium (aérien et substrat).
En effet, les filaments aériens agrégés de
cette espèce étaient le cible de beaucoup de chercheurs de
molécules insecticides et même des molécules antifongiques
(GUO et al, 2005). L'étude de l'activité
antibactérienne d' isarfiline contre les bactéries-cibles
(Bacillus subtilus, Escherichia coli et Staphylococcus
aureus), effectuée par Guo et al (2005), a
révélé l'absence d'une activité notable. Alors que
peut on dire de nos résultats ?
La présence d'une activité inhibitrice de la souche
23 B contre les bactéries- cible est peut être attribuée
à plusieurs facteurs ; au milieu de culture, au protocole
d'extraction, aux bactéries- cible, à la souche elle-même
pour des raisons peut être liées plus aux facteurs d'antagonistes
(cités en haut).
Il faut ajouter que l'absence d'une activité
antibactérienne notable du surnageant, ça ne veut pas dire que la
souche n'a pas des substances antibactériennes exogènes ; la
composition du milieu de culture, son pH, ainsi son volume peut influencer sur
les résultats.
Ailleurs, les résultats d'activités
antibactériennes des extraits éthanoliques et étheriques
du mycélium peuvent nous faire penser à la nature hydrophile de
la substance active, puisque l'activité était concentrée
dans l'extrait éthanolique.
| 


