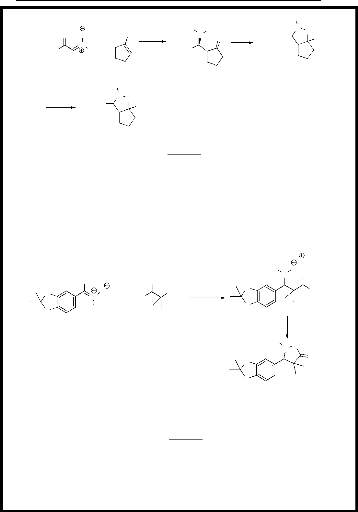
1. b. Réaction avec l'énolate de
lithium.
L'énolate de cyclopentanone lithium
généré in situ à partir de tri méthyle
silyle enol éther correspondant, en présence de méthyle
lithium, a été additionné à la nitrone. Nous
obtenons un produit qui va être soumis à une cyclisation
intramoléculaire d'une manière spontanée pour donner le
produit recherché à savoir l'isoxazolidine après
confirmation par le piégeage du produit par un agent silylant (le
chlorure de triméthylsilyle) (schéma 2)12.
Me
Me
1. c. Réactif de reformasky .
TMSCl
MeO2C
OTMS
N
O
- Schéma 2 -
L'addition du réactif de reformasky sur une nitrone,
suivie par une lactonisation spontanée, conduit directement au produit
qui est l'isoxazolidin-5-one (schéma
3)13.
ZnBr
Me
O
N
O
- Schéma 3 -
Me OLi NO
MeO2C OLi
MeO2C
OLi N O
O
+
N
Me
O
MeO
O
ZnBr
O
OEt
N
O
O
O
O
Rd = 52%
Me
H
O
+
EtO
O
N
Me
O
O
1. d.
80 - 90 %
- Schéma 5 -
Me OTMS
TMSOTf N
+ Sn(Bu)3
O
R
H
N R1
45-85%
R1 I
NIS N O
R
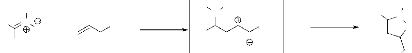
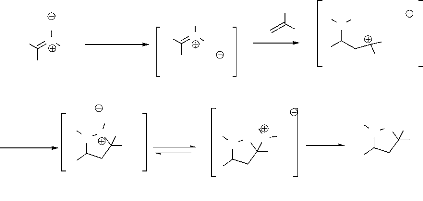
Réaction avec l'allyl trimétyl
silane.
Selon Wuts et Jung14 l'addition
d'allyltriméthylsilane sur les nitrones cycliques conjuguées, en
présence de TMSOTf donne l'hydroxylamine O-silylée
homoallylique (schéma 4). Tandis qu'avec les nitrones acycliques non
conjugues il se forme le
5-silylméthylisoxazolidine15. Cette
réaction passe par l'intermédiaire carbenium dont la durée
de vie est courte.
TMS TMSOTf
+
Me OTMS N
R
TMS
TfO
Me
R
N
O
Me
R
H
N O
TMS
R = tBu
48%
Me OTMS N
R
R = Ph
- Schéma 4 -
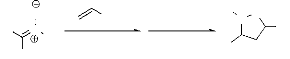
1. e. Réaction avec l'allyltributyl stannane
.
Le passage de l' allyltriméthylsilanne à
l'allyltributylstannane qui est beaucoup plus réactif, donne avec
succès le O-silyl hydroxylamine avec de bons rendements, et en
présence de TMSOTf. A partir de ces résultats ces
auteurs16 ont pu développer la
synthèse des 5- iodométhyl-isoxazolidines par simple
piégeage du mélange réactionnel avec le
Niodosuccinimide (NIS) (schéma 5) en une seule étape.
1.f. Réaction avec le silylènol
éther.
l'addition des silyle énol éthers
d'acétaldéhyde, d'acétone et d'acétophénone
sur des nitrones en présence de TMSOTf (1équi.) à 0°
C donne après 24 heures les 5- silyloxyisoxazolidines correspondants
avec de très bons rendements17,18.
L'utilisation d'une quantité catalytique de TMSOTf est possible, mais la
lenteur de la réaction nécessite une bonne conversion, car sous
ces conditions une partie du produit subit une élimination du silanol en
2,3- dihydro-isoxazole. Il a été prouvé que la
réaction procéde via la formation d'un ion
Osilyloxyiminium, selon le mécanisme décrit dans le
schéma 6
(1)
(2)
R2
OSi
TfO
R
H
OTMS
N R1
TfO
R1 OTMS
N
R
OSi
R2
O
R
H
N R1
TMSOTf
TfO
TfO
TMS
R1 O
OSi
R1
O
H2O N
R2
N O
R2
Si
N O
R1
TMS
OSi
R2
R
R
R
75-95%
- Schéma 6 - Les résultats obtenus sont
illustrés dans le tableau I
Tableau I
|
Nitrone
|
R
|
R1
|
R2
|
Si
|
Isoxazolidine
|
|
|
|
|
|
Rd(%)
cis/trans
|
|
1
|
Et
|
Bn
|
H
|
TBS
|
92 70/30
|
|
2
|
iPr
|
Bn
|
H
|
TBS
|
95 38/62
|
|
3
|
Et
|
Bn
|
Me
|
TMS
|
91 35/65
|
|
4
|
iPr
|
Bn
|
Ph
|
TMS
|
74 55/45
|
Puisque l'équilibre entre les ions oxoniums (1) et (2)
subsiste, Dhavale et al18 ont
développé un procédé, où, dans un premier
temps le TMSOTf provoque la réaction entre le silyl énol
éther et la nitrone, ensuite l'addition, à haute
température, du nucléophile silylé (cyanure de
triméthylsilyle ou allyltriméthylsilane) sur l'acétal pour
conduire finalement à l'isoxazolidine (schéma 7).
O
OTBS
60°C
TMSOTf -10°C
Ph
H
N
Me
Nu -TMS
Me
N O
Nu
Ph
Nu =allyl, Rd =44% Nu =CN, Rd =53%
- Schéma 7 -
1. g. Réaction avec le triméthyl
silyloxy-furane.
La réaction du 2-tri méthyl-silyloxy-furane avec
les nitrones qui est un cas particulier du silylcetène-acétal
conjugué, procure une voie complètement
régéosélective. En outre, le produit de cette
réaction qui est formé en premier lieu, souvent cyclisé
intramoléculaire il se forme le tetrahydrofuro[2.3.0]isoxazol-5(2H)one,
au contact du gel de silice pendant l'étape de purification par
chromatographie. Le butenolide peut être forcé à la
cyclisation en isoxazolidine par utilisation du fluorure de
tétrabutylammonium (Bu4NF) 19.
La stéréochimie de cette réaction est
contrôlée par la nature des deux substituants a situés sur
la nitrone. Quand le substituant placé en a est un cycle aromatique nous
obtenons principalement un produit syn, tandis qu'avec l'utilisation des
a-alkyl-N-benzylnitrones, le produit majoritaire est l'anti
(schéma 8)20.
O
SiO2 ou
Bu4NF
R1
N
O
TMSOTf
+
R
H
R
O OTMS
OTMS
O
N R1
R1
N O
O O
R
syn
R1
N O
R
O anti
O
-Schéma 8-
Les résultats obtenus sont illustrés dans le
tableau II
|
Nitrone
|
R
|
R1
|
Anti
(%)
|
Syn
(%)
|
Anti /
syn
|
|
1
|
Ph
|
Me
|
15
|
81
|
16/84
|
|
2
|
Ph
|
2-
|
3
|
81
|
4/96
|
|
3
|
iPr
|
Thienyl
|
70
|
10
|
88/12
|
|
|
Bn
|
|
|
|
-Tableau II-
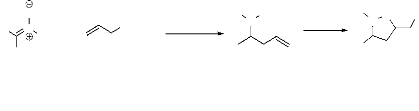
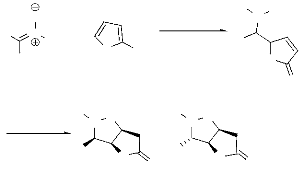
2. A partir d'oxime et d'alcène.
Un travail de recherche
bibliographique21,22 a révélé
que lorsque le formaldoxime réagit avec l'acrylate de méthyle,
nous obtenons un mélange d'isoxazolidines dont l'une (la
N-substituée) est majoritaire par rapport à l'autre. Par
contre la réaction de la benzophénone oxime avec la
méthyle vinyle cétone donne l'isoxazolidine
N-substituée (schéma 9). Ces produits sont formés
à partir de l'addition de Michaël de l'oxime sur l'oléfine
consécutive à la réaction dipolaire-1,3.
Ce mécanisme est corroboré par le chauffage
à 80 - 90°C, pendant quelques heures et l'utilisation de deux moles
d'acrylate de méthyle, ou acrylonitrile ou méthyle vinyle
cétone et une mole d'oxime. Il faut noter que l'emploi du
1-hexène n'aboutit à aucune réaction
23.
H3COOC
+ N
HO
H3COOC O
COOCH3 +
H3COOC O

N



NH
majoritaire minoritaire
Ph
HO O
+
Ph
N
O
Ph
Ph
O N
O
-Schéma 9 -
3. A partir de nitronate et d'alcène.
Les alkyl et silyl nitronates ou les N-alkoxy et
N-silyloxy nitrones peuvent réagir avec les alcènes par
réaction de cycloaddition dipolaire-1,3 pour obtenir la
N-alkoxy/Nsilyloxyisoxazolidine (schéma
10)24. Les produits obtenus à partir de
nitronates acycliques qui possèdent un proton en position 3 de
l'isoxazolidine, sont facilement transformés en 2- isoxazoline par
élimination du groupe alkoxy ou silyloxy selon un traitement acide ou
par simple chauffage.
OR
OR
N O
+
N
O
N
O
R= silyl, alkyl isoxazolidine 2-isoxazoline
- Schéma 10 -
4.
A partir d'hydroxylamine y-ö
insaturée.
Les hydroxylamines y-ö insaturées ont
été synthétisées à partir de l'addition du
réactif de grignard allylique sur une nitrone. L'avantage de ces
composés est leur utilisation dans les réactions
d'iodocyclisation des dérivés
O-silylés25,26. Ces derniers
peuvent être transformés en 5-iodométhylisoxazolidine dont
l'ouverture, par un traitement acide, est possible pour aboutir à la
chaîne ouverte que est la 1,3-amino alcool (schéma
11)27.
5.
R1
TMSO R1
N
HO R1
N
Nu
N
I-I
TMSCl
R
O
I
R
R
R1
N
O
H
NH
OH
R
R1
Nu
R
Nu
- Schéma 11 -
A partir de nitroalcène et
d'allylamine.
a. Hassner et
al28,29 ont découvert la réaction de
cycloaddition intramoléculaire de silylnitonate obtenu à partir
de l'addition de Michael de l'allylamine sur le nitroalcène, suivie par
le piégeage au moyen du chlorure de tri méthyle silane (TMSCl)
(schéma 13). La nitronate de silyle obtenue, réagit de
façon dipolaire-1,3 et intramoléculairement pour former
l'isoxazolidine correspondante, et en un seul
diastéréoisomère (schéma 12).
O
H
R1
R2 H
N
N
OSiMe3
-Schéma 12-
TMSCl
H
R1
N
N
+
NO2
R2
NEt3
OSiMe3
R1 N
O
R2
R1
R2
N
H
NO2
ON O
MeO2C Me
H
H
OAux
- Schéma 13 -
Me
CO2Me
+ OAux
H
Me
O O
N
OAux
TiCl2
O O
N
CO2Me
b. Denmark et
al30 ont pris un exemple typique, à savoir
la réaction catalysée par un acide de Lewis, entre
l'alcène possédant un auxiliaire chiral et un nitroalcène
selon un mécanisme d'hétéro Diels-Alder. Il se forme
l'intermédiaire nitronate de cycloalkyl chiral. Celui-ci donne,
après réaction de cycloaddition dipolaire-1,3, le produit
isoxazolidinique (schéma 13)31.
6. Réaction de plusieurs réactifs
simultanément.
Récemment l'hydroxylamine chirale a été
introduite comme un bon réactif pour la réaction de cycloaddition
dipolaire-1,3. Celle-ci conduit après action avec un mélange
d'aldéhyde et d'alcool allylique, à l'isoxazolidine
correspondante, avec un bon rendement32. La
diastéréosélectivité a été grandement
avantagée par l'utilisation de MgBr2 anhydre en engendrant le complexe
magnésium portant l'alcool allylique et la nitrone formée in situ
grâce à la coordination des atomes d'oxygène (schéma
14).
OH
OH
+ RCHO +
OH
NHOH
Ph
MgBr2/iPrOH
THF
OH
O
N
Ph
90%
R
-Schéma 14-
Le mécanisme réactionnel de l'obtention de
l'isoxazolidine dans le schéma 15.
Br2
Mg
OH
NHOH
Ph
OH
R O
H
+
MgBr2
HO
O
N
Ph
H
OH
O
N
Ph
R
OH
Ph
-Schéma 15-
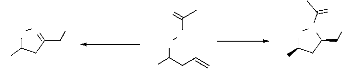
7. A partir de la cycisation électrophile de
dérivés O-homoallyl-hydroxylamine.
Les cyclisations électrophiles, dérivées
de différents O-homoallyl hydroxylamine, ont été
étudiées. En effet les O-homoallyl hydroxylamines non
protégées subissent une cyclisation pour donner des isoxazolines.
Cette nouvelle synthèse permet une cyclisation électrophilique
pour donner la formation des isoxazolidines.
La cyclisation peut être conduite par différents
agents électrophiles (tBuOCl, PhSeBr, NBS et NIS). L'oxydation
ne peut pas avoir lieu si les O-homoallyl hydroxylamines de
départ sont Sulfonées. La cyclisation électrophile fournit
des isoxazolidines-N-sulfonées avec une sélectivité
cis élevée (plus de 7:1). La cyclisation
électrophile d'O-homoallyl hydroxylamines
N-acylées donne les isoxazolines ou les isoxazolidines selon
les conditions de réaction (réactifs). La cyclisation en
milieu t-BuOCl aboutit aux isoxazolines via la cyclisation oxydante,
tandis que le NIS permet d'obtenir le produit de cyclisation 5-exo avec une
haute stéréo sélectivité (cis : trans. =13 :1)
(schéma 16)33.
O
O
O N Cl
Ph
tBuOCl
O NH
NIS
O N
I
Ph
Ph
69% 82%
e.d =12.5:1
-Schéma 16-
| 


