Résultats
La littérature nous rapporte que dans la
majorité des réactions 1.3-dipolaires entre les nitrones et les
oléfines nous avons la formation d'un mélange de
régioisomères et de diastérioisomères
(schéma 1), Nous avons opté pour la synthèse des
isoxazolidines en utilisant la réaction de cycloaddition dipolaire-1,3
entre l'a-phényl-N-méthylnitrone 1,
préparée à partir de la réaction de condensation
entre le benzaldéhyde et la CH3NHOH,HCl ,avec les alcènes
2, 3, et 4 (figure 1).
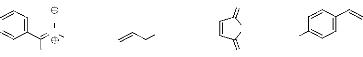
O
OH
F
H
O O O
N CH3
1 2 3 4
- Figure 1 -
Le but de ce travail est d'étudier la
réactivité, la régiosélectivité et la
diastéréosélectivité de cette réaction en
fonction de la nature des substituants portés par l'alcène
utilisé.
R1 H3C
N
benzène
reflux
R2
R2
O
R1
H3C
N
O
R2
+
R1
H
O
N
+
CH3
- Schéma 1 -
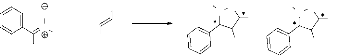
a. Réaction avec l'alcool allylique 2.
L'alcool allylique 2 est un alcène
monosubstitué portant le groupement hydroxyle en position allylique, ce
qui entraîne un effet inductif attracteur, par conséquent
l'alcène devient polarisée. Nous avons obtenu deux
régioisomères 5 et 6, dont
chaque régioisomère contient deux diastérioisomères
(5a, 5b) et
(6a, 6b). L'obtention du
régioisomère 5 est expliquée par l'effet
stérique du groupement phényle porté par la nitrone
1 et le groupement hydroxyle de l'alcène
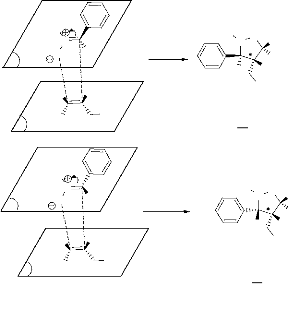
2. En effet, le rapprochement de l'alcène et de la
nitrone s'effectue par l'état de plus basse énergie (minimisation
des interactions des substituants). Les diastérioisomères sont
obtenus en tenant
compte de l'isomérie de la nitrone (schéma 3).
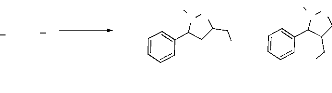
Ces produits ont le même Rf ce qui n'a pas permis leur séparation
par chromatographie sur colonne. On a pu identifier ces produits uniquement par
RMN H1 et RMN C13.
La réaction s'effectue selon le schéma
réactionnel suivant :
5a, 5b 5a,
5b
O
*
+
1
2
*
benzène
reflux, 24h
H3C
N
HO
H3C
N
O*
*
+
OH
- Schéma 2 -
3b
- Schéma 3 -
P
P
P
P
H
Hb H
OH
Ha
Hb H
OH
Ha
CH3 N O
H
N O
CH3
H3C
H3C
3a
trans
N O
H HaHb
N O
cis
H HaHb
H
H
OH
OH
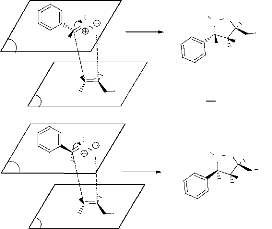
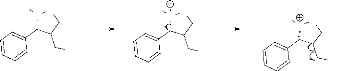
Le mécanisme d'obtention de ces produits est le suivant
:
H3C
N
O
O H
N
*
P
Hb
Ha
H3C
H
O
Hb
Ha
P
H3C
N
N
*
O H
OH
trans
4a
P
Hb H
OH
Ha
H3C
H
cis
4b
H
OH
P
Hb Ha
H
OH
- Schéma 4 -
H
Le spectre infra rouge montre :
- une bande à 3371 cm-1, due à la
vibration de valence de la liaison O-H - la bande de vibration de valence de la
liaison C=Carom à 1604 cm-1
- la bande de vibration de valence de C-O à 1275
cm-1 - la bande de vibration de valence de C-N à 1180
cm-1
- et la bande de vibration de valence de N-O à 1033
cm-1.
Dans l'analyse par spectroscopie de masse, le spectre de masse
n'indique pas la présence du pic de l'ion moléculaire mais des
fragments d'ions qui confirment la structure de la molécule.

Le schéma suivant montre l'explication de quelques
fragments de régioisomère 5 et
6.
- .OH
H3C
N O
m/z =176
H3C N O OH
H3C N O OH
H3C N O OH
-e
m/z =162
- CH2OH
H3C
N O
H3C N O OH
OH
OH
H3C N O
-e
H3C
N O
H3C
N O
m/z = 176
H3C
N O
OH
H3CN O
-é
H3C
N O
OH
OH
H3C
N O
OH

H3C
N O
m/z =162
- Schéma 5 -
L'analyse par spectroscopie RMN H1
précise d'une manière évidente, l'existence de deux
régioisomères 5 et 6. Quant
à l'identification de chaque diastérioisomère
(5a, 5b, 6a et
6b) par la RMN 1H,
ceci s'est avéré très difficile, ce qui a
nécessité l'emploi d'autres méthodes spectroscopiques plus
développées*.
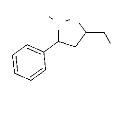
a. le Régioisomère 5 :
S,2.5
dd,7.28
dd,7.28
d,7.25
H
H
d,7.2
H
H
dd,4.4
H3C m,4.2
N O H OH
H Hdd,3.6
Hdd,3.7
d,7.2
H
H
Hm,1.12
m, 1.2
S, 2.12
5
Les protons des groupements méthylènes sur le C4
voient leurs signaux apparaître à 1.12 et 1.20 ppm sous la forme
de multiplet vers la région des champs forts. Le proton situé sur
le carbone C5 résonne sous forme de multiplet à 4.2 ppm. Ce
phénomène de déblindage est du à l'effet attracteur
des deux atomes d'oxygène voisins. Le signal du proton placé sur
le carbone 3 apparaît sous la forme de doublet de doublets à 4.4
ppm. Ceci est dû à la présence, sur le carbone voisin, de
l'atome d'azote. Les deux protons de CH2OH apparaissent
à 3.6 et 3.7 ppm, chacun sous la forme
de doublet de doublets et le proton de l'hydroxyle
résonne à 2.12 ppm (singulier). Les hydrogènes du
groupement méthyle ont leur signal à 2.5 ppm sous la forme d'un
singulier. Les protons du groupement phényle apparaissent comme suit
:
- Les protons en position ortho à 7.2 ppm.
- Les protons en position méta à 7.28 ppm.
- Les protons en position para à 7.25 ppm.
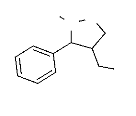
b. le Régioisomère 6 :
dd,7.22
S,2.5
H3C
H
d,7.40
dd,2.6
H H
2 dd,2.7
dd,2.7
H
N O
d,7.4
dd,3.5
H
H
Hdd.2.6
H
OH
S,2.12
H
m,2.
H
dd,7.22
H
dd,7
6
Les protons du groupe CH2OH et celles
situés sur C5 sont équivalents et résonnent à 2.6
et 2.7ppm sous la forme d'un doublet de doublets. Le proton en C4 voit son
signal apparaître à 2.2ppm. Le pic du proton, appartenant au C3,
apparaît à 3.5ppm sous la forme d'un doublet de doublet, le proton
de OH à 2.12ppm et les protons de CH3 à 2.5 ppm sous la forme
d'un singulier. Les protons du phényle apparaissent comme suit :
- Les protons en ortho à 7.40 ppm
- Les protons en méta à 7.22 ppm
- Les protons en para à 7.00 ppm.
L'analyse par spectroscopie de RMN 13C
indique aussi l'existence de ces régioisomères 5
et
6.
a.
Le Régioisomère 5 :
44.5
H3C
N O
65
129
128
138
60
74
35
OH
127
127
129
5
Le carbone C3 résonne à 60 ppm du à
l'effet de l'atome d'azote, et ce ci aussi pour C5 et CH2OH,
le C4 résonne à champs fort (plus loin par rapport aux autres
carbones) ; le CH3 résonne à 44.5ppm. Les
carbones du groupement phényle résonnent entre 127 et 129ppm, le
carbone 1résonne à champ faible (138ppm).
b. Le Régioisomère 6 :
44.5
H3C
N O
127
40
135
74
126
OH
124
76
127
6
77
124
Le carbone en position 3 résonne à champ fort
(pas d'effet électronique d'héteroatomes) les deux carbones
CH2OHet C5 résonnent dans le même champ (ils sont
presque équivalents) ; les carbones du noyau aromatique résonnent
entre 124 et 127ppm.
| 


