|

Nous adressons nos sincères remerciements à notre
promoteur Mr Maàmar Khaled qui a fait tous ce qui a pu pour nous
aider.
Nous remercions également les enseignants qui nous ont
aidé avec des explications Intéressantes comme :
Mr. Bekri Abdelkader.
Mr. Benachaiba Chellali.
Mr. Aissaoui.
Nous tenons à remercier encore tous les enseignants du
centre universitaire de Bechar qui ont participe à notre formation.
Finalement nous adressons nos salutations à toute la
promotion du 5eme année Electrotechnique 2006


?
,
???? ??? ????? ??? ???? ? ???? ??? ?????? ??????
??? ??? ??
, ????? ????? ??? ??? ??????
?????? ?? ???? ?????? ??? ??? ??? ????? ? ???? ??? ?? ????
. ?????? ?????? ?? ??? ????? ??? ?? ?? ? ??
????? ???????
?? ????? ??? ???? ?????? ?????? ??? ??? ???????? ????? ???
????
????? ??? ?????? ????? ???? ?????? ??? ????? ??? ???? ??????
.????? ?????? ???? ????? ?? ??????? ????? ???? ????
, ???????
??? ????? ?? ?? ???? ???? ??? ?????? ?? ?? ??? ????? ???
,?????? ??? , ???? , ????
, ????
, ? ?? ?????? ???? ??????? ???? ????
??? ?????? ?????? ?????? ?? ?? ??? ??????
...
????
, ?????
, ????
.??????? ?????? ?????
?????? ?? ?? ?? ???? ?????? ????? ????? ????? ??? ???? ?????
. ????? ??? ?????? ?? ?? ???? ?????? ???????
Introduction Générale 1
1)-Generalites sur les piles à
combustible
1.1)- Introduction 3
1.2)-Historique 3
1.3)- Principe de fonctionnement 5
1.4)- Constitution d'une pile à combustible 7
1.4.1)-L'électrolyte 8
1.4.2)-Les électrodes 8
1.4.3)-catalyseur 9
1.4.4)-Les plaques bipolaires 10
1.4.5)-Le reformeur 11
1.5)-Caractéristique électrique 12
1.5.1)-Tension de Nernst 12
1 .5.2)-Polarisation d'activation 14
1 .5.3)-Polarisation ohmique 14
1 .5.4)- Polarisation de concentration 14
1.6)-Différents types des piles 15
1 .6.1)-La pile alcaline (AFC) 16
1 .6.2)- Piles à membrane électrolyte
polymérique (PEMFC) 17
1 .6.3)- La pile à acide phosphorique (PAFC) 18
1 .6.4)- La pile à méthanol direct (DMFC) 19
1 .6.5)- La pile à oxyde solide (SOFC) 20
1 .6.6)- La pile à carbonates fondus (MCFC) 21
1.7)-Les applications des piles à combustible 22
1.8)-Architecture du système pile à combustible
25
1.9)-Les avantages et les inconvénients des piles à
combustibles 25
1.9.1)-Les avantages 25
1.9.2)-Les inconvénients 26
1.10)- Conclusion 26
2)-Modélisation statique de la pile à
combustible PEMFC
2.1)-Introduction 27
2.2)-Modélisation de la PEMFC 27
2.2.1)- Modèle de tension 28
2.3)-Dimensionnement du stack Pile à Combustible 33
2.3.1)-Détermination du nombre de cellules 33
2.3.2)-Détermination de la surface des cellules 34
2.4)-Caractéristique statique de la pile destinée
à l'application 35
2.4.1)-Caractéristique Tension/ courant et pression
35
2.4.2)-Caractéristique puissance / courant et pression
36
2.4.3)-Caractéristique Tension/courant et
Température 37
2.4.4)-Caractéristique puissance / courant et puissance
37
2.5)-Conclusion 38
3)-Modélisation dynamique de la pile à
combustible [PEMFC]
3.1)- Introduction 40
3.2)-Modélisation dynamique de la pile à
combustible 40
3.2.1)-Les hypothèses du modèle du coeur de la pile
40
3.2.1)-Expression de la tension du `stack' 41
3.2.2)-Calcul des pression partielles 41
3.2.3)-Résultat de la simulation et analyse 46
Fonctionnement à débit molaire constant 46
Fonctionnement à courant constant 48
3.3)-modélisation du système à pile à
combustible 50
3.3.1)-Modélisation du reformeur 50
3.3.2)-Modélisation des convertisseurs 51
3.3.3)-Analyse du Contrôle de la puissance Actif et
Réactif 53
3.4)-Résultat et analyse de la simulation du
système à pile à combustible 55
3.5)-Conclusion 63
Conclusion Générale 65
Introduction générale :
L'hydrogène constitue un vecteur
énergétique idéal pour remplacer à long terme les
énergies fossiles, d'autant qu'il est l'élément le plus
abondant de notre univers et qu'il est non toxique car sa combustion ne rejette
que de l'eau.
La pile à combustible est l'élément
électrochimique qui permet de convertir l'énergie de
l'hydrogène (H2) en électricité, en utilisant un
procédé électrochimique contrôlé (au lieu
d'une réaction thermique de combustion, dont le travail mécanique
engendré est ensuite converti en électricité).
Les piles à combustible sont présentées
comme l'énergie de demain, en parallèle avec l'hydrogène.
Pourtant, elles ne sont pas une technologie nouvelle, puisque leur principe de
fonctionnement a été découvert en 1839...
Il y a plusieurs facteurs qui poussent les pays
industrialisés à prendre le chemin des piles à
combustible.
L'un des facteurs déterminants de cette
évolution vient des problèmes climatiques et de la
nécessité de réduire les émissions de gaz à
effet de serre (notamment le CO2). On recherche des moyens de production
d'énergie moins polluants. On note ici l'empressement de l'union
européenne qui à décidé de réduire ses
émissions de gaz à effet de serre de 8 pourcents par rapport
à 1990 d'ici 2008, mais ils ne réalise que 2.9 pourcents à
la fin de l'année 2002, Les piles à combustibles tiennent la
solution de ce problème par ces applications dans Le domaine
transport.
Un autre facteur clé vient des réserves
limitées en énergies fossiles (pétrole, gaz naturel,
charbon) : les statistiques les plus pessimistes prévoient une
pénurie certaine vers 2050 pour les produits pétroliers donc
c'est le moment de penser à l'après pétrole. On ajoute que
L'utilisation de ces sources d'énergie engendre des effets secondaires
indésirables : émission de gaz à effet de serre dans le
cas des hydrocarbures, et production de déchets difficiles à
traiter dans le cas du nucléaire.
Dernier point enfin, les coupures d'électricité
en Italie, à Londres, aux Etats- Unis et même en Algérie en
2003 mettent en relief les faiblesses du réseau électrique et de
la production centralisée et mettent en valeur un moyen de production
plus délocalisé.
Ce travail est consacré à l'étude d'un
système énergétique à pile à
combustible destiné à une application
résidentielle.
Le premier chapitre présente l'état de l'art des
piles à combustible : son histoire, son principe de fonctionnement, sa
construction, ses types, ses applications, ses avantages et ses
inconvénients.
Le deuxième chapitre sera consacre à la
modélisation statique de la pile à combustible PEMFC. L'objectif
de cette partie est de présenter les caractéristiques de la pile
destinée à notre application (application résidentielle),
pour pouvoir réaliser des simulations globales sur de longs horizons de
temps.
.
Dans le troisième chapitre nous présenterons un
modèle dynamique de la pile à combustible PEMFC, avec
l'intégration du modèle du reformeur ainsi que le modèle
de l'onduleur. Le but est de mettre au plant un modèle globale pour la
simulation ainsi que la mise en place de la structure de commande des
convertisseurs statiques qui composent la chaîne.
1.1. Introduction :
Une pile à combustible est un générateur
qui convertit directement l'énergie interne d'un combustible en
énergie électrique, en utilisant un procédé
électrochimique contrôlé (au lieu d'une réaction
thermique de combustion, dont le travail mécanique engendré est
ensuite converti en électricité). Les rendements
théoriques attendus sont très élevés, et les sous
produits très peu polluants. Ces arguments, généralement
admis par l'ensemble de la communauté scientifique, en font une
alternative très probable au moteur thermique (essence, diesel), pour la
plupart de ses applications. Elle met en jeu, sans les mélanger un
combustible (hydrogène, méthanol, monoxyde de carbone ...) et un
comburant (généralement de l'oxygène pris dans l'air).
1.2. Historique :
En 1839 William GROVE décrit la première pile
à combustible. Elle fonctionne à l'hydrogène et à
l'oxygène, à basse température, avec des électrodes
de platine et de l'acide sulfurique comme électrolyte [1, 2].
Dans son expérience, il utilisait un tube en U avec
deux électrodes en platine. Grâce à un courant
électrique, il parvint à obtenir de l'hydrogène et de
l'oxygène: c'est ce que l'on appelle
l'électrolyse. Mais en coupant ce courant, il constata
que ces gaz donnaient lieu à un courant électrique de sens
inverse au premier.
Cependant, cette technique resta ensuite plus ou moins dans
l'oubli tandis que se développaient les machines thermiques, les
accumulateurs et les piles électriques. Pourtant des chercheurs
continuèrent de s'intéresser à cette technologie:
· En 1889, L. Mond et C. Langer introduisent les
catalyseurs (platine) et perfectionnent l'électrolyte,
· en 1921, E. Baur découvrant l'importance de la
cinétique et construit une cellule fonctionnant à haute
température (1000°C),
· Au début du siècle, l'électrolyte
est amélioré: introduction de nouveaux matériaux:
carbonates fondus, oxydes solides, acide phosphorique qui seront la base des
différents types des piles d'aujourd'hui.
Mais le progrès essentiel est marqué pour
Francis T. Bacon qui construit une pile avec un
électrolyte alcalin. Cette pile fonctionnait entre 80 et
2000.
On site une chronologie de développement des piles
à combustible :
+ 1839: Découverte de la pile à combustible par
WILLIAM grove. + 1945: les allemands et les russes débutent la
recherche.
+ 1960: Utilisation par la NASA pour alimenter les
fusées.
+ 1991: Commercialisation d'un moteur GPL fonctionnant au
méthanol
+ Novembre 1998: Grand système allemand de pile à
hydrogène et solaire (Evaluation du prototype).
+ Septembre 2000: La NASA lance une étude d'avions
à hydrogène, incluant des cellules de carburant.
+ Février 2001: Agence des nations unies lance le projet
d'autobus de cellule de carburant dans cinq pays en voie de
développement.
+ 2002-2003: bus équipé d'une pile à
combustible par Irisbus.
> Perspective future:
+ 2007-2008: la pile à combustible sera
compétitive sur le marché des autobus.
+ 2010: le surcoût de la pile à combustible sera
inférieur à 10% par rapport à un bus diesel. [9].
1.3. Principe de fonctionnement :
Une pile à combustible est un assemblage de cellules
élémentaires, en nombre suffisant pour assurer la production
électrochimique d'électricité dans les conditions de
tension et courant voulues. Chaque cellule est constituée de deux
compartiments différents alimentés chacun par les gaz
réactifs. Les deux électrodes, séparées par
l'électrolyte, complètent le dispositif. De façon
générale, le fonctionnement électrochimique d'une cellule
unitaire de pile à combustible peut se schématiser sous la forme
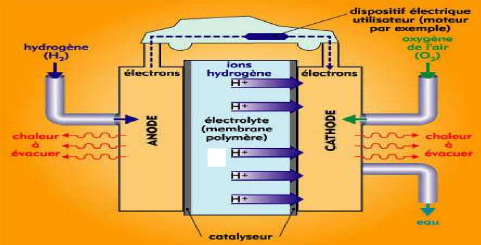
donnée dans la figure (1.2) [2, 3,4].
+
Figure (1.1): Principe de fonctionnement d'une
cellule ?? pile à combustible H2/O2 [1, 8].
Les électrodes sont exposées à un flux
de gaz qui fournit aux électrodes l'apport en carburant et en oxydant,
soit l'hydrogène et l'oxygène, respectivement. Les
électrodes doivent être perméables à ces gaz et
elles possèdent donc une structure poreuse. La structure et la
composition des électrodes peuvent être complexes et
requièrent donc d'être optimisées pour des applications
pratiques. L'électrolyte, pour sa part, doit posséder une
perméabilité aussi faible que possible aux gaz. Pour les piles
à combustible avec un électrolyte conducteur de protons (PEMFC),
l'hydrogène est oxydé à l'anode et les protons sont
transportés à travers l'électrolyte vers la cathode selon
la réaction suivante [1,2] :
2 H+ + 2 e- (1.1)
et à la cathode, l'oxygène est réduit selon
la réaction:
O2+4e- 2O-2 (1.2)
Les électrons circulent par le circuit externe durant ces
réactions. Une fois arrivés à la cathode, les protons se
recombinent avec les ions oxygène pour former de l'eau selon la
réaction:
2
1 O2 + 2 H+ + 2e- H2O (1.3)
Le bilan donne donc:
H2 + 1 O2 H2O + chaleur + électricité
(1.4)
2
Ces réactions d'oxydation de l'hydrogène
(à l'anode) et de réduction de l'oxygène (à la
cathode) s'effectuent à l'interface électrolyte/électrode
en présence d'un catalyseur (platine), en des points appelés
« points triples » figure (1.2) :
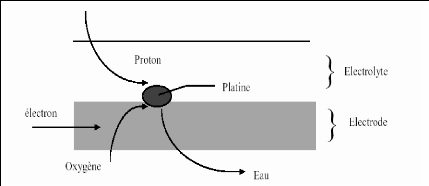
Figure (1.2): Schéma d'une zone active
de cellule de pile à combustible H2/O2 [1, 8].
En ces points, nous trouvons, autour de la particule de
catalyseur :
· Une continuité physique avec l'électrolyte
pour assurer la conduction des protons H+.
· Une continuité physique avec le conducteur
électronique qu'est l'électrode, pour assurer la conduction des
électrons eÎ.
· Une structure poreuse capable d'assurer la diffusion
de l'hydrogène ou de l'oxygène moléculaire.
· Une structure hydrophobe pour assurer
l'élimination de l'eau formée, dans le cas de la cathode.
· Une structure thermiquement conductrice pour assurer
l'évacuation de la chaleur de réaction.
· Nous pouvons ainsi apprécier la
difficulté de réalisation de cette interface qui
représente un point clé de la réalisation de l'ensemble
Electrode-Membrane-Electrode, appelé souvent EME.... [4]
1 .4. Constitution d'une pile à combustible :
Une pile à combustible est constituée d'un
empilement de cellules qui forment un `stack'. Ces cellules
élémentaires sont constituées de l'ensemble
électrode-membrane-électrode (EME) figure (1.3).

Figure (1.3) : `Stack' d'une pile à
combustible de type PEMFC [1, 8]
La figure suivante représente la structure d'une cellule
et d'un empilement.
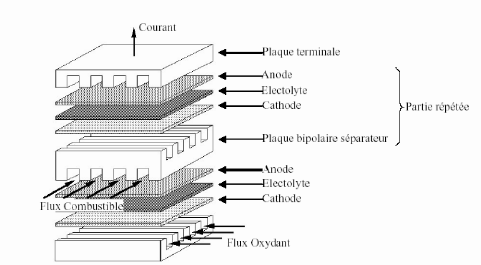
Figure (1.4) : Structure d'un empilement des
cellules PEMFC [Electro Encyclo] [4]
Cette figure met en évidence trois
éléments constitutifs d'une cellule : L'électrolyte (la
membrane dans le cas de la PEMFC), les électrodes (Anode, Cathode) et
les plaques.
1.4.1. L'électrolyte :
C'est l'élément principal de la pile a
combustible. Il permet que les espèces ioniques (et pas les
électrons) transitent de l'anode vers la cathode. Ces
électrolytes déterminent la température de fonctionnement
de la pile. Les caractéristiques de chaque type de pile sont leur
conductivité ionique, leur étanchéité aux gaz, leur
stabilité face aux réactifs chimiques et leurs
propriétés mécaniques. A cela s'ajoutent d'autres
contraintes selon le type de pile, le niveau de la température, les
composants des gaz, les espèces ioniques passant à travers
l'électrolyte ainsi que les conditions de pression. Les
différents types d'électrolyte seront traités sur chaque
type de pile [1,2]
1.4.2. Les électrodes :
Ils sont le siège des réactions
d'oxydoréduction, en plus ils ont une triple fonction:
· Supporter le catalyseur finement divisé et
permettre son contact avec les gaz.
· Permettre aux espèces protoniques de se
déplacer depuis les sites catalytiques d'oxydation de l'hydrogène
vers les sites où l'oxygène est réduit grâce
à la présence de polymère ionique.
· Evacuer les électrons des sites catalytiques
anodiques et redistribuer ces électrons sur les sites catalytiques
cathodiques [1, 2].
1.4.3. Catalyseur :
Le catalyseur est un métal utilisé pour
catalyser (accélérer) la réaction électrochimique
au niveau des électrodes, de plus, pour résister durablement la
corrosion (dissolution) dans cet environnement chimique très acide.
C'est pour cela, le métal le plus utilisé est du platine
(métal noble) pur ou allié à un élément de
transition (Cr, Mn, Ni, Co, Fe). [1, 2, 9]
-Les catalyseurs du coté anode :
Pour les piles de basse et moyenne température, on
utilise des métaux précieux: platine Pt, rhodium Rh,
ruthénium Ru ou palladium Pd; ou du Nickel de Raney. Les métaux
précieux sont répartis sur les électrodes en charbon actif
à très grande surface spécifique (noir
d'acétylène). Actuellement on utilise surtout du platine: celui
ci est réparti sous forme des particules de faible taille (2 nm).La
réaction de dissociation de l'hydrogène est assez complexe.
Ces électrodes sont très sensibles au CO (elles
ne supportent pas plus de 100 ppm) et au soufre, ce qui constitue un vrai
problème si on utilise de l'hydrogène issu du reformage: on
assiste alors à une diminution de la densité de courant
surfacique et donc de la puissance.
De nombreux travaux portent actuellement sur le remplacement
du platine jugé trop cher (80F/g) ou la diminution de la quantité
nécessaire: alliages de platine (Pt/Ru, Pt/Mb, Pt/Sn), terres rares...
Pour les piles de haute température, on peut utiliser des métaux
moins chers (Fer, Nickel, Cobalt) et on n'a pas de problème
d'empoisonnement au CO. [9]
- Les catalyseurs du côté cathode :
Pour les piles de basse et moyenne température, on
utilisera aussi des métaux précieux et certains métaux de
transition usuels (Chrome, Nickel), ou bien du charbon actif avec de l'or ou de
l'argent. Pour les piles de haute température, on peut utiliser soit du
Nickel fritté ou des oxydes mixtes. La réaction de
l'oxygène est aussi assez complexe.
Ces électrodes sont assemblées puis
collées de part et d'autre de la membrane par pressage à chaud.
L'ensemble électrode membrane électrode (EME) a une
épaisseur inférieure au millimètre. Cet ensemble EME est
intégré entre deux plaques bipolaires. [9]
1.4.4. Les plaques bipolaires :
Ces plaques sont accolées aux supports d'anode et de
cathode. Elles ont plusieurs rôles:
1)-Canaliser les gaz venant de l'extérieur, 2)-Collecter
les électrons (le courant),
3) Gérer les flux d'eau.
Généralement en graphite, ces plaques doivent
être conductrices du courant, mais aussi permettre une diffusion
homogène des gaz jusqu'aux électrodes ainsi qu'intervenir dans la
gestion de l'eau à évacuer ou à apporter pour humidifier
(pour les piles de type PEMFC). Elles doivent être résistantes aux
agressions du milieu (acide ou basique) et aussi être imperméables
aux gaz réagissant... [1,2, 9].

Figure (1.5) : Plaque bipolaire [1, 2]
La structure de ces ensembles est intéressante: des
canaux y sont gravés pour permettre le passage des réactifs.
Réalisées par usinage, elles sont très chères.
D'autres matériaux (inox, résines thermodurcissables) ou
méthodes de fabrication (emboutissage, thermocompression) permettant une
fabrication automatique sont à l'étude (les plaques bipolaires
à base de composites organiques, et les plaques bipolaires à base
de métaux et alliages).
A ces composants essentiels qui forment le coeur de la pile
s'ajoutera ensuite les auxiliaires nécessaires au bon fonctionnement. Il
s'agit des réservoirs pour le carburant et l'eau, du compresseur pour
l'air, de l'humidificateur, des pompes pour le carburant et l'eau, des
échangeurs de chaleur pour refroidir la pile, de l'onduleur pour
transformer le courant continu en sortie de pile. [1, 2]
1.4.5. Le reformeur :
L'hydrogène n'existant pas à l'état
naturel, il est nécessaire de le produire. C'est en effet le combustible
idéal pour toutes les piles, hormis les piles "haute température"
(MCFC, SOFC) qui peuvent aussi utiliser le CO et les DMFC qui fonctionnent au
méthanol.
Au niveau de la pile à combustible, on distingue les cas
suivants:
· la pile est alimentée directement par
hydrogène (produit en dehors du système par
vaporeformage (en général du gaz naturel), par oxydation
partielle, par électrolyse..., et stocké par exemple dans un
réservoir),
· l'hydrogène est produit au niveau du
"système pile" par reformage. On distingue alors:
· le reformage interne pour les MCFC et
SOFC qui aura lieu dans la pile elle-même,
· le reformage externe pour les PEMFC,
PAFC où il se produit dans un système séparé: le
système de reformage
Dans ce dernier cas, le principal auxiliaire est le
reformeur, qui permet à partir d'un composé
hydrocarboné (méthanol, éthanol, méthane, essence
....) d'air et/ou d'eau de produire un gaz riche en hydrogène. D'autres
organes sont nécessaires: dans le cas du reformage externe, le
combustible initial doit être purifié (présence de soufre)
et la teneur en CO du gaz arrivant à la pile doit être
extrêmement faible (surtout dans le cas des PEMFC qui
sont très sensibles au CO). Il faut aussi gérer les flux de
chaleur dans le système.
L'architecture diffère pour les piles "haute
température" (MCFC, SOFC): des combustibles comme le charbon peuvent
être utilisés: il faut donc le gazéifier, en revanche le
système de purification des gaz n'est plus nécessaire.
Le reformeur est le réacteur principal du
système de reformage: il est alimenté en carburant sous forme
gazeuse et ainsi que de l'eau ou de l'air. Cette réaction est
catalysée, ce qui donne lieu à d'importantes recherches sur le
meilleur catalyseur à utiliser selon le type de carburant et la
technique de reformage. Il existe en effet trois techniques de
reformage selon le mélange à l'entrée:
· le vaporeformage: le carburant
réagit avec l'eau,
· l'oxydation partielle: le carburant
réagit avec l'air,
· le reformage autotherme: le carburant
réagit avec l'eau et l'air. [9]
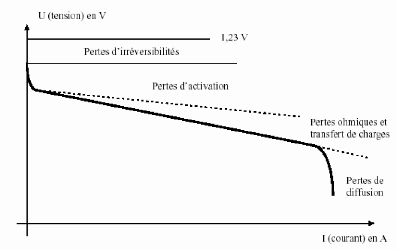
1.5. Caractéristique électrique :
La caractéristique électrique d'une pile
à combustible est déterminée par le nombre de cellules en
série, définissant la tension totale et par la taille de la
surface active, déterminant le courant délivré. Les
caractéristiques électriques d'une cellule de pile à
combustible basse température sont décrites à la Figure
(1.6). La tension à vide dite (tension de Nernst) est
d'environ 1,23 V. Lorsque la densité de courant augmente, les pertes
sont plus importantes (pertes d'activation et
ohmique) : la tension diminue. Pour de fortes densités de
courant, la tension chute rapidement (pertes de
concentration).
1.5.1. Tension de Nernst :
C'est le potentiel d'équilibre thermodynamique
définit en utilisant
l'équation de Nernst.
ÄG ÄS R T
.1
ENernst ref H 2 O 2
= + ( )
T T
- + +
[ln( )
P P
ln( )] (1.5)
2 . 2 .
F F 2 . F 2
Où
?G : est le changement d'énergie libre
(J/mol).
F : est la constante de faraday (96,487 C/Kmol).
?S : est le changement d'entropie (J/mol).
R : est la constante universel du gaz (8,3 14 J/K.mol).
PH2, PO2 : sont respectivement les pressions partielles
d'hydrogène et d'oxygène (atm).
T : indique la température de fonctionnement de
la pile (K).
Tref : est la température de
référence (K). [1, 2].
Figure (1.6) : Caractéristiques courant
- tension d'une pile à combustible [1,2]
En accord avec l'équation de Nernst pour la
réaction de l'hydrogène, le potentiel idéal d'une pile
à une température donnée peut être augmenté
en augmentant la pression des réactifs. Et on observe en effet des
améliorations dans les performances des piles à haute
pression.
Les pertes, appelées souvent polarisation, proviennent
principalement de trois sources: la polarisation d'activation, la polarisation
ohmique, et la polarisation de concentration. Ces pertes entraînent, pour
une pile de potentiel idéal ENernst, une chute de la
tension : V = Enernst - pertes.
1.5.2. Polarisation d'activation :
La polarisation d'activation est présentée quand
le taux d'une réaction électrochimique à la surface de
l'électrode est contrôlé par le ralentissement de la
cinétique pour cette électrode. En d'autres termes, la
polarisation d'activation est directement reliée au taux de la
réaction électrochimique. Dans les deux cas, pour qu'une
réaction chimique ou électrochimique puisse démarrer, les
réactifs doivent dépasser une barrière d'activation. Dans
le cas d'une réaction électrochimique les
pertes d'activation (çact) sont
supérieures à 50-100 mV. [1, 2]
1.5.3. Polarisation ohmique :
Les pertes ohmiques sont dues à la résistance
que rencontre le flux d'ions en traversant l'électrolyte et à la
résistance que rencontrent les électrons dans les
électrodes et le circuit électrique. Les pertes ohmiques sont
principalement dues à l'électrolyte et peuvent être
réduites en diminuant l'épaisseur de l'électrolyte et en
améliorant sa conductivité ionique. L'électrolyte et les
électrodes obéissant à la loi d'Ohm. [1, 2]
1.5.4. Polarisation de concentration :
Lorsque, à une électrode, il y a une perte de
potentiel dû à l'incapacité du système à
maintenir la concentration initiale des réactants, on a alors la
formation d'un gradient de concentration. De nombreux facteurs peuvent
contribuer à la polarisation de concentration: la faible diffusion du
gaz à travers les électrodes poreuses, la dissolution des
réactants ou des produits dans l'électrolyte, la diffusion des
réactifs ou des produits du site de la réaction vers
l'électrolyte ou l'inverse. A des densités de courants
élevées, la faible vitesse de transport des réactifs ou
des produits vers le site de la réaction est la contribution majeure
à la polarisation de concentration. [1,2]
1.6. Différents types des piles :
Les piles à combustible sont généralement
six types classifiés selon la nature d'électrolyte
utilisé, et leur température de fonctionnement, on distingue
alors les piles à basse température (<200°C) et les piles
à haute température (650- 100C°).Ces types sont :
V' -Les piles alcalines (AFC Akaline Fuel Cell) ;
V' -Les piles à membranes polymères
échangeuses de protons (PEMFC Proton Exchange Membranes Fuel Cell) ;
V' -Les piles au Méthanol direct (DMFC Direct Methnol Fuel
Cell) ;
V' -Les piles à acide phosphorique (PAFC Phosphoric
Acid Feul Cell) ; V' -Les piles à carbonates fondus (MCFC Molten
Carbonate Fuel Cell) ; V' -Les piles à oxydes solides (SOFC Solid Oxide
Fuel Cell).
Le Tableau (1.1) décrit les six grandes catégories,
leurs caractéristiques
techniques et leurs applications. [1,2, 9]
|
Type de pile
|
AFC PEMFC DMFC
|
PAFC MCFC SOFC
|
|
Gamme de
température
|
Basse température
|
Haute température
|
|
Nom
|
Alkalin Fuel Cell
|
Polymer Exchange Membran Fuel Cell
|
Direct Methanol Fuel cell
|
Phosphoric Acid Fuel
Cell
|
Molten Carbonate Fuel Cell
|
Solid Oxyd
Fuel Cell
|
|
Niveau de
température
|
60-80°C
|
60-100°C
|
60-100°C
|
180-220°C
|
600-660°C
|
700-1000°C
|
|
Electrolyte
|
Solution KOH
|
Membrane polymère conductrice de
protons
|
Membrane polymère conductrice de
protons
|
Acide phosphorique
|
Li2CO3 et
KCO3 fondu dans une
matrice LiAlO2
|
ZrO2 et Y2O3
|
|
Combustible
|
H2
|
H2 (pur ou
reformé)
|
Méthanol
|
H2 (pur ou
reformé)
|
H2 (pur ou
reformé)
|
H2 (pur ou
reformé)
|
|
Oxydants
|
O2 (pur)
|
Air
|
Air
|
Air
|
Air
|
Air
|
|
Gamme de
puissance
|
1wà100kw
|
1kw à 10Mw
|
1w à 10Mw
|
1w à
plusieurs kw
|
500kw à
10Mw
|
1kw à
100Mw
|
|
Rendement électrique
|
55-60%
|
35-45%
+75% en
cogénération
|
30 à 45%
|
|
50-60%
|
50-55%
75% en
cogénération
|
|
Ions dans
l'électrolyte
|
OH-
|
H+
|
H+
|
H+
|
CO32-
|
O2-
|
|
Domaines d'application
|
Spatial
|
Automobiles, Portable, Cogénération,
Maritime
|
Portable
|
Cogénération
|
Cogénération Production centralisée
d'électricité, Maritime (?)
|
Cogénération Production centralisée
d'électricité Automobile (APU), Maritime (?)
|
|
Niveau de
développement
|
Utilisée
|
Prototypes
|
Prototypes
|
Technologie mûre
|
Prototypes
|
Prototypes
|
Tableau (1.1): Description des six grandes
catégories des piles à combustible [1, 2, 4].
1.6.1. La pile alcaline (AFC) :
Les piles AFC ont l'avantage d'avoir le meilleur rendement de
toutes les piles à combustible, mais elles travaillent correctement
seulement en utilisant des gaz très purs ce qui est
considéré comme un inconvénient majeur pour de nombreuses
applications.
Utilisée depuis le début des années 1940,
cette pile se retrouve également à bord des vaisseaux spatiaux
habités de la NASA depuis les trentes dernières années.
Fonctionnant à des températures variant de 120 à
150°C, les réactions mises en jeu sont les suivantes:
à l'anode, avec un catalyseur au nickel ou au
platine-palladium, on a la réaction:
|
2 H2 + 4 HO-
|
|
4 H2O + 4 e-
|
|
et à la cathode, avec un catalyseur à l'oxyde de
nickel, à argent ou au platine-or, on a la réaction:
O2 + 4 e- + 2 H2O 4 HO-
Dans ce cas, l'électrolyte utilisé est une
solution de KOH (généralement en concentration de 30 à
40%), qui est un électrolyte conducteur d'hydroxyde (OH-).
Comparé aux piles à électrolyte acide, cet
électrolyte a l'avantage, d'accélérer la réduction
de l'oxygène, ce qui en fait un système intéressant pour
certaines applications spécifiques. L'électrolyte peut
réagir avec le dioxyde de carbone pour former un composé de
carbonate, ce qui réduit énormément le rendement de la
pile à combustible. En effet, le CO2 contenu dans l'air réagit
avec l'électrolyte dans la réaction suivante:
CO2 + 2 OH- ?(CO3)2-
Les catalyseurs sont habituellement une combinaison de nickel
et d'un métal inactif, comme l'aluminium, permettant ainsi de
réduire le coût global du système. Le magnésium
métallique ou des composés de graphite sont utilisés pour
les plaques bipolaires qui sont les connecteurs permettant de construire un
assemblage (ou stack) en reliant plusieurs piles en série. [1,2]
1.6.2. Piles à membrane électrolyte
polymérique (PEMFC) :
Ce type de pile a été mis au point pour les
missions spatiales Gemini de la NASA dans les années 1960, mais
fût ensuite vite remplacé par des AFC, faute de rendement
suffisant. Cette technologie a connu des progrès énormes dans les
années 1980, notamment avec l'arrivée de nouvelles membranes de
types Nafion (fabriquées par la société Dupont de
Nemours), permettant d'envisager le recours à
la technologie des piles à combustible pour la
généralisation des applications. La PEMFC fonctionne à une
température d'environ 80°C, de façon à maintenir
l'eau
à l'état liquide dans la membrane. Les
réactions suivantes se produisent: A l'anode, on a:
2 H2 4 H+ + 4 e-
et à la cathode, on a:
O2 + 4 H+ + 4 e-
·2
H2O .
L'électrolyte est une membrane polymérique mince
qui permet le passage des protons (H+). Un catalyseur à base
de platine est utilisé aux électrodes. Le monoxyde de carbone
peut être absorbé sur ce catalyseur s'il n'est pas
éliminé pendant le procédé de purification,
d'où une diminution de l'efficacité de la pile à
combustible. De nombreux centres de recherche sont à la recherche des
catalyseurs plus robustes et moins chers, et des électrolytes
polymériques échangeur d'ions plus efficaces et également
moins coûteux.
Les plaques bipolaires peuvent être faites à partir
des feuilles de graphite, de composites ou de métaux à base de
carbone. [1,2]
1.6.3. La pile à acide phosphorique (PAFC) :
La pile à combustible à acide phosphorique est
le système le plus avancé dans le développement et la
commercialisation. Elle est principalement utilisée pour des
applications stationnaires, en tant que générateur
électrique. Des centrales électriques de type PAFC ont
été installées dans différents endroits dans le
monde pour fournir de l'électricité, du chauffage et de l'eau
chaude à certains villages, usines ou hôpitaux.
Les avantages des PAFC sont sa facilité de fabrication,
sa stabilité thermique et chimique et la faible volatilité de
l'électrolyte aux températures de fonctionnement (entre 150 et
220°C). Ces facteurs ont facilité le développement
commercial de ce type de système. Les réactions qui se produisent
dans une PAFC sont les mêmes que dans le cas de la PEMFC, avec des
températures de fonctionnement variant de 180 à 220°C, on a
donc
à l'anode:

2 H2
4 H+ + 4 e-
et à la cathode:
O2 + 4 H+ + 4 e-
·2
H2O
Les composants de ces deux dernières piles à
combustible (PAFC et PEMFC) sont très semblables, sauf pour ce qui est
de l'électrolyte. Dans le cas de la PAFC,
l'électrolyte est de l'acide phosphorique (aussi un
électrolyte conducteur de protons), un liquide, alors qu'il s'agit d'un
polymère solide dans le cas de la PEMFC. Au début du
développement des PAFC, on a utilisé l'acide phosphorique en
solution afin de limiter la corrosion de certains constituants de la pile. Mais
avec les progrès faits dans les matériaux utilisés pour la
construction des piles, la concentration en acide est maintenant de 100%.
L'acide est généralement stabilisé dans une matrice
à base de SiC. La forte concentration en acide augmente la
conductivité de l'électrolyte et réduit la corrosion du
support des électrodes en carbone.
Comme dans le cas des PEMFC, cette pile utilise des
électrodes de carbone, avec un catalyseur à base de platine, qui
permettent la diffusion des gaz. Les plaques bipolaires sont deux plaques
poreuses séparées par une mince feuille de graphite pour former
un substrat côtelé dans lequel l'électrolyte peut
être stocké. On procède actuellement à l'essai
d'autres catalyseurs pour ce type de piles à combustible: fer-cobalt,
titane, chrome, zirconium. [1,2]
1.6.4. La pile à méthanol direct (DMFC)
:
Il ne faut pas confondre cette pile avec les piles qui
utilisent du méthanol (ou éthanol) comme source
d'hydrogène par le reformage externe (la pile à méthanol
indirect). La DMFC est une PEMFC utilisant du méthanol comme carburant,
le méthanol est alors directement en contact avec l'anode, à
laquelle les réactions suivantes se produisent (à des
températures de fonctionnement ne dépassant jamais
100°C):
A l'anode on a:
CH3OH + H2O
·6 H+ + 6 e- + CO2
et à la cathode on a:
O2 + 6 H+ + 6 e-
·6
H2O
Il est important de noter que dans une DMFC, ce sont les
protons qui se déplacent de l'anode à la cathode et non les
molécules de méthanol. Tout comme c'est le cas chez la PEMFC,
cette pile à combustible utilise un électrolyte
polymérique échangeur d'ions, cependant ces membranes ne sont pas
avantageuses pour bloquer le passage du méthanol. Le mouvement des
protons dans la membrane est associé à la teneur en eau de la
membrane. Le méthanol et l'eau ayant des propriétés
comparables (moment dipolaire), les molécules de méthanol sont
aussi bien transportés vers la cathode que les molécules d'eau
par un processus de drag
osmotique. A la cathode, le méthanol cause un
mélange de potentiels dus à l'interférence entre les
réactions d'oxydation du méthanol et de réduction de
l'oxygène. Cela a pour effet une baisse des performances de la pile. La
traversée du méthanol à travers la membrane dépend
de plusieurs facteurs, les plus importants étant la
perméabilité (et donc proportionnel à l'épaisseur)
de la membrane, la concentration en méthanol, la température de
fonctionnement, et les performances de l'anode elle-même. La membrane est
un facteur très important dans le problème de la traversée
du méthanol ; une membrane fine permet d'avoir une résistance de
la pile moins importante, mais elle tend à avoir une plus grande
perméabilité au méthanol. Une membrane épaisse est
donc avantageuse dans le cas des piles au méthanol.
Comme pour les PEMFC, les plaques bipolaires sont faites de
graphite, de métal ou de matériaux composites. Le catalyseur
à l'anode est composé d'un mélange de ruthénium et
de platine qui empêche l'empoisonnement par le monoxyde de carbone, qui
est l'intermédiaire dans la réaction. [1,2]
1.6.5. La pile à oxyde solide (SOFC) :
Le principe de fonctionnement des SOFC est basé sur le
mécanisme suivant: l'oxygène est dissocié à la
cathode en O2 -, puis l'anion migre à travers l'électrolyte
conducteur ionique à haute température et va se combiner à
l'anode avec l'hydrogène, ou le monoxyde de carbone, pour former de
l'eau et libérer des électrons. Les réactions mises en jeu
sont les suivantes:
A l'anode, avec un catalyseur au cermet de zirconium et nickel on
a la réaction: 2 H2 + 2 O2 - ?2 H2O + 4 e-
ou:
2 CO + 2 O2 - 2 CO2 + 4 e-
et à la cathode, dans les deux cas, à l'aide d'un
catalyseur au manganite de luthane dopé au strontium, on a la
réaction:
O2 + 4 e- ?2 O2-
La caractéristique principale des SOFC réside
donc dans leur haute température de fonctionnement (700 à 1 000
°C) nécessaire à l'obtention d'une conductivité
ionique suffisante de l'électrolyte céramique. Cette
température présente un double avantage. Elle permet d'abord
l'utilisation directe d'hydrocarbures, qui pourront être facilement
reformés en se passant de catalyseur à base des métaux
nobles. Elle produit d'autre part une chaleur élevée facilement
exploitable en cogénération, le rendement pouvant atteindre ainsi
80%. Mais elle
présente également un inconvénient, la
mise en température est longue et complique toute utilisation à
cycles courts et répétitifs (comme dans le cas des
transports).
Pour ces raisons, la technologie SOFC se prête
particulièrement bien à la production d'électricité
décentralisée et à la cogénération (domaines
couvrant des puissances allant de 1 kW à quelques dizaines de MW).
Grâce à son fort rendement et sa capacité potentielle
à fonctionner directement avec des hydrocarbures liquides, elle trouvera
également un débouché dans la propulsion navale, voire
terrestre (trains, camion...). La mise au point de ce type de pile implique, de
part cette haute température de fonctionnement, la résolution des
problèmes thermomécaniques de tenue des matériaux assez
complexes, ainsi que d'assemblage et d'étanchéité.
Une des particularités de la SOFC est son
électrolyte solide, habituellement du Zirconium (Zr2) dopé d'une
mole de 8 à 10% d'ytterbium (Y3+), lequel joue le rôle de
conducteur pour l'anion oxygène (O2 -). Les SOFC peuvent être de
conceptions plane, monolithique et tubulaire, et utiliser de l'acier
inoxydable, de l'acier austénitique, des matériaux
céramiques selon les températures de fonctionnement et
l'électrolyte désiré. [1,2]
1.6.6. La pile à carbonates fondus (MCFC) :
Le développement des piles à combustible
à carbonates fondus a débuté dans le milieu du
vingtième siècle. Les avantages et les inconvénients de ce
type de pile sont sensiblement les mêmes que dans le cas des SOFC. La
température élevée améliore
énormément la cinétique de la réaction de
réduction de l'oxygène et rend ainsi inutile l'utilisation des
métaux nobles comme catalyseurs. Les systèmes à base des
piles MCFC peuvent atteindre des rendements supérieurs à 50%,
voir supérieurs à 70% lorsqu'ils sont combinés à
d'autres générateurs. De plus, les MCFC peuvent utiliser une
large gamme de carburant (grâce au reformage interne), et ne sont pas
sensibles à la contamination par CO ou CO2 comme c'est le cas pour les
piles à basses températures. Les réactions ayant lieu dans
ce type des piles sont les suivantes:
A l'anode, avec un catalyseur fait d'un alliage nickel-chrome /
nickel-aluminium, on a la réaction:
2 H2 + 2 CO32- ?2 H2O + 2 CO2 + 4 e-
et à la cathode, avec un catalyseur d'oxyde de nickel, on
a:
O2 + 2 CO2 + 4 e- ? 2 CO32-
Ici, du dioxyde de carbone et de l'oxygène sont
consommés à la cathode et l'ion de carbonate (CO3 2-)
voyage de la cathode à l'anode.
L'électrolyte est fait d'un mélange de
carbonates de métaux alcalins (carbonates de lithium, de potassium et de
sodium) retenus par une matrice céramique d'oxyde d'aluminium et de
lithium (LiAlO2). Les plaques bipolaires sont faites d'acier inoxydable
recouvert de nickel du côté de l'anode. Le choix des
matériaux est extrêmement important, en raison de la nature
hautement corrosive de l'électrolyte et de la température de
fonctionnement très élevée. [1,2]
1.7. Les applications des piles à combustible
:
La pile à combustible peut être
considérée comme un générateur
d'électricité portable et autonome, si elle dispose de sa propre
réserve de combustible. Elle est donc très sérieusement
envisagée comme une candidate alternative aux moteurs thermiques dans la
plupart des modes de transports, terrestres ou maritimes.
Produisant électricité et chaleur à parts
sensiblement égales, suivant le type de pile (niveau de
température), une grande quantité d'applications en
cogénération sont considérées comme
réalistes, pour des cibles diverses, de l'habitat individuel à
tout type de bâtiment collectif ou tertiaire, sans oublier les sites
industriels. Au vu des très bons rendements électriques que l'on
peut obtenir, il peut même être envisagé, pour des
applications statiques, de ne récupérer que le courant produit,
notamment dans les zones où, pour des raisons de bruit et de pollution,
l'installation de tout autre générateur est exclue. Enfin, comme
la pile garde de très bons rendements même au niveau d'une seule
petite cellule, il n'est pas exclu de rêver à des micros
générateurs portables pour diverses applications exotiques (en
substitution des batteries plus ou moins limitées en capacités
volumique et massique). [1,2]
Nous présentons ici quatre principaux domaines
d'application :
Automobile : les véhicules
hybrides et les véhicules électriques ; les véhicules
particuliers et de golf, les bus (PEMFC, SOFC, AFC).
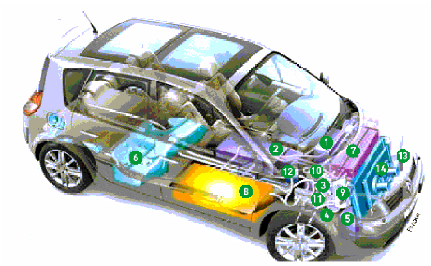
Figure (1.7) : Véhicule Scenic
équipe d'une pile à combustible et d'un système reformeur
d'essence [1, 2]
|
1-
|
batterie42V+convertisseur de tension.
|
8- Reformeur d'essence.
|
|
2-
|
Batterie de puissance.
|
9- Filtre à air.
|
|
3-
|
Onduleur.
|
10- Refroidisseur d'air comprime.
|
|
4-
|
Moteur électrique.
|
11- Ensemble turbine-compresseur.
|
|
|
12- Condenseur d'eau pure.
|
|
|
5-
|
Convertisseur 15KW.
|
|
|
|
13- Pompe à eau électrique.
|
|
6-
|
Réservoir d'essence.
|
|
|
|
14- Ensemble radiateur ventilateur.
|
|
7-
|
Pile à combustible.
|
|
Stationnaires :
génération de chaleur et d'électricité
(résidentiel, bâtiments publics type piscine, hôpital,
école, résidences, générateur de secours).le type
de pile le plus testé est PAFC, et aussi la PEMFC.

Figure (1.8) : Un système complet de
250 kW électrique Ballard [2]
Maritimes : Elles peuvent être
utilisées dans des petits bateaux à moteur et même dans des
sous marins. C'est une application relativement peu connue - et peu
médiatisée - des piles, mais qui pourrait connaître un
développement certain. Les piles les plus utilisées sont PEMFC,
MCFC.
Portables : téléphone,
ordinateur portable, caméra, matériel de camping ou militaire.
Les piles utilisées sont seulement PEMFC et DMFC à cause de leur
faible température de fonctionnement.

Figure (1.9) : Un système à pile
à combustible utilisé pour un téléphone portable
[2]
1.8. Architecture du système à pile
à combustible :
Le but de ce paragraphe est de décrire
brièvement les différents circuits (air, hydrogène, eau,
refroidissement, électrique) du groupe électrogène. Il
convient cependant de noter que ces circuits sont étroitement
couplés entre eux d'un point de vue thermique évidemment, mais
aussi hydraulique, par l'intermédiaire du circuit d'eau
d'humidification.
La figure 10 représente un groupe
électrogène à pile à combustible, qui fera l'objet
de notre travail d'un point de vue simplifier dans le chapitre 3.
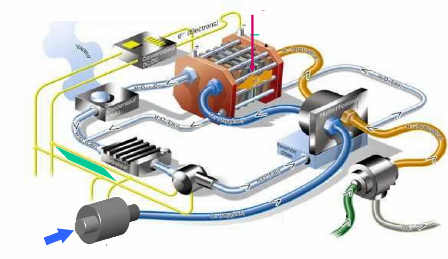
FC
DC/DC
Converter
Hydrogen
Compressor
Air
Fuel
Water
Condense
Humidificateu
Radiato
Pum
Reforme
Figure (1.10): Schéma fonctionnel d'un
groupe électrogène à pile à combustible [1].
1.9. Les avantages et les inconvénients des
piles à combustibles:
1.9.1. Les avantages :
Les piles à combustibles sont souvent
présentées comme la solution du futur dans les domaines de
production d'énergie électrique, de l'automobile. Cet attrait est
justifié par leurs nombreux avantages [9]:
· de hauts rendements énergétiques.
· de faibles émissions sonores.
· peu d'émissions (elles dépendent cependant
du combustible utilisé).
· elles sont de construction modulaire.
· diverses températures de fonctionnement.
· pas de parties rotatives.
1.9.2. Les inconvénients :
· Si les piles sont si intéressantes, pourquoi ne
les trouve-t-on pas sur le
marché? En fait, il reste de nombreux
points faibles qui sont à régler [9] :
· le coût.
· le poids et le volume.
· la durée de vie.
· la gestion thermique du module.
1.10. Conclusion :
Les piles à combustible, plus
généralement, la « filière hydrogène »,
est un moyen intéressant de valoriser l'énergie chimique contenue
dans divers combustibles, avec un très bon rendement, sous la forme
« noble » d'énergie électrique.
Les réactions électrochimiques en jeu ne produisent
pas d'émissions polluantes, et elles n'émettent ni bruit ni
odeur.
Déjà, de nombreuses installations fonctionnent,
et des programmes de recherche ambitieux tentent de développer de
nouvelles applications, notamment dans le domaine des transports et des
applications statiques (production d'énergie électrique,
cogénération).
Enfin, si les piles à combustible devenaient un jour un
produit de série pour les constructeurs automobiles (avec des puissances
embarquées de quelques dizaines de kW) à des prix compatibles
avec ce marché, la mise à disposition des particuliers de
générateurs individuels (quelques kW) pourrait concurrencer
grandement la connexion aux grands réseaux nationaux.
2.1 Introduction :
Dans ce chapitre on s'intéresse à la
modélisation statique de la pile à combustible PEMFC. Ce type de
pile retient notre attention pour trois raisons essentielles :
1) Sa température de fonctionnement relativement basse
laisse envisager une technologie simplifiée pour assurer un
démarrage rapide et une évacuation aisée de la chaleur
produite à température ambiante, ce premier point est essentiel
pour l'application résidentielle que nous traitons.
2) Elle est, ensuite, insensible à la présence de
CO2 dans l'air, contrairement à la filière alcaline.
3) Enfin elle est de technologie (tout solide) et donc peut
à la fois prétendre à des durées de vie
supérieures aux piles à électrolyte liquide (pas de
pièces mobiles au sein du convertisseur) ainsi qu'une industrialisation
plus aisée : ceci permet d'envisager un coup prospectif compatible avec
le marché visé, d'autant qu'elle offre une compacité
sensiblement supérieure à celle des autres filières. C'est
pour toutes ces raisons que nous avons choisi d'étudier l'utilisation
d'une pile PEMFC dans une application résidentielle.
Dans une pile à membrane échangeuse de protons,
le combustible brûlé est l'hydrogène et le comburant
l'oxygène, en général prélevé de l'air
ambiant, le produit de la réaction chimique étant l'eau.
L'hydrogène utilisé est soit, stocké dans des bouteilles
de gaz comprimé ou dans des hydrures métalliques, soit produit
par reformage à l'eau de différents combustibles : gaz naturel
(CH4), charbon, méthanol, propane, ...
2.2 Modélisation de la PEMFC :
Pour les piles à combustible avec un électrolyte
conducteur de protons (PEMFC), l'hydrogène est oxydé à
l'anode et les protons sont transportés à travers la membrane
vers la cathode selon la réaction:
H2 2 H+ + 2 e- (2.1)
Et à la cathode, l'oxygène est réduit selon
la réaction:
Les électrons circulent par le circuit externe durant
ces réactions. Une fois arrivés à la cathode, les protons
se recombinent avec les ions d'oxygène pour former de l'eau selon la
réaction:
|
H2 + 1/2 O2
|
|
H2O + chaleur + énergie électrique. [1,2]
(2.3)
|
|
2.2.1 Modèle de tension :
Il existe un grand nombre de modèles quasi statiques
pour décrire la réaction chimique présente dans une
cellule de pile à combustible. Dans le cadre de cette étude, le
modèle d'évolution de la tension choisi est issu des travaux
présentés par Amphlett [3].
Ce modèle est décrit en utilisant la combinaison
des lois élémentaires et des modèles empiriques. Dans le
développement des modèles élémentaires, les
transports de matière sont pris en compte via les équations de
Maxwell. Les potentiels d'équilibre thermodynamique sont définis
en utilisant l'équation de Nernst. Les surtensions d'activation sont
calculées par les équations de Tafel [3]. La résistance
interne est déterminée par les équations de Nernst-Planck
[4]. En utilisant la loi d'Ohm, nous pouvons exprimer la tension de cellule par
:
VFC = E Nernest - Vact - Vohm
- Vconc [3, 4] (2.4)
> Tension de Nernst :
ENernst dite tension réversible : est le
potentiel d'équilibre
thermodynamique définit en utilisant l'équation de
Nernst.
ÄG ÄS R T
.1 E ( )
- + +
[ln( ) ln( )] (2.5)
nerst ref H 2 O 2
= + T T P P
2 . 2 .
F F 2 . F 2
Où
?G : Est changement d'énergie libre (J/mol).
F : est la constante de faraday (96,487 C/Kmol).
?S : est le changement d'entropie (J/mol).
R : est la constante universel du gaz (8,3 14 J/K.mol).
PH2, PO2 : sont respectivement les pressions partielles
de hydrogène et l'oxygène (atm).
T : indique la température de fonctionnement de
la pile (K)
Tref : est la température de
référence (K)
En utilisant les valeurs standard de la température et de
la pression (SPT) L'équation peut être simplifier comme suit :
1
E T T P P
= - - + +
1,229 0 . 8 5 . 1 0 ( 29 8,1 5) 4,3 1 . 1 0 . .[ln( )
- -
3 5 ln( )] (2.6)
nerst H O
2 2
2
Il faut noté que la température de la membrane
et les pressions partielles du gaz varient en fonction du courant : avec
l'augmentation du courant les pressions d'hydrogène et de
l'oxygène diminuent, bien que la température augmente.
Les pertes, appelées souvent polarisation, proviennent
principalement de trois sources: la polarisation d'activation
(Vact), la polarisation ohmique (Vohm), et de la
polarisation de concentration (Vc onc). Ces pertes entraînent,
pour une pile de potentiel idéal ENernst, une chute
de la tension : V = ENernst - pertes [4].
> Polarisation d'activation (Charge transfert
kinetics) :
La polarisation d'activation est donnée par la relation de
Tafel [3] :
V T T Co I
= - î + î + î +
î
[ . . . ln( ) ln( )] (2.7)
act stack
1 2 3 2 4
Avec :
Istack est le courant de fonction de la pile, les î
représentent les
coefficients paramétriques pour chaque modèle de
pile, ces valeurs sont définies par des équations de la
thermodynamique et d'électrochimique dans [3], Co2 est la
concentration de l'oxygène dans l'interface du catalyseur de la cathode
donnée par la relation :
Po
Co -
= [7].
2
2 5,08. 1 0 . T
6 ( 498 / )
e
> Polarisation ohmique :
Les pertes ohmiques sont dues à la résistance
que rencontre le flux d'ions en traversant la membrane et à la
résistance que rencontrent les électrons dans les
électrodes et le circuit électrique. La membrane et les
électrodes obéissant à la loi d'Ohm, on peut exprimer les
pertes ohmiques par l'équation suivante:
Vohmic = Istack .(Rm +
R c ) (2.8)
Avec Rm est la résistance
équivalente de la membrane pour le flux d'électron, elle est
calculée par la relation :
.l (2.9)
R M
ñ
=
A
m
Où ñM est la résistivité
spécifique de la membrane pour le flux d'électron, A est
la surface active de la pile en (cm2), et l est la
largeur de la membrane en (cm).
Dans ce travail on a considéré que la membrane est
en Nafion
2
T I stack
.
303 A
1 8 1 ,6 . 1 0 .03 .
+
Istack +
A
0,062.
Istack 2,5
A
ñ = ...[3.7] (2.10)
ø
0,634
I
3 . . exp 4,1 8 .
stack
A
T - 303
-
T
> Polarisation de concentration (Mass Transport) :
La polarisation de concentration est donnée par la
relation suivante [3]:
|
Vcon B = - . ln 1
|
J
J max
|
|
(2.11)
|
Avec :
Jmax est la densité du courant limite
(A/cm2)
R T
.
B = Désigne la constante électrochimie
(V) [3, 7]
n F
.
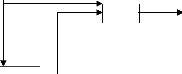
pH2
pO2
I
Pcell
X

Vcell = ENernst - V act + V ohm
+ V con
V cell

Figure 2.1 : modèle statique simplifie de
la pile à combustible (PEMFC)
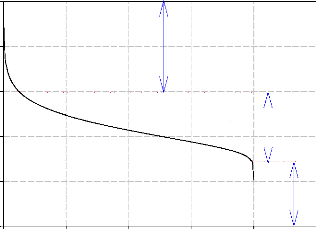
Cette loi de tension (2.4) permet de décrire la courbe
caractéristique tension/densité de courant d'une cellule de pile
à combustible PEMFC figure (2.2).
1.2
1.0
0.8
0.6
0.4
0.2
Zone I
Zone II
Zone III
0.0 0.5 1.0 1.5 2.0 2.5
Densité de courant J(A/m2)
Figure (2.2) : Caractéristique
Tension/Densité de courant (tension par cellule)
Nos résultats montrent que cette caractéristique
peut être décomposée en trois phénomènes
prépondérants en fonction de la valeur de la densité de
courant.
- La première zone représente la surtension
d'activation anode et cathode qui est le phénomène le plus
important pour les faibles densités de courant.
- La deuxième zone caractérise le comportement
ohmique de la cellule, c'est la zone la plus utilisée en fonctionnement
car elle est linéaire et elle est valable sur une forte plage de
variation de la densité de courant.
- La troisième zone liée à la polarisation
de concentration.
La puissance est définie comme le produit entre le
courant et la tension. Elle permet de décrire la courbe
Caractéristique densité de Puissance /Densité de courant
(par cellule)
0.0 0.5 1.0 1.5 2.0 2.5
densité de courant J(A/cm2)
Figure (2.3) : Caractéristique
densité de Puissance /Densité de courant (tension par cellule)
Les résultats obtenus sont conformes à ceux qui
sont obtenus par d'autres auteurs. A titre d'exemple nous présentons les
résultats donnés par Jérôme LACHAIZE
[4]. Qui a utilisé un modèle proche de ce
modèle pour comparaison (figure (2.2) et (2.3) avec (2.4) et (2.5))
consécutivement.
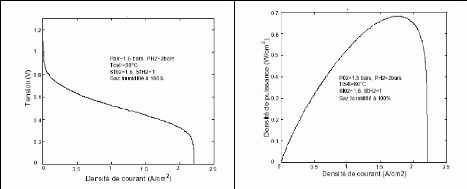
Figure (2.4) : Caractéristique
Tension/Densité de Figure (2.5) :
Caractéristique densité de Puissance /Densité
courant (tension par cellule) LACHAIZE [4] de
courant (tension par cellule) LACHAIZE [4]
2.3 Dimensionnement du stack Pile à Combustible
:
Le dimensionnement du stack consiste à
déterminer le nombre et la surface des cellules qui composent un stack
de pile à combustible. Ce dimensionnement doit tenir compte la puissance
nominale de la pile et la densité de courant que nous souhaitons
avoir.
2.3.1 Détermination du nombre de cellules :
La puissance électrique brute de l'empilement se calcule
par la relation suivante :
Ppile = N0.VFC.J.A
(2.12)
Ppile : Puissance électrique brute du stack
(W)
N0 : Nombre de cellules de l'empilement
VFc : Tension par cellule (V)
J : Densité de courant (A/m2)
A : Surface active des cellules (m2).
VFc et J : sont liées par la
caractéristique tension/courant de la pile, il reste donc trois
variables indépendantes à ajuster de façon à
obtenir la puissance souhaitée. Les contraintes liées à
l'application vont nous permettre de faire les choix nécessaires.
Il est intéressant d'avoir la tension Ustack =
N0.VFC la plus élevée et donc
le courant I=J.A le plus faible
possible car cela limite les pertes joule dans la cellule.
Pour satisfaire cette contrainte, il est possible :
· D'augmenter le nombre de cellules jusqu'à la
limite technologique actuelle.
· D'augmenter la tension par cellule, en diminuant la
densité de courant donc en augmentant la surface de cellule. Ce choix va
en outre dans le sens d'un bon rendement de pile.
Comme le montre la Figure (2.3), il est intéressant
d'avoir des densités de puissance élevées (pour
réduire l'encombrement et le coût/kW de la pile). Cela passe par
une faible surface de cellule, donc des densités de courant
élevées. Cette contrainte s'oppose à l'objectif d'avoir
une tension par cellule élevée. Une trop forte densité de
courant conduit de plus, à un rendement faible et donc à une
puissance thermique à évacuer élevée, ce qui posera
des problèmes pour le système. Une limite raisonnable pour la
densité de courant est de 0.6 A/cm2 ce qui correspond
à une tension de VFc=0.64V (Figure (2.2)), mais il
s'agit d'une valeur arbitraire qu'il faudrait valider par une étude
technico-économique.
Dans notre application La pile à combustible est
connectée à un système de production d'énergie
électrique pour une résidence dont la tension est de 240V. Ce qui
donne un nombre de cellules de :
N FC (2.13)
V 240
= = 340
U 0 . 7
2.3.2 Détermination de la surface des cellules :
Il est maintenant possible de déterminer les autres
paramètres de l'empilement :
A max
I
= . (2.15)
J
Dans notre application on va considérer que la puissance
utile maximale est de 40kW.
Ipac_max : Courant maximal correspondant à
Putile_max.
Donc :
40000
Imax = = A par mesure de sécurité nous
considérons que Imax=200 A
167
240
Se qui donnera A=333 cm2
2.4 Caractéristiques statiques de la pile
destinée à l'application :
L'objectif de cette partie est de présenter les
caractéristiques de la pile destinée de notre application
(application résidentielle), pour pouvoir réaliser des
simulations globales sur des longs horizons de temps.
Les valeurs des constantes physiques utilisées dans le
calcul numérique, sont données dans le tableau (2.1).
Paramètres
|
Valeurs
|
Paramètres
|
Valeurs
|
|
T
|
343K
|
æ1
|
-0.948
|
|
333 cm2
|
æ2
|
0.00286+0.0002.lnA+(4.3.10-5)lnCH2
|
|
178 jtm
|
æ3
|
7.6.10-5
|
|
1 atm
|
æ4
|
-1.93.10-4
|
|
1atm
|
W
|
23
|
|
0.016 V
|
Jmax
|
1500 mA/cm2
|
|
340
|
Jn
|
1.2 mA/cm2
|
|
0.0003 ~
|
N0
|
340
|
|
Tableau( 2.1) : constantes physiques
[3,4].
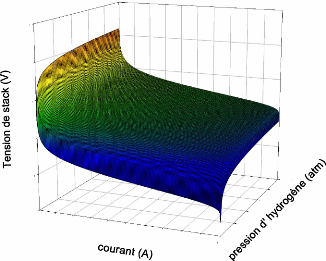
2.4.1Caractéristique Tension/ courant et pression :
Le résultat relatif à cette
caractéristique est présenté dans la figure (2.6). On
remarque que la tension diminue de (340 V jusqu' à 0 V) pour une
variation de courant de 0 A à 200 A. Cette dernière valeur du
courant représente le courant limite de la pile. On voit
également sur cette figure l'influence de la pression
(d'hydrogène) sur la tension. Pour des pressions faibles,
inférieures à 2 (atm) la tension augmente rapidement en fonction
de la pression. Contrairement Pour le cas des pressions supérieures
à cette valeur la caractéristique tension/pression est
saturée.
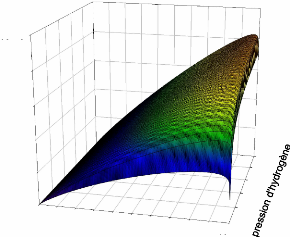
2.4.2Caractéristique puissance / courant et
pression :
La figure (2.7) montre la variation de la puissance de la
pile en fonction du courant et de la pression d'hydrogène. Cette figure
montre aussi que la puissance augmente de façon logarithmique en
fonction du courant jusqu à la puissance maximale (25 KW pour une
pression d'hydrogène de 2(atm)). Puis elle diminue rapidement pour des
courants supérieurs à 180 A.
500
400
300
200
100
10
8
6
0
4
20 40 6080 100120 140 160180 200
2
Figure (2.6) : Variation de la tension de la
pile en fonction du courant et de la pression d'hydrogène

50x103
40x103
30x103
20x103
10
10x103
8
6
4
20 40 60 80 100120 140 160 180 200
0
2
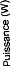
Figure (2.7) : Variation de la puissance de la
pile en fonction du courant et de la pression d'hydrogène
2.4.3Caractéristique Tension/courant et
Température :
Sur la figure (2.8) on a représenté la
variation de la tension de la pile en fonction du courant et de la pression
d'hydrogène simultanément. On remarque que la tension diminue en
fonction du courant en suivant la caractéristique tension par cellule
/densité de courant. On remarque aussi que cette caractéristique
est très sensible à la température (pour un courant de
100A une variation du température de 40 K produit une variation de 50V).
Ce ci nous entraîne à faire une régulation consistante de
la température.
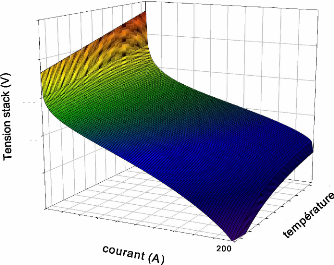
2.4.4Caractéristique puissance / courant et
puissance :
La variation de la puissance en fonction du courant et de la
température simultanément est présentée sur la
figure (2.9). Cette figure montre que la puissance de la pile est très
sensible à la température. De cet effet il faut très bien
choisir le point de fonctionnement de la température.
2.5 Conclusion :
Le modèle statique proposé dans ce chapitre
nous a permet de décrire : la courbe caractéristique
tension/densité de courant d'une cellule de pile à combustible
PEMFC, la courbe Caractéristique densité de Puissance
/Densité de courant (par cellule). Ce qui nous admis à faire
dimensionner la pile pour notre application résidentielle. Par la suite
nous avons donné la caractéristique statique de notre pile, en
tenant compte de l'influence de la pression et de la température. Cette
caractéristique montre que la tension et la puissance sont très
sensibles à la variation de la température et de la pression, ce
qui nous entraîne à faire des régulations afin de
stabiliser la tension de sortie pour la délivrer aux utilisateurs. Ces
régulations feront l'objet du chapitre suivant.
500
400
300
200
100
0
380 360
340
20 40 60 80 100 120 140 160 180
320
500
480
460
440
420
400
.
Figure (2.8) : Variation de la tension de la
pile en fonction du courant et de la température
30x1 03
25x1 03
20x1 03
15x1 03
10x1 03
5x1 03
0
204060801 00120140160180200
480 50 460
440
420
400
380
360
320340
0
Figure (2.9) : Variation de la puissance de la
pile en fonction du courant et de la température
3.1 Introduction :
Dans ce chapitre nous allons étudier
les
caractéristiques dynamiques de la pile
à combustible PEMFC. Qui feront l'objet de la modélisation et de
la commande d'un groupe électrogène à pile à
combustible, ainsi qu'une démarche pour réalisation des
simulations globales sur des longs horizons de temps.
Comme nous avons pu le constater dans le premier chapitre, le
générateur à pile à combustible est un
système complexe qui est composé de plusieurs actionneurs et sous
systèmes. L'utilisation de cette source d'énergie ne peut se
faire sans la mise en place de commandes appropriées.
3.2 Modélisation dynamique de la pile à
combustible :
La référence Mogos [5] fournit un modèle
dynamique du coeur de la pile (le `stack') utilisé pour analyser le
comportement d'un tel système en conditions normales de fonctionnement.
Ce modèle sera décrit dans ce paragraphe.
3.2.1 Les hypothèses du modèle du coeur de
la pile :
Quelques suppositions ont été faites à la
construction du modèle:
· Les gaz sont idéaux;
· Les canaux qui transportent les gaz le long des
électrodes ont un volume fixe mais leur longueur est petite. Cela nous
permet de considérer une seule valeur de la pression à
l'intérieur d'un canal ;
· La sortie d'un canal se fait via un seul orifice. Le
rapport entre les pressions à l'intérieur et à
l'extérieur du canal est assez grand pour pouvoir considérer
l'orifice comme étouffé ;
· La température est stable tout le temps;
· Les équations de la pile données dans le
chapitre 2 peuvent être appliquée pour déterminer la
tension aux bornes de la pile. [5]
3.2.1 Expression de la tension du `stack' :
En appliquant le modèle de la tension donné dans
le chapitre 2, la tension à la sortie du `stack' est calculée par
cette expression :
V cell = Enerst - V act -
Vohm - Vcon (3.1)
Où :
· N0 est le nombre de cellules élémentaires
connectées en série dans le
`stack'.
· ENernst est le potentiel d'équilibre
thermodynamique définit en utilisant l'équation de Nernst :
ÄG ÄS R T
.1
ENernst ref H 2 O 2
= + ( )
T T
- + +
[ln( )
P P
ln( )] (3.2)
2 . 2 .
F F 2 . F 2
· Vact est La polarisation d'activation est donnée
par la relation de Tafel [3] : V T T Co I
= - î + î + î +
î
[ . . . ln( ) ln( )] (3.3)
act stack
1 2 3 2 4
· Vohm décrit les pertes ohmiques dans le `stack'
:
Vohmic = Istack .(Rm +
R c ) (3.4)
· Vcon est la polarisation de concentration:
Vco
n B
= - . ln 1
3.2.2)-Calcul des pressions partielles :
Pour calculer les pressions partielles, chaque gaz individuel
a été considéré séparément et
l'équation des gaz idéaux a été appliquée
pour chacun. On donne ici l'exemple d'hydrogène :
PH 2 Van = n H 2 (3.6)
RT
Où
· Van est le volume de l'anode ;
· nH 2 est le nombre d'atome d'hydrogène
dans le canal de l'anode ;
· R est la constante universelle des gaz ((l.atm)/
(Kmol.K));
· T est la température absolue (K).
En isolant la pression et en appliquant la dérivée
a l'expression précédente on obtient :
d RT
( 2) =
P H q
V an
dt
H2 (3.7)
Où qH 2 est la dérivée de nH
2 et représente le débit molaire de l'hydrogène
[Kmol/s].
Il y a trois contributions pertinentes au débit molaire
de l'hydrogène :
· Le débit injecté à l'entrée
de la pileqH2 .
· Le débit de combustible qui participe à la
réaction chimiqueqr H2 .
out
· Le débit du combustible qui sort de la pile q
H2 .
q q q
H 2 H 2 H H
= - - q
(3.8)
(3.9)
in out r
2 2
Ainsi :
dt
d ( ) ( )
P H q q q
2 2 2 2
= - -
RT
Van H H H
in out r
Selon les relations de l'électrochimie, le débit
de l'hydrogène qui participe à la réaction peut être
calculé en fonction du courant traversant le 'stack' ir fc :

r
2
r fc
K i
r
q H
2
2
r
N i
= =
0 fc
F
(3.10)
Où: F
Kr 4
= est une constante définie afin de simplifier le
modèle [(Kmol)/ (s.A)].
N 0
En revenant au calcul de la pression partielle
d'hydrogène, il est possible d'écrire :
dt
dRT in
( ) (
P r
out
2 q q K i
= - - 2 )
H r fc
2 2
V an H H
(3.11)
out
On doit exprimer le débit molaire d'hydrogène qui
sort de l'anode qen
H2
fonction de sa pression à l'intérieur de
l'électrode p H2 .
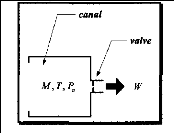
Pour cela on prend le cas général d'un orifice
considéré étouffé, alimenté avec une mixture
de gaz ayant la masse molaire moyenne M [Kg/Kmol] (figure (3.1)).
.Figure (3.1) : illustration [5]
Cet orifice (valve) présente la caractéristique
suivante pour une certaine valeur de la température T:

W = (3.12)
K M
Pu
Où:
· W : est le débit de mass (Kg/s) ;
· K : est la constante de la valve qui dépend en
principal de la surface
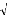
;
Kmol Kg
.
d'orifice ]
[
atm s
.
· Pu est la pression à l'intérieur
du canal (atm).
out
On peut donc, exprimer le débit molaire d'hydrogène
qui sort de l'anode q H2 en fonction de la pression à
l'intérieur d'électrode pH 2 par la relation:
q H = K P (3.13)
out
2 H 2 H 2
La relation (3.9) devient :
(
d

dt
|
(3.14)
) (3. 1 5)
|
|
RT in r
P 2 q K P K i
) ( 2
= - -
H r fc
2 2
2
V an H H H
|
)
|
Ce qui donne :
RT RT in
K
) ( 2
+ = -
H r
2
P P q K i
H R fc
2 2 2
V H
an an
V H
En appliquant la transformée de Laplace a
l'équation (3.15) on obtient:
1
KH2 ( 2
q K i
in r
H -
=
P 2 r fc
2
Van H
RT K H
[1+
) (3.16)
|
Van
En posant : K
ô =
H RT
2
H 2
|
il vient :
|
1
K
H -
H 2 ( 2 )
in
=
P q K i r
2 H R fc
2(3.17)
(1 )
+ ô s
H 2
Une opération similaire est faite pour l'oxygène,
on a obtient:
1
|
P r
K
O 2
O 2
= K i
2 + ô r fc
(1 )
s
O 2
|
(3.18)
|
Avec :
= [5]
V cath
O K
2
RT
ô
O2
La figure (3.2) représente le modèle dynamique du
coeur de la pile à combustible (PEMFC)
Vcell = ENernst - V act - Vohm
- Vconc
I
2Kr
Kr
+
qH2
qO2
+
x
Pcell
-
-
1
2
1+
KH
ô 2
H
1
2
1+
KO
ô 2
O
Vcell
Figure (3.2) : Modèle dynamique de la
pile à combustible PEMFC.
Les paramètres du modèle sont :
q H 2 : Le débit molaire de l'hydrogène
entrant, il est en (Kmol/s).
: Le débit molaire de l'oxygène entrant, il est en
(Kmol/s).
q O2
: La pression partielle de l'hydrogène, elle est en
(atm)
pH2
: La pression partielle de l'oxygène, elle est en
(atm).
p O2
: Constant molaire du modèle de l'hydrogène, il est
en (Kmol/atm.s).
KH 2
: Constant molaire du modèle de l'oxygène, il est
en (Kmol/atm.s).
kO2
N0 : Numéro des cellules élémentaires de la
pile.
I : Le courant de pile, il est en (A).
F : Le constant de Faraday, il est en (C/Kmol).
T : La température, elle est en (K).
ô H2 : Le constant de temps de l'hydrogène,
il est en (s).
ôO2 : Le constant de temps de l'oxygène, il est en
(s).
Vcell : La tension de sortie de la pile (continue), elle est en
(V). [5]
Les valeurs des constantes physiques utilisées dans la
simulation de la pile [PEMFC] sont données dans le tableau (3.1)
|
Paramètres
|
Valeurs
|
|
T
|
343K
|
|
F
|
9684600 C/Kmol
|
|
R
|
8314.47 j/Kmol.K
|
|
rH-O
|
1.168
|
|
Kr
|
0.996*10-6 Kmol/ (s.A)
|
|
KH 2
|
4.22*10-5 Kmol/ (s.A)
|
|
kO2
|
2.11*10-5 Kmol/(s.atm)
|
|
ô H 2
|
3.37 (s)
|
|
ôO2
|
6.74 (s)
|
Tableau (3.1) : Tableau des
paramètres.
3.2.3 Résultat de la simulation et analyse :
Dans cette partie nous avons traités deux modes de
fonctionnement de la pile avec débit molaire constant et avec courant
constant.
· Fonctionnement à débit
molaire constant :
Les figures suivantes représentent les résultats
relatifs à la simulation de la tension et la puissance dans le temps
d'une pile à combustible PEMFC avec le débit molaire
d`hydrogène et de l'oxygène constants.
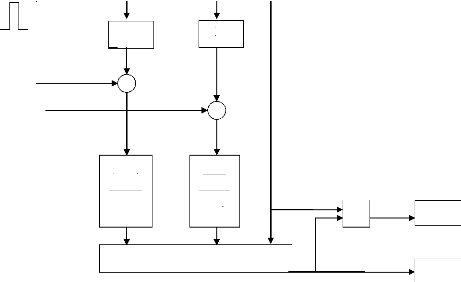
La figure (3.4) montre la réponse de la tension pour
une variation du courant (50 à 100A et de 100 à 50 A)
représenté sur la figure (3.3). On remarque que la tension
à un temps de réponse important de 20s.
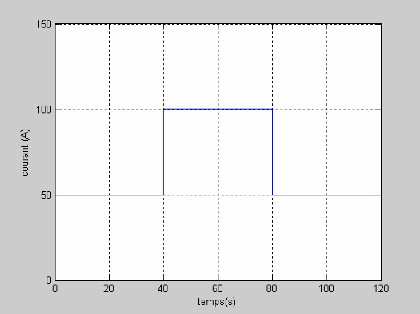
Figure (3.3) : Variation du courant de la pile
en fonction de temps
Figure (3.4) : Variation de la tension par
cellule en fonction du temps
Sur la figure (3.5) nous donnons la variation temporelle de la
puissance pour une variation du courant donnée dans la figure (3.3). On
constate que la puissance a un temps de réponse important de 20 s avec
des dépassements entre 15 à 20 %.
· Fonctionnement à courant constant
:
Les figures suivantes représentent les résultats
relatifs à la simulation de la tension et la puissance dans le temps
d'une pile à combustible PEMFC avec un courant dans la pile constant.
Les figures (3.7) et (3.8) représentent respectivement les
réponses temporelles de la tension et de la puissance, pour un
débit molaire variable dans le temps donné dans la figure (3.6).
On remarque ici que le temps de repense est de l'ordre 20 s ; et contrairement
au fonctionnement à débit molaire constant la puissance n'a pas
de dépassement.
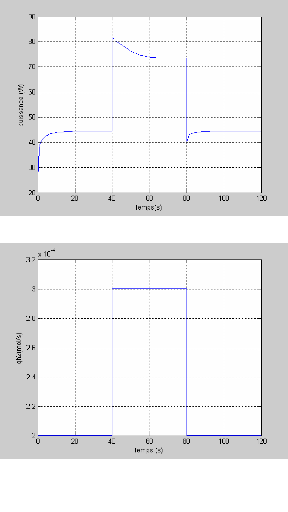
Figure (3.5) : Variation temporelle de la
puissance par cellule
Figure (3.6) : variation temporelle de
débit molaire.
54
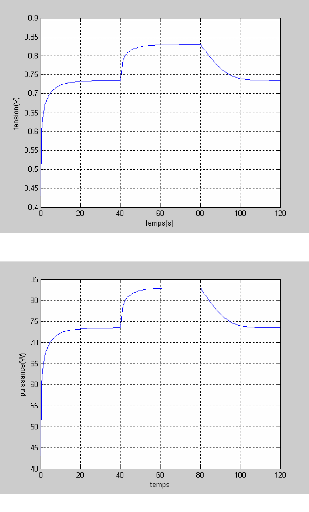
Figure (3.7) : Variation temporelle de la
tension par cellule
Figure (3.8) : variation de la puissance par
cellule en fonction du temps
3.3)-modélisation du système à
pile à combustible :
Dans cette partie nous allons donner un modèle simplifier
d'un système énergétique à pile à
combustible destiné à une application résidentielle.
3.3.1 Modélisation du reformeur :
D'après les essais chimiques, le modèle du
reformeur qui génère l'hydrogène à partir du
Méthane est obtenue comme une fonction de transfert du deuxième
ordre, la forme mathématique s'écrit comme suit[6] :

q H 2 =
2
1
q
mthane ô1ô2
CV
. ( 1 2 )
s + + +
ô ô S
(3.19)
Un correcteur intégrateur proportionnel et
dérivateur (PID) est utilisé Pour contrôler le débit
du Méthane d'après la puissance de sortie demandée de la
pile à combustible. Le reformeur et le contrôleur sont
illustrés dans la Figure (3.9), où U est le facteur de
l'utilisation du combustible. [6]
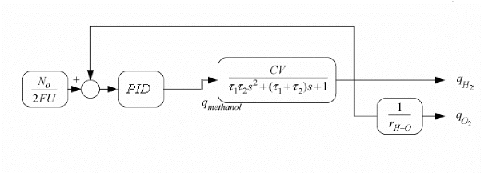
Figure. (3.9) : Modèle du reformeur.
[6]
3.3.2 Modélisation des convertisseurs :
Comme il est montré au paravent, la pile à
combustible est équipée d'un convertisseur DC/DC et d'un
convertisseur DC/AC pour transformer le signal de sortie en alternatif.
Dans ce modèle, uniquement un convertisseur DC/AC est
inclus pour les raisons suivantes :
La constante de temps des convertisseurs est de l'ordre des
microsecondes ou au
maximum de l'ordre des millisecondes. Par contre les
constantes de temps du
reformeur et du coeur de la pile sont de l'ordre des secondes.
Donc, d'une part la constante de temps du convertisseur sera d'effet
négligeable sur le temps de réponse total. D'une autre part
l'entrée de toutes les constantes de temps rend le modèle
très complexe.
Puisque l'opération est considérée
indépendante, le modèle du transformateur n'est pas inclus. Le
modèle simplifie de l'onduleur est donné dans la figure (3.10)
[6]
Figure (3.10) : Modèle de l'onduleur
[6].
La puissance et la tension de sortie sont contrôlées
par l'utilisation de l'indice de modulation `m' et l'angle de phase
`ä' de la tension alternative `V ac '.
Cette tension V ac s'écrit sous la forme :
Vac = m.V cell?ä
(3.20)
La puissance active peut se calculer par la relation :
mV.
P cell
ac = (3.21)
. sin( )
ä
X
De même la puissance réactive peut se calculer par
la formule suivante :
( . cell ) 2 - .
cell . S . co s(
ä )
m V m V V
Q = (3.22)
X
Le courant de charge est donné par l'équation
suivante :
It =
(3.23)
PL
)
V.cos(è S
Où :
Pl : est la puissance active de la charge
Le courant de la pile I se calcule par :
I m (3.24)
= . It . cos( è + ä )
Avec :
è : L'angle de phase de charge ;
X : La réactance de la ligne qui relie la pile avec la
charge ;
Un correcteur PI est utilisé pour contrôler l'indice
de modulation m, la fonction de transfert de ce dernier est donnée par
la relation :
|
m =
|
KK r
+ . S
5 6 V V
( -
S
|
ac
|
)
|
(3.25)
|
Ou :
K5, K6 : sont les gains du correcteur PI ;
Vr : La tension de référence.
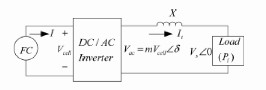
Le diagramme des blocs du convertisseur DC/AC avec le circuit de
la charge est représenté dans la figure. (3.11) [6]
Figure. (3.11) : diagramme de connexion du
convertisseur avec la charge [6].
3.3.3)-Analyse du Contrôle de la puissance Active et
Réactive:
Dans les générateurs synchrones traditionnels,
la quantité d'entrée de la vapeur à la turbine
contrôle la puissance active de la production du
générateur. Dans les machines synchrones, l'angle de la puissance
n'est pas mesuré, mais l'ajustement de l'angle de la puissance suit les
changements dans la vapeur d'entrée et la vitesse du rotor.
Dans la pile à combustible, il n'y a aucun
contrôle de la vitesse. Mais une ressemblance entre l'angle de phase
`ä' de la tension et le débit d'hydrogène. La
puissance peut être contrôlée comme suit :
La tension de la charge VS est considérée
constante, la tension alternative à la sortie du convertisseur
Vac est donnée par la relation (3.20), l'angle
ä contrôle l'écoulement de la puissance de la pile
à combustible vers la charge (relation (3.2 1).).
L'angle de la phase ä peut être
contrôlée en utilisant le débit molaire de l'entrée
d'hydrogène. L'expressionä, fournit le rapport entre la
production de puissance comme une quantité réglée, et la
quantité de débit d'entrée du combustible. Ce rapport est
décrit par les équations suivantes:
Pac = Pdc = Vcell I
(3.25)
La relation entre le débit molaire de l'hydrogène
et le courant de la pile est donnée par l'équation
électrochimie suivante :
q 2 N I
2 = (3.26)
0
H FU
A partir des équations (3.21), (3.25) et (3.26) on
déduit la formule de l'angle (ä) :
Sin (ä )= q
2 (3.27)
FUX
m V N H 2
s 0
Pour des angles de ä faibles : FUX
sinä =ä ä = q
2 (3.28)
m V N H 2
s 0
L'équation (3.28) décrit la relation entre
l'angle de phase de la tension de sortie et le débit molaire de
l'hydrogène. Les deux équations (3.21), (3.28) indiquent que
l'énergie active qui est en fonction de l'angle ä est
contrôlable à partir du débit molaire de
l'hydrogène.
Un scénario bien connu, quand la puissance de la
production d'un générateur synchrone augmente peut être
décrit comme suit:
L'opérateur augmente la quantité d'entrée
de la vapeur à la turbine qui cause une augmentation momentanée
dans la vitesse. L'augmentation de la vitesse cause un croissement de l'angle
de puissance ce qui augmente la puissance de la production.
Si le système est statiquement stable la vitesse va
revenir à la vitesse de synchronisme.
La quantité de vapeur peut être aussi
automatiquement contrôlé pour compenser la demande de la charge
terminale. En utilisant l'équation (3.28), un semblable scénario
peut être adopté pour contrôler la puissance de la
production de la pile, la seule différence est qu'il n'y a aucun
changement de la vitesse qui peut affecter la fréquence. Dans la pile
à combustible, la fréquence est arrangée à 50 Hz
par l'onduleur. Le débit de l'hydrogène peut être
contrôlé d'après la référence du
méthane manuellement ou automatiquement par le flux de la
réaction (figure (3.13)). Le flux de la réaction est
proportionnel à la charge terminale.
La puissance réactive dans un générateur
synchrone est accomplie par le contrôle de la tension de l'excitation.
Dans la pile à combustible, la puissance réactive peut être
contrôlée par l'indice de modulation m. [6]
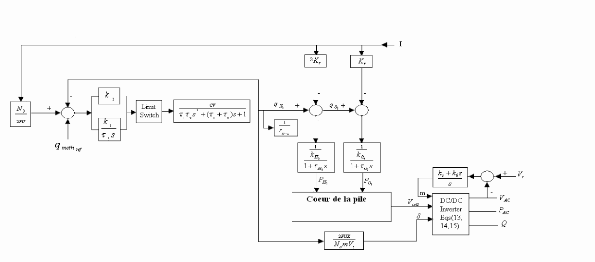
Figure (3.13) : modèle
général du système à pile à combustible
3.4 Résultats et analyses de la simulation du
système à pile à combustible :
Les paramètres du modèle sont donnés aux
tableau (3.2) .Ce modèle est étudié par des changements de
la charge présentés dans la figure (3.14). Ces changements
brusques dans la puissance active et réactive sont donnés pour
but d'étudier la réponse dynamique du système, et ne pas
pour représenter nécessairement les changements dans une charge
résidentielle. Le modèle de la charge est choisi pour
refléter toutes variations possibles de la puissance active et
réactive.
Les changements du courant, de la puissance active et
réactive, tension du `stack', les débits d'hydrogène et
d'oxygène et l'angle de phase sont illustrés dans les figures
(3.15-3.21).
La figure (3.16) représente la variation de la
puissance active de la pile Pac et de la charge Pch en fonction du temps. On
remarque que la puissance active de la pile Pac a bien suivit la puissance
active demandée par la charge Pch, avec un dépassement de
puissance acceptable, par contre la pile prend un temps important pour que sa
puissance atteindra la puissance demandée (pour que l'hydrogène
réagir). Donc il faut minimiser ce temps de réponse qui est
important afin de se stabiliser à la puissance demandée.
La figure (3.17) représente la variation de la
puissance réactive de la pile Qac et de la charge Qch en fonction du
temps. On remarque qu'à chaque variation de la puissance réactive
de la charge Qch, la puissance Qac suit instantanément cette variation
car le temps de réponse de l'onduleur est négligeable devant le
temps de réponse du système. On remarque aussi que la valeur de
la puissance délivrée est supérieure à celle qui
est demandée, ceci pour récupérer les pertes dues à
l'effet inductif de la ligne.
La figure (3.19) représente la variation du
débit molaire de l'hydrogène ainsi que de l'oxygène en
fonction du temps. Puisque le débit molaire contrôle la puissance
active demandée par la charge (comme il est illustré
précédemment), nous avons obtenu une variation semblable a celle
de la puissance.
Puisque l'angle de phase delta est en fonction du débit
molaire de l'hydrogène qH 2 (équation 3.2 8) et la
variation de ce dernier suit la variation de la
puissance active de la charge Pch, on remarque que la
variation de l'angle de phase `delta' est semblable à celle qui est
représentée dans la figure de la puissance active de la charge
Pch figure (3.20).
La figure (3.21) représente la variation de l'indice de
modulation `m'en fonction du temps. On remarque que l'indice change ses valeurs
afin d'assurer la puissance réactive demandée par la charge comme
il est illustré dans l'équation (3.22). L'allure de la variation
de l'indice de modulation n'est pas pareille avec la
variation de la puissance réactive demandée parce
qu'elle suit en plus la variation de delta.
|
Paramètres
|
Valeurs
|
Paramètres
|
Valeurs
|
|
T
|
343K
|
æ1
|
-0.948
|
|
A
|
333 cm2
|
æ2
|
0.00286+0.0002.lnA+(4.3.10-5)lnCH2
|
|
L
|
178 jtm
|
æ3
|
7.6.10-5
|
|
PH2
|
1 atm
|
æ4
|
-1.93.10-4
|
|
PO2
|
1atm
|
Ø
|
23
|
|
B
|
0.016 V
|
Jmax
|
1500 mA/cm2
|
|
RC
|
0.0003 Ç~
|
Jn
|
1.2 mA/cm2
|
|
T
|
343K
|
KH2
|
4.22*10-5 Kmol/(s.A)
|
|
F
|
9684600 C/Kmol
|
KO2
|
2.11*10-5 Kmol/(s.atm)
|
|
R
|
8314.47 j/Kmol.K
|
ô H 2
|
3.37 (s)
|
|
rH-O
|
1.168
|
ôO2
|
6.74 (s)
|
|
Kr
|
0.996*10-6 Kmol/
(s.A)
|
N0
|
340
|
Tableau (3.2) : paramètres du
modèle
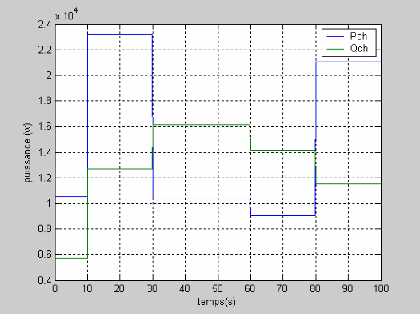
Figure (3.14) : variation temporelle de
puissance active et réactive de charge.
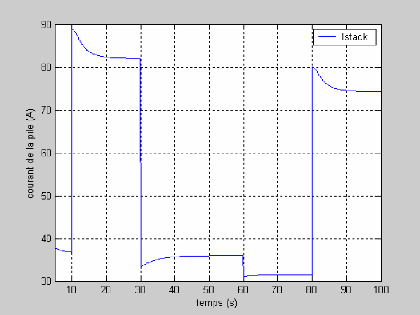
Figure (3.15) : Variation temporelle du
courant de la pile
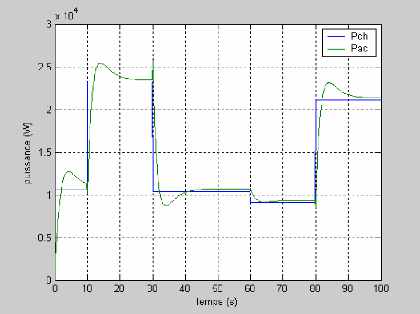
Figure (3.16) : Variation de la puissance
active en fonction du temps
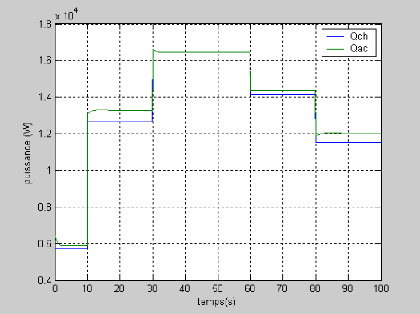
Figure (3.17) : Variation de la puissance
réactive en fonction du temps
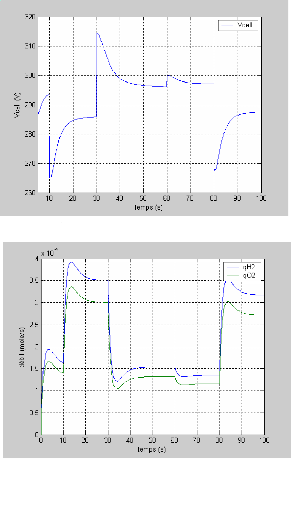
Figure (3.18) : Variation temporelle de la
tension de la pile
Figure (3.19) : Variation du débit
molaire d'hydrogène et d'oxygène en fonction du temps.
65
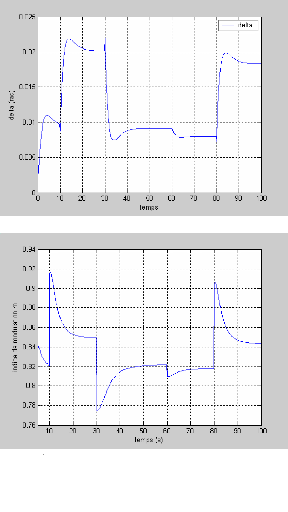
Figure (3.20) : Variation temporelle de l'angle
de phase de la tension
Figure (3.21) : Variation de l'indice de
modulation en fonction du temps.
La figure (3.20) représente la variation d'un rapport
entre la valeur réelle de la tension et la valeur de la tension
désirée. On remarque que le rapport entre eux est égal
à 1, c'est-à-dire que la pile a pu délivrer une tension
constante à travers une charge variable.
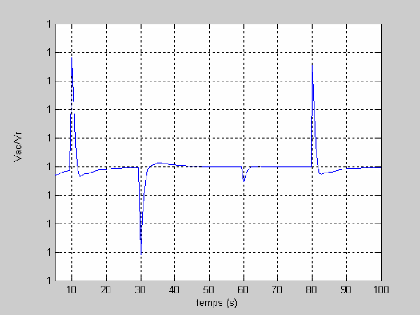
"
Figure (3.22) : Variation d u rapport
ac en fonction du temps.
"T
Nous modifiions maintenant les paramètres du correcteur
PID afin de minimiser le temps de réponse du système à
pile à combustible.
La figure (3.23) représente la nouvelle variation de la
puissance active demandée ainsi que la puissance active de la pile en
fonction du temps. La pile a réagit avec le changement de la puissance
demandée avec un temps de réponse minimale (acceptable), mais le
dépassement était très important (environ de 80 % de la
puissance nominale).
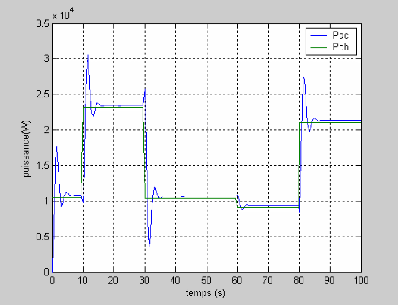
Figure (3.23) : Variation de la puissance
active en fonction du temps.
Les résultats obtenus sont conformes à ceux qui
sont obtenus par d'autres auteurs. A titre d'exemple nous présentons les
résultats relatifs à la réponse de la puissance active
donnés par M. Y. El-Sharkh, [6]. Qui a
utilisé un modèle proche de notre modèle, pour comparaison
(figure (2.24)).
Conclusion :
Dans ce chapitre nous avons présenté un
modèle dynamique pour un système énergétique
à pile à combustible, destiné à une application
résidentielle. Le modèle proposé inclut un modèle
de cellules, un modèle de reformeur de gaz, et une unité de
traitement de puissance.
Nous avons présenté un scénario pour
commander la puissance active et réactive de la pile. L'analyse est
basée sur des méthodes traditionnelles employées pour la
commande de la puissance d'un générateur synchrone.
Nos buts étaient d'assurer une tension constante, en plus
une puissance variable selon la demande de la charge. Nous avons pu maintenir
la tension de
sortie constante (240V), comme Nous avons pu délivrer
la puissance demandée par la charge. Le problème qui reste
à résoudre est d'assurer ces paramètres dans un temps plus
court et avec une valeur nominale proche à la valeur demandée.
Donc cette étude n'est pas complétée, il reste comme
perspective de trouver une technique fiable de régulation.
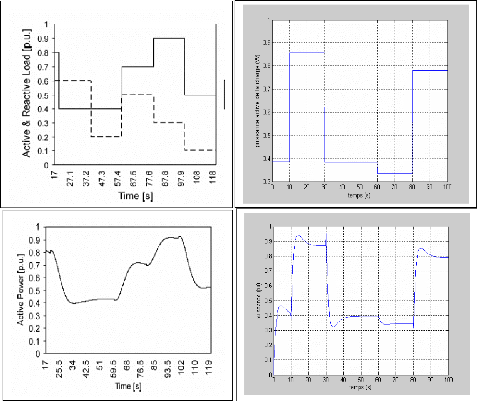
Figure 2.21 : comparaison des résultas
avec ceux de El-Sharkh, [6]
Conclusion générale et perspective :
Dans ce travail nous avons défini les piles à
combustibles, leur principe de fonctionnement, leurs avantages et leurs
problèmes, qui restent à résoudre. Notamment le
problème de coût qui a constitué des freins et des grands
challenges au développement des piles à combustible : Un
kilowatt-heure produit par une pile à combustible coûte
actuellement cinq à six fois plus cher que son équivalent fourni
par une technologie conventionnelle (turbine à gaz, centrale à
charbon..). Néanmoins, les prix baisseront naturellement avec
l'augmentation du volume du marché, lié à l'adaptation
progressive du grand public à ce procédé.
La modélisation statique d'une pile à
combustible de type PEMFC, nous a permis de décrire: la courbe
caractéristique tension/densité de courant d'une cellule ainsi
que la courbe Caractéristique densité de Puissance
/Densité de courant (par cellule). Ce qui nous admis à faire
dimensionner la pile pour notre application résidentielle, par la
détermination du nombre des cellules et de leurs surfaces.
Enfin, Nous avons réalisé un simulateur global
simplifier d'un système énergétique à pile à
combustible destiné à une application résidentielle.
L'analyse de la commande de puissance active et réactive de ce
système est basée sur des méthodes traditionnelles,
employées pour la commande d'un générateur synchrone.
A l'aide d'un correcteur PID au niveau du reformeur la pile a
pu délivrer une puissance selon la demande de la charge, avec une
tension à la sortie constante, mais le temps de réponse a
été important. Afin de résoudre ce problème, nous
avons modifié les paramètres du correcteur PID pour diminuer la
constante de temps du système. Le résultat obtenu a un
dépassement important. Donc il reste comme perspective de trouver une
stratégie de commande plus fiable.
| 


