2.2 Modélisation de la PEMFC :
Pour les piles à combustible avec un électrolyte
conducteur de protons (PEMFC), l'hydrogène est oxydé à
l'anode et les protons sont transportés à travers la membrane
vers la cathode selon la réaction:
H2 2 H+ + 2 e- (2.1)
Et à la cathode, l'oxygène est réduit selon
la réaction:
Les électrons circulent par le circuit externe durant
ces réactions. Une fois arrivés à la cathode, les protons
se recombinent avec les ions d'oxygène pour former de l'eau selon la
réaction:
|
H2 + 1/2 O2
|
|
H2O + chaleur + énergie électrique. [1,2]
(2.3)
|
|
2.2.1 Modèle de tension :
Il existe un grand nombre de modèles quasi statiques
pour décrire la réaction chimique présente dans une
cellule de pile à combustible. Dans le cadre de cette étude, le
modèle d'évolution de la tension choisi est issu des travaux
présentés par Amphlett [3].
Ce modèle est décrit en utilisant la combinaison
des lois élémentaires et des modèles empiriques. Dans le
développement des modèles élémentaires, les
transports de matière sont pris en compte via les équations de
Maxwell. Les potentiels d'équilibre thermodynamique sont définis
en utilisant l'équation de Nernst. Les surtensions d'activation sont
calculées par les équations de Tafel [3]. La résistance
interne est déterminée par les équations de Nernst-Planck
[4]. En utilisant la loi d'Ohm, nous pouvons exprimer la tension de cellule par
:
VFC = E Nernest - Vact - Vohm
- Vconc [3, 4] (2.4)
> Tension de Nernst :
ENernst dite tension réversible : est le
potentiel d'équilibre
thermodynamique définit en utilisant l'équation de
Nernst.
ÄG ÄS R T
.1 E ( )
- + +
[ln( ) ln( )] (2.5)
nerst ref H 2 O 2
= + T T P P
2 . 2 .
F F 2 . F 2
Où
?G : Est changement d'énergie libre (J/mol).
F : est la constante de faraday (96,487 C/Kmol).
?S : est le changement d'entropie (J/mol).
R : est la constante universel du gaz (8,3 14 J/K.mol).
PH2, PO2 : sont respectivement les pressions partielles
de hydrogène et l'oxygène (atm).
T : indique la température de fonctionnement de
la pile (K)
Tref : est la température de
référence (K)
En utilisant les valeurs standard de la température et de
la pression (SPT) L'équation peut être simplifier comme suit :
1
E T T P P
= - - + +
1,229 0 . 8 5 . 1 0 ( 29 8,1 5) 4,3 1 . 1 0 . .[ln( )
- -
3 5 ln( )] (2.6)
nerst H O
2 2
2
Il faut noté que la température de la membrane
et les pressions partielles du gaz varient en fonction du courant : avec
l'augmentation du courant les pressions d'hydrogène et de
l'oxygène diminuent, bien que la température augmente.
Les pertes, appelées souvent polarisation, proviennent
principalement de trois sources: la polarisation d'activation
(Vact), la polarisation ohmique (Vohm), et de la
polarisation de concentration (Vc onc). Ces pertes entraînent,
pour une pile de potentiel idéal ENernst, une chute
de la tension : V = ENernst - pertes [4].
> Polarisation d'activation (Charge transfert
kinetics) :
La polarisation d'activation est donnée par la relation de
Tafel [3] :
V T T Co I
= - î + î + î +
î
[ . . . ln( ) ln( )] (2.7)
act stack
1 2 3 2 4
Avec :
Istack est le courant de fonction de la pile, les î
représentent les
coefficients paramétriques pour chaque modèle de
pile, ces valeurs sont définies par des équations de la
thermodynamique et d'électrochimique dans [3], Co2 est la
concentration de l'oxygène dans l'interface du catalyseur de la cathode
donnée par la relation :
Po
Co -
= [7].
2
2 5,08. 1 0 . T
6 ( 498 / )
e
> Polarisation ohmique :
Les pertes ohmiques sont dues à la résistance
que rencontre le flux d'ions en traversant la membrane et à la
résistance que rencontrent les électrons dans les
électrodes et le circuit électrique. La membrane et les
électrodes obéissant à la loi d'Ohm, on peut exprimer les
pertes ohmiques par l'équation suivante:
Vohmic = Istack .(Rm +
R c ) (2.8)
Avec Rm est la résistance
équivalente de la membrane pour le flux d'électron, elle est
calculée par la relation :
.l (2.9)
R M
ñ
=
A
m
Où ñM est la résistivité
spécifique de la membrane pour le flux d'électron, A est
la surface active de la pile en (cm2), et l est la
largeur de la membrane en (cm).
Dans ce travail on a considéré que la membrane est
en Nafion
2
T I stack
.
303 A
1 8 1 ,6 . 1 0 .03 .
+
Istack +
A
0,062.
Istack 2,5
A
ñ = ...[3.7] (2.10)
ø
0,634
I
3 . . exp 4,1 8 .
stack
A
T - 303
-
T
> Polarisation de concentration (Mass Transport) :
La polarisation de concentration est donnée par la
relation suivante [3]:
|
Vcon B = - . ln 1
|
J
J max
|
|
(2.11)
|
Avec :
Jmax est la densité du courant limite
(A/cm2)
R T
.
B = Désigne la constante électrochimie
(V) [3, 7]
n F
.
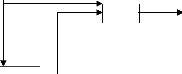
pH2
pO2
I
Pcell
X

Vcell = ENernst - V act + V ohm
+ V con
V cell

Figure 2.1 : modèle statique simplifie de
la pile à combustible (PEMFC)
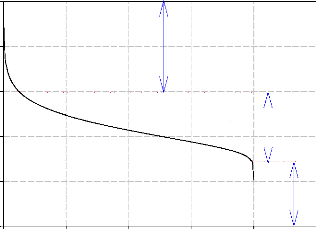
Cette loi de tension (2.4) permet de décrire la courbe
caractéristique tension/densité de courant d'une cellule de pile
à combustible PEMFC figure (2.2).
1.2
1.0
0.8
0.6
0.4
0.2
Zone I
Zone II
Zone III
0.0 0.5 1.0 1.5 2.0 2.5
Densité de courant J(A/m2)
Figure (2.2) : Caractéristique
Tension/Densité de courant (tension par cellule)
Nos résultats montrent que cette caractéristique
peut être décomposée en trois phénomènes
prépondérants en fonction de la valeur de la densité de
courant.
- La première zone représente la surtension
d'activation anode et cathode qui est le phénomène le plus
important pour les faibles densités de courant.
- La deuxième zone caractérise le comportement
ohmique de la cellule, c'est la zone la plus utilisée en fonctionnement
car elle est linéaire et elle est valable sur une forte plage de
variation de la densité de courant.
- La troisième zone liée à la polarisation
de concentration.
La puissance est définie comme le produit entre le
courant et la tension. Elle permet de décrire la courbe
Caractéristique densité de Puissance /Densité de courant
(par cellule)
0.0 0.5 1.0 1.5 2.0 2.5
densité de courant J(A/cm2)
Figure (2.3) : Caractéristique
densité de Puissance /Densité de courant (tension par cellule)
Les résultats obtenus sont conformes à ceux qui
sont obtenus par d'autres auteurs. A titre d'exemple nous présentons les
résultats donnés par Jérôme LACHAIZE
[4]. Qui a utilisé un modèle proche de ce
modèle pour comparaison (figure (2.2) et (2.3) avec (2.4) et (2.5))
consécutivement.
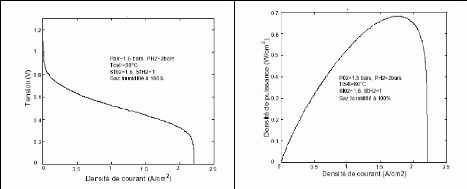
Figure (2.4) : Caractéristique
Tension/Densité de Figure (2.5) :
Caractéristique densité de Puissance /Densité
courant (tension par cellule) LACHAIZE [4] de
courant (tension par cellule) LACHAIZE [4]
| 


