|

1
RépubliqueTunisienne Ecole
Doctorale
Ministère de l'Enseignement Supérieur,
Sciences et Technologies
De la Recherche Scientifique Thèse
Et de la Technologie Génie
Biologique
N° d'ordre :
Université de Sfax
École Nationale d'Ingénieurs de
Sfax
Département de Génie
Biologique
THÈSE
Présentée pourl'obtention du grade
de
Docteur en Biologie
Par
Manel Hamza Karray
BIOCONVERSION ENZYMATIQUE DES COMPOSES
PHENOLIQUDES
DES EFFLUENTS ISSUS DE L'EXTRACTION
D'HUILE D'OLIVE : UNE VOIE PROMETTEUSE
DE VALORISATION
PAR LA PRODUCTION DE L'HYDROXYTYROSOL NATUREL.
Ce travail a été réalisé au
Laboratoire des Bioprocédés Environnementaux,
Centre de
Biotechnologie de Sfax.
Soutenue le devant la commission de jury composée
de :
Mr. : Président
Mr. : Rapporteur
Mr. : Rapporteur
Mr. : Examinateur
Mr. Sami SAYADI : Professeur au CBS Directeur de
thèse
valorisation au Centre de Biotechnologie de Sfax pour l'aide
qu'il a fournit
REMERCIMENTS
Ce travail qui a fait l'objet de cette thèse a
été réalisé au Laboratoire de
bioprocédés du Centre de Biotechnologie de Sfax.
Je tiens, tout d'abord, à exprimer ma haute
considération et mes remerciments au Monsieur le directeur de cette
thèse le Professeur Sayadi Sami, Directeur du Centre de
Biotechnologie Sfax et Directeur du Laboratoire des Bioprocédés
Environnementaux pour avoir dirigé ces travaux de thèse et pour
la dynamique qu'il a donné à ce travail. Je salue aussi la
souplesse et l'ouverture d'esprit de mon directeur de thèse qui a su me
laisser une large marge de liberté pour mener à bien ce travail
de recherche. Je lui suis particulièrement reconnaissante pour ces
conseils avisés et nécessaires. Je tiens également
à le remercier pour ses qualités scientifiques et
humaines.
Je tiens à exprimer ma reconnaissance à
Mme Dr Khoufi Sonia, maître assistant au Centre de
Biotechnologie Sfax, laboratoire de Bioprocédés Environnementaux,
pour sa gentillesse, pour toutes les discussions scientifiques que nous avons
eues ensemble, ses précieux conseils et pour son aide dans la correction
des publications. Merci aussi pour sa sérénité et pour
m'avoir souvent remonté le moral.
Je remercie le
Professeur............................d'avoir accepté de présider
le Jury de cette thèse, ainsi que pour sa gentillesse.
Je suis très sensible à l'honneur que m'ont
fait les Docteur...............et............en acceptant d'être les
rapporteurs de ce travail, et je les remercie pour leurs remarques
avisées.
Je tiens aussi de remercier Monsieur Ilem Hsaiiri
Directeur de l'unité de
pour la realisation de la fermentation et la bioconversion
à grande échelle. Qu'il trouve ici l'expression de mes sinceres
remerciements.
Mes remerciment s'adressent aussi à Monsieur Adel
Zitoun ingénieur à l'unité de valorisation au Centre de
Biotechnologie de Sfax, Kamel Mrad, Mohamed Amri, Nizar Elleuch et Haitham pour
leur aide et leur disponibilité.
Parmi tous les membres du laboratoire que j'ai pu
rencontrer, beaucoup sont partis, d'autres restent encore. Je tiens à
leur exprimer toute ma reconnaissance, pour leur aide, les discussions, et les
critiques qui m'ont permis de prendre du recul sur mon travail de thèse.
À tous, aux stagiaires, aux permanents, je vous exprime toute ma
reconnaissance pour avoir contribué à votre manière
à ce travail.
Qu'il me soit permis d'exprimer toute ma sympathie et mes
remerciements à tout le personnel du CBS et à tous les
enseignants de l'ENIS qui m'ont fait bénéficier de leurs
prestigieux enseignements.
Je clos enfin ces remerciements en dédiant cette
thèse de doctorat à ma famille que j'ai eu la chance d'avoir
à mes côtés, qui m'ont soutenu tout au long de ces
années de travail.
Abréviations
°C : Degré Celsius
A. : Aspergillus
BHT : butylated hydroxytoluéne
C : Carbone
Ca : Calcium
CLHP : Chromatographie liquide haute
pression
CMCase :
Carboxyméthylestérase
DMP : 2,6- diméthoxyphénol
DO : Densité optique
DPPH : 2,2-Di-Phenyl-1-Picryl Hydrazyl
DT : Dinar tunisien
g : Gramme
GRAS : Generally Recognized As
Safe
h : Heure
IC50 : la concentration du composé
à tester nécessaire à la
neutralisation du 50 % des radicaux libres de DPPH.
J : Jour
Jp : Flux du perméat
kDa : Kilodalton
KUI : KiloUnité International
L : Litre
LiP :Lignine Peroxydase
min : Minute
MnP :Manganése peroxydase
N : Azote
PNP : p-nitrophenol
PNPA : p-nitrophenyl
acétate
p-NPG :
p-nitrophenyl-â-D-glucopyranoside
V : Volume
rpm : Rotation par minute
ROS : Reactive Oxygen Species
SR : Sucres réducteurs
T. : Trametes
T. : Trichoderma
tr : Tour
UI : Unité internationale
â-glu : â-glucosidase
II-3-1 Propriétés de l'hydroxytyrosol 16
Sommaire
Introduction générale 1
Synthèse Bibliographique 4
Oléiculture 5
I- L'olivier 5
I-1 Origine et Histoire 5
I-2 L'olivier en Tunisie 5
I-3 Botanique de l'olivier 5
I-4 Culture de l'olivier 6
I-5 Intérêt économique en Tunisie 7
I-6 Les olives 8
II- Technologie d'extraction d'huile d'olives
8
II-1 Système discontinue de presse (dit classique) 9
II-2 Système continue à trois phases 9
II-3 Système continue à deux phases (dit
économique) 9
Les Margines 11
I- Introduction 11
II- Composition des margines 12
II-1 Produits phénoliques simples 13
II-2 Oleuropéine 14
II-2-1 Historique 14
II-2-2 Structure chimique de l'oleuropéine 14
II-2-3 Activité biologique de l'oleuropéine 15
II-2-4 Mode d'action de l'oleuropéine 16
II-3 Hydroxytyrosol 16
II-3-2 Synthèse de l'hydroxytyrosol 17
II-3-2 Les métabolites de l'hydroxytyrosol 17
III- Procédés de dépollution des
margines 18
IV. Différentes approches de valorisation des
margines 20
IV-1 Utilisation des margines comme fertilisant 21
IV-2 Production des protéines unicellulaires 21
IV-3 Production des enzymes pectinolytiques 21
IV-4 Application des margines dans la fabrication du compost
21
IV-5 Utilisation des margines comme source naturelle
d'antioxydants 22
Les Polyphénols 23
I- Introduction 23
II- Les différents types de polyphénols
23
II-1 Les acides phénoliques 24
II-2 Les flavonoïdes 24
II-3 Les tannins 24
II-4 La lignine 25
III- Les polyphénols de l'olivier 25
IV- Changement de la composition en polyphénols
durant la maturation de l'olive
26
V- Intérêts des polyphénols
26
V- 1 Vis-à-vis des plantes. 27
V-2 Vis-à-vis de l'homme 27
Les Antioxydants 29
I- Introduction 29
II- Les radicaux libres 29
II-1 Définition 29
II.2. Nature des radicaux libres 30
III- Dommages causés par les radicaux libres
31
III-1 Action sur l'ADN 31
III-2 Action sur les lipides 31
III-3 Action sur les glucides 32
III-3 Action sur les protéines 32
IV- Mécanisme d'action des antioxydants
32
V- Différents types d'antioxydants
34
V-1 Antioxydants synthétiques 34
V-2 Antioxydants naturels employés 35
VI- Sources végétales d'antioxydants
35
La Bioconversion 38
I- Introduction 38
II- Mode de production 38
II-1 Synthèse microbiologique 39
II-2 Synthèse enzymatique 39
III- Bioconversion des margines en produits utiles
40
IV- Bioconversion des composés
phénoliques 40
III-1 Bioconversion de l'oleuropéine par la
â-glucosidase thermophile immobilisée
recombinante de Sulfolobus solfataricus 41
III-2 Bioconversion de l'oleuropéine des olives 41
III-3 Bioconversion de l'oleuropéine d'huile d'olive
42
III-4 Bioconversion des sous produits de l'industrie
oléicole (grignon et margine) 42
III-5 Bioconversion des composés phénoliques de
blé 42
III-6 Bioconversion des composés phénoliques du
vin 43
Les Champignons 44
I-
I-5 Milieux de culture 58
Introduction 44
II- Classification des champignons 44
III- Aspergillus niger 45
III-1 Quelques enzymes produites par Aspergillus niger 47
III-1-1 Estérase 47
III-1-2 f3-Glucosidase 47
III-2 Applications biotechnologiques des estérases et
de f3-Glucosidase 47
III-2-1Applications biotechnologiques des estérases
47
III-2-2Applications biotechnologiques des f3-glucosidase
48
III-3 Immobilisation des f3-Glucosidases 48
IV- Trametes trogii 51
V- Trichoderma atroviride 51
Les techniques séparatives membranaires 52
I- Procédés de séparation
membranaire 52
II- Filtation tangentielle et frontale 53
III- Application des techniques séparatives
membranaires 53
Conclusion. 55
MATERIEL ET METHODES 56
I- Matériel 57
I-1 Appareillages 57
I-2 Produits chimiques 57
I-3 Substrats biologiques 58
I-3-1 Margine 58
I-3-2 Son de blé 58
I-4 Origine des champignons utilisés 58
I-5-1 Milieu liquide à base de son de blé pour
la production de f3-glucosidase à
partir d'une fermentation en erlenmeyer 58
I-5-2 Milieu liquide à base de son de blé pour la
préculture d'A. niger 58
I-5-3 Milieu liquide à base de son de blé pour la
fermentation d'A. niger pour la
production de f3-glucosidase 59
I-5-4 Milieu solide ME pour le repiquage et la conservation des
champignons 59
I-6 Conditions opératoires de la préculture d'A.
niger 59
I-7 Conditions opératoires de la culture d'A. niger 59
I-8 Chromatographie liquide à haute performance (CLHP)
59
I-9 Chromatographie liquide à haute performance
couplée à la spectrométrie de
masse (CLHP-SM) 60
I-10 Chromatographie phase gazeuse couplée à
la spectrométrie de masse (CPG-
SM) 60
II- Méthodes 61
II-1 Techniques de culture de champignons 61
II-1-1 Extraction des spores et culture de la souche
Aspergillus niger 61
II-1-2 Culture de la souche Trichoderma atroviride et de
la souche Trametes
trogii 61
II-2 Techniques de récupération des enzymes et
dosage de leurs activités 61
II-2-1 Préparation des enzymes 61
II-2-2 Dosage des activités enzymatiques 61
II-3 Bioconversion de la margine 64
II-3-1 Méthode de la biotransformation 64
II-3-2 Détermination du pH et de température
optimaux 64
II-3-3 Effet du volume de margine 64
II-3-4 Effet de la quantité de l'enzyme 64
II-3-S Effet de l'agitation 64
II-3-6 Cinétique de la bioconversion 64
II-3-7 Bioconversion à grande échelle 65
II-4 Techniques séparatives membranaires 65
II-4-1 Procédés de séparation 65
II-4-2 Mesure de séparation par performance membranaire
66
II-5 Concentration par évaporation 66
II-6 Extraction des composés phénoliques à
partir des margines 66
II-7 Analyse par Chromatographie liquide à haute
performance : CLHP 67
II.7.1. Analyse des monomères phénoliques 67
II-8 Détermination de l'activité antiradicalaire
67
II-8-1 Principe de la méthode 67
II-8-2 Mode opératoire 68
II-9 Analyse des protéines 68
II-9-1 Principe de la méthode 68
II-9-2 Mode opératoire 68
II-10 Détermination de la concentration des sucres
réducteurs 68
II-11 Détermination de la concentration des
ortho-diphénols totaux 69
II-12 Analyse par GC-MS 69
II-13 Détermination de la matière sèche (MS)
69
II-14 Dosage de glucose (méthode enzymatique GOD-PAP)
69
II-15 Estimation de la concentration en polyphénols des
margines 70
II-16 Immobilisation en Alginate de â-glucosidase 70
III. Caractérisation des margines brutes
71
Résultats et Discussion 74
I-Introduction 75
Chapitre I : 77
Optimisation de la production de â-glucosidase par
le champignon : Aspergillus
niger. 77
I- Optimisation des conditions et de la composition du
milieu de culture pour la
production de â-glucosidase par Aspergillus
niger 78
I-1 Optimisation des paramètres du procès de
production de f3-glucosidase 78
I-1-1 Effet du pH initial et de la température
78
I-1-2 Effet de la taille de l'inoculum et les
conditions de culture 79
I-2 Sélection du substrat pour la production de
f3-glucosidase 80
I-3 Sélection de la source d'azote pour la production de
f3-glucosidase 82
I-4 Effet du rapport C/N sur la production de f3-glucosidase
83
II- Résultats de la fermentation d'Aspergillus niger
sur le milieu de culture
optimisé 84
II-1 Enzymes produites durant la fermentation d'Aspergillus
niger dans le son
de blé 84
II-2 Caractérisation du jus de culture
d'Aspergillus niger 85
II-2-1 Evaluation de protéines et de sucre
réducteur dans le jus de fermentation 85
II-2-2 Evaluation des activités f3-glucosidase et
estérase dans le jus de fermentation 85
III- Caractérisation de la â-glucosidase
d'A. niger 87
III-1 Détermination de pH optimum 87
III-2 Détermination de la température optimale
88
IV- Production de â-glucosidase en fermenteur
89
IV-1 Procédé de la microfiltration tangentielle
pour la clarification de jus de
fermentation 90
IV-2- Procédé de la concentration du filtrat 91
IV-3- Effet de l'hydrolyse du son de blé sur la
fermentation 92
Chapitre II: 93
L'utilisation des enzymes hydrolytiques : une
méthode douce pour la
récupération de l'hydroxytyrosol à
partir des margines. 93
I. Mise en évidence de la bioconversion des margines
moyennant une réaction
enzymatique 94
III-7 Conclusion 123
I-1 Introduction 94
I-2 Hydrolyse enzymatique des margines par la culture d'A.
niger 94
I-2-1 Effet du substrat sur la biotransformation en
hydroxytytrosol 94
I-2-2 Identification au CLHP des produits obtenus
95
I-2-3 Identification au CG-SM des produits obtenus
98
I-2-4 Effet de la nature de biocatalyseur, le temps de la
réaction et le temps
d'incubation de culture d'A. niger sur la
biotransformation en hydroxytyrosol 99
I-3 Activité antioxydante 102
I-4 Conclusion 104
II. Les enzymes fongiques : un outil puissant pour enrichir
les margines en
antioxydants 104
II-1 Introduction 104
II-2 Production d'enzymes 105
II-3 Hydrolyse enzymatique des composés phénoliques
des margines 108
II-4 Effet antiradicalaire DPPH de l'extrait des margines 114
II-5 Conclusion 115
III- Optimisation du process de la bioconversion des
composés phénoliques des
margines 115
III-1 Introduction 115
III-2 Effet de la température sur la réaction de
bioconversion et sur l'activité f3-
glucosidase 116
III-3 Effet du pH sur la réaction de bioconversion et sur
l'activité f3- glucosidase.117
III-4 Effet du type de margine sur la libération de
l'hydroxytyrosol 118
III-5 Relation entre la production de l'hydroxytyrosol et la
concentration de f3-
glucosidase 120
III-6 Effet de l'agitation sur la réaction de
bioconversion 122
IV-Essai d'immobilisation de la â-glucosidase sur
l'alginate de calcium 124
IV-1 Introduction 124
IV-2 Effet de la concentration en alginate de calcium sur
l'activité â-glucosidase 124
V- Caractérisation des propriétés de
l'enzyme immobilisée 125
V-1 Introduction 125
V-2 Effet de la température et le pH sur l'enzyme
immobilisé 125
VI- Evaluation de la bioconversion par l'enzyme libre et
immobilisée 127
IV- Conclusion 128
Chapitre III: 130
Bioconversion des margine à grande
échelle. 130
I- Introduction 131
II- Essai de bioconversion des deux types de margine par
l'enzyme conservée131
II-1 Bioconversion de margine issue de huilerie super press
131
II-2 Bioconversion de margine issue de huilerie chaine continue
132
III- Essai de bioconversion des margines à
l'échelle pilote 132
II-1 Introduction 132
II-2 Bioconversion des margines issue de huilerie moderne chaine
continue à
l'échelle pilote 134
II-3 Bioconversion des margines issue de huilerie classique
super press à l'échelle
pilote 136
IV- Essai de la bioconversion des composés
phénoliques des margines à grande
échelle 137
V- Etude de la stabilité de l'hydroxytyrosol
produit 140
VI- Technologies de séparation de l'hydroxytyrosol
par membrane 142
VII- Caractérisation physico-chimique de
concentré ultime 147
VIII- Conclusion 149
CONCLUSION ET PERSPECTIVES 150
1
Introduction générale
Introduction générale
Les polyphénols sont des composés organiques
possédant au moins une fraction phénol dans leur structure
chimique. De nombreuses structures différentes existent, ils sont
subdivisés en différentes catégories qui sont les
flavonoïdes, les acides phénoliques, les lignanes, les
procyanidines et les tanins. Ils sont largement distribués dans les
fruits (pommes, kiwis, tomates, les baies et les raisins), les légumes
(par exemple, artichauts et poivrons), épices (par exemple, la curcumine
et la muscade), les boissons (par exemple, le thé, jus de fruits, vins
et chocolat) et différentes huiles (par exemple, d'olive, d'argan). Ils
sont connus pour leurs activités biologiques (par exemple, anti-VIH,
anti-athérosclérose, anti-cancer et anti-inflammatoires). Ils
sont de puissants antioxydants en fonction de leur capacité à i)
inactiver directement les radicaux libres, ii) inhiber la peroxydation
lipidique, iii) chélate de métal et iv) inhibent les enzymes
impliquées dans le stress oxydatif.
Parmi les sources intéressantes d'antioxydants
naturels, figurent les plantes. Les antioxydants extraits des
végétaux suscitent un grand intérêt dans les
domaines des industries alimentaires, cosmétiques et pharmaceutiques.
Depuis le début des années 1980, une recherche intensive de
molécules naturelles à activité antioxydante a
été menée. Les sources explorées sont en premier
lieu les épices, les plantes aromatiques et les condiments mais aussi
les huiles essentielles et les fruits.
Aliment ancestral du bassin méditerranéen,
l'huile d'olive voit sa production augmenter régulièrement, en
raison de la reconnaissance de sa haute valeur diététique.
Après le broyage de fruit d'olive et écart des parties solides
(grignons ou tourteaux d'olive) par pressage, la phase huileuse et la phase
aqueuse sont séparées et le résidu organique liquide,
appelé margines, est écarté. Ce sous-produit pose des
problèmes importants de pollution. La difficulté de traitement
des margines est due à leur forte concentration en charge polluante,
à leur grande toxicité pour la microflore et à leur
mauvaise biodégradabilité. La charge polluante en sortie
d'industrie oléicole est exceptionnelle : elle dépasse
généralement 120 g de DCO/l et peut atteindre 200 g DCO/l. La
toxicité de cet effluent est essentiellement due à sa haute
teneur en composés phénoliques, qui vont des monoaromatiques
jusqu'aux polyphénols de hauts poids moléculaires. Chaque
année, entre 20 et 35 millions de m3 de margines sont
produites autour du Bassin Méditerranéen. La majeure partie de
ces rejets liquides est traitée par collecte dans des bassins
d'évaporation aménagés à ciel ouvert. Dans ces
bassins, le
2
Introduction générale
processus de dégradation n'est que partiel, ce qui
entraîne l'accumulation et la concentration de la majeure partie de la
matière organique présente. Divers procédés ont
été testés pour le traitement des margines. Les
traitements physiques ou chimiques sont fondés sur la séparation
des constituants solubles et insolubles des margines et ne permettent de
traiter ultérieurement que la partie soluble. Les traitements
biologiques ou mixtes font appel à des microorganismes aérobies
et anaérobies. Certains micro-organismes aérobies
(bactéries ou champignons) dégradent en totalité les
composés polyaromatiques complexes et de hauts poids
moléculaires, comme les lignines, tannins et polyphénols des
margines. Toutefois, l'utilisation de dispositifs aérobies de
dépollution des margines se heurte au coût élevé de
la construction et de l'exploitation des installations, qui rend ces
procédés non rentables financièrement. Une alternative
à la dépollution complète est donc de réaliser une
dégradation partielle des margines par voie microbienne
(bactéries ou champignons), en respectant les structures aromatiques
présentes, ceci afin de biotransformer les structures polluantes en
composés d'intérêt industriel.
Les margines, par leur forte concentration en composés
polyaromatiques (de 2,5 à 20 g/l), constituent une source potentielle de
molécules ou de précurseurs de molécules à haute
valeur ajoutée et en particulier les ortho-diphénols. Ces
composés, de concentration 10 à 100 fois plus grande que celle
dans l'huile d'olive (Lesage-Meessen et al., 2001), sont connus pour leurs
propriétés antioxydantes et leur rôle
bénéfique dans la prévention de certaines maladies telles
que les maladies cardiovasculaires. Ces ortho-diphénols sont d'un
intérêt industriel majeur pour l'industrie agro-alimentaire qui
recherche des molécules naturelles pour remplacer les antioxydants de
synthèse. L'ortho-diphénol majoritaire des margines est
l'hydroxytyrosol. Ce produit `'noble» est réputé comme
étant un antioxydant très puissant. Il présente aussi une
large gamme d'activités biologiques en particulier les activités
antibactériennes, anti-inflammatoire et anti- hypertensive.
Pour les applications industrielles, la procédure de la
production d'hydroxytyrosol à partir des margines a été
développée durant ces dernières années (Allouche et
al., 2004 a). Une période de stockage des margines est nécessaire
pour la récupération de composés à haute valeur
ajoutée à partir de ces effluents. Certainement pour qu'une
fermentation spontanée aura lieu une longue durée de conservation
s'avère alors nécessaire dépassant parfois 100 jours (Feki
et al., 2006). Toutefois, la stabilité de l'hydroxytyrosol et
l'opposition à son oxydation et à sa dégradation fongique
et microbienne demande beaucoup de réflexion et de technicités
pratiques telles que par exemple la recherche de la concentration
d'éthanol à ajouter à ces effluents durant toute la
période d'enrichissement pour la stabilité de
3
Introduction générale
l'hydroxytyrosol converti. En effet, la recherche de nouvelles
techniques plus séduisantes franchissant à ces problèmes
sera alors obligatoire.
Le thème de notre étude s'incrit dans le cadre
de la recherche d'une méthode douce et non coûteuse
d'enrichissement des margines en terme d'hydroxytyrosol. Nous nous sommes
intéressés ainsi à la recherche de la méthode
optimale pour l'enrichissement des margines en hydroxytyrosol. La meilleure
conception de cette méthodologie proposée est que les
polyphénols contenus dans les margines peuvent être
modifiés au sein des margines moyennant leur bioconversion tout en
offrant un extrait riche en composés phénoliques simples. Ces
derniers, sont utiles pour les industries pharmaceutiques, alimentaires et
cosmétiques d'une part, et qui produisent un rejet pauvre en
polyphénols réduisant considérablement sa demande chimique
en oxygène (DCO) en d'autres termes.
Une source d'enzymes hydrolytiques sera alors utile pour
attaquer les polyphénols des margines. Pour cela, une étude
préliminaire de la souche Aspergillus niger a été
d'abord entreprise reposant sur l'optimisation des conditions de sa culture et
la composition de son milieu de production de â-glucosidase.
L'étude de la bioconversion des composés
phénoliques de la margine par différents champignons à
savoir Aspergillus niger, Trametes trogii et Trichoderma atroviride a
été par la suite entamée.
La bioconversion des composés phénoliques des
margines a été aussi optimiser en utilisant le jus de culture
d'A. niger dans le but d'améliorer au maximum le rendement de
libération de l'hydroxytyrsosol.
L'étude comparative de la bioconversion moyennant
différentes enzymes tels que la â-glucosidase pure et
l'estérase pure et d'autres enzymes commerciales a été
également effectuée.
Une étude ultérieure a reposée sur le
test de l'efficacité de l'immobilisation sur la bioconversion des
margines.
Une dernière partie de cette thèse a reposé
sur la bioconversion des margines à grande échelle et la
récupération de l'hydroxytyrosol par les techniques
séparatives membranaires.
4
Synthèse Bibliographique
5
Synthèse Bibliographique
Oléiculture
I- L'olivier
I-1 Origine et Histoire
L'olivier symbole de la paix, de la sagesse et de la
fécondité, est un arbre qui est connu depuis l'antiquité.
Son apparition et sa culture en Asie mineure remonteraient à plusieurs
millénaires. L'origine de l'olivier se perd dans la nuit des temps. Son
histoire se confond avec celle des civilisations qui ont vu le jour autour du
bassin Méditerranéen (Rayan et Robards, 1998). C'est ainsi que
l'on a retrouvé des fossiles de feuille d'olivier dans les gisements du
Pliocène de Mongardino (Italie), des restes fossilisés dans les
couches paléolithique supérieur en Afrique du Nord, des morceaux
d'oléastres et des noyaux dans les excavations de l'Enéolithique
en Espagne. Il en ressort que l'existence de l'olivier remonte au Xème
millénaire avant Jésus (Bitonti et al., 2000).
La culture de l'olivier en Tunisie date du
VIIIème siècle avant J.-C., avant même la
fondation de Carthage par la reine Didon. Les Phéniciens étaient
les pionniers de la culture de l'olivier en Afrique du Nord. A l'époque
des Carthaginois, une véritable culture de l'olivier avait
commencé à se répandre suite aux avantages accordés
aux paysans qui créaient des olivettes. Les Romains
développèrent davantage la culture de l'olivier en Tunisie et la
technique de l'extraction de l'huile comme en témoignent les fouilles
à Sbeïtla et El Jem ainsi que les nombreuses mosaïques
romaines découvertes à Sousse (Nefzaoui, 1991)
I-2 L'olivier en Tunisie
Le patrimoine oléicole tunisien compte près de
57 millions de pieds d'oliviers couvrants l'ensemble de territoire sur environ
1,620,000 hectares (30% des arbres terrestres) avec une dominance du
gouvernorat de Sfax (COI, 2000). De plus, 15 millions d'oliviers couvrants
800,000 ha sont plantés à une densité de 17 arbres/ha.
Cette plantation est cultivée sous des conditions climatiques
semi-arides et arides et dans des sols très pauvres (Braham, 1997).
I-3 Botanique de l'olivier
L'olivier (Olea) fait partie de la famille des
oléacées, tout comme le frêne, le jasmin, le troène,
le lilas et le forsythia, qui sont quelques uns des 25 genres composant cette
famille.
6
Synthèse Bibliographique
Le genre Olea est lui même composé d'une
trentaine d'espèces qui sont répandues sur les cinq continents,
mais l'Olea Europea est l'espèce la plus
représentée et se trouve partout dans le bassin de la
Méditerranée.
Si l'olivier, dans des conditions de culture normales, est
généralement improductif de sa 1ère à sa
12ème année, il commence à produire de sa
12éme à sa 50ème année et il
est dans la plénitude de sa capacité de production de sa
50ème à sa 150ème année, un
âge après lequel il ne rend normalement plus même si
certains oliviers peuvent atteindre 300 à 400 ans. La mise en fruits
initiale peut cependant se produire plus tôt, vers la
5ème année, si les conditions de culture sont
particulièrement favorables parce que l'olivier fait l'objet de soins
intensifs (irrigation, fumure, taille).
Le tronc de l'olivier est gris noir, strié et souvent
noueux et crevassé : il est tout à fait caractéristique de
cet arbre qui a souvent un aspect particulièrement torturé
lorsque l'olivier est ancien. Son bois est recherché pour sa
résistance et pour la finesse de son grain et maints ustensiles en sont
faits: saladiers, coupelles diverses, plateaux à fromage, tire-bouchons,
manches de couteaux, etc.
Les feuilles de l'arbre sont, elles aussi,
particulièrement caractéristiques : vert foncé sur le
dessus et vert argenté sur la face inférieure, elles se
renouvellent tous les trois ans.
L'arbre peut atteindre 3 à 5 mètres de hauteur
et même, lorsqu'il est laissé à l'état sauvage, 12
mètres et plus, avec une circonférence de 10 à 12
mètres. Certains auteurs (Loussert et Brousse, 1978) font même
état d'arbres, vus en Afrique du Nord, qui atteignent des hauteurs de 15
à 20 mètres avec un diamètre de 1,5 à 2
mètres car livrés à eux même dans des conditions
naturelles où l'homme n'intervient pas pour contrôler leur taille.
Sauf à être taillé dans ce but et à être
entretenu, l'olivier, livré à lui même, ne donne
normalement de fruits qu'une année sur deux; il produit, en moyenne, de
15 à 50 kilos d'olives et, comme il faut de 5 à 6 kilos d'olives
pour fabriquer un litre d'huile, chaque arbre permet, normalement, d'obtenir de
3 à 10 litres d'huile d'olives, selon les variétés.
Aujourd'hui, même si les soins apportés à sa culture
permettent une récolte chaque année, les rendements demeurent
irréguliers et les volumes de production très variables d'une
année à l'autre, comme le prouvent les statistiques.
J-4 Culture de l'olivier
Il existe au moins 50 variétés d'olivier dont
les fruits sont de formes, de tailles et de goûts différents ;
mais Olea Europa est la variété la plus répondue
et se trouve partout dans le bassin méditerranéen (Rayan et
Robards, 1998). L'olivier est une Oléacée à feuillage
7
Synthèse Bibliographique
persistant qui exige une luminosité poussé
durant toute l'année. La période de vie de cet arbre peut
atteindre 400 ans, grâce à sa capacité naturelle de
régénération par des rejets racinaires. Il commence
à produire des olives à partir de sa 12ème
année. Après cet âge, le rendement de l'olivier
décroît progressivement jusqu'à s'annuler vers la fin de sa
vie. Son fruit est une drupe ovoïde à mésocarpe charnu,
à noyau relativement gros et dur et dont le péricarpe passe du
vert tendre au violet plus aux moins noirâtre à maturité
complète (Bianco et Ucella, 2000). Par l'ampleur de ces racines, une
surface vernissée de ces feuilles et une pause estivale dans son cycle
végétatif, l'olivier peut s'adapter aux sécheresses
estivales. En revanche, l'olivier a des besoins en eau modestes. Une
pluviométrie de 500 à 700 mm par an est suffisante et il peut
même être cultivé dans de régions arides.
Néanmoins, l'olivier craint des ambiances humides et l'excès de
l'eau. L'olivier tolère les sols pauvres, légers et bien
égouttés ; par contre, il déteste les sols lourds. La
résistance de l'olivier au froid est relativement faible. Les jeunes
oliviers de moins de 5 ans supporte mal des températures
inférieures à -8°C. Les arbres adultes souffrent à
partir de -12 °C (Fernandez-Diaz, 1983). Les oliviers tunisiens se sont
adaptés à l'irrégularité des précipitations
et à leurs mauvaises répartitions. Ils puissent en profondeur le
peu d'eau disponible grâce à un système racinaires
très puissant, et ils doivent pouvoir exploiter une grande surface de
terre. D'où la nécessité de pratiquer une faible
densité de plantation. En Tunisie, deux principales
variétés d'olives à huile sont cultivées : la
variété «Chetoui» au Nord et la variété
«Chemlali» au centre et au Sud. D'autres variétés sont
aussi cultivées à savoir : Oueslati, Zalmati et Zarazi (Nefzaoui,
1991).
I-5 Intérêt économique en Tunisie
Le secteur oléicole Tunisien occupe une place majeure,
tant au plan écologique, agricole qu'au plan socio-économique.
Ainsi, l'oléiculture jouit une place stratégique dans
l'agriculture. La production d'olives à huile est tributaire des
conditions climatiques et reste une culture traditionnelle. L'activité
compte près de 1 440 huileries et occupe 250 000 oléiculteurs. La
production est répartie entre le Sud (54 %), le Centre (29 %) et le Nord
(17 %) alors que les huileries sont essentiellement implantées au Centre
(46 %) et au Sud (40 %). La capacité totale de trituration est
constituée de système classique (42 %), de super presse (27 %) et
de chaîne continue (31 %). Actuellement, dans les conditions climatiques
et culturales optimales, la production d'olive à huile peut atteindre,
voir dépasser un million de tonne. L'olivaison demeure une source
importante de travail, d'où son poids social : les journées de
travail comptabilisées par an en Tunisie, s'élèvent
à 25 ou 30 millions (Nefzaoui, 1991). Ce secteur procure aussi 37 % des
recettes des produits agricoles et agroalimentaires
8
Synthèse Bibliographique
exportés et ses revenus représentent 4 à
5 % des recettes de toutes les exportations tunisiennes (Msallem et
al., 2000).
J-6 Les olives
L'olive est une drupe charnue très riche en huile, sa
composition physique est indiquée dans la Fig. 1.
|
% du poids sec de l'olive
Epicarpe 2 à 2,5 %
Mésocarpe (= pulpe) 71,5 à 80,5%
Endocarpe (=paroi du noyau) 17,3 à 23,0%
Amandes 2,0 à 5,5%
|
Figure 1: Section transversale et composition
physique de l'olive
(Maymone et al., 1961 ; Nefzaoui, 1983)
II- Technologie d'extraction d'huile d'olives
Les olives vertes sont récoltées en septembre
ensuite la récolte se poursuit jusqu'à février. Durant
leur maturation, les fruits s'enrichissent en huile et changent de couleur en
passant du vert au noir. L'huile d'olive est contenue dans de minuscules poches
situées dans les cellules des olives. Ces poches sont appelées
vacuoles. Pour pouvoir récupérer cette huile, il faut briser la
paroi de ces derniers et donc, tout d'abord, celle de cellules des olives.
Cette dernière opération est appelé broyage. Dans la
plupart des cas, les olives sont broyées entières, c'est à
dire avec leur noyau. On obtient une pâte qui a une consistance plus au
moins liquide selon les variétés des olives, l'époque de
la cueillette et la pluviométrie. Le broyage ne suffit pas de briser la
totalité des vacuoles. Pour cela et afin de libérer le maximum
d'huile, un malaxage est appliqué à la pâte. Le broyage et
le malaxage permettent d'obtenir une pâte qui contient de la
matière solide (débris de noyau, épiderme, parois
cellulaires,...) et des liquide (huiles et eaux de végétations,
c'est-à-dire l'eau contenue dans les cellules végétales de
l'olive). L'étape suivante consiste à séparer la partie
solide (appelé grignon) de la partie liquide. Cette opération
s'appelle : séparation de phases. La dernière étape de
l'extraction de l'huile d'olive consiste à séparer l'huile de
végétation désignée sous terme
«margines», il s'agit de la décantation. Il faut donc
séparer l'huile de la margine.
9
Synthèse Bibliographique
Depuis des années, ce processus général
de trituration des olives a connu des développements technologiques qui
tendent vers la mécanisation complète du processus,
l'augmentation de la capacité de travail et la spécialisation du
processus d'extraction dans le souci de réduire les coûts mais
aussi d'améliorer la qualité de l'huile (Ben Sassi, 2006). A
l'heure actuelle, 3 techniques d'extractions sont mises en oeuvre (Caputo et
al., 2003) :
II-1 Système discontinue de presse (dit
classique)
C'est un système de pression intitulé
système discontinu dit encore système classique. Ce
système fait appel à des presses hydrauliques pour la
séparation des grignons du mélange huile/margine. Le grignon
demeure dans les scourtins. La phase liquide récupérée est
introduite dans une centrifugeuse verticale à assiette qui permet de
séparer l'huile d'olive des margines. Certaines huileries font appel
à un cycle de double pression, aussi appelé « système
super presse ». Le procédé marche sans ajout d'eau. Les
margines sont constituées principalement des eaux de
végétation, auxquelles s'ajoute l'eau de lavage et
éventuellement celle du broyage. Ce procédé conduit aux
margines les plus concentrées.
II-2 Système continue à trois phases
Il s'agit d'un système de type mouture / centrifugation
à trois phases (système à cycle continu). Le broyage est
réalisé par des broyeurs mécaniques à disques ou
à marteaux. Ces broyeurs fonctionnent en continue et la pâte est
alors obtenue instantanément. Cette pâte est ensuite
malaxée dans un bac en inox, dans lequel tourne une spirale ou une vis
sans fin, également en inox. La pâte malaxée est
injectée par une pompe dans une centrifugeuse dont l'axe est horizontal
appelée aussi décanteur. Cette dernière étape
permet la séparation des trois phases (huiles, grignons et margine).
Cette séparation des pâtes huileuses en grignons et mélange
huile/eau se fait par centrifugation continue. Elle requiert des pâtes
plus fluides et, à cette fin, de 50 à 100 litres d'eau chaude par
100 kg d'olives sont ajoutés tout au long du procédé.
Ensuite, l'huile est séparée des margines par une autre
centrifugeuse. Le volume d'eaux résiduaires est donc 2 à 3 fois
supérieur à celui produit par le système « Super
Presse ». Les margines issues de ce système sont évidemment
moins concentrées.
II-3 Système continue à deux phases (dit
économique)
Ce système est de type percolation-centrifugation
(système à cycle continu dit mixte). C'est une variante du
système à deux phases. Le système consiste en une
modification des centrifugeuses afin de réduire les effluents au nombre
de deux : l'huile et le marc qui contient
10
Synthèse Bibliographique
dés lors la quasi totalité de l'eau de
végétation des olives. Il n'y a alors pas de production des
margines, tous les polluants restant inclus dans les grignons. Ce
système a des nombreux avantages. Il permet de réaliser une
économie d'énergie, fournit une huile de meilleure
qualité, tout en permettant une réduction considérable de
la quantité d'eau engagée dans le moulin à huile.
Cependant, le grignon obtenu, plus humide que celui du système à
3 phases, est plus difficile à manier et à sécher en vue
d'en extraire l'huile qu'il contient.
Chaque type de ces systèmes d'extraction est
caractérisé par sa capacité de trituration, son coût
de fonctionnement (en termes de main d'oeuvre de consommation d'énergie
et de volume d'eau ajoutée), la pureté et la qualité de
l'huile obtenue, la quantité et le caractère polluant des sous
produits générés.
Actuellement, les systèmes de centrifugation se
développent au détriment des systèmes traditionnels de
presse, c'est le cas de l'Italie et de l'Espagne. En revanche, en Tunisie les
moulins à pression sont encore largement présents. Pour la
campagne 1992-1993, environ 63 % des huileries étaient
équipées de systèmes à pression (Berndt et
al., 1996). Alors que le procédé d'extraction
«écologique», c'est à dire le procédé
continu à deux phases, n'est pas encore appliqué. Actuellement 50
% des huileries (396 huileries) sont encore artisanales le reste sont
industrialisés dont 46 huileries ont un système d'extraction en
chaîne.
Sous l'angle opératoire, la différence
substantielle entre les deux types d'installations les plus répandus,
réside dans le fait que par la pression, l'extraction d'huile se fait
sans addition significative d'eau. Par contre, les systèmes à
cycles continus requièrent l'adjonction d'eau lors de la phase qui
précède la centrifugation. En ligne générale, on
obtient en moyenne, pour chaque tonne d'olive 200 kg d'huile, 400 à 600
kg de grignons et de 600 à 1200 l de margines (Caputo et al.,
2003).
L'industrie oléicole engendre donc deux sortes de
résidus, un résidu solide: les grignons et un résidu
liquide: les margines. Si les grignons ne posent pas de problèmes
environnementaux du fait qu'ils peuvent être valorisés en tant
qu'aliment pour les bétails ou pour la combustion (utilisation la plus
répondue en Tunisie), les margines sont classées parmi les
effluents les plus exigeants dans leur épuration vu leurs
quantités élevées et leurs charges polluantes
importantes.
11
Synthèse Bibliographique
Les Margines
I- Introduction
L'effluent liquide des huileries, dénommé «
Margines », est constitué des eaux de végétation des
olives et de celle ajoutées aux différents stades du
procédé d'extraction de l'huile. Si les premières
dépendent uniquement des caractéristiques des olives
triturées, les deuxièmes sont quant à elles
inhérentes au système d'extraction. En effet, lors de
l'extraction de l'huile d'olive, la consommation en eau diffère selon
que le système d'extraction fonctionne en discontinue ou en continue
(à trois phases ou à deux phases). A partir de la mise en oeuvre
de 100 Kg d'olives, on obtient en moyenne 20 Kg d'huile et, en fonction du
système d'extraction adopté, prés de :
40 Kg de grignons (avec une teneur en humidité de
l'ordre de 35 %) et 40 Kg de margines, si l'extraction est
réalisée par les systèmes traditionnels utilisant la
pression (Tamburino et al., 1999)
55 Kg de grignons (avec une teneur en humidité de
l'ordre de 50 %) et jusqu'à 100 Kg de margines, si l'extraction est
réalisée par les systèmes en continue à trois
phases (Amirante et al., 1993)
70 Kg de grignons (avec une teneur en humidité de
l'ordre de 60 %) et jusqu'à 10 Kg de margines, si l'extraction est
réalisée par les systèmes en continue à deux phases
(Di Giovacchino, 1996)
La production mondiale de margines est estimé à
30 millions de mètres cubes. En Tunisie, cette production peut
dépasser 400 000 m3 pendant les années de bonne
pluviométrie (Nefzaoui, 1991). D'après certains auteur, le
potentiel polluant des margines issue de la mise en oeuvre d'un quintal
(hectogrammes) d'olive est équivalent à celui de 45 habitants ; 2
litres de margines provoquent une pollution équivalente à celle
délivrée par 3 personne en un jour (Ranalli, 1991). Le processus
d'extraction à partir d'une tonne d'olives génère en
moyenne 45 à 55 Kg de demande biologique en oxygène (DBO5).
Sachant qu'en moyenne un habitant rejette annuellement de l'ordre de 20 Kg de
DBO5 et que l'industrie oléicole mondiale peut produire annuellement 420
106 Kg de DBO5, les margine produites dans le monde pourraient
corespondre aux déchets de 21 millions d'habitants chaque année
(Hamdi, 1996).
12
Synthèse Bibliographique
Les margines posent donc des sérieux problèmes
pour l'environnement. Leurs effets nocifs dérivent en grande partie de
leur contenue en composés polyphénoliques dont certains sont
très difficilement biodégradables. De plus, ces
polyphénols sont potentiellement toxiques pour les microorganismes et
peuvent à long terme entraîner une stérilisation des sols
et polluer la nappe phréatique. Néanmoins, il est à noter
qu'une partie des substances organiques des margines présentent de
fortes activités biologiques importantes en particulier
l'activité antioxydante. Pour limiter la nature polluante des margine,
les chercheurs ont essayé de valoriser ces effluents soit en produisant
du biogaz lors du traitement biologique ou bien en isolant les monomères
phénoliques à activité antioxydante. Cependant, les
procédés développés restent limités et leurs
coûts économiques sont très élevés. Par
conséquent, les bassins d'évaporation, par leur simplicité
d'utilisation, restent la solution la plus actuellement employée,
malgré leur danger et leur effet néfaste sur l'environnement.
II- Composition des margines
Les margines présentent une couleur brune
rougeâtre à noire et un aspect trouble. Leur odeur, qui rappelle
à l'état frais celle de l'huile d'olive, se révèle
gênante en cas de rancissement (huile résiduelle oxydée en
surface des bassins d'évaporation) ou de fermentation anaérobique
(fraction sédimentée des margines). Le pH des margines varie
entre 4 à 6 avec un fort pouvoir tampon. Divers auteurs ont
étudié leurs compositions. Les margines sont composés
d'environ 90 % d'eau, de 7 à 15 % de matière organique et de 1
à 2 % de substance minérale (Fiestas Ros de Ursinos, 1981). La
composition chimique des margines varie en fonction du stade de maturation des
olives, du processus d'extraction, des conditions climatiques et de la
variété des olives. Les concentrations maximales de la DBO5 et de
DCO des margines peuvent atteindre respectivement 100 et 200 (Sayadi et
Ellouze, 1993). Les margines présentent une fraction minérale
très variée. Elles sont très riches en potassium, sodium,
calcium et phosphore. Dans certains cas, ces effluents pourraient renfermer des
traces de métaux lourds tels que le Nickel, le cadmium et le cobalt
(Chamkha, 2001). La matière organique des margines se trouvent
essentiellement en solution, et en moindre quantité, en suspension ou en
émulsion. Sa composition est très complexe et
hétérogène. Plusieurs composés de nature et de
concentration très différentes sont présents dans les
margines. Ce sont les glucides, les lipides, les composés azotés,
les produits phénoliques des margines (Sayadi et Ellouz, 1995). Les
polyphénols représentent environ 20% de la matière
organique des margines. Ils sont surtout représentés par des les
tanins hydrolysables et des tanins condensés (composés
flavonoïdiques). Les composés flavonoïdiques sont
représentés par les
Synthèse Bibliographique
catéchines, divers dihydroxychalcones et anthocyanes.
Ces dernières sont responsables de la coloration rouge à noire
des margines. La concentration totale des tanins dans les margines peut
atteindre 12 g/l. Les margines ne contiennent pas de vrai lignine, mais des
pseudo-lignines caractéristique du fruit (Tanchev et al., 1980).
Les composés phénoliques contenus dans les
margines représentent environ 17,1 g/l (Sayadi et Ellouz, 1993).
Certaines structures sont fortement toxiques et liées à
l'inhibition de la biodégradation des margines. Toutefois, il est
à noter l'existence d'un pouvoir antioxydant important de certains
phénols d'où la nécessité de les
caractériser et de les valoriser.
II-1 Produits phénoliques simples
Plusieurs acides phénoliques ont été
identifié dans les margines. Il s'agit des acides caféique,
p-coumarique, protocatéchuique, vanillique (Labat et al.,
2000), p-hydroxyphényl acétique,
p-hydroxybenzoïque (Balice et Cera, 1984), férulique
(Ranalli, 1991), synergique et gallique (Perrin, 1992).
Les alcools phénoliques les plus connus sont le tyrosol
(4-hydroxyphènyléthanol) et l'hydroxytyrosol
(3,4-dihydroxyphényléthanol) (Capasso et al., 1992). Ces alcools
sont parfois associés à des glucosides comme le mono-glucoside du
3,4-dihydroxyphényléthanol (Bianco et al., 1998 ; Romero et al.,
2002). Le catéchol est le p-méthylcatéchol ont
été également identifié dans les margines (Capasso
et al., 1992)
Certains aldéhydes phénoliques ont
été aussi identifiés dans les margines à savoir le
3,4-dihydroxybenzaldéhyde, le p-hydroxybenzaldéhyde, la vanilline
et l'aldéhyde syringique (Ranalli, 1991). Les cinnamates ont
été également retrouvés dans les margines (Hamdi ,
1993 ; Labat et al., 2000). D'autres composés phénoliques sont
encore présents comme l'apigénin (flavone), la cyanidine, la
lutéoline (flavone 7-O-glucoside), la quercétine et le flavanol.
Les glucosides phénoliques de la pulpe d'olive et les anthocyanes sont
présents en quantités appréciables dans les margines
fraîches ou nouvellement produites (Fig. 2).
13
14
Synthèse Bibliographique
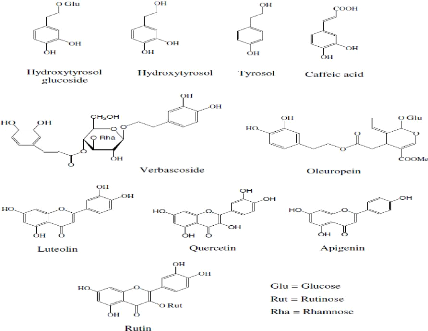
Figure 2 : Structures chimiques des
composés phénoliques des margines (Obied et al.,
2007).
II-2 Oleuropéine
II-2-1 Historique
L'oleuropéine, l'amer principe des olives, était
appelé et étudié par Bourquelot et Vintilesco, (1908). Par
la suite, Panizzi et al., (1960) ont montré que cette
molécule contient le glucose, le
â-3,4-dihydroxyphényléthyl alcool, et un acide (Fig. 1).
Ces auteurs ont proposé que l'acide était identique à un
agent hypotensive indiqué comme acide élénolique (Veer
et al., 1957). Ce dernier a été préparé
par hydrolyse à l'acide phosphorique d'extrait d'olives.
II-2-2 Structure chimique de l'oleuropéine
L'oleuropéine (Fig. 3) est le principal composé
phénolique de l'olivier. Il est le majeur biophénol de
l'écorce de l'arbre, de la feuille de l'olivier Olea europaea
à raison de 5 à 7 mg/g de feuilles fraîches, l'huile
d'olive et aussi le fruit : la drupe d'olives qui contient 20 à 100 mg/g
d'extrait sec (Perrin, 1992). Ce composé est une sécoiridoide
phénolique glucidique (Fig. 2). Sa fonctionnalité
hydroxyaromatique dérive du métabolisme du
phénylpropanoide et
15
Synthèse Bibliographique
shikimate (Caturla et al., 2005). C'est un glucoside
de l'acide élénolique estérifié par le
3,4-dihydroxy-phényléthanol (hydroxytyrosol).
Pendant la phase noire de la maturation des olives, les
auteurs ont mis en évidence l'apparition d'anthocyanes et la diminution
de l'oleuropéine (Amiot et al., 1989). L'oleuropéine
disparaît lorsque les olives deviennent complètement noires. Dans
les margines, ce composé est présent en faible quantité
par suite de sa dégradation au cours du processus d'extraction de
l'huile. Cette dégradation est réalisée soit par voie
chimique (chaleur), soie par voie biologique suit à l'action de
certaines enzymes hydrolytiques (Ciarfardini et al., 1994), ce qui
permet la libération d'hydroxytyrosol connu également pour son
pouvoir antioxydant.
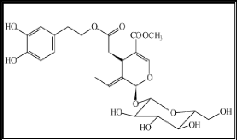
Figure 3 : Structure chimique de
l'oleuropéine (Bendini et al., 2007)
II-2-3 Activité biologique de l'oleuropéine
Durant ces dernières années, plusieurs
composés de l'olivier comme l'oleuropéine, ont montré de
différentes activités biologiques à savoir des
activités antimicrobiennes ou des activités antioxydantes
(Caturla et al., 2005). Des propriétés
hypoglycémiantes et anti-hypertensives ont été
attribuées à cette molécule. L'hydroxytyrosol et
l'oleuropéine ont été montré comme de puissants
radicaux (Briante et al., 2001 ; Saija & Uccella, 2001 ;
Paiva-Martins et al., 2003). En addition, la présence de
quelques biophénols dans l'huile d'olive et dans la drupe d'olive a
été montrée en relation avec la prévention contre
l'infarctus, les maladies des artères et l'athérosclérose
(épaississement de la paroi intérieure des artères) vue
que ces derniers sont capables d'inhiber l'agrégation des plaquettes
sanguines (Carluccio et al., 2003), de modéliser le
métabolisme de l'acide arachidonique (Kohyama et al., 1997) et
inhibe la peroxydation des LDL (Visioli et al., 1995 a, 2002 ; Visioli
& Galli, 2002).
En outre ces composés ont été
montrés dotés d'activité antimicrobiennes pour inhiber la
croissance d'une large variété de bactérie (Bisignano
et al., 1999), de champignons (Aziz et al., 1998) et de virus
(Ma et al., 2001). En particulier, l'oleuropéine a
été exhibé doté
16
Synthèse Bibliographique
d'activité antibactérienne contre une large
variété de bactérie Gram positive et Gram négative
causant des pathologies humaines (Bisignano et al., 1999). De plus,
l'oleuropéine a surtout montré une activité antivirale
contre l'enveloppe du virus (Micol et al., 2005). Ils tuent
également le virus de l'herpès. On suppose que
l'oleuropéine inactive les bactéries en dissolvant la paroi
externe du microbe. Elle interfère avec l'infection virale et sa
propagation en inactivant le virus ou en l'empêchant de se multiplier.
L'oleuropéine est capable de pénétrer directement dans des
cellules infectées, de stopper la réplication virale sans
affecter la cellule de l'hôte.
II-2-4 Mode d'action de l'oleuropéine
L'activité antimicrobienne de l'oleuropéine a
été montrée inférieure par rapport à celle
de l'hydroxytyrosol. Ceci peut être en relation avec la faible
capacité de pénétration de cette molécule à
travers la membrane cytoplasmique de la cellule vue la présence de la
structure glucidique (Saija et Uccella, 2001). Le mécanisme
moléculaire putatif de la large activité biologique de
l'oleuropéine a été parfois pointu. En effet, ce
composé, une fois digéré par la ?-glucosidase, enzyme
présente déjà dans les feuilles de la plante ou
dérivant des bactéries intestinales, il produit alors des
structures de glutaraldéhyde qui dénaturent les protéines,
les protéines crosslinking et qui possèdent des
propriétés lysine-alkylating (Konno et al., 1999).
II-3 Hydroxytyrosol
II-3-1 Propriétés de l'hydroxytyrosol
L'hydroxytyrosol est caractérisé par une haute
activité antioxydante, qui est analogue à plusieurs antioxydants
synthétiques et usuelles à savoir, le
2,6-di-tert-butyl-p-hydroxytoluene (BHT) et le
3-tert-butyl-6-hydroxyanisole (BHA) (Chimi et al., 1988). Aeschebach
et al. (1994) ont démontré que l'activité antioxydante de
cette molécule est comparable à celle du thymol, carvacrol,
6-gingérol, and zingérone. Il contribue à la
stabilité d'huile d'olive vierge. (Visioli et al, 1995 b). Il inhibe
également l'oxydation des LDL « low-density lipoproteins »
(Visioli et al., 1995 a) et confère aussi bien la protection cellulaire
(Galli et al., 1994) et les propriétés
diététiques de l'huile d'olive vierge (Visioli et Galli, 2002).
Outre son activité antioxydante, l'hydroxytyrosol présente un
intérêt important vis-à-vis de la santé humaine. On
a montré que cet ortho-diphénol s'oppose à l'effet
cytotoxique des métabolites réactifs de l'oxygène sur la
cellule, ce qui permet de prévenir les lésions cellulaires (Manna
et al., 1997 a). Dans une autre étude, Deiana et son
équipe ont observé que l'hydroxytyrosol inhibe les lésions
provoquées à l'ADN par le peroxynitrite (Deiana et
al.,1999). L'hydroxytyrosol
17
Synthèse Bibliographique
exerce aussi une nette action anti-inflammatoire. Petroni et
son équipe ont montré que l'hydroxytyrosol inhibe, la formation
d'un éicosaénoide pro-inflammatoire désigné sous le
terme «leucotriène B4» (Petroni et al., 1995). De la
Puerta et son équipe 1999 a constaté que l'hydroxytyrosol, le
tyrosol, l'oleuropéine et l'acide caféique inhibent la formation
du leucotriène B4 en réduisant l'activité de l'enzyme qui
catalyse cette formation, la 5-lipoxygénase (De la Puerta et
al., 1999). Il a d'ailleurs été signalé que cette
enzyme est inhibée par l'extrait d'olive et que les substances
responsables de cet effet sont l'hydroxytyrosol, l'oleuropéine et
l'acide cafeique (Kohyama et al., 1997). Une autre étude a
montré que l'hydroxytyrosol inhibe in vitro l'agrégation
plaquettaire et la formation d'éicosanénoîdes par les
plaquettes (Petroni et al., 1995).
II-3-2 Synthèse de l'hydroxytyrosol
La première procédure de synthèse de
l'hydroxytyrosol est une méthode basée sur la réduction de
l'acide 3,4- dihydroxyphenylacétique en présence du catalyseur
LiBH4 (Verhe et al., 1992). L'hydroxytyrosol naturel est
récupéré par une purification à partir des margines
(Capasso et al., 1999). Espin et al., (2001) ont
discuté la production de cette molécule en utilisant la
tyrosinase de champignon comme un biocatalyseur et l'acide ascorbique comme un
agent réducteur. D'autres méthodes enzymatiques sont aussi
décrites, et qui sont basés sur l'hydrolyse de
l'oleuropéine par la â-glucosidase et la déstabilisation de
la structure aglycone sous des conditions de température et de pH bien
définies (Briante et al., 2001). Les stratégies
biologiques ont ouvert une voie de bioconversion utilisant l'ensemble des
cellules pour la production de l'hydroxytyrosol (Allouche et al., 2004
b ; Bouallagui et Sayadi 2006). Vu l'intérêt majeur de
l'hydroxytyrosol, plusieurs études ont été
intéressé à l'élaboration de procédés
économiques viables pour la production de cet ortho-diphénol
à partir des margines (Allouche et al., 2004 a). Beaucoup de
procédés de production de l'hydroxytyrosol à partir des
margines ont été brevetés. Parmi ces derniers, figurent
essentiellement ceux de Crea (2002) et (2003). Dans ces études, les
margines sont acidifiées à pH 2 pour empêcher les
phénomènes de fermentation et stabiliser ainsi les structures
phénoliques. Après cette acidification, elles sont
stockées à température ambiante pendant au moins deux mois
pour favoriser la conversion de l'oleuropéine en hydroxytyrosol.
II-3-2 Les métabolites de l'hydroxytyrosol
In vivo, une fois absorbé, l'hydroxytyrosol peut subir
différentes voies de métabolisme (Fig. 4). En effet, l'alcool
déshydrogénase transforme l'hydroxytyrosol en 3,4 dihydroxyphenyl
acétaldéhyde puis en 3,4 dihydroxyphenyl acétique acide
par l'action de
18
Synthèse Bibliographique
l'aldéhyde déshydrogénase. Toutefois,
l'action de la sulfotransférase et la glucotransférase permet la
libération des conjugués sulfatés et des conjugués
glucuronides respectivement. Quant à
catéchol-O-methytransférase permet de donner le
4-hydroxy-3-methoxyphenylethanol, qui suite à l'action de l'alcool
déshydrogénase permet la libération de
4-hydroxy-3-methoxyphenylacétate d'éthyle qui sera
transformé en 4-hydroxy-3-methoxyphenylacétique acide par
l'aldéhyde déshydrogénase (Tuck & Hayball, 2002).
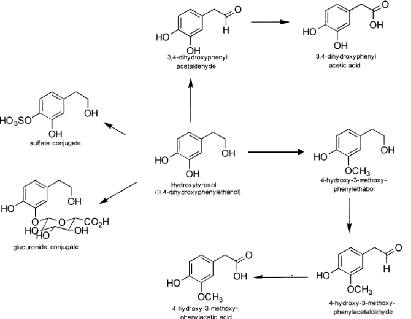
Alcool
déshydrogénase
Gluco-transférase
Aldéhyde
déshydrogénase
Alcool
déshydrogénase
Sulfo-transférase
Catéchol-O-methytransférase
Aldéhyde
déshydrogénase
Figure 4 : Postulation des voies enzymatiques
pour les métabolites de l'hydroxytyrosol in
Vivo (Tuck & Hayball, 2002) .
III- Procédés de dépollution des
margines
Comme nous l'avons cité précédemment, les
margines sont des déchets de l'industrie agroalimentaire à la
fois très riches et très inhibiteurs pour la flore
bactérienne susceptible d'effectuer leur biodégradation (Tableau
1).
19
Synthèse Bibliographique
Tableau 1 : Principales actions des
composés phénoliques sur le milieu naturel (Fiestas
Ros, 1981 ; Capasso et al., 1995).
|
Les méfaits des composés
phénoliques
|
|
Inhibiteurs enzymatiques
|
|
Dénaturation des protéines cellulaires
|
|
Destruction des membranes cellulaires
|
|
Pouvoir hypotenseur (oleuropéine)
|
|
Pouvoir anti-microbien tels que Lactobaccillus et les
bactéries sporulantes du sol
|
|
Inhibition du développement de certains champignons comme
Geotrichum, Rhyzopus et Rhyzoctonia
|
|
Asphyxie du milieu aquatique
|
|
Inhibition de la germination des graines
|
|
Action phytotoxique
|
C'est pourquoi, de nombreux procédés de
dépollution ont été envisagés. Le
procédé le plus utilisé dans le sud
méditerranéen réside dans l'utilisation des bassins
d'évaporation (Cabello et Fiestas, 1981). D'autres
procédés sont aussi employés tels que les traitements
physiques et biologiques.
- Les traitements physiques des margines consistent
essentiellement à l'épaississement des matières polluantes
organiques et minérales (solubles et insolubles) et à leur
séparation de la phase liquide. Parmi ces procédés
physiques ont peut citer la filtration, l'ultrafiltration, la
décantation, la polarisation, le séchage et l'utilisation des
filtres à charbon actif. Néanmoins, ces procédés
sont à l'origine d'une importante charge polluante solide. Vue leurs
importante viscosité, et leur forte concentration en matière
sèche, les margines posent de sérieux problèmes lors les
opérations de filtration et d'ultrafiltration (Hamdi, 1993). Il a
été convenu que toutes ces techniques sont extrêmement
coûteuses en énergies ou en réactifs, rendant difficile
leurs utilisations par les petites entreprises productrices.
- Les traitements biologiques des margines font recours
à des microorganismes (bactéries et champignons) pour oxyder et
dégrader la matière organique polluante en métabolites
simple comme le dioxyde de carbone (CO2), le méthane (CH4) et des
composés aliphatiques.
Traitement aérobie
La bio-oxydation aérobique consiste à utiliser
la matière organique (généralement soluble) comme source
de carbone et d'énergie pour des microorganismes en présence
d'oxygène dissous. L'importante énergie libérée est
utilisée par les microorganismes pour
20
Synthèse Bibliographique
leur croissance et leur maintenance ce qui se traduit par une
production de biomasse importante. Il existe de nombreuses configurations
technologiques pour les traitements aérobics. Le procédé
des boues activées tend à être exploité de plus en
plus largement pour les traitements des effluents des industries
agroalimentaires.
A cause de leurs effets antibactériens, les
composés phénoliques sont les principaux inconvénients
pour les traitements biologiques des margines. Pour résoudre ce
problème, plusieurs travaux ont étudié l'utilisation des
microorganismes capables de croître en aérobiose sur les margines
diluées dans le bût de réduire les charges organiques
initiales et la concentration des polyphénols (Borja et al.,
1992; Yesilada et al., 1998). D'après Balice et al.
(1988), le traitement direct des margines par les boues activées
nécessite leur dilution 70 fois par l'eau de robinet pour éviter
l'inhibition par les composés phénoliques.
Traitement anaérobie
Les deux principaux avantages qui ont concouru au
succès des procédés anaérobies sont: la
réduction de la consommation d'énergie et la faible production de
boue. La forte charge en matière organique et le caractère
saisonnier mettent aussi en faveur l'épuration des margines par la
digestion anaérobie. Cependant, le traitement anaérobie de ces
effluents bruts s'est avéré non envisageable à cause de
l'inhibition de la méthanisation observée par plusieurs
configurations de réacteurs. La présence des substances
inhibitrices essentiellement les polyphénols et les lipides dans les
margines diminue toujours la viabilité économique de ce processus
(Hamdi, et al., 1993; Gharsallah et al., 1999).
IV. Différentes approches de valorisation des
margines
Les tentatives de mises en place d'une technique de
dépollution des margines ont aboutit à l'élaboration de
procédés complexes et coûteux. Ces complications sont
essentiellement dues aux propriétés des composés
phénoliques présents dans les margines (Sayadi et al., 2000). Il
serait de ce fait, intéressent de concevoir des méthodes visant
l'atténuation de l'effet néfaste de certains composés
problématiques des margines. Dans la mesure où certains
polyphénols des margines sont biologiquement actifs, la mise en oeuvre
de techniques de valorisation de ces effluents serait d'une grande importance.
Dans cet égard, plusieurs techniques ont été
développées :
21
Synthèse Bibliographique
IV-1 Utilisation des margines comme fertilisant
De nombreux auteurs ont souligné que la richesse des
margines en matière organique et en éléments
minéraux (3,5 à 11 g de K2O; 0,6 à 2 g de P2O5
et 0,15 à 0,5 g de MgO par litre) permet leur utilisation comme
fertilisant complémentaire (Fiestas Ros, 1986).
Bien que les résultats relatifs à la charge
organique, aux composés phénoliques et à la
conductivité électrique semblent en faveur de l'épandage
des margines sur les sols (Levi-Minzi et al., 1992), d'autres
recherches semblent être nécessaires pour confirmer les
indications fertilisantes et/ou pour évaluer la persistance des
composés récalcitrants de la margine dans le sol (Mekki et
al., 2006).
IV-2 Production des protéines unicellulaires
Plusieurs travaux ont utilisé les margines en tant que
substrats pour la production de levures (Gharsallah, 1987; 1993) et pour
certains microorganismes servant pour l'alimentation des bétails. Ce
procédé ne manque pas d'intérêt, car il se traduit
par une diminution de la DBO5 (60 à 70 %) et l'obtention de
quantités importantes de levure (Nefzaoui, 1991). Néanmoins,
l'utilisation de ce type de protéines pour l'alimentation animale est
limitée par les composés phénoliques adsorbés sur
les cellules de levures.
IV-3 Production des enzymes pectinolytiques
La croissance de Cryptococcus albidus sur les
margines dans un réacteur agité pendant 48 h permet
d'éliminer en moyenne 75 % de la DBO5 avec une production de pectinases.
La production enzymatique est importante après élimination des
polyphénols par floculation-sédimentation. Le concentré
d'enzymes récupéré après ultrafiltration est
directement utilisé dans l'extraction d'huile d'olive, améliorant
ainsi significativement le rendement d'huile de 84,3 à 90,7 %
(Petruccioli et al., 1988).
IV-4 Application des margines dans la fabrication du
compost
Le compost s'obtient principalement par la dégradation
aérobie de la matière organique présente dans les
déchets solides (animaux et urbains). Une autre alternative possible
pour l'obtention du compost peut consister en un mélange des
déchets agricoles, forestiers et urbains avec les margines (Abid et
Sayadi, 2006). Le but de ce processus serait de favoriser la croissance des
microorganismes étant donné leurs teneurs élevées
en substances facilement fermentescibles (Berndt et al., 1996). En effet, le
compost produit à partir des margines est totalement exempt de
microorganismes pathogènes et plus riche en
Synthèse Bibliographique
phosphore et en potassium (Abid et Sayadi, 2006) que le
compost obtenu à partir des résidus solides urbains.
IV-5 Utilisation des margines comme source naturelle
d'antioxydants
L'expérience dans ce domaine est récente, il
s'agit en particulier de la récupération des composants
aromatiques et phénoliques et des solutions de glucides. Il est bien
connu que les margines renferment un certain nombre d'antioxydants
phénoliques naturels et en particulier les ortho-diphénols. Parmi
ces produits naturels figurent l'acide caféique et plus
particulièrement l'hydroxytyrosol (Allouche et al., 2004 a).
Ces molécules antioxydantes interviennent dans la protection des corps
gras insaturés contre l'auto-oxydation qui est responsable des
phénomènes de rancissement (Fki et al., 2005). Les
antioxydants ont donc un rôle conservateur en limitant
l'altération des produits alimentaires. L'intérêt de ces
antioxydants naturels est double : en plus de bénéficier du
« label naturel » très apprécié par les
consommateurs, ils constituent une alternative appropriée pour les
additifs artificiels impliquant parfois des risques de
cancérogenèse (Castera-Rossignol & Bosque ,1994).
22
23
Synthèse Bibliographique
Les Polyphénols
I- Introduction
Les plantes et en particulier les fruits et légumes
contiennent des phytomicronutriments à côté des
macronutriments, minéraux et vitamines. Ces phytomicronutriments ont
été considérés en tant que métabolites
secondaires des plantes que l'ont pensait qu'ils n'étaient que des
déchets du métabolisme des plantes. Actuellement, on s'est rendu
compte que ces micronutriments ne sont pas si secondaires mais contribuent
à protéger la plante contre les pathogènes, les
champignons de la pourriture, le rayonnement ultraviolet, etc. Ces
composés sont propres à une espèce ou à un groupe
d'espèces et participent à l'identité chimique de la
plante. Ils sont désignés par le terme « Polyphénols
» (Bravo, 1980).
La famille des « polyphénols » englobe une
large gamme de substances organiques renfermant dans leurs structures un ou
plusieurs cycles aromatiques contenant un ou plusieurs groupements hydroxyles.
Dans le cas général, le terme « polyphénols »
désigne des enchaînements de composés phénoliques
simples très hétérogènes aussi bien par la
composition de leurs molécules que par leurs modes de
polymérisation. Néanmoins, les monomères
phénoliques simples comportant plusieurs groupements hydroxyles sont
désignés aussi sous cette dénomination.
La famille des polyphénols contient plus de 8000
structures phénoliques couramment connus (Hammerstone et al.,
2000). Ces composés sont probablement les produits naturels les plus
répandus dans la nature et de ce fait, sont des éléments
faisant partie de l'alimentation animale. A titre d'exemple, l'homme consomme
en moyenne jusqu'à 10 g de polyphénols par jour (Day et
al., 2000). Les transformations oxydatives par voie chimique ou
enzymatique des composés phénoliques entraînent un
brunissement des tissus végétaux, ce qui pose des
problèmes technologiques dans les industries alimentaires.
II- Les différents types de polyphénols
La nature et les teneurs en polyphénols dans divers
fruits et légumes sont très variables. Ces derniers sont
classés selon la structure de leur squelette carboné : ce sont
surtout les acides phénoliques, les flavonoïdes, les lignines, les
tanins et dans une moindre mesure les stibènes et les lignanes.
24
Synthèse Bibliographique
II-1 Les acides phénoliques
Ce sont des composés phénoliques simples
formés généralement par un seul noyau aromatique
possédant un ou plusieurs groupements dont un parmi eux se termine par
une fonction acide. Cette famille de composés est la plus abondante dans
les aliments. Dans les plantes, la majorité des acides
phénoliques sont soit associés avec des fibres ou bien
liés à l'hémicellulose moyennant des liaisons esters
(Clifford et Scalbert, 2000).
Les acides phénoliques se divisent en plusieurs types
de composés, selon le nombre de carbones dans la chaîne renfermant
la fonction acides. On distingue principalement les acides à squelette
en C6-C1 (acides galliques, salicylique et protocatéchuique),
les acides à squelette en C6- (acides
phénylacétiques) et les acides à squelette en
C6-C3 (acides hydroxycinnamiques comme acide caféique, acide
p-coumarique) (Herrmann, 1989).
II-2 Les flavonoïdes
Le nom flavonoïde est dérivé du
mot « Flavus » en latin, qui signifie jaune. L'intérêt
nutritionnel pour les flavonoïdes date de la découverte de la
vitamine C par Szent Gyorgyi en 1938 (Szent-Görgyi, 1938 ;
Bruneton, 1993). Les flavonoïdes sont considérés comme des
micronutriments importants puisqu'ils peuvent jouer des rôles
antioxydants (Alan & Miller, 1996).
On regroupe sous le terme de « flavonoïdes
» les polyphénols possédant un squelette chimique en
(C6-C3-C6). Cette structure chimique est constituée de deux cycles
aromatiques liés par un hétérocycle oxygéné
renfermant trois atomes de carbones (Knekt et al., 1996). Les
flavonoïdes sont classés en fonction de leur degré
d'oxydation en anthocyanidines, flavonols, flavonols (catéchine),
flavones, flavanones, et flavanonols.
Ces flavonoïdes sont retrouvés dans les
végétaux et plus particulièrement dans les fruits et
légumes sous forme glycosylée rendant ainsi la molécule
plus hydrolysable. Les sucres couramment rattachés aux flavonoides sont
le glucose, le galactose, le rhamnose, la xylose, l'arabinose ainsi que des
disaccharides tels que la rutinose (Hopia & Heinonen, 1999).
II-3 Les tannins
Ce terme englobe les polyphénols formés
d'enchaînement de groupements phénoliques n'ayant pas
forcément la même structure mais ayant des
propriétés chimiques voisines. Généralement, on
désigne par « tannins » des composés phénoliques
ayant un poids moléculaire compris entre 500 et 3000 Da et qui sont
capables de se combiner aux protéines ou aux autres polymères
végétaux comme la cellulose ou la pectine (Metche et Girardin,
1980). Seuls les polymères de faible poids moléculaire sont
solubles dans l'eau. Au-delà d'un
25
Synthèse Bibliographique
certain poids moléculaire, les tannins sont insolubles
dans l'eau et entièrement non absorbables. La structure biochimique des
tannins est encore mal connue. Cependant, il est courant de distinguer les
tannins hydrolysables des tannins condensés (Zhao et Hagerman, 1995).
II-4 La lignine
La lignine peut être définie comme étant
les parties non glucidiques de la membrane cellulaires des
végétaux. La composition de la lignine varie en fonction de la
plante dont elle est extraite et des conditions d'extraction. La lignine
résulte de la polymérisation d'un composé
phénolique en C6-C3 de nature para-hydroxycinnamylique qui
serait essentiellement de l'alcool para-coumarylique et de ces
dérivés méthoxylés : l'alcool coniférylique
et l'alcool sinapylique (Himmel et al., 1991).
La lignine est le principal constituant du bois. Elle
présente de l'ordre de 20 à 30 % de carbone de la biomasse
végétale. C'est le deuxième composé organique de la
biosphère après la cellulose. C'est une source naturelle
renouvelable et abondante. La lignine se dépose entre les constituants
polysaccharidiques des parois des cellules végétales
spécialisées dans les fonctions de soutien et de conduction. La
biodégradation de la lignine est possible par les enzymes
ligninolytiques tels que la lignine peroxydase (LiP) et la manganése
peroxydase (MnP) (Sayadi & Odier, 1995).
III- Les polyphénols de l'olivier
Outres les triterpènes, les lipides, les glucides, et
les protides, l'olivier renferme des composés phénoliques dans
les feuilles et les fruits. Les produits phénoliques de l'olivier sont
conventionnellement désignés sous le terme «
polyphénols » même pour ceux comportant un seul noyau
aromatique ou/et possédant un seul groupement hydroxyle (Ryan &
Robards, 1998). Ces polyphénols sont des métabolites secondaires
qui résultent de la transformation des shikimates et des
phénylpraponoides an niveau de la plante. Les polyphénols de
l'olivier sont très variés et peuvent être
répertoriés selon six groupes majeurs à savoir : les
dérivés benzoïques, les dérivés cinnamiques,
les flavonoïdes, les iridoides, les tannins et les lignines. Les
constituants de ces différents groupes referment à leur tour des
« O-glucosides » pour les quels un ou plusieurs groupement hydroxyles
sont liés à un ou plusieurs sucres. Parmi ces sucres figurent
principalement le glucose et en faible proportion le rhamnose et les
disaccharides (Bitonti et al., 2000).
26
Synthèse Bibliographique
IV- Changement de la composition en polyphénols
durant la maturation de l'olive
La floraison de l'olivier marque le début du
développement du fruit. A près six à huit mois de la
floraison, l'olive atteint son poids maximum. Cette étape est suivie par
des modifications physiologiques du fruit ainsi qu'un changement de sa couleur.
C'est l'apparition de la couleur noire violacée qui indique la fin de la
morphologie de l'olive (Ryan et Robards, 1998 ; Jemai et al., 2009).
Des études antérieures ont montré que la maturation de
l'olive est accompagnée par la disparition de certains composés,
l'apparition de nouveaux composés et l'évolution de
l'activité de plusieurs enzymes intervenant dans la biosynthèse
ou la biodégradation des polyphénols (Amiot et al.,
1989). Par exemple, durant la première phase de maturation où
l'olive reste constamment verte, on assiste à une régression de
la concentration en chlorophylle et un enrichissement en huile. Par ailleurs,
plusieurs chercheurs ont montré qu'au cours de la maturation des olives,
les polyphénols de haut poids moléculaire subissent des
hydrolyses enzymatiques en donnant naissance à d'autres produits
phénoliques (Fig. 4) (Bouaziz et al., 2005). Cette hydrolyse
concerne en particulier l'oleuropéine qui est le polyphénol le
plus abondant dans la pulpe et dont sa concentration peut atteindre 14 % du
poids sec de l'olive. Amiot et ses collaborateurs (1989) ont montré que
la dégradation de l'oleuropéine dans l'olive s'accompagne de
l'accumulation de trois composés : l'hydroxytyrosol,
l'oleuropéine aglycone et l'acide élénolique (Fig 5).
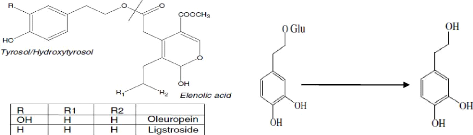
b
a
?-glucosidase
Figure 5 : Libération de
l'hydroxytyrosol et le tyrosol suite de la dégradation de
l'oleuropéine et le ligstroside respectivement (Visioli & Galli,
2003) (a); produit d'hydrolyse d'hydroxytyroosol 4-â-D-glucoside
(4-beta-D-glucosyl-3-hydroxyphenylethanol) (b).
V- Intérêts des
polyphénols
Pour les nutritionnistes, l'intérêt des les
polyphénols a pris de l'ampleur depuis que certaines de ces substances
se voient attribuer un certain nombre d'activités
bénéfiques que ce
27
Synthèse Bibliographique
soit pour les plantes (sources de ces polyphénols) que
pour l'homme (consommateur de ces polyphénols).
V- 1 Vis-à-vis des plantes.
L'intégration du métabolisme phénolique
dans le processus général du développement d'un organe
végétal pose en elle-même la question d'un
intérêt éventuel de ces substances pour les plantes. Les
travaux plus anciens ont montré que les polyphénols seraient
associés à de nombreux processus physiologiques : croissance
cellulaire, différenciation organogène, dormance des bourgeons,
floraison et tubérisation (Parr & Bolwell, 2000). Les
polyphénols et en particulier les anthocyanes et certains
flavonoïdes interviennent dans la qualité alimentaire des fruits et
participent à la coloration des fruits mûrs. Ces composés
déterminent également la saveur des fruits : les tannins sont
à l'origine de la sensation d'astringence des fruits non mûrs
(Talcott & Howard, 1999). Les flavanones sont responsables de l'amertume
des citrus et peuvent donner naissance, par transformation chimique, à
des dihydrochalcones à saveur sucrée (Hollman et al.,
1996).
D'autres composés phénoliques sont
impliqués lorsque la plante est soumise à des blessures
mécaniques. C'est ainsi que des phénols simples sont
synthétisés et l'activité peroxydasique
caractéristique des tissus en voie de lignification est stimulée.
Ces réactions aboutissent donc à la formation au niveau de la
blessure d'un tissu cicatriciel résistant aux infections. De plus, la
capacité d'une espèce végétale à
résister à l'attaque des insectes et des microorganismes est
souvent corrélée avec la teneur en composés
phénoliques. Par ailleurs, certains polyphénols responsables de
la coloration et l'odeur des fleurs représentent des signaux visuels
ainsi que sensoriels qui attirent les insectes pollinisateurs (Robards et
al., 1999).
V-2 Vis-à-vis de l'homme
Notre organisme est en permanence soumis à un stress
oxydant associé au métabolisme de l'oxygène dans nos
cellules. Ce métabolisme est utile pour la production d'énergie,
pour la défense contre des microorganismes pathogènes ainsi que
pour la détoxification de molécules toxiques. Mais, ce stress
oxydant a aussi des effets délétères sur les tissus et
induit une augmentation du risque de cancers, des maladies cardio-vasculaires,
d'ostéoporose ou des maladies inflammatoires (Bravo, 1980). La
consommation des polyphénols contenus dans les aliments contribue
à limiter ce stress oxydant et probablement à réduire les
risques de développer ces pathologies (Chung et al., 1998).
28
Synthèse Bibliographique
Ingérés par l'homme, les polyphénols sont
absorbés à travers la barrière intestinale et parviennent
au niveau des tissus cibles où ils peuvent exercer des effets
protecteurs. L'effet majeur des polyphénols sur les tissus humains
réside dans le pouvoir antioxydant de ces micronutriments. C'est ainsi
que les bienfaits des polyphénols semblent être étroitement
liés à leur exceptionnelle capacité à piéger
et à neutraliser les radicaux libres qui sont des espèces
extrêmement réactives et fortement néfastes pour
l'organisme. En effet, ces radicaux libres provoquent l'oxydation des divers
constituants de la cellule (en particulier sa membrane) entraînant ainsi
l'accélération de son vieillissement et de sa destruction.
Cependant, les polyphénols ne semblent jouer un rôle effectif que
s'ils sont sous formes biochimiques bien spécifiques. En effet,
l'activité antioxydante de chaque composé est liée
à la structure chimique de sa molécule :
? Nombre et position des groupements hydroxyles dans la
molécule.
? Rattachement d'un ou plusieurs glucides aux groupements
hydroxyles dans la molécule.
? Forme tridimensionnelle de la molécule.
Pendant les deux dernières décennies, il a
été démontré que les effets
bénéfiques des polyphénols vis-à-vis de l'organisme
vont convenablement au-delà de leurs propriétés
antioxydantes, comme le signalent un grand nombre de travaux. Les
polyphénols inhiberaient notamment l'agrégation plaquettaire,
réduisant ainsi les risques de thrombose et diminueraient la
perméabilité des vaisseaux ouvrant ainsi la voie à la
prévention des maladies cardio-vasculaires (Petroni et al.,
1995). Par ailleurs, les polyphénols joueraient un rôle clé
dans la protection cancéreuse en stimulant les enzymes de
détoxification et en inhibant la division des cellules malignes (Visioli
et al., 1998). De plus, il a été établi que les
polyphénols pourraient prévenir les maladies
neurodégénératives tels que la maladie de parkinson et
d'alzeimer et exercer plusieurs activités biologiques
intéressantes en particulier les activités anti-inflammatoires,
anti-bactériennes, anti-fongiques, hypotenseurs, diurétiques et
anti-hémorragiques (Tanabe et al., 1995). Il a
été convenu que les polyphénols sont promus à un
avenir thérapeutique envers toutes les pathologies engendrées par
les radicaux libres.
29
Synthèse Bibliographique
Les Antioxydants
I- Introduction
Il est très bien connu que tous les produits
alimentaires subissent au cours de leur conservation ou de leur transformation
des altérations de type oxydatif. L'auto-oxydation d'un aliment est un
phénomène purement chimique très complexe mettant en jeu
des réactions radicalaires capables de s'auto-entretenir et qui ne
nécessite pas la présence de l'oxygène
atmosphérique (oxygène activé bi-radicalaire). Dans le cas
des huiles, les premiers produits formés instables sont des
composés peroxydiques dont la structure dépond de la nature des
acides gras attaqués. Les radicaux alcool qui en dérivent par
scission conduisant à de multiples produits secondaires dont la nature
et les proportions dépendent de différents paramètres.
Parmi ces produits, apparaissent les molécules volatiles
(aldéhydes, hydrocarbures, alcools, acides, ...) qui modifient la
flaveur d'origine et confère une odeur et un goût
caractéristique de rance d'où la notion du « rancissement
des lipides ». Ils deviennent alors impropres à la consommation.
II- Les radicaux libres II-1
Définition
Un radical libre est une espèce chimique, atome ou
molécule, contenant un électron non apparié sur l'orbitale
externe (Jadot, 1994). Ces électrons non appariés rendent ces
espèces très instables et donc très réactives et
pour se stabiliser, elles vont tenter d'apparier leur électron
célibataire. Les radicaux libres peuvent avoir des origines externes ou
internes à l'organisme (Bhuiyan et al., 2009) :
- Externes : tabagisme actif ou passif, alcool, certains modes de
cuisson (barbecue, micro-ondes), pollution, stress, fatigue, rayons X
(radiographie), exposition au soleil, changement hormonal, certains
médicaments et l'exercice physique intensif.
- Internes : allergies, inflammations, infections et
micro-lésions tissulaires.
Plusieurs espèces radicalaires existent dans la nature,
celles dérivant de l'oxygène sont appelées radicaux libres
oxygénés (ROS de l'acronyme anglais Reactive Oxygen Species),
celles dérivant du carbone et celles dérivant de l'azote (oxyde
nitrique .NO, peroxynitrite .NO3-, ...). Dans
ce qui suit, nous citerons juste les ROS.
30
Synthèse Bibliographique
II.2. Nature des radicaux libres
II.2.1. Les espèces réactives
dérivées de l'oxygène
Les ROS résultent de réductions
mono-électroniques successives du dioxygène (O2)
aboutissant à la formation d'eau (Fig. 6).
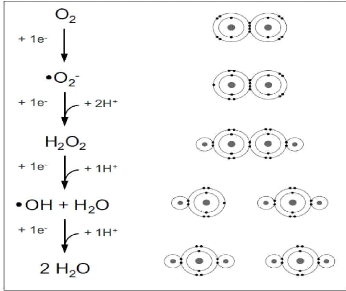
Figure 6 : Les radicaux
libres oxygénés «ROS» représentant les
différents états de réduction
du dioxygène
(Farr & Kogoma, 1991).
La configuration électronique du dioxygène
montre qu'il est avide d'électrons, ce qui lui confère un
caractère oxydant. Sa faible réactivité s'explique par sa
structure électronique. En effet, bien qu'il possède un nombre
pair d'électrons, il présente deux électrons non
appariés au niveau de ses orbitales moléculaires. Au contraire,
le dioxygène réagit en transférant un seul électron
à la fois, ce qui conduit, par ordre de réduction, à la
formation du radical superoxyde
(·O2-), du
peroxyde d'hydrogène (H2O2) et du radical hydroxyle
(·OH)
(Fig.6).
II-2-1-1 L'anion superoxyde : ·O2 -
Si l'oxygène, dans son état fondamental, accepte
un premier électron, celui-ci va occuper l'une des orbitales antiliantes
et former le radical superoxyde
·O2-. Il est plus
instable et plus réactif que la molécule d'oxygène du fait
que l'électron supplémentaire se place dans une orbitale
antiliante.
?O-O + e- O-O (O2 -).
31
Synthèse Bibliographique
II-2-1-2 Le peroxyde: H2O2
Le peroxyde est considéré comme une
espèce réactive dérivée de l'oxygène (ROS),
même s'il n'a pas une structure radicalaire car il est capable d'initier
ou de propager des dommages oxydatifs. Le peroxyde d'hydrogène (H2O2)
provient d'une réaction entre deux anions superoxyde, qui met fin au
processus radicalaire.
2 O2 -+ 2 H+ H2O2 + O2
II-2-1-3 L'hydroxyle : OH
L'hydroxyle (?OH) est très
réactif. Son temps de demi-vie en milieu aqueux est de 10-6
secondes. La coupure homolytique de la liaison O-O du peroxyde
d'hydrogène donne deux radicaux hydroxyles.
H2O2 2 ?OH
Cette rupture de liaison peut être causée par la
chaleur ou par des radiations ionisantes. Cependant, une solution de peroxyde
d'hydrogène avec des ions ferreux suffit à fournir des radicaux
hydroxyle. Cette réaction fut observée pour la première
fois par Fenton en 1894 (Dersoti, 1991).
H2O2 + Fe2 + ?OH + OH- + Fe 3+.
III- Dommages causés par les radicaux libres
Les radicaux libres sont à l'origine de
réactions en chaîne qui conduisent à des destructions
cellulaires. Leurs structures cibles essentielles sont l'ADN, les membranes
cellulaires, les lipides, les glucides et les protéines.
III-1 Action sur l'ADN
Les radicaux et en particulier ?OH, s'attaquent aux
différents nucléotides de l'ADN par modification des bases
azotées, par rupture des brins de la chaîne nucléotidique,
ou par déstabilisation de la forme géométrique de l'ADN en
rompant les liaisons hydrogène entre bases complémentaires. Ils
peuvent également être à l'origine de multiples
lésions cellulaires en attaquant les membranes cellulaires. Toutes ces
actions conduisent au développement de maladies telles que le cancer, le
vieillissement cellulaire,... etc.
III-2 Action sur les lipides
Les lipides sont une cible privilégiée des
radicaux libres qui provoquent l'oxydation des acides gras poly-insatures
(AGPI) des phospholipides membranaires. Le phénomène
d'auto-oxydation ou peroxydation lipidique (Fig. 7), consiste en l'attaque par
un radical libre, d'origine exogène ou endogène, de
dérives lipidiques.
32
Synthèse Bibliographique
Figure 7 : Mécanismes de la
peroxydation lipidique
Cette reaction est à l'origine de la formation
d'hydroperoxydes (ROOH) lipidiques. Les peroxydes lipidiques (ROO ) peuvent
aussi réagir avec d'autres composes cellulaires et être à
l'origine de molécules très toxiques. Par exemple, ils peuvent
réagir avec l'ADN et être à l'origine de substances
mutagènes.
III-3 Action sur les glucides
Les radicaux libres peuvent aussi agir sur le glucose et
générer des intermédiaires réactifs. Les dommages
oxydatifs peuvent alors se propager via l'attaque de radicaux formés sur
d'autres molécules.
III-3 Action sur les protéines
Les radicaux libres peuvent réagir avec les
différents acides aminés et donc altérer la structure des
protéines. Les fonctions de multiples enzymes, de récepteurs et
de protéines de transport cellulaire peuvent ainsi être
modifiées. C'est donc toute la machinerie cellulaire qui peut être
affectée.
IV- Mécanisme d'action des antioxydants
Un antioxydant est une substance qui, ajoutée à
faible dose à un produit naturellement oxydable à l'air, est
capable de ralentir le phénomène d'oxydation en augmentant le
temps au bout du quel il y a une altération décelable du produit.
L'antioxydant peut agir de trois différentes manières :
33
Synthèse Bibliographique
? En inhibant la formation des radicaux libres, on parle
d'antioxydant de rupture de chaîne désigné aussi sous forme
« Antioxydant vrai ».
? En fixant directement l'oxygène
préférentiellement dans la phase de propagation.
? En chélatant les métaux catalyseurs
d'oxydation, on parle alors « d'Antioxydant secondaire ».
D'autres substances dites synergistes sont capables de
régénérer un antioxydant vrai de type phénolique
sous sa forme active. Les antioxydants les plus répondus (AH) bloquent
l'auto-oxydation des lipides en donnant des atomes d'hydrogènes aux
radicaux lipidiques (RO°) et (ROO°) selon les réactions
suivantes :
RO° + AH ROH + A°
ROO° + AH ROOH + A°
Pour que l'antioxydant (AH) soit très actif, il est
nécessaire que le radical qui en dérive (A°) soit plus
stable que le radical lipidique (RO° ou ROO°) ou soit facilement
transformé en un produit stable. C'est ainsi que les antioxydants les
plus actifs sont de nature phénoliques. En effet, ils donnent naissance
à des radicaux très stables suite à la
délocalisation de l'électron célibataire sur le noyau
aromatique correspondant.
En ce qui concerne les antioxydants secondaires, ils agissent
soit en chélatant les métaux ou bien en captant l'oxygène.
C'est ainsi que la chélation des ions métalliques diminue l'effet
pro-oxydant de ces ions et augmente l'énergie d'activation des
réactions d'initiation bloquant ainsi les réactions radicalaires
d'oxydation. L'acide citrique, l'EDTA, les poly-phosphates sont de bons
chélateurs et sont largement utilisés dans les milieux
alimentaires souvent en synergie avec des antioxydants primaires notamment les
ortho-dihydroxyflavonoïdes. L'acide ascorbique, l'acide isoascorbique et
le palmitate d'ascorbyle peuvent piéger différentes formes
d'oxygène et les éliminer ainsi d'un système fermé.
Ces composés sont particulièrement actifs en combinaison avec des
antioxydants primaires, tels que les tocophérols (Berset & Cuvelier,
1995).
Il existe également des antioxydants enzymatiques tels
que la glucose-oxydase et la catalase qui consomme l'oxygène dissous
dans le milieu et décomposent les peroxydes lipidiques en produits
stables (Barlow, 1990).
34
Synthèse Bibliographique
V- Différents types d'antioxydants
V-1 Antioxydants synthétiques
Le butylhydroxyanisole (BHA) (E 320) et le
butylhydroxytoluène(BHT) (E 321) sont les antioxydants
synthétiques les plus utilisés dans l'industrie agroalimentaire.
Ces deux additifs sont insolubles dans l'eau mais ont une bonne
solubilité dans les milieux lipidiques. Ils sont stables dans les
conditions opératoires de la plupart des procédés
industriels. Ils sont volatils et donc facilement entraînables à
la vapeur d'eau. Ils peuvent agir en synergie avec les galates et l'acide
citrique. Plus d'études ont montré que le BHT et le BHA sont
toxiques et/ou cancérigènes à haute dose. Leur utilisation
est donc en baise (Gordon, 1990).
Le 2-tertiobutyl-4-hydroxyquinone (TBHQ) est parfaitement
soluble dans les matières grasses et il est très efficace dans
les huiles végétales. Il est stable à hautes
températures et peu volatils. La présence d'agents
chélateurs tels que l'acide citrique peut augmenter
considérablement les propriétés antioxydantes du TBHQ. Ce
composé est autorisé aux Etats-Unis, mais il est interdit en
Europe à cause de suspicion de sa génotoxicité (Coppen,
1989).
Les gallates de propyle (E 310), d'octyle (E311) et de
dodécyle (E 312) sont préparés industriellement par
estérification de l'acide gallique. Ils sont moins solubles dans les
matières grasses que le BHT et BHA. Ils sont sensibles à la
chaleur, ce qui les rend inaptes à l'utilisation dans des produits qui
doivent subir une cuisson à haute température. Ils
chélatent les ions fer en présence d'eau générant
alors des produits de couleur bleu-noir désagréable pour le
consommateur. Ils sont donc toujours utilisés avec des agents
complexants tels que l'acide citrique.
Actuellement, l'emploi des molécules antioxydantes de
synthèse est remis en cause en raison des risques toxicologiques
potentiels et de cancérisation. C'est pour cela que la
législation du comité européenne a interdit l'utilisation
des antioxydants de synthèse avec une concentration dépassant les
200 ppm (mg/kg). Par conséquent, et vue le désir des
consommateurs de retourner à l'utilisation des produits naturels, la
recherche des sources naturelles d'antioxydants a suscité
l'intérêt des grands laboratoires spécialisés
(Frankel, 1993).
35
Synthèse Bibliographique
V-2 Antioxydants naturels employés
Différents antioxydants naturels sont actuellement
commercialisés par plusieurs sociétés tels que :
Grindstedt, Eastman, Henkel, Kemin ou Roche. Ces antioxydants sont fournis sous
forme d'extrait à partir de la source naturelle correspondante (Six,
1994).
Parmi les antioxydants naturels, paraissent les
tocophérols et les tocotriénols qui sont largement
utilisés et ont fait l'objet de nombreuses études. Ils sont
autorisés en alimentation humaine sous forme d'extraits naturels ou sous
forme d'isomère de synthèse. Leur grande solubilité dans
les huiles et les graisses leur confère un intérêt
particulier. En effet, ils sont capables d'interrompre la réaction en
chaîne d'oxydation en agissant comme donneurs d'hydrogène via un
radical hydro-peroxyde. Un effet synergique est mis en évidence avec le
palmitate d'ascorbyle et un effet pro-oxydant a été
constaté au-delà de 500 ppm (Cuvelier et al., 1990).
Issu de l'huile de sésame, le sésamol
présente une bonne activité antioxydante. Il est présent
naturellement sous forme de dimère ou de diphénol. L'acide
ascorbique, un autre antioxydant naturel intéressent, il est
considéré comme synergiste car, en se transformant en acide
dihydro-ascorbique, il permet d'hydrogéner les antioxygènes
phénoliques oxydés par les peroxydes et de complexer les
métaux pro-oxydants. Il est autorisé dans toute matière
grasse à la concentration de 300 ppm. Cependant, sa solubilité
dans les huiles semble difficile. Son pouvoir antioxydant est supérieur
à celui de BHA et du BHT dans les huiles et peut également
être supérieur à celui de delta-tocophérol et des
extraits de romarin (Castera-Rossignol & Bosqua, 1994).
Les autres antioxydants d'origine naturelle sont des produits
extraits de plantes et en particulier des épices : romarin, thym, cumin,
clou de girofle, sauge et origan. Les molécules actives présentes
dans ces sources naturelles d'antioxydants sont soit des flavonoïdes, soit
des dérivés d'acide benzoïque, soit des
dérivés de l'acide cinnamique. D'autres molécules telles
que le carnosol et le rosmanol sont citées dans les extraits de romarin
(Farag et al., 1989).
VI- Sources végétales d'antioxydants
On connaît depuis longtemps des plantes efficaces dans
la protection des matières grasses contre l'oxydation. Les plantes les
plus étudiées et employées dans ce domaine sont les
épices
36
Synthèse Bibliographique
et les herbes aromatiques. L'utilisation directe des plantes
étant assez difficile cause de leur goût, odeur et
incompatibilité avec les formulations alimentaires, ce sont surtout les
extraits qui sont employés. La plupart des espèces qui ont une
forte activité antioxydante appartiennent à la famille des
Lamiacées (Moure et al., 2001). C'est le cas de romarin, sauge,
thym, cumin, sarriette, basilic, origan etc,... on connait aujourd'hui
l'activité antioxydante d'un nombre élevé de plantes et de
partie de plantes. Brand-Williams, Cuvelier et Brest (1995) les ont
passées en revue :
? Parmi les graines, on peut citer la couche à aleurone
et les germes de riz, de soja, d'avoine, d'orge, des haricots Azuki, du coton
et du sésame.
? Parmi les feuilles, on peut citer celles de luzerne, orge,
épinard, café et surtout le thé vert qui est très
riche en catéchines et dont les extraits antioxydants sont
commercialisés au Japon.
? Parmi les huiles, il y a à titre d'exemple les huiles
essentielles de thym, de clou de girofle, de menthe et des huiles de palm, de
coco et particulièrement l'huile d'olive où on retrouve des
quantités importantes de polyphénols.
Outre ces sources naturelles d'antioxydants, l'olive et son
huile ainsi que ses co-produits constituent les sources naturelles les plus
intéressantes d'antioxydants phénoliques qui présentent
empiriquement une certaine activité vis-à-vis l'oxydation des
corps gras (Visioli et al., 2002). Des travaux antérieurs ont
démontré le rôle de certains composés
phénoliques de l'olive à propos la bonne résistance
à l'oxydation radicalaire des huiles d'olive vierge. Il s'agit
principalement de l'oleuropéine, du tyrosol, de l'hydroxytyrosol et de
l'acide caféique (Bisignano et al., 1999 ; O Dowd et
al., 2004). Ces composés sont présents dans les margines
à des concentrations variant de 1 à 15 g/l (Visioli et
al., 1995 b).
L'hydroxytyrosol (3,4-dihydroxyphényléthanol),
est l'un des ortho-diphénols majoritaires des margines. Il est
doté de fort pouvoir antioxydants (Capasso et al., 1999 ;
Casalino et al., 2002). Plusieurs études antérieures ont
pu établir le classement suivant par ordre décroissant du pouvoir
antioxydant :
Hydroxytyrsol > Acide Caféique > BHT>
Oleuropéine > Tyrosol.
Synthèse Bibliographique
On attribue à l'hydroxytyrosol par ailleurs des
propriétés hypotensives, cicatrisantes, anti-inflamatoires et
plusiers autres activité biologiques très
bénéfiques pour la santé humaine (Manna et al.,
1997 b).
L'oleuropéine est le principal composé
phénolique de l'olive avec une teneur s'échelonnant de 20
à 100 mg/g d'extrait sec (Briante et al., 2004). Cependant, on
le retrouverait seulement à l'état de traces dans l'huile d'olive
et dans les margines car son hydrolyse lors de l'extraction de l'huile produit
l'hydroxytyrosol (Capasso, 1997). Selon le même auteur,
l'oleuropéine dispose d'un pouvoir antioxydant voisin de celui de BHT. A
la même concentration molaire dans l'huile d'olive, l'oleuropéine
serait plus efficace que le tyrosol mais restait moins efficace que
l'hydroxytyrosol et l'acide caféique.
Le tyrosol est un composé majoritaire dans l'huile
d'olive et dans les margines mais son pouvoir antioxydant reste
inférieur de celui de BHT et à d'autres composés de
l'huile d'olive (Miro-casas et al., 2003).
Enfin, l'acide caféique, ayant une structure chimique
ortho-diphénolique, présente une activité antioxydante
proche de celle de l'hydroxytyrosol.
37
38
Synthèse Bibliographique
La Bioconversion
I- Introduction
Les modes classiques de production des additifs naturels tels
que les arômes et les antioxydants, ne s'avèrent plus assez
performants face à la demande graduelle et croissante des industries
alimentaires, pharmaceutiques et cosmétiques. L'extraction à
partir des matières premières naturelles présente quelques
inconvénients tels que le risque de contamination par les solvants
d'extraction et le prix de revient très élevé. La
synthèse chimique, quant à elle, ne convient pas aux
consommateurs qui apprécient peu les composés artificiels. Les
additifs produits par le biais de la biotechnologie semblent être la
réponse pour faire face à ces inconvénients. En effet, les
méthodes de synthèse biologique offre l'avantage de
bénéficier de la dénomination de « Substance
Naturelle » tout en permettant aux fabricants de s'affranchir des
aléas liés à la production agricole. Dans ce contexte, la
communauté Européenne a établi en juin 1988 des directives
très strictes visant à réglementer le domaine de la
production des composés par voies biologiques : seules les substances
issues des procédés mettant en oeuvre des cellules animales, des
cellules végétales, des microorganismes et/ou leurs enzymes tout
en utilisant des précurseurs d'origine naturelle, peuvent
bénéficier de « Label Naturel ». De plus, la
stéréospécificité de certains systèmes
enzymatiques microbiens permet d'accéder aisément à des
molécules optiquement actives difficiles à obtenir par
synthèse chimique (Burkhaed et al., 1994). La biotechnologie
donne la possibilité de réaliser en une seule étape de
synthèse qui nécessitent souvent de nombreuses réactions
compliquées mettant en jeu des réactifs
généralement toxiques (Eyal et al., 2000).
II- Mode de production
Grâce aux progrès réalisés dans le
domaine des connaissances sur le fonctionnement des organismes vivants, le
champ d'action des procédés utilisant des microorganismes ou des
enzymes purifiés pour la production de molécules à haute
valeur ajoutée a été considérablement
élargi. Les molécules produites par des procédés
biotechnologiques sont parfois appelés « produits
néo-naturels ». Ils sont synthétisés par des enzymes
proches ou identiques à ceux normalement mis en jeu dans la
matière première végétale. Une synthèse
39
Synthèse Bibliographique
biologique peut être réalisée soit par des
microorganismes ou soit par des systèmes enzymatiques.
II-1 Synthèse microbiologique
Ce mode de production appelé aussi « fermentation
», fait appel à l'emploi des bactéries ou des champignons
cultivés en présence du réactif choisi comme
précurseur de la molécule à synthétiser. Ce type de
réactions biologiques est relativement facile à mettre en oeuvre.
La culture envisagée peut être améliorée par
l'optimisation des souches et des conditions expérimentales (Barhini
et al., 1998). Les processus de bio-production mettent en jeu des
réactions diverses telles que l'hydroxylation, l'oxydation, la
réduction, l'hydrolyse, l'estérification, la
décarboxylation, la méthylation, la condensation et
l'isomérisation. Les réactions de bio-production ont
été appliquées pour la production de plusieurs types de
produits en particulier les arômes et les antioxydants aromatiques (Edlin
et al., 1995).
L'exemple typique pour la production d'arôme
réside dans la synthèse de la vanille. Plusieurs études
ont montré que certaines bactéries (Pseudomonas putida,
Streptomyces setonii, Amycolatopsis...) et certains
champignons (Pycnoporus cinnabarinus, Aspergillus niger, ...)
sont capables de convertir l'acide férulique en vanilline (Muheim &
Lerch, 1999). La vanilline a été aussi produite suite à la
bioconversion de l'isoeugénol moyennant une bactérie de type
Bacillus sp (Eyal et al., 2000).
II-2 Synthèse enzymatique
Cette méthode met en jeu des enzymes purifiées
et immobilisées sur un support convenable. Le choix de la nature
d'enzyme dépend des structures chimiques du composé
précurseur et du produit à synthétiser. C'est ainsi que
pour produire un ortho-diphénol il convient d'utiliser une
monoxygénase, par ailleurs, en partant d'un précurseur
dépourvu de groupement hydroxyle, il est nécessaire d'employer
une dioxygénase. Ce type de réactions de bioconversion
nécessite l'utilisation de cofacteur tels que : NADH, NADPH et ATP
(Bouallagui & Sayadi, 2006). Sur le plan pratique, les réactions de
bioconversion utilisant des cellules (en croissance stationnaire) semblent
être plus intéressantes que celles mettant en jeu des enzymes
purifiées. Par ailleurs, la régénération des
cofacteurs constitue généralement un handicape à
l'utilisation de nombreuses enzymes.
40
Synthèse Bibliographique
III- Bioconversion des margines en produits utiles
Le procès de la bioconversion biologique des margines
mène à de panoplies de produits à hautes valeurs
ajoutées à travers des fermentations submergées liquides
et/ou des fermentations à l'état solide (Solid State fermentation
« SSF »). Ces idées ont intéressé plusieurs
laboratoires de recherche. Comme le montre le tableau 2, différentes
recherches ont été effectués durant ces dernières
années.
Tableau 2 : Produits à haute valeur
ajoutée obtenus par la bioconversion des margines
|
Résidus
|
Description process/ Biocatalyse
|
Produits
|
Réferences
|
|
Margine
|
Clostridium spp
|
Butanol (2.8-8 g/L)
|
Wahner et al., 1988
|
|
Margine
|
Arthobacter spp
|
Acide Indolacétique.
|
Tomati et al., 1990
|
|
Margine
|
Pseudomonas aeruginosa
|
Biosurfactant : rhamnolipid
|
Mercade et Manresa(1994)
|
|
Margine
|
Propionibacterium shermanii dans le margine
prédigéré par Aspergillus niger
|
Vitamin B12
|
Munoz, 1998
|
|
Margine
|
Eschericha coli P-260 Recombinante par l'expression de
l' enzyme 4-HPA hydrolase de Klebsiella pneumoniae
|
Pigments Synthétiques, colorants, alkaloides et polymers
avec la structure de base est un quinone
|
Martin et al., 1998
|
|
Margine
|
Funalia trogii ATC00800 Trametes versicolor
ATC00801
|
Hormones végétales de croissance : Acide
Gibberellique, Acide abscisique et indolacetique et cytokinine
|
Yurekli et al., 1999
|
|
Margine
|
Paenibacillus jamilae CP-7, dans des conditions
aérobiques dans un milieu à base de margine
|
Exo-polysaccharide : agent antitumoral avec des
propriétés inmunomodulateur
|
Ruiz-Bravo et al., 2001
|
|
Margine
|
Azotobacter chroococcum
|
Bioplastic: Homopolymers of 3-
hydroxybutyrate and 3-hydroxyvalerate
|
Pozo et al., 2002
|
IV-Bioconversion des composés phénoliques
41
Synthèse Bibliographique
III-1 Bioconversion de l'oleuropéine par la
Ji-glucosidase thermophile immobilisée recombinante de Sulfolobus
solfataricus
L'hydrolyse enzymatique de l'oleuropéine par la
13-glucosidase a été déjà
décrite (Limiroli et al., 1995). Elle engendre l'obtention de
l'oleuropéine aglycone. L'immobilisation d'une â-glucosidase
recombinante et thermophile de Sulfolobus solfataricus sur un support
en chitosane afin d'hydrolyser enzymatiquement l'oleuropéine à 60
et 70°C a été envisagée par Briante et al.
(2000). En supposant que l'hydrolyse enzymatique n'attaque qu'uniquement
la liaison glucosidique, la biotransformation ne génèrent alors
que des espèces aglycones instables qui en se clivant par une
température supérieure à 60 °C donneront une
quantité considérable en hydroxytyrosol. L'utilisation d'une
enzyme immobilisée thermophile dans un bioréacteur peut
résoudre les problèmes techniques relatifs à l'hydrolyse
de différents substrats. En effet, les hautes températures
utilisées limitent la croissance microbienne et aident à la
solubilisation du substrat. Dans le cas de l'hydrolyse de l'oleuropéine,
l'élévation de la température permet en une seule
étape et pendant un bref délai suite à une hydrolyse
enzymatique de l'oleuropéine et une hydrolyse chimique de l'aglycone
oleuropéine, l'obtention d'hydroxytyrosol (Briante et al.,
2000).
III-2 Bioconversion de l'oleuropéine des olives
L'oleuropéine des olives en saumure est
hydrolysée par la â-glucosidase (EC 3.2.1.2.1), enzyme produite
par la souche oleuropéinolytique telle que Lactobacillus
plantarum. Cette souche peut être isolée à partir
d'une saumure naturelle d'olives mûres non soumises à un
traitement alcalin. Lactobacillus plantarum est une bactérie
sous forme de bâtonnets, croît sur un pH limite de 3,5 et
tolère jusqu'à 1% d'oleuropéine et 8% de NaCl dans le
milieu de culture (Ciafardini et al., 1994). La â-glucosidase
produite par cette souche hydrolyse le
5-bromo-4-chloro-3-indolyl-â-D-glucopyranoside et
l'oleuropéine.
De plus, durant la maturation des olives, la
dégradation de l'oleuropéine sous l'action du
13-glucosidase et l'estérase a été mis en
évidence par Briante et al., 2002. Probablement, pendant la
maturation des olives, ces activités enzymatiques rétablies sont
en corrélation étroite avec la maturation des olives. Ils peuvent
être utilisés pour la caractérisation biochimique de
différentes variétés d'Olea europaea L. En outre,
la corrélation entre l'activité estérase et la
quantité d'acétyl-CoA suggère que cette activité
est importante dans le procès d'accumulation d'huile dans les olives
matures (Briante et al., 2002).
42
Synthèse Bibliographique
III-3 Bioconversion de l'oleuropéine d'huile
d'olive
En 2002, Ciafardini et Zullo ont démontré pour
la première fois que la 3-glucosidase des levures Saccharomyces
cerevisiae et du Candida wickerhamii peut hydrolyser
l'oleuropéine présente dans huile d'olive. Les analyses
enzymatiques effectuées directement sur l'huile d'olive non
traitée et sur l'huile d'olive stérilisée inoculée
avec les levures mentionnées ci-dessus ont prouvé une
activité 3-glucosidase qui est encore active sur le substrat
synthétique : le p-nitrophenyl 3- D-glucopyranoside (PNPG) et de
l'oleuropéine. L'absence des lipases chez Saccharomyces cerevisiae
et Candida wickerhamii isolées mènent à
soupçonner que les levures contribuent d'une manière positive
à l'amélioration de la qualité organoleptique d'huile sans
changer sa composition en triglycérides (Ciafardini & Zullo,
2002).
III-4 Bioconversion des sous produits de l'industrie
oléicole (grignon et margine)
Un traitement enzymatique des sous-produits d'huile d'olive
employant le surnageant de culture d'Aspergillus niger enrichis en
cinnamoyl estérases (EC 3.1.1.73) a été examiné en
vue de libérer des composés phénoliques simples et libres,
et particulièrement l'hydroxytyrosol. Il a été
envisagé sur un extrait phénolique du sous-produit d'huile
d'olive, obtenu par une extraction à l'éthanol. De grandes
quantités d'hydroxytyrosol libre ont été
libérées et à moins d'ampleur : le tyrosol, l'acide
caféique, l'acide p-coumarique et l'acide férulique
(Bouzid et al., 2005).
III-5 Bioconversion des composés phénoliques
de blé
Bhanja et collaborateur (2009) ont utilisé des
champignons filamenteux GRAS : Aspergillus oryzae et Aspergillus
awamori nakazawa afin d'enrichir le blé en terme de composés
phénoliques ayant des propriétés antioxydantes
intéressantes. Ils ont pu démontrer la corrélation entre
les phénols totaux libérés à partir des grains de
blé et les activités de trois différentes carbohydrate
hydrolase à savoir : á-amylase, 3-glucosidase et xylanase
produites par Aspergillus oryzae. En revanche pour le cas
d'Aspergillus awamori nakazawa, uniquement deux enzymes sont mises en
jeu à savoir, xylanase et 3-glucosidase et qui sont responsables de la
libération des composés phénoliques. Enfin, cette
étude a démontré que la fermentation des graines de
blé est la meilleure source de la phytochimie, de plus
différentes enzymes hydrolysantes les carbohydrates sont responsables du
développement des propriétés de la phytochimie du
blé fermenté.
Synthèse Bibliographique
III-6 Bioconversion des composés phénoliques
du vin
Le secteur oenologique a concentré son attention en
pectinase et glycosidase (Lambrechts et Pretorius, 2000). Les glycosidases sont
prometteuses en libération d'arôme du vin via un mécanisme
d'hydrolyse des précurseurs glycosidiques polymérisant des
molécules jouant le rôle d'arôme, exceptionnellement des
terpènes glycosides, qui sont responsables de différents
caractères du raisin (Winterhalter & Skouroumounis,
1997). Les composés glycosidiques responsables de
l'odeur du vin peuvent être hydrolysés par des traitements
chimiques ou enzymatiques, il s'agit d'un mécanisme faisant intervenir
différents glycosides (Stahl et al.,1993 ; Williams et
al., 1992). Differentes enzymes sont mises en évidence, telles que
la rhamnosidase (Rha, EC 3.2.1.40), l'arabinosidase (Ara, EC 3.2.1.55), et la
â-glucosidase (âG, EC 3.2.1.21) qui est capable de libérer
l'aglycone, qui est en relation directe avec l'augmentation de l'arôme
dans le vin (Gueguen et al., 1996).
43
44
Synthèse Bibliographique
Les Champignons
I- Introduction
Les champignons constituent un règne à part «
Kingdom of Fungi » dans le domaine des Eucaryotes « Domain of Eukarya
» (Woese, 1987 ; Woese et al., 1990).
Les champignons sont des végétaux cryptogames
(végétaux primitifs ne produisant ni fleur, ni fruit, ni graine,
comme les fougères, les algues, les mousses). Dépourvus de
chlorophylle, les champignons ne font donc pas de photosynthèse et ils
ne possèdent ni racine, ni tige, ni feuille. Leur appareil
végétatif est appelé thalle. C'est un agglomérat de
filaments microscopiques dont l'aspect varie selon les espèces. Leur
multiplication est assurée selon les espèces soit par croissance
et division du thalle, soit par émission des spores
différenciées.
II- Classification des champignons
Le règne des champignons comprend 5 embranchements
« phyla » Chytridiomycota, Zygomycota, Ascomycota, Basidiomycota,
et « Deuteromycotina ou Deuteromycetes » (Guarro et
al., 1999).
*L'embranchement des
Chytridiomycota, les chytrids, représente un
groupe de moisissures aquatiques primitives. Les champignons de ce phylum sont
caractérisés par leurs gamètes mobiles au moyen de
flagelles (Berbee & Taylor, 1993).
*Les Deuteromycètes ou l'embranchement
des Deuteromycotina sont aussi appelés les
« moisissures imparfaites ». Ce groupe contient les espèces
pour qui aucune étape sexuelle n'a été découverte.
A un moment donné, beaucoup de moisissures parasites ont
été classées dans ce groupe. Cependant, beaucoup de ces
espèces ont été récemment reclassées dans
d'autres phyla quand l'étape sexuelle a été
découverte. Un exemple de Deuteromycètes est celui de Candida
albicans, une moisissure dimorphique responsable des « infections de
la levure » chez l'homme (Hawksworth et al., 1995).
*Les zygomycètes, l'embranchement des
Zygomycota, sont caractérisés par la
formation de spores sexuelles appelées le zygospore. Ces derniers ne
sont pas contenus dans un sac ou un corps fructifiant spécialisé.
Les Zygospores se forment quand les noyaux haploïdes des cellules apicales
de deux hyphes fondent dans un processus de fécondation pour former
45
Synthèse Bibliographique
ensemble un zygote diploïde. Le zygote subit
immédiatement la méiose pour former des cellules haploïdes
qui se développent en zygospores. Ces derniers sont non
enveloppés ou « nus » et sont regroupés entre les
hyphes parentaux. Un exemple de zygomycète très connu est celui
de la moisissure noire du pain, Rhizopus nigricans (Weitzman et
al., 1995).
*Les ascomycètes sont membres du
l'embranchement des Ascomycota. Ils sont aussi
appelés « moisissures à sac » parce que leurs spores
sexuelles (ascospores) sont regroupées dans des sacs appelés
asci. La formation d'ascospores est semblable à celle de
zygospore, mais les ascospores sont formées par méiose et sont
regroupées dans l'asque. Neurospora crassa est un
ascomycète de grande importance dans les études
génétiques (Eriksson & Hawksworth, 1993).
*Les basidiomycètes, sont
classés dans l'embranchement des
Basidiomycota. Leurs spores sexuelles ou
basidiospores sont formées sur des structures complexes du corps
fructifiant appelé le basidia (Hawksworth et al.,
1995). Quelques basidiomycètes contiennent des moisissures les plus
complexes, y compris les champignons comestibles des forêts exemple : la
vesse-de-loup et champignon de Paris. C'est essentiellement cet embranchement
des champignons qui intervient dans le cycle du carbone et la
dégradation de la matière ligninocellulosique dans la
lithosphère. Les décomposeurs de bois ou basidiomycètes
peuvent être groupés dans trois catégories, moisissures de
la pourriture blanche (WRF) et moisissures de la pourriture brune (BRF), un
troisième groupe les moisissures décomposant la litière
(MDL). Les basidiomycètes représentent les habitants typiques du
sol dans les forêts et les prairies. Ces microorganismes sont les
décomposeurs fondamentaux des matières résiduelles de la
plante dans la couche supérieure du sol. Les moisissures
décomposant la litière sont capables d'attaquer tous les
composants du complexe lignocellulosique y compris les polymères
récalcitrants de la lignine (Steffen, 2003).
III- Aspergillus niger
Un des ascomycètes les plus important et à
multi-usage dans les applications biotechnologiques est Aspergillus
niger. Son utilisation intéresse la production d'enzymes
extracellulaires, telles que : la glucoamylase (Selvakumar et al.,
1998), pectinase (Castilhoa et al., 2000), lipase acidique (Mahadik
et al., 2002), estérase féruloyle (Asther et
al., 2002) et xylanase (Duarte & Costa-Ferreira, 1994). Cette souche
est également connue par sa production de quelques acides organiques
comme acide gluconique (Pandey et al., 2000) et acide citrique
(Kumar et al., 2003). L'acide citrique et plusieurs enzymes
produites par
46
Synthèse Bibliographique
Aspergillus niger sont considérés comme
GRAS (Generally Regarded As Safe) par les
Etats Unis Alimentaires et l'Administration des Médicaments «
United States Food and Drug Administration » (Schuster et al.,
2002). De plus, divers biotransformations de l'acide férulique (Bonnin
et al., 2001), de progestérone (Kulkarni et al.,
1998), de diperpénoide, d'isostéviole (De Oliveira et
al., 1999), de terpènes (Chen & Reese, 2002), de linalool
(Demyttenaere & Willemen, 1998) ont été
exécutées par le biais d'Aspergillus niger. Durant ces
deux dernières décennies, Aspergillus niger a
été développée comme l'hôte la plus
importante d'hyperproduction d'enzymes alimentaires (Schuster et al.,
2002).
A part les nombreux usages industriels, Aspergillus niger
est un important microorganisme écologique, en effet il joue un
rôle important dans la biodégradation des produits chimiques les
plus toxiques comme l'hexadécane (Volke-Sepulveda et al.,
2003), le traitement du rejet de la mélasse du bettrave et les margines
(Jiménez et al., 2003; Vassilev et al., 1997), et la
bioconversion de la boues de eaux usées (Molla et al., 2002).
La biomasse d'Aspergillus niger est également utilisée
dans la biosorption des métaux lourds risqués tels que le
cadmium, le chrome et le cuivre (Dursun et al., 2003 ; Kapoor &
Viraraghavan, 1997).
L'usage de produit naturel comme un support solide et une
source d'énergie et de carbone, particulièrement les
résidus agricoles offrent l'avantage de combiner l'utilisation d'un
substrat bon marché et une intéressante voie de valorisation de
ces sous produits. Nombreux sous produits générés par des
industries agro-alimentaires ont été utilisés comme un
substrat, tels que : le résidu de canne à sucre, le son de
blé, de riz et d'orge et la paille, la pulpe de betterave et la pulpe de
café (Cordova et al., 1998 ; Pandey et al., 2000 ;
Mandviwala & Khire, 2000, Brand et al., 2000 ; Roussos et
al., 1995 ).
Divers études antérieurs ont exhibé
l'aptitude de cette souche : Aspergillus niger a attaqué les
complexes polysaccharides tels que les pectines et les arabinoxylanes, les
composés les plus rencontrés dans la paroi cellulaire. Les
dérivés d'acide cinnamique comme l'acide coumarique et l'acide
férulique sont liés d'une façon covalente avec ces
polysaccharides via des liaisons esters, accroissant ainsi la complexité
avec ces structures polysaccharidiques. La dégradation des
polymères de cette paroi cellulaire exige plusieurs enzymes
hydrolytiques à savoir : hémicellulases, xylanases, pectinases et
estérases qui peuvent être produite par cet ascomycète
universel (Asther et al., 2002).
47
Synthèse Bibliographique
III-1 Quelques enzymes produites par Aspergillus niger
III-1-1 Estérase
L'estérase « carboxylique ester hydrolase »
est spécifique aux esters solubles, en revanche la lipase «
carboxylique ester hydrolase » est spécifiquement active sur les
esters d'acide gras insolubles et elle n'hydrolyse que les liaisons esters
présents uniquement à l'interface eau-huile. L'estérase
est une enzyme qui catalyse l'hydrolyse de diverses liaisons esters. Elle est
subdivisée en plusieurs groupes dépendants de la liaison esters
qu'elle a hydrolysée. Ces dernières agissent sur les esters
carboxyliques (3.1.1), thiolestérase (3.1.2), monoester phosphorique
hydrolase, les phosphatases (3.1.3), phosphodiesters hydrolases (3.1.6),
diphosphoprique monoestérase (3.1.7) et les triesters phosphoriques
hydrolases (3.1.8) (Ismail, 1998).
Parmis les estérases, l'estérase
féruloyle ou cinnamoyle qui appartient à la surclasse des ester
carboxyliques hydrolases. Elle hydrolyse la liaison esters entre le sucre et
l'acide hydroxycinnamique. Ces enzymes sont purifiées et
caractérisées à partir de plusieurs microorganismes,
incluant Streptomyces olivochromogenes, Clostridium
stercorarium, Aspergillus awamorri et Aspergillus niger
(Faulds & Williamson, 1991 et 1994 ; Donaghy et al., 2000 ; McCrae
et al., 1994 ; Kroon et al., 1996).
III-1-2 3-Glucosidase
3-Glucoside glucohydrolase, communément appelé
3-glucosidase, catalyse l'hydrolyse des liaisons alkyle et aryle-3-glucoside,
tels que la di-glucoside, les oligosaccharides et les polysaccharides. Cette
enzyme, O-glucoside hydrolase, « EC 3.2.1.x » est un large
groupe d'enzyme biochimiquement et industriellement important. Vu le nombre
important des combinaisons possibles entre les carbohydrates, il existe alors
un large nombre de glucosidase spécifique à beaucoup de substrat
(Henrissat, 1998).
III-2 Applications biotechnologiques des estérases
et de Ji-Glucosidase
III-2-1Applications biotechnologiques des
estérases
Les estérases sont impliquées dans plusieurs
réactions de bioconversion. En effet, cette dernière est capable
d'estérifier les acides gras du lait. Cette estérification
conduit à la formation des esters de ces acides qui sont responsables du
développement d'un arôme de fruit dans l'industrie artisanale du
fromage (Reddy et al., 1970). Une technique biotechnologique simple
pour l'obtention d'arôme de fraise par l'estérase de
Pseudomenas fragi qui croit dans le lait écrèmé
et le lactosérum (Ismail, 1998).
48
Synthèse Bibliographique
Le traitement enzymatique des sous produits d'huile d'olive
utilisant le jus de culture d'Aspergillus niger enrichie
d'estérase cinnamoyl a été testé avec sa
possibilité de libération de composés phénoliques
simples et exceptionnellement l'hydroxytyrosol (Bouzid et al., 2005).
Ces enzymes sont capables d'hydrolyser les liaisons esters entre les
composés phénoliques et les polysaccharides.
III-2-2Applications biotechnologiques des 3-glucosidase
La 3-glucosidase est largement utilisé dans divers
procès biotechnologiques, incluant la production du fuel éthanol
à partir des résidus agriculturals cellulosiques (Bothast et
Saha, 1997). Elle participe dans la celluloyse en hydrolysant le cellobiose. La
3-glucosidase joue un rôle important dans l'étape finale de la
saccharification biologique du matériel cellulosique. Certaines
3-glucosidases catalysent non seulement les réactions d'hydrolyse mais
aussi les réactions de trans-glycosylation (Cote et Tao, 1990). En
addition, la 3-glucosidase joue un majeur rôle dans la formation des
arômes du vin et du pomme sucré « Shochu » (Ohta et al.,
1991). Ceci est due à l'hydrolyse de terpenyl-3-D-glucosides en terpen
(Vasserot et al., 1995). De plus cette enzyme est démontré
efficace dans la libération des composés phénoliques
simple à partir des sous produits de l'industrie oléicole
(Briante et al., 2000 ; 2002).
III-3 Immobilisation des Ji-Glucosidases
L'utilisation des enzymes immobilisées présente
un grand intérêt pour différentes applications
industrielles notamment pour la production des sucres, des acides
aminés, et des drogues depuis plus de deux décennies (Saudagar et
Singhal, 2004). L'idée fondamentale d'immobiliser les enzymes est
d'inclure la protéine dans un support semi-perméable, qui
empêche l'enzyme de partir tout en permettant à des substrats,
à des produits, et à des cofacteurs de passer à travers.
Bien que les conditions exactes pour la matrice d'immobilisation sont
dictées par le type d'enzyme et l'application prévue, il est
clair que le matériel doit au moins être non dégradable et
compatible avec les enzymes. Le procédé pour l'immobilisation
doit également être assez doux pour ne pas dénaturer
l'enzyme pendant la préparation (Taqieddin et Amiji, 2004).
Il existe deux possibilités d'immobiliser des enzymes
:
Soit en tant qu'enzymes libres : ceci nécessite une
étape de purification induisant une perte partielle de celles-ci, mais
est idéale pour des enzymes sécrétées ;
49
Synthèse Bibliographique
soit en cellules entières : ceci est simple et
idéale pour des enzymes intracellulaires puisqu'elle évite les
étapes de purification. Cependant, des réactions parasites
peuvent interférer sur le produit et entraîner sa
dégradation.
L'immobilisation, d'une manière générale,
permet d'avoir une meilleure stabilité des enzymes, mais peut induire
des problèmes de diffusion et d'accessibilité au substrat
contrairement aux enzymes libres. L'immobilisation peut être
réalisée sur différents types de support, mais la plupart
des supports présentent l'inconvénient d'être chers. Les
principales méthodes pour préparer une enzyme immobilisée
incluent l'adsorption, l'inclusion, la liaison covalente et l'encapsulation
(Fig. 8). Quant aux matrices utilisées, on a principalement deux types
qui sont les plus employées (Saudagar et Singhal, 2004 ; Bai et Zhou,
2004) :
les polymères : l'agarose, la cellulose, les dextranes,
les polymères tels que le chlorure polyvinylique, les acrylates, les
nylons, le polystyrène. La matrice de polymère est
aisément fonctionnelle et l'attachement de la protéine s'effectue
facilement ;
les matériaux inorganiques : la silice sous forme de
billes de verre microporeuses et de gel de silice, peuvent doter les enzymes
immobilisées des propriétés mécaniques sur la
stabilité de pression.
Des hybrides de ces matières premières telles
que l'amide d'agarose-acryl et la silice polymère-enduite ont
été également employés pour l'immobilisation des
enzymes.
L'alginate est de loin le polymère le plus largement
répandu pour les technologies d'immobilisation et de
micro-encapsulation. L'alginate est un extrait d'algue composé de
chaînes alternant les résidus d'acide á-L-guluronique et
d'acide â-D-mannuroniques. Les supports d'alginate sont habituellement
faits en réticulant le groupe carboxylique de l'acide
á-L-guluronique avec un ligand cationique tel que le chlorure de
calcium, le chlorure de barium, ou le poly-(L-lysine). Les matrices d'alginate
réticulées avec des ions de Ca2+, sont cependant
instables dans l'environnement physiologique ou dans les solutions tampons
communes ayant une concentration élevée en ions phosphate et
citrate qui peuvent extraire les ions Ca2+ à partir de
l'alginate et liquéfient le système (Taqieddin et Amiji,
2004).
Synthèse Bibliographique

Figure 8 : Différentes méthodes
d'immobilisation.
50
Les enzymes immobilisées déjà
présentent sur le marché ont plusieurs avantages au niveau de
leurs utilisations industrielles, mais également quelques
inconvénients (Tableau 3).
Tableau 3 : Avantages et inconvénients
des enzymes industrielles immobilisées (Demirel et al.,
2004).
|
Avantages
|
Inconvénients
|
· Économie d'énergie
|
· Problèmes liés à la
dénaturation des
|
· Équipements adaptés...
|
enzymes
|
· Très haute spécificité
enzymatique
|
· Prix élevé de certaines applications
|
· Conditions douces d'utilisation (pH,
|
· Nécessité de co-facteurs (Ca2+,..) pour
|
T°C)
|
certaines réactions
|
· Peu de problèmes de stockage des
|
· Contrôle et ajustement du pH
|
préparations enzymatiques
|
· Milieux réactionnels variés induisant
des
|
· Catalyseurs actifs à faibles doses
|
mécanismes enzymatiques complexes :
|
· Très haute vitesse de réaction et
contrôle
|
- Catalyse homogène en milieux aqueux
|
facile
|
- Catalyse hétérogène (substrats
insolubles,
|
· Synthèses
stéréospécifiques,...
|
réactions en milieu organique)
|
· Biodégradables
|
|
|
Synthèse Bibliographique
IV- Trametes trogii
Trametes trogii est un des basidiomycètes de
pourriture blanche le plus universel. Il a été
démontré un producteur intéressent de laccase et d'autres
enzymes ligniniolytiques incluant MnP et LiP (Ellouze et al., 2008).
La laccase est une enzyme secrétée par divers
basidiomycétes dégradant la lignine (Kahraman et Gurdal, 2002),
et elle a été démontré comme une enzyme essentielle
pour la dégradation de lignine par les champignons sans peroxydases
(Eggert et al., 1997). Cette enzyme catalyse différentes
réactions de bioconversion à savoir, l'oxydation de nombreux
composés phénoliques et des amines aromatiques en exigeant un
médiateur, tout en utilisant par ailleurs une variété de
composés non phénoliques jouant le rôle de substrats.
V- Trichoderma atroviride
Trichoderma atroviride est un ascomycète, et
un mycoparasite effectif, fort et puissant. Il est à l'origine de divers
pathogénies de plantes impliquant des modifications morphologiques, des
secrétions enzymatiques et des antibiotiques (Reithner et al.,
2007). Un travail ultérieur de Kovács et al. (2008) a
décrit la sécrétion d'un nouveau microorganisme
cellulotique « Trichoderma atroviride » dans le sol
prétraité tout en produisant des cellulases et des
â-glucosidases dans ce matériel végétal.
51
52
Synthèse Bibliographique
Les techniques séparatives
membranaires
I- Procédés de séparation
membranaire
Tous les procédés de filtration utilisent une
membrane qui constitue une interface séparant deux milieux, à
savoir le rétentat du perméat. Le rôle de la membrane est
d'agir comme une barrière mince sélective. Sous l'effet d'une
force de transfert, elle permet le passage ou l'arrêt de certains
composants entre les deux milieux qu'elle sépare. Selon les
caractéristiques de la membrane, le transfert résultera, soit de
la facilité à diffuser à travers le matériau, soit
de la taille des composants par rapport à celle des pores de la
membrane, soit d'une interaction ionique, soit d'une combinaison de ces
différents paramètres. Dans le cas de la microfiltration, de
l'ultrafiltration, de la nanofiltration et de l'osmose inverse, la force de
transfert est un gradient de pression appliqué de part et d'autre de la
membrane. Pour la dialyse et les membranes liquides c'est un gradient de
concentration ; en ce qui concerne la pervaporation et la perméation
vapeur, la force agissante est un gradient d'activité combinant pression
et concentration. Enfin c'est un gradient de température qui est mis en
jeu pour ce qui est de la thermo-osmose et de la distillation membranaire.
La figure 9 montre les techniques membranaires de filtration
tangentielle les plus utilisées, leurs seuils de séparation et
aussi leurs domaines d'application.

Figure 9 : Procédés de
séparation sur membrane en fonction de la taille des solutés.
53
Synthèse Bibliographique
II- Filtation tangentielle et frontale
Les techniques séparatives à membranes sont des
procédés physiques de séparation qui utilisent les
propriétés de tamisage moléculaire d'une membrane poreuse
balayée par le liquide contenant les constituants à
séparer.
Lors d'une filtration frontale, la suspension à
traiter est amenée perpendiculairement au média filtrant (figure
10 a). Une accumulation de matières se produit formant une couche qui
diminue la porosité et, par la même, le débit de
filtration.
La filtration tangentielle est caractérisée par
le fait que la suspension à traiter circule parallèlement
à la surface membranaire à une certaine vitesse (figure 10 b).
Cette vitesse induit une contrainte de cisaillement qui devrait permettre le
contrôle du dépôt au voisinage du milieu de filtration en
réentraînant les particules dans le flux en circulation.
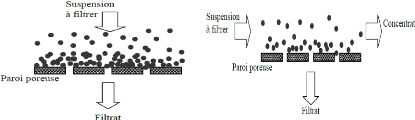
a b
Figure 10 : Schéma du
procédé de la filtration frontale (a) et tangentielle (b).
Selon le type de technologie utilisée, le
système de filtration peut donc fonctionner soit, à flux constant
soit à pression constante. La filtration à flux constant est
préférée dans la littérature par les travaux de
Defrance et al. 1999 et de Field et al. 1995 dont l'argument principal
avancé est que la pression n'est pas le facteur décisif d'une
filtration mais le flux. Donc fixer le flux permet de mieux contrôler
l'opération. De même pour la détermination du flux critique
les travaux de Metsamuuronen et al. 2002 utilisent le flux constant.
III- Application des techniques séparatives
membranaires
Les Procédés de séparation utilisant la
technologie membranaire sont apparus dans les années 1970. Ces
techniques qui utilisent des membranes synthétiques comme un obstacle
pour les séparations sélectives sont en expansion très
rapide en raison à leurs applications dans les processus de production.
Ils sont fondamentalement utilisés dans le traitement de l'effluents
industriels et l'industrie pharmaceutique et industries alimentaires, car ils
offrent
Synthèse Bibliographique
des avantages comparatifs tels que la consommation de faible
énergie, la souplesse de fonctionnement, la facilité
d'automatisation et la température ambiante ou à proximité
ambiante de fonctionnement (Scott, 1995).
La microfiltration utilisant des membranes en céramique
devient rapidement la technologie de choix pour la séparation des
cellules, ce qui freine les cellules entières tout en permettant
à l'enzyme de passer à travers et d'être
récupéré dans le flux de perméat. Il s'agit d'une
alternative économiquement viable aux techniques de séparation
classiques telle que la centrifugation. L'utilisation du procédé
de filtration membranaire plus simple pour récupérer les cellules
permet aux entreprises de biotechnologie la possibilité de simplifier
leur économie.
54
55
Synthèse Bibliographique
Conclusion
La Tunisie, 4ème producteur mondial d'huile
d'olive, produit en moyenne 600 000 m3/an de margines. Ce volume
engendre une charge organique d'ordre 60 milles tonnes de la DCO et 6 milles
tonnes de polyphénols par an. L'absence des méthodes de
traitement efficaces et économiques pousse les propriétaires des
moulins à huile à décharger les margines dans des bassins
d'évaporation (70 %) ou à les évacuer dans le milieu
naturel (30 %), ce qui cause la diminution de la qualité des sols
notamment l'activité microbienne et la contamination des nappes
phréatiques. La décharge de ces rejets est donc un sérieux
problème environnemental pour la Tunisie.
De nombreuses recherches relatives à l'étude de
traitement visant à dépolluer les margines ont été
menées depuis ces dernières décennies, mais la plupart
d'entre elles présentent un caractère académique et ne
permettent pas d'envisager l'extrapolation vers une application
réaliste, soit pour des raisons techniques, économiques soit
environnementales. Dans ce cadre, nous avons proposé de chercher un
procédé de traitement de margines fiable pour toutes les raisons
essentiellement celles liées à l'environnement.
Différentes études ont décrit la
production de l'hydroxytyrosol à partir de molécules
précurseur synthétique comme le tyrosol ou l'oleuropéine.
Le problème réside que la concentration de l'hydroxytyrosol dans
les margines brutes est très faible (de 0,2 à 0,4 g/l) et ne
possédant pas un support de récupération. De propres
procédures biotechnologiques doivent être développés
afin d'augmenter la concentration de cette molécule des margines.
Les champignons sont des microorganismes qui sont bien connus
pour leur excellente production des enzymes, qui sont utilisées dans
plusieurs processus industrielles. L'importance des enzymes microbiennes dans
les applications biotechnologiques a augmenté significativement dans ces
deux dernières décennies et actuellement dans la
biotransformation et la bioconversion des margines. Les enzymes offrent la voie
la plus simple et la plus rentable afin de réduire l'utilisation des
composés chimiques pour la conversion et la récupération
des composés phénoliques à partir des margines (Briante
et al., 2000-2004 ; Da Re et al., 2007).
Actuellement, la bioconversion des margines est le
procédé clé pour leur valorisation biologique en raison de
son faible coût et la production de molécules à hautes
valeur ajoutées. Cette technique a été appliquée
pour la première fois au traitement et l'exploitation des margines dans
le cadre de cette thèse.
Matériel et Méthodes
MATERIEL ET METHODES
56
57
Matériel et Méthodes
I- Matériel
I-1 Appareillages
Le matériel de laboratoire utilisé au cours de
notre étude consiste à :
- Autoclave Lequeux, France.
- Etuves MEMMERT GmbH+Co.KG Postfach, Allemagne.
- Hotte à flux laminaire FLUFRANCE, France.
- Microscope optique RME 5, Allemagne.
- Shaker CERTOMAT® R, Braun Biotech
International, Allemagne.
- Spectrophotomètre Shimadzu UV160U, Japan.
- Vortex Retsch (modèle MM 2000), Allemagne.
- Broyeur homogénéisateur : Ultra Turrax T25 basic,
IKA, Allemagne.
- Dispositif de filtration Millipore, filtre GF/D, France.
- pH-Meter (Metrohm) 691, Suisse.
- Rotavapeur «R110 Biichi»
- Système chromatographie liquide à haute
performance couplée à la spectrométrie
ultraviolet (CHPL-UV) de type «Waters».
- Système chromatographie liquide à haute
performance couplée à la spectrométrie de
masse (CHPL-SM) de type «Waters».
- Système chromatographie gazeuse couplée à
la spectrométrie de masse (CPG-SM) de
type «Hewlett-Packard model 5872 A».
I-2 Produits chimiques
Les produits utilisés au cours de cette étude
sont de pureté garantie et procurés chez des fournisseurs
agréés. Les fournisseurs et les produits sont :
Hydroxytyrosol, utilisé comme un standard, est
purifiée à partir des margines dans notre laboratoire (Allouche
et al., 2004 a). p-nitrophenol (PNP),
p-nitrophenyl-3-D-glucopyranoside (PNPG), p-nitrophenyl
acétate (PNPA), butylated hydroxytoluéne (BHT) and
2,6-diméthoxyphénol (DMP) est acquise de Sigma-Aldrich. La
3-glucosidase purifiée à partir d'Aspergillus niger (EC
2328898) est acheté aussi de Sigma-Aldrich. L'acétate
d'éthyle, l'acétonitrile, et l'acide orthophosphorique sont des
solvants à grade HPLC et acheté à partir de Prolabo
(France). Le réactif de folin « Folin-Ciocalteu phenol » est
procuré de Sigma-Aldrich Chemie (Switzerland). Le xylane de Sigma,
hydroxyethylcellulose (Fluka 54290).
58
Matériel et Méthodes
Finalement, 1,1-diphenyl-2-picrylhydrazyl (DPPH) et alginate
(poudre) sont procurés de Fluka (Switzerland).
I-3 Substrats biologiques
I-3-1 Margine
Les margines utilisées proviennent du système
d'extraction en discontinu «super presse» : MSP et du système
d'extraction continu «chaîne continue» MCC, depuis la campagne
de 2006-2007 jusqu'à celle de 2009-2010 de la région de Sfax. Les
margines sont collectées dans des bouteilles et stockées dans le
congélateur afin qu'elles gardent leurs caractéristiques
biologiques et physico-chimiques initiales.
I-3-2 Son de blé
Le son de blé utilisé est procuré à
partir de la Société Tunisienne de Produit Animale « STPA
». Un lot de dizaine de kilogrammes a été acheté et
stocké dans la chambre froide à + 4 °C.
I-4 Origine des champignons utilisés
Trois souches de champignons ont été
procurées de l'unité service de maintenance des souches du Centre
de Biotechnologie de Sfax (CBS) à partir de la Collection Tunisienne des
Microorganismes (CTM). Ces souches sont de références suivantes :
CTM 10099 (Aspergillus niger), CTM 10156 (Trametes trogii),
CTM 10476 (Trichoderma atroviride).
I-5 Milieux de culture
I-5-1 Milieu liquide à base de son de blé pour
la production de â-glucosidase à partir d'une fermentation en
erlenmeyer
Ce milieu de culture est constitué de 67 g de son de
blé supplémenté de 1 g/l KH2PO4, 2,5 g/l K2HPO4 ; 0,3 g/l
MgSO4·7H2O ; 0,3 g/l CaCl2 ; 3,75 g/l urée ; 3,75 g/l peptone de
blé ; 1 g/l extrait de levure ; 1 ml/l Tween 80 et 1ml/l
oligoéléments. Le pH est ajusté à 4 par l'addition
de HCl (2 M). Ce milieu est par la suite stérilisé par
autoclavage (20 min, 121°C).
I-5-2 Milieu liquide à base de son de blé pour
la préculture d'A. niger
Un fermenteur de volume total de 20 litres (Biolafitte) a
été utilisé pour préparer une préculture
d'A. niger. Le volume utile préparé est de 7 litres est
constitué de 469 g de son de blé supplémenté de 7 g
KH2PO4, 17,5 g K2HPO4 ; 2,1 g MgSO4·7H2O ; 2,1 g CaCl2 ; 52,5 g
urée ; 7 g extrait de levure ; 7 ml Tween 80 et 7 ml
oligoéléments. Le pH est ajusté à 4 par l'addition
de HCl (2 M). Ce milieu est par la suite stérilisé par chauffage
du contenue à 121°C
59
Matériel et Méthodes
durant 20 minutes. Un prétraitement du son de
blé a été effectué en l'hydrolysant partiellement
par son chauffage jusqu'à ébulition durant 10 minutes et en
ajustant son pH à 3. L'hydrolysat est filtré afin
d'éliminer les macromolécules, par la suite, le filtrat est
additionné au fermenteur. Cette étape supplémentaire
d'hydrolyse du son de blé est effectué afin d'éviter
l'appartiton abondante de mousse et/ou le colmatage des tyaux du fermenteur.
I-5-3 Milieu liquide à base de son de blé pour
la fermentation d'A. niger pour la production de
â-glucosidase
Un fermenteur de volume total de 100 litres (Biotron) a
été utilisé pour préparer une culture d'A.
niger. Le volume utile préparé est de 40 litres est
constitué de 2680 g de son de blé préalablement
hydrolysé supplémenté de 40 g KH2PO4, 100 g K2HPO4 ; 12 g
MgSO4·7H2O ; 12 g CaCl2 ; 300 g urée ; 40 g extrait de levure ; 40
ml Tween 80 et 40 ml oligoéléments. Le pH est ajusté
à 4 par l'addition de HCl (2 M). Ce milieu est par la suite
stérilisé par chauffage du contenue à 121°C durant 20
minutes.
I-5-4 Milieu solide ME pour le repiquage et la conservation des
champignons
A court et à moyen terme les champignons sont
conservés et repiqués sur le milieu solide ME. La composition de
ce milieu est la suivante : extrait de malt 20 g/l, agar-agar 20 g/l. Le pH de
ce milieu est réglé à 5,5.
I-6 Conditions opératoires de la préculture
d'A. niger
Le fermenteur Biolafitle de volume total 20 litres a
été utilisé pour lancer la préculture d' A.
niger avec un volume utile de 7 litres. Des spores d'A. niger
collecté stérilement à partir du milieu solide PDA
sont inoculés à raison de 6 108 spores/ml. Le pH de la
préculture est de 4,5. La température de la préculture est
de 30°C. L'agitation est de 300 tours/min. La durée de la
fermentation est de 5 à 7 jours et le volume d'air injecté est de
4 litres/min.
I-7 Conditions opératoires de la culture d'A.
niger
Le fermenteur Biotron de volume total 100 litres a
été utilisé pour lancer la culture d'A. niger
avec un volume utile de 40 litres. Le pH de la culture est de 4. La
température de la culture est de 30°C. L'agitation est de 200
tours/min. La durée de la fermentation est de 5 à 7 jours et le
volume d'air injecté est de 18 litres/min.
I-8 Chromatographie liquide à haute performance
(CLHP)
La chaîne CLHP utilisée est de type «
Shimadzu ». Elle comprend une pompe de type « LC-6A », un
détecteur de type « UV-SPD-6AV » fixé à une
longueur d'onde égale à 280
Matériel et Méthodes
nm, un intégrateur de type « CR-6A » et un
injecteur de type « Rhéodyne 7125 ». L'éluant
utilisé est un gradient de deux solutions : A (H3PO4; 0,1%) et B
(acétonitrile-eau; 7/3, V/V). pendant 20 minutes, la proportion de la
solution B augmente linéairement en passant de 20 % à 50 %. Cette
dernière proportion de (B) est maintenue constante pendant 10 minutes
puis elle augmente linéairement pour atteindre 80 % pendant 10 minutes.
Enfin, la proportion de (B) diminue jusqu'à 20 % au bout de 1à
minutes. Après filtration sur filtre 0,2 um, 20 ul de
l'échantillon à analysé sont injectés dans une
colonne de type « VP-ODS » de diamètre intérieur 4,6 mm
et de longueur 25 cm. Le débit utilisé est égale à
0,5 ml/min.
J-9 Chromatographie liquide à haute
performance couplée à la spectrométrie de masse
(CLHP-SM)
Le système CLHP utilisé est de type « Water
». Il est constitué par une pompe « 600 E » et par un
détecteur UV de type « Merck-Hitachi L-4000 UV detector ». La
colonne employée est la même que celle utilisé dans la
CLHP-UV. L'appareil (SM) est de type « Finnigan-MAT LCQ ».
L'ionisation adoptée est une ionisation chimique par protonation. La
température du vaporisateur est égale à 450 °C et
celle du capillaire est de 150 °C.
J-10 Chromatographie phase gazeuse couplée à
la spectrométrie de masse (CPG-SM)
Le système CPG-SM est de type « Hewlett-Packard
model 5872 A ». La colonne utilisée est une colonne capillaire
« HP5MS » de longueur 30 m et de diamètre intérieur
égal à 0,32 mm. Les températures de l'injecteur, de
l'interface et de la source sont égales à 260 °C, 280
°C et 175 °C respectivement. Le gaz vecteur est l'hélium
utilisé avec un débit égal à 1,7 ml/
min. la température de la colonne
augmente de 100 °C jusqu'à 260 °C pendant 10 minutes.
60
61
Matériel et Méthodes
II- Méthodes
II-1 Techniques de culture de champignons
II-1-1 Extraction des spores et culture de la souche
Aspergillus niger
La suspension qui stocke des spores est obtenue par culture du
champignon dans le milieu PDA «Potato Dextrose agar » à 30
°C pendant 5 jours (Selvakumar et al., 1998). Les spores sont
récupérées à partir de la surface par l'ajout de
l'eau stérile contenant 2 % (V/V) de Tween 80 et grattées avec
une spatule stérile. La suspension de spores obtenues est
filtrées puis stockées dans le glycérol 25 % (V/V)
à -20 °C.
La culture en batch d'Aspergillus niger est
effectuée dans des Erlenmeyers de 500 ml contenant 100 ml de milieu de
culture. L'inoculation est effectuée par 100 ul de la suspension de
spores dans des conditions stériles. La culture est incubée au
Shaker à 30°C et sous une agitation de 160 tr/min, pendant 10
à 15 jours.
II-1-2 Culture de la souche Trichoderma atroviride et
de la souche Trametes trogii
Les mycéliums de champignons sont hydratés et
inoculés dans le milieu solide PDA (Potato Dextrose Agar) et
cultivés à 30 °C pendant 7 jours. 2 % (V/V) d'inoculum
préalablement préparé et broyé sera
transféré au milieu de production stérile qui est
constitué par 100 ml de milieu de culture dans des erlenmeyeres de 500
ml. Ce milieu est identique à celui préparé pour la souche
Aspergillus niger.
II-2 Techniques de récupération des enzymes
et dosage de leurs activités
II-2-1 Préparation des enzymes
Les activités enzymatiques (laccase, estérase et
â-glucosidase) sont déterminées dans le filtrat de la
culture du champignon. Ce filtrat est obtenu par une filtration (moyennant un
papier Wattman GF/D).
Pour la culture d'Aspergillus niger,
l'échantillon est d'abord filtré (Whatman GF/D), ensuite
centrifugé dans le but d'éliminer les spores qui sont
formés pendant la fermentation d'Aspergillus niger. La solution
d'enzyme clarifiée est stockée à -20 °C
jusqu'à son utilisation ultérieure pour la biotransformation
et/ou le dosage enzymatique.
La â-glucosidase purifiée à partir de la
souche Aspergillus niger est préparée en dissolvent 1,5
mg de l'enzyme dans 0,8 ml du tampon citrate (20 mM pH 4,5).
II-2-2 Dosage des activités enzymatiques
? â-glucosidase
62
Matériel et Méthodes
L'activité â-glucosidase est
déterminé selon la méthode développé par
Norkrans (1950), mais en utilisant une concentration de la solution de substrat
de 5mM à la place de 1 mM. Un volume de 0,1 ml de la solution
enzymatique est mélangé à 1 ml de PNPG (5mM dans le tampon
citrate de sodium (50 mM), pH 4,8). La réaction enzymatique se
déroule à 50 °C pendant 10 minutes. La réaction est
arrêtée en additionnant 2 ml de la solution Na2CO3 (1 M), suivit
de 10 ml d'eau. L'absorbance est mesurée à 405 nm. Pour le blanc,
0,1 ml d'eau est additionné à la place de l'échantillon
enzymatique. L'activité â-glucosidase est définie comme le
nombre de umol de p-nitrophénol produit par minute sous les
conditions opératoires (UI). Les activités sont mesurées
en triplicata et exprimées en Unité international par millilitre
(UI/ml), avec UI définie la quantité de l'enzyme qui catalyse la
libération de 1 umol de p-nitrophenol par minute.
? Estérase
L'activité estérase est déterminée
selon la méthode développée par Mackness et al.
(1983). Le mélange réactionnel contient 50 ul du jus enzymatique,
50 ul de p-nitrophenyl acétate (PNPA) dans l'éthanol
(150 mM), et 2,9 ml du tampon Tris 6HCL (9,2 mM, pH 7,5) afin d'obtenir une
concentration de PNPA de 2,5 mM et un volume réactionnel total de 3
ml.
La réaction est initiée par l'addition de
l'extrait enzymatique et incubé à 25 °C durant 4 min.
L'absorbance est déterminée à 405 nm. La gamme
étalon, et la courbe standard est préparée dans la
série de 0 à 220 nmol de p- nitrophénol.
? Laccase
L'activité laccase est déterminée par
l'utilisation de la solution DMP 10 mM dans le tampon tartrate de sodium (100
mM, pH 5). L'extinction molaire å469 est égale à 27,500/M
cm, réfère à la concentration de DMP (Yaropolov et
al., 1994). Les réactions enzymatiques sont effectuées
à la température ambiante (22 à 25 °C). Une
unité d'enzyme est définie comme étant la quantité
d'enzyme oxydant 1 umol de substrat par minute.
? á-Amylase
L'activité á-amylase est
déterminée par le mélange de 0,25 ml de
l'échantillon avec 0.5 ml du tampon acétate (0.2 M ; pH 5,0) et
1.25 ml d'amidon soluble (1%). Après 10 min d'incubation à 50
°C, la concentration de glucose libérée à partir de
l'amidon par l'action de á-amylase est estimée à l'aide du
spectrophotomètre à 550 nm accordant la méthode de Miller
(1959). Une unité (U) de l'activité á-amylase est
définie comme la quantité de micromole de
63
Matériel et Méthodes
sucre réducteur (glucose) libéré par
minute sous les conditions de l'essai. Les résultats sont
exprimés en UI/ml.
? Protéase
L'activité protéase est déterminée
par le mélange de 0,5 ml de l'échantillon avec 0.5 ml de la
solution caséine à 1 %. Après 15 min d'incubation à
50 °C, on ajoute 0,5 ml de TCA (Tri-chloroacétique acide) à
20 %. Après incubation à la température ambiante pendant
15 minutes. Une centrifugation à 13 000 tours/min est par la suite
effectuée pendant 15 minutes. La concentration d'acides aminés
libérés à partir de la caséine par l'action de
protéase est estimée à l'aide du spectrophotomètre
à 280 nm. Une unité (U) de l'activité protéase est
définit comme la quantité de micromole d'acide aminé
libéré par minute sous les conditions de l'essai. Les
résultats sont exprimés en UI/ml.
? Cellulase
L'activité endoglucanase est mesurée en
utilisant le substrat hydroxyéthylcellulose (10 g/l) dans le tampon
citrate (50 mM ; pH 4,8) (Bailey & Nevalainen, 1981). Le substrat (900 ul)
est équilibré à 50 °C, 100 ul d'échantillon
sont additionnés, et après 10 min 1500ul de réactif de DNS
sont ajoutés (Ghose, 1987). Pour les standards, 100ul glucose (2.5-10
mM) sont additionnées au 900 ul de substrat et au 1500ul de DNS.
L'échantillon et le standard sont bouillis à 100 °C pendant
5 minutes et refroidie à la glace. L'absorbance est mesurée
à l'aide du spectrophotomètre à 540 nm
? Papier Filtre
L'activité papier filtre est mesuré en suivant
la méthode détaillé par Ghose, 1987. On utilise le papier
filtre Wattman N°1 dans le tampon citrate (50 mM ; pH 4,8) et à 50
°C. L'activité papier filtre est exprimée en UPF (umol/min
de substrat convertis)
? Xylanase
L'activité xylanase est déterminée par la
méthode de Bailey et al. (1992). Une unité (U) de
l'activité xylanase est définie comme la quantité d'enzyme
libérant 1umol de xylose équivalent par minute sous des
conditions de pH égale à 5 et de température de 50
°C. Le substrat de l'enzyme est préparé à la
concentration de 1% de xylane dans le tampon acétate pH 5.
64
Matériel et Méthodes
II-3 Bioconversion de la margine
II-3-1 Méthode de la biotransformation
Le test de la bioconversion des margines sont
étudiés en utilisant le mycélium d'Aspergillus niger
(ou pelotes), filtrat de culture et le jus de culture entier
(mycélium et le milieu extracellulaire).
II-3-2 Détermination du pH et de température
optimaux
L'effet de la température sur l'activité
3-glucosidase et l'efficacité de la biotransformation est
déterminée par l'examen de son activité sur son substrat
spécifique pNPG et sur la margine à pH 4,8 à
différentes températures, à savoir de la
température ambiante (25°C) jusqu'à 100°C.
L'effet du pH sur l'activité 3-glucosidase et
l'efficacité de la biotransformation est déterminée par
l'essai de son activité à 50 °C à différents
pH (de 4,0 à 8,0). Des solutions tampon citrate (50 mM) sont
préparés à différents pH (de 4,0 à 8,0) afin
d'évaluer le comportement de l'enzyme dans la bioconversion des
margines.
II-3-3 Effet du volume de margine
Différents volume de margines sont testés dans
la bioconversion afin de chercher l'optimum de la bioconversion. En effet, des
ratios de volume de margine / volume d'enzyme allant de 0,5 à 10 sont
également testés.
II-3-4 Effet de la quantité de l'enzyme
La quantité de l'enzyme utilisée a
été échangée de 40 UI à 9000 UI afin de
chercher l'optimum de la biotransformation.
II-3-5 Effet de l'agitation
La biotransformation a été évaluée
à deux différentes conditions à savoir la condition
statique et la condition agité. Cette dernière condition à
été menée à l'aide d'un réacteur adiabatique
à double paroi moyennant un agitateur magnétique.
II-3-6 Cinétique de la bioconversion
L'effet du temps de contact entre l'enzyme et les margine a
été aussi testé. Une cinétique de la bioconversion
est effectuée. Le temps de la réaction a varié de 15
minutes à 24 heures. Un contrôle est incubé par l'ajout de
l'eau à la place de l'enzyme. Les échantillons sont
réservés périodiquement à partir du milieu de la
biotransformation pour les analyses ultérieures.
65
Matériel et Méthodes
II-3-7 Bioconversion à grande échelle
Les réactions de bioconversion ont été
menées dans un réacteur et un réservoir fixe en acier
inoxydable dans des conditions optimales (Hamza, Khoufi & Sayadi 2012, a).
Pour la grande échelle de cette réaction de bioconversion 15 L de
deux types de OMW, (MCC: Margine Chaine Continuer et MSP: margine superbe
Press, qui sont fabriqués à partir moulin Sfax) ont
été effectuées dans un réacteur fermé
"Biolift 20 L" . Cependant, 40 L de margines du Nord Tunisien ont
été biotransformé dans un réservoir fixe
inoxydable. Ces margines fraîchement recueillie ont été
traitée avec la 3-glucosidase de concentration 500 UI/mL de milieu
réactionnel. L'enzyme 3-glucosidase a été obtenue suite
à la fermentation d'A. niger dans un fermenteur de 100 L durant
7 jours dans un milieu de culture enrichi par le son de blé. La
réaction enzymatique se déroule dans un réacteur
discontinu pilotée à 50 ° C pendant 120 min. La
quantité de produit hydroxytyrosol et l'activité enzymatique
residuel ont été déterminés au moment du
déroulement de la réaction. Après
bioprocédés, chacun sortes de margines sont collectées
dans des tanks et conservés à 4 °C jusqu'à la
séparation et la purification par des technologies membranaires.
II-4 Techniques séparatives membranaires
II-4-1 Procédés de séparation
Les expériences de filtration membranaire ont
été réalisées avec des installations de
microfiltration (MF) et ultrafiltration (UF) à échelle pilote. La
microfiltration contient deux membranes tubulaires en céramique, sa
surfce membranaire est egal à 0,2 m2. L'ultrafiltration
utilise des membranes organiques (18 PCI membranes d'ultrafiltration de PM 8000
daltons), sa surfce membranaire est égale à 0, 0825
m2. Les caractéristiques techniques des membranes de MF et UF
employés sont rapportées dans le Tableau 4.
Tableau 4: Caractéristiques techniques
des membranes.
|
Membrane
|
Processus
|
Conformation
|
Cut-off/surface
|
|
Hexagonale Ceramic, Tamis
|
MF
|
MICROLAB 130 S
19 canals Tubulaires
850 mm longueur; 7 mm de diameter.
|
0.2 um/0,2 m2
|
|
Organique
|
UF
|
18 PCI Ultrafiltration membranes
135 mm de diamétre; 1220 mm longueur.
|
8KD/0,0825 m2
|
Après la biotransformation, les grands volumes sont
mélangés et préfiltrés par la gaze. La suspension
est pompée dans la première étape à membrane, qui
est la microfiltration. La phase dense colloïdale qui est sous la forme de
micro-émulsion en raison de la présence de
66
Matériel et Méthodes
micro-gouttes d'huile doit être retirée par des
enzymes, mais dans notre expérience, elle est simplement rejetée.
Les technologies membranaires, la microfiltration (MF) et l'ultrafiltration
(UF) sont utilisés dans l'ordre. Le flux de perméat de chaque
section, se nourrit de l'étape de filtration suivante.
II-4-2 Mesure de séparation par performance membranaire
Le taux de flux de perméat moyen (J) a été
calculé avec l'équation. 1:
J = VP/AP.t (1)
Où J est le taux de flux moyen, VP est le volume total de
perméat, AP est la surface effective
de la membrane, et t est le temps de collecte de
perméat.
Le rejet est une détermination de la quantité de
molécule cible qui est retenu par la membrane
à l'essai avec l'Eq. 2:
R = (1 - CP/Cf) 100 (2)
Lorsque R est le coefficient de rejet, Cp la concentration de
l'hydroxytyrosol dans le perméat,
et Cf sa concentration dans l'alimentation.
Le VCR est un paramètre important dans le mode de
fonctionnement de concentration par lot,
en indiquant la réduction du volume initial au cours du
processus, en plus d'être le critère
pour mettre fin aux expériences de MF et UF. Le VCR est
défini comme le rapport entre le
volume de charge initiale VF et le volume du rétentat VR
résultant (Eq. 2).
VCR = VF/VR (3).
II-5 Concentration par évaporation
Le perméat de l'ultrafiltration est concentré
par l'évaporation de l'eau et la concentration de polyphénols
dans un petit volume. Une unité d'évaporation à
l'échelle pilote se compose de trois parties: préchauffeur afin
de porter la solution d'alimentation jusqu'à la température et la
pression (45 ° C, 100 mbars) pour démarrer l'évaporation sur
la première unité requise; des séparateurs pour la
séparation la vapeur de la liquide phase, et enfin des condenseurs pour
les vapeurs résiduelles et des unités de dégazage. La
température d'évaporation ne dépasse pas 45°C pour
éviter la détérioration thermique des
polyphénols.
II-6 Extraction des composés phénoliques
à partir des margines
L'extraction liquide-liquide des composés
phénoliques est adoptée par l'acétate d'éthyle. Les
échantillons des margines sont mélangés avec
l'acétate d'éthyle (V/V). Le mélange est vigoureusement
agité et centrifugé à 3000 tours/min pendant 5 minutes. La
phase
67
Matériel et Méthodes
organique est séparée et filtrée par une
seringue à filtre (0,45 uM). Le filtrat est analysé directement
par CLHP pour une détermination qualitative et quantitative des
composés phénoliques.
II-7 Analyse par Chromatographie liquide à haute
performance : CLHP
II.7.1. Analyse des monomères phénoliques
Le suivi de la concentration des molécules de
monomères phénoliques contenus dans les margines est
réalisé par chromatographie liquide à haute performance
(CLHP). Les composés sont identifiés et quantifiés par la
comparaison du temps de rétention et des aires des pics avec des
échantillons standards.
II.7.2. Analyse des masses moléculaires de
polyphénols
Le suivi de la variation des masses moléculaires de
polyphénols contenus dans les margines est réalisé par
chromatographie liquide à haute performance (CLHP) en utilisant une
colonne TSK-G2000 S-W-Supelco de longueur égale à 300 mm et de
diamètre intérieur de 7,5 mm avec un débit de 0,6 ml/mn.
La chaîne utilisée est de type Shimadzu. Elle comprend :
- Une pompe de type «LC-6A»;
- Un détecteur de type «UV-SPP-6AV» fixé
à une longueur d'onde égale à 280 nm; - Un
intégrateur de type «CR-6A»;
- Un injecteur de type «Rhéodyne 7125».
Comme phase mobile nous avons utilisé le tampon
phosphate 0,1 M à pH 6,8. Ce tampon contient 0,5 g/l de NaN3
(conservateur) et 0,1 M de Na2SO4 (déshydratant). Le débit est de
1 ml/min. Avant l'injection, l'échantillon est filtré sur
membrane « Millipore » de 0,45 ìm, puis dégazé
sous l'hélium. Les composés aromatiques sont
détectés à une longueur d'onde de 280 nm moyennant un
détecteur UV (Shimadzu class-VP).
II-8 Détermination de l'activité
antiradicalaire
II-8-1 Principe de la méthode
Cette méthode met en oeuvre un radical stable : 1,
1-diphenyl-2-picryl-hydrazyl radical (DPPH). Ce radical peut fixer un (H°)
arraché à l'antioxydant (AH). Il perd alors son absorbance
à 520 nm et on calcule, après établissement de
l'état stationnaire de la réaction, la quantité
d'antioxydant nécessaire pour faire disparaître 50 % du DPPH
(Brand-Williams et al., 1995). L'avantage de ce test est d'être rapide (2
à 6 heures) et de ne nécessiter aucune condition drastique.
68
Matériel et Méthodes
II-8-2 Mode opératoire
Pour chaque composé à tester, des solutions sont
préparées dans le méthanol à différentes
concentrations. Pour chaque solution, 4 ml sont mélangés avec 10
ml d'une solution méthanoïque de DPPH de concentration 1.5 x
10-4 M. Après agitation, les mélanges ainsi
préparés sont incubés pendant 30 minutes à
l'obscurité. La densité optique à 520 nm est par la suite
déterminée. On représente ainsi la courbe donnant la
variation de la densité optique en fonction du logarithme décimal
de la concentration. L'activité antioxydante de chaque composé
est exprimée en IC50 (ug/ml) qui représente la
concentration du composé à tester nécessaire à la
neutralisation du 50 % des radicaux libres de DPPH. L'activité
antioxydante est d'autant plus forte que la valeur de l'IC50 est plus
faible.
II-9 Analyse des protéines
La concentration des protéines est
déterminée en suivant la méthode de Bradford (1976).
II-9-1 Principe de la méthode
Le test est basé sur l'absorbance d'une solution acide
de bleu de Coomassie G-250 à la longueur d'onde de 595 nm quand la
liaison aux protéines se produit. Les deux interactions hydrophobes et
ioniques stabilisent la forme anionique du colorant, entraînant un
changement de couleur visible. Le coefficient d'extinction est
déterminé selon une gamme étalon d'une solution de
Sérum Albumine Bovine (SAB) de concentration allant de 50 à 100
ug/ml de protéines.
II-9-2 Mode opératoire
On ajoute à 0,2 ml au réactif de Bradford, 0,8
ml d'une des solutions standard de protéines ou d'échantillons
à doser préalablement dilués.
II-10 Détermination de la concentration des sucres
réducteurs
Le réactif de DNS est préparé en
mélangeant 10,6 de l'acide 3,5- dinitrosalicylique et 19,8 g de Na OH
dans 1416 ml d'eau distillée. 306 g du tartrate de sodium et de
potassium, 8,1 g de phénol et 8,3 g de sulfate de sodium sont par la
suite additionné (Al-Zuhair, 2008). 100 ul de l'échantillon sont
mélangés avec 900 ul du tampon citrate (50 mM pH 4,8). Ensuite
1,5 ml de la solution de DNS sont additionnés au mélange et
chauffé dans l'eau bouillante pendant 10 minutes. Les
échantillons sont ensuite refroidis à la température
ambiante avec l'ajout de 10 ml d'eau distillée. L'absorbance à
550 nm est déterminée à l'aide du
spectrophotomètre. La solution blanc est constituée de 100 ul
d'eau distillée à la place de l'échantillon à
analyser. La gamme étalon est préparée dans la
série de 0 à 2 g/l de glucose.
69
Matériel et Méthodes
II-11 Détermination de la concentration des
ortho-diphénols totaux
La détermination de la concentration des phénols
totaux revient à doser l'acide gallique équivalent (Bouaziz et
al., 2005). 1 ml de l'échantillon dilué est
transféré dans le tube à essai avec 1 ml d'éthanol
à 95 %, 5 ml d'eau distillé et 0,5 ml de réactif de folin
«Folin-Ciocalteu phénol» sont ensuite ajoutés.
Après un temps d'incubation de 5 minutes, 1 ml de la solution Na2CO3
à 5 % est ajouté, bien homogénéisé et
gardé à l'obscurité pendant une heure. Après,
l'échantillon est vortexé et l'absorbance est mesuré
à 725 nm utilisant le spectrophotomètre. La courbe
d'étalonnage est réalisée avec l'acide gallique.
II-12 Analyse par GC-MS
L'échantillon de margine (20 ml) sont extrait avec
l'acétate d'éthyle (60 ml). La phase organique est
collecté et réduit à un volume de 10 ml par
l'évaporation au rotavapeur (37 °C) et par la suite silylé.
Pour la procédure de silylation, on prépare un mélange de
pyridine (40 ul) et BSTFA (200 ul) et 20 ul d'extrait de margine qui est
mélangé et vortexé dans les tubes en verre qui sont
placés dans un bain marie à 80 °C pendant 45 minutes. A
partir de la solution silylé 1 ul est directement analysé par
GC-MS.
II-13 Détermination de la matière
sèche (MS)
La matière sèche (MS) représente
l'ensemble des substances organiques et inorganiques en solution ou en
suspension, contenues dans l'échantillon. Cette matière est
déterminée à 105°C par l'évaporation d'un
échantillon de masse m1, dans un creuset en porcelaine de masse initiale
m0, jusqu'à obtention d'une masse constante m2
(généralement après 24 h).
MS g/l = 1000 (m2-m0)/(m1-m0)
II-14 Dosage de glucose (méthode enzymatique
GOD-PAP)
Le dosage enzymatique du glucose est effectué en
présence des enzymes « glucose oxydase et peroxydase ».
D'abord, le glucose est oxydé en acide gluconique avec libération
de peroxyde d'hydrogène. Ce dernier réagit avec le phénol
et le 4-amino-antipyrine et sous l'action de la peroxydase il donne une
quinone-imine de couleur rosâtre. Trois échantillons sont
préparés: le blanc (2,5 ml des enzymes + 20 ul d'eau
bi-distillée), le standard (20 ìl standard + 2,5 ml des enzymes)
et l'échantillon de margine (20ìl échantillon +2,5 ml des
enzymes). Après incubation des échantillons à 37 °C
pendant 15 min, la mesure de la densité
70
Matériel et Méthodes
optique des échantillons est effectuée à
505 nm contre le blanc de réactif. Le calcul de la concentration du
glucose est égal alors :
Glucose g/l = DO échantillon/DO standard * Dilution
II-15 Estimation de la concentration en polyphénols
des margines
Un volume de margine est extrait trois fois par trois volumes
d'acétate d'éthyle dans une ampoule à décanter. La
phase organique (phase supérieure) est récupérée
dans un ballon de masse initiale m0, puis concentrée sous vide à
l'aide d'un rota-vapeur. Ensuite, le ballon est rincé par un volume
d'hexane afin d'éliminer la matière grasse. Ce ballon,
portée au four 105°C pendant 2 h, acquière une masse m. La
concentration (C) en polyphénols est la suivante :
C (g/l) = 1000 x (m - m0)/V
Avec m0 est la masse du ballon vide ; m est exprimée en
g et V en ml
II-16 Immobilisation en Alginate de
â-glucosidase
Tout d'abord, on prépare une solution d'alginate de
sodium en ajoutant 2,3 g pour 100 mL d'eau distillée bouillante sous
agitation. L'homogénéisation s'effectue lentement et est
accompagnée d'une désaération de la solution pendant 30
min. Lorsque la température est redescendue aux alentours de 40-45
°C, on ajoute l'enzyme toujours sous agitation.
La suspension ainsi réalisée est placée
dans une seringue et une goutte à goutte est effectué dans une
solution contenant un ion bivalent à savoir le chlorure de calcium
(CaCl2) à 0,05 M maintenue sous agitation à température
ambiante, ce qui va permettre la formation des billes. A l'issue de
l'écoulement de la suspension, les billes sont laissées sous
agitation 30 min, ensuite elles sont rincées à l'eau
distillée puis mises à équilibrer dans une solution de
chlorure de calcium (CaCl2) à 0,005 M. Les billes sont alors
prêtes pour la bioconversion et conservées à 4 °C.
Différents paramètres sont alors testés pour optimiser la
bioconversion des composés phénoliques des margines, tels que
:
? l'effet du pourcentage d'alginate de sodium (de 1 à
4%)
? la taille des billes : Afin de tester l'effet de la taille
sur la bioconversion, différents types de billes ont été
coulés à l'aide d'embouts de tailles plus ou moins grandes afin
d'obtenir des billes ayant une taille de 1 à 4 mm.
71
Matériel et Méthodes
III. Caractérisation des margines brutes
La production nationale de margines qui proviennent du
système à pression (40 %) et du système continu (60 %)
s'élève à 650 000 m3/an (1995-2004). Sur 21
régions productrices de margine en Tunisie, la région de Sfax
vient en première position avec 210 mille m3/an (Msallem et
al., 2000). Les margines brutes utilisées au cours de notre étude
sont issues de deux systèmes d'extraction « chaîne continue
» nommé MCC et « super presse » nommé à son
tour MSP. Le tableaux 3 résume les différentes
caractéristiques physico-chimiques des margines utilisées.
Comme signalé dans la partie « Synthèse
bibliographique », la composition des margines est non seulement
dépendante du type d'extraction, mais également, et dans une
moindre mesure, de la variété des olives, de la période de
la campagne, des pratiques culturales et de la modalité de l'extraction
(Lesage-Meessen et al., 2001; Obied et al., 2005). Ceci a
été remarqué dans le Tableau 5, où les margines
brutes provenant de deux systèmes d'extraction différents
à savoir le Super Presse et la chaine continue, ont une variation des
caractéristiques surtout celles responsables de leur richesse en
polyphénols (polyphénols, ortho-diphénols,
hydroxytyrosol,...).
Tableau 5 : Caractéristiques
physico-chimiques des margines : MCC et MSP.
|
MCC
|
MSP
|
|
pH
|
5,1
|
5,4
|
|
Polyphénols (g/l)
|
30,3
|
33
|
|
Ortho-diphénols (mg/l)
|
7,42
|
4,34
|
|
Matière en suspension (g/l)
|
110,63
|
119,04
|
|
Sucre réducteur (g/l)
|
23
|
26,25
|
|
Glucose (g/l)
|
5,6
|
5,98
|
|
Hydroxytyrosol (g/l)
|
0,019 à 0,045
|
0,022 à 0,065
|
|
â-Glucosidase (UI/ml)
|
80
|
83
|
L'analyse du Tableau 5 montre que les margines ont un pH
légèrement acide, ils renferment une quantité de sucre
réducteur importante, qui est de l'ordre de 23 g/l pour les MCC et de
26,25 pour les MSP. Une activité â-glucosidase de 80 à 83
UI/ml dans ces rejets a été remarquable, qui peut avoir comme
origine, soit le fruit, soit les microorganismes qui cohabitent ces rejets. Il
est également remarquable que ces margines sont très riches en
composés phénoliques ayant une moyenne de concentrations
très élevées qui est de l'ordre de 30 g/l. En revanche, la
quantité totale d'ortho-diphénols est très faible ; elle
est de l'ordre de 7,42 mg/l pour margine chaine continue (MCC) et de 4,34 mg/l
pour la margine Super Presse
Matériel et Méthodes
(MSP). L'analyse chromatographique par le C18-CLHP montre que
ces margines renferment une quantité très faible en
hydroxytyrosol (0,019 à 0,065 g/l) et une quantité importante en
oleuropéine et ses dérivés (Figure 11). L'ensemble de ces
caractéristiques mettent les margines parmi les effluents industriels
les plus toxiques et les plus riches en composés phénoliques. Une
voie de valorisation de ces rejets par leur enrichissement en composés
à haute valeur ajoutée comme les antioxydants sera alors
prometteuse.
La composition phénolique des margines a
été étudiée profondemment par plusieurs chercheurs
(Bianco et al., 2003; Della Greca et al., 2004; Obied et
al., 2005; De Marco et al., 2007). Les polyphénols des
margines sont surtout représentés par les monophénols
simples et les composés polymérisés tels que les tannins,
les flavonoides, l'oleuropéine qui est le composé
sécroiroide, le déméthyloleuropéine et le
dialdéhydique formé de l'acide élénolique (EDA)
liée du 3,4-dihydroxyphényléthanol (3,4-DHPEA ou
hydroxytyrosol). Également, ce rejet contient d'autres
sécoiroides comme le verbascoide et le ligstroside. D'autres groupes de
composés phénoliques y sont présents qui sont des
dérivés d'acide cinnamique (acide p-coumarique,
férulique et caféique) et d'acide benzoïque (acide
3,4-dihydroxyphényacetique et acide 4-hydroxybenzoique). D'autre
phénols sont retrouvés dans les margines comme le
catéchol, méthylcatéchol, phénylalchols (tyrosol,
hydroxytyrosol). Et relativement une haute concentration de composés
flavonoïques qui sont représentés par les catéchines,
les quercétines, les dihydroxyglycones, et les anthocyanes
(cyaniding-3-glucoside et cyaniding-3-rutinoside). Ces dernières sont
responsables de la coloration rouge à noire des margines
(Fernández-Bolaños et al., 2006). Particulièrement, le
glucoside d'hydroxytyrosol est le composé phénolique
prédominant des margines et de la drupe d'olive (Romero, et
al., 2002). Ces composés phénoliques ont des structures
chimiques extrêmement variées. Plusieurs approches peuvent
être appliquées pour l'identification des composés
phénoliques. Parmi ces techniques on site la chromatographie liquide
à haute performance (CLHP), la chromatographie gazeuse -
spectrométrie de masse (CG-SM) et chromatographie liquide -
spectrométrie de masse (LC-SM) qui sont les plus efficaces.
72
Matériel et Méthodes

73
Figure 11: C-18 CLHP chromatogramme de l'extrait de
margine brute frais. HT : hydroxytyrosol, Ty :Tyrosol, OE :
Oleuropéine.
74
Résultats et Discussion
Résultats et Discussion
75
Résultats et Discussion
I-Introduction
Pour les applications industrielles, la procédure de la
production d'hydroxytyrosol à partir des margines a été
développée durant ces dernières années (Allouche et
al., 2004 a). Une période de stockage des margines est nécessaire
pour la récupération de composés à haute valeur
ajoutée à partir de ces effluents. Certainement pour qu'une
fermentation spontanée aura lieu une longue durée de conservation
s'avère alors nécessaire dépassant parfois 100 jours (Feki
et al., 2006). Toutefois, la stabilité de l'hydroxytyrosol et
l'opposition à son oxydation et à sa dégradation fongique
et microbienne demande beaucoup de réflexion et de technicités
pratiques telles que par exemple la recherche de la concentration
d'éthanol à ajouter à ces effluents durant toute la
période d'enrichissement pour la stabilité de l'hydroxytyrosol
converti. En effet, la recherche de nouvelles techniques plus
séduisantes franchissant à ces problèmes sera alors
obligatoire.
La recherche d'une méthode douce et non coûteuse
d'enrichissement des margines en terme de d'hydroxytyrosol sera alors
essentielle. Nous nous sommes intéressés ainsi à la
recherche de la méthode optimale pour l'enrichissement des margines en
hydroxytyrosol. La meilleure conception de cette méthodologie
proposée est que les polyphénols contenus dans les margines
peuvent être modifiés au sein des margines moyennant leur
bioconversion tout en offrant un extrait riche en composés
phénoliques simples. Ces derniers, sont utiles pour les industries
pharmaceutiques, alimentaires et cosmétiques d'une part, et qui
produisent un rejet pauvre en polyphénols réduisant
considérablement sa demande chimique en oxygène (DCO) en d'autres
termes.
Une source d'enzymes hydrolytiques sera alors utile pour
attaquer les polyphénols des margines. Pour cela, une étude
préliminaire de la souche Aspergillus niger a été
d'abord entreprise reposant sur l'optimisation des conditions de sa culture et
la composition de son milieu de production de â-glucosidase.
L'étude de la bioconversion des composés
phénoliques de la margine par différents champignons à
savoir Aspergillus niger, Trametes trogii et Trichoderma atroviride a
été par la suite entamée.
La bioconversion des composés phénoliques des
margines a été aussi optimiser en utilisant le jus de culture
d'A. niger dans le but d'améliorer au maximum le rendement de
libération de l'hydroxytyrsosol.
76
Résultats et Discussion
L'étude comparative de la bioconversion moyennant
différentes enzymes tels que la â-glucosidase pure et
l'estérase pure et d'autres enzymes commerciales a été
également effectuée.
Une étude ultérieure a reposée sur le test
de l'efficacité de l'immobilisation sur la bioconversion des
margines.
Une dernière partie de cette thèse a reposé
sur la bioconversion des margines à grande échelle et la
récupération de l'hydroxytyrosol par les techniques membranaires
et la concentration du perméat de l'ultrafiltration par
évaporation.
77
Résultats et Discussion
Chapitre I :
Optimisation de la production de â-glucosidase
par le
champignon : Aspergillus niger.
78
Résultats et Discussion
I- Optimisation des conditions et de la composition du
milieu de culture pour la production de Ji-glucosidase par Aspergillus
niger
Les â-glucosidases sont fréquemment
demandées dans les applications industrielles agro-alimentaires, en
particulier le secteur oenologique (Lambrechts et Pretorius, 2000 ; Gueguen et
al., 1996) pour la production d'arôme et l'odeur du vin, et le secteur
oléicole (Bouzid et al., 2005 ; Ciafardini et Zullo, 2002 ;
Briante et al., 2002) pour la production de composés phénoliques
simples, libres et à haute valeur ajoutée à partir de sous
produit de l'industrie oléicole tels que feuille, grignon, margine, ...
Pour cela, les quantités d'enzymes utilisées sont de plus en plus
importantes. Pour que l'enzyme produite soit compétitive sur le
marché, elle doit être produite à des coûts
infiniment réduits. En effet, une optimisation pour produire le maximum
d'enzymes actives avec le minimum de produits et d'énergie s'impose. La
production de la â-glucosidase dépend de plusieurs facteurs
chimiques et physiques de fermentation (Barbagallo et al., 2004). La
composition du milieu de culture tels que la nature de la source de carbone et
d'azote et leur rapport C/N, les minéraux, les facteurs de croissances,
les vitamines et les inducteurs, influence considérablement la
quantité d'enzyme produite. Les paramètres physiques sont
également déterminants sur la production et ce comme le pH, la
température, l'aération et l'agitation. Les meilleures conditions
pour produire le maximum de â-glucosidase avec la souche Aspergillus
niger ont été donc étudiées.
I-1 Optimisation des paramètres du procès de
production de Ji-glucosidase
I-1-1 Effet du pH initial et de la température
Dans le but de démontrer l'effet du pH initial sur la
production de â-glucosidase, A. niger a été
cultivée dans un milieu à base du son de blé avec
différents pH initiaux allant de 2 à 10 dans des erlenmeyers. Les
résultats obtenus sont regroupés dans la Fig
12a. Le pH optimum de la production de â-glucosidase est
égal à 4. En tenant compte du temps d'incubation de ce champignon
dans la culture submergée conduisant à un risque de
contamination, ce pH acide est considéré comme une
propriété physiologique favorable. Il a été
reporté que plusieurs types de champignon sont plus acidophiles durant
les cultures submergées tels que Ganderma lucidum (Yang &
Lian 1998; Yang et al. 2000).
Afin de chercher la température optimale de production
de â-glucosidase, ce microorganisme est cultivé à
différentes températures (25 °C , 27 °C , 30 °C ,
37 °C , 45 °C , 55 °C ). Le maximum de production de
â-glucosidase mesurée durant cette fermentation a
été illustré sur la Fig. 12b. D'après ces
résultats obtenus, la quantité de â-glucosidase produite
s'amplifie en augmentant la température d'incubation de 25 à 30
°C avec une température optimale de 30
79
Résultats et Discussion
°C. Pour les températures supérieures
à 30 °C, le degré de production de cette enzyme
décroit. En effet, la température 37 °C est attribuée
à d'autres champignons mésophiles. Alors que les autres
températures (45 °C et 55 °C) sont attribuées à
un autre type de champignon thermophile. En conclusion A. niger est un
champignon mésophile qui préfère une température de
30 °C et un pH égal à 4 pour la production de
3-glucosidase.
I-1-2 Effet de la taille de l'inoculum et les conditions
de culture
Parmi différentes propriétés
physiologiques, la taille de l'inoculum, peut jouer un rôle important
dans le développement du champignon (Glazebrook et al. 1992). Pour
examiner l'effet du volume de l'inoculum, A. niger a été
cultivée dans un milieu liquide tout en variant la taille de l'inoculum
(6 107 spores/ml, 6 108 spores/ml, 6 109
spores/ml, 6 1010 spores/ml). Comme c'est montré sur la Fig.
12 C, la taille optimale de l'inoculum pour la production de 3-glucosidase par
A. niger est de 6×108 spores/ml. Un inoculum
adéquat permet une initiation rapide de croissance du mycélium et
de la formation de métabolites, et ceci par la colonisation totale du
milieu par le champignon tout en réduisant l'envahissement du
contaminant. Une diminution de la production d'enzyme est observée quand
la taille de l'inoculum dépasse l'optimum. En effet, la production
enzymatique atteint son plafond si un bon échange entre les nutriments
et la biomasse aura lieu dans l'erlenmeyer. Pour cela, une agitation dans un
shaker s'avère inévitable pour une meilleure production de
l'enzyme par A. niger (Fig. 12d). Les conditions de
déséquilibre entre les nutriments et la biomasse en
prolifération résultent d'une diminution de synthèse
d'enzyme (Ramachandran, et al., 2005).
80
Résultats et Discussion
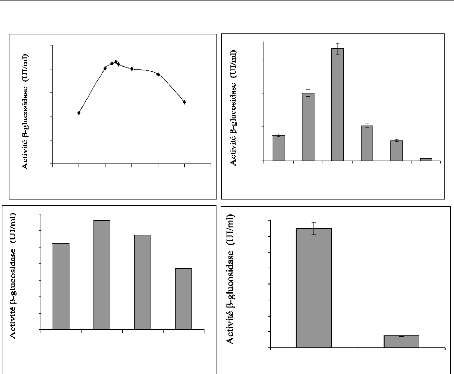
d
8000
7000
6000
5000
4000
3000
2000
1000
0
6000
4000
2000
0
25°C 27°C 30°C 37°C 45°C
55°C
b
Température d'incubation
Agité Statique
a
0 2 4 6 8 10 12
pH
5000
4000
3000
2000
1000
0
7000
6000
5000
4000
3000
2000
1000
0
6x10^7 6x10^8 6x10^9 6x10^10
Taile de Îinoculum
(spores/ml)
c
Figure 12: Effets du pH initial du milieu
(a), température d'incubation (b), taille de l'inoculum (c) et les
conditions de culture (d) sur la production de 3-glucosidase durant une
fermentation à base du son de blé par A. niger.
I-2 Sélection du substrat pour la production de
Ji-glucosidase
Différents substrats ont été
testés comme la seule source de carbone pour la production de
3-glucosidase par A. niger. La Fig. 13 donne le maximum
d'activité 3-glucosidase mesurée durant cette fermentation. Pour
les substrats solides testés, le son de blé prouve être le
mieux approprié et convenable pour la colonisation du champignon, tout
en indiquant une croissance maximale visible en surface de mycélium et
un niveau de production d'enzyme le plus élevé (4500 #177; 0,08
UI/ml). Ce degré élevé de production de 3-glucosidase peut
être attribué à la présence de 3-glucosides dans le
son de blé. Le développement d'un processus de production de
3-glucosidase basé sur l'utilisation de son de blé comme un
substrat solide est très fascinant, vu qu'il s'agit d'une source de
carbone disponible et bon marché. Pour tous les autres substrats
à base de céréales testés, tels que le son de
l'orge (1790 #177; 0,06 UI/ml) et le gruau de farine (682 #177; 0,03 UI/ml)
sont supposés un support de production de 3-glucosidase
modéré. Alors que le saccharose (520#177; 0,2 IU/ml), la
cellulose (191 #177; 0,25 IU/ml) et le
âco ctiv
U
ctiv âco
a d d
Aivi â-ucoda (U
uco
i
A
p
81
Résultats et Discussion
lactose (64 #177; 0,09 IU/ml) donnent uniquement un pauvre
degré de production (Fig. 13a). Contrairement à ce
résultat, Cruz et Park (1982), ont utilisé les graines de soja
comme un substrat solide qui ont été économiques,
très facile à fermenter avec une récupération
facile des polysaccharides et des molécules obtenues suite à la
fermentation. De même Garcia-Kirchner et al., 2005 ont utilisé
différents résidues de matériel lignocellulosiques comme
l'unique source de carbone pour la production de béta-glucosidase par
A. niger, et ils ont démontré que les débris de
canne à sucre sont le meilleur substrat.
La concentration initiale de son de blé de 7% est
supposée la meilleure puisqu'elle permet l'obtention du maximum de
production de â-glucosidase (4624#177; 0,25UI/ml) (Fig. 13 b). Quoique
que les microorganismes filamenteux sont généralement
reportés pour croitre, quand on se contente d'une humidité de
substrat allant de 50 à 75% (Pandey et al., 2000). Annunziato et al.,
(1986) ont démontré que l'humidité initiale de 35%
s'avère l'optimale pour un degré élevé de
production de á-galactosidase par Aspergillus oryzae. Pour un
substrat comme le son de blé, l'activité de l'eau est très
élevée pour cette raison, une distribution superficielle de
solution de sels minéraux augmente et engendre des agglomérations
de substrat. Pour un substrat comme le son de blé, l'activité
d'eau est très élevée par la suite une augmentation
légère du contenu d'eau par l'addition de solution de sel
minérale peut mener à l'agglomération du substrat.
L'importance d'humidité et l'activité d'eau implique qu'il est
nécessaire d'envisager les quantités d'eau exactes a
ajouté au substrat, en le préparant (Gowthaman et al.,
2001).
82
Résultats et Discussion
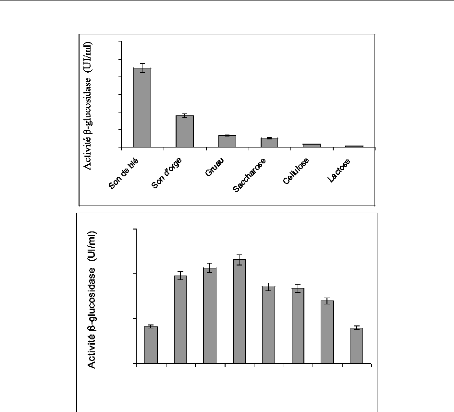
b
6000
4000
2000
0
1% 3% 5% 7% 9% 11% 13% 15%
4000
6000
5000
3000
2000
1000
0
Source de carbone
a
Concentration du son de blé (%)
Figure 13: L'activité 3-glucosidase
des préparations enzymatiques résultantes de la fermentation de
différents substrats par A. niger (a) et de différentes
concentrations de son de blé (b).
I-3 Sélection de la source d'azote pour la
production de Ji-glucosidase
Différentes sources d'azote organiques et inorganiques
à savoir urée peptone de caséine mycopeptone peptone
végétale peptone de soja peptone de viande peptone de blé
nitrate d'ammonium sulfate d'ammonium nitrate de sodium et nitrate de potassium
ont été testées afin de démontrer leurs effets sur
la production de 3-glucosidase par A. niger. Le maximum de production
de 3-glucosidase durant la fermentation à été
regroupé et illustré sur la Fig. 14. La
quantité totale d'azote de ces sources est égale à la
quantité de (NH4)2SO4 dans le milieu de base. L'utilisation de la
peptone de blé et d'urée comme la source d'azote, produit la
meilleure production de l'activité 3-glucosidase (4297 #177; 0,08UI/ml
et 4100#177; 0,08UI/ml respectivement), par comparaison avec les autres sources
d'azote utilisées. Ainsi, la peptone de blé et l'urée sont
sélectionnés pour faire une expérience mélangeant
ces derniers dans un seul erlenmeyer, depuis une activité assez
importante de 3-glucosidase (6500 #177; 0,08 IU/ml) a
83
Résultats et Discussion
été obtenue quand la peptone de blé et
l'urée sont ajoutés ensemble dans le milieu de culture comme une
source d'azote. Pour les autres sources d'azote testés tels que la
peptone de caséine (3025 #177; 0,06 IU/ml), la peptone
végétale (3200 #177; 0,03 IU/ml), peptone de viande (3250 #177;
0,06 IU/ml) supposé de bon producteur de 3-glucosidase. La Mycopeptone
(2150 #177; 0,2 IU/ml), la peptone de soja (2200 #177; 0,25 IU/ml), le sulfate
d'ammonium, le nitrate d'ammonium, le nitrate de potassium (2100 #177; 0,09
IU/ml) et le nitrate de sodium (1000 #177; 0.09 IU/ml) donne uniquement des
résultats modérés.
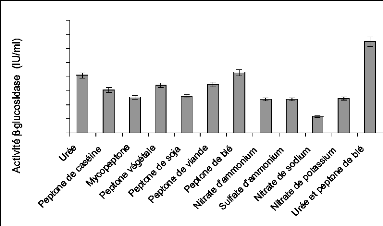
4000
8000
7000
6000
5000
3000
2000
1000
0
Figure 14: Activité 3-glucosidase des
préparations enzymatiques résultantes de la fermentation de son
de blé par A. niger avec la présence de
différentes sources d'azote.
I-4 Effet du rapport C/N sur la production de
Ji-glucosidase
Bien que le rapport C/N affecte fréquemment le taux de
biosynthèse de plusieurs métabolites, l'influence du ratio C/N
sur la production de 3-glucosidase reste non évaluée
jusqu'à présent. Le comportement de la souche A. niger
dans le son de blé durant 7 jours de fermentation à 30
°C avec différents rapport C/N qui varie de 1 à 80 ont
été étudié en respectant l'activité
3-glucosidase. Comme c'est montré sur la Fig. 15,
l'activité 3-glucosidase est très sensible au ratio C/N. En
effet, la meilleure activité (7000 UI/ml) est obtenue avec le rapport
C/N égale à 10. Nos résultats sont un meilleur
agrément avec d'autres procès de fermentation pour la production
d'autres types d'enzyme, par exemple, la biosynthèse de laccase est
favorisée par un faible rapport C/N (Levin et al., 2002,
2010).
84
Résultats et Discussion
1 5 10 15 20 40 80
Ratio C/N
Figure 15: Activité
â-glucosidase des préparations enzymatiques résultant de la
fermentation du son de blé par A. niger avec la présence
de différents ratios C/N.
II- Résultats de la fermentation d'Aspergillus
niger sur le milieu de culture optimisé
II-1 Enzymes produites durant la fermentation
d'Aspergillus niger dans le son de blé
La caractérisation de la préparation enzymatique
obtenue à partir de jus de culture d'A. niger à la fin
de la fermentation a permis de décrypter la biosynthèse de la
majorité des enzymes produites par cette souche. Les résultats
obtenus sont regroupés sur le tableau 6.
Tableau 6: Caractérisation de la
préparation enzymatique obtenue à partir de jus de culture
d'A. niger.
|
Jus de
culture
|
|
Protéines (ug/ml)
|
127
|
|
Laccase (UI/ml)
|
0,00
|
|
á-amylase (UI/ml)
|
92,22
|
|
Ji-glucosidase (UI/ml)
|
4500-7185
|
|
Sucre réducteur (g/l)
|
1,75
|
|
Protéase (UI/ml)
|
0,00
|
|
Estérase (UI/ml)
|
100-230
|
|
xylanase (UI/ml)
|
5,4
|
|
CMCase (UI/ml)
|
0,6
|
|
Papier filtre (UI/ml)
|
0,144
|
85
Résultats et Discussion
D'après ces résultats, la quantité de
protéine produite est de 127 ug/ml et celle de sucre réducteur
résiduel est de 1,75 g/l. Le jus de culture est dépourvu de
laccase (0 UI/ml) et de protéase (0 UI/ml), alors que la
biosynthèse de á-amylase (92,22 UI/ml), de xylanase (5,4 UI/ml),
CMCase (0,6 UI/ml) et d'activité papier filtre (0, 144 UI/ml)
s'avère assez modérée. Quant à la production
d'estérase (100 à 230 UI/ml) est moyennement importante. Et la
meilleure biosynthèse enzymatique par cette souche dans ces conditions
optimales est réservée pour la 3-glucosidase (7185 UI/ml) vu la
richesse du milieu de culture en 3-glucanes.
II-2 Caractérisation du jus de culture
d'Aspergillus niger
II-2-1 Evaluation de protéines et de sucre
réducteur dans le jus de fermentation
Le contenu en protéine et en sucre réducteur
(SR) dans le filtrat de jus de culture fongique est aussi
déterminé durant la fermentation. Les résultats
collectés sont illustrés dans la Fig. 16a.
Durant cette fermentation, la croissance du champignon est rapide durant les
trois premiers jours de l'incubation et le mycélium colonise
efficacement entiérement le substrat pendant le huitième jour.
Les résultats montrent que la quantité en protéine dans le
jus de fermentation croît linéairement jusqu'à atteindre
127 ug/ml à la fin de la fermentation (Fig. 16a). Ce
résultat indique la production progressive des enzymes extracellulaires
par le champignon. La Fig 16a montre aussi l'évolution
de la concentration des sucres réducteurs durant le temps d'incubation.
L'analyse de ces résultats montre que la concentration des sucres
réducteurs augmente durant le début de la fermentation qui est
enrichit à 8 g/l en 2 jours de fermentation. Cependant, cette
concentration décroît à 1 g/l durant le troisième
jour d'incubation et se stabilise à cette valeur durant tout le temps
d'incubation. Ces résultats peuvent être expliqués par la
libération de sucres réducteurs à partir des
polysaccharides du son de blé par les cellulases d'A. niger et
la consommation simultanée de ces derniers par le mycélium
produit.
II-2-2 Evaluation des activités Ji-glucosidase et
estérase dans le jus de fermentation
La production d'une préparation multienzymatique par
A. niger sur le son de blé est améliorée par
l'optimisation des paramètres opératoires de la culture et de la
composition de milieu de culture comme il a été décrit
dans la partie I présentée ci-dessus. La production des enzymes
fongiques est contrôlée par la mesure de l'activité
3-glucosidase et estérase. L'activité 3-glucosidase et le contenu
en protéine dans le milieu extracellulaire sont des indicateurs d'une
colonisation fongique efficace, et cette activité croît avec le
temps de culture (Fig. 16). Les résultats
collectés suite à l'étude de la cinétique de
production de 3-glucosidase et d'estérase ont été
illustrés sur la Fig. 16b. Durant la production de
3-
86
Résultats et Discussion
glucosidase par le champignon ; une phase de latence est
observée durant les 3 premiers jours de la fermentation. Par la suite
deux phases peuvent être regardées ; d'abord une première
phase avec une vitesse de production de â-glucosidase
modérée; cette phase commence le quatrième jour (714 UI/ml
d'activité â-glucosidase) et s'achève vers le
septième jour (4233 UI/ml d'activité
â-glucosidase). (Fig. 16b). A partir du huitième
jour d'incubation de la culture on note une deuxième phase de production
de â-glucosidase où l'activité â-glucosidase croit de
5938 UI/ml à 6380 UI/ml. Cette dernière présente la
vitesse de production la plus intéressante. Concernant la seconde
enzyme, l'estérase, la Fig. 16b montre que cette
activité croît durant les deux premiers jours de la fermentation
pour aboutir à 230 UI/ml, puis elle décroît à 140
UI/ml tout en restant presque stable jusqu'à la fin de la fermentation.
Cette étude indique une colonisation efficace du champignon sur le son
de blé avec une production efficace de â-glucosidase et
d'estérase. De plus, les résultats ont montré que le jus
de culture est un mélange multienzymatique estérase, CMCase,
á-amylase, xylanase et â-glucosidase comme a été
décrit dans la partie II-1 de ce chapitre. Ces enzymes sont connues de
leurs rôles important dans la mobilisation des substrats
phénoliques durant les bio-procès fongiques (Benoit et al.,
2006). Pour cela, nous développeront une voie d'enrichissement des
composés phénoliques simples dans les margines par le jus de
culture produit par la fermentation d'A. niger. L'utilisation de ce
jus de culture bien enrichit en â-glucosidase peut résoudre le
problème des faibles concentrations en hydroxytyrosol dans les margines
fraîches et les problèmes techniques industrielles en relation
avec l'hydrolyse chimique des margines.
87
Résultats et Discussion
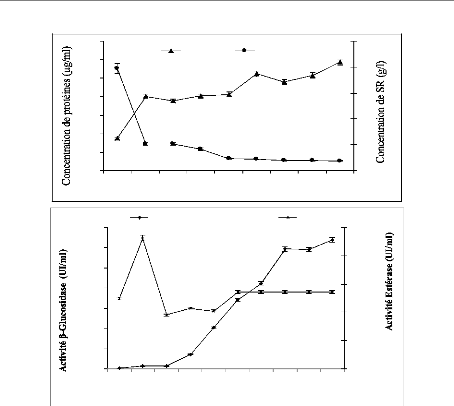
b
7000
250
6000
200
5000
150
4000
3000
100
2000
50
1000
0
0
1 2 3 4 5 6 7 8 9 10
â-Glucosidase Estérase
Temps de culture (Jours)
Protéines SR
2 3 4 5 6 7 8 9 10
140
120
100
80
60
40
20
0
10
8
6
4
2
0
Temps (jours)
a
/g
Figure 16: Evaluation de la quantité de
sucre réducteur et de protéines dans le jus de
fermentation
durant le temps d'incubation (a) et la production de 3-glucosidase et
d'estérase
dans des erlenmeyers agités (b) sous les conditions
optimales de culture à travers une
fermentation d'A. niger
sur le son de blé.
III- Caractérisation de la Ji-glucosidase d'A.
niger
n
Ccen
Avit stse
III-1 Détermination de pH optimum
L'étude caractéristique du jus enzymatique a
été développée afin de déterminer le pH
optimum de l'activité 3-glucosidase. L'enzyme est
testée dans un large domaine de pH (de 2 à 10).
Conformément à la Fig 17a les résultats
montrent une meilleure activité pour les pH acide que pour les pH
alcalin. A pH 4,8 l'enzyme montre 100 % d'activité. Cependant, une
négligeable activité est obtenue pour les pH de 7 à 10.
Donc la 3-glucosidase obtenue est active dans des environnements acides de pH
allant de 4 à 5. Ceci est assez avantageux pour des applications
industrielles par cette enzyme et notamment pour le traitement des margines.
88
Résultats et Discussion
III-2 Détermination de la température
optimale
L'étude thermique de l'activité enzymatique a
été également effectuée. La température
optimale de la préparation enzymatique est déterminée
à pH 4,8. Une variation de température de 25 °C à 100 °C a
été choisie. Les résultats relatifs à cette
étude thermique sont collectés et présentés sur
la Fig. 17b. La préparation enzymatique est plus active
à 50 °C et l'activité 13-glucosidase décroit à
40 % à 70 °C (Fig. 17b). Donc cette enzyme
s'avère non thermophile. La stabilité thermique de la
13-glucosidase est déterminée par incubation du jus enzymatique
à trois différentes températures à savoir : 4
°C, 25 °C et 50 °C. L'activité résiduelle est
déterminée après 1 heure d'intervalle durant 48 heures
d'incubation. Le résultat est résumé dans la Fig.
17c. D'après ce résultat, la conservation à 4
°C garde la bonne activité de la 13-glucosidase durant la
période d'étude. Ainsi, la demi-vie de l'enzyme est de 24 heures
à 50 °C. A la température optimale de 50 °C au bout de
3 h, on trouve encore 75% d'activité résiduelle. Cette enzyme est
alors non thermostable mais elle est convenable à la température
optimale pour des applications en bioconversion.
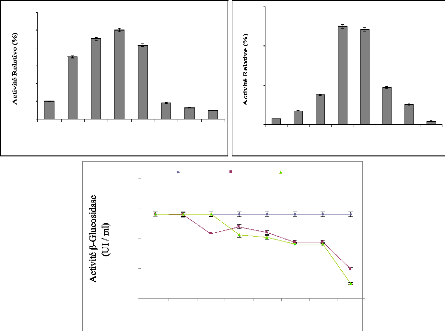
100
80
60
40
20
0
b
120
80
40
0
120
a
2 3 4 4,8 5 6 7 8
pH
25 30 40 50 60 70 80 100
Température (°C)
4 °C 25 50 °C
c
0 1 2 3 4 6 24 48
Temps (h)
10000
8000
6000
4000
2000
Figure 17 : Caractérisation de la
13-glucosidase d'A. niger: Influence du pH (a), Influence de la
température (b), stabilité du jus enzymatique à 4°C,
25 °C et 50 °C (c).
89
Résultats et Discussion
IV- Production de â-glucosidase en fermenteur
Un fermenteur de volume total de 100 litres a
été utilisé pour préparer une culture
d'Aspergillus niger. Le volume utile préparé est de 40
litres. La souche A. niger CTM 10099 a été
utilisée pour la production de â-glucosidase à partir de la
fermentation de son de blé. Le procédé de la fermentation
est schématisé sur la Fig 18.
Traitement de la matière
première: Son de
Blé
Traitement thermique
(100 °C, 10 min)
Traitement acide
(pH 3)
Décantation
Fermentation d'A.
niger
(Préculture+Culture)
Conservation de l'enzyme
(Lyophilisation)
Séparation des cellules
(Technologie des
membranes
:
microfiltration (0,2 um)
Concentration de
perméat (evaporation)
Surnageant
Culture
.
Figure 18 : Diagramme de fermentation à
grande échelle d'A. niger sur le son de blé et
la
récupération de l'enzyme.
La figure 19 représentant les cinétiques de
production des â-glucosidase en fermentation à grande
échelle (40 litres de volume utile dans un fermenteur de 100 litres de
volume total) montre que la production de cette enzyme nécessite une
phase de latence de 3 jours où l'activité enzymatique est presque
constente est égale à 1000 UI/ml. Par la suite la production
enzymatique entre dans une deuxième phase et augmente progressivement
pour atteinde 3390 UI/ml et cette phase passe du quatierième
jusqu'à huitième jour de la fermentation. Enfin la
dernière phase où la production enzymatique décroit
légérement pour atteindre 3000 UI/ml au neuvième jour de
la fermentation. Ceci peut être expliqué par l'épuisement
des substances nutritives à partir du milieu de culture. Une
fermentation en continue peut améliorer l'induction de production de
cette enzyme. Le pouvoir inducteur du son de blé a été mis
en évidence en fermentation d'Aspergillus nier sur ce substrat
aussi bien
90
Résultats et Discussion
en erlenmyer qu'en fermenteur. La fermentation en milieu
liquide a en effet montré le grand pouvoir inducteur du son de
blé vis a vis de la production de la béta-glucosidase. D'autres
chercheurs ont montré l'aptitude à produire les activites
3-glucosidase sur le bagasse par deux souches fongiques à savoir
Talaromyces thermophilus et Trichoderma reesei mais avec un
taux maximal inférieur à celui obtenu par A. niger (30
UI/ml) (Boussarssar, 2008).
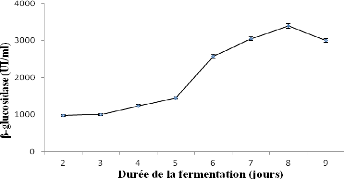
Figure 19 : Cinétique de production de
3-glucosidase en fermentation à grande échelle d'A.
niger
sur le son de blé.
IV-1 Procédé de la microfiltration
tangentielle pour la clarification de jus de fermentation
Pour la récupération d'enzyme à partir du
jus de culture, la première étape est le retrait du
mycélium à partir du bouillon de fermentation. En
général, les techniques de centrifugation et la filtration
conventionnelle sont utilisées à cette fin. Avec une forte
consommation d'énergie, ces techniques ne donnent pas 100% de
récupération, comme la plupart des produits reste
piégé à l'intérieur du gâteau du
mycélium. Elle exige un lavage poussé du mycélium pour
augmenter la récupération du produit. La technologie de
séparation par membrane a de nombreux avantages par rapport aux
classiques de filtration et la centrifugation (Sheehan, Hamilton et Levy,
1988). La microfiltration est utilisée pour la clarification du bouillon
de fermentation et de la récolte de cellules (Strathmann, 1985;
couronnes, Nissen et Ziegler, 1987; Frenander et Jonsson, 1996). Afin de bien
séparer le culot (mycélium de champignon) de jus de fermentation
qui renferme l'enzyme recherchée (3-glucosidase), un
procédé de technologie membranaire a été
utilisé moyennant la microfiltration tangentielle qui utilise un flux
parallèle à la membrane utilisée ayant un diamètre
de pores de 0,2 um. Le bilan de ce procédé est
résumé sur le tableau 7.
? Le volume de jus de fermentation (Vi)= 35 litres
91
Résultats et Discussion
? Le volume de filtrat après microfiltration (VF) = 30
litres
? Le volume de retentât après microfiltration (VR) =
5 litres
? Le volume de l'eau du premier lavage de la membrane (VL1) = 10
litres
? Le volume de l'eau du deuxième rinçage de la
membrane (VL2) = 5 litres
Bilan :
Activité 3-glucosidase avant microfiltration =
Activité 3-glucosidase après microfiltration Activité
3-glucosidase avant microfiltration = Activité (Filtrat+
Rétentat+ Eau de lavage)
Le bilan de la microfiltration a décelé une
perte de 12,96 KUI. La microfiltration permet une bonne séparation du
mycélium du jus de fermentation avec sa bonne clarification en
éliminant tous les résidus du son de blé résiduels,
les mycéliums et les spores, néanmoins ce procédé
de microfiltration présente des pertes de 10,58% d'enzyme qui sont
retenus dans la membrane, comme le montre le bilan.
Tableau 7 : Bilan de microfiltration
|
Activité (UI/ml)
|
Activité totale (KUI)
|
Rendement (%)
|
|
Jus de fermentation
|
3500
|
122,5
|
|
|
Filtrat
|
2028,5
|
60,855
|
49,67
|
|
Rétentat
|
7642
|
38,21
|
31,19
|
|
Eau de premier lavage
|
1000
|
10
|
0,16
|
|
Eau de deuxième lavage
|
95
|
0,475
|
0,38
|
|
Activité totale
|
|
109,54
|
89,42
|
|
Pertes
|
|
12,96
|
10,58
|
IV-2- Procédé de la concentration du
filtrat
La concentration du jus de fermentation filtré a
été effectuée moyennant l'évaporation
de l'eau par la chaleur en utilisant la Rotavap. Un essai a
été effectué pour choisir le barème temps,
température adéquat. Trois différentes températures
ont été testées à savoir 40 °C, 50 °C et
60 °C pour obtenir un facteur de concentration égale à 5,71
(cad Vi = 200 ml et Vf = 35
ml). Les résultats obtenus relatifs à
l'activité enzymatique avant et après concentration ont
été regroupés sur le tableau 8.
Tableau 8 : Etude de la concentration du
permeat
|
40 °C
(1h 30min)
|
50 °C
(1h 5min)
|
60 °C
(40 min)
|
|
Activité initiale de jus (UI/ml)
|
2557
|
2557
|
2557
|
92
Résultats et Discussion
|
Activité après concentration (UI/ml)
|
11129
|
12129
|
13161
|
|
Facteur de concentration (5,71x)
|
|
|
|
D'après ces résultats on remarque qu'avec le
facteur de concentration de 5,71 ; presque une même activité
finale de â-glucosidase obtenue après la concentration du jus de
fermentation. La température 60 °C n'altère pas
l'activité de l'enzyme après 40 min de chauffage.
IV-3- Effet de l'hydrolyse du son de blé sur la
fermentation
Le son de blé est un sous produit non soluble dans
l'eau, il est très riche en glucanes et en polysaccharides. En revanche
ce dernier peut engendrer des problèmes de mousse dans le fermenteur qui
est sous agitation continue durant plusieurs jours tout en créant un
milieu hétérogène non uniforme pour les champignons.
L'idée de son hydrolyse préalable avant son utilisation dans le
fermenteur peut améliorer le rendement de production de l'enzyme. Les
résultats relatifs de cette partie sont résumés sur le
Tableau 9.
Tableau 9 : Effet de l'hydrolyse du son de blé sur
la fermentation
|
Son non hydrolysé
|
Son hydrolysé
|
|
Activité â-glucosidase du jus (UI/ml)
|
2557
|
3895
|
L'activité â-glucosidase du jus a
été améliorée de 1,5 fois par l'hydrolyse du son de
blé, elle est de l'ordre de 3895 UT/ml. Le son de blé a subit une
hydrolyse avec l'acide (pH = 3) suivie d'un traitement thermique (chauffage
jusqu'à ébullition pendant 10 minutes). Ce traitement peut
libérer des polysaccharides et/ou de glucides à assimilation
facile par le champignon qui rend sa croissance plus aisé sur ce
substrat et sa synthèse de â-glucosidase plus
élevée.
93
Résultats et Discussion
Chapitre II:
L'utilisation des enzymes hydrolytiques : une
méthode douce pour la récupération de l'hydroxytyrosol
à partir des margines.
Résultats et Discussion
I. Mise en évidence de la bioconversion des
margines moyennant une réaction
enzymatique
I-1 Introduction
L'hydroxytyrosol est le majeur composé
phénolique naturel des margines (Bonnin et al., 2002). Il est
inséré dans l'oleuropéine aglycone et il est obtenu par sa
libération suite à une hydrolyse des ces glucosides durant le
stockage et la presse des olives, due à l'action des estérases
extracellulaires ou à une catalyse acide (Romero et al., 2002).
De plus ce composé est libéré suite à l'hydrolyse
de l'hydroxytyrosol 4-13-D-Glucoside suite à l'action de 13-glucosidase,
dont les margines présentes une richesse considérable en ce
composé (Romero et al., 2002). Depuis, l'hydrolyse enzymatique
des margines par le jus de culture d'A. niger a été
étudiée dont le but de l'enrichissement de ces margines en
hydroxytyrosol. L'évaluation du procès enzymatique s'avère
nécessaire pour la récupération du maximum d'un tel
produit (Fig. 20).
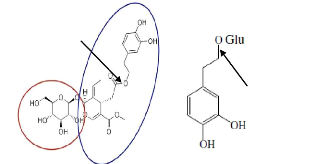
Action de l'estérase
Action de ?-glucosidase
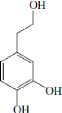
94
Oleuropéine Hydroxytyrosol glycoside
Hydroxytyrosol
Figure 20 : Proposition d'hydrolyse de
quelques polyhénols des margines
par le jus de culture d'A.
niger.
I-2 Hydrolyse enzymatique des margines par la culture d'A.
niger
I-2-1 Effet du substrat sur la biotransformation en
hydroxytytrosol
La première tentative de l'enrichissement de
l'hydroxytyrosol récupéré à partir des margines a
été portée sur l'extraction à l'acétate
d'éthyle puis à l'exposition de l'extrait à une
activité hydrolytique par les enzymes d'A. niger. Pour cette
raison, la fraction organique récupérée par l'extraction
à l'acétate d'éthyle est séchée par le
rotavapor puis dissoute dans un
95
Résultats et Discussion
volume fixe d'eau distillée. La deuxième et la
troisième alternatives s'intéressent à l'exposition des
margines brutes et la fraction résiduelle (margines obtenus après
une extraction à l'acétate d'éthyle) à une
hydrolyse enzymatique par le jus de culture d'A. niger de 5 jours de
culture qui est utilisé pour des réactions enzymatiques des trois
échantillons préparés pendant deux heures. Ces
réactions enzymatiques préliminaires sont réalisées
par le contenu de culture toute entière (c'est-à-dire sans
séparation de mycélium par filtration). Cette biocatalyse
enzymatique a une activité â-glucosidase de 3000 UI/ml (Fig. 16b).
La concentration en phénols totaux dans la fraction phénolique,
la fraction résiduelle ou épuisée et les margines brutes
sont de 1,2 ; 4,6 et 5,8 g/l, respectivement (Tableau 10). Après le
traitement hydrolytique, ces concentrations croient à 1,5 ; 6,2 et
7,1g/l, respectivement (Tableau 10). La transformation en phénols totaux
contenus dans les margines brutes et la fraction résiduelle est due
à la mobilisation des composés aromatiques à partir des
complexes phénoliques. Néanmoins, pour le cas de la fraction
phénolique la légère augmentation des phénols
totaux dans cette dernière est peut être due à l'addition
de jus de fermentation qui est riche en composés phénoliques issu
de l'hydrolyse du son de blé (Ishii, 1997 ; Williamson et al., 1998). Ce
résultat indique que la fraction résiduelle libère une
large quantité de phénols libres. Initialement, son contenu
phénolique est de 4,6 g/l et croît après le traitement
hydrolytique à 6,2 g/l, ceci indique la libération de
phénols libres actifs par les enzymes fongiques. Cet enrichissement en
contenu phénoliques peut améliorer l'activité antioxydante
des margines particulièrement, si le phénol libéré
est l'hydroxytyrosol.
Tableau 10: Le contenu en phénols totaux
et la concentration d'hydroxytyrosol de la fraction organique, la fraction
épuisée, les margines brutes (fraîches) et les margines
acidifiées avant et après traitement hydrolytique par la culture
entière d'A. niger.
|
Phénols (g/l)
|
Hydroxytyrosol (g/l)
|
|
Traitement hydrolytique
|
Avant
|
Après
|
Avant
|
Après
|
|
Fraction phénolique
|
1,20#177;0,5
|
1,50#177;0,5
|
0,05#177;0,005
|
0,15#177;0,05
|
|
Fraction épuisée
|
4,60#177;0,7
|
6,20#177;0,8
|
0,02#177;0,005
|
0,75#177;0,15
|
|
Margines brutes fraîches
|
5,80#177;0,65
|
7,10#177;0,75
|
0,05#177;0,005
|
0,56#177;0,15
|
|
Margines acidifiés (pH 2)
|
6,40#177;0,85
|
-
|
0,18#177;0,06
|
-
|
I-2-2 Identification au CLHP des produits obtenus
Les analyses quantitatives et qualitatives des composés
phénoliques durant les réactions de bioconversion sont
contrôlées par CLHP. Pour les phénols
récupérés, une procédure d'extraction
liquide-liquide utilisant le solvant : acétate d'éthyle est
appliquée aux échantillons. Il a été
rapporté que l'acétate d'éthyle (AE) est le meilleur
solvant convenant
96
Résultats et Discussion
pour une extraction des monomères phénoliques
(Allouche et al., 2004 a). Pour l'évaluation de la
réaction enzymatique avec les différents substrats,
l'acétate d'éthyle (v/v) est sélectionné pour
l'extraction des composés phénoliques simples à partir des
échantillons. Les chromatogrammes de CLHP des margines brutes, la
fraction organique et la fraction résiduelle avant et après
l'hydrolyse sont montrés sur la Fig. 21. Le profile de CLHP des margines
brutes fraîches montre que l'oleuropéine et l'hydroxytyrosol sont
les majeurs composés et ils sont présents à 66,5% et 2%,
respectivement. Le tyrosol est aussi détecté mais sa
concentration est très faible, en comparaison avec les autres
phénols. Les trois composés phénoliques présent
dans les margines en forte concentration sont l'oleuropéine,
l'hydroxytyrosol, et le tyrosol. Ces trois composés sont associés
structurellement. En effet, l'hydroxytyrosol et le tyrosol ont des structures
identiques à l'exception de l'hydroxytyrosol qui possède un
groupement hydroxyle en position méta. L'oleuropéine est
un ester qui consiste de l'hydroxytyrosol et l'acide élénolique.
L'oleuropéine est le majeur composé phénolique dans le
fruit d'olive, qui peut présenter jusqu'à 14 % de l'extrait sec
du fruit, l'hydrxytyrosol est le majeur composé phénolique
d'huile d'olive (Jemai et al., 2009). Pour les fruits d'olive mature,
la concentration de l'oleuropéine décroît et celle de
l'hydroxytyrosol, le produit d'hydrolyse de l'oleuropéine croît
(Jemai et al., 2009). Par ailleurs, l'hydroxytyrosol a
été synthétisé enzymatiquement utilisant une
tyrosinase fongique (Espin et al., 2001). Cette procédure
biologique est environnementale et elle est adaptée au procès
industriel. La base de cette étude est que la large quantité de
l'hydroxytyrosol et les phénols monomériques peuvent se trouver
dans les margines après son traitement hydrolytique par un procès
enzymatique convenable.
La comparaison des différents rendements de production
de l'hydroxytyrosol en considérant les substrats utilisés est
résumée dans le Tableau 10. Ce résultat et le profil de
CLHP indiquent que la concentration de l'hydroxytyrosol augmente après
le traitement hydrolytique de différents échantillons. Comme
c'est indiqué dans les chromatogrammes de CLHP (Fig. 21), les margines
hydrolysées montrent une concentration élevée en
hydroxytyrosol (0,56 g/l) en la comparant avec le control (0,05) et les
margines acidifiées (0,18). Aussi, ces profiles montrent l'augmentation
des concentrations en tyrosol (Ty), l'acide p-coumarique (PC) et
l'acide caféique (CA) après l'hydrolyse des margines brutes et de
la fraction résiduelle. Concernant l'utilisation de la fraction
phénolique comme substrat pour la biotransformation nous observons une
mineure augmentation de la concentration d'hydroxytyrosol (0,15 g/l). En outre,
les résultats présentés dans le Tableau 10 notent que la
bioconversion enzymatique a augmenté la concentration en HT environ 37,5
et 11 fois, en présence de la fraction épuisée et
97
Résultats et Discussion
le margine brut respectivement. En utilisant la fraction
épuisée comme substrat; 0,75 g/l d'hydroxytyrosol est produit,
suggérant que l'hydrolyse enzymatique peut être une technologie
très prometteuse qui peut être utilisée pour augmenter la
concentration d'hydroxytyrosol de margine épuisé obtenu
après une première série d'extraction par solvant de
margine. L'utilisation de margine brut pour la biotransformation enzymatique
pour libérer la concentration maximale d' hydroxytyrosol pourrait
être aussi très rationaliste. Nos résultats confirment que
la 3-glucosidase et l'estérase sont le principal facteur de
libération de l'hydroxytyrosol à partir de l'oleuropéine
tandis que d'un autre étude a démontré que la
bioconversion enzymatique de ce composé en utilisant la 3-glucosidase
recombinante et hyperthermophile de l'archaeon Sulfolobus solfactaricus
exprimé dans Escherichia coli (Briante et al.,
2000). Ici, il convient de noter qu'en vertu des conditions utilisées
dans la biotransformation dans cette étude, l' hydroxytyrosol a
été obtenue à partir de oléuropéine et
d'autres molécules complexes présentes dans le margine, qui sont
moins extractible par le solvant d'acétate d'éthyle. En fait, le
margine contient généralement en plus de l'oleuropéine,
d'autres molécules phénoliques glucosylés, comme le
ligstroside et le démethyl-oleuropéine que, lorsque ils sont
hydrolysées donnent naissance à des formes d'hydroxytyrosol et
plusieurs acide élénolique (Mazzeia et al., 2009).
L'amélioration de la bioconversion du substrat en hydroxytyrosol est
probablement due à l'action de 3-glucosidase, estérase et
d'autres enzymes.
Résultats et Discussion
Temps (min) Temps (min)
98
Temps (min) Temps (min)
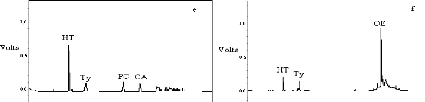
Temps (min) Temps (min)
Figure 21 : Les chromatogrammes de HPLC (UV 280
nm) de la fraction phénolique (extrait à l'AE) (a), fraction
phénolique hydrolysée (b), fraction épuisée (c),
fraction épuisée hydrolysée (d), margine brute
fraîche hydrolysé (e) et acidifié (pH 2) OW (f). Tyrosol:
Ty; Hydroxytyrosol: HT; Acide para-coumarique: PC; Acide caféique: CA;
Oleuropein: OE.
I-2-3 Identification au CG-SM des produits obtenus
L'identification des différents phénols
libérés suite au traitement enzymatique des margines est
achevée par la technique de CG-SM et par la comparaison avec des
composés phénoliques de références (Fig. 22). Les
majeurs composés phénoliques identifiés sont : le tyrosol,
HT, l'acide p-coumarique et l'acide caféique (Fig. 22). Les
autres composés à savoir les acides gras ont été
aussi détectés (Fig. 22).
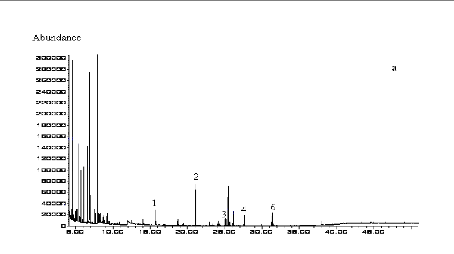
Temps (min)
99
Résultats et Discussion
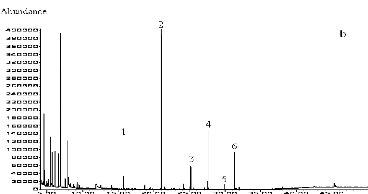
Temps (min)
Figure 22: Chromatogramme d'ion total gaz des
produits extrait à l'acétate d'éthyle obtenu à
partir des margines (a) et margine hydrolysé (b). Les composés
identifiés par la masse tout en respectant leur temps de
rétention sont les suivants : 15,69: tyrosol (1); 21,05: hydroxytyrosol
(2); 25,16: acide para-coumarique (3); 27,59: acide palmitique (4); 29,9: acide
caféique (5);
31,39: acide oléique (6).
J-2-4 Effet de la nature de biocatalyseur, le temps de
la réaction et le temps d'incubation de culture d'A. niger sur la
biotransformation en hydroxytyrosol
Pour améliorer la production d'hydroxytyrosol,
plusieurs facteurs efficients pourraient être étudiés,
principalement la nature du biocatalyseur, le temps de la réaction de
bioconversion et le temps d'incubation de culture d'A. niger. Les
enzymes d'A. niger peuvent se présenter libres dans le
surnageant de la culture ou fixé à la biomasse. Dans cette partie
d'étude, nous avons cherché la caractérisation de
l'emplacement d'enzymes actives : libre ou fixé à la biomasse qui
est considéré comme le biocatalyseur pour la biotransformation.
C'est pourquoi,
100
Résultats et Discussion
les réactions de bioconversion des margines par la
biomasse (mycélium), le filtrat de culture (jus de culture) et la
culture entière (mixte) ont été étudiées. La
Fig. 23 illustre le temps de formation d'hydroxytyrosol pendant ces
réactions. Le contrôle sans enzyme a été aussi
exécuté et aucune production significative d'hydroxytyrosol n'a
été observée (Fig. 23). La quantification d'hydroxytyrosol
du contrôle a montré une concentration de 0.05 g/l qui correspond
seulement à 6,25% de sa valeur finale dans les margines
hydrolysées. Il devrait noter qu'en absence de jus de culture d'A.
niger, le substrat n'a pas été converti en hydroxytyrososl
même avec la condition à haute température (50 °C). La
bioconversion des margines par le filtrat a été
caractérisée par une production d'hydroxytyrosol rapide avec des
concentrations plus élevé que ceux obtenus dans des
expériences semblables en présence de la culture entière
et la biomasse lavée. La quantité de l'hydroxytytrosol produit en
présence de filtrat (0,80 g/l) augmente de 42,8 % comparé
à la culture entière (0,56 g/l). Ici, nous pouvons expliquer
cette différence par la dégradation de l'hydroxytyrosol par la
biomasse. L'utilisation de biomasse, précédemment lavée
par le tampon citrate pH 4,8 a abouti à moins de libération
d'hydroxytyrososl (0,08 g/l) pendant les premiers temps de réaction.
Cependant, la concentration en hydroxytyrosol a augmenté à 0.27
g/l après 6 h de réaction de bioconversion (Fig. 23). Cela peut
être expliqué par le fait que le mycélium a continué
sa production d'enzyme pendant l'incubation avec les margines. Dans ce cas nous
avons noté qu'une augmentation d'activité 3-glucosidase dans le
réacteur enzymatique de bioconversion (220 UI/ml).
Nous pouvons conclure que la concentration la plus haute
d'hydroxytyrosol (0,8 g/l) a été obtenue en utilisant le filtrat
d'enzyme produit par A. niger avec une activité 3-glucosidase
de 3000 UI/ml après 2 h de réaction. Selon ces résultats,
le jus enzymatique est le meilleur biocatalyseur pour la libération de
l'hydroxytyrosol. Cette découverte indique que la 3 glucosidase est
l'enzyme clé dans ce processus aussi la concentration 3-glucosidase est
essentielle pour la bioconversion de polymères des margines pour
évacuer l'hydroxytyrosol. La synthèse et la
sécrétion de 3-glucosidase sont très importantes et la
présence relativement des hauts niveaux d'activité 3-glucosidase
avec l'estérase ensemble semble être essentielle pour une
hydrolyse enzymatique efficace des margines.
Pour réaliser le rendement maximal en hydroxytyrosol,
l'état de croissance de culture d'A. niger utilisée pour
la conversion des margines a été aussi optimisé. Les
fermentations en batch de son de blé avec l'A. niger ont
été examinées dans des mêmes conditions
contrôlées. Les filtrats de culture obtenus aux différents
temps d'incubation ont été évalués pour la
bioconversion des margines. Les résultats ont montré que, pendant
les 5 premiers jours de
101
Résultats et Discussion
culture, la libération de l'hydroxytyrosol était
synchrone avec l'activité â-glucosidase présente dans le
jus de culture (les Figues 16 b et 24). Une association entre une
activité élevée de â glucosidase (le jour 2-5) et
une libération de l'hydroxytyrosol a été observée,
confirmant de nouveau le rôle d'hydrolyse de cette enzyme.
Néanmoins, à une activité enzymatique plus importante
(4800 UT/ml) correspondant au jus de culture au huitième jour
d'incubation, la concentration en hydroxytytrosol était uniquement de
0,5 g/l contre 0,8 g/l obtenu au cinquième jour d'incubation. En effet,
la concentration en hydroxytyrosol a diminué lentement, qui pourrait
être en raison du fait qu'il est dégradé par le
mycélium ou les spores du champignon qui ont apparu au sixième
jour.
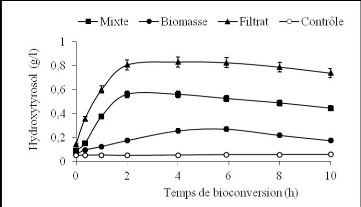
Figure 23 : Evolution de la concentration de
l'hydroxytyrosol dans les margines durant son hydrolyse par la culture
entière, le filtrat et la biomasse de culture d'A. niger
à 50 °C.
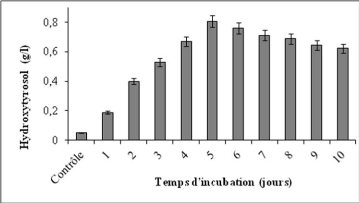
Figure 24 : La concentration d'hydroxytyrosol
après la bioconversion des margines en utilisant le filtrat de culture
du A. niger à différents temps d'incubation.
102
Résultats et Discussion
Ces résultats indiquent que la f3-glucosidase est
l'enzyme clé dans ce processus; également la concentration de
f3-glucosidase est essentielle pour la bioconversion des polymères de
margines pour libérer l'hydroxytyrosol. Cela a été
démontré par Capasso et al. (1997) qui ont étudié
l'hydrolyse enzymatique de l'oleuropéine, extrait de la plante
d'olive, par la f3-glucosidase libre de l'amande. Cela doit
également être pris en compte que la quantité
d'hydroxytyrosol dans le margine ne vient pas seulement de l'hydrolyse de
l'oleuropéine et le verbascoside mais aussi à partir de
l'hydrolyse de l'hydroxytyrosol 4-f3-D-glucoside (Romero et al., 2002)
où la f3-glucosidase est l'enzyme clé pour la
libération
d'hydroxytyrosol. La présence de niveaux relativement
élevés des activités f3-glucosidase et estérase
semble être essentielle pour l'hydrolyse enzymatique efficace des
margines. L'utilisation de préparation enzymatique d'A. niger
obtenue après 5 jours d'incubation est un bio-catalyseur efficace
pour la bioconversion de margine. Dans ces conditions de
biotransformation, de concentration élevée
d'hydroxytyrosol (0,8 g/l) sont collectées par
une procédure très simple (enzymatique hydrolyse
- extraction EA) qui peut s'avérer utile pour une nouvelle demande de
recyclage de margine. La f3-glucosidase recombinante homogène
hyperthermophile archaeon de S. solfactaricus, exprimé dans
E. coli, a été immobilisée sur le support, le
chitosane utilisé pour produire hydroxytyrosol à partir de
l'oléuropéine de commerce (Briante et al., 2000). En outre, les
propriétés antioxydantes du principale produits obtenus ont
été purifiés et caractérisés (Briante et
al., 2001) jusqu'à une production de hydroxytyrosol de 91-94% en poids a
été atteint (Briante et al., 2004).
I-3 Activité antioxydante
Les composés phénoliques sont connus par
l'exposition de radicaux libres qui aide à enlever les oxydations
(l'activité d'antioxydant), qui est déterminée par leur
réactivité comme des donneurs d'hydrogène ou
d'électrons et leur stabilité de la résultante en
antioxydants radicalaire dérivé, leur réactivité
avec d'autres antioxydants et leurs propriétés de
chélation des métaux (De Leonardis et al., 2007). Dans la
présente étude, l'activité antioxydante d'extraits des
margines brutes (frais), margines hydrolysées, la fraction
épuisée, la fraction épuisée hydrolysée,
l'hydroxytyrosol purifiée et BHT a été mesurée par
la méthode de l'effet antiradicalaire DPPH de piégeage de
radicaux libre et l'IC50 est présenté dans le Tableau 11. La
méthode DPPH estime la capacité de l'extrait pour étouffer
le radical libre DPPH. Tous les extraits ont montré le potentiel
d'antioxydant dans l'essai du radical DPPH (Tableau 11).
103
Résultats et Discussion
Tableau 11: Détermination de
l'activité antioxydante (IC50) des margines brutes (fraîches),
margine hydrolysée, fraction épuisée, fraction
épuisée hydrolysée, BHT et hydroxytyrosol
purifié.
|
Echantillons
|
IC50 (ug/ml)
|
|
Margine brute (fraîche)
|
650#177;60
|
|
Margine Hydrolysée
|
75.2#177;10
|
|
Fraction épuisée
|
805#177;80
|
|
Fraction épuisée hydrolysée
|
20#177;0,75
|
|
BHT
|
29#177;115
|
|
Hydroxytyrosol
|
23#177;0,90
|
Le BHT a montré une forte activité antioxydante
avec une valeur d'IC50 de 29 ug/ml. L'activité antioxydante des margines
brute (fraîche) était naturellement très faible (IC50=650
ug/ml) en comparaison de l'activité de BHT. Cependant, cette
activité a augmenté après l'hydrolyse enzymatique avec une
valeur d'IC50 de 75,2 ug/ml (Tableau 11). Ces activités antioxydantes
des extraits phénoliques dépendent des caractéristiques
qualitatives du profil phénolique et non pas du contenu
phénolique total (Ziogas et al., 2010 ; Randhir et Shetty,
2007). La valeur de l'IC50 de l'extrait des margines hydrolysées prouve
que cet extrait contient des composés de haute activité
d'antioxydant comme l'hydroxytyrosol (IC50=23 ug/ml). Le tableau 11 montre
aussi l'activité antioxydante de l'extrait de la fraction
épuisée et la fraction épuisée hydrolysée.
De ces résultats nous avons noté une activité antioxydante
très faible de l'extrait de la fraction épuisée (IC50 =
805 ug/ml) cela signifie que les composés phénoliques ayant la
convenance de la forte activité antioxydante ont été
extraits pendant la première étape d'extraction à
l'acétate d'éthyle. L'hydrolyse de cette fraction
épuisée utilisant la préparation d'enzyme d'A.
niger, nous a permis d'enregistrer une haute activité antioxydante
(IC50 = 20 ug/ml) qui est plus élevée que l'activité
antioxydante des margines hydrolysées, BHT et hydroxytyrosol pur. Cela
pourrait être expliqué par la réaction de synergie entre
l'hydroxytyrosol et d'autres composés phénoliques simples qui
peuvent aussi être évacué pendant l'hydrolyse enzymatique
tels que l'acide caféique et l'acide p-coumarique (Fig. 21d).
On le connaît de la littérature que parmi des composés
phénoliques des margines, l'hydroxytyrosol et l'acide caféique
montrent de fortes propriétés antioxydantes mais dans tous les
cas le tyrosol et l'acide férulique sont considérés comme
des neutraceuticallement positif (Litridou et al.; 1997).
104
Résultats et Discussion
D'antérieurs résultats ont montré que les
phénols d'olive récupéré par l'extraction à
l'acétate d'éthyle des margines sont de bons antioxydants pour le
saindoux (De Leonardis et al., 2007). D'autres études ont montré
que les polyphénols des margines ont un effet d'antioxydant sur des
cellules épithéliales humaines intestinales (Manna et
al. , 1997 a) et une action cytostatique sur quelques cellules tumorale
(Owen et al. , 2000). Fki et al. (2005) ont montré que
l'extrait des margines peut être utilisé comme des antioxydants
naturels alternatifs pour stabiliser des huiles comestibles, en apaisant en
même temps une préoccupation majeure de consommateurs sur
l'utilisation d'antioxydants synthétiques dans les produits
alimentaires.
I-4 Conclusion
Nous annonçons un traitement enzymatique très
simple et rapide des margines fraîches tout en obtenant des
quantités importantes en hydroxytyrosol. Les traitements d'hydrolyse
d'une fraction phénolique, la fraction épuisée et les
margines brutes (fraîches) ont été examinés
utilisant le jus de fermentation d'A. niger sur le son de blé.
Quelques facteurs d'exploitation de cette bioconversion ont été
aussi ajustés. Cette étude indique que la réaction
d'hydrolyse des margines brutes (fraîches) pendant 2 h par un filtrat
obtenu d'un bouillon de culture d'A. niger après 5 jours
d'incubation, permet de libérer l'hydroxytyrosol à une
concentration de 0,8 g/l de margine. Ce processus produit un produit naturel et
bioactif d'une source végétale, par opposition à la
molécule obtenue par synthèse chimique. Le projet de
prétraitement enzymatique peut s'avérer utile non seulement pour
les applications de laboratoire, mais aussi
pour la potentielle application industrielle pour le recyclage
des margines.
II. Les enzymes fongiques : un outil puissant pour
enrichir les margines en antioxydants
II-1 Introduction
Les champignons sont des microorganismes bien connus pour la
vaste gamme d'enzymes qu'ils produisent et qui ils sont utilisés dans
beaucoup de processus industriels. L'importance d'enzymes microbiennes dans les
applications de biotechnologie a grandi significativement dans les deux
dernières décennies et actuellement dans la bioconversion de
sous-produits industriels. La présente étude a été
entreprise pour évaluer la possibilité d'appliquer des milieux de
culture (sans aucune étape de purification) de trois souches : A.
niger (CTM 10099), T. atroviride (CTM 10476) et T. trogii
(CTM 10156) sur les margines dans le but d'augmenter la concentration de
composés d'antioxydant comme l'hydroxytyrosol.
105
Résultats et Discussion
II-2 Production d'enzymes
A. niger CTM 10099, T. atroviride CTM 10476
et T. trogii CTM 10156 ont été cultivé dans des
cultures liquides pendant 10 jours, utilisant le sous-produit agricole
disponible, le son de blé, comme la source de carbone unique. La
production de B-glucosidase par les champignons mésophiles A. niger
cultivé sur le son de blé a été
améliorée par l'optimisation de la composition moyenne et des
conditions de fermentation (résultats motionnés dans le chapitre
I). Les mêmes conditions de culture optimisées ont
été utilisées pour les fermentations de T. atroviride
et T. trogii. Pour la caractérisation du profil d'enzyme
des trois préparations seulement les activités 3-glucosidase,
estérase et laccase ont été analysées. Les
résultats obtenus sont regroupés sur la Fig. 25 et tableau 12.
Cette illustration montre les profils de production typiques de 3-glucosidase,
estérase et laccase pendant la fermentation de son de blé par le
A. Niger, T. atroviride et T. trogii.
Tableau 12: Maximum des activités
3-glucosidase, estérase et laccase (UI/ml) enregistré dans le jus
de culture des trois souches durant la fermentation sur le son de blé et
la concentration de l'hydroxytyrosol (g/l) obtenue après le traitement
enzymatique des margines par ces trois préparation enzymatiques (Valeur
moyenne #177; écart type (n = 3)).
|
â-glucosidase
|
Estérase
|
Laccase
|
Hydroxytyrosol
|
|
Aspergillus niger
|
8380#177;150
|
130#177;20
|
0#177;0,0
|
1,1#177;0.2
|
|
Trichoderma atroviride
|
365#177;50
|
218#177;20
|
840#177;50
|
0,5#177;0,2
|
|
Tramates trogii
|
29#177;10
|
230#177;20
|
2246#177;50
|
0,2#177;0,1
|
|
â-glucosidase purifiée
|
3533#177;150
|
0#177;0,0
|
0#177;0,0
|
1,15#177;0,2
|
|
Margines brutes
|
80#177;10
|
nd
|
nd
|
0,049#177;,02
|
nd: non détérminé
Ces résultats montrent que les trois souches produisent
différentes quantités de 3-glucosidase (tableau 12). A. niger
et T. atroviride avait une plus forte activité
3-glucosidase que le T. trogii et vice versa pour l'activité
laccase (Fig.25). La comparaison de production de 3-glucosidase a
révélé qu'A. niger a produit la plus haute
activité par rapport à T. atroviride et T.
trogii. Dans cette étude, nous avons noté qu'A. niger
a produit environ 10 fois plus de 3-glucosidase que T.
atroviride. La Fig. 25 a et le tableau 12 illustrent que la culture
d'A. niger sur le son de blé n'a pas produit une
activité laccase significative. D'une façon intéressante,
l'activité estérase a été détectée
dans les trois préparations de jus de culture au même ordre de
production. Après 10 jours de culture, les plus fortes activités
3-glucosidase (6380 UI/ml) et laccase (2246 UI/L) ont été
obtenues dans les jus de culture d'A. niger et T. trogii,
respectivement (Fig. 25a et 25c). Cependant, T. atroviride a produit
les trois enzymes aux
106
Résultats et Discussion
niveaux modérés (Fig. 25b). Cette souche,
isolée à partir de saule préalablement traité,
s'est également montré éfficace pour produire des
cellulases et des â-glucosidases sur ce matériel (Kovács
et al., 2008).
Selon l'étude de Bonnin et al., 2002, les
enzymes qui dégradent la paroi cellulaire et les polysaccharides, y
compris la cinnamoyl estérase produite par A. niger
cultivé sur la pulpe de betterave à sucre, a de haut
intérêt pour la libération de l'acide férulique
à partir du sous-produits agroindustriels, comme la pulpe de betterave
à sucre ou le son de maïs. Sur la lumière de cette
étude, les enzymes présents dans le jus de culture d'A.
niger, T. atroviride et T. trogii pourrait exercer un
effet semblable sur les structures moléculaires des margines qui
présentent des glucosides et des liaisons ester entre les
poly-phénols et les polysaccharides et/ou lignine (Walter et
al., 1973). C'est pourquoi, nous avons évalué l'effet de
filtrats des jus fongiques sur l'hydrolyse de macromolécules des
margines pour évacuer des composés phénoliques libres
ayant de forte activité antioxydante.
107
Résultats et Discussion
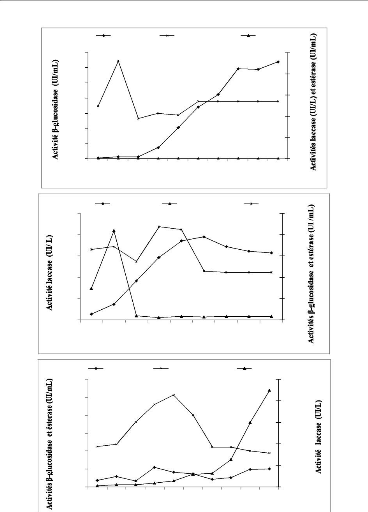
a
BG Estérase Laccase
250
200
150
100
50
0
7000
6000
5000
4000
3000
2000
1000
0
b
BG Laccase Estérase
250
200
150
100
50
0
1000
800
600
400
200
0
c
300
2500
250
2000
200
1500
150
1000
100
500
50
0
0
1 2 3 4 5 6 7 8 9 10
BG Estérase Laccase
Temps de culture (Jours)
1 2 3 4 5 6 7 8 9 10
Temps de culture (Jours)
2 3 4 5 6 7 8 9 10
Temps de culture (Jours)
Activit
lacca
i c
A
Figure 25: Evolution des activités
â-glucosidase (BG), estérase et laccase dans le jus de culture de
A. niger (a), T. atroviride (b) et T. trogii (c)
durant 10 jours de fermentation sur le son de blé.
108
Résultats et Discussion
II-3 Hydrolyse enzymatique des composés
phénoliques des margines
L'utilisation des préparations enzymatiques commerciaux
dans le processus d'extraction d'huile d'olive pour augmenter la concentration
de composés phénoliques dans la pâte et l'huile pendant les
étapes de malaxation a été approuvée par Garcia et
al., 2001. De plus plusieurs recherches identifient les margines comme une
source potentielle du récupération de composés
phénoliques (Allouche et al., 2004; Aldini et al., 2006). Dans notre
étude, l'acétate d'éthyle a été
utilisé pour extraire des composés phénoliques des
margines. Les analyses quantitatives et qualitatives de ces composés
phénoliques ont été effectuées moyennant la
chromatographie liquide haute pression : CLHP. La Fig. 26a illustre les
chromatogrammes de CLHP de l'extrait à l'acétate d'éthyle
des margines brutes et fraîches (le contrôle). Ce profil montre que
les margines fraîches sont riches en oleuropéine (le pic 3) et un
autre composé de verbascoside non identifié (le pic 4). Des
composés bio-actives phénoliques simples comme HT (le pic 1) et
tyrosol (le pic 2) sont aussi présents à de faibles
concentrations. La concentration de l'hydroxytyrosol est de 0,049 g/l. Ce
contenu correspond à la fraction libre en hydroxytyrosol dans les
margines brutes fraîches. Cependant, les margines sont une source
hydrolysable de phénols comme l'oleuropéine, les ligstrosides ou
les verbascosides (Bianco et Uccella, 2000), dans lesquelles les principaux
composants phénoliques sont des glycosides et des esters. Par
conséquent, de grandes quantités de constituants
phénoliques seraient libérées quand l'hydrolyse chimique
ou enzymatique est survenue dans les margines, particulièrement les
orthodiphénoliques comme l'hydroxytyrosol qui est reconnu par ces
propriétés antioxydantes. L'analyse enzymatique montre que les
margines brutes contiennent une activité â-glucosidase de 80 UI/ml
(Tableau 10). Cette enzyme peut provenir du fruit : l'olive (Jemai et al.,
2009) et aussi des activités des microorganismes (Ciafardini et Zullo,
2000). Cette concentration d'enzyme (aussi bien que d'autres enzymes
hydrolytiques) n'est pas suffisante pour l'hydrolyse des conjugués
cités et c'est pourquoi la concentration de l'hydrytyrosol augmente avec
le temps de stockage des margines, suite à la fermentation
spontanée et l'enrichissement de ces effluents en hydroxytyrosol (Fki et
al., 2005). Ici, nous suggérons d'augmenter la concentration de ce
composé bioactif par un traitement enzymatique tout en utilisant le jus
de culture des champignons comme un processus d'intensification.
Résultats et Discussion
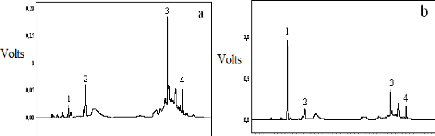
Temps (min)
Temps (min)
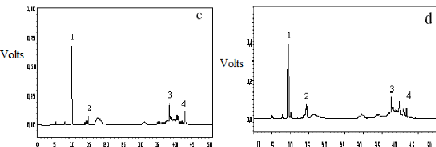
Temps (min) Temps (min)
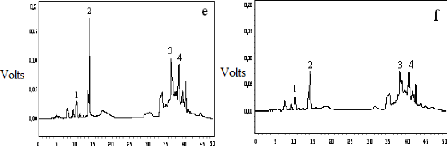
109
Temps (min) Temps (min)
Figure 26 : Chromatogramme HPLC des
composés phénoliques de la fraction d'acétate
d'éthyle (détection à X = 280 nm) extraits de margines
fraîches et brutes (a) et margines après son hydrolyse par
B-glucosidase purifiée (b) et par les préparations enzymiques
collectés suite à la fermentation du son de blé par le
A. niger au dixième jours (c), T. atroviride au
quatrième jour (d) et dixième jour (e) et T. trogii
dixième jour (f) de culture. 1 : hydroxytyrosol; 2 : tyrosol; 3 :
oleuropéine; 4 : composé non identifié.
Des jus d'enzymes fongiques obtenus par les cultures de A.
niger, T. atroviride et T. trogii cultivé sur le
son de blé ont été annoncés
précédemment (Chapitre II : II-2) pour leur richesse d'enzymes
spécifiques. Pour étudier l'effet de chaque préparation
enzymatique à la libération de composés phénoliques
simples des margines, les filtrats de jus de culture des
110
Résultats et Discussion
trois champignons ont été testés pour
l'hydrolyse des margines pendant 2.0 h à 50 °C. Les jus de culture
de ces champignons seront choisis en termes de leur spécificité
en enzymes pour la transformation en composés orthodiphénoliques
les substrats conjugués des margines. La Fig. 27 donne
l'évolution de la concentration en hydroxytyrosol hydrolysée dans
les margines par les jus extracellulaires fongiques
récupérés à différent temps d'incubation des
cultures. Comme c'est indiqué de cette figure, les quantités
significatives en hydroxytyrosol ont été libérées
après les différentes hydrolyses enzymatiques des margines.
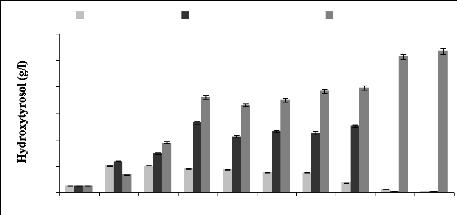
Trametes trogii Trichoderma atroviride Aspergillus
niger
Contrôle Jour 2 Jour 3 Jour 4 Jour 5 Jour 6 Jour 7
Jour 8 Jour 9 Jour 10
1,2
1
0,8
0,6
0,4
0,2
0
Figure 27 : Evolution de la concentration de
l'hydroxytyrosol dans la fraction phénolique récupérer
à partir des margines après son hydrolyse par les jus
extracellulaires collecté durant la fermentation sur son de blé
par les trois souches.
L'étude quantitative des extraits de margines suite
à son hydrolyse permet de présenter les chromatogrammes de HPLC
résumé sur la Fig. 26. D'après cette figure on note une
augmentation de l'intensité du pic de l'hydroxytyrosol (1) avec une
diminution concomitante du sommet de l'oleuropéine (3) pendant la
réaction de bioconversion des margines par les trois types de
préparation d'enzyme. L'identification de l'hydroxytyrosol a
été aussi confirmée par l'analyse LC-MS (chromatographie
liquide couplée à la masse spectrale) (Fig.28). Les
concentrations les plus élevées en hydroxytyrosol ont
été obtenues en présence de jus de culture d'A.
niger. La concentration en ce composé dans les margines a
augmenté avec l'âge du jus de culture du A. niger qui
pourrait être en corrélation avec la concentration des enzymes
extracellulaires hydrolytiques comme l'activité B-glucosidase dans le
jus de culture. La bonne corrélation entre la haute activité
â-glucosidase et la libération de l'hydroxytyrosol dans les
margines pourrait être observée (Fig. 25 et 27) pour les trois
souches. Ces résultats peuvent confirmer que la â-glucosidase joue
un rôle biochimique
111
Résultats et Discussion
significatif dans l'hydrolyse catalysant des liaisons
glycosidiques dans les oligo et les polysaccharides présents dans les
margines. L'activité estérase mesurée dans les trois jus
de cultures a montré des activités qui varient entre 100-200
UI/ml (Fig. 25). Cette enzyme permet l'hydrolyse de la liaison ester entre les
composés phénoliques et les polysaccharides. L'oleuropéine
est un ester héterosidique de l'acide élenolique et
l'hydroxytyrosol B-glucosylée. Ainsi, l'hydroxytyrosol peut être
provenu de l'oleuropéine, via l'aglycone, par la libération de
l'acide elénolique avec un réarrangement final dans le
composé de secoiridoides (Walter et al., 1973). Ce résultat est
en accord avec des études précédentes de Capasso et
al., 1999 ; Briante et al., 2002.
Intens.
x107
0.8
0.6
0.4
0.2
0.0
1.2
1.0
3. -MS, Line, 2.2-2.3min (#81-#85), 100%=11564689
136.9
152.9
168.8
178.8
184.9
198.8
212.8
226.7
244.9
258.8
306.8
a
100
|
|
125 150
|
175
|
200
|
225
|
250
|
275 300 m/z
|
|
x106
|
3.
|
|
|
|
|
|
-MS2(152.9), Line, 2.3-2.4min (#82-#86),
100%=1017523
|
|
|
1.0
|
|
|
123.0
|
|
|
|
|
b
|
|
|
0.8
|
|
|
|
|
|
|
|
|
|
|
0.6
|
|
|
|
|
|
|
|
|
|
|
Intens.
0.4
|
|
|
|
|
|
|
|
|
|
|
0.2
|
|
|
|
|
|
|
|
|
|
|
109.0
|
|
|
|
|
|
|
|
|
|
0.0
|
|
|
|
|
|
|
|
|
100 125 150 175 200 225 250 275 300 m/z
Figure 28: Spectre de masse du l'ion total du
pic chromatographique du temps de rétention
2,2 min dans les margines
hydrolysées: (a) MS et (b) MS2.
La concentration maximale de l'hydroxytyrosol
enregistré par l'analyse CLHP était de 1,1 ; 0,5 et 0,2 g/l
respectivement en présence des jus de culture d'A. niger du
jour 10 (6380,95 UI/ml d'activité â-glucosidase), T.
atroviride du jour 4 (365 UI/ml d'activité â-glucosidase) et
T. trogii du jour 2 (29,05 UI/ml d'activité
â-glucosidase). Ces concentrations sont 21,63 ; 10,2 et le 4,08 fois plus
élevé que le contrôle (Tableau 12) si l'on utilise les jus
de culture d' A. niger, T. atroviride et T. trogii
respectivement. On a également observé une
112
Résultats et Discussion
augmentation de tyrosol dans le cas du T. atroviride
(de 0.05 g/l à 0.17g/l) (Fig. 26e). Ce résultat montre que
les enzymes de T. artroviride sont également actives sur des
polymères contenant le tyrosol en tant qu'antité
phénolique tel que le ligostroside. Cependant, l'utilisation du jus de
culture de T. artroviride qui a montré des activités
modérées de 3-glucosidase et de laccase a eu comme
conséquence la diminution de la concentration de HT des margines (de 0.5
à 0.03) à la fin de la fermentation (Fig. 25e). Cette
dégradation est expliquée par l'oxydation de HT par la laccase
qui est très sensible aux agents oxydants que le tyrosol (Chakroun et
al., 2010). L'utilisation de jus de culture de T. trogii qui a
montré de forte activité laccase a abouti à la diminution
de la concentration des composés phénoliques totales (Fig. 25c et
26f). Ces résultats montrent que la laccase est efficace pour la
transformation ou l'oxydation de composés phénoliques simples et
complexes et peut être considéré comme un outil efficace
pour la désintoxication de déchets phénoliques comme les
margines. La transformation oxydative de mélanges phénoliques
naturels et synthétiques par la laccase de Trametes versicolor
a été aussi examiné par Canfora et al., 2008.
De la présente partie d'étude, nous pouvons
conclure que la margine est une source des phénols hydrolysables tels
que l'oleuropéine, le ligstroside ou le verbascoside, qui
présentent des liens glucosidiques et ester entre les principaux
composants de phénol et les polysaccharides et/ou la lignine (Bianco, et
Uccella, 2000 ; Walter, et al., 1973). En conséquence, une
quantité plus élevée de HT est libérée quand
l'hydrolyse enzymatique est produite dans la margine en employant la
préparation enzymatique spécifique.
Effet des préparations enzymatiques
commerciales.
Des expériences de bioconversion en employant la
3-glucosidase purifiée par d'A. niger (EC
2328898),l'estérase purifiée et le viscozyme ont
été conduits aux mêmes conditions opérationnels. Ces
préparations enzymatiques ont été ajoutées aux
margines à des proportions donnant une concentration en 3-glucosidase et
éstérase de 1500 UI/ml au milieu réactionnel.
L'utilisation de la 3-glucosidase pure d'A. niger (CE 2328898) UI/ml a
abouti à l'obtention de 1,15 g/l d'hydroxytyrosol. Cette valeur est
largement proche à celle obtenue en utilisant le jus de culture d'A.
niger brute obtenue sans aucune étape de purification (Fig. 29).
Cependant, l'augmentation du contenu en orthodiphénol utilisant la
3-glucosidase d'A. niger pure pendant la biotransfomation des margines
peut rappeler beaucoup d'études qui ont utilisé cette enzyme pour
l'hydrolyse de l'oleuropéine pure (Ciafardini et Zullo, 2000), ou les
extraits de feuille d'Olea europaea (Briante, et al., 2002) ou dans
des olives vertes (Walter et al., 1973). En revanche,
l'estérase pure seule n'a aucun effet sur la bioconversion et la
modification des composés phénoliques des margines.
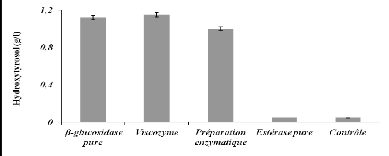
113
Résultats et Discussion
La figure 29 montre également l'effet du viscozyme sur
la libération de HT dans les margine. Cette dernière montre que
le viscozyme est le meilleur biocatalyseur utulisé, il a augmenté
la concentration d'HT de 0,05 (contrôle) à 1,15 g/l. Ceci peut
être expliqué par la composition multienzymatique de cette
préparation enzymatique commerciale, qui contient des cellulases, des
arabinases, des hémicellulases, des gluconases et des xylanases, capable
d'agir sur un grand nombre de composants, agit fondamentalement sur les
substrats solubles et insolubles (Duenas et al., 2007), et ceci cause
des modifications de plusieurs composés phénoliques et peut
libérer des composés phénoliques plus simples. Ces
résultats ont indiqué que la préparation enzymatique
d'A. niger a le même effet que le viscozyme et la 3-glucosidase
purifiée pour la libération d'HT. Alors que l'estérase n'a
pas d'effet sur la bioconversion. Par conséquent, A. niger,
généralement identifié comme le micro-organisme
`'generally recognised as a safe (GRAS)», est un excellent producteur de
la 3-glucosidase, qui est l'enzyme hydrolytique principale pour le
monomerisation des polyphénols des margines. Par conséquent, la
préparation enzymatique d'A. niger est la meilleure alternative
pour augmenter le contenu de HT dans les margines par l'intermédiaire de
la propre réaction de la bioconversion. De plus, la préparation
enzymatique d'A. niger est exempt de laccase qui est une enzyme
oxydante pour les composés phénoliques. Une concentration
élevée de HT 1,1 g/l a été obtenue après 2
heures de réaction enzymatique des margines en présence de
préparation enzymatique d'A. niger à 50 °C, et à
pH 4,8 et en état statique. La concentration obtenue de HT par cette
méthode de bioconversion peut être améliorée par
l'optimisation d'autres paramètres : concentration en enzymes,
état d'agitation, temps de réaction... etc.
Figure 29: Concentration maximale de
l'hydroxytyrosol libéré à partir de margines
traités par
la 3-glucosidase pure d'A. niger, viscozyme, la
préparation enzymatique d'A. niger, estérase
pure et
le contrôle.
Selon les travaux précédents (Espin et
al., 2001 ; Bouallagui et Sayadi 2006 ; Capasso et al., 1999 ;
Briante et al., 2002), des procédures de synthèse pour
la production d'HT sont
114
Résultats et Discussion
chers et/ou ont des rendements bas en produit. Pour
l'application à grande échelle du bio-processus proposé, 1
m3 de margine a eu comme conséquence la production de 1,1
kilogramme de HT. Le calcul du coût préliminaire d'hydrolyse des
margines par la préparation enzymatique d'A. niger donne une
valeur très intéressante des 1181,5 DT/m3. Par
conséquent, ce bio-processus a pu ouvrir une nouvelle
méthodologie possible pour récupérer un rendement
élevé d'HT à bas pris.
II-4 Effet antiradicalaire DPPH de l'extrait des
margines
L'effet antiradicalaire DPPH des extraits des margines brutes et
hydrolysées à l'acétate d'éthyle, BHT,
Hydroxytyrosol pur et l'oleuropéine pure est représentée
dans le Tableau 13.
Tableau 13 : Effets antiradicalaires des
composés phénoliques (Valeur moyenne #177; écart type (n =
3)).
|
Extraits et composés purs
|
IC50 (ug/ml)
|
|
BHT
|
28 #177;1,15
|
|
Extrait à l'acétate d'éthyle des
margines brutes
|
501#177;13
|
|
Extrait à l'acétate d'éthyle des
margines hydrolysées
|
45#177;3,12
|
|
Hydroxytyrosol Pure
|
22#177;2,02
|
|
Oleuopéine
|
173#177;4,93
|
Parmi les composés présents dans les margines,
il a été trouvé que les composantes
ortho-dihydroxylés aromatiques présentent une plus grande
activité antiradicalaire sur le radical libre de DPPH, en particulier
l'hydroxytyrosol et 3,4 - dihydroxyphényl acide acétique (Fki
et al., 2005). Comme le montre le tableau 5, l'hydroxytyrosol est un
antioxydant puissant et son activité (IC50 = 22 ug/ml) est le plus
élevé que celui d'un antioxydant commercial : BHT, (IC50 = 28
ug/ml). En particulier, les activités antioxydantes des extraits des
margines brutes et hydrolysées ont été inférieur
à celui du BHT (tableau 13). L'effet antiradicalaire de l'extrait des
margines brutes (IC50 = 501 ug/ml) est partiellement liée à sa
teneur en acide caféique, le 3,4-dihydroxyphényl acide
acétique et en particulier à l'oleuropéine. L'extrait
à l'acétate d'éthyle des margines hydrolysées
présentait une plus grande activité antiradicalaire (IC50 = 45
ug/ml) par rapport à l'extrait à l'acétate d'éthyle
des margines brutes et de l'oleuropéine (Tbleau 13). Ces
résultats ont démontré que l'hydrolyse enzymatique des
margines par la préparation d'enzyme d'A. niger conduit
à une augmentation de l'activité antioxydante. Cela est dû
à la conversion de l'oleuropéine et d'autres composés
verbascosides en hydroxytyrosol qui s'avère un antioxydant exceptionnel
ayant une forte capacité d'élimination et d'absorption
radicalaire. Les résultats dans le tableau 13 ont prouvé que
115
Résultats et Discussion
l'activité antioxydante de hydroxytyrosol et l'extrait
d'acétate d'éthyle ont été plus
élevée que celle de l'oleuropéine (IC50 = 173 ug/ml).
L'hydroxytyrosol se produisant après ce type de bioconversion puisse
être considéré comme un composé ayant des
propriétés antioxydantes élevées (Tableau 13). On
l'a démontré dans cette étude et beaucoup d'autres que
l'activité antioxydante de l'hydroxytyrosol était plus haute que
celle de l'oleuropéine (Soni et al., 2006). Fki, Allouche, et
Sayadi (2005) ont prouvé que la margine pourrait être une source
naturelle de substances utiles, notamment HT, qui ont une action puissante sur
le piégeage des radicaux superoxydes.
II-5 Conclusion
Les présents résultats ont montré que
A. niger, T. trogii et T. atroviride croissent sur un milieu de
culture économique (le son de blé comme l'unique source de
carbone) tout en produisant une préparation d'enzyme extracellulaire
ayant des activités estérase, 13-glucosidase et laccase.
Évalués sur les margines brutes (fraîches) ayant de
très basse charge de monomères phénoliques comme
l'hydroxytyrsol, ces jus de culture ont pu convertir des phénols
hydrolysables comme l'oleuropéine, ligstroside ou verbascoside en
monomères comme l'hydroxytyrosol. Les meilleurs résultats ont
été atteints en utilisant le jus de culture d'A. niger
présentant une forte activité 13-glucosidase (faible
activité estérase et aucune laccase) où 1,1 g/l
d'hydroxytyrosol a été libéré de margines
fraîches ne contenant que 0,05 g/l d'hydroxytyrosol naturellement libres.
Ainsi, la réaction de bioconversion proposée dans cette
étude, permettant la récupération de l'hydroxytyrosol
naturel, offre une alternative à la méthode d'extraction
conventionnelle et la fermentation microbienne. Cette méthode est
environnemental, amical qui permet également d'améliorer le
rendement d'extraction et de la qualité des extraits. La grande
efficacité de l'hydroxytyrosol comme un antioxydant puissant a
été confirmée par la méthode antiradicalaire DPPH.
Cela permet des perspectives encourageantes en matière de
commercialisation de l'hydroxytyrosol comme un puissant antioxydant naturel.
III- Optimisation du procès de la bioconversion
des composés phénoliques des margines III-1
Introduction
L'hydroxytyrosol est l'un des majeurs composés
phénoliques dans le fruit d'olive et il a été
prouvé pour être le plus avantageux à son effet
pharmacologique remarquable et des activités d'antioxydant (Fabiani
et al., 2002 ; Visioli et al., 2004). Actuellement,
beaucoup
116
Résultats et Discussion
d'études sur la biodisponibilité et le
métabolisme dans l'homme sont conduites pour établir ses effets
avantageux de santé (Miró-Casas et al., 2003 ; Visioli
et al., 2005). Parce que l'hydroxytyrosol fait comme d'habitude une
partie d'autres molécules comme l'oleuropein, le
démethyloleuropein, le verbascoside et l'hydroxytyrosol glucosides
(Amiot et al., 1989 & 1986 ; Romero et al. , 2002 ; Jemai
et al. , 2009 ; Ziogas et al., 2010). La gestion, le
traitement et la disposition sûre des margines imposent des
préoccupations environnementales sérieuses. Le concept principal
de la méthodologie en ceci proposée est que les
polyphénols contenus dans les margines pourrait être
sélectivement hydrolysés par des enzymes se permettant de
libérer des composés utiles pour l'industrie pharmaceutique et
cosmétique d'une part et la production d'eaux usées sans
polyphénols ayant une DCO significativement réduite d'autre part.
L'hydroxytyrosol a été choisi comme un modèle pour les
études de la biotransformation. Dans cette étude, nous
suggérons la biotransformation des margines par l'utilisation de la
préparation enzymatique obtenue suite à la fermentation du son de
blé par A. niger. L'analyse des activités enzymatiques
de jus de culture d'A. niger a montré une forte activité
3-glucosidase (plus de 4500 IU/ml) et une activité estérase
modérée (200 IU/ml). Les différents paramètres de
la réaction d'hydrolyse enzymatique proposée ont
été étudiés et optimisés pour maximiser la
libération de l'hydroxytyrosol. Cette partie de recherche vise à
trouver la méthodologie à hydrolyser les margines par une
préparation enzymatique pour obtenir le maximum de rendement en
hydroxytyrosol. Les variables opérationnelles principales dirigeant le
processus d'hydrolyse enzymatique (la température, le temps, le pH,
l'agitation) ont été étudiées. La proportion entre
l'enzyme et le substrat a aussi été évaluée. La
réaction enzymatique proposée a été
appliquée à deux sortes différentes de margine; le premier
est produit par un processus d'extraction discontinu traditionnel (MSP :
Margine Super Presse) et le deuxième est produit par une centrifugation
continue suit l'utilisation d'un système à trois phases (MCC :
Margine Chaîne Continue).
III-2 Effet de la température sur la
réaction de bioconversion et sur l'activité â-
glucosidase
Les différents essais d'activité 3-glucosidase
et des réactions de bioconversion des margines ont été
effectués dans des lots séparés contrôlés aux
différentes conditions de température. On montre l'effet de ce
paramètre sur l'activité 3-glucosidase et sur la production de
l'hydroxytyrosol par l'hydrolyse enzymatique des margines par la
préparation d'enzyme enrichie en 3-glucosidase dans la Fig. 30. La
température de réaction varie de 25 à 100 °C. Les
contrôles ont été également réalisés
par addition de l'eau au lieu de la préparation enzymatique. La Fig. 30
montre que la température n'a pas d'effet sur la libération
117
Résultats et Discussion
d'hydroxytyrosol. Toutefois, l'ajout de la préparation
enzymatique montre une augmentation de la concentration de l'hydroxytyrosol en
toute la gamme de température. Les résultats montrent que
l'activité 3-glucosidase a augmenté progressivement avec
l'augmentation de la température de 25 à 50 °C. Cependant,
l'activité 3-glucosidase était significativement plus importante
dans des températures s'étendant entre 50 et 70 °C que cela
aux limites de 25 à 40 °C. Comme c'est montré dans la Fig.
30, la préparation d'enzyme brute a montré que l'activité
catalytique est plus élevée à 50 °C. Elle a
été complètement inactivée à une incubation
de température de 100 °C (Fig. 30).
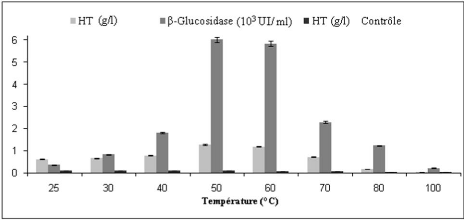
Figure 30: Effet de la température sur
l'activité 3-glucosidase et la production de l'hydroxytyrosol. Les
barres d'erreur indiquent l'écart type (n = 2).
La température optimale de notre enzyme est semblable
à la majorité de 3-glucosidases bactériennes et fongiques
annoncée précédent (Gueguen et al., 1994 ; Wei
et al. , 1996 ; Sharmila et al. , 1998 ; Saha & Bothast.,
1996 ; Yan et al., 1998), et bien sure inférieure que certaines
3-glucosidases thermostables (Hang & Woodams, 1994 ; Saha et al., 1994).
Cependant, la tolérance de chaleur de notre 3-glucosidase est plus haute
que les expériences de 3-glucosidases les plus annoncées
(Barbagallo, 2004).
III-3 Effet du pH sur la réaction de bioconversion
et sur l'activité â- glucosidase
Le pH optimum pour l'activité 3-glucosidase a
été déterminé sur une gamme de pH allant de 2
à 8. La même étude a été exploitée
pour la bioconversion des composés phénoliques des margines, en
présence de la préparation enzymatique enrichie en 3-glucosidase.
Les contrôles ont été également
réalisés par addition d'eau au lieu de préparation
enzymatique. Les effets du pH sur l'activité 3-glucosidase et sur le
rendement de
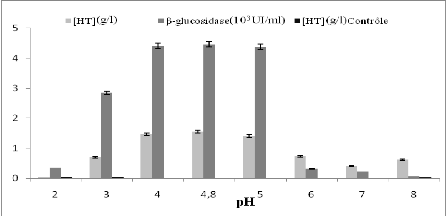
118
Résultats et Discussion
bioconversion ont été représentés
dans la Fig. 31. La Fig. 31 montre que le pH n'a pas d'effet sur la
libération d'hydroxytyrosol. Toutefois, l'ajout de la préparation
enzymatique montre une augmentation de la concentration de l'hydroxytyrosol
dans toute la gamme de pH. Les résultats indiquent que la 3-glucosidase
a montré une activité maximale à pH 4,8. Il a
été totalement inactif à un pH au-dessus de 6 et moins de
3. L'activité 3-glucosidase a été comparativement plus
élevée dans la gamme acide que dans le domaine alcalin.
Remarquablement, la 3-glucosidase d'A. Niger a montré un pH
optimal relativement élevé que la plupart des 3-glucosidases
d'autres champignons et de bactéries (Zheng & Shetty, 2000). Ce pH
optimum de réaction de bioconversion de 4,8 coïncide très
bien avec le pH naturel des margines qui varie entre 4,6 et 5.
Figure 31 : Effet du pH sur l'activité
3-glucosidase de jus de culture d'A. niger et sur la production de
l'hydroxytyrosol. Les barres d'erreur indiquent l'écart type (n = 2).
L'effet du pH démontre aussi une corrélation
positive entre la libération de l'hydroxytyrosol et l'activité
3-glucosidase. La réaction de bioconversion à pH 4,8 donne la
plus forte concentration d'hydroxytyrosol (1,54 g/l), qui est le
résultat de la plus haute activité 3-glucosidase
enregistrée dans ces expériences.
III-4 Effet du type de margine sur la libération de
l'hydroxytyrosol
Le processus de fabrication d'huile d'olive a connu des
changements évolutifs. Le processus traditionnel discontinus a
été remplacé par le processus de centrifugation en continu
en utilisant un système à trois phases. Dans cette étude,
les margines générées par le premier et le second
processus est appelé «Margine Super Presse» (MSP) et
«Margine Chaine Continue» (MCC), respectivement. Une étude
comparative de la bioconversion des composés
Résultats et Discussion
phénoliques de ces deux types de margines par la
même préparation enzyme a été opéré
dans des batch en erlenmeyrs. Ces deux types de margines proveniennent à
partir de la même variété d'olive (Chemlali) et au
même jour. Le tableau 14 résume la concentration en
composés phénoliques simples totaux et la concentration de
l'hydroxytyrosol avant et après la biotransformation des composés
phénoliques de ces deux types de margines.
Tableau 14: Le contenu en phénols
simples et la concentration en hydroxytyrosol avant et après l'hydrolyse
enzymatique de MCC et MSP. (Valeur moyenne #177; écart type (n = 3))
|
Type de
|
[Ph]i (g/l)
|
[Ph]f (g/l)
|
[HT]i (g/l)
|
[HT]f (g/l)
|
|
Margine
|
|
|
|
|
|
MCC
|
7,420#177;1,05
|
12,900#177;1,75
|
0,018#177;0,005
|
1,520#177;0,05
|
|
MSP
|
4,340#177;0,65
|
9,420#177;13
|
0,015#177;0,005
|
0,890#177;0,07
|
i : concentration initiale f : concentration finale HT:
Hydroxytyrosol
La concentration initiale de l'hydroxytyrosol était
très faible dans le MCC (0,015 g/l) et le MSP (0,018 g/l) (Tableau 14).
Après la biotransformation, la concentration des composés
phénoliques simples totaux a fortement augmenté, en raison du
clivage des saccharides polyphénoliques par la préparation
enzymatique d'A. Niger (Tableau 14). Pour les deux types de margines,
les analyses CLHP montrent que le principal composé phénolique
simple et majeur était l'hydroxytyrosol (Fig. 32).
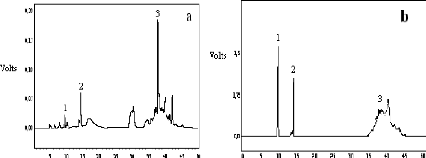
119
Temps (min) Temps (min)
Figure 32: chromatogrammes CLHP à 280
nm des extraits de margine avant (a) et après l'hydrolyse enzymatique
(b): (1) Hydroxytyrosol; (2) Tyrosol; (3) Oleuropéine.
La concentration de cet antioxydant atteint une valeur de 0,89
et 1,52 g/l respectivement en MSP et le MCC. Cela montre que la
libération de l'hydroxytyrosol dépend du type des margines. Bien
sûr, cela pourrait être attribuée à des
différences à la technique de
120
Résultats et Discussion
traitement; bien que nous pensons que cela pourrait
également être dû à la quantité d'eau
ajoutée lors de l'extraction d'huile d'olive. L'étude comparative
de la bioconversion des composés phénoliques de ces deux types de
margines démontre que le MCC a plus de potentiel de biotransformation
que MSP (Tableau 14). Cela pourrait être dû au fait que les
phénols les plus hydrolysables comme l'oleuropéine, le
ligstroside ou le verbascoside sont présents, et donc plus
d'hydroxytyrosol est libéré (Bianco & Uccella, 2000). Pour
cette raison, nous avons choisi l'utilisation du MCC pour le reste du
travail.
III-5 Relation entre la production de l'hydroxytyrosol et
la concentration de Ji-glucosidase
Dans cette partie, nous avons étudié l'effet de
la concentration de l'enzyme sur la bioconversion des composés
phénoliques des margines. Ici, le volume de margines a été
fixé et nous avons fait varier la quantité en enzyme. Pour ces
expériences, la préparation enzymatique possède une
activité 3-glucosidase de 4600 UI/ml. Les réactions de
bioconversion ont été menées à pH 4,8 et à
température de 50 °C, qui ont été
déterminés comme des conditions optimales pour la 3-glucosidase
d'A. Niger (Fig. 30 et 31). Les concentrations de l'enzyme ont
été variées de 0 à 1125 IU/ml de milieu
réactionnel. La relation entre la production de l'hydroxytyrosol et la
concentration de l'enzyme a également été examinée.
Les résultats sont représentés dans la Fig. 33. Comme le
montre cette figure, la concentration de l'hydroxytyrosol a
considérablement augmenté au cours des différentes
expériences.
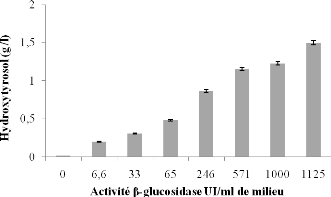
Figure 33 : Effet de la concentration de
3-glucosidase sur la production de l'hydroxytyrosol. Les barres d'erreur
indiquent l'écart type (n = 2).
121
Résultats et Discussion
Néanmoins, le contrôle (sans addition d'enzyme)
n'a pas montré d'augmentation de la concentration en hydroxytyrosol au
cours du temps d'incubation. Cela démontre que le jus de culture
d'A. Niger montre une haute activité hydrolytique sur les
polymères présents dans les margines. En fait, ce processus
semble être très intéressant parce que l'enrichissement des
margines en hydroxytyrosol est possible grâce à une
réaction enzymatique simple (pas de réglage du pH, aucun produit
chimique ajouté, etc.). L'augmentation de la production de
l'hydroxytyrosol est proportionnelle à l'activité de l'enzyme
dans le milieu réactionnel. Les résultats montrent que tout en
augmentant la concentration de l'enzyme dans le milieu réactionnel, la
concentration en hydroxytyrosol augmente. Ces résultats montrent que la
13-glucosidase est l'enzyme clé dans ce processus; aussi une forte
concentration de 13-glucosidase est essentiel pour la bioconversion des
polymères de margines et la libération de l'hydroxytyrosol. Cela
a été démontré par Capasso et al. (1996)
qui ont étudié l'hydrolyse enzymatique de l'oleuropéine,
extrait de la plante d'olive, par la 13-glucosidase libre d'amande. Il devrait
également être pris en compte que la quantité de
l'hydroxytyrosol dans la margine vient non seulement de l'hydrolyse de
l'oleuropéine et la verbascoside mais aussi de l'hydrolyse de
l'hydroxytyrosol 4-13-D-glucoside (Romero et al., 2002 ; Feki et
al., 2006, Fki et al., 2005) où la 13-glucosidase est
l'enzyme clé pour la libération de l'hydroxytyrosol.
Le rendement le plus élevé en hydroxytyrosol
(1,5 g/l) a été observé à une concentration de
l'enzyme de 1125 UI/ml de milieu réactionnel (Fig. 33). Nous avons
noté qu'il ya une augmentation de la concentration de l'hydroxytyrosol
environ 0,4 g/l en doublant la concentration de l'enzyme de 571 à 1125
UI/ml. Le système idéal consisterait à la vitesse de
réaction la plus rapide que possible par l'équilibre de la
quantité de 13-glucosidase utilisée. Afin d'économiser la
quantité d'enzymes, nous suggérons l'utilisation de 500 UI/ml
comme la concentration optimale qui génère la libération
suffisante de l'hydroxytyrosol.
En fait, le pré-traitement enzymatique des margines qui
semblait être un processus très prometteur car l'enrichement des
margines en hydroxytyrosol est possible grâce à une
réaction enzymatique unique sans ajustement du pH et ajout de produits
chimiques. L'hydroxytyrosol hydrolysé à partir des margines peut
être récupéré par une ultrafiltration ou par une
simple extraction liquide-liquide. Le procédé d'ultrafiltration
directe conduirait à un concentré contenant des composés
phénoliques cibles. Alternativement, le procédé
d'extraction par solvant de la margine hydrolysée abouti à un
extrait contenant les composés cibles et une fraction
épuisée représentant la phase aqueuse de la margine. Cette
fraction reste à son pH initial, est libre de polyphénols et a
une Demande Chimique en Oxygène
122
Résultats et Discussion
considérablement réduit en comparaison de
margines initiales. Ces caractéristiques rendent les eaux usées
hydrolysées très facile à traiter par des
procédés biologiques.
III-6 Effet de l'agitation sur la réaction de
bioconversion
Dans cette partie, l'effet de l'agitation sur le taux de
libération de l'hydroxytyrosol a été étudié.
La cinétique d'hydrolyse des margines par la préparation
enzymatique enrichi en â-glucosidase a été
évalué par la détermination de la concentration de
l'hydroxytyrosol. Les évolutions de l'accumulation d'hydroxytyrosol lors
de la réaction de bioconversion du MCC ont été
illustrées dans la Fig. 34. La bioconversion a été
effectuée dans les conditions optimales déterminées
précédemment. La concentration optimale en â-glucosidase de
500 UI/ml a été utilisée dans le milieu
réactionnel.
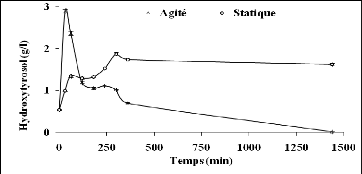
Figure 34: Cinétique de production de
l'hydroxytyrosol durant l'hydrolyse enzymatique de
MCC dans des conditions
statiques et agités. Les barres d'erreur indiquent l'écart type
(n = 2).
Les résultats montrent que la production de
l'hydroxytyrosol est rapide et excellent pour les margines hydrolysées
dans un état d'agitation. Les concentrations maximales d'hydroxytyrosol
de 2,9 g/l et 1,5 g/l ont été respectivement obtenues
après 30 min d'agitation et après 5 h en condition statique (Fig.
34). Ici, nous notons que l'agitation permet d'accélérer et
d'améliorer l'hydrolyse enzymatique des margines. Ce résultat
pourrait s'expliquer par la saturation des sites catalytiques actifs de la
â-glucosidase d'A. Niger dans un état statique. Sur la
base de ces résultats, nous concluons que l'agitation est un
paramètre important pour optimiser l'hydrolyse enzymatique des margines.
Cependant, les résultats montrent que l'état statique fait la
plus grande stabilité d'hydroxytyrosol dans le milieu
réactionnel. En fait, la molécule d'hydroxytyrosol est
très sensible à l'oxydation essentiellement dans un état
agité. Gómez-Alonso et al. (2007) ont
démontré que la majorité des composés
phénoliques d'olive en particulier l'hydroxytyrosol ne sont pas
très stables même dans des conditions de stockage doux. En effet,
dans des études précédentes, la stabilisation des
résidus d'huile d'olive avec
123
Résultats et Discussion
l'éthanol a été trouvé pour
être une étape essentielle pour empêcher les
réactions oxydatives enzymatiques et non enzymatiques responsables de la
dégradation des composés phénoliques et/ou de leurs
polymérisation (Lesage-Meessen et al., 2001 ; Feki et al.,
2006). En conséquence de ce travail, la destruction de l'hydroxytyrosol
est survenue après quelques heures de la réaction par son
oxydation avec l'oxygène moléculaire (Fig. 29) et son exposition
à la lumière, qui s'est intensifiée dans un état
d'agitation. Cela a été démontré par deux
expériences d'hydrolyse enzymatique. La première a
été réalisée en présence d'oxygène
atmosphérique et le second a été contrôlé
dans la présence d'azote. La deuxième expérience a
montré la production de l'hydroxytyrosol maximale et une plus grande
stabilité en comparaison avec le premier (Fig. 35). Par ailleurs,
l'hydrolyse enzymatique de la margine dans un état agité a
montré la stabilité seulement pour les 30 premières
minutes de la concentration d'hydroxytyrosol au cours des 6 heures de
réaction et ensuite a diminué progressivement avec le temps. Pour
cette raison, 30 min de réaction enzymatique est suffisant pour
libérer la forte concentration de l'hydroxytyrosol du MCC (2,9 g/l).
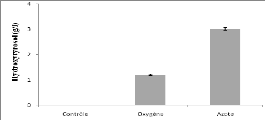
Figure 35: Effet de l'oxygène
moléculaire sur la stabilité de l'hydroxytyrosol.
En comparaison avec la méthode de stockage à
long terme qui a été publié par Feki et al.,
2006, la méthode suggérée enzymatique est très
prometteuse. Après 5 mois de stockage, une accumulation importante de
hydroxytyrosol a été observée. La concentration
correspondante a augmenté dans les margines par un facteur de 3,5 (Feki
et al., 2006). En effet, la méthode de stockage à long
terme est très simple mais nécessite des coûts de gestion
élevés. Il nécessite un espace énorme pour
plusieurs mois et produit des boues et de mauvaise odeur.
III-7 Conclusion
Dans la présente recherche, nous avons
étudié les effets de (i) les conditions physico-chimiques (pH,
température, temps et agitation), (ii) le type de margine comme substrat
et (iii) la concentration d'enzyme sur la réaction de bioconversion des
margines. Cette réaction a consisté en une hydrolyse enzymatique
des composés phénoliques des margines par le jus de
124
Résultats et Discussion
culture d'A. niger riche en 3-glucosidase qui est
produite par la fermentation d'A. niger sur un substrat bon
marché: le son de blé.
Une forte concentration d'hydroxytyrosol (2,9 g/l) a
été obtenu après 30 min de réaction enzymatique de
margine à 50 °C, à pH 4,8 et en état agité.
Cette concentration n'est pas rapporté avant et c'est une des plus
fortes concentrations d'hydroxytyrosol rapporté après conversion
chimique ou biologique des margines.
Le projet de prétraitement enzymatique des margines a
permis la récupération de l'hydroxytyrosol naturel sans produits
ni méthodes chimiques, de solvants de qualité alimentaire, ce qui
fait de ce procédé économiquement faisable. Le calcul
préliminaire du coût du processus a donné une valeur
très intéressante de 1181 DT/m3 de margines (dinars
tunisien par mètre cube de margine). Ce bio-processus va certainement
ouvrir de nouveaux horizons dans le marketing de l'hydroxytyrosol comme un
puissant antioxydant naturel.
IV-Essai d'immobilisation de la Ji-glucosidase sur
l'alginate de calcium
IV-1 Introduction
L'immobilisation de 3-glucosidase dans un support solide offre
la perspective de réductions des coûts et élargit la
flexibilité de conception du processus, en permettant l'opération
continue et simplifiant en aval le traitement. Dans le présent travail,
un essai d'immobilisation de 3 -glucosidase par encapsulation dans l'alginate
de calcium a été examiné comme une approche pour
l'immobilisation
IV-2 Effet de la concentration en alginate de calcium sur
l'activité â-glucosidase
Différentes concentrations en alginate de calcium ont
été préparées et utilisées pour
l'encapsulation de l'enzyme du jus de culture d'A. niger
fermentée sur le son de blé. La Fig. 36 montre
l'activité 3-glucosidase de deux billes en fonction des diverses
concentrations en alginate de calcium. Cette activité a persisté
pour la plupart des concentrations d'alginate de calcium, cependant la Fig. 36
indique clairement que la meilleure concentration d'alginate de calcium est de
2 %. A cette concentration l'activité 3-glucosidase de deux billes est
de 200 UT/ml. En revanche pour un pourcentage de 8% l'activité
enzymatique chute de 48%. Ces résultats semblent être en accord
avec ceux obtenus par Goksungur et Guvenc (1999) où la concentration
optimale en alginate de calcium est de 2%.
125
Résultats et Discussion
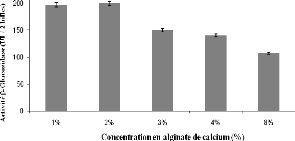
Figure 36 : Effet de la concentration en
alginate de sodium sur l'activité â-glucosidase
Une concentration de 1% en alginate de calcium a comme
conséquence des billes très molles et peuvent être plus
facilement cassées en raison de leur basse force mécanique, ayant
pour résultat la fuite des enzymes des billes (Idris et Suzana, 2006).
Tandis que l'augmentation de l'alginate de calcium à une concentration
supérieure à 2% durcit les billes, de ce fait des
problèmes de diffusion peuvent se produire et l'accès de l'enzyme
à son substrat sera plus difficile.
V- Caractérisation des propriétés de
l'enzyme immobilisée
V-1 Introduction
En général l'immobilisation des enzymes leur
confère les caractéristiques suivantes:
? augmentation de leur stabilité dans le temps,
? élargissement du domaine d'utilisation vis à vis
des conditions de température et de
pH,
? facilité de séparation en vue d'une
réutilisation,
? possibilité de mise en oeuvre de procédés
continus
V-2 Effet de la température et le pH sur l'enzyme
immobilisé
L'immobilisation permet d'améliorer la
résistance de l'enzyme aux conditions qui lui sont normalement
néfastes. Nous avons donc testé les effets de la
température et du pH sur l'activité immobilisée dans les
mêmes conditions que l'enzyme native. Une étude comparative de
l'effet de la variation de la température sur l'enzyme libre et
immobilisée a été effectuée. La température
a été variée de 30 °C à 60 °C. Les
résultats relatifs à cette étude sont illustrés sur
la Fig. 37 a. La même comparaison des deux formes d'enzyme a
été effectuée en raisonnant sur le pH. La gamme de pH
varie de 2 à 10. Les résultats relatifs à cette
étude sont
126
Résultats et Discussion
illustrés sur la Fig. 37 b. Sur la Fig. 37, nous
observons qu'une fois immobilisée elle présente une
activité sur une gamme de température et de pH plus
importante.
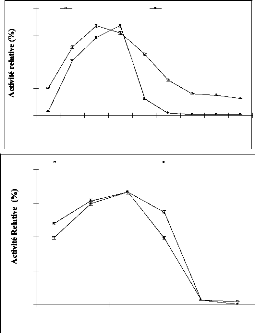
a
90
60
30
0
120 Enzyme immobilisée Enzyme libre
2 3 4 5 6 7 8 9 10
pH
b
120
90
60
30
0
Température °C
30 40 50 60 70 80
Enzyme immobilisée Enzyme libre
Figure 37: Comparaison de l'effet de la
température et du pH entre â-glucosidase libre
et
immobilisée sur l'alginate de calcium. a :
Température. b : pH.
Dans le cas de la température, l'activité subit
une perte d'activité de l'ordre de 30% à 60 °C (Fig. 37 a)
alors que pour le pH la perte d'activité est observée à un
pH 5,5 et 10 (Fig. 37 b) pour l'enzyme libre. En revanche, suite à son
encapsulation dans des billes d'alginate de calcium, l'enzyme
immobilisée permet d'améliorer l'activité enzymatique
à 60 °C de 23% et au pH 6 de 50%. Seulement la chute
d'activité de l'enzyme libre était légèrement plus
prononcée aux acidités élevées, une
caractéristique a été aussi observé par Nagatomo
et al., (2005). Ceci peut être provisoirement attribué au
rôle protecteur du microenvironnement entourant le biocatalyseur. De plus
; des modèles grossièrement semblables ont été
obtenu, où le profil du pH optimum n'est pas significativement
changé avec l'immobilisation. Ceci a été annoncés
précédemment par Nagatomo et al., (2005). D'autre part, un
changement de l'optimum pH de 5 à 4 a été observé
comme le résultat d'immobilisation dans l'alginate. Chang et Juang
(2007) ont aussi annoncé un changement vers un environnement plus acide
suite à l'immobilisation de â-glucosidase dans des supports de
chitosan-argile.
127
Résultats et Discussion
L'enzyme immobilisée est montrée efficace
jusqu'à 55°C, sans fuite d'enzyme observée, mais au-dessus
de cette température, la fonte du support a été
observée. Ce comportement postérieur a été aussi
annoncé (Rebro et al., 2007) et empêché la nouvelle
évaluation de ce support aux températures plus hautes, à
savoir, jusqu'à 65°C. Au-dessus de cette température, il y a
une chute aiguë d'activité de l'enzyme libre. En revanche, Chang
& Juang (2007) ont annoncé une gamme de tolérance plus haute
à la chaleur de â-glucosidase immobilisée sur des
composés d'argile quand comparés à l'enzyme libre. Les
températures optimales d'enzymes libres et immobilisées
étaient de 50 °C. Martino et al., (1996) et Synowiecki et
Wolosowska (2006) ont aussi annoncé une tolérance accrue vers la
chaleur suite à l'immobilisation bien que sans changements dans la
température optimale.
VI- Evaluation de la bioconversion par l'enzyme libre et
immobilisée
La recherche de l'efficacité de la bioconversion des
composés phénoliques des margines par l'enzyme immobilisée
par rapport à celle libre a été l'objectif de cette partie
d'étude. En effet, suite à son encapsulation dans des billes
d'alginate de calcium, une quantité de billes immobilisant de l'enzyme
équivalentes à 500 UI/ml de milieu réactionnel
(donnée démontrée dans le chapitre II-III) a
été testé via sa capacité de bioconversion des
composés phénoliques des margines. Un control sans enzyme et un
autre avec l'enzyme libre ont été également
effectués. La réaction a été déroulée
à pH 4,8 durant 2h dans des conditions statiques à 50 C. Les
résultats obtenus sont représentés sur les Fig. 38 et
39.
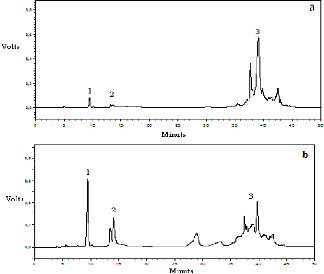
128
Résultats et Discussion
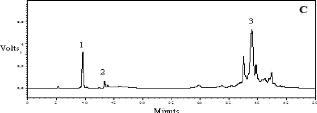
Figure 38: Chromatogrammes CLHP à 280 nm
des extraits de margine avant (a) et après l'hydrolyse enzymatique Libre
(b) et Immobilisée (c) : (1) Hydroxytyrosol; (2) Tyrosol; (3)
Oleuropéine.
Les chromatogrammes CLHP à 280 nm des extraits de
margine ont démontré que la margine brute est pauvre en
hydroxytyrosol (pic 1) dont sa concentration de départ était de
0,065 g/l et riche en composés phénoliques complexes tel que
l'oleuropéine (pic 3). Un changement du profil chromatographique des
extraits de margine a été observé suite à la
bioconversion par les deux formes d'enzyme avec un taux de bioconversion plus
faible observé avec l'enzyme immobilisée qui diminue de 50%.
Cette chute de l'activité enzymatique peut être dûe au fait
de possibles gênes stériques et de limitations dans
l'accessibilité au site actif (Fig. 38; Fig. 39)
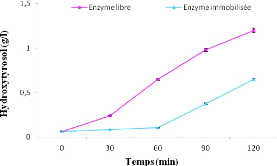
Figure 39:Comparaison de la bioconversion par
l'enzyme libre et immobilisée. IV- Conclusion
L'encapsulation de l'enzyme dans des billes d'alginate de
calcium a été utilisée comme la méthode
d'immobilisation envisagée dans cette étude. L'enzyme
immobilisée est montrée efficace jusqu'à 55 °C, sans
fuite d'enzyme observée, mais au-dessus de cette température, la
fonte du support a été observée. Ces résultats ont
montré des modèles grossièrement semblables ont
été obtenu, où le profil du pH et de température
optimum n'est pas significativement changé avec l'immobilisation. Un
changement du profil chromatographique des extraits de margine a
été observé suite à la bioconversion des
composés phénoliques des
129
Résultats et Discussion
margines par les deux formes d'enzyme avec un taux de
bioconversion plus faible observé avec l'enzyme immobilisée qui
diminue de 50%.
130
Résultats et Discussion
Chapitre III:
Bioconversion des margines à grande
échelle.
131
Résultats et Discussion
I- Introduction
La bio-transformation naturelle des margines peut produire
des molécules à haute valeur ajoutées; l'identification de
ces métabolites est essentielle dans la stratégie de choix de
molécules biologiquement actif. En appliquant les technologies de
bioconversion en bioréacteur des margines, la bioconversion du substrat
(oleuropéine, hydroxytyrosol glucosides, ...) en ses métabolites
de dégradation, a été réalisée à
grande échelle. Notre choix s'est porté sur differents types de
margines produits par les huileries classiques de Super presse (MSP : margine
super presse) et moderne de chaine continue (MCC : Margine chaine continue) du
Nord et de Sud de la Tunisie. L'enzyme produite par la fermentation à
grande échelle d'Aspergillus niger sur le son de blé
peut être exploitée comme biocatalyseur dans un système
bioréacteur. La â-glucosidase fournit par cette fermentation est
de l'ordre de 3000 UI/ml (cette partie est décrite dans le chapitre I-
paragraphe IV)
II- Essai de bioconversion des deux types de margine par
l'enzyme conservée
II-1 Bioconversion de margine issue d'huilerie super
press
Afin d'évaluer l'efficacité de l'enzyme
conservée sur la bioconversion des margines, un test en batch de 50 ml
de margine MSP a été effectué dans les conditions
optimisées. La réaction a été menée 2 heures
à 50 °C sous agitation douce en présence de 500 UI de
â-glucosidase par millilitre de margine. Les chromatogrammes de CLHP des
extraits de margine avant et après biotransfromation sont
présentés sur la Fig. 40.
Figure 40: Bioconversion des margines MSP par
l'enzyme stockée : (a) avant bioconversion, (b) après
bioconversion par l'enzyme lyophylisée.
D'après ces résultats on remarque que le taux de
l'hydroxytyrosol a passé de 0,46 g/l à 1,1 g/l. Le rendement de
l'amélioration de la concentration de l'hydroxytyrosol est de 2,4 fois
pour ce type de margine. Ceci démontre la fiabilité de ce
système de bioconversion avec l'enzyme fournit par le fermenteur et
conservée sous forme lyophylisée.
132
Résultats et Discussion
II-2 Bioconversion de margine issue de huilerie chaine
continue
Afin d'évaluer l'efficacité de l'enzyme
conservée sur la bioconversion des margines, un test en batch de 50 ml
de margine MCC a été également effectué dans les
mêmes
conditions optimisées. Les chromatogrammes de CLHP des
extraits de margine avant et après biotransfromation sont
présentés sur la Fig. 41.
Figure 41: Bioconversion des margines MCC par
l'enzyme stockée : (a) avant bioconversion, (b) après
bioconversion par l'enzyme lyophylisée.
D'après ces résultats on remarque que le taux de
l'hydroxytyrosol a passé de 0,23 g/l à 0,67 g/l. Le rendement de
l'amélioration de la concentration de l'hydroxytyrosol est de 2,91 fois
pour ce type de margine. Ceci démontre la fiabilité de ce
système de bioconversion avec l'enzyme fourni par le fermenteur et
conservé sous forme lyophylisée.
En conclusion, l'enzyme conservée s'est montrée
efficace pour la bioconversion des composés phénoliques des deux
types de margine tout en libérant l'hydoxytyrosol sous forme simple qui
a été complexé dans l'oleuropéine et/ou
l'hydroxytyrosol glycoside pour augmenter sa concentration dans les margines
MSP et MCC de 2,4 et de 2,91 fois respectivement.
III- Essai de bioconversion des margines à
l'échelle pilote
II-1 Introduction
A l'heure actuelle, et malgré des besoins industriels
importants, en particulier cosmétiques et agro-alimentaires, il n'existe
pas de procédé permettant la production d'hydroxytyrosol à
l'échelle industrielle. Seuls des procédés de
synthèse à petite échelle ont été
décrits ; cependant ces procédés ne sont pas
économiquement viables car ils conduisent à des coûts de
production trop élevés.
133
Résultats et Discussion
La seule source naturelle d'hydroxytyrosol reste pour le
moment l'olive et les sous- produits de l'huile d'olive (Bezançon et al,
2000). L'huile d'olive ne contient qu'une faible quantité
d'hydroxytyrosol, les teneurs allant de 0,01 à 1 mg/100 g d'huile. Ceci
s'explique par la grande solubilité de l'hydroxytyrosol dans l'eau
(environ 5 g/100 ml) ; en conséquence, il se retrouve fortement
présent dans les margines, et qui sont dans la majorité des cas
rejetées dans la nature. Une première voie de production
d'hydroxytyrosol s'appuie sur sa purification à partir des margines. La
majorité de ce type de procédés mène souvent
à l'obtention d'un produit impur étant donné la grande
diversité et l'importante quantité de polyphénols
répertoriés dans les margines (2,5-3% en poids, environ une
centaine de composés différents ; Labat et al., 2000). De plus,
l'obtention d'une fraction purifiée contenant l'hydroxytyrosol à
partir de ces déchets implique plusieurs étapes
chromatographiques utilisant de grandes quantités de solvants (Capasso
et al., 1992, 1994 et 1999; Visioli et al, 1998). Par conséquent, depuis
plusieurs années les études se sont multipliées pour
tenter de trouver un procédé moins coûteux de purification
d'hydroxytyrosol, ces tentatives se sont révélées dans
l'ensemble sans grand succès. D'autres voies de production basées
sur des méthodes chimiques incluent la synthèse d'hydroxytyrosol
par réduction chimique de l'acide
3,4-dihydroxyphénylacétique (Bai et al, 1998; Tuck et al, 2000),
et par conversion catalytique du tyrosol en hydroxytyrosol par un
mélange de méthylrhénium trioxide (MTO) et de peroxyde
d'hydrogène. Deux voies de production enzymatique d'hydroxytyrosol ont
également été décrites :
- une production d'hydroxytyrosol par hydrolyse
d'oleuropéine en présence de 13-glucosidase (Briante et al.
2001). La 13-glucosidase utilisée dans le procédé de
Briante et al. est produite par une souche d'Escherichia coli
recombinante, cette 13-glucosidase provient de l'archée
Sulfolobus solfataricus qui est une bactérie hyperthermophile.
Ce procédé présente plusieurs inconvénients : d'une
part, l'enzyme et l'oleuropéine doivent être préalablement
purifiées à partir de la culture bactérienne et à
partir de feuilles d'oliviers respectivement, et d'autre part, l'extrait final
est constitué d'un mélange d'hydroxytyrosol et de deux formes de
l'acide élénolique ;
- une synthèse enzymatique par conversion du tyrosol en
présence d'une tyrosinase extraite d'un champignon (Espin et al., 2001).
Cette seconde méthode enzymatique présente également des
limites : d'une part, le procédé nécessite la purification
préalable de la tyrosinase avec plusieurs étapes qui font encore
augmenter les coûts de production ; d'autre part, le
procédé nécessite la présence d'acide ascorbique
pour inhiber l'activité crésolase (l'oxydation, en
présence de dioxygène, d'un monophénol en catéchol)
de la tyrosinase et ainsi éviter la formation de quinones ; une
étape de purification finale supplémentaire doit donc être
mise en oeuvre pour éliminer l'acide ascorbique du mélange
réactionnel.
134
Résultats et Discussion
Un autre type de production a été
réalisé à partir de cellules entières
cultivées sur le tyrosol. Les bactéries productrices sont
Serratia marscecens (Allouche et Sayadi, 2005), Pseudomonas
aeruginosa (Allouche et al, 2004 ; Bouallagui et Sayadi, 2006),
Pseudomonas putida F6 (Brooks et al, 2006) et Halomonas sp. HTB24
(Liebgott et al, 2007). Le système enzymatique responsable de la
bioconversion du tyrosol en hydroxytyrosol n'a jamais été
identifié chez les différentes espèces bactériennes
précitées. Ces procédés microbiologiques
présentent également des limites :
-P. aeruginosa est une bactérie
pathogène de classe 2, ce qui entraîne une grande réticence
à l'utilisation de l'hydroxytyrosol qu'elle produit ;
-pour toutes ces souches, la production d'hydroxytyrosol reste
faible. En effet, on constate une dégradation de l'hydroxytyrosol en
3,4-dihydroxyphénylacétate (3,4-DHPA), ce dernier se
dégradant par la suite en succinate et pyruvate.
En résumé, l'extraction à partir de
matières premières naturelles donne de faibles quantités
d'hydroxytyrosol, elle présente le risque de contamination par les
solvants d'extraction et aboutit, du fait d'un nombre d'étapes trop
important, à un prix de revient trop élevé. La
synthèse chimique, quant à elle, est assez limitée ; elle
utilise des substrats ou des catalyseurs toxiques et difficiles à
obtenir. Enfin, pour le moment, les procédés microbiologiques
décrits utilisent, pour certains, des bactéries pathogènes
avec les inconvénients que l'on connaît et présentent un
rendement trop faible pour être économiquement
intéressants.
Dans le cadre de ces travaux, on a maintenant mis en
évidence que l'enzyme impliquée dans la bioconversion des
composés phénoliques des margines est une protéine
à activité 13-glucosidase. Ainsi, les objets de la
présente invention se rapportent à (i) l'utilisation d'une
13-glucosidase d'A. niger produite suite à la fermentation de
cette souche sur le son de blé dans le fermenteur de 100 litres
(Biotron) pour catalyser la bioconversion des composés
phénoliques des margines en hydroxytyrosol, (ii) un
procédé de production d'hydroxytyrosol in vitro comprenant au
moins une étape de conversion des composés phénoliques
complexes en hydroxytyrosol.
II-2 Bioconversion des margines issue de huilerie moderne
chaine continue à l'échelle
pilote
Le réacteur « biolafit » 20 litres a
été utilisé pour la bioconversion des composés
phénoliques de 15 litres de margine MCC. La réaction a
été menée 2 heures à 50 °C sous
Résultats et Discussion
agitation douce en présence de 500 UI de
â-glucosidase par millilitre de margine. Un contrôle sans enzyme a
été également effectué afin d'évaluer
l'effet des enzymes endogènes de la margine durant les 2 heures de la
bioconversion. La cinétique de production de l'hydroxytyrosol ainsi que
l'activité â-glucosidase résiduelle dans le mélange
réactionnel ont été déterminées et
présentées sur la Fig. 42.
135
Figure 42 : Cinétique de production de
l'hydroxytyrosol dans les margines MCC (a), Activité â-glucosidase
résiduelle dans le mélange réactionnel et les margines
brûtes (b).
D'après la Fig. 42 on remarque que l'ajout de l'enzyme
améliore la concentration de l'hydroxytyrosol dans les margines MCC avec
un rendement de 2,7 fois. L'enrichissement se déroule d'une façon
progressive pour passer de 0,17 g/l dans les margines brûtes à
0,31 après 60 minutes d'incubation en présence d'enzyme. Alors
que après 120 minutes de réaction enzymatique cette concentration
s'éleve pour atteindre 0,46 g/l (Fig 42 a). Néomoins, pour le
contôle, on observe uniquement une
136
Résultats et Discussion
légére élevation de la concentration de
l'hydroxytyrosol dans les margines pour passer de 0,17 g/l à 0,2 g/l
après 2 heures d'incubation en présence de l'eau à la
place de l'enzyme et dans les mêmes conditions opératoires. Cette
faible augmentation est dûe à la présence d'une faible
activité â-glucosidase dans les margines brûtes de 14,76
UI/ml. L'évaluation de l'activité â-glucosidase
résiduelle dans le mélange réactionnel a
démontré que cette activité est présente et presque
constante est de l'ordre de 200 UI/ml durant toutes les 2 heures de
réaction (Fig. 42 b).
II-3 Bioconversion des margines issue de huilerie
classique super press à l'échelle pilote
Le réacteur «biolafit» 20 litres a
été également utilisé pour la bioconversion des
composés phénoliques de 15 litres de margine MSP. La
réaction a été menée 2 heures à 50 °C
sous agitation douce en présence de 500 UI de â-glucosidase par
millilitre de margine. La cinétique de production de l'hydroxytyrosol
dans le mélange réactionnel a été
déterminée et présentée sur la Fig. 43.
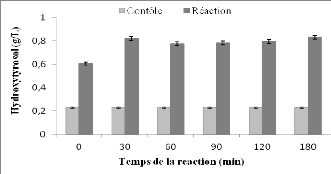
Figure 43 : Cinétique de production de
l'hydroxytyrosol dans les margines MSP à grande
échelle.
Le rendement de la bioconversion des composés
phénoliques des margines MSP à grande échelle est de 3,6
fois. Le contrôle comporte 0,23 g/l d'hydroxytyrosol, alors que l'ajout
de l'enzyme engendre la libération immédiate de ce
composé, en effet la concentration de ce composé passe de 0,23
g/l à 0,60 g/l immédiatement après ajout de l'enzyme
dés le temps zéro. Néamoins cette concentration se
soulève à 0,81 g/l après 30 minutes de réaction
enzymatique pour se stabiliser à cette concentration jusqu'à 180
minutes à 50 °C (Fig. 43).
137
Résultats et Discussion
En conclusion, le rendement de la bioconversion des
composés phénoliques des margines MCC est de 2,7 et
inférieur à celui des margines MSP qui est de 3,6 fois. Cela peut
être dû à la concentration initiale des ploymères
phénoliques.
IV-Essai de la bioconversion des composés
phénoliques des margines à grande échelle
Un bac de 50 litres a été utilisé pour la
bioconversion des composés phénoliques de 40 litres de margine
apportées à partir d'une huilerie de Nord de la Tunisie. La
réaction a été menée 2 heures à 50 °C
sous homogéneisation douce en présence de 500 UT de 3-glucosidase
par millilitre de margine. La cinétique de production de
l'hydroxytyrosol ainsi que l'activité 3-glucosidase résiduelle
dans le mélange réactionnel ont été
déterminées et présentées sur la Fig. 44.

b
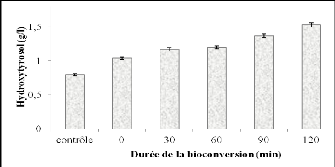
a
Figure 44 : Cinétique de production de
l'hydroxytyrosol dans les margines de Nord (a),
Activité
3-glucosidase résiduelle dans le mélange réactionnel et
les margines brûtes (b).
D'après la Fig. 44 on remarque que l'ajout de l'enzyme
améliore la concentration de l'hydroxytyrosol dans les margines de Nord
avec un rendement de 1,9 fois.
138
Résultats et Discussion
L'enrichissement se déroule d'une façon
progressive pour passer de 0,8 g/l dans les margines brûtes à 1,2
g/l après 60 minutes d'incubation en présence d'enzyme. Alors
qu'après 120 minutes de réaction enzymatique cette concentration
s'éleve pour atteindre 1,53 g/l (Fig 44 a). L'évaluation de
l'activité â-glucosidase résiduelle dans le
mélange réactionnel a démontré que
cette activité est présente et presque constante est de l'ordre
de 200 UI/ml durant toutes les 2 heures de réaction (Fig. 44 b).
En conclusion, au cours des expériences enzymatiques,
les concentrations de l'hydroxytyrosol maximales égales à 1,53,
0,83 et 0,46 g/l ont été obtenues en présence de 500 UT de
â-glucosidase d'A. niger par millilitre de margines dans les
margines de Nord, MSP et MCC respectivement. Ces concentrations sont 2,70 ;
3,61 et 1,77 fois plus élevées que le contrôle (Fig 42, 43,
44). Ces rapports de grandes échelles obtenus sont inférieurs
à ceux trouvés avec la petite échelle du travail de Hamza
et al., (2012 b). Cela est dû à la concentration initiale de
l'hydroxytyrosol dans les gros volumes de margines frais est beaucoup plus
élevé que dans de petits volumes de margines frais qui sont
obtenus à partir du séparateur dans le moulin à huile.
Cependant, dans la pratique pour le scale up, les grands volumes de margines
sont pris à partir de réservoirs de stockage, où la
biotransformation a déjà commencé. C'est ce qui explique
la forte concentration initiale de l'hydroxytyrosol dans les 15 L de MCC (0,17
g / L), les 15 L de MSP (0,23 g / L) et les 40 L de margine de North (0,86 g /
L) frais (Fig. 45). De cette partie de l'étude, nous pouvons conclure
que les margines sont une source de phénols hydrolysables tels que
l'oléuropéine, le ligstroside ou les verbascosides, qui
possèdent des liens glucosidiques et ester entre les principaux
composants phénoliques et des polysaccharides et/ou de lignine (Bianco
& Uccella 2000 , Walter, Fleming et Etchells, 1973). En conséquence,
une quantité importante de l'hydroxytyrosol est libérée
lors de l'hydrolyse enzymatique. En fait, le projet de prétraitement
enzymatique s'avérer utile non seulement pour les applications de
laboratoire, mais aussi pour une application pilote ou industrielle pour
recyclage de margine.
139
Résultats et Discussion
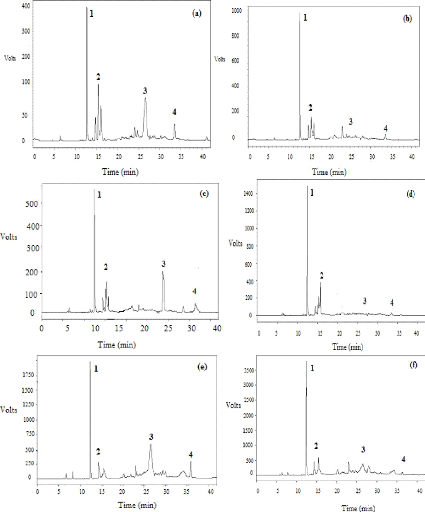
Figure 45 : Les chromatogrammes de CLHP des
composés phénoliques (détection à X = 280 nm) de
l'extrait brut MCC (a), et hydrolysé MCC par la b-glucosidase d'A.
niger (b), de l'extrait brut MSP (c), hydrolysat de MSP par la
b-glucosidase d'A. niger (d), de l'extrait brut de margine de Nord
Tunisie (e) et hydrolysée de margine nord de la Tunisie par
b-glucosidase d'A. niger (f). 1, hydroxytyrosol, 2, tyrosol, 3,
composé non identifié, 4, oléuropéine.
140
Résultats et Discussion
V- Etude de la stabilité de l'hydroxytyrosol
produit
Récemment les sous-produits de l'olivier ont
suscité beaucoup d'intérêt en tant que sources
d'ingrédients fonctionnels dans les formulations de produits
alimentaires. Cependant, avant d'être incorporés dans les aliments
ou les boissons, la stabilité de ces constituants dans les matrices
alimentaires pendant le traitement et durant le stockage doivent être
considérés. Les consommateurs s'attendent à ce que la
qualité des aliments doit être maintenue à un niveau
élevé de la production à la consommation (Kilcast &
Subramaniam, 2003). Plusieurs facteurs peuvent affecter la stabilité des
constituants bioactifs d'un produit alimentaire pendant et après le
traitement, y compris le brunissement enzymatique, le pH et la
température. Par conséquent, avant d'incorporer l'extrait de
margine dans la boisson, il est important d'étudier aussi bien l'effet
des conditions de stockage et de traitement sur ses composés
phénoliques. L'étude de la stabilité de l'hydroxytyrsol
dans sa solution aqueuse de margine a été entreprise est ce
durant 4 mois. La quantité résiduelle de l'hydroxytyrsol en g/l a
été déterminée par CLHP est présentée
sur la Fig 46.
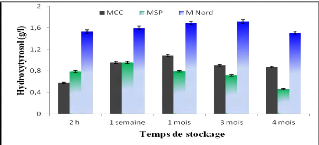
Figure 46 : Etude de la stabilité de
l'hydroxytyrosol produit.
D'après cette étude, on remarque qu'après
une semaine de la réaction il ya une amèlioration de la
concentration de l'hydroxytyrsol (de 0,58 g/l après 2h de
réaction à 0,95g/l après 1 semaine de stockage) dans les
margines MCC cela est peut être dûe à l'hydrolyse totale de
tous les polyphénols complexes contenant de l'hydroxytyrsol. Ainsi la
concentration de ce dernier termine à s'intensifier pour atteindre 1,083
et 1,7 g/l pour les types de margine MCC et M Nord respectivement, après
un mois de stockage. Toutefois, pour le troisième type de margine MSP,
on remqraue une diminution progressive de ce composé durant les quatres
mois de stockage. Cela peut être expliqué par l'apparition d'un
champignon qui a envahit tout le milieu et a utilisé les composés
phénoliques comme source d'energie pour sa croissance, une
141
Résultats et Discussion
dégradation biologique de l'hydroxytyrsosol a
été peut être observée à 4°C. La
concentration de l'hydroxytyrosol dans le margine MSP est devenue 0,45 g/l elle
a abouti persque la moitié de la concentration. Alors que pour les deux
autres types MCC et M Nord, la chutte de la concentration n'est observée
qu'à partir du quatrième
mois. On peut conclure que l'hydroxytyrosol ne dois pas
être conservé à +4°C tel quel est dans les margines
hydrolysées durant quelques mois, mais de préférence une
extraction immédiate de ce composé par des techniques
membranaires utilisant une cascade de celle-ci (microfiltration,
ultrafiltration) afin d'obtenir des extraits enrichies
en hydroxytyrosol aptes à être utilisé
dans une concentration par évaporation pour l'élimination de
l'eau et la bonne conservation de l'hydroxytyrsol.
La stabilité de l'hydroxytyrsol dans des solutions
aqueueses a été l'objectif du travail de l'équipe
Zafra-Gómez et al., 2011. Ils ont montré que la présence
de sels dans l'eau et la température produit l'oxydation du
composé et la perte de l'activité biologique. Par
conséquent, les résultats sont d'une grande importance pour les
études animales futures avec ce composé, pour prédire la
stabilité des échantillons d'aliments liquides potentiels
contenant ce composé. Aussi les concentrations inférieures de
l'hydroxytyrsol sont plus susceptibles de se dégrader que les plus
élevées. Par conséquent, ils ont observé des
changements dans la stabilité de l'hydroxytyrosl avec la variation de sa
concentration, de la température et le contenu ionique des solutions
aqueuses.
Les attributs de la qualité d'un aliment fonctionnel
peuvent changer au cours du stockage. Les mauvaises conditions de stockage des
aliments fonctionnels et des boissons peuvent conduire à la perte
d'ingrédients bioactifs avec l'apparition d'indésirable couleur
et le changement d'odeur (Harbourne, et al., 2011). Par conséquent, il
est d'une grande importance de mesurer le taux de variation d'un
paramètre de qualité donné avec le stockage. Le pH acide
des margines peut jouer un rôle important dans sa stabilité au
cours du stockage, car il a été constaté que les infusions
légèrement acides (pH 4,6) conservent la couleur et les
composés phénoliques totaux (90%) pendant environ 4 mois. Dans
les margines, après 5 mois de stockage, on a observé une
accumulation importante de hydroxytyrosol sans une hydrolyse enzymatique
préalabble (Feki et al., 2006). La concentration correspondante
a augmenté de 0,77 à 0,98 à 3,1-3,5 g/L. Cependant, les
concentrations des autres composés phénoliques ont nettement
diminué. En revanche, il a été possible de maintenir la
concentration de l'hydroxytyrosol constant au cours du stockage en ajoutant 10
% d'éthanol (Feki et al., 2006). En outre, dans une autre étude,
Obied et al. (2008) ont comparé différentes conditions de
142
Résultats et Discussion
stockage de mardines, dans une tentative d'identifier les
conditions optimales qui préservent les composés
phénoliques et leurs propriétés antioxydantes comme il est
juste après l'extraction de l'huile d'olive. Ils ont
déterminé le taux des phénols et la capacité
antioxydante des margines stockées à 4 °C et des margines
conservées avec 40% (p/p) d'éthanol et 1% (p/p) d'acide
acétique et stockées à 4 °C pendant 30 jours, par
rapport à ceux des margines stockées à température
ambiante. Aucune de ces conditions de stockage pourrait empêcher la
diminution rapide des concentrations phénoliques et la capacité
antioxydante, qui est arrivé au cours des 24 premières heures
(Obied et al., 2008).
Habituellement, les produits de fruits tels que les jus, les
boissons et les boissons mixtes sont conservés par des traitements
thermiques, qui sont connus pour inactiver efficacement les micro-organismes et
les enzymes délétères. Cependant, la température
élevée atteinte au cours du traitement affecte
négativement leurs propriétés organoleptiques et
nutritionnelle (Aguilò-Aguayo et al., 2010). Malheureusement, à
l'heure actuelle il n'existe aucune information disponible portée sur la
composition phénolique de boissons à base d'extrait d'olive et
quels processus thermique et quelles conditions de stockage suivre-t-on?
VI- Technologies de séparation de l'hydroxytyrosol
par membrane
Dans les applications récentes, la filtration sur
membrane est plus préférable être appliquée en mode
transversal. Dans la filtration à écoulement tangential,
l'alimentation est pompée dans le module à membrane, où il
est séparé en deux courants à savoir le filtrat (ou
perméat) et le rétentat, dans lequel l'espèce retenu a
été concentrée. L'ultrafiltration à courants
croisés diffère de la filtration frontale conventionnelle en ce
que le rétentat s'écoule parallèlement à travers la
surface de la membrane et non perpendiculaire vers celle-ci (Lojkine et al.,
1992). Ce mouvement tangentiel des fluides supprime la majeure partie du
matériau rejeté à partir la surface de la membrane, et
minimise par conséquent, l'accumulation sur la surface de la membrane.
On sait que les technologies membranaires emploient des filtres spéciaux
(membrane) qui sont exploités dans un état fluido-dynamique
particulièr (tangentiel) qui permettent de réduire l'encrassement
du filtre et assure par conséquent un grand flux de perméat en
fonction du temps (Cheryan, 1986). Ces technologies sont définies comme
BAT (Best Available Technology) de l'EPA (Environmental Protection Agency) et
sont également reconnus par l'Union européenne (UE). Les
technologies membranaires sont largement appliquées dans le monde entier
non seulement pour le traitement des eaux usées, mais surtout pour la
récupération de solutés dispersées, souvent
polluant, et pour produire de l'eau purifiée.En outre, le traitement des
margines est basé sur l'application de la technologie
Résultats et Discussion
membranaire dans le but d'extraire et récupérer
le maximum de polyphénols afin de faciliter l'évacuation de ces
déchets (Pizzichini & Russo, 2005; Russo, 2007).
Dans cette étude, le traitement des margines par
l'application de la technologie de membrane a été proposé
dans le but d'extraire et récupérer le maximum de
polyphénols afin de faciliter l'élimination de ces
déchets. Le système hydraulique de traitement de margines avec
les membranes est rapporté dans la figure 47.
MF
UF
Concentration (CC)
70 L 37.5 L
VCR
2.15
VCR
3.95
28 L
VCR
12.72
â-glucosidase
500 IU/ml
143
32.5 L 9.5 L 2.2 L
Rétentat MF Rétentat UF Concentrat
CC
Figure 47 : Processus de la mise en place de la section
membranaire.
La figure 47 montre la voie de traitement par fractionnement
de margine brut. Ce processus de traitement permet la séparation des
margines brutes en quatre fractions liquides dans différents
pourcentages volumétriques. Compte tenu de 70 L de margines, comme
charge de MF, les volumes respectifs de perméat et le concentré
de chaque section de la membrane et le rapport de concentration en volume (VCR)
entre le volume d'alimentation initial/volume de rétentat final de
chaque section de membrane sont rapportés sur la figure 47. Selon le
procédé proposé, le margine est soumis à une
hydrolyse enzymatique par la â-glucosidase pour hydrolyser
l'oléuropéine et des composants verbascosides de margines afin
d'être amélioré en hydroxytyrosol libre dans les margines
(Fig. 42, 43,44, 45). La fraction liquide séparée à partir
des produits de dégradation est ensuite utilisée dans un
système de membrane comprenant la microfiltration tangentielle,
l'ultrafiltration tangentielle et une unité d'évaporation, dans
l'ordre. Tous les deux fractions de rétentat de la membrane,
respectivement 32,5 L de MF et de 9,5 L d'UF constituent les nouveaux produits
raffinés avec l'ajout de l'25,8 litres d'eau purifiée,
après les étapes de concentration et de 2,2 L de volume de
concentré enrichi en polyphénols. Le concentré ultime du
système après évaporation est riche en hydroxytyrosol (7,2
g / L de HT) (Fig. 48, Tableau 16).
144
Résultats et Discussion
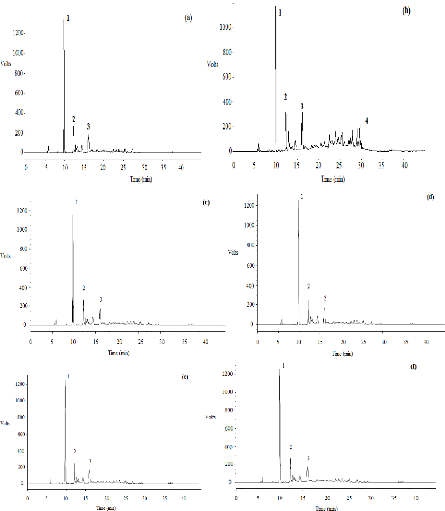
Figure 48 : Les chromatogrammes de CLHP de
composés phénoliques (détection à ë = 280 nm)
des extraits de perméat de MF (a), de rétentat MF (b),
perméat de l'UF (c), le rétentat UF (d), avant de concentration
(e) et après concentration (échantillon était dilué
10 fois) (f). 1, hydroxytyrosol, 2, tyrosol, 3, composé non
identifié, 4, oléuropéine.
145
Résultats et Discussion
Le flux de perméat en fonction du temps, pour les
sections de MF et d'UF sont présentés sur la figure 49.
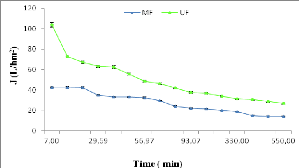
Figure 49 : Flux de perméat en
fonction du temps des sections membranaires de microfiltration (MF) et
ultrafiltration (UF).
Comme c'est indiqué dans la figure 49, la
réduction de flux de perméat, représente une tendance
classique pour les technologies membranaires, mais les profils de la
productivité des deux sections de filtration baissent lentement, ceci
est une démonstration d'un règlement de paramètre d'un
procédé satisfaisant. Quand un processus de filtration sur
membrane telles que l'ultrafiltration est utilisée, le flux et le
rendement en baisse peut être observé. Les causes sont: i) la
polarisation de concentration (à savoir l'accumulation des
solutés de façon réversible est survenu
immédiatement) et ii) des phénomènes d'encrassement comme
l'adsorption, bouche-pores et le dépôt de solutés
solidifiés, un processus à long terme, et plus ou moins
irréversible. Le résultat de ces deux phénomènes
est une force d'entraînement pour la diminution de la filtration ou d'une
augmentation de la résistance contre le transport du solvant
pénétrant lors de la filtration. Le degré de diminution du
flux dépend de nombreuses variables qui sont les solutions et les
équipements (Van den Berg & Smolders, 1990).
Le tableau 15 résume les conditions opératoires
de chaque section de la membrane. Les flux initiaux de traitement de margine
par MF et UF étaient de 42,85 et 103,89 L/m2h sous des
pressions transmembranaires de 1,8 et 2,2 bar, respectivement.
Tableau 15 : Caractéristiques
techniques des membranes
|
Membrane
|
Process
|
Conformation
|
Cut-off/area
|
DP(bar)
|
T (°C)
|
|
Hexagonal Ceramic, Tami
|
MF
|
MICROLAB 130 S Tubular 19 canals 850 mm length 7 mm in
diameter
|
0.2 um/0,2 m2
|
1-2
|
25-30
|
|
Organic
|
UF
|
18 PCI Ultrafiltration membranes 135 mm diameter 1220 mm
length
|
8KD/0,0825 m2
|
2-3
|
18-20
|
146
Résultats et Discussion
L'efficacité des différentes conditions de
fonctionnement a été évaluée par la
détermination de la demande chimique en oxygène (DCO), le pH, la
conductivité, la concentration de l'hydroxytyrosol, la teneur en
composés phénoliques totaux et la matière séche. La
charge en DCO est due à la teneur en matières organiques,
notamment des composés azotés, des sucres, des acides organiques,
des huiles, de cellulose et des composés polyphénoliques. Elle
est de concentration égale à 165 g/L dans la margines brute. Une
réduction substantielle de la DCO et de matière séche a
été obtenue. La technologie de membrane fournit un perméat
légèrement coloré (données non
présentées), ce qui nécessite nettement moins de DCO pour
son oxydation (3,42% de la DCO initiale) (Tableau 16). La microfiltration
élimine 72,12% des DCO initiale. En effet, le rétentat de
microfiltration contient toute la matière organique dans les margines se
présentant sous la forme d'une suspension de matière insoluble.
Alors que, les composés hydrophiles tels que les sucres réduits,
l'hydroxytyrsosol et les minéraux se trouvent dans le perméat de
MF. Le taux de rejet de l'hydroxytyrosol variait de 8 à 9%. Ce processus
permet de récupérer seulement 24% des hydroxytyrosol dans le
concentré final. Ce pourcentage peut être considérablement
améliorée en prévoyant une dilution de rétentat de
MF et d'UF par de d'eau pure, tout en répétant le processus
(données non montrées).
Tableau 16: Le pH, la teneur en matière
séche, la conductivité, la demande chimique en
oxygène,
le contenu en phénols simples et la concentration d'hydroxytyrosol avant
et après
l'hydrolyse enzymatique des margines et après la
microfiltration, l'ultrafiltration et la
concentration.
|
Margine Brute Hydrolysed OMW Microfiltration
|
Ultrafiltration
|
Concentration
|
|
P R
|
P
|
R
|
|
|
pH
|
|
|
|
|
|
|
5.03#177;0.2 4.93#177;0.2
|
4.78#177;0.2
|
4.73#177;0.2
|
4.81#177;0.2
|
4.79#177;0.2
|
4.84#177;0.2
|
|
Matière séche (g/100g)
|
|
|
|
|
|
|
9.33#177;0.5 9.23#177;0.5
|
6.28#177;0.5
|
11.12#177;0.5
|
4.71#177;0.5
|
5.72#177;0.5
|
41.95#177;0.5
|
|
Conductivité (ms)
|
|
|
|
|
|
|
11.26#177;0.5 11.25#177;0.5
|
11.17#177;0.5
|
10.62#177;0.5
|
10.29#177;0.5
|
10.7#177;0.5
|
15.11#177;0.5
|
|
DCO (g/l)
|
|
|
|
|
|
|
165.76#177;1.5 165.83#177;1.5
|
57.76#177;1.5
|
119.25#177;1.5
|
48.44#177;1.5
|
59.62#177;1.5
|
nd
|
|
Ortho phénols totaux (g/L)
|
|
|
|
|
|
|
4.5#177;1.2 5.5#177;1.2
|
3.31#177;0.5
|
7.27#177;1.2
|
1.96#177;0.2
|
2.7#177;0.5
|
17.6#177;2.5
|
|
Sucre Reducteur (g/L)
|
|
|
|
|
|
|
26#177;3.2 60#177;4.2
|
nd
|
nd
|
nd
|
nd
|
158.21#177;8.5
|
|
Hydroxytyrosol (g/L)
|
|
|
|
|
|
|
0.23#177;0.2 0.93#177;0.2
|
0.85#177;0.1
|
0.72#177;0.1
|
0.79#177;0.1
|
0.807#177;0.1
|
7.2#177;1
|
P: Perméat ; nd: non determiné ;
R:Rétentat ; DCO : Demande Chimique en Oxygène (g/L)
147
Résultats et Discussion
Les résultats de caractérisation de margine
après séparation membranaire par CLHP sont illustrés sur
la Fig. 48. Ces chromatogrammes identifient un total de 3 composés, le
composé majeur était l'hydroxytyrosol (Fig.48). L'extrait
à l'acétate d'éthyle obtenue après hydrolyse
enzymatique est riche en hydroxytyrosol plus de 1 g/L, mais pauvres en
macromolécules comme l'oleuropéine, le verbascoside et la
ligstroside. En utilisant la technologie des membranes de MF, ainsi que l'UF,
l'hydroxytyrosol et le tyrosol, ayant des poids moléculaires faibles de
154 et 138 g/mol, respectivement, se trouvent concentré dans le
rétentat (Fig.48). Ainsi, la diafiltration est nécessaire pour
récupérer au maximum ce composé. L'élimination de
l'eau par l'évaporation à des températures
modérées a permis l'obtention d'un concentré riche en
hydroxytyrosol. Les résultats obtenus montrent que le
prétraitement enzymatique, MF, UF et la concentration avec
l'évaporation peuvent être utilisés comme un traitement
efficace des margines au processus doux. Un tel prétraitement peut
améliorer efficacement un processus d'extraction ultérieure des
composés phénoliques du perméat et améliore
l'efficacité de tout traitement secondaire. En outre, 41% de
l'enrichissement de phénols totaux est due à la libération
de l'hydroxytyrosol (Tableau 16). Par conséquent, une production durable
et plus propre d'une grande quantité d'hydroxytyrosol peut être
atteint. L'utilisation du procédé à l'échelle
pilote pour la récupération d'hydroxytyrosol naturel est une
méthode alternative prometteuse. Le rétentat de l'unité de
MF et d'UF peut également être utilisé pour y extraire des
composés polyphénoliques ou peut être utilisé dans
l'industrie alimentaire comme additif pour le pain, pizza, etc, mais il est
aussi plus intéressant comme substrat pour la production de
méthane en anaérobiose. Pizzichini & Russo (2005) ont
révélé un processus proche pour récupérer
totalement les composants chimiques des margines en utilisant des technologies
membranaires.
VII- Caractérisation physico-chimique de
concentré ultime
Le tableau 14 donne les principales caractéristiques
des fractions de margine pendant le processus de traitement. Le pH du
concentré final était égal à 4,84. Le pH est
à peu près constant tout au long du processus. De plus, la
conductivité est maintenue constante, néomoins après la
concentration par évaporation, elle a augmenté. Une concentration
élevée de sucre réducteur de 158,21 g/L a
été dosée dans ce concentré (Tableau 16). La teneur
minérale de ce nouveau produit est principalement composée de
métaux. La teneur en métal du concentré final a
été montrée dans le tableau 17.
148
Résultats et Discussion
Tableau 17: Composition minérale de
l'ultime concentré de margine purifié
|
Composition minérale
|
|
Zn (ppm)
|
0.2404#177;0.05
|
|
Cd (ppm)
|
0.0264#177;0.01
|
|
Ca (ppm)
|
1.1564#177;0.2
|
|
Fe (ppm)
|
0.046#177;0.01
|
|
K (ppm)
|
61.36#177;5.1
|
|
Mg (ppm)
|
61.72#177;6.3
|
|
Na (ppm)
|
46.4#177;0.5
|
|
Cr (ppm)
|
0
|
|
Pb (ppm)
|
0
|
|
Ni (ppm)
|
0
|
|
Cu (ppm)
|
0
|
Ce produit est exempt de métaux lourds, mais il est
riche en calcium, fer, potassium, manganèse et sodium (Tableau 17). Les
métaux sont importants aussi bien du point de vue nutritionnel que
toxicologique. Certains métaux, en particulier le fer, le cuivre et le
zinc, sont des substances essentielles pour le corps humain et leur carence
peut avoir des effets aigus et chroniques. Toutefois, même ces
éléments peuvent avoir des effets toxiques en fonction de la
forme chimique, la dose, la voie d'absorption, et une foule d'autres facteurs
(Leung et al., 2010). Aussi, les margines contiennent des ions de métaux
importants comme le magnésium et le calcium qui sont
déclarées pour minimiser le risque de maladie cardiaque (Anne,
2011). D'autres métaux, en particulier les métaux lourds tels que
le plomb (Pb) et le cadmium (Cd), sont bien connus comme éléments
potentiellement toxiques. Le concentré final obtenu contient une
très faible quantité de cadmium (0,0264 ppm) (Tableau 17). La
contamination métallique peut avoir lieu au cours de la manipulation et
du traitement des olives, de la ferme au point de consommation. D'où
l'importance d'être en mesure de contrôler de faibles
concentrations de métaux dans les aliments afin de s'assurer que le
niveau sécuritaire (par exemple <0,05 mg / kg de poids humide pour le
Cd et le Pb, le règlement n ° 1881/2006 « Commission
Regulation (EC) No. 1881/2006 ») ne soit pas
dépassée. Aucun effort ne doit être épargné
pour éliminer les oligo-éléments tels que le cuivre et le
fer où ces éléments sont dans l'approvisionnement
alimentaire à court. Des éléments tels que le cadmium et
le plomb, qui peuvent s'accumuler dans l'organisme, doivent être
minimisées. Par conséquent, les caractéristiques des
techniques d'extraction des matières premières ont un effet
significatif sur la composition des extraits finaux, et donc dans le processus
industriel, la composition phénolique de l'extrait d'olive doit
être normalisée. Un extrait aqueux de margine
149
Résultats et Discussion
adapté pour les aliments et les boissons peuvent
être obtenues facilement par simple ultrafiltration (Galanakis et al.,
2010). Les scénarios de commercialisation dépendra de
l'utilisation prévue, si les composés individuels, un
mélange de plusieurs ou d'un extrait aqueux crud de margine doit
être récupéré.
VIII- Conclusion
Cette étude a suggéré le scal-up du
traitement enzymatique pour les margines avec le but d'augmenter la
concentration en HT. Les traitements d'hydrolyse ont été
étudiés à l'aide de filtrat de culture d'A. niger
sur le son de blé dans un fermenteur de 100 L durant 7 jours.
L'utilisation de filtrat de culture d'A. niger comme un bio-catalyseur
donne 1,53 ; 0,83 et 0,46 g d'hydroxytyrosol par litre de margine de Nord, MSP
et MCC, respectivement. Ce processus donne un produit naturel et un produit
bioactif d'une source végétale, par opposition à la
molécule obtenue par synthèse chimique. Le projet enzymatique de
pré-traitement peut s'avérer utile non seulement pour les
applications de laboratoire, mais aussi pour étendre la capacité
d'application à l'echelle pilote pour le recyclage des margines.
L'application des procédés de filtration membranaire permet la
récupération de quatre grandes fractions liquides dans
différents pourcentages volumétriques, qui sont tous
adaptés pour un usage commercial en agroalimentaire, nutritionnel et
cosmétique. Dans le concentrat ultime obtenu seulement 24%
d'hydroxytyrosol ont été recupéré. Par
conséquent, le nouveau produit obtenu obéi aux besoins
alimentaires; voir que son pH est légèrement acide, elle est
concentrée en hydroxytyrosol et le sucre réducteur, il contient
des minéraux bénéfiques pour la santé et ne
contient pas de métaux lourds ou de produits chimiques.
150
Conclusion et Perspectives
CONCLUSION ET PERSPECTIVES
Les travaux de recherche entrepris dans cette thèse
rentrent dans le cadre de l'enrichissement des margines en terme
d'hydroxytyrosol par une méthode douce et biologique ouvrant une voie de
la bioconversion des composés phénoliques des margines par le
biais d'enzymes produites par des champignons suite à leur fermentation
sur un milieu de culture local et bon marché. Cette molécule
cible de notre étude est un ortho-diphénol naturel dotées
de l'activité antioxydante. L'objectif de notre étude est donc
(i) d'optimiser des conditions de la culture et la composition du milieu la
production de 3-glucosidase par la souche Aspergillus niger, (ii)
d'étudier la bioconversion des composés phénoliques de la
margine par différents champignons à savoir Aspergillus
niger, Trametes trogii et Trichoderma atroviride, (iii) d'optimiser les
paramètres de la bioconversion des composés phénoliques
des margines en utilisant le jus de culture d'A. niger dans le but
d'améliorer au maximum le rendement de libération de
l'hydroxytyrsosol, (iv) de comparer la bioconversion des composés
phénoliques des margines moyennant différentes enzymes tels que
la 3-glucosidase pure et l'estérase pure et d'autres enzymes
commerciales, (v) de tester l'efficacité de l'immobilisation de
3-glucosidase de la souche Aspergillus niger sur la bioconversion des
margines. (vi) d'achever la bioconversion des margines à grande
échelle et la récupération de l'hydroxytyrosol par les
techniques membranaires et la concentration du perméat de
l'ultrafiltration par évaporation.
Durant la première étape de notre travail, nous
avons montré que la composition du milieu de culture optimisé
pour la production de 3-glucosidase de la souche Aspergillus niger est
le son de blé comme l'unique source de carbone, la peptone de blé
comme la source d'azote organique, l'urée comme la source d'azote
inorganique, le rapport C/N est égal à 10 et la taille de
l'inoculum est de 6 108 spores/ml. Quant aux paramètres de
culture optimisés sont le pH égale à 4, la
température d'incubation est de 30 °C et les batchs de fermentation
liquide sont soumis à une agitation de 160 rpm. Au cours de cette
première partie, une amélioration de la production de
3-glucosidase de la souche Aspergillus niger a été
obtenue. L'activité maximale de 3-glucosidase obtenue était
égale à 7185 UT/ml et celle d'estérase était
égale à 230 UI/ml. La 3-glucosidase de la souche Aspergillus
niger à une température optimale d'action égale
à 50 °C et un pH optimum d'action de 4,8. Sa demi-vie à 50
°C est de 24 heures, elle est non thermostable. L'utilisation du
fermenteur de 100 litres a permis la réussite de la fermentation
d'A. niger sur le son de blé à grande échelle et
la production de 3-
151
Conclusion et Perspectives
glucosidase avec une activité égale à
3895 UT/ml suite au prétraitement du son de blé avant sa
fermentation.
Les résultats de la bioconversion ont montré que
le filtrat enzymatique est le meilleur biocatalyseur pour la libération
de l'hydroxytyrosol. Cette étude indique que la réaction
d'hydrolyse des margines brutes (fraîches) pendant 2 h par un filtrat
obtenu d'un bouillon de culture d'A. niger après 5 jours
d'incubation, permet de libérer l'hydroxytyrosol à une
concentration de 0,8 g/l de margine. Cette découverte indique que la
3-glucosidase est l'enzyme clé dans ce processus aussi l'enrichissement
en 3-glucosidase est essentielle pour la bioconversion de polymères des
margines pour évacuer l'hydroxytyrosol.
Les présents résultats ont montré
également qu'A. niger, T. trogii et T. atroviride croissent sur
un milieu de culture économique (le son de blé comme l'unique
source de carbone) tout en produisant une préparation d'enzyme
extracellulaire ayant des activités estérase, 3-glucosidase et
laccase. Évalués sur les margines brûtes (fraîches)
ayant de très basse charge de monomères phénoliques comme
l'hydroxytyrsol, ces jus de culture ont pu convertir des phénols
hydrolysables comme l'oleuropéine, ligstroside ou verbascoside en
monomères comme l'hydroxytyrosol. Les meilleurs résultats ont
été atteints en utilisant le jus de culture d'A. niger
présentant une forte activité 3-glucosidase (faible
activité estérase et aucune laccase) où 1,1 g/l
d'hydroxytyrosol a été libéré de margines
fraîches ne contenant que 0,05 g/l d'hydroxytyrosol naturellement libre.
Ainsi, la réaction de bioconversion proposée dans cette
étude, permettant la récupération de l'hydroxytyrosol
naturel, offre une alternative à la méthode d'extraction
conventionnelle et la fermentation microbienne. Cette méthode est
environnemental, douce qui permet également d'améliorer le
rendement d'extraction et de la qualité des extraits. La grande
efficacité de l'hydroxytyrosol comme un antioxydant puissant a
été confirmée par la méthode antiradicalaire
DPPH.
Dans la présente recherche, nous avons aussi
étudié les effets de (i) les conditions physico-chimiques (pH,
température, temps et agitation), (ii) le type de margine comme substrat
et (iii) la concentration d'enzyme sur la réaction de bioconversion des
margines. Une forte concentration de hydroxytyrosol (2,9 g/l) a
été obtenu après 30 min de réaction enzymatique de
margine à 50 O C, à pH 4,8 et en état agité. Cette
concentration n'est pas rapporté avant et c'est une des plus fortes
concentrations d'hydroxytyrosol rapporté après conversion
chimique ou biologique des margines.
Les résultats de l'immobilisation de l'enzyme ont
montré des modèles grossièrement semblables du profil du
pH et de température, l'optimum de ces paramètres n'est pas
significativement changé avec l'immobilisation. Un changement du profil
chromatographique
152
Conclusion et Perspectives
des extraits de margine a été observé
suite à la bioconversion des composés phénoliques des
margines par les deux formes d'enzyme avec un taux de bioconversion plus faible
observé avec l'enzyme immobilisée qui diminue de 50%.
L'étude comparative de la bioconversion des
composés phénoliques des margines par différentes enzymes
commerciales et pures a indiqué que la préparation enzymatique
d'A. niger a le même effet que le viscozyme et la
â-glucosidase purifiée pour la libération de HT.
L'estérase pure n'a aucun effet sur cette finalité.
La bioconversion à grande échelle a
été conduite pour biotransformer les composés
phénoliques de 40 litres de margine de Nord et 15 litres de margine MSP
et MCC de Sfax. Ceci a permis l'amélioration de la concentration de
l'hydroxytyrosol de 2,70 ; 3,61 et 1,77 fois que le contrôle dans le cas
de margine Nord, MSP et MCC respectivement. Le projet enzymatique de
pré-traitement peut s'avérer utile non seulement pour les
applications de laboratoire, mais aussi pour étendre la capacité
d'application à l'echelle pilote pour le recyclage des margines.
L'application des procédés de filtration membranaire permet la
récupération de quatre grandes fractions liquides dans
différents pourcentages volumétriques, qui sont tous
adaptés pour un usage commercial en agroalimentaire, nutritionnel et
cosmétique. Dans le concentrat ultime obtenu seulement 24%
d'hydroxytyrosol ont été recupéré. De plus, le
nouveau produit obtenu obéi aux besoins alimentaires; voir que son pH
est légèrement acide, elle est concentrée en
hydroxytyrosol et le sucre réducteur, il contient des minéraux
bénéfiques pour la santé et ne contient pas de
métaux lourds ou de produits chimiques.
Pour la poursuite de ce travail, plusieurs autres axes de
recherche pourraient être développés :
- Pour une application industrielle l'enrichissement les
margines en
hydroxytyrosol, une bioconversion en continue de l'hydroxytyrsol
devrait être envisagée.
- Pour conserver les activités de l'hydroxytyrsol on
doit protéger la fonction
ortho-diphénol contre l'oxydation. Pour cela, il est
nécessaire de développer une méthode biologique permettant
d'acétyler les différents groupements hydroxyles de
l'hydroxytyrosol.
- Pour valoriser la méthode de production de
l'hydroxytyrol nous proposons
d'étudier son application dans plusieurs secteurs
industriels tels que l'industrie
Conclusion et Perspectives
agroalimentaire et l'industrie cosmétique.
L'hydroxytyrosol pourrait être testé dans des jus, des huiles
alimentaires et dans des produits à application cutanné.
153
Références bibliographiques
Références bibliographiques
A
Abid, N., & Sayadi, S. (2006).
Detrimental effects of olive mill wastewater on the composting process of
agricultural waste. Waste Manag. 26 (10):
1099-1107.
Aguilò-Aguayo, I., Soliva-Fortuny, R., &
Mart?n-Belloso, O. (2010).Color and viscosity of water melon juice
treated by high-intensity pulsed electric fields or heat. Innovative Food
Science and Emerging Technologies. 11: 299-305.
Alan, L., & Miller, N. D. (1996).
Antioxidant flavonoids : Structure, function and clinical usage.
Alt Med Rev. 1(2): 103-111.
Allouche N., Damak A., Ellouz R., & Sayadi S.
(2004 b). Use of whole cells of Pseudomonas aeruginosa for
synthesis of the antioxidant hydroxytyrosol via conversion of tyrosol. App.
Environ. Microb. 70: 2105-2109.
Allouche, N., Fki, I., & Sayadi, S. (2004
a) Toward a high yield recovery of antioxidants and
purified hydroxytyrosol from olive mill wastewaters. J
Agric Food Chem. 52: 267-73. Al-Zuhair S.
(2008). The effect of crystallinity of cellulose on the rate of
reducing sugars
production by heterogeneous enzymatic hydrolysis. Biores.
Technol. 99: 4078-4085. Amiot M. J., Fleuriet A.,
& Macheix J. J. (1986) Importance and evolution of phenolic
compounds in olive during growth and maturation. J. Agric.
Food Chem. 34: 823-826. Amiot, M.J., Fleuriet,
A., & Macheix, J.J. (1989). Accumulation of oleuropein
derivatives
during Olive maturation. Phytochemistry.
28: 67-69.
Amirante, P., Di Renzo, G. C., Di Giovacchino, L.,
Bianchi, B., & Catalano, P. (1993). Evolution technologique des
installations d'extraction de l'huile d'olive. Olivae.
48: 43-53.
Références bibliographiques
Anne, K. (2011). Magnesium and calcium in
drinking water and heart diseases. In J. Nriagu (Ed.), Encyclopedia of
environmental health, 535-544, USA: Elsevier.
Annunziato, M.E; Mohaney, R. R; Mudgett.
(1986), Production of á-galactosidase from Aspergillus oryzae
grown in solid- state culture. J. Food. Sci. 51
: 1370-1371.
Asther, M., Haon, M., Roussos, S., Record, E., Michel
Delattre, M., Lesage-Meessen, L., Labat, M., & Asther, M. (2002)
Feruloyl esterase from Aspergillus niger a comparison of the
production in solid state and submerged fermentation. Process
Biochemistry. 38: 685-691
Aziz, N.H., Farag, S.E., Mousa, L.A., & Abo-Zaid,
M.A. (1998). Comparative antibacterial and antifungal effects of some
phenolic compounds. Microbios 93: 43-54.
B
Bai, Z.W., Zhou, Y.K. (2004) A novel enzyme
support derived from aminated silica gel and polysuccinimide: preparation and
application for the immobilization of porcine pancreatic lipase. Reactive
& Functional Polymers. 59: 93-98.
Bailey, M.J. & Nevalainen, K.M.H. (1981)
Introduction, isolation and testing of stable Trichoderma reesei
mutants with improved production of solubilizing cellulase. Enzyme
Microb Technol. 3:153-157.
Bailey, M.J., Biely, P., & Poutanen, K.
(1992). Interlaboratory testing of methods for assay of xylanase
activity. J. Biotechnol. 23: 257-270.
Balice, V., & Cera, O. (1984). Acidic
phenolic fraction of the juice of olives determined by gas chromatographic
method. Grasas Aceite. 25: 178-180;
Balice, V., Carveri, C., Cera, O., Rindone, B.
(1988). The fate of tannin-like compounds from olive mill effluents in
biological treatments. In Proceedings of the fifth International Symposium on
anaerobic digestion. Academic Press, New York. 275.
Barbagallo, R. N., Spagna, G., Palmeri, R., Restuccia,
C., & Giudici, P. (2004) Selection, characterization and
comparison of 3-glucosidase from mould and yeasts employable for enological
applications. Enzyme Microb. Tech. 35: 58-66.
Barhini, P., Montebove, F., Ruzzi, M. & Scheisser,
A. (1998). Optimal conditions for bioconversion of ferulic acid into
vanillic acid by Pseudomonas fluorescens BF13 cells. Appl.
Microbiol. Biotechnol. 49: 309-314.
Barlow, S. M. (1990). Toxicological aspect of
antioxidants used as food additives. In : food antioxidants. Ed:
Hudson B. J. F., Elsevier, Amsterdam.
Références bibliographiques
Ben Sassi, A., Boularbah, A., Jaouad, A., Walker, G.,
Boussaid, A. (2006). A comparison of Olive oil Mill Wastewaters (OMW)
from three different processes in Morocco. Process Biochem.
41(1): 74-78.
Bendini, A., Cerretani, L., Carrasco-Pancorbo, A.,
Gómez-Caravaca, A.-M., Segura, Carretero, A.,
Fernández-Gutiérrez, A. & Lercker, G. (2007)
Phenolic Molecules in Virgin Olive Oils: a Survey of Their Sensory Properties,
Health Effects, Antioxidant Activity and Analytical Methods. An Overview of the
Last Decade. Review Molecules, 12:
1679-1719.
Benoit, I., Navarro, D., Marnet, N., Rakotomanomana,
N., Lesage-Meessen, L., Sigoillot, J.C., Asthera, M. (2006). Feruloyl
esterases as a tool for the release of phenolic compounds from agro-industrial
by-products. Carbohyd Resea. 341: 1820-1827.
Berbee, M.L. & Taylor, JW. (1993).
Ascomycete relationships: dating the origin of asexual lineages with 18S
ribosomal RNA gene sequence data. In D. R. Reynolds, and J. W. Taylor
(ed.), The fungal holomorph: mitotic, meiotic and pleomorphic speciation in
fungal systematics. CAB International, Wallingford, United Kingdom. 67-78.
Berndt, L., Fiestas Ros de Ursinos, J.A., Geissen, K.,
Kachouri, M., Xanthouis, D. (1996). Les expériences
méditerranéennes dans le traitement des eaux résiduaires
des huileries d'olives, GTZ, Tunis.
Berset, C., & Cuvelier, M. E. (1995).
Evaluer et prévenir l'oxydation des lipides. La bretagne
Agroalimentaire. 1: 4-13.
Bezançon, P., Debosque S., Delpeuch F.,
Descomps, B., Gerber, M., Léger, C. L., Padilla, M., et Puygrenier, M.
(2000). Alimentation méditerranéenne et santé :
actualités et perspectives. 170 pp. Editions John Libbey Eurotext,
Montrouge, France.
Bhanja, T., Kumari, A., Banerjee, R. (2009).
Enrichment of phenolics and free radical scavenging property of wheat koji
prepared with two filamentous fungi. Food Chem. 114:
806-812.
Bhuiyan, M.A.R., Hoque, M.Z., Hossain, S.J.
(2009) Free Radical Scavenging Activities of Zizyphus
mauritiana. World J. Agri Sci.5 (3): 318-322.
Bianco, A. D. & Uccella, N. ( 2000).
Biophenolic componts of olives. Food Res. Int. 33:
475485.
Bianco, A. D., Mozzei, R. A., Melchioni, C., Romeo,
G., Scarpati, M. L., Soriero, A. & Vccella, N. (1998).
Microcomponents of olive oil-III. Glucosides of 2(3,4-dihydroxyphenylethanol.
Food Chem. 63: 461-464.
Références bibliographiques
Bianco, A., Buiarelli, F., Cartoni, G., Coccioli, F.,
Jasionowska, R., Margherita, P. (2003). Analysis by liquid
chromatography tandem mass spectrometry of biophenolic compounds in olives and
vegetation waters. Part I. J Separ Sci. 26:
409-416.
Bisignano, G., Tomaino, A., Lo Cascio, R., Crisafi,
G., Uccella, N. & Saija, A. (1999). On the in-vitro antimicrobial
activity of oleuropein and hydroxytyrosol. J. Pharm. Pharmacol.
51: 971-974.
Bitonti, M. B., Chiappetta, A., Innocent, A.M.,
Muzzalupo, I. & Uccella, N. (2000). Biophenol functionality and
distribution in Olea Europa L. Drupes. Olivo & Olio.
3(1/2): 20-29.
Bonnin, E, Saulnier, L, Brunel, M, Marot, C,
Lesage-Meessen, L, Asther, M. (2002) Release of ferulic acid from
agroindustrial by-products by the cell wall-degrading enzymes produced by
Aspergillus niger I-1472. Enz. Microbiol Technol.
31: 1000-1005. Bonnin, E., Brunel, M., Gouy, Y.,
Lesage-Meessen, L., Asther, M. & Thibault, J.-F. (2001)
Aspergillus niger I-1472 and Pycnoporus cinnabarinus MUCL39533,
selected for the biotransformation of ferulic acid to vanillin, are also able
to produce cell wall polysaccharide-degrading enzymes and feruloyl esterases.
Enzyme Microb. Technol. 28: 70-80.
Borja, R., Martin, A., Maestro, R., Alba, J., Fiestas,
J. A. (1992). Enhancement of the anaerobic digestion
of OMW by the removal of phenolic inhibitors. Process Biochem.
27: 231-237.
Bothast, R. J., & Saha, B. C. (1997).
Ethanol production from agricultural biomass substrat. Adv. Appl.
Microbiol. 44: 261-286.
Bouallagui, Z. & Sayadi, S. (2006).
Production of high hydroxytyrosol yields via tyrosol conversion by
Pseudomonas aeruginosa immobilized Resting Cells. J. Agric. Food
Chem. 54: 9906-9911.
Bouaziz, M., Grayer, R. J., Simmonds, M. S. J., Damak,
M. & Sayadi, S. (2005). Identification and Antioxidant Potential
of Flavonoids and Low Molecular Weight Phenols in Olive Cultivar Chemlali
Growing in Tunisia. J. Agric. Food Chem. 53(2):
236-241.
Bourquelot, E., & J. Vintilesco.
(1908). Sur l'oleuropéine, nouveau principe de
nature
glucosidique retiré de l'Olivier (Olea europaea
L.). C. R. Acad. Sci. 147: 533-535.
Boussarsar H. (2008). Application de traitements thermique et
enzymatique de
solubilisation et saccharification de la fraction
hémicellulosique en vue de la
Références bibliographiques
valorisation de la bagasse de canne à sucre.
Thèse de l'université de Reims Champagne-Ardenne
Bouzid, O., Navarro, D., Roche, M., Asther, M., Haon,
M., Delattre, M., Lorquin, J., Labat, M., Marcel Asther, M. &
Lesage-Meessen, L. (2005). Fungal enzymes as a powerful tool to
release simple phenolic compounds from olive oil by-product. Process
Biochemistry. 40 : 1855-1862.
Bradford, M. M. (1976). A rapid and sensitive
method for the quantitation of microgram quantities of protein utilizing the
principle of protein dye binding. Anal. Biochem. 72:
248-254.
Braham, M. (1997). Activité
écophysiologique, état nutritif et croissance de l'Olivier soumis
à une contrainte hydrique. Thèse de Doctorat, 1996 - 1997.
Université de Gand - Belgique, p. 19 - 23.
Brand, D., Pandey, A., Roussos, S. & Soccol, C.R.
(2000). Biological detoxification of coffee husk by filamentous fungi
using a solid state fermentation system. Enzyme Microb Technol.
27: 127-33.
Brand-Williams, W., Cuvelier, M.E., Berset, C.
(1995) Use of a free radical method to
evaluate antioxidant activity. Review article. LWT - Food
Sci Technol. 28 (1): 25-30 Bravo, L.
(1980). Polyphenols: chemistry, dietary sources, metabolism, and
nutritional
significance. Nut. Rev. 56:
317-333.
Briante, R., La Cara, F., Febbraio, F., Barone, R.,
Piccialli, G., Carolla, R., Mainolfi, P., De Napoli, L., Patumi, M.,
Fontanazza, G. & Nucci, R. (2000). Hydrolysis of oleuropein by
recombinant â-glycosidase from hyperthermophilic archaeon Sulfolobus
solfataricus immobilised on chitosan matrix. J. Biotechnol.
77: 275-286
Briante, R., La Cara, F., Tonziello, M.P., Febbraio,
F. & Nucci, R. (2001). Antioxidant activity of the main bioactive
derivatives from oleuropein hydrolysis by hyperthermophilic beta-glycosidase.
J. Agric. Food Chem. 49: 3198-3203.
Briante, R., Patumi, M., Febbario, F., & Nucci, R.
(2004). Production of highly purified hydroxytyrosol from Olea
europaea leaf extract biotransformation by thermophilic beta-glycosidase.
J. Biotechnol. 111(1): 67-77.
Briante, R., Patumi, M., Limongelli, S., Febbraio, F.,
Vaccaro, C., Di Salle, A., La Cara, F., Nucci, R. (2002) Changes in
phenolic and enzymatic activities content during fruit ripening in two Italian
cultivars of Olea europaea L. Plant Science.
162: 791-/798.
Références bibliographiques
Brooks, S. J., Doyle, E. M., O'Connor, K. E.
(2006) Tyrosol to hydroxytyrosol biotransformation by immobilized cell
extracts of Pseudomonas putida F6. Enz. Microbial Tech. 39
: 191-196.
Bruneton, J. (1999).
Pharmacognosie, phytochimie et plantes médicinales. La
Voisier TEC et DOC, Paris. 5ème édition. 250-270.
Burkhaed, K. D., Peterson, S. W. & Bolen, P. L.
(1994). Microbial hydroxylation. Hydroxylation of aniline by
Aspergillus alliaceus, A. Albertensis and A. Terreus.
J. Indus. Microbiol. 13: 233-237.
C
Cabello, L. & Fiestas Ros, J. A. (1981).
Bassins d'évaporation. Actes séminaire international sur la
valorisation des sous produits de l'olivier. FAO-UNDP, Tunisie.
81-92.
Capasso, R. (1997). The chemistry,
biotechnology and ecotoxicology of the polyphénols natyrally occurring
in vegetable waste. Current Topics in Phytochem. 1:
145-156.
Capasso, R., Cristinzio, G., Evidente, A. &
Scognamiglio, F. (1992). Isolation, spectroscopy and selective
phytotoxic effects of polyphenols from vegetable wastewaters.
Phytochem. 31: 4125-4128.
Capasso, R., Evidente, A., Avolio, S., Solla, F.
(1999). A highly convenient synthesis of hydroxytyrosol and its
recovery from agricultural waste waters. J. Agric. Food Chem.
47: 1745-1748.
Capasso, R., Evidente, A., Cutignano, A., Vurro, M.,
Zonno, M.C., and Bottalico, A. (1996). Fusaric and 9,
10-dehydrofusaric acids and their methyl esters from Fusarium nygamai.
Phytochem. 41: 1035-1039.
Capasso, R., Evidente, A., Schivo, L., Orru, G.,
Marcialis, M., Cristinzio, G. (1995). Antibacterial polyphenols from
olive mill wastewaters. J. Appl. Bacteriol. 79:
393398.
Caputo, A.C., Scacchia, F., Pelagagge, P. M.
(2003). Disposal of by-products in olive oil industry: waste-to-energy
solutions. Appl Thermal Engin. 23: 197-214.
Carluccio, M.A. ; Siculella, L., Ancora, M.A.,
Massaro, M., Scoditti, E., Storelli, C., Visioli, F., Distante, A. & De
Caterina, R. (2003). Olive oil and red wine antioxidant polyphenols
inhibit endothelial activation: antiatherogenic properties of Mediterranean
diet phytochemicals. Arterioscler. Thromb. Vasc.
Biol. 23 : 622-629.
Références bibliographiques
Casalino, E., Calzaretti, G., Sbiano, C., Landriscina,
V., Tecce, F. & Landriscina, C. (2002). Antioxidant effect of
hydroxytyrosol and Mn+2 in liver of cadmium-
intoxicated rats. Comp. Biochem. Physiol. C: Toxicol.
Pharmacol. 133: 625-632.
Castera-Rossignol, A. & Bosque, F. (1994).
Nouvelle approche des antioxydants. O.C.L. 1:
131-143.
Castilhoa, L. R., Medronhob, R. A. & Alvesa, T. L.
M. (2000). Production and extraction of pectinases obtained by
solid-state fermentation of agro-industrial residues with Aspergillus
niger. Bioresour. Technol. 71: 45-50.
Caturla, N. , Pérez-Fons, L., Estepa, A. &
Micol, V. (2005) Differential effects of oleuropein, a biophenol from
Olea europaea, on anionic and zwiterionic phospholipid model
membranes. Chem Phys Lipids. 137: 2-17.
Chakroun, H., Mechichi, T., Martinez, M-J., Dhouib,
A., & Sayadi, S. (2010).
Purification and characterization of a novel laccase from the
ascomycete Trichoderma atroviride: Application on bioremediation of
phenolic compounds. Process Biochem. 45: 507-513.
Chamkha, M. (2001). Etude de
métabolisme de composés aromatiques par des bactéries
anaérobies isolées de margines d'olives et de tourteaux de
karité. Thèse de l'université provence, Aix-Marseille
I.
Chang, M.-Y. & Juang, R.-S. (2007)
«Use of chitosan-clay composite as immobilization support for improved
activity and stability of â-glucosidase,» Biochem. Eng.
J. (35) 1: 93-98.
Chen, A. R. M. & Reese, P. B. (2002).
Biotransformation of terpenes from Stemodia maritima by
Aspergillus niger ATCC 9142. Phytochem. 59:
57-62.
Cheryan M. (1986). Ultrafiltration handbook,
Technomic Publishing Company, 369.
Chimi, H., Sadik, A., Le Tutour, B., & Rahmani, M.
(1988). Contribution à l'étude comparative des pouvoirs
antioxidants dans l'huile d'olive du tyrosol, de l'hydroxytyrosol, de l'acide
caféique, de l'oleuropeine et du B.H.T. Rev FR Transfus Immu.
35: 339-344.
Chung, K. T., Wong, T. Y., Wei, C. I., Huang, Y. W.
& Lin, Y. (1998). Tannins and human health: a review. Crit.
Rev. Food Sci. Nutr. 38: 421-464.
Références bibliographiques
Ciafardini, G. & Zullo, B.A. (2002)
Microbiological activity in stored olive oil. Inter. J. Food
Microbiol. 75: 111-118.
Ciafardini, G., Marsilio, V., Lanza, B. & Pozzi,
N. (1994) Hydrolysis of oleuropein by Lactobacillus plantarum
strains associated with olive fermentation. App Env Microbiol.
60 (11): 4142-4147.
Clifford, M. N. & Scalbert, A. (2000).
Ellagitannins, occurrence in foods, biovailability and cancer prevention.
J. Food Sci. Agric. 80: 1118-1125.
COI. (2000). Politiques oléicoles
nationales, Tunisie E. 108/Doc. N°4, Réf. 13.
Commission Regulation (EC) No. 1881/2006 of
19 December 2006 setting maximum levels for certain contaminants in food
stuffs. Available from: <
http://eur lex.europa.eu/ LexUriServ/
LexUriServ.do?
uri=CELEX:02006R1881-20100701:EN:NOT> visited on December 26th, 2010.
Coppen, P. P. (1989). The use of
antioxidants. In : Rancidity in foods. Eds : Allen J. C. and
Hamilton R. J. Elsevier, Amsterdam, 83-104.
Cordova, J, Nemmaoui, M, Ismaïli-Alaoui, M,
Morin, A, Roussos, S, Raimbault, M & Benjilali, B
(1998). Lipase production by solid state fermentation
of olive cake and sugar cane bagasse. J. Mol. Catalysis .
5: 75-78.
Cote, G.L. & Tao, B.Y. (1990).
Oligosaccharides synthesis by enzymatic transglycosylation. Glycoconjugate
J. 7: 145-162.
Crea, R. (2002) Method of obtaining a
hydroxytyrosol-rich composition from vegetation water. Patent No.
WO0218310.
Crea, R. (2003) Hydroxytyrosol-rich
composition from vegetation water and method of use thereof. Patent
No. US2003108651.
Cruz, R. & Park, Y.K. (1982) Production
of fungal a-galactosidase and its application to the hydrolysis of
galactooligosaccharides in soybean milk. J. Food Sci.
47: 1973-1975.
Cuvelier, M. E., Berset, C. & Richard, H.
(1990). Use of a new test for determining comprarative antioxidant
activity of BHA, BHT, alpha and gamma tocopherols and extracts from rosemary
and sage. Sci. Alim. 10: 795-806.
D
Da Re, V., Papinutti, L., Villalba, L., Forchiassin,
F. & Levin, L. (2007). Preliminary studies on the biobleaching of
loblolly pine Kraft pulp with Trametes trogii crude extracts.
Enzyme Microb. Tech. doi:10.1016/j.enzmictec. 11.004.
Références bibliographiques
Day, A. J., Canada, F. J., Diaz, J. C., Kroon, P. A.,
Mclauchlan, W. R., Faulds, C. B., Plumb, G. W., Morgan, M. R. A. &
Williamson, G. (2000). Dietary flavonoid and isoflavone glycosides are
hydrolysed dy lactase site of lactase phlorizin hydrolase. FEBS Lett.
468: 166-170.
De la Puerta, R., Ruiz-Gutierrez, V. & Hoult, J.R.
(1999). Inhibition of leukocyte 5-lipoxygynase by phenolics from
virgin olive oil. Biochem. Pharmacol. 57: 445-449.
De Leonardis, A, Macciola, V, Lembo, G, Aretini, A, Nag, A.
(2007). Studies on oxidative
stabilisation of lard by natural antioxidants recovered from
olive-oil mill wastewater. Food Chem. 100:
998-1004.
De Marco, E., Savarese, M., Paduano, A., Sacchi, R.
(2007). Characterization and fractionation of phenolic compounds
extracted from olive oil mill wastewaters. Food Chem.
104(2): 858-867.
De Oliveira, B. H., Dos Santos, M. C. & Leal, P.
C. (1999). Biotransformation of the diperpenoid, isosteviol, by
Aspergillus niger, Penicillium chrysogenum and Rhizopus arrhizus.
Phytochemistry. 51: 737-741.
Defrance, L. & Jaffrin, M.Y. (1999)
Comparison between filtrations at fixed transmembrane pressure and fixed
permeate flux: application to a membrane bioreactor used for wastewater
treatment. J. Membrane Sci. 152: 203-210.
Deiana, M., Aruoma, O.I., Bianchi, M.L., Spencer,
J.P., Kaur, H., Halliwell, B., Aeschbach, R., Banni, S., Dessi, M.A., Corongiu,
F.P. (1999). Inhibition of peroxynitrite dependent DNA base
modification and tyrosine nitration by the extra virgin olive oil-derived
antioxidant hydroxytyrosol. Free Radic. Biol. Med.
26: 762769.
Della Greca, M., Previtera, L., Temessi, F., Carrelli,
A. (2004). Low molecular-weight components of olive oil mill
waste-waters. Phytochem Anal. 15: 184-188.
Demirel, D., Ozdural, A.R., Mutlu, M. (2004)
Preparation and characterization of magnetic duolite-polystyrene composite
particles for enzyme immobilization. J. Food Eng.
62:203-208.
Demyttenaere, J. C. R. & Willemen, H. M.
(1998). Biotransformation of linalool to furanoid and pyranoid
linalool oxides by Aspergillus niger. Phytochem.
47: 10291036.
Références bibliographiques
Dersoti, E. (1991) Trace elements,
micronutrients, and free radicals, The Humana Press Inc. pp 62.
Di Giovacchino, L. (1996). L'influence des
systèmes d'extraction sur la qualité d'olive. Olivae.
63: 52-63.
Donaghy, J.A., Bronnenmeier, K., Soto-Kelly, P.F.,
McKay, A.M. (2000). Purification and characterization of an
extracellular feruloyl esterase from the thermophilic anaerobe Clostridium
stercorarium. J Appl Microbiol. 88: 458- 466.
Duarte, J. C. & Costa-Ferreira, M.
(1994). Aspergilli and lignocellulosics: Enzymology and
biotechnological applications. FEMS Microbiol. Rev.
13: 377-386.
Duenas, M., Hernandez, T., & Estrella, I.
(2007). Changes in the content of bioactive polyphenolic compounds of
lentils by the action of exogenous enzymes. Effect on their
antioxidant activity. Food Chem. 101:
90-97.
Dursun, A. Y., Uslu, G., Cuci, Y. & Aksu, Z.
(2003). Bioaccumulation of copper(II), lead(II) and chromium(VI) by
growing Aspergillus niger. Process Biochem.
38: 16471651.
E
Edlin, D. A. N., Narbad; A., Dickinson, J. R. &
Lloyds, D. (1995). The biotransformation of simple phenolic compounds
by Brettanomyces anomalus. FEMS Microbiol. Lett.
125: 311-316.
Eggert, C., Temp, U. & Eriksson, K.E.L.
(1997). Laccase is essential for lignin degradation by the white-rot
fungus Pycnoporus cinnabarinus. FEBS Lett.
407: 89-92.
Ellouze, M., Aloui, F. & Sayadi, S.
(2008). Detoxification of Tunisian landfill leachates by selected
fungi. J. Hazard. Mater. 150: 642-648.
Eriksson O.E. & Hawksworth D. L. (1993)
Outline of the ascomycetes. Syst. Ascomycetum 12:
51-257.
Espin, J.C., Soler-Rivas, C., Cantos, E.,
Tomàs-Barberàn, F.A. & Wichers, H.J. (2001).
Synthesis of the antioxidant hydroxytyrosol using tyrosinase as biocatalyst.
J. Agric. Food Chem. 49: 1187-1193.
Eyal, S., Uzi, R. & Yuval, S. (2000).
Isolation of bacillus sp. Capable of transforming isoeugenol to
vanillin. J. Biotechnol. 78: 1-9.
F
Références bibliographiques
Fabiani, R., De Bartolomeo, A., Rosignoli, P.,
Servili, M., Montedoro, G.F. & Morozzi, G. (2002). Cancer
chemoprevention by hydroxytyrosol isolated from virgin olive oil through G1
cell cycle arrest and apoptosis. Europ. J. Cancer Prev. 11:
351-358.
Farag, R. S., Badei, A; Z. M. A., Hewedi, J. F. M.
& El-Baroty, G. S. A. (1989). Antioxidant activity of some spice
essential oils on linoleic acid oxidation in aqueous media. J. A. Q. C. S.
66: 792-799.
Farr, S. B., Kogoma, T. (1991). Oxidative
stress responses in Escherichia coli and Salmonella
typhimurium. Microbiol rev 55: 561-585.
Faulds, C.B. & Williamson, G. (1991). The
purification and characterization of 4-hydroxy-3-methoxycinnamic (ferulic) acid
esterase from Streptomyces olivochromogenes . J Gen
Microbiol. 137: 2339- 2345.
Faulds, C.B. & Williamson, G. (1994).
Purification and characterization of a ferulic acid esterase (FAE-III) from
Aspergillus niger : specificity for the phenolic moiety and binding to
microcrystalline cellulose. Microbiology. 140:
779-787.
Feki, M., Allouche, N., Bouaziz, M., Gargoubi, A.
& Sayadi, S. (2006). Effect of storage of olive mill wastewaters
on hydroxytyrosol concentration. Eur. J. Lipid Sci. Technol.
108: 1021-1027.
Fernández-Bolaños, J., Rodríguez,
G., Rodríguez, R., Guillén, R. & Jiménez, A.
(2006). Potential use of olive by-products. Extraction of interesting
organic compounds from olive oil waste. GRASAS Y ACEITES. 57
(1): 95-106. ISSN: 0017-3495
Fernandez-Diaz, M. J. (1983) Olives. In
biotechnology. 5: 379-397. Edited by rehm H.J. & Reed
G. Chemie, Weinheim.
Field, R.W., Wu, D., Howell, J.A. & Gupta, B.B.
(1995). Critical flux concept for microfiltration fouling.
J.Membrane Sci. 100: 259-272.
Fiestas Ros, J.A. (1981). Différentes
utilisations des margines: recherches en cours, résultats obtenus et
applications. Séminaire international sur la valorisation des sous
produits de l'olivier. FAQ, Tunisie Décembre. 93-110.
Fiestas Ros, J.A. (1986). Vegetation water used
as fertilizer, Proceedings of international Symposium on olive By-Products
Valorisation. FAQ, UNDP. Sevilla. Spain 321-330. Fki, I.,
Allouche, N. & Sayadi, S. (2005) The use of polyphenolic extract,
purified hydroxytyrosol and 3,4-dihydroxyphenyl acetic acid from olive mill
wastewater for the stabilization of refined oils: a potential alternative to
synthetic antioxidants. Food Chem. 93 (2):
197-204.
Références bibliographiques
Frankel, E. N. (1993). In search of better
methods to evaluate natural antooxidants and oxidative stability in foods
lipids. Trends in Foods Sci. technol. 4: 220-225.
Frenander, U., Jonsson, A.S. (1996) Cell
harvesting by cross-flow microfiltration using a shear-enhanced module,
Biotechnol. Bioeng. 52: 397-403.
G
Galanakis, C. M., Tornberg, E., & Gekas, V.
(2010). Clarification of high-added value products from olive mill
wastewater. Journal of Food Engineering. 99:
190-197.
Galli, S.J., Zsebo, K.M. & Geissler, E.N.
(1994). The kit ligand, stem cell factor. Adv
Immunol. 55: 1-96.
Garcia-Kirchner, O, Segura-Granados, M,
Rodriguez-Pascual, P. 2005 Effect of media composition and growth
conditions on production of beta-glucosidase by Aspergillus niger C-6.
Appl. Biochem. Biotechnol. 121-124:347-359
Gharsallah, N. (1987). Mise au point d'un
procédé de valorisation et de dépollution des eaux
usées des huileries (margines) production de protéines
d'organismes unicellulaires par culture aérobie de levure, production de
biogaz par fermentation anaérobie. Thèse UTC. France.
Gharsallah, N. (1993). Production of single
cell protein from olive mill wastewater by yeasts. Environ Technol.
14: 391-395.
Gharsallah, N., Labat, M., Aloui, F. & Sayadi, S.
(1999). The effect of Phanerochaete chrysosporium
pretreatment of olive mill wastewaters on anaerobic digestion. Res
Conserv Recycl. 27: 187-192.
Ghose, T.K. (1987) Measurement of cellulase
activities. Pure Appl Chem.59:257-68.
Glazebrook, M.A., Vining, L.C. and White, R.L.
(1992) Growth morphology of
Streptomyces akiyoshiensis in submerged culture:
influence of pH, inoculum, and nutrients. Canadian J. Microbiol.
38: 98-103.
Goksungur Y. & Guvenc U. (1999)
Production of lactic acid from beet molasses by calcium alginate immobilized
L. delbrueckii IFO 3202 batch and continuous. J. Chem. Eng.
Biotechnol. 74:131-136.
Gómez-Alonso, S., Mancebo-Campos, V.,
Desamparados Salvador, M. & Fregapane, G. (2007) Evolution of
major and minor components and oxidation indices of virgin olive oil during 21
months storage at room temperature. Food Chem. 100:
36-42.
Références bibliographiques
Gordon, M., H. (1990). The mechanism of
antioxidant action in vitro. In: BJF Hudson (Ed.), Food antioxidants
Elsevier Applied Science, London: 1-18.
Gowthaman, M. K., Krishna, Ch., Moo-Young, M.
(2001). Fungal solid state fermentation-an overview. Appl.
Mycology Biotechnol. 1 : 305-352.
Guarro, J., Gené, J. & Stchigel, A.M.
(1999). Developments in Fungal Taxonomy. Clinic. Microbiol.
Rev. 12: 454-500.
Gueguen, Y, Chemardin, P, Janbon, G, Arnaud, A, Galzy,
P. (1996) A very efficient â-glucosidase catalyst for the
hydrolysis of flavor precursors of wines and fruit juices. J. Agr. Food
Chem. 44: 2336-2340.
Gueguen, Y., Chemardin, P., Arnaud, A. & Galzy, P.
(1994). Purification and
characterization of the endocellular
â-glucosidase of a new strain of Candida entomophila
isolated from fermenting agave (Agave sp.) juice. Biotechnol.
Appl. Biochem. 20: 185-198.
H
Hamdi, M. (1993). Future prospects and
constraints of olive mill wastewaters use and treatment: A review
Bioprocess Eng. 8: 209-214.
Hamdi, M. (1996). Anaerobic digestion of
olive mill wastewaters. Process Biochem. 31:
105110.
Hammerstone, J. F., Lazarus, S. A. & Schmith, H.
H. (2000). Proantocyanidin content and variation in some commonly
consumed foods. J. Nutr. 130: 20866S-2095S.
Hamza M., Khoufi S. & Sayadi S. (2012 b).
Fungal enzymes as a powerful tool to release antioxidants from olivemill
wastewater. Food Chemistry, 131, 1430-1436.
Hamza M., Khoufi S., Sayadi S. (2012 a). Changes
in the content of bioactive polyphenolic compounds of olive mill wastewater by
the action of exogenous enzymes. Journal of Agricultural and Food
Chemistry, 60(1), 66-73.
Hang, Y. D. & Woodams, E. E. (1994). Apple
pomace: A potential substrate for production
of â-glucosidase by Aspergillus foetidus.
Food Sci. Tech. 27: 587-589.
Harbourne, N., Marete, E., Jacquier, J. C., &
O'Riordan, D. (2011). Stability of phytochemicals as sources of
anti-inflammatory nutraceuticals in beverages - A review.
Hawksworth, D.L., Kirk, P. M., Sutton, B. C. &
Pegler, D.N. (1995). Ainsworth and Bisby's dictionary of the fungi,
8th ed. International Mycological Institute, Egham, United Kingdom.
Références bibliographiques
Henrissat, B. (1998). Enzymology of cell-wall
degradation. Biochem. Soc. Trans. 26: 153- 209.
Herrmann, K. (1989). Occurrence and content
of hydroxycinnamic and hydroxybenzoic acid coumpounds in foods. Critic.
Rev. Food Sci. Nutr. 28(4): 315-342.
Himmel, M.E., Tatsumoto, K., Grohmann K., Johnson, D.
K.& Chum, H. L. (1991). Molecular weight distribution of aspen
lignins from conventional gel permeation chromatography, universal calibration
and sedimentation equilibrium. J. Chromtogr. 498:
93-104.
Hollman, P.C. H., Hertog, M. G. L. & Katan, M. B.
(1996). Analysis and helth effects of flavanoids. Foods Chem.
57: 43-46.
Hopia, A. & Heinonen, M. (1999).
Antioxidant activity of flavonol aglycones and their glycosides in methyl
linoleate. J.A.O.C.S. 76: 139-144.
I
Idris, A. & Suzana, W. (2006). Effect of
sodium alginate concentration, bead diameter, initial pH and temperature on
lactic acid production from pineapple waste using immobilized Lactobacillus
delbrueckii. Process Biochem. 41: 1117-1123.
Ishii, T. (1997) Structure and functions of
feruloylated polysaccharides. Plant Sci. 127:
111127.
Ismail, S. (1998) Production of
fatty acid alcohol esters by esterase activity from Pseudomonas fragi.
Thèse, McGili University Montreal, Québec.
J
Jadot, G. (1994) Antioxydant et
vieillissement, Jhon Libbey Eurotext, Paris. 34.
Jemai, H., Bouaziz, M. & Sayadi, S.
(2009). Phenolic composition, sugar contents and
antioxidant activity of Tunisian sweet olive cultivar with regard
to fruit ripening. J. Agric. Food Chem. 57:
2961-2968.
Jiménez, A. M., Borja, R. & Martin, A.
(2003) Aerobic-anaerobic biodegradation of beet molasses alcoholic
fermentation wastewater. Process Biochem. 38:
1275-1284.
K
Kahraman, S.S. & Gurdal, I.H. (2002). Effect
of synthetic and natural culture media on laccase production by white-rot
fungi. Bioresource Technol. 82: 215-217.
Références bibliographiques
Kapoor, A. & Viraraghavan, T. (1997)
Heavy metal biosorption sites in Aspergillus niger. Bioresour.
Technol. 61 : 221-227.
Khoufi S., Hamza M. & Sayadi S. (2011).
Enzymatic hydrolysis of olive wastewater for
hydroxytyrosol enrichment. Bioresource Technology,
102 (19) : 9050-9058.
Kilcast, D., & Subramaniam, P. (2003).
The stability and shelf-life of food. Cambridge, England: Woodhead
Publishing.
Knekt, P., Jarvinen, R., Reunanen, A., & Maatela,
J. (1996). Flavonoid intake and coronary mortality in Finland : a
cohort study. Brit. Med. J. 312: 478-481.
Kohyama, N., Nagata, T., Fujimoto, S. & Sekiya, K.
(1997). Inhibition of arachidonate lipoxygenase activities by
2-(3,4-dihydroxyphenyl)ethanol, a phenolic compound from olives.
Biosci. Biotechnol. Biochem. 61 :
347-350.
Konno, K., Hirayama, C., Yasui, H., Nakamura, M.
(1999). Enzymatic activation of oleuropein: a protein crosslinker used
as a chemical defense in the privet tree. Proc. Natl. Acad. Sci. U.S.A.
96: 9159-9164.
Kovács, K., Megyeri, L., Szakacsa, G., Kubicek,
C. P., Galbe, M. & Zacchi, G. (2008). Trichoderma atroviride
mutants with enhanced production of cellulase and â-
glucosidase on pretreated willow. Enzyme and Microbial
Technology. 43: 48-55.
Kroner, K.H., Nissen, N., Ziegler, H., (1987)
Improved dynamic filtration of microbial suspensions, Bio/Techn. 5: 921-926.
Kroon, P.A., Faulds, C.B. & Williamson,
G..(1996) Purification and characterization of a novel esterase
induced by growth of Aspergillus niger on sugar beet pulp.
Biotechnol Appl Biochem. 23: 255-262.
Kulkarni, A. G., Lele, S. S. & Kulkarni, P. R.
(1998). Improved adsorption of Aspergillus niger 589 spores
on high-density polyethylene for progesterone biotransformation. J.
Ferment. Bioeng. 86: 510-512.
Kumar, D., Jain, V. K., Shanker, G. & Srivastava,
A. (2003) Citric acid production by solid-state fermentation using
sugarcane bagasse. Process Biochem. 38 (12):
17311738
L
Labat, M., Augur, C., Rio, B., Perraud-Gainé,
I. & Sayadi, S. (2000). Biotechnological potentialities of
polyphenolic compounds of coffee and comparison with olive. In Coffee
Biotechnology and Quality. 517-531. Edited by Sera, T., Socco C. R.,
Pandey A. & Roussos S. Dordrecht, Netherlands: Kluywer.
M
Références bibliographiques
Lambrechts, M.G., & Pretorius, I.S.
(2000) Yeast and its importance to wine aroma. Review. S Afr J Enol
Vitic. 21:97-129.
Lesage-Meessen, L., Navarro, D., Maunier, S.,
Sigoillot, J-C, Lorquin, J., Delattre, M. (2001). Simple phenolic
content in olive oil residues as a function of extraction systems. Food
Chem. 75: 501- 507.
Leung, S. W., Siddhanti, S., Williams, B., Chan, A. W.
K., Minski, M. J., Daniels, C. K., & Lai, J. C. K. (2010). Effects
of diet intakes on metal and electrolyte distributions in vital organs.
Procedia Environmental Sciences. 2: 92-97.
Levi-Minzi, R., Saviozzi, A., Raffaldi, R., Martorana,
F. (1992). Dynamique de certaines caractéristiques des margines
épandues sur le sol. Oléa. 47:
459-463.
Levin, L., Forchiassin, F., Ramos, A.M.
(2002). Copper induction of lignin modifying enzymes in the white-rot
fungus Trametes trogii. Mycologia. 94: 377e383.
Levin, L., Melignani, E., Ramos, A.M. (2010).
Effect of nitrogen sources and vitamins on ligninolytic enzyme production by
some white-rot fungi. Dye decolorization by selected culture filtrates.
Bioresource Technol. 101: 4554-4563.
Liebgott, P.P., Labat, M., Casalot, L., Amouric, A. et
Lorquin, J. (2007). Bioconversion of tyrosol into hydroxytyrosol and
3,4-dihydroxyphenylacetic acid under hypersaline conditions by a new
Halomonas sp. strain HTB24. FEMS Microbiology Letters.
276: 24-33.
Limiroli, R., Consonni, R., Ottolina, G., Marsilio,
V., Bianchi, G., Zetta, L. (1995). 1H and 13C NMR
characterisation of new oleuropein aglycones. J. Chem. Soc. Perkin
Trans. 1: 1519-1523.
Litridou, M, Linssen, J, Schols, H, Bergmans, M,
Posthumus, M, Tsimodou, M. (1997)
Phenolic compounds in virgin olive oils: fraction by solid phase
extraction and antioxidant activity assessment. J. Sci. Food Agric.
74: 169-74.
Lojkine MH, Field RW, Howell JA. (1992).
Crossflow microfiltration of cell suspension: A review of models with emphasis
on particle size effects. Transactions of Industrial Chemistry and
Engineering. 70 (C): 149-164.
Loussert, R. & Brousse, G.
(1978). L'olivier. G.P. Maisonneuve et Larose
(ed): 167 - 175.
Références bibliographiques
Ma, S.C., He, Z.D., Deng, X.L., But, P.P., Ooi, V.E.,
Xu, H.X., Lee, S.H., , S.F. (2001). In vitro evaluation of secoiridoid
glucosides from the fruits of Ligustrum lucidum as antiviral agents.
Chem. Pharm. Bull. (Tokyo) 49: 1471-1473.
Mackness, M. I., Walker, C. H., Rowlands, D. C. &
Price, N. R. (1983). Esterase activity in homogenates of three strains
of the rust red flour beetle Tribolium castaneum (Herbst). Comp.
Biochem. Physiol. C. 74: 65-68.
Mahadik, N. D., Puntambekar, U. S., Bastawde, K. B.,
Khire, J. M. & Gokhale, D. V. (2002). Production of acidic lipase
by Aspergillus niger in solid-state fermentation. Process
Biochem. 38: 715-721.
Mandviwala, T.N. & Khire, J.M. (2000).
Production of high activity thermostable phytase from thermotolerant
Aspergillus niger in solid state fermentation. J. Ind. Microbiol.
Biotechnol. 24: 237-243.
Manna, C, Galletti, P, Cucciolla, V, Moltedo, O, Leone,
A, Zappia, V. (1997 a) The protective effect of the olive oil
polyphenols (3-4-dyhydroxyphenyl)-ethanol counteracts reactive oxygen
metabolite induced cytoxicity in caco-2-cells. J. Nutr.
12: 286-92. Manna, C., Galletti, P., Cucciolla, V.,
Montedoro, G.F., Zappia, V. (1997 b). Olive oil hydroxytyrosol
protects human erythrocytes against oxidative damages. J. Nutr.
Biochem. 10: 159-165.
Martin, M., Ferrer, E., Sanz, J., Gibello, A.
(1998) Process for the biodegradation of aromatic compounds and
synthesis of pigments and colorants, alkaloids and polymers, with the use of
the recombinant strain Escherichi coli P260. Patent N° WO98/04679
(5.02.1998).
Martino, A., Durante, M., Pifferi, P. G., Spagna, G.
& Bianchi, G. (1996).
«Immobilization of â-glucosidase from a
commercial preparation, part 1: a comparative study of natural supports,»
Process Biochem. 31(3): 281-285.
Maymone, B., A. Battaglini and M. Tiberio.
(1961). Ricerche sul valore nutritivo della sansa d'olive. Alimentazione
Animale. 5: 219-250.
Mazzeia, R., Giornoa, L., Piacentinia, E., Mazzucab, S.,
Drioli, E., 2009. Kinetic study of a biocatalytic membrane reactor
containing immobilized b-glucosidase for the hydrolysis of oleuropein. J.
Membr. Sci. 339: 215-223.
Références bibliographiques
McCrae, SI, Leith, KM, Gordon, AH, Wood, TM.
(1994) Xylan-degrading enzyme system produced by the
fungus Aspergillus awamori: isolation and characterization of a
feruloyl esterase and a p-coumaroyl esterase. Enzyme Microb. Technol.
16: 826-834.
Mekki, A, Dhouib, A. & Sayadi, S. (2006).
Changes in microbial and soil properties following amendement with
treated and untreated olive mill wastewater. Microbiol Res.
161 (2): 93-101.
Mercade, M.E., Manresa, M.A. (1994). The use
of agroindustrial by-products for biosurfactant production. J. Am. Oil
Chem. Soc. 71: 61-64.
Metche, M. & Giarardin, M. (1980). Les
polymères végétaux pariétaux et alimentaires non
azotés. C. Costes, Ed.: Gauthier-Villars: 251-287.
Metsamuuronen, S., Howell, J. & Nystrom, M.
(2002). Critical flux in ultrafiltration of myoglobin and baker's
yeast. J. Membrane Sci. 196: 13-25.
Micol, V., Caturla, N., Pérez-Fons, L., Mas,
V., Pérez, L., Estepa, A. (2005). The olive leaf extract
exhibits antiviral activity against viral haemorrhagic septicaemia rhabdovirus
(VHSV). Antivir. Res. 66: 129-136.
Miller, G.L. (1959). Use of dinitrosalicylic
acid reagent for determination of reducing sugar. Anal. Chem.
31: 426-429.
Miro-casas, E., Covas, M. L., Fito, M.,
Farre-Albadalejo, M., Marrugat, & De la Torre, R. (2003). Tyrosol
and hydroxytytrosol are absorbed from moderate and sustained doses of virgin
olive oil in humans. Eur. J. Clin. Nutr. 57(1):
186-190.
Miró-Casas, E.; Covas, M.I.; Farre, M.; Fito,
M.; Ortuño, J.; Weinbrenner, T.; Roset, P.; De la Torre, R.
(2003) Hydroxytyrosol disposition in humans. Clinical Chem.
49: 945-951.
Molla, A. H., Fakhru'l-Razi, A., Abd-Aziz, S., Hanafi,
M. M., Roychoudhury, P. K. & Alam, M. Z. (2002).
A potential resource for bioconversion of domestic wastewater sludge.
Bioresour. Technol. 85 : 263-272.
Moure, A., Cruz, J.M., Franco, D., Dominguez, J.M.,
Sineiro, J., Dominguez, H., Nunez, M.J., Pajaro, J.C.
(2001). Oxidative stabilization of cold-pressed
sunflower oil using phenolic compounds of the same seeds. Food Chem.
72: 145.
Msallem, M., Mehri, H. & Radhouane, L.
(2000). Inventaire des collections d'olivier en Tunisie. Plant
Genet Resour News lett. 122: 36-40.
Muheim, A. & Lerch, K. (1999). Towards a
high yield bioconversion of ferulic acid to vanillin. Appl. Microbiol.
Biotechnol. 51: 456-461.
P
Références bibliographiques
Munoz, S. (1998) Procedimiento para la
produccion de vitamina B12 a partir de residuos contaminantes de la
industria de la aceituna. Patent N° ES2122927 (16.12.1998).
N
Nagatomo, H., Matsushita, Y., Sugamoto, K., &
Matsui, T. (2005) «Preparation and properties of
gelatin-immobilized â-glucosidase from Pyrococcus
furiosus,» Bioscience, Biotechnol. Biochem.
69(1): 128-136.
Nefzaoui, A (1983). Etude de l'utilisation
des sous-produits de l'oliver en alimentation animale en Tunisie. FAO
Animal Production and Health Division, Rome.
Nefzaoui, A. (1991). Valorisation des sous
produits de l'olivier. Options Méditerranéennes-Série
séminaire. 16: 101-108.
Norkrans, B. (1950). Influence of
cellulolytic enzymes from Hymenocetes on cellulose preparations of
different crystallinity. Physiol. Plant. 3: 75-81
O
O Dowd, Y., Driss, F., Dang, P. M., Elbim, C.,
Gougerot, P. M. A. Pasquier, C. & El-Benna, J. (2004). Antioxidant
effect of hydroxytyrosol, a polyhenol from olive: scavenging of hydrogen
peroxide but not superoxide anion produved by human neutrophils. Biochem.
Pharmacol. 68(10): 2003-2008.
Obied H.K., Bedgood Jr. D.R., Prenzler P.D., Robards
K. (2007). Bioscreening of Australian olive mill waste extracts:
Biophenol content, antioxidant, antimicrobial and molluscicidal activites.
Food Chemical Toxicol 45: 1238-1248.
Obied, H.K., Allen, M.S., Bedgood, D.R., Prenzler,
P.D., Robards, K., Stockmann, R. (2005). Bioactivity and analysis of
biophenols recovered from olive mill waste. J. Agricul Food Chem.
53: 823-837.
Ohta, T., Shimojo, H., Hashimoto, K., Kondo, H.,
Samuta, T. & Ohba, T. (1991). â-glucosidase activity in
Shiro-Koji and it contribution to sweet potato Shochu flavor. J. Brew. Soc.
Japan. 86: 536-539.
Owen, R.W., Giacosa, A., Hull, W.E., Haubner, R.,
Spiegelhalder, B. & Bartsch, H.
(2000). The antioxidant/anticancer potential of phenolic
compounds isolated from olive oil. Euro J Cancer. 36:
1235-1247.
Références bibliographiques
Paiva-Martins, F., Gordon, M.H. & Gameiro, P.
(2003). Activity and location of olive oil phenolic antioxidants in
liposomes. Chem. Phys. Lipids. 124:
23-36.
Pandey, A., Soccol, C.R., Nigam, P. & Soccol, V.T.
(2000). Biotechnologica potential of agro-industrial residues. I:
sugarcane bagasse. Biores Technol. 74: 69-80.
Panizzi, L. M., J. M. Scarpati, et E. G. Oriente.
(1960). Constituzione della oleuropeina, glucoside, glucoside amaro e
ad azione ipotensiva dell olivo. Nota H. Gazz. Chim. Ital.
90: 1449-1485.
Parr, A. J. & Bolwell, G. P. (2000).
Phenols in the plant and in the man. J. Sci. Food Agri.
80: 1013-1032.
Perrin, J. L. (1992). Les composés
mineurs et les antioxydants naturels de l'olive et de son huile. Rev. Fr.
Corps Gras. 39: 25-32.
Petroni, A., Blasevich, M., Salami, M., Papini, N.,
Montedero, G.F. & Galli, C. (1995). Inhibition of platelet
aggregation and eicosanoid production by phenolic components of olive oil.
Thromb. Res. 78: 151-160.
Petruccioli, M., Servili, M., Montedoro, F., Federici,
F. (1988) Development of recycle procedure for the utilization of
vegetation waters in the olive-oil extraction process. Biotechnol. Lett.
10: 55 - 60.
Pizzichini M. & Russo C. (2005). Process
for recovering the components of olive mill wastewater with membrane
technologies. International. Patent WO2005123603.
Pozo, C., Martinez-Toledo, M.V., Rodelas, B.,
Gonzalez-Lopez, J. (2002). Effects of culture conditions on the
production of polyhydroxyalkanoates by Azotobacter chroococcum H23 in
media containing a high concentration of alpechin (wastewater from olive oil
mills) as primary carbon source. J. Biotechnol. 97:
125-131.
R
Ramachandran, S., Roopesh, K., Nampoothiri, K.M.,
Szakacs, G., Pandey, A. (2005). Mixed substrate fermentation for the
production of phytase by Rhizopus spp. using oilcakes as substrates.
Process Biochem. 40: 1749-1754.
Ranalli, A. (1991). L'effluent des huileries
d'olive : propositions en vue de son utilisation et de son épuration.
Références aux normes italiennes en la matière.
Sciences et Techniques. 37: 30-39.
Randhir, R, Shetty, K. (2007). Mung beans
processed by solid-state bioconversion improves
phenolic content and functionality relevant for diabetes and
ulcer management. Innov Food Sci Emerg Technol. 8:
197-204.
Références bibliographiques
Rayan, D. & Robards, K. (1998). Phenolic
compounds in olives. Analyst. 123: 31R-44R.
Rebro, M., Rosenberg, M., Mlichová, Z., &
Kritofíková L. (2007). «Hydrolysis of
sucrose by invertase entrapped in polyvinyl alcohol hydrogel
capsules,» Food Chem. 102(3): 784-787.
Reddy, M. C., Lindsay, R. C. & Montgomery, M. W.
(1970). Ester production by Pseudomenas frogi. IV.
Demonstration of esterase activity. App. Microbio. 20
: 555557.
Reithner, B., Schuhmacher, R., Stoppacher, N., Pucher,
M., Brunner, K. & Zeilinger, S. (2007). Signaling via the
Trichoderma atroviride mitogen-activated protein kinase Tmk1
differentially affects mycoparasitism and plant protection. Fungal Genet.
Biol. 44: 1123-1133.
Robards, K., Prenzler, P. D., Tucker, G., Swatsitang,
P. & Glover, W. (1999). Phenolic compounds and their role in
oxidative process in fruits. Food Chem. 66:
401-436.
Romero, C., Brenes, M., Garcia, P., & Garrido, A.
(2002). Hydroxytyrosol 4-beta-D-glucoside, an important phenolic
compound in olive fruits and derived products. J. Agric. Food Chem.
50(13): 3835-3839.
Roussos, S., Lonsane, B.K., Raimbault, M.,
Viniegra-Gonzalez, G. (1995). Advances in solid state fermentation.
Proceedings of the 2nd International Symposium on Solid State
Fermentation. FMS-95. Kluwer Academic Publishers.
Ruiz-Bravo, A., Jimenez-Valera, M., Moreno, E.,
Guerra, V., Ramos-Cormenzana, A. (2001). Biological response modifier
activity of an exopolysaccharide from Paenibacillus jamilae CP-7.
Clinical and Diagnostic. Laboratory Immunol. 8:
706710.
Russo C. (2007). A new membrane process for
the selective fractionation and total recovery of polyphenols, water and
organic substances from vegetation waters. Journal of Membrane
Science, 288, 239-246.
Ryan, D. & Robards, K. (1998). Phenolic
compounds in olives. Analyst. 123: 31R-44R.
S
Saha, B. C., Freer, S. N. & Bothast, R. J.
(1994). Production, purification, and properties of a
thermostable â-glucosidase from a color variant strain of
Aureobasidium pullulans. Appl. Environ. Microbiol.
60: 3774-3780.
Références bibliographiques
Saha, B. C.; Bothast, R. J. (1996).
Production, purification, and characterization of a highly
glucose-tolerant novel 18-glucosidase from Candida peltata.
Appl. Environ. Microbiol. 62: 3165-3170.
Saija, A. & Uccella, N. (2001). Olive
biophenols: functional effects on human wellbeing.
TIFS. 11: 357-363.
Saudagar, P.S. & Singhal, R.S. (2004)
Curdlan as a support matrix for immobilization of enzyme. Carbohydr Polymers.
56: 483-488.
Sayadi, S. & Odier, E. (1995).
Degradation of synthetic lignin by protoplasts of Phanerochaete chrysosporium
with prurified lignin peroxydase or manganese peroxydase. Acta
Biotechnologica.15:57-66.
Sayadi, S., Allouche, N., Jaoua, M., Aloui, F.
(2000). Detrimental effects of high molecular mass polyphenols on
olive mill wastewater biotreatment. Process Biochem.
35: 725735.
Sayadi, S., Ellouz, R. (1993). The use of
Phanerochaete chrysosporium for the treatment of olive mill
wastewaters. In "Proceedings of the Second Arab Conferences on Perspectives of
Modern Biotechnology". 24-28, Amman, Jordan, 409-425.
Sayadi, S., Ellouz, R. (1995). Role of lignin
peroxidase and manganese peroxidase from Phanerochaete chrysoxporium
in the decolorization of olive mill wastewaters by the Phanerochaete
chrysosporium. Appl Environ Microbiol. 61:
1028-1030.
Schuster E., Dunn-Coleman N., Frisvad J. C. & Van
Dijck P. W. M. (2002). On the safety of Aspergillus niger. A
review. Appl. Microbiol. Biotechnol. 59: 426-435.
Scott, K. (1995) Handbook of Industrial Membranes, 1st ed.,
Elsevier Advanced Technol. 23-110.
Selvakumar, P., Ashakumary, L. & Pandey, A.
(1998). Biosynthesis of glucoamylase from Aspergillus niger
by solid-state fermentation using tea waste as the basis of a solid
susbtrate. Bioresour. Technol. 65: 83-85.
Sharmila, T.; Sreeramulu, G.; Nand, K.
Purification and characterization of 18-glucosidase from
Clostridium papyrosolvens. Biotechnol. Appl. Biochem.
1998, 27, 175-179.
Sheehan J.J., Hamilton B.K., Levy P.F. (1988)
Pilot-scale membrane filtration process for the recovery of an extracellular
bacterial protease, ACS Symp. Ser. 419: 130-155.
Six, P. (1994). Current research in natural
food antioxidants. Infom. 5: 679-688.
Références bibliographiques
Soni, M.G., Burdog, G.A., Christian, M.S., Bitler,
C.M., Crea, R. (2006). Safety assessment of aqueous olive pulpe
extract as an antioxidant or antimicrobial agent in foods. Food Chemical
Toxicol. 44, 903-915.
Sorensen; A, Lubeck; PS, Lubeck; M, Teller; PJ,
Ahring; BK. (2011) â-glucosidases from a new Aspergillus species
can substitute commercial â-glucosidases for saccharification of
lignocellulosic biomass. Can: J: Microbiol. 57(8):
638-650.
Stahl Biskup, E, Intert, F, Holthnujzen, JH, Stengele,
M, Schultz, G. (1993) Glycosidically bound volatiles-a review
1986-1991. Flav Fragr J. 8:61-80.
Steffen, K.T. (2003) Degradation of
recalcitrant biopolymers and polycyclic aromatic hydrocarbons by
litter-decomposing basidiomycetous fungi. Academic Dissertation in Microbiology
To be presented, with the permission of the Faculty of Agriculture and Forestry
of the University of Helsinki, for public criticism in the auditorium 1041 at
the Viikki Biocenter (Viikinkaari 5) of the University of Helsinki on October
the 28th 2003 at 12 o'clock noon. Helsinki 2003.
Strathmann H., (1985) Membranes and membrane
processes in biotechnology, Trends Biotechnol. 3: 112-118.
Synowiecki, J. & Woosowska, S. (2006)
«Immobilization of thermostable â-glucosidase from
Sulfolobus shibatae by cross-linking with transglutaminase,»
Enzyme Microbial. Technology. 39(7):1417-1422.
Szent-Györgyi, A. (1938). Therapeutic
properties of vitamins. Presse Medicale 46 (995):
1893-1971.
T
Talcott, S. C. & Hoaward, L. R. (1999).
Phenolic autooxidation is responsible for color degradation in processed carrot
puree. J. Agric. Food Chem. 47 : 2109-2115.
Tamburino, V., Zimbone, S. M. & Quattrone, P.
(1999) Accumulation et écoulement des margines par
épandage sur le sol agricole. Olivae. 76:
36-45.
Tanabe, M., Kanda, T. & Yanagida, A.
(1995). Fruit polyphenols ; process for production thereof ; and
antioxydant, hypotensive agent, antimutagenic agent, antiallergic agent and
anticariogenic agent, each comprising said polyphenol. Brevet N° :
EP0657167.
Tanchev, S., Joncheva, N., Genov, N., & Codounis, M.
(1980). Identification of antocyanins contained in olives.
Georgike Ereuna. 4: 5-13.
Taqieddin, E., Amiji, M. (2004) Enzyme
immobilization in novel alginate-chitosan core-shell microcapsules.
Biomaterials. 25:1937-1945.
Références bibliographiques
Tomati, U., Di Lena, G., Galli, E., Grappelli, A.,
Buffone, R. (1990). Indolacetic acid production from olive waste water
by Arthrobacter spp. Agrochimica. 34:
228-232. Tuck, K. & Hayball, P.-J. (2002) Major phenolic
compounds in olive oil: metabolism and health effects. Reviews: current topics.
J. Nutri Biochem. 13: 636-644.
V
Van Den Berg, G.B. & Smolders, C.A.
(1990). Flux Decline in Ultrafiltration Processes. Desalination.
77. 101-133.
Vasserot, Y., Arnaud, A. & Galzy, P.
(1995). Monoterpenyl glycosides in plants and their biotechnological
transformation. Acta Biotechnol. 15: 77-95.
Vassilev, N., Fenice, M., Federeci, F. & Azcon, R.
(1997). Olive mill wastewater treatment by immobilized cells of
Aspergillus niger and its enrichment with soluble phosphate. Process
Biochem. 32: 617-620.
Veer W. L. C., Gerris V., Ribbers J. E., Oud P. J.,
Van Ree P. J., Beyerman H. C. & Bontekol J. S. (1957). A compound
isolated from Olea europea. J. Rec. Trav. Chim. Pays
Bas. 76: 839.
Verhe, R., Papadopoulos, G., Boskou, D.
(1992) Preparation of hydroxytyrosol bull. Liason Groupe
Polyphenols. 15: 237-244.
Visioli, F. & Galli, C. (2002).
Biological properties of olive oil phytochemicals. Crit. Rev.
Food Sci. Nutr. 42:
209-221.
Visioli, F., & Galli, C. 2003. Olives and
their production waste products as sources of bioactive compounds. Cur Top
Nutraceutical Res. 1: 85-88.
Visioli, F., Bellomo, G. 1 Galli, C. (1998).
Free radical-scavenging properties of olive oil polyphenols.
Biochem. Biophys. Res. Commun. 247:
60-64.
Visioli, F., Bellomo, G., Montedoro, G. & Galli, C.
(1995 a). Low density lipoprotein oxidation is inhibited in vitro by
olive oil constituents. Atherosclerosis.
117: 25-32. Visioli, F., Galli, C., Galli, G. & Caruso, D.
(2002) Biological activities and metabolic fate of olive oil phenols.
Eur J Lipid Sci Technol. 104: 677-84.
Visioli, F., Vinceri, F.F. & Galli, C.
(1995 b). Waste waters from olive oil production are rich in natural
antioxidants. Experientia. 51: 32-34.
Visioli, F.; Caruso, D.; Grande, S.; Bosisio, R.;
Villa, M.; Galli, G.; Sirtori, C.; Galli, C. Virgin Olive Oil Study
(VOLOS): vasoprotective potential of extra virgin olive oil in mildly
dyslipidemic patients. Eur. J. Nutr. 2005,
44, 121-127.
Références bibliographiques
Visioli, F.; Grande, S.; Bogani, P.; Galli, C.
The role of antioxidants in the Mediterranean diets: focus on cancer.
Eur. J. Cancer Prevention. 2004, 13,
337-343.
Volke-Sepulveda, T. L., Gutierrez-Rojas, M. &
Favela-Torres, E. (2003). Biodegradation of hexadecane in liquid and
solid-state fermentations by Aspergillus niger. Bioresour.
Technol. 87: 81-86.
W
Wahner, R.S., Mendez, B.A., Giulietti, A.M.
(1988). Olive black water as raw material for butanol production.
Biol. Wastes. 23: 215-220.
Walter, W. M. Jr., Fleming, H. P., Etchells, J. L.
(1973). Preparation of Antimicrobial
Compounds by Hydrolysis of Oleuropein from Green Olives.
App. Microbiology. 26 (5): 773-776.
Wei, D. L.; Kirimura, K.; Usami, S.; Lin, T. H.
(1996) Purification and characterization of an extracellular
â-glucosidase from the wood-grown fungus Xylaria
regalis. Curr. Microbiol. 33: 297-301.
Weitzman, I., Whittier, S., McKitrick, J. C. &
Della-Latta, P. (1995). Zygospores: the last word in identification of
rare and atypical zygomycetes isolated from clinical specimens. J. Clin.
Microbiol. 33:781-783
Weitzman, I., Whittier, S., McKitrick, J. C. &
Della-Latta, P. (1995). Zygospores: the last word in identification of
rare and atypical zygomycetes isolated from clinical specimens. J. Clin.
Microbiol. 33:781-783
Williams, P.J., Sefton, M.A., Francis, I.L.
(1992) Glycosidic precursors of varietal grape and wine flavor. Flav
Precurs ACS Symp Ser. 74-86.
Williams, P.J., Sefton, M.A., Francis, I.L.
(1992) Glycosidic precursors of varietal grape and wine flavor. Flav
Precurs ACS Symp Ser. 74-86.
Williamson, G., Faulds, C.B., Kroon, P.A.
(1998). Specificity of ferulic acid (feruloyl) esterases. Biochem.
Soc. Trans. 26: 205-209.
Winterhalter, P. & Skouroumounis, G.K.
(1997) Glyconjugated aroma compounds: occurrence, role and
biotechnological transformation. Adv. Biochem. Eng. Biotech.
55:73-105.
Winterhalter, P. & Skouroumounis, G.K.
(1997) Glyconjugated aroma compounds: occurrence, role and
biotechnological transformation. Adv. Biochem. Eng. Biotech.
55:73-105.
Références bibliographiques
Woese, C.R. (1987). Bacterial evolution.
Microbiol. Rev. 5: 221-271.
Woese, C.R. (1987). Bacterial evolution.
Microbiol. Rev. 5: 221-271.
Woese, C.R., Kandler, O. & Wheelis, M.L.
(1990). Towards a natural system of organisms: proposal for the
domains Archaea, Bacteria, and Eucarya. Proc.
Natl. Acad. Sci. USA 87: 4576-4579
Woese, C.R., Kandler, O. & Wheelis, M.L.
(1990). Towards a natural system of organisms: proposal for the
domains Archaea, Bacteria, and Eucarya. Proc.
Natl. Acad. Sci. USA 87: 4576-4579
Y
Y
Yan, T. R.; Lin, Y. H.; Lin, C. L. (1998)
Purification and characterization of an extracellular 18-glucosidase
II with high hydrolysis and transglucosylation activities from Aspergillus
niger. J. Agric. Food Chem. 46: 431-437.
Yan, T. R.; Lin, Y. H.; Lin, C. L. (1998)
Purification and characterization of an extracellular 18-glucosidase
II with high hydrolysis and transglucosylation activities from Aspergillus
niger. J. Agric. Food Chem. 46: 431-437.
Yang, F.C. & Lian, C.B. (1998) Effect of
cultivating conditions on the mycelial growth of
Ganoderma lucidum in submerged flask cultures.
Bioprocess Eng. 19: 233-236.
Yang, F.C. & Lian, C.B. (1998) Effect of
cultivating conditions on the mycelial growth of Ganoderma lucidum in
submerged flask cultures. Bioprocess Eng. 19:
233-236.
Yang, F.C., Ke, Y.F. & Kuo, S.S. (2000)
Effect of fatty acids on the mycelial growth and polysaccharides formation by
Ganoderma lucidum in shake flask cultures. Enzyme Microbial
Technol. 27: 295-301.
Yang, F.C., Ke, Y.F. & Kuo, S.S. (2000)
Effect of fatty acids on the mycelial growth and polysaccharides formation by
Ganoderma lucidum in shake flask cultures. Enzyme Microbial
Technol. 27: 295-301.
Yaropolov, A.I., Skorobogatko, O.V., Vartanov, S.S.
& Varfolomeyev, S.D. (1994). Laccase: Properties, catalytic
mechanism and applicability. Appl. Biochem. Biotechnol.
49: 257-278.
Références bibliographiques
Yaropolov, A.I., Skorobogatko, O.V., Vartanov, S.S.
& Varfolomeyev, S.D. (1994). Laccase: Properties, catalytic
mechanism and applicability. Appl. Biochem. Biotechnol.
49: 257-278.
Yesilada, O., Sik, S. & Sam, M. (1998).
Biodegradation of olive oil mill wastewater by Coriolus versicolor and
Funalia Trogii: effects of agitation, initial COD concentration,
inoculum size and immobilization. World J Microbiol Biotechnol.
14: 37-42.
Yesilada, O., Sik, S. & Sam, M. (1998).
Biodegradation of olive oil mill wastewater by Coriolus versicolor and
Funalia Trogii: effects of agitation, initial COD concentration,
inoculum size and immobilization. World J Microbiol Biotechnol.
14: 37-42.
Yurekli F., Yesilada O., Yurekli M., Topcuoglu S.F.
(1999). Plant growth hormone production from olive oil mill and
alcohol factory wastewaters by white rot fungi. World J. Microb.
Biot. 15: 503-505.
Yurekli F., Yesilada O., Yurekli M., Topcuoglu S.F.
(1999). Plant growth hormone production from olive oil mill and
alcohol factory wastewaters by white rot fungi. World J. Microb.
Biot. 15: 503-505.
Z
Z
Zafra-Gómez A., B. Luzón-Toro, Capel-Cuevas
S., Carlos Morales J. (2011). Stability of
Hydroxytyrosol in Aqueous Solutions at Different
Concentration, Temperature and with Different Ionic Content: A Study Using
UPLC-MS. Food and Nutrition Sciences. 2 : 1114-1120
doi:10.4236/fns.2011.210149.
Zbakh H., El Abbassi A. (201é).
Potential use of olive mill wastewater in the preparation of functional
beverages: A review. Journal of functional foods 4:53-65
Zhao, Y. & Hagerman, A. E. (1995).
Simultaneous determination of hydrolysable tannin and condensed tannin. Am.
Chemis. Soc. 210-228.
Zhao, Y. & Hagerman, A. E. (1995).
Simultaneous determination of hydrolysable tannin and condensed tannin. Am.
Chemis. Soc. 210-228.
Zheng, Z., Shetty, K. (2000) Solid-state
bioconversion of phenolics from cranberry pomace
and role of Lentinus edodes b-glucosidase. J Agric Food
Chem. 48: 895-900.
Références bibliographiques
Zheng, Z., Shetty, K. (2000) Solid-state
bioconversion of phenolics from cranberry pomace and role of Lentinus edodes
b-glucosidase. J Agric Food Chem. 48:
895-900.
Ziogas V, Tanou G, Molassiotis A, Diamantidis G,
Vasilakakis M. (2010) Antioxidant and free radical-scavenging
activities of phenolic extracts of olive fruits. Food Chem.
120: 1097-1103

République Tunisienne Ecole Doctorale
Sciences et Technologies Thèse
Génie Biologique
N° d'ordre: GB
Ministère de l'Enseignement Supérieur,de la
Recherche Scientifiqueet de la Technologie
Université de Sfax
École Nationale d'Ingénieurs de
Sfax
BIOCONVERSION ENZYMATIQUE DES COMPOSES PHENOLIQUDES
DES
EFFLUENTS ISSUS DE L'EXTRACTION D'HUILE D'OLIVE : UNE
VOIE
PROMETTEUSE DE VALORISATION PAR LA PRODUCTION DE
L'HYDROXYTYROSOL
NATUREL.
Manel Hamza Karray
Résumé: Au cours de ce
travail, nous avons étudié et optimisé la production de
13-glucosidase par fermentation en milieu liquide du son de blé par
Aspergillus niger. Un essai de la production de 13-glucosidase dans un
fermenteur de 100 litre a été entrepri et a permis l'obtention de
3895 UI/ml comme activité maximale. L'utilisation de la
préparation enzymatique d'A. niger pour l'hydrolyse des
margines a montré une augmentation significative de la concentration de
l'hydroxytyrosol. L'effet hydrolytique de la préparation enzymatique
produite lors de ce travail a été comparable à celui
trouvé lors de l'hydrolyse de margines par la 13-glucosidase pure. La
bioconversion a été entreprise à grande échelle
pour biotransformer les composés phénoliques de 40 litres de
margine de Nord et 15 litres de margine MSP et MCC de Sfax. Ceci a permis
l'amélioration de la concentration de l'hydroxytyrosol de 2,70 ; 3,61 et
1,77 fois dans le cas de margine Nord, MSP et MCC respectivement. Une
série de procédés a été par la suite
effectuée pour la purification et la concentration de l'hydroxytyrosol.
Une microfiltration, une ultrafiltration de 70 litres de margine
hydrolysée et une concentration du perméat de l'UF ont
été effectuées dans l'ordre. Uniquement 24%
d'hydroxytyrosol a été récupéré dans le
concentrat final. Le nouveau produit obtenu obéi aux besoins
alimentaires.
Mots clés Aspergillus
niger, 13-glucosidase, fermentation en milieu liquide, margine, hydrolyse
enzymatique, composés phénoliques, antioxydants, microfiltration,
ultrafiltration.
Abstract: During this work, we have
studied and optimized the 13-glucosidase production by liquid state
fermentation of wheat bran by Aspergillus niger. A trial production of
13-glucosidase in a fermenter with 100 liters was companies and helped obtain
3895 IU/ml as the maximum activity. The use of A. niger enzyme
preparation for olive mill wastewater (OMW) hydrolysis showed a significant
increase of simples phenolics and reduced sugars. The hydrolytic effect of the
enzyme preparation produced during this study was comparable to that found
during the hydrolysis of OMW by different commercial enzyme preparations. The
bioconversion was carried out large-scale biotransformation of phenolic
compounds of 40 liters of North OMW and 15 liters of MSP and MCC from Sfax.
This has helped improve the concentration of hydroxytyrosol 2.70, 3.61 and 1.77
times in the case North OMW, MSP and MCC respectively. A series of processes
was subsequently performed for the purification and concentration of
hydroxytyrosol. Microfiltration, ultrafiltration of 70 liters of hydrolyzed OMW
and concentration of the UF permeate were carried out in order. Only 24% of
hydroxytyrosol was recovered in the final concentrate. The new product obtained
obeyed the dietary needs.
Key-words Aspergillus niger,
13-glucosidase, liquid state fermentation, OMW, enzymatic hydrolysis,
phenolic compounds, antioxydants, microfiltration, ultrafiltration.
| 


